Производные малонамида, блокирующие активность γ- секретазы
Номер патента: 9940
Опубликовано: 28.04.2008
Авторы: Флор Александер, Якоб-Рётне Роланд, Галлей Гуидо, Востль Вольфганг, Китас Эрик Аргириос, Петерс Йенс-Уве
Формула / Реферат
1. Производные малонамида общей формулы
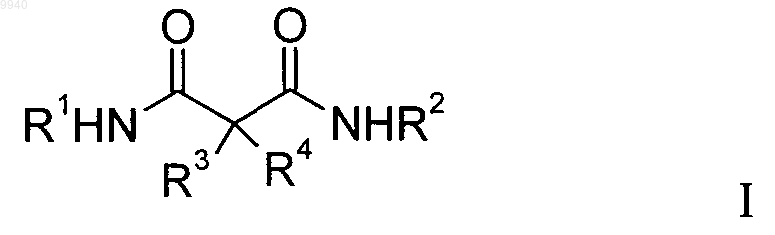
где R1 означает одну из следующих групп:
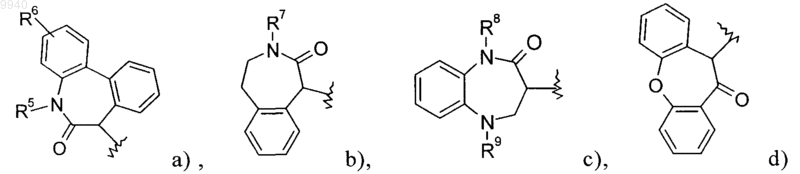
R2 означает С1-С7алкил, С2-С7алкинил, -(CH2)n-O-С1-С7алкил, -(CH2)n-S-C1-С7алкил, -(CH2)n-CN,
-(CR'R'')n-CF3, -(CR'R'')n-CHF2, -(CR'R'')n-CH2F, -(CH2)n-C(O)O-С1-С7алкил, -(CH2)n-галоген или означает
-(CH2)n-С3-С7циклоалкил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей фенил, галоген или CF3,
R', R'' независимо от значения n и независимо друг от друга означают водород, С1-С7алкил,
С1-С7алкокси, галоген или гидрокси,
R3, R4 независимо друг от друга означают водород, С1-С7алкил, С1-С7алкокси, фенил или галоген,
R5 означает водород, С1-С7алкил, -(CH2)n-CF3 или -(CH2)n-С3-С7циклоалкил,
R6 означает водород или галоген,
R7 означает водород или С1-С7алкил,
R8 означает водород, С1-С7алкил, С2-С7алкинил, -(СН2)n-CF3, -(СН2)n-С3-С7циклоалкил или -(CH2)n-фенил, необязательно замещенный галогеном,
R9 означает водород, С1-С7алкил, -C(O)Н, -C(O)-С1-С7алкил, -C(O)-CF3, -C(O)-CH2F, -C(O)-CHF2,
-C(O)-С3-С7циклоалкил, -C(O)-(CH2)n-O-С1-С7алкил, -C(O)O-(CH2)n-С3-С7циклоалкил, -C(O)-фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей галоген или -C(O)O-С1-С7алкил, или означает -S(O)2-С1-С7алкил, -S(O)2-CF3, -(СН2)n-С3-С7циклоалкил, или означает -(СН2)n-фенил, необязательно замещенный галогеном,
n равно 0, 1, 2, 3 или 4,
и их фармацевтически приемлемые кислотно-аддитивные соли, оптически чистые энантиомеры, рацематы или диастереомерные смеси.
2. Производные малонамида общей формулы
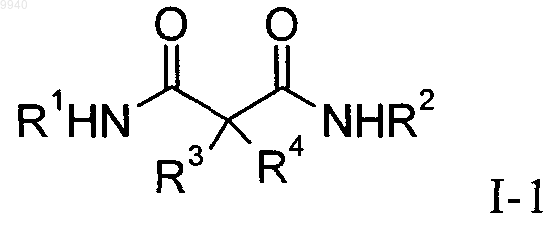
где R1 означает одну из следующих групп:
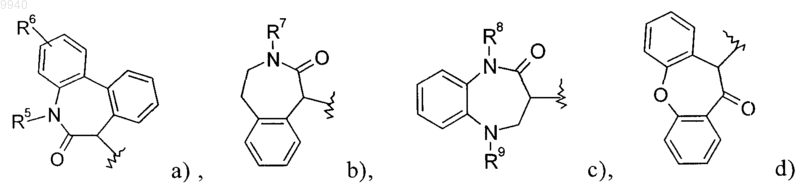
R2 означает С1-С7алкил, С2-C7алкинил, -(CH2)n-O-С1-С7алкил, -(CH2)n-S-C1-С7алкил, -(CH2)n-CN,
-(CR'R'')n-CF3, -(CR'R'')n-CHF2, -(CH2)n-C(O)O-C1-С7алкил, -(CH2)n-галоген или означает -(CH2)n-С3-С7циклоалкил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей фенил, галоген или CF3,
R', R'' независимо от значения n и независимо друг от друга означают водород, С1-С7алкил, С1-С7алкокси, галоген или гидрокси,
R3, R4 независимо друг от друга означают водород, С1-С7алкил, фенил или галоген,
R5 означает С1-С7алкил или -(CH2)-С3-С7циклоалкил,
R6 означает водород или галоген,
R7 означает водород или С1-С7алкил,
R8 означает водород, С1-С7алкил, С2-С7алкинил или -(CH2)-С3-С7циклоалкил,
R9 означает водород, С1-С7алкил, -C(O)-С1-С7алкил, -C(O)-С3-С7циклоалкил, -(CH2)n-С3-С7циклоалкил, фенил, -C(O)-фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей галоген или -C(O)O-С1-С7алкил, или означает -(CH2)n-фенил, необязательно замещенный галогеном,
n равно 0, 1, 2, 3 или 4,
и их фармацевтически приемлемые кислотно-аддитивные соли, оптически чистые энантиомеры, рацематы или диастереомерные смеси.
3. Соединения формулы I по п.1, где R1 означает группу а).
4. Соединения формулы I по п.3, где R2 означает -(CH2)n-С3-С7циклоалкил, необязательно замещенный группой CF3.
5. Соединения формулы I по п.4, включающие N-циклопропилметил-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)малонамид или 2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(1-трифторметилциклопропилметил)малонамид.
6. Соединения формулы I по п.2, где R2 означает С1-С7алкил, -(CH2)n-O-С1-С7алкил или -(CH2)n-S-С1-С7алкил.
7. Соединения формулы I по п.6, включающие
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2-метоксиэтил)малонамид,
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2-метилтиоэтил)малонамид,
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(3-метоксипропил)малонамид,
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-пропилмалонамид или
2-фтор-2-метил-N-(3-метилбутил)-N'-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)малонамид.
8. Соединения формулы I по п.2, где R2 означает -(CR'R'')n-CF3 или -(CR'R'')n-CHF2.
9. Соединения формулы I по п.8, включающие
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,2-трифторэтил)малонамид,
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,3-трифторпропил)малонамид,
2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,2-трифторэтил) малонамид,
2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4-тетрафторбутил)малонамид,
2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(4,4,4-трифторбутил)малонамид,
2-метил-N-(5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(4,4,4-трифтор-3-метоксибутил)малонамид,
N-(5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]aзeпин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
2-метил-N-(6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-6-oксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
2,2-диметил-N-((S)-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(-)-2-метокси-N-(6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил) малонамид,
(2R)-2-фтор-2-метил-N-((S)-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(2S)-2-фтор-2-метил-N-[(S)-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(R)-N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(S)-N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(R)-N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)-2-фтор-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2-метокси-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4-пентафторбутил)малонамид,
N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(3,3,4,4,4-пентафторбутил)малонамид,
N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'-(3,3,4,4,4-пентафторбутил)малонамид,
(R)-N-((S)-5-циклопропилметил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2-фтор-2-метил-N'-(3,3,4,4,4-пентафторбутил)малонамид,
N-(5-изопропил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-(5-изопропил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
2,2-диметил-N-((S)-5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(2S)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид,
2-метокси-N-((S)-5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-((S)-5-метил-6-оксо-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4-пентафторбутил)малонамид или
2,2-диметил-N-[(S)-6-оксо-5-(2,2,2-трифторэтил)-6,7-дигидро-5Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид.
10. Соединения формулы I по п.1, где R1 означает группу b).
11. Соединения формулы I по п.10, включающие 2-метил-N-(3-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[d]азепин-1-ил)-N'-(2,2,2-трифторэтил)малонамид.
12. Соединения формулы I по п.1, где R1 означает группу с).
13. Соединения формулы I по п.12, где R2 означает -(CR'R'')n-CF3.
14. Соединения формулы I по п.13, включающие
2-метил-N-(1-метил-2-оксо-5-фенил-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,2-трифторэтил)малонамид,
N-((3S)-5-бензоил-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[(3S)-5-(4-фторбензоил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[(3S)-5-(4-хлорбензоил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[(3S)-5-(3,5-дифторбензоил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
метиловый эфир 4-{(3S)-5-метил-4-оксо-3-[2-(2,2,3,3,3-пентафторпропилкарбамоил)пропиониламино]-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбонил}бензойной кислоты,
N-((3S)-5-ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[5-((3S)-4-фторбензил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[(3S)-5-(4-хлорбензоил)-1-циклопропилметил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(2RS)-метил-N-((3S)-1-метил-2-оксо-5-трифторметансульфонил-2,3,4,5-тетрагидро-1Н-бензо[b][1,4] диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(2RS)-метил-N-((3S)-1-метил-2-оксо-5-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1Н-бензо[b][1,4] диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[(3S)-5-(2-метоксиацетил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
N-[(S)-5-метансульфонил-2-оксо-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
(2RS)-метил-N-[(S)-2-оксо-(2,2,2-трифторэтил)-5-триторметансульфонил-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид,
циклопропилметиловый эфир 5-метил-4-оксо-(3S)-[(2RS)-(2,2,3,3,3-пентафторпропилкарбамоил) пропиониламино]-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты,
N-[(S)-5-циклопропанкарбонил-2-оксо-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид,
циклопропилметиловый эфир 4-оксо-(3S)-[(2RS)-(2,2,3,3,3-пентафторпропилкарбамоил)пропиониламино]-5-(2,2,2-трифторэтил)-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты,
N-[(S)-5-ацетил-1-изопропил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид или
N-((S)-5-ацетил-1-бензил-2-оксо-2,3,4,5-тетрагидро-1Н-бензо[b][1,4]диазепин-3-ил)-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид.
15. Соединения формулы I по п.1, где R1 означает группу d).
16. Соединения формулы I по п.15, включающие 2-метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,2-трифторэтил)малонамид или 2-метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид.
17. Способ получения производного малонамида формулы I по пп.1-16, включающий взаимодействие соединения формулы
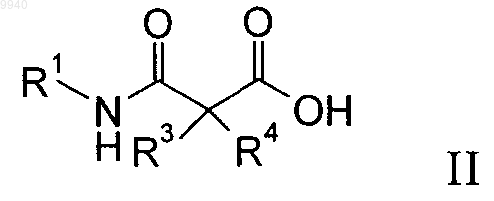
с соединением формулы NH2R2 (III) с образованием соединения формулы

где R1-R4 имеют значения, указанные в п.1, и при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
18. Производное малонамида по любому из пп.1-16, полученное способом по п.17.
19. Лекарственное средство, предназначенное для лечения болезни Альцгеймера, содержащее одно или более соединений по любому из пп.1-16 и фармацевтически приемлемые эксципиенты.
20. Применение соединения по любому из пп.1-16 для получения лекарственного средства, предназначенного для лечения болезни Альцгеймера.
Текст
где R1 означает одну из следующих группR2 означает (низш.)алкил, (низш.)алкинил, -(СН 2)n-O-(низш.)алкил, -(CH2)n-S-(низш.)алкил, -(CH2)2CN, -(CR'R)n-CF3, -(CR'R)n-CHF2, -(CR'R)n-CH2F, -(CH2)n-С(O)O-(низш.)алкил, -(CH2)n-галоген, или означает -(CH2)CHn-циклоалкил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей фенил, галоген или CF3, R', R независимо от значения n и независимо друг от друга означают водород, (низш.)алкил, (низш.)алкокси, галоген или гидрокси,R3, R4 независимо друг от друга означают водород, (низш.)алкил, (низш.)алкокси, фенил или галоген,R5 означает водород, (низш.)алкил, -(CH2)n-CF3 или -(CH2)n-циклоалкил, R6 означает водород или галоген, R7 означает водород или (низш.)алкил,R8 означает водород, (низш.)алкил, (низш.)алкинил, -(CH2)n-CF3, -(CH2)n-циклоалкил или -(CH2)nфенил, необязательно замещенный галогеном,R9 означает водород, (низш.)алкил, -C(O)Н, -C(O)-(низш.)алкил, -C(O)-CF3, -C(O)-CH2F, -C(O)CHF2, -C(O)-циклоалкил, -C(O)-(CH2)n-O-(низш.)алкил, -C(O)O-(CH2)n-циклоалкил, -C(O)-фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей галоген или -C(O)O-(низш.)алкил, или означает -S(O)2-(низш.)алкил, -S(O)2-CF3, -(CH2)n-циклоалкил, или означает -(CH2)n-фенил, необязательно замещенный галогеном, n равно 0, 1, 2, 3 или 4,и к их фармацевтически приемлемым кислотно-аддитивным солям, оптически чистым энантиомерам, рацематам или диастереомерным смесям. Термин "алкил", используемый в описании заявки, означает насыщенную алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил,изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и т.п. Предпочтительные группы (низш.)алкил означают группы, содержащие 1-4 атома углерода. Термин "(низш.)алкинил", используемый в описании заявки, означает ненасыщенную углеводородную группу с прямой или разветвленной цепью, содержащую от 2 до 7 атомов углерода и по меньшей мере одну тройную связь. Термин "циклоалкил" означает насыщенную карбоциклическую группу, содержащую 3-7 атомов углерода. Термин "галоген" означает хлор, иод, фтор и бром. Термин "(низш.)алкокси" означает группу, в которой алкильные остатки имеют значения, указанные выше, и которая присоединена через атом кислорода. Группа "-(CR'R)n-" может означать, например, -CH2-, -СН 2-СН 2-, -СН 2-CH2-СН 2-, -CH2-CF2-, -CH2CH2-CF2-, -CH2-CH2-СН(ОСН 3)-, -CH2CH(OH)- или -С(СН 3)2-СН(ОН)-. Термин фармацевтически приемлемые кислотно-аддитивные соли включает соли неорганических кислот и органических кислот, таких как хлористо-водородная кислота, азотная кислота, серная кислота,фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота,уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, паратолуолсульфоновая кислота и т.п. Установлено, что соединения общей формулы I являются ингибиторами -секретазы, а родственные им соединения могут применяться для лечения болезни Альцгеймера. Болезнь Альцгеймера (AD) представляет собой наиболее распространенный вариант деменции, от которой страдают люди преклонного возраста. В патологическом отношении AD характеризуется отложением в ткани мозга внеклеточных амилоидных бляшек и внутриклеточных нейрофибриллярных узлов. Амилоидные бляшки в основном состоят из амилоидных пептидов (абета-пептидов), которые образуются из -амилоидного белка-предшественника (АРР) в результате нескольких стадий протеолитического гидролиза. Идентифицированы некоторые формы АРР, которые наиболее часто представляют собой белки, содержащие 695, 751 и 770 аминокислотных остатков. Все указанные белки кодируются одним геном и образуются за счет сплайсинга различного типа. Абета-пептиды образуются из одного и того же домена АРР, но отличаются N- и С-концевыми фрагментами, большинство из них содержат 40 и 42 аминокислотных остатка. Абета-пептиды образуются из АРР благодаря последовательному воздействию двух протеолитических ферментов, которые носят названия - и -секретазы. -Секретаза сначала расщепляет связи во вне-1 009940 клеточном домене АРР, т.е. расщепляет внешний фрагмент транс-мембранного домена (ТМ), с образованием С-концевого фрагмента АРР, содержащего ТМ- и цитоплазматический домен (CTF). CTF является субстратом -секретазы, которая расщепляет в ТМ несколько соседних связей с образованием Апептидов и цитоплазматического фрагмента. Большинство абета-пептидов содержат 40 аминокислотных остатков (А 40), минорные компоненты содержат в С-концевом фргаменте два дополнительных аминокислотных остатка. Предполагается, что среди амилоидных пептидов более патогенными являются именно эти минорные компоненты.-Секретаза представляет собой типичную аспартилпротеазу. -Секретаза обладает протеолитической активностью, содержит несколько белков, ее точный состав установлен неполностью. Однако, важными активными компонентами секретазы являются пресенилины и возможно она представляет собой новую группу атипичных аспартил-протеаз, которые расщепляют в субстратах ТМ-домены и которые сами являются политопными мембранными белками. Другими важными компонентами -секретазы являются никастрин и продукты генов aph-1 и pen-2. Достоверными субстратами -секретазы являются АРР и белки семейства рецепторов Notch, однако -секретаза обладает широкой субстратной специфичностью и может расщеплять также мембранные белки, не относящиеся к белкам АРР и Notch. Наличие -секретазной активности является абсолютно необходимым условием для образования абета-пептидов. Этот факт установлен как методами молекулярной генетики, т.е. выключением генов пресенилина, так и с использованием низкомолекулярных ингибиторов. Поскольку согласно амилоидной гипотезе (о причине AD) образование и отложение абета-пептидов является основной причиной заболевания, предполагается, что селективные и эффективные ингибиторы -секретазы могут найти применение при профилактике и лечении AD. Таким образом, соединения по настоящему изобретению могут использоваться для лечения AD благодаря блокированию активности -секретазы и снижению или торможению образования различных амилоидогенных абета-пептидов. Современные данные по ингибированию -секретазы описаны, например, в следующих публикациях:(2002), Drug Development Research, 56, 211-227 (2002), Drug Discovery Today, 6, 9, 459-462 (май 2001),FEBS Letters, 483, 6-10 (2000), Science, 297, 353-356 (июль 2002) и Journ. of Medicinal Chemistry, 44, 13,2039-2060 (2001). Объектом настоящего изобретения являются соединения формулы I, применение соединений формулы I и их фармацевтически приемлемых солей для получения лекарственных средств, предназначенных для лечения заболеваний, связанных с ингибированием -секретазы, способы их получения, лекарственные средства на основе соединений по изобретению и их получение, а также применение соединений формулы I для лечения или профилактики болезни Альцгеймера. Другим объектом изобретения являются все формы оптически чистых энантиомеров, рацематов или диастереомерных смесей соединений формулы I. Предпочтительны соединения формулы I, в которых R1 означает группу а), а R2 означает -(CH2)nциклоалкил, необязательно замещенный CF3, например, следующие соединения: N-циклопропилметил-2 метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d] азепин-7-ил)малонамид или 2-фтор-2-метил-N-(5 метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(1-трифторметилциклопропилметил)малонамид. Кроме того, предпочтительны соединения формулы I, в которых R1 означает группу а), а R2 означает (низш.)алкил, -(CH2)n-O-(низш.)алкил или -(CH2)n-S-(низш.)алкил, например, следующие соединения: 2-метил-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)-N'-(2-метоксиэтил)малонамид,2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2-метилтиоэтил)малонамид,2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3-метоксипропил)малонамид,2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-]N'-пропилмалонамид или 2-фтор-2-метил-N-(3-метилбутил)-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)малонамид. Кроме того, предпочтительны соединения формулы I, в которых R1 означает группу а), а R2 означает -(CR'R)n-CF3 или -(CR'R)n-CHF2, например,2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,2-трифторэтил)малонамид,2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,3-трифторпропил)малонамид,-2 009940 2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,2-трифторэтил) малонамид,2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5H-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4-тетрафторбутил)малонамид,2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(4,4,4-трифторбутил)малонамид,2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(4,4,4-трифтор-3-метоксибутил)малонамид,2-фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4-тетрафторбутил)малонамид,N-(5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3 пентафторпропил)малонамид,2-метил-N-(6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,2,2-диметил-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил) малонамид,(-)-2-метокси-N-(6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил) малонамид,(2R)-2-фтор-2-метил-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,(2S)-2-фтор-2-метил-N-[(S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид,N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,(R)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'(2,2,3,3,3-пентафторпропил)малонамид,(S)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'(2,2,3,3,3-пентафторпропил)малонамид,N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'(2,2,3,3,3-пентафторпропил)малонамид,(R)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-фтор-2-метилN'-(2,2,3,3,3-пентафторпропил)малонамид,N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метокси-N'(2,2,3,3,3-пентафторпропил)малонамид,N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4 пентафторбутил)малонамид,N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(3,3,4,4,4 пентафторбутил)малонамид,N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'(3,3,4,4,4-пентафторбутил)малонамид,(R)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-фтор-2-метилN'-(3,3,4,4,4-пентафторбутил)малонамид,N-(5-изопропил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3 пентафторпропил)малонамид,N-(5-изопропил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'-(2,2,3,3,3 пентафторпропил)малонамид,N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,2,2-диметил-N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид,(2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3 пентафторпропил)малонамид,(2S)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3 пентафторпропил)малонамид,2-метокси-N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид,N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4-пентафторбутил)малонамид илиN-S)-5-ацетил-1-бензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-(2RS)-метил-N'(2,2,3,3,3-пентафторпропил)малонамид. Предпочтительны также соединения, в которых R1 означает группу b), например, 2-метил-N-(3 метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[d]азепин-1-ил)-N'-(2,2,2-трифторэтил)малонамид. Предпочтительны также соединения формулы I, в которых R1 означает группу d), например, 2 метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,2-трифторэтил)малонамид или 2 метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Одним вариантом осуществления изобретения являются соединения общей формулы где R1 означает одну из следующих группR2 означает (низш.)алкил, (низш.)алкинил, -(CH2)n-O-(низш.)алкил, -(CH2)n-S-(низш.)алкил, -(CH2)nCN, -(CR'R)n-CF3, -(CR'R)3-CHF2, -(CH2)n-C(O)O-(низш.)алкил, -(CH2)n-галоген, или означает -(CH2)n-4 009940 циклоалкил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей фенил, галоген и CF3,R',R независимо от значения n и независимо друг от друга означают водород, (низш.)алкил,(низш.)алкокси, галоген или гидрокси,R3, R4 независимо друг от друга означают водород, (низш.)алкил, фенил или галоген,R5 означает (низш.)алкил или -(СН 2)n-циклоалкил, R6 означает водород или галоген, R7 означает водород или (низш.)алкил,R8 означает водород, (низш.)алкил, (низш.)алкинил или -(CH2)n-циклоалкил,R9 означает водород, (низш.)алкил, -C(O)-(низш.)алкил, -C(O)-(низш.)циклоалкил, -(CH2)nциклоалкил, фенил, -C(O)-фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей галоген или -C(O)O-(низш.)алкил, или означает -(CH2)n-фенил, необязательно замещенный галогеном,n равно 0, 1, 2, 3 или 4,и их фармацевтически приемлемые кислотно-аддитивные соли, оптически чистые энантиомеры,рацематы или диастереомерные смеси. Указанные соединения формулы I и их фармацевтически приемлемые соли получают известным методами, например способом, указанным ниже, который включает а) взаимодействие соединения формулы где R1-R4 имеют значения, указанные выше, и при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли. Подробное описание способа приводится ниже в примерах 1-121. Исходные материалы формулы IV являются известными соединениями или их можно получить известными методами. Амины формулы VI и III являются коммерческими препаратами или их можно получить описанными в литературе методами. Схема 1 На схеме R1 и R2 имеют значения, указанные выше, a R10 и R11 независимо означают (низш.)алкил. Как показано на схеме 1, соединение формулы I можно получить по следующей последовательности реакций. В охлажденный раствор соединения формулы V, например, моно-трет-бутилового эфира 2 метилмалоновой кислоты, и амина формулы VI, например, 7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин 6-она, в ТГФ добавляли гидроксибензотриазол, диизопропилэтиламин и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида и смесь перемешивали при КТ в течение ночи. Растворитель выпаривали, остаток промывали, высушивали и очищали обычным способом. Затем к раствору полученного соединения формулы VII, например, трет-бутилового эфира N-(5 метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)моноамида 2-метилмалоновой кислоты, в дихлорметане добавляли ТФУ (трифторуксусную кислоту) и смесь перемешивали при КТ в течение ночи. Затем смесь переносили в дихлорметан, промывали и сушили. Растворитель выпаривали, при этом получали соединение формулы II, например, N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил) моноамид 2-метилмалоновой кислоты. Полученное соединение и соединение формулы III, например циклопропилметиламин, помещали в одноразовую полипропиленовую пробирку и растворяли в ДМФА.-5 009940 Затем добавляли TPTU (тетрафторборат 2-(2-пиридон-1-ил)-1,1,3,3-тетраметилурония) и смесь встряхивали при КТ в течение ночи. Полученное соединение формулы I выделяли и очищали соответствующим способом. Из соединений формулы I можно получить соответствующую кислотно-аддитивную соль. Соли получают при обработке соединения по меньшей мере стехиометрическим количеством соответствующей кислоты, такой как хлористо-водородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и т.п., и органической кислоты, такой как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота,бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, пара-толуолсульфоновая кислота, салициловая кислота и т.п. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ,этанол или метанол и т.п., и добавляют кислоту в том же растворителе. Температуру поддерживают в диапазоне от 0 до 50 С. Образующаяся соль самопроизвольно выпадает в осадок или ее можно растворить в менее полярном растворителе. Кислотно-аддитивные соли соединений формулы I можно превратить в соответствующие свободные основания при добавлении, по меньшей мере, стехиометрического количества пригодного основания, такого, как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммония и т.п. Соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли обладают ценными фармакологическими свойствами. Установлено прежде всего, что соединения по настоящему изобретению могут ингибировать -секретазу. Соединения испытывали по указанной ниже методике. Определение ингибирующей активности в отношении -секретазы Активность анализируемых соединений определяли по расщеплению -секретазой соответствующих субстратов. Анализ можно проводить на клеточном уровне, например, используя субстрат секретазы, у которого цитоплазматический домен гибридизирован с фактором транскрипции. Клетки трансфектируют гибридным геном и репортерным геном, например, геном люцеферазы светлячка, экспрессия которого усиливается фактором транскрипции. Расщепление гибридного субстрата -секретазой приводит к экспресии репортерного гена, которая регистрируется в ходе соответствующего анализа. Активность -секретазы можно также определять в бесклеточной среде in vitro, например, клеточный лизат,содержащий комплекс -секретазы, инкубируют с соответствующим субстратом (полученным из АРР),который расщепляется до абета-пептидов. Количество полученных пептидов можно определять специфичными методами ИФА. Клеточные линии нейронального происхождения секретируют абета-пептиды,которые измеряют специфичнным методом ИФА. Обработка соединениями, которые ингибируют секретазу, приводит к снижению уровня секретируемых абета-пептидов, что является показателем ингибирования. При определениия активности -секретазы in vitro в качестве источника -секретазы используют мембраную фракцию клеток НЕК 293, в качестве субстрата используют рекомбинантный АРР. Гибридный белок включает С-концевой фрамент из 100 аминокислот АРР человека, гибридизованный с гексагистидиновым фрагментом, предназначенным для последующей очистки методом аффинной хроматографии, и экспрессированный в E.coli в регулируемый вектор экспрессии, например, pEt15. Такой рекомбинантный белок соответствует укороченному фрагменту АРР, который образуется после расщепления-секретазой внеклеточного домена и который является субстратом -секретазы. В основном анализ описан в статье Li Y.M. и др., PNAS, 97(11), 6138-6143 (2000). Клетки Hek293 разрушали механическим способом, микросомальную фракцию выделяли дифференциальным центрифугированием. Мембраны солюбилизировали в растворе детергента (0,25% CHAPSO) и инкубировали с субстратом АРР. Абетапептиды, образующиеся при расщеплении субстрата -секретазой, определяли специфичным методом ИФА, описанным в литературе (Brockhaus М. и др., Neworeport, 9(7), 1481-1486 (1998. Предпочтительные соединения характеризуются величинами IC50 0,1 мкМ. Данные по ингибированию -секретазы приводятся ниже в таблице 1. Таблица 1 Пример Соединения формулы I и фармацевтически приемлемые соли соединений формулы I можно использовать в качестве лекарственных средств, например, в форме фармацевтических препаратов. Фармацевтические препараты можно вводить пероральным способом, например, в форме таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение можно проводить ректальным способом в форме суппозиториев, и парентеральным способом в форме инъекционных растворов. Соединения формулы I можно перерабатывать в смеси с фармацевтически инертными, неорганическими или органическими носителями для получения фармацевтических препаратов. В качестве носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла,воски, жиры, полутвердые и жидкие полиолы и т.п., однако, в зависимости от природы активного вещества в случае мягких желатиновых капсул обычно не требуется никаких носителей. Пригодными носителями для получения растворов и сиропов являются, например, вода, полиолы, глицерин, растительные масла и т.п. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п. Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизирующие агенты, стабилизирующие агенты, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные вещества. Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель также являются объектом настоящего изобретения, как и способ их получения, который включает смешивание одного или более соединений формулы I и/или фармацевтически приемлемых кислотно-аддитивных солей и при необходимости одного или более других терапевтически ценных соединений с образованием галеновой готовой формы в смеси с одним или более терапевтически инертными носителями. Соединения формулы I, а также их фармацевтически приемлемые соли могут применяться для лечения или профилактики заболеваний, таких как болезнь Альцгеймера, благодаря ингибированию секретазы. Дозы могут изменяться в широких пределах в соответствии с индивидуальными требованиями в каждом конкретном случае. В случае перорального введения взрослому человеку суточная доза может изменяться от приблизительно 0,01 мг до приблизительно 1000 мг соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Суточная доза может вводиться в виде разовой дозы или разделенными дозами, причем верхний предел может быть превышен в соответствии с показанием. Состав таблетки (влажное гранулирование) мг в таблетке Ингредиенты 5 мг 25 мг 100 мг 500 мг 1. Соединения формулы I 5 25 100 500 2. Лактоза безводная DTG 125 105 30 150 Методика получения 1. Смешать ингредиенты 1, 2, 3 и 4, гранулировать смесь в очищенной воде. 2. Высушить гранулы при температуре 50 С. 3. Размолоть гранулы на соответствующем оборудовании. 4. Добавить ингредиент 5 и перемешивать в течение трех мин; таблетировать на соответствующем прессе. Состав капсул мг в капсуле Ингредиенты 5 мг 25 мг 100 мг 500 мг 1. Соединени формулы I 5 25 100 500 2. Лактоза безводная 159 123 148 3. Кукурузный крахмал 25 35 40 70 4. Тальк 10 15 10 25 5. Стеарат магния 1 2 2 5 Всего 200 200 300 600 Методика получения 1. Смещать ингредиенты 1, 2 и 3 в соответствующем смесителе в течение 30 мин. 2. Добавить ингредиенты 4 и 5 и перемешать в течение 3 мин. 3. Заполнить смесью капсулы соответствующего размера. Примеры Пример 1. N-Циклопропилметил-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 ил)малонамид.N-(3-диметиламинопропил)-N'-этилкарбодиимида (925 мг, 4,83 ммоля). Смесь перемешивали при КТ в течение ночи. Растворитель упаривали, остаток переносили в этилацетат, промывали водой и сушили(Na2SO4). Растворитель упаривали, остаток очищали хроматографией на силикагеле (элюент: МеОН,CH2Cl2), при этом получали указанное в заголовке соединение (920 мг, 48%). МС: m/e 395,3 (М+Н+).b) N-(5-Метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)моноамид 2-метилмалоновой кислоты. В раствор трет-бутилового эфира N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)моноамида 2-метилмалоновой кислоты (920 мг, 2,33 ммоля) в дихлорметане (3 мл) добавляли ТФУ (3 мл) и смесь перемешивали при КТ в течение ночи. Затем смесь переносили в дополнительную порцию дихлорметана, промывали водой и сушили (Na2SO4). Растворитель упаривали, остаток очищали хроматографией на силикагеле (элюент: МеОН, CH2Cl2), при этом получали указанное в заголовке соединение(20 мг, 0,059 ммоля) и циклопропилметиламин (5 мг, 0,059 ммоля) помещали в одноразовую полипропиленовую пробирку и растворяли в ДМФА (2 мл). Затем добавляли TPTU (тетрафторборат 2-(2-пиридон 1-ил)-1,1,3,3-тетраметилурония (19 мг, 0,065 ммоля) и смесь встряхивали при КТ в течение ночи. Указанное в заголовке соединение, МС: m/е 392,2 (М+Н+), выделяли из реакционной смеси с использованием препаративной ЖХВР в автоматизированной системе (колонка: CombiPrep 50 х 20 мм, С 18 YMC, элюент: градиент СН 3 СН/0,1% ТФУ (водн.), 5-95%, 6,0 мин,230 нм, скорость элюции 40 мл/мин). Пример 2. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-этилмалонамид. Указанное в заголовке соединение, МС: m/е 366,2 (М+Н+), получали из этиламина аналогично тому,как описано в примере 1. Пример 3. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-пропаргилмалонамид. Указанное в заголовке соединение, МС: m/e 376,3 (М+Н+), получали из пропаргиламина аналогично тому, как описано в примере 1.-8 009940 Пример 4. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2-метоксиэтил) малонамид. Указанное в заголовке соединение, МС: m/e 396,3 (М+Н+), получали из 2-метоксиэтиламина аналогично тому, как описано в примере 1. Пример 5. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-пропилмалонамид. Указанное в заголовке соединение, МС: m/e 380,3 (М+Н+), получали из пропиламина аналогично тому, как описано в примере 1. Пример 6. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2-метилтиоэтил)малонамид. Указанное в заголовке соединение, МС: m/e 412,3 (М+Н+), получали из 2-метилтиоэтиламина аналогично тому, как описано в примере 1. Пример 7. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-циклобутилмалонамид. Указанное в заголовке соединение, МС: m/e 392,3 (М+Н+), получали из циклобутиламина аналогично тому, как описано в примере 1. Пример 8. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3-метоксипропил)малонамид. Указанное в заголовке соединение, МС: m/e 410,3 (М+Н+), получали из 3-метоксипропиламина аналогично тому, как описано в примере 1. Пример 9. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-цианометилмалонамид. Указанное в заголовке соединение, МС: m/e 377,3 (М+Н+), получали из аминоацетонитрила аналогично тому, как описано в примере 1. Пример 10. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-циклопропилмалонамид. Указанное в заголовке соединение, МС: m/e 378,3 (М+Н+), получали из циклопропиламина аналогично тому, как описано в примере 1. Пример 11. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2-цианоэтил) малонамид. Указанное в заголовке соединение, МС: m/e 391,2 (М+Н+), получали из 3-аминопропионитрила аналогично тому, как описано в примере 1. Пример 12. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2-этоксиэтил) малонамид. Указанное в заголовке соединение, МС: m/e 410,3 (М+Н+), получали из 2-этоксиэтиламина аналогично тому, как описано в примере 1. Пример 13. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,2-трифторэтил)малонамид. Указанное в заголовке соединение, МС: m/e 420,2 (М+Н+), получали из 2,2,2-трифторэтиламина аналогично тому, как описано в примере 1. Пример 14. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,3-трифторпропил)малонамид. Указанное в заголовке соединение, МС: m/e 434,3 (М+Н+), получали из 3,3,3-трифторпропиламина аналогично тому, как описано в примере 1. Пример 15. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид. Указанное в заголовке соединение, МС: m/e 470,1 (М+Н+), получали из 2,2,3,3,3-пентафторпропиламина аналогично тому, как описано в примере 1. Пример 16. трет-Бутиловый эфир [2-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 илкарбамоил)пропиониламино]уксусной кислоты. Указанное в заголовке соединение, МС: m/e 452,3 (М+Н+), получали из трет-бутилового эфира глицина аналогично тому, как описано в примере 1. Пример 17. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,3-трифтор-2-гидроксипропил)малонамид. Указанное в заголовке соединение, МС: m/e 450,2 (М+Н+), получали из 3-амино-1,1,1-трифтор-2 пропанола аналогично тому, как описано в примере 1. Пример 18. N-(2,2-Дифтор-3-фенилциклопропилметил)-2-метил-N'-(5-метил-6-оксо-6,7-дигидро 5 Н-дибензо[b,d]азепин-7-ил)малонамид. Указанное в заголовке соединение, МС: m/e 504,3 (М+Н+), получали из С-(2,2-дифтор-3 фенилциклопропил)метиламина аналогично тому, как описано в примере 1. Пример 19. N-(2,2-Дифторциклопропилметил)-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо-9 009940 Указанное в заголовке соединение, МС: m/e 428,2 (М+Н+), получали из С-(2,2-дифторциклопропил) метиламина аналогично тому, как описано в примере 1. Пример 20. 2-Метил-N-(3-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[d]азепин-1-ил)-N'-(2,2,2-трифторэтил)малонамид. а) Моноэтиловый эфир 2-метилмалоновой кислоты. В раствор гидроксида калия (6,44 г, 115 ммолей) в 200 мл этанола добавляли диэтиловый эфир метилмалоновой кислоты (20,0 г, 115 ммолей) и смесь кипятили с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали, концентрировали на роторном испарителе, добавляли 50 мл воды и смесь экстрагировали эфиром (2 х 50 мл). Водный раствор подкисляли 4 М соляной кислотой и экстрагировали этилацетатом (3 х 50 мл). Объединенные органические слои сушили (MgSO4) и концентрировали при пониженном давлении. Полученный продукт использовали без дополнительной обработки. МС: m/eb) Этиловый эфир N-(2,2,2-трифторэтил)моноамида 2-метилмалоновой кислоты. В раствор моноэтилового эфира метилмалоновой кислоты (1,56 г, 10,6 ммоля) в 20 мл тетрагидрофурана добавляли 2,2,2-трифторэтиламин (1,06 г, 10,6 ммоля), гидрохлорид N-(3-диметиламинопропил)N'-этилкарбодиимида (2,05 г, 10,6 ммоля), гидрат 1-гидроксибензотриазола (1,44 г, 10,6 ммоля) и N,Nдиизопропилэтиламин (2,75 г, 21,2 ммоля) и смесь перемешивали при комнатной температуре в течение 18 ч. Затем смесь выливали в 0,5 н. HCl (50 мл) и экстрагировали дихлорметаном (3 х 50 мл). Объединенные органические слои экстрагировали 0,5 н. водным раствором NaHCO3, сушили (MgSO4) и упаривали на роторном испарителе. Остаток очищали хроматографией на колонке (элюент: гексан/этилацетат, 2:1),при этом получали указанное в заголовке соединение в виде твердого кристаллического вещества белого цвета (1,48 г, 61%). МС: m/e (%) 226,1 (М-Н+, 100).c) N-(2,2,2-Трифторэтил)моноамид 2-метилмалоновой кислоты. В раствор этилового эфира N-(2,2,2-трифторэтил)моноамида 2-метилмалоновой кислоты (1,48 г,6,52 ммоля) в 40 мл тетрагидрофурана добавляли 20 мл воды и гидроксид лития (1,09 г, 26 ммолей) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме, добавляли воду (50 мл) и экстрагировали дихлорметаном (3 х 30 мл). Водную фазу подкисляли 8 н. соляной кислотой и экстрагировали дихлорметаном (4 х 30 мл). Объединенные органические слои после второй экстракции сушили (MgSO4) и упаривали в вакууме, при этом получали указанное в заголовке соединение в виде твердого вещества белого цвета (1,09 г,84%). МС: m/e (%) 197,9 (М-Н+, 100).d) 2-Метил-N-(3-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[d]азепин-1-ил)-N'-(2,2,2-трифторэтил) малонамид. В раствор N-(2,2,2-трифторэтил)моноамида 2-метилмалоновой кислоты (0,066 г, 0,3 ммоля) в 2 мл тетрагидрофурана добавляли (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-он (0,057 г, 0,3 ммоля), гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,058 г, 0,3 ммоля), гидрат 1 гидроксибензотриазола (0,040 г, 0,3 ммоля) и N,N-диизопропилэтиламин (0,116 г, 0,9 ммоля) и смесь перемешивали при комнатной температуре в течение 18 ч. Затем добавляли 0,5 н. HCl (5 мл) и смесь экстрагировали дихлорметаном (3 х 5 мл). Объединенные органические слои экстрагировали 0,5 н. водным раствором NaHCO3, сушили (MgSO4) и упаривали на роторном испарителе. Остаток очищали экспрессхроматографией (элюент: гексан/этилацетат, 3:1), при этом получали смесь диастереомеров указанного в заголовке соединения в виде твердого вещества белого цвета (0,10 г, 89%). МС: m/e (%) 372,1 (М+Н+,100). Пример 21. 2-Метил-N-(1-метил-2-оксо-5-фенил-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)N'-(2,2,2-трифторэтил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии d) (RS)-3-амино-1-метил-5-фенил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она вместо(RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 449,1(M+H+, 100). Пример 22. N-(5-Метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-фенил-N'-(2,2,2-трифторэтил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира фенилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, и на стадии d) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо (RS)-1 амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 482,1(М+Н+, 100). Пример 23. 2-Фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,2 трифторэтил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, и на стадии d) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо(RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 438,3 (М+Н+, 100). Пример 24. 2-Фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) пентафторпропиламина вместо 2,2,2-трифторэтиламина и на стадииd) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 488,2 (М+Н+, 100). Пример 25. 2-Метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'(2,2,3,3,3-пентафторпропил)малонамид. а) (S)-3-Амино-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. В раствор трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)карбаминовой кислоты (5,0 г, 18 ммолей) в 80 мл тетрагидрофурана при -75 С добавляли раствор литий-бис(триметилсилил)амида (1 М в тетрагидрофуране, 18 мл, 18 ммолей). Реакционную смесь перемешивали при -75 С в течение 30 мин, нагревали до комнатной температуры и добавляли метилиодид (3,07 г, 21,6 ммоля). Смесь перемешивали при комнатной температуре в течение 2,5 ч и концентрировали в вакууме. Остаток распределяли между 1 М раствором NaHSO4 и этилацетатом. Объединенные органические слои повторно экстрагировали водой и сушили (MgSO4). Растворитель упаривали, добавляли 20 мл дихлорметана и 20 мл трифторуксусной кислоты, смесь перемешивали при комнатной температуре в течение 2,5 ч, концентрировали в вакууме, добавляли этилацетат и дважды экстрагировали водой. Водную фазу подщелачивали гидроксидом натрия и трижды экстрагировали этилацетатом. Объединенные органические слои сушили (MgSO4) и упаривали. Остаток очищали хроматографией на колонке (элюент: дихлорметан/метанол, 9:1), при этом получали (S)-3-амино-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он (2,1 г, 65%). МС: m/e (%) 192,2 (М-Н+, 100).b) 2-Метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) пентафторпропиламина вместо 2,2,2-трифторэтиламина, и на стадии d) (S)-3-амино-1 метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 421,2(М-Н+, 100). Пример 26. N-3S)-5-Бензоил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2 метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. В раствор 2-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'(2,2,3,3,3-пентафторпропил)малонамида(0,2 г, 0,47 ммоля) в 3 мл дихлорметана добавляли триэтиламин(0,096 г, 0,95 ммоля) и бензоилхлорид (0,08 мг, 0,57 ммоля). Смесь перемешивали при комнатной температуре в течение 20 мин, добавляли соляную кислоту (10 мл 1 н. раствора) и смесь дважды экстрагировали дихлорметаном. Объединенные органические слои экстрагировали 1 н. раствором бикарбоната натрия,сушили (MgSO4) и концентрировали в вакууме. Полученное масло очищали хроматографией на колонке,при этом получали пену белого цвета (0,15 г, 60%). МС: m/e (%) 527,3 (М+Н+, 100). Пример 27. N-3S)-5-Бензоил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)2,2-диметил-N'-(2,2,2-трифторэтил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 25, при использовании на стадии b) диэтилового эфира 2,2-диметилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты и 2,2,2-трифторэтиламина вместо пентафторпропиламина с последующей обработкой бензоилхлоридом, как описано в примере 26, причем выходы были аналогичны описанным в указанных примерах. МС: m/e (%) 491,3 (М+Н+, 100). Пример 28. N-[(3S)-5-(4-Фторбензоил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании 4-фторбензоилхлорида вместо бензоилхлорида, при этом выходы были аналогичны описанным в примере 26. МС: m/e (%) 545,3 (М+Н+, 100). Пример 29. N-[(3S)-5-(4-Хлорбензоил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании 4-хлорбензоилхлорида вместо бензоилхлорида, при этом выходы были аналогичны описанным в примере 26. МС: m/e (%) 561,4 (М+Н+, 100). Пример 30. N-[(3S)-5-(3,5-Дифторбензоил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид.- 11009940 Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании 3,5-дифторбензоилхлорида вместо бензоилхлорида, при этом выходы были аналогичны описанным в примере 26. МС: m/e (%) 563,4 (М+Н+, 100). Пример 31. 2-Фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,3 трифтор-2-гидрокси-1,1-диметилпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина, и на стадии d) рац.-3-амино-1,1,1-трифтор-3-метил-2-бутанола вместо (RS)-1-амино 3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 496,2 (М+Н+, 100). Пример 32. 2-Фтор-N-(2-фторэтил)-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин 7-ил)малонамид. Указанное в заголовке соединение получали аналогично тому, как описано в примере 20 при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 2-фторэтиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 402,2 (М+Н+, 100). Пример 33. N-(2,2-Дифторэтил)-2-фтор-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d] азепин-7-ил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 2,2-дифторэтиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 420,1(M+H+, 100). Пример 34. 2-Фтор-N-(2-цис-фторциклопропил)-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)малонамид. Указанное в заголовке соединение получали аналогично тому, как описано в примере 20 при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) цис-2-фторциклопропиламина вместо (RS)-1-амино-3 метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 414,2 (М+Н+, 100). Пример 35. 2-Фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4-тетрафторбутил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 3,3,4,4-тетрафторбутиламина (полученного из соответствующего бромида с использованием фталимида, как описано в статье Jacobs и др.: J.Med.Chem, 37, 1282 (1994 вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 484,2 (М+Н+, 100). Пример 36. 2-Фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(4,4,4 трифторбутил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 4,4,4-трифторбутиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 466,2 (М+Н+, 100). Пример 37. 2-Фтор-2-метил-N-(3-метилбутил)-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 3-метилбутиламина вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 426,2 (М+Н+, 100). Пример 38. 2-Фтор-2-метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(1 трифторметилциклопропилметил)малонамид.- 12009940 Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2-фтор-2-метилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 1-трифторметилциклопропилметиламина (полученного из соответствующего спирта с использованием фталимида, как описано в статье Jacobs и др., J. Med. Chem, 37, 1282(1994 вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 478,1 (М+Н+, 100). Пример 39. Метиловый эфир 4-(3S)-5-метил-4-оксо-3-[2-(2,2,3,3,3-пентафторпропилкарбамоил) пропиониламино]-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбонилбензойной кислоты. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании 4-(метоксикарбонил)бензоилхлорида вместо бензоилхлорида, при этом выход был аналогичен описанному в примере 26. МС: m/e (%) 583,3 (М+Н+, 100). Пример 40. N-3S)-5-Ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2 метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании ацетилхлорида вместо бензоилхлорида, при этом выход был аналогичен описанному в примере 26. МС: m/e (%) 465,2 (М+Н+, 100). Пример 41. 2-Метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,2-трифторэтил) малонамид. а) Гидрохлорид (RS)-11-амино-11 Н-дибензо[b,f]оксепин-10-она. В раствор 11 Н-дибензо[b,f]оксепин-10-она (1,85 г, 8,77 ммоля) в 4 мл толуола при -20 С добавляли трет-бутоксид калия (2,5 г, 21,9 ммоля) и раствор насыщали N2. Реакционную смесь перемешивали в течение 15 мин, затем добавляли изоамилнитрит (1,2 г, 10,5 ммоля). Раствор перемешивали при комнатной температуре в течение ночи, охлаждали до 0 С в течение 15 мин, затем добавляли воду (80 мл), уксусную кислоту (4 мл) и этилацетат (80 мл). Водную фазу экстрагировали этилацетатом. Объединенные органические слои повторно экстрагировали водой и сушили (MgSO4). Этилацетат упаривали, полученную суспензию оксима в толуоле охлаждали до 0 С в течение 1 ч и фильтровали. Твердое вещество растворяли в тетрагидрофуране (20 мл), затем добавляли 8 мл 1 М раствора соляной кислоты в тетрагидрофуране и 20 мг оксида платины. Через реакционную смесь пропускали N2, а затем помещали в атмосферу водорода при давлении 50 фунт/кв.дюйм при комнатной температуре. Реакционную смесь перемешивали в течение ночи в атмосфере водорода, при этом получали осадок, который отделяли фильтрованием, промывали тетрагидрофураном и перекристаллизовывали из метанола/тетрагидрофурана, при этом получали 0,9 г кристаллов белого цвета. t пл.215-217C.b) 2-Метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,2-трифторэтил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20 при использовании на стадии d) (RS)-11-амино-11 Н-дибензо[b,f]оксепин-10-она вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны указанным в примере 20. МС: m/e(%) 407,3 (М+Н+, 100). Пример 42. 2-Метил-N-(11-оксо-10,11-дигидродибензо[b,f]оксепин-10-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) 2,2,3,3,3-пентафторпропиламина вместо 2,2,2-трифторэтиламина и на стадии d) (RS)11-амино-11 Н-дибензо[b,f]оксепин-10-она вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 457,4 (М+Н+, 100). Пример 43. 2-Метил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(4,4,4-трифтор-3-метоксибутил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 4,4,4-трифтор-3-метоксибутиламина (полученного из 4,4,4-трифтор-3-метоксибутанамида восстановлением в присутствии литийалюминийгидрида, как описано в статье Jacobs и др., J.Med. Chem, 37, 1282 (1994 вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 476,3 (М-Н+, 100). Пример 44. 2-Фтор-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4-тетрафторбутил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 3,3,4,4-тетрафторбутиламина (полученного из соответствующего бромида с использованием фталимида, как описано в статье Jacobs и др., J.Med.Chem, 37, 1282 (1994 вместо (RS)1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 464,2 (М-Н+, 100). Пример 45. N-(3-Изопропоксипропил)-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d] азепин-7-ил)малонамид.- 13009940 Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 3-изопропоксипропиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 436,3 (М+Н+, 100). Пример 46. N-3S)-1-Циклопропилметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 25, при использовании на стадии а) циклопропилметилбромида вместо метилиодида, при этом выходы были аналогичны описанным в примере 25. МС: m/e (%) 463,5 (М+Н+, 100). Пример 47. N-3S)-1,5-Диметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метилN'-(2,2,3,3,3-пентафторпропил)малонамид.a) трет-Бутиловый эфир 3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)карбаминовой кислоты. В раствор трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил) карбаминовой кислоты (5,0 г, 18 ммолей) в 80 мл тетрагидрофурана при -75 С добавляли раствор бис(триметилсилил)амид лития (1 М раствор в тетрагидрофуране, 18 мл, 18 ммолей). Реакционную смесь перемешивали в течение 30 мин при -75 С, нагревали до комнатной температуры и добавляли метилиодид (3,07 г, 21,6 ммоля). Смесь перемешивали в течение 2,5 ч при комнатной температуре и концентрировали в вакууме. Остаток распределяли между 1 М раствором NaHSO4 и этилацетатом. Объединенные органические слои повторно экстрагировали водой и сушили (MgSO4), при этом получали третбутиловый эфир (1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты в виде пены белого цвета (4,95 г, 94%). МС: m/e (%) 292,0 (М+Н+, 100).b) (S)-3-Амино-1,5-диметил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. В раствор трет-бутилового эфира (1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)карбаминовой кислоты (0,29 г, 1 ммоль) в диметилформамиде (3 мл) добавляли карбонат калия (0,46 г, 3,33 ммоля) и метилиодид (0,17 г, 1,2 ммоля) и смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли воду (10 мл) и смесь экстрагировали этилацетатом (2 х 10 мл). Объединенные органические слои сушили (MgSO4) и продукт очищали хроматографией на колонке (элюент: гексан/этилацетат, 1:1), при этом получали твердое вещество белого цвета (0,19 г, 62%). Указанное соединение растворяли в смеси 2 мл дихлорметана и 2 мл трифторуксусной кислоты и перемешивали при КТ в течение 2,5 ч. Смесь концентрировали в вакууме, затем добавляли дихлорметан и смесь экстрагировали раствором бикарбоната натрия. Органическую фазу сушили (MgSO4) и упаривали, при этом получали 0,12 г (S)-3-амино-1,5-диметил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она в виде твердого вещества светло-желтого цвета. МС: m/e (%) 206,4 (М+Н+, 100). с) N-3S)-1,5-Диметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) пентафторпропиламина вместо 2,2,2-трифторэтиламина и на стадии d) (S)-3-амино 1,5-диметил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 437,5 (М+Н+, 100). Пример 48. N-3S)-5-Циклопропилметил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 47, при использовании на стадии b) циклопропилметилбромида вместо метилиодида при этом выходы были аналогичны описанным в примере 47. МС: m/e (%) 477,3 (М+Н+, 100). Пример 49. N-[5-3S)-4-Фторбензил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 47, при использовании на стадии b) 4-фторбензилбромида вместо метилиодида, при этом выходы были аналогичны описанным в примере 47. МС: m/e (%) 531,3 (М+Н+, 100). Пример 50. N-[(3S)-5-(4-Хлорбензоил)-1-циклопропилметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании N-3S)-1-циклопропилметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метилN'-(2,2,3,3,3-пентафторпропил)малонамида вместо 2-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида и при использовании 4 хлорбензоилхлорида вместо бензоилхлорида, при этом выход были аналогичен описанному в примере 26. МС: m/e (%) 601,5 (М+Н+, 100). Пример 51. N-(5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'(2,2,3,3,3-пентафторпропил)малонамид.a) 5-Циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он. В раствор 5 Н,7 Н-дибензо[b,d]азепин-6-она (0,5 г, 2,4 ммоля) в 6 мл диметилформамида при комнатной температуре добавляли гидрид натрия (0,143 г, 3,58 ммоля). Реакционную смесь перемешивали в течение 1 ч, затем при 60 С добавляли циклопропилметилбромид (0,97 г, 7,2 ммоля) и перемешивали при 60 С в течение ночи. Смесь охлаждали до комнатной температуры и распределяли между водой и дихлорметаном. Объединенные органические слои экстрагировали раствором сульфата натрия, сушили(MgSO4) и концентрировали в вакууме, остаток очищали хроматографией на колонке (элюент: гексан/этилацетат, 1:1), при этом получали 5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он в виде твердого кристаллического вещества белого цвета (0,6 г, 95%). МС: m/e (%) 264,1 (M+H+, 100).b) (RS)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он. В раствор 5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-она (0,3 г, 1,14 ммоля) в 5 мл толуола добавляли изоамилнитрит (0,285 г, 2,44 ммоля) и смесь охлаждали до 0 С. Затем медленно добавляли раствор бис(триметилсилил)амида калия (0,5 М раствор в толуоле, 3,6 мл, 1,83 ммоля) и смесь перемешивали при указанной температуре в течение 1 ч. Затем добавляли раствор гидросульфата натрия и смесь дважды экстрагировали этилацетатом. Объединенные органические слои экстрагировали водой и сушили (MgSO4). Растворитель упаривали, при этом получали пену белого цвета (0,2 г), которую растворяли в этаноле (5 мл). Затем добавляли палладий на угле (90 мг) и смесь гидрировали в атмосфере Н 2 при давлении 2,5 бар в течение 32 ч. Катализатор отделяли фильтрованием и растворитель упаривали. Остаток распределяли между дихлорметаном (5 мл) и 4 н. соляной кислотой (2 мл). Водный раствор отделяли, подщелачивали добавлением гидроксида натрия, дважды экстрагировали этилацетатом, экстракт сушили (MgSO4) и растворитель упаривали, при этом получали твердое вещество грязно-белого цвета (0,1 г, 52%). МС: m/e (%) 279,3 (М+Н+,100). с) N-(5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3 пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) 2,2,3,3,3-пентафторпропиламина вместо 2,2,2-трифторэтиламина и на стадии d) (RS)7-амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 508,4 (М-Н+, 100). Пример 52. N-3S)-1-Ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'(2,2,3,3,3-пентафторпропил)малонамид. а) 5-Ацетил-3-амино-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. Раствор трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3 ил)карбаминовой кислоты (0,5 г, 1,8 ммоля) в 1,7 мл уксусного ангидрида перемешивали при 65 С в течение 3 ч. Смесь выливали в воду (5 мл) и экстрагировали дихлорметаном (2 х 10 мл). Объединенные органические слои сушили (MgSO4) и упаривали, при этом получали пену светло-желтого цвета (0,6 г). Продукт растворяли в смеси 2 мл дихлорметана и 2 мл трифторуксусной кислоты и перемешивали при КТ в течение 2,5 ч. Смесь концентрировали в вакууме, затем добавляли дихлорметан и экстрагировали раствором бикарбоната натрия. Органическую фазу сушили (MgSO4) и упаривали, при этом получали(S)-1-ацетил-3-амино-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он в виде твердого вещества светложелтого цвета (0,31 г). МС: m/e (%) 220,4 (М+Н+, 100).b) N-(1-Ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) пентафторпропиламина вместо 2,2,2-трифторэтиламина и на стадии d) (S)-1-ацетил-3 амино-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 449,2(М+Н+, 100). Пример 53. N-3S)-5-Ацетил-1-циклопропилметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании N-3S)-1-циклопропилметил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-2-метилN'-(2,2,3,3,3-пентафторпропил)малонамида вместо 2-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида и при использовании ацетилхлорида вместо бензоилхлорида, при этом выходы были аналогичны описанным в примере 26. МС: m/e(%) 503,2 (М-Н+, 100). Пример 54. N-(3-трет-Бутоксипропил)-2-метил-N'-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d] азепин-7-ил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 3-трет-бутоксипропиламина вместо (RS)-1-амино-3-метил-1,3,4,5-тетра- 15009940 гидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 396,2 (М-С 4 Н 9+Н+, 100); 452,2 (М+Н+, 43). Пример 55. 2-Метил-N-3S)-2-оксо-1-проп-2-инил-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 25, при использовании на стадии а) проп-2-инилбромида вместо метилиодида, при этом выходы были аналогичны описанным в примере 25. МС: m/e (%) 447,5 (М+Н+, 100). Пример 56. N-3S')-5-Циклопропанкарбонил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании циклопропанкарбонилхлорида вместо бензоилхлорида, при этом выходы были аналогичны описанным в примере 26. МС: m/e (%) 491,5 (М+Н+, 100). Пример 57. 2-Этил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира этилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 2,2,3,3,3-пентафторпропиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 484,5 (М+Н+, 100). Пример 58. 2-Изопропил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира изопропилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 2,2,3,3,3-пентафторпропиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 498,5 (М+Н+, 100). Пример 59. N-3S)-5-Циклопропилметил-2-оксо-1-проп-2-инил-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 47, при использовании на стадии а) проп-2-инилбромида вместо метилиодида и на стадии b) циклопропилметилбромида вместо метилиодида, при этом выходы были аналогичны описанным в примере 47. МС: m/e (%) 501,4[1,4]диазепин-3-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методике, описанной в примере 26, при использовании 2-метил-N-3S)-2-оксо-1-проп-2-инил-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида вместо 2-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида и при использовании циклопропанкарбонилхлорида вместо бензоилхлорида, при этом выходы были аналогичны описанным в примере 26. МС:m/e (%) 515,4 (М+Н+, 100). Пример 61. N-(5-Метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира малоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 2,2,3,3,3-пентафторпропиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 456,5 (М+Н+, 100). Пример 62. 2,2-Диметил-N-(5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии а) диэтилового эфира 2,2-диметилмалоновой кислоты вместо диэтилового эфира метилмалоновой кислоты, на стадии b) (RS)-7-амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2 трифторэтиламина и на стадии d) 2,2,3,3,3-пентафторпропиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 484,5 (М+Н+, 100). Пример 63. N-(3-Фтор-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) (RS)-7-амино-3-фтор-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она (полученного анало- 16009940 гично тому, как описано для 2-фторпроизводного в патенте WO9932453) вместо 2,2,2-трифторэтиламина и на стадии d) 2,2,3,3,3-пентафторпропиламина вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 486,4 (М-Н+,100). Пример 64. N-(2-Фтор-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) (RS)-7-амино-2-фтор-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо 2,2,2-трифторэтиламина и на стадии d) 2,2,3,3,3-пентафторпропиламина вместо (RS)-1-амино-3-метил-1,3,4,5 тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e(%) 486,2 (М-Н+, 100). Пример 65. 2-Метил-N-(6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. а) 5-(4-Метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-он. В раствор 5 Н,7 Н-дибензо[b,d]азепин-6-она (0,82 г, 4 ммоля) в 15 мл диметилформамида при комнатной температуре добавляли гидрид натрия (55% раствор в масле, 0,20 г, 5 ммолей). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин, добавляли параметоксибензилхлорид(0,75 г, 5 ммолей) и смесь перемешивали при комнатной температуре в течение 2 ч. Затем смесь распределяли между водой и этилацетатом. Органический слой экстрагировали 1 н. соляной кислотой и водные слои промывали этилацетатом. Объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (элюент: гексан/этилацетат, 1:1), при этом получали 5-(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-он (1,175 г, 91%) в виде бесцветного масла. МС:b) (RS)-7-Амино-5-(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-он. В раствор 5-(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-она (1,15 г, 3,5 ммоля) в 15 мл толуола добавляли изоамилнитрит (0,836 г, 7 ммолей) и смесь охлаждали до 0 С. Затем медленно добавляли раствор бис(триметилсилил) амида калия (0,5 М в толуоле, 21,4 мл, 10,5 ммоля) и смесь перемешивали при указанной температуре в течение 2 ч. Затем добавляли раствор гидросульфита натрия и смесь дважды экстрагировали этилацетатом. Объединенные органические слои экстрагировали водой, сушили (MgSO4) и упаривали. Полученное твердое вещество очищали хроматографией на колонке (элюент: дихлорметан/метанол, 95:5), при этом получали оксим (1,03 г, 81%). Указанное соединение растворяли в этаноле(5 мл), добавляли 1,5 мл 2 н. соляной кислоты, палладий на угле (10%, Degussa 1835, 100 мг) и смесь гидрировали в атмосфере Н 2 при давлении 5 бар при комнатной температуре в течение 24 ч. Катализатор отделяли фильтрованием и растворитель упаривали. Остаток распределяли между дихлорметаном (5 мл) и 4 н. соляной кислотой (2 мл). Водный раствор отделяли, подщелачивали добавлением гидроксида натрия, дважды экстрагировали этилацетатом, экстракт сушили (MgSO4) и упаривали, при этом получали твердое вещество белого цвета (0,8 г, 63%). МС: m/e (%) 345,3 (М+Н+, 100).c) (RS)-7-Амино-5 Н,7 Н-дибензо[b,d]азепин-6-он. В раствор (RS)-7-амино-5-(4-метоксибензил)-5H,7H-дибензо[b,d]азепин-6-она (0,1 г, 0,29 ммоля) в 8 мл дихлорметана при 0 С добавляли трифторуксусную кислоту (0,67 мл, 8,7 ммоля) и трифторметансульфоновую кислоту (0,25 мл, 2,9 ммоля) и смесь перемешивали при комнатной температуре в течение 4 ч. Затем смесь концентрировали в вакууме при 40 С, добавляли водный раствор NaHCO3 и дважды экстрагировали этилацетатом. Объединенные органические слои сушили (MgSO4) и упаривали, при этом получали масло светложелтого цвета, которое использовали на следующей стадии без дополнительной очистки.(RS)-2-Метил-N-(6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 20, при использовании на стадии b) 2,2,3,3,3-пентафторпропиламина вместо 2,2,2-трифторэтиламина и на стадии d) (RS)7-амино-5 Н,7 Н-дибензо[b,d]азепин-6-она вместо (RS)-1-амино-3-метил-1,3,4,5-тетрагидробензо[d]азепин-2-она, при этом выходы были аналогичны описанным в примере 20. МС: m/e (%) 456,5 (М+Н+, 100). Пример 66. N-S)-6-Оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил) малонамид.a) (S)-7-Амино-5-(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-он. Рацемическую смесь (RS)-7-амино-5-(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-она разделяли хроматографией на колонке Chiralpak AD (элюент: изопропанол/гептан, 1:3), при этом получали (S)-7 амино-5-(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-он, [] 589 -146 (1% в CHCl3), и (R)-7-амино-5(4-метоксибензил)-5 Н,7 Н-дибензо[b,d]азепин-6-он, [] 589 +148 (1% в CHCl3).- 17009940 Метоксибензильную группу в составе (S)-7-амино-5-(4-метоксибензил)-5H,7 Н-дибензо[b,d]азепин 6-она удаляли, как описано в примере 65, стадия с) и полученный (S)-7-амино-5 Н,7 Н-дибензо[b,d]азепин 6-он конденсировали с N-(2,2,3,3,3-пентафторпропил)моноамидом малоновой кислоты, как описано в примере 65, стадия d), при этом получали (S)-N-(6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'(2,2,3,3,3-пентафторпропил)малонамид. []589 -79,7 (1% в МеОН). МС: m/e (%) 442,4 (М+Н+, 100). Пример 67. 2,2-Диметил-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид.(S)-7-Амино-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(2,2,3,3,3-пентафторпропил)моноамидом 2,2-диметилмалоновой кислоты, аналогично тому, как описано в примерах 65 и 66, при этом получали 2,2-диметил-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. []589 -38,8 (1% в CHCl3). МС: m/e (%) 470,3 (M+H+, 100). Пример 68. (-)-2-Метокси-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3 пентафторпропил)малонамид.a) Метиловый эфир N-(2,2,3,3,3-пентафторпропил)моноамида 2-метоксималоновой кислоты. Монометиловый эфир 2-метоксималоновой кислоты конденсировали с 2,2,3,3,3-пентафторпропиламином аналогично тому, как описано в примере 73, при этом получали метиловый эфир N(2,2,3,3,3-пентафторпропил)моноамида 2-метоксималоновой кислоты в виде бесцветного масла. МС: m/eb) N-(2,2,3,3,3-Пентафторпропил)моноамид 2-метоксималоновой кислоты. Метиловый эфир N-(2,2,3,3,3-пентафторпропил)моноамида 2-метоксималоновой кислоты омыляли аналогично тому, как описано в примере 75b, при этом получали 2-метокси-N-(2,2,3,3,3 пентафторпропил)моноамид малоновой кислоты в виде твердого вещества белого цвета. МС: m/e (%) 266,0 (М+Н+, 100).(S)-7-Амино-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(2,2,3,3,3-пентафторпропил)моноамидом 2-метоксималоновой кислоты аналогично тому, как описано в примерах 65 и 66, при этом получали (-)-2-метокси-N-(6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил) малонамид в виде твердого вещества белого цвета. []589 -87,6 (1% в МеОН). МС: m/e (%) 472,0 (М+Н+,100). Пример 69. (2R)-2-Фтор-2-метил-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид.a) Этиловый эфир N-[(S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]моноамида (2S)-2-фтор-2 метилмалоновой кислоты. Указанное в заголовке соединение получали в виде твердого вещества белого цвета; МС: m/e 371(М+Н)+, конденсацией (S)-7-амино-5 Н,7 Н-дибензо[b,d]азепин-6-она и моноэтилового эфира (2S)-2-фтор 2-метилмалоновой кислоты (избыток энантиомера 96,9%) аналогично тому, как описано в примере 1 а). Моноэтиловый эфир (2S)-2-фтор-2-метилмалоновой кислоты получали стереоселективным гидролизом соответствующего диэфира с использованием гидролазы Candida cylindracea, как описано в статьеb) N-[(S)-6-Оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]моноамида(2S)-2-фтор-2-метилмалоновой кислоты. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 341 (М-Н)-, при гидролизе этилового эфира (2S)-2-фтор-2-метил-N-[(S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 ил]моноамида малоновой кислоты в щелочных условиях аналогично тому, как описано в примере 1b).c) (2R)-2-Фтор-2-метил-N-[(S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид Указанное в заголовке соединение получали в виде твердого вещества белого цвета; МС: m/e 474(М+Н)+, оптическая чистота 96,4%, конденсацией N-[(S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 ил]моноамида (2S)-2-фтор-2-метилмалоновой кислоты и 2,2,3,3,3-пентафторпропиламина аналогично тому, как описано в примере 1 с). Пример 70. (2S)-2-Фтор-2-метил-N-[(S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 474(RS)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он разделяли методом ЖХВР на колонке Chiralpak AD (элюент: изопропанол/гептан, 1:4), при этом получали (S)-7-амино-5- 18009940 циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он, []589 -162 (1% в МеОН), и (R)-7-амино-5 циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он, []589 +163 (1% в МеОН). Определение абсолютной конфигурации проводили с использованием рентгеноструктурного анализа производного (S)-N-R)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-(6 метоксинафталин-2-ил)пропионамида с (-)-(S)-напроксеном. Раствор (+)-7-амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-она (0,05 г, 0,18 ммоля), (+)(S)-напроксена (0,04 г, 0,18 ммоля), 1-гидроксибензотриазола (0,03 г, 0,18 ммоля), диизопропилэтиламина (0,063 мкл, 0,36 ммоля) и гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,04 г, 0,18 ммоля) в тетрагидрофуране перемешивали при комнатной температуре в течение ночи. Смесь экстрагировали 1 н. соляной кислотой/дихлорметаном, продукт очищали хроматографией на силикагеле, при этом получали (S)-N-R)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-(6-метоксинафталин-2-ил)пропионамид в виде твердого вещества белого цвета (0,09 г, 97%), которое кристаллизовали из этанола. t пл.151-152 С, МС: m/e (%) 491,4 (М+Н+, 100).b) N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. К раствору (S)-7-амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он (0,11 г, 0,38 ммоля) и 3-оксо-3-(2,2,3,3,3-пентафторпропиламино)пропионовой кислоты (0,09 г, 0,38 ммоля) в 10 мл тетрагидрофурана добавляли гидрат 1-гидроксибензотриазола (0,06 г, 0,38 ммоля), диизопропилэтиламин (0,13 мкл, 0,76 ммоля) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,7 г 0,38 ммоля) и реакционную смесь перемешивали при 0 С в течение 4 ч при и комнатной температуре в течение ночи. Растворитель удаляли перегонкой, остаток очищали хроматографией на силикагеле (элюент: гептан/этилацетат, градиент от 0% до 100%), при этом получали N-S)-5-циклопропилметил-6-оксо-6,7 дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид (0,17 г, 89%) в виде твердого вещества белого цвета. []589 -63,9 (1% в СНСl3). МС: m/e (%) 496,3 (М+Н+, 100). Пример 72. (R)-N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2 метил-N'-(2,2,3,3,3-пентафторпропил)малонамид и Пример 73. (S)-N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2 метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. К раствору (S)-7-амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он (0,15 г, 0,54 ммоля) и 2-метил-3-оксо-3-(2,2,3,3,3-пентафторпропиламино)пропионовой кислоты (0,13 г, 0,54 ммоля) в 13 мл тетрагидрофурана добавляли гидрат 1-гидроксибензотриазола (0,07 г, 0,54 ммоля), диизопропилэтиламин (0,19 мкл, 1,08 ммоля) и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (0,11 г, 0,54 ммоля) и смесь перемешивании при комнатной температуре в течение ночи. Реакционную смесь экстрагировали 1 н. соляной кислотой/дихлорметаном, продукт очищали хроматографией на силикагеле (элюент: этилацетат), при этом получали твердое вещество (0,22 г), которое разделяли хроматографией на колонке Chiralpak AD (элюент: гептан/изопропанол, 80:20), при этом получали (R)-N-S)-5 циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид (0,10 г) в виде твердого вещества белого цвета, []589 -74,6 (1% в CHCl3), МС: m/e (%) 510,3 (М+Н+, 100), и (S)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2 метил-N'-(2,2,3,3,3-пентафторпропил)малонамид (0,09 г) в виде твердого вещества белого цвета, []589 63,8 (1% в CHCl3), МС: m/e (%) 510,3 (М+Н+, 100). Пример 74. N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид.(S)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(2,2,3,3,3 пентафторпропил)моноамидом 2,2-диметилмалоновой кислоты аналогично тому, как описано в примере 73, при этом получали N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2 диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета. []589 -60,4(S)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с моноэтиловым эфиром (S)-2-фтор-2-метилмалоновой кислоты аналогично тому, как описано в примере 73, при этом получали этиловый эфир (S)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 ил)-2-фтормоноамида 2-метилмалоновой кислоты в виде бесцветного масла. МС: m/e (%) 425,4 (М+Н+,100).- 19009940 раствором моногидрата гидроксида лития (0,02 г, 0,52 ммоля) в 1 мл воды при комнатной температуре в течение 2 ч. Тетрагидрофуран упаривали, остаток экстрагировали диэтиловым эфиром, подкисляли добавлением 0,5 мл 1 н. соляной кислоты и экстрагировали этилацетатом, при этом получали (S)-N-S)-5 циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-фтормоноамид 2-метилмалоновой кислоты (0,18) г в виде твердого вещества белого цвета. МС: m/e (%) 397,4 (М+Н+, 100).(S)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-фтормоноамид 2-метилмалоновой кислоты конденсировали с 2,2,3,3,3-пентафторпропиламином аналогично тому, как описано для RJR 7, при этом получали (R)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Ндибензо[b,d]азепин-7-ил)-2-фтор-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета. []589 -45,7 (1% в CHCl3). МС: m/e (%) 528,2 (M+H+, 100). Пример 76. N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метокси-N'-(2,2,3,3,3-пентафторпропил)малонамид.(S)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(2,2,3,3,3 пентафторпропил)моноамидом 2-метоксималоновой кислоты аналогично тому, как описано в примере 73, при этом получали N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2 метокси-N'-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета. []589 -105,5(S)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(3,3,4,4,4 пентафторбутил)моноамидом малоновой кислоты аналогично тому, как описано в примере 73, при этом получалиN-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4 пентафторбутил)малонамид в виде твердого вещества белого цвета. []589 -57,5 (1% в CHCl3). МС: m/e(%) 510,1(M+H+, 100). Пример 78. N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метилN'-(3,3,4,4,4-пентафторбутил)малонамид. а) Этиловый эфир N-(3,3,4,4,4-пентафторбутил)моноамида 2-метилмалоновой кислоты. Моноэтиловый эфир 2-метилмалоновой кислоты конденсировали с 3,3,4,4,4-пентафторбутиламином аналогично тому, как описано в примере 73, при этом получали этиловый эфир N-(3,3,4,4,4 пентафторбутил)моноамида 2-метилмалоновой кислоты в виде бесцветного масла. МС: m/e (%) 292,1(М+Н+, 100).b) N-(3,3,4,4,4-Пентафторбутил)моноамид 2-метилмалоновой кислоты. Этиловый эфир N-(3,3,4,4,4-пентафторбутил)моноамида 2-метилмалоновой кислоты омыляли аналогично тому, как описано в примере 75b, при этом получали N-(3,3,4,4,4-пентафторбутил)моноамид 2 метилмалоновой кислоты в виде твердого вещества белого цвета. МС: m/e (%) 262,1(М-Н+, 100).(S)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(3,3,4,4,4 пентафторбутил)моноамидом 2-метилмалоновой кислоты аналогично тому, как описано в примере 73,при этом получали N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2 метил-N'-(3,3,4,4,4-пентафторбутил)малонамид (эпимеры) в виде твердого вещества белого цвета. МС:(S)-7-Амино-5-циклопропилметил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(3,3,4,4,4 пентафторбутил)моноамидом 2,2-диметилмалоновой кислоты аналогично тому, как описано в примере 73, при этом получали N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2 диметил-N'-(3,3,4,4,4-пентафторбутил)малонамид (эпимеры) в виде твердого вещества белого цвета.(S)-N-S)-5-Циклопропилметил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-фтормоноамид 2-метилмалоновой кислоты конденсировали с 3,3,4,4,4-пентафторбутиламином аналогично тому, как описано в примере 73, при этом получали (R)-N-S)-5-циклопропилметил-6-оксо-6,7-дигидро-5 Ндибензо[b,d]азепин-7-ил)-2-фтор-2-метил-N'-(3,3,4,4,4-пентафторбутил)малонамид в виде твердого вещества белого цвета. []589 -56,7 (1% в СНСl3). МС: m/e (%) 542,0 (М+Н+, 100). Пример 81. N-(5-Изопропил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2-метил-N'-(2,2,3,3,3 пентафторпропил)малонамид.- 20009940 Указанное в заголовке соединение получали по методикам, описанным в примере 65, при использовании на стадии а) 2-иодпропана вместо параметоксибензилхлорида. Стадию с) исключали и синтез продолжали со стадии d), при этом выходы были аналогичны описанным в примере 65. МС: m/e (%) 496,1(M-H+, 100). Пример 82. N-(5-Изопропил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-2,2-диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали по методикам, описанным в примере 65, при использовании на стадии а) 2-иодпропана вместо параметоксибензилхлорида, при исключении стадии с) и при использовании на стадии d) N-(2,2,3,3,3-пентафторпропил)моноамида 2,2-диметилмалоновой кислоты вместо N-(2,2,3,3,3-пентафторпропил)моноамид 2-метилмалоновой кислоты, при этом выходы были аналогичны описанным в примере 65. МС: m/e (%) 510,3 (М-Н+, 100). Пример 83. N-S)-5-Метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид.(S)-7-Амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(2,2,3,3,3-пентафторпропил)моноамидом малоновой кислоты аналогично тому, как описано в примере 73, при этом получали NS)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета. []589 -52,7 (1% в CHCl3). МС: m/e (%) 456,4 (М+Н+, 100). Пример 84. 2,2-Диметил-N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N-(2,2,3,3,3-пентафторпропил)малонамид.(S)-7-Амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(3,3,4,4,4-пентафторбутил)моноамидом 2,2-диметилмалоновой кислоты аналогично тому, как описано в примере 73, при этом получали 2,2-диметил-N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета, []589 -53,8 (1% в CHCl3). МС: m/e (%) 484,0 (M+H+, 100). Пример 85. (2R)-2-Фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]N'-(2,2,3,3,3-пентафторпропил)малонамид.a) Этиловый эфир N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)моноамида (2S)2-фтор-2-метилмалоновой кислоты. Указанное в заголовке соединение получали в виде бесцветного масла конденсацией (S)-7-амино-5 метил-5 Н,7 Н-дибензо[b,d]азепин-6-она и моноэтилового эфира (2S)-2-фтор-2-метилмалоновой кислоты аналогично тому, как описано в примере 1 а). МС: m/e 385 (М+Н)+. Моноэтиловый эфир (2S)-2-фтор-2-метилмалоновой кислоты (оптическая чистота 91%) получали стереоселективным гидролизом соответствующего диэфира с использованием гидролазы Candida cylindracea, как описано в статье J. Org. Chem., 51, 1003-1006 (1986).N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 ил)моноамида (2S)-2-фтор-2-метилмалоновой кислоты (75 мг, 0,2 ммоля) в 1 мл тетрагидрофурана обрабатывали в течение 2 ч при комнатной температуре раствором моногидрата гидроксида лития (8 мг, 0,2 ммоля) в 0,5 мл воды. Затем тетрагидрофуран упаривали при пониженном давлении и водный слой экстрагировали диэтиловым эфиром (2 х 10 мл). Объединенные органические слои промывали 5 мл воды, объединенные водные слои подкисляли добавлением 0,025 мл соляной кислоты (25%) и экстрагировали этилацетатом (3 х 15 мл). Органические слои промывали 15 мл насыщенного раствора хлорида натрия,объединяли, сушили над сульфатом натрия и упаривали при пониженном давлении, при этом получали указанное в заголовке соединение в виде пены белого цвета (69 мг, 99% от теоретич.). МС: m/e 355 (МН)-. с) (2R)-2-Фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 488 (М+Н)+, оптическая чистота 94%, конденсацией N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)моноамида (2S)-2-фтор-2-метилмалоновой кислоты и 2,2,3,3,3-пентафторпропиламина аналогично тому, как описано в примере 1 с). Пример 86. (2S)-2-Фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 488N-(2,2,3,3,3-Пентафторпропил)моноамид (2S)-2-фтор-2-метилмалоновой кислоты получали аналогично тому, как описано при получении N-(2,2,2-трифторэтил)моноамида (2RS)-метилмалоновой кисло- 21009940 ты (пример 20 с при замене моноэфира (2RS)-метилмалоновой кислоты на моноэфир (2S)-2-фтор-2 метилмалоновой кислоты. Пример 87. 2-Метокси-N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид.(S)-7-Амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с 2-метокси-N-(2,2,3,3,3 пентафторпропил)моноамидом малоновой кислоты аналогично тому, как описано в примере 73, при этом получали 2-метокси-N-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета, []589 -71,8 (1% в CHCl3). МС: m/e (%) 486,4 (М+Н+, 100). Пример 88. N-S)-5-Метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4-пентафторбутил)малонамид.(S)-7-Амино-5-метил-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(3,3,4,4,4-пентафторбутил)моноамидом малоновой кислоты аналогично тому, как описано в примере 73, при этом получалиN-S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4-пентафторбутил)малонамид в виде твердого вещества белого цвета. []589 -51,4 (1% в CHCl3). МС: m/e (%) 470,1 (М+Н+, 100). Пример 89. 2,2-Диметил-N-[(S)-6-оксо-5-(2,2,2-трифторэтил)-6,7-дигидро-5 Н-дибензо[b,d]азепин-7 ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид.a) 7-Амино-5-(2,2,2-трифторэтил)-5 Н,7 Н-дибензо[b,d]азепин-6-он. Рацемическую смесь (RS)-7-амино-5-(2,2,2-трифторэтил)-5 Н,7 Н-дибензо[b,d]азепин-6-она разделяли хроматографией на колонке Chiralpak AD (элюент: изопропанол/гептан, 1:3), при этом получали (S)-7 амино-5-(2,2,2-трифторэтил)-5 Н,7 Н-дибензо[b,d]азепин-6-он, []589 -29 (1% в CHCl3) и (R)-7-амино-5(2,2,2-трифторэтил)-5 Н,7 Н-дибензо[b,d]азепин-6-он. []589 +26 (1% в CHCl3).(S)-7-Амино-5-(2,2,2-трифторэтил)-5 Н,7 Н-дибензо[b,d]азепин-6-он конденсировали с N-(3,3,4,4,4 пентафторбутил)моноамидом 2,2-диметилмалоновой кислоты аналогично тому, как описано в примере 73, при этом получали (S)-2,2-диметил-N-[(S)-6-оксо-5-(2,2,2-трифторэтил)-6,7-дигидро-5 Н-дибензо[b,d] азепин-7-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид в виде твердого вещества белого цвета. []589 13,9 (1,1% в CHCl3). МС: m/e (%) 550,5 (М-Н+, 100). Пример 90. (2RS)-2-Фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]N'-(3,3,4,4,4-пентафторбутил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 502N-(3,3,4,4,4-Пентафторбутил)моноамид (2RS)-2-фтор-2-метилмалоновой кислоты получали аналогично тому, как описано для N-(2,2,2-трифторэтил)амида (2RS)-метилмалоновой кислоты (пример 20 с при замене моноэфира (2RS)-метилмалоновой кислоты на моноэфир (2RS)-2-фтор-2-метилмалоновой кислоты и при замене 2,2,2-трифторэтиламина на 3,3,4,4,4-пентафторбутиламин (J. Fluorine Chemistry 55(1), 85 (1991. Примеры 91 и 92. (2R)-2-Фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин 7-ил]-N'-(3,3,4,4,4-пентафторбутил)малонамид и (2S)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро 5 Н-дибензо[b,d]азепин-7-ил]-N'-(3,3,4,4,4-пентафторбутил)малонамид. Разделение двух изомеров(2RS)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Ндибензо[b,d]азепин-7-ил]-N'-(3,3,4,4,4-пентафторбутил)малонамида (0,2 г, пример WG) проводили на препаративной колонке для хиральной ЖХВР (CHIRALPAK AD, скорость потока: 35 мл/мин, элюент: н-гептан/изопропанол, 4:1), при этом получали (2R)-2-фтор-2-метил-N-[(S)-5-метил-6-оксо-6,7-дигидро 5 Н-дибензо[b,d]азепин-7-ил]-N'-(3,3,4,4,4-пентафторбутил)малонамид (23 мг, 11% от теоретич., оптическая чистота 99,5%, МС: m/e 502 (М+Н)+), который элюировался в первой фракции, и (2S)-2-фтор-2 метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(3,3,4,4,4-пентафторбутил) малонамид (22 мг, 11% от теоретич., оптическая чистота 99,5%, МС: m/e 502 (М+Н)+), который элюировался во второй фракции. Оба изомера получали в виде желтоватой пены. Пример 93. (2RS)-2-Метил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'(3,3,4,4,4-пентафторбутил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 484N-(3,3,4,4,4-Пентафторбутил)моноамид (2RS)-2-метилмалоновой кислоты получали аналогично тому, как описано при получении N-(2,2,2-трифторэтил)моноамида (2RS)-метилмалоновой кислоты (пример 20 с, при замене 2,2,2-трифторэтиламина на 3,3,4,4,4-пентафторбутиламин (J.Fluorine Chemistry 55(1), 85 (1991.- 22009940 Пример 94. 2,2-Диметил-N-[(S)-5-метил-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил]-N'-(3,3,4,4,4-пентафторбутил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 498N-(3,3,4,4,4-Пентафторбутил)моноамид 2,2-диметилмалоновой кислоты получали аналогично тому,как описано при получении (2RS)-метил-N-(2,2,2-трифторэтил)моноамида малоновой кислоты в примере 20 с), при замене моноэфира (2RS)-метилмалоновой кислоты на моноэфир 2,2-диметилмалоновой кислоты и при замене 2,2,2-трифторэтиламина на 3,3,4,4,4-пентафторбутиламин. Пример 95. (2RS)-Метил-N-3S)-1-метил-2-оксо-5-трифторметансульфонил-2,3,4,5-тетрагидро-1 Нбензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 555 (М+Н)+, при взаимодействии (2RS)-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)N'-(2,2,3,3,3-пентафторпропил)малонамида (пример 25) с ангидридом трифторметансульфоновой кислоты аналогично тому, как описано в примере 26. Пример 96. N-3S)-5-Формил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены светло-желтого цвета, МС: m/e 451(М+Н)+, ацилированием (2RS)-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида муравьиной кислотой в присутствии ангидрида уксусной кислоты аналогично тому, как описано в примере 26. Пример 97. N-[(3S)-5-(2-Фторацетил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены светло-желтого цвета, МС: m/e 483(М+Н)+, ацилированием (2RS)-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида хлорангидридом фторуксусной кислоты аналогично тому, как описано в примере 26. Пример 98. (2RS)-Метил-N-[(3S)-1-метил-2-оксо-5-(2,2,2-трифторацетил)-2,3,4,5-тетрагидро-1 Нбензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 519 (М+Н)+, ацилированием (2RS)-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида ангидридом трифторуксусной кислоты аналогично тому, как описано в примере 26. Пример 99. N-[(3S)-5-(2-Метоксиацетил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены светло-желтого цвета, МС: m/e 495(М+Н)+, ацилированием (2RS)-метил-N-3S)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил)-N'-(2,2,3,3,3-пентафторпропил)малонамида хлорангидридом метоксиуксусной кислоты аналогично тому, как описано в примере 26. Пример 100. N-[(S)-5-Метансульфонил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b]a) Гидрохлорид (S)-3-амино-1-(2,2,2-трифторэтил)-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она. Указанное в заголовке соединение получали в виде твердого вещества желтого цвета алкилированием трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты 2,2,2-трифторэтилтрифлатом с последующим отщеплением трет-бутоксикарбонильной группы в присутствии кислоты аналогично тому, как описано в примере 25 а).b) (2RS)-Метил-N-[(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 491 (М+Н)+, конденсацией гидрохлорида (S)-3-амино-1-(2,2,2-трифторэтил)-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2 она и N-(2,2,3,3,3-пентафторпропил)моноамида (2RS)-метилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примере 20d).c) N-[(S)-5-Метансульфонил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде аморфного вещества грязно-белого цвета, МС:m/e 567 (М-Н)-, при взаимодействии (2RS)-метил-N-[(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида с ангидридом метансульфоновой кислоты аналогично тому, как описано в примере 26. Пример 101. (2RS)-Метил-N-[(S)-2-оксо-1-(2,2,2-трифторэтил)-5-трифторметансульфонил-2,3,4,5 тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде аморфного вещества белого цвета, МС: m/e 623(М+Н)+, при взаимодействии (2RS)-метил-N-[(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н- 23009940 бензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида с ангидридом трифторметансульфоновой кислоты аналогично тому, как описано в примере 26. Пример 102. (2RS)-Метил-N-[(S)-2-оксо-5-(2,2,2-трифторацетил)-1-(2,2,2-трифторэтил)-2,3,4,5 тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества светло-желтого цвета, МС:m/е 587 (М+Н)+, при взаимодействии (2RS)-метил-N-[(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)малонамида с ангидридом трифторуксусной кислоты аналогично тому, как описано в примере 26. Пример 103. (S)-N-(5-Метансульфонил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид.a) трет-Бутиловый эфир (S)-(1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты. трет-Бутиловый эфир (S)-(1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты получали в виде пены светло-желтого цвета, МС: m/e 292 (М+Н)+, алкилированием трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты метилиодидом, как описано в примере 25 а), с последующей хроматографией на силикагеле (элюент: н-гептан/этилацетат, 3:1).b) трет-Бутиловый эфир [(S)-5-метансульфонил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]карбаминовой кислоты. К смеси ангидрида метан сульфоновой кислоты (623 мг, 3,4 ммоля) и N-этилдиизопропиламина(0,12 мл, 0,7 ммоля), охлажденной до 0 С, добавляли раствор трет-бутилового эфира (S)-(1-метил-2-оксо 2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты (200 мг, 0,7 ммоля) в 2 мл дихлорметана. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 18 ч. Затем реакционную смесь охлаждали до 0 С и обрабатывали насыщенным раствором карбоната натрия. Органический слой отделяли, промывали насыщенным раствором гидрохлорида аммония и водой, сушили над сульфатом натрия и упаривали. Неочищенный материал очищали хроматографией на силикагеле(элюент: дихлорметан/этилацетат, 96:4), при этом получали трет-бутиловый эфир S)-5-метансульфонил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты (100 мг,40 % от теоретич.) в виде пены белого цвета. МС: m/e 370 (М+Н)+.c) Гидрохлорид (S)-3-амино-5-метансульфонил-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2 она. К раствору трет-бутилового эфира S)-5-метансульфонил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Нбензо[b][1,4]диазепин-3-ил)карбаминовой кислоты (100 мг, 0,27 ммоля) в 5 мл диоксана добавляли соляную кислоту (0,22 мл) и нагревали в закрытой колбе при 50 С в течение 1 ч. Затем растворитель упаривали при пониженном давлении и остаток перегоняли в виде азеотропной смеси с толуолом. Растворитель удаляли при пониженном давлении, при этом с количественным выходом получали гидрохлорид(S)-3-амино-5-метансульфонил-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она в виде твердого вещества светло-желтого цвета. МС: m/e 270 (М+Н)+.(S)-N-(5-Метансульфонил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 501 (М+Н)+, конденсацией гидрохлорида (S)-3-амино-5-метансульфонил-1-метил-1,3,4,5-тетрагидробензо[b] [1,4]диазепин-2-она и N-(2,2,3,3,3-пентафторпропил)моноамида (2RS)-метилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примере 20d). Пример 104. N-[(S)-5-(2,2-Диметилпропионил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]-N'-(2,2,3,3,3-пентафторпропил)амид.a) трет-Бутиловый эфир [(3S)-5-(2,2-диметилпропионил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Нбензо[b][1,4]диазепин-3-ил]карбаминовой кислоты. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 376(М+Н)+, ацилированием трет-бутилового эфира (S)-(1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил)карбаминовой кислоты хлорангидридом пивалиновой кислоты аналогично тому, как описано в примере 103b).b) Гидрохлорид (S)-3-амино-5-(2,2-диметилпропионил)-1-метил-1,3,4,5-тетрагидробензо[b][1,4] диазепин-2-она. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 276(М+Н)+, при отщеплении трет-бутоксикарбонильной группы в составе трет-бутилового эфира [(3S)-5(2,2-диметилпропионил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]карбаминовой кислоты аналогично тому, как описано в примере 103 с). с) N-[(S)-5-(2,2-Диметилпропионил)-1-метил-2-оксо-2,3,4,5-тетрагидро-[Н-бензо[b][1,4]диазепин-3 ил]-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 493 (М+Н)+, конденсацией гидрохлорида (S)-3-амино-5-(2,2-диметилпропионил)-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она и N-(2,2,3,3,3-пентафторпропил)моноамида малоновой кислоты аналогично тому,как описано в примере 20d).N-(2,2,3,3,3-Пентафторпропил)моноамид малоновой кислоты получали аналогично тому, как описано при получении (2RS)-метил-N-(2,2,2-трифторэтил)моноамида малоновой кислоты в примере 20 с) при замене моноэфира (2RS)-метилмалоновой кислоты на моноэфир малоновой кислоты. Пример 105. N-[(3S)-5-(2,2-Диметилпропионил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 507 (М+Н)+, конденсацией гидрохлорида (S)-3-амино-5-(2,2-диметилпропионил)-1-метил-1,3,4,5-тетрагидробензо[b][1,4] диазепин-2-она и N-(2,2,2-трифторэтил)моноамида (2RS)-метилмалоновой кислоты (пример 20 с аналогично тому, как описано в примере 20d). Пример 105. N-[(3S)-5-(2,2-Диметилпропионил)-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 507 (М+Н)+, конденсацией гидрохлорида (S)-3-амино-5-(2,2-диметилпропионил)-1-метил-1,3,4,5-тетрагидробензо [b][1,4] диазепин-2-она и N-(2,2,2-трифторэтил)моноамида (2RS)-метилмалоновой кислоты (пример 20 с аналогично тому, как описано в примере 20d). Пример 106. Циклопропилметиловый эфир малонамида 5-метил-4-оксо-(3S)-[(2RS)-(2,2,3,3,3-пентафторпропилкарбамоил)пропиониламино]-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты.a) Циклопропилметиловый эфир (S)-3-трет-бутоксикарбониламино-5-метил-4-оксо-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты. Раствор трет-бутилового эфира (S)-(1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)карбаминовой кислоты (пример 103 а, 350 мг, 1,2 ммоля) в 10 мл N,N-диметилформамида последовательно обрабатывали твердым диоксидом углерода (1 г), бромметилциклопропаном (237 мг, 1,7 ммоля) и карбонатом цезия (626 мг, 1,9 ммоля) и реакционную смесь перемешивали в закрытой колбе при 80 С в течение 2,5 сут. Растворитель упаривали при пониженном давлении, остаток растворяли в смеси 30 мл этилацетата и 10 мл воды, органический слой отделяли, сушили над сульфатом натрия и упаривали при пониженном давлении. Неочищенное соединение очищали хроматографией на силикагеле (элюент: гептан/этилацетат, 3:1), при этом получали циклопропилметиловый эфир (S)-3-трет-бутоксикарбониламино 5-метил-4-оксо-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты (410 мг, 87% от теоретич.) в виде смолы белого цвета. МС: m/e 579 (М+ОАс)+.b) Гидрохлорид циклопропилметилового эфира (S)-3-амино-5-метил-4-оксо-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты. Указанное в заголовке соединение получали в виде пены светло-желтого цвета при отщеплении трет-бутоксикарбонильной группы в составе циклопропилметилового эфира (S)-3-трет-бутоксикарбониламино-5-метил-4-оксо-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты аналогично тому, как описано в примере 103 с).c) Циклопропилметиловый эфир малонамида 5-метил-4-оксо-(3S)-[(2RS)-(2,2,3,3,3-пентафторпропилкарбамоил)пропиониламино]-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 579(М+ОАс)+, конденсацией гидрохлорида циклопропилметилового эфира (S)-3-амино-5-метил-4-оксо 2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты и N-(2,2,2-трифторэтил)моноамидаa) трет-Бутиловый эфир [(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]карбаминовой кислоты. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 360(М+Н)+, алкилированием трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты 2,2,2-трифторэтилтрифлатом аналогично тому, как описано в примере 25 а), с последующей хроматографией на силикагеле (элюент : дихлорметан/метанол, 98:2).[1,4]диазепин-3-ил]карбаминовой кислоты. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 419(M+NH4)+, ацилированием трет-бутилового эфира [(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил]карбаминовой кислоты ангидридом уксусной кислоты аналогично тому,как описано в примере 103b).c) Гидрохлорид (S)-5-ацетил-3-амино-1-(2,2,2-трифторэтил)-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она. Указанное в заголовке соединение получали в виде твердого вещества светло-желтого цвета, МС:m/e 302 (М+Н)+, отщеплением трет-бутоксикарбонильной группы в составе трет-бутилового эфира [(S)- 25009940 5-ацетил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]карбаминовой кислоты в присутствии соляной кислоты аналогично тому, как описано в примере 103 с).d) N-[(S)-5-Ацетил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил](2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 533a) трет-Бутиловый эфир [(S)-5-циклопропанкарбонил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]карбаминовой кислоты. Указанное в заголовке соединение получали в виде твердого вещества желтого цвета, МС: m/e 428[b][1,4]диазепин-2-она. Указанное в заголовке соединение получали в виде твердого вещества желтого цвета, МС: m/e 328(М+Н)+, отщеплением трет-бутоксикарбонильной группы в составе трет-бутилового эфира [(S)-5 циклопропанкарбонил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил] карбаминовой кислоты в присутствии соляной кислоты аналогично тому, как описано в примере 103 с).c) N-[(S)-5-Циклопропанкарбонил-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил]-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 559a) Циклопропилметиловый эфир (S)-3-трет-бутоксикарбониламино-4-оксо-5-(2,2,2-трифторэтил)-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 475 (M+NH4)+, при взаимодействии трет-бутилового эфира [(S)-2-оксо-1-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]карбаминовой кислоты (пример 107b с диоксидом углерода и бромметилциклопропаном в присутствии карбоната цезия аналогично тому, как описано в примере 106 а).b) Гидрохлорид циклопропилметилового эфира (S)-3-амино-4-оксо-5-(2,2,2-трифторэтил)-2,3,4,5 тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты Указанное в заголовке соединение получали в виде пены желтоватого цвета, отщеплением третбутоксикарбонильной группы в составе циклопропилметилового эфира (S)-3-трет-бутоксикарбониламино-4-оксо-5-(2,2,2-трифторэтил)-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты в присутствии соляной кислоты аналогично тому, как описано в примере 103 с). Указанное соединение использовали на следующей стадии без дополнительной очистки и анализа.c) Циклопропилметиловый эфир 4-оксо-(3S)-[(2RS)-(2,2,3,3,3-пентафторпропилкарбамоил)пропиониламино]-5-(2,2,2-трифторэтил)-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты. Указанное в заголовке соединение получали в виде твердого вещества светло-желтого цвета, МС:m/e 647 (М+ОАс)+, конденсацией гидрохлорида циклопропилметилового эфира (S)-3-амино-4-оксо-5(2,2,2-трифторэтил)-2,3,4,5-тетрагидробензо[b][1,4]диазепин-1-карбоновой кислоты и N-(2,2,3,3,3-пентафторпропил)моноамида (2RS)-метилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примере 20d). Пример 110. (2RS)-N-[(S)-5-Ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил]-2-фтор-2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид.a) трет-Бутиловый эфир [(S)-5-ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил]карбаминовой кислоты. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 334(М+Н)+, ацилированием трет-бутилового эфира (S)-(1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4] диазепин-3-ил)карбаминовой кислоты (пример 103 а ангидридом уксусной кислоты аналогично тому,как описано в примере 103b).b) Гидрохлорид (S)-5-ацетил-3-амино-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она. Указанное в заголовке соединение получали в виде твердого вещества светло-желтого цвета, МС:c) (2RS)-N-[(S)-5-Ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2-фтор 2-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 483 (М+Н)+, конденсацией гидрохлорида (S)-5-ацетил-3-амино-1-метил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она иN-(2,2,3,3,3-Пентафторпропил)моноамид (2RS)-2-фтор-2-метилмалоновой кислоты получали аналогично тому, как описано для N-(2,2,2-трифторэтил)моноамиду (2RS)-метилмалоновой кислоты в примере 20 с) при замене моноэфира (2RS)-метилмалоновой кислоты на моноэфир (2RS)-2-фтор-2-метилмалоновой кислоты. Пример 111. N-[(S)-5-Ацетил-1-этил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2,2 диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид.a) трет-Бутиловый эфир S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты. Указанное в заголовке соединение получали в виде твердого вещества серого цвета, МС: m/e 320(М+Н)+, ацетилированием трет-бутилового эфира (S)-(2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты ангидридом уксусной кислоты аналогично тому, как описано в примере 52 а).b) (S)-5-Ацетил-3-амино-1-этил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. Указанное в заголовке соединение получали в виде воскообразного вещества желтоватого цвета,МС: m/e 248 (М+Н)+, алкилированием трет-бутилового эфира S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты этилиодидом, с последующим отщеплением третбутоксикарбонильной группы в присутствии кислотного катализатора аналогично тому, как описано в примере 25 а). Указанное соединение использовали на следующей стадии без дополнительной очистки.c) N-[(S)-5-Ацетил-1-этил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2,2-диметилN'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета; МС: m/e 493(М+Н)+, конденсацией (S)-5-ацетил-3-амино-1-этил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она и N(2,2,3,3,3-пентафторпропил)моноамида 2,2-диметилмалоновой кислоты аналогично тому, как описано в примерах 20d) и 27. Пример 112. N-S)-5-Ацетил-1-этил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 479a) (S)-5-Ацетил-3-амино-1-изопропил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. Указанное в заголовке соединение получали в виде воскообразного вещества желтоватого цвета,МС: m/e 262 (М+Н)+, алкилированием трет-бутилового эфира S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил)карбаминовой кислоты в присутствии 2-иодпропана с последующим отщеплением трет-бутоксикарбонильной группы в присутствии кислотного катализатора аналогично тому,как описано в примере 25 а). Указанное соединение использовали на следующей стадии без дополнительной очистки.b) N-[(S)-5-Ацетил-1-изопропил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2RS)метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 493(М+Н)+, конденсацией (S)-5-ацетил-3-амино-1-изопропил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она и N-(2,2,3,3,3-пентафторпропил)моноамида (2RS)-метилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примерах 20d) и 27. Пример 114. N-[(S)-5-Ацетил-1-бензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]2,2-диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид. а) (S)-5-Ацетил-3-амино-1-бензил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. Указанное в заголовке соединение получали в виде твердого вещества светло-желтого цвета, МС:m/e 310 (М+Н)+, алкилированием трет-бутилового эфира S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро-1 Нбензо[b][1,4]диазепин-3-ил)карбаминовой кислоты бензилбромидом, с последующим отщеплением третбутоксикарбонильной группы в присутствии кислотного катализатора аналогично тому, как описано в примере 25 а). Указанное соединение использовали на следующей стадии без дополнительной очистки.b) N-[(S)-5-Ацетил-1-бензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2,2-диметилN'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 553(М-Н)+, конденсацией (S)-5-ацетил-3-амино-1-бензил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она и N(2,2,3,3,3-пентафторпропил)моноамида 2,2-диметилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примерах 20d) и 27. Пример 115. N-S)-5-Ацетил-1-бензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил)(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 539(М-Н)-, конденсацией (S)-5-ацетил-3-амино-1-бензил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-она и N(2,2,3,3,3-пентафторпропил)амида (2RS)-метилмалоновой кислоты (см. пример 25b аналогично тому,как описано в примерах 20d) и 27. Пример 116. N-[(S)-5-Ацетил-1-(4-фторбензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил]-2,2-диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид. а) (S)-5-Ацетил-3-амино-1-(4-фторбензил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2-он. Указанное в заголовке соединение получали в виде пены белого цвета, МС: m/e 328 (М+Н)+, алкилированием трет-бутилового эфира (S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил)карбаминовой кислоты 4-фторбензилбромидом с последующим отщеплением трет-бутоксикарбонильной группы в присутствии кислотного катализатора аналогично тому, как описано в примере 25 а). Указанное соединение использовали на следующей стадии без дополнительной очистки.b) N-[(S)-5-Ацетил-1-(4-фторбензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-2,2 диметил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 571(М-Н)-, конденсацией (S)-5-ацетил-3-амино-1-(4-фторбензил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2 она и N-(2,2,3,3,3-пентафторпропил)моноамида 2,2-диметилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примерах 20d) и 27. Пример 117. N-S)-5-Ацетил-1-(4-фторбензил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин 3-ил)-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Указанное в заголовке соединение получали в виде твердого вещества белого цвета, МС: m/e 557(М-Н)-, конденсацией (S)-5-ацетил-3-амино-1-(4-фторбензил-1,3,4,5-тетрагидробензо[b][1,4]диазепин-2 она и N-(2,2,3,3,3-пентафторпропил)моноамида (2RS)-метилмалоновой кислоты (см. пример 25b аналогично тому, как описано в примерах 20d) и 27. Примеры 118 и 119. N-[(S)-1-Ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2R или 2S)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид и N-[(S)-1-Ацетил-4-оксо-2,3,4,5-тетрагидро 1 Н-бензо[b][1,4]диазепин-3-ил]-(2S или 2R)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид. Разделение двух изомеров N-[(S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3 ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамида (0,2 г, пример 52) проводили на препаративной колонке для хиральной ЖХВР (CHIRALPAK AD, давление: 15 бар, скорость потока: 35 мл/мин,элюент: н-гептан/изопропанол, 4:1), при этом получали (+)-N-[(S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро-1 Нбензо[b][1,4]диазепин-3-ил]-(2R или 2S)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид (77 мг, 35% от теоретич., оптическая чистота 99,5%, МС: m/e 449 (М-Н)-), который элюировался в первой фракции, и(-)-N-[(S)-1-ацетил-4-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2S или 2R)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамид (77 мг 35% от теоретич., оптическая чистота 99,4%, МС: m/e 449 (МН)-), который элюировался во второй фракции. Оба соединения получали в виде твердого вещества белого цвета. Примеры 120 и 121.N-[(S)-5-Ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2S или 2R)метил-N'-(2,2,3,3,3-пентафторпропил)малонамид Разделение двух изомеров N-[(S)-5-ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2RS)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамида (0,6 г, пример 40) проводили на препаративной колонке для хиральной ЖХВР (CHIRALPAK AD, давление: 15 бар, скорость потока: 35 мл/мин, элюент: н-гептан/изопропанол, 4:1 ), при этом получали (+)-N-[(S)-5-ацетил-1-метил-2-оксо 2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2R или 2S)-метил-N'-(2,2,3,3,3-пентафторпропил) малонамид (220 мг 36,7% от теоретич., оптическая чистота 99,5%), который элюировался в первой фракции, и (-)-N-[(S)-5-ацетил-1-метил-2-оксо-2,3,4,5-тетрагидро-1 Н-бензо[b][1,4]диазепин-3-ил]-(2S или 2R)-метил-N'-(2,2,3,3,3-пентафторпропил)малонамида (247 мг, 41,2% от теоретич., оптическая чистота 99,5%), который элюировался во второй фракции. Оба соединения получали в виде твердого вещества белого цвета.- 28009940 Перечисленные ниже соединения получали аналогично тому, как описано в примерах, указанных выше. Пример 122. 2,2-Диметил-N-S)-6-оксо-6,7-дигидро-5 Н-дибензо[b,d]азепин-7-ил)-N'-(3,3,4,4,4-пентафторбутил)малонамид. МС: m/e (%) 484,5 (М+Н)+, 100. Пример 123.
МПК / Метки
МПК: C07D 223/18, C07D 223/16, C07D 313/14, C07D 243/14, A61K 31/55, A61K 31/5513
Метки: активность, секретазы, производные, gamma, малонамида, блокирующие
Код ссылки
<a href="https://eas.patents.su/30-9940-proizvodnye-malonamida-blokiruyushhie-aktivnost-gamma-sekretazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные малонамида, блокирующие активность γ- секретазы</a>
Предыдущий патент: Жирные кислоты со средней длиной цепи, глицериды и аналоги в качестве стимуляторов эритропоэза
Следующий патент: Имидазопиридинзамещённые тропановые производные, обладающие активностью антагониста ccr5 рецептора, для лечения вируса иммунодефицита человека (вич) и воспаления
Случайный патент: Мост и способ изготовления этого моста












