Производные 4-(7-гало-2-хино(кса-) линилокси)фенокси-пропионовой кислоты в качестве противоопухолевых средств
Номер патента: 9679
Опубликовано: 28.02.2008
Авторы: Паломино Эдуардо, Хорвитц Джером П., Хейзелдайн Стюарт Т., Полин Лиза, Корбетт Томас Х.
Формула / Реферат
1. Соединение формулы (I)

где А представляет собой СН или N;
Х представляет собой F, Cl или Br;
Y представляет собой водород или (C1-С7)алкокси и
Z представляет собой аминокислоту;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором Y представляет собой Н.
3. Соединение по п.1, в котором Y представляет собой -ОМе.
4. Соединение по любому из пп.1-3, в котором Х представляет собой -Cl.
5. Соединение по любому из пп.1-3, в котором Х представляет собой -Br.
6. Соединение по любому из пп.1-5, в котором Z представляет собой аминокислоту.
7. Соединение по любому из пп.1-5, в котором Z представляет собой -NH-(СН2)2-SO3H.
8. Соединение по любому из пп.1-5, в котором Z представляет собой -NH-CH3-CO2H.
9. Соединение по любому из пп.1-5, в котором Z представляет собой -NH-CH(CH3)-CO2H.
10. Соединение формулы (I)
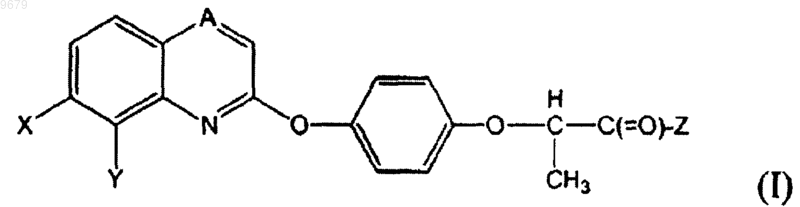
где А представляет собой CH;
Х представляет собой F, Cl или Br;
Y представляет собой (С1-C7)алкокси и
Z представляет собой -NRaRb; где Ra и Rb независимо друг от друга представляют собой водород или (C1-C7)алкил;
или его фармацевтически приемлемая соль.
11. Соединение по п.10, в котором Y представляет собой -ОМе.
12. Соединение по п.10 или 11, в котором Х представляет собой -Cl.
13. Соединение по п.10 или 11, в котором Х представляет собой -Br.
14. Соединение по любому из пп.10-13, в котором Z представляет собой -NH2.
15. Соединение по любому из пп.10-13, в котором Z представляет собой -NHCH3.
16. Соединение формулы (I)
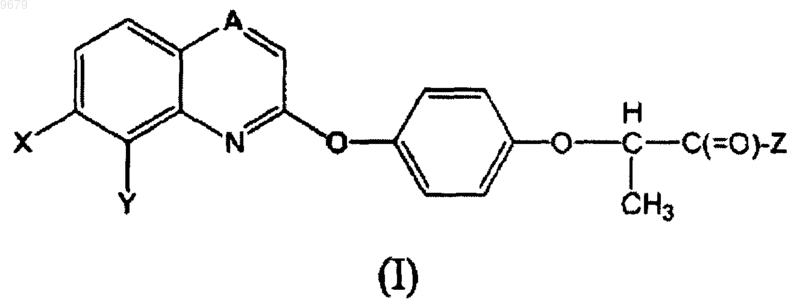
где А представляет собой CH;
Х представляет собой F, Cl или Br;
Y представляет собой водород или (С1-C7)алкокси и
Z представляет собой -NRaRb; Ra и Rb независимо друг от друга представляют собой водород или (С1-C7)алкил;
или его фармацевтически приемлемая соль.
17. Соединение по п.16, в котором Y представляет собой H.
18. Соединение по п.16, в котором Y представляет собой -ОМе.
19. Соединение по любому из пп.16-18, в котором Х представляет собой -Cl.
20. Соединение по любому из пп.16-18, в котором Х представляет собой -Br.
21. Соединение по любому из пп.16-20, в котором Z представляет собой -NRaRb, где Ra и Rb независимо друг от друга представляют собой водород или метил.
22. Соединения
2-{4-((7-бром-2-хинолинил)окси)фенокси}пропионметиламид;
2-{4-((7-хлор-2-хинолинил)окси)фенокси}пропиондиметиламид;
(2-(4-(7-хлор-2-хиноксалинил)окси)фенокси)пропиониламино этансульфоновая кислота;
(2-(4-(7-бром-2-хинолинил)окси)фенокси)пропиониламино этансульфоновая кислота;
{2-{4-(7-бром-хинолин-2-илокси)фенокси}пропиониламино}уксусная кислота;
{2-{4-(7-хлор-хиноксалин-2-илокси)фенокси}пропиониламино}уксусная кислота;
(R)(2-(4-(7-бром-2-хинолинил)окси)фенокси)пропиониламино-этансульфоновая кислота;
(R){2-[4-(7-бром-хинолин-2-илокси)фенокси]пропиониламино}уксусная кислота и
(R){2-{4-(7-хлор-хиноксалин-2-илокси)фенокси}пропиониламино}уксусная кислота
или их фармацевтически приемлемые соли.
23. Соединение по любому из пп.1-22, которое представляет собой (R)-энантиомер.
24. Соединение по любому из пп.1-22, которое представляет собой (S)-энантиомер.
25. Соединение по любому из пп.1-24, где соединение выделено и очищено при помощи хроматографии, кристаллизаци или с использованием обоих этих способов.
26. Соединение по п.25, при этом соединение представляет собой твердое вещество.
27. Соединение по п.25, при этом соединение представляет собой кристаллическое твердое вещество.
28. Соединение по п.1, в котором А представляет собой CH.
29. Соединение по п.6, в котором А представляет собой N.
30. Фармацевтическая композиция для лечения рака у млекопитающих, включающая соединение по любому из пп.1-29 и фармацевтически приемлемый растворитель или носитель.
31. Фармацевтическая композиция по п.30, при этом фармацевтическую композицию изготавливают в виде единичной лекарственной формы.
32. Фармацевтическая композиция по п.31, при этом единичная лекарственная форма сформирована для перорального применения.
33. Фармацевтическая композиция по п.31, при этом единичная лекарственная форма сформирована для применения путем инъекций.
34. Соединение по любому из пп.1-29 для использования в медицинской терапии.
35. Применение соединения по любому из пп.1-29 для изготовления лекарственного средства для лечения рака у млекопитающих.
36. Терапевтический способ лечения рака у млекопитающих, включающий введение млекопитающему, нуждающемуся в такой терапии, эффективного количества соединения по любому из пп.1-29.
37. Терапевтический способ лечения рака у млекопитающих, включающий введение млекопитающему, нуждающемуся в такой терапии, эффективного количества фармацевтической композиции по любому из пп.30-33.
38. Терапевтический способ лечения рака у млекопитающих, включающий совместное введение млекопитающему, нуждающемуся в такой терапии, эффективного количества смеси двух или более соединений по любому из пп.1-29.
39. Терапевтический способ лечения рака у млекопитающих, включающий совместное введение млекопитающему, нуждающемуся в такой терапии, эффективного количества смеси двух или более фармацевтических композиций по любому из пп.30-33.
Текст
009679 Правительственное субсидирование Изобретение, описанное здесь, было сделано при частичной правительственной поддержке в виде гранта NCI-NIHСА 82341, выданного Национальным институтом раковых заболеваний. Правительство Соединенных Штатов имеет определенные права в данном изобретении. Перекрестная ссылка Данная заявка подтверждает приоритет предварительной патентной заявки США 60/393,858, зарегистрированной 3.07.2002, которая включена в данную заявку в виде ссылки. Предпосылки изобретения В патентах США 5,364,831 и 6,197,728 описаны гербицидные соединения формулы где X представляет собой атом галогена;R включает -C(=O)R1, где R1 представляет собой различные замещенные алкоксирадикалы, -SR3 радикалы и NHR4-радикалы, при этом R4 представляет собой группы C1-4-алкоксикарбонилалкил, гидроксиалкил, фенил, C1-4-алкоксиалкил или ди-С 1-4-алкиламино. В патенте США 4,629,493 описаны гербицидные соединения формулы где А представляет собой СН или N; Х представляет собой галоген; n = 0, 1 или 2;R1 представляет собой водород или низший алкил иR и R4, соответственно, представляют собой водородный атом или низший алкил. Одно из этих соединений в настоящее время серийно выпускается для борьбы с однолетними и многолетними травянистыми сорняками широколистных культур. Это соединение имеет следующую формулу:Corbett et. al., Investigational New Drugs, 16, 129-139 (1998) провели оценку серии хиноксалиновых соединений на активность против твердых опухолей у мышей. Следующее соединение(здесь далее обозначаемое ХК 469) было описано как обладающее широким спектром действия против трансплантированных опухолей мышей. Это соединение также было описано как обладающее относительно низкой эффективностью и несколькими нежелательными побочными эффектами, в том числе токсичностью in vivo, включая, например, паралитическую непроходимость кишечника, повреждение эпителия ЖКТ (желудочно-кишечного тракта), мозговую токсичность, нервно-мышечную токсичность и потерю веса.Hazeldine et al., J. Med. Chem., 2001, 44, 1758-1776, описывают противоопухолевые соединения формулы где, например, W может представлять собой H или Cl; Х может представлять собой H, Cl, F или NO2;Y может представлять собой H, F, Cl, Br, I, метокси или N3;Z может представлять собой H, Cl или метокси; иR может представлять собой OH, алкокси или NR'R", где R' и R" представляют собой H, метил, NH2 или ОН, см. табл. 5 указанной публикации.Hazeldine et al., J. Med. Chem., 2002, 45, 3130 описывают биоизостеры и когенеры противоопухолевого соединения (XK469). В находящейся на одновременном рассмотрении предварительной заявке США, серийный 60/309,144, зарегистрированной 7.07.2001, в настоящее время заявка PCT/US02/24442, под названием где Y представляет собой F, Cl, Br, метил или метокси; или его фармацевтически приемлемая соль. В настоящее время существует необходимость в новых противоопухолевых средствах. Краткое изложение изобретения Данное изобретение относится к соединениям, являющимся эффективными противоопухолевыми средствами. Соответственно, соединениями по изобретению являются соединения формулы (I) где А представляет собой СН или N; Х представляет собой F, Cl или Br;Y представляет собой водород, гидрокси или (С 1-С 7)алкокси; и Z представляет собой аминокислоту или гетероцикл; или их фармацевтически приемлемая соль. Некоторые варианты осуществления изобретения относятся также к соединениям по изобретению,имеющим вышеописанную формулу (I), где А представляет собой СН; Х представляет собой F, Cl илиBr; Y представляет собой гидрокси или (С 1-С 7)алкокси; и Z представляет собой -NRaRb; где Ra и Rb независимо друг от друга представляют собой водород, (С 1-С 7)алкил, (С 1-С 7)алканоил, арил, арил(С 1 С 7)алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидиновую,пиперидиновую,морфолиновую,1,3-бензодиазепиновую,1,4-бензодиазепиновую или 1,5 бензодиазепиновую группы; или их фармацевтически приемлемая соль. Некоторые варианты осуществления изобретения относятся также к соединениям по изобретению,имеющим вышеописанную формулу (I), где А представляет собой СН; Х представляет собой F, Cl илиBr; Y представляет собой водород, гидрокси, или (С 1-С 7)алкокси; и Z представляет собой -NRaRb; где Ra и Rb независимо друг от друга представляют собой (С 1-С 7)алканоил, арил, арил(С 1-С 7)алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидиновую, пиперидиновую, морфолиновую, 1,3-бензодиазепиновую, 1,4-бензодиазепиновую или 1,5-бензодиазепиновую группы; или их фармацевтически приемлемая соль. Некоторые варианты осуществления изобретения касаются также соединений по изобретению,имеющих вышеописанную формулу (I), где А представляет собой N; Х представляет собой F, Cl или Br;Y представляет собой гидрокси; и Z представляет собой -NRaRb; где Ra и Rb независимо друг от друга представляют собой водород, (C1-C7)алкил, (C1-C7)алканоил, арил, арил(С 1-C7)алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидиновую, пиперидиновую, морфолиновую, 1,3-бензодиазепиновую, 1,4-бензодиазепиновую или 1,5-бензодиазепиновую группы; или их фармацевтически приемлемая соль. Некоторые варианты осуществления изобретения касаются также соединений по изобретению,имеющих вышеописанную формулу (I), где А представляет собой N; Х представляет собой F, Cl или Br;Y представляет собой водород, гидрокси или (С 1-C7)алкокси; и Z представляет собой -NRaRb; где Ra и Rb независимо друг от друга представляют собой (С 1-C7)алканоил, арил, арил(C1-C7)алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют пирролидиновую, пиперидиновую, морфолиновую, 1,3-бензодиазепиновую, 1,4-бензодиазепиновую или 1,5-бензодиазепиновую группы; или их фармацевтически приемлемая соль. Изобретение также относится к терапевтическому способу ингибирования роста опухолевых клеток у млекопитающих, включающему введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по изобретению. Изобретение также относится к терапевтическому способу лечения рака у млекопитающих, включающему введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по изобретению. Изобретение также относится к терапевтическому способу лечения рака у млекопитающих, включающему совместное введение млекопитающему, нуждающемуся в таком лечении, эффективного коли-2 009679 чества смеси двух или более соединений по изобретению, например предшественника соединения формулы (I). Изобретение также относится к использованию соединения по изобретению в медицинской терапии. Изобретение также относится к использованию соединения по изобретению для изготовления лекарственного средства для лечения рака у млекопитающих. Подробное описание изобретения Авторы обнаружили, что соединения по изобретению формулы (I), а также метаболизируемые invivo продукты исходных соединений по изобретению формулы (I), применяемые отдельно или в комбинации, могут быть полезными в качестве противоопухолевых средств и средств для лечения рака. Перечисленные далее термины, если не указано иное, означают следующее. Галоген означает фтор, хлор, бром или иод. Алкил, алкокси и.т.д. означает неразветвленные и разветвленные группы; но ссылка на конкретный радикал, например "пропил", включает только неразветвленный радикал, а разветвленный изомер, такой как "изопропил", будет упомянут отдельно. Если алкил может быть частично ненасыщенным, эта алкильная цепь может включать одну или более (например, 1, 2, 3 или 4) двойных или тройных связей в цепи. Термин "арил" означает фенильный радикал или орто-слитый бициклический карбоциклический радикал, содержащий 9-10 кольцевых атомов, в котором по меньшей мере одно кольцо является ароматическим. Термин "арилалкил" или "арил(C1-C7)алкил" относится к группе формулы арил(C1-C7)алкил-, где арил и (С 1-C7)алкил имеют значения, определенные выше. Термин "аминокислота" включает остатки природных аминокислот (например, Ala, Arg, Asn, Asp,Cys, Glu, Gln, Gly, His, Hyl, Hyp, He, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val) в D- или L-форме, а также неприродных аминокислот (например, таурина, фосфосерина, фосфотреонина, фосфотирозина,гидроксипролина, гамма-карбоксиглутамата, гиппуровой кислоты, октагидроиндол-2-карбоновой кислоты, статина, 1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты, пеницилламина, орнитина, цитруллина, -метилаланина, парабензоилфенилаланина, фенилглицина, пропаргилглицина, саркозина и третбутилглицина). Этот термин также включает природные и неприродные аминокислоты, содержащие обычную аминозащитную группу (например, ацетил или бензилоксикарбонил), а также природные и неприродные аминокислоты, защищенные у карбокси-окончания (например, такими группами, как (C1C7)алкил, фенил, бензиновый эфир или амид; или такими как -метилбензиламид). Другие пригодные амино- и карбокси-защитные группы также известны специалистам (см., например, Т. W. Greene, Protecting Groups In Organic Synthesis; Wiley: New York, 1981, и ссылки, приведенные там). Аминокислоты могут быть соединены с остальной частью соединения формулы (I) через карбокси-окончание, аминоокончание, или через любое другое удобное место присоединения, например через серу цистеина. Наиболее предпочтительной аминокислотой является таурин (H2N-(CH2)2-SO3H) или его соли, присоединенные ковалентной связью со стороны его N-окончания к карбонилу соединения формулы (I). Термин "гетероцикл" означает Z-радикал, присоединенный или сцепленный с углеродным атомом карбонила через азотный атом кольца моноциклической, слитой бициклической или соединнной мостиковой связью бициклической насыщенной или ненасыщенной кольцевой системы, содержащей пять или двенадцать кольцевых атомов, в том числе углеродных, и 1-4 гетероатома, независимо друг от друга выбранных из группы, включающей непероксидный кислород, серу и по меньшей мере один N(X), где Х отсутствует или представляет собой Н, О, (C1-С 4)алкил, фенил или бензил. Предпочтительные гетероциклы могут быть, например, пирролидиновыми, пиперидиновыми, морфолиновыми, 1,3 бензодиазепиновыми, 1,4-бензодиазепиновыми или 1,5-бензодиазепиновыми группами."Выделенное" соединение означает соединение, выделенное из среды, в которой оно может обычно присутствовать. Например, соединение может быть выделено из окружающей среды с получением выделенного соединения. Выражение "частично ненасыщенный", например, (C1-C7)алкил, который может быть частично ненасыщенным, означает, что указанный заместитель имеет одну или более ненасыщенных связей, например, одну или более двойных связей, одну или более тройных связей, или обе эти связи."Очищенное" соединение означает соединение, которое в данном количестве вещества имеет концентрацию по меньшей мере 50, 60, 70, 80, 90% и промежуточные значения концентраций. Например,выделенное соединение может иметь концентрацию 51, 52, 53, 54% и т.п. Предпочтительно, соединение имеет концентрацию 90-95% и промежуточные значения. Более предпочтительно, соединение имеет концентрацию 95-99% и промежуточные значения. Еще более предпочтительно, соединение имеет концентрацию 99-99,9% и промежуточные значения. Наиболее предпочтительно, соединение имеет концентрацию более 99,9% данного количества."Возможный" или "возможно" означает, что описываемое событие или состояние не обязательно должно иметь место, и что описание включает случаи, когда событие или состояние имеет место, и случаи, когда оно не имеет место. Например, "возможно замещенный" означает, что указанный заместитель-3 009679 может присутствовать, а может не присутствовать, и что описание включает случаи, когда указанный заместитель присутствует, и случаи, когда указанный заместитель не присутствует. Выражения "включая", "например", "такие как" и т.п. используются с иллюстративной целью и не ограничивают область изобретения. Существительные в единственном числе в данной заявке следует расценивать как "по меньшей мере один" или "один или более", в том числе в формуле изобретения, если не указано иное. Специалистам будет понятно, что соединения по изобретению, имеющие хиральный центр, могут существовать в оптически активных и рацемических формах и могут быть выделены в этих формах. Некоторые соединения могут проявлять полиморфизм. Следует понимать, что данное изобретение включает все рацемические, оптически активные, полиморфные или стереоизомерные формы, или их смеси,соединений по изобретению, которые обладают полезными свойствами, описанными здесь, так как в науке хорошо известны способы получения оптически активных форм (например, путем выделения рацемической формы различными способами перекристаллизации, путем синтеза целевого соединения из оптически активных исходных материалов, путем хирального синтеза или путем хроматографического разделения с использованием хиральной неподвижной фазы) и способы определения, например, противоопухолевой активности, гербицидной активности или другой терапевтической активности с использованием стандартных тестов, описанных здесь, или с использованием других подобных тестов, хорошо известных в науке. Специфические и предпочтительные значения радикалов, заместителей и диапазонов, перечисленные ниже, приведены лишь для иллюстрации и не исключают других указанных значений или других значений в пределах указанных диапазонов для радикалов и заместителей. Соединения по изобретению включают соединения формулы (I), включающие любую комбинацию значений, специфические значения, более специфические значения и предпочтительные значения, описанные здесь. В частности, (C1-C7)алкил может представлять собой метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил, 3-пентил, гексил или гептил;(C1-C7)алкокси может представлять собой метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, пентокси, 3-пентокси, гексилокси, 1-метилгексилокси или гептилокси; (C1C7)алканоил может представлять собой ацетил, пропаноил, бутаноил, пентаноил, 4-метилпентаноил, гексаноил или гептаноил; арил может представлять собой фенил, инденил или нафтил. Если (C1-C7)алкил является ненасыщенным или частично ненасыщенным, он может, в частности,представлять собой винил, аллил, 1-пропенил, 2-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1,3 бутадиенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4 гексенил, 5-гексенил, этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2 пентинил, 3-пентинил, 4-пентинил, 5-гексен-1-инил, 2-гексинил, 3-гексинил, 4-гексинил или 5-гексинил. Специфическим значением для Х является F, Cl или Br. Другим специфическим значением для Х является Cl. Другим специфическим значением для Х является Br. Специфическим значением для Y является водород, гидрокси или (C1-C7)алкокси. Другим специфическим значением для Y является водород (-Н). Другим специфическим значением для Y является гидрокси (-ОН). Другим специфическим значением для Y является (C1-C7)алкокси. Другим специфическим значением для Y является метокси (-ОМе). Специфическим значением для Z является -NRaRb. Другим специфическим значением для Z является -NH2. Другим специфическим значением для Z является-NHCH3. Другим специфическим значением для Z является -N(СН 3)2. Другим специфическим значением для Z является пирролидиновый радикал. Другим специфическим значением для Z является пиперидиновый радикал. Другим специфическим значением для Z является морфолиновый радикал. Другим специфическим значением для Z является 1,3-бензодиазепиновый радикал. Другим специфическим значением для Z является 1,4-бензодиазепиновый радикал. Другим специфическим значением для Z является 1,5-бензодиазепиновый радикал. Другим специфическим значением для Z является аминокислота. Другим специфическим значением для Z является альфа-аминокислота. Другим специфическим значением для Z является аминокислота, включающая альфа-углеродный атом, который имеет неводородный заместитель в (L)-конфигурации. Другим специфическим значением для Z является аминокислота, включающая альфа-углеродный атом, который имеет неводородный заместитель в (D)-конфигурации. Другим специфическим значением для Z является -NH-(СН 2)2-SO3H. Другим специфическим значением для Z является -NH-СН 2-СО 2 Н. Другим специфическим значением для Z является -NH-CH(CH3)CO2H. Специфическая группа соединений формулы (I) включает соединения, в которых углерод, несущий метальную группу, находится в (D)-конфигурации.-4 009679 Предпочтительная группа соединений формулы (I) включает соединения, в которых углерод, несущий метальную группу, находится в (L)-конфигурации. Предпочтительные соединения по изобретению включают, в частности: 2-4-7-бром-2-хинолинил)окси)фенокси пропионметиламид; 2-4-7-хлор-2-хинолинил)окси)феноксипропиондиметиламид;(R) 2-4-(7-хлор-хиноксалин-2-илокси)-феноксипропиониламиноуксусную кислоту; или их фармацевтически приемлемые соли. Предпочтительные соединения по изобретению включают, например, соединения формулы где Х представляет собой Cl, Y представляет собой водород или (С 1-C7)алкокси, a Z представляет собой -NRaRb или аминокислоту; и соединения по изобретению формулы где Х представляет собой Cl или Br, Y представляет собой водород или (C1-C7)алкокси, а Z представляет собой -NRaRb или аминокислоту; или их фармацевтически приемлемые соли. Более предпочтительно, соединения по изобретению включают соединения формулы где Х представляет собой Cl или Br, Y представляет собой водород или метокси, a Z представляет собой аминокислоту; или их фармацевтически приемлемые соли. Еще более предпочтительно, соединения по изобретению включают соединения формулы где Х представляет собой Cl или Br, Y представляет собой водород или метокси, Z представляет собой аминокислоту в виде соответствующего (R)-энантиомера (энантиомеров); или их фармацевтически приемлемые соли. Изобретение также относится к терапевтическому способу лечения рака у млекопитающих, включающему введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения по изобретению, например соединения формулы (I), в которой Z представляет собой таурин или глицин. Другой способ лечения по изобретению включает совместное введение различных соединений по изобретению формулы (I), например смеси двух или более соединений формулы (I). В случаях, когда соединения являются достаточно основными или кислотными для образования стабильных нетоксичных кислых или основных солей, может быть целесообразным введение соединения в виде соли. Примеры фармацевтически приемлемых солей включают соли, образованные реакцией с органическими кислотами, дающими физиологически приемлемый анион, например тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, -кетоглутарат и -глицерофосфат. Могут быть также образованы приемлемые неорганические соли, например гидрохлорид, сульфат, нитрат, бикарбонат и карбонат.-5 009679 Фармацевтически приемлемые соли могут быть получены с использованием стандартных методик,хорошо известных в науке, например реакцией достаточно основного соединения, такого как амин, с подходящей кислотой, дающей физиологически приемлемый анион. Могут быть также получены соли щелочных металлов (например, натрия, калия или лития) или щелочно-земельных металлов (например,кальция) и карбоновых кислот. Соединения формулы (I) могут применяться в составе фармацевтических композиций и вводиться млекопитающему, такому как человек, в различных формах, адаптированных к выбранному способу введения, т.е. пероральному или парентеральному, в частности внутривенному, внутримышечному, местному или подкожному. Таким образом, описываемые соединения могут вводиться системно, например перорально, в комбинации с фармацевтически приемлемым носителем, таким как инертный растворитель или усвояемый пищевой носитель. Они могут быть заключены в твердые или мягкие желатиновые капсулы, могут быть спрессованы в таблетки или могут вводиться непосредственно с пищей, принимаемой пациентом. Для перорального терапевтического применения активное соединение может быть смешано с одним или более наполнителей и использовано в форме глотательных таблеток, буккальных таблеток, жевательных таблеток, капсул, эликсиров, суспензий, сиропов, пилюль и т.п. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентный состав композиций и препаратов,безусловно, может варьироваться и предпочтительно может составлять от 2 до 60 вес.% данной единичной лекарственной формы. Количество активного соединения в таких терапевтически полезных композициях должно обеспечивать эффективный дозировочный уровень. Таблетки, пастилки, пилюли, капсулы и т.п. могут также содержать следующие компоненты: связующие, такие как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; наполнители,такие как дикальция фосфат; разрыхлители, такие как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; смазочные вещества, такие как стеарат магния; и подсластители, такие как сахароза, фруктоза, лактоза или аспартам, или ароматизаторы, такие как перечная мята, гаультериевое масло или вишневый ароматизатор. Если единичная лекарственная форма представляет собой капсулу, она может содержать, кроме веществ, перечисленных выше, жидкий носитель, например растительное масло или полиэтиленгликоль. Могут также присутствовать различные другие вещества, например, для покрытия или иной модификации физической формы твердого лекарственного препарата. Например, таблетки,пилюли или капсулы могут иметь покрытие из желатина, воска, шеллака или сахара и т.п. Сироп или эликсир может содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метили пропилпарабены в качестве консервантов, краситель и ароматизатор, например вишневый или апельсиновый. Безусловно, любое вещество, используемое при изготовлении лекарственной формы, должно быть фармацевтически приемлемым и по существу нетоксичным в используемых количествах. Кроме того, активное соединение может быть введено в состав препаратов и устройств замедленного высвобождения. Активное соединение может также вводиться внутривенно или интраперитонеально путем вливания или инъекции. Растворы активного соединения или его солей могут быть приготовлены на воде, возможно, в смеси с нетоксичным поверхностно-активным веществом. Могут быть также приготовлены дисперсии в глицерине, жидких полиэтиленгликолях, триацетине и их смесях, а также в маслах. В обычных условиях хранения и использования эти препараты содержат консервант, предотвращающий рост микроорганизмов. Лекарственные формы, предназначенные для инъекций или вливаний, могут включать стерильные водные растворы или дисперсии, или стерильные порошки, содержащие активный ингредиент, адаптированные для экстемпорального приготовления стерильных растворов или дисперсий для инъекций или вливаний, возможно, инкапсулированные в липосомах. Во всех случаях конечная лекарственная форма должна быть стерильной, текучей и стабильной в условиях изготовления и хранения. Жидкий носитель может представлять собой растворитель или жидкую дисперсионную среду, содержащую, например,воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли и т.п.), растительные масла, нетоксичные эфиры глицерина и их подходящие смеси. Соответствующая текучесть может поддерживаться, например, путем образования липосом, путем поддержания требуемого размера частиц в случае дисперсии или путем использования поверхностно-активных веществ. Предотвращение воздействия микроорганизмов может осуществляться при помощи различных антибактериальных и фунгицидных средств, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях предпочтительно использование изотонических средств, например сахаров, буферов или хлорида натрия. Пролонгированное всасывание инъекционных композиций может осуществляться путем использования в этих композициях средств, замедляющих всасывание, например моностеарата алюминия и желатина. Стерильные инъекционные растворы готовят путем введения активного соединения в требуемом количестве в соответствующий растворитель, вместе с различными другими ингредиентами, описанными выше, по мере необходимости, с последующей фильтрационной стерилизацией.-6 009679 В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются вакуумная сушка и сублимационная сушка, в результате которых получают порошок активного ингредиента вместе с дополнительным желаемым ингредиентом,присутствующим в описанных ранее стерильно-фильтрованных растворах. В случае местного применения описываемые соединения могут наноситься в чистом виде, т.е. если они представляют собой жидкости. Однако в целом предпочтительно нанесение их на кожу в виде композиций или составов в комбинации с дерматологически приемлемым носителем, который может быть твердым или жидким. Пригодные твердые носители включают мелкодисперсные твердые вещества, такие как тальк, глину, микрокристаллическую целлюлозу, кремнезем, глинозем и т.п. Пригодные жидкие носители включают воду, диметилсульфоксид (DMSO), спирты или гликоли или водоспиртовые/водогликольные смеси,в которых описываемые соединения могут быть растворены или диспергированы в эффективных количествах, возможно, при помощи нетоксичных поверхностно-активных веществ. Вспомогательные добавки,такие как ароматизаторы и дополнительные противомикробные средства, могут быть добавлены для оптимизации свойств композиции для данного применения. Полученные жидкие композиции могут наноситься из поглощающих прокладок, использоваться для пропитки бинтов и других повязок или распыляться на пораженную область с использованием пульверизаторов или аэрозольных распылителей. Также в составе жидких носителей могут быть использованы загустители, такие как синтетические полимеры, жирные кислоты, соли и эфиры жирных кислот, жирные спирты, модифицированные целлюлозы или модифицированные минеральные вещества, для образования легко намазывающихся паст, гелей, мазей, мыл и т.п., для нанесения непосредственно на кожу пациента. Примеры подходящих дерматологических композиций, которые могут быть использованы для нанесения соединений формулы (I) на кожу, известны в фармацевтике; например, см. Jacquet et al. (патент США 4608392), Geria (патент США 4992478), Smith et al. (патент США 4559157) и Wortzman(патент США 4820508). Соответствующие дозы соединений формулы (I) могут быть определены путем сравнения их активности in vitro и in vivo у модельных животных. Способы экстраполяции эффективных доз у мышей и других животных на людей известны в науке; например, см. патент США 4938949. Количество соединения, или его активной соли, или производного, требуемое для использования в лечении, будет изменяться не только в зависимости от конкретной выбранной соли, но и от способа применения, природы заболевания, подлежащего лечению, а также возраста и состояния пациента, и, в конечном счете, будет определяться лечащим врачом. Соединение предпочтительно применяют в виде единичной лекарственной формы; например, содержащей 5-1000 мг/м 2, предпочтительно 10-750 мг/м 2, наиболее предпочтительно 50-500 мг/м 2 активного ингредиента на единичную лекарственную форму. Выбранная доза может быть представлена в виде однократной дозы или в виде разделнной общей дозы, повторяемой через определнные интервалы времени, например две, три, четыре или более субдозы в день. Сама субдоза может быть также разделена, например, на ряд отдельных, свободно распределенных во времени приемов. Соединения по изобретению являются действенными противоопухолевыми средствами и обладают высокой эффективностью и/или пониженной токсичностью по сравнению с XK469. Предпочтительно,соединения по изобретению более эффективны и менее токсичны, чем XK469 (R), и/или не попадают в потенциальное место катаболической стадии метаболизма, характерное для XK469, т.е. имеют метаболический профиль, отличный от XK469. Данное изобретение относится к терапевтическим способам лечения рака у млекопитающих, которые включают введение млекопитающему, страдающему раком, эффективного количества соединения или композиции по изобретению. Термин "млекопитающие" включает приматов, людей, грызунов, собачьих, кошачьих, крупный рогатый скот, овец, лошадей, свиней, коз и т.д. Термин "рак" относится к любому типу злокачественных новообразований, например рак толстой кишки, рак молочной железы,меланома и лейкоз, и в целом отличается нежелательной пролиферацией клеток, например нерегулируемым ростом, отсутствием дифференциации, локальной тканевой инвазией и метастазами. Способность соединения по изобретению к лечению рака может быть определена с использованием аналитических методик, хорошо известных в науке. Например, разработка программ лечения, оценка токсичности, анализ данных, количественная оценка убивания опухолевых клеток и биологической значимости скрининга с использованием трансплантируемых опухолей описаны в литературе. Кроме того,способность соединения по изобретению к лечению рака может быть определена с использованием тестов, описанных ниже. Для оценки соединений по изобретению и известных противоопухолевых соединений использовали следующие общие методики. Поддержание опухоли у животных В исследованиях использовали аденокарциному-03 протоков поджелудочной железы, аденокарциному-16/С молочной железы, аденокарциному-17/Adr молочной железы и человеческую меланому LOX.-7 009679 Опухоли поддерживали в исходном штамме мышей (С 57 В 1/6 для опухолей поджелудочной железы 03 и С 3 Н для опухолей молочной железы). Мышей Balb/c SCID (с дефицитом В- и Т-клеток) использовали для поддержания опухолей и испытаний по химиотерапии человеческой меланомы LOX. Опухоли трансплантировали в соответствующий гибрид F1 (B6D2F1 = самки С 57 В 1/6 самцы DBA/2) или в исходный штамм для химиотерапевтических испытаний. Индивидуальные значения веса тела мышей для каждого опыта отличались в пределах 5 г, а все мыши в начале лечения весили более 17 г. Мыши получали пищу и воду без ограничений. Химиотерапия твердых опухолей Животных группировали, имплантировали подкожно 30-60 мг фрагментов опухолей при помощи троакара 12 калибра в день 0 и снова группировали неизбирательным распределением на различные группы лечения и контрольные группы. На ранней стадии лечения химиотерапию начинали в течение 1-3 дней после имплантации опухоли, когда количество клеток было относительно мало (107-108). Для исследования более поздних стадий или стадий прогрессирования опухолям давали вырасти в течение 5 или более дней до начала лечения. Опухоли измеряли кронциркулем дважды в неделю. Мышей умерщвляли, когда вес опухоли достигал 1500 мг. Вес опухоли оценивали на основе двухмерных измерений: Вес опухоли (в мг) = (аb2)/2, где а и b представляют собой длину и ширину опухоли (мм) соответственно. Конечные точки для оценки противоопухолевой активности по отношению к твердым опухолямa) замедление роста опухоли (величина Т-С), где Т - среднее время (в днях), требуемое для достижения опухолями в группе лечения предварительно заданной величины (например, 1000 мг), а С - среднее время (в днях), требуемое для достижения опухолями в контрольной группе того же размера. Выжившие мыши с исчезнувшими опухолями были исключены из этих расчетов (для случаев излечения составлена отдельная таблица). Эта величина представляет собой важный критерий противоопухолевой активности, так как она дает возможность количественной оценки убивания опухолевых клеток.b) расчет убивания опухолевых клеток для подкожно (SC) растущих опухолей. Логарифм убивания клеток рассчитывали по следующей формулеlog10 общего убивания клеток (в массе) = (величина Т-С в днях) / (3,32) (Td),где Т-С - замедление роста опухоли, как описано выше, а Td - время удвоения объема опухоли (в днях), оцененное по оптимально подогнанной прямой на логарифмическом графике экспоненциального роста опухолей в контрольной группе (в диапазоне от 100 до 800 мг). Перевод величин Т-С в десятичный логарифм убивания клеток возможен благодаря тому, что Td опухолей, возобновивших рост после лечения (обозначаемого Rx), приближается к значениям Td опухолей у необработанных контрольных мышей. В некоторых случаях как для данных оценки in vivo за прошлый период, так и для данных, представленных в данном изобретении, важно сравнение логарифмических величин убивания в исследованиях, существенно отличающихся по методике. С этой целью была составлена таблица активности, которая приведена ниже. Следует отметить, что необходим рейтинг активности в диапазоне отдо , для того чтобы вызвать частичную регрессию (PR) или полную регрессию (CR) большинства трансплантированных твердых опухолей мышей массой 100-300 мг. Таким образом, соединение с рейтингом активности + илине может рассматриваться как активное по обычным клиническим критериям. PR представляет собой снижение массы опухоли менее чем на 50% от размера до лечения. CR представляет собой снижение массы опухоли до величины менее пальпируемого размера (т.е. снижение до наименьшей обнаружимой массы). Перевод десятичного логарифма убывания клеток в оценку активности Измерения в группах лечения и в контрольных группах проводили, когда размер опухолей в контрольной группе достигал примерно 700-1200 мг (среднее значение в группе). Величина Т/С в процентах является показателем противоопухолевой эффективности: Т/С=0% означает отсутствие опухолевого роста. Т/С=100% означает отсутствие противоопухолевой активности, т.е. обработанные и контрольные опухоли росли одинаково. Величина Т/С 42% рассматривается как существенная противоопухолевая активность по критериям Drug Evaluation Branch of the Division of Cancer Treatment (NCI) (подразделение оценки лекарственных средств отдела лечения рака Национального института раковых заболеваний). Величина Т/С 10% рассматривается как весьма существенная противоопухолевая активность, и этот уровень используется NCl для подтверждения успешности клинических испытаний в случае соответст-8 009679 вия требованиям токсичности, состава и некоторым другим требованиям (так называемая активность уровня DN-2). Самое низкое значение потери веса тела (среднее или групповое) более 20% или уровень смертности от лекарства более 20% рассматривается в большинстве испытаний одиночных лечебных курсов как показатель чрезмерно токсической дозы. Изготовление лекарственных препаратов для инъекций мышам Соединения в виде их натриевых солей готовили в 1% растворе бикарбоната натрия, воде или буферизованном фосфатно-солевом растворе (PBS), с доведением рН до 7,0-7,5 соляной кислотой, и вводили внутривенно (IV) или перорально (РО), в объеме 0,2 мл на инъекцию. Амидное соединение - данные in-vivo теста Далее приведены характеристики для соединений, полученных по изобретению (Таблица А), в сравнении с XK469 (Таблицы 1-10). Таблица 1. Эти данные включают сравнение активности XK469 и соединения 14 а по отношению к аденокарциноме поджелудочной железы 03 ранней стадии у самцов мышей BDF1. Клетка 5: соединение 14 а вводили IV при дозе 120 мг/кг/инъекцию, 1 раз в день в дни 3-6, 9-11 и два раза в день в дни 7-8 до общей дозы 1320 мг/кг. Потеря веса составила -0,8 г (-3,6%). Токсичность при этой дозе не была достигнута. Соединение 14 а оказалось активным и обеспечило Т/С 7,3% и логарифм убивания клеток 1,9 (рейтинг активности ). Это была высшая нетоксичная доза (HTND). Клетка 6: соединение 14 а вводили IV при дозе 60 мг/кг/инъекцию, 1 раз в день в дни 3-6, 9-11 и два раза в день в дни 7-8 до общей дозы 660 мг/кг. Потеря веса составила -0,4 г (-1,8%), а смерть от лекарства 0/5. Эта доза показала минимальную активность и обеспечила Т/С 40% и логарифм убивания клеток 0,7(рейтинг активности +). Клетка 7: соединение 14 а вводили IV при дозе 30 мг/кг, 1 раз в день в дни 3-6, 9-11 и два раза в день в дни 7-8 до общей дозы 330 мг/кг. Потеря веса составила 0,4 г (-1,8%), летальных исходов не было. Эта доза оказалась неактивной и показала Т/С 74% и логарифм убивания клеток 0,3 (рейтинг активности отрицательный (-. Клетка 8: соединение XK469 вводили IV при дозе 60 мг/кг один раз в день в дни 3-5 до общей дозы 180 мг/кг. Лечение прекратили раньше времени из-за плохого состояния мышей и потери веса -3,6 г (15,5%), при низшем значении в день 8. Смертей от лекарства не было, и мыши восстановили вес на 13-й день. Известно что MTD (максимальная допустимая доза) для XK469 составляет 450-480 мг/кг IV. Тем не менее, данная субоптимальная доза 180 мг/кг была активной и обеспечила Т/С = 11% и логарифм убивания клеток 1,43 (рейтинг активности ). Таблица 2. Эти данные включают сравнение активности XK469 и соединения 14b по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии. Соединение 14b, моно-метиламид XK469, оценивали по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии. Следует отметить, что это соединение было водонерастворимым, и поэтому его вводили перорально. Клетка 2: контрольный опыт XK469: XK469 вводили IV один раз в день в дни 3-6, 10 до общей дозы 300 мг/кг. Это вызвало потерю веса тела -15%; низшее значение - день 8, полное восстановление день 12 (приблизительно). Эта доза оказалась высокоактивной (1/5 излечении, логарифм убивания среди неизлечившихся 3,3, рейтинг активности ). Клетка 3: 14b вводили РО при разовой дозе 150 мг/кг два раза в день на 3-й день. Дозу увеличили до 250 мг/кг два раза в день в дни 4-7 до общей дозы 2300 мг/кг. Это привело к потере веса -9%, низшее значение - день 8, полное восстановление на 10-й день. Эта доза оказалась умеренно активной (Т/С = 39%, логарифм убивания 0,8, рейтинг активности +). Клетки 4 и 5: лечение прекратили раньше времени для экономии соединения. Таблица 3. Эти данные включают сравнение активности XK469 и соединения 14 с по отношению к аденокарциноме молочной железы (M17/Adr), обладающей мультилекарственной устойчивостью. Соединение 14 с (диметиламидное производное 8-метокси-XK469) оказалось активным (Клетка 5). Клетка 1: контрольный опыт без лечения: Время до 1000 мг = 8,5 дней (Td 1,1 день). Рост опухоли соответствовал ожидаемому. Клетка 2: (отрицательный контрольный опыт) Адриамицин вводили один раз в день IV при дозе 7,5 мг/кг/инъекцию в дни 1, 7 до общей дозы 15 мг/кг. Известно, что эта доза является максимально допустимой. Она оказалась неактивной (Т/С = 90%). Клетка 4: XK469 вводили один раз в день IV при дозе 56 мг/кг/инъекцию в дни 1-5 и 10 до общей дозы 336 мг/кг. Доза оказалась весьма активной: Т/С = 9%, логарифм убивания 4,2, рейтинг активности. Клетка 5: соединение 14 с представляет собой диметиламид карбоновой кислоты соединения 13 а. Соединение 14 с вводили РО один раз в день 145 мг/кг в дни 1-3 и 7-9 до общей дозы 870 мг/кг. Токсичность не была достигнута. Эта доза оказалась активной (Т/С = 20%; логарифм убивания 1,5; рейтинг активности ). Следует обратить внимание на данный план лечения. Если должна была произойти адаптация к препарату, то она произошла бы именно при такой схеме лечения. Тогда можно было бы ожидать существенного снижения противоопухолевой активности (по сравнению с 13 а при короткой, высокодоз-9 009679 ной схеме лечения). Кроме того, можно было ожидать, что следующие, более низкие дозы будут по существу неактивными при такой схеме. В действительности активность не снизалась, и следующие, более низкие дозы были все еще активными. В кратком изложении дозоинтенсивная схема (два раза в день, дни 1-3) 13 а (внутривенное введение) показала Т/С=7% и логарифм убивания 1,5 при общей дозе 162 мг/кг(что в точности соответствует логарифму убивания для 14 с при 870 мг/кг РО). Клетка 6: 14 с вводили РО один раз в день 90 мг/кг в дни 1-3 и 7-9 до общей дозы 540 мг/кг. Эта доза оказалась активной: Т/С=31%; логарифм убивания 1,4, рейтинг активности . Клетка 7: 14 с вводили РО один раз в день 55,8 мг/кг в дни 1-3 и 7-9 до общей дозы 334,8 мг/кг. Эта доза оказалась активной: Т/С=31%; логарифм убивания 1,0, рейтинг активности +. Клетка 8: 14 с вводили РО один раз в день 34,6 мг/кг в дни 1-3 и 145 мг/кг в дни 7-9 до общей дозы 538,8 мг/кг, что соответствует общей дозе в Клетке 6. Эта доза оказалась умеренно активной (логарифм убивания 0,9, рейтинг активности +). Если адаптации к препарату не было, то логарифм убивания должен был быть таким же, как в Клетке 6. Активность была сниженной (по сравнению с Клеткой 6), но тот факт, что активность присутствовала, по-видимому, означает, что существенной адаптации не было. Таблица 4. Эти данные включают сравнение активности XK469 и соединения 14 е (диметиламид 11b) по отношению к аденокарциноме поджелудочной железы (Р 03). Соединение 14 е оказалось активным (Клетка 2) и показало улучшение по сравнению с XK469 (Клетка 5). Потребность в более высокой дозе для соединения 14 е можно считать недостатком по сравнению с соединением 11b (Клетка 14). Данное исследование было запланировано для отдельной оценки соединений 11b, 14 е и XK469 (Rэнантиомер). Клетка 1: контрольный опыт без лечения: Время до 1000 мг = 12,5 дней (Td 2,0 дня). Это была быстрорастущая сублиния Panc-03. Она хуже поддается излечению, чем предшествующие медленнорастущие линии. Поведение и рост соответствовали ожидаемым. Клетка 2: соединение 14 е вводили РО при разовой дозе 120 мг/кг два раза в день, в дни 3-9 до общей дозы 1680 мг/кг. Очевидной токсичности не было, и мыши набрали вес. Эта доза (хотя и очень большая) оказалась весьма активной (Т/С = 8,3%, логарифм убивания 2,5, рейтинг активности ). Клетка 3: соединение 14 е вводили РО при разовой дозе 60 мг/кг два раза в день, в дни 3-9 до общей дозы 840 мг/кг. Эта доза оказалась почти столь же активной, как следующая более высокая доза. Тот факт, что следующая более низкая доза (Клетка 4) была почти неактивной, показывает, что высшая доза(Клетка 2) плохо всасывалась из желудочно-кишечного тракта (ЖКТ). Это часто происходит при очень больших дозах водонерастворимых соединений. Однако доза, используемая в Клетке 3, тоже была очень большой (общая доза 840 мг/кг). Хотя она и показала определенную активность (логарифм убивания 2,2),она не превзошла соединение 11b. Клетка 4: соединение 14 е вводили РО при разовой дозе 30 мг/кг два раза в день, в дни 3-9 до общей дозы 420 мг/кг. Эта доза оказалась минимально активной по показателю Т/С и неактивной по логарифму убивания. Клетка 5: XK469 (R) вводили IV один раз в день при дозе 57 мг/кг/инъекцию в дни 3-9 до общей дозы 399 мг/кг. Это установленная адекватная доза при такой схеме. Она показала потерю веса -6,7%, при низшем значении на 8-й день, полное восстановление на 11-й день. Доза оказалась активной (Т/С = 4,1%,логарифм убивания 1,7, рейтинг активности ). Клетка 6: XK469 (R) вводили IV один раз в день при дозе 38 мг/кг/инъекцию в дни 3-9 до общей дозы 266 мг/кг. Доза была активной (Т/С=8,3%, логарифм убивания 1,4, рейтинг активности ). Клетка 14: соединение 11b (рацемическое) вводили IV один раз в день при дозе 48 мг/кг/инъекцию в дни 3-9 до общей дозы 336 мг/кг. Это привело к потере веса -8,9% (низшее значение - день 11). К сожалению, мышей не взвешивали в дни 12, 13, 14,15, 16, а на 17-й день прирост веса составлял более грамма на мышь по сравнению с весом до лечения. Это можно рассматривать как полное восстановление веса примерно на 15 день. Доза оказалась активной (Т/С = 0%, логарифм убывания 2,6, рейтинг активности). Это более высокая активность по сравнению с XK469 и несколько более высокая активность по сравнению с соединением 14 е. Следует отметить, что соединение 11b требует более низкой дозы, чемXK469. Таблица 5. Эти данные включают сравнение активности XK469 (R) и рацемического соединения 14f по отношению к аденокарциноме поджелудочной железы (Р 03). Соединение 14f (Клетка 3) показало активность, подобную активности XK469 (R) (Клетка 2). Таким образом, соединение 14f оказалось лучше переносимым при используемой дозе и не привело к потере веса или другим негативным симптомам. Однако токсичность не была достигнута, и потребность в более высокой дозе показывает, что рацемическая смесь, испытываемая в данном эксперименте, обладает лишь полуактивностью, в то время как Sформа оказалась неактивной (см. табл. 6 ниже). Клетка 2: XK469 (R) вводили IV один раз в день при дозе 45 мг/кг/инъекцию в дни 3-10 до общей дозы 360 мг/кг. Потеря веса составила 7%, низшее значение наступило на 11 день, а полное восстановление на 14 день. Эта доза оказалась активной и обеспечила Т/С 21% и логарифм убивания клеток 1,84- 10009679 Клетка 3: соединение 14f вводили IV в дни 3-8 при следующих дозах: 60 мг/кг/инъекцию (один раз в день - дни 3-5, два раза в день - день 6), 80 мг/кг (два раза в день - день 7, один раз в день - день 8). Затем для некоторых мышей способ введения изменили на SC (подкожный) из-за повреждения хвостовой вены. Остальную часть лечения проводили следующим образом: 80 мг/кг/инъекцию (один раз в день SC дни 9-11, при этом 3 мыши получили IV инъекцию в день 11). Конечная общая доза составила 780 мг/кг. Потери веса не было. Эта доза оказалась активной (Т/С = 10%, логарифм убивания клеток = 1,67, рейтинг активности ). Таблица 6. Эти данные включают сравнение активности XK469 (R) и каждого из R- и Sэнантиомеров соединения 14f по отношению к человеческой меланоме (LOX) у мышей SCID.S-энантиомер соединения 14f оказался неактивным (Клетка 3) и не показал существенной токсичности, кроме легкого кратковременного возбуждения в последний день инъекций. Соединение 14f (R)(Клетка 2) представляет собой активную форму, и его активность сравнима с активностью XK469 (R)(Клетка 4). R-форма показала некоторую токсичность, признаками которой были потеря веса (-13,5%) и побеление лап (признак лейкопении), что прошло в течение 4 дней после наступления. Однако наиболее интересно то, что оба энантиомера 14f оказались лучше переносимыми, чем этого можно было ожидать. Показательно также сравнение соответствующих общих доз XK469 и соединения 14f, приведенное в Табл. 5 для этого эксперимента. Следует отметить, что мыши SCID переносили более высокую дозу соединения 14f по сравнению с XK469. Известно, что мыши SCID переносят около 40-50% обычной мышиной максимально допустимой дозы (MTD) XK469. Клетка 2: соединение 14f (R) вводили IV, один раз в день в дни 1-6 и два раза в день в 7-й день до общей дозы 700 мг/кг. Эта доза показала минимальную противоопухолевую активность (Т/С = 47%, логарифм убивания = 0,8). Потеря веса составила -2,8 г (-13,5%; низшее значение на 13-й день) и отсутствие смертей от лекарства. В день 14 было отмечено побеление лап у мышей (признак лейкопении). Эти симптомы прошли на 18-й день. Клетка 3: соединение 14f (S) вводили IV, один раз в день в дни 1-6, два раза в день на 7-й день до общей дозы 700 мг/кг. Эта доза показала минимальную противоопухолевую активность (Т/С = 71 %, логарифм убивания = 0,3). Симптомы, присутствующие при использовании R-энантиомера (см. выше), не проявлялись при использовании S-формы препарата. Мыши, получавшие S-энантиомер, набрали вес в ходе лечения (+2,0% на 8-й день) и показали умеренное возбуждение / гиперактивное поведение в последний день лечения.XK469 (R) вводили IV, один раз в день в дни 1-7 до общей дозы 175 мг/кг. Эта доза показала противоопухолевую активность (Т/С=34%, логарифм убивания 0,8). Известно, что мыши SCID переносят примерно 50% обычной мышиной MTD (360 мг/кг). Таблица 7. Эти данные включают сравнение активности рацемического соединения 14g, соединения XK469 (R) и 2-4-7-бром-2-хинолинил)окси)фенокси пропионовой кислоты соединения 11 с (R),по отношению к аденокарциноме молочной железы 16/С ранней стадии. Удлиненный курс инъекций(через день 7 инъекций) мог бы обеспечить лучшее сравнение за счет предотвращения избыточной потери веса. Эту оценку повторяли на основе удлиненного курса инъекций с использованием R-формы соединения 14g для подтверждения его энантиомерной активности и сравнивали с соединением 11 с (R), см. табл. 9 ниже. Тем не менее, рацемическое соединение 14g оказалось активным и обеспечило получение 1/5 (20%) животных без опухолей (день 161). Затем животным снова имплантировали Mam16/С/71. Опухолевые имплантаты росли успешно, что показывает отсутствие участия иммунологических факторов в предыдущем излечении. Следует отметить, что рацемическое соединение 14g оказалось переносимым при удвоенной дозе (умеренная потеря веса -11%), что показывает, что или R-, или S-энантиомер является инертным, как было в случае 14f, тауринового производного XK469. Рацемическое соединение 14g: соединение вводили два раза в день при дозе 60 мг/кг IV, в дни 1-5, с 4-часовым интервалом между инъекциями. Инъекции прекратили из-за повреждения хвостовой вены. Потеря веса составила 11% (низшее значение на 4-й день), с полным восстановлением на 10-й день (время восстановления хозяина 6 дней). Такой курс лечения оказался активным (Т/С=14%, логарифм убивания клеток = 0,9, рейтинг активности +). У одной мыши исчезла опухоль, и это состояние сохранилось до 161-го дня. Животному снова имплантировали Mam16/С/71 для подтверждения того, что это было излечение. Опухолевые имплантаты росли успешно, что показывает отсутствие участия иммунологических факторов в предыдущем излечении. Соединение XK469 (R): соединение вводили при дозе 50 мг/кг/инъекцию IV один раз в день в дни 1-5 до общей дозы 250 мг/кг. Инъекции прекратили из-за потери веса и плохого внешнего вида животных (потеря веса -15,3% на 6-й день, взъерошенный вид). У животных началась диарея (замечена на 7-й день), и вес продолжал падать (низшее значение потери веса -21,2% на 7-й день). Восстановление веса началось на 8-й день, а значение, соответствующее весу до начала инъекций, было достигнуто на 12-й день. Хотя смертельных исходов не было, эту дозу можно считать токсической из-за избыточной потери веса (20%). Штамм С 3 Н не является чрезвычайно выносливым, и обычная MTD составляет 360-450- 11009679 мг/кг. Тем не менее, соединение XK469 было активным (Т/С = 4%, логарифм убивания клеток = 1,6, рейтинг активности ). Соединение 11 с (R): это соединение вводили один раз в день при дозе 48 мг/кг/инъекцию IV в дни 1-5 до общей дозы 240 мг/кг. Инъекции прекратили из-за потери веса и плохого внешнего вида животных (потеря веса -17,5% на 6-й день и взъерошенный вид). Вес продолжал падать, и у некоторых животных была замечена диарея на 8-й и 9-й день. Одно животное умерло на 10-й день, и результат вскрытия подтвердил смерть от лекарства (диарея в момент смерти, размягчение стенок ЖКТ, уменьшенная печень и селезенка). Данную дозу можно считать токсической из-за избыточной потери веса (низшее значение 29,4% на 9-й день), хотя выжившие мыши восстановили вес до значения, соответствующего весу до начала инъекций, на 13-й день. Соединение 11 с оказалось активным при этой токсической дозе (Т/С 0%,логарифм убивания клеток =1,8, рейтинг активности ). Другие соединения оценивали in vivo, как описано ниже и показано в табл. 8-10. Таблица 8. R-энантиомеры соединения 11 с, соединения XK469 и соединения 14f оценивали отдельно, на основе удлиненного курса инъекций по отношению к мышиной аденокарценоме молочной железы 16/С ранней стадии. Это исследование подтверждает активность R-компонента 14f. Следует отметить сходные черты активности 11c (R) (Клетка 2), XK469 (R) (Клетка 3) и 14f (R) (Клетка 4), кроме необходимости в более высокой дозе для 14f. R-энантиомеры показали по существу эквивалентную активность и обеспечили логарифм убивания клеток 4,0 (рейтинг активности ) при удлиненном курсе периодических инъекций. Все три средства были хорошо переносимы, при этом для XK469 была отмечена умеренная потеря веса (-7,4%). 14f и 11 с (R) показали меньшую потерю веса (-3,0% и -4,3% соответственно). При всех значениях потери веса полное восстановление наступило в течение 2-4 дней с момента низшего значения, что означает быстрое восстановление хозяина. 11 с (R): Животные в Клетке 2 получали инъекции 60 мг/кг/инъекцию через день, начиная в день 1,до общей дозы 480 мг/кг. При этом удлиненном графике соединение 11 с (R) оказалось хорошо переносимым, и никаких неблагоприятных эффектов отмечено не было. Потеря веса была умеренной -1,14 г (4,3%); низшее значение наступило на 14-й день, при полном восстановлении на 17-й день. Эта доза оказалась высоко активной (Т/С 0%, логарифм убивания клеток 4,8, рейтинг активности ), но излечений не было.XK469 (R): животные в Клетке 3 получали инъекции 60 мг/кг/инъекцию через день, всего 8 инъекций, начиная с 1-го дня, до общей дозы 480 мг/кг. При этом удлиненном графике соединение XK469 (R) также было хорошо переносимым и привело к потере веса -2,0 г (7,4%); низшее значение наступило на 17-й день, при полном восстановлении веса на 20-й день. Соединение XK469 (R) при такой схеме оказалось высоко активным (Т/С = 0%, логарифм убивания клеток = 5,4, рейтинг активности ). Излечений не было. 14f (R): Животные в Клетке 4 получали дозы с таким увеличением: 80 мг/кг/инъекцию (1-й день),100 мг/кг (3-й день), 120 мг/кг (4-й день), 160 мг/кг (5-й день), 200 мг/кг (дни 7, 9) и 250 мг/кг (дни 11, 13,15) до общей дозы 1610 мг/кг. Соединение 14f (R) оказалось хорошо переносимым при таких дозах и графике введения и привело к умеренной потере веса -0,8 г (-3,0%). Низшее значение потери веса наступило на 14-й день, при полном восстановлении на 16-й день. R-энантиомер соединения 14f оказался высоко активным (Т/С = 0%, логарифм убивания клеток = 4,2, рейтинг активности ). Никаких негативных симптомов после инъекции соединения 14f (R) отмечено не было и излечений также не было. Животные в Клетке 5 получали дозы с таким увеличением: 50 мг/кг/инъекцию (1-й день), 65 мг/кг(3-й день), 75 мг/кг (4-й день), 100 мг/кг (5-й день) и 125 мг/кг (дни 6, 7, 9) до общей дозы 665 мг/кг. На этом инъекции прекратили для экономии лекарственного препарата. Эта, более низкая, доза 14f (R) также была активной (Т/С 14%, логарифм убивания клеток 1,8, рейтинг активности ). Таблица 9. Данная оценка подтвердила активность R-энантиомера соединения 14g. Оценке 14g (R) препятствовал нижний предел растворимости этого соединения при IV введении, поэтому в данном случае применили IP (интраперитонеальные) инъекции. За исключением необходимости в более высокой дозе для 14g (R) это соединение показало эффективность (Клетка 3, рейтинг активности ), эквивалентную эффективности исходного соединения (11 с (R (Клетка 5, рейтинг активности ), при таком способе введения и коротком интенсивном графике лечения.R-энантиомеры 14g и 11 с вводили IP ежедневно против аденокарциномы поджелудочной железы 03 ранней стадии. IP-введение использовали по двум причинам. Во-первых, R-форма 14g имеет предел растворимости 25 мг/кг (0,2 мл/инъекцию). Это около 40% дозы, вводимой IV для рацемической смеси (60 мг/кг, см. табл. 7). Низкая растворимость R-формы делает IV-инъекцию технически неприемлемым способом введения из-за чрезмерного количества инъекций, требуемых для доставки адекватной общей дозы. Во-вторых, хотя эта лекарственная серия активна при пероральном введении, РО-способ в данном эксперименте не использовали из-за возможности расщепления амидной связи сильными желудочными кислотами. По той же причине 14g (R) готовили без кислоты или основания, чтобы минимизировать возможность расщепления с восстановлением исходного соединения (11 с (R. 14g (R): Животным в Клетке 2 вводили это соединение IP при дозе 75 мг/кг/инъекцию два раза в день (2 х/день) в дни 3-5 до общей дозы 450 мг/кг. Был отмечен увеличенный объем мочеиспускания и- 12009679 осунувшийся вид животных, что означает возможный диуретический эффект препарата. Доза оказалась токсической, при этом произошла одна смерть от лекарства на 10-й день. Результаты вскрытия показали нормальный размер желудка и жидкое заполнение верхнего и нижнего отделов ЖКТ (диарея). Среднее значение потери веса 23,4% было достигнуто на 9-й день, а остальные выжившие животные восстановили вес до исходного доинъекционного значения на 17-й день. Хотя эта доза оказалась токсической, соединение 14g (R) было активным (Т/С = 0%, логарифм убивания клеток = 1,52, рейтинг активности ). Анализируя данные, теперь можно сказать, что удлиненный график инъекций через день был бы лучше переносимым. Животным в Клетке 3 вводили это соединение IP при дозе 45 мг/кг/инъекцию два раза в день в дни 3-7 до общей дозы 450 мг/кг. Затем инъекции прекратили, поскольку у этих животных также обнаружились признаки диуретического эффекта. Среднее значение потери веса 6,7% было достигнуто на 9-й день, а полное восстановление веса на 12-й день. Эта доза оказалась активной при таком графике введения и обеспечила Т/С = 12,6%, логарифм убивания клеток = 1,72, рейтинг активности . 11 с (R): животным в Клетке 4 вводили это соединение IP при таких дозах: 50 мг/кг/инъекцию в дни 3-5, 7 и 60 мг/кг/инъекцию в день 6 до общей дозы 260 мг/кг. Инъекции прекратили из-за потери веса(низшее значение -16,7% при полном восстановлении на 17-й день) и плохого внешнего вида животных(взъерошенные, съежившиеся, большой объем мочеиспускания). Одна смерть от лекарства произошла на 11-й день. Результаты вскрытия показали нормальную селезенку, жидкое заполнение верхнего и нижнего отделов ЖКТ и побеление лап. Оглядываясь назад, теперь можно сказать, что удлиненный график инъекций через день был бы лучше переносимым. Животным в Клетке 5 вводили это соединение 30 мг/кг/инъекцию (дни 3-5, 7) и 37,5 мг/кг/инъекцию(день 6) до общей дозы 157,5 мг/кг. При этой дозе не было потери веса или внешних признаков истощения. Доза оказалась активной (Т/С=26%, логарифм убивания клеток = 1,58, рейтинг активности ). Таблица 10. R-энантиомеры 14h (R), 14i (R), 11c (R) и ХК 469 (R) оценивали на основе удлиненных графиков инъекций по отношению к аденокарциноме поджелудочной железы 03 ранней стадии. Низкая водорастворимость соединения 14h (R) (данный эксперимент) и испытанного ранее соединения 14g (R)(см. табл. 9) не дает возможности IV-введения по техническим причинам (слишком много инъекций). Пероральный (РО) способ введения, который является предпочтительным альтернативным способом для этой серии лекарственных средств, был сочтен неприменимым из-за возможного расщепления амидных связей 14h и 14i (R) в кислотной среде желудка. Таким образом, в данном тесте все соединения сначала вводили IP с целью выявления приемлемого альтернативного способа введения. Однако после первой IP инъекции соединения 14i (R) было отмечено появление длительных болевых ощущений. Поскольку данное соединение сохраняет хорошую водорастворимость, для последующих инъекций способ введения изменили на IV (Клетка 4). При общей дозе 455 мг/кг, вводимой в соответствии с удлиненным графиком,14i (R) показало Т/С 10%, логарифм убивания 1,6 (рейтинг активности ), что подтверждает активностьR-формы этого соединения. Учитывая умеренную потерю веса, можно предположить, что могут быть введены и более высокие дозы (очевидно, с большей эффективностью). Однако 14i (R) требует более высокой дозы, чем исходное соединение, XK469 (R). Животным в Клетке 7 вводили XK469 (R) до общей дозы 350 мг/кг, путем IP инъекций по тому же графику, и получили 5% Т/С, логарифм убивания 2,2, что соответствует рейтингу активности . 14h (R): инъекции IP также вызвали болевые ощущения. В отличие от 14i (R) данное соединение обладает гораздо более низкой водорастворимостью. Таким образом, для достижения адекватной общей дозы, для последующих инъекций способ введения был изменен на SC (подкожный) (SC в задней части шеи, опухоли были имплантированы SC с двух сторон, на боках мыши, в средней части между передними и задними лапами). При удлиненном графике инъекций до общей дозы 615 мг/кг соединение 14h (R) показало Т/С 3%, логарифм убивания 1,9 (рейтинг активности ), что подтверждает активность Rформы соединения. Однако соединение 14h (R) оказалось менее активным и потребовало большей общей дозы, чем исходное соединение 11 с (R) (общая доза 400 мг/кг), вводимое IP по такому же графику животным в Клетке 11 (Т/С 0%, логарифм убивания 3,3, 1/5 излечение от опухоли на 148-й день). Этим животным снова имплантировали опухоль P03/142. Имплантаты росли успешно, что показывает отсутствие участия иммунологических факторов в предыдущем излечении. 14i (R): Клетка 2: дозу 135 мг/кг ввели IP только в день 3. Больше инъекций не было из-за длительной болевой реакции, вызванной таким способом введения и дозой. Мыши вытягивали задние конечности и распластывались на период до 1 часа после инъекции - классическая болевая реакция. Наблюдалась выраженная потеря веса -1,6 г (-6,7%) в 7-й день (низшее значение) с полным восстановлением на 9-й день. Несмотря на низкую общую дозу, введенную в этом случае, соединение 14i (R) при IP-введении оказалось активным и обеспечило Т/С 10% и логарифм убивания клеток 1,1 (рейтинг активности +). Клетка 3: дозу 80 мг/кг вводили IP только в 3-й день. Как и для животных в Клетке 2, после этого инъекции прекратили из-за длительной болевой реакции (в течение часа). На 4-й день произошла одна смерть от инъекции (воспаление верхнего отдела ЖКТ, выявленное при вскрытии). Несмотря на низкую веденную дозу, 14i (R) в этой группе также оказалось активным, хотя и весьма умеренно (Т/С 37%, логарифм убивания 0,7, рейтинг активности +).- 13009679 Клетка 4: первоначальная доза 50 мг/кг IP, введенная на 3-й день, не вызвала никаких отрицательных реакций после инъекции. Способ введения изменили на IV из-за существенных болевых ощущений,вызванных более высокими дозами, и инъекции продолжали через день (общим количеством 7) до 15-го дня до общей дозы 455 мг/кг. Умеренная потеря веса до низшего значения -0,8 г (-3,4%) произошла на 7-й день, с полным восстановлением на 11-й день (прирост веса во время лечения). Эта доза оказалась умеренно активной (Т/С 8%, логарифм убивания 1,6, рейтинг активности ). Учитывая умеренную потерю веса, можно предположить, что могут быть введены существенно более высокие дозы этого веществаXK469 (R): Клетка 5: SC инъекции 80 мг/кг/инъекцию вводили в дни 3-5 до общей дозы 240 мг/кг. Инъекции прекратили из-за существенной потери веса -16,7% (низшее значение наступило на 9-й день,полное восстановление на 14-й день). Одна смерть от лекарства произошла на 10-й день (вскрытие: диарея, жидкое заполнение воспаленного ЖКТ, показывающее эпителиальное повреждение ЖКТ). Этот способ и график введения выбрали для определения того, является ли соединение XK469 (и данная серия) активным при SC-введении. Оглядываясь назад, теперь можно сказать, что более низкая доза, вводимая по периодическому графику, была бы лучше переносимой. Тем не менее, соединение XK469 (хотя и при дозе LD20 по этому графику) при SC-введении оказалось активным и обеспечило Т/С 9% и логарифм убивания 1,6, рейтинг активности . Клетка 6: IP инъекции 80 мг/кг/инъекцию вводили в дни 3 и 5. Были отмечены спорадические вытягивания задних конечностей (проходящая боль), продолжающиеся 1-2 минуты после инъекции. В дни 7 и 9 мыши не получали инъекций из-за плохого внешнего вида и перенесенной потери веса (-11,6%, низшее значение на 9-й день). Полное восстановление произошло на 11-й день, и инъекции возобновили в дни 11 и 13 до общей дозы 320 мг/кг. Соединение XK469 оказалось весьма активным при IP способе введения по этому графику (Т/С 5%, логарифм убивания клеток 2,0, рейтинг активности ). Клетка 7: IP инъекции 50 мг/кг/инъекцию вводили через день 7 инъекций, начиная с 3-го дня, до общей дозы 350 мг/кг. Эта доза оказалась хорошо переносимой, без негативных симптомов после инъекции. Низшее значение потери веса -0,8 г (-3,0%) наступило на 8-й день, а полное восстановление - на 11-й день (прирост веса во время лечения). Соединение XK469 оказалось весьма активным при IP способе введения по этому удлиненному периодическому графику и обеспечило Т/С 5% и логарифм убивания 2,2(рейтинг активности ). 14h (R): Клетка 8: Первоначальную дозу 135 мг/кг вводили IP в 3-й день. Была отмечена проходящая отчность и болевая реакция после инъекции, поэтому последующие инъекции вводили SC. 14h (R) вводили SC в дни 5 и 7 (135 мг/кг), при этом никаких реакций после инъекции не было отмечено. На 9-й день сделали перерыв в инъекциях из-за слегка взъерошенного вида животных и потери веса (низшее значение на 9-й день) -2,8 г (-11,6%). Хотя до 20-го дня мыши не восстановили полностью свой исходный вес, они стабильно набирали вес и их внешний вид улучшался, начиная с 11-го дня, поэтому лечение возобновили с 11-го дня (50 мг/кг) и продолжали в дни 13 и 15 (80 мг/кг) до общей дозы 615 мг/кг. Соединение 14h (R) при этой дозе оказалось активным и обеспечило Т/С 3% и логарифм убивания клеток 1,9 (рейтинг активности ). Клетка 9: IP инъекции при дозе 80 мг/кг/инъекцию вводили в дни 3, 5 и 7. Были отмечены спорадические вытягивания задних конечностей (проходящая боль), продолжающиеся 1-2 минуты после инъекции. На 9-й день сделали перерыв в инъекциях из-за взъерошенного вида мышей и потери веса (низшее значение -13,3% на 10-й день). Хотя до 20-го дня мыши не восстановили полностью свой исходный вес,они стабильно набирали вес и их внешний вид улучшался, начиная с 11-го дня, поэтому инъекции возобновили в дни 11, 13 и 15 до общей дозы 480 мг/кг. Соединение 14h (R) также оказалось очень активным при этой дозе и обеспечило Т/С 6% и логарифм убивания клеток 1,7 (рейтинг активности ). Клетка 10: IP инъекции при дозе 50 мг/кг/инъекцию вводили через день 7 инъекций, начиная с 3 го дня, до общей дозы 350 мг/кг. Эта доза оказалась хорошо переносимой, без негативных симптомов после инъекции. Потеря веса была умеренной, низшее значение -1,6 г (-6,6%) на 8-й день, полное восстановление на 15-й день (прирост веса во время лечения). Соединение 14h (R) оказалось умеренно активным при IP введении с использованием такого периодического графика и обеспечило Т/С 16,5% и логарифм убивания 1,0 (рейтинг активности +). 11 с (R): Клетка 11: IP инъекции при дозе 80 мг/кг/инъекцию вводили в дни 3 и 5. Были отмечены спорадические вытягивания задних конечностей (проходящая боль), продолжающиеся 1-2 минуты после инъекции. В дни 7 и 9 сделали перерыв в инъекциях из-за взъерошенного вида мышей и выраженной потери веса -18% (низшее значение на 9-й день). Хотя до 16-го дня мыши не восстановили полностью свой исходный вес, они стабильно набирали вес и их внешний вид улучшался, начиная с 11-го дня, поэтому инъекции возобновили в дни 11, 13 и 15 до общей дозы 400 мг/кг. Хотя перенесенная потеря веса у мышей в данной группе лечения означает почти LD10 дозу (при 20% потери веса тела доза считается чрезвычайно токсической по стандартам NCI), соединение 11 с (R) оказалось высоко активным при IP введении и обеспечило Т/С 0% и логарифм убивания клеток 3,3 (рейтинг активности ). У одной мыши исчезла опухоль, и это состояние сохранилось до 148-го дня, когда животным снова имплантиро- 14009679 вали Р 03/142. Опухолевые имплантаты росли успешно, что показывает отсутствие участия иммунологических факторов в предыдущем излечении. Клетка 12: IP инъекции при дозе 50 мг/кг/инъекцию вводили через день 7 инъекций, начиная с 3 го дня, до общей дозы 350 мг/кг. Эта доза оказалась хорошо переносимой, без негативных симптомов после инъекции. Потеря веса была умеренной, низшее значение -0,8 г (-3,2%) наступило на 8-й день, полное восстановление на 11-й день (прирост веса во время лечения). Соединение 11 с (R) оказалось активным при IP способе введения с использованием такого удлиненного периодического графика и обеспечило Т/С 3% и логарифм убивания 1,4 (рейтинг активности ). Общие методики получения Получение 4-(7-замещенных-2-хинолинил)оксифеноксисоединений пропионовой кислоты(Схемы I-II). Как показано на Схеме I, одноэтапное получение транс-3-этоксиакрилоил хлорида (3) путем реакции этилвинилового эфира (1) и оксалил хлорида (2), с последующим декарбоксилированием, описано у Tietze et al., Synthesis, 1079-1080 (1993). Схема I Амидирование метазамещенных анилинов (4 а-е) соединением 3, т.е. превращение в 5 а-е, было смоделировано на основе методики, описанной Campbell и Roberts (патент США 4710507) для получения транс-N-(4-бром-3-метилфенил)-3-этоксипропенамида. Циклизацию последнего в смеси 5- (7 а-е) и 7 замещенных хинолин-2-олов (6 а-е) проводили или в концентрированной серной, или в соляной кислоте(Campbell и Roberts). Большинство 7-замещенных производных (8 а-е) отделяли от региоизомера (9 а-е) фракционированной кристаллизацией. Из остатка дополнительно получали соединение 8 а-с колоночной хроматографией на силикагеле. Как показано на схеме II, 2-хлорхинолины 8 а-е соединяли с 2-(4 гидроксифенокси)пропионовой кислотой (20) с использованием или NaH, или K2CO3 в DMF (N,Nдиметилформамиде) с обратным холодильником с последующим подкисленном для получения кислот(21 а-е) с использованием следующей методики. К раствору 7-замещенного-2-хлорхинолина и 2-(4 гидроксифенокси)пропионовой кислоты (1 экв.), растворенных в DMF (5 мл/ммоль), добавили порциями 60% NaH (3 экв.) и смесь осторожно нагревали с обратным холодильником в течение 2 ч. После охлаждения смесь концентрировали с получением твердого вещества, к которому добавили воду, и раствор профильтровали через целит, затем промыли водой. Фильтрат экстрагировали эфиром, водный слой подкисляли 1 М HCl до pH 3-4. 2-(4-Гидроксифенокси)пропионовую кислоту (1 экв.), растворенную в DMF (5 мл/ммоль), добавили порциями 60% NaH (3 экв.) и смесь осторожно нагревали с обратным холодильником в течение 2 ч. После охлаждения ее концентрировали с получением твердого вещества, к которому добавили воду и раствор профильтровали через целит, а потом промыли водой. Фильтрат экстрагировали эфиром, водный слой подкисляли 1 М HCl до рН 3-4. После охлаждения твердое вещество собрали, высушили, растворили в AcOEt и профильтровали через силикагель. Фильтрат концентрировали до уменьшения объема, твердое вещество собрали и перекристаллизовали из AcOEt-гептана с получением соединений пропионовой- 15009679 кислоты (11 а-е). В альтернативе, реакция может быть проведена с использованием K2CO3 (2,5 экв.) вместо NaH, но время реакции при этом обычно увеличивается, например, до 12 ч. Эти кислоты могут быть также превращены в их соли с металлами (12 а-е) путем реакций с гидроксидами металлов. Схема II Соединение XK469, которое имеет один стереогенный центр в положении С-2 пропионовой кислоты, обычно получают в форме рацемической смеси. R-(+)-формы 11b и 11 с получали путем этерификации серийно выпускаемой R-(+)-2-(4-гидроксифенокси) пропионовой кислоты с 8b и 8 с. ХиральнаяHPLC (высокоэффективная жидкостная хроматография) R-формы 11b и 11 с показала, что оба эти соединения были получены с чистотой 99% ее (энантиомерный избыток). HPLC-разделение рацемических соединений 11b и 11 с проводили с использованием колонки ASTEC Chirobiotic Т 2504,6 мм, 65% H2O,35% CH3OH, 20 мМ NH4NO3 при 1 мл/мин, обнаружение при 250 нм. Ту же колонку, систему растворителей и спектральные параметры использовали для определения энантиомерной чистоты (R-)-11b и (R-)11c. Далее изобретение будет описано при помощи следующих неограничивающих примеров. Получение 4-(7-замещенных-2-хинолинил)оксифеноксипропионамидных соединений (А=СН) и 4-(7-замещенных-2-хиноксалинил)оксифеноксипропионамидных соединений (А=N) (схема III). Далее следует описание превращения одного из 2-4-7-бром- и 7-хлор-2-хинолинил)окси) феноксисоединений пропионовой кислоты в соответствующие моно- и дизамещенные пропионамидные производные. Соединения формулы 14 получали из соответствующих соединений формулы 13a-d с использованием реакционных условий, описанных ниже. Обозначения конкретных заместителей X, Y, A, Z, Ra и Rb в конечных соединениях формулы 14a-i представлены в табл. А. В результате реакции 2-4-(7-бром-2-хинолинил)оксифеноксипропионовой кислоты 11 с (А=СН)(схема II) с тионилхлоридом получили промежуточные хлорангидриды, которые после обработки метиламином в THF (тетрагидрофуране) превращаются в монометиламид 14d (табл. А) с хорошим выходом. Подобным образом, в результате реакции хлорангидрида соединения 11b (X=Cl, Y=Н, A=CH) в THF с диметиламином получили N,N'-диметиламид 14 е (табл. А). Обработкой хлорангидридов (RS)- или (R+)-, или (S-)-соединения XK469 (А=N) и соединения 11 с(А=СН) соответственно аминокислотой таурином (NH2CH2CH2SO3H) в THF (тетрагидрофуране) и в присутствии 1 М NaOH получили соответствующие (RS)-, (R+)- или (S-)-тауриновые соединения с хорошим выходом в форме натриевой соли (14f и 14g) с хорошим выходом. Те же реакции с аминокислотой глицином (NH2CH2CO2H) дают получение N-аминокислотного производного (14h и 14i, табл. А). Схема III Таблица А. Соединения, полученные по схеме IIISOCl2 (0,40 мл, 0,66 г, 5,4 ммоль) нагревали в течение 1 ч, потом концентрировали с получением желтоватого твердого вещества. Это вещество растворили в THF (10 мл); добавили метиламин (2 М в THF), пока смесь не стала основной, и концентрировали с получением желтоватого твердого вещества. Добавили воду (10 мл) и насыщенный NaHCO3 до рН 8 и экстрагировали смесь AcOEt (2 х 25 мл). Объединенные экстракты промыли насыщенным NaCl (10 мл), после сушки (MgSO4) профильтровали через силикагель и выпарили с получением грязно-белого твердого вещества. Это вещество перекристаллизовали из EtOHгептана с получением указанного соединения 14d (0,20 г, 95%) в виде белых кристаллов; т.пл. 150-151 С; 1 Н ЯМР (400 MHz, CDCl3)8.06 (d, J= 8.8 Hz, 1H), 7.93 (d, J= 1.6 Hz, 1H), 7.59 (d, J= 9.2 Hz, 1H), 7.48 (dd,J= 8.4, 1.6 Hz, 1H), 7.19-7.14 (m, 2H), 7.07 (d, J= 8.8 Hz, 1H), 6.97-6.91 (m, 2H), 6.56 (bs, 1H), 4.68 (q, J= 6.4SOCl2 (0,48 мл, 0,78 г, 6,6 ммоль) нагревали с обратным холодильником в течение 1 ч. После охлаждения раствор концентрировали при пониженном давлении с получением желтой жидкости, которую растворили в THF (15 мл). Добавили диметиламин (2 М в THF), пока смесь не стала основной, и выпарили с получением светло-коричневого твердого вещества. Добавили воду (15 мл) и насыщенный NaHCO3 до рН 8 и экстрагировали смесь AcOEt (225 мл). Объединенные экстракты промыли насыщенным NaCl (210 мл) и после сушки (MgSO4) выпарили с получением желтой жидкости. Эту жидкость очистили колоночной флэш-хроматографией (1:4 гексаны:AcOEt) (Rf = 0,44 (1:4 гексаны: AcOEt с получением белого твердого вещества, которое кристаллизовали из EtOH-гептана с получением указанного соединения 14 е (0,42 г,87%) в виде грязно-белого твердого вещества, т.пл. 148-150 С; 1 Н ЯМР (400 MHz, CDCl3)8.05 (d, J = 9.2 Hz, 1H), 7.75 (d, J= 2.4 Hz, 1H), 7.65 (d, J= 9.2 Hz, 1H), 7.34 (dd, J = 8.8, 2.4 Hz, 1H), 7.17-7.11 (m, 2H),7.03 (d, J= 8.0 Hz, 1H), 6.96-6.90 (m, 2H), 4.96 (q, J= 6.4 Hz, 1H), 3.14 (s, 3H), 2.97 (s, 3H), 1.62 (d, J= 7.2 Hz,3H). 13 С ЯМР (100 MHz, CDCl3)171.3, 162.8, 154.6, 147.6, 147.2, 139.6, 135.9, 128.7, 127.2, 125.8, 124.1,122.9, 115.9, 113.0, 74.5, 36.8, 36.6, 17.9. IR (инфракрасная спектроскопия) (KBr) 1650, 1605, 1590, 1570,1485, 1435, 1420, 1410, 1395,1370,1365, 1340, 1295,1280, 1250, 1225, 1190,1160, 1140, 1115,1100, 1080,1065, 1030, 1005, 990, 960, 940, 875, 850, 825, 805, 790, 770, 730, 625, 605, 505, 480, 450, 360 см-1. MS (EI)N, 7.55. Обнаружено: С, 64.55; Н, 5.15; N, 7.47. Пример 3. Натрия (2-(4-(7-хлор-2-хиноксалинил)окси)фенокси)пропиониламиноэтансульфонат (14f). Смесь (XK469) (0,49 г, 1,4 ммоль) и SOCl2 (0,52 мл, 0,85 г, 7,1 ммоль) нагревали в течение 1 ч, а затем выпарили с получением желтой жидкости, которую растворили в THF (1,5 мл). Полученный раствор и 1 М NaOH (1,6 мл, 1,6 ммоль) добавили по каплям с равномерной скоростью к раствору натрия аминоэтилсульфоната (таурина) (0,17 г, 1,3 ммоль) в 1 М NaOH (1,4 мл, 1,4 ммоль) при 0 С. После перемешивания в течение 0,5 ч при комнатной температуре смесь разбавили водой (10 мл) и добавили 1 МH2SO4 до pH 3. Смесь промыли эфиром (2 х 25 мл) и в водный слой добавили 1 М NaOH до pH 7, а затем выпарили и высушили с получением желтоватого твердого вещества. Это вещество растерли с горячимCH3OH, нерастворимый материал отфильтровали, фильтрат выпарили и перекристаллизовали из CH3OHEtOH с получением указанного соединения 14f; (0,47 г, 74%) в виде белых кристаллов, т.пл. 250-252 С; 1 Н ЯМР (400 MHz, CD3OD)8.68 (s, 1H), 7.99 (d, J= 8.8 Hz, 1H), 7.71 (d, J = 1.6 Hz, 1H), 7.61 (d, J= 8.8 Hz,1H), 7.21 (d, J = 9.2 Hz, 2H), 7.06 (d, J= 8.8 Hz, 2H), 4.72 (q, J= 6.4 Hz, 1H), 3.74-3.58 (m, 2H), 3.03-2. 88 (m,2H), 1. 57 (d, J= 6.8 Hz, 3H). IR (KBr) 3260, 1650, 1565, 1550, 1500, 1485, 1440, 1395, 1370. 1330, 1290,1260, 1230, 1195, 1140, 1105, 1090, 1055, 1000, 915, 835, 820, 805, 770, 695, 665, 635, 610, 530, 500, 430 см-1;MS (EI, отрицательный ион) m/z (%) 450 (М-Na, 100), 343 (3). Разделение хиральной HPLC (S-энантиомер 19,6 мин, R-энантиомер 23,2 мин) с использованием колонки Regis (R,R)-Whelk-O1 2504,6 мм, 75% гексаны, 25% 2-PrOH, 15 мМ AcONH4 при 1,5 мл/мин,обнаружение при 245 нм. Ту же серию реакций проводили с соединением XK469 (R+) или (S-) для получения соответствующего энантиомера соединения 14f; (R+) т.пл. 250-252 С, []D = +20.2 (с=0.50, H2O); или (S-) 251-253 С,[]D = -20.0 (с=0.50, H2O). Пример 4. А. Рацемическое. Натрия (2-(4-(7-бром-2-хинолинил)окси)фенокси)пропиониламиноэтансульфонат (14g). Смесь соединения 11 с (X = 7-Br; А = СН) (полученного в соответствии с J. Med. Chem. 2002, 45,3130, 3135, см. соединение 11d) (0,23 г, 0,59 ммоль) и SOCl2 (0,45 мл, 0,73 г, 6,2 ммоль) нагрели в течение- 18009679 1 ч, а затем выпарили с получением желтого твердого вещества, которое растворили в THF (2,0 мл). Этот раствор и 1 М NaOH (0,7 мл, 0,7 ммоль) добавили по каплям к раствору таурина (0,07 г, 0,55 ммоль) в 1 МNaOH (0,6 мл, 0,6 ммоль) при 0 С. После перемешивания в течение 0,5 ч при комнатной температуре смесь разбавили водой (5 мл) и добавили 1 М H2SO4 до pH 3. Смесь промыли эфиром (210 мл), в водный слой добавили 1 М NaOH до рН 7, затем выпарили и высушили с получением указанного соединения 14g в виде грязно-белого твердого вещества. Это вещество смешали с горячим CH3OH, нерастворимый осадок отфильтровали, а фильтрат выпарилили и перекристаллизовали из CH3OH с получением указанного соединения (0,21 г, 75%) в виде грязно-белых кристаллов. Т.пл. 231-233 С; 1 Н ЯМР (400 MHz,CD3OD)8.26 (d, J = 9.2 Hz, 1H), 7.87 (d, J = 1.6 Hz, 1H), 7.76 (d, J= 8.0 Hz, 1H), 7.55 (dd, J= 8.8, 1.6 Hz,1H), 7.18-7.10 (m, 3H), 7.08-7.02 (m, 2 Н), 4.72 (q, J= 6.4 Hz, 1H), 3.71-3.60 (m, 2H), 3.04-2.90 (m, 2H), 1.57(d, J=7.6 Hz, 3H). В. (R)-энантиомер. Натрия (2-(4-(7-бром-2-хинолинил)окси)фенокси)пропиониламиноэтансульфонат 14g (R). Получали по вышеописанной методике (А. Рацемическое) с тем исключением, что соединение 11 с получали путем этерификации 8 с и серийно выпускаемой R-(+)-2-(4-гидроксифенокси)пропионовой кислоты 10.(R)-энантиомер: т.пл. 251-253 С, []D = +20.0 (с=0.25, CH3OH). Разделение хиральной HPLC (Sэнантиомер 21,8 мин, R-энантиомер 25,7 мин) с использованием колонки Regis (R,R)-Whelk-O1 2504,6 мм, 75% гексаны, 25% 2-PrOH, 15 мМ AcONH4 при 1,5 мл/мин, обнаружение при 230 нм. Пример 5. А. Рацемическое. 2-[4-(7-бром-хинолин-2-илокси)фенокси]пропиониламиноуксусная кислота (14h). Получали по методике примера 4 с тем исключением, что раствор глицина заменили раствором таурина для получения соединения формулы, соответствующей 14h, где R=Н, т.е., Z=-NHCH2CO2H, т.пл. 157-159 С, или его солей. В. (R)-энантиомер. 2-[4-(7-бром-хинолин-2-илокси)фенокси]пропиониламиноуксусная кислота(14h (R. Получали по вышеописанной методике (А. Рацемическое) с тем исключением, что соединение 11 с получали путем этерификации 8 с и серийно выпускаемой R-(+)-2-(4-гидроксифенокси)пропионовой кислоты 10.(R)-энантиомер: т.пл. 172-174 С, []D = +8.6 (с = 0.50, СН 3 ОН). Разделение хиральной HPLC (Sэнантиомер 24,0 мин, R-энантиомер 29,0 мин) с использованием колонки Regis (R,R)-Whelk-O1 2504,6 мм, 65% гексаны, 35% 2-PrOH, 15 мМ AcONH4 при 1 мл/мин, обнаружение при 220 нм. Пример 6. А. Рацемическое. 2-4-(7-Хлор-хиноксалин-2-илокси)-феноксипропиониламиноуксусная кислота (14i). Получали по методике примера 3 с тем исключением, что раствор глицина заменили раствором таурина для получения соединения формулы, соответствующей 14i, где R=Н, т.е. Z= -NHCH2CO2H, т.пл. 188-190 С, или его солей. В. (R)-энантиомер. 2-4-(7-хлор-хиноксалин-2-илокси)феноксипропиониламиноуксусная кислота (14i (R. Получали по вышеописанной методике (А. Рацемическое) с тем исключением, что XK469 получали путем этерификации серийно выпускаемой R-(+)-2-(4-гидроксифенокси)пропионовой кислоты 10.(S-энантиомер 21,7 мин, R-энантиомер 26,7 мин) с использованием колонки Regis (R,R)-Whelk-O1 2504,6 мм, 65% гексаны, 35% 2-PrOH, 15 мМ AcONH4 при 1 мл/мин, обнаружение при 240 нм. Пример 7. Далее представлены образцы фармацевтических лекарственных форм, содержащие соединение формулы I ("Соединение X") для терапевтического или профилактического использования у людей. Приведенные выше составы могут быть получены обычными способами, известными в фармацевтической технологии. Все публикации, патенты и патентные документы включены в данную заявку в виде ссылки, как если бы каждый из них был включен в данную заявку в виде ссылки. Изобретение описано на примерах различных специфических и предпочтительных вариантов осуществления и методик. Однако следует понимать, что в пределах области изобретения может быть сделано множество изменений и модификаций. Таблица 1. Оценка соединения 14 а и ХК 469 по отношению к аденокарциноме поджелудочной железы 03 ранней стадии у самцов мышей BDF1- 21009679 Таблица 2. Оценка соединения 14b по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии Таблица 3. Оценка соединения 14 с по отношению к аденокарциноме молочной железы 17/ADR ранней стадии- 22009679 Таблица 4. Оценка соединений 11b, 14e и XK469 по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии у самок мышей BDF1 Таблица 5. Оценка соединения 14f по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии Таблица 7. Оценка соединения 14g рацемического, ХК 469 (R) и 11c (R) по отношению к аденокарциноме молочной железы 16/с ранней стадии- 24009679 Таблица 8. Оценка соединений 14f (R), 11 с (R) и ХК 469 (R) по отношению к аденокарциноме молочной железы 16/с ранней стадии Таблица 9. Оценка соединений 14g (R) и 11 с (R) по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии- 25009679 Таблица 10. Оценка соединений 14h (R), 14i (R), 1lc (R) и ХК 469 (R) по отношению к аденокарциноме протоков поджелудочной железы 03 ранней стадии где А представляет собой СН или N; Х представляет собой F, Cl или Br;Y представляет собой водород или (C1-С 7)алкокси иZ представляет собой аминокислоту; или его фармацевтически приемлемая соль. 2. Соединение по п.1, в котором Y представляет собой Н. 3. Соединение по п.1, в котором Y представляет собой -ОМе. 4. Соединение по любому из пп.1-3, в котором Х представляет собой -Cl. 5. Соединение по любому из пп.1-3, в котором Х представляет собой -Br. 6. Соединение по любому из пп.1-5, в котором Z представляет собой аминокислоту.- 26009679 7. Соединение по любому из пп.1-5, в котором Z представляет собой -NH-(СН 2)2-SO3H. 8. Соединение по любому из пп.1-5, в котором Z представляет собой -NH-CH3-CO2H. 9. Соединение по любому из пп.1-5, в котором Z представляет собой -NH-CH(CH3)-CO2H. 10. Соединение формулы (I)Z представляет собой -NRaRb; где Ra и Rb независимо друг от друга представляют собой водород или (C1-C7)алкил; или его фармацевтически приемлемая соль. 11. Соединение по п.10, в котором Y представляет собой -ОМе. 12. Соединение по п.10 или 11, в котором Х представляет собой -Cl. 13. Соединение по п.10 или 11, в котором Х представляет собой -Br. 14. Соединение по любому из пп.10-13, в котором Z представляет собой -NH2. 15. Соединение по любому из пп.10-13, в котором Z представляет собой -NHCH3. 16. Соединение формулы (I)Y представляет собой водород или (С 1-C7)алкокси иZ представляет собой -NRaRb; Ra и Rb независимо друг от друга представляют собой водород или(С 1-C7)алкил; или его фармацевтически приемлемая соль. 17. Соединение по п.16, в котором Y представляет собой H. 18. Соединение по п.16, в котором Y представляет собой -ОМе. 19. Соединение по любому из пп.16-18, в котором Х представляет собой -Cl. 20. Соединение по любому из пп.16-18, в котором Х представляет собой -Br. 21. Соединение по любому из пп.16-20, в котором Z представляет собой -NRaRb, где Ra и Rb независимо друг от друга представляют собой водород или метил. 22. Соединения 2-4-7-бром-2-хинолинил)окси)феноксипропионметиламид; 2-4-7-хлор-2-хинолинил)окси)феноксипропиондиметиламид;(R)2-4-(7-хлор-хиноксалин-2-илокси)феноксипропиониламиноуксусная кислота или их фармацевтически приемлемые соли. 23. Соединение по любому из пп.1-22, которое представляет собой (R)-энантиомер. 24. Соединение по любому из пп.1-22, которое представляет собой (S)-энантиомер. 25. Соединение по любому из пп.1-24, где соединение выделено и очищено при помощи хроматографии, кристаллизаци или с использованием обоих этих способов. 26. Соединение по п.25, при этом соединение представляет собой твердое вещество. 27. Соединение по п.25, при этом соединение представляет собой кристаллическое твердое вещество. 28. Соединение по п.1, в котором А представляет собой CH. 29. Соединение по п.6, в котором А представляет собой N. 30. Фармацевтическая композиция для лечения рака у млекопитающих, включающая соединение по любому из пп.1-29 и фармацевтически приемлемый растворитель или носитель.- 27009679 31. Фармацевтическая композиция по п.30, при этом фармацевтическую композицию изготавливают в виде единичной лекарственной формы. 32. Фармацевтическая композиция по п.31, при этом единичная лекарственная форма сформирована для перорального применения. 33. Фармацевтическая композиция по п.31, при этом единичная лекарственная форма сформирована для применения путем инъекций. 34. Соединение по любому из пп.1-29 для использования в медицинской терапии. 35. Применение соединения по любому из пп.1-29 для изготовления лекарственного средства для лечения рака у млекопитающих. 36. Терапевтический способ лечения рака у млекопитающих, включающий введение млекопитающему, нуждающемуся в такой терапии, эффективного количества соединения по любому из пп.1-29. 37. Терапевтический способ лечения рака у млекопитающих, включающий введение млекопитающему, нуждающемуся в такой терапии, эффективного количества фармацевтической композиции по любому из пп.30-33. 38. Терапевтический способ лечения рака у млекопитающих, включающий совместное введение млекопитающему, нуждающемуся в такой терапии, эффективного количества смеси двух или более соединений по любому из пп.1-29. 39. Терапевтический способ лечения рака у млекопитающих, включающий совместное введение млекопитающему, нуждающемуся в такой терапии, эффективного количества смеси двух или более фармацевтических композиций по любому из пп.30-33.
МПК / Метки
МПК: A61K 31/498, C07D 215/22, A61K 31/47, A61P 35/00, C07D 241/44
Метки: 4-(7-гало-2-хино(кса, кислоты, средств, качестве, противоопухолевых, линилокси)фенокси-пропионовой, производные
Код ссылки
<a href="https://eas.patents.su/29-9679-proizvodnye-4-7-galo-2-hinoksa-liniloksifenoksi-propionovojj-kisloty-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-(7-гало-2-хино(кса-) линилокси)фенокси-пропионовой кислоты в качестве противоопухолевых средств</a>
Предыдущий патент: Водная адгезивная композиция для склеивания гофрированного картона и её применение
Следующий патент: Иммуномодулирующие гетероциклические соединения
Случайный патент: Пиперидинильные производные в качестве модуляторов активности хемокинового рецептора












