Кристаллическая форма эплеренона, обладающая повышенной скоростью растворения
Номер патента: 7934
Опубликовано: 27.02.2007
Авторы: Стал Гленн Л., Десай Субхаш, Йан Крис Й., Борчардт Томас Б., Синг Йуен-Лунг Л., Ферро Леонард Дж., Пилипоскас Дэниел Р., Гэнсер Скотт, Мудипалли Партха С., Карлос Марлон В., Год Генри Т., Бартон Кэтлин, Вечорек Джозеф Дж., Литтл Клэй Р., Питц Марк А.
Формула / Реферат
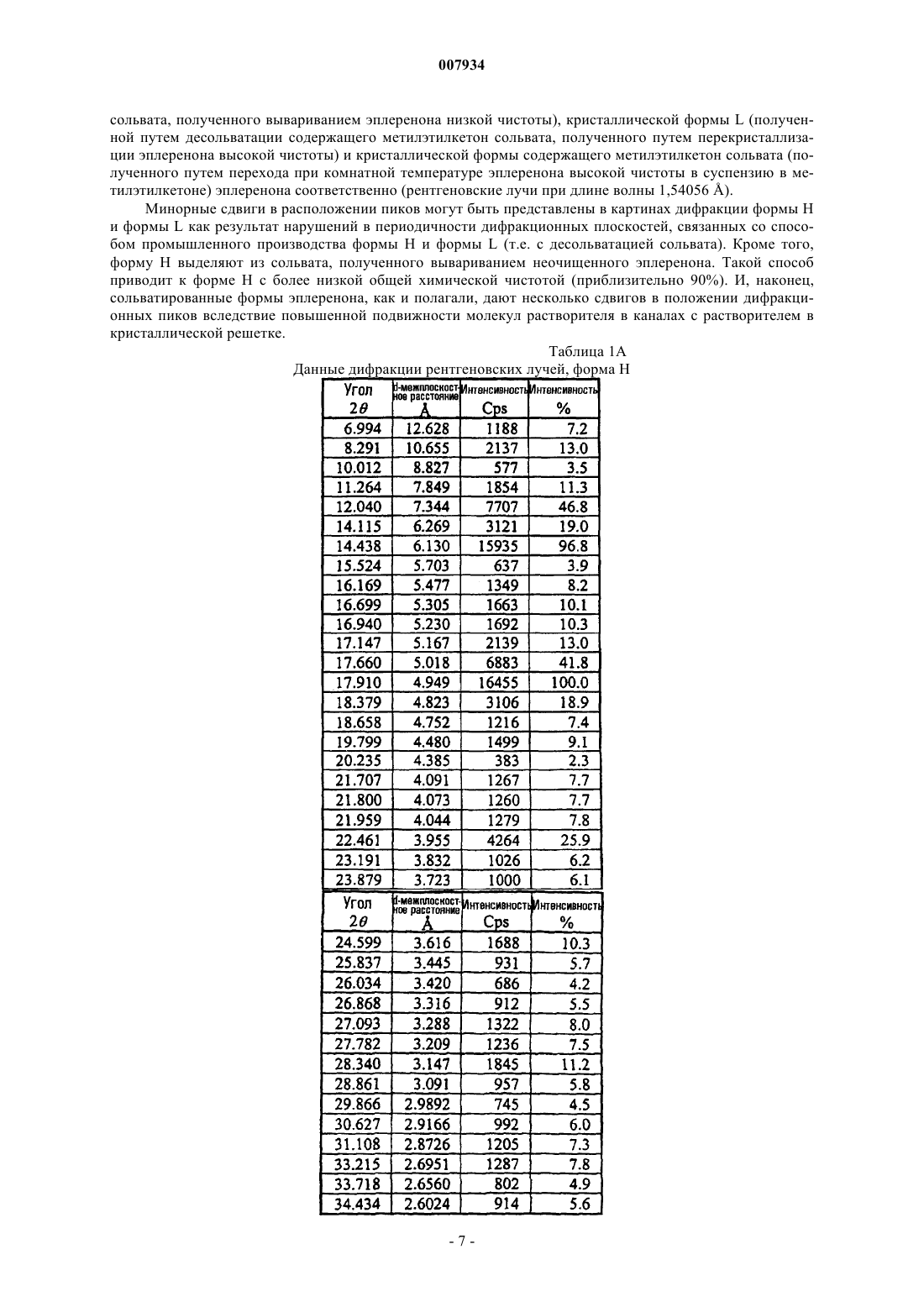
1. Фармацевтическая композиция в пероральной лекарственной форме, содержащая приблизительно от 10 до приблизительно 1000 мг эплеренона и по меньшей мере один фармацевтически приемлемый наполнитель, в которой эплеренон, присутствующий в композиции, имеет фазовую чистоту приблизительно от 50 до приблизительно 100% формы Н эплеренона; и характеризуется картиной порошковой дифракции рентгеновских лучей при длине волны 1,54056 Е, содержащей пики при 7 + 0,2ш 2q, 8,3 + 0,2ш 2q и 12,0 + 0,2ш 2q.
2. Композиция по п.1, где фазовая чистота составляет приблизительно от 95 до приблизительно 100% формы Н кристаллического эплеренона.
3. Композиция по п.2, где эплеренон представляет собой, по существу, фазово-чистую форму Н кристаллического эплеренона.
4. Композиция по п.1, где указанная композиция является, по существу, свободной от одной или более из форм L кристаллического эплеренона, сольватированного кристаллического эплеренона и аморфного эплеренона.
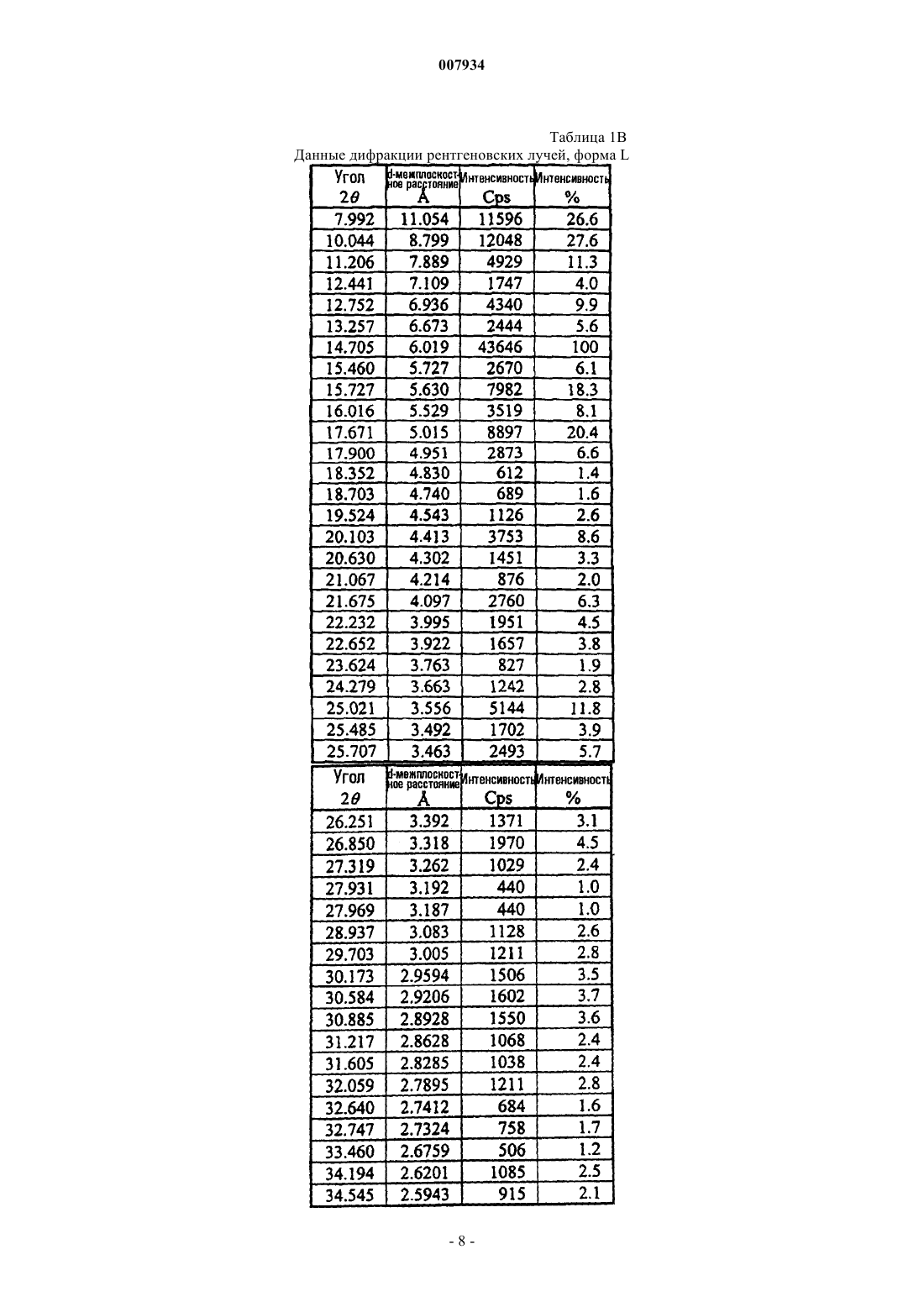
5. Композиция по п.1, где баланс эплеренона состоит из одной или более (i) форм L кристаллического эплеренона, имеющего моноклинальную кристаллическую систему, (ii) сольватированных кристаллических форм эплеренона и (iii) аморфного эплеренона.
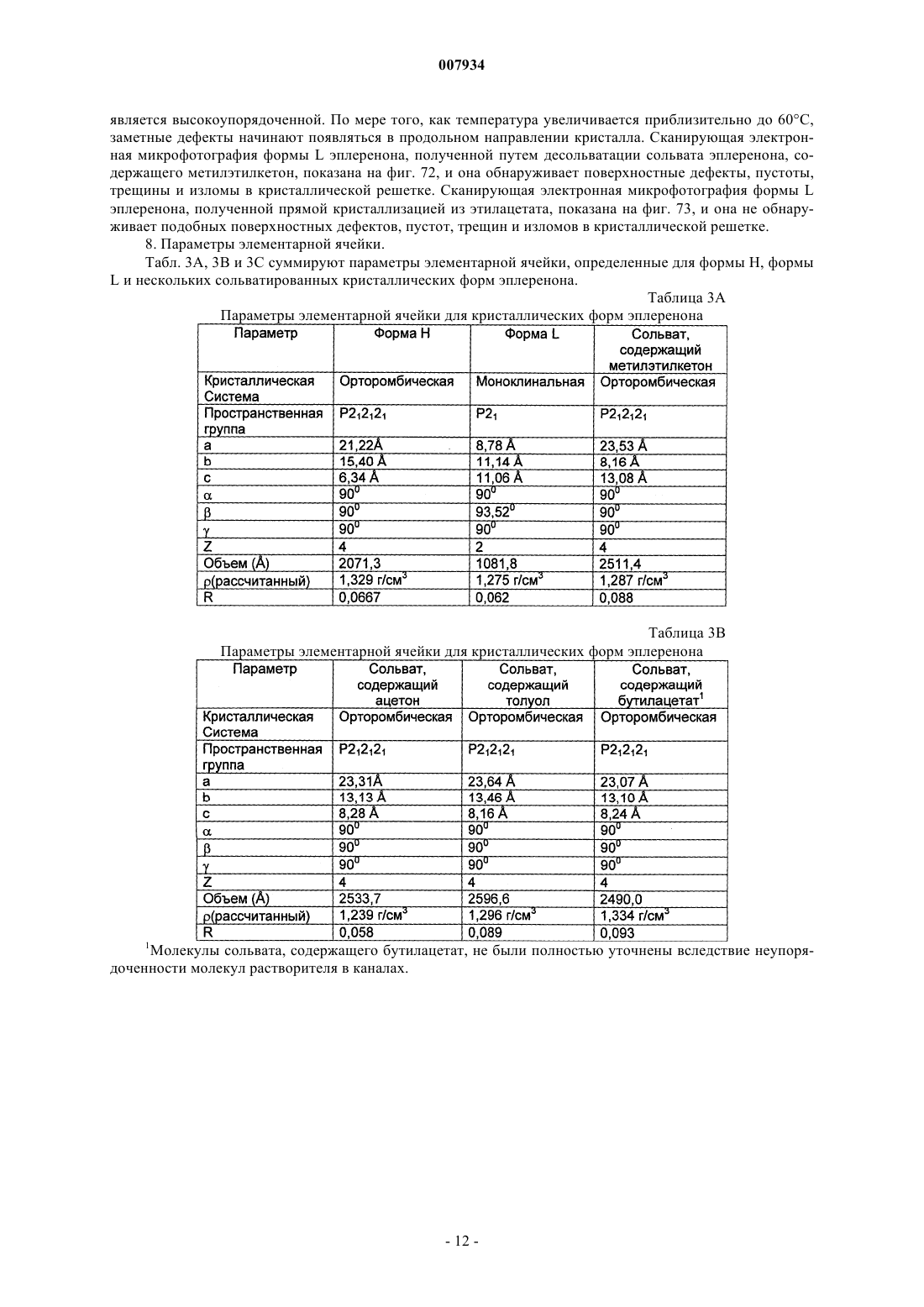
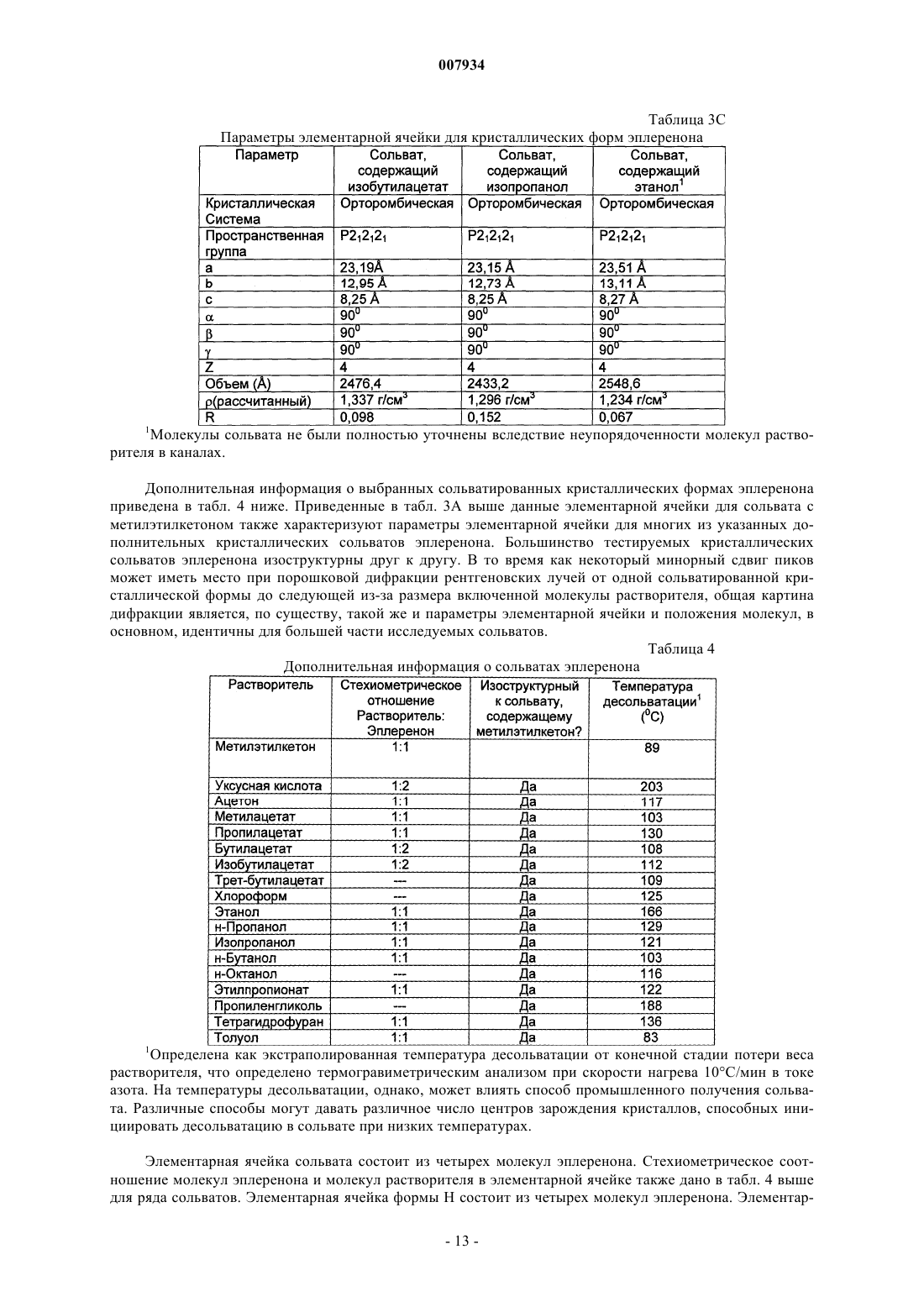
6. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется по меньшей мере одним из следующих параметров элементарной ячейки:
(а) орторомбической кристаллической системой,
(б) пространственной группой P212121,
(в) размером ячеек a, b и с, составляющим, соответственно, приблизительно 21,22 Е, приблизительно 15,41 Е и приблизительно 6,34 Е,
(г) размером каждой из элементарных ячеек a, b и g, составляющим приблизительно 90ш,
(д) объемом 2071,3 Е и
(е) величиной Z, составляющей 4.
7. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется картиной порошковой дифракции рентгеновских лучей, которая не содержит значительного пика при 8,0 + 0,2ш 2q.
8. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется картиной порошковой дифракции рентгеновских лучей, по существу, такой, какая показана на фиг. 1.
9. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется инфракрасным спектром поглощения, содержащим полосы поглощения приблизительно при 1399 см-1, приблизительно при 1664 см-1 и приблизительно при 1739 см-1.
10. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется инфракрасным спектром поглощения, который не содержит значительной полосы поглощения приблизительно при 1724 см-1.
11. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется инфракрасным спектром поглощения, который является, по существу, таким, какой показан на фиг. 35.
12. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется тем, что имеет интервал температур плавления приблизительно от 247 примерно до 251шС.
13. Композиция по п.12, где интервал температур плавления формы Н кристаллического эплеренона определяется путем дифференциальной сканирующей калориметрии при скорости нагревания, составляющей 10шС в минуту.
14. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется термограммой дифференциальной сканирующей калориметрии, имеющей единственную эндотерму, которая имеет место при температуре в области приблизительно от 247шС и примерно до 251шС.
15. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется термограммой дифференциальной сканирующей калориметрии, по существу, такой, как показано на фиг. 18.
16. Композиция по п.1, где форма Н кристаллического эплеренона характеризуется одним или более из следующего:
а) картиной порошковой дифракции рентгеновских лучей при длине волны 1,54056 Е, содержащей пики при 12,0 + 0,2ш 2q, 8,3 + 0,2ш 2q и 7 + 0,2ш 2q;
б) инфракрасным спектром поглощения, содержащим полосы поглощения приблизительно при 1739 и приблизительно при 1399 см-1, и
в) термограммой дифференциальной сканирующей калориметрии, имеющей единственную эндотерму, которая имеет место при температуре в области приблизительно от 247шС и примерно до 251шС.
17. Композиция по п.16, где форма Н кристаллического эплеренона характеризуется двумя или более из следующего:
а) картиной порошковой дифракции рентгеновских лучей при длине волны 1,54056 Е, содержащей пики при 12,0 + 0,2ш 2q, 8,3 + 0,2ш 2q и 7 + 0,2ш 2q;
б) инфракрасным спектром поглощения, где спектр содержит полосы поглощения приблизительно при 1739 и приблизительно при 1399 см-1 и
в) термограммой дифференциальной сканирующей калориметрии, имеющей единственную эндотерму, которая имеет место при температуре в области приблизительно от 247шС и примерно до 251шС.
18. Композиция по п.17, где форма Н кристаллического эплеренона характеризуется:
а) картиной порошковой дифракции рентгеновских лучей при длине волны 1,54056 Е, содержащей пики при 12,0 + 0,2ш 2q, 8,3 + 0,2ш 2q и 7 + 0,2ш 2q;
б) инфракрасным спектром поглощения, где спектр содержит полосы поглощения приблизительно при 1739 и приблизительно при 1399 см-1, и
в) термограммой дифференциальной сканирующей калориметрии, имеющей единственную эндотерму, которая имеет место при температуре в области приблизительно от 247шС и примерно до 251шС.
19. Композиция по п.1, дополнительно содержащая форму L кристаллического эплеренона, где указанная форма L кристаллического эплеренона имеет моноклинальную кристаллическую систему.
20. Композиция по п.1, дополнительно содержащая сольватированную кристаллическую форму эплеренона.
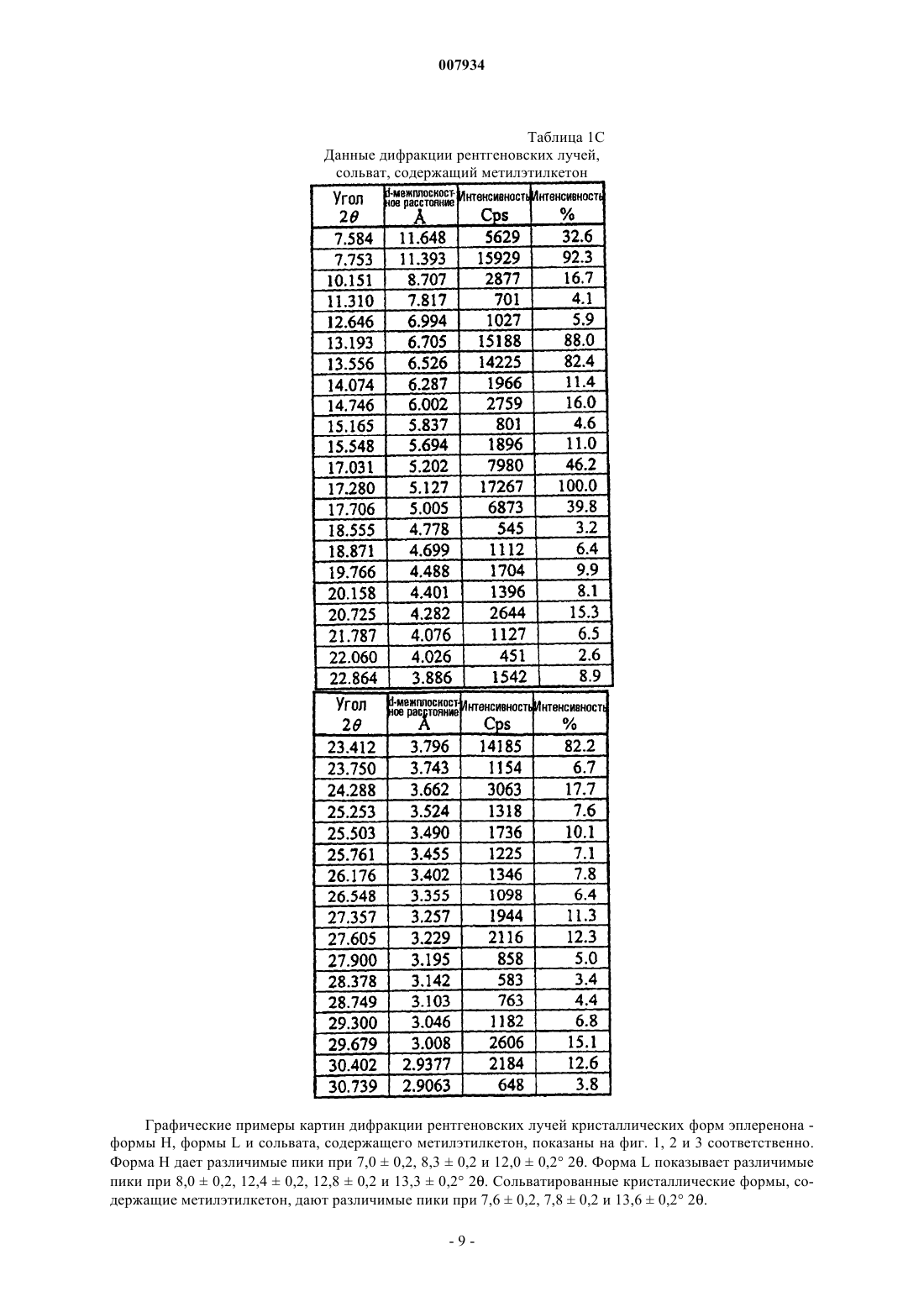
21. Композиция по п.20, где указанная сольватированная кристаллическая форма эплеренона представляет собой кристаллический сольват эплеренона, содержащий метилэтилкетон.
22. Композиция по п.1, дополнительно содержащая аморфный эплеренон.
23. Композиция по п.1, дополнительно содержащая один или более активаторов роста кристаллов формы Н.
24. Композиция по п.1, дополнительно содержащая одно или более соединений, выбранных из группы, состоящей из:
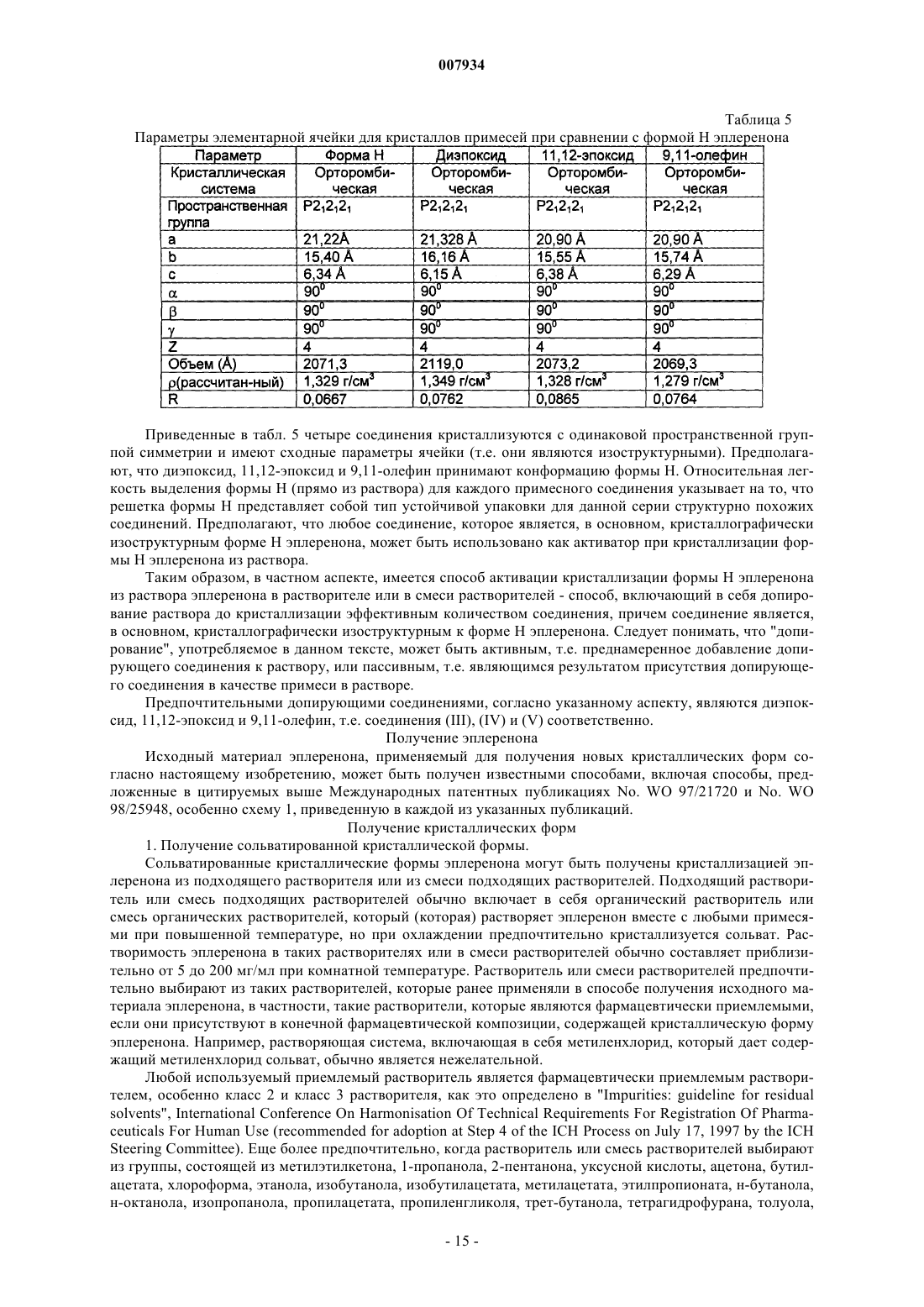
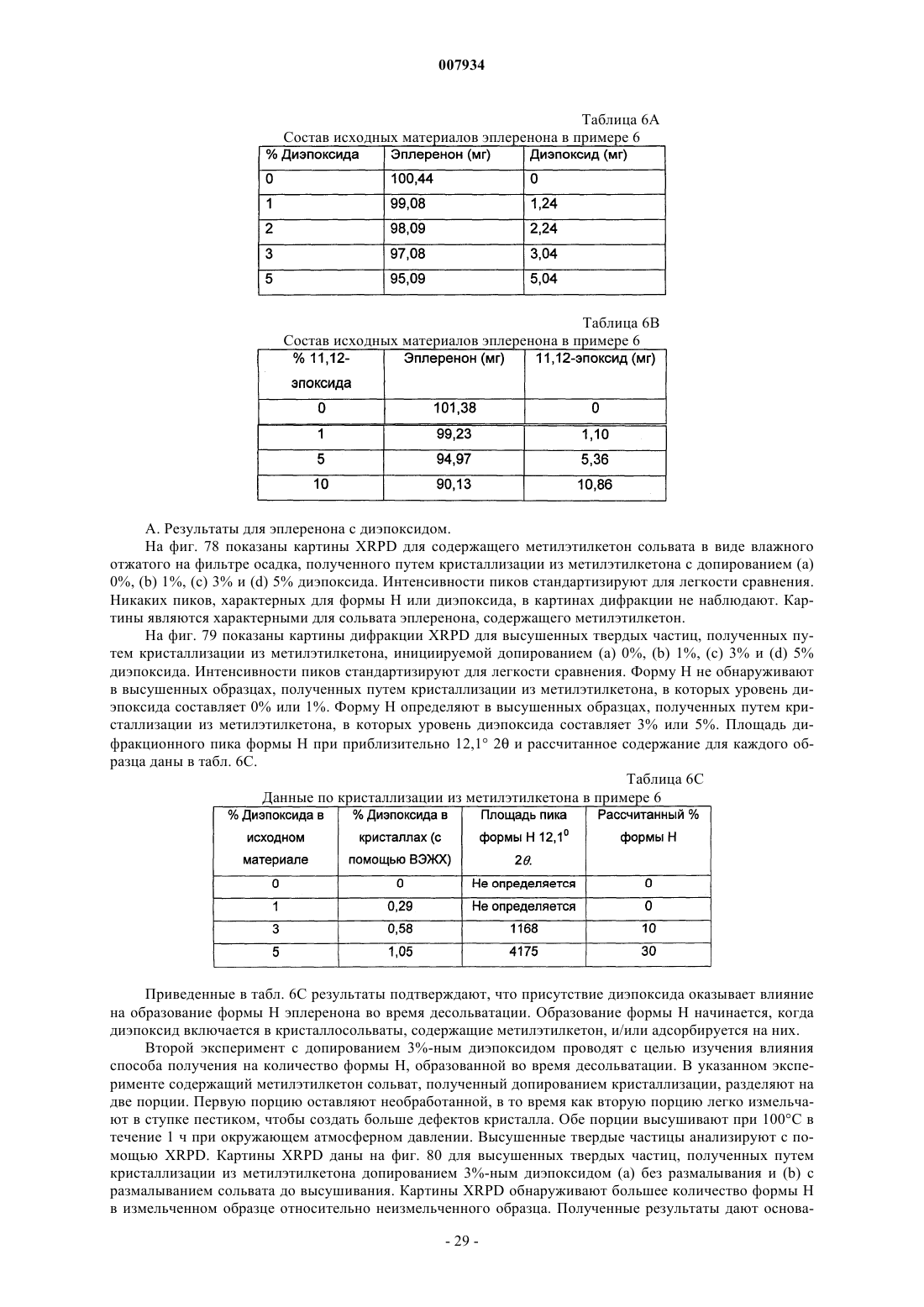
(а) 7-метилового эфира g-лактона 4a,5a,9a,11a-диэпокси-17-гидрокси-3-оксо-17a-прегнан-7a,21-дикарбоновой кислоты;
(б) 7-метилового эфира g-лактона 11a,12a-эпокси-17-гидрокси-3-оксо-17a-прегн-4-ен-7a,21-дикарбоновой кислоты и
(в) 7-метилового эфира g-лактона 17-гидрокси-3-оксо-17a-прегна-4,9(11)-диен-7a,21-дикарбоновой кислоты и их смесей.
25. Композиция по п.24, содержащая по меньшей мере 0,5 вес.% одного или более из указанных соединений по сравнению с общим суммарным весом эплеренона плюс одного или более из указанных соединений.
26. Композиция по п.25, содержащая по меньшей мере 1 вес.% одного или более из указанных соединений по сравнению с общим суммарным весом эплеренона плюс одного или более из указанных соединений.
27. Композиция по п.26, содержащая по меньшей мере 2 вес.% одного или более из указанных соединений яю сравнению с общим суммарным весом эплеренона плюс одного или более из указанных соединений.
28. Композиция по п.1, где пероральная дозированная форма представляет собой твердую пероральную дозированную форму, которая выбрана из группы, состоящей из таблеток, капсул и порошков.
29. Композиция по п.1, где форма Н кристаллического эплеренона содержит частицы, имеющие размер D90 в интервале примерно от 25 мкм и примерно до 400 мкм.
30. Способ получения формы Н кристаллического эплеренона, включающий в себя:
(а) получение раствора исходного материала эплеренона в высококипящем растворителе или смеси растворителей, содержащей высококипящий растворитель, и
(б) непосредственную кристаллизацию из раствора формы Н кристаллического эплеренона, имеющей орторомбическую кристаллическую систему и картину порошковой дифракции рентгеновских лучей при длине волны 1,54056 Е, содержащую один или более пиков, выбранных из группы, состоящей из 12,0 + 0,2ш 2q, 8,3 + 0,2ш 2q и 7 + 0,2ш 2q, где стадия кристаллизации проводится при температуре выше температуры энантиотропного перехода для указанной формы Н кристаллического эплеренона.
31. Способ по п.30, где форма Н кристаллического эплеренона характеризуется картиной порошковой дифракции рентгеновских лучей, которая не содержит значительного пика при 8,0 + 0,2ш 2q.
32. Способ по п.30, где растворителем является нитробензол.
33. Способ по п.30, где растворитель отличен от метиленхлорида, метиленхлорид/этилового эфира, этилового эфира, метиленхлорид/изопропанола и этилацетата.
34. Способ по п.30, где растворитель отличен от метиленхлорида, метиленхлорид/этилового эфира, этилового эфира, метиленхлорид/изопропанола, этилацетата, метилэтилкетона, этанола и ацетона.
35. Способ по п.30, где растворитель или смесь растворителей затравливают кристаллами формы Н кристаллического эплеренона до стадии кристаллизации или в процессе кристаллизации.
36. Способ по п.30, дополнительно включающий в себя стадию измельчения формы Н кристаллического эплеренона после кристаллизации до размера частиц D90 примерно менее чем 400 мкм.
37. Способ по п.36, дополнительно включающий в себя стадию измельчения формы Н кристаллического эплеренона после кристаллизации до размера частиц D90 в интервале примерно от 40 до 100 мкм.
38. Способ по п.30, где раствор дополнительно содержит один или более активаторов роста формы Н кристаллического эплеренона.
39. Способ по п.38, где активаторы роста формы Н кристаллического эплеренона выбраны из группы, состоящей из:
(а) 7-метилового эфира g-лактона 4a,5a,9a,11a-диэпокси-17-гидрокси-3-оксо-17a-прегнан-7a,21-дикарбоновой кислоты;
(б) 7-метилового эфира g-лактона 11a,12a-эпокси-17-гидрокси-3-оксо-17a-прегн-4-ен-7a,21-дикарбоновой кислоты и
(в) 7-метилового эфира g-лактона 17-гидрокси-3-оксо-17a-прегна-4,9(11)-диен-7a,21-дикарбоновой кислоты и их смесей.
40. Способ по п.38, где раствор содержит по меньшей мере 0,5 вес.% одного или более из активаторов роста по сравнению с общим суммарным весом исходного материала эплеренона плюс одного или более из активаторов роста.
41. Способ по п.40, где раствор содержит по меньшей мере 1 вес.% одного или более из активаторов роста по сравнению с общим суммарным весом исходного материала эплеренона плюс одного или более из активаторов роста.
42. Способ по п.40, где раствор содержит по меньшей мере 2 вес.% одного или более из активаторов роста по сравнению с общим суммарным весом исходного материала эплеренона плюс одного или более из активаторов роста.
43. Способ получения формы Н кристаллического эплеренона, подразумевающий:
(а) обработку исходного материала эплеренона низкой чистоты в растворителе, который способствует образованию сольватированной кристаллической формы эплеренона, или в смеси, содержащей такой растворитель;
(б) кристаллизацию эплеренона из растворителя или смеси, с образованием сольвата и
(в) десольватацию сольвата, с образованием кристаллической формы эплеренона, имеющей орторомбическую кристаллическую систему и картину порошковой дифракции рентгеновских лучей при длине волны 1,54056 Е, содержащую один или более пиков, выбранных из группы, состоящей из 12,0 + 0,2ш 2q, 8,3 + 0,2ш 2q и 7,0 + 0,2ш 2q.
44. Способ по п.43, где растворитель выбран из группы, состоящей из сольватов, содержащих метилэтилкетон, 2-пентанон, уксусную кислоту, ацетон, бутилацетат, хлороформ, этанол, изобутанол, изобутилацетат, метилацетат, этилпропионат, н-бутанол, н-октанол, н-пропанол, изопропанол, пропилацетат, пропиленгликоль, трет-бутанол, тетрагидрофуран, толуол и трет-бутилацетат, и их смесей.
45. Способ по п.44, где растворитель или смесь растворителей выбраны из группы, состоящей из метилэтилкетона, этанола или их смесей.
46. Способ по п.43, дополнительно подразумевающий измельчение эплеренона до или после кристаллизации до размера частиц D90 примерно менее чем 400 мкм.
47. Способ по п.43, дополнительно подразумевающий измельчение эплеренона до или после кристаллизации до размера частиц D90 в интервале примерно от 40 до 100 мкм.
48. Способ по п.43, где стадия обработки дополнительно включает в себя нагревание исходного материала эплеренона низкой чистоты в растворителе или смеси растворителей, пока не будет достигнута точка кипения растворителя или смеси растворителей.
49. Способ по п.43, где исходный материал эплеренона дополнительно содержит один или более активаторов роста формы Н кристаллического эплеренона.
50. Способ по п.49, где активаторы роста формы Н кристаллического эплеренона содержат одно или более соединений, которые выбраны из группы, состоящей из:
(а) 7-метилового эфира g-лактона 4a,5a,9a,11a-диэпокси-17-гидрокси-3-оксо-17a-прегнан-7a,21-дикарбоновой кислоты;
(б) 7-метилового эфира g-лактона 11a,12a-эпокси-17-гидрокси-3-оксо-17a-прегн-4-ен-7a,21-дикарбоновой кислоты и
(в) 7-метилового эфира g-лактона 17-гидрокси-3-оксо-17a-прегна-4,9(11) -диен-7a,21-дикарбоновой кислоты и их смесей.
51. Способ по п.49, где исходный материал эплеренона содержит по меньшей мере примерно 0,5 вес.% одного или более из активаторов роста по сравнению с общим суммарным весом эплеренона плюс одного или более из активаторов роста.
52. Способ по п.51, где исходный материал эплеренона содержит по меньшей мере 1 вес.% одного или более из активаторов роста по сравнению с общим суммарным весом эплеренона плюс одного или более из активаторов роста.
53. Способ по п.52, где исходный материал эплеренона содержит по меньшей мере 2 вес.% одного или более из активаторов роста по сравнению с общим суммарным весом эплеренона плюс одного или более из активаторов роста.
54. Способ лечения или профилактики у субъекта состояния или нарушеншя, опосредованного альдостероном, подразумевающий введение субъекту терапевтически или профилактически эффективного количества фармацевтической композиции по п.1.
55. Способ по п.54, где субъекту предписано лечение или профилактика состояния или нарушения, опосредованного альдостероном.
56. Способ по п.54, где указанное состояние или нарушение выбрано из группы, состоящей из гипертензии, сердечной недостаточности, цирроза печени, избытка коллагена, фиброза, доброкачественной гипертрофии простаты и депрессии.
57. Способ по п.56, где состоянием или нарушением является гипертензия.
58. Способ по п.56, где состоянием или нарушением является сердечная недостаточность.
59. Применение композиции по п.1 в качестве лекарственного средства для лечения или профилактики состояния или нарушения, опосредованного альдостероном.
60. Применение формы Н кристаллического эплеренона в качестве лекарственного средства для лечения состояния или нарушения, опосредованного альдостероном.
Текст
007934 Область изобретения Данное изобретение относится к сфере фармацевтических агентов, проявляющих активность антагонистов рецепторов альдостерона, в частности, антагониста рецепторов альдостерона эплеренона. В частности, изобретение относится к новой кристаллической форме эплеренона, к способам получения данной кристаллической формы, к фармацевтическим композициям, содержащим указанную кристаллическую форму, к способам лечения и/или профилактики состояний, опосредованно вызванных альдостероном, и/или нарушений, включающих в себя состояния и расстройства, связанные с гиперальдостеронизмом, таким как гипертония, с помощью данной кристаллической формы, и к использованию указанной кристаллической формы в производстве лекарственных средств. Предпосылки к созданию изобретения Соединение метиловый эфир -лактона 9,11-эпокси-17-гидрокси-3-оксопрегн-4-ен-7,21-дикарбоновой кислоты, имеющее структуру (I) и известное как эплеренон, было впервые описано в патенте СШАNo. 4559332 заявителем Grob et al., который раскрыл класс 9,11-эпоксистероидных соединений и их солей. Эплеренон является антагонистом рецепторов альдостерона и может вводиться в терапевтически эффективном количестве в случаях, когда показано применение антагониста рецепторов альдостерона,как, например, при лечении патологических состояний, связанных с гиперальдостеронизмом, включая гипертонии, нарушение сердечной деятельности, включая сердечную недостаточность, и цирроз печени. Вышеуказанный патент США No. 4559332, который включен в данный текст в виде ссылки, в основном, раскрывает получение эплеренона и получение фармацевтических композиций, содержащих эплеренон. Дополнительные способы получения 9,11-эпоксистероидных соединений и их солей, включая эплеренон, описаны в Международных патентных публикациях No. WO 97/21720 и No. WO 98/25948.Grob et al. (1997) "Steroidal aldosterone antagonists: increased selectivity of 9,11-epoxy derivatives",Helvetica Chimica Acta, 80, 566-585 описан рентгеноструктурный анализ кристаллической структуры сольвата эплеренона, полученного кристаллизацией эплеренона из растворяющей системы метиленхлорид/диэтиловый эфир.Steroid Biochemistry, 32 (13), 223-227 описано применение некомпозиционного эплеренона, имеющего размер частиц 20 мкм в единичной дозе эплеренона. Спиронолактон 20-спироксан-стероид структуры (II), обладающий активностью антагониста рецепторов альдостерона, является коммерчески доступным для лечения гипертонии. Однако спиронолактон имеет антиандрогенную активность, которая может привести к гинекомастии и импотенции у мужчин. Он также обладает слабой активностью прогестерона, что может вызывать менструальные нарушения у женщин. В связи с этим исследователи проявляют интерес к разработке дополнительных активных антагонистов рецепторов альдостерона, таких как эплеренон, который не взаимодействует с другими стероидными рецепторными системами, такими как стероидные рецепторные системы глюкокортикоида, прогестина и андрогена, и/или который обладает более широким спектром лечения.Agafonov et al. (1991), "Polymorphism of spirolactone", Journal of Pharmaceutical Sciences, 80 (2), 181185 описан содержащий ацетонитрил сольват, содержащий этанол сольват, содержащий этилацетат сольват, содержащий метанол сольват и две несольватированные кристаллические формы спиронолактона. Brittan (1999), Polymorphism in Pharmaceutical Solids, pp. 114-116, 207, 235 и 261 (Marcel Dekker) ,также описаны такие формы спиронолактона в твердом состоянии. Эплеренон имеет очень низкую растворимость в водной среде, и высвобождение лекарства в желудочно-кишечном тракте из пероральных дозированных форм часто является фактором, ограничивающим-1 007934 биологическую активность лекарственного средства и, в частности, скорость наступления терапевтического эффекта после перорального введения. Краткое описание сущности изобретения В настоящее время получена новая кристаллическая форма эплеренона, имеющая относительно быструю скорость растворения в водной среде и имеющая другие уникальные свойства относительно других форм эплеренона в твердом состоянии. Указанная кристаллическая форма охарактеризована полностью в данном тексте ниже, но для удобства ее называют "форма Н". В первом аспекте изобретение относится к новой кристаллической форме Н эплеренона как таковой. Среди свойств, отличающих форму Н от другой кристаллической формы, названной "форма L", для формы Н характерна орторомбическая кристаллическая система, по данным картины порошковой дифракции рентгеновских лучей, с пиком при 12,00,2 2 и точкой плавления в области приблизительно от 247 до 251 С. Во втором аспекте изобретение относится к эплеренону как лекарственному веществу, представляющему собой форму Н эплеренона, по крайней мере, в определяемом количестве. В третьем аспекте изобретение относится к эплеренону как лекарственному веществу, которое является, в основном, фазово-чистой формой Н эплеренона. Употребляемый в тексте термин "фазовочистый" относится к чистоте в отношении других форм эплеренона в твердом состоянии и необязательно означает высокую степень химической чистоты относительно других соединений. В четвертом аспекте изобретение относится к сольватированным кристаллическим формам эплеренона, которые при десольватации могут дать форму Н эплеренона. В пятом аспекте изобретение относится к фармацевтическим композициям, содержащим форму Н эплеренона с необязательно сопутствующей одной или более других форм эплеренона в твердом состоянии, причем в полной стандартной лекарственной форме количество эплеренона составляет приблизительно от 10 до 1000 мг и, кроме того, содержащим один или более фармацевтически приемлемых наполнителей. В шестом аспекте изобретение относится к способам получения формы Н эплеренона и получения композиций, содержащих форму Н эплеренона. В седьмом аспекте изобретение относится к способу профилактики и/или лечения состояния или нарушения, опосредованного альдостероном, включающему в себя введение субъекту терапевтически эффективного количества эплеренона, где, по крайней мере, присутствует фракция эплеренона в форме Н эплеренона. Дополнительные аспекты изобретения обсуждаются по всему тексту данного описания. Краткое описание фигур На фиг. 1 показана картина порошковой дифракции рентгеновских лучей формы Н эплеренона. На фиг. 2 показана картина порошковой дифракции рентгеновских лучей формы L эплеренона. На фиг. 3 показана картина порошковой дифракции рентгеновских лучей сольвата эплеренона, содержащего метилэтилкетон. На фиг. 4-14 приведены картины порошковой дифракции рентгеновских лучей следующих сольватов эплеренона: сольватов, содержащих н-пропиловый спирт, тетрагидрофуран, этилпропионат, уксусную кислоту, ацетон, толуол, изопропанол, этанол, изобутилацетат, бутилацетат, метилацетат и пропилацетат, соответственно. На фиг. 15 показана термограмма, снятая с помощью дифференциального сканирующего калориметра (DSC), неизмельченной формы L эплеренона, кристаллизованной прямо из метилэтилкетона. На фиг. 16 приведена DSC-термограмма неизмельченной формы L эплеренона, полученной путем десольватации сольвата, который получен в результате кристаллизации эплеренона высокой чистоты из метилэтилкетона. На фиг. 17 показана DSC-термограмма формы L эплеренона, полученной путем измельчения продукта десольватации сольвата, который получен в результате кристаллизации эплеренона высокой чистоты из метилэтилкетона. На фиг. 18 приведена DSC-термограмма неизмельченной формы Н эплеренона, полученной путем десольватации сольвата, который получен в результате вываривания эплеренона низкой чистоты из соответствующих растворителей. На фиг. 19-34 показаны DSC-термограммы следующих сольватов эплеренона: сольватов, содержащих н-пропиловый спирт, тетрагидрофуран, этилпропионат, уксусную кислоту, хлороформ, ацетон, толуол, изопропанол, трет-бутилацетат, этанол, изобутилацетат, бутилацетат, метилацетат, пропилацетат,н-бутанол и н-октанол, соответственно. На фиг. 35 показаны инфракрасные (ИК) спектры (диффузно-отраженные, DRIFT) формы Н эплеренона. На фиг. 36 показаны ИК-спектры (диффузно-отраженные, DRIFT) формы L эплеренона. На фиг. 37 показаны ИК-спектры (диффузно-отраженные, DRIFT) сольвата эплеренона, содержащего метилэтилкетон.-2 007934 На фиг. 38 показаны ИК-спектры (диффузно-отраженные, DRIFT) эплеренона в растворе хлороформа. На фиг. 39-51 показаны ИК-спектры следующих сольватов эплеренона: сольватов, содержащих нпропиловый спирт, тетрагидрофуран, этилпропионат, уксусную кислоту, ацетон, толуол, изопропанол,этанол, изобутилацетат, бутилацетат, пропилацетат, метилацетат, пропиленгликоль и трет-бутилацетат,соответственно. На фиг. 52 показаны 13 С ЯМР спектры формы Н эплеренона. На фиг. 53 показаны 13 С ЯМР спектры формы L эплеренона. На фиг. 54-71 приведены профили термогравиметрического анализа следующих сольватов эплеренона: сольватов, содержащих метилэтилкетон, н-пропиловый спирт, тетрагидрофуран, этилпропионат,уксусную кислоту, хлороформ, ацетон, толуол, изопропанол, этанол, изобутилацетат, бутилацетат, метилацетат, пропилацетат, пропиленгликоль, н-бутанол, н-октанол и трет-бутилацетат, соответственно. Фиг. 72 представляет собой сканирующую электронную микрофотографию формы L эплеренона,полученной десольватацией сольвата эплеренона, содержащего метилэтилкетон. Фиг. 73 представляет собой сканирующую электронную микрофотографию формы L эплеренона,полученной путем прямой кристаллизации из этилацетата. На фиг. 74 показана картина порошковой дифракции рентгеновских лучей кристаллической формы соединения 7-метиловый эфир -лактона 4,5;9,11-диэпокси-17-гидрокси-3-оксо-17-прегнан-7,21 дикарбоновой кислоты, (диэпоксид), выделенной из метилэтилкетона. На фиг. 75 показана картина порошковой дифракции рентгеновских лучей кристаллической формы соединения 7-метиловый эфир -лактона 11,12-эпокси-17-гидрокси-3-оксо-17-прегн-4-ен-7,21 дикарбоновой кислоты (11,12-эпоксид), выделенной из изопропанола. На фиг. 76 показана картина порошковой дифракции рентгеновских лучей кристаллической формы соединения 7-метиловый эфир -лактона 17-гидрокси-3-оксо-17-прегна-4,9(11)-диен-7,21-дикарбоновой кислоты (9,11-олефин), выделенной из н-бутанола. На фиг. 77 иллюстрируется зависимость между свободной энергией Гиббса и температурой для энантиотропно родственных полиморфов. На фиг. 78 показаны картины порошковой дифракции рентгеновских лучей сольвата в виде влажного осадка, отжатого на фильтре, содержащего метилэтилкетон, который получен путем кристаллизации из метилэтилкетона с допированием диэпоксидом в концентрации (а) 0%, (b) 1%, (с) 3% и (d) 5%. На фиг. 79 показаны картины порошковой дифракции рентгеновских лучей высушенных твердых частиц, полученных путем кристаллизации из метилэтилкетона с допированием диэпоксидом в концентрации (а) 0%, (b) 1%, (с) 3% и (d) 5%. На фиг. 80 приведены картины порошковой дифракции рентгеновских лучей высушенных твердых частиц, полученных путем кристаллизации из метилэтилкетона с допированием диэпоксидом в концентрации 3%, (а) без дробления сольвата до высушивания и (b) с дроблением. На фиг. 81 показаны картины порошковой дифракции рентгеновских лучей сольвата в виде влажного осадка, отжатого на фильтре, содержащего метилэтилкетон, полученного путем кристаллизации из метилэтилкетона с допированием 11,12-эпоксидом в концентрации (а) 0%, (b) 1%, (с) 5% и (d) 10%. На фиг. 82 показаны картины порошковой дифракции рентгеновских лучей высушенных твердых частиц, полученных путем кристаллизации из метилэтилкетона с допированием 11,12-эпоксидом в концентрации (а) 0%, (b) 1%, (с) 5% и (d) 10%. На фиг. 83 показана кубическая диаграмма чистоты продукта, чистоты исходного материала, скорости охлаждения и конечной температуры, основанная на приведенных в табл. 7 А примера 7 данных. На фиг. 84 показана полунормированная кривая, построенная с помощью кубической диаграммы фиг. 83, для определения переменных величин, оказывающих статистически значимое влияние на чистоту конечного материала. Фиг. 85 представляет собой график зависимости, основанный на данных, приведенных в табл. 7 А примера 7 данного текста, показывающий взаимосвязь между чистотой исходного материала и скоростью охлаждения в отношении влияния на чистоту конечного материала. На фиг. 86 приведена кубическая диаграмма весовой доли формы Н, чистоты исходного материала,скорости охлаждения и конечной температуры, на основе данных, приведенных в табл. 7 А примера 7 данного текста. На фиг. 87 приведена полунормированная кривая, построенная с помощью кубической диаграммы фиг. 86, для определения переменных величин, оказывающих статистически значимое влияние на чистоту конечного материала. Фиг. 88 представляет собой график зависимости, основанный на данных, приведенных в табл. 7 А примера 7 данного текста, показывающий, как влияет чистота исходного материала и конечнаятемпература на чистоту конечного материала. Фиг. 89 показывает картину дифракции рентгеновских лучей аморфного эплеренона. На фиг. 90 показана DSC-термограмма аморфного эплеренона.-3 007934 На фиг. 91 приведены скорости растворения, измеренные для четырех полиморфных образцов эплеренона. Подробное описание изобретения Как и для всех других фармацевтических соединений и композиций, химические и физические характеристики эплеренона являются важными для его коммерческого развития. Такие характеристики включают в себя, не ограничиваясь ими, (1) свойства уплотняемости, такие как молярный объем, плотность и гигроскопичность, (2) термодинамические характеристики, такие как температура плавления,давление пара и растворимость, (3) кинетические характеристики, такие как скорость растворения и устойчивость (включая устойчивость в условиях окружающей среды, особенно к влаге, и в условиях хранения), (4) характеристики поверхности, такие как площадь поверхности, смачиваемость, поверхностное натяжение и форма, (5) механические характеристики, такие как твердость, предел прочности на растяжение, уплотняемость, обрабатываемость, подвижность и смешиваемость и (6) фильтрационные свойства. Указанные характеристики могут влиять, например, на получение и хранение фармацевтических композиций, содержащих эплеренон. Формы эплеренона в твердом состоянии, которые проявляют улучшенные одну или более из указанных характеристик по сравнению с другими формами эплеренона в твердом состоянии, являются желательными. Согласно настоящему изобретению, получены новые формы эплеренона в твердом состоянии. В частности, данные формы включают в себя различные сольватированные кристаллические формы, по крайней мере две несольватированные и негидратированные кристаллические формы (обозначенные как форма Н и форма L) и аморфную форму эплеренона. Каждая форма эплеренона в твердом состоянии, описанная в настоящем изобретении, обладает одной или более из вышеуказанных химических и/или физических характеристик, проявляющих преимущество перед другими формами эплеренона в твердом состоянии, описанными в данном тексте или раскрытыми в литературе. Форму Н и форму L называют в приоритетных документах, приведенных в данном описании, как "форма I" и "форма II" соответственно и временами их называют "полиморф с высокой точкой плавления" и "полиморф с низкой точкой плавления" соответственно. Настоящее изобретение относится к форме Н эплеренона. Форма Н обладает более высокой скоростью растворения (приблизительно на 30% быстрее) в водной среде, чем, например, форма L эплеренона при температурах ниже температуры энантиотропного перехода (как описано в данном тексте ниже). В тех случаях, когда растворение эплеренона в желудочно-кишечном тракте является скоростьконтролируемой стадией в доставке эплеренона к таргетированным клеткам и тканям, более быстрое растворение приводит к повышению биологической активности. Поэтому форма Н может проявлять повышенную биологическую активность относительно формы L. Кроме того, выбор формы эплеренона в твердом состоянии, обладающей повышенной скоростью растворения, способствует большей гибкости в выборе наполнителей для фармацевтических композиций и в формировании этих композиций, в частности, таких, которые осуществляют немедленное высвобождение эплеренона, по сравнению с другими формами в твердом состоянии, имеющими более низкую скорость растворения. Форма L эплеренона также имеет преимущества перед другими его формами в твердом состоянии. В частности, она обладает более высокой физической устойчивостью при температурах ниже температуры энантиотропного перехода (как обсуждают в данном описании ниже), чем, например, форма Н. Формы эплеренона в твердом состоянии, такие как форма L, которая не требует особых условий для ее получения или хранения и которая не нуждается в частой замене, являются желательными. Например, выбор формы эплеренона в твердом состоянии, проявляющей физическую устойчивость в продолжение выполнения способа промышленного получения (такого как измельчение эплеренона с получением материала с меньшим размером частиц и большей площадью поверхности), может не требовать особых условий для его получения и повышенных затрат, особенно связанных с такими особыми условиями получения. Аналогично, выбор формы эплеренона в твердом состоянии, проявляющей физическую устойчивость в широком диапазоне условий хранения (особенно если рассматривать различные условия хранения, которые могут иметь место в продолжение жизни продукта эплеренона), может помочь избежать полиморфных или других деградационных изменений в эплереноне, приводящих к потере продукта или к ухудшению эффективности продукта. Поэтому выбор формы эплеренона в твердом состоянии, такой как форма L,обладающей большей физической устойчивостью, имеет значительное преимущество перед менее устойчивыми формами эплеренона. Изобретение также относится к сольватированным кристаллическим формам эплеренона. Указанные сольватированные формы применяют как промежуточные в процессе приготовления формы Н и формы L эплеренона; в контексте настоящего изобретения интерес представляют сольватированные кристаллические формы эплеренона, которые при десольватации могут давать форму Н эплеренона. Преимущество от использования сольватированной кристаллической формы как промежуточной заключается в достижении собственной микронизации кристалла, способствующей десольватации, которая обсуждается позже в данном изобретении. Такая микронизация может снизить или исключить потребность в измельчении. Кроме того, в тех случаях, когда все еще требуется дополнительное измельчение,-4 007934 легче измельчить определенные сольваты до стадии десольватации, чем измельчить форму Н или формуL после десольватации сольватированной кристаллической формы. Фармацевтически приемлемые сольватированные кристаллические формы эплеренона также можно использовать непосредственно в фармацевтической композиции. В одном аспекте сольватированные кристаллические формы, применяемые непосредственно в получении таких композиций, не содержат метиленхлорид, изопропанол или этиловый эфир; в другом аспекте, не содержат метиленхлорид, изопропанол, этиловый эфир, метилэтилкетон или этанол; и еще в другом аспекте, не содержат метиленхлорид, изопропанол, этиловый эфир, метилэтилкетон, этанол, этилацетат или ацетон. Самым предпочтительным для такого применения является исключение из сольватированной кристаллической формы эплеренона растворителей, которые не являются фармацевтически приемлемыми растворителями. Сольватированные кристаллические формы, применяемые в фармацевтических композициях, в основном и предпочтительно содержат фармацевтически приемлемый высококипящий растворитель и/или водородсвязывающий растворитель, такой как бутанол, но не ограничивается им. Полагают, что сольватированные кристаллические формы вкупе могут проявлять различные скорости растворения, и там, где растворение эплеренона в желудочно-кишечном тракте является скорость-контролируемой стадией в доставке эплеренона к клеткам- и тканям-мишеням, могут проявлять различные биологические активности относительно формы Н и формы L. Изобретение также относится к аморфной форме эплеренона. Аморфный эплеренон используют в качестве промежуточной формы в получении формы Н и формы L эплеренона. Кроме того, полагают,что аморфный эплеренон обладает различной скоростью растворения и там, где аморфный эплеренон присутствует в фармацевтической композиции и где растворение эплеренона в желудочно-кишечном тракте является скорость-контролируемой стадией в доставке эплеренона к клеткам-мишеням, такой аморфный эплеренон может проявить отличную от формы Н и формы L биологическую активность. Также интерес представляют комбинации форм в твердом состоянии, выбранных из группы, состоящей из формы Н эплеренона, формы L эплеренона, сольватированных кристаллических форм эплеренона и аморфного эплеренона. Такие комбинации применяют, например, в получении фармацевтических композиций, имеющих ряд профилей растворения, включая композиции с контролируемым высвобождением. В одном из аспектов настоящего изобретения предлагается комбинация форм в твердом состоянии, содержащая форму Н эплеренона, по крайней мере, в определяемом количестве, в равновесии с одной или более формами в твердом состоянии, выбранных из группы, состоящей из формы L эплеренона, сольватированных кристаллических форм эплеренона и аморфного эплеренона. В зависимости от предполагаемого использования формы эплеренона в твердом состоянии, рассмотрение условий получения может способствовать выбору особой формы в твердом состоянии или особой комбинации таких форм в твердом состоянии. Например, фазово-чистую форму L получить обычно легче, чем фазово-чистую форму Н. Однако смесь формы Н и формы L легче получить, чем фазово-чистую форму L, что позволяет использовать исходный материал эплеренона относительно низкой степени химической чистоты. Использование сольватированной кристаллической формы вместо формы Н или формы L в композиции исключает стадию процессинга, а именно десольватацию, в данных способах, которые в других случаях должны протекать путем десольватации сольватированной кристаллической формы. В отличие от этого, стадию десольватации можно исключить, например, если форму L непосредственно кристаллизуют из соответствующего растворителя без вмешательства в препарат и десольватации промежуточной сольватированной кристаллической формы. Такие способы описаны более подробно в данном тексте ниже. Определения Термин аморфный, употребляемый для эплеренона в данном тексте, означает твердое состояние,при котором молекулы эплеренона находятся в неупорядоченном состоянии и не образуют различимой кристаллической решетки или элементарной ячейки. Когда препарат подвергают исследованию посредством порошковой дифракции рентгеновских лучей, аморфный эплеренон не проявляет каких-либо характерных для кристаллов пиков. В тех случаях, когда ссылаются на точку кипения вещества или раствора, термин точка кипения означает точку кипения вещества или раствора при условиях, подходящих для данного способа. Термин кристаллическая форма, который применяют к эплеренону в данном тексте, означает форму в твердом состоянии, при котором молекулы эплеренона располагаются с образованием различимой кристаллической решетки (i), содержащей различимые элементарные ячейки, и (ii) дающей дифракционные пики при рентгеноструктурном анализе. Термин кристаллизация, употребляемый в данном тексте, может относиться к кристаллизации и/или перекристаллизации, в зависимости от применяемых условий, касающихся получения исходного материала эплеренона. Термин вываривание, употребляемый в данном тексте, означает способ, при котором суспензию твердого эплеренона в растворителе или в смеси растворителей нагревают при температуре кипения растворителя или смеси растворителей при условиях, подходящих для данного способа.-5 007934 Термин прямая кристаллизация, употребляемый в данном тексте, относится к кристаллизации эплеренона непосредственно из подходящего растворителя без образования и десольватации промежуточной сольватированной кристаллической формы эплеренона в твердом состоянии. Термин эплеренон как лекарственное вещество, употребляемый в данном тексте, означает эплеренон как таковой, как определено контекстом, в котором термин используют, и может относиться к некомпозиционному эплеренону или к эплеренону, присутствующему в фармацевтической композиции в качестве ингредиента. Термин размер частиц, употребляемый в данном тексте, относится к размеру частиц, определяемому с помощью принятых методов измерения размера частиц, хорошо известных в данной области,таких как рассеяние лазерного излучения, фракционирование с помощью седиментационного метода,фотоновая корреляционная спектроскопия или диск-центрифугирование. Размер частиц D90 является таким размером частиц, что 90 вес.% частиц имеют меньший размер, чем размер частиц D90, определяемый с помощью обычных методов измерения размера частиц. Термин "DSC" означает дифракционную сканирующую калориметрию. Термин "HPLC" означает ВЭЖХ. Термин "IR" означает инфракрасный. Термин "чистота", употребляемый в тексте, если не указано особо, означает химическую чистоту эплеренона согласно принятому анализу ВЭЖХ. Употребляемый в тексте термин "эплеренон низкой чистоты" обычно означает эплеренон, который содержит эффективное количество активатора роста кристаллов формы Н и/или ингибитора роста кристаллов формы L. Употребляемый в тексте термин эплеренон высокой чистоты обычно означает эплеренон, который не содержит или содержит меньше, чем эффективное количество, активатора роста кристаллов формы Н и/или ингибитора роста кристаллов формы L. Термин фазово-чистый, употребляемый в тексте, означает чистоту данной кристаллической или аморфной формы эплеренона в твердом состоянии, определяемой с помощью аналитических методов инфракрасной спектроскопии, описанных в данном тексте. Термин "XRPD" означает порошковую дифракцию рентгеновских лучей. Термин "rpm" означает обороты в минуту. Термин "TGA" означает термогравиметрический анализ. Термин "Тm" означает температуру плавления. Характеристика кристаллической формы 1. Молекулярная конформация. Анализ рентгеновских лучей монокристалла показывает, что конформация молекул эплеренона различается между формой Н и формой L, в частности, в отношении ориентации эфирной группы у положения 7 стероидного кольца. Ориентация эфирной группы может быть определена с помощью торсионного угла С 8-С 7-С 23-О 1. В кристаллической решетке формы Н молекула эплеренона принимает конформацию, в которой метоксигруппа эфира приблизительно совмещается с С-Н связью у 7-положения, а карбонильная группа приблизительно располагается в центре стероидного кольца В. Торсионный угол С 8-С 7-С 23-О 1 составляет приблизительно -73,0 в данной конформации. В указанной ориентации карбонильный атом кислорода эфирной группы (O1) находится в близком контакте с атомом кислорода 9,11-эпиксидного кольца(O4). Расстояние O1-O4 составляет приблизительно 2,97 , которое является меньше расстояния ван-дерВаальсова контакта 3,0(принимая ван-дер-Ваальсовы радиусы для атомов кислорода равными 1,5 ). В кристаллической решетке формы L молекула эплеренона принимает конформацию, в которой эфирная группа поворачивается приблизительно на 150 относительно эфирной группы формы Н и имеет торсионный угол С 8-С 7-С 23-О 1 приблизительно +76,9. В данной ориентации метоксигруппа эфира направлена к 4,5-алкеновому сегменту кольца А стероида. В указанной ориентации расстояние между любым атомом кислорода эфирной группы (O1, O2) и атомом кислорода 9,11-эпоксидного кольца (O4) увеличивается относительно расстояния, определяемого для формы Н. Расстояние O2-O4 составляет приблизительно 3,04 , при этом понижается указанное выше расстояние ван-дер-Ваальсова контакта. Расстояние O1-O4 составляет приблизительно 3,45 . В сольватированных кристаллических формах, анализируемых с помощью дифракции рентгеновских лучей монокристалла, молекула эплеренона, повидимому, принимает конформацию, характерную для формы L. 2. Порошковая дифракция рентгеновских лучей. Различные кристаллические формы эплеренона анализируют с помощью порошкового дифрактометра Siemens D5000 или с помощью дифрактометра Inel Multipurpose. С помощью порошкового дифрактометра Siemens D5000 данные получены для 2 (два тэта) величин от 2 до 50 с шагом 0,020 и шаговым периодом в две секунды. При использовании дифрактометра Inel Multipurpose образцы помещают в алюминиевый держатель и данные регистрируют в течение 30 мин при всех величинах 2 одновременно. Табл. 1 А, 1 В и 1 С представляют важные параметры основных пиков в зависимости от величин 2 и интенсивностей для кристаллической формы Н (полученной путем десольватации содержащего этанол-6 007934 сольвата, полученного вывариванием эплеренона низкой чистоты), кристаллической формы L (полученной путем десольватации содержащего метилэтилкетон сольвата, полученного путем перекристаллизации эплеренона высокой чистоты) и кристаллической формы содержащего метилэтилкетон сольвата (полученного путем перехода при комнатной температуре эплеренона высокой чистоты в суспензию в метилэтилкетоне) эплеренона соответственно (рентгеновские лучи при длине волны 1,54056 ). Минорные сдвиги в расположении пиков могут быть представлены в картинах дифракции формы Н и формы L как результат нарушений в периодичности дифракционных плоскостей, связанных со способом промышленного производства формы Н и формы L (т.е. с десольватацией сольвата). Кроме того,форму Н выделяют из сольвата, полученного вывариванием неочищенного эплеренона. Такой способ приводит к форме Н с более низкой общей химической чистотой (приблизительно 90%). И, наконец,сольватированные формы эплеренона, как и полагали, дают несколько сдвигов в положении дифракционных пиков вследствие повышенной подвижности молекул растворителя в каналах с растворителем в кристаллической решетке. Таблица 1 А Данные дифракции рентгеновских лучей, форма Н Таблица 1 В Данные дифракции рентгеновских лучей, форма L Таблица 1 С Данные дифракции рентгеновских лучей,сольват, содержащий метилэтилкетон Графические примеры картин дифракции рентгеновских лучей кристаллических форм эплеренона формы Н, формы L и сольвата, содержащего метилэтилкетон, показаны на фиг. 1, 2 и 3 соответственно. Форма Н дает различимые пики при 7,00,2, 8,30,2 и 12,00,2 2. Форма L показывает различимые пики при 8,00,2, 12,40,2, 12,80,2 и 13,30,2 2. Сольватированные кристаллические формы, содержащие метилэтилкетон, дают различимые пики при 7,60,2, 7,80,2 и 13,60,2 2.-9 007934 Примеры картин дифракции рентгеновских лучей показаны на фиг. 4-14 для следующих сольватных кристаллических форм эплеренона: сольвата с н-пропиловым спиртом, сольвата с тетрагидрофураном, сольвата с этилпропионатом, сольвата с уксусной кислотой, сольвата с ацетоном, сольвата с толуолом, сольвата с изопропанолом, сольвата с этанолом, сольвата с изобутилацетатом, сольвата с нбутилацетатом и сольвата с метилацетатом соответственно. 3. Температура плавления/разложения. Температуры плавления и/или разложения несольватированных кристаллических форм эплеренона определяют с помощью дифференциального сканирующего калориметра ТА Instruments 2920. Каждый образец в количестве 1-2 мг помещают либо в закрытый, либо в незакрытый алюминиевый резервуар и нагревают так, чтобы достичь скорости увеличения температуры приблизительно 10 С/мин. Температуру плавления/разложения определяют, экстраполируя начало к максимуму эндотермы плавления/разложения. Плавление формы Н и формы L эплеренона связано с химическим разложением и потерей содержащегося растворителя из кристаллической решетки. На температуру плавления/разложения также влияет обработка твердого вещества до анализа. Например, неизмельченная форма L с размером частиц D90 приблизительно 180-450 мкм, полученная путем прямой кристаллизации из соответствующего растворителя или путем десольватации сольвата, полученного в результате кристаллизации эплеренона высокой чистоты из соответствующего растворителя или смеси растворителей, в основном, имеет температурный диапазон плавления/разложения приблизительно от 237 до 242 С. Измельченная форма L с размером частиц D90 приблизительно от 80 до 100 мкм, которую получают путем кристаллизации сольвата из раствора эплеренона высокой чистоты в соответствующем растворителе или в смеси растворителей, путем десольватации сольвата и измельчением полученной формы L, в основном, имеет более низкий и широкий диапазон температур плавления/разложения, составляющий приблизительно от 223 до 234 С. Неизмельченная форма Н с размером частиц D90 приблизительно 180-450 мкм, полученная путем десольватации сольвата, который получают вывариванием эплеренона низкой чистоты, в основном, имеет более высокий диапазон температур плавления/разложения, составляющий приблизительно от 247 до 251 С. Примеры DSC термограмм (а) неизмельченной формы L, непосредственно кристаллизованной из метилэтилкетона, (b) неизмельченной формы L, образованной при десольватации сольвата, который получают путем кристаллизации эплеренона высокой чистоты из метилэтилкетона, (с) формы L, полученной путем измельчения десольватированного сольвата, образованного в результате кристаллизации эплеренона высокой чистоты из метилэтилкетона и (d) неизмельченной формы Н, образованной при десольватации сольвата, полученного вывариванием эплеренона низкой чистоты из метилэтилкетона, как показано на фиг. 15, 16, 17 и 18 соответственно. Термограммы DSC сольватированных форм эплеренона записывают с помощью дифференциального сканирующего калориметра Perkin Elmer Pyris 1. Каждый образец в количестве 1-2 мг помещают в незакрытый алюминиевый резервуар и нагревают так, чтобы достичь скорости увеличения температуры приблизительно 10C/мин. Одно или более эндотермических явлений при более низких температурах связаны с изменениями энтальпии, которые происходят при потере растворителя из сольватной кристаллической решетки. Высокотемпературная эндотерма или эндотермы связаны с плавлением/разложением формы L или формы Н эплеренона. Примеры термограмм DSC показаны на фиг. 19-34 для следующих сольватированных кристаллических форм эплеренона: сольвата с н-пропиловым спиртом, сольвата с тетрагидрофураном, сольвата с этилпропионатом, сольвата с уксусной кислотой, сольвата с хлороформом,сольвата с ацетоном, сольвата с толуолом, сольвата с изопропанолом, сольвата с этанолом, сольвата с трет-бутилацетатом, сольвата с изобутилацетатом, сольвата с бутилацетатом, сольвата с метилацетатом,сольвата с пропилацетатом, сольвата с н-бутанолом и сольвата с н-октанолом соответственно. 4. Инфракрасная абсорбционная спектроскопия. Инфракрасные абсорбционные спектры несольватированной формы Н и формы L эплеренона регистрируют с помощью Nicolet DRIFT (диффузно-отраженный инфракрасный с Фурье-преобразованием) спектрофотометра Magna System 550. При этом используют систему Spectra-Tech Collector и чашку для микрообразца. Образцы (5%) анализируют в бромиде калия и сканируют при длине волн от 400 до 4000 см-1. Инфракрасные абсорбционные спектры эплеренона в разбавленном растворе хлороформа (3%) и в виде сольватированных кристаллических форм регистрируют с помощью спектрофотометра Biorad FTS45. Растворы образцов в хлороформе анализируют, используя ячейку для раствора с длиной пути 0,2 мм и стенками из хлорида натрия. FTIR спектры сольватов получают с помощью IMB micro-MIR (многократное внутреннее отражение) приспособления. Образцы сканируют в области от 400 до 4000 см-1. Примеры инфракрасных абсорбционных спектров (а) формы Н, (b) формы L, (с) содержащего метилэтилкетон сольвата и (d) эплеренона в растворе хлороформа показаны на фиг. 35, 36, 37 и 38 соответственно. Табл. 2 иллюстрирует абсорбционные полосы для эплеренона в форме Н, формы L и сольватных кристаллических форм, содержащих метилэтилкетон. Полосы абсорбции для эплеренона в растворе хлороформа также показаны для сравнения.- 10007934 Различия между формой Н и либо формой L, либо сольватом, содержащим метилэтилкетон, наблюдали, например, в карбонильной области спектра. Форма Н имеет карбонильную полосу приблизительно при 1739 см-1, в то время как и форма L, и содержащий метилэтилкетон сольват имеют соответствующую полосу приблизительно при 1724 и 1722 см-1 соответственно. Полоса эфирного карбонила имеет место приблизительно при 1727 см-1 для эплеренона в растворе хлороформа. Изменение частоты полос эфирного карбонила между формой Н и формой L отражает изменение ориентации эфирной группы между двумя кристаллическими формами. Кроме того, полоса эфира коньюгированного кетона в А-кольце стероида сдвинута приблизительно от 1664-1667 см-1 в форме Н или в содержащем метилэтилкетон сольвате приблизительно до 1655 см-1 в форме L. В растворе хлороформа соответствующая карбонильная полоса наблюдается приблизительно при 1665 см-1. Другая разница между формой Н и формой L наблюдается в области поворота С-Н. Форма Н имеет абсорбцию приблизительно при 1399 см-1, которая не наблюдается в форме L, сольвате, содержащем метилэтилкетон, или эплереноне, находящемся в растворе хлороформа. Полоса при 1399 см-1 наблюдается в области вырезания СН 2 для метиленовых групп С 2 и С 21, примыкающих к карбонильным группам. Таблица 2 ИК абсорбционные полосы (см-1) для форм эплеренона Примеры инфракрасных абсорбционных спектров показаны на фиг. 39-51 для следующих сольватированных кристаллических форм эплеренона: сольвата с н-пропиловым спиртом, сольвата с тетрагидрофураном, сольвата с этилпропионатом, сольвата с ацетоном, сольвата с толуолом, сольвата с изопропанолом, сольвата с этанолом, сольвата с изобутилацетатом, сольвата с бутилацетатом, сольвата с пропилацетатом, сольвата с метилацетатом, сольвата с пропиленгликолем и сольвата с трет-бутилацетатом соответственно. 5. Спектроскопия ядерного магнитного резонанса (ЯМР). 13 С ЯМР спектры получают в области 31, 94 МГц. Примеры 13 С ЯМР спектров формы Н и формы L эплеренона показаны на фиг. 52 и 53 соответственно. Форма Н эплеренона, анализируемая для получения данных, отраженных на фиг. 52, не является фазово-чистой и включает в себя небольшое количество формы L эплеренона. Форма Н наиболее четко различима по резонансам углерода приблизительно при 64,8, 24,7 и 19,2 м.д. Форма L наиболее четко различима посредством определения резонансов углерода приблизительно при 67,1 и 16,0 м.д. 6. Термогравиметрия. Термогравиметрический анализ выполняют с помощью термогравиметрического анализатора ТАInstruments TGA 2950. Образцы помещают в незакрытый алюминиевый резервуар под током азота. Начальная температура была 25 С и увеличивалась со скоростью приблизительно 10 С/мин. Примеры профилей гравиметрического анализа показаны на фиг. 54-71 для следующих сольватированных кристаллических форм эплеренона: сольвата с метилэтилкетоном, сольвата с н-пропиловым спиртом, сольвата с тетрагидрофураном, сольвата с этилпропионатом, сольвата с уксусной кислотой,сольвата с хлороформом, сольвата с ацетоном, сольвата с толуолом, сольвата с изопропанолом, сольвата с этанолом, сольвата с изобутилацетатом, сольвата с н-бутилацетатом, сольвата с метилацетатом, сольвата с пропилацетатом, сольвата с пропиленгликолем, сольвата с н-бутанолом, сольвата с н-октанолом и сольвата с трет-бутилацетатом соответственно. 7. Микроскопия. Микроскопию со стадией нагревания проводят на монокристаллах сольвата эплеренона, содержащего метилэтилкетон, с помощью универсального Цейсовского микроскопа с поляризованным светомLinkam THMR 600 Hot Stage. Кристаллосольват является двулучепреломляющим и пропускающим свет в поляризованном свете при комнатной температуре, что указывает на то, что кристаллическая решетка- 11007934 является высокоупорядоченной. По мере того, как температура увеличивается приблизительно до 60 С,заметные дефекты начинают появляться в продольном направлении кристалла. Сканирующая электронная микрофотография формы L эплеренона, полученной путем десольватации сольвата эплеренона, содержащего метилэтилкетон, показана на фиг. 72, и она обнаруживает поверхностные дефекты, пустоты,трещины и изломы в кристаллической решетке. Сканирующая электронная микрофотография формы L эплеренона, полученной прямой кристаллизацией из этилацетата, показана на фиг. 73, и она не обнаруживает подобных поверхностных дефектов, пустот, трещин и изломов в кристаллической решетке. 8. Параметры элементарной ячейки. Табл. 3 А, 3 В и 3 С суммируют параметры элементарной ячейки, определенные для формы Н, формыL и нескольких сольватированных кристаллических форм эплеренона. Таблица 3 А Параметры элементарной ячейки для кристаллических форм эплеренона Таблица 3 В Параметры элементарной ячейки для кристаллических форм эплеренона Молекулы сольвата, содержащего бутилацетат, не были полностью уточнены вследствие неупорядоченности молекул растворителя в каналах.- 12007934 Таблица 3 С Параметры элементарной ячейки для кристаллических форм эплеренона Молекулы сольвата не были полностью уточнены вследствие неупорядоченности молекул растворителя в каналах. Дополнительная информация о выбранных сольватированных кристаллических формах эплеренона приведена в табл. 4 ниже. Приведенные в табл. 3 А выше данные элементарной ячейки для сольвата с метилэтилкетоном также характеризуют параметры элементарной ячейки для многих из указанных дополнительных кристаллических сольватов эплеренона. Большинство тестируемых кристаллических сольватов эплеренона изоструктурны друг к другу. В то время как некоторый минорный сдвиг пиков может иметь место при порошковой дифракции рентгеновских лучей от одной сольватированной кристаллической формы до следующей из-за размера включенной молекулы растворителя, общая картина дифракции является, по существу, такой же и параметры элементарной ячейки и положения молекул, в основном, идентичны для большей части исследуемых сольватов. Таблица 4 Дополнительная информация о сольватах эплеренона Определена как экстраполированная температура десольватации от конечной стадии потери веса растворителя, что определено термогравиметрическим анализом при скорости нагрева 10 С/мин в токе азота. На температуры десольватации, однако, может влиять способ промышленного получения сольвата. Различные способы могут давать различное число центров зарождения кристаллов, способных инициировать десольватацию в сольвате при низких температурах. Элементарная ячейка сольвата состоит из четырех молекул эплеренона. Стехиометрическое соотношение молекул эплеренона и молекул растворителя в элементарной ячейке также дано в табл. 4 выше для ряда сольватов. Элементарная ячейка формы Н состоит из четырех молекул эплеренона. Элементар- 13007934 ная ячейка формы L состоит из двух молекул эплеренона. Элементарные ячейки сольватов претерпевают превращение во время десольватации в элементарные ячейки формы Н и/или формы L, когда молекулы эплеренона подвергаются перемещению и вращению с тем, чтобы заполнить пространства, оставленные молекулами растворителя. В табл. 4 также представлены температуры десольватации для ряда различных сольватов. 9. Кристаллические свойства примесей. Выбранные примеси в эплереноне могут вызывать образование формы Н в течение десольватации сольвата. В частности, оценивают влияние следующих двух примесных молекул: 7-метиловый эфир лактона 4,5;9,11-диэпокси-17-гидрокси-3-оксо-17-прегнан-7,21-дикарбоновой кислоты (III) Действие этих примесей на кристаллическую форму эплеренона, полученную путем десольватации,описано подробнее в примерах, приведенных в данном тексте. Данное сходство в структуре монокристалла 7-метиловый эфир-лактона 17-гидрокси-3-оксо-17 прегна-4,9(11)-диен-7,21-дикарбоновой кислоты (V) (9,11-олефин) и формы Н эплеренона приводит к предположению, что 9,11-олефин также может вызывать образование формы Н во время десольватации сольвата. Монокристаллическую форму выделяют для каждого примесного соединения. Дифракционные картины рентгеновских лучей для кристаллических форм, выделенных для диэпоксида, 11,12-эпоксида и 9,11-олефина даны на фиг. 74, 75 и 76 соответственно. Картина порошковой дифракции рентгеновских лучей каждой примесной молекулы подобна картине порошковой дифракции формы Н, в предположении, что форма Н и три примесных соединения имеют сходные монокристаллические структуры. Монокристаллы каждого примесного соединения также выделяют и подвергают рентгеноструктурному анализу, чтобы удостовериться, что указанные три соединения обладают монокристаллическими структурами, сходными со структурой формы Н. Монокристаллы диэпоксида выделяют из метилэтилкетона. Монокристаллы 11,12-эпоксида выделяют из изопропанола. Монокристаллы 9,11-олефина выделяют из н-бутанола. Данные кристаллической структуры, определенные для кристаллической формы каждого примесного соединения, представлены в табл. 5. Полученная кристаллическая система и параметры ячейки были, в основном, одинаковые для формы Н, кристаллических форм диэпоксида, 11,12-эпоксида и 9,11-олефина.- 14007934 Таблица 5 Параметры элементарной ячейки для кристаллов примесей при сравнении с формой Н эплеренона Приведенные в табл. 5 четыре соединения кристаллизуются с одинаковой пространственной группой симметрии и имеют сходные параметры ячейки (т.е. они являются изоструктурными). Предполагают, что диэпоксид, 11,12-эпоксид и 9,11-олефин принимают конформацию формы Н. Относительная легкость выделения формы Н (прямо из раствора) для каждого примесного соединения указывает на то, что решетка формы Н представляет собой тип устойчивой упаковки для данной серии структурно похожих соединений. Предполагают, что любое соединение, которое является, в основном, кристаллографически изоструктурным форме Н эплеренона, может быть использовано как активатор при кристаллизации формы Н эплеренона из раствора. Таким образом, в частном аспекте, имеется способ активации кристаллизации формы Н эплеренона из раствора эплеренона в растворителе или в смеси растворителей - способ, включающий в себя допирование раствора до кристаллизации эффективным количеством соединения, причем соединение является,в основном, кристаллографически изоструктурным к форме Н эплеренона. Следует понимать, что "допирование", употребляемое в данном тексте, может быть активным, т.е. преднамеренное добавление допирующего соединения к раствору, или пассивным, т.е. являющимся результатом присутствия допирующего соединения в качестве примеси в растворе. Предпочтительными допирующими соединениями, согласно указанному аспекту, являются диэпоксид, 11,12-эпоксид и 9,11-олефин, т.е. соединения (III), (IV) и (V) соответственно. Получение эплеренона Исходный материал эплеренона, применяемый для получения новых кристаллических форм согласно настоящему изобретению, может быть получен известными способами, включая способы, предложенные в цитируемых выше Международных патентных публикациях No. WO 97/21720 и No. WO 98/25948, особенно схему 1, приведенную в каждой из указанных публикаций. Получение кристаллических форм 1. Получение сольватированной кристаллической формы. Сольватированные кристаллические формы эплеренона могут быть получены кристаллизацией эплеренона из подходящего растворителя или из смеси подходящих растворителей. Подходящий растворитель или смесь подходящих растворителей обычно включает в себя органический растворитель или смесь органических растворителей, который (которая) растворяет эплеренон вместе с любыми примесями при повышенной температуре, но при охлаждении предпочтительно кристаллизуется сольват. Растворимость эплеренона в таких растворителях или в смеси растворителей обычно составляет приблизительно от 5 до 200 мг/мл при комнатной температуре. Растворитель или смеси растворителей предпочтительно выбирают из таких растворителей, которые ранее применяли в способе получения исходного материала эплеренона, в частности, такие растворители, которые являются фармацевтически приемлемыми,если они присутствуют в конечной фармацевтической композиции, содержащей кристаллическую форму эплеренона. Например, растворяющая система, включающая в себя метиленхлорид, который дает содержащий метиленхлорид сольват, обычно является нежелательной. Любой используемый приемлемый растворитель является фармацевтически приемлемым растворителем, особенно класс 2 и класс 3 растворителя, как это определено в "Impurities: guideline for residualSteering Committee). Еще более предпочтительно, когда растворитель или смесь растворителей выбирают из группы, состоящей из метилэтилкетона, 1-пропанола, 2-пентанона, уксусной кислоты, ацетона, бутилацетата, хлороформа, этанола, изобутанола, изобутилацетата, метилацетата, этилпропионата, н-бутанола,н-октанола, изопропанола, пропилацетата, пропиленгликоля, трет-бутанола, тетрагидрофурана, толуола,- 15007934 метанола и трет-бутилацетата. Еще предпочтительнее, когда растворитель выбирают из группы, состоящей из метилэтилкетона и этанола. В другом аспекте данного способа, растворитель или смесь растворителей выбирают из группы, состоящей из 1-пропанола, 2-пентанона, уксусной кислоты, ацетона, бутилацетата, хлороформа, изобутанола, изобутилацетата, метилацетата, этилпропионата, н-бутанола, н-октанола, пропилацетата, пропиленгликоля, трет-бутанола, тетрагидрофурана, толуола, метанола и бутилацетата. В другом аспекте данного способа, растворитель или смесь растворителей выбирают из группы, состоящей из 1-пропанола, 2-пентанона, уксусной кислоты, ацетона, бутилацетата, хлороформа, изобутанола, изобутилацетата, метилацетата, этилпропионата, н-бутанола, н-октанола, н-пропанола, пропилацетата, пропиленгликоля, трет-бутанола, тетрагидрофурана, толуола, метанола и трет-бутилацетата. С целью приготовления сольватированной кристаллической формы эплеренона количество исходного материала эплеренона растворяют в объеме растворителя и охлаждают до тех пор, пока не образуются кристаллы. Температуру растворителя, при которой эплеренон добавляют к растворителю, обычно выбирают на основании кривой растворимости растворителя или смеси растворителей. Для большинства описанных в тексте растворителей, например, указанная температура растворителя обычно составляет по крайней мере приблизительно 25 С, предпочтительно приблизительно от 30 С до точки кипения растворителя и более предпочтительно примерно от температуры на 25 С ниже точки кипения растворителя до точки кипения растворителя. Альтернативно, горячий растворитель может быть добавлен к эплеренону, и смесь может охлаждаться до тех пор, пока не образуются кристаллы. Температуру растворителя во время его добавления к эплеренону обычно выбирают на основе кривой растворимости растворителя или смеси растворителей. Для большинства приведенных в данном тексте растворителей, например, температура растворителя обычно составляет по крайней мере 25 С, предпочтительно примерно от 15 С до точки кипения растворителя и боле предпочтительно - примерно от температуры, которая на 15 С ниже точки кипения растворителя, до точки кипения растворителя. Количество исходного материала эплеренона, смешанное с данным объемом растворителя, также зависит от кривой растворимости растворителя или смеси растворителей. Обычно количество добавленного к растворителю эплеренона полностью не растворяется в таком объеме растворителя при комнатной температуре. Для большинства приведенных в данном тексте растворителей количество исходного материала эплеренона, смешанное с данным объемом растворителя, обычно превышает по крайней мере приблизительно в 1,5-4,0 раза, предпочтительно приблизительно в 2,0-3,5 раза и более предпочтительно приблизительно в 2,5 раза количество эплеренона, которое растворится в данном объеме растворителя при комнатной температуре. После того как исходный материал эплеренона полностью растворится в растворителе, раствор обычно медленно охлаждают, чтобы кристаллизовать сольватированную кристаллическую форму эплеренона. Для большинства приведенных в данном тексте растворителей, например, раствор охлаждают со скоростью, меньшей, чем приблизительно 20 С/мин, предпочтительно со скоростью приблизительно 10 С/мин или медленнее, более предпочтительно со скоростью приблизительно 5 С/мин или медленее и еще предпочтительнее со скоростью приблизительно 1 С/мин или медленнее. Конечная температура, при которой извлекают сольватированную кристаллическую форму, зависит от кривой растворимости растворителя или смеси растворителей. Для большинства приведенных в данном тексте растворителей, например, конечная температура обычно составляет менее чем приблизительно 25 С, предпочтительно менее чем приблизительно 5 С и более предпочтительно менее чем приблизительно -5 С. Снижение конечной температуры обычно способствует образованию сольватированной кристаллической формы. Альтернативно, другие способы могут быть применены для получения сольвата. Примеры таких способов включают в себя, но они не являются ограничивающими, (i) растворение исходного материала эплеренона в одном растворителе и добавление со-растворителя, чтобы способствовать кристаллизации сольватной кристаллической формы, (ii) рост сольвата при диффузии паров, (iii) выделение сольвата с помощью упаривания, такого как упаривание с помощью роторного испарителя, и (iv) превращение суспензии. Кристаллы сольватированной кристаллической формы, полученные описанным выше способом,могут быть отделены от растворителя подходящими принятыми средствами, такими как фильтрация или центрифугирование. Энергичное перемешивание растворяющей системы во время кристаллизации обычно приводит к образованию кристаллов с меньшим размером частиц. 2. Получение формы L из сольвата. Форма L эплеренона может быть получена прямо из сольватированной кристаллической формы путем десольватации. Десольватацию можно выполнять любыми подходящими способами десольватации,такими как, не ограничиваясь ими, нагревание сольвата, снижение давления окружающей сольват среды или комбинации этих способов. Если сольват нагревают для удаления растворителя, например, в термостате, температура сольвата в течение указанного процесса обычно не превышает температуру энантио- 16007934 тропного перехода формы Н и формы L. Данная температура предпочтительно не превышает приблизительно 150 С. Давление при десольватации и время десольватации не являются решающими. Давление при десольватации предпочтительно составляет приблизительно одну атмосферу или меньше. Поскольку давление при десольватации снижается, то температура, при которой проводят десольватацию, и/или время десольватации также снижаются. В частности, для сольватов, обладающих более высокими температурами десольватации, высушивание в вакууме позволит применить более низкие температуры высушивания. Время для десольватации должно быть достаточным для десольватации и, таким образом, для того,чтобы полностью достичь образования формы L. Для того, чтобы обеспечить получение продукта, который, в основном, содержит всю форму L, исходным материалом эплеренона обычно должен быть высокоочищенный эплеренон, предпочтительно,по существу, чистый эплеренон. Используемый для получения формы L эплеренона исходный материал эплеренона обычно имеет по крайней мере 90% чистоты, предпочтительно по крайней мере 95% чистоты и более предпочтительно по крайней мере 99% чистоты. Как обсуждается более детально в других разделах данного изобретения, определенные загрязнения в исходном материале эплеренона могут отрицательно влиять на выход и на содержание формы L продукта, полученного указанным способом. Кристаллизованный продукт эплеренона, полученный данным способом из исходного материала,представляющего собой высокоочищенный эплеренон, обычно содержит по крайней мере 10% формы L,предпочтительно по крайней мере 50% формы L, более предпочтительно по крайней мере 75% формы L,еще более предпочтительно по крайней мере 90% формы L, еще более предпочтительно по крайней мере 95% формы L и еще предпочтительнее, в основном, фазово-чистую форму L. 3. Получение формы Н из сольвата. Содержащий форму Н продукт может быть получен, в основном, таким же способом, который описан для получения формы L, путем (i) использования исходного материала эплеренона низкой чистоты вместо исходного материала высокоочищенного эплеренона, (ii) затравливания системы растворителей кристаллами фазово-чистой формы Н, или (iii) комбинирования (i) и (ii). 3.1. Использование примесей в качестве активаторов и ингибиторов роста кристаллов. Присутствие и количество выбранных примесей в исходном материале эплеренона скорее, чем общее количество всех примесей в исходном материале эплеренона, воздействует на возможность образования кристаллов формы Н в течение десольватации сольвата. Выбранная примесь представляет собой обычно активатор роста формы Н или ингибитор роста формы L. Она может содержаться в исходном материале эплеренона, содержаться в растворителе или смеси растворителей до добавления исходного материала эплеренона, и/или добавлена к растворителю или смеси растворителей после добавления исходного материала эплеренона. В публикации Bonafede et al. (1995), "Selective nucleation and growth of anorganic polymorph by ledge-directed epitaxy on a molecular crystal substrate", J. Amer. Chem. Soc., 117 (30),включенной в данный текст в виде ссылки, обсуждают использование активаторов роста и ингибиторов роста в полиморфных системах. Для настоящего изобретения подходящая примесь представляет собой соединение, имеющее монокристаллическую структуру, в основном, идентичную монокристаллической структуре формы Н эплеренона. Примесью предпочтительно является соединение, имеющее картину порошковой дифракции рентгеновских лучей, идентичную картине порошковой дифракции рентгеновских лучей формы Н эплеренона, и более предпочтительно ее выбирают из группы, состоящей из диэпоксида, 11,12-эпоксида, 9,11-олефина и из их комбинаций. Количество примеси, необходимое для получения кристаллов формы Н, обычно зависит отчасти от растворителя или смеси растворителей и растворимости примеси относительно эплеренона. При кристаллизации формы Н из растворителя метилэтилкетона, например, весовое соотношение диэпоксида к исходному материалу эплеренона низкой чистоты обычно составляет по крайней мере приблизительно 1:100, предпочтительно по крайней мере 3:100, более предпочтительно от 3:100 до 1:5 и еще предпочтительнее от 3:100 до 1:10. 11,12-Эпоксид имеет более высокую растворимость в метилэтилкетоне, чем диэпоксид, и обычно требуется большее количество 11,12-эпоксида для получения кристаллов формы Н эплеренона. Там, где примесью является 11,12-эпоксид, весовое соотношение диэпоксида к исходному материалу эплеренона низкой чистоты обычно составляет по крайней мере приблизительно 1:5, более предпочтительно по крайней мере 3:25 и еще предпочтительнее от 3:25 до 1:5. Там, где применяют в качестве примесей для получения кристаллов формы Н как диэпоксид, так и 11,12-эпоксид, весовое соотношение каждой примеси к исходному материалу эплеренона может быть ниже, чем соответствующее отношение при использовании только одной примеси в получении кристаллов формы Н. Смесь формы Н и формы L эплеренона обычно получают при десольватировании сольвата, содержащего выбранную примесь. Весовая доля формы Н в продукте, полученном в результате первоначальной десольватации сольвата, обычно составляет приблизительно менее 50%. Дальнейшая обработка указанного продукта путем кристаллизации или выпаривания, как описано ниже, обычно увеличивает весовую долю формы L в продукте. 3.2. Затравливание.- 17007934 Кристаллы формы Н также могут быть получены путем затравливания системы растворителей кристаллами фазово-чистой формы Н (или активатором роста формы Н и/или ингибитором роста формы L,как описано ранее) до кристаллизации эплеренона. Исходный материал эплеренона может представлять собой эплеренон низкой чистоты или эплеренон высокой чистоты. Когда образовавшийся сольват, полученный из любого исходного материала, десольватируют, весовая доля формы Н в продукте обычно составляет по крайней мере приблизительно 70% и может быть значительной и составлять приблизительно 100%. Весовое соотношение затравочных кристаллов формы Н, добавленных к системе растворителей, к исходному материалу эплеренона, добавленному к системе растворителей, обычно составляет по крайней мере приблизительно 0,75:100, предпочтительно от 0,75:100 до 1:20 и более предпочтительно от 1:100 до 1:50. Затравочные кристаллы формы Н могут быть получены любыми способами, описанными в данном изобретении для приготовления кристаллов формы Н, в частности, для приготовления кристаллов формы Н путем вываривания, как описано ниже. Затравочные кристаллы формы Н могут быть добавлены одномоментно, несколькими порциями или в течение продолжительного периода времени. Однако добавление затравочных кристаллов формы Н обычно заканчивают до того, как эплеренон начинает кристаллизоваться из раствора, т.е. затравливание заканчивается до достижения точки помутнения (нижняя точка метастабильной зоны). Обычно затравливание выполняют, когда температура раствора колеблется от температуры, составляющей приблизительно на 0,5 С выше точки помутнения, до температуры, составляющей на 10 С выше точки помутнения, предпочтительно в пределах приблизительно от температуры, которая на 2 С выше, до температуры, которая на 3 С выше точки помутнения. Поскольку температура выше точки помутнения, при которой добавляют затравочные кристаллы, увеличивается, количество затравки, требуемое для кристаллизации формы Н, обычно возрастает. Затравливание предпочтительно имеет место не только при температуре выше точки помутнения,но и в пределах метастабильной зоны. Как точка помутнения, так и метастабильная зона зависят от растворимости и концентрации эплеренона в растворителе или смеси растворителей. Для разбавления 12 объемами метилэтилкетона, например, верхняя точка метастабильной зоны обычно составляет приблизительно от 70 до 73 С, и нижняя точка метастабильной зоны (т.е. точка помутнения) составляет приблизительно от 57 до 63 С. Для концентрации из 8 объемов метилэтилкетона метастабильная зона является более узкой, поскольку раствор перенасыщен. При указанной концентрации точка помутнения раствора имеет место приблизительно от 75 до 76 С. Поскольку точка кипения метилэтилкетона составляет приблизительно 80 С при условиях окружающей среды, затравливание для такого раствора происходит приблизительно между 76,5 С и точкой кипения. Иллюстративный неограничивающий пример затравливания формой Н приведен в примере 7 данного текста. Кристаллизованный продукт эплеренона, полученный с помощью активатора роста формы Н или ингибитора роста формы L и/или затравки формой Н, обычно содержит по крайней мере 2% формы Н,предпочтительно по крайней мере 5% формы Н, более предпочтительно по крайней мере 7% формы Н и еще предпочтительнее, по крайней мере, приблизительно 10% формы Н. Остаточный кристаллизованный продукт эплеренона обычно является формой L. 3.3. Получение формы Н путем измельчения эплеренона. В другом аспекте, было обнаружено, что небольшое количество формы Н может быть получено путем подходящего измельчения эплеренона. Концентрации формы Н в размолотом эплереноне составляют приблизительно 3%. 4. Получение формы L из сольвата, приготовленного из эплеренона низкой степени чистоты. Как описано выше, кристаллизация эплеренона низкой степени чистоты с образованием сольвата и последующей десольватацией сольвата приводит к продукту, содержащему как форму Н, так и форму L. Продукт с большим содержанием формы Н может быть получен из эплеренона низкой степени чистоты таким же способом, как описан выше для получения формы Н путем затравливания растворяющей системы кристаллами фазово-чистой формы L или с помощью активатора роста формы L и/или ингибитора роста формы Н. Протокол затравливания и весовое соотношение количества затравочных кристаллов формы L, добавленных к растворяющей системе, к количеству исходного материала эплеренона, добавленного к растворяющей системе, обычно являются подобными таким соотношениям, которые ранее описаны для получения эплеренона формы Н путем затравливания кристаллами фазово-чистой формы Н. Кристаллизованный продукт эплеренона, полученный таким способом, обычно содержит по крайней мере 10% формы L, предпочтительно по крайней мере 50% формы L, более предпочтительно по крайней мере 75% формы L, более предпочтительно по крайней мере 90% формы L, еще предпочтительнее по крайней мере приблизительно 95% формы L и еще предпочтительнее, в основном, фазово-чистую форму L. Протоколы затравливания, описанные в данном тексте в отношении получения эплеренона формы Н, также могут учитывать осуществление контроля за размером частиц кристаллизованного эплеренона. 5. Кристаллизация формы L прямо из раствора.- 18007934 Форма L эплеренона также может быть получена путем прямой кристаллизации эплеренона из подходящего растворителя или смеси растворителей без образования промежуточного сольвата и последующей необходимости для десольватации. Обычно (i) размер молекулы растворителя является несовместимым с имеющимся пространством канала в сольватной кристаллической решетке, (ii) эплеренон и любые присутствующие примеси растворяются в растворителе при повышенных температурах, и (iii) охлаждение приводит к кристаллизации несольватированной формы L эплеренона. Растворимость эплеренона в растворителе или смеси растворителей обычно составляет приблизительно от 5 до 200 мг/мл при комнатной температуре. Растворитель или смесь растворителей предпочтительно содержит один растворитель или более растворителей, выбранных из группы, состоящей из метанола, этилацетата, изопропилацетата, ацетонитрила, нитробензола, воды и этилбензола. Для того, чтобы кристаллизовать форму L эплеренона прямо из раствора, количество исходного материала эплеренона растворяют в объеме растворителя и охлаждают до тех пор, пока не образуются кристаллы. Температуру растворителя, при которой эплеренон добавляют к растворителю, обычно подбирают на основании кривой растворимости растворителя или смеси растворителей. Для большинства описанных в данном тексте растворителей такая температура растворителя составляет по крайней мере приблизительно 25 С, предпочтительно приблизительно от 30 С до точки кипения растворителя и более предпочтительно приблизительно от температуры, которая на 25 С ниже точки кипения растворителя, до точки кипения растворителя. Альтернативно, горячий растворитель может быть добавлен к эплеренону, и смесь охлаждают до тех пор, пока не образуются кристаллы. Температуру растворителя во время его добавления к эплеренону обычно подбирают на основании кривой растворимости растворителя или смеси растворителей. Для большинства описанных в данном тексте растворителей такая температура растворителя составляет по крайней мере приблизительно 25 С, предпочтительно приблизительно от 50 С до точки кипения растворителя и более предпочтительно приблизительно от температуры, которая на 15 С ниже точки кипения растворителя, до точки кипения растворителя. Количество исходного материала эплеренона, смешанное с данным объемом растворителя, также будет зависеть от кривой растворимости растворителя или смеси растворителей. Обычно количество эплеренона, добавленное к растворителю, не будет полностью растворяться в таком объеме растворителя при комнатной температуре. Для большинства описанных в данном тексте растворителей количество исходного материала эплеренона, смешанное с данным объемом растворителя, обычно составляет приблизительно в 1,5-4,0 раза больше, предпочтительно приблизительно в 2,0-3,5 раза больше, например,приблизительно в 2,5 раза больше количества эплеренона, которое будет растворяться в таком объеме растворителя при комнатной температуре. Для того, чтобы обеспечить получение продукта, содержащего, в основном, фазово-чистую формуL, исходный материал эплеренона обычно берется в виде эплеренона высокой чистоты. Исходный материал эплеренона предпочтительно составляет по крайней мере приблизительно 65% чистоты, более предпочтительно по крайней мере 90% чистоты, еще более предпочтительно по крайней мере 98% чистоты и наиболее предпочтительно по крайней мере приблизительно 99% чистоты. После того как исходный материал эплеренона полностью растворяется в растворителе, раствор медленно охлаждают, чтобы кристаллизовать форму L эплеренона. Для большинства описанных в данном тексте растворителей, например, раствор охлаждают со скоростью, меньшей, чем приблизительно 1 С/мин, предпочтительно со скоростью 0,2 С/мин или менее и более предпочтительно со скоростью от 0,05 до 0,1 С/мин. Конечная температура, при которой кристаллы формы L извлекают, будет зависеть от кривой растворимости растворителя или смеси растворителей. Для большинства описанных в данном тексте растворителей конечная температура составляет менее чем приблизительно 25 С, предпочтительно менее чем 5 С и более предпочтительно менее чем -5 С. Альтернативно, другие способы могут быть использованы для получения кристаллов формы L эплеренона. Примеры таких способов включают в себя, не ограничиваясь ими, (i) растворение исходного материала эплеренона в одном растворителе и добавление со-растворителя, чтобы способствовать кристаллизации формы L эплеренона, (ii) рост формы L эплеренона при диффузии паров, (iii) выделение формы L эплеренона путем упаривания, такого как упаривание с помощью роторного испарителя, и (iv) превращение суспензии. Кристаллы формы L эплеренона, полученные, как описано выше, могут быть отделены от растворителя любыми подходящими принятыми средствами, такими как фильтрация или центрифугирование. Кроме того, форма L эплеренона может быть получена путем вываривания (как описано ниже) суспензии эплеренона высокой чистоты в метилэтилкетоне и фильтрации вываренного эплеренона при точке кипения суспензии. 6. Получение формы Н прямо из раствора. Заявители полагают, что если кристаллизацию проводят при температуре выше температуры энантиотропного перехода (Tt) для формы Н и формы L, в частности, если присутствуют активаторы роста формы Н и ингибиторы роста формы L или растворитель затравливают кристаллами фазово-чистой фор- 19007934 мы Н, то форма Н будет кристаллизоваться прямо из раствора, т.к. форма Н является более стабильной при таких высоких температурах. Предпочтительно, когда растворяющая система содержит высококипящий растворитель, такой как нитробензол. Подходящие активаторы роста формы Н включают в себя, но не ограничиваются ими, соединения диэпоксид и 11,12-олефин, определяемые выше в данном тексте. 7. Вываривание эплеренона с растворителем. Сольватированные кристаллические формы, форма Н и форма L, также могут быть получены путем вываривания исходного материала эплеренона в подходящем растворителе или смеси растворителей. Например, количество исходного материала эплеренона объединяют с объемом растворителя или смеси растворителей, кипятят с обратным холодильником и дистиллят удаляют, в то время как дополнительное количество растворителя добавляют одновременно с удалением дистиллята. Альтернативно, дистиллят может быть конденсирован и возвращен в повторный цикл без добавления растворителя в течение процесса вываривания. Обычно, как только первоначальный объем растворителя удаляют или конденсируют и возвращают в повторный цикл, суспензию охлаждают, и при этом образуются сольватированные кристаллы. Сольватированные кристаллы могут быть отделены от растворителя любыми подходящими принятыми средствами, такими как фильтрация или центрифугирование. Десольватация сольвата, как ранее описано, приводит к форме Н или форме L эплеренона, в зависимости от присутствия или отсутствия выбранных примесей в сольватированных кристаллах. Подходящий растворитель или смесь растворителей обычно включает в себя один растворитель или более растворителей, ранее описанных в данном тексте. Растворитель может быть выбран, например, из группы, состоящей из метилэтилкетона и этанола. Количество исходного материала эплеренона, добавленное к растворителю, используемому в процессе вываривания, обычно является достаточным для того, чтобы сохранить суспензию (т.е. эплеренон не полностью растворяется в растворителе или смеси растворителей) при точке кипения растворителя или смеси растворителей. Показано, что могут быть использованы концентрации эплеренона приблизительно 0,25г/мл в метилэтилкетоне или приблизительно 0,125 г/мл в этаноле. Суспензию обычно охлаждают медленно, как только обмен растворителя заканчивается, чтобы кристаллизовать сольватированную кристаллическую форму эплеренона. Для исследуемых растворителей суспензию охлаждают со скоростью, приблизительно меньшей чем 20 С/мин, предпочтительно 10 С/мин или менее, более предпочтительно 5 С/мин или менее и еще предпочтительнее 1 С/мин или менее. Конечная температура, при которой выделяют сольватированную кристаллическую форму, будет зависеть от кривой растворимости растворителя или смеси растворителей. Для большинства описанных в данном тексте растворителей конечная температура обычно составляет приблизительно менее 25 С,предпочтительно менее 5 С и более предпочтительно менее -5 С. Если продукт, содержащий главным образом или исключительно форму L, является желательным,то обычно вываривают исходный материал эплеренона высокой степени чистоты. Исходный материал эплеренона высокой степени чистоты предпочтительно составляет по крайней мере приблизительно 98% чистоты, более предпочтительно по крайней мере 99% чистоты и еще более предпочтительно по крайней мере 99,5% чистоты. Продукт эплеренона, полученный указанным способом с помощью вываривания,содержит приблизительно по крайней мере 10%, предпочтительно по крайней мере 50%, более предпочтительно по крайней мере 75%, еще более предпочтительно по крайней мере 90%, еще предпочтительнее по крайней мере 95% формы L и самое предпочтительное - в основном фазово-чистую форму L. Если продукт, содержащий главным образом или исключительно форму Н, является желательным,то обычно вываривают исходный материал эплеренона низкой степени чистоты. Исходный материал эплеренона низкой степени чистоты обычно содержит столько активатора роста формы Н и/или ингибитора роста формы L, сколько требуется для получения формы Н. Предпочтительно, исходный материал эплеренона низкой степени чистоты составляет приблизительно по крайней мере 65% чистоты, более предпочтительно по крайней мере 75% чистоты и еще предпочтительнее по крайней мере 80% чистоты. Продукт эплеренона, полученный указанным способом с помощью вываривания, содержит приблизительно по крайней мере 10%, предпочтительно по крайней мере 50%, более предпочтительно по крайней мере 75%, еще более предпочтительно по крайней мере 90%, еще предпочтительнее по крайней мере 95% формы Н и самое предпочтительное - в основном фазово-чистую форму Н. 8. Получение аморфного эплеренона. Аморфный эплеренон может быть получен в малых количествах путем подходящего измельчения твердого эплеренона, такого как дробление, размалывание и/или микронизация. Фазово-чистый аморфный эплеренон, т.е. аморфный эплеренон, в основном лишенный кристаллического эплеренона, может быть получен, например, лиофилизацией раствора эплеренона, в частности, водного раствора эплеренона. Такие способы иллюстрируются в примерах 13 и 14 данного текста. Обсуждение дополнительной обработки 1. Обсуждение термодинамической стабильности.- 20007934 Форма L является более термодинамически стабильной, чем форма Н при температурах окружающей среды. Как описано в примере 5 данного текста, когда органическую суспензию, содержащую эквивалентные количества формы Н и формы L, оставляют на ночь при комнатной температуре, и остаточные твердые частицы затем собирают и анализируют с помощью порошковой дифракции рентгеновских лучей, результаты анализа указывают на то, что эплеренон полностью превращается в форму L. Данные дифференциальной сканирующей калориметрии (DSC), приведенные в тексте выше, указывают на то,что форма Н является термодинамически более стабильной, чем форма L при высоких температурах,поскольку она имеет более высокую температуру плавления/разложения. Вместе взятые, превращение суспензии и данные DSC указывают на то, что форма Н и форма L являются энантиотропно родственными, т.е. изменение в стабильности взаимосвязи между двумя полиморфами имеет место около температуры перехода (Tt), причем форма L является более стабильной при низких температурах. Фиг. 12 показывает зависимость свободной энергии Гиббса от температуры, обычно наблюдаемой для энантиотропно родственных полиморфов, таких как форма Н и форма L эплеренона, Tt относится к температуре перехода, Тm относится к точке плавления формы Н и формы L. Таким образом, температуру обработки предпочтительно поддерживают ниже температуры перехода в процессе получения композиций, содержащих форму L. Например, применяемые для десольватации температуры высушивания обычно составляют приблизительно менее 150 С, предпочтительно менее 125 С, более предпочтительно менее 115 С, более предпочтительно менее 110 С и еще предпочтительнее от 80 до 110 С. Кроме того, охлаждение (например, с помощью жидкого азота) может быть необходимым на стадиях, связанных с уменьшением размера частиц, для того, чтобы поддержать температуру кристаллов формы L ниже температуры перехода. 2. Обсуждение внутренней микронизации. Применяемый для получения кристаллического эплеренона способ может влиять на свойства полученной кристаллической формы. Например, в форме L, полученной путем десольватации сольвата, выявлена большая распространенность поверхностных дефектов, пор, трещин и разломов в кристаллической решетке, чем в форме L, полученной путем прямой кристаллизации из растворителя. Указанная внутренняя микронизация десольватированного кристалла приводит к увеличению как доступной площади поверхности кристалла, так и скорости растворения кристалла. Поэтому время растворения может быть укорочено путем отбора кристаллов формы L, полученных десольватацией, удлинено путем отбора кристаллов формы L, полученных прямой кристаллизацией, или в других случаях может регулироваться путем отбора соответствующей комбинации кристаллов формы L, полученных путем десольватации, и кристаллов формы L, полученных путем прямой кристаллизации. Внутренняя микронизация также может эффективно снижать или устранять необходимость уменьшения размера частиц на стадиях обработки, где кристаллы формы L, полученные десольватацией, используют для приготовления фармацевтической композиции. Одним недостатком применения таких кристаллов формы L, однако, является необходимость стадии десольватации, которая не требуется для кристаллов формы L, полученных путем прямой кристаллизации. Получение форм твердого состояния согласно способу Аспекты настоящего изобретения также включают в себя особенные формы эплеренона в твердом состоянии и их комбинации, полученные в соответствии со способами, описанными в данном изобретении. В частности, форма Н эплеренона, отдельно или в комбинации с одной или более дополнительных форм в твердом состоянии (включая сольватированные кристаллические формы, форму L и аморфный эплеренон, полученные, как указано выше в данном изобретении), является аспектом настоящего изобретения. Кроме того, сольватированные кристаллические формы, используемые как промежуточные при получении формы Н эплеренона путем десольватации, и полученные, как описано выше в данном изобретении, являются аспектами настоящего изобретения. Комбинации форм твердого состояния В комбинациях, содержащих первую форму эплеренона в твердом состоянии и вторую форму эплеренона в твердом состоянии, где первую и вторую формы эплеренона в твердом состоянии выбирают из формы Н, формы L, сольватированного эплеренона и аморфного эплеренона, может быть использовано любое подходящее весовое соотношение первой и второй формы в твердом состоянии. Вообще в таких комбинациях весовое соотношение первой и второй формы в твердом состоянии предпочтительно составляет приблизительно от 1:99 до 99:1 и более предпочтительно по крайней мере 1:9, более предпочтительно по крайней мере 1:1, более предпочтительно по крайней мере 2:1, более предпочтительно по крайней мере 5:1 и наиболее предпочтительно по крайней мере 9:1. Согласно аспекту настоящего изобретения, первой формой в твердом состоянии является форма Н и второй формой в твердом состоянии является форма L. В другом аспекте, третья форма в твердом состоянии также присутствует. Размер частиц эплеренона Хотя каждая из указанных выше форм эплеренона в твердом состоянии или их комбинации могут содержать частицы, размер которых колеблется в широком диапазоне, однако, было обнаружено, что уменьшение размера частиц формы эплеренона в твердом состоянии до размера частиц D90, равного при- 21007934 близительно менее 400 мкм, может улучшить биологическую активность некомпозиционного эплеренона и фармацевтических композиций, содержащих такую форму эплеренона в твердом состоянии. Таким образом, размер частиц D90 некомпозиционного эплеренона или эплеренона, используемого в качестве исходного материала при приготовлении фармацевтической композиции, в основном, составляет приблизительно менее 400 мкм, предпочтительно менее 200 мкм, более предпочтительно менее 150 мкм,еще более предпочтительно менее 100 мкм и еще предпочтительнее менее 90 мкм. В одном аспекте, размер частиц D90 является приблизительно не менее 25 мкм. Частицы с размеромD90 в диапазоне приблизительно от 25 до 400 мкм, как было найдено, имеют приемлемую биологическую активность в отношении многих назначений, что позволяет избежать затрат и увеличения потребностей в контроле за выбросами в окружающую среду, связанными с измельчением до малых размеров. Приемлемая биологическая активность в указанном диапазоне величин является особенно важной там, где значительная доля фракции эплеренона присутствует как форма Н эплеренона, обусловленная, по крайней мере, частично более высокой скоростью растворения данной кристаллической формы. Подходящий диапазон размера частиц D90, согласно указанному аспекту, составляет приблизительно от 40 до 100 мкм. Другой подходящий диапазон составляет приблизительно от 30 до 50 мкм. Еще другой подходящий диапазон составляет приблизительно от 50 до 150 мкм. Также другой подходящий диапазон составляет приблизительно от 75 до 125 мкм. Любое измельчение, размалывание, микронизация или другие способы уменьшения размера частиц,известные в данной области, могут быть использованы для того, чтобы достичь любого желаемого диапазона размера частиц для эплеренона в твердом состоянии, как изложено выше. Например, измельчение посредством струи воздуха или дробления может быть эффективным для данной цели. В тех случаях, где желаемой является, по возможности, самая высокая биологическая активность,но с меньшими затратами, было обнаружено, что уменьшение размера частиц формы эплеренона в твердом состоянии до размера частиц D90, составляющего приблизительно менее 15 мкм, может в дальнейшем повысить биологическую активность некомпозиционного эплеренона и фармацевтических композиций, содержащих такую форму эплеренона в твердом состоянии, даже по сравнению с диапазонами размера частиц D90, определяемыми выше. Поэтому размер частиц D90 в одном аспекте составляет приблизительно от 0,01 мкм (10 нм) до 15 мкм. Предпочтительно в данном аспекте размер частиц D90 составляет приблизительно менее 10 мкм, более предпочтительно менее 1 мкм, еще более предпочтительно менее 800 нм, еще более предпочтительно менее 600 нм, и наиболее предпочтительно менее 400 нм. В зависимости от применения, подходящий размер частиц D90 находится в диапазоне приблизительно от 100 до 800 нм. Другой подходящий диапазон составляет приблизительно от 200 до 600 нм. Также другой подходящий диапазон составляет приблизительно от 400 до 800 нм. И еще другой подходящий диапазон составляет от 500 нм до 1 мкм. Формы эплеренона в твердом состоянии, имеющие размер частиц D90 приблизительно менее 15 мкм, могут быть получены в соответствии с применяемыми способами уменьшения размера частиц, известными в данной области. Такие способы включают в себя, но не ограничиваются ими, способы, описанные в следующих патентах и публикациях, каждый из которых включен в данный текст в виде ссылки. Патент США No. 4826689 ViolantoFischer. Патент США No. 5145684 Liversidge et al. Патент США No. 5298262 NaRajagopalan. Патент США No. 5302401 Liversidge et al. Патент США No. 5336507 NaRajagopalan. Патент США No. 5340564 IlligSarpotdar. Патент США No. 5346702 NaRajagopalan. Патент США No. 5352459 Hollister et al. Патент США No. 5354560 Lovrecich. Патент США No. 5384124 Courteille et al. Патент США No. 5429824 June. Патент США No. 5503723 Ruddy et al. Патент США No. 5510118 Bosch et al. Патент США No. 5518187 Bruno et al. Патент США No. 5518738 Eickhoff et al. Патент США No. 5534270 De Castro. Патент США No. 5536508 Canal et al. Патент США No. 5552160 Liversidge et al. Патент США No. 5560931 Eickhoff et al. Патент США No. 5560932 Bagchi et al. Патент США No. 5565188 Wong et al. Патент США No. 5569448 Wong et al. Патент США No. 5571536 Eickhoff et al.- 22007934 Патент США No. 5573783 DesienoStetsko. Патент США No. 5580579 Ruddy et al. Патент США No. 5585108 Ruddy et al. Патент США No. 5587143 Wong. Патент США No. 5591456 Franson et al. Патент США No. 5622938 Wong. Патент США No. 5662883 Bagchi et al. Патент США No. 5665331 Bagchi et al. Патент США No. 5718919 Ruddy et al. Патент США No. 5747001 Wiedmann et al. Международная патентная публикация No. WO 93/25190. Международная патентная публикация No. WO 96/24336. Международная патентная публикация No. WO 98/35666. В иллюстративном способе эплеренон в грубом твердом состоянии добавляют к жидкой среде, в которой он, в основном, не растворяется, с образованием премикс-суспензии. Концентрация эплеренона в жидкой среде может изменяться приблизительно от 0,1 до 60% и предпочтительно составляет приблизительно от 5 до 30 вес.%. Кажущаяся вязкость премикс-суспензии составляет приблизительно менее 1000 сП. Премикс прямо может быть обработан механическими средствами, например, с помощью шаровой мельницы, чтобы уменьшить размер частиц D90 эплеренона до желаемого диапазона. Альтернативно,премикс можно сначала подвергнуть перемешиванию, например, с помощью роликовой мельницы или мешалки типа Cowles до образования гомогенной дисперсии, в которой не имеется больших агломератов, видимых невооруженным глазом, и затем подвергнуть истиранию, например, с помощью мельницы с циркулирующей в замкнутом цикле средой. Частицы могут быть измельчены в присутствии поверхностно-модифицирующего агента, например, полимера или смачивающего агента. Альтернативно, частицы могут находиться в контакте с поверхностно-модифицирующим агентом после истирания. Поверхностно-модифицирующий агент может снижать агломерацию частиц, а также оказывать другие положительные воздействия. Частицы должны быть уменьшены в размере при температуре, которая не разрушает эплеренон в значительной степени. Температуры при обработке приблизительно менее 30-40 С являются обычно предпочтительными. Если желательно, оборудование для обработки может быть охлаждено обычными охлаждающими приспособлениями. Способ обычно выполняют при температуре окружающей среды и при давлениях, которые являются безопасными и эффективными для способа измельчения. Например,давления окружающей среды при обработке представляют собой давления в шаровых мельницах, жерновых мельницах и вибрационных мельницах. Регуляция температуры может быть достигнута путем снабжения рубашкой или погружения размалывающей камеры в ледяную воду. Давления при обработке предлагаются приблизительно от 0,07 до 3,5 кг/см 2, причем обычными давлениями являются приблизительно от 0,7 до 1,4 кг/см 2. После окончания измельчения раздробляющую среду отделяют от измельченного продукта, в сухом виде или в виде жидкой дисперсии, с помощью принятых способов разделения, таких как фильтрация, просеивание через сито или тому подобное. Фармацевтические композиции Данное изобретение также охватывает класс фармацевтических композиций, содержащих (i) форму Н эплеренона, необязательно вместе с одной или более дополнительных форм эплеренона в твердом состоянии, выбранных из группы, состоящей из формы L, сольватированных кристаллических форм и аморфного эплеренона и (ii) один или более фармацевтически приемлемых носителей и/или разбавителей и/или адъювантов (вместе названные в данном тексте как наполнители) и, необязательно, (iii) один или более активных ингредиентов, отличных от эплеренона. В предпочтительном аспекте все количество содержащегося в композиции эплеренона присутствует в виде фазово-чистой формы Н; однако, если присутствует комбинация форм в твердом состоянии, предпочтительные весовые соотношения форм в твердом состоянии являются такими, как утверждены в данном описании выше. Иначе, все количество эплеренона, содержащегося в композиции, может присутствовать в виде фазово-чистого сольватированного кристаллического эплеренона или в виде аморфного эплеренона. В другом аспекте изобретения композиция содержит как форму Н, так и форму L. Весовое соотношение формы L к форме Н в композиции составляет, в основном, приблизительно от 1:20 до 20:1. В другом аспекте, указанное весовое соотношение составляет приблизительно от 10:1 до 1:10; приблизительно от 5:1 до 1:5; приблизительно от 2:1 до 1:2; для примера, весовое соотношение может быть приблизительно 1:1. Композиции согласно изобретению могут быть приспособлены к соответствующему способу введения, включая, без ограничений, пероральный, трансбуккальный, подъязычный, парентеральный, например, внутрисосудистый, внутрибрюшинный, подкожный или внутримышечный, местный и ректаль- 23007934 ный (например, с помощью суппозитория) способы. Данные композиции содержат эплеренон в желаемом количестве в комбинации с одним или более фармацевтически приемлемых наполнителей, соответствующих желаемому способу введения. 1. Пероральные композиции и наполнители для них. Пероральные дозированные формы таких композиций предпочтительно содержат один или более наполнителей, выбранных из группы, состоящей из разбавителей, дезинтегрирующих агентов, связующих агентов и адгезивов, смачивающих агентов, смазок и противоклейких агентов. Более предпочтительно, такие пероральные дозированные формы подвергают таблетированию или покрывают оболочкой для соответствующего введения. Полученные таблетки или капсулы могут содержать композицию немедленного высвобождения и/или композицию контролируемого высвобождения, которая может быть получена, например, в виде дисперсии эплеренона в гидроксипропилметилцеллюлозе (НРМС). Благодаря соответствующему выбору и комбинации наполнителей, могут быть получены композиции, обладающие улучшенными характеристиками, касающимися, среди прочих характеристик, эффективности, биологической активности, времени освобождения, устойчивости, совместимости эплеренона с наполнителями, безопасности, профиля растворения, профиля дезинтеграции и/или других фармакокинетических, химических и/или физических характеристик. Наполнители предпочтительно являются водорастворимыми или диспергируемыми в воде и обладают свойствами смачивания, чтобы уравновесить низкую растворимость эплеренона в воде. В случаях, когда композицию получают в виде таблетки, комбинация выбранных наполнителей дает таблетки, которые обладают, среди прочих характеристик, улучшенными профилями растворимости и дезинтеграции, твердостью, сопротивлением раздавливанию и/или крошковатостью. 1.1. Разбавители. Композиции согласно изобретению необязательно содержат один или более фармацевтически приемлемых разбавителей в качестве наполнителей. Подходящие разбавители включают в себя - либо по отдельности, либо в комбинации - лактозу и моногидрат лактозы; крахмалы, включая прямопрессуемый крахмал и гидролизованные крахмалы (например, Celutab и Emdex); маннит; сорбит; ксилит; декстрозу (Cerelose 2000) и моногидрат декстрозы; дигидрат двухосновного фосфата кальция; разбавители на основе сахарозы; кондитерский сахар; моногидрат моноосновного сульфата кальция; дигидрат сульфата кальция; гранулярный тригидрат лактата кальция; декстраты; инозит; гидролизованное цельное зерно; амилозу; целлюлозы, включая микрокристаллическую целлюлозу, пищевые источники - и аморфной целлюлозы (например, Rexcel) и порошкованную целлюлозу; карбонат кальция; глицин; бентонит; поливинилпирролидон и тому подобное. Такие разбавители, если присутствуют, составляют в целом приблизительно от 5 до 99%, предпочтительно от 10 до 85% и более предпочтительно от 20 до 80% общего веса композиции. Выбранный разбавитель или разбавители предпочтительно обладают подходящими реологическими свойствами, и там, где таблетки являются желательными, и сжимаемостью. Лактоза и микрокристаллическая целлюлоза, либо по отдельности, либо в комбинации, являются предпочтительными разбавителями. Оба разбавителя являются химически совместимыми с эплереноном. Экстрагранулярная микрокристаллическая целлюлоза (т.е. микрокристаллическая целлюлоза, добавленная к влажной гранулированной композиции после стадии высушивания) может быть использована для увеличения твердости (для таблеток) и/или времени дезинтеграции. Лактоза, особенно моногидрат лактозы, является в особенности предпочтительной. Лактоза обычно дает композиции, обладающие подходящими скоростями высвобождения эплеренона, устойчивостью, пре-компрессионной подвижностью и/или высушиваемостью при относительно низкой стоимости разбавителя. Она придает высокую плотность субстрату, что способствует уплотнению во время гранулирования (когда применяют мокрое гранулирование) и поэтому улучшает реологические свойства смеси. 1.2. Дезинтегрирующие агенты. Композиции согласно изобретению необязательно содержат один или более фармацевтически приемлемых дезинтегрирующих агентов в качестве наполнителей, в частности, для композиций в виде таблеток. Подходящие дезинтегрирующие агенты включают в себя, либо по отдельности, либо в комбинации, крахмалы, включая натриевую соль крахмалгликолевой кислоты (например, Explotab от PenWest) и прежелатинизированные кукурузные крахмалы (например, National 1551, National 1550 и Colocorn 1500), глины (например, Veegum HV) , целлюлозы, такие как очищенная целлюлоза, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза и карбоксиметилцеллюлоза натрия, кроскармелозу натрия (например, Ac-Di-Sol от FMC), альгинаты, кросповидон и гумми, такие как агарагар, гуаргумми, гумми плодов рожкового дерева, карайа (karaya), пектин и трагант. Дезинтегрирующие агенты могут быть добавлены на подходящей стадии приготовления композиции, в частности, до гранулирования или на стадии смазывания до прессования. Такие дезинтегрирующие агенты, если присутствуют, составляют в целом приблизительно от 0,2 до 30%, предпочтительно от 0,2 до 10% и более предпочтительно от 0,2 до 5% общего веса композиции. Кроскармелоза натрия является предпочтительным дезинтегрирующим агентом для распадаемости таблетки или капсулы и, если присутствует, предпочтительно составляет приблизительно от 0,2 до 10%,более предпочтительно от 0,2 до 7% и еще предпочтительнее от 0,2 до 5% общего веса композиции. Кро- 24007934 скармелоза натрия придает исключительные свойства гранулированным композициям настоящего изобретения для внутригранулярной дезинтеграции. 1.3. Связующие агенты. Композиции согласно изобретению необязательно содержат один или более фармацевтически приемлемых связующих агентов или адгезивов в качестве наполнителей, в частности, для композиций в виде таблеток. Такие связующие агенты и адгезивы предпочтительно придают достаточное слипание порошку, подвергаемому таблетированию, для проведения нормальных операций по дальнейшей обработке,таких как отбор по размеру, смазывание, прессование и упаковывание, но вс ещ сохраняют таблетке способность распадаться и композиции - способность всасываться при приеме внутрь. Подходящие связующие агенты и адгезивы включают в себя, либо отдельно, либо в комбинации, аравийскую камедь; трагант; сахарозу; желатин; глюкозу; крахмалы, такие как, но не ограничивающиеся ими, прежелатинизированные крахмалы (например, National 1551 и National 1550); целлюлозы, такие как, но не ограничивающиеся ими, метилцеллюлоза и карбоксиметилцеллюлоза натрия (например, Tylose); альгиновую кислоту и соли альгиновой кислоты; смешанную кремневокислую соль магния и алюминия; полиэтиленгликоль (PEG); гуаргумми; кислоты полисахаридов; бентониты; поливинилпирролидон (повидон или PVP), например, повидон К-15, К-30 и К-29/32; полиметакрилаты; НРМС; гидроксипропилцеллюлозу (например, Klucel) и этилцеллюлозу (например, Ethocel). Такие связующие агенты и/или адгезивы, если присутствуют, составляют в целом приблизительно от 0,5 до 25%, предпочтительно от 0,75 до 15% и более предпочтительно от 1 до 10% общего веса композиции. НРМС является предпочтительным связующим, используемым для придания когезивных свойств порошковой смеси композиции эплеренона. НРМС, если присутствует, составляет в целом примерно от 0,5 до 10%, предпочтительно от 1 до 8%, и более предпочтительно от 2 до 4% от общего веса композиции. Низкомолекулярная НРМС, обладающая вязкостью приблизительно от 2 до 8 сП, может быть использована, хотя вязкости приблизительно от 2 до 6 сП являются предпочтительными, в особенности вязкости приблизительно от 2 до 4 сП. Вязкости НРМС определяют для 2%-ного раствора в воде при 20 С. Содержание метоксигрупп в НРМС обычно составляет приблизительно от 15 до 35%, в то время как содержание гидроксипропильных групп обычно составляет приблизительно вплоть до 15%, предпочтительно от 2 до 12%. 1.4. Смачивающие агенты. Эплеренон не растворяется в водном растворе. Соответственно, композиции согласно изобретению необязательно, но предпочтительно, содержат один или более фармацевтически приемлемых смачивающих агентов в качестве наполнителей. Такие смачивающие агенты предпочтительно выбирают для того,чтобы поддержать эплеренон в близком контакте с водой, т.е., как полагают, в состоянии, которое увеличивает относительную биологическую активность композиции. Неограничивающие примеры поверхностно-активных веществ, которые можно использовать в качестве смачивающих агентов в композициях настоящего изобретения, включают в себя четвертичные аммониевые соединения, например, хлорид бензалкония, хлорид бензетония и хлорид цетилпиридиния,диоктилсульфосукцинат натрия, полиоксиэтиленалкилфенильные эфиры, например, ноноксинол 9, ноноксинол 10 и октоксинол 9, полоксамеры (блок-сополимеры полиоксиэтилена и полиоксипропилена),полиэтиленгликолевые диглицериды и масла, например, моно- и диглицериды полиоксиэтилен(8)глицерилкаприловой/каприновой кислоты (например, Labrasol от Gattefosse), полиоксиэтилен(35) касторовое масло и полиоксиэтиленовое гидрогенизованное касторовое масло; полиоксиэтиленалкиловые эфиры, например, полиэтиленгликолевый(20) эфир цетостеарилового спирта, полиэтиленгликолевые эфиры жирных кислот, например, полиэтиленгликолевый (40) эфир стеариновой кислоты,полиэтиленгликолевые эфиры сорбитана, например, полисорбат 20 и полисорбат 80 (например, Tween 80 от ICI), пропиленгликолевые эфиры жирных кислот, например, пропиленгликолевый эфир лауриновой кислоты (например, Lauroglycol от Gattefosse), лаурилсульфат натрия, жирные кислоты и их соли,например, олеиновую кислоту, олеат натрия и олеат триэтаноламина, глицериновые эфиры жирных кислот, например, глицерилмоностеарат, эфиры сорбитана, например, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат и сорбитанмоностеарат, тилоксапол, и их смеси. Такие смачивающие агенты, если присутствуют, составляют в целом приблизительно от 0,25 до 15%, предпочтительно от 0,4 до 10% и более предпочтительно от 0,5 до 5% общего веса композиции. Предпочтительными являются смачивающие агенты, представляющие собой анионные поверхностно-активные вещества. Лаурилсульфат натрия, если присутствует, составляет приблизительно от 0,25 до 7%, более предпочтительно от 0,4 до 4% и еще предпочтительнее от 0,5 до 2% общего веса композиции. 1.5. Смазывающие агенты, способствующие скольжению агенты и противоклейкие агенты. Композиции согласно изобретению необязательно содержат один или более фармацевтически приемлемых смазывающих агентов и/или способствующих скольжению агентов в качестве наполнителей. Подходящие смазывающие агенты и/или способствующие скольжению агенты, либо по отдельности,либо в комбинации, включают в себя глицериновый эфир бегеновой кислоты (например, Compritol 888); стеариновую кислоту и ее соли, включая стеараты магния, кальция и натрия; гидрогенизованные- 25007934 растительные масла (например, Sterotex); коллоидную двуокись кремния; тальк; воски; борную кислоту; бензоат натрия; ацетат натрия; фумарат натрия; хлорид натрия; DL-лейцин; полиэтиленгликоли (например, Carbowax 4000 и Carbowax 6000); олеат натрия; лаурилсульфат натрия и лаурилсульфат магния. Такие смазывающие и/или способствующие скольжению агенты, если присутствуют, составляют в целом приблизительно от 0,1 до 10%, предпочтительно от 0,2 до 8% и более предпочтительно от 0,25 до 5% общего веса композиции. Стеарат магния является предпочтительным смазывающим агентом, например, для снижения трения между аппаратурой и гранулированной смесью во время прессования композиций в таблетки. Подходящие противоклейкие агенты включают в себя тальк, кукурузный крахмал, DL-лейцин, лаурилсульфат натрия и стеараты металлов. Тальк является предпочтительным противоклейким и/или способствующим скольжению агентом, например, для снижения прилипания композиции к поверхностям аппаратуры и также для снижения электризации в смеси. Тальк, если присутствует, составляет приблизительно от 0,1 до 10%, более предпочтительно от 0,25 до 5% и еще предпочтительнее от 0,5 до 2% общего веса композиции. 1.6. Другие наполнители. Другие наполнители, такие как красители, ароматизаторы и подсластители, известны в области фармацевтики и могут быть использованы в композициях настоящего изобретения. Таблетки могут быть покрыты оболочкой, например, энтеросолюбильной оболочкой, или не покрыты. Кроме того, композиции согласно изобретению могут содержать, например, буферные агенты. 1.7. Предпочтительные пероральные композиции. В одном аспекте, композиция настоящего изобретения содержит эплеренон в желаемом количестве и один или более целлюлозных наполнителей. Термин целлюлозный наполнитель охватывает наполнители, представляющие собой целлюлозу или ее производные, включая, не ограничиваясь этим, очищенную целлюлозу, микрокристаллическую целлюлозу и алкилцеллюлозы и их производные и соли (например, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, НРМС, карбоксиметилцеллюлозу,включая кроскармелозу натрия и т.д.). Предпочтительно по крайней мере один такой присутствующий целлюлозный наполнитель выбирают из группы, состоящей из (C1-6 алкил)целлюлоз и их производных и солей. Еще предпочтительнее, указанный целлюлозный наполнитель выбирают из группы, состоящей из гидрокси(С 2-4 алкил)-(C1-4 алкил)целлюлоз и их производных и солей. Кроме того, композиции данного изобретения предпочтительно содержат один или более наполнителей, выбранных из группы, состоящей из разбавителей, дезинтегрирующих агентов, связующих агентов, смачивающих агентов, смазывающих агентов и противоклейких агентов. Более предпочтительно,указанные композиции содержат один или более наполнителей, выбранных из группы, состоящей из лактозы, микрокристаллической целлюлозы, кроскармелозы натрия и НРМС, наиболее предпочтительно содержат еще один или более дополнительных наполнителей, выбранных из группы, состоящей из лаурилсульфата натрия, стеарата магния и талька. Отдельные наполнители, перечисленные выше в настоящем аспекте, необязательно могут быть в случае необходимости заменены другими подходящими наполнителями. Приемлемые наполнителизаместители являются химически совместимыми как с эплереноном, так и с другими наполнителями. Хотя другие разбавители, дезинтегрирующие агенты, связующие агенты и адгезивы, смачивающие агенты, смазывающие агенты и/или противоклейкие или способствующие скольжению агенты могут быть применены, композиции, содержащие эплеренон с размером частиц в нано-области, лактозу, микрокристаллическую целлюлозу, кроскармелозу натрия и НРМС и, необязательно, лаурилсульфат натрия, стеарат магния и/или тальк, обладают наилучшим сочетанием фармакокинетических, химических и/или физических характеристик, родственных характеристикам других композиций. В другом аспекте композиция настоящего изобретения содержит приблизительно от 1 до 95% эплеренона; приблизительно от 5 до 99% фармацевтически приемлемого разбавителя; приблизительно от 0,5 до 30% фармацевтически приемлемого дезинтегрирующего агента и приблизительно от 0,5 до 25% фармацевтически приемлемого связующего агента; все проценты указаны по весу. Такая композиция необязательно может дополнительно содержать приблизительно от 0,25% до 15% фармацевтически приемлемого смачивающего агента; приблизительно от 0,1 до 10% фармацевтически приемлемого смазывающего агента; приблизительно от 0,1 до 15% фармацевтически приемлемого противоклейкого агента. В еще другом аспекте композиция согласно изобретению находится в виде пероральной стандартной лекарственной формы, предпочтительно таблетки или капсулы, содержащей эплеренон и целлюлозный наполнитель, как это описано выше. Предпочтительно, когда композиция содержит один или более наполнителей, выбранных из группы, состоящей из моногидрата лактозы, микрокристаллической целлюлозы, кроскармелозы натрия, гидроксипропилметилцеллюлозы, лаурилсульфата натрия, стеарата магния и талька. 2. Парентеральные композиции.- 26007934 Формы эплеренона в твердом состоянии согласно изобретению могут быть введены парентерально,например, с помощью внутривенной, внутримышечной или подкожной инъекции суспензии эплеренона в твердом состоянии в жидком носителе, например физиологическом солевом растворе, растворе декстрозы и в воде. Суспензионные композиции могут содержать соответствующие наполнительные ингредиенты, выбранные из тех, которые описаны для пероральных композиций в данном тексте выше. 3. Чрескожные композиции. Другие композиции могут быть в виде местной или чрескожной мази или крема, содержащих диспергированный в них эплеренон в твердом состоянии в количестве, например, приблизительно от 0,075 до 30%, предпочтительно от 0,2 до 20% и более предпочтительно от 0,4 до 15 вес.%. Такая местная или чрескожная композиция может по желанию включать в себя соединение, которое усиливает всасывание или проникновение эплеренона через кожу. Примеры таких соединений, усиливающих проникновение через кожу, включают в себя диметилсульфоксид и родственные соединения. Новые формы эплеренона в твердом состоянии могут быть введены чрескожно с помощью накладки либо типа резервуара, либо типа пористой мембраны или твердого матрикса. В любом случае эплеренон доставляется непрерывно из резервуара или из микрокапсул через мембрану в эплеренонпроницаемый адгезив, который находится в контакте с кожей или слизистой субъекта. Если эплеренон всасывается через кожу, то контролируемая и предопределенная доза эплеренона может быть введена реципиенту. В случае микрокапсул инкапсулирующий агент может служить мембраной. Способы лечения и профилактики Настоящее изобретение также охватывает способ лечения и/или профилактики состояния или нарушения, опосредованного альдостероном, способ, заключающий в себе лечение субъекта, имеющего такое состояние или нарушение или чувствительного к нему, терапевтически эффективным количеством эплеренона в твердом состоянии или фармацевтической композицией, содержащей эплеренон в твердом состоянии, по крайней мере, определяемую фракцию эплеренона в твердом состоянии, представленную формой Н эплеренона, и равновесную смесь, содержащую одну или более форм L эплеренона, форм сольватированного кристаллического эплеренона и аморфного эплеренона. Такой способ применяют в лечении и/или профилактике состояния или нарушения у субъекта, которому предписано введение антагониста альдостерона, включая, но не ограничиваясь этим, лечение состояний гиперальдостеронизма,таких как гипертония, нарушение деятельности сердца, включая сердечную недостаточность, цирроз печени, избыток коллагена, фиброз, доброкачественную гипертрофию простаты и депрессию. Кроме лечения человека, указанные формы эплеренона в твердом состоянии и содержащие его фармацевтические композиции также применяют в ветеринарии для лечения домашних, экзотических и сельскохозяйственных животных, например лошадей, собак и кошек. Формы эплеренона в твердом состоянии и содержащие его композиции также можно применять (i) в комбинированной терапии частично или полностью вместо других антагонистов альдостероновых рецепторов и/или (ii) в комбинированной терапии с другими лекарственными средствами. Фраза "комбинированная терапия" охватывает введение каждого лекарственного средства в последовательном порядке в режиме, который окажет благотворное действие комбинации лекарств, а также со-введение лекарственных средств в основном одновременно, как, например, в одной капсуле или инъекции, содержащей определенное соотношение указанных активных агентов, или в виде многочисленных раздельных для каждого агента дозированных форм или инъекций. Неограничивающие примеры такой комбинированной терапии включают в себя лечение сердечно-сосудистых заболеваний с помощью комбинирования антагониста рецептора альдостерона и антагониста рецептора ангиотензина II, как описано в Международной патентной публикации No. WO 96/24373, лечение застойных нарушений сердечной деятельности с помощью комбинирования антагониста рецептора альдостерона и антагониста ангиотензина II, как описано в Международной патентной публикации No. WO 96/40257, и лечение нарушений сердечной деятельности с помощью комбинирования антагониста рецептора альдостерона, АСЕ (ангиотензинпревращающего фермента) ингибитора и диуретика, как описано в Международной патентной публикации No. WO 96/24372, причем все указанные публикации включены в данный текст в виде ссылки. ПРИМЕРЫ Следующие примеры содержат подробное описание способов получения различных форм эплеренона в твердом состоянии, приведенных в данном тексте. Данные подробные описания входят в объем изобретения без каких-либо ограничений этого объема. Все проценты даны по весу, если не указано особо. Исходный материал эплеренона, используемый в каждом из следующих примеров, был получен в соответствии со схемой 1, приведенной в цитируемой выше Международной патентной публикации No.WO 98/25948. Пример 1. Получение сольвата, содержащего метилэтилкетон, из исходного материала эплеренона высокой чистоты и получение формы L эплеренона из сольвата.A. Получение сольвата, содержащего метилэтилкетон. Эплеренон высокой чистоты (99% чистоты с 0,2% в целом диэпоксида и 11,12-эпоксида) в количестве 437 мг растворяют в 10 мл метилэтилкетона путем нагревания до кипения на плитке с магнитной мешалкой со скоростью вращения 900 об./мин. Полученный раствор оставляют охлаждаться до комнат- 27007934 ной температуры при непрерывном перемешивании с помощью магнитной мешалки. Раствор, имеющий комнатную температуру, переносят в баню с температурой 1 С при непрерывном перемешивании в течение 1 ч. Твердый, содержащий метилэтилкетон, сольват собирают из охлажденного раствора путем фильтрации в вакууме.B. Получение формы L эплеренона. Твердый содержащий метилэтилкетон сольват, полученный как описано выше, сушат в термошкафу при 100 С в течение 4 ч при окружающем атмосферном давлении. Как было определено с помощьюDSC и XRPD анализа, высушенный твердый продукт представляет собой чистую форму L. Пример 2. Получение дополнительных сольватов из исходного материала эплеренона высокой чистоты. Дополнительные сольватированные кристаллические формы получают, в основном, как в примере 1 путем замены метилэтилкетона каждым из следующих растворителей: н-пропанолом, 2-пентаноном,уксусной кислотой, ацетоном, бутилацетатом, хлороформом, этанолом, изобутанолом, изобутилацетатом, изопропанолом, метилацетатом, этилпропионатом, н-бутанолом, н-октанолом, пропилацетатом,пропиленгликолем, трет-бутанолом, тетрагидрофураном и толуолом. Пример 3. Получение сольвата, содержащего метилэтилкетон, путем выращивания кристаллов с помощью диффузии паров. Эплеренон (99,9% чистоты) в количестве 400 мг растворяют в 20 мл метилэтилкетона путем нагревания на плитке с образованием основного раствора. Порцию в 8 мл основного раствора разбавляют до 10 мл метилэтилкетоном, полученный раствор называют 80%-ным разбавленным образцом. Порцию 4 мл основного раствора разбавляют до 10 мл метилэтилкетоном (40%-ный разбавленный образец). Порцию 2 мл основного раствора разбавляют до 10 мл метилэтилкетоном (20%-ный разбавленный образец). Различные разбавленные образцы в 20-миллилитровых сцинтилляционных флаконах переносят в эксикатор, содержащий небольшое количество гексана как антирастворителя. Эксикатор герметично закрывают, и пары гексана диффундируют в метилэтилкетонные растворы. Кристаллы содержащего метилэтилкетон сольвата эплеренона растут в 80%-ном разбавленном образце в течение 24 ч. Пример 4. Получение сольватных кристаллических форм эплеренона с помощью роторного испарителя. Приблизительно 400 мг эплеренона (99,9% чистоты) взвешивают в 250-миллилитровую круглодонную колбу. Растворитель, выбранный из метилэтилкетона и перечисленных в примере 2 растворителей, в количестве 150 мл добавляют в колбу и, если необходимо, раствор слабо нагревают до тех пор,пока эплеренон не растворится. Полученный прозрачный раствор помещают в роторный испаритель Buchi с температурой в бане приблизительно 85 С, и растворитель удаляют в вакууме. Удаление растворителя заканчивают, когда приблизительно 10 мл растворителя остается в колбе. Полученные твердые частицы анализируют соответствующим способом (например, XRPD, DSC, TGA, микроскопией и т.д.) для определения кристаллической формы. Пример 5. Превращение суспензии. Приблизительно 150 мг формы L эплеренона и 150 мг формы Н эплеренона добавляют к 5 мл этилацетата. Полученную суспензию перемешивают с помощью магнитной мешалки со скоростью 300 об./мин в течение ночи. На следующий день образец полученного твердого продукта собирают путем фильтрации. Анализ образца с помощью XRPD указывает на то, что образец полностью состоит из формы L эплеренона. Пример 6. Получение (а) сольвата из исходного материала эплеренона низкой чистоты и (b) формы Н кристаллического эплеренона из полученного сольвата. Образцы, содержащие различные количества примесей диэпоксида или 11,12-эпоксида, указанных в данном описании, получают путем добавления желаемого количества примеси к 7-миллилитровому сцинтилляционному флакону вместе с количеством эплеренона, достаточным для достижения общей массы образца 100 мг. Содержание примеси в каждом образце дано в табл. 6 А и 6 В, где примесью является соответственно диэпоксид или 11,12-эпоксид. Маленький магнит для перемешивания добавляют к каждому сцинтилляционному флакону вместе с 1 мл метилэтилкетона. Флаконы свободно покрывают колпачками, и твердые частицы растворяются при кипячении на плитке с магнитной мешалкой. Полученные твердые частицы затем собирают путем фильтрации в вакууме и немедленно анализируют с помощью XRPD. Затем твердые частицы помещают в термошкаф при 100 С и сушат в течение 1 ч при окружающем атмосферном давлении. Высушенные твердые частицы анализируют с помощью XRPD на содержание формы Н путем мониторинга площади дифракционного пика формы Н при приблизительно 12,1 2. Все картины дифракции XRPD записывают, используя дифрактометр Inel Multipurpose diffractometer.- 28007934 Таблица 6 А Состав исходных материалов эплеренона в примере 6 Таблица 6 В Состав исходных материалов эплеренона в примере 6 А. Результаты для эплеренона с диэпоксидом. На фиг. 78 показаны картины XRPD для содержащего метилэтилкетон сольвата в виде влажного отжатого на фильтре осадка, полученного путем кристаллизации из метилэтилкетона с допированием (а) 0%, (b) 1%, (с) 3% и (d) 5% диэпоксида. Интенсивности пиков стандартизируют для легкости сравнения. Никаких пиков, характерных для формы Н или диэпоксида, в картинах дифракции не наблюдают. Картины являются характерными для сольвата эплеренона, содержащего метилэтилкетон. На фиг. 79 показаны картины дифракции XRPD для высушенных твердых частиц, полученных путем кристаллизации из метилэтилкетона, инициируемой допированием (а) 0%, (b) 1%, (с) 3% и (d) 5% диэпоксида. Интенсивности пиков стандартизируют для легкости сравнения. Форму Н не обнаруживают в высушенных образцах, полученных путем кристаллизации из метилэтилкетона, в которых уровень диэпоксида составляет 0% или 1%. Форму Н определяют в высушенных образцах, полученных путем кристаллизации из метилэтилкетона, в которых уровень диэпоксида составляет 3% или 5%. Площадь дифракционного пика формы Н при приблизительно 12,1 2 и рассчитанное содержание для каждого образца даны в табл. 6 С. Таблица 6 С Данные по кристаллизации из метилэтилкетона в примере 6 Приведенные в табл. 6 С результаты подтверждают, что присутствие диэпоксида оказывает влияние на образование формы Н эплеренона во время десольватации. Образование формы Н начинается, когда диэпоксид включается в кристаллосольваты, содержащие метилэтилкетон, и/или адсорбируется на них. Второй эксперимент с допированием 3%-ным диэпоксидом проводят с целью изучения влияния способа получения на количество формы Н, образованной во время десольватации. В указанном эксперименте содержащий метилэтилкетон сольват, полученный допированием кристаллизации, разделяют на две порции. Первую порцию оставляют необработанной, в то время как вторую порцию легко измельчают в ступке пестиком, чтобы создать больше дефектов кристалла. Обе порции высушивают при 100 С в течение 1 ч при окружающем атмосферном давлении. Высушенные твердые частицы анализируют с помощью XRPD. Картины XRPD даны на фиг. 80 для высушенных твердых частиц, полученных путем кристаллизации из метилэтилкетона допированием 3%-ным диэпоксидом (а) без размалывания и (b) с размалыванием сольвата до высушивания. Картины XRPD обнаруживают большее количество формы Н в измельченном образце относительно неизмельченного образца. Полученные результаты дают основа- 29007934 ние предполагать, что условия, при которых выделяют и обрабатывают содержащий метилэтилкетон сольват, могут влиять на форму кристаллов, что является результатом десольватации. В. Результаты, полученные для эплеренона с 11,12-эпоксидом На фиг. 81 показаны картины XRPD для содержащего метилэтилкетон сольвата в виде влажного отжатого на фильтре осадка, полученного путем кристаллизации из метилэтилкетона с допированием (а) 0%, (b) 1%, (с) 5% и (d) 10% 11,12-эпоксида. Интенсивности пиков стандартизируют для легкости сравнения. Никаких пиков, характерных для формы Н или 11,12-эпоксида, в картинах дифракции не наблюдают. Картины являются характерными для сольвата эплеренона, содержащего метилэтилкетон. На фиг. 82 показаны картины дифракции XRPD для высушенных твердых частиц, полученных путем кристаллизации из метилэтилкетона с допированием (а) 0%, (b) 1%, (с) 5% и (d) 10% 11,12-эпоксида. Интенсивности пиков стандартизируют для легкости сравнения. Форма Н не определяется в высушенных образцах, полученных в результате кристаллизации из метилэтилкетона, в которых уровень допирующего 11,12-эпоксида составляет 0, 1 или 5%. Форму Н определяют в высушенных образцах, полученных путем кристаллизации из метилэтилкетона, в которых уровень допирующего 11,12-эпоксида составляет 10%. Площадь дифракционного пика формы Н приблизительно при 12,1 2 и рассчитанное содержание для каждого образца даны в табл. 6D. Таблица 6D Данные кристаллизации из метилэтилкетона в примере 6 Приведенные в табл. 6D результаты подтверждают, что присутствие 11,12-эпоксида оказывает влияние на образование формы Н эплеренона во время десольватации. Количество примеси при кристаллизации из метилэтилкетона, требуемое для инициации образования формы Н эплеренона, оказывается выше для 11,12-эпоксида, чем для диэпоксида. Пример 7. Влияние кристаллизации и сушки на конечную кристаллическую форму. Следующие четыре эксперимента проводят с целью изучения влияния кристаллизации и сушки на конечную кристаллическую форму: (i) кристаллизация эплеренона из метилэтилкетона (23 + 3 статистическая модель эксперимента), (ii) кристаллизация остатка низкого качества из маточной жидкости, (iii) кристаллизация эплеренона высокой степени чистоты с затравкой формой Н, и (iv) кристаллизация эплеренона низкой степени чистоты с затравкой формой L. Параметры в указанных экспериментах включают в себя скорость охлаждения, степень чистоты исходного материала и конечную температуру кристаллизации. Установлено для данного примера, что эплеренон высокой степени чистоты определяется как ультрачистый (с помощью ВЭЖХ) измельченный эплеренон, а эплеренон низкой степени чистоты определяется как эплеренон 89% чистоты. Для того, чтобы получить эплеренон низкой степени чистоты, извлеченные маточные жидкости из способа получения эплеренона анализируют и смешивают с образованием материала, который содержит 61,1% эплеренона, 12,8% диэпоксида и 7,6% 11,12-эпоксида. Затем этот материал смешивают с достаточным количеством эплеренона высокой степени чистоты с получением 89%-ного эплеренона. А. Кристаллизация из метилэтилкетона. В экспериментах с кристаллизацией из метилэтилкетона все операции выполняют, используя 60 г эплеренона высокой чистоты. Высшая конечная температура составляет 45 С и низшая конечная температура составляет 5 С. Высшая скорость охлаждения составляет 3 С/мин и низшая скорость охлаждения составляет 0,1 С/мин. Средние точки составляют скорость охлаждения 1,5 С/мин, чистоту эплеренона 94,5% и конечную температуру 25 С. После того, как фоновое показание было снято с помощью FTIR, 250 мл метилэтилкетона помещают в 1-литровый реактор Mettler RC-1, MP10 и перемешивают со скоростью 100 об./мин. После нескольких сканирований эплеренон помещают в реактор с последующим добавлением дополнительных 470 мл метилэтилкетона. Скорость перемешивания увеличивают до 500 об./мин для того, чтобы суспендировать твердые частицы, и температуру в бане повышают до 80 С. Температуру в бане поддерживают на уровне 80 С для достижения растворения эплеренона. Черные или белые точки в основном были видны в полученном прозрачном растворе. Температуру в бане затем снижают путем охлаждения с желаемой скоростью до желаемой конечной температуры, которую поддерживают в течение 1 ч до того, как переносят в колбу, и фильтруют с получением влажного отжатого на фильтре осадка. Реактор, колбу и мокрый оса- 30
МПК / Метки
МПК: C07J 71/00, A61K 31/58
Метки: форма, скоростью, растворения, кристаллическая, эплеренона, повышенной, обладающая
Код ссылки
<a href="https://eas.patents.su/30-7934-kristallicheskaya-forma-eplerenona-obladayushhaya-povyshennojj-skorostyu-rastvoreniya.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическая форма эплеренона, обладающая повышенной скоростью растворения</a>
Предыдущий патент: 2,4,5-тризамещенные производные тиазолила и их противовоспалительная активность
Следующий патент: Солнечный интенсифицированный тепличный комплекс
Случайный патент: Гербициды, полученные из циклопентадиона