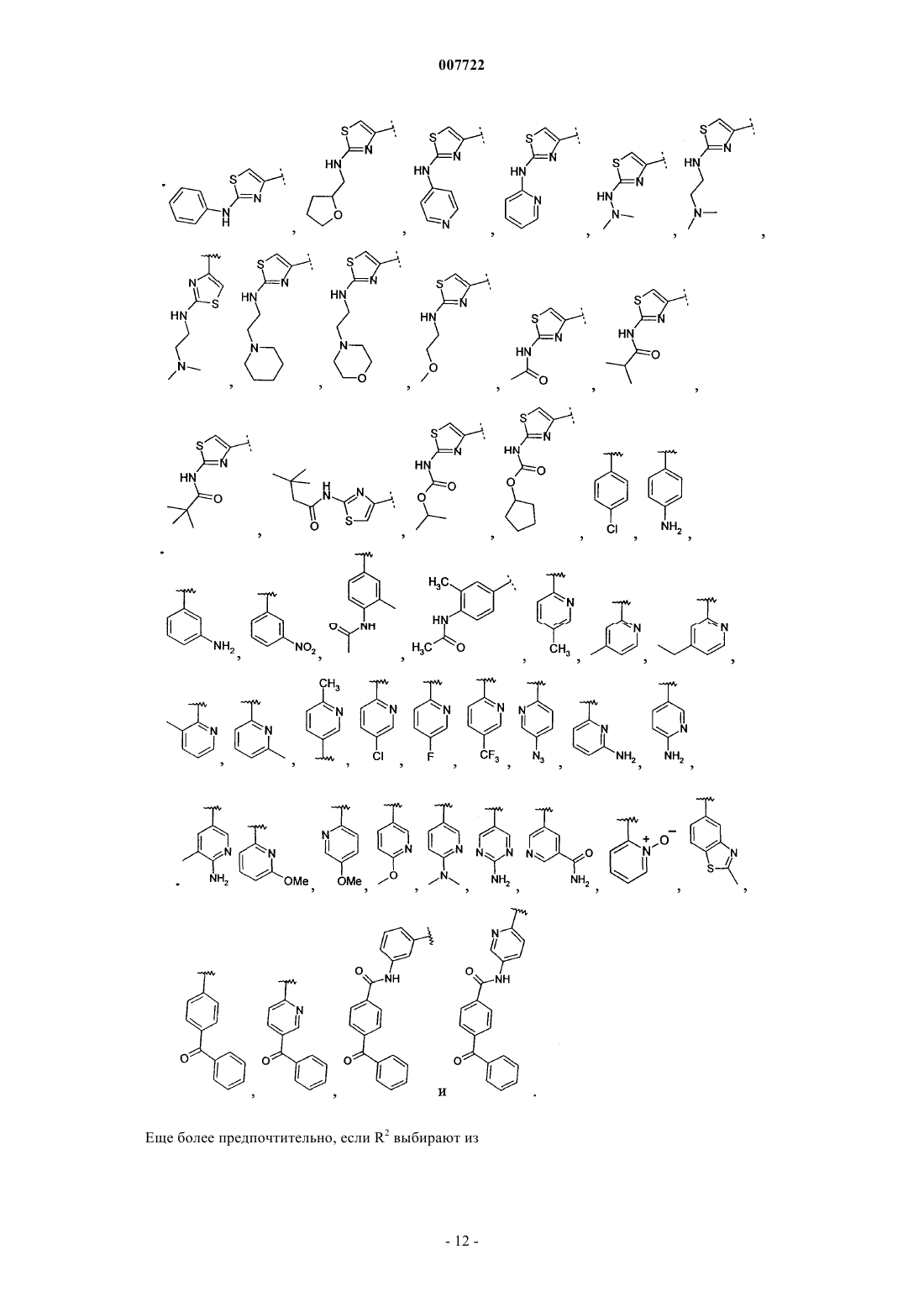Ингибиторы вирусной полимеразы
Номер патента: 7722
Опубликовано: 29.12.2006
Авторы: Ранкур Жан, Фазаль Гульрез, Жоликёр Эрик, Больё Пьер Луи, Пупар Марк-Андре, Куколь Жорж, Жийяр Джеймс
Формула / Реферат
1. Изомер, энантиомер, диастереомер или таутомер соединения, представленного формулой I
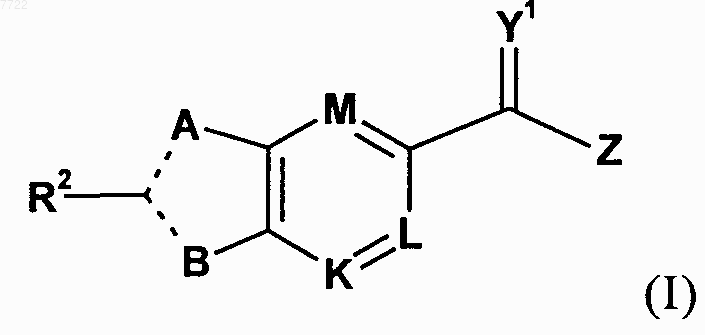
в которой А представляет собой О, S, NR1 или CR1, где R1 выбирают из группы, состоящей из Н, -СН2СООН, -С(СН3)НСООН и (C1-6)алкила, необязательно замещенного OR11, где R11 представляет собой Н или (С1-6)алкил;
----- означает либо простую, либо двойную связь;
R2 выбирают из Н, галогена, R21, OR21, SR21, COOR21, SO2N(R22)2, N(R22)2, CON(R22)2, NR22C(O)R22 или NR22C(O)NR22, в которых R21 и каждый R22 независимо представляют собой Н, (C1-6)алкил, галогеналкил, (С2-6)алкенил, (C3-7)циклоалкил, (С2-6)алкинил, (С5-7)циклоалкенил, 6- или 10-членный арил или Het, причем указанные R21 и R22 необязательно замещены радикалом R20, или оба R22 соединены вместе с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла с атомом азота, к которому они присоединены, где R10 и R20 каждый представляет собой
1-4 заместителя, выбранных из галогена, ОРО3Н, NO2, циано, азидо, C(=NH)NH2, C(=NH)NH(C1-6) алкила или C(=NH)NHCO(C1-6)алкила; или
1-4 заместителя, выбранных из:
а) (С1-6)алкила или галогеналкила, (C3-7)циклоалкила, C3-7спироциклоалкила, необязательно содержащего 1 или 2 гетероатома, (С2-6)алкенила, (C3-6)циклоалкенила, (С2-8)алкинила, (C1-6) алкил-(C3-7)циклоалкила, каждый из которых необязательно замещен радикалом R150;
б) OR104, где R104 представляет собой Н, (С1-6алкил), (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
в) OCOR105, где R105 представляет собой (C1-6)алкил, (C3-7)циклоалкил, (С1-6)алкил-(C3-7)циклоалкил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, в которых каждый R108 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил, или (C1-6алкил)Het, или гетероцикл необязательно замещены радикалом R150;
д) NR111R112, где R111 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, и R112 представляет собой Н, CN, (C1-6)алкил, (C3-7) циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С1-6алкил)арил, (С1-6алкил)Het, COOR115 или SO2R115, в которых R115 представляет собой (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С1-6алкил)арил или (C1-6алкил)Het, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (С1-6алкил)арил, или (C1-6алкил)Het, или гетероцикл необязательно замещены радикалом R150;
е) NR116COR117, где R116 и R117 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (С1-6алкил)Het, причем указанные (C1-6)алкил, (C3-7) циклоалкил, (С1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С1-6алкил)арил или (C1-6алкил)Het, или R118 ковалентно присоединен к радикалу R119 и к атому азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, указанные алкил, циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (С1-6алкил)Het или гетероцикл необязательно замещены радикалом R150;
з) NR121COCOR122, где R121 и R122 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, 6- или 10-членный арил, Het, (C1-6алкил)арил или (C1-6алкил)Неt, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
или R122 представляет собой OR123 или N(R124)2, в которых R123 и каждый R124 независимо представляют собой Н, (С1-6алкил), (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (С1-6алкил)Het, или R124 представляет собой ОН или O(C1-6алкил), или оба R124 ковалентно связаны друг с другом с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het и гетероцикл необязательно замещены радикалом R150;
и) COR127, где R127 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (С1-6 алкил)арил или (С1-6алкил)Het необязательно замещены радикалом R150;
к) COOR128, где R128 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7) циклоалкил, арил, Het, (C1-6алкил)арил или (С1-6алкил)Het, причем указанные (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил и (C1-6алкил)Het необязательэю замещены радикалом R150;
л) CONR129R130, где R129 и R130 независимо представляют собой Н, (С1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (С1-6алкил)Het, или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкил-циклоалкил, арил, Het, (C1-6алкил)арил, (C1-6алкил)Het и гетероцикл необязательно замещены радикалом R150;
м) арила, Het, (C1-6алкил)арила или (C1-6алкил)Het, каждый из которых необязательно замещен радикалом R150; и
где R150 определяют как
1-3 заместителя, выбранных из галогена, ОРО3Н, NO2, циано, азидо, C(=NH)NH2, С(=NН)NH(C1-6) алкилаили С(=NH)NHCO(С1-6)алкила; или
1-3 заместителя, выбранных из:
а) (С1-6)алкила или галогеналкила, (C3-7)циклоалкила, C3-7спироциклоалкила, необязательно содержащего 1 или 2 гетероатома, (C2-6)алкенила, (С2-8)алкинила, (C1-6)алкил-(C3-7)циклоалкила, каждый из которых необязательно замещен радикалом R160;
б) OR104, где R104 представляет собой Н, (С1-6алкил), (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R160;
в) OCOR105, где R105 представляет собой (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R160;
г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, в которых каждый R108 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (С1-6алкил)Het или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил, или (C1-6алкил)Het, или гетероцикл необязательно замещены радикалом R160;
д) NR111R112, где R111 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, и R112 представляет собой Н, CN, (C1-6)алкил, (C3-7) циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил, (C1-6алкил)Het, COOR115 или SO2R115, в которых R115 представляет собой (C1-6)алкил, (C3-7)циклоалкил, или (С1-6)алкил-(C3-7) циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил, или (C1-6 алкил)Het, или гетероцикл необязательно замещены радикалом R160;
е) NR116COR117, где R116 и R117 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные (C1-6)алкил, (C3-7) циклоалкил, (С1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R160;
ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (С1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или R118 ковалентно связан с R119 и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил, или (C1-6 алкил)Het, или гетероцикл необязательно замещены радикалом R160;
з) NR121COCOR122, где R121 и R122 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, 6- или 10-членный арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R160, или R122 означает OR123 или N(R124)2, в которых R123 и каждый R124 независимо представляет собой Н, (С1-6алкил), (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (С1-6алкил)Het, или R124 означает ОН или O(C1-6алкил), или оба R124 ковалентно связаны друг с другом с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het и гетероцикл необязательно замещены радикалом R160;
и) COR127, где R127 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R160;
к) тетразола, COOR128, где R128 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил и (C1-6алкил)Het необязательно замещены радикалом R160; и
л) CONR129R130, где R129 и R130 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкшы, арил, Het, (C1-6алкил)арил, (C1-6алкил)Het и гетероцикл необязательно замещены радикалом R160;
где R160 определяют как 1 или 2 заместителя, которые выбирают из тетразола, галогена, CN, C1-6алкила, галогеналкила, COOR161, SO3H, SR161, SO2R161, OR161, N(R162)2, SO2N(R162)2, NR162COR162 или CON(R162)2, где R161 и каждый R162 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(С3-7)циклоалкил; или оба R162 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла;
В означает NR3 или CR3, при условии, что один из А или В представляет собой либо CR1, либо CR3, где R3 выбирают из (C3-7)циклоалкила или (С5-7)циклоалкенила;
K означает N или CR4, где R4 представляет собой Н или галоген; или R4 представляет собой OR41, где R41 представляет собой Н или (С1-6)алкил;
L представляет собой N или CR5, где R5 имеет те же самые значения, как и R4, определенный выше;
М представляет собой N или CR7, где R7 имеет те же самые значения, как и R4, определенный выше;
Y1 означает О;
Z означает OR6, где R6 представляет собой Н или (C1-6)алкил;
или его соль.
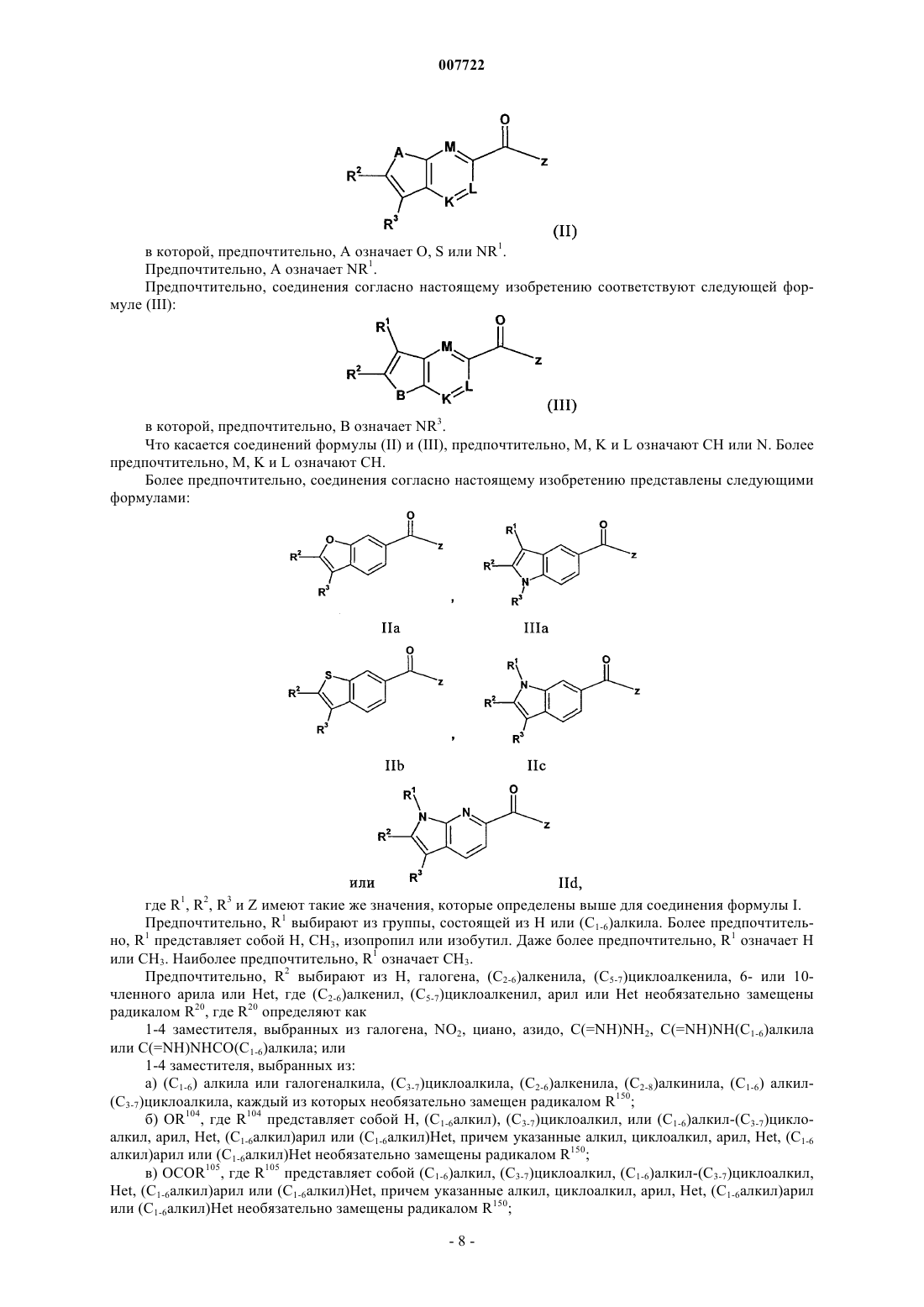
2. Соединение по п.1, представленное следующей формулой (II):

в которой предпочтительно А означает О, S или NR1.
3. Соединение по п.2, в котором А означает NR1.
4. Соединение по п.1, представленное следующей формулой (III):

в которой предпочтительно В означает NR3.
5. Соединение по п.1, в котором М, K и L означают СН или N.
6. Соединение по п.5, в котором М, K и L означают СН.
7. Соединение по п.1, представленное следующими формулами:
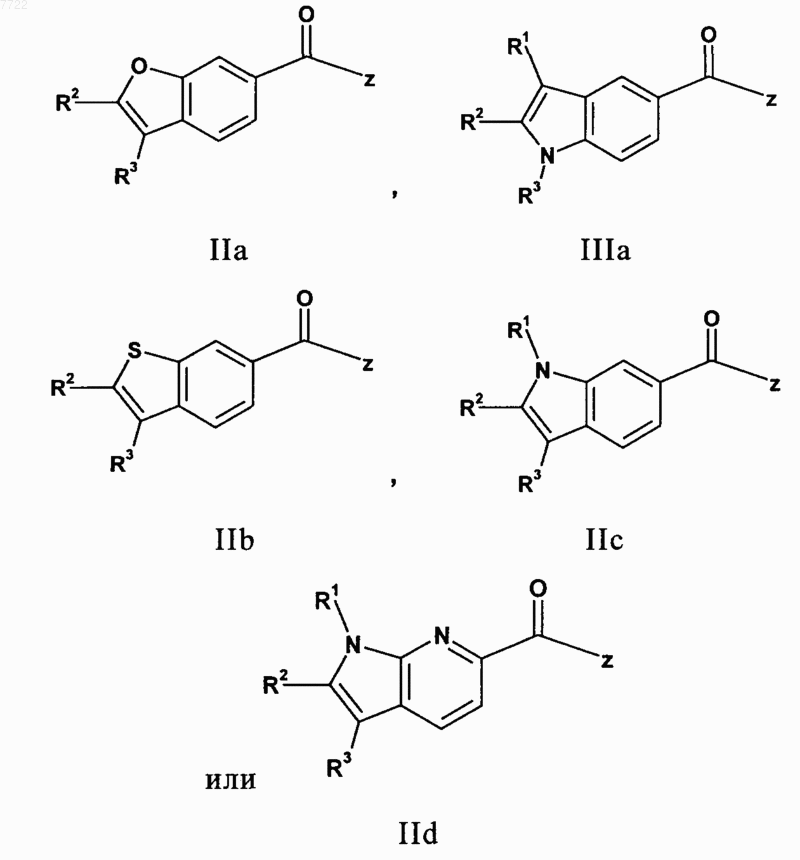
в которых R1, R2, R3 и Z являются такими, как определено в п.1.
8. Соединение по п.1, в котором R1 выбирают из группы, состоящей из Н или (C1-6)алкила.
9. Соединение по п.8, в котором R1 означает Н, СН3, изопропил или изобутил.
10. Соединение по п.9, в котором R1 означает Н или СН3.
11. Соединение по п.10, в котором R1 означает СН3.
12. Соединение по п.1, в котором R2 выбирают из Н, галогена, (C2-6)алкенила, (С5-7)циклоалкенила, 6- или 10-членного арила или Het, где (C2-6)алкенил, (С5-7)циклоалкенил, арил или Het необязательно замещены радикалом R20, где R20 определяют как
1-4 заместителя, выбранных из галогена, NO2, циано, азидо, C(=NH)NH2, C(=NH)NH(C1-6)алкила или C(=NH)NHCO(C1-6)алкила; или
1-4 заместителя, выбранных из:
а) (C1-6)алкила или галогеналкила, (C3-7)циклоалкила, (C2-6)алкенила, (С2-8)алкинила, (С1-6)алкил-(C3-7) циклоалкила, каждый из которых необязательно замещен радикалом R150;
б) OR104, где R104 представляет собой Н, (С1-6алкил), (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (С1-6 алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
в) OCOR105, где R105 представляет собой (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (С1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, в которых каждый R108 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил, или (C1-6алкил)Het, или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (С1-6алкил)арил, или (C1-6алкил)Het, или гетероцикл необязательно замещены радикалом R150;
д) NR111R112, где R111 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, и R112 представляет собой Н, CN, (C1-6)алкил, (C3-7) циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С1-6алкил)арил, (С1-6алкил)Het, COOR115 или SO2R115, где R115 представляет собой (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6алкил)арил, или (C1-6алкил)Het, или гетероцикл необязательно замещены радикалом R150;
е) NR116COR117, где R116 и R117 каждый представляет собой Н, (С1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные (C1-6)алкил,
(C3-7)циклоалкил, (С1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (С1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или R118 ковалентно связан с R119 и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; указанные алкил, циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С1-6алкил)арил, или (C1-6 алкил)Het, или гетероцикл необязательно замещены радикалом R150;
з) NR121COCOR122, где R121 и R122 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалъшы, 6- или 10-членный арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150, или R122 означает OR123 или N(R124)2, где R123 и каждый R124 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (С1-6алкил)Het, или R124 означает ОН или O(C1-6алкил), или оба R124 ковалентно связаны друг с другом с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het и гетероцикл необязательно замещены радикалом R150;
и) COR127, где R127 представляет собой Н, (С1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (С1-6алкил)арил или (C1-6алкил)Het необязательно замещены радикалом R150;
к) COOR128, где R128 представляет собой Н, (C1-6алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, причем указанные (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил и (C1-6алкил)Het необязательно замещены радикалом R150;
л) CONR129R130, где R129 и R130 независимо представляют собой Н, (С1-6)алкил, (C3-7)циклоалкил,
(C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6алкил)арил или (C1-6алкил)Het, или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6алкил)арил, (C1-6алкил)Het и гетероцикл необязательно замещены радикалом R150;
м) арила, Het, (C1-6алкил)арила или (C1-6алкил)Het, каждый из которых необязательно замещен радикалом R150, где R150 представляет собой предпочтительно
1-3 заместителя, выбранных из галогена, NO2, циано или азидо; или
1-3 заместителя, выбранных из:
а) (C1-6)алкила или галогеналкила, (C3-7)циклоалкила, (С2-6)алкенила, (С2-8)алкинила, (C1-6) алкил(C3-7)циклоалкила, каждый из которых необязательно замещен радикалом R160;
б) OR104, где R104 представляет собой Н, (C1-6алкил) или (C3-7)циклоалкил, причем указанные алкил или циклоалкил необязательно замещены радикалом R160;
г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, где каждый R108 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het и гетероцикл необязательно замещены радикалом R160;
д) NR111R112, где R111 представляет собой Н, (C1-6)алкил или (C3-7)циклоалкил, и R112 представляет собой Н, (C1-6)алкил или (C3-7)циклоалкил, COOR115 или SO2R115, где R115 представляет собой (C1-6)алкил или (C3-7)циклоалкил, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160;
е) NR116COR117, где R116 и R117 каждый представляет собой Н, (C1-6)алкил или (C3-7)циклоалкил, причем указанные (C1-6)алкил и (C3-7)циклоалкил необязательно замещены радикалом R160;
ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (С1-6)алкил или (C3-7)циклоалкил, или R118 ковалентно связан с радикалом R119 и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160;
з) NR121COCOR122, где R121 представляет собой Н, (C1-6)алкил или (C3-7)циклоалкил, причем указанные алкил и циклоалкил необязательно замещены радикалом R160, или R122 означает OR123 или N(R124)2, где R123 и каждый R124 независимо представляют собой Н, (C1-6алкил) или (C3-7)циклоалкил, или оба R124 ковалентно связаны друг с другом с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160;
и) COR127, где R127 представляет собой Н, (С1-6)алкил или (C3-7)циклоалкил, причем указанные алкил и циклоалкил необязательно замещены радикалом R160;
к) COOR128, где R128 представляет собой Н, (C1-6)алкил или (C3-7)циклоалкил, причем указанные
(C1-6)алкил и (C3-7)циклоалкил необязательно замещены радикалом R160; и
л) CONR129R130, где R129 и R130 независимо представляют собой Н, (C1-6)алкил или (C3-7)циклоалкил, или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160;
где R160 определяют как 1 или 2 заместителя, выбранные из галогена, CN, C1-6алкила, галогеналкила, COOR161, OR161, N(R162)2, SO2N(R162)2, NR162COR162 или CON(R162)2, где R161 и каждый R162 независимо представляют собой Н, (С1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил; или оба R162 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла.
13. Соединение по п.12, в котором R2 выбирают из арила или Het, каждый из которых необязательно монозамещен или дизамещен заместителями, выбранными из группы, состоящей шч галогена, галогеналкила, N3, или
a) (C1-6)алкила, необязательно замещенного группой ОН, O(C1-6)алкил или SO2(C1-6алкил);
б) (C1-6)алкокси;
д) NR111R112, где оба R111 и R112 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил, или R112 представляет собой 6- или 10-членный арил, Het, (C1-6)алкил-арил или (C1-6)алкил-Het; или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом азотсодержащего гетероцикла, причем каждый из указанных алкила, циклоалкила, арила, Het, алкиларила или алкил-Het необязательно замещены галогеном или
OR161 или N(R162)2, где R161 и каждый R162 независимо представляет собой Н, (C1-6)алкил, или оба R162 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом азотсодержащего гетероцикла;
е) NHCOR117, где R117 представляет собой (C1-6)алкил,O(C1-6)алкил или O(C3-7)циклоалкил;
и) СО-арила и
л) CONH2, СОNH(C1-6)алкила, СОN(C1-6алкил)2, CONH-арила или CONHC1-6алкиларила.
14. Соединение по п.13, где R2 представляет собой арил или Het, каждый из которых необязательно монозамещен или дизамещен заместителями, выбранными из группы, состоящей из галогена, галогеналкила, или
а) (C1-6)алкила, необязательно замещенного группой ОН, O(C1-6)алкил или SO2(C1-6алкил);
б) (C1-6)алкокси; и
д) NR111R112, где оба R111 и R112 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил, или R112 представляет собой 6- или 10-членный арил, Het, (C1-6)алкиларил или (C1-6)алкил-Het или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом азотсодержащего гетероцикла, причем каждый из указанных алкила, циклоалкила, арила, Het, алкиларила, или алкил-Het необязательно замещен галогеном, или OR161 или N(R162)2, где R161 и каждый R162 независимо представляют собой Н, (C1-6)алкил, или оба R162 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом азотсодержащего гетероцикла.
15. Соединение по п.14, где R2 означает фенил или гетероцикл, выбранный из
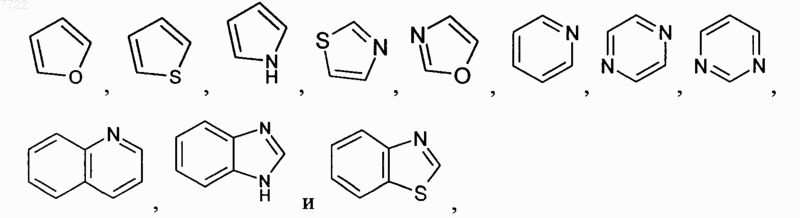
каждый из которых необязательно замещен, как определено в п.14 формулы изобретения.
16. Соединение по п.15, в котором R2 выбирают из Н, Br, СН=СН2,
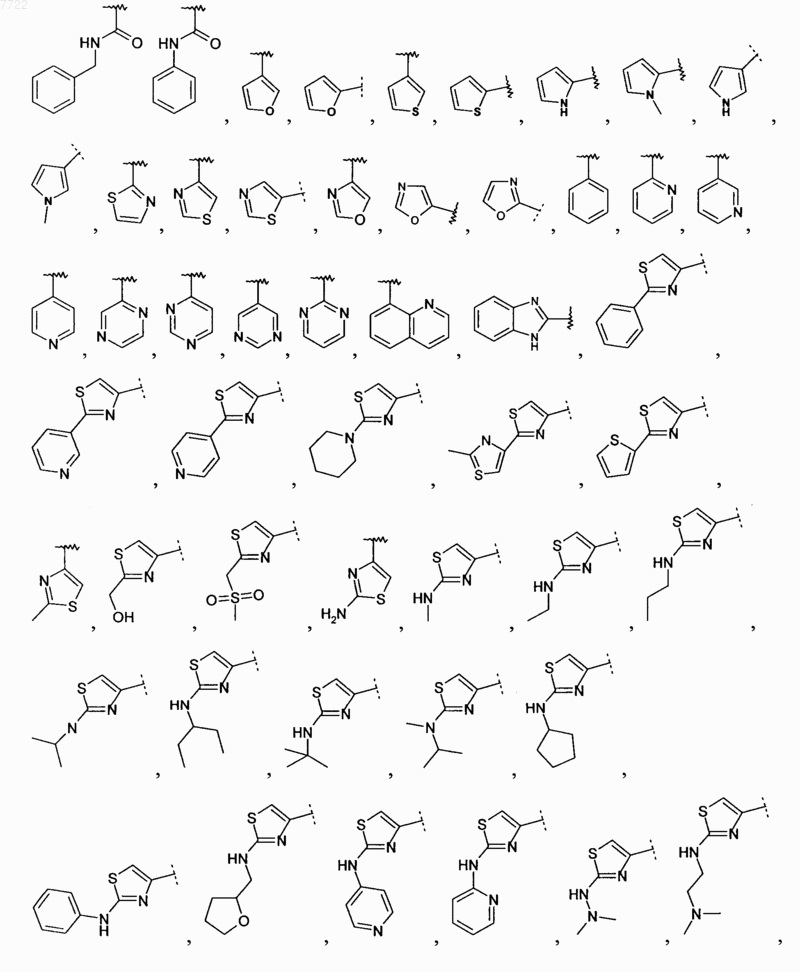
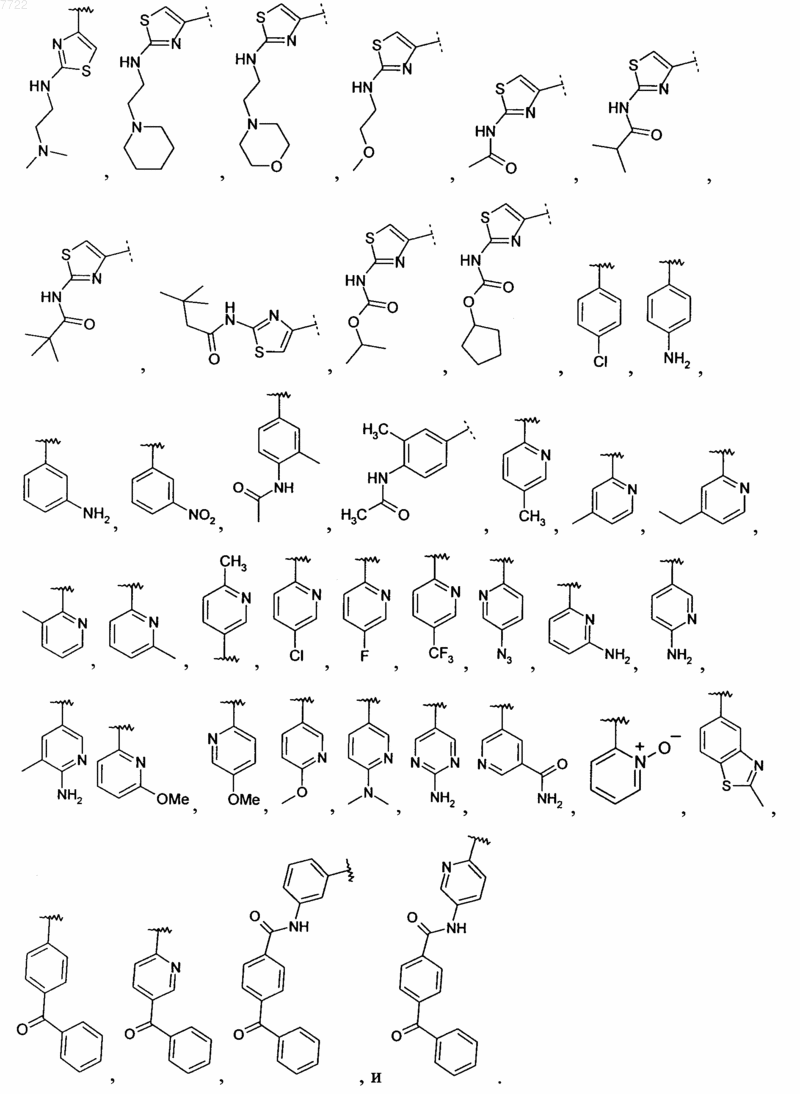
17. Соединение по п.16, в котором R2 выбирают из
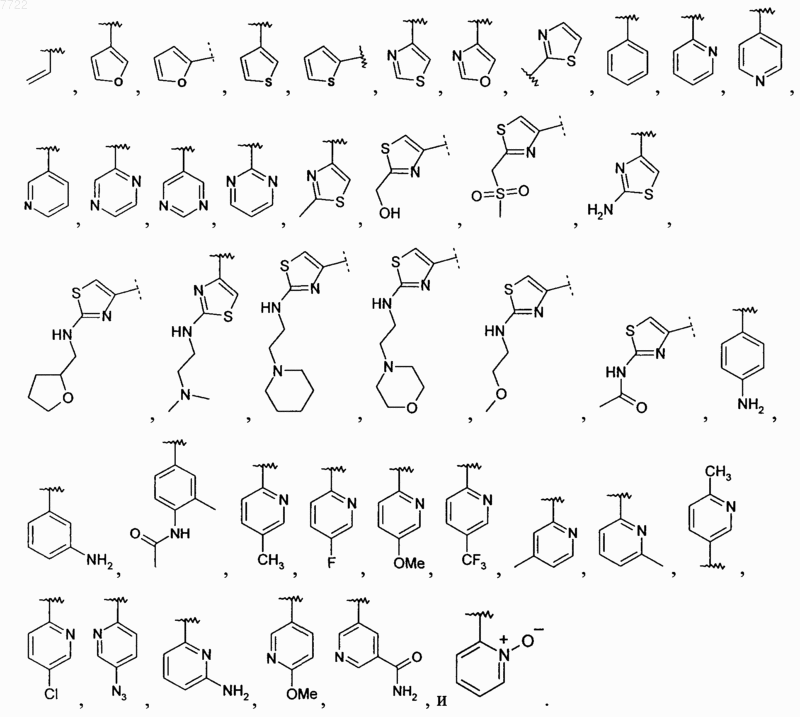
18. Соединение по п.17, в котором R2 выбирают из

19. Соединение по п.1, в котором R3 означает (C3-7)циклоалкил.
20. Соединение по п.19, в котором R3 означает циклопентил или циклогексил.
21. Соединение по п.1, в котором Z означает ОН.
22. Соединение, выбранное из соединений формулы
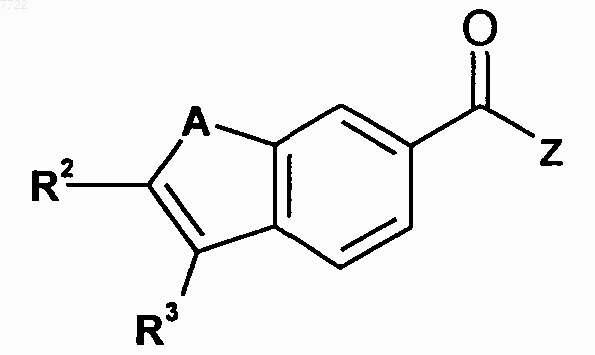
в которой A, R2, R3 и Z являются такими, как определено ниже
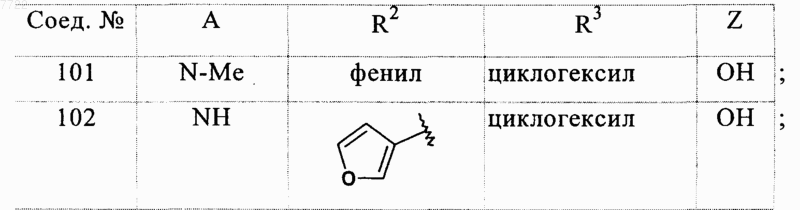
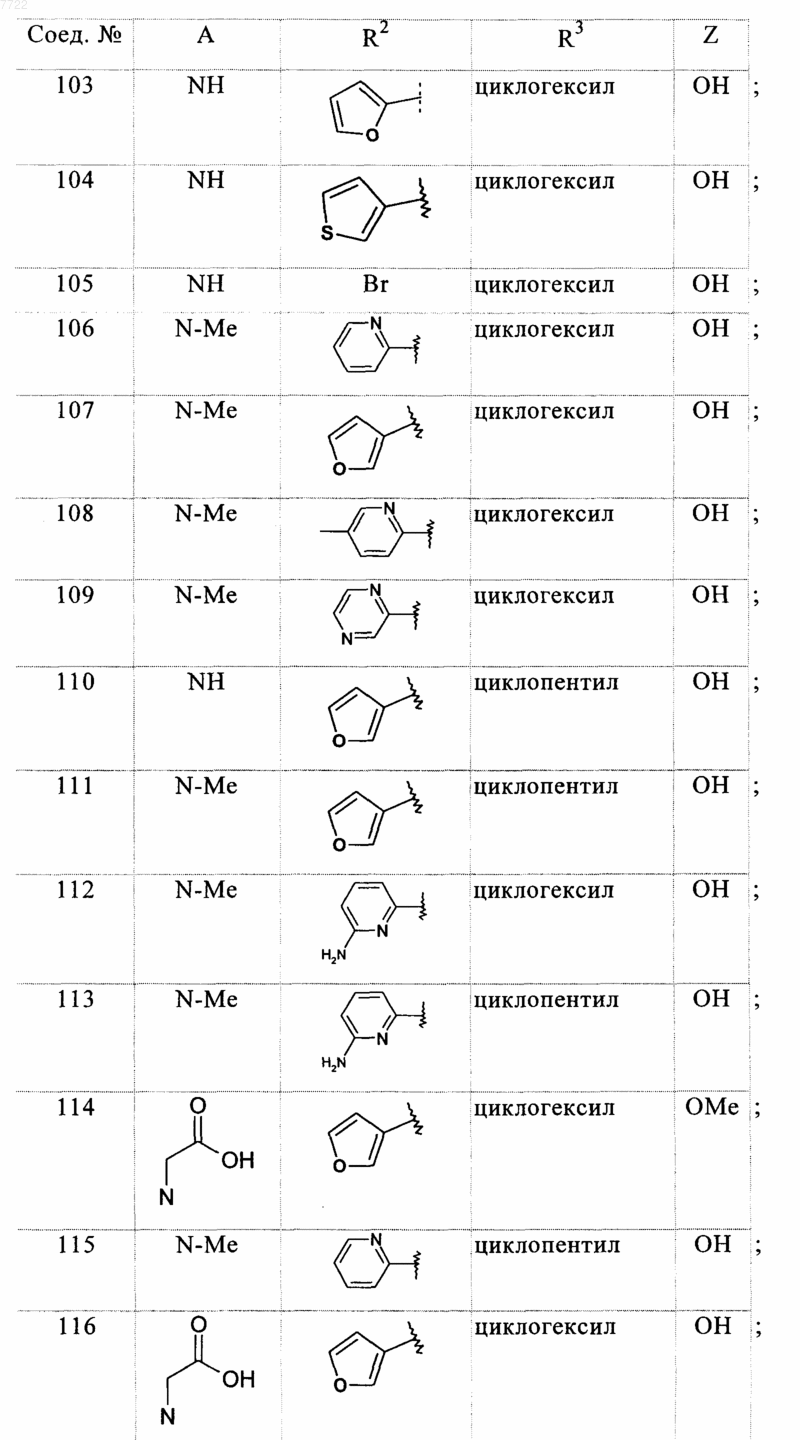
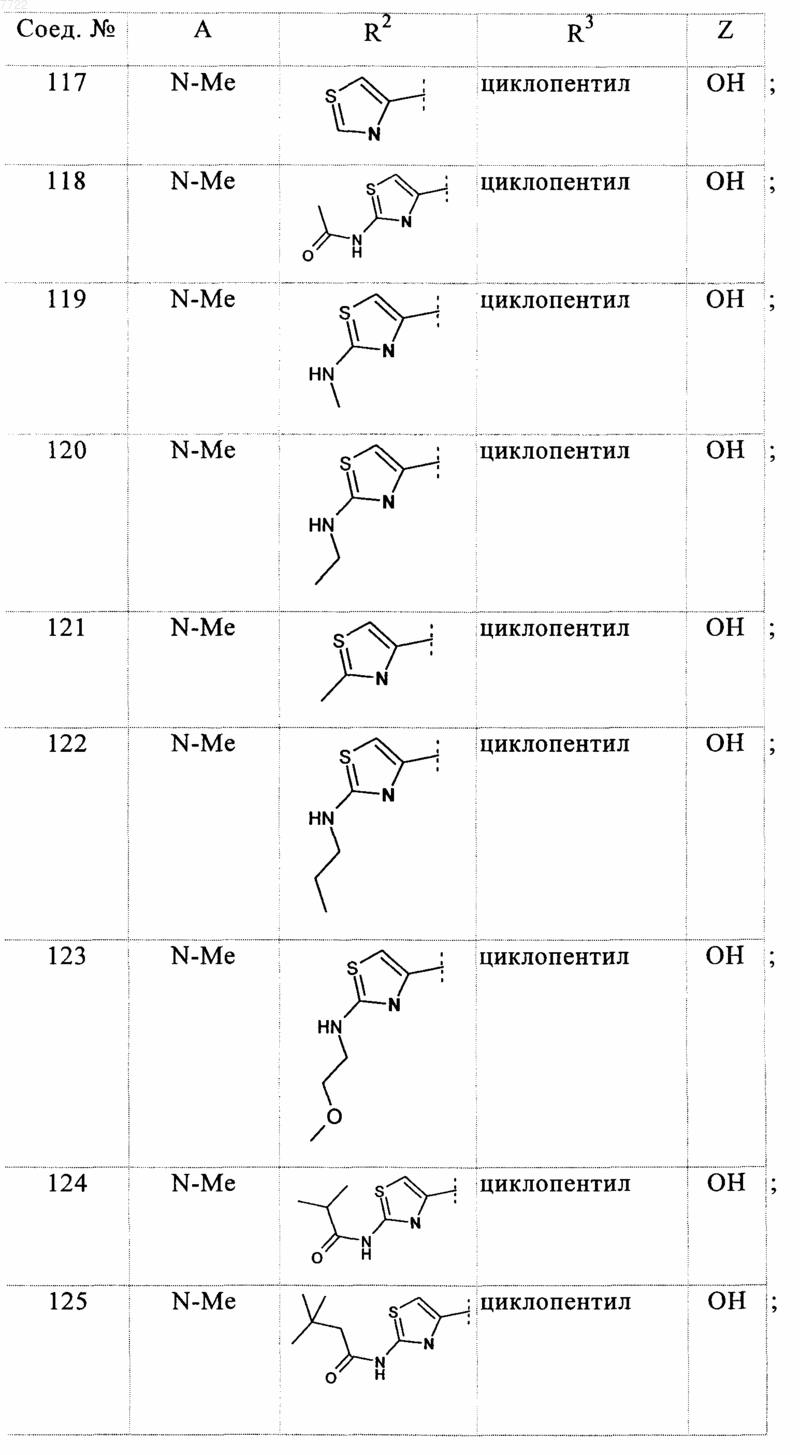
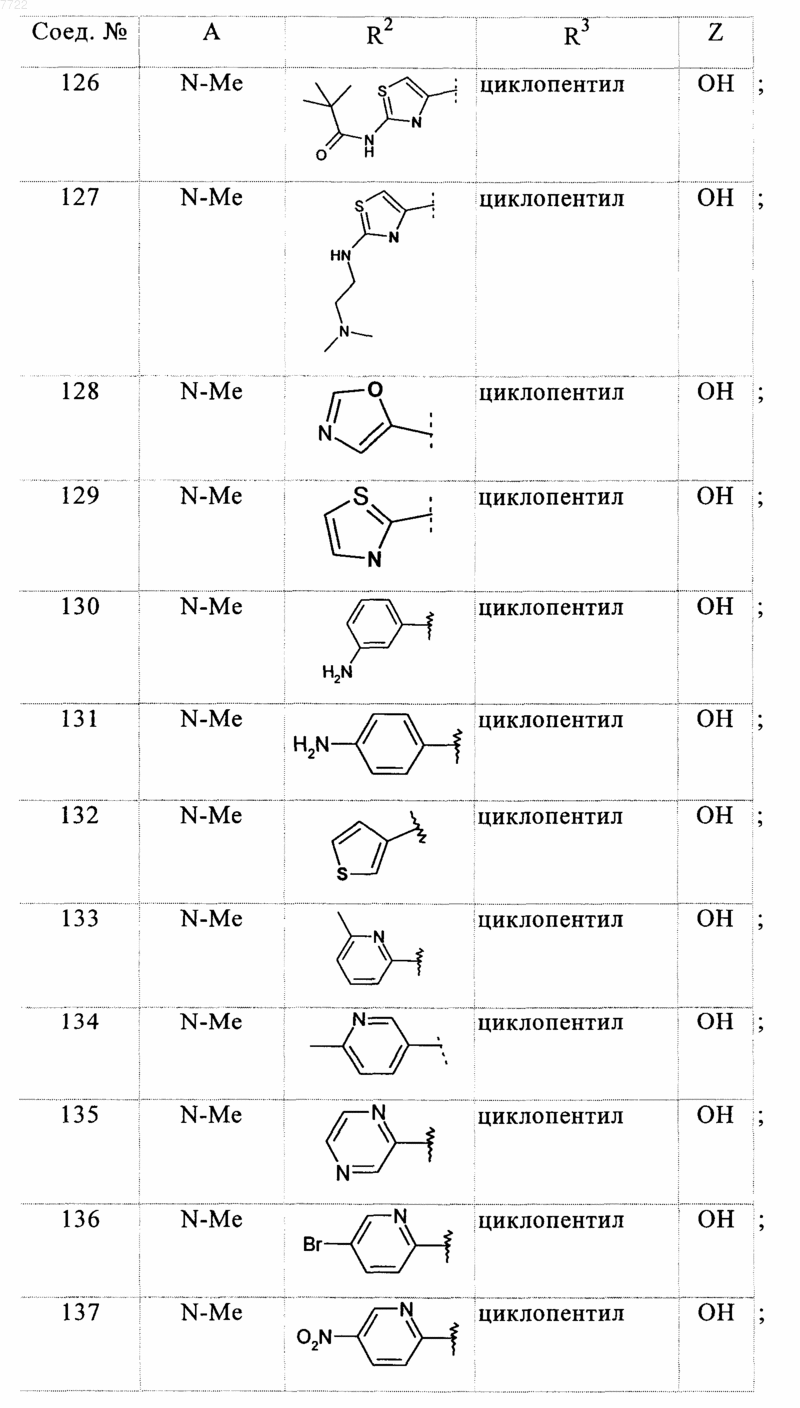
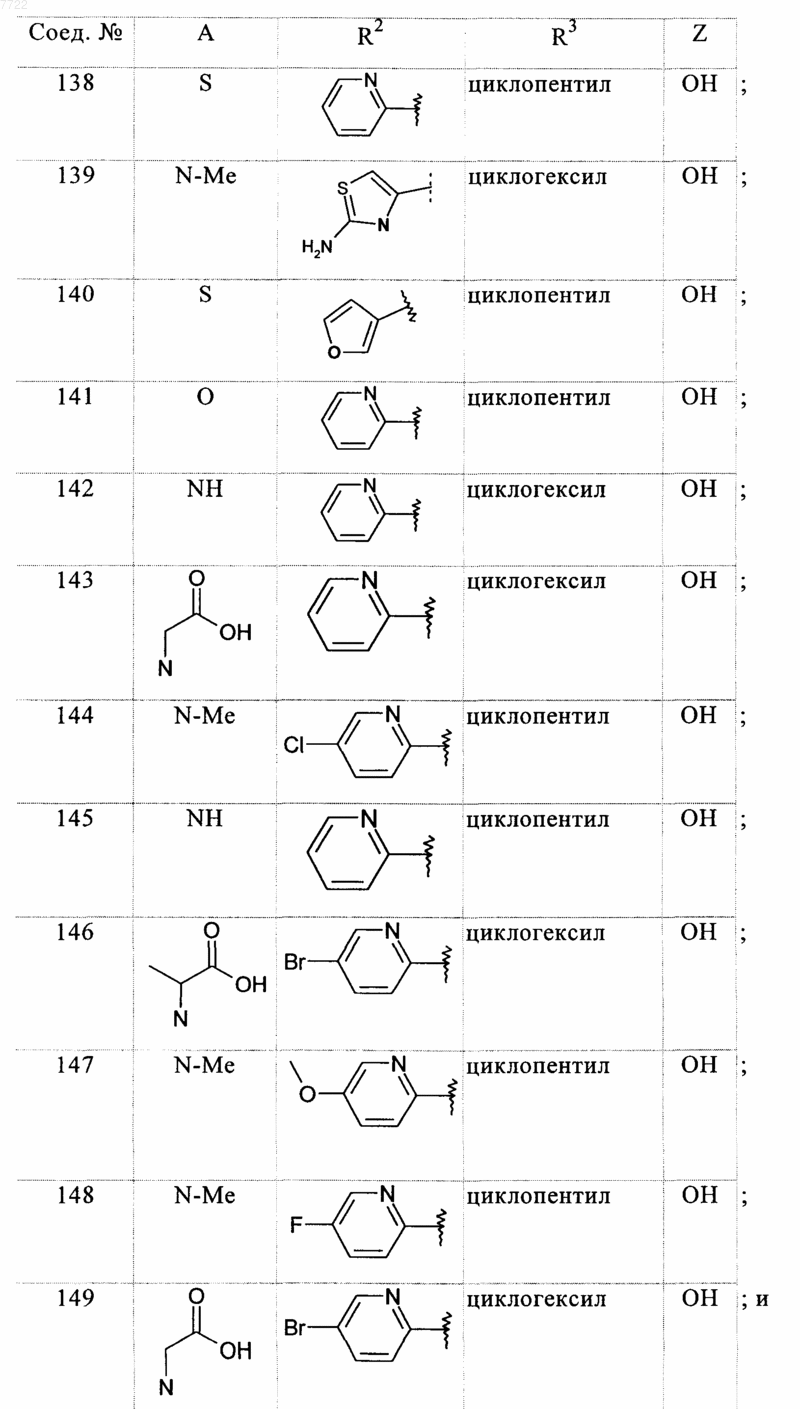
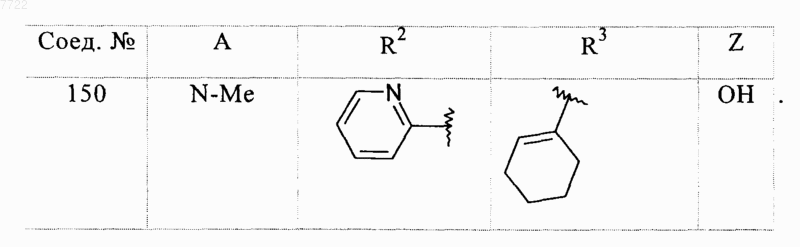
23. Соединение, выбранное из соединений формулы
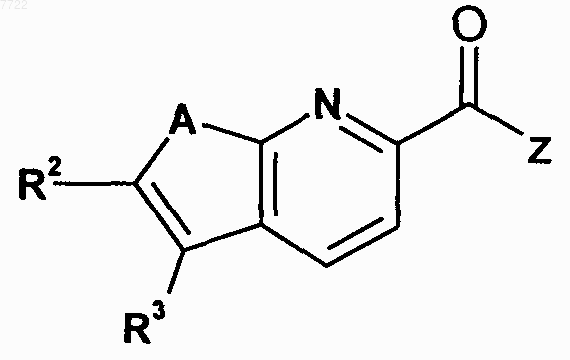
в котором A, R2, R3 и Z являются такими, как определено ниже
24. Соединение, представленное формулой Iа
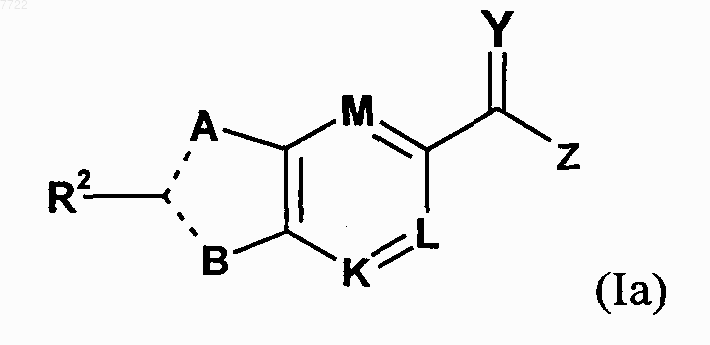
в которой А означает О, S, NR1 или CR1;
В означает NR3 или CR3;
R1 выбирают из группы, состоящей из радикалов Н или (C1-6)алкил;
R2 выбирают из группы, состоящей из Н, галогена, (C1-6)алкила, (C3-7)циклоалкила, фенила, 5- или 6-членного гетероцикла, содержащего от 1 до 4 гетероатомов, выбранных из О, N и S, пиридин-N-оксида и 9- или 10-членного гетеробицикла, содержащего 1-4 гетероатома, выбранных из О, N и S, указанные фенил, гетероцикл и гетеробицикл необязательно замещены 1-4 заместителями, выбранными из группы, состоящей из следующих заместителей: галоген, С(галоген)3, (C1-6)алкил, ОН, O(C1-6алкил), NH2, и N(C1-6 алкил)2;
R3 означает (C3-7)циклоалкил;
М означает N, CR4 или COR5, где R4 выбирают из группы, состоящей из Н и галогена; и
R5 выбирают из группы, состоящей из Н и (C1-6)алкила;
K и L означают N или СН;
---- означает либо простую, либо двойную связь;
Y означает О;
Z представляет собой OR6, где R6 выбирают из группы, состоящей из Н и (C1-6)алкила;
или соль этого соединения.
25. Применение соединения формулы I согласно п.1 или его фармацевтически приемлемой соли в качестве ингибитора репликации вируса гепатита С (HCV).
26. Фармацевтическая композиция для лечения или предупреждения инфекционного заболевания, вызываемого вирусом гепатита С, включающая эффективное количество соединения формулы I согласно п.1 или фармацевтически приемлемой соли этого соединения, и фармацевтически приемлемый носитель.
27. Фармацевтическая композиция по п.26, дополнительно включающая иммуномодулирующий агент.
28. Фармацевтическая композиция по п.27, в которой указанный иммуномодулирующий агент выбирают из a-, b-, d-, g- и w-интерферонов.
29. Фармацевтическая композиция по п.26, дополнительно включающая рибавирин или амантадин.
30. Фармацевтическая композиция по п.26, дополнительно включающая еще один ингибитор полимеразы вируса гепатита С (HCV-полимеразы).
31. Фармацевтическая композиция по п.30, дополнительно включающая ингибитор другой мишени вируса гепатита С, выбранной из хеликазы, полимеразы, металлопротеазы и IRES (от англ. internal ribosome entry site - внутренний сайт входа рибосомы).
32. Промежуточное соединение формулы (1а) или (1b)
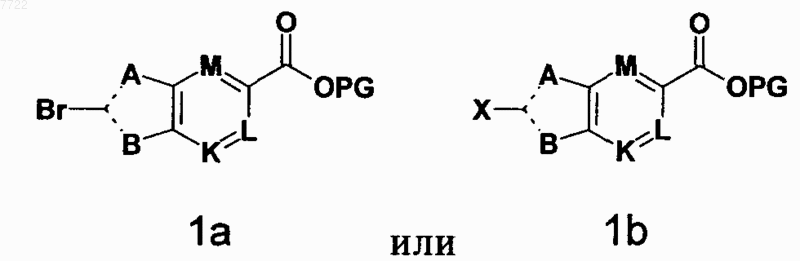
в которой А, В, K, L и М являются такими, как определено в п.1,
PG означает Н или защитную группу для карбоксигруппы и
X означает металл.
33. Способ получения соединений формулы (iii)
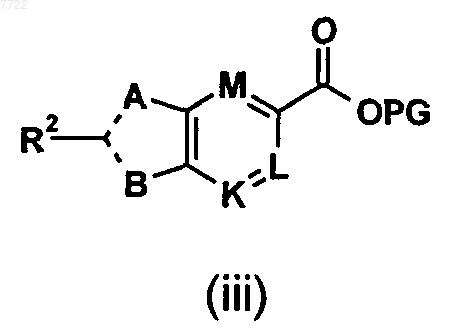
в которой A, R2, В, K, L, M, PG и X являются такими, как определено в п.32 формулы изобретения, включает:
а) взаимодействих т присутствии металлического катализатора, основания и добавки в подходящем растворителе промежуточного соединения (1а) согласно п.32 с соединением R2-X.
34. Способ получения соединений формулы (iii)
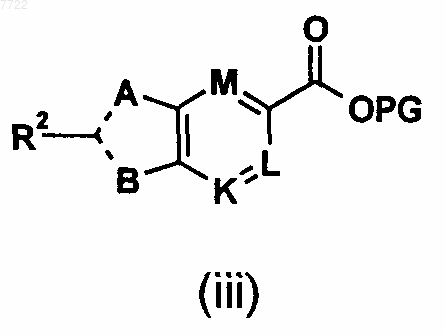
в котором A, R2, В, K, L, М и PG являются такими, как определено в п.32,
включает:
а) взаимодействие в присутствии катализатора на основе металла, основания и добавки в подходящем растворителе промежуточного соединения (1b) по п.32 с соединением R2-X', где значение X' определено в п.32.
35. Способ по п.33 или 34, согласно которому указанный катализатор на основе металла выбирают из Pd, Ni, Ru и Cu.
36. Способ по п.33 или 34, согласно которому указанную добавку выбирают из фосфинового лиганда, соли меди, соли лития, соли аммония и CsF.
37. Способ по п.33 или 34, согласно которому указанный катализатор на основе металла выбирают из Li, Sn(C1-6алкил)3, Sn(арил)3, В(ОН)2, В(ОC1-6алкил)2 и галогенида металла.
38. Применение соединения формулы I по п.1 для изготовления лекарственного средства для лечения инфекционного заболевания, вызываемого вирусом гепатита С (HCV).
Текст
007722 Область техники, к которой относится изобретение Настоящее изобретение относится к ингибиторам РНК-зависимых РНК-полимераз, в частности к ингибиторам вирусных полимераз, входящим в семейство Flaviviridae, более конкретно, к ингибиторам полимеразы вируса гепатита С. Предшествующий уровень техники По подсчетам ежегодно в США происходит приблизительно 30000 случаев инфицирования вирусом гепатита С (HCV - от англ. hepatitis С virus) (Kolykhalov, A.A.; Mihalik, K.; Feinstone, S.M.; Rice,С.М.; 2000; J. Virol., v. 74, pp. 2046-2051). HCV трудно распознается системой иммунологической защиты организма-хозяина; и до 85% людей, инфицированных вирусом гепатита С, становятся хроническиHCV-инфицированными. Многие из таких стойких хронических инфекционных заболеваний приводят к хроническому заболеванию печени, включая цирроз и гепатоцеллюлярную карциному (Hoofnagle, J.H.; 1997; Hepatology, v. 26: 15S-20S). По подсчетам во всем мире имеется 170 млн носителей вируса гепатита С и последних стадий заболевания печени, связанных с воздействием вируса гепатита С, в настоящее время являются основной причиной трансплантации печени. Только в США гепатит С ответственнен за от 8000 до 10000 смертей ежегодно. Без эффективного вмешательства в последующие 10-20 лет это число, как полагают, утроится. Не существует вакцины для предотвращения HCV-инфицирования. Продолжительное лечение хронических инфицированных больных интерфероном или интерфероном и рибавирином в настоящее время является единственной апробированной терапией, но при ее использовании продолжительный эффект достигается менее, чем в 50% случаев (Lindsay, K.L.; 1997; Hepatology, v. 26: 71S-77S, и Reichard, О.; Schvarcz, R.; Weiland, О.; 1997, Hepatology, v. 26: 108S-111S).HCV относится к семейству Flaviviridae, род hepacivirus, который включает три вида небольших оболочечных вирусов с РНК положительной полярности (Rice, СМ.; 1996; "Flaviviridae: the viruses andtheir replication"; pp. 931-960 in Fields Virology; Fields, B.N.; Knipe, D.M.; Howley, P.M. (eds.); LippincottRaven Publishers, Philadelphia Pa.). Геном HCV размером 9,6 т.п.н. состоит из открытой рамки считывания(ORF), ограниченной 5'- и 3'-нетранслированными участками (NTRs). Длина такого участка 5'-NTR, принадлежащего HCV, составляет 341 нуклеотид, этот участок выполняет функцию внутреннего сайта входа рибосомы для кэп-независимой инициации трансляции (Lemon, S.H.; Honda, M.; 1997; Semin. Virol.,v. 8:p. 274-288). HCV-полипротеин расщепляется ко- и лосттрансляционно на по меньшей мере 10 индивидуальных полипептидах (Reed, K. Е.; Rice, С. М.; 1999; Curr. Top. Microbiol. Immunol., v. 242: p. 55-84). Структурные белки образуются из сигнальной пептидазы в N-концевой области полипротеина. Две протеазы вируса являются медиаторами расщепления в прямом направлении (т.е. 5'-3'направлении) с получением при этом неструктурных белков (NS-белков), которые функционируют как компоненты РНКрепликазы HCV. NS2-3 протеаза охватывает С-концевую половину NS2 и N-концевую треть NS3 и катализирует цис-расщепление NS2/3 сайта. Эта же часть NS3 также кодирует каталитический домен NS3-4A сериновой протеазы, который расщепляется на четырех участках, расположенных в 5'-3'направлении. Сконцевые две трети NS3 очень хорошо сохраняются в HCV изолятах, проявляя активность в отношении РНК-связывания, РНК-стимулированной NTP-азы и раскручивания молекулы РНК. Хотя NS4B- и NS5Aфосфопротеин, вероятно, являются компонентами репликазы, их специфическая роль не известна. Продукт расщепления белка со стороны С-конца, NS5B, представляет собой фрагмент удлинения HCVрепликазы, обладающей РНК-зависимой РНК-полимеразной (RdRp) активностью (Behrens, S.E.; Tomei,L.; DeFrancesco, R.; 1996; EMBO J., v. 15: 12-22; а также Lohmann, V.; Korner, F.; Herian, U.;Bartenschlager, R.; 1997; J. Virol., v. 71: 8416-8428). Недавно было показано на модели шимпанзе, что мутации, устраняющие NS5B активность, устраняют инфективность РНК (Kolykhalov, A. A.; Mihalik, К.;Feinstone, S. M.; Rice, С. М.; 2000; J. Virol, v. 74, pp. 2046-2051). Разработка новых и специфических лекарственных средств против вируса гепатита С имеет первостепенное значение, специфические функции вируса, существенные для репликации, представляют собой наиболее привлекательные объекты для разработки лекарственных средств. Отсутствие РНКзависимых РНК-полимераз у млекопитающих, и факт, что этот фермент, по-видимому, является существенным для репликации вируса, позволяет предположить, что NS5 В-полимераза представляет собой идеальную мишень для лекарственных средств против вируса гепатита С. В заявке WO 00/06529 сообщается об ингибиторах NS5B, которые представляют собой , дикетокислоты. В заявках WO 00/13708, WO 00/10573, WO 00/18231 и WO 01/47883 сообщается об ингибиторахNS5B, предложенных для лечения HCV. Сущность изобретения Таким образом, целью настоящего изобретения является получение нового ряда соединений, обладающих повышенной ингибирующей активностью в отношении HCV-полимеразы. Согласно первому аспекту настоящего изобретения предлагается изомер, энантиомер, диастереомер или таутомер соединения, представленного формулой IR2 выбирают из Н, галогена, R21, OR21, SR21, COOR21, SO2N(R22)2, N(R22)2, CON(R22)2, NR22C(O)R22 или NR22C(O)NR22, в которых R21 и каждый R22 независимо представляют собой Н, (С 1-6)алкил, галогеналкил, (С 2-6)алкенил, (С 3-7)циклоалкил, (С 2-6)алкинил, (С 5-7)циклоалкенил, 6- или 10-членный арил илиHet, причем указанные R21 и R22 необязательно замещены радикалом R20, или оба R22 соединены вместе с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла с атомом азота, к которому они присоединены, где R10 и R20 каждый представляет собой 1-4 заместителя, выбранных из галогена, ОРО 3 Н, NO2, циано, азидо, C(=NH)NH2, С(=NH)NH(С 1-6) алкила или С(=NH)NHCO(С 1-6)алкила; или 1-4 заместителя, выбранных из:a) (C1-6) алкила или галогеналкила, (C3-7)циклоалкила, C3-7 спироциклоалкила, необязательно содержащего 1 или 2 гетероатома, (С 2-6)алкенила, (C3-6)циклоалкенила, (С 2-8)алкинила, (C1-6)алкил-(C3-7)циклоалкила, каждый из которых необязательно замещен радикалом R150; б) OR104, где R104 представляет собой Н, (С 1-6 алкил), (C3-7)циклоалкил или (С 1-6)алкил-(C3-7)циклоалкил, арил, Het, (С 1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het,(C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; в) OCOR105, где R105 представляет собой (С 1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил,Het, (С 1-6 алкил)арил или (С 1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (С 1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, в которых каждый R108 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или гетероцикл необязательно замещены радикалом R150; д) NR111R 112, где R111 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7) циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, и R112 представляет собой Н, CN, (C1-6)алкил,(C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил, (C1-6 алкил)Het, COOR115 или SO2R115, в которых R115 представляет собой (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или гетероцикл необязательно замещены радикалом R150; е) NR116COR117, где R116 и R117 каждый представляет собой Н, (С 1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные (С 1-6)алкил,(C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С 1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или R118 ковалентно присоединен к радикалу R119 и к атому азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; указанные алкил, циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или гетероцикл необязательно замещены радикалом R150; з) NR121OCOR122, где R121 и R122 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, 6- или 10-членный арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил или (С 1-6 алкил)Het необязательно замещены радикалом R150; или R122 представляет собой OR123 или N(R124)2, в которых R123 и каждый R124 независимо представляют собой Н, (С 1-6 алкил), (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или R124 представляет собой ОН или O(C1-6 алкил), или оба R124 ковалентно связаны-2 007722 друг с другом с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (С 1-6 алкил)арил или (C1-6 алкил)Het и гетероцикл необязательно замещены радикалом R150; и) COR127, где R127 представляет собой Н, (С 1-6)алкил, (С 3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (С 1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het,(C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; к) COOR128, где R128 представляет собой Н, (С 1-6)алкил, (C3-7)циклоалкил, или(C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные (С 1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)пиклоалкил, арил, Het, (C1-6 алкил)арил и (C1-6 алкил)Het необязательно замещены радикалом R150; л) CONR129R130, где R129 и R130 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6 или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил,арил, Het, (C1-6 алкил)арил, (C1-6 алкил)Het и гетероцикл необязательно замещены радикалом R150; м) арила, Het, (C1-6 алкил)арила или (C1-6 алкил)Het, каждый из которых необязательно замещен радикалом R150; и где R 150 определяют как 1-3 заместителя, выбранных из галогена, ОРО 3 Н, NO2, циано, азидо, C(=NH)NH2, C(=NH)NH(C1-6) алкила или С(=NH)NHCO(С 1-6)алкила; или 1-3 заместителя, выбранных из: а) (C1-6)алкила или галогеналкила, (C3-7)циклоалкила, C3-7 цпироциклоалкила, необязательно содержащего 1 или 2 гетероатома, (С 2-6)алкенила, (С 2-8)алкинила, (C1-6)алкил-(C3-7)циклоалкила, каждый из которых необязательно замещен радикалом R160; б) OR104, где R104 представляет собой Н, (С 1-6 алкил), (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С 1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R160; в) OCOR105, где R105 представляет собой (С 1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил,Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R160; г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, в которых каждый R108 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или гетероцикл необязательно замещены радикалом R160; д) NR111R112, где R111 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, и R112 представляет собой Н, CN, (C1-6)алкил,(C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С 1-6 алкил)арил, (C1-6 алкил)Het, COOR115 или SO2R115, в которых R115 представляет собой (C1-6)алкил, (C3-7)циклоалкил, или (С 1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или гетероцикл необязательно замещены радикалом R160; е) NR116COR117, где R116 и R117 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)никлоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные (С 1-6)алкил, (C3-7) циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R160; ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или R118 ковалентно связан с R119 и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла,причем указанные алкил, циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или гетероцикл необязательно замещены радикалом R160; з) NR121COCOR122, где R121 и R122 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)никлоалкил, 6- или 10-членный арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R160, или R122 означает OR123 или N(R124)2, в которыхR123 и каждый R124 независимо представляет собой Н, (С 1-6 алкил), (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или R124 означает ОН или О(С 1-6 алкил), или оба R124 ковалентно связаны друг с другом с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указан-3 007722 ные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил или (С 1-6 алкил)Het и гетероцикл необязательно замещены радикалом R160; и) COR127, где R127 представляет собой Н, (С 1-6)алкил, (С 3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (С 1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R160; к) тетразола, COOR128, где R128 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (С 1-6 алкил)Het, причем указанные (C1-6)алкил, (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил и (C1-6 алкил)Het необязательно замещены радикалом R160; и л) CONR129R130, где R129 и R130 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил,(C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил, (C1-6 алкил)Het и гетероцикл необязательно замещены радикаломR160; где R160 определяют как 1 или 2 заместителя, которые выбирают из тетразола, галогена, CN, С 1-6 алкила, галогеналкила, COOR161, SO3H, SR161, SO2R161, OR161, N(R162)2, SO2N(R162)2, NR162COR162 илиCON(R162)2, где R161 и каждый R162 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил или(С 1-6)алкил-(C3-7)циклоалкил; или оба R162 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; В означает NR3 или CR3, при условии, что один из А или В представляет собой либо CR1, либо CR3,где R3 выбирают из (C3-7)циклоалкила или (С 5-7)циклоалкенила;L представляет собой N или CR5, где R5 имеет те же самые значения, как и R4, определенный выше; М представляет собой N или CR7 , где R7 имеет те же самые значения, как и R4, определенный выше;Z означает OR6, где R6 представляет собой Н или (C1-6)алкил; или его соль. В качестве альтернативы, в соответствии с первым аспектом настоящего изобретения предлагается соединение, представленное формулой IаR1 выбирают из группы, состоящей из радикалов Н и (C1-6)алкил;R2 выбирают из группы, состоящей из Н, галогена, (C1-6)алкила, (C3-7)циклоалкила, фенила, 5- или 6-членного гетероцикла, содержащего от 1 до 4 гетероатомов, выбранных из О, N и S, пиридин-N-оксида и 9- или 10-членного гетеробицикла, содержащего 1-4 гетероатома, выбранных из О, N и S,указанные фенил, гетероцикл и гетеробицикл необязательно замещены 1-4 заместителями, выбранными из группы, состоящей из следующих заместителей: галоген, С(галоген)3, (С 1-6)алкил, ОН, O(C16 алкил), NH2 и N(C1-6 алкил)2;Z представляет собой OR6, где R6 выбирают из группы, состоящей из Н и (С 1-6)алкила; или соль этого соединения. Согласно третьему аспекту настоящего изобретения предлагается применение соединения формулы I или его фармацевтически приемлемая соль, в качестве ингибитора репликации вируса гепатита С (HCV). Согласно четвертому аспекту настоящего изобретения предлагается фармацевтическая композиция для лечения или предупреждения инфекционного заболевания, вызываемого вирусом гепатита С, включающая эффективное количество соединения формулы I или фармацевтически приемлемой соли этого соединения, и фармацевтически приемлемый носитель. Указанная композиция может дополнительно включать иммуномодулирующий агент.-4 007722 Предпочтительно указанный иммуномодулирующий агент выбирают из -, -, -, - и интерферонов. Фармацевтическая композиция дополнительно может включать рибавирин или амантадин. Кроме того, фармацевтическая композиция может дополнительно включать еще один ингибитор полимеразы вируса гепатита С (HCV-полимеразы). Фармацевтическая композиция может дополнительно включать ингибитор другой мишени вируса гепатита С, выбранной из хеликазы, полимеразы, металлопротеазы и IRES (от англ. internal ribosome entry site - внутренний сайт входа рибосомы). Еще одним аспектом настоящего изобретения является промежуточное соединение формулы (1 а) или (1b) в которой А, В, K, L и М являются такими, как это определено выше при характеристике соединения формулы I, PG означает Н или защитную группу для карбоксигруппы и X означает металл. Настоящее изобретение также относится к способу получения соединений формулы (iii) в которой A, R2, В, K, L, M, PG и X являются такими, как это определено выше. Способ включает взаимодействие в присутствии металлического катализатора, основания и добавки в подходящем растворителе промежуточного соединения (1 а) согласно п.36, с соединением R2-X. Настоящее изобретение относится к ещ одному способу получения соединений формулы (iii) в котором A, R2, В, K, L, М и PG являются такими, как это определено выше. Этот способ включает взаимодействие в присутствии катализатора на основе металла, основания и добавки в подходящем растворителе промежуточного соединения (lb) с соединением R2-X'. Предпочтительно катализатор на основе металла выбирают из Pd, Ni, Ru и Cu. Добавку предпочтительно выбирают из фосфинового лиганда, соли меди, соли лития, соли аммония и CsF. Предпочтительно катализатор на основе металла выбирают из Li, Sn(С 1-6 алкил)3, Sn(арил)3, B(OH)2,В(ОС 1-6 алкил)2 и галогенида металла. Ещ одним аспектом изобретения является применение соединения формулы I для изготовления лекарственного средства для лечения инфекционного заболевания, вызываемого вирусом гепатита С(HCV). Подробное описание изобретения Используемая терминология Если не указано иное, то используются следующие определения. При использовании в тексте заявки термины "(С 1-3)алкил", "(С 1-4)алкил" или "(C1-6)алкил", используемые либо по отдельности, либо в сочетании с другим радикалом, как предполагается, означают ациклические алкильные радикалы с линейной или разветвленной цепью, содержащие до 3, 4 или 6 атомов углерода соответственно. Примеры таких радикалов включают метил, этил, пропил, бутил, гексил, 1 метилэтил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил. При использовании в тексте заявки термин "(С 2-6)алкенил", используемый либо по отдельности, либо в сочетании с другим радикалом, как предполагается, означает ненасыщенный ациклический алкильный радикал с линейной цепью, содержащий от двух до шести атомов углерода. При использовании в тексте заявки термин "(C2-6)алкинил", используемый либо по отдельности, либо в сочетании с другой группой, как предполагается, означает ненасыщенный sp-гибридизованный ациклический радикал с линейной цепью, содержащий от 2 до 6 атомов углерода.-5 007722 При использовании в тексте заявки термин "(C3-7)циклоалкил", используемый либо по отдельности,либо в сочетании с другим радикалом, означает циклоалкильный радикал, содержащий от трех до семи атомов углерода, этот термин включает циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. При использовании в тексте заявки термин "(С 5-7)циклоалкенил", используемый либо по отдельности, либо в сочетании с другим радикалом, означает ненасыщенный циклический радикал, содержащий от пяти до семи атомов углерода. При использовании в тексте заявки термин "защитная группа для карбоксигруппы" относится к защитной группе, которая может быть использована при проведении взаимодействия, такие группы перечислены в Greene, "Protective Groups in Organic Chemistry", John WileySons, New York (1981), а также в-Карбоксильную группу остатка с концевым С-атомом обычно защищают и используют в виде сложноэфирной группы (CPG), которую можно удалить с получением при этом группы карбоновой кислоты. Защитные группы, которые могут быть использованы, включают: 1) алкиловые сложные эфиры, например такие, как метиловый, триметилсилилэтиловый и третбутиловый,2) аралкиловые сложные эфиры, например такие, как бензиловый и замещенный бензиловый, или 3) сложноэфирные группы, которые могут быть отщеплены при обработке мягким основанием или мягкими восстанавливающими средствами, например, такие как трихлорэтиловая и фенациловая сложноэфирная группа. При использовании в тексте заявки термин "арил", или "6- или 10-членный арил", используемый либо по отдельности, либо в сочетании с другим радикалом, означает ароматический радикал, содержащий шесть или десять атомов углерода, например фенил или нафтил. При использовании в тексте заявки термин гетероатом означает О, S или N. При использовании в тексте заявки термин "гетероцикл", используемый либо по отдельности, либо в сочетании с другим радикалом, означает моновалентный радикал, полученный посредством удаления атома углерода из 5-, 6-, или 7-членного насыщенного или ненасыщенного (включая ароматический) гетероцикла, содержащего от 1 до 4 гетероатомов, выбранных из азота, кислорода и серы. Кроме того, термин "гетероцикл" при использовании в тексте заявки означает гетероцикл, в соответствии с приведенным выше определением, сопряженный с одним или более другим циклом, который может быть или гетероциклом, или каким-либо другим циклом. Примеры таких гетероциклов включают, но не ограничиваются указанным, пирролидин, тетрагидрофуран, тиазолидин, пиррол, тиофен, кумарин, гидантоин,диазепин, 1 Н-имидазол, изоксазол, тиазол, тетразол, пиперидин, 1,4-диоксан, 4-морфолин, пиридин, пиридин-N-оксид, пиримидин, тиазоло [4,5-b]- пиридин, хинолин или индол, или следующие гетероциклы: При использовании в тексте заявки термин "9- или 10-членный гетеробицикл" или "гетеробицикл",используемый либо по отдельности, либо в сочетании с другим радикалом, означает гетероцикл, в соответствии с приведенным выше определением, сопряженный с одним или более другим циклом, который может быть или гетероциклом, или каким-либо другим циклом. Примеры таких гетероциклов включают,не ограничиваясь указанным, тиазоло[4,5-b]-пиридин, хинолин или индол, или следующие гетероциклы: При использовании в тексте заявки термин "Het" означает 5- или 6-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из О, N и S, или 9-или 10-членный гетеробицикл, содержащий,где это возможно, от 1 до 5 гетероатомов, выбранных из О, N и S. При использовании в тексте заявки термин "галоген" означает атом галогена и включает фтор, хлор,бром и иод. При использовании в тексте заявки термин "галогеналкил", как предполагается, означает алкил, как это определено выше, в котором каждый атом водорода может быть последовательно заменен атомом галогена, например СН 2 Вr или CF3. При использовании в тексте заявки термин "галогенид металла", как предполагается, означает лю-6 007722 бой металл, который связан с атомом галогена и который предназначен для использования в катализируемой металлами реакции кросс-сочетания. Примеры таких галогенидов металлов включают, но не ограничиваются указанным, -MgCl, -CuCl или -ZnCl и подобные им галогениды. При использовании в тексте заявки термин "ОН" означает гидроксильную группу. Специалисту в данной области техники хорошо известно, что гидроксильная группа может быть заменена эквивалентными функциональными группами. Примеры таких эквивалентов функциональной группы, которые рассматриваются в соответствии с настоящим изобретением, включают, но не ограничиваются указанным,простые эфирные группы, сульфгидрильные группы, и первичные, вторичные и третичные аминогруппы. При использовании в тексте заявки термин "SH" означает сульфгидрильную группу. Предполагается, что в рамках настоящего изобретения, вне зависимости от того, присутствует ли группа "SH" или группа "SR", она также может быть заменена группой в любом другом подходящем состоянии окисления, например такой группой, как SOR, SO2R или SO3R. Предполагается, что термин "замещенный", в том случае, когда он используется в отношении радикала, содержащего более чем один фрагмент, такого как С 1-6 алкиларил или C1-6 алкил-Het, означает замещение, которое относится к обоим фрагментам, т.е. как алкил, так и арил или фрагменты Het могут быть замещены определенными заместителями. При использовании в тексте заявки термин "СООН" означает группу карбоновой кислоты. Специалистам в данной области техники хорошо известно, что группы карбоновой кислоты могут быть заменены эквивалентными функциональными группами. Примеры таких эквивалентных функциональных групп, которые рассматриваются в соответствии с настоящим изобретением, включают, но не ограничиваются указанным, сложноэфирные группы, амидные группы, группы бороновых кислот или тетразольные группы. При использовании в тексте заявки термин "эквивалентная функциональная группа", как предполагается, означает фрагмент или его замещенное 1 функциональное производное, которые могут быть заменены другим фрагментом, который имеет сходные электронные свойства, аналогичные гибридизацию и реакционную способность. При использовании в тексте заявки термин "катализатор на основе металла", как предполагается,означает металл, например, такой как палладий (0) или палладий (2), который связывается с отщепляемой группой и предназначен для использования в реакции кросс-сочетания. Примеры таких катализаторов на основе палладия включают, но не ограничиваются указанным, Pd(Ph3)4, Pd/C, Pd(OAc)2, PdCl2 и подобные им катализаторы. Альтернативные соединения металла, которые могут катализировать реакции кросс-сочетания, включают, но не ограничиваются указанным, Ni(acac)2, Ni(OAc)2 или NiCl2. При использовании в тексте заявки термин "производное", как предполагается, означает "детектируемую метку", "аффинную метку" или "фотореактивную группу". Термин "детектируемая метка" означает любую группу, которая может связываться с полимеразой или с соединением, являющимся предметом настоящего изобретения, причем такую, что в том случае, когда соединение присоединяется к мишени - полимеразе, такая метка позволяет осуществить прямо или косвенно распознавание соединения, таким образом, что возможно обнаружить, измерить и определить количество соединения. Примеры таких"меток", как предполагается, включают, но не ограничиваются указанным, флуоресцентные метки, хемилюминесцентные метки, колориметрические метки, ферментативные маркеры, радиоактивные изотопы и аффинные метки, например, такие как биотин. Эти метки присоединяют к соединению или к полимеразе в соответствии с хорошо известными методиками. Термин "аффинная метка" означает лиганд (который присоединяется к полимеразе или к соединению, являющемуся предметом настоящего изобретения), сильное сродство которого к рецептору может быть использовано для того, чтобы выделить из раствора объект, к которому присоединился лиганд. Примеры таких лигандов включают биотин или его производное, полипептид на основе гистидина, полиаргинин, амилозный фрагмент сахарида или определенный эпитоп, распознаваемый специфическими антителами. Такие аффинные метки присоединяют к соединению или к полимеразе в соответствии с хорошо известными методиками. Термин "фотореактивная группа" означает группу, которая при активации под воздействием света трансформируется из инертной группы в реакционноспособную, например такую, как свободный радикал. Примеры таких групп включают, но не ограничиваются указанным, бензофеноновые, азидные и подобные им группы. При использовании в тексте заявки термин "фармацевтически приемлемая соль" включает такие соли, которые получены с использованием фармацевтически приемлемых оснований и являются нетоксичными. Примеры подходящих оснований включают холин, этаноламин и этилендиамин. В объем настоящего изобретения также входят соли Na+, K+ и Са (см. также Pharmaceutical salts, Birge, S.M. et al.,J. Pharm. Sci., (1977), 66, 1-19, включено в настоящее описание в качестве ссылки). Наиболее предпочтительные варианты осуществления изобретения A Предпочтительно, соединения, являющиеся предметом настоящего изобретения, соответствуют следующей формуле (II): в которой, предпочтительно, А означает О, S или NR1. Предпочтительно, А означает NR1. Предпочтительно, соединения согласно настоящему изобретению соответствуют следующей формуле (III): в которой, предпочтительно, В означает NR3. Что касается соединений формулы (II) и (III), предпочтительно, М, K и L означают СН или N. Более предпочтительно, М, K и L означают СН. Более предпочтительно, соединения согласно настоящему изобретению представлены следующими формулами: где R1, R2, R3 и Z имеют такие же значения, которые определены выше для соединения формулы I. Предпочтительно, R1 выбирают из группы, состоящей из Н или (C1-6)алкила. Более предпочтитель 1 но, R представляет собой Н, СН 3, изопропил или изобутил. Даже более предпочтительно, R1 означает Н или СН 3. Наиболее предпочтительно, R1 означает СН 3. Предпочтительно, R2 выбирают из Н, галогена, (C2-6)алкенила, (С 5-7)циклоалкенила, 6- или 10 членного арила или Het, где (C2-6)алкенил, (С 5-7)циклоалкенил, арил или Het необязательно замещены радикалом R20, где R20 определяют как 1-4 заместителя, выбранных из галогена, NO2, циано, азидо, C(=NH)NH2, С(=NH)NH(С 1-6)алкила или С(=NH)NHCO(С 1-6)алкила; или 1-4 заместителя, выбранных из: а) (C1-6) алкила или галогеналкила, (C3-7)циклоалкила, (C2-6)алкенила, (С 2-8)алкинила, (C1-6) алкил(C3-7)циклоалкила, каждый из которых необязательно замещен радикалом R150; б) OR104, где R104 представляет собой Н, (C1-6 алкил), (C3-7)циклоалкил, или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; в) OCOR105, где R105 представляет собой (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил,Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150;-8 007722 г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, где каждый R108 независимо представляет собой Н,(C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, указанный алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или гетероцикл необязательно замещен радикаломR150; д) NR111R112, где R111 представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, и R112 представляет собой Н, CN, (C1-6)алкил,(C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил, (C1-6 алкил)Het, COOR115 или SO2R115, где R115 представляет собой (С 1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил,арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het или гетероцикл необязательно замещены радикалом R150; е) NR116COR117, где R116 и R117 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, указанный (C1-6)алкил, (C3-7) циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещен радикалом R150; ж) NR118CONR119R120, где R118, R119 и R120 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или R118 ковалентно связан с радикалом R119 и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они оба присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; причем указанные алкил, циклоалкил, (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или(C1-6 алкил)Het или гетероцикл необязательно замещены радикалом R150; з) NR121COCOR122, где R121 и R122 каждый представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил, (С 1-6) алкил-(C3-7)циклоалкил, 6- или 10-членный арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; или R122 представляет собой OR123 или N(R124)2, где R123 и каждый R124 независимо представляет собой Н, (C1-6 алкил), (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (С 1124 представляет собой ОН или O(C1-6 алкил), или оба R124 ковалент 6 алкил)арил или (C1-6 алкил)Het, или R но связаны вместе с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het и гетероцикл необязательно замещены радикалом R150; и) COR127, где R127 представляет собой Н, (С 1-6)алкил, (С 3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные алкил, циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het необязательно замещены радикалом R150; к) COOR128, где R128 представляет собой Н, (C1-6)алкил, (С 3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, причем указанные (С 1-6 алкил, (C3-7)циклоалкил,или (С 1-6)алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил и (C1-6 алкил)Het необязательно замещены радикалом R150; л) CONR129R130, где R129 и R130 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил, (C1-6) алкил-(C3-7)циклоалкил, арил, Het, (C1-6 алкил)арил или (C1-6 алкил)Het, или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, указанные алкил, циклоалкил, алкилциклоалкил, арил, Het, (C1-6 алкил)арил, (C1-6 алкил)Het и гетероцикл необязательно замещены радикалом R150; м) арила, Het, (С 1-6 алкил)арила или (С 1-6 алкил)Het, каждый из которых необязательно замещен радикалом R150; где R150 предпочтительно означает 1-3 заместителя, выбранных из галогена, NO2, пиано или азидо; или 1-3 заместителя, выбранных из: а) (C1-6)алкила или галогеналкила, (C3-7)циклоалкила, (C2-6)алкенила, (С 2-8)алкинила, (С 1-6)алкил-(C3160 7)циклоалкила, каждый из которых необязательно замещен радикалом R ; 104 104 б) OR , где R представляет собой Н, (С 1-6 алкил) или (C3-7)циклоалкил, указанные алкил или циклоалкил необязательно замещены радикалом R160; г) SR108, SO2N(R108)2 или SO2N(R108)C(O)R108, где каждый R108 независимо представляет собой Н,(C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил, арил, Het, или оба R108 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7 членного насыщенного гетероцикла, причем указанные алкил, циклоалкил, арил, Het и гетероцикл необязательно замещены радикалом R160; д) NR111R112, где R111 представляет собой Н, (С 1-6)алкил, или (C3-7)циклоалкил, и R112 представляет-9 007722 собой Н, (C1-6)алкил или (C3-7)циклоалкил, COOR115 или SO2R115, где R115 представляет собой (C1-6)алкил или (C3-7)циклоалкил, или оба R111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160; е) NR116 СOR117, где R116 и R117 каждый представляют собой Н, (C1-6)алкил или (C3-7)циклоалкил,причем указанные (C1-6)алкил и (C3-7)циклоалкил необязательно замещены радикалом R160; ж) NR118CONR119R120, где каждый из R118, R119 и R120 представляет собой Н, (C1-6)алкил или (C3-7) циклоалкил, или R118 ковалентно связан с радикалом R119 и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; или R119 и R120 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла; причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160; з) NR121COCOR122, где R121 представляет собой Н, (C1-6)алкил или (C3-7)циклоалкил, причем указанные алкил и циклоалкил необязательно замещены радикалом R160; или R 122 представляет собой OR123 или N(R124)2, где R123 и каждый R124 независимо представляет собой Н, (С 1-6 алкил) или (C3-7)циклоалкил, или оба R124 ковалентно связаны вместе с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, причем указанные алкил, циклоалкил и гетероцикл необязательно замещены радикалом R160; и) COR127, где R127 представляет собой Н, (С 1-6)алкил или (C3-7)циклоалкил, указанные алкил и циклоалкил необязательно замещены радикалом R160; к) COOR128, где R128 представляет собой Н, (С 1-6)алкил или (С 3-7)циклоалкил, указанный (С 1-6)алкил и (C3-7)циклоалкил необязательно замещены радикалом R160; и л) CONR129R130, где R129 и R130 независимо представляют собой Н, (C1-6)алкил или (C3-7)циклоалкил,или оба R129 и R130 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла, указанный алкил, циклоалкил и гетероцикл необязательно замещен радикалом R160; где R160 определяют как 1 или 2 заместителя, выбранные из галогена, CN, С 1-6 алкила, галогеналкила, COOR161, OR161, N(R162)2, SO2N(R162)2, NR162COR162 или CON(R162)2, где R161 и каждый R162 независимо представляет собой Н, (C1-6)алкил, (C3-7)циклоалкил или (C1-6)алкил-(C3-7)циклоалкил; или оба R162 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом 5-, 6- или 7-членного насыщенного гетероцикла. Более предпочтительно, R2 выбирают из арила или Het, каждый из которых необязательно монозамещен или дизамещен заместителями, выбранными из группы, состоящей из галогена, галогеналкила, N3 или а) (C1-6)алкила, необязательно замещенного группой ОН, O(C1-6)алкил или SO2(C1-6 алкил); б) (C1-6)алкокси; д) NR111R112, где оба R111 и R112 независимо представляют собой Н, (C1-6)алкил, (C3-7)циклоалкил или 112R112 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом азотсодержащего гетероцикла, каждый из указанных алкила, циклоалкила, арила, Het, алкиларила или алкил-Het необязательно замещен галогеном, илиOR161 или N(R162)2, где R161 и каждый R162 представляет собой независимо Н, (C1-6)алкил, или оба 162R ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом азотсодержащего гетероцикла; е) NHCOR117, где R117 представляет собой (C1-6)алкил, O(C1-6)алкил или O(C3-7)циклоалкил; и) СО-арила; и л) CONH2, CONH(C1-6 алкил), COH(C1-6 алкил)2, CONH-арила или CONHC1-6 алкиларила. Еще более предпочтительно, когда R2 представляет собой арил или Het, каждый из которых необязательно монозамещен или дизамещен заместителями, выбранными из группы, состоящей из галогена,галогеналкила или а) (C1-6)алкила, необязательно замещенного группой ОН, O(C1-6)алкил или SO2(C1-6 алкил); б) (C1-6)алкокси; и д) NR111R112, где оба R111 и R112 независимо представляют собой Н, (C1-6)алкил, (C3-7)цикло-алкил,или R112 представляет собой 6- или 10-членный арил, Het, (C1-6)алкиларил или (C1-6)алкил-Het; или обаR111 и R112 ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом азотсодержащего гетероцикла, каждый из указанных алкила, циклоалкила, арила, Het,алкиларила или алкил-Het необязательно замещен галогеном, или- OR161 или N(R162)2, где R161 и каждый R162 представляет собой независимо Н, (C1-6)алкил, или оба 162R ковалентно связаны друг с другом и с атомом азота, к которому они присоединены, с образованием при этом азотсодержащего гетероцикла. Даже более предпочтительно, когда R2 означает фенил или гетероцикл, выбранный из каждый из которых необязательно замещен таким образом, как определено выше. Даже более предпочтительно, если R выбирают из группы, состоящей из Н, Br, СН=СН 2,Предпочтительно, R3 представляет собой (C3-7)циклоалкил. Наиболее предпочтительно, R3 означает циклопентил или циклогексил. Предпочтительно, Z означает ОН. Конкретные варианты осуществления изобретения В объем настоящего изобретения входят все соединения формулы I, которые представлены в табл. 1 и 2. Активность полимеразы Способность соединений формулы (I) ингибировать синтез РНК, осуществляемый под воздействием РНК-зависимой РНК-полимеразы вируса гепатита С, может быть оценена по любой методике, пригодной для измерения активности РНК-зависимой РНК-полимеразы. Подходящая методика описана в- 13007722 примерах. Специфичность активности РНК-зависимой РНК-полимеразы Для того, чтобы показать, что соединения, являющиеся предметом настоящего изобретения, специфически ингибируют активность HCV-полимеразы, соединения были протестированы в отношении ингибирующей активности по методике с использованием ДНК-зависимой РНК-полимеразы. В том случае, когда соединение формулы (I) или одну из его терапевтически приемлемых солей используют в качестве противовирусного агента, это соединение вводят перорально, местно или систематически млекопитающим, например людям, кроликам или мышам, вместе с наполнителем, включающим один или более фармацевтически приемлемый носитель, количественное соотношение которого определяется растворимостью и химической природой соединения, выбранным способом введения и общепринятой биологической практикой. Для перорального введения соединение или терапевтически приемлемая соль могут быть изготовлены по рецептуре в виде единичных дозированных форм, таких как капсулы или таблетки, каждая из которых содержит определенное количество активного ингредиента, варьирующееся от приблизительно 25 до 500 мг, в фармацевтически приемлемом носителе. Для местного введения может быть изготовлена по рецептуре композиция, содержащая соединение в фармацевтически приемлемом носителе, с содержанием активного агента от 0,1 до 5%, предпочтительно 0,5 до 5%. Такие композиции могут находиться в форме раствора, крема или лосьона. В случае парентерального введения соединение формулы (I) вводят либо внутривенной, либо подкожной, либо внутримышечной инъекцией, в виде композиции с фармацевтически приемлемыми наполнителями или носителями. Для введения посредством инъекции предпочтительно использовать соединение в виде раствора в стерильном водном разбавителе, который также может содержать другие растворенные вещества, такие как буферные средства или консерванты, а также достаточное количество фармацевтически приемлемых солей или глюкозы, для того, чтобы раствор был изотоническим. Подходящие наполнители или носители для вышеуказанных композиций описаны в руководствах по фармацевтике, например в "Remington's The Science and Practice of Pharmacy", 19th ed., Mack Publishing Company, Easton, Penn., 1995, или в руководстве "Pharmaceutical Dosage Forms and Drugs Delivery Systems", 6th ed., H.C. Ansel et al., Eds., WilliamsWilkins, Baltimore, Maryland, 1995. Дозировка соединений будет в значительной степени варьироваться в зависимости от формы введения и конкретного выбранного активного агента. Кроме того, она будет значительно варьироваться для различных конкретных пациентов. Как правило, лечение начинают с небольшого постепенного увеличения дозы, до тех пор, пока не будет достигнут оптимальный при данных обстоятельствах эффект. Как правило, соединение формулы I наиболее желательно вводить в концентрации, уровень которой позволяет в основном достичь эффективное противовирусное воздействие, не оказывая при этом какого-либо вредного или опасного побочного действия. Для перорального введения соединение или терапевтически приемлемую соль вводят в количестве,находящемся в интервале от 10 до 200 мг на 1 кг массы тела в день, предпочтительно в интервале от 25 до 150 мг на 1 кг. При системном введении соединение формулы (I) вводят в дозе от 10 до 150 мг на 1 кг массы тела в день, хотя возможны указанные выше вариации. Для того, чтобы воздействие было эффективным, наиболее предпочтительна дозировка, находящаяся в интервале от приблизительно 10 до 100 мг на 1 кг массы тела в день. В том случае, когда композиции согласно настоящему изобретению включают комбинацию соединения формулы I и одного или более терапевтического или профилактического агента, оба соединения и дополнительный агент должны присутствовать в таком количестве, чтобы дозировка составляла от приблизительно 10 до 100% и более предпочтительно между приблизительно 10 и 80% от дозировки, обычно вводимой при использовании режима монотерапии. В том случае когда эти соединения или их фармацевтически приемлемые соли использованы для приготовления композиции вместе с фармацевтически приемлемым носителем, полученная композиция может быть введена in vivo млекопитающему, такому как человек, для того, чтобы ингибировать активность HCV-полимеразы, или для лечения или предотвращения инфекционного вирусного заболевания,вызываемого HCV. Такое лечение также может быть достигнуто при использовании соединений, являющихся предметом настоящего изобретения, в сочетании с агентами, которые включают, но не ограничиваются указанным, следующее: иммуномодулирующие агенты, такие как -, -, - или -интерфероны,другие противовирусные агенты, такие как рибавирин, амантадин, другие ингибиторы NS5B HCVполимеразы, ингибиторы других мишеней, участвующих в жизненном цикле HCV, которые включают,но не ограничиваются указанным, следующее: хеликазу, NS2/3-протеазу, NS3-протеазу или внутренний сайт входа рибосомы (IRES - от англ. internal ribosome entry site); или их комбинацию. Для создания единичной дозированной формы с соединениями согласно настоящему изобретению могут быть объединены дополнительные агенты. В качестве альтернативы такие дополнительные агенты могут быть введены млекопитающему раздельно как часть составной дозированной формы.- 14007722 Методология и синтез Производные индола или аналоги согласно настоящему изобретению могут быть получены из известных моноциклических ароматических соединений при осуществлении, с необходимой модификацией, известных из литературы последовательных реакций, например, таким образом, как описано в статьеJ. W. Ellingboe et al., Tet. Lett., 1997, v. 38, p. 7963 и в статье S. Cacchi et al., Tet. Lett., 1992, v. 33, p. 3915. На схеме 1, приведенной ниже, значения R1, R2, R3, R6, K, L и М являются такими, как указано в тексте заявки, на этой схеме показано, каким образом указанные методики могут быть использованы для синтеза соединения формулы I, являющегося предметом настоящего изобретения. Схема 1 При осуществлении способа, показанного на схеме 1, подходящим образом защищенная 3 трифторацетамидо-4-иодбензойная кислота I(i) взаимодействует с алкином I(ii) в присутствии катализатора на основе металла (например, комплекса металлического палладия, такого как PdCl2(PPh3)2, Pd2dba3,Pd(PPh3)4 и подобного им соединения), основания (Et3N, ДИЭА и подобное соединение, или соль неорганического основания, включая карбонаты металлов, фториды и фосфаты), и, необязательно, в присутствии дополнительного фосфинового лиганда (триарил- или гетероарилфосфин, dppe (1,2-бис(дифенилфосфино)этан), dppf (1,1'-бис(дифенилфосфино)ферроцен), dppp (1,3-бис(дифенилфосфино)пропан) и подобные им лиганды). Подходящие растворители для проведения этой реакции включают ДМФ, диоксан, ТГФ, ДМЭ (1,2-диметоксиэтан) толуол, MeCN, ДМА и подобные им растворители, при температуре,варьирующейся от 20 до 170 С, или, в качестве альтернативы, без растворителя при совместном нагревании компонентов. В качестве альтернативы, в реакции кросс-сочетания может быть использован 3 амино-4-иодбензоат в подходящим образом защищенном виде, а аминогруппа может быть подвергнута трифторацетилированию на последующей стадии, как описано в статье J.W. Ellingboe et al., Tet. Lett.,1997, v. 38, p. 7963. Реакция вышеуказанных диарилалкинов I(iii) с трифлатом енола в условиях реакции кросссочетания, аналогичных описанным выше условиям, позволяет получить после гидрирования производное индола I(iv). Трифлаты енола известны и могут быть получены из соответствующих кетонов в соответствии с известными из литературы методами (например, трифлат циклогексена может быть получен из циклогексанона, ангидрида трифторметансульфоновой кислоты (triflic anhydride) и пространственно затрудненного органического основания, например, такого как 2,6-ди-трет-бутил-4-метилпиридин). Гидрирование двойной связи, первоначально присутствующей в R1, может быть осуществлено под действием газообразного водорода или донора водорода (формиата аммония, муравьиной кислоты и подобных им соединений) в присутствии катализатора на основе металла (предпочтительно, Pd) в подходящем растворителе (низшие алкиловые спирты, ТГФ и т.п.). В заключение, после гидролиза сложноэфирной защитной группы соединения I(iv), полученное в результате производное 6-карбоксииндола I(v) превращают в соединение формулы I посредством взаимодействия с подходящим амином формулы H2N-R6. Конденсация 6-индолкарбоновой кислоты с аминами H2N-R6 может быть осуществлена при использовании обычных реагентов, используемых для образования амидной связи, таких как ТБТУ, ГАТУ, БОФ, BroP, EDAC, DCC, изобутилхлорформиат и подобные им соединения, или посредством активации карбоксильной группы превращением в соответствующий хлорангидрид перед проведением конденсации с амином. После этой стадии защитную группу уда- 15007722 ляют с получением при этом соединения формулы I. В качестве альтернативы, соединения формулы 1 могут быть получены при введении заместителей в предварительно имеющееся индольное ядро посредством следующей модификации описанной в литературе методики, например такой, как описано в статье P. Gharagozloo et al., Tetrahedron, 1996, v. 52, p. 10185 или в статье К. Freter., J. Org. Chem., 1975, v. 40, p. 2525. Такая методика показана на схеме 2 Схема 2 При использовании способа, показанного на схеме 2, в качестве исходного вещества используют коммерчески доступную 6-индолкарбоновую кислоту 2(i), которую также возможно получить согласно способу, описанному в статье S.Kamiya et al., Chem. Pharm. Bull., 1995, v. 43, p. 1692. Индол 2(i) взаимодействует с кетоном 2(ii) в условиях реакции альдольного типа с использованием кислоты или основания. Подходящие условия для проведения такой конденсации включают использование сильных оснований, таких как гидроксиды щелочных металлов, алкоксиды и гидриды в среде растворителей, таких как низшие алкиловые (МеОН,EtOH, трет-BuOH и т.п.), ТГФ, диоксан, ДМФ, ДМСО, ДМА и подобные им растворители при температуре реакции, варьирующейся от -20 до 120 С. В качестве альтернативы, конденсацию возможно проводить в кислотных условиях с использованием органических или минеральных кислот, или тех и других. Подходящие условия включают использование смеси АсОН и водного раствора фосфорной кислоты при температуре, варьирующейся от 15 до 120 С. После введения защиты для карбоксильной группы в виде сложноэфирной группы (обычно с низшим алкилом) известными методами, индольный атом азота может быть проалкилирован с введением радикала R3, если это необходимо. Условия реакции алкилирования атома производного индола хорошо известны специалистам в данной области техники и включают использование сильных оснований, таких как гидриды щелочных металлов, гидроксиды, амиды, алкоксиды и алкилпроизводные металлов, в подходящем растворителе (например, таком как ТГФ, диоксан, ДМЭ, ДМФ, MeCN, ДМСО, спирты и подобные им растворители) при температуре, варьирующейся от -78 до 140 С. Для алкилирования индольного аниона используют электрофильную форму R3. Примеры таких электрофилов включают иодиды, бромиды, хлориды и сложные эфиры - сульфонаты (мезилат, тозилат, брозилат или трифлат). Галогенирование (обычно бромирование, но также и иодирование) 2-положения индола 2(iv) позволяет получить соединение 2(v). Подходящие галогенирующие агенты включают, например, элементарный бром, N-бромсукцинимид, трибромид пиридина, дибромгидантоин и соответствующие иодпроизводные. Подходящие растворители для проведения такой реакции инертны по отношению к реакционноспособным галогенирующим агентам и включают, например, углеводороды, хлорированные углеводороды (ДХМ, CCl4, СНCl3), простые эфиры (ТГФ, ДМЭ, диоксан), уксусную кислоту, этилацетат, IPA и смеси этих растворителей. Температура реакции варьируется от -40 до 100 С. Выбранный способ проведения бромирования индолов, показанный на схеме 2, описан в статье L. Chu., Tet. Lett., 1997, v. 38, p. 3871. Производные 2-броминдола 2(v) могут быть непосредственно превращены в полностью замещенные ключевые производные I(v) посредством реакции кросс-сочетания с арил- или гетероарилпроизвод- 16007722 ными бороновых кислот, сложными эфирами бороновых кислот или производными триалкилстаннанов. Эти бороновые или оловоорганические реагенты коммерчески доступны или могут быть получены в соответствии с общепринятыми методиками, описанными в литературе. Кросс-сочетание с органобороновыми реагентами может быть проведено с использованием каких-либо вариантов реакции Сузукиреакции кросс-сочетания, о которой сообщалось в литературе. Эта реакция, как правило, включает использование катализатора на основе переходного металла (обычно Pd), триарил- или тригетероарилфосфиновых лигандов, добавки, например такой, как неорганический хлорид (например, LiCl), и основания (обычно, водного раствора неорганического основания, такого как карбонат или фосфат натрия или калия). Реакцию обычно проводят в спиртовом растворителе (EtOH), ДМЭ, толуоле, ТГФ и подобных растворителях при температуре, варьирующейся от 25 до 140 С. Кросс-сочетание с оловосодержащими реагентами может проводиться посредством каких-либо вариантов реакции Штилле (Stille) - реакции кросс-сочетания, о которой сообщалось в литературе. Для проведения этой реакции обычно используют катализатор на основе переходного металла (обычно Pd),триарильные или тригетероарильные фосфиновые лиганды, и добавки, например, такие как неорганический хлорид (например, LiCl) или иодид (например, CuI). Подходящие растворители для проведения этой реакции включают толуол, ДМФ, ТГФ, ДМЭ и подобные им растворители при температуре, варьирующейся от 25 до 140 С. Промежуточное соединение I(v) затем превращают в соединение формулы I,как показано на схеме 1. В качестве альтернативы, производное 2-броминдола 2(v) может быть подвергнуто трансметаллированию под действием оловоорганических реагентов (или цинкорганических реагентов) и использовано в реакции кросс-конденсации по Штилле в условиях, описанных выше. В этом случае для введения R2 используют ароматические и гетероароматические галогениды (хлориды, бромиды, иодиды) или трифлаты. Превращение производных 2-броминдола 2(v) в соответствующее оловоорганическое соединение 2(vi) проводят посредством первоначального обмена галоген-металл при низкой температуре (обычно от-78 до -30 С) с использованием алкиллитиевого реагента (например, н-BuLi или трет-BuLi) или с использованием металлического лития. Неустойчивое 2-литийиндольное соединение затем стабилизируют взаимодействием с галогенидом триалкилолова (например, таким как н-Bu3SnCl или Me3SnCl). В качестве альтернативы, литийиндольное промежуточное соединение может быть стабилизировано взаимодействием с хлоридом цинка с образованием при этом соответствующего органоцинката, который также может вступать в катализируемую переходными металлами реакцию кросс-сочетания с ароматическими или гетероароматическими галогенидами или трифлатами, которая описана, например, в статье М. Rowley., J. Med. Chem., 2001, v. 44, p. 1603. Настоящее изобретение также относится к соединению формулы I, в котором карбоксильная группа находится в 5-положении индольной системы. Синтез таких соединений основывается на использовании,с необходимыми модификациями, известных из литературы методик и показан на схеме 3. Схема 3 При осуществлении способа синтеза, показанного на схеме 3, этил-4-ацетамидо-3-иодобензоат 3(i) вступает в катализируемую металлами реакцию кросс-сочетания с алкином 3(ii) с образованием при этом 2,3-дизамещенного-5-индолкарбоксилата 3(iii) в соответствии с адаптированным вариантом методики,описанной в статье A. Bedeschi et al., Tet. Lett. 1997, v. 38, p. 2307. Производное индола 3(iii) затем алкилируют по атому азота, используя электрофильные группы R1 (галогениды, сложные эфиры - сульфонаты), под действием оснований, таких как гидроксиды щелочных металлов, фториды, гидриды амидов,алкиллитий, фосфорсодержащие основания и подобные им соединения, с получением при этом соединения 3(iv). Подходящие растворители для проведения такого алкилирования включают ДМФ, DMA,ДМСО, MeCN, ТГФ, диоксан, ДМЭ и подобные им основания. После омыления сложноэфирной группы- 17007722 щелочным раствором полученное производное 5-индолкарбоновой кислоты 3(v) подвергают взаимодействию с H2N-R6, применяя обычные реагенты, используемые для образования амидной связи, как описано выше (схема 1), с получением при этом соединения формулы I. Примеры Настоящее изобретение более подробно проиллюстрировано представленными ниже примерами,которые не ограничивают объем изобретения. Все реакции проводят в атмосфере азота или аргона. Значения температуры указаны в градусах Цельсия. Экспресс-хроматографию осуществляют на силикагеле. Процентные значения или соотношения для растворов относятся к соотношению объема к объему, если не указано иное. Анализы методом масс-спектроскопии выполнены с использованием масс-спектроскопии с электроспреем. Сокращения и обозначения, используемые в тексте заявки, включают следующее ДИЭА: диизопропилэтиламин; ДМАП: 4-(диметиламино)пиридин; ДМСО: диметилсульфоксид; ДМФ: N,N-диметилформамид;Et2O: диэтиловый эфир; ЖХВР: жидкостная хроматография высокого разрешения;UTP: уридина 5'-трифосфат; ИПА: изопропилацетат; Примеры 1-22 иллюстрируют способы синтеза наиболее типичных соединений согласно настоящему изобретению. Метиловый эфир 3-амино-4-иодобензойной кислоты. 3-Амино-4-иодобензойную кислоту (13,35 г, 50,8 ммоль) добавляют к МеОН (150 мл), затем добавляют SOCl2 (4,8 мл, 65,8 ммоль, 1,3 эквивалента). Полученную смесь кипятят с обратным холодильником в течение 3 ч и затем летучие удаляют при пониженном давлении. Полученный остаток три раза подвергают упариванию с МеОН и высушивают в вакууме (15,23 г). Метиловый эфир 3-трифторацетамидо-4-иодобензойной кислоты. Производное анилина, полученное как описано выше (14,53 г, 52 ммоль), растворяют в ДХМ (200 мл) и добавляют ТФУА (15 мл, 104 ммоль). Темно-фиолетовый раствор кипятят с обратным холодильником в течение ночи. Летучие удаляют при пониженном давлении и полученный остаток пропускают через небольшой слой силикагеля, используя в качестве элюента ДХМ. Целевой продукт получают в виде розового твердого вещества (13,81 г). Метиловый эфир 4-фенилэтинил-3-(2,2,2-трифорэтаноламино)бензойной кислоты. Иодид, полученный как описано выше (0,742 г, 2 ммоль), фенилацетилен (0,37 мл, 3,9 ммоль, 1,7 эквивалента) и Et3N (6 мл) помещают в сухую колбу в атмосфере аргона. Добавляют PdCl2(PPh3)2 (0,241 г, 0,3 ммоль) и полученную смесь перемешивают при комнатной температуре до завершения реакции,определяемого анализом методом ЖХВР (5 ч). Реакционную смесь при пониженном давлении концентрируют до половины объема и разбавляют водой (80 мл). Смесь экстрагируют, используя EtOАс (3 х 100 мл), и после этого органический экстракт промывают 5% раствором НСl (100 мл), затем (100 мл) и насыщенным раствором соли (40 мл). После высушивания над MgSO4 полученный остаток очищают экспресс-хроматографией, используя в качестве элюента 20% EtOАс-гексан и получая при этом целевой алкин-продукт кросс-сочетания в виде желто-коричневого твердого вещества (0,442 г). Метиловый эфир 3-(циклогексенил)-2-фенилиндол-6-карбоновой кислоты. В высушенную при сильном накаливании колбу помещают тонкоизмельченный безводный K2 СО 3(0,153 г, 1,1 ммоль) и алкиновое производное (0,390 г, 1,1 ммоль), полученно как описано выше. Добавляют сухой ДМФ (4 мл) и дегазируют суспензию, пропуская аргон. Добавляют трифлат енола, полученный из циклогексанона (0,802 г, 3,3 ммоль, 3 эквивалента), это соединение получают в соответствии с методикой, описанной в статье A.G. Martinez, M. Hanack et al. J. Heterocyclic Chem., 1988, v. 25, p. 1237,или используя эквивалентные методы, описанные в литературе, затем добавляют Pd(PPh3)4 (0,086 г, 0,07 ммоль) и перемешивают полученную смесь в течение 8 ч при комнатной температуре. ДМФ удаляют под вакуумом, а полученный остаток очищают методом экспресс-хроматографии, используя в качестве элюента ДХМ (0,260 г). Метиловый эфир 3-циклогексил-2-фенилиндол-6-карбоновой кислоты. Соединение, полученное как описано выше, гидрируют обычным образом (газообразный H2, 1 атм) над 20% Pd(OH)2, используя МеОН в качестве растворителя. Целевой циклогексаниндол выделяют, отфильтровав катализатор. 3-Циклогексил-2-фенилиндол-6-карбоновая кислота. Сложный метиловый эфир, полученный как описано выше (0,154 г, 0,15 ммоль), кипятят с обратным холодильником в течение ночи в смеси МеОН (10 мл) и 2 н раствора NaOH (6 мл), до тех пор пока не пройдет полностью гидролиз, окончание которого определяют методом ЖХВР. После охлаждения до комнатной температуры добавляют 2 н раствор НСl (5 мл), а затем АсОН до рН 7. МеОН удаляют при пониженном давлении, добавляют воду (50 мл), и экстрагируют продукт, используя EtOАс. Экстракт промывают водой и насыщенным раствором соли и высушивают (MgSO4). После удаления летучих при пониженном давлении получают указанную в названии индолкарбоновую кислоту в виде светлооранжевого твердого вещества (0,149 г).- 19007722 По той же самой методике, но используя 2-этинилпиридин вместо фенилацетилена, получают 3 циклогексан-2-(2-пиридил)индол-6-карбоновую кислоту. Пример 2 3-Циклогексенил-6-индолкарбоновая кислота. Круглодонную колбу емкостью 12 л оборудуют дефлегматором и механической мешалкой и эту систему продувают газообразным азотом. В колбу помещают 6-индолкарбоновую кислоту (300,00 г, 1,86 моль, 3 эквивалента), а затем МеОН (5,5 л). После перемешивания в течение 10 мин при комнатной температуре добавляют циклогексанон (579 мл, 5,58 моль). Затем порциями в течение 10 мин добавляют метоксид натрия в метаноле (25% мас/мас, 2,6 л, 11,37 моль, 6,1 эквивалента). После этого смесь кипятят с обратным холодильником в течение 48 ч. После охлаждения до комнатной температуры добавляют воду (4 л) и удаляют метанол при пониженном давлении. Оставшуюся водную фазу подкисляют до рН 1 концентрированной НСl (1,2 л). Полученный желтоватый осадок собирают фильтрацией, промывают водой и высушивают под вакуумом при 50 С. Целевое циклогексановое производное получают в виде серовато-желтого твердого вещества (451,0 г, выход 100%). 3-Циклогексил-6-индолкарбоновая кислота. Ненасыщенное производное, полученное как описано выше, гидрируют в течение 20 ч при давлении газообразного водорода 55 фунт/кв.дюйм над 20% Pd(OH)2/C (10,25 г), используя в качестве растворителя смесь ТГФ-МеОН (2,5 л) в соотношении 1:1. После того, как катализатор отфильтрован, летучие удаляют при пониженном давлении, и остаток растирают с гексаном. Желтовато-коричневое твердое вещество собирают фильтрацией, промывают гексаном и высушивают под вакуумом (356,4 г, выход 78%). Метиловый эфир 3-циклогексил-6-индолкарбоновой кислоты. Трехгорлую колбу емкостью 5 л оборудуют обратным холодильником и механической мешалкой и продувают систему газообразным азотом. Индолкарбоновую кислоту, полученную как описано выше(300,00 г, 1,233 моль), помещают в колбу и суспендируют в МеОН (2 л). Добавляют по каплям тионилхлорид (5 мл, 0,0685 моль, 0,05 эквивалента) и кипятят смесь с обратным холодильником в течение 48 ч. Летучие удаляют при пониженном давлении, а остаток растирают с гексаном, для того чтобы получить желтовато-коричневое твердое вещество, которое промывают гексаном и высушивают под вакуумом(279,6 г, выход 88%). Метиловый эфир 2-бромо-3-циклогексил-6-индолкарбоновой кислоты. Применяя методику, описанную в статье L. Chu, Tet. Lett., 1997, v.38, p. 3871, растворяют метиловый эфир 3-циклогексил-6-индолкарбоновой кислоты (4,65 г, 18,07 ммоль) в смеси ТГФ (80 мл) и СНСl3(80 мл). Полученный раствор охлаждают на бане со льдом и добавляют пербромид пиридинийбромида(200 мл), промывают 1 М раствором NaHSO3 (2 х 50 мл), насыщенным водным раствором NaHCO3 (2 х 50 мл) и насыщенным раствором соли (50 мл). После высушивания над Na2SO4 растворитель удаляют при пониженном давлении, а остаток перекристаллизовывают из смеси ТБМЭ-гексан. Целевое 2 броминдольное производное собирают фильтрацией, промывают гексаном и высушивают (3,45 г). После упаривания маточной жидкости получают красное твердое вещество, которое очищают экспрессхроматографией, используя 15% EtOАс в гексане и получая при этом дополнительно 3,62 г чистого соединения. Суммарный выход составляет 5,17 г (выход 85%). Пример 3. Общая методика проведения реакции Сузуки-кросс-сочетания арилзамещенных и гетероарилзамещенных бороновых кислот с 2-броминдольными производными. Кросс-сочетание ароматических/гетероароматических бороновых кислот или сложноэфирных производных с 2-броминдолами, такими, например, как описанное в примере 2 соединение, может быть осуществлено при использовании любых модификаций катализируемой металлами обычной реакции Сузуки-реакции кросс-сочетания, которая описана в литературе и хорошо известна специалистам в данной области техники. Приведенные далее примеры служат для иллюстрации таких способов и не ограни- 20007722 чивают объем настоящего изобретения. Метиловый эфир 3-циклогексил-2-фуран-3-ил-1 Н-индол-6-карбоновой кислоты.LiCl (2,25 г, 53 ммоль, 2 эквивалента) растворяют в смеси EtOH (100 мл) и толуола (100 мл). Добавляют 1 М водный раствор Na2CO3 (66 мл, 66 ммоль) и дегазируют смесь аргоном в течение 45 мин. ДобавляютPd(PPh3)4 (3,06 г, 2,65 ммоль, 0,1 эквивалента) и перемешивают смесь в течение ночи при 75-85 С в атмосфере аргона. Летучие удаляют при пониженном давлении, а остаток повторно растворяют в EtOАс(500 мл). Раствор промывают водой, насыщенным NaHCO3 (100 мл) и насыщенным раствором соли (100 мл). После высушивания над смесью MgSO4 и обесцвечивания активированным углем смесь фильтруют и концентрируют при пониженном давлении. Маслянистый остаток растирают со смесью ТБМЭ (20 мл) и гексана (40 мл), охлаждают на льду и собирают фильтрацией выпавшее в осадок твердое вещество,которое промывают холодным 25% ТБМЭ в гексане и высушивают (3,09 г). Фильтрат и промывочную жидкость, полученную при указанной выше фильтрации, объединяют, концентрируют и очищают экспресс-хроматографией, используя 10-25% EtOАс в гексане и получая при этом дополнительно 4,36 г продукта. Суммарный выход 2-(3-фурил)индола, полученного в соответствии с примером 3, составляет 8,25 г. Пример 4 Метиловый эфир 3-циклогексил-1-метил-6-индолкарбоновой кислоты. Метиловый эфир 3-циклогексил-6-индолкарбоновой кислоты, полученный согласно примеру 2(150,00 г, 0,583 моль), помещают в трехгорлую колбу емкостью 3 л, снабженную механической мешалкой, и продувают газообразным азотом. Добавляют ДМФ (1 л), после чего раствор охлаждают на бане со льдом. Добавляют небольшими порциями (15 мин) NaH (60% дисперсия в масле, 30,35 г, 0,759 моль, 1,3 эквивалента) и перемешивают смесь в течение 1 ч на холоде. Добавляют небольшими порциями иодметан (54,5 мл, 0,876 моль, 1,5 эквивалента), поддерживая температуру внутри колбы между 5 и 10 С. Затем реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакцию останавливают, выливая реакционную смесь в ледяную воду (3 л), в результате чего образуется осадок кремового цвета. Полученное вещество собирают фильтрацией, промывают водой и высушивают в вакууме при 45 С (137,3 г, выход 86%). Метиловый эфир 2-бромо-3-циклогексил-1-метил-6-индолкарбоновой кислоты. Производное 1-метилиндола, полученное как описано выше (136,40 г, 0,503 моль), помещают в трехгорлую колбу емкостью 5 л, снабженную механической мешалкой, и продувают газообразным азотом. Добавляют небольшими порциями СНСl3 (750 мл) и ТГФ (750 мл) и охлаждают раствор до 0 С. Затем добавляют трибромид пиридина (пербромид пиридинийбромида, 185,13 г, 0,579 моль, 1,15 эквивалента) и перемешивают смесь в течение 1 ч при 0 С. Растворитель удаляют при пониженном давлении при комнатной температуре, а остаток растворяют в EtOAc (3 л). Раствор промывают водой и насыщенным раствором соли, высушивают (обесцвечивание активированным углем/MgSO4) и концентрируют при пониженном давлении. Остаток суспендируют в ТБМЭ и нагревают до 50 С. Суспензию выдерживают в течение ночи в холодильнике и полученный кристаллический продукт кремового цвета собирают фильтрацией. Этот продукт промывают, используя ТБМЭ, и высушивают в вакууме (134,3 г, выход 76%). Производное броминдола, полученное в соответствии с примером 4 (2,70 г, 7,71 ммоль), растворяют в сухом ТГФ (40 мл) и охлаждают раствор до -78 С в атмосфере аргона. Добавляют по каплям в течение 15 мин раствор н-BuLi в гексане (1,4 М, 6,90 мл, 9,64 ммоль, 1,25 эквивалента) и продолжают перемешивание при низкой температуре в течение 75 мин. К полученной суспензии добавляют в течение 5 мин н-Bu3SnCl (2,93 мл, 10,8 ммоль, 1,4 эквивалента). Суспендированное вещество растворяется, и полученный раствор перемешивают в течение 1 ч при -78 С. Реакционную смесь нагревают до комнатной температуры и затем удаляют ТГФ при пониженном давлении. Остаток растворяют в ТБМЭ (150 мл),промывают, используя смесь: насыщенный раствор соль - вода в соотношении 1:1, высушивают надMgSO4. Полученное соединение очищают хроматографией на силикагеле, который предварительно деактивируют смешением с 5% раствором Et3N в гексане. Этот же растворитель используют в качестве элюента для хроматографии. Указанный в заголовке станнан выделяют в виде желтого маслянистого веществ(3,42 г, выход 79%). Пример 6. Общая методика проведения реакции Штилле - кросс-сочетания 2-станнаниндола, полученного согласно примеру 5, с ароматическими/гетероароматическими галогенидами. Кросс-сочетание ароматических/гетероароматических галогенидов или псевдогалогенидов (предпочтительно бромидов, иодидов и трифлатов) с производным станнана, полученным в соответствии с примером 5, может быть осуществлено при использовании каких-либо модификаций общепринятой катализируемой металлом реакции Штилле - реакции кросс-сочетания, как описано в литературе. Приведенные ниже примеры служат для иллюстрации такого способа синтеза. Метиловый эфир 3-циклогексил-1-метил-2-пиридин-2-ил-1 Н-индол-6-карбоновой кислоты Производное станнана, полученное в соответствии с примером 5 (3,42 г, 6,1 ммоль), растворяют в ДМФ (10 мл) и добавляют CuI (0,116 г, 0,61 ммоль, 0,1 эквивалента), LiCl (0,517 г, 12,21 ммоль, 2 эквивалента), трифенилфосфин (0,320 г, 1,22 ммоль, 0,2 эквивалента) и 2-бромпиридин (0,757 мл, 7,94 ммоль,1,3 эквивалента). Раствор дегазируют током аргона (30 мин) и добавляют Pd(PPh3)4 (0,352 г, 0,31 ммоль,0,05 эквивалента). После пропускания азота дополнительно в течение 10 мин раствор нагревают и перемешивают в атмосфере аргона при 100 С в течение ночи. Затем ДМФ удаляют под вакуумом, а остаток растворяют в EtOАс (150 мл). Раствор промывают 1 Н раствором NaOH (25 мл) и насыщенным раствором соли (25 мл), затем высушивают над MgSO4. Растворитель удаляют при пониженном давлении, а остаток очищают экспресс-хроматографией,используя в качестве элюента СНСl3, а затем 5-10% EtOАс в СНСl3 (1,516 г, выход 71%). Пример 7. Общая методика проведения реакции Штилле - кросс-сочетания 2-броминдолов с арилили гетероарилстаннанами. Метиловый эфир 3-циклогексил-1-метил-2-пиридин-2-ил-1 Н-индол-6-карбоновой кислоты Производное 2-броминдола, полученное в соответствии с примером 4 (0,150 г, 0,428 ммоль), и 2 триметилстаннилтиофен (S.F. Thames et al. J. Organometal. Chem., 1972, v. 38, p. 29; 0,150 г, 0,61 ммоль,1,4 эквивалента) растворяют в сухом ТГФ (7 мл) в герметично закрытой пробирке и дегазируют раствор,пропуская ток аргона в течение 30 мин. Добавляют Pd(Сl)2(PPh3)2 (0,018 г, 0,026 ммоль, 0,06 эквивалента) и герметично закрывают пробирку. Полученный раствор нагревают до 80 С в течение 40 ч. Реакционную- 22007722 смесь охлаждают до комнатной температуры, добавляют EtOАс (10 мл) и фильтруют суспензию. После упаривания растворителя остаток повторно обрабатывают в указанных выше условиях реакции дополнительно в течение 20 ч, используя свежие 2-станнилтиофен (0,150 г, 0,61 ммоль) и катализатор (0,020 г). После охлаждения до комнатной температуры, отфильтровав твердые вещества, растворитель упаривают, а остаток очищают экспресс-хроматографией, используя в качестве элюента 15-100% СНСl3 в гексане (0,133 г, выход 88%). Такая же методика может быть использована для взаимодействия станнанпроизводного с 2 броминдолом, полученным согласно примеру 2. Пример 8. Общая методика проведения N-алкилирования 2-арил и 2-гетероарил-6-индолкарбоксилатов. Метиловый эфир 3-циклогексил-1-метил-2-пиридин-2-ил-1 Н-индол-6-карбоновой кислотыNaH (60% дисперсия в масле, 0,186 г, 4,64 ммоль, 1,5 эквивалента) промывают гексаном (20 мл) для того, чтобы удалить масло и затем повторно суспендируют в ДМФ (5 мл). После охлаждения до 0 С на бане со льдом производное индола (1,000 г, 3,09 ммоль), полученное в соответствии с примером 3, добавляют по каплям в виде раствора в ДМФ (3 мл + 2 мл для промывки). После перемешивания в течение 15 мин добавляют в один прием иодметан (0,385 мл, 6,18 ммоль, 2 эквивалента) и перемешивают смесь в течение 2 ч на холоде и дополнительно 2 ч при комнатной температуре. Затем реакцию останавливают добавлением 1 Н раствора НСl (1 мл), после чего разбавляют, используя ТБМЭ (100 мл). Раствор промывают 1 Н раствором НС 1 (25 мл) и высушивают (MgSO4). После удаления летучих при пониженном давлении полученный остаток очищают методом экспресс-хроматографии, используя в качестве элюента 510% EtOАс в гексане, получая при этом указанное в заголовке соединение в виде белого твердого вещества (0,903 г, выход 86%). Другие N-алкилиндольные производные, входящие в объем настоящего изобретения, могут быть получены при использовании аналогичной методики из подходящих электрофилов (например, таких какEtI,изо-PrI, изо-BuI, BnBr). Пример 9. Общая методика проведения омыления 6-индолкарбоксилатов с получением соответствующих свободных карбоновых кислот. Эту методику используют как для индолзамещенных, так и для N-метилиндолзамещенных карбоксилатов. 3-Циклогексил-1 -метил-2-пиридин-2-ил-1 Н-индол-6-карбоновая кислота 6-Индолкарбоксилат, полученный в соответствии с примером 6 (1,517 г, 4,35 ммоль), растворяют в ДМСО (8 мл) и добавляют 5 н раствор NaOH (4,4 мл). Смесь перемешивают при 50 С в течение 30 мин. После этого раствор охлаждают до комнатной температуры и добавляют по каплям в воду (15 мл). Нерастворившиеся примеси черного цвета удаляют фильтрованием, затем к фильтрату добавляют по каплям АсОН (2 мл). Образовавшийся белый осадок собирают фильтрацией, промывают водой и высушивают (1,37 г, выход 94%). Пример 10. 1-Циклогексил-2-фенил-1 Н-индол-5-карбоновая кислота- 23007722 Этиловый эфир 4-амино-3-иодобензойной кислоты. Этиловый эфир 4-аминобензойной кислоты (15,00 г, 91 ммоль) и иод (11,80 г, 46,5 ммоль) смешивают с водой (80 мл) и хлорбензолом (4,60 г, 41 ммоль). Смесь перемешивают в течение 30 мин, в это время температура постепенно повышается до 90 С. Добавляют в течение 10 ч при 90 С пероксид водорода (30%, 50 мл). После перемешивания при указанной температуре дополнительно в течение 6 ч смесь охлаждают и раствор отделяют декантированием от оставшегося твердого вещества. Твердое вещество растворяют в ДХМ и последовательно промывают раствором тиосульфата натрия и насыщенным раствором соли. После высушивания (MgSO4) растворитель удаляют при пониженном давлении, а полученное коричневое твердое вещество растирают с гексаном для того, чтобы удалить дииодированные побочные продукты. Целевое соединение получают в виде коричневого твердого вещества (22,85 г, выход 86%). Этиловый эфир 4-ацетамидо-3-иодобензойной кислоты. Производное анилина (1,00 г, 3,44 ммоль), полученное как описано выше, растворяют в пиридине (5 мл) и охлаждают раствор на льду. Добавляют по каплям АсСl (0,32 мл, 4,47 ммоль, 1,3 эквивалента), затем смесь перемешивают в течение 1 ч при 0 С и в течение 2 ч при комнатной температуре. Затем реакционную смесь разбавляют 1 Н раствором НСl и экстрагируют продукт, используя ТБМЭ (100 мл). Органическую фазу промывают 1 Н раствором НСl (50 мл), высушивают (MgSO4) и концентрируют, получая при этом целевое соединение в виде твердого вещества рыжевато-коричневого цвета (1,121 г, выход 97%). Этиловый эфир 2-фенил-индол-5-карбоновой кислоты. В соответствии с методикой, описанной в статье A. Bedeschi et al. Tet. Lett., 1997, v.38, 2307, ацетанилидное производное, полученное как описано выше (0,900 г, 2,7 ммоль), подвергают взаимодействию с фенилацетиленом (0,385 мл, 3,5 ммоль, 1,3 эквивалента) в присутствии PdCl2(PPh3)2 (10 мольных%) иCuI (10 мольных%) в смеси диоксана (5 мл) и тетраметилгуанидина (5 мл). Целевой 2-фенилиндол (0,589 г, выход 82%) выделяют в виде твердого желтого вещества после проведения экспресс-хроматографии с использованием 15% EtOАс в гексане. Этиловый эфир 1-циклогекс-1-енил-2-фенил-1 Н-индол-5-карбоновой кислоты. 2-Фенилиндольное производное, полученное как описано выше (0,265 г, 1,0 ммоль), растворяют в ДМФ (2 мл) и добавляют моногидрат гидрохлорида цезия (0,208 г, 1,2 ммоль, 1,2 эквивалента). Полученный раствор охлаждают на бане со льдом и добавляют по каплям (5 мин) 3-бромоциклогексен (0,193 г,1,2 ммоль, 1,2 эквивалента) в виде раствора в ДМФ (1 мл). Смесь перемешивают в течение 30 мин при 0 С. Реакционную смесь разбавляют водой (25 мл), экстрагируют, используя Et2O (2 х 50 мл), полученный экстракт высушивают над MgSO4. Растворитель упаривают при пониженном давлении, получая при этом белое вспененное вещество (0,095 г), которое используют на следующей стадии без дополнительной очистки. 1-Циклогексил-2-фенил-1 Н-индол-5-карбоновая кислота. Индол, полученный как описано выше, без проведения очистки, гидрируют обычным образом (газообразный H2, 1 атм) в EtOН над 20% Pd(OH)2 на углероде в течение 20 ч при комнатной температуре. После того, как катализатор отфильтрован, ЕtOН удаляют при пониженном давлении. Остаток растворяют в смеси МеОН (1 мл) и ДМСО (1 мл) и добавляют 5 Н раствор NaOH (0,5 мл). Смесь перемешивают в течение ночи при 50 С. Реакционную смесь охлаждают и добавляют воду (10 мл). После подкисления 1 Н раствором НСl, продукт подвергают экстракции в Et2O (70 мл) и высушивают раствор (Na2SO4). После упаривания растворителя получают остаток зеленого цвета, состоящий из смеси (85 мг) целевой 1-циклогексил-2-фенилиндол-5-карбоновой кислоты и 1,3-дициклогексил-2 фенилиндол-5-карбоновой кислоты в соотношении 2:1. Пример 11. 1-Циклогексил-3-метил-2-фенил-1 Н-индол-5-карбоновая кислота- 24007722 Раствор дегазируют, пропуская аргон в течение 1 ч и добавляют ацетат палладия (0,039 г, 0,17 ммоль, 0,1 эквивалента). Смесь перемешивают при 80 С в атмосфере аргона в течение 20 ч. Реакционную смесь разбавляют водой (25 мл) и экстрагируют, используя EtOAc (50 мл). Экстракт промывают насыщенным раствором соли (3 х 25 мл) и высушивают (MgSO4). Концентрирование при пониженном давлении и очистка экспресс-хроматографией с использованием в качестве элюента системы 10-15% EtOАс-гексан позволяет получить целевой 2-фенил-3-метил индол (0,275 г,наименее полярный компонент) и 3-фенил-2-метилзамещенный изомер (0,109 г, более полярный компонент). Этиловый эфир 1-(3-циклогексенил)-3-метил-2-фенилиндол-5-карбоновой кислоты. Менее полярный изомер, полученный как описано выше (0,264 г, 0,95 ммоль), растворяют в ДМСО(2 мл) и добавляют моногидрат гидроксида цезия (0,191 г, 1,14 ммоль, 1,2 эквивалента), а затем 3 бромоциклогексен (0,183 г, 1,14 ммоль, 1,2 эквивалента в 0,7 мл ДМСО). Полученную смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют дополнительное количество моногидратаCsOH (0,400 г, 2,4 эквивалента) и 3-бромоциклогексена (0,400 г, 2,4 эквивалента), после чего продолжают перемешивание дополнительно в течение 30 мин. То же количество этих двух реагентов добавляют еще раз, и после дополнительного перемешивания в течение 30 мин при комнатной температуре реакционную смесь разбавляют 1 Н раствором НСl (6 мл) и водой (20 мл). Продукт экстрагируют, используя ТБМЭ (100 мл), высушивают (MgSO4) и после концентрирования при пониженном давлении полученный остаток очищают экспресс-хроматографией, используя 5-10% EtOАс в гексане, получая при этом целевой N-алкилированный индол (0,130 г). Этиловый эфир 1-циклогексил-3-метил-2-фенилиндол-5-карбоновой кислоты. Ненасыщенный продукт, полученный как описано выше, гидрируют (газообразный H2, 1 атм) обычным образом над 20% Pd(OH)2 в EtOH при комнатной температуре в течение 3 ч. 1-Циклогексил-3-метил-2-фенил-1 Н-индол-5-карбоновая кислота. Гидрированный продукт, полученный как описано выше, растворяют в смеси ДМСО (2 мл) и МеОН(2 мл). Добавляют 5 Н раствор NaOH (0,5 мл) и полученную смесь перемешивают в течение ночи при 60 С. После разбавления водой (40 мл) водную фазу, содержащую продукт, промывают смесью Et2Oгексан в соотношении 1:1 (50 мл), после чего подкисляют 1 Н раствором НСl до рН 1. Высвобожденную свободную кислоту экстрагируют диэтиловым эфиром (2 X 50 мл), полученный экстракт высушивают над Na2SO4. После удаления растворителя при пониженном давлении получают целевой индол в виде светло-коричневого твердого вещества (0,074 г). Пример 12. Метиловый эфир 2-бром-3-циклопентил-1 -метил-1 Н-индол-6-карбоновой кислоты В трехгорлую колбу емкостью 3 л, снабженную механической мешалкой, помещают индол-6 карбоновую кислоту (220 г, 1,365 моль) и гранулы KОН (764,45 г, 13,65 моль, 10 эквивалентов). Добавляют воду (660 мл) и МеОН (660 мл) и нагревают смесь до 75 С. Добавляют по каплям в течение 18 ч циклопентанон (603,7 мл, 6,825 моль, 5 эквивалентов), используя насос. Реакционную смесь нагревают в течение дополнительных 3 ч (после чего, по данным ЖХВР, реакция полностью завершается) и охлаждают до 0 С в течение 1 ч. Выпавшую в осадок соль калия собирают фильтрованием, после чего промывают, используя ТБМЭ (2 х 500 мл) для того, чтобы удалить продукты автоконденсации циклопентанона. Полученное коричневое твердое вещество повторно растворяют в воде (2,5 л), после чего промывают раствор, используя ТБМЭ (2 х 1 л). После подкисления концентрированной НСl (425 мл) до рН 3 полученный осадок серовато-желтого цвета собирают фильтрацией, промывают водой (2 х 1 л) и высушивают под вакуумом при 70 С. Масса неочищенного продукта составляет 275,9 г (88,9% выход по массе), а гомогенность - 85% (ЖХВР). Продукт, полученный как описано выше, без проведения очистки (159,56 г, 0,70 моль), растворяют в МеОН (750 мл) и добавляют 20% Pd(OH)2 на углероде (8,00 г). Смесь гидрируют в аппарате Парра при давлении водорода 50 фунт/кв. дюйм в течение 18 ч. После завершения гидрирования катализатор удаляют фильтрованием через целит, а растворитель отгоняют при пониженном давлении. Полученное коричневое твердое вещество высушивают при 70 С под вакуумом в течение 12 ч. Продукт без очистки(153,2 г) получают в виде коричневого твердого вещества, его гомогенность по данным ЖХВР составляет 77%. Неочищенную 3-циклопентилиндол-6-карбоновую кислоту (74,00 г, 0,323 моль) помещают в трех- 25007722 горлую колбу емкостью 3 л, снабженную механической мешалкой и термометром. Систему продувают газообразным азотом и добавляют безводный ДМФ (740 мл). После растворения исходного соединения добавляют безводный карбонат натрия (66,91 г, 0,484 моль, 1,5 эквивалента) и перемешивают смесь в течение 5 мин. Добавляют подметан (50 мл, 0,807 моль, 2,5 эквивалента), затем перемешивают смесь в течение 5 ч, в результате чего по данным анализа методом ЖХВР наблюдается 97% конверсия в сложный метиловый эфир. Реакционную смесь охлаждают на бане со льдом и добавляют небольшими порциями в течение 3 мин гидрид натрия (95%, не содержит примеси масла, 10,10 г, 0,420 моль, 1,3 эквивалента) (процесс экзотермичен: температура внутри колбы повышается от 8 до 30 С). После перемешивания в течение дополнительных 15 мин охлаждающую баню убирают и продолжают перемешивание в течение 1,5 ч при комнатной температуре, после чего дальнейшее протекание реакции прекращается (по данным ЖХВР). Добавляют дополнительное количество NaH (1,55 г, 65 ммоль, 0,2 эквивалента) и подметана (1,0 мл, 16 ммоль, 0,05 эквивалента), и после перемешивания в течение 15 мин реакция, по данным ЖХВР, полностью завершается (96% N-метилирования). Реакционную смесь медленно при энергичном перешивании (2 мин) выливают в воду (4 л) и через 10 мин подкисляют до рН 2 концентрированной НСl (85 мл). Смесь перемешивают в течение 5 мин для того, чтобы завершить превращение какого-либо оставшегося количества карбоната и бикарбоната калия в более растворимый хлорид. Значение рН доводят до 7-4 Н раствором NaOH (40 мл) и перемешивают смесь в течение ночи при комнатной температуре. Выпавшее в осадок вещество собирают фильтрацией,промывают водой (600 мл) и высушивают при 60 С под вакуумом. Продукт без проведения очистки(79% гомогенность по данным ЖХВР) получают в виде коричневого твердого вещества (72,9 г). Неочищенное вещество, полученное как описано выше, растирают с минимальным количеством МеОН для того, чтобы удалить незначительное количество примесей. Затем твердое вещество собирают фильтрацией и растворяют в минимальном количестве горячего EtOАс. После охлаждения до комнатной температуры добавляют гексан (5 хобъем) и охлаждают смесь на льду, затем отфильтровывают. После этого фильтрат упаривают досуха, получая целевой продукт.N-метилиндол (10,60 г, 41,2 ммоль), полученный как описано выше, растворяют в изопропилацетате (150 мл) и добавляют ацетат натрия (5,07 г, 62 ммоль, 1,5 эквивалента). Охлаждают суспензию на бане со льдом и добавляют по каплям в течение 2 мин бром (2,217 мл, 43,3 ммоль, 1,05 эквивалента). Суспензия бледного янтарного цвета изменяет свою окраску на темно-красную (экзотермический процесс: нагрев от 5 до 13 С). Суспензию перемешивают в течение 1 ч при 0 С. Реакция полностью завершается при добавлении дополнительного количества брома (0,21 мл, 4,2 ммоль, 0,10 эквивалента), о чем свидетельствуют данные анализа методом ЖХВР. После этого реакцию останавливают добавлением 10% водного раствора сульфита натрия (15 мл), а затем воды (50 мл) и K2CO3 (10,6 г, 1,8 эквивалента) для того, чтобы нейтрализовать НВr. Органический слой отделяют, промывают 10% водным раствором сульфита натрия и водным раствором K2CO3, затем высушивают (MgSO4). Растворитель удаляют при пониженном давлении и подвергают остаток совместному упариванию с ТБМЭ (75 мл) с получением серовато-желтого твердого вещества, которое высушивают под вакуумом в течение ночи (13,80 г). Неочищенное вещество растирают с кипящим МеОН (80 мл) в течение 30 мин, охлаждают на льду и собирают серовато-желтое твердое вещество фильтрованием. Полученный продукт высушивают при 60 С под вакуумом (10,53 г,выход 76%). Пример 13. 3-Циклопентил-1-метил-2-винил-1 Н-индол-6-карбоновая кислота К производному 2-броминдола, полученному в соответствии с примером 12 (2,044 г, 6,08 ммоль), в сухом диоксане (20 мл) добавляют винилтрибутилолово (1,954 мл, 6,69 ммоль). Раствор дегазируют,барботируя азот в течение 15 мин. Затем добавляют бис(трифенилфосфин)палладий (II) хлорид (213,4 мг,0,304 ммоль) и нагревают реакционную смесь при 100 С в течение ночи. Реакционную смесь разбавляют эфиром и последовательно промывают водой и насыщенным раствором соли. После обычной обработкиAcOEt-гексан), получая целевое соединение (1,32 г, 4,70 ммоль, выход 77%) в виде белого твердого вещества. К сложному эфиру (153 мг, 0,54 ммоль), полученному как описано выше, в смеси ТГФ (2,8 мл) и метанола (1,4 мл) добавляют водный раствор гидроксида лития (226,6 мг, 5,40 ммоль в 1,6 мл воды). Реакционную смесь перемешивают при 50 С в течение 1,5 ч и разбавляют водой. Водный слой подкисляют 1 М водным раствором НСl и три раза экстрагируют, используя CH2Cl2, объединенные органические слои последовательно промывают водой (2 X) и насыщенным раствором соли. После обычной обработки(MgSO4, фильтрация и концентрирование) выделяют целевую неочищенную кислоту (150 мг). К бромиду (1,00 г, 2,855 ммоль), полученному в соответствии с примером 4, в сухом диоксане (10 мл) добавляют винилтрибутилолово (917,8 мкл, 3,141 ммоль). Раствор дегазируют, барботируя через него азот в течение 15 мин. Затем добавляют бис(трифенилфосфин)палладий (II) хлорид (101 мг, 0,144 ммоль) и кипятят раствор с обратным холодильником в течение 7 ч. Реакционную смесь разбавляют этиловым эфиром и последовательно промывают водой и насыщенным раствором соли. После обычной обработки (MgSO4,фильтрация и концентрирование) остаток подвергают экспресс-хроматографии (5 см, градиент: гексан 2,5% AcOEt - 5% AcOEt - 10% AcOEt-гексан), получая целевое соединение (773 мг, 2,60 ммоль, выход 91%) в виде бледно-желтого твердого вещества. К олефиновому производному (100 мг, 0,336 ммоль), полученному как описано выше, в смеси ацетона, (690 мкл), трет-бутанола (690 мкл) и воды (690 мкл) последовательно добавляют Nметилморфолин-N-оксид (NMMO; 48 мг, 0,410 ммоль) и 2,5% раствор тетраоксида осмия в трет-бутаноле(33 мкл). Реакционную смесь перемешивают при комнатной температуре в течение трех дней и затем концентрируют. Остаток растворяют в EtOАс и последовательно промывают водой (2 X) и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и концентрирование) выделяют неочищенный диол (117 мг). К неочищенному диолу (приблизительно 0,336 ммоль), полученному как указано выше, в смеси ТГФ (3,2 мл) и воды (3,2 мл) при 0 С добавляют периодат натрия (86,2 мг, 0,403 ммоль). Охлаждающую баню затем убирают и перемешивают реакционную смесь при комнатной температуре в течение 1 ч 45 мин. Затем добавляют AcOEt. Полученный раствор последовательно промывают 10% водным раствором лимонной кислоты, водой, насыщенным водным раствором NaHCO3, водой (2 X) и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и концентрирование) выделяют целевой неочищенный альдегид (92 мг, 0,307 ммоль, выход 91%). Смесь альдегида (25,8 мг, 0,086 ммоль), полученного как описано выше, безводного карбоната натрия (12,4 мг, 0,090 ммоль) и Tosmic (паратолуолсульфонилметилизоцианид, 17,57 мг, 0,090 ммоль) в абсолютном МеОН (500 мкл) кипятят с обратным холодильником в течение 2 ч. Затем добавляют AcOEt и смесь последовательно промывают водой (2 X) и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и .концентрирование) выделяют целевой неочищенный оксазол (28 мг, 0,083 ммоль, выход 96%). К сложному эфиру, полученному как описано выше (28 мг, 0,083 ммоль), в смеси ТГФ (425 мкл),МеОН (210 мкл) с водой (250 мкл) добавляют гидроксид лития (34,8 мг, 0,830 ммоль). Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем разбавляют водой и подкисляют 1 Н водным раствором НСl. Водный слой экстрагируют дихлорметаном (3 X) и последовательно промывают водой (2 X) и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и концентрирование) выделяют указанную в заголовке неочищенную кислоту (30 мг). Пример 15. 2-(1 Н-бензимидазол-2-ил)-3-циклогексил-1-метил-1 Н-индол-6-карбоновая кислота К смеси альдегида, полученного согласно примеру 14 (28 мг, 0,094 ммоль), и 1,2-диаминобензола(10,9 мг, 0,101 ммоль) в ацетонитриле (500 мкл) и ДМФ (200 мкл) добавляют хлоранил (24,8 мг, 0,101 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение трех дней. ДобавляютAcOEt и реакционную смесь последовательно промывают 1 Н водным раствором NaOH (2 X), водой(4 X) и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и концентрирование) остаток подвергают экспресс-хроматографии (1 см, 30% AcOEt-гексан), получая при этом целевое производное бензимидазолзамещенного сложного эфира (11 мг, 0,028 ммоль, выход 30%). К сложному эфиру, полученному как описано выше (11 мг, 0,028 ммоль), в смеси с ТГФ (240 мкл),МеОН (120 мкл) и водой (140 мкл) добавляют гидроксид лития (11,7 мг, 0,280 ммоль). Реакционную- 27007722 смесь перемешивают в течение ночи при комнатной температуре, затем разбавляют водой и подкисляют 1 Н водным раствором НСl. Водный слой экстрагируют дихлорметаном (3 X) и последовательно промывают водой (2 X) и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и концентрирование) выделяют указанную в заголовке неочищенную кислоту (9 мг, 0,0241 ммоль, выход 86%). Пример 16. 6-Метиловый эфир 3-циклопентил-1-метил-1 Н-индол-2,6-дикарбоновой кислоты К 3-циклопентилальдегиду, полученному по методике, аналогичной описанной в примере 15 (20 мг,0,07 ммоль) и 2-метил-2-бутену (541 мкл, 5,11 ммоль) в трет-бутаноле (500 мкл) при 0 С добавляют свежеприготовленный раствор хлорита натрия (64,2 мг, 0,711 ммоль) в фосфатном буфере (98 мг NaH2PO4 в 150 мкл воды). Реакционную смесь перемешивают в течение 45 мин при комнатной температуре, затем добавляют насыщенный раствор соли. Водный слой дважды экстрагируют, используя EtOАс. Объединенные органические слои последовательно промывают 0,5 Н водным раствором НСl и насыщенным раствором соли. После обычной обработки (MgSO4, фильтрация и концентрирование) выделяют 23,1 мг целевой неочищенной кислоты в виде желтого твердого вещества. Пример 18. 3-Циклопентил-2-пиридин-2-ил-бензофуран-6-карбоновая кислота.(0,250 г, 5,9 ммоль) и CuI (0,057 г, 0,3 ммоль) растворяют в ДМФ (30 мл) и дегазируют смесь, барботируя аргон в течение 30 мин. Добавляют тетракис(трифенилфосфин)палладий (0,208 г, 0,18 ммоль) и перемешивают смесь при 100 С в атмосфере аргона. Через 19 ч реакционную смесь охлаждают до комнатной температуры, выливают в воду (70 мл) и экстрагируют, используя ТБМЭ. Органическую фазу промывают водой (2 X) и насыщенным раствором соли, высушивают (MgSO4) и концентрируют, получая при этом остаток, который очищают экспресс-хроматографией. Целевое 2(2-пиридил)бензофурановое производное (0,536 г, выход 63%) получают в виде белого твердого вещества. Нитрил, полученный как описано выше (0,200 г, 0,694 ммоль), суспендируют в смеси конц. H2SO4(5 мл), АсОН (4 мл) и воды (2 мл). После кипячения с обратным холодильником в течение 1,5 ч данные ТСХ свидетельствуют о завершении гидролиза. Смесь охлаждают на льду и добавляют по каплям 10 H раствор NaOH до рН 9. Водный слой промывают дихлорметаном и затем подкисляют до рН 6 5 Н раствором HCl. Полученный продукт экстрагируют, используя EtOAc, высушивают (MgSO4) и удаляют растворители при пониженном давлении. Целевую карбоновую кислоту получают в виде белого твердого вещества. Пример 19. Этиловый эфир 2-бромо-3-циклопентил-бензо[b]тиофен-6-карбоновой кислоты. К раствору 3-бромо-6-циклопентанкарбонилфенола, полученного согласно примеру 17 (5,194 г,- 28007722 19,30 ммоль), в ДМФ (58,0 мл) добавляют при комнатной температуре 1,4-диазобицикло[2,2,2]октан(4,33 г, 38,60 ммоль) и диметилтиокарбамилхлорид (4,77 г, 38,6 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч. После этого смесь подкисляют 1 Н раствором НСl до рН 3 и затем экстрагируют, используя EtOAc. Органические слои объединяют и промывают насыщенным раствором соли, высушивают над MgSO4. Неочищенную смесь очищают, пропуская через слой силикагеля, используя 3% EtOAc/гексан и получая при этом 6,976 г (100%) целевого тиокарбамата в виде бесцветного маслянистого вещества. Чистый O-3-бромо-6-циклопентанкарбонил-N,N-диметилтиокарбамат, полученный как описано выше (43,147 г, 121,1 ммоль), нагревают при температуре внутри колбы, равной 180-190 С, в течение 5 ч. Для контроля за ходом реакции используют ТСХ (20% EtOAc/гексан: Rf: 0,6 (исходное вещество), 0,5(продукт. Неочищенное соединение используют на следующей стадии без дополнительной очистки.S-3-бромо-6-циклопентанкарбонил-N,N-диметилтиокарбамат, полученный как описано выше, без проведения очистки, растворяют в МеОН (600 мл), добавляют KOH (40,0 г, 714 ммоль) и смесь кипятят с обратным холодильником в течение 1,5 ч. Смесь охлаждают до комнатной температуры и удаляют растворитель, используя роторный испаритель. Остаток растворяют в воде и подкисляют 6 Н раствором НСl до рН 3. Затем экстрагируют, используя EtOАс, и очищают полученный неочищенный продукт хроматографией на силикагеле с использованием 1-5% EtOAc/гексан. Целевое производное тиофенола (31,3 г,91%) получают в виде желтого маслянистого вещества. К раствору 3-бромо-6-циклопентанкарбонилтиофенола, полученного как описано выше (0,314 г,1,105 ммоль), в ацетоне (5,0 мл) добавляют K2CO3 (0,477 г, 3,45 ммоль), а затем добавляют этилбромацетат (0,221 г, 0,147 мл, 1,33 ммоль). Полученную смесь перемешивают в течение ночи. Реакционную смесь отфильтровывают через бумажный фильтр и концентрируют фильтрат. После очистки на силикагеле с использованием 5% EtOAc/гексан получают 0,334 г (82%) продукта в виде бесцветного маслянистого вещества. Сложный эфир без проведения очистки, полученный как описано выше, растворяют в ТГФ (12,0 мл), добавляют при комнатной температуре 1 Н раствор NaOH (5,0 мл). Смесь перемешивают при комнатной температуре в течение 2-3 ч или до тех пор, пока по данные ТСХ не будут свидетельствовать об окончательном завершении реакции. Растворитель удаляют, используя роторный испаритель. Затем добавляют воду и подкисляют смесь 6 Н раствором НСl до рН 3, после чего экстрагируют, используяEtOАс, промывают насыщенным раствором соли и высушивают над MgSO4. Растворитель удаляют при пониженном давлении и используют остаток без дополнительной очистки. К кислоте, полученной как описано выше, без проведения очистки добавляют ангидрид уксусной кислоты (16,0 мл), а затем NaOAc (0,573 г), после чего смесь кипятят с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры и выливают в смесь льда и толуола. Добавляют 6 Н раствор NaOH до тех пор, пока значение рН не достигнет приблизительно 7, затем экстрагируют, используя EtOAc, промывают насыщенным раствором соли и высушивают над MgSO4. Растворитель удаляют на роторном испарителе, а остаток очищают на силикагеле, используя гексан, с получением при этом 0,795 г (80%) 6-бромо-3-циклопентил бензотиофена в виде бесцветного маслянистого вещества. Смесь 6-бромо-3-циклопентилбензотиофена (0,723 г, 2,57 ммоль), полученного как описано выше, и цианида меди (0,272 г, 3,04 ммоль) в ДМФ (1,4 мл) кипятят с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры, затем разбавляют, используя EtOАс. Добавляют 2 Н раствор NH4OH, перемешивают смесь в течение 10 мин и отфильтровывают через целит. Водный слой экстрагируют, используя EtOАс. Органические слои объединяют и промывают насыщенным раствором соли,высушивают над MgSO4, и удаляют растворитель при пониженном давлении. Полученный продукт используют без дополнительной очистки. 3-Циклопентил-6-цианобензотиофен (17,65 г, 77,65 ммоль) растворяют в уксусной кислоте (310 мл),затем при комнатной температуре добавляют бром (49,64 г, 310,6 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, для контроля за ходом реакции используют ЖХВР. После завершения реакции для того, чтобы удалить уксусную кислоту, к реакционной смеси добавляют толуол(3 х 100 мл). Неочищенный продукт высушивают при пониженном давлении и используют без дополнительной очистки. Цианопроизводное, полученное как описано выше, без проведения очистки, добавляют в этанол(150 мл, денатурированный) и конц. H2SO4 (45 мл), затем смесь кипятят с обратным холодильником в течение 1-2 дней. После завершения реакции (по данным ЖХВР) реакционную смесь охлаждают до комнатной температуры и выливают в охлаждаемую льдом воду, затем экстрагируют дихлорметаном (5 х 100 мл), органические слои объединяют и промывают 5% раствором NaHCO3 и насыщенным раствором соли. Растворитель удаляют при пониженном давлении, а остаток очищают на силикагеле, используя 1%EtOAc/гексан. Собранные фракции концентрируют, остаток суспендируют в метаноле. Твердое вещество отфильтровывают и промывают охлажденным льдом метанолом, получая 15,9 г (58%, две стадии) чистого сложного этилового эфира в виде светло-желтого твердого вещества.(0,085 г, 2,0 ммоль) и CuI (0,019 г, 0,1 ммоль) растворяют в ДМФ (10 мл) и смесь дегазируют посредством барботирования аргона в течение 30 мин. Добавляют тетракис(трифенилфосфин)палладий (0,069 г,0,06 ммоль) и перемешивают смесь при 100 С в атмосфере аргона. Через 24 ч реакционную смесь охлаждают до комнатной температуры, выливают в воду (70 мл) и экстрагируют, используя ТБМЭ. Органическую фазу промывают водой (2 X) и насыщенным раствором соли, высушивают (MgSO4) и концентрируют, получая при этом остаток, который очищают экспресс-хроматографией. Целевой 2(2 пиридил)бензотиофензамещенный сложный эфир (0,197 г, выход 56%) получают в виде бледно-желтого воскообразного вещества. Сложный эфир, полученный как описано выше, подвергают гидролизу обычным образом, используя NaOH, получая при этом указанную в заголовке кислоту, которую можно использовать непосредственно или после очистки с использованием метода ЖХВР или экспресс-хроматографии. Эта кислота может вступать во взаимодействие с производными амина в соответствии с общей методикой, которая описана в примере 37. Пример 21. 3-Циклопентил-2-фуран-3-ил-бензо[b]тиофен-6-карбоновая кислота 2-Бромбензотиофензамещенный сложный эфир, полученный в соответствии с примером 19, подвергают взаимодействию с 3-фуранбороновой кислотой, как описано в примере 3, с получением при этом целевого 2-(3-фурил)бензотиофензамещенного сложного эфира с выходом 85%. Омыление этого сложного этилового эфира проводят, используя NaOH, при комнатной температуре с получением при этом указанного в заголовке производного карбоновой кислоты. Пример 22. 3-Циклогексил-1-метил-2-фенил-1 Н-пирроло[2,3-b]пиридин-6-карбоновая кислота 7-Азаиндол (15,00 г, 0,127 моль) растворяют в МеОН (330 мл), добавляют метоксид натрия (25% мас./мас. в МеОН, 172 мл, 0,753 моль) и добавляют циклогексанон (52,86 мл, 0,51 моль). Смесь кипятят с обратным холодильником в течение 60 ч и затем концентрируют при пониженном давлении. После охлаждения смесью воды со льдом реакционную смесь подкисляют до рН 8, используя 3 Н раствор HCl, и собирают фильтрацией выпавшее в осадок твердое вещество. Полученный продукт промывают водой,растирают со смесью ТБМЭ-гексан и высушивают азеотропной перегонкой с толуолом (19,8 г). Вещество, полученное как описано выше (15,00 г, 75,65 ммоль), растворяют в смеси EtOН (130 мл) и ТГФ (30 мл) и добавляют 20% Pd(OH)2 на углероде (1,30 г). Смесь гидрируют при давлении газообразного H2, равном 1 атм, в течение 24 ч, после чего добавляют дополнительное количество катализатора(1,30 г). После перемешивания в атмосфере газообразного H2 в течение дополнительных 16 ч катализатор удаляют фильтрованием и упаривают раствор при пониженном давлении с получением при этом остатка,который растирают с ТБМЭ и получают твердое вещество янтарного цвета (13,9 г). Производное азаиндола, полученное как описано выше (7,50 г, 37,45 ммоль), растворяют в DME(1,2-диметоксиэтан, 130 мл) и добавляют мета-хлорпербензойную кислоту (12,943 г, 60,0 ммоль). После перемешивания в течение 2 ч летучие удаляют при пониженном давлении и суспендируют остаток в воде
МПК / Метки
МПК: A61K 31/404, C07D 409/04, C07D 413/04, C07D 401/04, C07D 405/04, A61K 31/437, C07D 209/08, C07D 417/04, A61K 31/4402, A61K 31/381, C07D 403/04
Метки: вирусной, ингибиторы, полимеразы
Код ссылки
<a href="https://eas.patents.su/30-7722-ingibitory-virusnojj-polimerazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вирусной полимеразы</a>
Предыдущий патент: Гетеробиарильные производные в качестве ингибиторов матриксных металлопротеиназ
Следующий патент: Фрикционно – кольцевое передаточное устройство и способ управления его работой
Случайный патент: Труба для быстрого охлаждения, устройство и способ проведения каталитических газофазных реакций