Новые соединения гетероциклического оксима, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 7718
Опубликовано: 29.12.2006
Авторы: Ренар Пьер, Лебергю Никола, Бутэн Жан Альбер, Кэньяр Даньель-Анри, Карато Паскаль, Бертелот Паскаль, Энтровинь Карина, Пайю Сильви, Леклерк Вероник, Дакке Катрин
Формула / Реферат
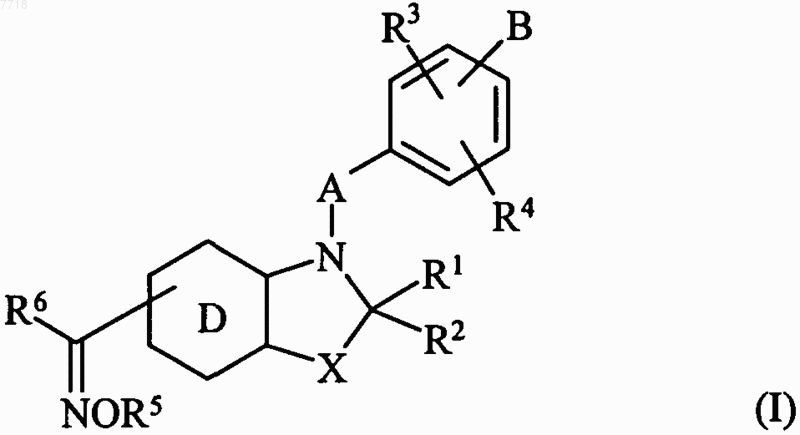
1. Соединения формулы (I)
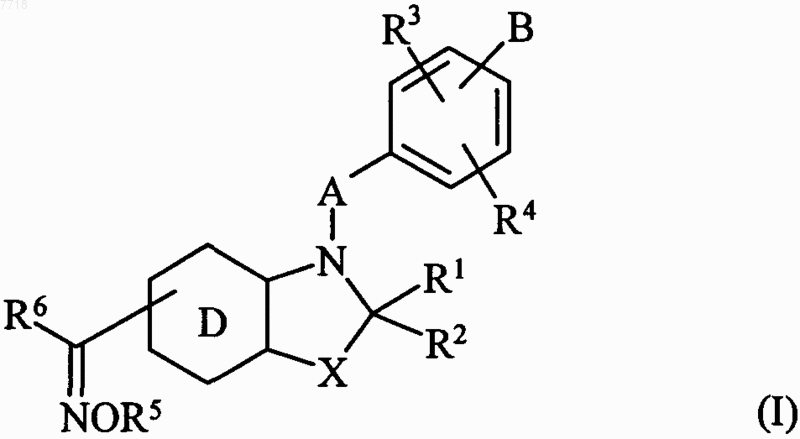
в которой X представляет собой атом кислорода или серы, или группу СН2 или 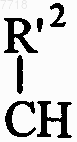 (где R'2 вместе с R2 образует дополнительную связь),
(где R'2 вместе с R2 образует дополнительную связь),
R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (С1-С6)алкильную группу, арильную группу, арил-(С1-С6)алкильную группу, в которой алкильная часть является линейной или разветвленной, арилоксигруппу, арил-(С1-С6)алкоксигруппу, в которой алкильная часть является линейной или разветвленной, линейную или разветвленную (С1-С6)алкоксигруппу, гидроксигруппу, аминогруппу, линейную или разветвленную (С1-С6)алкиламиногруппу или ди-(С1-С6)алкиламиногруппу, в которой алкильные части являются линейными или разветвленными,
или R1 и R2 вместе образуют оксо-, тиоксо- или иминогруппу,
причем также возможно, что R2 вместе с R'2 образуют дополнительную связь,
А представляет собой (С1-С6)алкиленовую цепь, в которой одна СН2-группа может быть заменена гетероатомом, выбранным из кислорода и серы, или группой NRa (в которой Ra представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу), или фениленовой или нафтиленовой группой,
R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена или группу R, OR или NRR', где R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, линейную или разветвленную (С2-С6)алкенильную группу, линейную или разветвленную (С2-С6)алкинильную группу, арильную группу, арил-(С1-С6)алкильную группу, в которой алкильная часть является линейной или разветвленной, арил-(С2-С6)алкенильную группу, в которой алкенильная часть является линейной или разветвленной, арил-(С2-С6)алкинильную группу, в которой алкинильная часть является линейной или разветвленной, гетероарильную группу, гетероарил-(С1-С6)алкильную группу, в которой алкильная часть является линейной или разветвленной, гетероарил-(С2-С6)алкенильную группу, в которой алкенильная часть является линейной или разветвленной, гетероарил-(С2-С6)алкинильную группу, в которой алкинильная часть является линейной или разветвленной, (С3-С8)циклоалкильную группу, (С3-С8)циклоалкил-(С1-С6)алкильную группу, в которой алкильная часть является линейной или разветвленной, или линейную или разветвленную (С1-С6)полигалоалкильную группу), или R3 и R4 вместе с атомами углерода, несущими их, когда они расположены на двух соседних атомах углерода, образуют цикл, который имеет 5 или 6 кольцевых членов и который может содержать гетероатом, выбранный из кислорода, серы и азота,
R5 и R6, которые могут быть одинаковыми или различными, каждый может принимать те же значения, что и R, как указано выше,
D представляет собой бензольное ядро, в этом случае X не может представлять собой группу 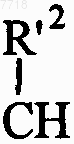 , как указано выше,
, как указано выше,
или D представляет собой пиридиновое, пиразиновое, пиримидиновое или пиридазиновое ядро,
В представляет собой линейную или разветвленную (С1-С6)алкильную группу или линейную или разветвленную (С2-С6)алкенильную группу, причем эти группы замещены
группой формулы (II)

в которой -R7 представляет собой группу 
 , в которой Z представляет собой атом кислорода или серы, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,
, в которой Z представляет собой атом кислорода или серы, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,
и R8 представляет собой арильную группу, арилалкильную группу, в которой алкильная часть содержит от 1 до 6 атомов углерода и может быть линейной или разветвленной, гетероарильную группу, гетероарилалкильную группу, в которой алкильная часть содержит от 1 до 6 атомов углерода и может быть линейной или разветвленной, CN, тетразол, -OR, -NRR',  , в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,
, в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,
или группой R9, в которой R9 представляет собой CN, тетразол, 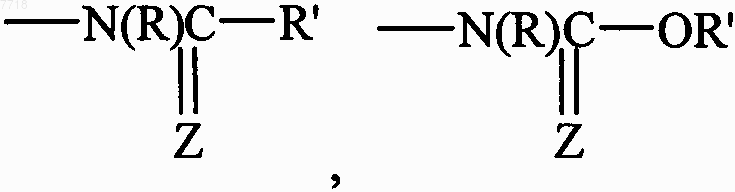 или
или 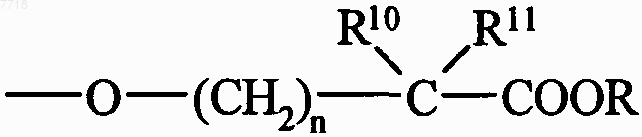 группу, в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше, n представляет собой 0, 1, 2, 3, 4, 5 или 6, и R10 и R11, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, причем понимают, что R10 и R11 не могут одновременно представлять собой атом водорода,
группу, в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше, n представляет собой 0, 1, 2, 3, 4, 5 или 6, и R10 и R11, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, причем понимают, что R10 и R11 не могут одновременно представлять собой атом водорода,
или В представляет собой группу формулы (II) или группу R9, как они указаны выше,
причем понимают, что оксим R6-C(=N-OR5)- может находиться в Z или Е конфигурации,
арил означает фенильную, нафтильную или бифенильную группу, причем эти группы могут быть частично гидрогенированны,
гетероарил означает любую моно- или бициклическую ароматическую группу, содержащую от 5 до 10 членов, которая может быть частично гидрогенированна в одном из колец в случае бициклических гетероарилов и которая содержит от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы,
причем арильная и гетероарильная группы, определенные таким образом, могут быть замещены 1-3 группами, выбранными из линейной или разветвленной (C1-С6)алкильной группы, линейной или разветвленной (С1-С6)полигалоалкильной группы, линейной или разветвленной (С1-С6)алкоксигруппы, гидроксигруппы, карбоксигруппы, формильной группы, NRbRc (в которой Rb и Rc, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (С1-С6)алкильную группу, арильную группу или гетероарильную группу), сложноэфирной группы, амидогруппы, нитрогруппы, цианогруппы и атомов галогена,
их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, в которой R1 и R2 вместе образуют оксогруппу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, в которой R3 и R4 представляют собой атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, в которой А представляет собой этиленоксигруппу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, в которой D представляет собой бензольное ядро, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, т которой X представляет собой атом серы, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, в которой R5 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, в которой R5 представляет собой алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, в которой R6 представляет собой незамещенную фенильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, в которой R6 представляет собой замещенную фенильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по п.1, в которой R6 представляет собой фенильную группу, замещенную атомом галогена, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по п.1, в которой В представляет собой алкильную группу, замещенную группой  , в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по п.1, в которой В представляет собой алкильную группу, замещенную группой 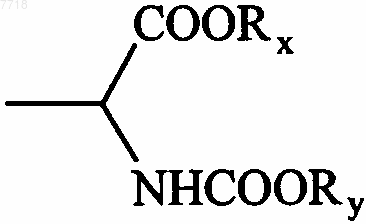 , в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по п.1, в которой В представляет собой алкильную группу, замещенную группой 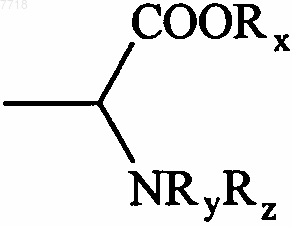 , в которой Rx, Ry и Rz, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rx, Ry и Rz, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
15. Соединения формулы (I) по п.1, в которой В представляет собой группу 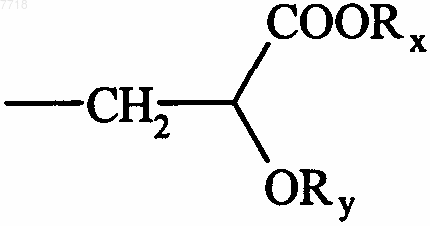 , в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
16. Соединения формулы (I) по п.1, в которой В представляет собой группу 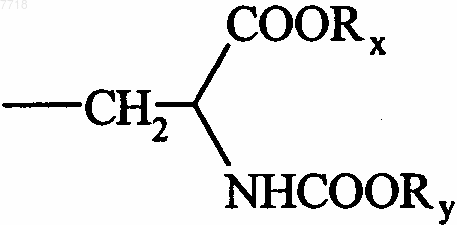 , в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
17. Соединения формулы (I) по п.1, в которой В представляет собой группу 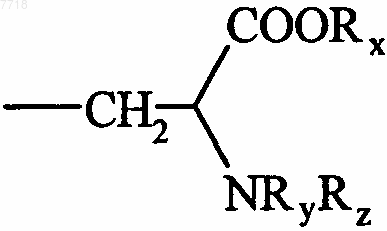 , в которой Rx, Ry и Rz, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
, в которой Rx, Ry и Rz, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.
18. Соединения формулы (I) по п.1, которые представляют собой
метил 2-этокси-3-{4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2Н)-ил) этокси]фенил}пропаноат,
метил 2-этокси-3-{4-[2-(6-[(Z)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропаноат,
метил 3-{4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропаноат,
2-этокси-3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил} пропановую кислоту,
2-этокси-3-{4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту,
2-этокси-3-{4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту, энантиомер 1,
2-этокси-3-{4-[2-(6-[(E)-метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту, энантиомер 2,
2-этокси-3-{4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту,
2-этокси-3-{4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту, энантиомер 1,
2-этокси-3-{4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту, энантиомер 2,
2-этокси-3-{4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}пропановую кислоту,
метил 3-{4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил}-2-этоксипропаноат,
метил 3-{4-[2-(6-[(3-хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил}-2-этоксипропаноат,
метил 2-метокси-3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)эток-си]фенил}пропаноат,
3-{4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фе-нил}-2-этоксипропановую кислоту,
3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту,
3-{4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту,
3-{4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 1,
3-{4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 2,
3-{4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту,
3-{4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 1,
3-{4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 2,
3-{4-[2-(6-[(трет-бутоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-этоксипропановую кислоту.
19. Соединения формулы (I) по п.1, которые представляют собой
метил 2-[(трет-бутоксикарбонил)амино]-3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2Н)-ил)этокси]фенил}пропаноат,
метил 2-[(трет-бутоксикарбонил)амино]-3-{4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 2-[(бутоксикарбонил)амино]-3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-[(феноксикарбонил)амино]пропаноат,
метил 2-{[(бензилокси)карбонил]амино}-3-{4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
метил 2-[(трет-бутоксикарбонил)(метил)амино]-3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}пропаноат,
N-(трет-бутоксикарбонил)-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилаланин,
N-(трет-бутоксикарбонил)-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2Н)-ил) этокси]фенилаланин.
20. Соединения формулы (I) по п.1, которые представляют собой
метил 2-амино-3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил}пропаноат,
метил 2-амино-3-{4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил}пропаноат,
метил 3-{4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил}-2-(метиламино)пропаноат.
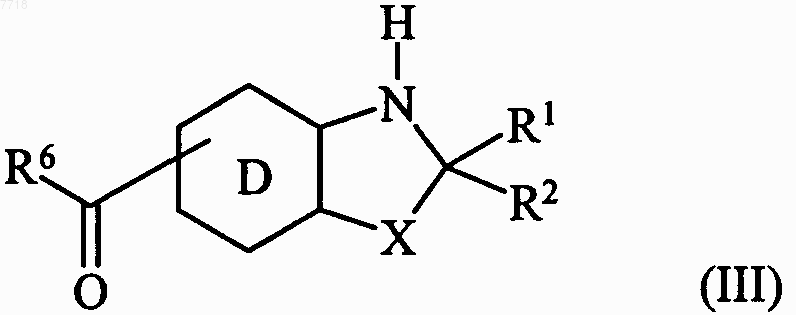
21. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (III)
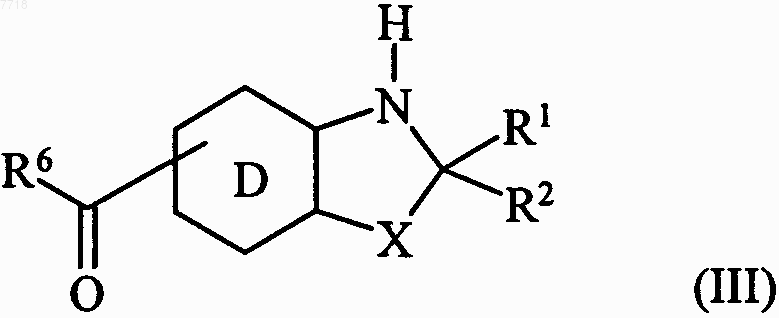
в которой D, R1, R2, R6 и X принимают значения, указанные для формулы (I), с которым конденсируют, в основной среде, соединение формулы (IV)
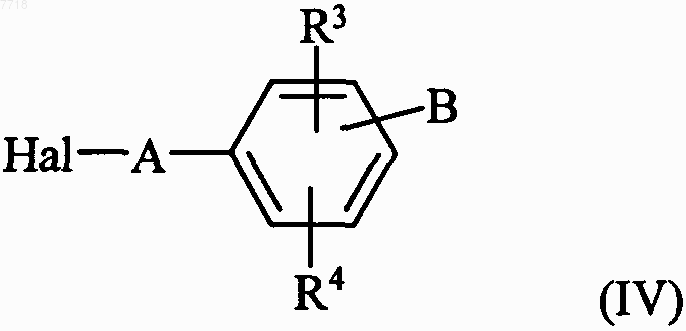
в которой А, В, R3 и R4 принимают значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (V)
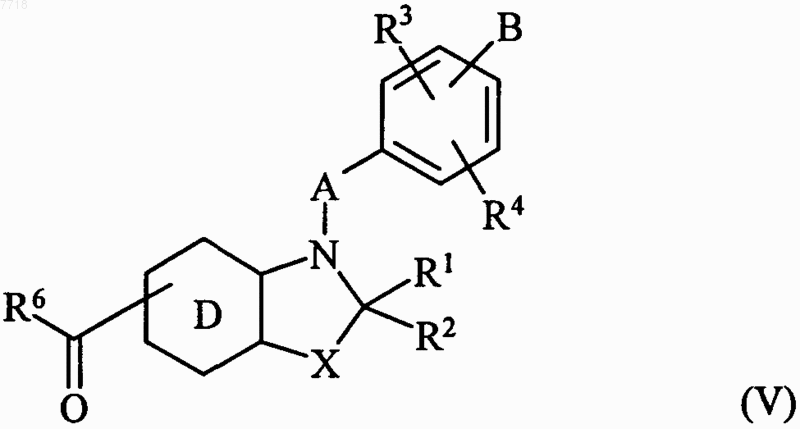
в которой R1, R2, R3, R4, R6, A, В, D и X принимают значения, указанные для формулы (I),
которое подвергают действию соединения формулы R5O-NH2, в которой R5 принимает значения, указанные для формулы (I), с получением соединения формулы (I)
которое может быть очищено в соответствии с обычной техникой разделения, которое превращают, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое разделяют, где приемлемо, на его изомеры в соответствии с обычной техникой разделения.
22. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (III)
в которой D, R1, R2, R6 и X принимают значения, указанные для формулы (I), с которым конденсируют соединение формулы R5O-NH2, в которой R5 принимает значения, указанные для формулы (I), с получением соединения формулы (VI)
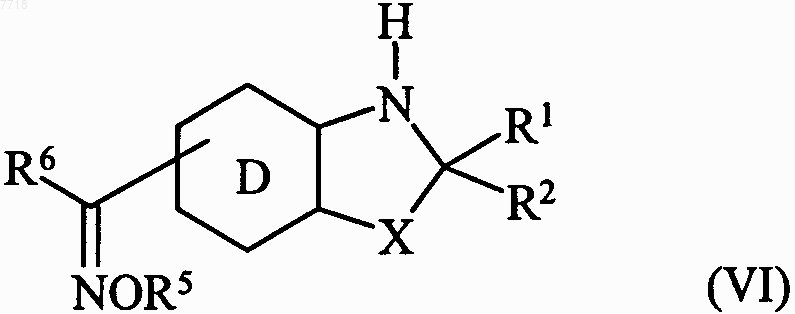
в которой R1, R2, R5, R6, D и X принимают значения, указанные для формулы (I), с которым конденсируют в основной среде соединение формулы (IV)
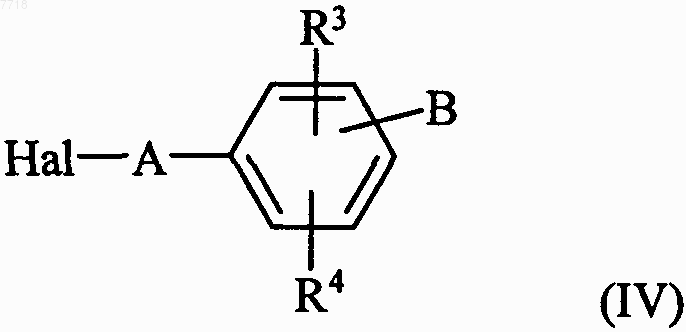
в которой А, В, R3 и R4 принимают значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (I)
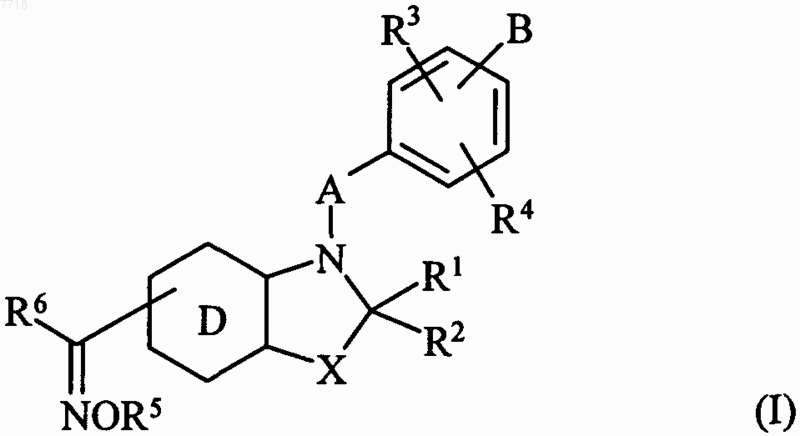
которое может быть очищено в соответствии с обычной техникой разделения, которое превращают, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое разделяют, где приемлемо, на его изомеры в соответствии с обычной техникой разделения.
23. Соединения формулы (V) по п.21
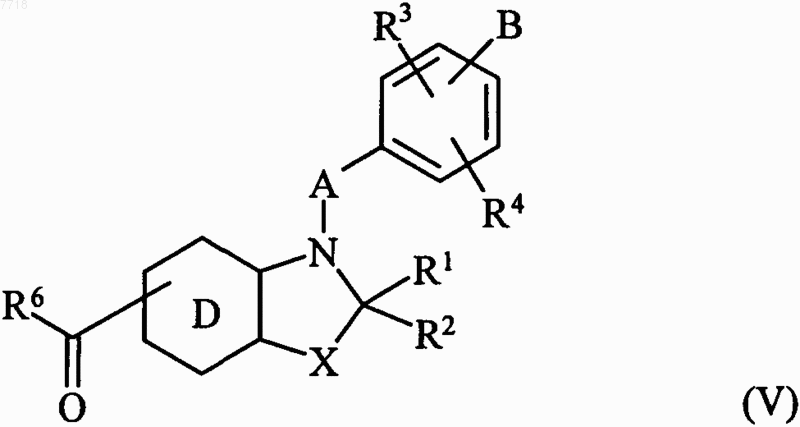
в которой R6, D, X, A, R1, R2, R3, R4 и В принимают значения, указанные в п.1,
для применения в качестве промежуточных веществ для синтеза соединений формулы I.
24. Фармацевтические композиции, которые включают в качестве активного вещества по крайней мере одно соединение формулы (I) по любому из пп.1-20 или 23 или его соль присоединения с фармацевтически приемлемой кислотой или основанием, отдельно или в комбинации с одним или более фармацевтически приемлемыми наполнителями.
25. Фармацевтические композиции по п.24, для применения при изготовлении лекарственного средства для лечения и/или профилактики гипергликемии, дислипидемии и, особенно, при лечении инсулиннезависимых диабетов типа II, резистентности к инсулину, непереносимости глюкозы, расстройств, связанных с синдромом X, болезни коронарной артерии и других сердечно-сосудистых заболеваний, заболеваний почек, ретинопатии, расстройств, связанных с активацией эндотелиальных клеток, псориаза, синдрома поликистоза яичника, деменции, остеопороза, кишечных воспалительных болезней, миотонической дистрофии, панкреатита, артериосклероза, ксантомы, а также при лечении или предупреждении диабетов типа I, ожирения, регуляции аппетита, анорексии, булимии, нервной анорексии, точно также как раковых патологий и особенно гормонально-зависимых раковых опухолей, таких как рак груди или рак толстой кишки, и как ингибиторов ангиогенеза.
Текст
007718 Настоящее изобретение относится к новым соединениям гетероциклического оксима, к способу их получения и к фармацевтическим композициям, содержащим их. Соединения, описанные в настоящем изобретении, являются новыми и обладают фармакологическими свойствами, представляющими особый интерес: они являются превосходными гипогликемическими и гиполипидемическими средствами. Лечение инсулинонезависимых диабетов типа II остается неудовлетворительным несмотря на введение на рынок большого количества пероральных гипогликемических соединений, разработанных для облегчения секреции инсулина и стимулирования его действия в периферических целевых тканях. В течение последних десяти лет класс соединений, имеющих тиазолидиндионовую структуру (US 5 089 514, US 5 306 726), продемонстрировал выраженную антидиабетическую активность путем повышения селективности к инсулину в периферических целевых тканях (скелетная мышца, печень, жировая ткань) животных моделей, имеющих инсулинонезависимые диабеты типа II. Эти соединения также понижают уровни инсулина и уровни липидов у тех же животных моделей и вызывают in vitro дифференциирование преадипоцитных линий клеток в адипоцитные линии клеток (A. Hiragun и др., J. Cell. Physiol,1988, 134, 124-130; R. F. Kleitzen и др., Mol. Pharmacol., 1992, 41, 393-398). Обработка преадипоцитных линий клеток с помощью тиазолидиндиона розиглитазона приводит к индуцированию экспрессии специфических генов метаболизма липидов, таких как аР 2 и адипсин, а также экспрессии переносчиков глюкозы GLUT1 и GLUT4, полагают, что наблюдаемый in vivo эффект тиазолидиндионов может быть опосредован via жировую ткань. Этот специфический эффект получают путем стимуляции транскрипционных ядра: пероксисома пролифератор-активированный рецептор гамма(PPAR 2). Такие соединения способны восстанавливать чувствительность к инсулину в периферических тканях, таких как жировая ткань или скелетная мышца (J.E. Gerich, New Engl. Med., 19, 321, 1231-1245). Однако соединения, имеющие тиазолидиндионовую структуру (троглитазон, розиглитазон), вызывают беспокоящие побочные эффекты у человека, включая проблемы печени (Script No. 2470, 1999, Sept. 8, 25). Большое количество гипогликемических средств обладают значительными побочными эффектами(печеночный, сердечный, кроветворный), которые ограничивают их долговременное применение при лечении инсулинонезависимых диабетов типа II. Разработка новых терапевтических средств, являющихся менее токсичными и которые являются активными в течение длительного периода, является чрезвычайно необходимой при такой патологии. Кроме того, гиперлипидемия часто наблюдается у диабетиков (Diabetes Саrе, 1995, 18 (приложение 1), 86/8/93). Совокупный эффект гипергликемии и гиперлипидемии повышает риск сердечнососудистого заболевания у диабетиков. Гипергликемия, гиперлипидемия и ожирение стали патологиями современного мира, характеризующегося приемом пищи в больших количествах и хроническим недостатком физических упражнений. Повышение частоты таких патологий вызывает необходимость разработки новых терапевтических средств, являющихся активными при таких расстройствах: соединений, имеющих превосходную гипогликемическую и гиполипидемическую активность, в то же время не вызывающих побочных эффектов,наблюдаемых при лечении тиазолидиндионами, которые в результате являются очень полезными при лечении и/или профилактике таких патологий, и особенно необходимы при лечении инсулинонезависимых диабетов типа II для понижения периферальной инсулиновой резистентности и для нормализации контроля глюкозы. Кроме того, что соединения настоящего изобретения являются новыми, они отвечают указанным выше фармакологическим критериям и являются превосходными гипогликемическими и гиполипидемическими средствами. Более определенно, настоящее изобретение относится к соединениям формулы (I)(где R'2 вместе с в которой X представляет собой атом кислорода или серы, или группу СН 2 илиR образует дополнительную связь),R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, арилоксигруппу, арил-(С 1 С 6)алкокси группу, в которой алкильная часть является линейной или разветвленной, линейную или разветвленную (С 1-С 6)алкоксигруппу, гидроксигруппу, аминогруппу, линейную или разветвленную (С 12-1 007718 С 6)алкиламиногруппу или ди-(С 1-С 6)алкиламиногруппу, в которой алкильные части являются линейными или разветвленными,или R1 и R2 вместе образуют оксо-, тиоксо- или иминогруппу,причем также возможно, что R2 вместе с R'2 образуют дополнительную связь,А представляет собой (С 1-С 6)алкиленовую цепь, в которой одна СН 2 группа может быть заменена гетероатомом, выбранным из кислорода и серы, или группой NRa (в которой Ra представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу), или фениленовой или нафтиленовой группой,R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена или группу R, OR или NRR' (где R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 2-С 6)алкенильную группу, линейную или разветвленную (С 2 С 6)алкинильную группу, арильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, арил-(С 2-С 6)алкенильную группу, в которой алкенильная часть является линейной или разветвленной, арил-(С 2-С 6)алкинильную группу, в которой алкинильная часть является линейной или разветвленной, гетероарильную группу, гетероарил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, гетероарил-(С 2-С 6)алкенильную группу,в которой алкенильная часть является линейной или разветвленной, гетероарил-(С 2-С 6)алкинильную группу, в которой алкинильная часть является линейной или разветвленной, (С 3-С 8)циклоалкильную группу, (С 3-С 8)циклоалкил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, или линейную или разветвленную (С 1-С 6)полигалоалкильную группу),или R3 и R4 вместе с атомами углерода, несущими их, когда они расположены на двух соседних атомах углерода, образуют цикл, который имеет 5 или 6 кольцевых членов и который может содержать гетероатом, выбранный из кислорода, серы и азота,R5 и R6, которые могут быть одинаковыми или различными, каждый может принимать те же значения, что и R, как указано выше,D представляет собой бензольное ядро, в этом случае X не может представлять собой группу ,как указано выше,или D представляет собой пиридиновое, пиразиновое, пиримидиновое или пиридазиновое ядро,В представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или линейную или разветвленную (С 2-С 6)алкенильную группу, причем эти группы замещены группой формулы (II), в которой Z пред-R7 представляет собой группу ставляет собой атом кислорода или серы, и R и R', которые могут быть одинаковыми или различными,принимают значения, указанные выше,и R8 представляет собой арильную группу, арилалкильную группу, в которой алкильная часть содержит от 1 до 6 атомов углерода и может быть линейной или разветвленной, гетероарильную группу,гетероарилалкильную группу, в которой алкильная часть содержит от 1 до 6 атомов углерода и может быть линейной или разветвленной, CN, тетразол, -OR, -NRR' в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,или группой R9, в которой R9 представляет собой CN, тетразол, или группу, в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше, n представляет собой 0, 1, 2,3, 4, 5 или 6, и R10 и R11, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, причем понимают, что R10 иR11 не могут одновременно представлять собой атом водорода,или В представляет собой группу формулы (II) или группу R9, как они указаны выше, причем понимают, что оксим R6-C(=N-OR5)- может находится в Z или Е конфигурации,арил означает фенильную, нафтильную или бифенильную группу, причем эти группы могут быть-2 007718 частично гидрогенированны,гетероарил означает любую моно- или бициклическую ароматическую группу, содержащую от 5 до 10 членов, которая может быть частично гидрогенированна в одном из колец в случае бициклических гетероарилов и которая содержит от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы,причем арильная и гетероарильная группы, определенные таким образом, могут быть замещены 1-3 группами, выбранными из линейной или разветвленной (С 1-С 6)алкильной группы, линейной или разветвленной (С 1-С 6)полигалоалкильной группы, линейной или разветвленной (С 1-С 6)алкоксигруппы, гидрокси группы, карбокси группы, формильной группы, NRbRc (в которой Rb и Rc, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу или гетероарильную группу), сложноэфирной группы,амидо группы, нитро группы, циано группы, и атомов галогена,к их энантиомерам и диастереоизомерам, а также к их солям присоединения с фармацевтически приемлемой кислотой или основанием. Из числа фармацевтически приемлемых кислот могут быть упомянуты, не ограничиваясь представленными примерами, хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфоновая кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота, глутаровая кислота, фумаровая кислота, винная кислота,малеиновая кислота, лимонная кислота, аскорбиновая кислота, метансульфоновая кислота, камфорная кислота, щавелевая кислота и т.д. Из числа фармацевтически приемлемых оснований могут быть упомянуты, не ограничиваясь представленными примерами, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин т.д. Предпочтительными соединениями изобретения являются соединения формулы (I), в которой R1 и 2R вместе образуют оксогруппу. Предпочтение отдается R3 и R4 группам, которые представляют собой атомы водорода. А предпочтительно представляет собой алкиленовую цепь, в которой одна СН 2 может быть заменена гетероатомом, особенно предпочтительно атомом кислорода. Особенно изобретение относится к соединениям формулы (I), в которой А представляет собой этиленокси группу. Предпочтительными группами D являются бензольное ядро и пиридиновое ядро, более предпочтительно бензольное ядро.X предпочтительно представляет собой атом кислорода или атом серы, более предпочтительно атом серы. Предпочтительными R5 группами являются атом водорода и алкильная группа, например метильная группа.R6 преимущественно представляет собой фенильную группу, которая является незамещенной или замещенной группами, такими как алкильная группа, алкоксигруппа и атомы галогена. Предпочтительными В группами являются алкильные или алкенильные группы, более предпочтительно алкильные группы, замещенные группойRx, Ry и Rz, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или алкильную группу, например группы: метил, этил, пропил, изопропил, бутил,изобутил, трет-бутил, пентил, изопентил, неопентил или гексил,полигалоалкильную группу, например, группы: трифторметил или трифторэтил,или фенильную или бензильную группу. Более особенно, изобретение относится к соединениям формулы (I), в которой В представляет собой алкильную или алкенильную группу, замещенную группой значения, указанные выше., в которой n и Rx приВ также преимущественно представляет собой группу нимают значения, указанные выше. Особенно преимущественно изобретение относится к соединениям формулы (I), в которойX представляет собой атом серы,R1 и R2 вместе образуют оксогруппу,А представляет собой цепь,R3 и R4 одновременно представляют собой атом водорода,R5 представляет собой атом водорода или алкильную группу,R6 представляет собой фенильную или замещенную фенильную группу, более предпочтительно замещенную атомом галогена,D представляет собой бензольное ядро,-3 007718, в которой Rx и Ry принимают значения, указанные выше. Даже более предпочтительно, изобретение относится к соединениям формулы (I), которые представляют собой метил 2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенилпропаноат,метил 2-этокси-3-4-[2-(6-[(Z)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропаноат,метил 3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил 2-(2,2,2-трифторэтокси)пропаноат,2-этокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил пропановую кислоту,2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту,2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 1,2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил пропановую кислоту, энантиомер 2,2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту,2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 1,2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 2,2-этокси-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил пропановую кислоту,2-этокси-3-4-[2-(6-[(E)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропановую кислоту,2-этокси-3-4-[2-(6-[(Z)(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту,метил 3-4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропаноат,метил 3-4-[2-(6-[(3-хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-этоксипропаноат,метил 2-метокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропаноат,3-4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил 2-этоксипропановую кислоту,3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-(2,2,2 трифторэтокси)пропановую кислоту,3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту,3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 1,3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 2,3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту,3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 1,3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 2,3-4-[2-(6-[(трет-бутоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2 этоксипропановую кислоту,метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил пропаноат,метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил пропаноат,метил 2-[(бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-4 007718 3(2H)-ил)этокси]фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2[(феноксикарбонил)амино]пропаноат,метил 2-[(бензилокси)карбонил]амино-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат,метил 2-[(трет-бутоксикарбонил)(метил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат,N-(трет-бутоксикарбонил)-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенилаланин,N-(трет-бутоксикарбонил)-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенилаланин,метил 2-амино-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропаноат,метил 2-амино-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(метиламино)пропаноат. Энантиомеры, диастереоизомеры и соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений изобретения образуют неотъемлемую часть изобретения. Настоящее изобретение касается также способа получения соединений формулы (I), этот способ характеризуется тем, что в качестве исходного вещества используют соединение формулы (III) в которой D, R1, R2, R6 и X принимают значения, указанные для формулы (I), с которым конденсируют, в основной среде, соединение формулы (IV) в которой А, В, R3 и R4 принимают значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы(V) в которой R1, R2, R3, R4, R6, A, В, D и X принимают значения, указанные для формулы (I),которое подвергают действию соединения формулы R5O-NH2, в которой R5 принимает значения,указанные для формулы (I), с получением соединения формулы (I) которое может быть очищено в соответствии с обычной техникой разделения, которое превращают,при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое разделяют, где приемлемо, на его изомеры в соответствии с обычной техникой разделения. Предпочтительный вариант относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества используют соединение формулы (III) в которой D, R1, R2, R6 и X принимают значения, указанные для формулы (I), с которым конденсируют соединение формулы R5O-NH2, в которой R5 принимает значения, указанные для формулы (I), с получением соединения формулы (VI) в которой R1, R2, R5, R6, D и X принимают значения, указанные для формулы (I), с которым конденсируют, в основной среде, соединение формулы (IV) в которой А, В, R3 и R4 принимают значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (I) которое может быть очищено в соответствии с обычной техникой разделения, которое превращают,при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое разделяют, где приемлемо, на его изомеры в соответствии с обычной техникой разделения. Соединения формулы (III) являются коммерчески доступными соединениями или их получают,специалисты, квалифицированные в данном уровне техники, при помощи обычных химических реакций,которые хорошо известны или описаны в литературе. Другой аспект настоящего изобретения относится также к соединениям формулы (V) в которой R6, D, X, A, R1, R2, R3, R4 и В принимают значения, указанные для соединений формулы(I), для применения в качестве промежуточных веществ для синтеза соединений формулы I и в качестве гипогликемических и гиполипидемических средств. Соединения настоящего изобретения обладают особенно ценными фармакологическими свойствами. Соединения показывают особенно превосходную активность в понижении уровней глюкозы крови. Благодаря указанным свойствам они могут быть использованы терапевтически при лечении и/или профилактике гипергликемии, дислипидемии и особенно при лечении инсулиннезависимых диабетов типаII, непереносимости глюкозы, расстройств, связанных с синдромом X (включая гипертензию, ожирение,резистентность к инсулину, атеросклероз, гиперлипидемию), болезни коронарной артерии и других сердечно-сосудистых заболеваний (включая артериальную гипертензию, сердечную недостаточность, венозную недостаточность), заболеваний почек (включая гломерулонефрит, гломерулосклероз, нефротический синдром, гипертензивный нефросклероз), ретинопатии, расстройств, связанных с активацией эндотелиальных клеток, псориаза, синдрома поликистоза яичника, деменции, осложнений диабетов и остеопороза. Они могут быть использованы в качестве ингибиторов альдозоредуктазы для стимулирования когнитивных функций при деменции и осложнениях диабетов, кишечных воспалительных болезнях, миото-6 007718 нической дистрофии, панкреатите, артериосклерозе, ксантоме. Активность этих соединений также показана для лечения и/или профилактики других болезней,включая диабеты типа I, гипертриглицеридемию, синдром X, резистентность к инсулину, дислипидемию у диабетиков, гиперлипидемию, гиперхолестеринемию, артериальную гипертензию, сердечную недостаточность и сердечно-сосудистое заболевание, особенно атеросклероз. Кроме того, соединения показаны для применения в регуляции аппетита, особенно в регуляции приема пищи у людей, страдающих от расстройств, таких как ожирение, анорексия, булимия и нервная анорексия. Следовательно, соединения могут быть использованы для предупреждения или лечения гиперхолестеринемии, ожирения с преимущественными влияниями на гиперлипидемию, гипергликемии, остеопороза, непереносимости глюкозы, резистентности к инсулину или расстройств, при которых резистентность к инсулину является вторичным физиопатологическим механизмом. Применение этих соединений позволяет снизить общий холестерин, вес тела, резистентность к лептину, глюкозу плазмы, триглицериды, LDLs, VLDLs, a также свободные жирные кислоты плазмы. Соединения могут быть использованы в комбинации с HMG СоА редуктаза ингибиторами, фибратами, никотиновой кислотой, холестирамином, колестиполом, пробуколом, GLP1, метформином, бигуанидами или ингибиторами реабсорбции глюкозы и могут применяться вместе или в разное время, чтобы действовать в синергии у лечащегося пациента. Кроме того, они показывают активность при раковых патологиях и особенно гормональнозависимых раковых опухолях, таких как рак груди или рак толстой кишки, а также обладают ингибирующим эффектом на ангиогенезисные процессы, которые подразумеваются при таких патологиях. Среди фармацевтических композиций, согласно настоящему изобретению, можно особенно отметить те, которые являются подходящими для перорального, парентерального, назального, под- или чреcкожного, ректального, подъязычного, глазного или респираторного применения и особенно таблетки и драже, подъязычные таблетки, сашеты, пакетики, капсулы, глоссеты, пилюли, суппозитории, кремы,мази, кожные гели и питьевые или инъекционные ампулы. Полезную дозу варьируют в зависимости от пола, возраста и веса пациента, способа применения,характера терапевтического показания и применения любых сопутствующих лечений, и указанная доза находится в пределах от 0,1 мг до 1 г в 24 ч в один или большее количество приемов. Следующие примеры иллюстрируют настоящее изобретение, но никоим образом не ограничивают его. Пример 1. Метил 2-этокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропаноат. Стадия А. Метил 3-[4-(2-хлорэтокси)фенил]-2-этокси-2-пропеноат. К 150 мл свежеперегнанного тетрагидрофурана, помещенного в баню с ледяной водой при 0 С, в атмосфере аргона, добавляют гидрид натрия (0,0473 моль) и затем метил 2-этокси-2-диэтилфосфоноацетат (0,0394 моль), при этом поддерживая температуру при 0 С. После перемешивания в течение 1 ч добавляют 4-(2-хлорэтокси)бензальдегид (0,0394 моль), растворенный в минимуме свежеперегнанного тетрагидрофурана, в атмосфере аргона при 0 С. Перемешивают раствор в течение 1 ч при 0 С. Позволяют раствору достичь комнатной температуры, при этом перемешивая в течение 16 ч. Выпаривают тетрагидрофуран. Добавляют 100 мл воды и затем дважды экстрагируют с помощью 100 мл дихлорметана. Органическую фазу промывают водой, сушат над MgSO4 и затем выпаривают. Маслянистый продукт очищают на силикагелевой колонке, используя смесь элюанта:петролейный эфир/дихлорметан (1/1). Заглавное соединение получают в форме масла. Стадия В. Метил 3-[4-(2-хлорэтокси)фенил]-2-этоксипропаноат. К 100 мл тетрагидрофурана добавляют соединение, полученное на стадии А (0,0175 моль), и затем палладий-на-угле (0,2 г). Перемешивают при комнатной температуре в атмосфере водорода в течение 1 дня. Отфильтровывают палладий-на-угле и затем выпаривают фильтрат. Маслянистый продукт очищают на силикагелевой колонке, используя смесь элюанта: петролейный эфир/дихлорметан (1/1). Заглавное соединение получают в виде масла. Стадия С. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропаноат. К 20 мл диметилформамида добавляют карбонат калия (0,01044 моль) и затем 6-бензоилбензотиазолинон (0,00453 моль). Нагревают при 100 С в течение 1 ч. Добавляют соединение, полученное на стадии В (0,00348 моль), и нагревают при 150 С в течение 16 ч. Выпаривают диметилформамид. Переносят осадок в 50 мл воды и затем дважды экстрагируют с помощью 50 мл дихлорметана. Органическую фазу сушат над MgSO4 и затем выпаривают. Осадок перекристаллизовывают из метанола и получают заглавное соединение в форме твердого вещества. Точка плавления: 118-119 С. Стадия D. Метил 2-этокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]фенилпропаноат. К 30 мл метанола добавляют соединение, полученное на стадии С (0,00198 моль), О-метилгидроксиламин гидрохлорид (0,00594 моль) и пиридин (0,00594 моль). Нагревают при орошении в течение 3 ч.-7 007718 Выпаривают досуха. Добавляют 100 мл соляной кислоты (1 N) и затем дважды экстрагируют с помощью 50 мл дихлорметана. Органическую фазу сушат над MgSO4 и затем выпаривают с получением заглавного соединения. Пример 1 а. Метил 2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Соединение, полученное на стадии D примера 1 переносят в диэтиловый эфир и заглавное соединение осаждают селективным способом и отфильтровывают с получением (Е) изомера. Точка плавления: 122-123 С. Пример 1b. Метил 2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Фильтрат, полученный в примере 1 а, выпаривают и полученный осадок перекристаллизовывают с получением заглавного соединения. Пример 2. Метил 2-этокси-3-4-[2-(6-[(Z)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилпропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропаноат. К 20 мл диметилформамида добавляют карбонат калия (0,01044 моль) и затем 6-бензоилбензотиазолинон (0,00453 моль). Нагревают при 100 С в течение 1 ч. Добавляют соединение, полученное на стадии В примера 1 (0,00348 моль), и нагревают при 150 С в течение 16 ч. Выпаривают диметилформамид. Переносят осадок в 50 мл воды и затем дважды экстрагируют с помощью 50 мл дихлорметана. Органическую фазу сушат над MgSO4 и затем выпаривают. Осадок перекристаллизовывают из метанола и получают заглавное соединение в форме твердого вещества. Точка плавления: 118-119 С. Стадия В. Метил 2-этокси-3-4-[2-(6-[(Z)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. К 30 мл метанола добавляют соединение, полученное на стадии А (0,00198 моль), гидроксиламин гидрохлорид (0,00594 моль) и пиридин (0,00594 моль). Нагревают при орошении в течение 3 ч. Выпаривают досуха. Добавляют 100 мл соляной кислоты (1 N) и затем дважды экстрагируют с помощью 50 мл дихлорметана. Органическую фазу сушат над MgSO4 и затем выпаривают. (Е) соединение осаждают,используя диэтиловый эфир. Фильтрат затем выпаривают с получением (Z) соединения, указанного в заглавии, которое перекристаллизовывают из метанола. Точка плавления: 114-115 С. Пример 3. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропаноат. Стадия А. Метил 3-[4-(2-хлорэтокси)фенил]-2-(2,2,2-трифторэтокси)-2-пропеноат. Процедуру выполняют как на стадии А примера 1, заменяя 2-этокси-2-диэтилфосфоноацетат на 2(2,2,2-трифторметокси)-2-диэтилфосфоноацетат. Белое твердое вещество. Точка плавления: 50-51 С. Стадия В. Метил 3-[4-(2-хлорэтокси)фенил]-2-(2,2,2-трифторэтокси)пропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 1. Масло. Стадия С. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-(2,2,2-трифторэтокси)пропаноат. Исходя из соединения, полученного на стадии В, процедуру выполняют как на стадии С примера 1. Твердое вещество. Точка плавления: 46-47 С. Стадия D. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропаноат. Исходя из соединения, полученного на стадии С, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Твердое вещество. Точка плавления: 67-68 С. Пример 4. Метил 3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропаноат. Исходя из соединения, полученного на стадии С примера 3, процедуру выполняют как на стадии В примера 2. Твердое вещество. Точка плавления: 55-56 С. Пример 5. 2-Этокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропановая кислота. Заглавное соединение получают путем гидролиза соединения, полученного в примере 1, используя КОН в смеси метанол/вода.-8 007718 Пример 5 а. 2-Этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси)фенилпропановая кислота. Заглавное соединение получают путем гидролиза соединения, полученного в примере 1 а, используя КОН в смеси метанол/вода. Твердое вещество. Точка плавления: 151-152 С. Исходя из соединения, полученного в примере 5 а, примеры 5 а(1) и 5 а(2) получают путем хирального разделения на CHIRALPAK AD, используя смесь н-гептан/изопропанол/трифторуксусная кислота(750/250/1) и определение при 280 нм. Пример 5 а(1). 2-Этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота, энантиомер 1. Заглавное соединение получают с оптической чистотой более чем 99%. Пример 5 а(2). 2-Этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота, энантиомер 2. Заглавное соединение получают с оптической чистотой 98,6%. Пример 5b. 2-Этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота. Заглавное соединение получают путем гидролиза соединения, полученного в примере 1b, используя КОН в смеси метанол/вода. Исходя из соединения, полученного в примере 5b, примеры 5b(1) и 5b(2) получают посредством хирального хроматографического разделения. Пример 5b(1). 2-Этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота, энантиомер 1. Пример 5b(2). 2-Этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота, энантиомер 2. Пример 6. 2-Этокси-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропановая кислота. Начиная с (Z, Е) смеси, полученной в примере 2, процедуру выполняют как в примере 5. Точка плавления: 84-85 С. Пример 6 а. 2-Этокси-3-4-[2-(6-[(E)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота. Начиная с (Е) соединения, полученного в примере 2, процедуру выполняют как в примере 5. Пример 6b. 2-Этокси-3-4-[2-(6-[(Z)(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенилпропановая кислота. Начиная с (Z) соединения, полученного в примере 2, процедуру выполняют как в примере 5. Пример 7. Метил 3-4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенил-2-этоксипропаноат. Стадия А. Метил 3-4-[2-(6-(3-хлорбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропаноат. Процедуру выполняют как на стадии С примера 1, заменяя 6-бензоилбензотиазолинон на 6-(3 хлор)бензоилбензотиазолинон. Точка плавления: 100-101 С. Стадия В. Метил 3-4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Твердое вещество. Точка плавления: 113-114 С. Пример 8. Метил 3-4-[2-(6-[(3-хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии А примера 7, процедуру выполняют как на стадии В примера 2. Два (Z) и (Е) соединения не разделяют. Твердое вещество. Точка плавления: 146-147 С. Пример 9. Метил 2-метокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропаноат. Процедуру выполняют как в примере 1, заменяя 2-этокси-2-диэтилфосфоноацетат на 2-метокси-2 диэтилфосфоноацетат. Точка плавления: 142-144 С. Пример 10. Метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо 1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат.-9 007718 Стадия А. Метил 2-[(трет-бутоксикарбонил)амино]-3-(4-гидроксифенил)пропаноат. 25 г метил 2-амино-3-(4-гидроксифенил)пропионата (128 ммоль) растворяют в 110 мл метанола. Температуру понижают до 0 С и подряд добавляют 53,4 мл триэтиламина и затем 30,73 г ди-трет-бутил дикарбоната. Смеси позволяют достичь комнатной температуры и реакционную смесь перемешивают в течение ночи. Растворитель выпаривают и осадок очищают с помощью колоночной хроматографии на силикагеле(элюант:циклогексан/этилацетат 7/3) для того, чтобы получить заглавное соединение в форме белого твердого вещества. Точка плавления: 106-108 С. Стадия В. Метил 2-[(трет-бутоксикарбонил)амино]-3-[4-(2-хлорэтокси)фенил]пропаноат. 5 г (16,94 ммоль) соединения, полученного на стадии А, растворяют в 100 мл ацетона и добавляют 7,02 г карбоната калия. Смесь нагревают при орошении растворителя и перемешивают в течение 1 ч; затем добавляют 24,29 г 1-бром-2-хлорэтана и реакционную смесь перемешивают при орошении в течение 12 дней. Смесь отфильтровывают и фильтрат выпаривают. Полученный осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 8/2) с получением заглавного соединения в форме белого твердого вещества. Точка плавления: 52-54 С. Стадия С. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(трет-бутоксикарбонил)амино]пропаноат. 3,6 г 6-бензоилтиазолинона растворяют в 40 мл диметилформамида и затем добавляют 4,87 г карбонат калия и температуру доводят до 80 С в течение 1 ч. Затем добавляют 6,05 г соединения, полученного на стадии В, и реакционную смесь перемешивают при 100 С в течение ночи. Смесь отфильтровывают и растворитель выпаривают досуха. Осадок переносят в этилацетат и промывают насыщенным раствором гидрокарбоната натрия. Объединенные органические фазы сушат над сульфатом магния и концентрируют. Второй осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 6/4). Заглавное соединение получают в форме желтого твердого вещества. Точка плавления: 76-79 С. Стадия D. Метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии С, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Масло. Пример 11. Метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2 оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии С примера 10, процедуру выполняют как на стадии В примера 2. Два (Z) и (Е) соединения не разделяют. Точка плавления: 80-82 С. Пример 12. Метил 2-[(бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо 1,3-бензотиазол-3(2H)-ил)этокси]фенил-пропаноат. Стадия А. Метил 2-амино-3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат трифторацетат. 4 г соединения, полученного на стадии С примера 10, растворяют в 200 мл дихлорметана и температуру понижают до 0 С. Затем добавляют 12,47 мл трифторуксусной кислоты и реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Растворитель выпаривают, смесь переносят в воду и рН доводят до 7-8. Водную фазу экстрагируют дихлорметаном; затем органические фазы сушат(MgSO4) и выпаривают. Осадок растирают в порошок в диэтиловом эфире и фильтруют с отсасыванием с получением заглавного соединения в форме белого твердого вещества. Точка плавления: 130-132 С. Стадия В. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(бутоксикарбонил)амино]пропаноат. 700 мг соединения, полученного на стадии А, растворяют в 10 мл этилацетата; затем добавляют 0,494 мл триэтиламина и температуру понижают до 0 С. Добавляют 0,229 мл бутилхлорформиата и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок очищают с помощью колоночной хроматографии на силикагеле (элюант: петролейный эфир/AcOEt 7/3). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 74-76 С. Стадия С. Метил 2-[(бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат.- 10007718 Исходя из соединения, полученного на стадии В, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 13. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-[(феноксикарбонил)амино]пропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(феноксикарбонил)амино]пропаноат. 1,5 г соединения, полученного на стадии А примера 12, растворяют в 20 мл этилацетата; затем добавляют 1,06 мл триэтиламина и температуру понижают до 0 С. Затем добавляют 0,637 мл фенилхлорформиата и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 6/4). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 74-76 С. Стадия В. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенил-2-[(феноксикарбонил)амино]пропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 14. Метил 2-[(бензилокси)карбонил]амино-3-4-[2-(6-[(гидроксиимино)-(фенил)метил]-2 оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(бензилокси) карбонил]аминопропаноат. 1,5 г соединения, полученного на стадии А примера 12, растворяют в 20 мл этилацетата; затем добавляют 1,06 мл триэтиламина и температуру понижают до 0 С. Добавляют 0,725 мл бензилхлорформиата и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 6/4). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 64-68 С. Стадия В. Метил 2-[(бензилокси)карбонил]амино-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2 оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 15. Метил 2-(ацетиламино)-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилпропаноат. Стадия А. Метил 2-(ацетиламино)-3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил пропаноат. 500 мг соединения, полученного на стадии А примера 12, растворяют в 10 мл этилацетата; затем добавляют 0,353 мл триэтиламина и температуру понижают до 0 С. Добавляют 0,121 мл ацетилхлорида и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок перекристаллизовывают из смеси толуол/изопропанол (95/5). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 142-144 С. Стадия В. Метил 2-(ацетиламино)-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 16. Метил 2-(бутириламино)-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилпропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-(бутириламино) пропаноат. 500 мг соединения, полученного на стадии А примера 12, растворяют в 10 мл этилацетата; 0,353 мл триэтиламина затем добавляют и температуру понижают до 0 С. Добавляют 0,177 мл бутирилхлорида и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 6/4). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 67-69 С. Стадия В. Метил 2-(бутириламино)-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 17. Метил 2-(бензоиламино)-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилпропаноат.- 11007718 Стадия А. Метил 2-(бензоиламино)-3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил пропаноат. 500 мг соединения, полученного на стадии А примера 12, растворяют в 10 мл этилацетата; затем добавляют 0,353 мл триэтиламина и температуру понижают до 0 С. Добавляют 0,197 мл бензоилхлорида и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 7/3). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 124-126 С. Стадия В. Метил 2-(бензоиламино)-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 18. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-[(фенилацетил)амино]пропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(фенилацетил)амино]пропаноат. 500 мг соединения, полученного на стадии А примера 12, растворяют в 10 мл этилацетата; затем добавляют 0,353 мл триэтиламина и температуру понижают до 0 С. Добавляют 0,226 мл фенилацетилхлорида и смеси позволяют достичь комнатной температуры и перемешивают в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Осадок очищают с помощью колоночной хроматографии на силикагеле (элюант:петролейный эфир/AcOEt 8/2). Заглавное соединение получают в форме белого твердого вещества. Точка плавления: 122-124 С. Стадия В. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенил-2-[(фенилацетил)амино]пропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 19. Метил 2-амино-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропаноат. Растворяют соединение, полученное в примере 10 (1 экв.) в 250 мл безводного DCM и по каплям добавляют ТФА (20 экв.). Перемешивают в течение 5 ч и выпаривают. Переносят в воду и подщелачивают, используя 10% K2 СО 3. Экстрагируют с помощью этилацетата. Промывают органические фазы водой,сушат над MgSО 4, фильтруют и выпаривают. Переносят в минимум метанола и барботируют газообразный НСl через эту смесь в течение 30 мин. Выпаривают досуха и переносят в диизопропиловый эфир. Отфильтровывают осадок и перекристаллизовывают из диэтилового эфира. Точка плавления: 112-114 С. Пример 20. Метил 2-амино-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропаноат. Исходя из соединения, полученного в примере 11, процедуру выполняют как в примере 19. Точка плавления: 119-122 С. Пример 21. Метил 2-[(трет-бутоксикарбонил)(метил)амино]-3-4-[2-(6-(метоксиимино)(фенил)метил 2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(третбутоксикарбонил)(метил)амино]пропаноат. Растворяют соединение, полученное на стадии С примера 10 (1 экв.), и CH3I (2 экв.) в 55 мл безводного ДМФА и помещают в ледяную баню при 0 С. Добавляют NaH (1,5 экв.) порциями. Раствору позволяют достичь комнатной температуры. Гидролизуют, подкисляют с помощью НСl и фильтруют. Полученный сырой продукт очищают с помощью хроматографии на силикагеле (элюант: диэтиловый эфир/толуол 2/8). Масло. Стадия В. Метил 2-[(трет-бутоксикарбонил)(метил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 22. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-(метиламино)пропаноат. Исходя из соединения, полученного в примере 21, процедуру выполняют как в примере 19. Пример 23. Метил 2-(2-гидроксифенил)-3-4-[2-(6-[(метоксиимино)(фенил)метил]2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат.- 12007718 1-ый способ. Стадия А. 6-Бензоил-3-(2-4-[(2-оксо-2,3-дигидро-1-бензофуран-3-ил)метил]феноксиэтил)-1,3 бензотиазол-2(3 Н)-он. Начиная с 6-бензоилбензотиазолинона и 3-[4-(2-хлорэтокси)бензил]-1-бензофуран-2(3H)-она, процедуру выполняют как на стадии С примера 1. Стадия В. 6-[(Метоксиимино)(фенил)метил]-3-(2-4-[(2-оксо-2,3-дигидро-1-бензофуран-3-ил)метил] феноксиэтил)-1,3-бензотиазол-2(3 Н)-он. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Стадия С. Метил 2-(2-гидроксифенил)-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат. 1,5 г соединения, полученного на стадии В, в 50 мл метанола и 0,1 мл концентрированной серной кислоты, нагревают при орошении в течение 2 ч. Затем растворитель выпаривают, осадок гидролизуют и полученный осадок хроматографируют на силикагеле (элюант: AcOEt/толуол 5/95). Точка плавления: 80-82 С. 2-ой способ. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-(2-гидроксифенил)пропаноат. Начиная с 6-бензоилбензотиазолинона и метил 3-[4-(2-хлорэтокси)фенил]-2-(2-гидроксифенил)пропаноата, процедуру выполняют как на стадии С примера 1. Точка плавления: 119-121 С. Стадия В. Метил 2-(2-гидроксифенил)-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Точка плавления: 80-82 С. Пример 24. 2-(2-Гидроксифенил)-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилпропановая кислота. Заглавное соединение получают после гидролиза соединения, полученного в примере 23, используя смесь NaOH/диоксан. Пример 25. Метил 2-бензил-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропаноат. Стадия А. Метил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-3-фенилпропаноат. Процедуру выполняют как на стадии С примера 1, заменяя метил [(2-хлорэтокси)фенил]-2 этоксипропаноат на метил 2-бензил-3-[4-(2-хлорэтокси)фенил]пропаноат. Заглавное соединение получают в форме бежевого твердого вещества. Точка плавления: 65-67 С. Стадия В. Метил 2-бензил-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 26. Метил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] бензил-4-фенилбутаноат. Стадия А. Метил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-4-фенилбутаноат. Процедуру выполняют как на стадии С примера 1, заменяя [(2-хлорэтокси)фенил]-2-этоксипропаноат на метил 2-[4-(2-хлорэтокси)бензил]-4-фенилбутаноат. Белое твердое вещество. Точка плавления: 51-54 С. Стадия В. Метил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензил-4-фенилбутаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Два (Z) и (Е) соединения не разделяют. Белое твердое вещество. Точка плавления: 80-83 С. Пример 27. Метил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] бензил-4-фенилбутаноат. Исходя из соединения, полученного на стадии А примера 26, процедуру выполняют как на стадии В примера 2. Два (Z) и (Е) соединения не разделяют. Бежевое твердое вещество. Точка плавления: 58-60 С. Пример 28. Метил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] бензил-5-фенилпентаноат. Стадия А. Метил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]бензил-5-фенилпентаноат.- 13007718 Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на метил 2-[4-(2-хлорэтокси)бензил]-5-фенилпентаноат. Бежевое твердое вещество. Точка плавления: 55-57 С. Стадия В. Метил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] бензил-5-фенилпентаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 29. N-(трет-Бутоксикарбонил)-4-[2-(6-[(гидроксимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилаланин. Заглавное соединение получают путем гидролиза, в основной среде, соединения, полученного в примере 11. Точка плавления: разложение после 250 С. Пример 30. N-(трет-Бутоксикарбонил)-4-[2-(6-[(метоксимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилаланин. Заглавное соединение получают путем гидролиза, в основной среде, соединения, полученного в примере 10. Пример 31. Этил 2-4-[2-(6-[(метоксимино)(фенил)метил]-2-оксо-1,3-бензо-тиазол-3(2H)-ил)этокси] фенокси-2-метилпропаноат. Стадия А. Этил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропаноат. К раствору, который нагревают при 80 С в течение 2 ч, 6-бензоил-бензотиазолинона (7,6 ммоль) в присутствии K2 СО 3 в 20 мл ДМФА добавляют этил 2-[4-(2-хлорэтокси)фенокси]-2-метилпропаноат. Реакционную смесь нагревают при 120 С в течение 5 дней, охлаждают, гидролизуют, используя 100 мл воды и подщелачивают, используя 1N NaOH. Полученный осадок отфильтровывают и затем перекристаллизовывают из циклогексана с получением заглавного соединения в форме белого порошка. Точка плавления: 120-121 С. Стадия В. Этил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенокси-2-метилпропаноат. Раствор соединения, полученного на стадии А (500 мг), и О-метилгидроксиламин гидрохлорид (165 мг) в 15 мл пиридина нагревают при орошении в течение 3 ч. Реакционную смесь гидролизуют, используя 100 мл ледяной воды, подкисляют, используя 6N НСl, и затем экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния и затем выпаривают досуха при пониженном давлении. Затем осадок очищают на силикагеле, элюант: AcOEt/ПЭ 2/8, с получением заглавного соединения в форме белого масла (воск). Пример 32. Этил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2-метилпропаноат. Раствор соединения, полученного на стадии А примера 31 (500 мг), и гидроксиламин гидрохлорид(137 мг) в 10 мл пиридина нагревают при орошении в течение 3 ч. Реакционную смесь гидролизуют, используя 100 мл ледяной воды, и подкисляют, используя 6N НСl. Полученный осадок затем отфильтровывают, промывают водой и затем петролейным эфиром и очищают на силикагеле (элюант AcOEt/ПЭ 2/8) с получением заглавного соединения в форме белого порошка. Точка плавления: 60-62 С. Пример 33. 2-4-[2-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси 2-метилпропановая кислота. К раствору соединения, полученного на стадии В примера 31 (0,8 г) в 5 мл этанола 95, добавляют гидроксид калия (100 мг), растворенного в 1 мл этанола 95. Реакционную смесь нагревают при орошении в течение ночи. После охлаждения до комнатной температуры, раствор подкисляют, используя 1NHCl. Полученный осадок затем отфильтровывают и очищают в обратной фазе, RP18, элюант МеОН/Н 2 О 6/4, с получением заглавного соединения в форме белого порошка. Точка плавления: разложение после 170 С. Пример 34. 2-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси-2-метилпропановая кислота. К раствору соединения, полученного в примере 32 (0,5 г) в 5 мл этанола 95, добавляют гидроксид калия (107 мг), растворенного в 1 мл этанола 95. Реакционную смесь нагревают при орошении в течение ночи. После охлаждения до комнатной температуры, раствор подкисляют, используя 1N HCl. Полученный осадок затем фильтруют и очищают на обратной фазе, RP18, элюант МеОН/Н 2 О 6/4, с получением заглавного соединения в форме белого порошка. Точка плавления: разложение после 170 С. Пример 35. Этил 2-4-[2-(6-[(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенокси-2-метилпропаноат. Стадия А. Этил 2-4-[2-(6-(3-хлорбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропаноат.- 14007718 К раствору, который нагревают при 80 С в течение 2 ч, 6-(3'-хлорбензоил)бензотиазолинона (1,8 г) в присутствии K2 СО 3 (1,72 г) в 20 мл ДМФА добавляют этил 2-[4-(2-хлорэтокси)фенокси]-2-метилпропаноат (1,96 г). Реакционную смесь нагревают при 120 С в течение 5 дней, охлаждают, гидролизуют, используя 100 мл воды, и подщелачивают, используя 1N NaOH. Полученный осадок отфильтровывают и затем перекристаллизовывают из циклогексана с получением заглавного соединения в форме белого порошка. Точка плавления: 125-126 С. Стадия В. Этил 2-4-[2-(6-[(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенокси-2-метилпропаноат. Раствор соединения, полученного на стадии А (1,00 г), и О-метилгидроксиламин гидрохлорид (309 мг) в 15 мл пиридина нагревают при орошении в течение 3 ч. Реакционную смесь гидролизуют, используя 100 мл ледяной воды, и подкисляют, используя 6N НСl. Полученный осадок отфильтровывают, промывают водой и затем перекристаллизовывают из петролейного эфира путем охлаждения в морозильной камере с получением заглавного соединения в форме белого порошка. Точка плавления: 93-98 С. Пример 36. 2-4-[2-(6-[(3-Хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2-метилпропановая кислота. К раствору соединения, полученного в примере 35 (0,4 г) в 5 мл этанола 95, добавляют гидроксид калия (40 мг), расстворенный в 1 мл этанола 95. Реакционную смесь нагревают при орошении в течение ночи. После охлаждения до комнатной температуры, раствор подкисляют, используя 1N HCl. Затем полученный осадок отфильтровывают и очищают на обратной фазе, RP18, элюант МеОН/Н 2 О 6/4, с получением заглавного соединения в форме белого порошка. Точка плавления: разложение, начиная с 230 С. Пример 37. Этил 2-4-[2-(6-[(3-хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенокси-2-метилпропаноат. Раствор соединения, полученного на стадии А примера 35 (1,30 г), и гидроксиламин гидрохлорид(335 мг) в 10 мл пиридина нагревают при орошении в течение 3 ч. Реакционную смесь гидролизуют, используя 100 мл ледяной воды, и подкисляют, используя 6N НСl. Затем полученный осадок фильтруют,промывают водой и затем петролейным эфиром и затем очищают на обратной фазе, RP18, элюант МеОН/Н 2 О 6/4, с получением заглавного соединения в форме белого порошка. Пример 38. 2-4-[2-(6-[(3-Хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2-метилпропановая кислота. К раствору соединения, полученного в примере 37 (0,6 г) в 5 мл этанола 95, добавляют гидроксид калия (90 мг), расстворенный в 1 мл этанола 95. Реакционную смесь нагревают при орошении в течение ночи. После охлаждения до комнатной температуры, раствор подкисляют, используя 1N HCl. Затем полученный осадок отфильтровывают и очищают на обратной фазе, RP18, элюант МеОН/Н 2 О 6/4, с получением заглавного соединения в форме белого порошка. Точка плавления: разложение, начиная с 170 С. Пример 39. Этил 5-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2,2-диметилпентаноат. Стадия А. Этил 5-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2,2-диметилпентаноат. К раствору, который нагревают при 80 С в течение 2 ч, 6-бензоил-бензотиазолинона (1 г) в присутствии K2 СО 3 (1,08 г) в 10 мл ДМФА добавляют этил 5-[4-(2-хлорэтокси)фенокси]-2,2-диметилпентаноат(1,41 г). Реакционную смесь нагревают при 120 С в течение 5 дней и затем гидролизуют, используя 100 мл воды. Раствор экстрагируют этилацетатом, сушат над сульфатом магния и затем выпаривают досуха при пониженном давлении. Осадок очищают на силикагеле, элюант AcOEt/ПЭ 2/8, с получением заглавного соединения в форме белого порошка. Точка плавления: 82-84 С. Стадия В. Этил 5-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенокси-2,2-диметилпентаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Точка плавления: 66-68 С. Пример 40. 4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил ацетонитрил. Стадия А. 4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилацетонитрил. Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на [4-(2-хлорэтокси)фенил]ацетонитрил. Белое твердое вещество. Точка плавления: 160-162 С. Стадия В. 4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил ацетонитрил.- 15007718 Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Пример 41. 3-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил пропаннитрил. Стадия А. 3-4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилпропаннитрил. Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на 3-[4-(2-хлорэтокси)фенил]пропаннитрил. Белое твердое вещество. Точка плавления: 106-108 С. Стадия В. 3-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил пропаннитрил. Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Пример 42. 6-[(Гидроксиимино)(фенил)метил]-3-2-[4-(1H-тетразол-5-илметил)фенокси]этил-1,3 бензотиазол-2(3H)-он. Стадия А. 6-Бензоил-3-2-[4-(1 Н-тетразол-5-илметил)фенокси]этил-1,3-бензотиазол-2(3 Н)-он. Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на 5-[4-(2-хлорэтокси)бензил]-1H-тетразол. Белое твердое вещество. Точка плавления: 140-142 С. Стадия В. 6-[(Гидроксиимино)(фенил)метил]-3-2-[4-(1 Н-тетразол-5-илметил)фенокси]этил-1,3 бензотиазол-2(3 Н)-он. Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Пример 43. 6-[(Гидроксиимино)(фенил)метил]-3-(2-4-[2-(1H-тетразол-5-ил)этил]феноксиэтил)-1,3 бензотиазол-2(3H)-он. Стадия А. 6-Бензоил-3-(2-4-[2-(1H-тетразол-5-ил)этил]феноксиэтил)-1,3-бензотиазол-2(3 Н)-он. Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на 5-2-[4-(2-хлорэтокси)фенил]этил-1 Н-тетразол. Белое твердое вещество. Точка плавления: 120-124 С. Стадия В. 6-[(Гидроксиимино)(фенил)метил]-3-(2-4-[2-(1 Н-тетразол-5-ил)этил]феноксиэтил)-1,3 бензотиазол-2(3 Н)-он. Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Пример 44. трет-Бутил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилэтилкарбамат. Стадия А. трет-Бутил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилэтилкарбамат. Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на трет-бутил 2-[4-(2-хлорэтокси)фенил]этилкарбамат. Белое твердое вещество. Точка плавления: 114-116 С. Стадия В. трет-Бутил 2-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенилэтилкарбамат. Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Пример 45. N-(2-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилэтил)ацетамид. Стадия А. N-(2-4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси)фенилэтил)ацетамид. Процедуру выполняют как на стадии С примера 1, заменяя метил 3-[4-(2-хлорэтокси)фенил]-2 этоксипропаноат на N-2-[4-(2-хлорэтокси)фенил]этилацетамид. Белое твердое вещество. Точка плавления: 108-110 С. Стадия В. N-(2-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенилэтил)ацетамид. Исходя из соединения, полученного на стадии А, процедуру выполняют как в примере 37. Пример 46. Этил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] феноксипропаноат. Стадия А. Этил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]феноксипропаноат. Процедуру выполняют как на стадии С примера 1, заменяя метил [(2-хлорэтокси)фенил]-2 этоксипропаноат на этил 2-[4-(2-хлорэтокси)фенокси]пропаноат. Белое твердое вещество. Точка плавления: 100-101 С. Стадия В. Этил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] феноксипропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин.- 16007718 Пример 47. Этил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] феноксибутаноат. Стадия А: Этил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]феноксибутаноат. Процедуру выполняют как на стадии С примера 1, заменяя метил [(2-хлорэтокси)фенил]-2-этоксипропаноат на этил 2-[4-(2-хлорэтокси)фенокси]бутаноат. Белое твердое вещество. Точка плавления: 113-114 С. Стадия В. Этил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] феноксибутаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 48. 2-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси пропановая кислота. Стадия А. 2-4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]феноксипропановая кислота. Исходя из соединения, полученного на стадии А примера 46, процедуру выполняют как в примере 33. Белое твердое вещество. Точка плавления: 159-160 С. Стадия В. 2-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси пропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 49. Этил 2-4-[2-(6-[N-метоксиэтанимидоил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси 2-метилпропаноат. Стадия А. Этил 2-4-[2-(6-ацетил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии С примера 1, заменяя метил [(2-хлорэтокси)фенил]-2-этоксипропаноат на этил 2-[4-(2-хлорэтокси)фенокси]-2-метилпропаноат и заменяя 6-бензоилбензотиазолинон на 6-ацетилбензотиазолинон. Белое твердое вещество. Точка плавления: 112-113 С. Стадия В. Этил 2-4-[2-(6-[N-метоксиэтанимидоил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси 2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Два (Z) и (Е) соединения не разделяют. Бесцветное масло. Пример 50. 2-4-[2-(6-[N-Метоксиэтанимидоил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси 2-метилпропановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 49, процедуру выполняют как в примере 33. Белое твердое вещество. Точка плавления. 145-148 С. 2-ой способ. Стадия А. 2-4-[2-(6-Ацетил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропановая кислота. Исходя из соединения, полученного на стадии А примера 49, процедуру выполняют как в примере 33. Точка плавления: 175,5-177,5 С. Стадия В. 2-4-[2-(6-[N-Метоксиэтанимидоил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2 метилпропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Белое твердое вещество. Точка плавления: 145-148 С. Пример 51. Этил 2-4-[2-(6-[N-гидроксиэтанимидоил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси 2-метилпропаноат. Исходя из соединения, полученного на стадии А примера 49, процедуру выполняют как на стадии В примера 2. Пример 52. 2-4-[2-(6-[N-Гидроксиэтанимидоил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси-2 метилпропановая кислота. Исходя из соединения, полученного в примере 51, процедуру выполняют как в примере 33. Белое твердое вещество. Точка плавления: 185-187 С. Пример 53. Метил 3-4-[2-(6-[циклопропил(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенил-2-этоксипропаноат. Стадия А. Метил 3-4-[2-(6-(циклопропилкарбонил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил 2-этоксипропаноат.- 17007718 Процедуру выполняют как на стадии С примера 1, заменяя 6-бензоилбензотиазолинон на 6-(циклопропилкарбонил)бензотиазолинон. Точка плавления: 97-98 С. Стадия В. Метил 3-4-[2-(6-[циклопропил(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 54. Метил 3-4-[2-(6-[(3-хлорфенил)(метоксиимино)метил] -2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенил-2-этоксипропаноат. Стадия А. Метил 3-4-[2-(6-(3-хлорбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропаноат. Процедуру выполняют как на стадии С примера 1, заменяя 6-бензоилбензотиазолинон на 6-(3 хлорбензоил)бензотиазолинон. Стадия В. Метил 3-4-[2-(6-[(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)ил)этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2,заменяя гидроксиламин на О-метилгидроксиламин. Пример 55. 3-4-[2-(6-[(3-Хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропановая кислота. Исходя из соединения, полученного в примере 53, процедуру выполняют как в примере 33. Точка плавления: 96-98 С. Пример 56. Метил 3-4-[2-(6-[(3-хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенил-2-этоксипропаноат. Процедуру выполняют как в примере 54, заменяя в стадии В О-метилгидроксиламин на гидроксиламин. Пример 57. Метил 3-4-[2-(6-[(трет-бутоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии С примера 1, процедуру выполняют как на стадии В примера 2, заменяя гидроксиламин на O-(трет-бутил)гидроксиламин. Пример 58. 3-4-[2-(6-[(трет-Бутоксиимино)(фенил)метил]-2-оксо-1,3-бензо-тиазол-3(2H)-ил)этокси] фенил-2-этоксипропановая кислота. Исходя из соединения, полученного в примере 57, процедуру выполняют как в примере 33. Точка плавления: 80-81 С. Пример 59. Метил 3-4-[2-(6-(бензилокси)имино](фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии С примера 1, процедуру выполняют как на стадии В примера 2, заменяя гидроксиламин на О-бензилгидроксиламин. Пример 60. 3-4-[2-(6-(Бензилокси)имино](фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропановая кислота. Исходя из соединения, полученного в примере 59, процедуру выполняют как в примере 33. Точка плавления: 105-106 С. Пример 61. 3-4-[2-(6-[(Z)-(3-Хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропановая кислота. Исходя из соединения, полученного в примере 7, процедуру выполняют как в примере 33. Точка плавления: 96-98 С. Пример 62. 3-4-[2-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил 2-(2,2,2-трифторэтокси)пропановая кислота. Исходя из соединения, полученного в примере 3, процедуру выполняют как в примере 33. Точка плавления: 56-57 С. Пример 62 а. 3-4-[2-(6-[(E)-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропановая кислота. Соединение, полученное в примере 62, переносят в диэтиловый эфир. Заглавное соединение осаждают селективно и отфильтровывают. Исходя из соединения, полученного в примере 62 а, примеры 62 а(1) и 62 а(2) получают путем хирального разделения на CHIRALPAK AD, используя смесь метенол/вода/трифторуксусная кислота(1000/5/1) и определение при 285 нм. Пример 62 а(1). 3-4-[2-(6-[(E)-(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропановая кислота, энантиомер 1. Заглавное соединение получают с оптической чистотой более чем 99%. Пример 62 а(2). 3-4-[2-(6-[(E)-(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропановая кислота, энантиомер 2. Заглавное соединение получают с оптической чистотой, большей или равной 98%. Пример 62b. 3-4-[2-(6-[(Z)-Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-(2,2,2-трифторэтокси)пропановая кислота.- 18007718 Соединение, полученное в примере 62, переносят в диэтиловый эфир. Фильтрат восстанавливают и выпаривают с получением заглавного соединения. Исходя из соединения, полученного в примере 62b, примеры 62b(1) и 62b(2) получают путем разделения на хиральной колонке. Пример 62b(1). 3-4-[2-(6-[Z)-Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-(2,2,2-трифторэтокси)пропановая кислота, энантиомер 1. Пример 62b(2). 3-4-[2-(6-[Z)-Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-(2,2,2-трифторэтокси)пропановая кислота, энантиомер 2. Пример 63. Метил 2-изопропокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2H)-ил)этокси]фенилпропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-изопропоксипропаноат. Процедуру выполняют как в примере 1, стадии А, В и С, заменяя метил 2-этокси-2-диэтилфосфоноацетат в стадии А на метил 2-изопропокси-2-диэтилфосфоноацетат. Стадия В. Метил 2-изопропокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 64. 2-Изопропокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропановая кислота. Исходя из соединения, полученного в примере 63, процедуру выполняют как в примере 33. Точка плавления: 72-74 С. Пример 65. Этил 3-4-[2-(6-[(3-бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенил-2-этоксипропаноат. Стадия А. Этил 3-4-[2-(6-(3-бромбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропаноат. Процедуру выполняют как в примере 1, стадии А, В и С, заменяя метил 2-этокси-2-диэтилфосфоноацетат в стадии А на этил 2-этокси-2-диэтилфосфоноацетат и заменяя 6-бензоилбензотиазолинон в стадии С на 6-(3-бромбензоил)бензотиазолинон. Стадия В. Этил 3-4-[2-(6-[(3-бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Масло. Пример 66. Этил 3-4-[2-(6-[(Z)-(3-бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенил-2-этоксипропаноат. Соединение, полученное в примере 65, переносят в диэтиловый эфир и заглавное соединение осаждают селективным способом и фильтруют с получением (Z) изомера. Точка плавления: 86-88 С. Пример 67. Этил 5-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2,2-диметилпентаноат. Исходя из соединения, полученного на стадии А примера 39, процедуру выполняют как на стадии D примера 1. Точка плавления: 82-84 С. Пример 68. 5-4-[2-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси 2,2-диметилпентановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 67, процедуру выполняют как в примере 33. Точка плавления: 127-129 С. 2-ой способ. Стадия А. 5-4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2,2-диметилпентановая кислота. Исходя из соединения, полученного на стадии А примера 39, процедуру выполняют как в примере 33. Точка плавления: 90-92 С. Стадия В. 5-4-[2-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси 2,2-диметилпентановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Точка плавления: 127-129 С. Пример 69. 3-4-[2-(6-[(3-Бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропановая кислота. Исходя из соединения, полученного в примере 65, процедуру выполняют как в примере 33. Точка плавления: 58-60 С. Пример 70. 3-4-[2-(6-[(Z)-(3-Бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенил-2-этоксипропановая кислота.- 19007718 Соединение, полученное в примере 69, переносят в диэтиловый эфир и заглавное соединение осаждают селективным способом и отфильтровывают с получением (Z) изомера. Точка плавления: 74-76 С. Пример 71. 5-4-[2-(6-[(Гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси 2,2-диметилпентановая кислота. Исходя из соединения, полученного в примере 39, процедуру выполняют как в примере 33. Точка плавления: 148-150 С. Пример 72. Этил 3-4-[2-(6-[(2-бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил) этокси]фенил-2-этоксипропаноат. Стадия А. Этил 3-4-[2-(6-(2-бромбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропаноат. Процедуру выполняют как в примере 1, стадии А, В и С, заменяя метил 2-этокси-2-диэтилфосфоноацетат в стадии А на этил 2-этокси-2-диэтилфосфоноацетат и заменяя 6-бензоилбензотиазолинон в стадии С на 6-(2-бромбензоил)бензотиазолинон. Масло. Стадия В. Этил 3-4-[2-(6-[(2-бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенил-2-этоксипропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Масло. Пример 73. 3-4-[2-(6-[(2-Бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 72, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. 3-4-[2-(6-(2-Бромбензоил)-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-этоксипропановая кислота. Исходя из соединения, полученного на стадии А примера 72, процедуру выполняют как в примере 33. Точка плавления: 64-66 С. Стадия В. 3-4-[2-(6-[(2-Бромфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенил-2-этоксипропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 74. Метил 2-4-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси]фенокси-2-метилпропаноат. Стадия А. Метил 2-4-[3-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2-метилпропаноат на метил 2-[4-(3-хлорпропокси)фенокси]-2-метилпропаноат. Стадия В. Метил 2-4-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 75. 2-4-[3-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси] фенокси-2-метилпропановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 74, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. 2-4-[3-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропановая кислота. Исходя из соединения, полученного на стадии А примера 74, процедуру выполняют как в примере 33. Точка плавления: 121-122 С. Стадия В. 2-4-[3-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси 2-метилпропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 76. Метил 2-3-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси] фенокси-2-метилпропаноат. Стадия А. Метил 2-3-[3-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на метил 2-[3-(3-хлорпропокси)фенокси]-2-метилпропаноат. Стадия В. Метил 2-3-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1.- 20007718 Пример 77. 2-3-[3-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси] фенокси-2-метилпропановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 76, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. 2-3-[3-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропановая кислота. Исходя из соединения, полученного на стадии А примера 76, процедуру выполняют как в примере 33. Точка плавления: 79-80 С. Стадия В. 2-3-[3-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси 2-метилпропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 78. Метил 2-3-[4-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)бутокси] фенокси-2-метилпропаноат. Стадия А. Метил 2-3-[4-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на метил 2-[3-(4-хлорбутокси)фенокси]-2-метилпропаноат. Стадия В. Метил 2-3-[4-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 79. 2-3-[4-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)бутокси] фенокси-2-метилпропановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 78, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. 2-3-[4-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси]фенокси-2-метилпропановая кислота. Исходя из соединения, полученного на стадии А примера 78, процедуру выполняют как в примере 33. Точка плавления: 70-71 С. Стадия В. 2-3-[4-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси]фенокси 2-метилпропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 80. Этил 2-4-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси]фенокси-2-метилпропаноат. Стадия А. Этил 2-4-[3-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на этил 2-[4-(3-хлорпропокси)фенокси]-2-метилпропаноат. Воск. Стадия В. Этил 2-4-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 81. Этил 2-3-[4-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси] фенокси-2-метилпропаноат. Стадия А. Этил 2-3-[4-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на этил 2-[3-(4-хлорбутокси)фенокси]-2-метилпропаноат. Точка плавления: 99-101 С. Стадия В. Этил 2-3-[4-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)бутокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 82. Этил 2-3-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)пропокси] фенокси-2-метилпропаноат. Стадия А. Этил 2-3-[3-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на этил 2-[3-(3-хлорпропокси)фенокси]-2-метилпропаноат. Воск. Стадия В. Этил 2-3-[3-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)пропокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1.- 21007718 Пример 83. N-Бутирил-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилаланин. Стадия А. 4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]-N-бутирилфенилаланин. Исходя из соединения, полученного на стадии А примера 16, процедуру выполняют как в примере 33. Точка плавления: 146-148 С. Стадия В. N-Бутирил-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенилаланин. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 84. Метил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2-метилпропаноат. Стадия А. Метил 2-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя этил 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на метил 2-[4-(2-хлорэтокси)фенокси]-2-метилпропаноат. Точка плавления: 97-98 С. Стадия В. Метил 2-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 31. Пример 85. Этил 2-3-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенокси-2-метилпропаноат. Стадия А. Этил 2-3-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропаноат. Процедуру выполняют как на стадии А примера 31, заменяя 2-[4-(2-хлорэтокси)фенокси]-2 метилпропаноат на этил 2-[3-(2-хлорэтокси)фенокси]-2-метилпропаноат. Точка плавления: 115-116 С. Стадия В. Этил 2-3-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенокси-2-метилпропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 31. Пример 86. 2-3-[2-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенокси 2-метилпропановая кислота. 1-ый способ. Исходя из соединения, полученного в примере 85, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. 2-3-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси-2-метилпропановая кислота. Исходя из соединения, полученного на стадии А примера 85, процедуру выполняют как в примере 33. Точка плавления: 130-131 С. Стадия В. 2-3-[2-(6-[(Метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенокси 2-метилпропановая кислота. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии D примера 1. Пример 87. N-[Бензоил-4-[2-(6-гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил-этокси] фенилаланин. 1-ый способ. Исходя из соединения, полученного в примере 17, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. N-Бензоил-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенилаланин. Исходя из соединения, полученного на стадии А примера 17, процедуру выполняют как в примере 33. Точка плавления: 108-110 С. Стадия В. N-Бензоил-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенилаланин. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 88. N-[(Бензоилокси)карбонил]-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилаланин. 1-ый способ. Исходя из соединения, полученного в примере 14, процедуру выполняют как в примере 33. 2-ой способ. Стадия А. 4-[2-(6-Бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]-N-[(бензилокси)-карбонил]фенилаланин. Исходя из соединения, полученного на стадии А примера 14, процедуру выполняют как в примере 33. Точка плавления: 74-76 С. Стадия В. N-[(Бензилокси)карбонил]-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол 3(2 Н)-ил)этокси]фенилаланин. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Пример 89. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]- 22007718 фенил-2-[(трифторацетил)амино]пропаноат. Стадия А. Метил 3-4-[2-(6-бензоил-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси]фенил-2-[(трифторацетил)амино]пропаноат. Процедуру выполняют как на стадии А примера 15, заменяя ацетилхлорид на трифторацетилхлорид. Точка плавления: 60-62 С. Стадия В. Метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил)этокси] фенил-2-[(трифторацетил)амино]пропаноат. Исходя из соединения, полученного на стадии А, процедуру выполняют как на стадии В примера 2. Фармакологическое исследование Пример А. Изучение острой токсичности. Острую токсичность оценивали после перорального введения группам, каждая из которых включает 8 мышей (262 г). За животными наблюдали с равномерными интервалами в течение первого дня и ежедневно в течение 2 недель после обработки. LD50 (доза, которая приводит к смерти 50% животных) была оценена и показала низкую токсичность соединений настоящего изобретения. Пример В. Исследование эффективности на генетических моделях. Мутации у лабораторных животных и также различные чувствительности к режимам диеты позволили разработать животные модели, которые имеют инсулинонезависимые диабеты и гиперлипидемию,связанную с ожирением и с резистентностью к инсулину. Генетические модели мышей (ob/ob) (Diabetes, 1982, 31 (1), 1-6) и Zucker (fa/fa) крысы были разработаны в различных лабораториях для того, чтобы понять физиопатологию этих болезней и протестировать эффективность новых антидиабетических соединений (Diabetes, 1983, 32, 830-838). Антидиабетический и гиполипидемический эффект у ob/ob мыши. 10-недельную ob/ob мышь женского пола (Harlan) используют для in vivo испытаний. Животных удерживают при 12-часовом цикле свет-темнота при 25 С. Мышь имеет базальную гипергликемию 2 г/л. Животных случайным образом выбирают на основе их гликемии, чтобы сформировать группы, состоящие из шести животных. Соединения, тестируемые интраперитонеальным путем, растворяют в смеси диметилсульфоксида (10%) и Солютола (Solutol) (15%), чтобы применять при 10 мг/кг в объеме 2,5 мл/кг дважды в день в течение 4 дней. При per os пути применения, соединения тестируют применяя при 30 мг/кг в объеме 2,5 мл/кг 1% НЕС дважды в день в течение 4 дней. Контрольные группы получают растворитель при тех же условиях, что и обработанные группы. Активность этих продуктов оценивают, измеряя гликемию через 24 ч после последнего применения и измеряя вес тела ежедневно. Соединения настоящего изобретения показывают очень хорошую способность понижать гликемию,которая сравнима с эффектами, полученными при использовании розиглитазона (rosiglitazone), который используют в качестве референтного вещества, но с несущественным изменением в весе тела, в то время как при тех же условиях розиглитазон показывает значительное увеличение через 4 дня. Кроме того, никаких побочных эффектов не наблюдается в течение in vivo испытаний. Так например, соединение примера 3 понижает гликемию 51% по сравнению с контрольной группой, которая сравнима с гликемией 61%, наблюдаемой для розиглитазона при тех же условиях. Более того, животные, обработанные розиглитазоном, показывают повышение веса тела 33% в сравнении с повышением веса тела контрольной группы, в то время как соединение примера 3, при тех же условиях показывают понижение 80% набирания веса в сравнении с контрольной группой. Пример С. Фармацевтическая композиция. 1000 таблеток, каждая из которых содержит 5 мг активного ингредиента метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-(2,2,2-трифторэтокси)пропаноата.(где R'2 вместе с в которой X представляет собой атом кислорода или серы, или группу СН 2 илиR образует дополнительную связь),R1 и R2, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу, арильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, арилоксигруппу, арил-(С 1 С 6)алкоксигруппу, в которой алкильная часть является линейной или разветвленной, линейную или разветвленную (С 1-С 6)алкоксигруппу, гидроксигруппу, аминогруппу, линейную или разветвленную (С 1 С 6)алкиламиногруппу или ди-(С 1-С 6)алкиламиногруппу, в которой алкильные части являются линейными или разветвленными,или R1 и R2 вместе образуют оксо-, тиоксо- или иминогруппу,причем также возможно, что R2 вместе с R'2 образуют дополнительную связь,А представляет собой (С 1-С 6)алкиленовую цепь, в которой одна СН 2-группа может быть заменена гетероатомом, выбранным из кислорода и серы, или группой NRa (в которой Ra представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу), или фениленовой или нафтиленовой группой,R3 и R4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена или группу R, OR или NRR', где R и R', которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 2-С 6)алкенильную группу, линейную или разветвленную (С 2 С 6)алкинильную группу, арильную группу, арил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, арил-(С 2-С 6)алкенильную группу, в которой алкенильная часть является линейной или разветвленной, арил-(С 2-С 6)алкинильную группу, в которой алкинильная часть является линейной или разветвленной, гетероарильную группу, гетероарил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, гетероарил-(С 2-С 6)алкенильную группу,в которой алкенильная часть является линейной или разветвленной, гетероарил-(С 2-С 6)алкинильную группу, в которой алкинильная часть является линейной или разветвленной, (С 3-С 8)циклоалкильную группу, (С 3-С 8)циклоалкил-(С 1-С 6)алкильную группу, в которой алкильная часть является линейной или разветвленной, или линейную или разветвленную (С 1-С 6)полигалоалкильную группу), или R3 и R4 вместе с атомами углерода, несущими их, когда они расположены на двух соседних атомах углерода, образуют цикл, который имеет 5 или 6 кольцевых членов и который может содержать гетероатом, выбранный из кислорода, серы и азота,R5 и R6, которые могут быть одинаковыми или различными, каждый может принимать те же значения, что и R, как указано выше,2D представляет собой бензольное ядро, в этом случае X не может представлять собой группу ,как указано выше,или D представляет собой пиридиновое, пиразиновое, пиримидиновое или пиридазиновое ядро,В представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или линейную или разветвленную (С 2-С 6)алкенильную группу, причем эти группы замещены группой формулы (II), в котов которой -R7 представляет собой группу рой Z представляет собой атом кислорода или серы, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,и R8 представляет собой арильную группу, арилалкильную группу, в которой алкильная часть содержит от 1 до 6 атомов углерода и может быть линейной или разветвленной, гетероарильную группу,гетероарилалкильную группу, в которой алкильная часть содержит от 1 до 6 атомов углерода и может быть линейной или разветвленной, CN, тетразол, -OR, -NRR' в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше,или группой R9, в которой R9 представляет собой CN, тетразол, или группу, в которой Z принимает значения, указанные выше, и R и R', которые могут быть одинаковыми или различными, принимают значения, указанные выше, n представляет собой 0, 1, 2, 3, 4, 5 или 6, и R10 и R11, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, причем понимают, чтоR10 и R11 не могут одновременно представлять собой атом водорода,или В представляет собой группу формулы (II) или группу R9, как они указаны выше,причем понимают, что оксим R6-C(=N-OR5)- может находиться в Z или Е конфигурации,арил означает фенильную, нафтильную или бифенильную группу, причем эти группы могут быть частично гидрогенированны,гетероарил означает любую моно- или бициклическую ароматическую группу, содержащую от 5 до 10 членов, которая может быть частично гидрогенированна в одном из колец в случае бициклических гетероарилов и которая содержит от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы,причем арильная и гетероарильная группы, определенные таким образом, могут быть замещены 1-3 группами, выбранными из линейной или разветвленной (C1-С 6)алкильной группы, линейной или разветвленной (С 1-С 6)полигалоалкильной группы, линейной или разветвленной (С 1-С 6)алкоксигруппы, гидроксигруппы, карбоксигруппы, формильной группы, NRbRc (в которой Rb и Rc, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, линейную или разветвленную(С 1-С 6)алкильную группу, арильную группу или гетероарильную группу), сложноэфирной группы, амидогруппы, нитрогруппы, цианогруппы и атомов галогена,их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 2. Соединения формулы (I) по п.1, в которой R1 и R2 вместе образуют оксогруппу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, в которой R3 и R4 представляют собой атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, в которой А представляет собой этиленоксигруппу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, в которой D представляет собой бензольное ядро, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, в которой X представляет собой атом серы, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по п.1, в которой R5 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по п.1, в которой R5 представляет собой алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по п.1, в которой R6 представляет собой незамещенную фенильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по п.1, в которой R6 представляет собой замещенную фенильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по п.1, в которой R6 представляет собой фенильную группу, замещенную атомом галогена, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по п.1, в которой В представляет собой алкильную группу, замещен, в которой Rx и Ry, которые могут быть одинаковыми или различными, представную группой ляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по п.1, в которой В представляет собой алкильную группу, замещенную группой, в которой Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по п.1, в которой В представляет собой алкильную группу, замещенную группой, в которой Rx, Ry и Rz, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 15. Соединения формулы (I) по п.1, в которой В представляет собой группуRx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием.Rx и Ry, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 17. Соединения формулы (I) по п.1, в которой В представляет собой группуRx, Ry и Rz, которые могут быть одинаковыми или различными, представляют собой атом водорода или алкильную группу, их энантиомеры и диастереоизомеры, а также их соли присоединения с фармацевтически приемлемой кислотой или основанием. 18. Соединения формулы (I) по п.1, которые представляют собой метил 2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенилпропаноат,метил 2-этокси-3-4-[2-(6-[(Z)-(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропаноат,метил 3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил 2-(2,2,2-трифторэтокси)пропаноат,2-этокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил пропановую кислоту,2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту,2-этокси-3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 1,2-этокси-3-4-[2-(6-[(E)-метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 2,2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту,2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 1,2-этокси-3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту, энантиомер 2,2-этокси-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенилпропановую кислоту,метил 3-4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропаноат,метил 3-4-[2-(6-[(3-хлорфенил)(гидроксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенил-2-этоксипропаноат,метил 2-метокси-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)эток- 26007718 си]фенилпропаноат,3-4-[2-(6-[(Z)-(3-хлорфенил)(метоксиимино)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-этоксипропановую кислоту,3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2-(2,2,2 трифторэтокси)пропановую кислоту,3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту,3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 1,3-4-[2-(6-[(E)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 2,3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту,3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 1,3-4-[2-(6-[(Z)-(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(2,2,2-трифторэтокси)пропановую кислоту, энантиомер 2,3-4-[2-(6-[(трет-бутоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2 этоксипропановую кислоту. 19. Соединения формулы (I) по п.1, которые представляют собой метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3 бензотиазол-3(2 Н)-ил)этокси]фенилпропаноат,метил 2-[(трет-бутоксикарбонил)амино]-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3 бензотиазол-3(2H)-ил)этокси]фенилпропаноат,метил 2-[(бутоксикарбонил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3 бензотиазол-3(2H)-ил)этокси]фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2[(феноксикарбонил)амино]пропаноат,метил 2-[(бензилокси)карбонил]амино-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3 бензотиазол-3(2H)-ил)этокси]фенилпропаноат,метил 2-[(трет-бутоксикарбонил)(метил)амино]-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо 1,3-бензотиазол-3(2H)-ил)этокси]фенилпропаноат,N-(трет-бутоксикарбонил)-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)ил)этокси]фенилаланин,N-(трет-бутоксикарбонил)-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2 Н)-ил) этокси]фенилаланин. 20. Соединения формулы (I) по п.1, которые представляют собой метил 2-амино-3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропаноат,метил 2-амино-3-4-[2-(6-[(гидроксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси] фенилпропаноат,метил 3-4-[2-(6-[(метоксиимино)(фенил)метил]-2-оксо-1,3-бензотиазол-3(2H)-ил)этокси]фенил-2(метиламино)пропаноат. 21. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (III) в которой D, R1, R2, R6 и X принимают значения, указанные для формулы (I), с которым конденсируют, в основной среде, соединение формулы (IV) в которой А, В, R3 и R4 принимают значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (V) в которой R1, R2, R3, R4, R6, A, В, D и X принимают значения, указанные для формулы (I),которое подвергают действию соединения формулы R5O-NH2, в которой R5 принимает значения,указанные для формулы (I), с получением соединения формулы (I) которое может быть очищено в соответствии с обычной техникой разделения, которое превращают,при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое разделяют, где приемлемо, на его изомеры в соответствии с обычной техникой разделения. 22. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (III) в которой D, R1, R2, R6 и X принимают значения, указанные для формулы (I), с которым конденсируют соединение формулы R5O-NH2, в которой R5 принимает значения, указанные для формулы (I), с получением соединения формулы (VI) в которой R1, R2, R5, R6, D и X принимают значения, указанные для формулы (I), с которым конденсируют в основной среде соединение формулы (IV) в которой А, В, R3 и R4 принимают значения, указанные для формулы (I), и Hal представляет собой атом галогена, с получением соединения формулы (I) которое может быть очищено в соответствии с обычной техникой разделения, которое превращают,при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое разделяют, где приемлемо, на его изомеры в соответствии с обычной техникой разделения. 23. Соединения формулы (V) по п.21 в которой R6, D, X, A, R1, R2, R3, R4 и В принимают значения, указанные в п.1,для применения в качестве промежуточных веществ для синтеза соединений формулы I. 24. Фармацевтические композиции, которые включают в качестве активного вещества по крайней мере одно соединение формулы (I) по любому из пп.1-20 или 23 или его соль присоединения с фармацевтически приемлемой кислотой или основанием, отдельно или в комбинации с одним или более фармацевтически приемлемыми наполнителями. 25. Фармацевтические композиции по п.24, для применения при изготовлении лекарственного средства для лечения и/или профилактики гипергликемии, дислипидемии и, особенно, при лечении инсулиннезависимых диабетов типа II, резистентности к инсулину, непереносимости глюкозы, расстройств, связанных с синдромом X, болезни коронарной артерии и других сердечно-сосудистых заболеваний, заболеваний почек, ретинопатии, расстройств, связанных с активацией эндотелиальных клеток,псориаза, синдрома поликистоза яичника, деменции, остеопороза, кишечных воспалительных болезней,миотонической дистрофии, панкреатита, артериосклероза, ксантомы, а также при лечении или предупреждении диабетов типа I, ожирения, регуляции аппетита, анорексии, булимии, нервной анорексии,точно также как раковых патологий и особенно гормонально-зависимых раковых опухолей, таких как рак груди или рак толстой кишки, и как ингибиторов ангиогенеза.
МПК / Метки
МПК: C07D 277/68, A61P 3/10, A61P 3/06, C07D 417/06, A61K 31/428
Метки: оксима, содержащие, композиции, новые, фармацевтические, получения, гетероциклического, соединения, способ
Код ссылки
<a href="https://eas.patents.su/30-7718-novye-soedineniya-geterociklicheskogo-oksima-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения гетероциклического оксима, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: 2-амино-4, 5-тризамещенные производные тиазолила
Следующий патент: 5-фенилпиримидины,способ и промежуточные продукты для их получения и их применение для борьбы с фитопатогенными грибами
Случайный патент: Способ изменения угловой ориентации и стабилизации космического аппарата, устройство для его осуществления












