Способ обнаружения мрнк вируса папилломы человека
Формула / Реферат
1. Способ in vitro скрининга субъектов-людей для оценки у них риска развития карциномы шейки матки, включающий скрининг субъекта на наличие экспрессии транскриптов мРНК гена E6 HPV и классификация субъекта в одну из двух категорий риска развития карциномы шейки матки, основанных на экспрессии мРНК E6, при этом индивидуумов, положительных по экспрессии мРНК E6, считают несущими интегрированный HPV или модифицированный эписомальный геном HPV и, следовательно, классифицируют как подверженных высокому риску развития карциномы шейки матки, тогда как индивидуумов, отрицательных по экспрессии мРНК E6, считают не несущими интегрированный HPV или модифицированный эписомальный геном HPV и, следовательно, классифицируют как не подверженных выявляемому риску развития карциномы шейки матки; характеризующийся тем, что скрининг на наличие экспрессии мРНК E6 проводят с применением изотермической амплификации в сочетании с детекцией продукта амплификации в реальном времени.
2. Способ in vitro идентификации субъектов-людей с аномальными клеточными изменениями в шейке матки, включающий скрининг субъекта на наличие экспрессии транскриптов мРНК гена E6 HPV, при этом индивидуумов с наличием экспрессии мРНК E6 идентифицируют как несущих аномальные клеточные изменения в шейке матки; характеризующийся тем, что скрининг на наличие экспрессии мРНК E6 проводят с применением изотермической амплификации в сочетании с детекцией продукта амплификации в реальном времени.
3. Способ по п.1 или 2, отличающийся тем, что изотермическая амплификация представляет собой NASBA, опосредованную транскрипцией амплификацию, опосредованную сигналом амплификацию РНК или изотермическую амплификацию в жидкой фазе.
4. Способ по п.3, отличающийся тем, что скрининг на наличие экспрессии проводят с применением NASBA в реальном времени.
5. Способ по любому из пп.1-4, отличающийся тем, что субъекты-люди представляют собой субъектов, у которых ранее было идентифицировано инфицирование ДНК вируса папилломы человека в клетках шейки матки.
6. Способ по любому из пп.1-5, отличающийся тем, что субъекты-люди представляют собой субъектов, с ранее поставленным диагнозом ASCUS, повреждения CIN 1 или кондилома.
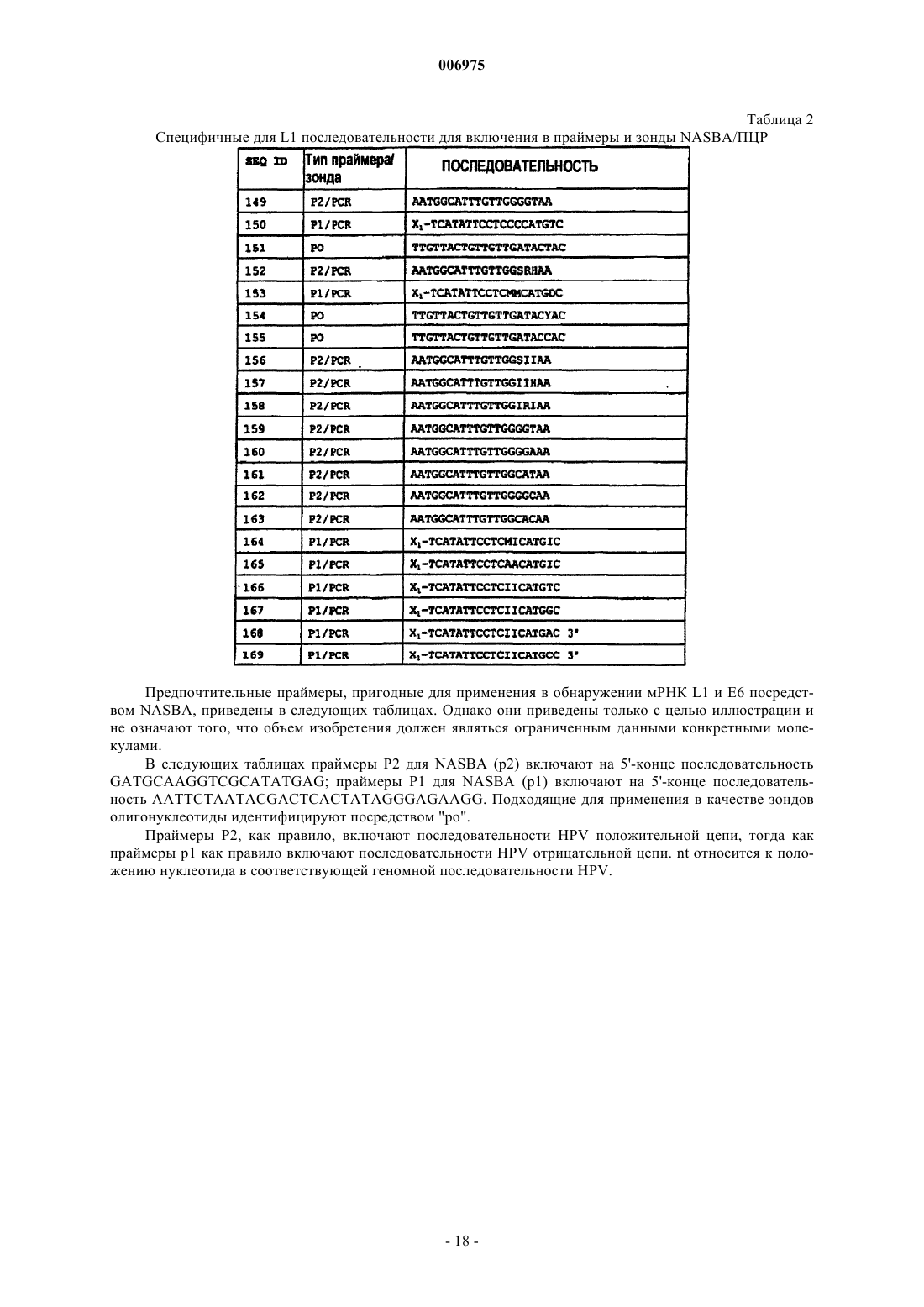
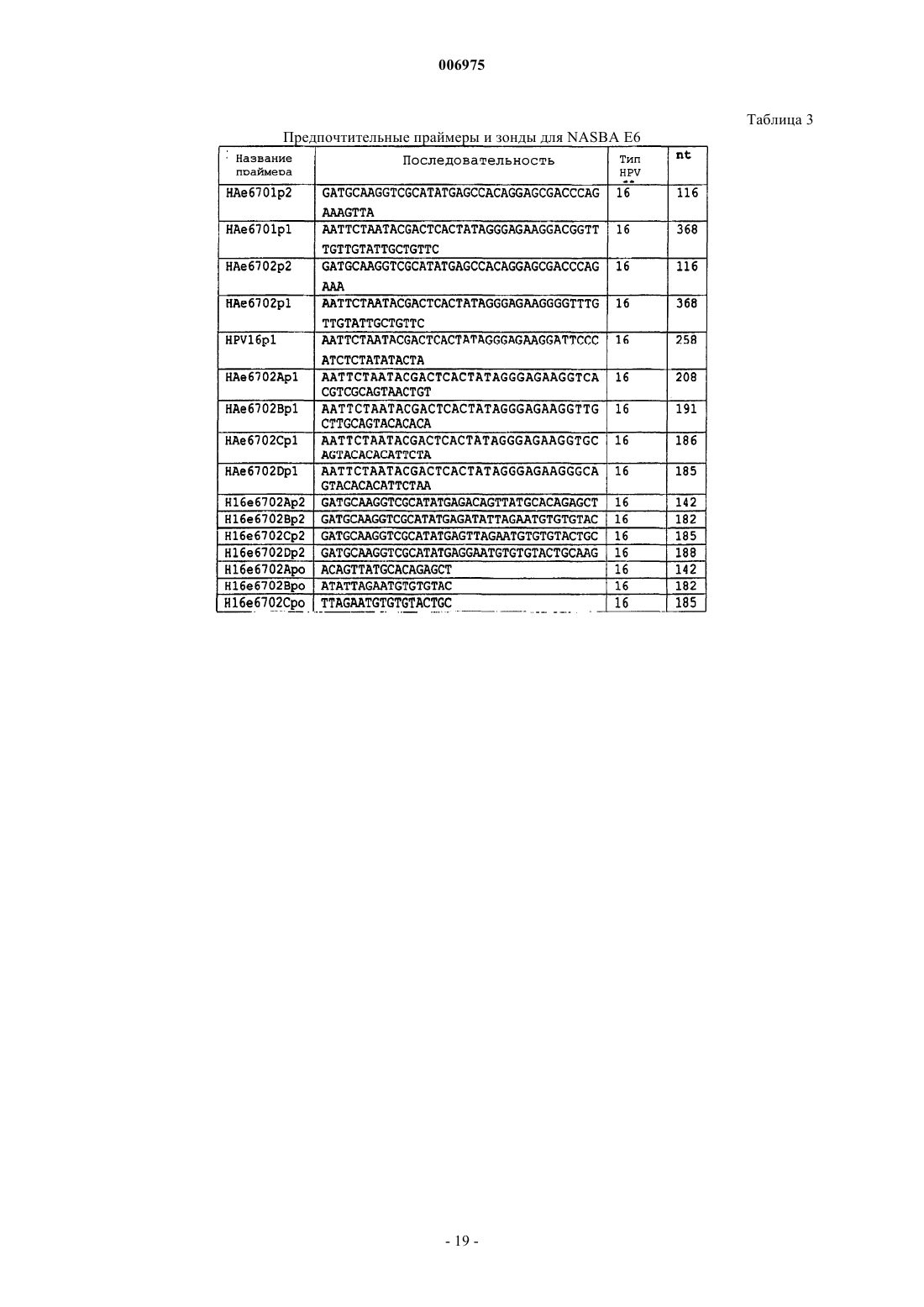
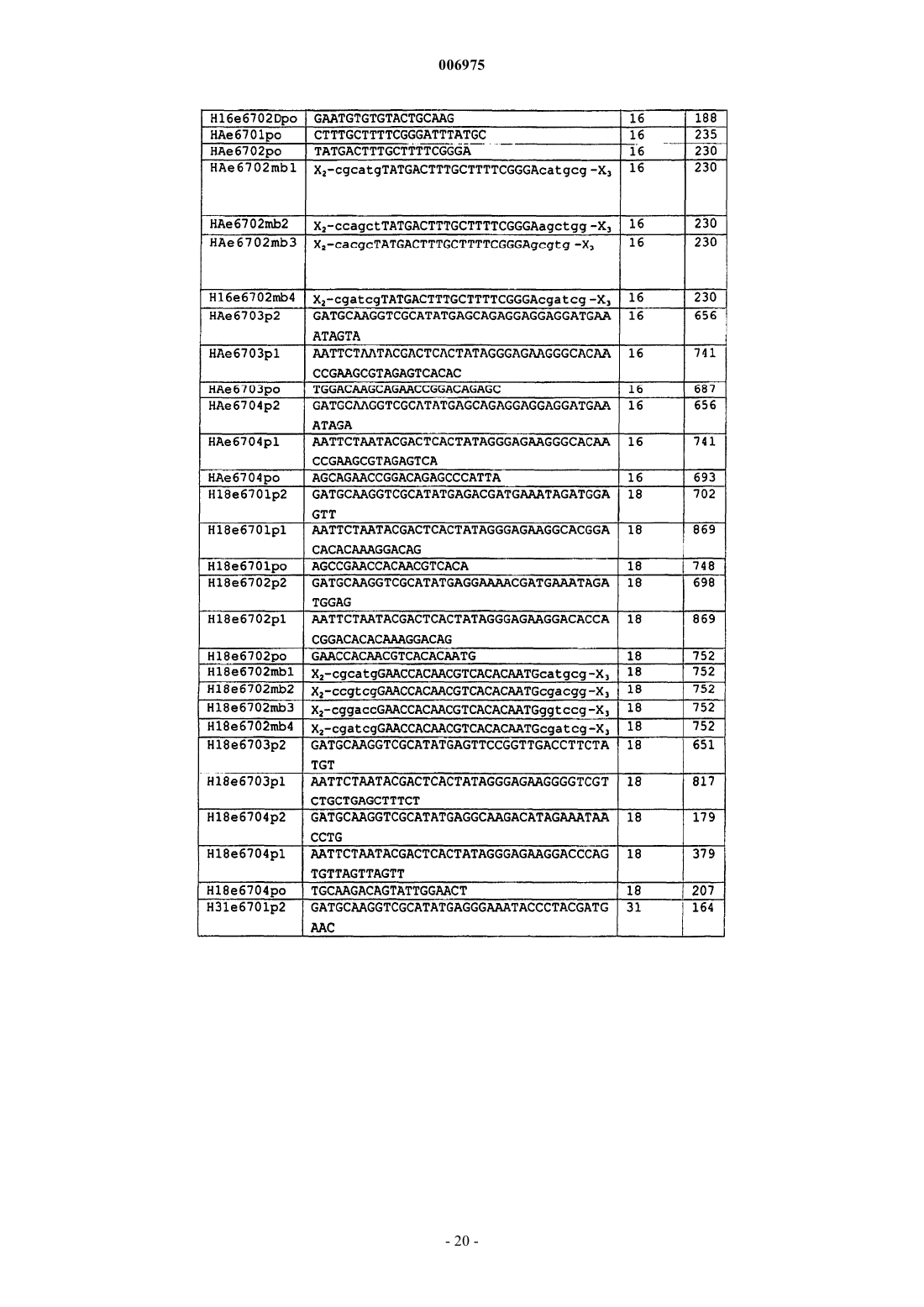
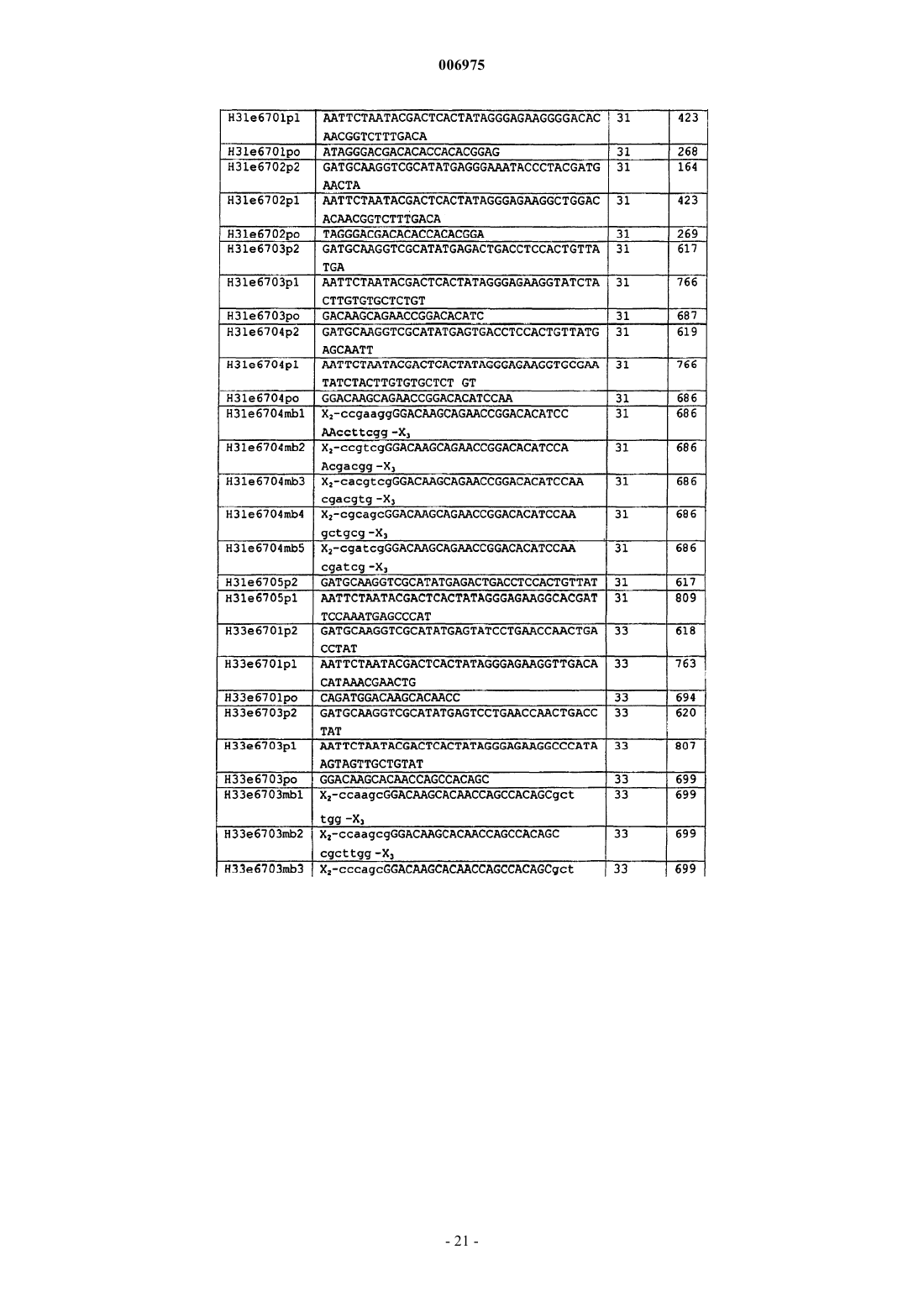
7. Способ по любому из пп.1-6, отличающийся тем, что включает скрининг на наличие экспрессии мРНК E6 с использованием технологии, способной обнаружить мРНК E6 по меньшей мере одного ассоциированного с раком типа HPV.
8. Способ по п.7, отличающийся тем, что включает скрининг на наличие экспрессии мРНК E6 с использованием технологии, способной обнаружить мРНК E6 HPV типов 16, 18, 31, 33 и предпочтительно 45.
9. Способ по любому из пп.1-8, отличающийся тем, что индивидуумов, положительных по экспрессии мРНК E6 по меньшей мере одного из HPV типов 16, 18, 31, 33 или 45, считают несущими интегрированный HPV.
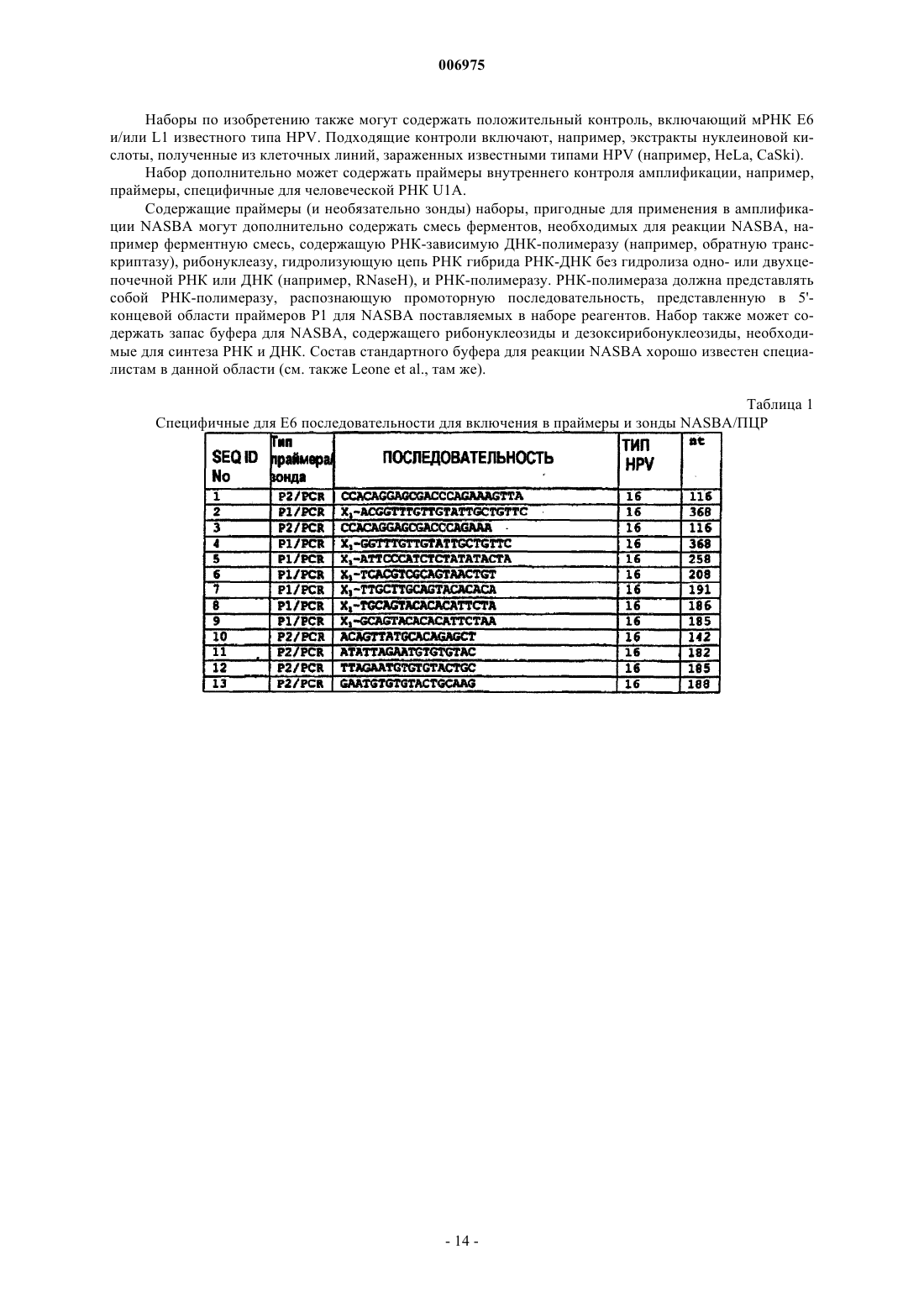
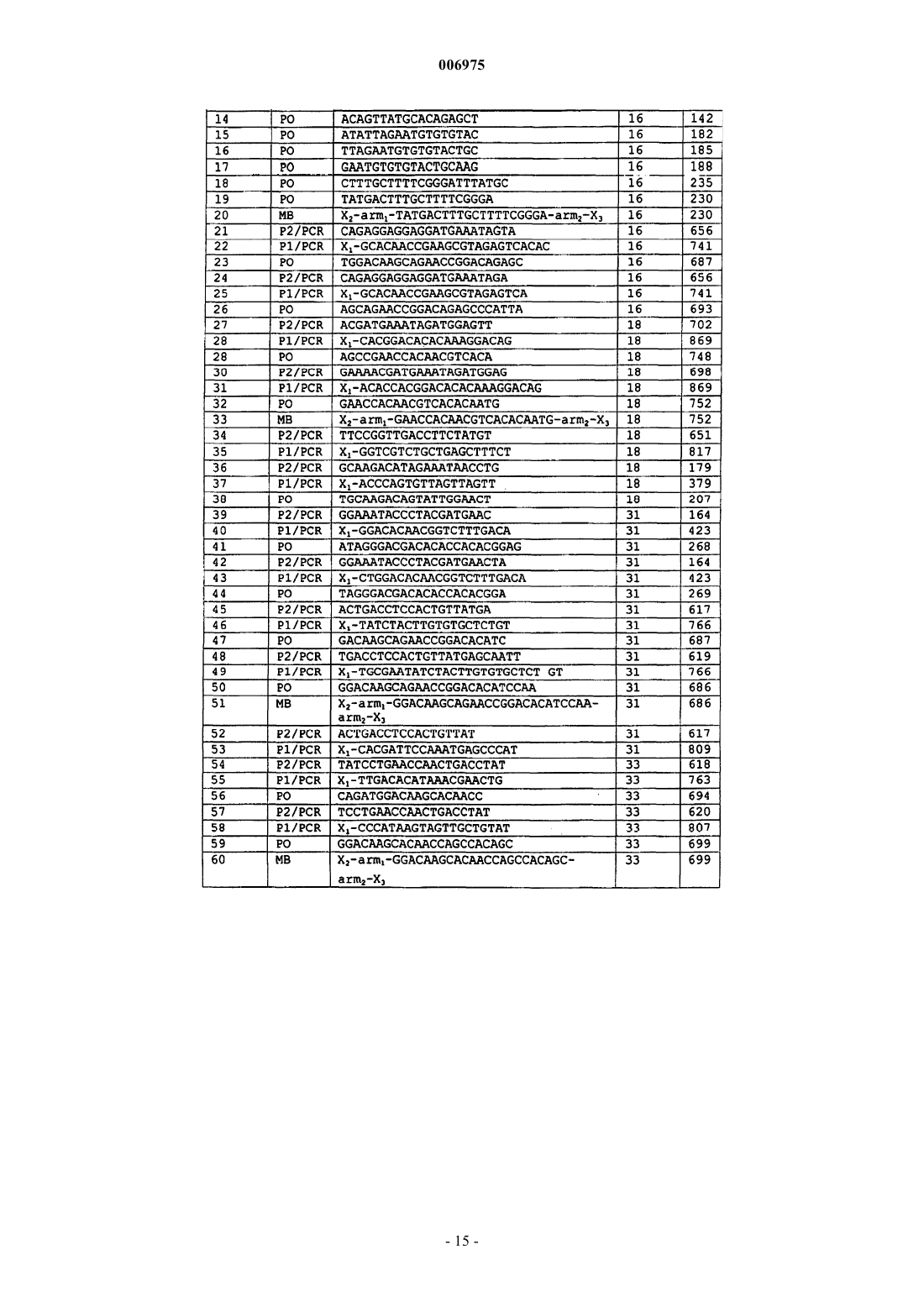
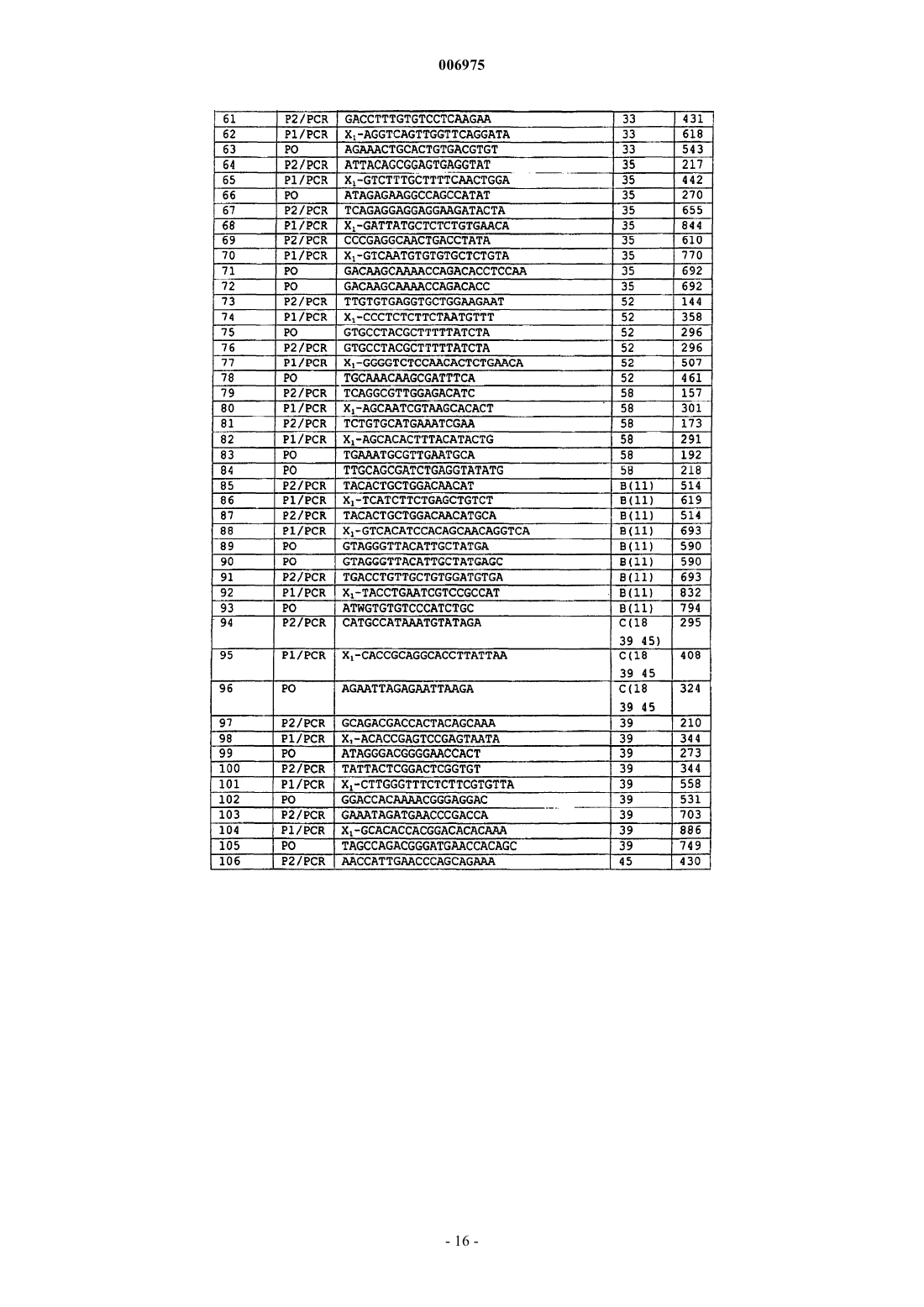
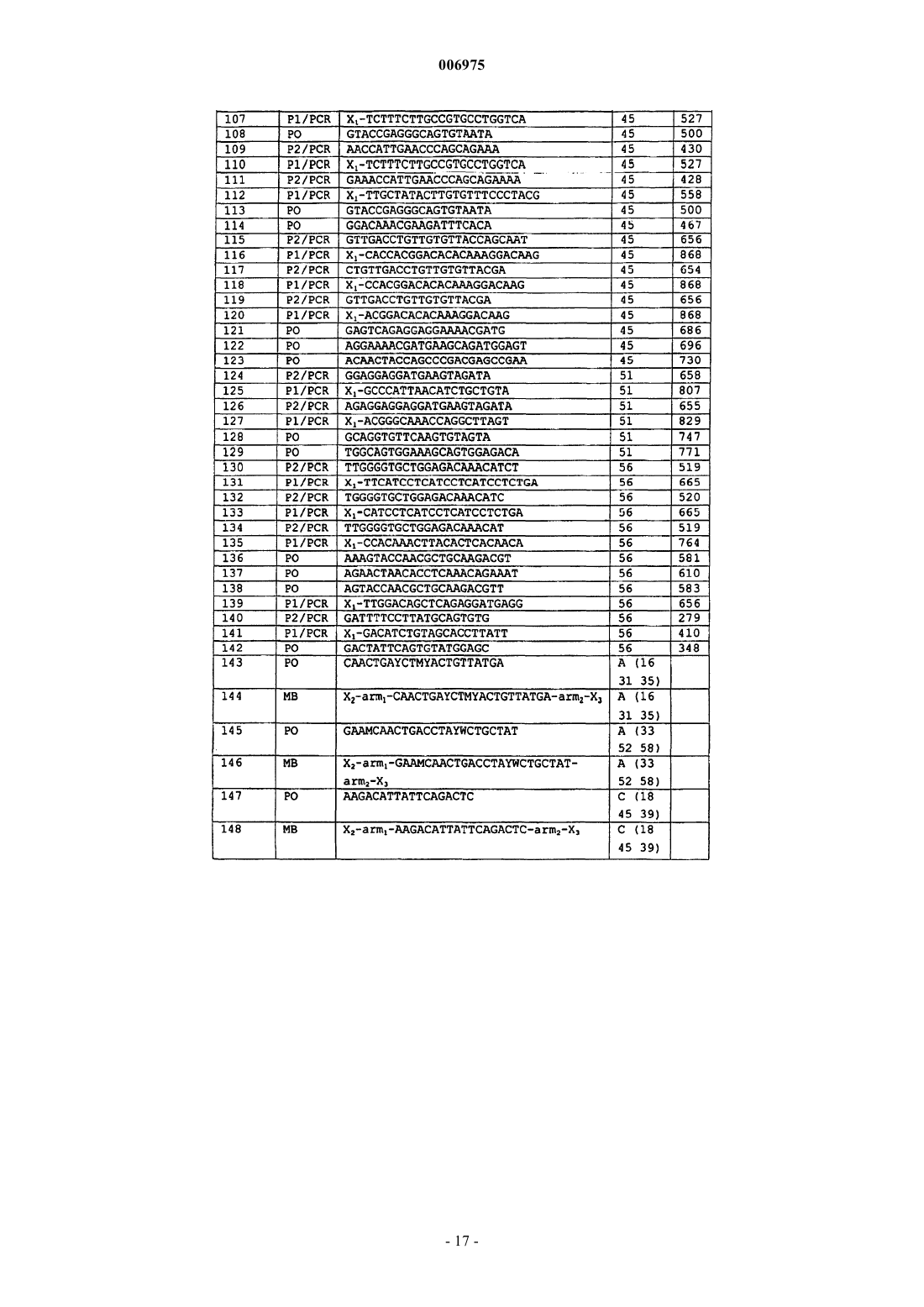
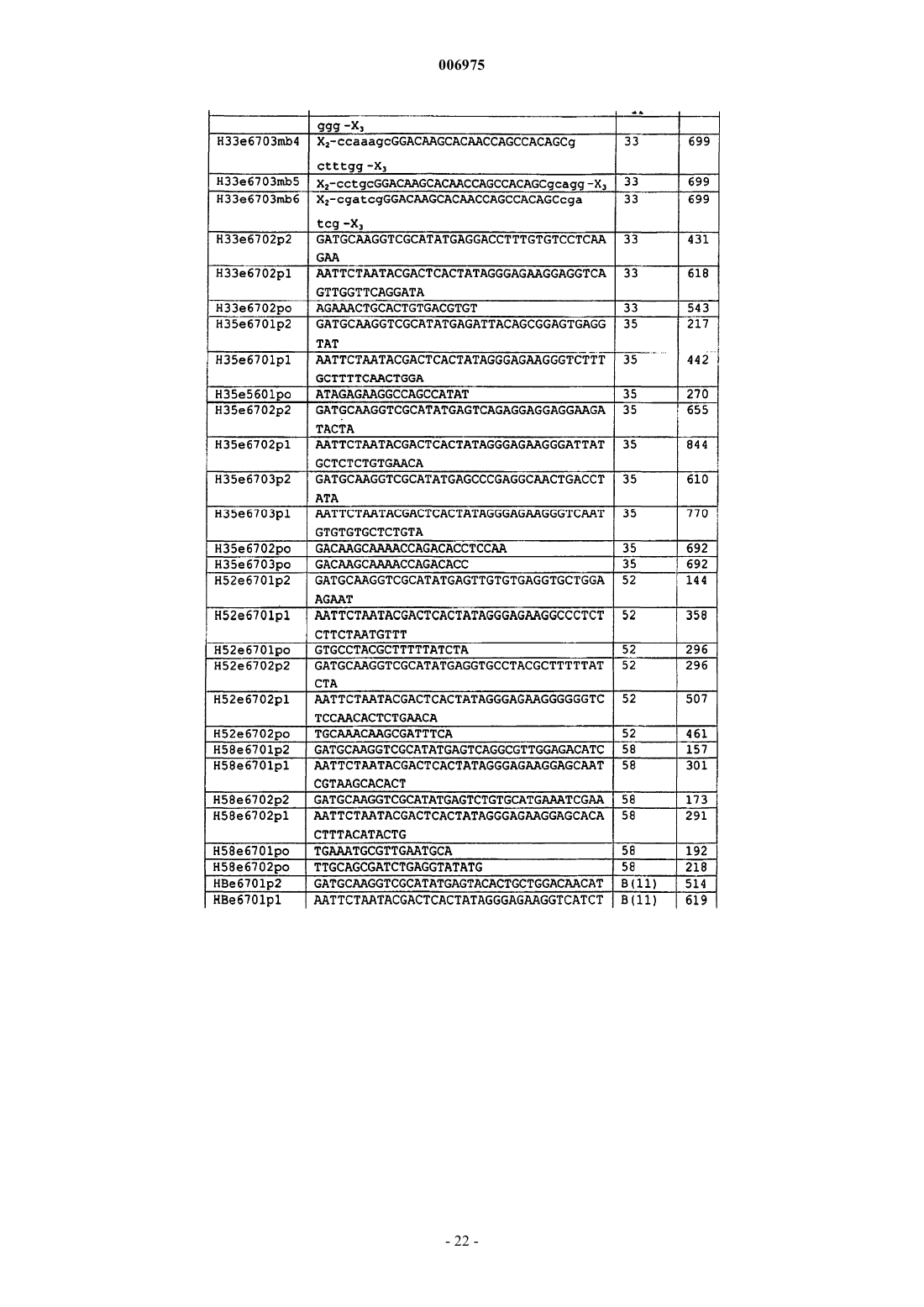
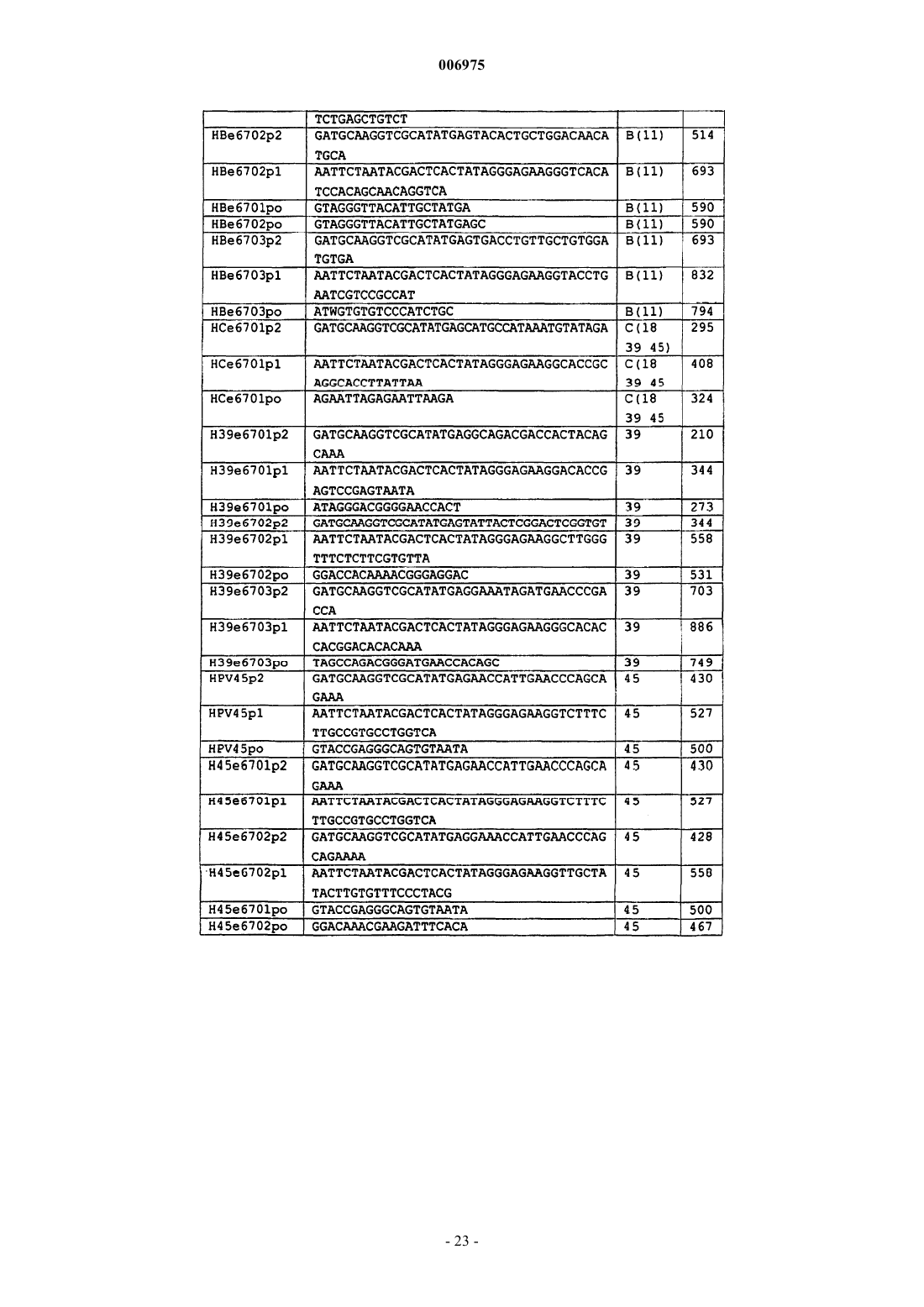
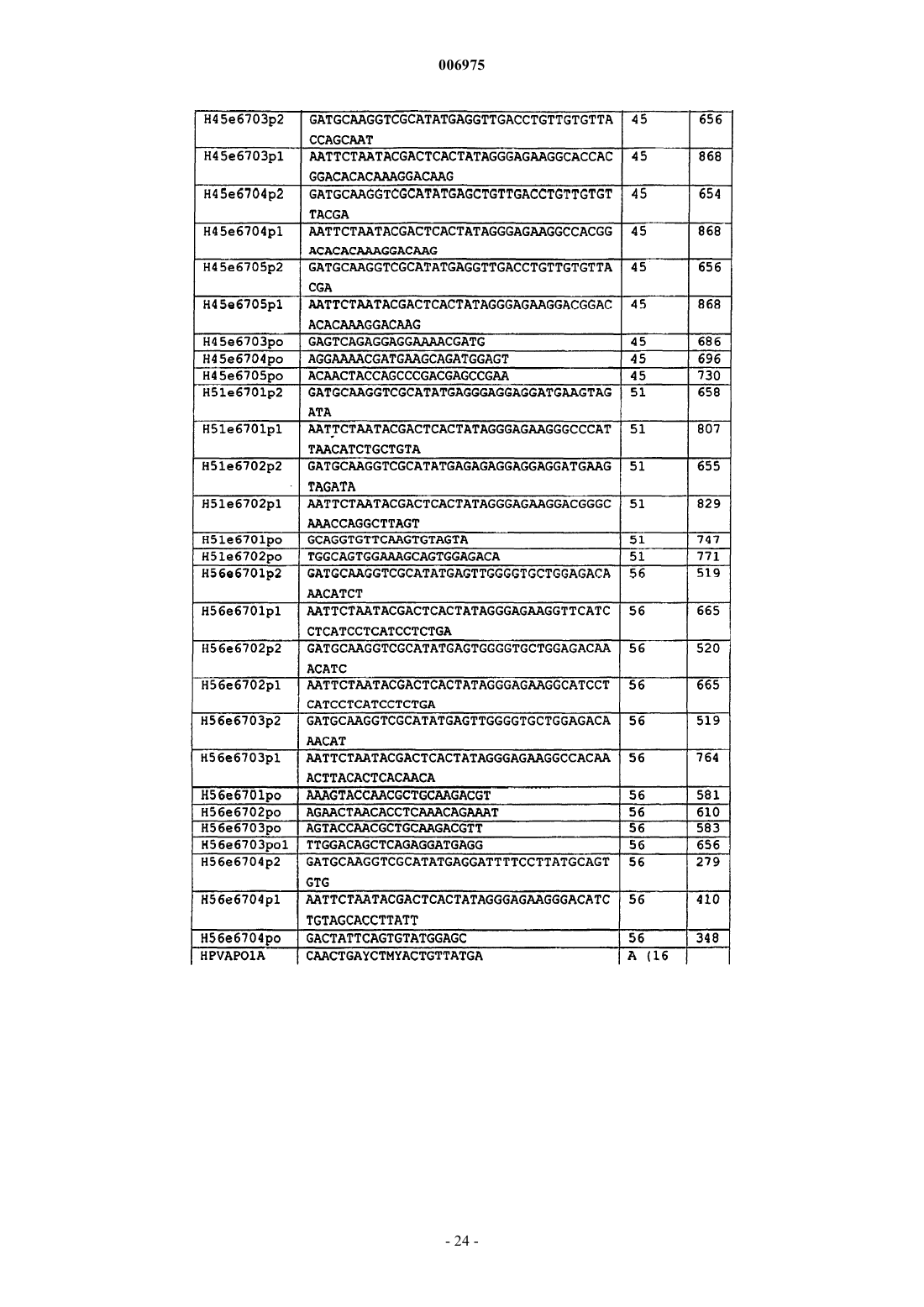
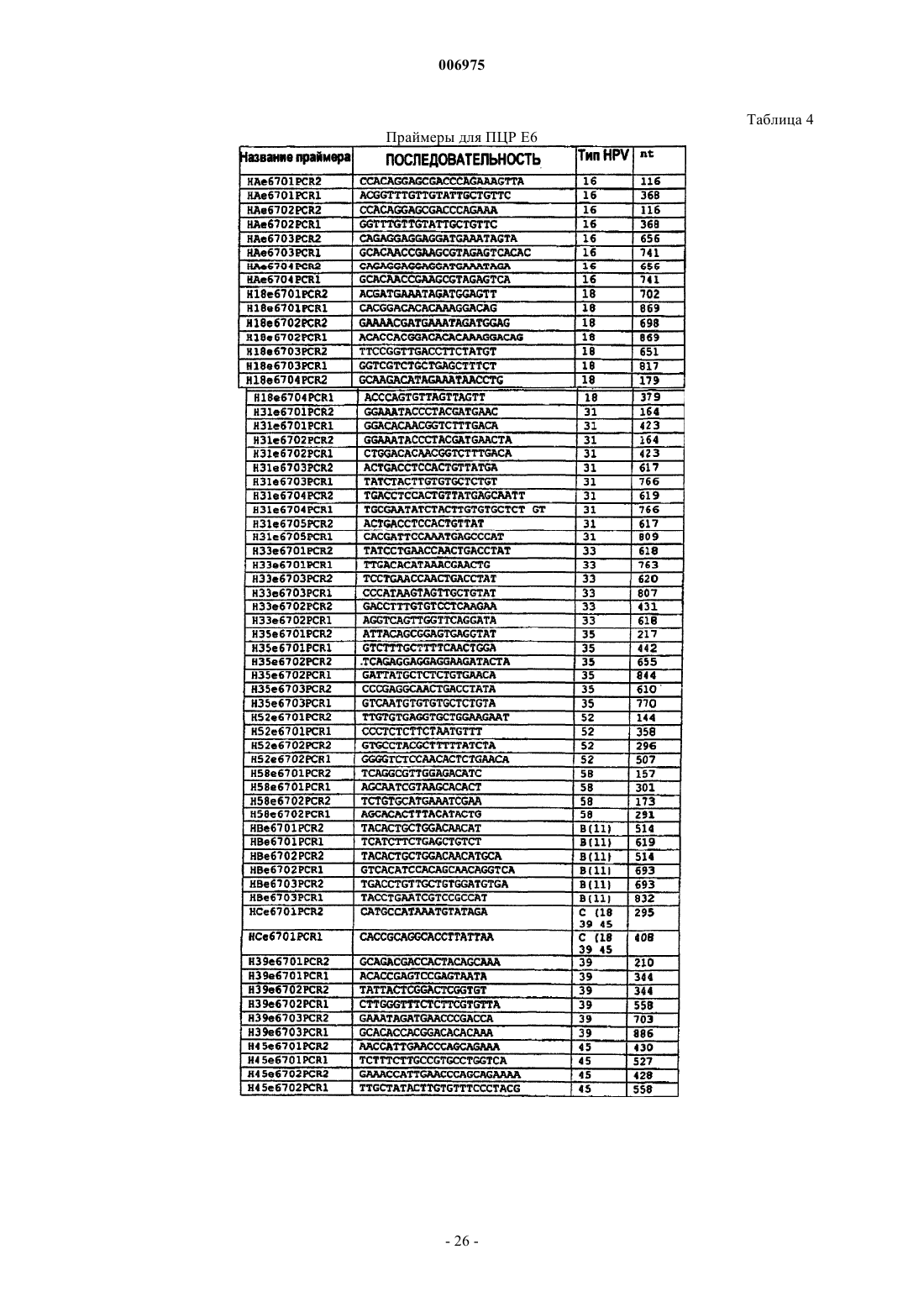
10. Набор, используемый для обнаружения транскриптов мРНК гена(ов) E6 HPV, включающий одну или более пар праймеров, позволяющих проводить амплификацию области транскриптов E6 HPV типов 16, 18, 31 и 33 посредством NASBA и один или более зондов в виде молекулярного бекона.
11. Набор по п.10, отличающийся тем, что включает отдельные пары праймеров, специфичные для каждого из HPV типов 16, 18, 31 и 33.
12. Набор по п.10 или 11, отличающийся тем, что включает одну или более, две или более, а предпочтительно все из следующих пар праймеров и сопровождающих зондов для идентификации:

Текст
006975 Область изобретения Настоящее изобретение относится к способам in vitro скрининга людей для определения у них риска развития карциномы шейки матки. Предпосылки изобретения Карцинома шейки матки представляет собой одно из наиболее распространенных злокачественных заболеваний во всем мире и одну из главных причин заболеваемости и смертности женщин (Parkin DM,Pisani P, Ferlay J (1993) Int. J. Cancer 54: 594-606; Pisani P, Parkin DM, Ferlay J (1993) Int. J. Cancer 55: 891903). В 1996 г. в Соединенных Штатах прогнозировано 15700 новых случаев инвазивного рака шейки матки, а Всемирная Организация Здравоохранения оценивает частоту встречаемости заболевания во всем мире как 450000 в год (1990). Ежегодная частота встречаемости заболевания различается в разных частях света, составляя от 7,6 на 100000 в западной Азии до 46,8 на 100000 в южной Африке (Parkin et al., 1993 там же). Современное понимание карциномы шейки матки таково, что она представляет собой многостадийное заболевание, часто развивающееся в течение периода 10-25 лет. Инвазивная плоскоклеточная карцинома шейки матки представлена проникновением через базальную мембрану и прорастанием в строму или в собственную мембрану эпителия. Клиническое течение карциномы шейки матки обнаруживает значительную изменчивость. Прогноз относится к клинической стадии, вовлечению лимфатических узлов, первичной опухолевой массе, гистологическому типу, глубине проникновения и лимфатическому проникновению (Delgado G, et al., (1990) Gynecol Oncol 38: 352-357). У некоторых пациенток с менее благоприятными характеристиками опухоли наблюдают относительно благоприятный исход, в то время как у других наблюдают летальный исход при изначально ограниченном заболевании. Это показывает очевидную необходимость дополнительных маркеров для дальнейшей характеристики вновь диагностированных карцином шейки матки, чтобы обеспечить соответствующую риску терапию (IkenbergH, et al., Int. J. Cancer 59: 322-6, 1994). Эпидемиологические исследования карциномы шейки матки показали сильную ассоциацию с религиозными, матримониальными и сексуальными параметрами. Почти в 100 исследованных случаях изучали связь между HPV и неоплазией шейки матки и почти во всех обнаружили положительные ассоциации(IARC monographs, 1995). Ассоциация является сильной, устойчивой и специфичной для ограниченного числа типов вируса (Munoz N, Bosch FX (1992) HPV and cervical neoplasia: review of case-control and cohort studies. IARC Sci Publ 251-261). В наиболее информативных исследованиях с поразительным постоянством для инвазивной злокачественной опухоли и выраженных очагов повреждения CIN наблюдали сильные ассоциации с ДНК HPV 16, исключая возможность того, что данную ассоциацию можно объяснить случайностью, отклонением или смешиванием (IARC monographs, 1995). Косвенное доказательство позволяло предположить, что ДНК HPV, обнаруженная в опухолевых клетках, представляет собой хороший маркер роли инфекции HPV на ранних стадиях канцерогенеза. Между увеличением вирусной нагрузки и риском карциномы шейки матки показана зависимость "доза-эффект" (Munoz and Bosch, 1992 там же). В некоторых больших сериях до 100% опухолей являлись положительными на наличие HPV,однако, можно еще обсуждать существование карцином шейки матки без наличия вируса (Meijer CJ, etCancer 72: 147-153). Наиболее часто встречающиеся типы HPV, найденные в плоскоклеточных карциномах шейки матки, представляют собой HPV 16 (41-86%) и 18 (2-22%). Кроме того, также обнаружены HPV 31, 33, 35,39, 45, 51, 52, 54, 56, 58, 59, 61, 66 и 68 (IARC, monographs, 1995). На Международной конференции в Барселоне HPV2000 HPV 16, 18, 31 и 45 определили как HPV высокого риска, тогда как HPV 33, 35, 39,51, 52, 56, 58, 59, 61, 68 определили как HPV промежуточного риска (Keerti V. Shah. P71). 13 HPV высокого риска и HPV промежуточного риска вместе часто обозначают как ассоциированные с раком типыHPV. В ряде исследований анализировали потенциальную роль тестирования HPV в скрининге шейки матки (см. Cuzick et al. A systematic review of the role of human papillomavirus testing within a cervicalReid et al. (Reid R, et al., (1991) Am J Obstet Gynecol 164: 1461-1469) первыми показали роль тестирования HPV в контексте скрининга. Данное исследование проводили в группе женщин с высоким риском, из клиник для передающихся половым путем заболеваний и специалистов-гинекологов, а для выявления HPV применяли чувствительную (с низкой жесткостью) блот-гибридизацию по Саузерну. Всего в список вошли 1012 женщин, а цервикографию рассматривали также как возможное дополнение к цитологическому обследованию. Всего обнаружили двадцать три повреждения CIN II/III, но только 12 выявили посредством цитологического обследования (чувствительность 52%, специфичность 92%). 16 выраженных очагов повреждения выявили посредством тестирования HPV.Bauer et al. (Bauer HM, et al., (1991) JAMA 265: 472-477) опубликовали основанное на ПЦР исследование на ранних стадиях, с применением праймеров MY09/11 (Manos M, et al., (1990) Lancet 335: 734) среди молодых женщин, проходящих процедуру стандартного мазка (студентки колледжа). Среди 467-1 006975 женщин авторы обнаружили долю с положительными результатами в размере 46%, что гораздо выше,чем для анализа "дот-блот" (11%). В исследовании с применением ПЦР с праймерами GP5/6 (Van Den Brule AJ, et al., (1990) J Clin Microbiol 28: 2739-2743) van den Brule et al. (Van Den Brule AJ, et al., (1991) Int. J. Cancer 48: 404-408) показали очень сильную корреляцию наличия HPV с неоплазией шейки матки, определенной посредством цитологического обследования. У более старших женщин (в возрасте 35-55 лет) с отрицательными результатами цитологического обследования процент наличия HPV составлял всего 3,5%, и данная величина уменьшалась до 1,5%, если рассматривали только типы 16, 18, 31 и 33, в то время как все женщины с гистологической карциномой in situ, оказались HPV-положительными, а у 90% обнаружили один из четырех указанных выше типов. Женщины с менее серьезными цитологическими аномалиями обладают меньшими долями носительства HPV градуальным путем, демонстрируя четкую тенденцию.Roda Housman et al. (Roda Housman AM, et al., (1994) Int J Cancer 56: 802-806) расширили данные исследования посредством наблюдения еще за 1373 женщинами с аномальными мазками. Данное исследование также подтвердило возрастание положительной доли с увеличением тяжести результатов мазка. Авторы также обнаружили, что уровень гетерогенности HPV уменьшался с 22 типов для мазков с невыраженными изменениями до десяти типов "повышенного риска" для мазков с выраженными изменениями. В данную статью не включали женщин с отрицательными цитологическими результатами, а также цитологическое заболевание не подтверждали гистологически.Cuzick et al. (Cuzick J, et al., (1992) Lancet 340: 112-113; Cuzick J et al., (1994) Br J Cancer 69: 167-171) первыми сообщили, что тестирование HPV предоставляет полезную информацию для сортировки цитологических аномалий, обнаруженных в ходе случайного скрининга. В исследовании 133 женщин, направленных на кольпоскопию, авторы обнаружили степень положительного предсказания в размере 42%,сходную с соответствующей величиной для умеренного дискариоза. Наиболее убедительными данные результаты являлись для HPV 16, где при биопсии обнаружили, что 39 из 42 женщин с носительствомHPV 16 обладают выраженной CIN. Данное исследование указывает на важность определения вирусной нагрузки и принимает за положительные только высокие уровни типов высокого риска. Сох et al. (Cox JT, et al., (1995) Am J Obstet Gynecol 172: 946-954) показали значение тестированияHPV с применением системы Hybrid Capture (DIGENE Corporation, Gaithersburg, MD, USA) для установления очередности медицинской помощи женщинам с пограничными результатами мазков. Данный тест проводили для 217 таких женщин из справочной службы колледжей, и для CINII/III обнаружили чувствительность в размере 93% по сравнению с 73% для повторного цитологического обследования. Показали, что высокая вирусная нагрузка дополнительно улучшает эффективность посредством уменьшения ложноположительных результатов. Когда в качестве уровня отсечения принимали 5 RLU, обнаруживали PPV приблизительно в размере 24% без потери чувствительности.Cuzick et al. (Cuzik J, et al., (1995) Lancet 345: 1533-1536) оценили тестирование HPV в контексте первичного скрининга среди 1985 женщин, проходящих стандартный скрининг в клинике планирования семьи. Чувствительность с применением типоспецифичной ПЦР для четырех наиболее распространенных типов HPV (75%) превышала чувствительность цитологического обследования (46%), a PPV для положительного теста на HPV (42%) являлось сходным со значением для умеренного дискариоза (43%). В WO 91/08312 описаны способы определения прогноза для инфицированных HPV индивидов, которые включают измерение уровня активности HPV посредством определения в образце транскриптов полноразмерных генов HPV Е 6 и/или Е 7 или их частей и сравнение измерений активности HPV с предварительно установленной взаимосвязью между активностью и риском развития до тяжелой дисплазии шейки матки или карциномы. В WO 99/29890 описаны способы определения инфекции HPV, основанные на измерении и анализе уровней экспрессии генов. В частности, в WO 99/29890 описаны способы, которые основаны на измерении уровней экспрессии двух или более генов HPV (например, HPV Е 6, Е 7, L1 и Е 2) и последующем сравнении отношения экспрессии сочетаний данных генов для указания на стадию вызванного HPV заболевания у пациентки. Авторы настоящего изобретения определили, что возможно получить клинически применимое определение заболевания, ассоциированного с HPV, основанное только на простом положительном/отрицательном определении экспрессии транскриптов мРНК L1 и Е 6 HPV, без необходимости точных количественных измерений уровней экспрессии или определения различий уровней экспрессии двух транскриптов. Данный способ технически прост и в предпочтительном осуществлении подлежит автоматизации в формате от средней до высокой производительности. Кроме того, на основании результатов,полученных с применением способа по изобретению, авторы изобретения определили новую схему классификации пациенток на основании риска развития карциномы шейки матки, которая связана с соответствующими заболеванию молекулярными изменениями в характере экспрессии генов HPV и не зависит от классификации CIN. Следовательно, в первом аспекте, изобретение относится к способу in vitro скрининга людей, для определения риска развития у них карциномы шейки матки, который включает скрининг на наличие экспрессии транскриптов мРНК гена L1 и гена E6 вируса папилломы человека, где субъектов с наличием-2 006975 экспрессии полноразмерной мРНК L1 и/или E6 считают подверженными риску развития карциномы шейки матки. Признаком положительных результатов скрининга в способе по изобретению служит выраженная экспрессия мРНК L1 и/или мРНК E6 в клетках шейки матки. Наличие экспрессии либо одной из данных мРНК, либо обеих мРНК принимают за показатель того, что субъект подвержен "риску" развития карциномы шейки матки. Женщины, у которых экспрессируется мРНК Е 6, подвержены высокому риску развития клеточных изменений, так как онкогенные Е 6 и Е 7 связываются с регулирующими клеточный цикл белками и действуют как переключатель пролиферации клеток. Отчетливая экспрессия мРНК Е 6 представляет прямое указание на изменения клеток шейки матки. Экспрессия мРНК L1 в присутствии или в отсутствие экспрессии мРНК Е 6 также указывает на присутствие активного HPV. В более широком контексте скрининга шейки матки, женщин, идентифицированных как положительных на наличие экспрессии мРНК L1 и/или мРНК Е 6, можно выбрать для дальнейшего исследования, например, с применением цитологического обследования. Так, на первом уровне способ по настоящему изобретению может относиться к технически простым способам предварительного скрининга популяции женщин для идентификации HPV-положительных субъектов, которых можно выбирать для дальнейшего исследования. В конкретном осуществлении способ по изобретению можно применять для классификации субъектов по четырем различным классам риска развития карциномы шейки матки на основании положительной/отрицательной оценки экспрессии мРНК L1 и Е 6. Таким образом, в дополнительном аспекте изобретение относится к способу in vitro скрининга людей для оценки риска развития у них карциномы шейки матки, который включает скрининг субъектов на наличие экспрессии транскриптов мРНК гена L1 HPV и транскриптов мРНК гена E6 HPV, и классификацию субъектов в одну из четырех категорий риска развития карциномы шейки матки на основании экспрессии мРНК L1 и/или E6 согласно следующей классификации: Категория риска 1: субъекты с отсутствием экспрессии мРНК L1, но с наличием экспрессии мРНК Е 6 по меньшей мере одного из HPV типов 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66 или 68. Таких индивидов с наличием экспрессии мРНК Е 6 по меньшей мере одного из HPV типов 16, 18, 31 или 33 считают подверженными более высокому риску, например, по сравнению с индивидами с отсутствием данных типов, но с наличием экспрессии мРНК Е 6 по меньшей мере одного из HPV типов 35, 39, 45, 52, 56, 58,59, 66 или 68. Категория риска 2: субъекты, с наличием экспрессии мРНК L1 и с наличием экспрессии мРНК E6 по меньшей мере одного из HPV типов 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66 или 68. Индивидов с наличием экспрессии мРНК E6 по меньшей мере одного из HPV типов 16, 18, 31 или 33 считают подверженными более высокому риску, например, по сравнению с индивидами с отсутствием данных типов,но с наличием экспрессии мРНК E6 по меньшей мере одного из HPV типов 35, 39, 45, 52, 56, 58, 59, 66 или 68. Категория риска 3: субъекты, с наличием экспрессии мРНК L1, но с отсутствием экспрессии мРНКE6 ассоциированных с раком типов HPV (например, с отсутствием экспрессии мРНК E6 HPV типов 16,18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66 и 68). Категория риска 4: субъекты с отсутствием экспрессии мРНК L1 и с отсутствием экспрессии мРНК Е 6. В предпочтительном осуществлении наличие экспрессии определяют по присутствию более чем 50 копий транскрипта на мл (или общий объем образца), а отсутствие экспрессии определяют при наличии менее чем 1 копии транскрипта на мл (или общий объем образца). Приведенная выше классификация основана на молекулярных событиях, значимых для риска развития карциномы шейки матки и независимых от статуса CIN субъектов. Таким образом, данный способ классификации может предоставить альтернативу применения цитологического обследования в стандартном скрининге женщин для идентификации подверженных потенциальному риску развития карциномы шейки матки. Способ также можно применять как дополнение к цитологическому обследованию,например, как подтверждающий тест для подтверждения оценки риска, полученной на основании цитологического обследования. Женщины с наличием экспрессии, связанных с высоким риском мРНК E6 HPV одного из типов 16,18, 31 или 33, но с отсутствием экспрессии L1, подвержены наивысшему уровню риска развития серьезных изменений клеток и клеточных аномалий. Это является следствием того факта, что отрицательный результат экспрессии мРНК L1 непосредственно указывает на интегрированный HPV и, следовательно,на более высокую вероятность высокой и постоянной экспрессии E6 и Е 7. Интеграция вируса в геном человека также напрямую влияет на стабильность клеток. Интеграция HPV также уменьшает возможность регрессии клеточных изменений. У женщин с наличием экспрессии мРНК E6 HPV одного из типов 16, 18, 31 или 33 и с наличием экспрессии мРНК L1 присутствует экспрессия HPV "высокого риска" и все еще сохраняется возможность того, что HPV интегрирован. Однако риск у таких женщин не классифицируют как такой высокий,-3 006975 как у женщин с отсутствием L1 и с присутствием E6, так как существует приемлемая вероятность того,что у них нет интегрированного HPV. Женщин с отсутствием экспрессии мРНК E6 HPV типов 16, 18, 31 или 33, но с наличием экспрессии мРНК E6 других типов HPV, например, 35, 39, 45, 52, 56, 58, 59, 66 и 68, все еще рассматривают как"с риском" и, следовательно, их можно поместить в категории риска 1 или 2 (как определено выше), в зависимости от того, присутствует или отсутствует у них экспрессия мРНК L1. Женщин с наличием экспрессии мРНК L1, но с отсутствием мРНК E6 считают подверженными умеренному риску. В образце могут присутствовать типы HPV высокого риска, а экспрессия L1 свидетельствует о литической активности. Могут присутствовать также интегрированные типы HPV, но только тех вирусов, которые являются редкими. Однако определение литической активности может указывать на то, что в клетках вскоре могут произойти некоторые изменения. В более широком контексте скрининга шейки матки способ по изобретению можно применять для классификации женщин по риску развития карциномы шейки матки и, таким образом, предоставлять основание для решений относительно лечения и/или дополнительного скрининга. В качестве примера женщин из категории риска 1, особенно тех, для которых показано наличие экспрессии мРНК E6 HPV по меньшей мере одного из типов 16, 18, 31 или 33, можно идентифицировать как требующих "немедленного вмешательства", что означает конизацию или кольпоскопию, включая биопсию или гистологическое обследование. Женщин из категории риска 2, как определено выше, можно считать требующими немедленного внимания, что означает только кольпоскопию или кольпоскопию, включающую биопсию и гистологическое обследование. Женщин из категории риска 3, как определено выше, можно считать требующими немедленного повторного тестирования, что означает повторный вызов для дополнительного теста экспрессии HPV,немедленно или после относительно короткого интервала, например шести месяцев. Женщин из категории риска 4, как определено выше, можно снова включить в программу скрининга для повторного тестирования экспрессии HPV. В дополнительном осуществлении изобретение относится к способу in vitro скрининга людей на присутствие интегрированного HPV или модифицированного эписомального генома HPV, который включает скрининг субъектов на наличие экспрессии транскриптов мРНК гена L1 и гена E6 вируса папилломы человека, где субъектов с отсутствием экспрессии мРНК L1, но с наличием экспрессии мРНКE6 считают несущими интегрированный HPV. Термин "интегрированный HPV" относится к геному HPV, интегрированному в геном человека. Термин "модифицированный эписомальный геном HPV" принимают для обозначения генома HPV,который сохраняется в клетке человека в виде эписомы, то есть не интегрирует в геном человека и который по сравнению с эквивалентным геномом HPV дикого типа несет модификацию, приводящую к конститутивной или постоянной экспрессии транскриптов генов E6 и/или Е 7. "Модификация" в основном означает делецию, мультимеризацию или конкатемеризацию эписомы, перестройку эписомы и т.д.,влияющие на регуляцию экспрессии Е 6/Е 7. Как указано выше, присутствие интегрированного HPV или модифицированного эписомального генома HPV, показывают отрицательным результатом экспрессии мРНК L1, совместно с положительным результатом экспрессии мРНК E6 в клетках шейки матки. Следовательно, возможность прогнозировать присутствие интегрированного HPV или модифицированного эписомального генома HPV в данном анализе серьезно зависит от возможности оценки отрицательного результата экспрессии мРНК L1. Это требует способа детекции с максимальной чувствительностью, кроме того дающего минимальные ложноотрицательные результаты. В предпочтительном осуществлении для отбора на присутствие или отсутствие мРНК L1 этого добиваются посредством применения чувствительного способа амплификации и детекции в реальном времени. Наиболее предпочтительным способом является амплификация NASBA в реальном времени с применением зондов в виде молекулярных беконов, как описано у Leone et al., NucleicAcids Research., 1998, Vol 26, 2150-2155. Благодаря чувствительности данного способа появление ложноотрицательных результатов сведено к минимуму, а результат "отсутствие экспрессии L1" можно принимать с большей уверенностью. В дополнительном осуществлении способ скрининга людей на присутствие интегрированного HPV или модифицированного эписомального генома HPV может основываться на скрининге на наличие экспрессии только мРНК E6. Таким образом, изобретение относится к способу in vitro скрининга людей на присутствие интегрированного HPV или модифицированного эписомального генома HPV, включающего скрининг субъекта на наличие экспрессии транскриптов мРНК гена Е 6 вируса папилломы человека, где субъектов с наличием экспрессии мРНК E6 считают несущими интегрированный HPV или модифицированный эписомальный геном HPV. Кроме того, индивидов можно распределять в одну из двух категорий риска развития карциномы шейки матки, основываясь на определении "есть/нет" экспрессии только мРНК E6. Следовательно, изобретение относится к способу in vitro скрининга людей для оценки риска развития у них карциномы шейки матки, который включает скрининг субъекта на наличие экспрессии транскриптов мРНК гена E6HPV и распределение субъекта в одну из двух категорий риска развития карциномы шейки матки на основании экспрессии мРНК E6, где индивидов, с наличием экспрессии мРНК E6, считают несущими интегрированный HPV или модифицированный эписомальный геном HPV и, следовательно, классифицируют как группу "высокого риска" развития карциномы шейки матки, тогда как индивидов с отсутствием экспрессии мРНК E6 считают не несущими интегрированного HPV или модифицированного эписомального генома HPV и, следовательно, классифицируют как группу "невыявляемого риска" развития карциномы шейки матки. Индивидов распределяют в одну из двух категорий риска развития карциномы шейки матки, основываясь на определении "есть/нет" экспрессии мРНК E6 в клетках шейки матки. Индивидов с наличием экспрессии мРНК E6 считают несущими интегрированный HPV или модифицированный эписомальный геном HPV и, следовательно, классифицируют как группу "высокого риска" развития карциномы шейки матки, тогда как индивидов с отсутствием экспрессии мРНК E6 считают не несущими интегрированногоHPV или модифицированного эписомального генома HPV и, следовательно, классифицируют как группу"невыявляемого риска" развития карциномы шейки матки. В контексте скрининга шейки матки классификация субъектов на две группы с "высоким риском" или "невыявляемым риском" развития карциномы шейки матки предоставляет основание для решений относительно лечения и/или дополнительного скрининга. Например, субъектов из категории высокого риска можно считать требующими незамедлительного дальнейшего анализа, например, посредством гистологической кольпоскопии, тогда как субъектов из категории невыявляемого риска можно направлять обратно в программу скрининга с трех- или пятилетними интервалами. Данные способы особенно пригодны для оценки риска развития карциномы у субъектов, для которых известно, что они инфицированыHPV, например, пациенток, положительно тестирующихся на ДНК HPV или субъектов, для которых ранее выявляли аномалии шейки матки по результатам цитологического обследования или теста по Папаниколау. У субъектов, распределенных в категорию невыявляемого риска на основании экспрессии мРНК E6, может присутствовать ДНК HPV, однако, отрицательный результат экспрессии E6 показывает,что на момент тестирования HPV не связан с онкогенной активностью. Присутствие интегрированного HPV или модифицированного эписомального генома HPV, показанное по положительному результату экспрессии мРНК E6, само по себе указывает на наличие у субъекта аномальных клеточных изменений в шейке матки. Следовательно, изобретение также относится к способу in vitro идентификации людей с аномальными клеточными изменениями в шейке матки, который включает скрининг субъекта на наличие экспрессии транскриптов мРНК гена E6 HPV, где индивидов, с наличием экспрессии мРНК E6, идентифицируют как индивидов с аномальными клеточными изменениями в шейке матки. Термин "аномальные клеточные изменения в шейке матки" включает клеточные изменения, которые являются характеристикой более тяжелого заболевания, чем невыраженные повреждения в шейке матки или плоскоклеточные интраэпителиальные повреждения с низкой степенью злокачественности,включает клеточные изменения, характерные для заболеваний равной или большей тяжести, чем выраженная CIN (определяемая как неопластическая экспансия трансформированных клеток), CIN (интраэпителиальная неоплазия шейки матки) III или плоскоклеточная интраэпителиальная неоплазия с высокой степенью злокачественности (HSIL), включающая повреждения с полиплоидным профилем ДНК и"злокачественные" повреждения CIN с повышенным средним значением индекса ДНК, высоким процентом анеуплоидии ДНК и коэффициентами превышения в 2,5 раза (Hanselaar et al., 1992, Anal Cell Pathol.,4:315-324; Rihet et al., 1996, J. Clin Pathol 49:892-896 и McDermott et al., 1997, Br. J. Obstet Gynaecol. 104:623-625). Интраэпителиальная неоплазия шейки матки (сокращенно "CIN"), называемая также дисплазией шейки матки, представляет собой состояние шейки матки, вызываемое вирусом папилломы человека.CIN классифицируют как I, II или III в зависимости от тяжести. Данное состояние считают предраковой аномалией, однако, не раком как таковым. Наиболее мягкая форма, CIN I, обычно исчезает самопроизвольно, хотя в редких случаях может прогрессировать до рака. Две более тяжелые формы, CIN II и CINIII, чаще всего с течением времени не изменяются или ухудшаются. Они могут становиться раком, однако, при адекватном лечении этого почти никогда не происходит.HPV идентифицировали как причину развития клеточных изменений в шейке матки, которые могут приводить к развитию карциномы шейки матки. Данные клеточные изменения ассоциированы с конститутивной или постоянной экспрессией белков Е 6/Е 7 из генома вируса HPV. Таким образом, можно заключить, что у субъектов, у которых можно обнаружить экспрессию мРНК Е 6, особенно у тех субъектов,у которых обнаруживают постоянную экспрессию Е 6 при оценке в течение периода времени, уже проявляются клеточные изменения в шейке матки. Данные изменения могут происходить только в очень немногих клетках шейки матки, и их невозможно выявить посредством обычного цитологического обследования. Тем не менее, с применением чувствительных, специфичных и точных методов детекции мРНК Е 6 возможно идентифицировать тех субъектов, у которых уже происходят клеточные изменения в шейке матки, на более ранней стадии, чем это возможно с применением обычного цитологического скрининга.-5 006975 Это может позволить более ранние терапевтические вмешательства с целью предотвратить развитие карциномы шейки матки. В результате интеграции HPV в геном человека или в результате "модификации" в модифицированном эписомальном геноме HPV утрачен нормальный контроль транскрипции вирусного онкогена Е 6/Е 7 (Durst et al., 1985, J Gen Virol, 66 (Pt 7): 1515-1522; Pater and Pater, 1985 Virology 145:313-318;Schwarz et al., 1985, Nature 314: 111-114; Park et al., 1997, там же). Напротив, в предзлокачественных повреждениях и инфицированном HPV нормальном эпителии преобладают вирусы папилломы в "немодифицированных" эписомальных формах, следовательно, транскрипция онкогена (Е 6/Е 7) может отсутствовать или подвергаться эффективной регуляции в сторону снижения (Johnson et al., 1990, J Gen Virol, 71(Pt 7): 1473-1479; Falcinelli et al., 1993, J Med Virol, 40: 261-265). Показано, что интеграция ДНК вируса папилломы человека типа 16 в геном человека приводит к более нестабильной клеточной активности/геному и увеличенной стабильности мРНК Е 6 и Е 7 (Jeon and Lambert, 1995, Proc Natl Acad Sci USA 92: 1654-1658) . Таким образом, оказалось, что интеграция HPV, обычно выявляемая в злокачественных опухолях шейки матки, но только нечасто выявляемая в очагах повреждения CIN (Carmody et al., 1996,Mol Cell Probes, 10: 107-116), представляет собой важное событие в канцерогенезе шейки матки. Способы по настоящему изобретению обнаруживают экспрессию вирусной мРНК Е 6/Е 7 в шейке матки вместо ДНК. Экспрессия вирусных Е 6/Е 7 в клетках шейки матки представляет собой гораздо более точное определение риска развития рака, чем простое выявление присутствия вируса. Более того,обнаружение транскриптов онкогенов HPV может представлять собой более чувствительный индикатор прямого участия вирусных онкогенов в канцерогенезе (Rose et al., 1994, Gynecol Oncol, 52: 212-217; Roseet al., 1995, Gynecol Oncol, 56: 239-244). Обнаружение транскриптов Е 6/Е 7 посредством амплификации и детекции представляет собой пригодный для определений рисков в отношении развития CIN и ее дальнейшего развития в опухоль шейки матки диагностический инструмент, особенно у пациенток, инфицированных HPV типов высокого риска с ASCUS и CIN I (Sotlar et al., 1998, Gynecol Oncol, 69: 114-121;Selinka et al., 1998, Lab Invest, 78: 9-18). Экспрессия транскриптов Е 6/Е 7 HPV-16/18 является равнокоррелированной с физическим статусом ДНК HPV (Park et al., 1997, Gynecol Oncol, Vol: 65(1), 121-9). В большинстве клеток карциномы шейки матки гены E6 и Е 7 специфичных вирусов папилломы человека транскрибируются с вирусных последовательностей, интегрированных в хромосомы клетки-хозяина (von Kleben Doeberitz et al., 1991, Proc NatlAcad Sci USA. Vol: 88(4), 1411-5). В большой серии повреждений CIN определяли вирусную нагрузку и интеграцию вируса (Pietsaro et al., 2002, J Clin Microbiol, Vol: 40(3), 886-91). Только один образец содержал исключительно эписомальную ДНК HPV16, а данный очаг повреждения спонтанно регрессировал. Семнадцать из 37 образцов инвазивной карциномы шейки матки, посредством ПЦР, охватывающей полный ген Е 1/Е 2, предварительно идентифицировали как содержащие полностью интегрированный геномHPV16, а в 16 случаях данный факт подтвердили посредством rliPCR. Однако в одном случае обнаружили низкий уровень эписомальной дезоксирибонуклеиновой кислоты в добавление к доминирующей интегрированной форме. Из оставшихся 20 образцов карциномы, для которых наличие эписомальных форм показали при предыдущем анализе, в 14 обнаружили наличие интегрированных форм с применениемrliPCR, а четыре содержали мультимерные (модифицированные) эписомальные формы. Таким образом, в итоге, в 31 из 37 карцином (84%) выявили интегрированный геном HPV16, в то время как обнаружить отсутствие интеграции не удалось. (Kalantari et al., 2001, Diagn Mol Pathol, Vol: 10(1), 46-54). Фактически нет наблюдений, что существуют клетки карциномы шейки матки без интегрированного HPV или модифицированной эписомальной ДНК HPV (Kalantari et al., 2001; Pietsaro et al., 2002, там же) . В дальнейшем показали, что Е 6 и Е 7 могут транскрибироваться только с интегрированной или модифицированной эписомальной ДНК HPV (von Kleben Doeberitz et al., 1991, там же). Таким образом, авторы настоящего изобретения предполагают, что обнаружение экспрессии Е 6/Е 7 обеспечивает непосредственное выявление интегрированного HPV или модифицированного эписомального HPV и высокой онкогенной активности, и заключают, что в клиническом контексте обнаружения только экспрессии E6(Е 6/Е 7) достаточно для выявления субъектов с "высоким риском" развития карциномы шейки матки. Иными словами, если в образце из шейки матки можно обнаружить экспрессию мРНК Е 6/Е 7, это напрямую указывает на клеточные аномалии в шейке матки, и существует очень высокий риск развития рака шейки матки, обусловленный постоянной активностью онкогена HPV. Таким образом, обнаружение у человека мРНК Е 6/Е 7 означает, что у данного субъекта очень высоко риск развития карциномы шейки матки, и он подлежит безотлагательному дальнейшему скринингу, например, посредством кольпоскопии. Если экспрессии мРНК Е 6/Е 7 не обнаруживают, у субъекта, тем не менее, может присутствовать инфекция HPV. Однако из-за отсутствия интеграции и активности онкогена инфекция может спонтанно регрессировать (как наблюдали Pietsaro et al., 2002, там же). В клиническом контексте эффективность способов, зависящих от скрининга на наличие экспрессии только мРНК E6, серьезно зависит от возможности с уверенностью принимать отрицательный результат экспрессии мРНК E6. Это снова требует способа детекции, обладающего максимальной чувствительностью, кроме того, дающего минимальные ложноотрицательные результаты. В предпочтительном осуще-6 006975 ствлении этого достигают применением чувствительного способа амплификации и детекции в реальном времени, чтобы вести отбор по присутствию или отсутствию мРНК E6. Наиболее предпочтительным способом является амплификация NASBA в реальном времени с применением зондов в виде молекулярных беконов, как описано у Leone et al., Nucleic Acids Research., 1998, Vol 26, 2150-2155. Благодаря чувствительности данного способа появление ложноотрицательных результатов сведено к минимуму, а результат "отсутствие экспрессии Е 6" можно принимать с большей уверенностью. Это необычайно важно,если анализы необходимо использовать в контексте клинической программы скрининга. В способах, основанных на определении одной мРНК Е 6, является предпочтительным выявлять, по меньшей мере, HPV типов 16, 18, 31, 33 и 45, а в предпочтительном осуществлении анализ может определять только данные типы HPV. ДНК HPV типов 16, 18, 31 и 33 обнаруживали более чем в 87% образцов карциномы шейки матки (Karlsen et al., 1996, J Clin Microbiol, 34:2095-2100). В других исследованиях показали, что Е 6 и Е 7 почти неизменно сохраняются при раке шейки матки, так что их экспрессия, вероятно, необходима для перехода к злокачественному состоянию и его поддержания (Choo et al., 1987, JMed Virol 21:101-107; Durst et al., 1995, Cancer Genet Cytogenet, 85:105-112). В отличие от систем обнаружения HPV, основанных на определении неповрежденного генома или последовательности гена L1,обнаружение мРНК HPV, экспрессированной с области Е 6/Е 7, может выявить более чем 90% пациенток,непосредственно связанных с риском развития карциномы шейки матки. В клинике, способы, основанные на обнаружении мРНК Е 6, предпочтительнее для применения после скрининга, то есть для дальнейшего анализа индивидов с предварительным диагнозом ASCUS, CIN I или кондилома. Способ можно применять для отбора индивидов с высоким риском развития карциномы шейки матки среди группы индивидов с предварительным диагнозом ASCUS, CIN I или кондилома.ASCUS, кондилому и CIN I можно определить как более или менее одинаковый диагноз из-за очень низкой воспроизводимости между разными цитологами и разными цитологическими отделениями. Ostor (IntJ. Gyn Path. 12:186-192, 1993) обнаружил, что приблизительно только 1% случаев CIN I могут прогрессировать до карциномы шейки матки. Таким образом, существует реальная необходимость в эффективном способе идентификации подгруппы индивидов с ASCUS, кондиломой или CIN I, со значительным риском развития карциномы шейки матки. В исследовании Karlsen et al., 1996 в 87% случаев карциномы шейки матки обнаружили HPV одного из типов 16, 18, 31 или 33. При включении сюда HPV 45 для приблизительно 90% образцов карциномы шейки матки обнаружена связь с данными пятью типами HPV. Следовательно, рассчитывая по данным, предоставленным Ostor (Int J. Gyn Path. 12:186-192. 1993),более чем 99,9% пропущенных случаев ASCUS, CIN I и кондиломы, выявляют с применением набора авторов настоящего изобретения HPV-Proofer. В способе по изобретению "наличие экспрессии" мРНК принимают для обозначения экспрессии выше фонового уровня. Не существует абсолютной необходимости точного количественного определения уровня экспрессии мРНК или для точного определения относительных уровней экспрессии мРНК L1 и Е 6. В некоторых осуществлениях способы по изобретению могут включать количественное определение уровней экспрессии мРНК. В предпочтительном осуществлении для обеспечения четкого разделения между "наличием экспрессии" и "отсутствием экспрессии", определение "наличия экспрессии" может требовать присутствия более чем 50 копий соответствующей мРНК (на мл образца или на общий объем образца), в то время как определение "отсутствия экспрессии" может требовать присутствия менее чем 1 копии соответствующей мРНК (на мл образца или на общий объем образца). Способы по изобретению предпочтительно включают скрининг мРНК E6 с применением способа,обеспечивающего специфичное определение мРНК, ассоциированных с раком типов HPV, более предпочтительно ассоциированных с раком типов HPV с высоким риском. В наиболее предпочтительном осуществлении способы включают скрининг мРНК E6 с применением способа, обеспечивающего определение мРНК E6 HPV типов 16, 18, 31 и 33, а предпочтительно также 45. Наиболее предпочтительно,чтобы способ специфично обнаруживал экспрессию мРНК E6 по меньшей мере одного из HPV типов 16,18, 31, 33 и предпочтительно также 45, а наиболее предпочтительно - все пять типов. Однако женщины с наличием экспрессии E6 типов, отличных от 16, 18, 31, 33 и 45, например, 35, 39, 45, 52, 56, 58, 59, 66 и 68 все еще могут обладать "риском" развития карциномы шейки матки. Таким образом, способ может включать скрининг на наличие экспрессии мРНК E6 одного или более данных типов HPV, наиболее предпочтительно в дополнение к скринингу мРНК E6 HPV типов 16, 18, 31, 33 и 45. Отдельные типыHPV проявляют заметное географическое/популяционное распределение. Следовательно, целесообразным может представлять собой включение праймеров, специфичных для типа HPV, для которого известно преобладание в тестируемой популяции/географической области, например, в дополнение к скринингу HPV типов 16, 18, 31, 33 и 45. Во избежание неопределенности, если не указано иначе, термин "мРНК Е 6", как применяют здесь,включает все природные транскрипты мРНК, содержащие целую открытую рамку считывания E6 или ее часть, включающие природные варианты сплайсинга, и, следовательно, включает транскрипты, дополнительно содержащие целую открытую рамку считывания Е 7 или ее часть (и более того, дополнительные открытые рамки считывания). Термины "мРНК Е 6/Е 7", "транскрипты Е 6/Е 7" и т.д. применяются как-7 006975 взаимозаменяемые с терминами "мРНК Е 6", "транскрипты Е 6", а также включают природные транскрипты мРНК, содержащие целую открытую рамку считывания E6 или ее часть, включающую природные варианты сплайсинга, и транскрипты, содержащие целую открытую рамку считывания Е 7 или ее часть. Термин "экспрессия онкогена", если не указано иначе, также относится к природным транскриптам мРНК, содержащим целую открытую рамку считывания E6 или ее часть, включающим природные варианты сплайсинга, и транскрипты, содержащие целую открытую рамку считывания Е 7 или ее часть. В клетках, инфицированных HPV 16, к настоящему времени описали четыре вида мРНК Е 6/Е 7, то есть не подвергающийся сплайсингу транскрипт E6 и три образованные в результате сплайсинга транскрипта, названные Е 6I, Е 6II и E6III (Smotkin D, et al., J Virol. 1989 Mar 63 (3): 1441-7; Smotkin D Wettstein FO. Proc Natl Acad Sci USA. 1986 Jul 83 (13): 4680-4; Doorbar J. et al., Virology. 1990 Sep 178 (1): 25462; Cornelissen MT, et al. J Gen Virol. 1990 May 71(Pt 5): 1243-6; Johnson MA, et al. J Gen Virol. 1990 Jul 71(Pt 7): 1473-9; Schneider-Maunoury S, et al. J Virol. 1987 Oct 61(10): 3295-8; Sherman L, et al. Int. J Cancer. 1992 Feb 50 (3): 356-64). Все четыре транскрипта транскрибируются с одного промотора (р 97), расположенного непосредственно выше второго ATG ORF E6. В одном осуществлении способы могут включать скрининг транскриптов Е 6, содержащих целую открытую рамку считывания Е 7 или ее часть. Этого можно достичь, например, с применением праймеров или зондов, специфичных для кодирующей области Е 7. В дополнительном осуществлении способы могут включать скрининг на присутствие "полноразмерных" транскриптов Е 6. В случае HPV 16 термин "полноразмерные транскрипты Е 6" относится к транскриптам, содержащим всю область от нуклеотида (nt) 97 до nt 880 в ORF E6, включая nt 97 и 880. Положения нуклеотидов пронумерованы согласно стандартной номенклатуре HPV (см. Human Papillomavirus Compendium OnLine, доступный в интернет или в бумажном виде из базы данных HV, Mail StopK710, Los Alamos National Laboratory, Los Alamos, NM 87545, USA). Специфичного обнаружения полноразмерных транскриптов можно добиться, например, с применением праймеров или зондов, специфичных для области, присутствующей только в полноразмерных транскриптах E6, но не в вариантах сплайсинга. Различные типы HPV проявляют различный характер экспрессии мРНК Е 6/Е 7. Карты транскрипции для различных типов HPV, включающих типы 16 и 31, которые можно использовать для облегчения разработки зондов или праймеров для обнаружения транскриптов Е 6/Е 7, находятся в открытом доступе вHuman Papillomavirus Compendium (см. выше). Здесь описаны олигонуклеотидные праймеры для E6, которые можно применять для амплификации областей мРНК E6 различных типов HPV посредством NASBA или ПЦР. В предпочтительном осуществлении способы, включающие скрининг на наличие экспрессии мРНКL1, могут включать скрининг на наличие экспрессии мРНК L1 с применением способа, позволяющего определять мРНК L1, по существу, всех известных типов HPV или, по меньшей мере, основных ассоциированных с раком типов HPV (например, предпочтительно всех HPV типов 16, 18, 31 и 33) . Здесь описаны праймеры и зонды для L1, обеспечивающие определение мРНК L1 HPV типов 6, 11, 16, 18, 31, 33, 35 и 51 в образцах шейки матки. Определение транскриптов L1 может представлять собой определение "вирулентности" HPV, имея в виду присутствие литической активности HPV. Определение транскриптов Е 6/Е 7 можно назвать определением "патогенеза" HPV, так как экспрессия данных мРНК указывает на молекулярные события, ассоциированные с риском развития карциномы. При исследовании 4589 женщин с применением способа, основанного на скрининге на наличие экспрессии мРНК Е 6 и L1 (см. сопроводительные примеры), оказалось возможным определить за исключением одного все случаи повреждений CIN III или рака. В дополнительных осуществлениях описанные выше способы по изобретению могут включать скрининг на наличие экспрессии транскриптов мРНК человеческого гена р 16ink4a, в дополнение к скринингу на наличие экспрессии транскриптов L1 и/или Е 6 HPV. Положительный результат для экспрессии мРНК р 16ink4a принимают как дополнительное указание на риск развития карциномы шейки матки. Р 16ink4a и представители родственного семейства могут функционировать путем регуляции фосфорилирования и супрессии увеличения продукта гена ретинобластомы (RB). В подтверждение этого, обнаружили, что существует обратная зависимость между экспрессией белка р 16ink4a и присутствием нормального RB в выбранных линиях раковых клеток; белок pl6ink4a определяют тогда, когда RB является мутантным, удаленным или инактивированным, и его значительно меньше, или он отсутствует в линиях клеток, содержащих нормальный RB. Kheif et al. (Kheif SN et al., Proc. Natl. Acad. Sci. USA 93:4350-4354. 1996), обнаружили, что белок pl6ink4a экспрессирован в клетках карциномы шейки матки человека, содержащих мутантный RB или функционально инактивированный посредством Е 7 RB дикого типа. Они также показывали, что инактивация RB коррелирует с повышающей регуляцией р 16ink4a, подтверждая обратную связь, вовлекающую pl6ink4a и RB. Milde-Langosch et al. (Milde-Langosch K., et al. (2001) Virchows Arch 439: 55-61) обнаружили, что существуют значительные корреляции между высокой экспрессией р 16 и инфекцией HPV 16/18, а также между высокой экспрессией р 16 и экспрессией онкогенов Е 6/Е 7 HPV 16/18. Klaes et al. (Klaes R, et al., (2001) Int. J. Cancer 92: 276-284) наблюдали сильно повы-8 006975 шенную экспрессию продукта гена р 16ink4a в 150 из 152 выраженных диспластических очагов повреждения шейки матки (от CIN II до инвазивного рака), в то время как нормальный эпителий шейки матки или воспалительные или метапластические повреждения не окрашивались специфичными для р 16ink4a моноклональными антителами Е 6 Н 4. Для всех очагов повреждения, относящихся к CIN I, ассоциированных сLR-HPV типами, реакционной способности не показали или показали только фокальную или случайную реакционную способность, в то время как все кроме двух повреждений, относящихся к CIN I, ассоциированных с HR-HPV типами, показали сильное и диффузное окрашивание на p16ink4a. Описанные способы скрининга можно проводить на препарате нуклеиновой кислоты, выделенной из клинического образца или образца биопсии, содержащих клетки шейки матки, полученных у тестируемого субъекта. Подходящие образцы, которые можно применять как источник нуклеиновых кислот,включают (в качестве неограничивающих примеров) мазки из шейки матки, образцы биопсии шейки матки, соскобы из шейки матки, образцы биопсии кожи/бородавок, а также заключенные в парафин ткани и клетки, фиксированные формалином или метанолом. Препарат нуклеиновой кислоты для скрининга с применением описанных способов должен включать мРНК, однако, он не должен представлять собой препарат очищенной поли А+мРНК, а для реакцииNASBA как исходный материал подходят также препараты тотальной РНК или неочищенные препараты тотальной нуклеиновой кислоты, содержащие РНК и геномную ДНК, или даже неочищенные лизаты клеток. По существу, для выделения препарата нуклеиновой кислоты из тестового образца можно использовать любой способ, известный в данной области. Предпочтительный способ представляет собой"Boom", описанный в US-A-5234809 и ЕР-В-0389063. Данный способ, который можно применять для выделения препарата нуклеиновой кислоты, содержащего РНК и ДНК, основан на свойствах нуклеиновой кислоты связываться с частицами диоксида кремния в присутствии вызывающего диссоциацию комплексов средства гуанидинтиоцианата (GuSCN). Способы по изобретению основаны на оценке активной транскрипции генома HPV в клетках шейки матки. Способы не ограничены в отношении точного способа, применяемого для определения экспрессии мРНК. В данной области известно множество способов определения специфичных последовательностей мРНК и их можно применять по изобретению. Например, специфичные мРНК можно определять посредством способов гибридизации, амплификации или секвенирования. Наиболее предпочтительно выявлять экспрессию мРНК посредством способа амплификации, наиболее предпочтительно, изотермической амплификацией, такой как NASBA, опосредованной транскрипцией амплификацией, способом опосредованной сигналом амплификации РНК, изотермической амплификацией в жидкой фазе т.д. Все данные способы хорошо известны в данной области. Наиболее предпочтительно экспрессию мРНК определяют посредством изотермической амплификации в сочетании с определением продукта амплификации в реальном времени. Наиболее предпочтительное сочетание представляет собой амплификацию посредством NASBA, сопряженную с определением продукта амплификации в реальном времени с применением способа с зондами в виде молекулярных беконов, как описано у Leone et al., Nucleic Acids Research, 1998, Vol 26, 2150-2155. Способы для определения HPV в тестируемом образце с применением способа NASBA как правило включают следующие стадии:(a) составление реакционной смеси, содержащей подходящие пары праймеров, РНК-зависимую ДНК-полимеразу, рибонуклеазу, гидролизующую цепь РНК гибрида РНК-ДНК без гидролиза одноцепочечной или двухцепочечной РНК или ДНК, РНК-полимеразу, распознающую данный промотор и рибонуклеозид- и дезоксирибонуклеозидтрифосфаты;(b) инкубацию реакционной смеси с препаратом нуклеиновой кислоты, выделенной из тестируемого образца, в котором предполагают наличие HPV в реакционных условиях, обеспечивающих реакцию амплификации NASBA, и(c) определения и/или количественного измерения любого специфичного для HPV продукта реакции амплификации NASBA. Определение специфичного(ых) продукта(ов) реакции NASBA (т.е. смысловых и/или антисмысловых копий РНК-мишени) можно проводить посредством ряда различных путей. В одном подходе продукт(ы) NASBA можно определять с применением специфичных к HPV гибридизационных зондов, способных к специфичному отжигу с продуктом NASBA. Гибридизационный зонд может являться связанным с детектируемой меткой, например, флуоресцентным, люминесцентным, радиоактивным или хемилюминесцентным соединением или ферментной меткой или любой другой меткой известной специалисту в данной области. Точная природа метки не важна, но она должна являться способной к продукции сигнала, детектируемого внешними способами или самостоятельно или в соединении с одним или более дополнительными веществами (например, субстратом для фермента). Предпочтительный способ определения представляет собой так называемую "NASBA в реальном времени", обеспечивающую непрерывный мониторинг образования продукта реакции NASBA во время протекания реакции. В предпочтительном осуществлении этого можно достичь с применением зондов в виде "молекулярных беконов", содержащих специфичную для HPV последовательность, способную к отжигу с продуктом NASBA, формирующую спаренный стебель олигонуклеотидную последователь-9 006975 ность и пару групп люминофор/гаситель, как известно в данной области и описано здесь. Если зонд в виде молекулярного бекона добавляют к реакционной смеси до амплификации, то возможно контролировать образование продукта NASBA в реальном времени (Leone et al., Nucleic Acids Research, 1998, Vol 26, 2150-2155). Наборы реагентов и устройства для проведения определения посредством NASBA коммерчески доступны (например, NucliSens EasyQ system, из Organon Teknika). В дополнительном подходе технологию молекулярных беконов можно включить в олигонуклеотиды праймера 2, что обеспечивает мониторинг реакции NASBA в реальном времени без необходимости отдельного гибридизационного зонда. В еще одном дополнительном подходе образование продуктов реакции NASBA можно контролировать с применением общего меченого зонда для детекции, который гибридизуется с нуклеотидной последовательностью на 5'-конце олигонуклеотидного праймера 2. Это представляет собой эквивалент системы детекции "NucliSens" поставляемой Organon Teknika. В данной системе специфичности для продуктов NASBA, полученных из мРНК-мишени HPV, можно достичь посредством применения специфичных к HPV захватывающих зондов, содержащих, как описано здесь, олигонуклеотиды зонда, прикрепленные к твердой основе, такой как магнитные микрогранулы. Наиболее предпочтительный общий меченый зонд для детекции представляет собой зонд ECL для детекции, поставляемый Organon Teknika. Ампликоны NASBA гибридизуются со специфичными для HPV захватывающими зондами и общим зондом ECL (посредством комплементарной последовательности на праймере 2). После гибридизации комплексы гранула/ампликон/зонд ECL можно уловить на магнитный электрод автоматического устройства для считывания ECL (например, NucliSens reader, поставляемый Organon Teknika). Далее импульс напряжения запускает реакцию ECL. Определение мРНК HPV также имеет клиническую значимость при раках, отличных от карциномы шейки матки, включающих, например, карциному головы и шеи, карциному полости рта и языка, карциному кожи, анальную и вагинальную карциному. Определение мРНК HPV также может являться очень полезным при диагностике микрометастазов в лимфатических узлах нижней части тела. Следовательно,изобретение также относится к способам скрининга на наличие восприимчивости к указанным выше видам рака, основанным на скрининге на наличие экспрессии транскриптов L1 и E6 HPV. В соответствии с дополнительным аспектом настоящего изобретения предоставляют набор для применения в обнаружении транскриптов генов L1 и E6 HPV, где набор содержит по меньшей мере одну пару праймеров, пригодных для применения в амплификации области транскриптов L1 по меньшей мере из HPV типов 16, 18, 31 и 33, а предпочтительно также HPV 45, и одну или более пар праймеров, позволяющих амплификацию областей транскриптов E6 из HPV типов 16, 18, 31 и 33, а предпочтительно также HPV 45."Пара праймеров" принимают для обозначения пары праймеров, которые можно применять в сочетании для амплификации специфичной области мРНК L1 или E6 с применением любой известной технологии нуклеиновых кислот. В предпочтительных осуществлениях пара праймеров, включаемая в набор,подходит для применения при амплификации NASBA или подобном способе изотермической амплификации. Отдельные праймеры, составляющие каждую пару праймеров, включенную в набор, можно поставлять отдельно (например, отдельный контейнер для каждого праймера) или более предпочтительно можно поставлять смешанными в одном контейнере. Сочетания двух или более пар праймеров можно поставлять готовыми в одном контейнере набора. Может являться удобным поставлять две или более пары праймеров в одном контейнере, где две или более реакции амплификации должны являться "множественными", что означает непрерывное проведение в одном реакционном сосуде. Пара(ы) праймеров, пригодная для применения в амплификации области транскриптов E6, должна обеспечивать амплификацию области мРНК E6, по меньшей мере, большинства ассоциированных с раками HPV типов 16, 18, 31 и 33, а предпочтительно также HPV 45. Существует несколько различных путей, которыми этого можно достичь. В одном осуществлении набор может содержать отдельные пары праймеров, специфичные к каждому HPV типов 16, 18, 31 и 33, а предпочтительно также HPV 45. Данные пары праймеров можно поставлять в наборе в раздельных контейнерах или их можно поставлять как смеси двух или более пар праймеров в одном контейнере, например, для обеспечения многократности реакций амплификации. В дополнительном осуществлении набор может содержать одну пару праймеров способную к амплификации области гена E6 HPV типов 16, 18, 31 и 33, а предпочтительно также HPV 45, которая также обеспечивает амплификацию всех четырех (предпочтительно пяти) типов в одной реакции амплификации. Этого, например, можно достичь с применением пары вырожденных праймеров или выбора области мРНК E6, высококонсервативной в типах HPV. Пара праймеров для Е 6 может соответствовать любой области мРНК Е 6 и может обеспечивать амплификацию целых открытых рамок считывания E6 и/или Е 7 или их частей. Набор может дополнительно содержать пары праймеров, пригодных для применения в амплификации мРНК Е 6 из HPV типов, отличных от типов 16, 18, 31 и 33, а предпочтительно также HPV 45. На- 10006975 пример, набор можно дополнить праймерами для E6 для определения типа HPV, являющегося эндемичным в конкретной географической области или популяции. Пара(ы) праймеров, пригодная для применения в амплификации области транскриптов L1, должна обеспечивать амплификацию области мРНК L1, по меньшей мере, большинства ассоциированных с раком HPV типов 16, 18, 31 и 33, а предпочтительно также HPV 45, и предпочтительно должна являться пригодной для применения в амплификации области мРНК L1 по существу всех известных типов HPV. С применением таких праймеров возможно тестировать наличие активной транскрипции мРНК L1 множества типов HPV в одной реакции амплификации. Конструировать праймеры, способные к определению транскриптов L1 множества типов HPV, возможно посредством отбора областей транскриптов L1, являющихся высококонсервативными. В дополнительном подходе, специфичности для множества типов HPV можно достичь с применением вырожденных олигонуклеотидных праймеров или комплексных смесей полинуклеотидов, с незначительными изменениями последовательности, предпочтительно соответствующих участкам изменчивости последовательности в генотипах HPV. Рациональное обоснование применения таких вырожденных праймеров или смесей представляет собой то, что смесь может содержать по меньшей мере одну пару праймеров, способную к определению каждого типа HPV. В еще одном дополнительном подходе специфичности для множества типов HPV можно достичь посредством включения в праймеры одного или более нуклеотидов инозина предпочтительно в участки изменчивости последовательности в генотипах HPV. Пары праймеров для E6 и L1 можно поставлять в раздельных контейнерах набора или пару(ы) праймеров для L1 можно поставлять в качестве смеси с одним или более парами праймеров для E6 в одном контейнере. Наборы могут дополнительно содержать один или более зондов, пригодных для применения в определении продуктов реакций амплификации, проводимых с применением включенных в набор пар праймеров. Зонд(ы) можно поставлять как отдельный реагент в наборе. Альтернативно, зонд(ы) можно поставлять как смесь с одной или более парами праймеров. Праймеры и зонды, включенные в набор, предпочтительно представляют собой одноцепочечные молекулы ДНК. Также можно применять неприродные, синтетические полинуклеотиды, сохраняющие способность образовывать пары оснований с комплементарной молекулой нуклеиновой кислоты, включающие синтетические олигонуклеотиды, с введенными в них модифицированными основаниями и синтетические олигонуклеотиды, где связи между отдельными нуклеотидами включают связи, отличные от фосфодиэфирных связей. Праймеры и зонды можно получать хорошо известными в данной области способами, такими как химический синтез с применением стандартных устройств и протоколов для олигонуклеотидного синтеза. Праймеры и зонды, как правило, представляют собой выделенные одноцепочечные полинуклеотиды не более чем из 100 оснований в длину, более типично - менее чем из 55 оснований в длину. Во избежание неопределенности здесь устанавливают, что термины "праймер" и "зонд" исключают природные полноразмерные геномы HPV. В набор можно включить некоторые общие типы олигонуклеотидных праймеров и зондов, содержащие специфичные для HPV последовательности. Как правило, такие праймеры и зонды могут содержать дополнительные, не относящиеся к HPV последовательности, например последовательности, необходимости для реакции амплификации или облегчения детекции продуктов реакции амплификации. Первым типом праймеров являются олигонуклеотиды праймера 1 (также обозначаемые здесь как праймеры Р 1 для NASBA), представляющие собой олигонуклеотиды, как правило, приблизительно 50 оснований в длину, содержащие в среднем приблизительно 20 оснований на 3'-конце, которые комплементарны области мРНК-мишени. Олигонуклеотиды, пригодные для применения в качестве праймеров Р 1 для NASBA, в табл. 1 обозначают как "P1/PCR". Олигонуклеотиды праймера Р 1, как правило, обладают структурой X1-SEQ, где SEQ представляет собой последовательность, специфичную для HPV, a X1 представляет собой последовательность, содержащую промотор, который распознается специфичной РНК-полимеразой. Для использования в олигонуклеотидах по настоящему изобретению предпочтительными являются промоторы бактериофагов, например, промоторы Т 7, Т 3 и SP6, так как они обеспечивают преимущества высокого уровня транскрипции, которая зависит только от связывания соответствующей РНК-полимеразы. В предпочтительном осуществлении последовательность X1 может содержать последовательность AATTCTAATACGACTCACTATAGGG или последовательность AATTCTAATACGACTCACTATAGGGAGAAGG. Данные последовательности содержат промотор Т 7, включая участок инициации транскрипции для РНК-полимеразы Т 7. Специфичные для HPV последовательности в праймерах,обозначенных в табл. 1 как "P1/PCR", также можно адаптировать для применения в стандартных праймерах ПЦР. Когда данные последовательности применяют как основу праймеров Р 1 для NASBA, они обладают общей структурой X1-SEQ, как определено выше. Промоторная последовательность X1 существенна в праймере Р 1 для NASBA. Однако когда те же последовательности применяют как основу праймеров стандартной ПЦР присоединение X1 не является обязательным.- 11006975 Второй тип праймеров представляют собой олигонуклеотиды праймера 2 для NASBA (также обозначаемые здесь как праймеры Р 2 для NASBA), которые, как правило, включают последовательность приблизительно из 20 оснований, в основном идентичных мРНК-мишени. Олигонуклеотидные последовательности, обозначенные в табл. 1 как "P2/PCR" пригодны для применения и в праймерах Р 2 дляNASBA и в праймерах для стандартной ПЦР. Предназначенные для использования в качестве праймеров Р 2 для NASBA олигонуклеотиды в конкретном, но не ограничивающем осуществлении, дополнительно содержат последовательность нуклеотидов на 5'-конце, которая не связана с мРНК-мишенью, но способна к гибридизации с общим зондом для детекции. Зонд для детекции предпочтительно является меченным, например, флуоресцентной, люминесцентной или ферментативной меткой. В одном осуществлении зонд для детекции является меченым меткой, обеспечивающей детекцию с применением способа ECL, хотя необходимо принимать во внимание, что изобретение ни в коем случае не ограничено данным конкретным способом детекции. В предпочтительном осуществлении 5'-конец олигонуклеотидов праймера 2 может содержать последовательность GATGCAAGGTCGCATATGAG. Данная последовательность способна гибридизоваться с общим зондом ECL, доступным из Organon Teknika и обладающим следующей структурой:Ru(bpy)32+-GATGCAAGGTCGCATATGAG-3' В другом осуществлении олигонуклеотиды праймера 2 могут содержать технологию "молекулярных беконов", известную в данной области и описанную, например, в WO 95/13399, выданном Tyagi иKramer, Nature Biotechnology. 14: 303-308, 1996, для обеспечения мониторинга реакции NASBA в реальном времени. Также в набор можно включить олигонуклеотиды зонда, специфичного к мишени. Олигонуклеотиды зонда, как правило, включают последовательность приблизительно из 20-25 нуклеотидов, в основном идентичную области мРНК-мишени или комплементарную ей. Примеры, специфичные для HPV олигонуклеотидных последовательностей, пригодных для применения в качестве зондов, обозначены в табл. 1 как "РО". Олигонуклеотиды зонда можно применять как специфичные для мишени гибридизационные зонды для детекции продуктов реакций NASBA или ПЦР. В таком контексте олигонуклеотиды зонда можно. связывать с твердой основой, такой как парамагнитные гранулы, для формирования захватывающего зонда (см. ниже). В предпочтительном осуществлении 5'-конец олигонуклеотида зонда может быть мечен биотином. Добавление биотиновой метки облегчает прикрепление зонда к твердой основе посредством связи биотин/стрептавидин или биотин/авидин. Специфичные к мишени зонды, обеспечивающие детекцию продуктов амплификации в реальном времени, могут включать технологию "молекулярных беконов", которая известна в данной области и описана, например, у Tyagi и Kramer, Nature Biotechnology. 14: 303-308, 1996 и в WO 95/13399. Примеры специфичных для HPV олигонуклеотидных последовательностей, пригодных для применения в качестве молекулярных беконов обозначены в табл. 1 как "MB". Термин "зонды в виде молекулярных беконов", как применяют здесь, применят для обозначения молекул со структурой Х 2-плечо 1-мишень-плечо 2-Х 3 где мишень представляет собой специфичную к мишени последовательность нуклеотидов, Х 2 и Х 3 представляют собой флуоресцентную группу и группу гасителя, способную к существенному или полному гашению флуоресценции флуоресцентной группы, когда они оба удерживаются вместе в непосредственной близости, а плечо 1 и плечо 2 представляют собой комплементарные последовательности, способные к формированию спаренного стебля. Предпочтительные сочетания последовательностей плечо 1 и плечо 2 представляют собой следующее, однако, это предназначено скорее для иллюстрации, чем ограничения изобретения. Применение технологии молекулярных беконов обеспечивает мониторинг реакций амплификации,например амплификации NASBA, в реальном времени (см. Leone et al., Nucleic Acids Research., 1998, vol: 26, pp 2150-2155). Зонды в виде молекулярных беконов, как правило, включают комплементарные последовательности, фланкирующие специфичную для HPV последовательность, представленные здесь обозначением плечо 1 и плечо 2, которые способны гибридизоваться друг с другом, формируя структуру спаренного стебля. Точные последовательности плечо 1 и плечо 2 не являются предметом изобретения, за исключением необходимости того, что данные последовательности должны являться способными к формированию спаренного стебля, когда зонд не связан с последовательностью-мишенью HPV. Зонды в виде молекулярных беконов также включают флуоресцентную группу и группу гасителя,где флуоресцентная группа и группа гасителя представлены здесь посредством обозначения Х 2 и Х 3. Специалисту необходимо принять во внимание, что группы люминофора и гасителя выбирают так, чтобы группа гасителя являлась способной к существенному или полному гашению флуоресценции флуоресцентной группы, когда две группы находятся в непосредственной близости, например, когда зонд находится в "закрытой" конформации шпильки в отсутствии последовательности-мишени. При связывании с последовательностью-мишенью флуоресцентная группа и группа гасителя разделяются, так что флуоресценция флуоресцентной группы больше не гасится. В данной области известно много примеров пригодных пар групп гаситель/люминофор, которые можно применять по изобретению (см. WO 95/13399, Tyagi и Kramer, там же). Применяют широкий диапазон флуорофоров, выполненных в различных цветах, включающих, например, 5-(2'-аминоэтил) аминонафталин-1-сульфоновую кислоту (EDANS), флуоресцеин, FAM и техасский красный (см. Tyagi,Bratu and Kramer, 1998, Nature Biotechnology, 16, 49-53). Применение зондов, меченых флуорофорами с различной окраской дает возможность "множественной" детекции двух или более различных зондов в одном реакционном сосуде. Предпочтительный гаситель представляет собой 4-(4'-диметиламинофенилазо)бензойную кислоту (DABCYL), нефлуоресцирующий хромофор, служащий в качестве "универсального" гасителя для широкого диапазона флуорофоров. Группы люминофора и гасителя можно ковалентно связать с зондом в любой ориентации с люминофором на 5'-конце или вблизи него и гасителем на 3'-конце или вблизи него или наоборот. Протоколы для синтеза зондов в виде молекулярных беконов известны в данной области. Подробный протокол для синтеза предоставлен в статье, озаглавленной "Molecular Beacons: Hybridization Probes for Detection of Nucleic Acids in Homogenous Solutions", написанной Sanjay Tyagi et al., Department of Molecular Genetics, Public Health Research Institute, 455 FirstAvenue, New York, NY 10016, USA, доступной в режиме онлайн с веб-сайта PHRI (на www.phri.nyu.edu или www.molecular-beacons.org). Пригодные сочетания праймеров Р 1 для NASBA и Р 2 для NASBA можно применять для проведения реакции амплификации NASBA. Для проведения реакции амплификации NASBA олигонуклеотиды праймера 1 и праймера 2 должны являться способными служить затравкой для синтеза двухцепочечной ДНК с области-мишени мРНК. Для того чтобы это произошло олигонуклеотиды праймера 1 и праймера 2 должны содержать специфичные для мишени последовательности, комплементарные к областям смысловой и антисмысловой цепи мРНК-мишени соответственно. На первой фазе цикла амплификации NASBA, так называемой "нециклической" фазе, олигонуклеотиды праймера 1 отжигаются с комплементарной последовательностью мРНК-мишени, а их 3'-конец удлиняется под действием РНК-зависимой ДНК-полимеразы (например, обратная транскриптаза) с формированием первой цепи синтеза кДНК. Цепь РНК полученного гибрида РНК:ДНК затем расщепляется,например, под действием RNaseH, оставляя одноцепочечную ДНК. Олигонуклеотиды праймера 2 отжигаются с комплементарной последовательностью 3'-конца данной одноцепочечной ДНК, а его конец удлиняется (под действием обратной транскриптазы), формируя двухцепочечную ДНК. РНК-полимераза затем способна транскрибировать множество копий РНК с транскрипционно активной теперь промоторной последовательности в двухцепочечной ДНК. Данный транскрипт РНК, представляющий собой антисмысловую цепь исходной мРНК-мишени, может действовать в качестве матрицы для дальнейшего цикла реакций NASBA, с праймером 2, отжигающимся к РНК и служащем затравкой для синтеза первой цепи кДНК и праймером 1, служащем затравкой для синтеза второй цепи кДНК. Основные принципы реакции NASBA хорошо известны в данной области (см. Compton, J. Nature. 350: 91-92). Описанные здесь специфичные к мишени олигонуклеотиды зонда также можно связать с твердой основой, такой как магнитные микрогранулы, и применять в качестве "захватывающих зондов" для иммобилизации продукта реакции амплификации NASBA (одноцепочечной РНК). Описанные здесь специфичные к мишени зонды в виде "молекулярных беконов" можно применять для мониторинга реакции- 13006975 Наборы по изобретению также могут содержать положительный контроль, включающий мРНК E6 и/или L1 известного типа HPV. Подходящие контроли включают, например, экстракты нуклеиновой кислоты, полученные из клеточных линий, зараженных известными типами HPV (например, HeLa, CaSki). Набор дополнительно может содержать праймеры внутреннего контроля амплификации, например,праймеры, специфичные для человеческой РНК U1A. Содержащие праймеры (и необязательно зонды) наборы, пригодные для применения в амплификации NASBA могут дополнительно содержать смесь ферментов, необходимых для реакции NASBA, например ферментную смесь, содержащую РНК-зависимую ДНК-полимеразу (например, обратную транскриптазу), рибонуклеазу, гидролизующую цепь РНК гибрида РНК-ДНК без гидролиза одно- или двухцепочечной РНК или ДНК (например, RNaseH), и РНК-полимеразу. РНК-полимераза должна представлять собой РНК-полимеразу, распознающую промоторную последовательность, представленную в 5'концевой области праймеров Р 1 для NASBA поставляемых в наборе реагентов. Набор также может содержать запас буфера для NASBA, содержащего рибонуклеозиды и дезоксирибонуклеозиды, необходимые для синтеза РНК и ДНК. Состав стандартного буфера для реакции NASBA хорошо известен специалистам в данной области (см. также Leone et al., там же). Таблица 1 Специфичные для Е 6 последовательности для включения в праймеры и зонды NASBA/ПЦР- 17006975 Таблица 2 Специфичные для L1 последовательности для включения в праймеры и зонды NASBA/ПЦР Предпочтительные праймеры, пригодные для применения в обнаружении мРНК L1 и E6 посредством NASBA, приведены в следующих таблицах. Однако они приведены только с целью иллюстрации и не означают того, что объем изобретения должен являться ограниченным данными конкретными молекулами. В следующих таблицах праймеры Р 2 для NASBA (р 2) включают на 5'-конце последовательностьGATGCAAGGTCGCATATGAG; праймеры Р 1 для NASBA (p1) включают на 5'-конце последовательность AATTCTAATACGACTCACTATAGGGAGAAGG. Подходящие для применения в качестве зондов олигонуклеотиды идентифицируют посредством "ро". Праймеры Р 2, как правило, включают последовательности HPV положительной цепи, тогда как праймеры p1 как правило включают последовательности HPV отрицательной цепи. nt относится к положению нуклеотида в соответствующей геномной последовательности HPV. Пары праймеров P1 и Р 2, обладающие одинаковым префиксом (например, НАе 6701 р 1 и НАе 6701 р 2), предназначены для применения в сочетании. Однако также можно применять другие сочетания, как обобщено ниже для HPV типов 16, 18, 31, 33 и 45. Пригодные пары праймеров для амплификации мРНК Е 6 HPV 16 представляют собой следующие пары: НАе 6701 р 2 или НАе 6702 р 2 (оба nt 116) с НАе 6701 р 1 или НАе 6702 р 1 (оба nt 368). НАе 6701 р 2 или НАе 6702 р 2 (оба nt 116) с HPV16pl (nt 258). Н 16 е 6702 Ар 2 (nt 142), Н 16 е 6702 Вр 2 (nt 182), Н 16 е 6702 Ср 2 (nt 185) или H16e6702Dp2 (nt 188) с(nt 186) или HAe6702Dpl (185). Данные сочетания пригодны для амплификации всех вариантов сплайсинга E6. НАе 6703 р 2 или НАе 6704 р 2 (оба nt 656) с НАе 6703 р 1 или НАе 6704 р 1 (оба nt 741). Данные сочетания пригодны для амплификации всех транскриптов, содержащих кодирующую область Е 7 (по меньшей мере, до nt 741). Следующие пары праймеров предпочтительны для амплификации мРНК Е 6 HPV 18: Н 18 е 6701 р 2 (nt 702) или Н 18 е 6702 р 2 (nt 698) с Н 18 е 6701 р 1 или Н 18 е 6702 р 1 (оба nt 869). Н 18 е 6703 р 2 (nt 651) с H18e6703pl (nt 817). Н 18 е 6704 р 2 (nt 179) с H18e6704pl (nt 379). Следующие пары праймеров предпочтительны для амплификации мРНК Е 6 HPV 31: Н 31 е 6701 р 2 или Н 31 е 6702 р 2 (оба nt 164) с Н 31 е 6701 р 1 или Н 31 е 6702 р 1 (оба nt 423). Н 31 е 6703 р 2 (nt 617), Н 31 е 6704 р 2 (nt 619) или Н 31 е 6705 р 2 (nt 617) с H31e6703pl (nt 766),H31e6704pl (766) или H31e6705pl (nt 809). Следующие пары праймеров предпочтительны для амплификации мРНК Е 6 HPV 33: Н 33 е 6701 р 2 (nt 618) или Н 33 е 6703 р 2 (nt 620) с Н 33 е 6701 р 1 (nt 763) или H33e6703pl (nt 807). Н 33 е 6702 р 2 (nt 431) с H33e6702pl (nt 618). Следующие пары праймеров предпочтительны для амплификации мРНК Е 6 HPV 45:- 25006975 Таблица 4 Праймеры для ПЦР Е 6 Предпочтительные пары праймеров для ПЦР к HPV типов 16, 18, 31 и 33 представляют собой аналоги пар праймеров для NASBA. Таблица 5 Предпочтительные праймеры и зонды для NASBA L1- 27006975 Таблица 6 Предпочтительные праймеры для ПЦР L1 Специфичные для HPV последовательности SEQ ID NO. 149 и 150 (праймеры Onc2A2/Onc2Al-PCR и Onc2A1/Onc2A2-PCR) идентичны фрагментам геномной последовательности HPV типа 16 в положениях 6596-6615 (SEQ ID NO. 149; Onc2A2/Onc2Al-PCR) и в положениях 6729-6747 (SEQ ID NO. 150;Onc2B1/Onc2B2-PCR) представляют собой варианты указанных выше последовательностей, соответственно, включая несколько вырожденных оснований. Представление последовательностей описанных здесь вырожденных олигонуклеотидов применяет стандартный код IUB для смешанных участков оснований: N=G,A,T,C; V=G,A,C; B=G,T,C; Н=А,Т,С; D=G,A,T; K=G,T; S=G,C; W=A,T; M=A,C; Y=C,T;R=A,G. Также возможно применять варианты специфичной для HPV последовательности SEQ ID NO. 152(Onc2B2/Onc2B1-PCR) и SEQ ID NO. 153 (Onc2B1/Onc2B2-PCR) там, где любой из двух нуклеотидовSRH на 3'-конце последовательности заменен инозином (I), как указано ниже: 5' AATGGCATTTGTTGGIIHAA 3' 5' AATGGCATTTGTTGGSIIAA 3' 5' AATGGCATTTGTTGGIRIAA 3' Специфичные для HPV последовательности SEQ ID NO. 156-163 (представленные в праймерахOnc2C2, Onc2D2, Onc2E2, Onc2F2, Onc2G2, Onc2H2, Onc2I2, Onc2J2, Onc2C1-PCR, Onc2D1-PCR,Onc2E1-PCR, Onc2F1-PCR, Onc2G1-PCR, Onc2H1-PCR, Onc2I1-PCR и Onc2J1-PCR) представляют собой варианты, основанные на специфичной для HPV последовательности SEQ ID NO. 152 (Onc2B2/Onc2B1PCR), тогда как специфичные для HPV последовательности SEQ ID NO. 164-169 (представленные в праймерах Onc2K1, Onc2L1, Onc2M1, Onc2N1, Onc2O1, Onc2P1, Onc2K2-PCR, Onc2L2-PCR, Onc2M2PCR, Onc2N2-PCR, Onc2O2-PCR и Onc2P2-PCR) представляют собой варианты, основанные на специфичной для HPV последовательности SEQ ID NO. 153 (Onc2Bl/Onc2B2-PCR). Данные варианты содержат вырожденные основания, а также остатки инозина (I). Данная разновидность последовательности позволяет олигонуклеотидам, включающим различные последовательности, связываться с множеством типов HPV. Основания инозина не препятствуют гибридизации и таким образом их можно внести в участках изменчивости типов HPV для конструирования "консенсусного" праймера, способного связываться с множеством типов HPV. Для амплификации NASBA мРНК L1 HPV можно применять любой из одного или более праймеровOnc2A2, Onc2B2, Onc2C2, Onc2D2, Onc2E2, Onc2F2, Onc2G2, Onc2H2, Onc2I2 и Onc2J2 в сочетании с любым из одного или более праймеров Onс 2 А 1, Onс 2 В 1, Onс 2K1, Onc2Ll, Onc2Ml, Onc2Nl, Onc2O1 иOnс 2 Р 1. Для амплификации ПЦР мРНК L1 HPV можно применять любой из одного или более праймеровOnc2H1-PCR, Onc2I1-PCR и Onc2J1-PCR в сочетании с любым из одного или более праймеров Onc2A2PCR, Onc2B2-PCR, Onc2K2-PCR, Onc2L2-PCR, Onc2M2-PCR, Onc2N2-PCR, Onc2O2-PCR и Onc2P2-PCR. Изобретение будет более понятным при ссылке к следующим экспериментальным примерам и фигурам, где на фиг. 1 А представлены результаты одиночной реакции анализа NASBA в реальном времени с применением молекулярного бекона с FAM на образце от пациентки для HPV 16, тогда как на фиг. 1 В представлен множественный анализ NASBA в реальном времени с применением молекулярного бекона сFAM фиг. 1 А и молекулярного бекона, меченного техасским красным для UIA; на фиг. 2 А представлена одиночная реакция NASBA в реальном времени с молекулярным беконом с FAM на образце от пациентки для HPV 18, тогда как на фиг. 2 В представлена множественная версия с меченным техасским красным молекулярным беконом для HPV 18 и меченного FAM бекона для HPV 33; на фиг. 3 А представлена одиночная реакция NASBA в реальном времени с молекулярным беконом,меченным FAM для HPV 31, тогда как на фиг. 3 В представлена множественная версия, включающая меченный техасским красным молекулярный бекон для HPV 45; на фиг. 4 А представлена одиночная реакция NASBA в реальном времени с молекулярным беконом,меченным FAM для HPV 33, тогда как фиг. 4 В представляет собой множественную версию, включающую меченный техасским красным молекулярный бекон для HPV 18; на фиг. 5 А представлена одиночная реакция NASBA в реальном времени с молекулярным беконом,меченным FAM для HPV 45, тогда как на фиг. 5 В представлена множественная версия, включающая меченный техасским красным молекулярный бекон для HPV 45 и меченный FAM молекулярный бекон дляHPV 31; и на фиг. 6 представлен HPV, выявляемый посредством PreTect HPV-Proofer и ПЦР, в сравнении с цитологией или гистологией. Пример 1. Выявление мРНК HPV посредством основанной на NASBA амплификации нуклеиновой кислоты и детекции в реальном времени. Сбор и подготовка клинических образцов. Образцы мазков по Папаниколау и HPV собирали у 5970 женщин из программы скрининга шейки матки в Осло, Норвегия. Образцы, предназначенные для экстракции РНК/ДНК, обрабатывали, как указано ниже. Образцы из шейки матки собирали у каждой женщины, проходящей по программе скрининга шейки матки, с применением клеточного мазка (Rovers Medical Devices, The Netherlands). Клеточный мазок затем погружали в 9 мл лизирующего буфера (5 М гуанидинтиоционат). Так как РНК в 5 М гуанидинтиоционате лучше всего защищена при -70 С только 1 мл общего объема образца применяли для каждого цикла экстракции. Образцы в лизирующем буфере хранили при -20 С не более чем одну неделю, затем при -70 С до выделения ДНК/РНК. В первом цикле экстракции РНК и ДНК автоматически выделяли от 5300 женщин с применением 1 мл от общего образца в объеме 9 мл лизирующего буфера. РНК и ДНК эктрагировали по способу выделения "Booms" из Organon Teknika (Organon Teknika В. V., Boselind 15, P.O. Box 84, 5280 AB Baxtel, TheNetherlands; в настоящий момент Biomerieux, 69280 Marcy l'Etoile, France) с применением устройства для экстракции NucliSens, следуя протоколу автоматической экстракции. Клеточные линии. ДНК и РНК клеточных линий HeLa (HPV 18), SiHa (HPV 16) и CaSki (HPV 16) применяли в качестве положительных контролей для реакций ПЦР и NASBA. Данные клетки также применяли как материал образца в исследовании чувствительности (пример 2). Клетки SiHa обладают 1-2 интегрированными копиями HPV 16 на клетку, тогда как клетки CaSki обладают от 60 до 600 копий HPV 16 и в интегрированном и в эписомальном состоянии. Клетки HeLa обладают приблизительно 10-50 копиями HPV 18 на клетку. Выявление и типирование HPV посредством ПЦР. Выделенную из соскоба шейки матки ДНК подвергали ПЦР с применением консенсусных праймеров GP5+/6+ (ЕР-В-0 517 704). ПЦР проводили в 50 мкл объема реакционной смеси, содержащей 75 мМTris-HCl (рН 8,8 при 25 С), 20 мМ (NH4)2SO4, 0,01% Tween 20, 200 мМ каждого dNTP, 1,5 мМ MgCl2, 1 Ед рекомбинантной ДНК-полимеразы Taq (MBI Fermentas) , 3 мкл образца ДНК и 50 пмоль каждого из праймеров GP5+ и GP6+. После 2 мин стадии денатурации при 94 С проводили 40 циклов амплификации на устройстве для ПЦР (Primus 96, HPL block, MWG, Germany). Каждый цикл включал стадию денатурации длительностью 1 мин, стадию отжига праймеров при 40 С длительностью 2 мин и стадию удлинения цепи при 72 С длительностью 1,5 мин. Последнюю стадию удлинения продлевали на 4 мин для гарантии полного удлинения амплифицированной ДНК. Положительные на GP5+/6+ образцы подвергали ПЦР по протоколам для HPV типов 16, 31 и 33,как указано ниже:HPV 16, 31 и 33: ПЦР проводили в 50 мкл содержащих 75 мМ Tris-HCl (рН 8,8 при 25 С), 200 мМ каждого dNTP, 1,5 мМ MgCl2, 2,5 Ед рекомбинантной ДНК-полимеразы Taq (MBI Fermentas), 3 мкл образца ДНК и 25 пмоль каждого из праймеров. После 2 мин стадии денатурации при 94 С проводили 35- 29006975 циклов амплификации на устройстве для ПЦР (Primus 96, HPL block, MWG, Germany). Каждый цикл включал стадию денатурации длительностью 30 с, стадию отжига праймеров при 57 С длительностью 30 с и стадию удлинения цепи при 72 С длительностью 1 мин. Последнюю стадию удлинения продлевали на 10 мин для гарантии полного удлинения амплифицированной ДНК. В протоколе для HPV 33 стадия отжига проходит при 52 С. Протокол для HPV 18. Праймеры конструировали для определения HPV типа 18. ПЦР проводили в 50 мкл содержащих 75 мМ Tris-HCl (pH 8,8 при 25 С), 20 мМ (NH4)2SO4, 0,01%Fermentas), 3 мкл образца ДНК и 25 пмоль каждого из праймеров. После 2 мин стадии денатурации при 94 С проводили 35 циклов амплификации на устройстве для ПЦР (Primus 96, HPL block, MWG,Germany). Каждый цикл включал стадию денатурации длительностью 30 с, стадию отжига праймеров при 57 С длительностью 30 с и стадию удлинения цепи при 72 С длительностью 1 мин. Последнюю стадию удлинения продлевали на 10 мин для гарантии полного удлинения амплифицированной ДНК. Набор праймеров к гену человеческого -глобина применяли как контроль качества ДНК (Operatingprocedure, University Hospital Vrije Universiteit, Amsterdam, The Netherlands). ПЦР проводили в 50 мкл содержащих 75 мМ Tris-HCl (pH 8,8 при 25 С), 200 мМ каждого dNTP, 1,5 мМ MgCl2, 1 Ед рекомбинантной ДНК-полимеразы Taq (MBI Fermentas), 3 мкл образца ДНК и 25 пмоль каждого из праймеров. После 2 мин стадии денатурации при 94 С проводили 35 циклов амплификации на устройстве для ПЦР (Primus 96, HPL block, MWG, Germany). Каждый цикл включал стадию денатурации при 94 С длительностью 1 мин, стадию отжига праймеров при 55 С длительностью 1,5 мин и стадию удлинения цепи при 72 С длительностью 2 мин. Последнюю стадию удлинения продлевали на 4 мин для гарантии полного удлинения амплифицированной ДНК. В качестве положительного контроля для HPV 18 применяли HeLa,тогда как в качестве положительного контроля для HPV 16 применяли SiHa или CaSki. В качестве отрицательного контроля применяли воду. Применяемые для ПЦР HPV праймеры Визуализацию продуктов ПЦР проводили на ДНК-чипе 500 (Agilent Technologies, USA) согласно его инструкции. В ДНК-чипе применяют гель-электрофорез в микромасштабе с оптимальным пределом детекции от 0,5 до 50 нг/мл. Результаты обрабатывали с применением программного обеспечения Bioanalyzer 2100 (Agilent Technologies, USA). Следующая ниже таблица подтверждает праймеры, применяемые для ПЦР HPV в образцах от пациенток и указывает дополнительные праймеры для ПЦР, пригодные для HPV 35, 39, 45, 51, 52, 58 и
МПК / Метки
Метки: мрнк, вируса, человека, папилломы, обнаружения, способ
Код ссылки
<a href="https://eas.patents.su/30-6975-sposob-obnaruzheniya-mrnk-virusa-papillomy-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ обнаружения мрнк вируса папилломы человека</a>
Предыдущий патент: Оральная фармацевтическая композиция цефподоксима проксетила
Следующий патент: Способ получения 3-трифторметилфенил-4-цианобензилкетона
Случайный патент: Мембранный модуль со спиральновитыми мембранами прямого осмоса