Замещенные арилпиразины
Номер патента: 6938
Опубликовано: 30.06.2006
Авторы: Юн Тейянг, Де Ломберт Стивен, Джи Пинг, Ходжеттс Кевин Дж., Жанг Кунью, Доллер Дарио, Хорват Реймонд Ф.
Формула / Реферат
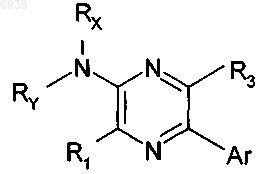
1. Соединение формулы
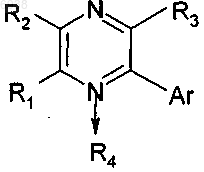
или его фармацевтически приемлемая соль, где
R1 выбран из Н, C1-4алкила, С2-4алкенила, С2-4алкинила, галогена, C1-4галогеноалкила, трифторметила, трифторметокси, -NН(С1-4алкил), -N(C1-4алкил)(С1-4алкил) и -О(C1-4алкил);
R2 выбран из группы, состоящей из -XRA и Y, где X, RA и Y определены ниже; и
R3 выбран из группы, состоящей из водорода, галогена, С1-4алкила, -О(С1-4алкил), трифторметила, трифторметокси и Y;
R4 отсутствует или представляет собой атом кислорода;
Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, или
Аr выбран из группы, состоящей из нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RC;
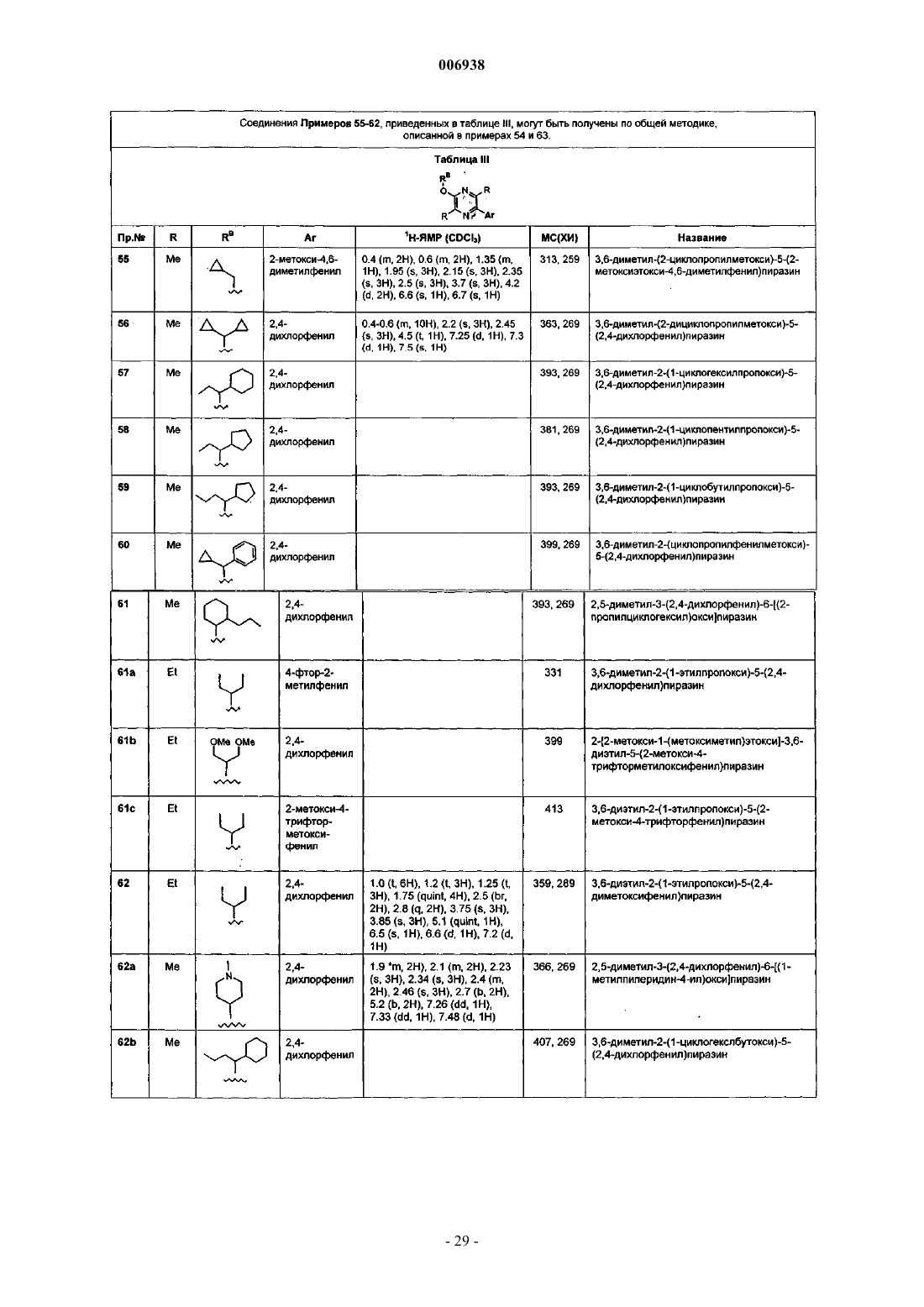
при условии, что если Аr представляет собой замещенный галогеном фенил, нафтил или замещенный галогеном нафтил, то соединения, где R3 представляет собой водород, исключаются;
RA и RB, которые могут быть одинаковыми или разными, в каждом случае независимо выбраны из группы, состоящей из водорода и прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, каждый из которых также может быть замещен одним или двумя заместителем(ями), выбранным(и) из гидрокси, галогена, -O(C1-4алкил), -NH(C1-4алкил), -N(C1-4алкил)(C1-4алкил) и Z;
Rc, в каждом случае независимо, выбран из группы, состоящей из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6алкила, С2-6алкенила, C1-4алкинила, С3-7циклоалкила, (С3-7циклоалкил)С1-4алкила, -О(С1-4алкил), замещенного заместителем RD в количестве от 0 до 2, -NН(C1-4алкил) и -N(C1-4алкил)(C1-4алкил);
Rd, в каждом случае независимо, выбран из группы, состоящей из галогена, гидрокси, C1-4алкила, -O(C1-4алкил), -NН(C1-4алкил), -N(С1-4алкил)(С1-4алкил), морфолино, пирролидино, пиперидино, тиоморфолино, пиперазино, 4-гидроксипиперидино, трифторметила и трифторметокси;
X, в каждом случае независимо, выбран из группы, состоящей из -СН2-, -CHRb-, -О-, -S-, -NH-, -NRB-; и
Y и Z, в каждом случае независимо, выбраны из группы, состоящей из 3-7-членных карбоциклических и гетероциклических групп, которые являются насыщенными, ненасыщенными или ароматическими, которые могут быть замещены одним или двумя заместителями, выбранными из галогена, оксо, гидрокси, С1-4алкила, -О(С1-4алкил), -NН(С1-4алкил) и -N(С1-4алкил)(С1-4алкил), и указанные 3-7-членные гетероциклические группы содержат один или два гетероатом(а), выбранный(ые) из N, О и S, причем точкой присоединения является либо атом углерода, либо атом азота; и
n в каждом случае независимо выбран из 0, 1 и 2.
2. Соединение по п.1, где Аr выбран из группы, состоящей из пиридила, пиридонила или пиримидинила, каждый из которых незамещен или моно-, ди- или тризамещен заместителем RC.
3. Соединение по п.1, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC.
4. Соединение по п.1, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, и R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси.
5. Соединение по п.1, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или три-замещенный заместителем RC, и RA и RB, которые могут быть одинаковыми или разными, независимо представляют собой прямые, разветвленные или циклические алкильные группы, имеющие от 1 до 8 атомов углерода.
6. Соединение по п.1, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, и RA и RB, которые могут быть одинаковыми или разными, в каждом случае независимо выбраны из группы, состоящей из прямых, разветвленных и циклических алкильных групп, имеющих от 1 до 8 атомов углерода; и
R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила и метокси.
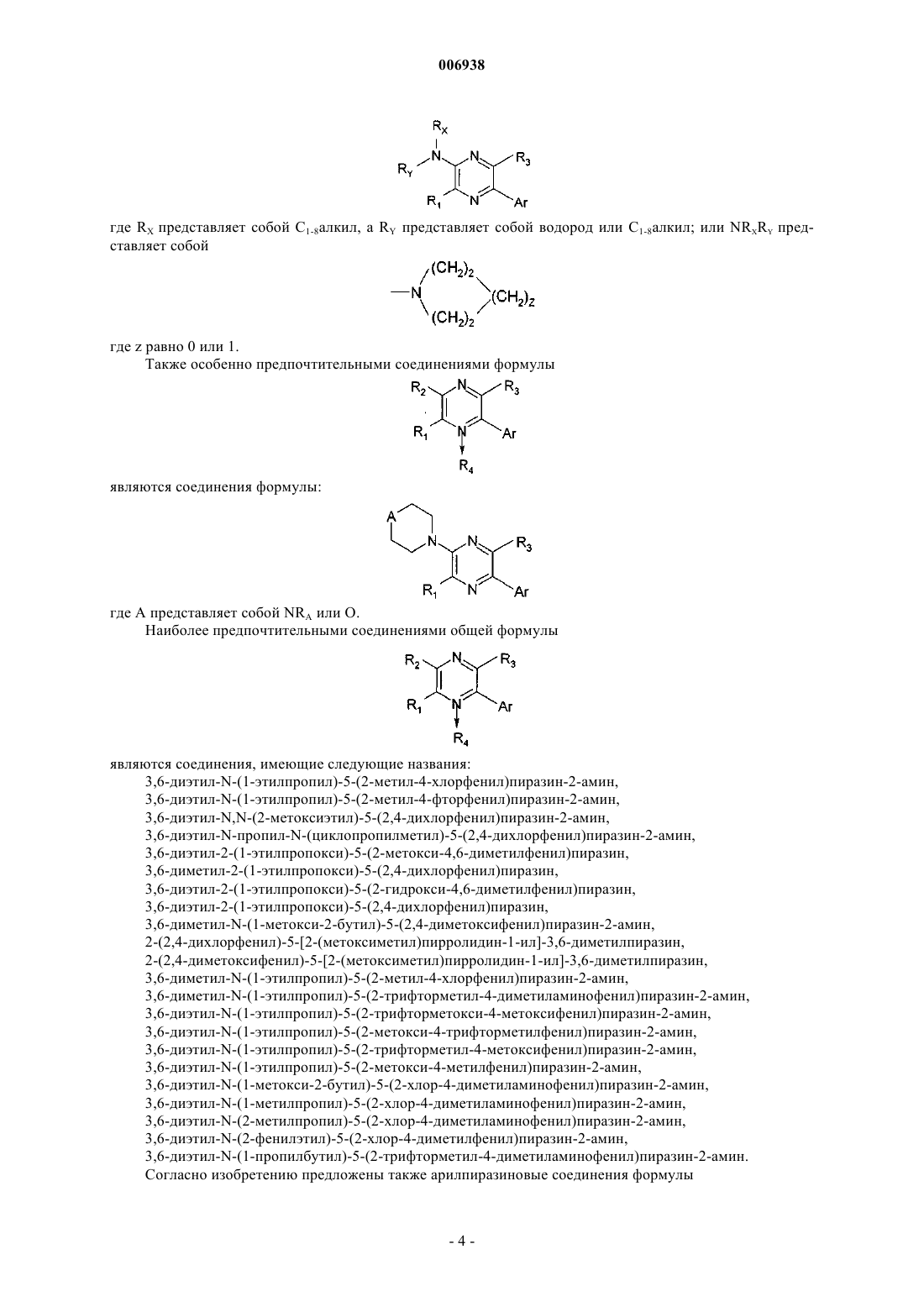
7. Соединение по п.1 формулы
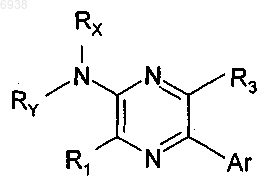
где RX представляет собой С1-8алкил, a RY представляет собой водород или С1-8алкил; или NRxRy представляет собой

где z равно 0 или 1.
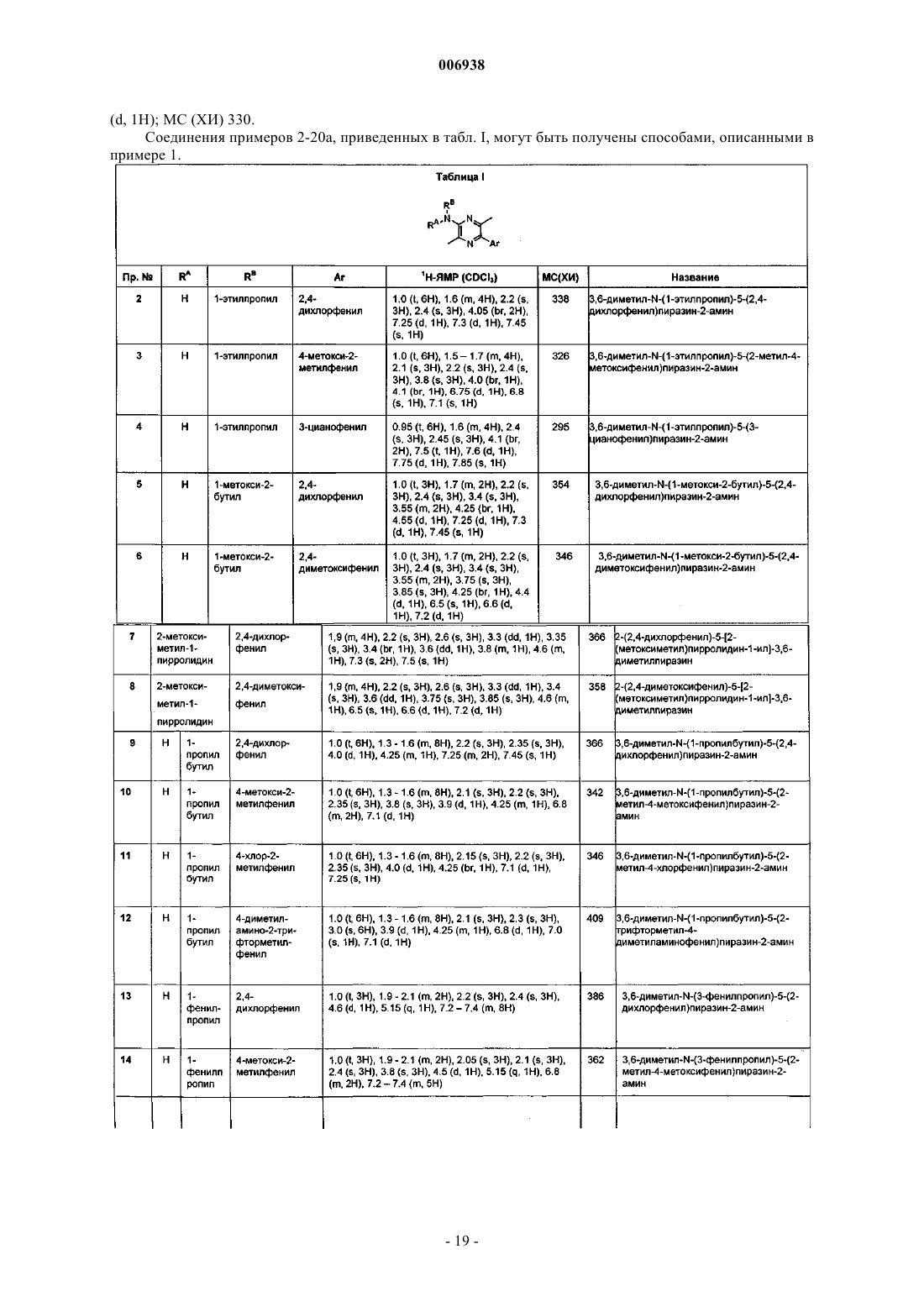
8. Соединение по п.1 формулы
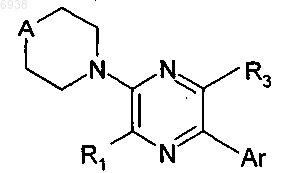
где А представляет собой NRA или О.
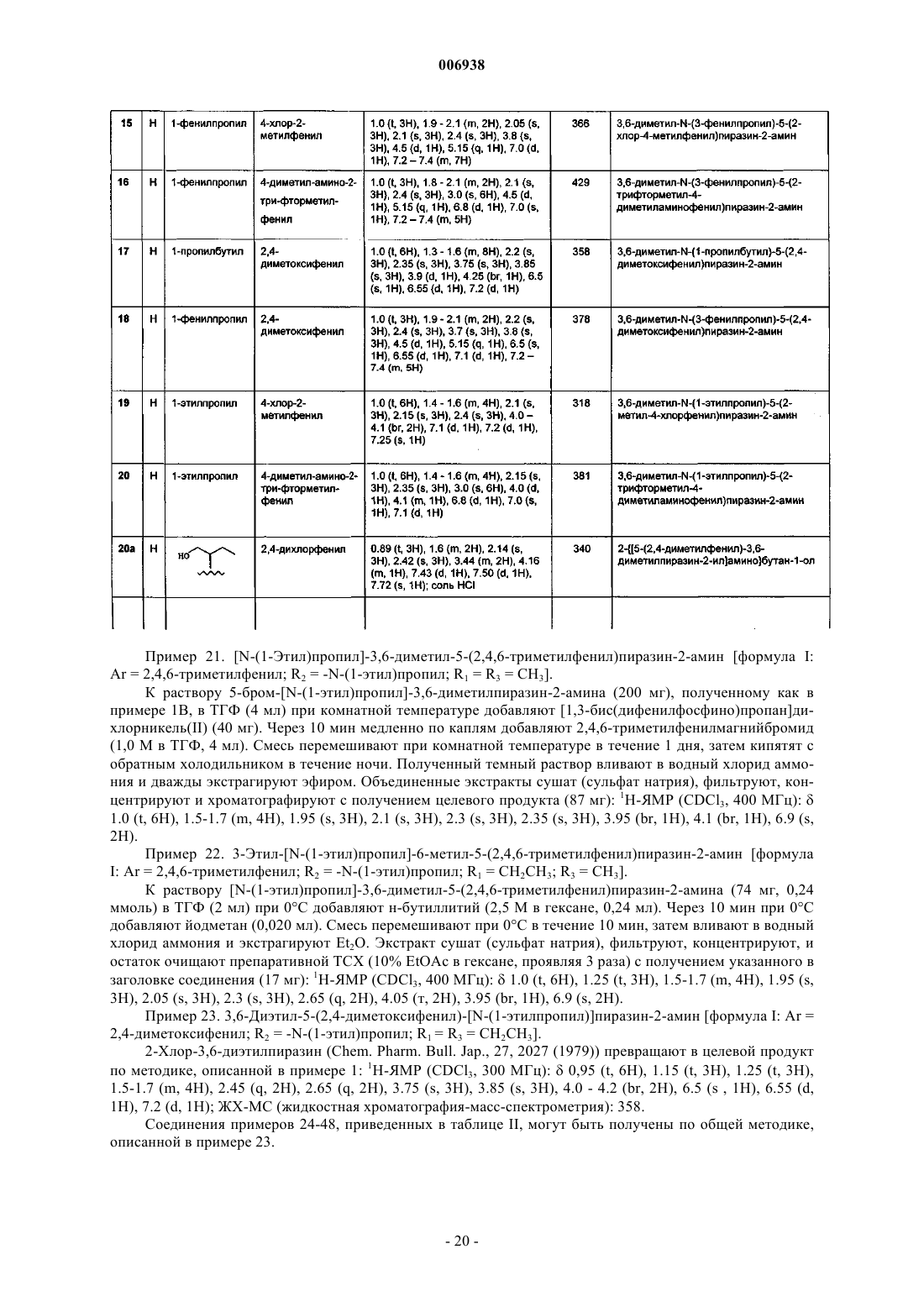
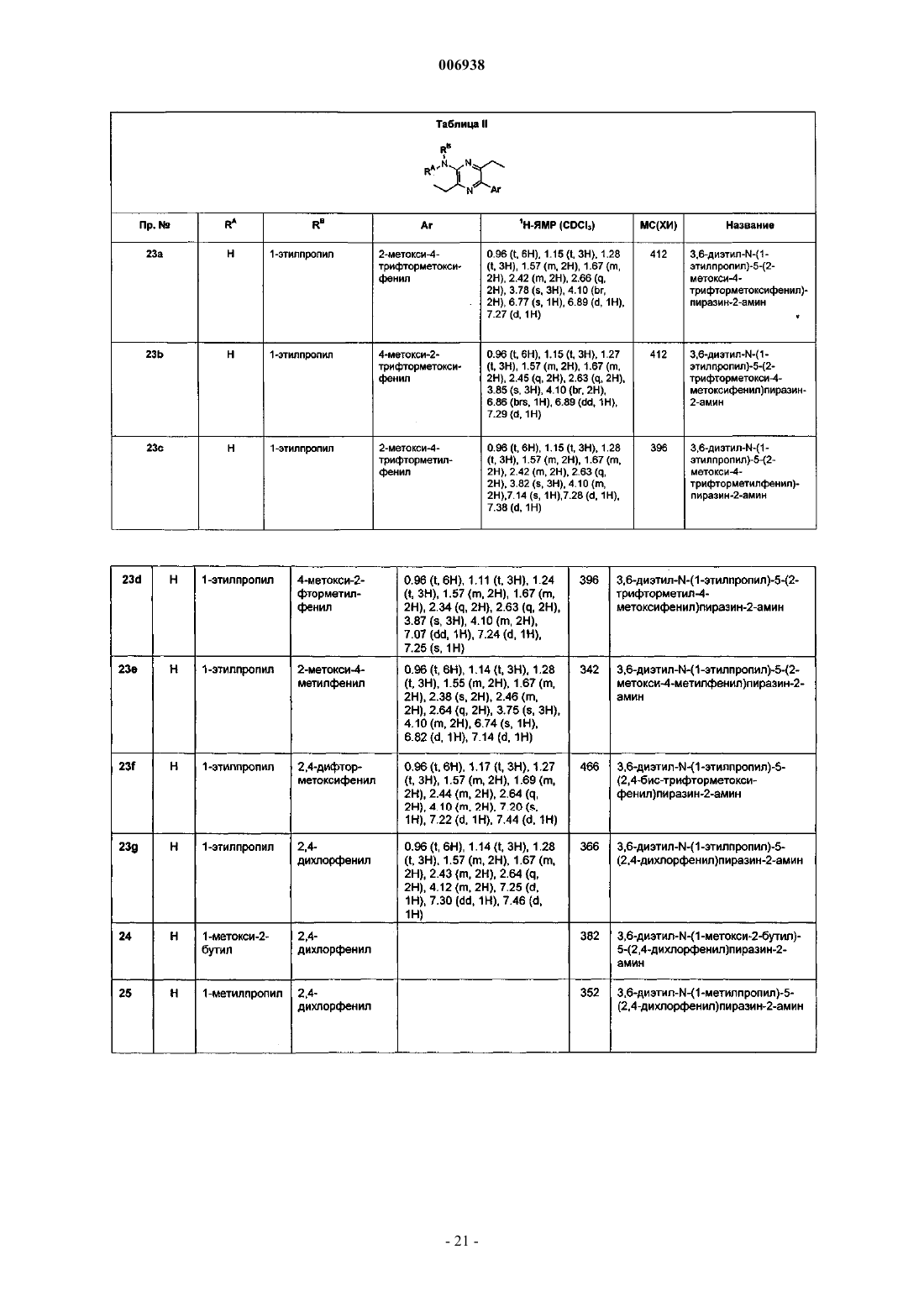
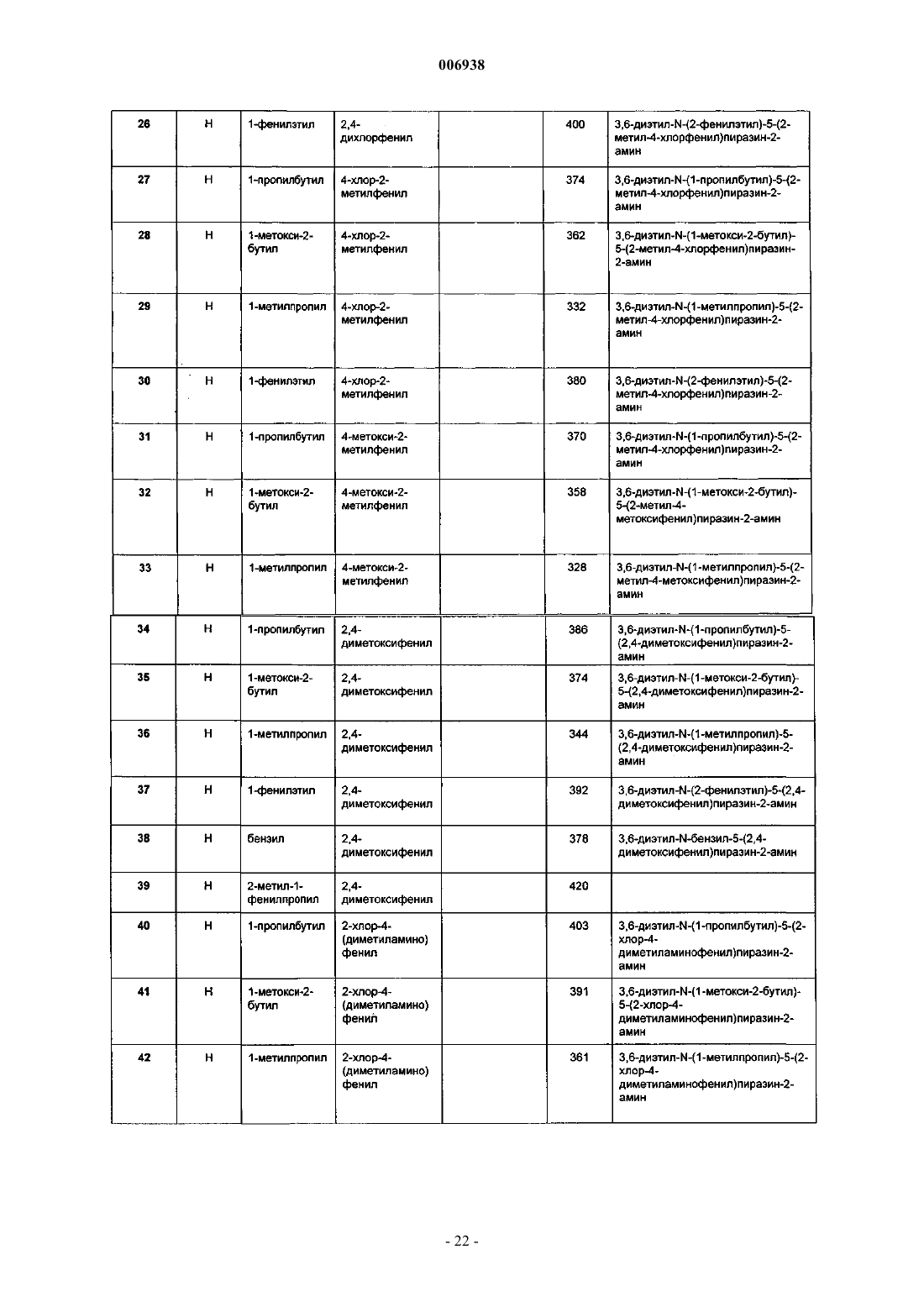
9. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-этилпропил)-5-(2-метил-4-хлорфенил)пиразин-2-амин.
10. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-этилпропил)-5-(2-метил-4-фторфенил) пиразин-2-амин.
11. Соединение по п.1, имеющее название 3,6-диэтил-N,N-(2-метоксиэтил)-5-(2,4-дихлорфенил)пиразин-2-амин.
12. Соединение по п.1, имеющее название 3,6-диэтил-N-пропил-N-(циклопропилметил)-5-(2,4-дихлорфенил)пиразин-2-амин.
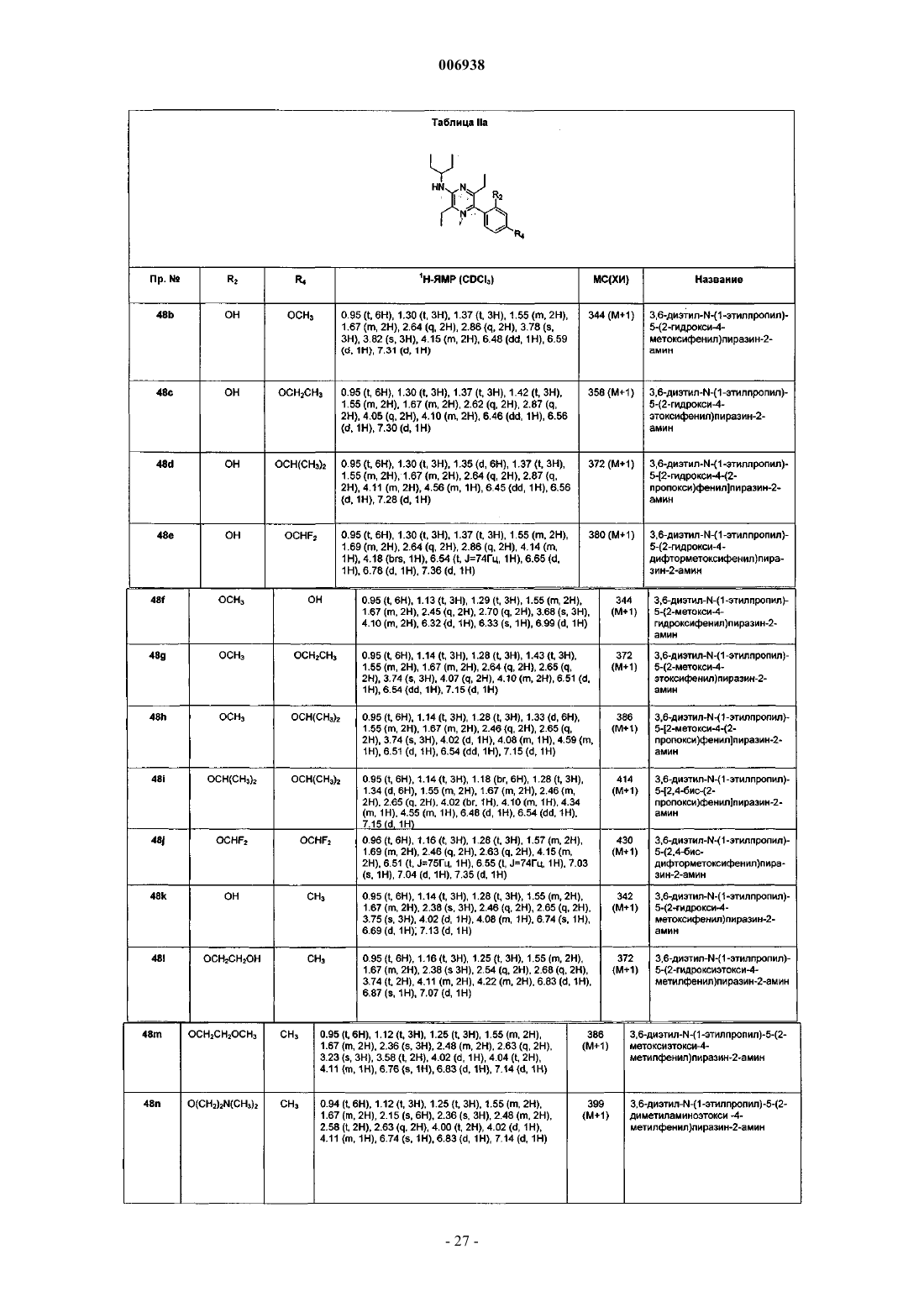
13. Соединение по п.1, имеющее название 3,6-диэтил-2-(1-этилпропокси)-5-(2-метокси-4,6-диметилфенил)пиразин.
14. Соединение по п.1, имеющее название 3,6-диметил-2-(1-этилпропокси)-5-(2,4-дихлорфенил)пиразин.
15. Соединение по п.1, имеющее название 3,6-диэтил-2-(1-этилпропокси)-5-(2-гидрокси-4,6-диметилфенил)пиразин.
16. Соединение по п.1, имеющее название 3,6-диэтил-2-(1-этилпропокси)-5-(2,4-дихлорфенил)пиразин.
17. Соединение по п.1, имеющее название 3,6-диметил-N-(1-метокси-2-бутил)-5-(2,4-диметоксифенил)пиразин-2-амин.
18. Соединение по п.1, имеющее название 2-(2,4-дихлорфенил)-5-[2-(метоксиметил)пирролидин-1-ил]-3,6-диметилпиразин.
19. Соединение по п.1, имеющее название 2-(2,4-диметоксифенил)-5-[2-(метоксиметил)пирролидин-1-ил]-3,6-диметилпиразин.
20. Соединение по п.1, имеющее название 3,6-диметил-N-(1-этилпропил)-5-(2-метил-4-хлорфенил)пиразин-2-амин.
21. Соединение по п.1, имеющее название 3,6-диметил-N-(1-этилпропил)-5-(2-трифторметил-4-диметиламинофенил)пиразин-2-амин.
22. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-этилпропил)-5-(2-трифторметокси-4-метоксифенил)пиразин-2-амин.
23. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-этилпропил)-5-(2-метокси-4-трифторметилфенил)пиразин-2-амин.
24. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-этилпропил)-5-(2-трифторметил-4-метоксифенил)пиразин-2-амин.
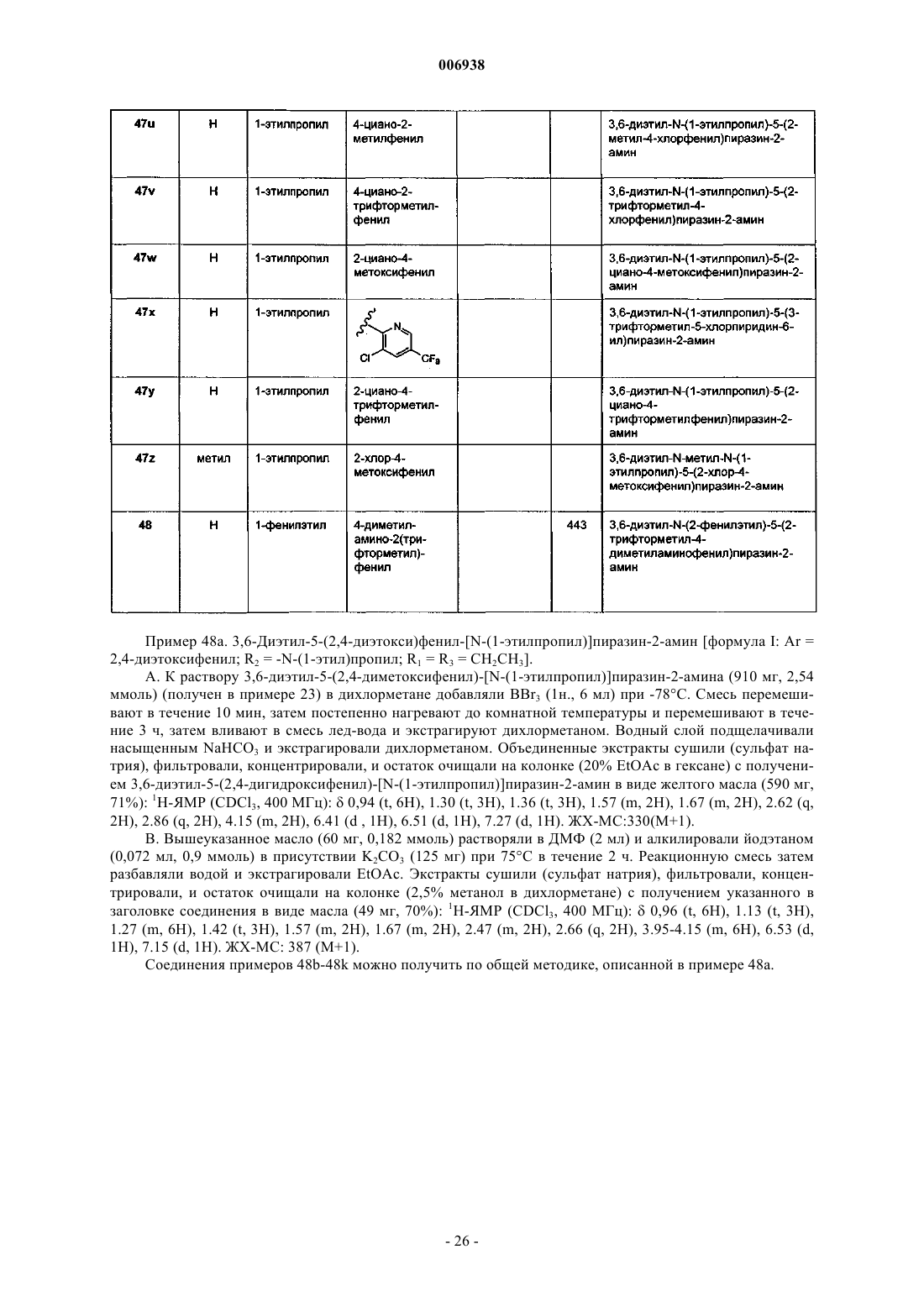
25. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-этилпропил)-5-(2-метокси-4-метилфенил)пиразин-2-амин.
26. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-метокси-2-бутил)-5-(2-хлор-4-диметиламинофенил)пиразин-2-амин.
27. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-метилпропил)-5-(2-хлор-4-диметиламинофенил)пиразин-2-амин.
28. Соединение по п.1, имеющее название 3,6-диэтил-N-(2-метилпропил)-5-(2-хлор-4-диметиламинофенил)пиразин-2-амин.
29. Соединение по п.1, имеющее название 3,6-диэтил-N-(2-фенилэтил)-5-(2-хлор-4-диметилфенил)пиразин-2-амин.
30. Соединение по п.1, имеющее название 3,6-диэтил-N-(1-пропилбутил)-5-(2-трифторметил-4-диметиламинофенил)пиразин-2-амин.
31. Соединение формулы
Формула А
где RX выбран из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, которые также могут быть замещены одним или двумя заместителем(ями), независимо выбранным(и) из гидрокси, -О(С1-4алкил), -NН(C1-4алкил), -N(С1-4алкил)(С1-4алкил) и фенила;
RY выбран из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, которые также могут быть замещены одним или двумя заместителем(ями), независимо выбранным(и) из гидрокси, -О(C1-4алкил), -NН(C1-4алкил), -N(C1-4алкил)(C1-4алкил) и фенила;
R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси;
Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, или
Аr выбран из группы, состоящей из нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RC;
RC, в каждом случае независимо, выбран из группы, состоящей из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6алкила, С2-6алкенила, С2-4алкинила, С3-7циклоалкила, (С3-7циклоалкил)С1-4алкила, -O(C1-4алкил), -NН(С1-4алкил) и -N(C1-4алкил)(С1-4алкил).
32. Соединение по п.31, где Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC; и R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси.
33. Соединение по п.31, где
R1 и R3 независимо выбраны из галогена, C1-4алкила, -О(С1-4алкил), трифторметила и трифторметокси; и
Аr представляет собой фенил, который моно-, ди- или тризамещен одним или более заместителем(ями), независимо выбранным(и) из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и С1-6алкила, C1-4алкокси, C1-4алкокси(C1-4алкокси), моно- или ди(C1-4)амино(С1-4алкокси) и моно- или ди(С1-4алкил)амино.
34. Соединение по п.31, где
RX представляет собой водород;
RY выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода;
R1 и R3 независимо выбраны из галогена, С1-4алкила и -O(C1-4алкил); и
Аr представляет собой фенил, который моно-, ди- или тризамещен заместителем(ями), независимо выбранным(и) из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и С1-6алкила, C1-4алкокси, C1-4алкокси(C1-4алкокси), моно- или ди(С1-4)амино(С1-4алкокси) и моно- или ди(С1-4алкил)амино.
35. Соединение по п.31, где
RX представляет собой водород;
RY выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода;
R1 и R3 независимо выбраны из галогена, C1-4алкила и -О(С1-4алкил) и трифторметокси; и
Аr представляет собой фенильную группу формулы

где L обозначает связь с пиразиновым кольцом в формуле А;
и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(ми) из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6алкила, C1-4алкокси, С1-4 алкокси(С1-4алкокси), моно- или ди(С1-4)амино(С1-4алкокси) и моно- или ди(С1-4алкил)амино.
36. Соединение по п.31, где
RХ представляет собой водород;
Ry выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода;
R1 и R3 независимо выбраны из галогена, C1-4алкила и -O(C1-4алкил); и
Аr представляет собой фенильную группу формулы
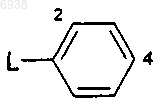
где L обозначает связь с пиразиновым кольцом в формуле А;
и эта фенильная группа замещена по положениям 2 и 4 заместителями, независимо выбранными из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и С1-6алкила, C1-4 алкокси, C1-4алкоксиС1-4алкокси), моно- или ди(C1-4)амино(С1-4алкокси) и моно- или ди(C1-4алкил)амино.
37. Соединение по п.31 формулы
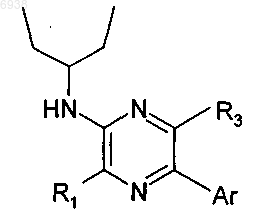
где R1 и R3, в каждом случае независимо, выбраны из галогена, С1-4алкила и -О(C1-4алкил); и
Аr представляет собой фенильную группу формулы

где L обозначает связь с пиразиновым кольцом в формуле А;
и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(ми) из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6алкила, С1-4алкокси, С1-4алкокси(С1-4алкокси), моно- или ди(C1-4)амино(С1-4 алкокси) и моно- или ди(С1-4алкил)амино.
38. Соединение по п.31 формулы
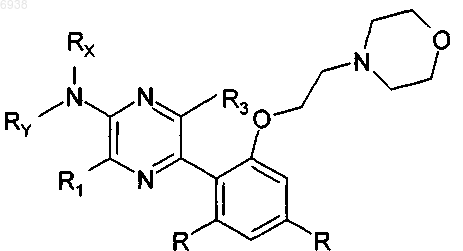
где R, в каждом случае независимо, выбран из группы, состоящей из водорода, трифторметила, трифторметокси, C1-6алкила, C1-4алкокси и моно- или ди(C1-4алкил)амино; и
R1 и R3 независимо выбраны из галогена, C1-4алкила и -О(С1-4алкил).
39. Соединение по п.31, где
Аr представляет собой фенил, который моно-, ди- или тризамещен заместителем RC; и
RX и RY, которые могут быть одинаковыми или разными, в каждом случае независимо, выбраны из группы, состоящей из прямых, разветвленных и циклических алкильных групп, имеющих от 1 до 8 атомов углерода; и
R1 и R3 независимо выбраны из группы, состоящей из метила, этила и метокси.
40. Соединение формулы
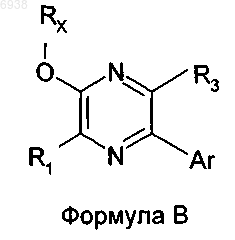
где RX выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп, в том числе (циклоалкил)алкильных групп, имеющих от 1 до 8 атомов углерода, каждая из которых также может быть замещена одним или двумя заместителем(ями), независимо выбранным(и) из
a) гидрокси, -О(С1-4алкил), -NН(C1-4алкил), -N(C1-4алкил)(C1-4алкил), и
b) 3-7-членных карбоциклических групп, которые являются насыщенными, ненасыщенными или ароматическими, которые могут быть замещены одним или двумя заместителем(ями), выбранным(и) из галогена, гидрокси, амино, С1-4алкила, -O(C1-4алкил), -NН(C1-4алкил) и -N(C1-4алкил)(С1-4алкил), и где указанные 3-7-членные гетероциклические группы содержат один или два гетероатом(а), выбранный(ые) из N, О и S, причем точкой присоединения является либо атом углерода, либо атом азота;
R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси;
Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, или
Аr выбран из группы, состоящей шч нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RC;
RC в каждом случае независимо выбран из группы, состоящей из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и С1-6aлкила, С2-6алкенила, С2-4алкинила, С3-7циклоалкила, (С3-7циклоалкил)C1-4алкила, -O(С1-4алкил), -NН(C1-4алкил) и -N(С1-4алкил)(С1-4алкил).
41. Соединение по п.40, где RX выбран из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода.
42. Соединение по п.41, где
Аr представляет собой фенильную группу формулы
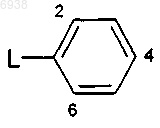
где L обозначает связь с пиразиновым кольцом в формуле В; и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(и) из галогена, циано, трифторметила, трифторметокси, гидрокси и С1-6алкила, C1-4алкокси и моно- или ди(С1-4алкил) амино.
43. Соединение по п.41, где
Аr представляет собой фенильную группу формулы

где L обозначает связь с пиразиновым кольцом в формуле В; и эта фенильная группа замещена по положениям 2 и 4 заместителями, независимо выбранными из галогена, циано, трифторметила, трифторметокси, С1-6алкила, С1-4алкокси.
44. Соединение по п.40 формулы
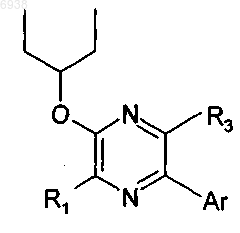
где R1 и R3 независимо выбраны из C1-4алкила и -O(C1-4алкил); и Аr представляет собой фенильную группу формулы
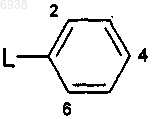
где L обозначает связь с пиразиновым кольцом в формуле В; и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(ми) из галогена, трифторметила, трифторметокси, гидрокси, С1-6алкила, С1-4алкокси и моно- или ди(С1-4алкил)амино.
45. Соединение по п.40, где R1 и R3 независимо выбраны из группы, состоящей из метила, этила и метокси.
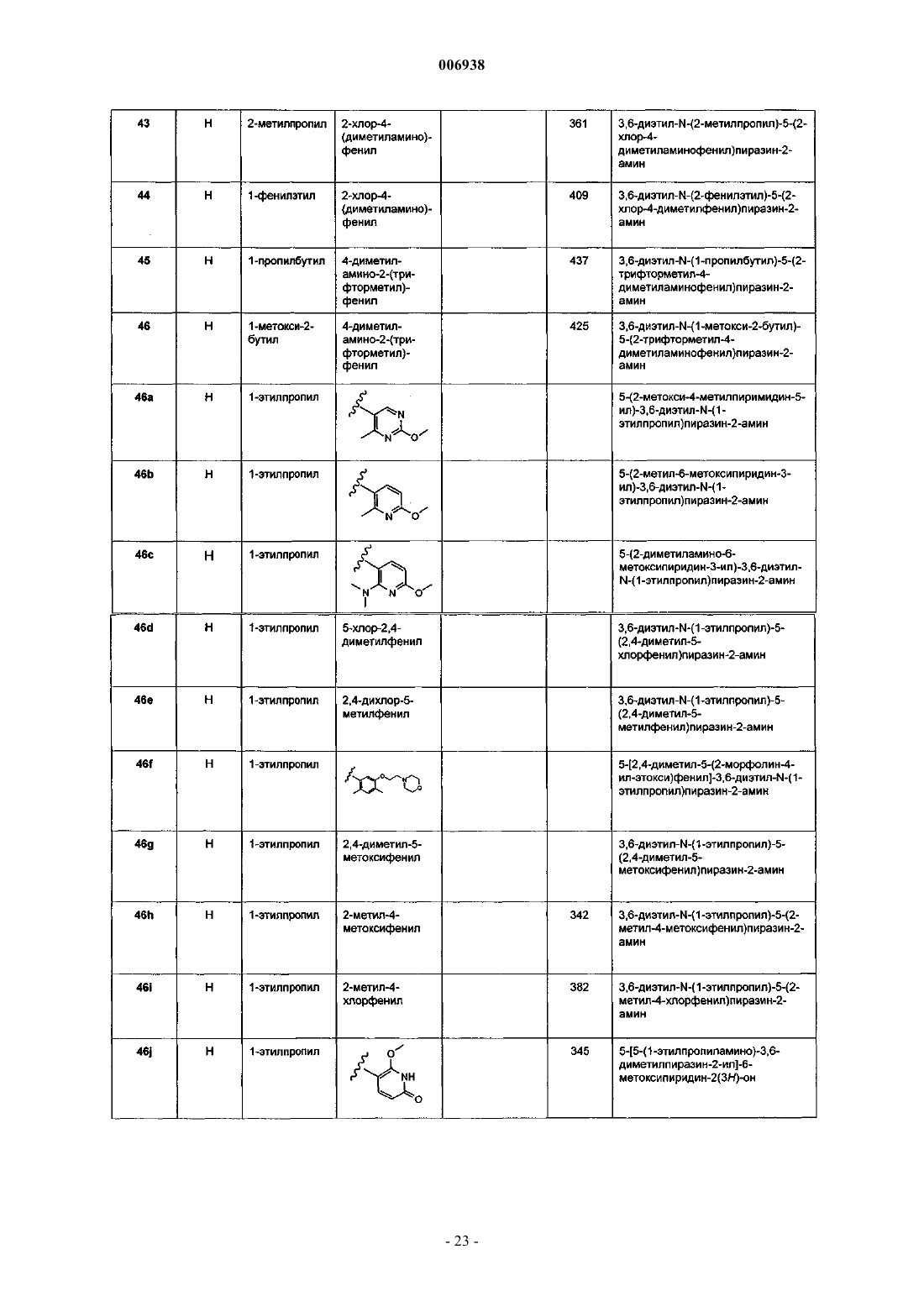
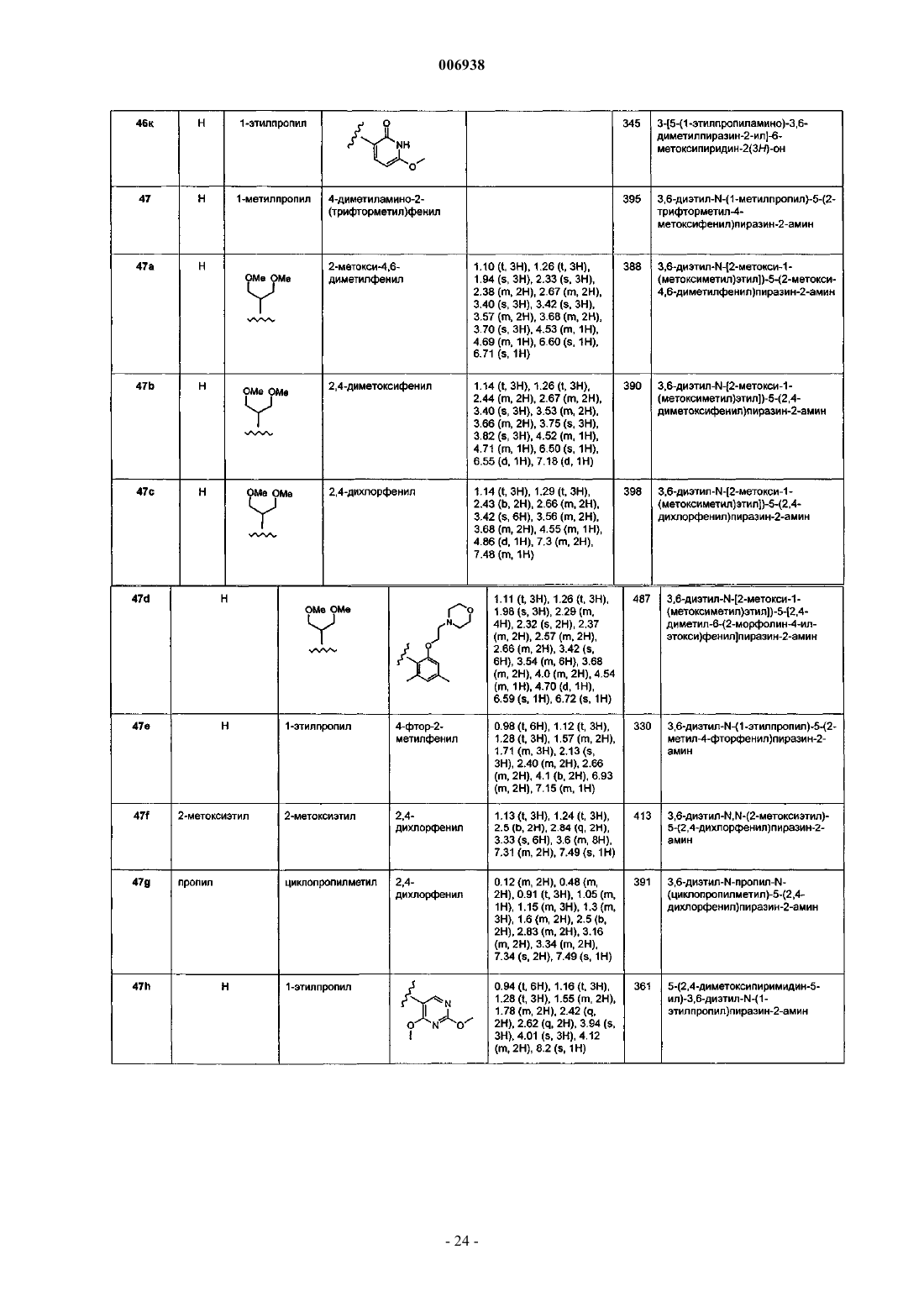
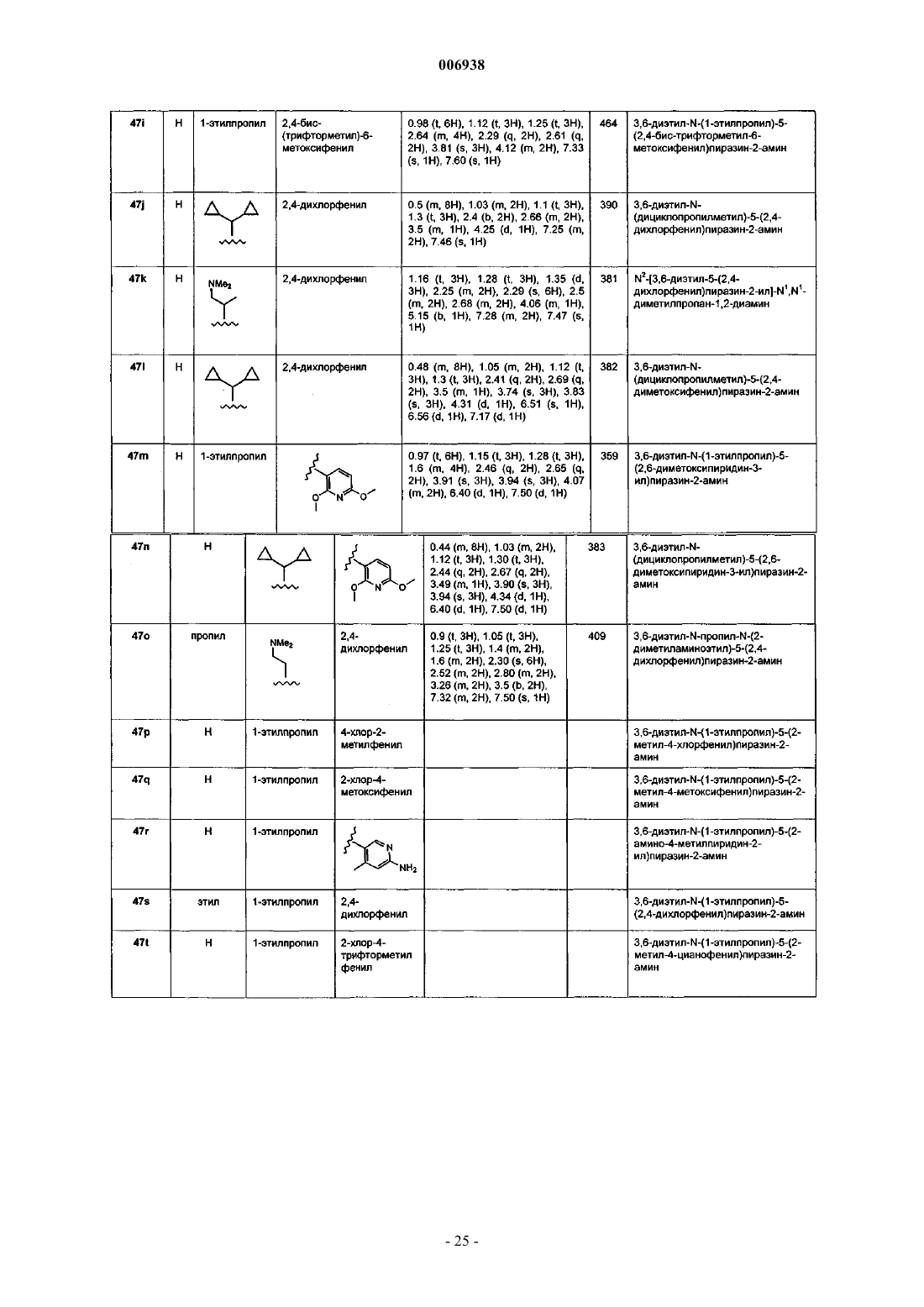
46. Соединение, имеющее название 2-(2-метокси-5-трифторметоксифенил)-3-этил-6-метиламино-5-(1-этилпропокси)пиразин.
47. Способ ингибирования связывания CRF с CRF1-рецептором, при котором осуществляют контактирование раствора, содержащего CRF и соединение по п.1, с клеточным рецептором, при этом соединение присутствует в растворе в концентрации, достаточной для ингибирования связывания CRF с клетками IMR32 in vitro.
48. Способ изменения сигнал-трансдуцирующей активности CRF1-рецептора, при котором осуществляют контактирование клетки, экспрессирующей этот рецептор, с соединением по п.1.
49. Способ модулирования функции рецептора, сопряженного с G-белком, при котором клетки, экспрессирующие рецептор, сопряженный с G-белком, подвергают воздействию эффективного количества соединения по п.1.
50. Способ по п.49, где рецептор, сопряженный с G-белком, представляет собой CRF1-рецептор.
51. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение по п.1.
52. Способ модуляции функции CRF-рецептора, при котором пациенту, нуждающемуся в такой модуляции, вводят эффективное количество соединения по п.1.
53. Способ лечения расстройства или заболевания ЦНС, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения по п.1.
54. Способ по п.53, при котором для лечения расстройства или заболевания ЦНС пациенту, нуждающемуся в таком лечении, вводят от 0,1 до 140 мг на кг массы тела в сутки соединения по п.1.
55. Способ по п.53, где расстройство или заболевание ЦНС представляет собой тревожное расстройство, расстройство, связанное со стрессом, или расстройство приема пищи.
56. Способ по п.53, где расстройство или заболевание ЦНС представляет собой депрессию или биполярное расстройство.
57. Способ по п.53, где расстройство или заболевание ЦНС представляет собой нервную анорексию, нервную булимию или ожирение.
58. Способ по п.53, где пациентом является человек.
59. Способ локализации CRF-рецепторов в образцах срезов ткани, при котором
осуществляют контактирование детектируемого меченого соединения по п.1 с образцом ткани в условиях, которые дают возможность этому соединению связываться с CRF-рецепторами внутри этого образца ткани;
промывание этого образца ткани для удаления несвязанного соединения; и
детектирование оставшегося связанного соединения.
60. Упакованная фармацевтическая композиция, содержащая фармацевтическую композицию по п.51, в контейнере и инструкции для применения композиции для лечения пациента, страдающего тревожным расстройством, расстройством, связанным со стрессом, или расстройством приема пищи.
Текст
006938 Эта заявка имеет приоритет согласно предварительной заявке США серийный номер 60/182934, поданной 16 февраля 2000 г., и предварительной заявке США серийный номер 60/206455, поданной 22 мая 2000 г., содержание которых включено в данное описание изобретения посредством ссылки. Область изобретения Настоящее изобретение относится к новым арилпиразиновым соединениям, которые обладают фармакологическими свойствами, полезными в том, что они связываются с клеточными рецепторами, в том числе CRF-рецепторами. Некоторые из этих соединений могут связываться с такими рецепторами и модулировать их активность. Важно то, что соединения по изобретению включают соединения, которые связываются с высокой селективностью и/или высоким сродством с CRF1-рецепторами (рецепторы к кортикотропин-рилизинг-фактору типа 1). Данное изобретение также относится к фармацевтическим композициям, содержащим такие соединения, и к применению таких соединений в качестве фармацевтических агентов, например, в лечении психиатрических расстройств и неврологических заболеваний,включая большую депрессию, тревожные расстройства, посттравматическое стрессовое расстройство,супрануклеарный паралич и расстройства приема пищи, а также в лечении иммунологических, сердечнососудистых или сердечных заболеваний и гиперчувствительности толстой кишки, связанной с психопатологическим расстройством и стрессом. Дополнительно, данное изобретение относится к применению таких соединений в качестве зондов для локализации клеточных рецепторов в срезах ткани. Предшествующий уровень техники Кортикотропин-рилизинг-фактор (CRF) - пептид, состоящий из 41 аминокислоты, - является первичным физиологическим регулятором секреции пептида, производного от проопиомеланокортина(РОМС), из передней доли гипофиза. Кроме эндокринной роли в гипофизе, иммуногистохимическая локализация CRF продемонстрировала, что этот гормон имеет широкое экстрагипоталамическое распределение в центральной нервной системе и продуцирует широкий спектр автономных, электрофизиологических и поведенческих эффектов, согласующихся с нейромедиаторной или нейромодуляторной ролью в мозгу. Доказательство значительной роли в интеграции ответа иммунной системы на физиологические,психологические и иммунологические стрессоры также имеется. Клинические данные доказывают, что CRF участвует в психиатрических расстройствах и неврологических заболеваниях, включая депрессию, тревожные расстройства и расстройства приема пищи. РольCRF была постулирована также в этиологии и патофизиологии болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, прогрессирующего супрануклеарного паралича и бокового амиотрофического склероза, так как они относятся к дисфункции нейронов CRF в центральной нервной системе. При аффективном расстройстве или большой депрессии концентрация CRF в спинномозговой жидкости (CSF) значительно возрастает у индивидуумов, не принимающих лекарственных средств. К тому же плотность CRF-рецепторов значительно снижена в лобной коре жертв суицида, что согласуется с гиперсекрецией CRF. Кроме того, имеется притупленный адренокортикотропный (АСТН) ответ на CRF(введенный внутривенно), наблюдаемый у пациентов с депрессией. Предклинические исследования на крысах и приматах - не людях дают дополнительное подтверждение гипотезы, согласно которой гиперсекреция CRF может быть вовлечена в симптомы, наблюдаемые при депрессии у человека. Имеется также предварительное доказательство того, что трициклические антидепрессанты могут изменять уровеньCRF и таким образом модулировать количество CRF-рецепторов в мозге.CRF также вовлечен в этиологию тревожных расстройств. CRF продуцирует анксиогенные эффекты у животных и взаимодействует с бензодиазепиновыми/небензодиазепиновыми анксиолитиками, и это было продемонстрировано на целом ряде поведенческих моделей тревоги. Предварительные исследования с использованием предполагаемого антагониста CRF-рецепторов - спирального овечьего CRF (9-41)- в различных поведенческих парадигмах демонстрируют, что антагонист продуцирует "подобные анксиолитическим" эффекты, которые качественно сходны с эффектами бензодиазепинов. Все нейрохимические, эндокринные исследования и исследования связывания рецепторов продемонстрировали взаимодействие CRF с бензодиазепиновыми анксиолитиками, что дает дополнительные доказательства того,что CRF вовлечен в эти расстройства. Хлордиазепоксид ослабляет "анксиогенные" эффекты CRF и в конфликтном анализе, и в анализе на акустический испуг на крысах. Антагонист бензодиазепиновых рецепторов Ro 15-1788, который сам по себе не имел поведенческой активности в конфликтном анализе,реверсировал эффекты CRF дозозависимым образом, а бензодиазепиновый обратный агонист FG 7142 усиливал действие CRF.CRF также вовлечен в патогенез ряда иммунологических, сердечно-сосудистых или сердечных заболеваний, таких как гипертензия, тахикардия и застойная сердечная недостаточность, удар и остеопороз, а также вовлечен в преждевременные роды, психосоциальную карликовость, вызванную стрессом лихорадку, язву, диарею, послеоперационный илеус и гиперчувствительность толстой кишки, связанную с психопатологическим расстройством и стрессом. Механизмы и сайты действия, через которые традиционные анксиолитики и антидепрессанты продуцируют свои терапевтические эффекты, полностью объяснены. Однако была выдвинута гипотеза, согласно которой они вовлечены в подавление гиперсекреции CRF, которая наблюдается при этих заболеваниях. Особый интерес представляет тот факт, что предварительные исследования по проверке эффек-1 006938 тов пептидного антагониста CRF-рецепторов (а-спиральный CRF9.41) в различных поведенческих парадигмах продемонстрировали, что антагонист CRF продуцирует "подобные анксиолитическим" эффекты,которые качественно схожи с эффектами бензодиазепинов. Некоторые имеющие малые молекулы соединения, предназначенные для лечения связанных с CRF расстройств, описаны в литературе (смотри обзор J. McCarthy et al. Curr. Pharm. Des. 5:289 (1999. Однако ни одно из этих соединений не имеет арилпиразиновую структуру. В WO 98/38174, Сох et al, раскрыты некоторые производные арилпиразина для применения в качестве блокаторов натриевых каналов в лечении расстройств центральной нервной системы. Согласно заявки Сох эти арилпиразиновые соединения замещены двумя амино- или амидогруппами. Сущность изобретения Теперь авторами открыты новые арилпиразиновые соединения, в том числе арилпиразины, которые могут связываться с высоким сродством и высокой селективностью с CRF1-рецепторами, в том числеCRF1-рецепторами человека. Поэтому данное изобретение включает в себя способы лечения расстройств и заболеваний, связанных с CRF1-рецепторами, включая расстройства и заболевания ЦНС, в частности аффективные расстройства и заболевания, и острые и хронические неврологические расстройства и заболевания. Арилпиразиновые соединения по изобретению предпочтительно замещены по положению 2 кольца карбоциклической арильной группой, такой как фенил, нафтил и тому подобное, или гетероароматической группой, в частности гетероароматической группой, содержащей в кольце азот, такой как пиридил,пиримидинил и тому подобное. Арилпиразиновые соединения по изобретению предпочтительно замещены также по положению 5 кольца (пара-положение относительно арильного заместителя) заместителем, не являющимся водородом, в частности неароматической группой, такой как алкил, алкенил, алкинил, гетероалкил и тому подобное, предпочтительно аминоалкил и алкокси. Предпочтительно, арилпиразиновые соединения по изобретению не замещены по положению 3 кольца (то есть в положении 3 находится водород) или замещены группой, отличной от амино (-NH2) или алкиламидо (-NНС(=О)алкил, в частности -NНС(=О)C1-4 алкил или -NНС(=О)С 3-7 циклоалкил), и/или по положению 5 кольца замещены группой, отличной от водорода, алкила, аминоалкила или радикала азотсодержащего гетероциклического соединения. В одном аспекте настоящего изобретения предложены арилпиразиновые соединения формулы или их фармацевтически приемлемые соли,где R1 выбран из Н, C1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, галогена, C1-4 галогеноалкила, трифторметила, трифторметокси, -NH(C1-4 алкил), -N(C1-4 алкил)(C1-4 алкил) и -О(C1-4 алкил);R4 отсутствует или представляет собой атом кислорода; Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, или Аr выбран из группы, состоящей из нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RC; при условии, что если Аr представляет собой замещенный галогеном фенил, нафтил или замещенный галогеном нафтил, то соединения, где R3 представляет собой водород, исключаются;RA и RB, которые могут быть одинаковыми или разными, в каждом случае независимо выбраны из группы, состоящей из водорода и прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, каждый из которых также может быть замещен одним или двумя заместителем(ями), выбранным(и) из гидрокси, галогена, -О(С 1-4 алкил), -NН(С 1-4 алкил), -N(C1-4 алкил)(C1-4 алкил) иRC в каждом случае независимо выбран из группы, состоящей из галогена, циано, галогеноалкила,трифторметила, трифторметокси, гидрокси, амино и C1-6 алкила, С 2-6 алкенила, C1-4 алкинила, С 3-7 циклоалкила, (С 3-7 циклоалкил)C1-4 алкила, -О(С 1-4 алкил), замещенного заместителем RD в количестве от 0 до 2,-NН(C1-4 алкил) и -N(С 1-4 алкил)(С 1-4 алкил);RD в каждом случае независимо выбран из группы, состоящей из галогена, гидрокси, С 1-4 алкила,-О(С 1-4 алкил), -NН(C1-4 алкил), -N(С 1-4 алкил)(С 1-4 алкил), морфолино, пирролидино, пиперидино, тиоморфолино, пиперазино, 4-гидроксипиперидино, трифторметила и трифторметокси;X в каждом случае независимо выбран из группы, состоящей из -СН 2-, -CHRB-, -О-, -S-, -NH-,-NRB-; иY и Z в каждом случае независимо выбраны из группы, состоящей из 3-7-членных карбоциклических и гетероциклических групп, которые являются насыщенными, ненасыщенными или ароматическими, которые могут быть замещены одним или двумя заместителями, выбранными из галогена, оксо, гидрокси, C1-4 алкила, -O(C1-4 алкил), -NН(С 1-4 алкил) и -N(C1-4 алкил)(C1-4 алкил), и указанные 3-7-членные гетероциклические группы содержат один или два гетероатом(а), выбранный(ые) из N, О и S, причем точкой присоединения является либо атом углерода, либо атом азота; иn в каждом случае независимо выбран из 0, 1 и 2. Предпочтительными соединениями формулы являются соединения, где Аr выбран из группы, состоящей из пиридила, пиридонила или пиримидинила,каждый из которых незамещен или моно-, ди- или тризамещен заместителем RC. Предпочтительными соединениями формулы также являются соединения, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC. Предпочтительными соединениями формулы являются соединения, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, и R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила,этила, этокси и метокси. Более предпочтительными соединениями формулы являются соединения, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, и RA и RB, которые могут быть одинаковыми или разными, независимо представляют собой прямые, разветвленные или циклические алкильные группы, имеющие от 1 до 8 атомов углерода. Еще более предпочтительными соединениями формулы являются соединения, где R4 отсутствует, и Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, и RA и RB, которые могут быть одинаковыми или разными, в каждом случае независимо выбраны из группы, состоящей из прямых, разветвленных и циклических алкильных групп, имеющих от 1 до 8 атомов углерода и R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена,метила, этила и метокси. Особенно предпочтительными соединениями формулы являются соединения общей формулы где RX представляет собой С 1-8 алкил, a RY представляет собой водород или C1-8 алкил; или NRXRY представляет собой где z равно 0 или 1. Также особенно предпочтительными соединениями формулы где А представляет собой NRA или О. Наиболее предпочтительными соединениями общей формулы являются соединения, имеющие следующие названия: 3,6-диэтил-N-(1-этилпропил)-5-(2-метил-4-хлорфенил)пиразин-2-амин,3,6-диэтил-N-(1-этилпропил)-5-(2-метил-4-фторфенил)пиразин-2-амин,3,6-диэтил-N,N-(2-метоксиэтил)-5-(2,4-дихлорфенил)пиразин-2-амин,3,6-диэтил-N-пропил-N-(циклопропилметил)-5-(2,4-дихлорфенил)пиразин-2-амин,3,6-диэтил-2-(1-этилпропокси)-5-(2-метокси-4,6-диметилфенил)пиразин,3,6-диметил-2-(1-этилпропокси)-5-(2,4-дихлорфенил)пиразин,3,6-диэтил-2-(1-этилпропокси)-5-(2-гидрокси-4,6-диметилфенил)пиразин,3,6-диэтил-2-(1-этилпропокси)-5-(2,4-дихлорфенил)пиразин,3,6-диметил-N-(1-метокси-2-бутил)-5-(2,4-диметоксифенил)пиразин-2-амин,2-(2,4-дихлорфенил)-5-[2-(метоксиметил)пирролидин-1-ил]-3,6-диметилпиразин,2-(2,4-диметоксифенил)-5-[2-(метоксиметил)пирролидин-1-ил]-3,6-диметилпиразин,3,6-диметил-N-(1-этилпропил)-5-(2-метил-4-хлорфенил)пиразин-2-амин,3,6-диметил-N-(1-этилпропил)-5-(2-трифторметил-4-диметиламинофенил)пиразин-2-амин,3,6-диэтил-N-(1-этилпропил)-5-(2-трифторметокси-4-метоксифенил)пиразин-2-амин,3,6-диэтил-N-(1-этилпропил)-5-(2-метокси-4-трифторметилфенил)пиразин-2-амин,3,6-диэтил-N-(1-этилпропил)-5-(2-трифторметил-4-метоксифенил)пиразин-2-амин,3,6-диэтил-N-(1-этилпропил)-5-(2-метокси-4-метилфенил)пиразин-2-амин,3,6-диэтил-N-(1-метокси-2-бутил)-5-(2-хлор-4-диметиламинофенил)пиразин-2-амин,3,6-диэтил-N-(1-метилпропил)-5-(2-хлор-4-диметиламинофенил)пиразин-2-амин,3,6-диэтил-N-(2-метилпропил)-5-(2-хлор-4-диметиламинофенил)пиразин-2-амин,3,6-диэтил-N-(2-фенилэтил)-5-(2-хлор-4-диметилфенил)пиразин-2-амин,3,6-диэтил-N-(1-пропилбутил)-5-(2-трифторметил-4-диметиламинофенил)пиразин-2-амин. Согласно изобретению предложены также арилпиразиновые соединения формулы Формула А где Rx выбран из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, которые также могут быть замещены одним или двумя заместителем(ями), независимо выбранным(и) из гидрокси, -О(C1-4 алкил), -NН(C1-4 алкил), -N(С 1-4 алкил)(С 1-4 алкил) и фенила;RY выбран из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, которые также могут быть замещены одним или двумя заместителем(ями), независимо выбранным(и) из гидрокси, -О(C1-4 алкил), -NН(С 1-4 алкил), -N(С 1-4 алкил)(С 1-4 алкил) и фенила;R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси; Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RС, или Аr выбран из группы, состоящей из нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RС;RС в каждом случае независимо выбран из группы, состоящей из галогена, циано, галогеноалкила,трифторметила, трифторметокси, гидрокси, амино и C1-6 алкила, С 2-6 алкенила, С 2-4 алкинила, С 3-7 циклоалкила, (С 3-7 циклоалкил)С 1-4 алкила, -O(C1-4 алкил), -NH(C1-4 алкил) и -N(C1-4 алкил)(C-4 алкил). Предпочтительными соединениями формулы А являются соединения, где Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RС; и R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси. Более предпочтительными соединениями формулы А являются соединения, гдеR1 и R3 независимо выбраны из галогена, C1-4 алкила, -О(C1-4 алкил), трифторметила и трифторметокси; и Аr представляет собой фенил, который моно-, ди- или тризамещен одним или более заместителем(ями), независимо выбранным(и) из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6 алкила, C1-4 алкокси, C1-4 алкокси(C1-4 алкокси), моно- или ди(С 1-4)амино(С 1-4 алкокси) и моно- или ди(С 1-4 алкил)амино. Предпочтительными соединениями формулы А также являются соединения, гдеRY выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп,имеющих от 1 до 8 атомов углерода;R1 и R3 независимо выбраны из галогена, C1-4 алкила и -O(C1-4 алкил); и Аr представляет собой фенил, который моно-, ди- или тризамещен заместителем(ями), независимо выбранным(и) из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино иC1-6 алкила, C1-4 алкокси, C1-4 алкокси(C1-4 алкокси), моно- или ди(C1-4)амино(С 1-4 алкокси) и моно- или ди(С 1-4 алкил)амино. Более предпочтительными соединениями формулы А являются соединения, гдеRY выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп,имеющих от 1 до 8 атомов углерода;R1 и R3 независимо выбраны из галогена, С 1-4 алкила и -О(С 1-4 алкил) и трифторметокси; и Аr представляет собой фенильную группу формулы где L обозначает связь с пиразиновым кольцом в формуле А; и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(ми) из галогена,циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6 алкила, С 1-4 алкокси, C1-4 алкокси(C1-4 алкокси), моно- или ди(C1-4)амино(С 1-4 алкокси) и моно- или ди(С 1-4 алкил)амино. Предпочтительными соединениями формулы А также являются соединения, гдеRY выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп,имеющих от 1 до 8 атомов углерода;R1 и R3 независимо выбраны из галогена, C1-4 алкила и -О(C1-4 алкил); и Аr представляет собой фенильную группу формулы где L обозначает связь с пиразиновым кольцом в формуле А; и эта фенильная группа замещена по положениям 2 и 4 заместителями, независимо выбранными из галогена, циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и С 1-6 алкила, C1-4 алкокси, C1-4 алкокси(С 1-4 алкокси), моноили ди(С 1-4)амино(С 1-4 алкокси) и моно- или ди(С 1-4 алкил)амино. Особенно предпочтительными соединениями формулы А являются соединения формулы где R1 и R3 в каждом случае независимо выбраны из галогена, C1-4 алкила и -О(C1-4 алкил); и Аr представляет собой фенильную группу формулы где L обозначает связь с пиразиновым кольцом в формуле А; и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(ми) из галогена,циано, галогеноалкила, трифторметила, трифторметокси, гидрокси, амино и C1-6 алкила, C1-4 алкокси, С 1-4 алкокси(C1-4 алкокси), моно- или ди(C1-4)амино(С 1-4 алкокси) и моно- или ди(С 1-4 алкил)амино. Также особенно предпочтительными соединениями формулы А являются соединения формулы где R в каждом случае независимо выбран из группы, состоящей из водорода, трифторметила,трифторметокси, С 1-6 алкила, C1-4 алкокси и моно-или ди(C1-4 алкил)амино; иR1 и R3 независимо выбраны из галогена, C1-4 алкила и -О(С 1-4 алкил). Предпочтительными также являются соединения формулы А, где Аr представляет собой фенил, который моно-, ди- или тризамещен заместителем RC; иRX и RY, которые могут быть одинаковыми или разными, в каждом случае независимо выбраны из группы, состоящей из прямых, разветвленных и циклических алкильных групп, имеющих от 1 до 8 атомов углерода; иR1 и R3 независимо выбраны из группы, состоящей из метила, этила и метокси. Согласно изобретению предложены также арипиразиновые соединения формулы Формула В где Rx выбран из группы, состоящей из прямых, разветвленных или циклических алкильных групп,в том числе (циклоалкил)алкильных групп, имеющих от 1 до 8 атомов углерода, каждая из которых также может быть замещена одним или двумя заместителем(ями), независимо выбранным(и) изb) 3-7-членных карбоциклических групп, которые являются насыщенными, ненасыщенными или ароматическими, которые могут быть замещены одним или двумя заместителем(ями), выбранным(и) из галогена, гидрокси, амино, С 1-4 алкила, -О(С 1-4 алкил), -NН(С 1-4 алкил) и -N(C1-4 алкил)(С 1-4 алкил), и где указанные 3-7-членные гетероциклические группы содержат один или два гетероатом(а), выбранный(ые) из N, О и S, причем точкой присоединения является либо атом углерода, либо атом азота;R1 и R3 независимо выбраны из группы, состоящей из водорода, галогена, метила, этила, этокси и метокси;-6 006938 Аr представляет собой фенил, моно-, ди- или тризамещенный заместителем RC, или Аr выбран из группы, состоящей из нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RC;RC в каждом случае независимо выбран из группы, состоящей из галогена, циано, галогеноалкила,трифторметила, трифторметокси, гидрокси, амино и C1-6 алкила, С 2-6 алкенила, С 2-4 алкинила, С 3-7 циклоалкила, (С 3-7 циклоалкил)С 1-4 алкила, -О(C1-4 алкил), -NН(C1-4 алкил) и -N(С 1-4 алкил)(С 1-4 алкил). Предпочтительными соединениями формулы В являются соединения, гдеRX выбран из прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода. Предпочтительными соединениями формулы В также являются соединения, где Аr представляет собой фенильную группу формулы где L обозначает связь с пиразиновым кольцом в формуле В; и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(и) из галогена,циано, трифторметила, трифторметокси, гидрокси и C1-6 алкила, C1-4 алкокси и моно- или ди(С 1-4 лкил) амино. Более предпочтительными соединениями формулы В являются соединения, где Аr представляет собой фенильную группу формулы где L обозначает связь с пиразиновым кольцом в формуле В; и эта фенильная группа замещена по положениям 2 и 4 заместителями, независимо выбранными из галогена, циано, трифторметила, трифторметокси, C1-6 алкила, C1-4 алкокси. Более конкретно, предпочтительными соединениями формулы В являются соединения формулы где R1 и R3 независимо выбраны из C1-4 алкила и -O(C1-4 алкил); и Аr представляет собой фенильную группу формулы где L обозначает связь с пиразиновым кольцом в формуле В; и эта фенильная группа замещена по одному, двум или трем положениям 2, 4 и 6 заместителем(ями), независимо выбранным(ми) из галогена, трифторметила, трифторметокси, гидрокси, C1-6 алкила, C1-4 алкокси и моно- или ди(C1-4 алкил)амино. Предпочтительными также являются соединения формулы В, где R1 и R3 независимо выбраны из группы, состоящей из метила, этила и метокси. Согласно изобретению предложено также арилпиразиновое соединение, имеющее название 2-(2 метокси-5-трифторметоксифенил)-3-этил-6-метиламино-5-(1-этилпропокси)пиразин. Структура этого соединения следующая: В указанных выше формулах предпочтительные группы Аr включают 2,4-дихлорфенил, 2,4 диметоксифенил, 4-метокси-2-метилфенил, 2,4,6-триметилфенил, 4-метокси-2,6-диметилфенил, 4-циано 2,6-диметилфенил, 2-метокси-4,6-диметилфенил, 2-метокси-4,6-бис(трифторметил)фенил, 2,6-дихлор-4-7 006938 метоксифенил, 2-(2-(1-морфолино)этокси)-4,6-диметилфенил, 2-(2-(4-гидрокси-1-пиперидино)этокси)4,6-диметилфенил, 2-метил-4-(диметиламино)-3-пиридил, 2-хлор-4-диметиламино-3-пиридил и 2 метокси-4,6-диметил-3-пиридил. В указанных выше формулах предпочтительные группы R1 включают метил, этил, хлоро, бромо,иодо, трифторметил, метокси и диметиламино. В указанных выше формулах предпочтительные группы R2 включают дипропиламино, бис(2 метоксиэтил)амино, 4-метил-1-пиперазино, 3-пентиламино, 4-гептиламино, 1,3-диметокси-2-пропиламино, 1-(диметиламино)-2-пентиламино, 1-(3-пиридил)-2-бутиламино, (2-метокси-5-пиридин)амино, 3 пентилокси, 4-гептилокси, 1-метокси-2-бутилокси и 1,3-диметокси-2-пропилокси. В указанных выше формулах предпочтительные группы R3 включают метил, этил, хлоро, трифторметил, метокси, (1-морфолино)метил, 2-(1-пирролидино)этил и (2-метокси)этокси. Предпочтительные арилпиразины по изобретению проявляют хорошую активность в стандартныхin vitro анализах на связывание CRF-рецепторов. Этот анализ приведен в нижеследующем примере 96. Особенно предпочтительные арилпиразины по изобретению в таком стандартном in vitro анализе на связывание CRF-рецепторов имеют IС 50 примерно 1,5 микромоль или менее, еще более предпочтительноIC50 примерно 100 наномоль или менее, или еще более предпочтительно IC50 примерно 10 наномоль или менее, или даже 1 наномоль или менее в таком определенном стандартном in vitro анализе на связываниеCRF-рецепторов. Предпочтительные арилпиразины по изобретению не проявляют активность в стандартном in vitro анализе на функционирование Na каналов. Этот анализ приведен в нижеследующем примере 99. Особенно предпочтительные арилпиразины по изобретению не показывают какую-либо статистически значимую активность в стандартном in vitro анализе на функционирование Na каналов при уровне достоверности р 0,05. Согласно изобретению предложен способ ингибирования связывания CRF с CRF1-рецептором, при котором осуществляют контактирование раствора, содержащего CRF и соединение по изобретению, с клеточным рецептором, при этом соединение присутствует в растворе в концентрации, достаточной для ингибирования связывания CRF с клетками IMR32 in vitro. Согласно изобретению предложен также способ изменения сигнал-трансдуцирующей активностиCRF1-рецептора, при котором осуществляют контактирование клетки, экспрессирующей этот рецептор,с соединением по изобретению. Данное изобретение также включает в себя способы лечения пациентов, которые страдают или подвержены (то есть профилактическое лечение) определенным расстройствам или заболеваниям, эффективным количеством соединения по изобретению. Пациентом может быть человек или другое млекопитающее, например другие приматы. Лечение людей, домашних животных-компаньонов (любимцев) или скота, страдающих определенным заболеванием, эффективным количеством соединения по изобретению охвачено изобретением. Соединения по настоящему изобретению полезны для лечения расстройств ЦНС, в частности аффективных расстройств, тревожных расстройств, расстройств, связанных со стрессом, расстройств приема пищи и злоупотребления веществами. Аффективные расстройства включают все типы депрессии, биполярное расстройство, циклотимию и дистимию. Тревожные расстройства включают генерализованное тревожное расстройство, паническое расстройство, фобии и обсессивно-компульсивное расстройство. Расстройства, связанные со стрессом, включают посттравматическое стрессовое расстройство, геморрагический стресс, вызванные стрессом психотические эпизоды, психосоциальную карликовость, стрессовую головную боль, вызванные стрессом расстройства иммунной системы, такие как вызванная стрессом лихорадка, и вызванные стрессом расстройства сна. Расстройства приема пищи включают нервную анорексию, нервную булимию и ожирение. Эти состояния здесь и далее отнесены к первичным расстройствам ЦНС, связанным с CRF. Арилпиразиновые соединения по изобретению полезны также в лечении различных неврологических расстройств, в том числе супрануклеарного паралича, связанной со СПИДом деменции, мультиинфарктной деменции, нейродегенеративных расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона, травмы головы, травмы спинного мозга, ишемического нейронального повреждения, бокового амиотрофического склероза, расстройств восприятия боли, таких как фибромиалгия, и эпилепсии. Далее на эти состояния ссылаются как на вторичные, связанные с CRF расстройства ЦНС. Согласно изобретению предложен способ лечения расстройства или заболевания ЦНС, при котором пациенту, нуждающемуся в таком лечении, вводят эффективное количество соединения по изобретению. Предпочтительно, пациенту вводят от 0,1 до 140 мг на кг массы тела в сутки соединения по изобретению. В частности, расстройство или заболевание ЦНС представляет собой тревожное расстройство, расстройство, связанное со стрессом, или расстройство приема пищи. В частности, расстройство или заболевание ЦНС представляет собой депрессию или биполярное расстройство. В частности, заболевание ЦНС представляет собой нервную анорексию, нервную булимию или ожирение. Арилпиразиновые соединения по изобретению полезны в качестве модуляторов функции рецепто-8 006938 ра, сопряженного с G-белком. Кроме того, арилпиразиновые соединения по изобретению полезны в качестве модуляторов CRFрецептора при лечении ряда желудочно-кишечных, сердечно-сосудистых, гормональных, аутоиммунных и воспалительных состояний. Такие состояния включают синдром раздраженного кишечника, язвы, болезнь Крона, спастическую толстую кишку, диарею, послеоперационный кишечный илеус и гиперчувствительность толстой кишки, связанную с психопатологическими расстройствами или стрессом, гипертензию, тахикардию, застойную сердечную недостаточность, бесплодие, синдром эутиреоидной слабости, воспалительные состояния, вызванные ревматоидным артритом и остеоартритом, боль, астму, псориаз и аллергию. Далее на эти состояния ссылаются как на связанные с CRF расстройства не-ЦНС. Арилпиразиновые соединения по изобретению также полезны в качестве модуляторов CRF1 рецептора при лечении состояний у животных, связанных с аберрантными уровнями CRF. Эти состояния включают стресс-синдром у свиней, бычью лихорадку от транспортировки, конскую пароксизмальную фибрилляцию и дисфункции, вызванные изоляцией у кур, стресс от стрижки у овец или стресс у собак,связанный со взаимодействием человек-животное, психосоциальную карликовость и гипогликемию. Далее на эти состояния у животных ссылаются как на связанные с CRF расстройства у животных. Согласно изобретению предложен способ модулирования функции рецептора, сопряженного с Gбелком, при котором клетки, экспрессирующие рецептор, сопряженный с G-белком, подвергают воздействию эффективного количества соединения по изобретению. В предпочтительном воплощении данного способа рецептор, сопряженный с G-белком, представляет собой CRF1-рецептор. Согласно изобретению предложен также способ модуляции функции CRF-рецептора, при котором пациенту, нуждающемуся в такой модуляции, вводят эффективное количество соединения по изобретению. В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение по изобретению, в частности для использования в лечении любых первичных расстройств ЦНС, вторичных расстройств ЦНС, связанных с CRF расстройств не-ЦНС или связанных с CRF расстройств у животных. Предложена также упакованная фармацевтическая композиция, содержащая фармацевтическую композицию по изобретению в контейнере и инструкции для применения композиции для лечения пациента, страдающего тревожным расстройством, расстройством, связанным со стрессом, или расстройством приема пищи. Дополнительно, данное изобретение относится к применению CRF1 соединений в качестве зондов для локализации рецепторов в срезах ткани. Согласно изобретению предложен способ локализации CRF-рецепторов в образцах срезов ткани,при котором осуществляют контактирование детектируемого меченого соединения по изобретению с образцом ткани в условиях, которые дают возможность этому соединению связываться с CRF-рецепторами внутри этого образца ткани; промывание этого образца ткани для удаления несвязанного соединения; и детектирование оставшегося связанного соединения. Арилпиразиновые соединения по изобретению (и особенно меченые соединения по данному изобретению) полезны в качестве стандартов и реагентов для определения способности потенциального фармацевтического агента связываться с CRF-рецептором. Подробное описание изобретения Изобретение относится к соединениям формулы или их фармацевтически приемлемым солям, гдеR4 отсутствует или представляет собой атом кислорода; Аr представляет собой фенил, моно-, ди- или три-замещенный заместителем RC, или Аr выбран из группы, состоящей из нафтила или гетероциклической группы, имеющей 1 кольцо, от 3 до 8 атомов в кольце и 1 или 2 гетероатома, выбранные из N, О или S, каждый из которых не замещен или моно-, ди- или тризамещен заместителем RC; при условии, что если Аr представляет собой замещенный галогеном фенил, нафтил или замещен-9 006938 ный галогеном нафтил, то соединения, где R3 представляет собой водород, исключаются;RA и RB, которые могут быть одинаковыми или разными, в каждом случае независимо выбраны из группы, состоящей из водорода и прямых, разветвленных или циклических алкильных групп, имеющих от 1 до 8 атомов углерода, каждый из которых также может быть замещен одним или двумя заместителем(ями), выбранным(и) из гидрокси, галогена, -О(C1-4 алкил), -NH(C1-4 алкил), -N(С 1-4 алкил)(C1-4 алкил) иRC в каждом случае независимо выбран из группы, состоящей из галогена, циано, галогеноалкила,трифторметила, трифторметокси, гидрокси, амино и С 1-6 алкила, С 2-6aлкенила, C1-4 алкинила, С 3-7 циклоалкила, (С 3-7 циклоалкил)C1-4 алкила, -О(C1-4 алкил), замещенного заместителем RD в количестве от 0 до 2,-NН(С 1-4 алкил) и -N(C1-4 алкил)(C1-4 алкил);RD В каждом случае независимо выбран из группы, состоящей из галогена, гидрокси, C1-4 алкила,-О(C1-4 алкил), -NН(C1-4 алкил), -N(C1-4 алкил)(С 1-4 алкил), морфолино, пирролидино, пиперидино, тиоморфолино, пиперазино, 4-гидроксипиперидино, трифторметила и трифторметокси;X в каждом случае независимо выбран из группы, состоящей из -СН 2-, -CHRB-, -О-, -S-, -NH-, -NRB-; иY и Z в каждом случае независимо выбраны из группы, состоящей из 3-7-членных карбоциклических и гетероциклических групп, которые являются насыщенными, ненасыщенными или ароматическими, которые могут быть замещены одним или двумя заместителями, выбранными из галогена, оксо, гидрокси, C1-4 алкила, -О(C1-4 алкил), -NН(C1-4 алкил) и -N(C1-4 алкил)(C1-4 алкил), и указанные 3-7-членные гетероциклические группы содержат один или два гетероатом(а), выбранный(ые) из N, О и S, причем точкой присоединения является либо атом углерода, либо атом азота; иn в каждом случае независимо выбран из 0, 1 и 2. Описанные здесь соединения могут иметь один или более чем один асимметрический центр или плоскость. Соединения по настоящему изобретению, содержащие асимметрически замещенный атом,могут быть выделены в оптически активной или рацемической формах. В данной области хорошо известно, как получить оптически активные формы, например, разделением рацемических форм (рацематов), асимметрическим синтезом или синтезом из оптически активных исходных материалов. Разделение рацематов может быть выполнено, например, общепринятыми способами, такими как кристаллизация в присутствии разделяющего агента или хроматография с использованием, например, хиральной ВЭЖХколонки (ВЭЖХ высокоэффективная жидкостная хроматография). Многие геометрические изомеры олефинов, соединений с двойной связью C=N и тому подобного также могут присутствовать в описанных здесь соединениях, и все такие стабильные изомеры предусматриваются в настоящем изобретении. Цис и транс геометрические изомеры соединений по настоящему изобретению описаны, и они могут быть выделены в виде смеси изомеров или в виде отдельных изомерных форм. Все хиральные (энантиомерные и диастереомерные) и рацемические формы, а также геометрические изомерные формы структуры подразумеваются, если специально не указана конкретная стереохимия или изомерная форма. Соединения-антагонисты CRF, предложенные согласно данному изобретению, и их меченые производные полезны также в качестве стандартов и реагентов для определения способности потенциального фармацевтического агента связываться с CRF-рецептором. Меченые производные соединений-антагонистов CRF, предложенных согласно данному изобретению, полезны также в качестве радиоактивного датчика для визуализации посредством позитронной эмиссионной томографии (PET) или для одиночно-фотонной эмиссионной компьютерной томографии(SPECT). Определения Термин "замещенный", используемый здесь, означает, что любой один или более чем один атом водорода на указанном атоме замещен заместителем из указанной группы при условии, что нормальная валентность указанного атома не превышена и что это замещение дает в результате стабильное соединение. Если заместитель представляет собой кето (то есть =O), то на атоме замещены два водорода. Кетозаместители не присутствуют на ароматических группировках. Настоящее изобретение охватывает все изотопы атомов, имеющихся в настоящих соединениях. Изотопы включают те атомы, которые имеют тот же самый атомный номер, но разные массовые числа. В качестве общего примера и без ограничения,изотопы водорода включают тритий и дейтерий. Изотопы углерода включают 11 С, 13 С и 14 С. Если какая-либо переменная величина встречается более чем один раз в какой-либо составляющей или формуле соединения, то ее определение в каждом случае не зависит от ее определения в каждом другом случае. Так, например, если указано, что группа замещена заместителями R в количестве 0-2, то указанная группа возможно может быть замещена заместителями R в количестве вплоть до 2, и R в каждом случае независимо выбран из определения R. Допустимы также комбинации заместителей и/или переменных величин, только если такие комбинации дают в результате стабильные соединения. Как указано выше, различные заместители в различных формулах являются "возможно замещенными", в том числе Ar, R1, R2 и R3. Если эти заместители (Ar, R1, R2 и R3) замещены, то они могут быть замещены по одному или более чем одному доступному положению, в типичном случае по положениям 1-3 или 4, одной или более чем одной отличной от водорода подходящей группой, такой как раскрыто- 10006938 здесь. Подходящие группы, которые могут находиться на "замещенной" группе Аr, R1, R2 и R3 или другом заместителе, включают, например, галоген, такой как фторо, хлоро, бромо и йодо; циано; гидроксил; нитро; азидо; алканоил, такой как С 1-6 алканоильная группа, например ацил, и тому подобное; карбоксамидо; алкильные группы, включая группы, имеющие от 1 до примерно 12 атомов углерода, или 1, 2, 3, 4,5 или 6 атомов углерода; алкенильные и алкинильные группы, включая группы, имеющие одну или более чем одну ненасыщенную связь и от 2 до примерно 12 атомов углерода, или 2, 3, 4, 5 или 6 атомов углерода; алкоксигруппы, имеющие одну или более чем одну кислородную связь и от 1 до примерно 12 атомов углерода, или 1, 2, 3, 4, 5 или 6 атомов углерода; арилокси, такой как фенокси; алкилтиогруппы,включая группировки, имеющие одну или более чем одну тиоэфирную связь и от 1 до 12 атомов углерода, или 1, 2, 3, 4, 5 или 6 атомов углерода; алкилсульфинильные группы, включая группировки, имеющие одну или более чем одну сульфинильную связь и от 1 до 12 атомов углерода, или 1, 2, 3, 4, 5 или 6 атомов углерода; алкилсульфонильные группы, включая группировки, имеющие одну или более чем одну сульфонильную связь и от 1 до 12 атомов углерода, или 1, 2, 3, 4, 5 или 6 атомов углерода; аминоалкильные группы, такие как группы, имеющие один или более чем один атом N и от 1 до примерно 12 атомов углерода, или 1, 2, 3, 4, 5 или 6 атомов углерода; карбоциклический арил, имеющий 6 или более атомов углерода, в частности фенил (например группа Аr, которая является замещенной или незамещенной бифенильной группировкой); аралкил, имеющий от 1 до 3 отдельных или конденсированных колец и от 6 до примерно 18 кольцевых атомов углерода, причем бензил является предпочтительной группой; аралкокси, имеющий от 1 до 3 отдельных или конденсированных колец и от 6 до примерно 18 кольцевых атомов углерода, причем О-бензил является предпочтительной группой; или гетероароматическую или гетероалициклическую группу, имеющую от 1 до 3 отдельных или конденсированных колец и от 3 до примерно 8 членов в кольце и один или более чем один атом N, О или S, например кумаринил, хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил, бензотиазолил, тетрагидрофуранил, тетрагидропиранил, морфолино и пирролидинил. Здесь положение замещения фенильного кольца зависит от точки присоединения заместителя к этому фенильному кольцу относительно точки присоединения фенильной группы к остальной части данного химического соединения. Например, L указывает точку присоединения фенильного кольца к остальной части химического соединения. Числа 2, 3, 4, 5 и 6 указывают индивидуальные атомы кольца,к которым могут быть присоединены заместители. Используемый здесь термин "алкил" охватывает разветвленные и прямоцепочечные насыщенные алифатические углеводородные группы, имеющие конкретное число атомов углерода. Примеры алкила включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, втop-бутил, тpeтбутил, н-пентил и втop-пентил. Алкильные группы типично имеют от 1 до примерно 16 атомов углерода,более типично от 1 до примерно 12 атомов углерода. Предпочтительные алкильные группы представляют собой С 1-С 6 алкильные группы. Особенно предпочтительные группы представляют собой метил, этил,пропил, бутил, 3-пентил. Используемый здесь термин "циклоалкил" охватывает насыщенные кольцевые группы, имеющие предусмотренное число атомов углерода, такие как циклопропил, циклобутил, циклопентил или циклогексил. В типичном случае циклоалкильные группы будут иметь от 3 до примерно 8 членов в кольце. В термине "(С 3-6 циклоалкил)С 1-4 алкил", как определено выше, точка присоединения находится на алкильной группе. Этот термин охватывает, без ограничений, циклопропилметил, циклогексилметил,циклогексилметил. Используемый здесь термин "алкенил" охватывает углеводородные цепи либо с прямой, либо с разветвленной конфигурацией и одной или более чем одной ненасыщенной связью углерод-углерод, которая может встречаться в любом стабильном месте цепи, такие как этенил и пропенил. Алкенильные группы типично будут иметь от 2 до примерно 12 атомов углерода, более типично от 2 до примерно 12 атомов углерода. Используемый здесь термин "алкинил" охватывает углеводородные цепи либо с прямой, либо с разветвленной конфигурацией и одной или более чем одной тройной связью углерод-углерод, которая может встречаться в любом стабильном месте цепи, такие как этинил и пропинил. Алкинильные группы типично будут иметь от 2 до примерно 16 атомов углерода, более типично от 2 до примерно 12 атомов углерода. Используемый здесь термин "галогеноалкил" охватывает как разветвленные, так и прямые насыщенные алифатические углеводородные группы, имеющие предусмотренное число атомов углерода, замещенные одним или более чем одним атомом галогена (например -CVFW, где v равно числу от 1 до 3, aw равно числу от 1 до (2v+1. Примеры галогеноалкила включают, без ограничений, трифторметил, трихлорметил, пентафторэтил и пентахлорэтил. Типичные галогеноалкильные группы будут иметь от 1 до- 11006938 примерно 16 атомов углерода, более типично от 1 до примерно 12 атомов углерода. Используемый здесь термин "алкокси" представляет алкильную группу, как она определена выше, с предусмотренным числом атомов углерода, присоединенных через кислородный мостик. Примеры алкоксигрупп включают, без ограничений, метокси, этокси, н-пропокси, изопропокси, н-бутокси, 2 бутокси, трет-бутокси, н-пентокси, 2-пентокси, 3-пентокси, изопентокси, неопентокси, н-гексокси, 2 гексокси, 3-гексокси и 3-метилпентокси. Алкоксигруппы типично будут иметь от 1 до примерно 16 атомов углерода, более типично от 1 до примерно 12 атомов углерода. Используемый здесь термин "алкилтио" включает в себя группы, имеющие одну или более чем одну тиоэфирную связь и от 1 до примерно 16 атомов углерода, более типично от 1 до примерно 12 атомов углерода, еще более типично от 1 до примерно 6 или 8 атомов углерода. Используемый здесь термин "алкилсульфинил" включает в себя группы, имеющие одну или более чем одну сульфоксидную группу (SO) и от 1 до примерно 16 атомов углерода, более типично от 1 до примерно 12 атомов углерода, еще более типично от 1 до примерно 6 или 8 атомов углерода. Используемый здесь термин "алкилсульфонил" включает в себя группы, имеющие одну или более чем одну сульфонильную группу (SO2) и от 1 до примерно 16 атомов углерода, более типично от 1 до примерно 12 атомов углерода, еще более типично от 1 до примерно 6 или 8 атомов углерода. Используемый здесь термин "алкиламино" включает в себя группы, имеющие одну или более чем одну первичную, вторичную и/или третичную аминогруппу и от 1 до примерно 16 атомов углерода, более типично от 1 до примерно 12 атомов углерода, еще более типично от 1 до примерно 6 или 8 атомов углерода. Используемые здесь термины "галогено" или "галоген" означают фторо, хлоро, бромо и йодо; а"противоион" представляет собой небольшой, отрицательно заряженный ион, такой как хлорид, бромид,гидроксид, ацетат, сульфат и тому подобное. Используемые здесь термины "карбоцикл" или "карбоциклический остаток" означают любой 3-7 членный моноцикл или бицикл или 7-13-членный бицикл или трицикл, каждый из которых может быть насыщенным, частично ненасыщенным или ароматическим. Примеры таких карбоциклов включают, без ограничений, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктан, [4.3.0]бициклононан, [4.4.0]бициклодекан, [2.2.2]бициклооктан, флуоренил,фенил, нафтил, инданил, адамантил и тетрагидронафтил. Используемые здесь термины "гетероцикл" или "гетероциклоалкил" означают стабильное 5-7 членное моноциклическое или бициклическое или 7-10-членное бициклическое гетероциклическое кольцо, которое является насыщенным, частично ненасыщенным или ненасыщенным (ароматическим), и которое состоит из атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S, и в том числе любую бициклическую группу, в которой любое из определенных выше гетероциклических колец конденсировано с бензольным кольцом. Гетероатомы серы или азота возможно могут быть окисленными. Гетероциклическое кольцо может быть присоединено к своей боковой группе по любому гетероатому или атому углерода, который дает в результате стабильную структуру. Описанные здесь гетероциклические кольца могут быть замещены по атомам углерода или азота, если конечное соединение стабильно. Азот в гетероцикле возможно может быть кватернизирован. Если общее число атомов S и О в гетероцикле превышает 1, то предпочтительно, чтобы эти гетероатомы не были смежными друг с другом. Предпочтительно, чтобы общее число атомов S и О в гетероцикле не превышало 1. Используемый здесь термин "ароматическая гетероциклическая система" или аналогичный термин,такой как "гетероарил", означает стабильное 5-7-членное моноцикличесчое или бициклическое или 7-10 членное бициклическое гетероциклическое ароматическое кольцо, которое состоит из атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S. Предпочтительно, чтобы общее число атомов S и О в ароматическом гетероцикле не превышало 1. Примеры гетероциклов включают, без ограничений, акридинил, азоцинил, бензимидазолил, бензофуранил, бензтиофуранил,бензтиофенил, бензоксазолил, бензтиазолил, бензотриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолил, карбазолил, NH-карбазолил, карбонилил, хроманил, хроменил, циннолинил,декагидрохинолинил, 2 Н,6 Н-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил,индолил, 3 Н-индолил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3 оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил,оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксантиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил,пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол,пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2 Н-пирролил, пирролил, хиназолинил,хинолинил, 4 Н-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5 тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и- 12006938 ксантенил. Предпочтительные гетероциклы включают, без ограничений, пиридинил, фуранил, тиенил, пирролил, пиразолил, пирролидинил, имидазолил, индолил, бензимидазолил, 1H-индазолил, оксазолидинил,бензотриазолил, бензизоксазолил, оксиндолил, бензоксазолинил и изатионил. Охвачены также конденсированные кольца и спиро-соединения, содержащие, например, вышеуказанные гетероциклы. Используемый здесь термин "карбоциклический арил" включает в себя группы, которые содержат от 1 до 3 отдельных или конденсированных колец и от 6 до примерно 18 атомов углерода без гетероатома в качестве члена кольца. Особенно предпочтительные карбоциклические арильные группы включают фенил и нафтил, в том числе 1-нафтил и 2-нафтил. Выражение "фармацевтически приемлемый" используется здесь для обозначения тех соединений,веществ, композиций и/или лекарственных форм, которые в рамках прочно сложившегося в медицине суждения пригодны для применения в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений соразмерно с разумным соотношением польза/риск. Используемое здесь выражение "фармацевтически приемлемые соли" относится к производным описанных соединений, которые представляют собой родительское соединение, модифицированное путем получения его соли с основанием или кислотой. Примеры фармацевтически приемлемых солей включают, без ограничений, соли органических или неорганических кислот основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты, и тому подобное. Фармацевтически приемлемые соли включают общепринятые нетоксичные соли или четвертичные аммониевые соли родительского соединения, образованные, например, из нетоксичных органических или неорганических кислот. Например, такие общепринятые нетоксичные соли включают соли, получаемые из неорганических кислот, таких как хлороводородная, бромоводородная, серная, сульфаминовая, фосфорная, азотная и тому подобное; и соли, получаемые из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая,метансульфоновая, этандисульфоновая, щавелевая, изэтионовая, НООС-(СН 2)n-СООН, где n равно 0-4, и тому подобное. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из родительского соединения, которое содержит основную или кислотную группировку, общепринятыми химическими способами. Обычно такие соли могут быть получены путем взаимодействия этих соединений в форме свободных кислот или оснований со стехиометрическим количеством соответствующего основания или соответствующей кислоты в воде или в органическом растворителе или в их смеси; обычно предпочтительной является неводная среда, такая как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Список подходящих солей приведен в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, p. 1418 (1985); содержание этого источника информации включено в данное описание изобретения ссылкой на него. Термин "пролекарства" включает в себя любые ковалентно связанные носители, которые in vivo высвобождают активное родительское лекарственное средство формулы I, когда такое пролекарство вводят млекопитающему. Пролекарства соединения формулы I получают модифицированием функциональных групп, присутствующих в соединении, так чтобы эти модификации расщеплялись либо при рутинном манипулировании, либо in vivo до родительского соединения. Пролекарства включают соединения формулы I, где гидрокси, амино или сульфгидрильная группа связана с какой-либо группой так, что при введении млекопитающему пролекарство или соединение формулы I расщепляется с образованием соответственно свободной гидроксильной, свободной амино или свободной сульфгидрильной группы. Примеры пролекарств включают, без ограничений, ацетатные, формиатные и бензоатные производные спиртовых и аминных функциональных групп в соединениях формулы I, и тому подобное. Комбинации заместителей и/или переменных допустимы, если только такие комбинации дают стабильные соединения. Стабильное соединение или стабильная структура означает соединение, которое достаточно устойчиво, чтобы уцелеть при выделении из реакционной смеси с необходимой степенью чистоты и приготовлении из него эффективного терапевтического агента. Термин "терапевтически эффективное количество" соединения по данному изобретению означает количество, эффективное для антагонизации аномального уровня CRF или для лечения симптомов аффективного расстройства, тревоги или депрессии у хозяина. Соединения общей формулы I можно вводить перорально, местно, парентерально, ингаляцией или распылением или ректально в составе стандартных лекарственных препаратов, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и носители. Используемый здесь термин "парентеральный" охватывает подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекционные или инфузионные способы. Кроме того, предложен фармацевтический препарат, содержащий соединение общей формулы I и фармацевтически приемлемый носитель. Одно или более чем одно соединение общей формулы I может присутствовать вместе с одним или более чем одним нетоксичным фармацевтически приемлемым носителем и/или разбавителем и/или адъювантом и, если желательно, с другими активными ингредиентами. Фармацевтические композиции, содержащие соеди- 13006938 нения общей формулы I, могут быть в форме, подходящей для перорального применения, например в виде таблеток, пилюль, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов или эликсиров. Композиции, предназначенные для перорального применения, могут быть получены любым известным в данной области способом изготовления фармацевтических композиций, и такие композиции могут содержать один или более чем один агент, выбранный из группы, состоящей из подсластителей,корригентов, красителей и консервантов для обеспечения получения фармацевтически первоклассных и вкусных препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые пригодны для изготовления таблеток. Этими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие агенты, например кукурузный крахмал или альгиновая кислота; связывающие агенты, например крахмал, желатин или аравийская камедь; и смазывающие агенты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия или могут быть покрыты оболочкой известными способами, чтобы замедлить разрыхление и всасывание в желудочно-кишечном тракте и тем самым обеспечить пролонгированное действие в течение более длительного периода времени. Например, можно использовать вещество, обеспечивающее замедленное действие, такое как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального применения могут быть также представлены в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем, например с карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешан с водой или масляной средой, например с арахисовым маслом, вазелиновым маслом или оливковым маслом. Водные суспензии содержат активные вещества в смеси с эксципиентами, подходящими для изготовления водных суспензий. Такими эксципиентами являются суспендирующие агенты, например натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидропропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакант и аравийская камедь; диспергирующими или увлажняющими агентами могут быть природные фосфатиды, например лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этиленоксида с длинноцепочечными алифатическими спиртами, например гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными эфирами, производными от жирных кислот и гексита, такие как полиоксиэтиленсорбитолмоноолеат, или продукты конденсации этиленоксида с неполными эфирами, производными от жирных кислот и ангидридов гексита, такие как полиоксиэтиленсорбитанмоноолеат. Водные суспензии также могут содержать один или более чем один консервант, например этил- или н-пропилпарагидроксибензоат, один или более чем один краситель, один или более чем один корригент и один или более чем один подсластитель, такой как сахароза или сахарин. Масляные суспензии можно приготовить суспендированием активных ингредиентов в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как вазелиновое масло. Масляные суспензии могут содержать загуститель,например пчелиный воск, твердый парафин или цетиловый спирт. Указанные выше подсластители и корригенты могут быть добавлены для обеспечения получения вкусных пероральных препаратов. Эти композиции можно защищать путем добавления антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, пригодные для приготовления водной суспензии путем добавления воды, предоставляют активный ингредиент в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом и одним или более чем одним консервантом. Примеры подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов приведены выше. Дополнительные эксципиенты, например подсластители, корригенты и красители, также могут присутствовать. Фармацевтические композиции по изобретению также могут быть в форме эмульсий масло-в-воде. Масляная фаза может быть растительным маслом, например оливковым маслом или арахисовым маслом,или минеральным маслом, например вазелиновым маслом, или их смесью. Подходящие эмульгирующие агенты могут быть природными камедями, например аравийской камедью или трагакантом, природными фосфатидами, например соей, лецитином и эфирами или неполными эфирами, производными от жирных кислот и гексита, ангидридов, например сорбитанмоноолеатом, и продуктами конденсации указанных неполных эфиров с этиленоксидом, например полиоксиэтиленсорбитанмоноолеатом. Эмульсии также могут содержать подсластители и корригенты. Сиропы и эликсиры могут быть приготовлены с использованием подсластителей, например глицерина, пропиленгликоля, сорбита или сахарозы. Такие препараты могут содержать также смягчающее средство, консервант, корригент и краситель. Фармацевтические композиции могут быть в форме стерильной инъецируемой водной или масляной суспензии. Такую суспензию можно приготовить известными способами, используя подходящие диспергирующие или увлажняющие агенты и суспендирующие агенты, которые были упомянуты выше. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Приемлемыми наполнителя- 14006938 ми и растворителями, которые могут быть использованы, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно используют стерильные нелетучие масла. С этой целью можно использовать любое нелетучее масло, в том числе синтетические моно- или диглицириды. К тому же, жирные кислоты, такие как олеиновая кислота, находят применение в приготовлении инъецируемых препаратов. Соединения общей формулы I также можно вводить в форме суппозиториев для ректального введения лекарственного средства. Эти композиции могут быть приготовлены смешением лекарственного средства с подходящим, не вызывающим раздражения эксципиентом, который является твердым веществом при обычных температурах, но жидким при ректальной температуре и поэтому будет плавиться в прямой кишке, высвобождая лекарственное средство. Такими веществами являются масло какао и полиэтиленгликоли. Соединения общей формулы I можно вводить парентерально в стерильной среде. Лекарственное средство в зависимости от наполнителя и концентрации можно либо суспендировать, либо растворить в наполнителе. Предпочтительно, адъюванты, такие как местные анестетики, консерванты и буферные агенты, могут быть растворены в наполнителе. Типичными субъектами, которым можно вводить соединения по изобретению, являются млекопитающие, в частности приматы, особенно люди. Для ветеринарного применения подойдет широкое разнообразие субъектов, например скот, такой как крупный рогатый скот, овцы, козы, коровы, свиньи и тому подобное; домашняя птица, например куры, утки, гуси, индейки и тому подобное; и домашние животные, в частности кошки и собаки. Для диагностического и исследовательского применения подходит большое множество млекопитающих, в том числе грызуны (например мыши, крысы, хомяки), кролики,приматы и свиньи, например инбредные свиньи, и тому подобное. К тому же, для in vitro применений,таких как in vitro диагностические и исследовательские применения, подходят жидкости организма и образцы клеток вышеуказанных субъектов, например млекопитающего, в частности примата, например кровь, моча или образцы ткани человека, или кровь, моча или образцы ткани животных, упомянутых для ветеринарного применения. Уровни дозировки порядка от примерно 0,1 до примерно 140 мг соединения по изобретению на килограмм массы тела в сутки полезны в лечении вышеуказанных состояний (от примерно 0,5 мг до примерно 7 г на пациента в сутки). Количество активного ингредиента, который может быть объединен с веществами-носителями с образованием однократной дозировочной формы, будет варьировать в зависимости от хозяина, которого подвергают лечению, и от конкретного способа введения. Стандартные лекарственные формы, как правило, содержат от примерно 1 до примерно 500 мг активного ингредиента. Частота дозирования также может варьировать в зависимости от используемого соединения и конкретного заболевания, которое лечат. Однако для лечения большинства расстройств ЦНС предпочтительной является схема дозировки 4 раза в сутки или меньше. Для лечения стресса и депрессии особенно предпочтительна схема дозировки 1 или 2 раза в сутки. Однако следует иметь в виду, что конкретный уровень дозы для любого конкретного пациента будет зависеть от различных факторов, в том числе от активности используемого конкретного соединения,возраста, массы тела, общего состояния здоровья, пола, диеты, времени введения, пути введения, скорости экскреции, лекарственной комбинации и тяжести конкретного заболевания, подвергающегося терапии. Предпочтительные соединения по изобретению имеют определенные фармакологические свойства. Такие свойства включают, без ограничений, пероральную биодоступность, низкую токсичность, низкое связывание белка сыворотки крови и желательные in vitro и in vivo периоды полужизни. Прохождение через гематоэнцефалический барьер для соединений, применяемых для лечения расстройств ЦНС, является необходимым свойством, тогда как низкие уровни в мозгу соединений, применяемых для лечения периферических расстройств, часто являются предпочтительными. Для прогнозирования этих желательных фармакологических свойств можно использовать анализы. Анализы, используемые для прогнозирования биодоступности, включают в себя транспорт через монослои кишечных клеток человека, в том числе монослои клеток Сасо-2. Анализ на токсичность для культивируемых гепатоцитов можно использовать для прогнозирования токсичности соединений. Прохождение соединения через гематоэнцефалический барьер у людей можно прогнозировать, основываясь на данных по уровням соединения в мозгу у лабораторных животных, которым соединение вводили внутривенно. Для прогнозирования связывания сывороточных белков можно использовать анализы на связывание альбумина. Такие анализы описаны в обзоре Oravcova, et al. (Jornual of Chromatografy В (1996), volume 677, pages 1-27). Период полужизни соединения обратно пропорционален частоте дозировки соединения. Период полужизни соединений in vitro можно прогнозировать по данным анализов микросомальной полужизни,как описано Kuhnz and Gieschen (Drug Metabolism and Disposition (1998), volume 26, pages 1120-1127). Альтернативно, период полужизни соединений можно прогнозировать по данным микросомального анализа in vitro, такого как анализ, приведенный в примере 99b.- 15006938 Настоящее изобретение также относится к способу изменения активности CRF-рецепторов, при котором клетки, экспрессирующие такие рецепторы, подвергают воздействию эффективного количества соединения по изобретению, причем это соединение присутствует в растворе в концентрации, достаточной для конкретного изменения сигнал-трансдуцирующей активности в ответ на CRF в клетках, экспрессирующих высокие уровни CRF1-рецепторов in vitro. Этот способ включает в себя изменение сигналтрансдуцирующей активности CRF-рецепторов in vivo, например, у пациентов, получивших количество соединения формулы I, которое достаточно для изменения сигнал-трансдуцирующей активности в ответ на CRF в клетках, экспрессирующих высокие уровни CRF1 in vitro. Количество соединения, которое достаточно для изменения сигнал-трансдуцирующей активности в ответ на CRF-рецепторы, можно определить с помощью анализа на трансдукцию сигнала, опосредованную CRF-рецептором, такого как анализ, при котором связывание CRF с CRF-рецептором на поверхности клетки приводит к изменениям в экспрессии репортерного гена. Настоящее изобретение также относится к упакованным фармацевтическим композициям для лечения расстройств, реагирующих на модуляцию С 5 а-рецептора, например расстройств приема пищи, депрессии или стресса. Упакованные фармацевтические композиции включают в себя контейнер, содержащий терапевтически эффективное количество по меньшей мере одного модулятора CRF1-рецептора,как описано выше, и инструкции по применению для лечения расстройства, реагирующего на модуляцию CRF1-рецептора, у пациента. Получение арилпиразинов Соединения по настоящему изобретению могут быть получены целым рядом способов, хорошо известных специалисту в области органической химии. Соединения по настоящему изобретению можно синтезировать, используя спосбоы, описанные ниже, вместе со способами синтеза, известными в области синтетической органической химии, или их вариантами. Предпочтительные способы включают, без ограничений, способы, описанные ниже. Каждый источник информации, цитируемый ниже, включен в данное описание изобретения ссылкой на него. Предпочтительные способы получения соединений по настоящему изобретению включают, но не ограничиваются ими, способы, описанные на схеме I, схеме II и схеме III. Специалисту в данной области будет ясно, что можно варьировать исходные вещества и использовать дополнительные стадии для получения соединений, охваченных настоящим изобретением. Полное содержание всех источников информации, цитируемых ниже, включено в данное описание изобретения посредством ссылки. Использованы следующие сокращения: Согласно общему способу А, где R1 и R3 такие, как определено для формулы I, a Hal представляет собой атом галогена, соответственно хлорид или бромид, галогенид в VI может быть замещен аминным или (тио)алкоксидным нуклеофилом. Так, аминопиразин можно получить из VI и амина в присутствии подходящего катализатора на основе переходного металла, такого как, без ограничений, ацетат палладия(II) или трис(дибензилиденацетон)-дипалладий(0), лиганда, такого как, без ограничений, 1,1'-бис (дифенилфосфин)ферроцен, 2,2'-бис(дифенилфосфин)-1,1'-бинафтил, дициклогексил(2-бифенил)фосфин,трициклогексилфосфин или три-трет-бутилфосфин, и основания, такого как тpeт-бутоксид натрия или калия в инертных растворителях, таких как, без ограничений, толуол, диметиловый эфир этиленгликоля,диглим, ДМФ или N-метилпирролидинон, при температуре в пределах от температуры окружающей среды до 100 С. (Тио)алкилпиразины можно получить путем обработки VI натриевой или калиевой солью спирта или тиола в инертном растворителе, таком как ТГФ, ДМФ, N-метилпирролидинон или метилсульфоксид, при температуре окружающей среды или при повышенной температуре вплоть до тем- 16006938 пературы кипения используемого растворителя. Галогенирование можно выполнить различными способами, известными в данной области, включающими обработку N-хлорсукцинимидом, бромом, Nбромсукцинимидом, трибромидом пиридиния, дибромидом трифенилфосфина, иодом и Nиодсукцинимидом в растворителях, таких как, без ограничений, дихлорметан, уксусная кислота или метилсульфоксид. Бромпиразин можно превратить в арилпиразин VII катализируемой переходным металлом реакцией сочетания с металлоарильным реагентом (Аr-[М]). Более широко используемые пары реагент/катализатор включают арилбороновую кислоту/палладий(0) (реакция Сузуки; N. Miyaura and A. Suzuki, Chemical Review 1995, 95, 2457), арилтриалкилстаннан/палладий(0) (реакция Штилле; T.N. Mithell,Synthesis 1992, 803), арилцинк/палладий(0) и арильный реактив Гриньяра/никель(II). Палладий(0) представляет собой каталитическую систему с различной комбинацией пары металл/лиганд, которая включает, без ограничений, тетракис(трифенилфосфин)палладий(0), ацетат палладия(II)/три(орто-толил)фосфин, трис(дибензилиденацетон)дипалладий(0)/три-трет-бутилфосфин и дихлор[1,1'-бис(дифенилфосфин)ферроцен]палладий(0). Никель(II) представляет собой никельсодержащий катализатор, такой как[1,2-бис(дифенилфосфино)этан]дихлорникель(II) и [1,3-бис(дифенилфосфино)пропан]дихлорникель(II). Арилпиразин VII, когда X представляет собой NH, можно затем преобразовать в VIII N-алкилированием. Группа N-H депротонируется сильным основанием, таким как, без ограничений, гидрид щелочного металла, амид щелочного металла или алкоксид щелочного металла, в инертных растворителях, таких как ТГФ, ДМФ или метилсульфоксид. Алкилирование можно проводить с использованием алкилгалогенида,соответственно бромида или йодида, при температурах в пределах от 0-100 С. Схема II (способ В) Альтернативно, соединения формулы VII можно получить, как показано на схеме II. Катализируемое переходным металлом сочетание галогенпиразина VI, как описано в способе А, может дать промежуточное соединение VIII. Окисление стерически менее затрудненного атома азота может быть осуществлено с использованием различных известных в данной области окислителей, которые включают метахлорпероксибензойную кислоту, трифторперуксусную кислоту, перекись водорода и монопероксифталевую кислоту. N-оксид можно подвергнуть перегруппировке с образованием хлорпиразина IX при действии оксихлорида фосфора при температуре в пределах от температуры окружающей среды до 100 С. Замещение хлора нуклеофилом, содержащим азот, кислород или серу, как это описано в способе А, может дать соединение формулы VII. Схема III (способ С) Еще один способ получения соединений формулы VII иллюстрируется на схеме III. Соединения формулы X, 3,6-диалкил-2,5-дихлорпиразины, можно получить из 2-алкилглицина по известной в литературе методике (Chemical and Pharmaceutical Bulletin of Japan 1979, 27, 2027). Нуклеофильное замещение одного хлорида с последующим сочетанием типа Сузуки или по другому, как описано в способе А,может давать соединения формулы VII. Схема IV (способ D) Еще один способ получения соединений формулы VII иллюстрируется на схеме IV. Имеющийся в продаже 2,6-дихлорпиразин можно подвергнуть монозамещению нуклеофилом, содержащим азот, ки- 17006938 слород или серу, с получением XI. Так, X может реагировать с амином в растворителях, таких как дихлорметан, ацетонитрил, ТГФ, ДМФ, N-метилпирролидинон, метилсульфоксид, метанол, этанол и изопропанол, при температуре в пределах от 0 С до температуры кипения растворителя. Кроме того, X может реагировать с (тио)алкоксидом натрия или калия в инертных растворителях, таких как, без ограничений, ТГФ, ДМФ, N-метилпирролидинон или метилсульфоксид, при температуре в пределах от 0 С до температуры окружающей среды. Полученный монохлорпиразин XI можно галогенировать, использовав условия, описанные в способе А, с образованием смеси региоизомерных бромидов ХIIа и ХIIb. Катализируемое переходными металлами (гетеро)арил-арильное сочетание ХIIа, как описано в способе А, с еще одним последующим галогенированием, может дать соединение VII (R1 = Hal, R3 = Cl), которое далее можно превратить в VII замещением одного или обоих атомов галогена, последовательно или одновременно, различными нуклеофилами (R1[M] и R3-[M]), одинаковыми или разными, в присутствии или в отсутствие катализатора на основе переходного металла. Упомянутые выше нуклеофилы могут включать(тио)алкоксид натрия или калия, алкиламин и металлорганический реагент, такой как, без ограничений,алкильные реагенты Гриньяра, алкилбороновые кислоты и их эфиры или алкилстаннаны. Упомянутый выше катализатор на основе переходного металла может представлять собой палладиевый или никелевый катализатор, описанный в способе А. Другой региоизомерный бромид ХIIb также можно превратить в VII, изменив порядок последовательности превращений. Специалист в данной области поймет, что также можно изменить порядок превращений, чтобы получить соединения формулы VII через промежуточное соединение XIII. Как обсуждалось выше, предпочтительные арилпиразины по изобретению проявляют хорошую активность в стандартных in vitro анализах на связывание CRF-рецепторов, в частности в анализе, конкретно приведенном в нижеследующем примере 96. Здесь ссылки на "стандартный in vitro анализ на связывание рецепторов" относятся к анализу, как он определен в нижеследующем примере 96. Как правило,предпочтительные соединения, предпочтительные арилпиримидины по изобретению, имеют IC50 примерно 10 микромоль или меньше, более предпочтительно примерно 100 наномоль или меньше, еще более предпочтительно 10 наномоль или меньше или даже 1 наномоль или меньше в таком определенном стандартном in vitro анализе на связывание CRF-рецепторов, пример которого приведен в нижеследующем примере 96. Примеры Получение соединений по настоящему изобретению иллюстрируется следующими далее примерами, которые не должны истолковываться как ограничивающие объем или сущность изобретения до конкретных методик и соединений, описанных в них. Имеющиеся в продаже реагенты использовали без дополнительной очистки. Комнатная температура или температура окружающей среды составляет 20-25 С. Концентрирование в вакууме предполагает использование роторного испарителя. Аббревиатура ТСХ относится к тонкослойной хроматографии. Спектральные данные протонного ядерного магнитного резонанса (1 Н-ЯМР) получали при 300 или 400 МГц. Масс-спектральные данные получали методами либо химической ионизации (ХИ), либо химической ионизации при атмосферном давлении (ХИАД). Пример 1. [N-(1-Этил)пропил]-5-(2,4-диметоксифенил)-3,6-диметилпиразин-2-амин [формула I: АrA. К смеси 2-хлор-3,6-диметилпиразина (0,83 ммоль), трис(дибензилиденацетон)дипалладия(0) (2 мол.%) и BINAP (2,2'-бис-(дифенилфосфино)-1,1'-бинафтила) (6 мол.%) в диметиловом эфире этиленгликоля (2 мл) в атмосфере азота добавляют 1-этилпропиламин (1,0 ммоль), а затем тpeт-бутоксид натрия(1,25 ммоль). Смесь перемешивают при 70-80 С в течение 2,5 ч, разбавляют водным хлоридом аммония и экстрагируют смесью гексан-Et2 О 1:1. Объединенные экстракты сушат (сульфат натрия), фильтруют,концентрируют и хроматографируют на силикагеле (элюент - смесь гексан-ЕtOАс от 10:1 до 4:1) с получением аминопиразина.B. Раствор N-(1-этил)пропил-3,6-диметилпиразин-2-амина (0,72 г, 3,7 ммоль) в дихлорметане (20 мл) охлаждают до 0 С и порциями добавляют N-бромсукцинимид (0,72 г, 4,1 ммоль). После добавления смесь затем перемешивают в течение 1 ч, одновременно давая возможность нагреться до комнатной температуры. Смесь затем концентрируют до небольшого объема в вакууме, растирают с гексаном, фильтруют, промывают гексаном, и фильтрат концентрируют и хроматографируют на силикагеле с получением бромида (1,07 г), концентрируют и хроматографируют на силикагеле с получением бромида (1,07 г). С. Смешанный раствор 5-бром-[N-(1-этил)пропил]-3,6-диметилпиразин-2-амина (0,40 г, 1,47 ммоль) и тетракис(трифенилфосфин)палладия(0) (33 мг, 2 мол.%) в диметиловом эфире этиленгликоля (8 мл) перемешивают при комнатной температуре в течение 15 мин, последовательно добавляя 2,4 диметоксибензолбороновую кислоту (1,76 ммоль) и водный раствор карбоната натрия (1,0 М, 4 мл). Смесь нагревают до 75 С при перемешивании в течение 1,5 ч, затем разбавляют 0,1 н. гидроксидом натрия и дважды экстрагируют смесью гексан-диэтиловый эфир 1:1. Объединенные экстракты сушат(сульфат натрия), фильтруют, концентрируют и хроматографируют на силикагеле (гексан-ЕtOАс от 4:1 до 1:1) с получением указанного в заголовке соединения (0,5 г): 1 Н-ЯМР (CDCl3, 400 МГц):0.95 (t, 6H),1.6 (m, 4H), 2.2 (s, 3 Н), 2.4 (s, 3 Н), 3.75 (s, 3 Н), 3.85 (s, 3 Н), 3.95 (br d, 1 Н), 4.1 (br q, 1 Н), 6.55 (d, 1 Н), 7.2(d, 1 Н); МС (ХИ) 330. Соединения примеров 2-20 а, приведенных в табл. I, могут быть получены способами, описанными в примере 1. Пример 21. [N-(1-Этил)пропил]-3,6-диметил-5-(2,4,6-триметилфенил)пиразин-2-амин [формула I: Аr = 2,4,6-триметилфенил; R2 = -N-(1-этил)пропил; R1 = R3 = СН 3]. К раствору 5-бром-[N-(1-этил)пропил]-3,6-диметилпиразин-2-амина (200 мг), полученному как в примере 1 В, в ТГФ (4 мл) при комнатной температуре добавляют [1,3-бис(дифенилфосфино)пропан]дихлорникель(II) (40 мг). Через 10 мин медленно по каплям добавляют 2,4,6-триметилфенилмагнийбромид(1,0 М в ТГФ, 4 мл). Смесь перемешивают при комнатной температуре в течение 1 дня, затем кипятят с обратным холодильником в течение ночи. Полученный темный раствор вливают в водный хлорид аммония и дважды экстрагируют эфиром. Объединенные экстракты сушат (сульфат натрия), фильтруют, концентрируют и хроматографируют с получением целевого продукта (87 мг): 1 Н-ЯМР (CDCl3, 400 МГц):1.0 (t, 6H), 1.5-1.7 (m, 4H), 1.95 (s, 3 Н), 2.1 (s, 3 Н), 2.3 (s, 3 Н), 2.35 (s, 3 Н), 3.95 (br, 1 Н), 4.1 (br, 1 Н), 6.9 (s,2H). Пример 22. 3-Этил-[N-(1-этил)пропил]-6-метил-5-(2,4,6-триметилфенил)пиразин-2-амин [формулаI: Аr = 2,4,6-триметилфенил; R2 = -N-(1-этил)пропил; R1 = CH2CH3; R3 = СН 3]. К раствору [N-(1-этил)пропил]-3,6-диметил-5-(2,4,6-триметилфенил)пиразин-2-амина (74 мг, 0,24 ммоль) в ТГФ (2 мл) при 0 С добавляют н-бутиллитий (2,5 М в гексане, 0,24 мл). Через 10 мин при 0 С добавляют йодметан (0,020 мл). Смесь перемешивают при 0 С в течение 10 мин, затем вливают в водный хлорид аммония и экстрагируют Et2O. Экстракт сушат (сульфат натрия), фильтруют, концентрируют, и остаток очищают препаративной ТСХ (10% ЕtOАс в гексане, проявляя 3 раза) с получением указанного в заголовке соединения (17 мг): 1 Н-ЯМР (CDCl3, 400 МГц):1.0 (t, 6 Н), 1.25 (t, 3 Н), 1.5-1.7 (m, 4H), 1.95 (s,3 Н), 2.05 (s, 3 Н), 2.3 (s, 3 Н), 2.65 (q, 2H), 4.05 (т, 2 Н), 3.95 (br, 1 Н), 6.9 (s, 2H). Пример 23. 3,6-Диэтил-5-(2,4-диметоксифенил)-[N-(1-этилпропил)]пиразин-2-амин [формула I: Аr = 2,4-диметоксифенил; R2 = -N-(1-этил)пропил; R1 = R3 = СН 2 СН 3]. 2-Хлор-3,6-диэтилпиразин (Chem. Pharm. Bull. Jap., 27, 2027 (1979 превращают в целевой продукт по методике, описанной в примере 1: 1 Н-ЯМР (CDCl3, 300 МГц):0,95 (t, 6H), 1.15 (t, 3 Н), 1.25 (t, 3 Н),1.5-1.7 (m, 4H), 2.45 (q, 2H), 2.65 (q, 2H), 3.75 (s, 3 Н), 3.85 (s, 3 Н), 4.0 - 4.2 (br, 2H), 6.5 (s , 1H), 6.55 (d,1H), 7.2 (d, 1H); ЖХ-МС (жидкостная хроматография-масс-спектрометрия): 358. Соединения примеров 24-48, приведенных в таблице II, могут быть получены по общей методике,описанной в примере 23. Пример 48 а. 3,6-Диэтил-5-(2,4-диэтокси)фенил-[N-(1-этилпропил)]пиразин-2-амин [формула I: Аr = 2,4-диэтоксифенил; R2 = -N-(1-этил)пропил; R1 = R3 = CH2CH3]. А. К раствору 3,6-диэтил-5-(2,4-диметоксифенил)-[N-(1-этилпропил)]пиразин-2-амина (910 мг, 2,54 ммоль) (получен в примере 23) в дихлорметане добавляли ВВr3 (1 н., 6 мл) при -78 С. Смесь перемешивают в течение 10 мин, затем постепенно нагревают до комнатной температуры и перемешивают в течение 3 ч, затем вливают в смесь лед-вода и экстрагируют дихлорметаном. Водный слой подщелачивали насыщенным NaHCO3 и экстрагировали дихлорметаном. Объединенные экстракты сушили (сульфат натрия), фильтровали, концентрировали, и остаток очищали на колонке (20% ЕtOАс в гексане) с получением 3,6-диэтил-5-(2,4-дигидроксифенил)-[N-(1-этилпропил)]пиразин-2-амин в виде желтого масла (590 мг,71%): 1 Н-ЯМР (CDCl3, 400 МГц):0,94 (t, 6H), 1.30 (t, 3H), 1.36 (t, 3H), 1.57 (m, 2H), 1.67 (m, 2 Н), 2.62 (q,2 Н), 2.86 (q, 2 Н), 4.15 (m, 2 Н), 6.41 (d , 1 Н), 6.51 (d, 1H), 7.27 (d, 1H). ЖХ-МС:330(М+1). В. Вышеуказанное масло (60 мг, 0,182 ммоль) растворяли в ДМФ (2 мл) и алкилировали йодэтаном(0,072 мл, 0,9 ммоль) в присутствии K2 СО 3 (125 мг) при 75 С в течение 2 ч. Реакционную смесь затем разбавляли водой и экстрагировали ЕtOАс. Экстракты сушили (сульфат натрия), фильтровали, концентрировали, и остаток очищали на колонке (2,5% метанол в дихлорметане) с получением указанного в заголовке соединения в виде масла (49 мг, 70%): 1 Н-ЯМР (CDCl3, 400 МГц):0,96 (t, 6H), 1.13 (t, 3H),1.27 (m, 6H), 1.42 (t, 3 Н), 1.57 (m, 2 Н), 1.67 (m, 2 Н), 2.47 (m, 2 Н), 2.66 (q, 2H), 3.95-4.15 (m, 6 Н), 6.53 (d,1 Н), 7.15 (d, 1H). ЖХ-МС: 387 (М+1). Соединения примеров 48b-48k можно получить по общей методике, описанной в примере 48 а.A. К раствору 2-хлор-3,6-диметилпиразина (0,71 г, 5,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (140 мг, 2,5 мол.%) в диметиловом эфире этиленгликоля (30 мл) добавляют 2-метокси-4,6 диметилбензолбороновую кислоту (1,08 г, 6,0 ммоль), а затем 1 М водный раствор карбоната натрия (15 мл). Смесь перемешивают при 70-75 С в течение ночи, одновременно давая возможность охладиться,разбавляют насыщенным водным раствором бикарбоната натрия и дважды экстрагируют Et2O. Объединенные экстракты сушат (сульфат натрия), фильтруют и концентрируют в вакууме. Остаток очищают фильтрованием через короткую силикагелевую колонку с получением 1,4 г сырого продукта.B. Полученное выше сырое вещество растворяют в дихлорметане (20 мл), охлаждают до 0 С и порциями добавляют мета-хлорпероксибензойную кислоту (70%, 1,2 г). После 4 ч при температуре окружающей среды смесь разбавляют н-гексаном (20 мл) и промывают 1 М водным раствором гидроксида натрия. Органическую фазу отделяют, сушат (сульфат натрия), фильтруют, концентрируют в вакууме, и остаток прямо используют на следующей стадии без дополнительной очистки.C. Сырой N-оксид растворяют в триоксохлориде фосфора (10 мл), и этот раствор нагревают при 80 С в течение ночи. Выпаривание триоксихлорида фосфора и обычная водная обработка остатка с последующей хроматографирей на силикагеле дает 2-арил-5-хлор-3,6-диметилпиразин в виде белого твердого вещества (0,76 г).D. К раствору полученного на стадии С хлорпиразина (260 мг, 0,94 ммоль) и трис(дибензилиденацетон)дипалладия(0) (11 мг) в толуоле (10 мл) добавляют 0,2 М раствор три-третбутилфосфина в толуоле (0,10 мл). Через 15 мин при температуре окружающей среды последовательно добавляют 1-этилпропиламин (0,14 мл) и тpeт-бутоксид калия (1,0 М в ТГФ, 1,4 мл), и эту реакционную смесь нагревают при 80 С в течение 4 ч. Смесь оставляют охлаждаться до комнатной температуры, разбавляют эфиром, промывают водным раствором хлорида аммония, сушат (сульфат натрия), фильтруют,концентрируют и хроматографируют на силикагеле с получением целевого продукта в виде белого твердого вещества (250 мг): 1 Н-ЯМР (CDCl3, 400 МГц)0,95 (t, 6H), 1.5-1.7 (m, 4H), 2.0 (s, 3 Н), 2.1 (s, 3 Н),2.4 (s, 6H), 3.7 (s, 3H), 3.95 (br q, 1 Н), 4.1 (br q, 1 Н), 6.6 (в, 1 Н), 6.7 (в, 1 Н). Соединения примеров 50-53 можно получить по общей методике, описанной в примере 49. Пример 50. N-Бензил-5-(2-метокси-4,6-диметилфенил)-3,6-диэтилпиразин-2-амин [формула I: Аr=2-метокси-4,6-диметилфенил; R2 = -OCH(CH2CH3); R1 = R3 = СН 3]. К суспензии NaH (60% в минеральном масле, 40 мг) в ДМФ (0,5 мл) добавляют 3-пентанол (0,1 мл). Смесь перемешивают при температуре окружающей среды до тех пор, пока водород не перестанет выделяться. К раствору полученного алкоксида добавляют раствор 2-арил-5-хлор-3,6-диметилпиразина (20 мг в 0,5 мл растворителя), полученного как в примере 49 с, в N-метилпирролидиноне. После 1 ч при комнатной температуре смесь нагревают до 70 С в течение еще 1 ч, дают возможность охладиться, разбавляют водным раствором хлорида аммония и дважды экстрагируют диэтиловым эфиром. Объединенные органические вещества сушат (сульфат натрия), фильтруют, концентрируют и хроматографируют на силикагеле с получением указанного в заголовке соединения в виде бесцветного масла (15 мг): 1 Н-ЯМР (CDCl3,400 МГц):1.0 (t, 6 Н), 1.75 (m, 4 Н), 1.95 (s, 3 Н), 2.15 (s, 3 Н), 2.35 (s, 6H), 2.45 (s, 3 Н), 3.7 (s, 3 Н), 3.95 (br
МПК / Метки
МПК: C07D 241/18, C07D 241/20, C07D 241/12, A61P 25/00, C07D 401/04, C07D 403/04, C07D 409/04, A61K 31/4965, C07D 405/12, C07D 401/12, C07D 241/52
Метки: арилпиразины, замещенные
Код ссылки
<a href="https://eas.patents.su/30-6938-zameshhennye-arilpiraziny.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные арилпиразины</a>
Предыдущий патент: Растворы, содержащие эпинастин
Следующий патент: Парентеральная композиция парацетамола
Случайный патент: Аспирационный способ открытия устья крупных лимфатических коллекторов