Производные азетидина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 6583
Опубликовано: 24.02.2006
Авторы: Бушар Эрве, Букерель Жан, Гризони Серж, Майерс Майкл, Ашар Даниель, Иттэнжер Огюстэн, Филош Брюно
Формула / Реферат
1. Соединения формулы (I)

в которой
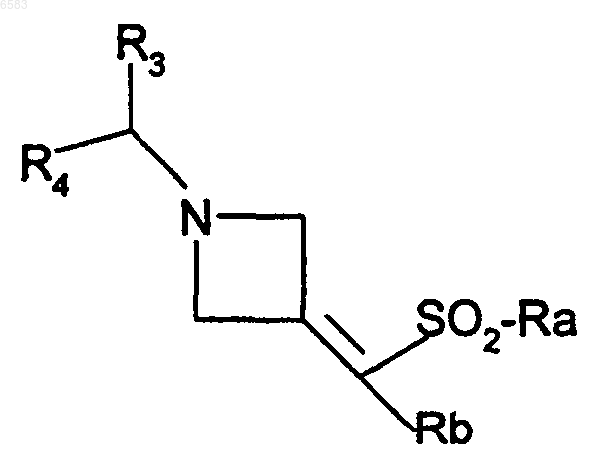
R означает радикал CR1R2, C=C(R5)SO2R6 или C=C(R7)SO2alk; причем либо R1 означает атом водорода и R2 означает радикал -C(R8)(R9)(R10), -C(R8)(R11)(R12), -CO-NR13R14, -CO-R6, -CO-циклоалкил, -SO-R6, -SO2-R6, -C(OH)(R6)(алкил), -C(=NOalk)R6, -C(=NO-CH2-CH=CH2)R6, -CH2-C(=NOalk)R6, -CH(R6)N31R32, -CH(R6)NHCONHalk или -CH(R6)NHCOalk;
либо R1 означает алкил, NH-R15, цианогруппу, -S-alk-NR16R17, -CH2-NR18R19 или -NR20R21 и R2 означает радикал -C(R8)(R11)(R12);
R3 и R4, одинаковые или разные, означают либо фенил, незамещенный или замещенный одним или несколькими атомами галогена, алкильными группами или группами -alk-NR24R25, или замещенный CH2Cl, когда R обозначает радикал CR1R2, где R1 обозначает NH-R15, а R2 обозначает радикал -C(R8)(R11)(R12); либо гетероароматический радикал, выбираемый среди пиридильного, пиримидинильного, тиенильного циклов, причем эти гетероароматические радикалы могут быть незамещены или замещены одним или несколькими атомами галогена;
R5 означает атом водорода;
R6 означает радикал Ar или Het;
R7 означает гетероцикленил, возможно замещенный -CSO-фенилом;
R8 означает атом водорода;
R9 означает радикал -CO-NR26R27, -COOH, -COOalk, -CH2OH, -NH-CO-NH-alk или -CH2-NHR28;
R10 означает радикал Ar или Het;
R11 означает радикал -SO2-alk, -SO2-Ar, -SO2-Het;
R12 означает атом водорода или радикал Ar или Het;
R13 означает атом водорода или алкил;
R14 означает радикал Ar, -alk-Ar или -alk-Het;
R15 означает алкил, циклоалкил или -alk-NR29R30;
R16 и R17, одинаковые или разные, означают атом водорода или алкил, или же R16 и R17 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий один или несколько других гетероатомов, выбираемых среди атомов кислорода, серы и азота и возможно замещенный одним или несколькими алкильными радикалами;
R18 означает атом водорода или алкил;
R19 означает атом водорода или алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk; -NR20R21 означает насыщенный или ненасыщенный 3-8-членный моногетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, азота и серы;
R24 и R25, одинаковые или разные, означают атом водорода или алкил, -COOalk, циклоалкил, алкилциклоалкил, -alk-O-alk, гидроксиалкил или же R24 и R25 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами, радикалами -COalk, -COOalk, -CO-NHalk, -CS-NHalk, оксогруппами, гидроксиалкильными радикалами, радикалами -alk-O-alk, -CO-NH2;
R26 и R27, одинаковые или разные, означают атом водорода или алкил, гидроксиалкил, циклоалкил, циклоалкилалкил, -alk-COO-alk, -alk-Ar, -alk-Het, Het, -alk-N(alk)2; R26 и R27 с атомом азота, с которым они связаны, также могут образовывать ненасыщенный или насыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий один или несколько других гетероатомов, выбираемых среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными, алкоксильными радикалами, атомами галогена;
R28 означает радикал -CONHalk, -COalk или циклоалкилкарбонил;
n равно 1, 2 или 3;
R29 и R30, одинаковые или разные, означают атом водорода или алкил, или же R29 и R30 вместе с атомом азота, с которым они связаны, образуют насыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами;
R31 и R32, одинаковые или разные, означают атом водорода или алкил, Ar или -alk-Ar, или же R31 и R32 вместе с атомом азота, с которым они связаны, образуют гетероцикл, выбираемый среди азиридинила, азетидинила, пирролидинила и пиперидинила;
alk означает алкильный или алкиленовый радикал;
Ar означает фенил, возможно замещенный одним или несколькими заместителями, выбираемыми среди атома галогена, алкила, алкоксила, -CO-alk, цианогруппы, -COOH, -COOalk, -CONR22R23, -CO-NH-NR24R25, алкилсульфанила, алкилсульфинила, алкилсульфонила, алкилсульфанилалкила, алкилсульфинилалкила, алкилсульфонилалкила, гидроксиалкила, -alk-NR24R25, -NR24R25, алкилтиоалкила, формила, гидроксила, CF3, OCF3, Het, -O-alk-NH-циклоалкила или SO2NH2;
Het означает ненасыщенный или насыщенный 3-10-членный моно- или бигетероцикл, содержащий один или несколько гетероатомов, выбираемых среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими атомами галогена, алкильными, алкоксильными, алкоксикарбонильными группами, группами -CONR22R23, гидроксильными, гидроксиалкильными группами, оксогруппами или группами SO2NH2;
причем алкильные и алкиленовые радикалы и части и алкоксильные радикалы и части имеют линейную или разветвленную цепь и содержат 1-6 атомов углерода; циклоалкильные радикалы содержат 3-10 атомов углерода и гетероциклоалкильные и гетероцикленильные радикалы содержат 3-10 атомов углерода;
их оптические изомеры и их соли с неорганической или органической кислотой.
2. Соединения по п.1, в которых Het выбирают среди пиридила, пиримидинила, тиенила.
3. Соединения формулы (I) по п.1, в которых, когда R16 и R17 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, он представляет собой пиперазинильный цикл.
4. Соединения формулы (I) по п.1, в которых гетероциклом, образованным NR20R21, является имидазолильный цикл.
5. Соединения формулы (I) по п.1, в которых, когда R24 и R25 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, он представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл.
6. Соединения формулы (I) по п.1, в которых, когда R26 и R27 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, он представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл.
7. Соединения формулы (I) по п.1, в которых, когда R29 и R30 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- шыш бигетероцикл, он представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл.
8. Соединения формулы (I) по п.1, в которых
R означает радикал CR1R2, причем
либо R1 означает атом водорода и R2 означает радикал -C(R8)(R11)(R12) или C(R8)(R9)(R10);
либо R1 означает алкил и R2 означает радикал -C(R8)(R11)(R12);
R3 и R4, одинаковые или разные, означают либо фенил, незамещенный или замещенный одним или несколькими атомами галогена, алкильными группами, группами -alk-NR24R25, или замещенный CH2Cl, когда R обозначает радикал CR1R2, где R1 обозначает NH-R15, а R2 обозначает радикал -C(R8)(R11)(R12);
либо гетероароматический радикал, выбираемый среди пиридильного, пиримидинильного, тиенильного циклов, причем эти гетероароматические радикалы могут быть незамещены или замещены одним или несколькими атомами галогена;
R8 означает атом водорода;
R9 означает радикал -CO-NR26R27, -COOalk, -CH2OH, -NH-CO-NH-alk или -CH2-NHR28;
R10 означает радикал Ar или Het;
R11 означает радикал -SO2-alk, -SO2-Ar, -SO2-Het;
R12 означает атом водорода или радикал Ar или Het;
R24 и R25, одинаковые или разные, означают атом водорода или алкил, циклоалкил, алкилциклоалкил, гидроксиалкил, или же R24 и R25 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами, радикалами -COalk, -COOalk, -CO-NHalk, -CS-NHalk, оксогруппами, группами -CO-NH2;
Ar означает фенил, возможно замещенный 1 или 2 заместителями, выбираемыми среди атома галогена, алкила, алкоксила, -CO-alk, цианогруппы, -COOalk, -CONR22R23, алкилсульфонила, гидроксиалкила, -alk-NR24R25, -NR24R25, гидроксила, CF3, OCF3, -O-alk-NH-циклоалкила или SO2NH2;
Het означает бензофурильный, бензотиазолильный, бензотиенильный, бензоксазолильный, фурильный, изохинолильный, пирролильный, пиридильный, хинолильный, 1,2,3,4-тетрагидроизохинолильный, 1,2,3,4-тетрагидрохинолильный, тиазолильный или тиенильный цикл;
их оптические изомеры и их соли с неорганической или органической кислотой.
9. Соединение, выбираемое среди следующих соединений:
(RS)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин;
(R)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин;
(S)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин;
(RS)-1-[бис(4-хлорфенил)метил]-3-[(пирид-3-ил)(метилсульфонил)метил]азетидин;
(R)-1-[бис(4-хлорфенил)метил]-3-[(пирид-3-ил)(метилсульфонил)метил]азетидин;
(S)-1-[бис(4-хлорфенил)метил]-3-[(пирид-3-ил)(метилсульфонил)метил]азетидин;
(RS)-1-[бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин;
(R)-1-[бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин;
(S)-1-[бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин;
1-[бис(4-хлорфенил)метил]-3-(RS)-{[3-азетидин-1-илфенил]метилсульфонилметил}азетидин;
1-[бис(4-хлорфенил)метил]-3-(R)-{[3-азетидин-1-илфенил]метилсульфонилметил}азетидин;
1-[бис(4-хлорфенил)метил]-3-(S)-{[3-азетидин-1-илфенил]метилсульфонилметил}азетидин;
(RS)-1-[3-({1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонилметил)фенил]пирролидин;
(R)-1-[3-({1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонилметил)фенил]пирролидин;
(S)-1-[3-({1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонилметил)фенил]пирролидин;
(RS)-N-[3-({1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонилметил)фенил]-N-метиламин;
(R)-N-[3-({1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонилметил)фенил]-N-метиламин;
(S)-N-[3-({1-[бис(4-хлорфенил)метил]азетидин-3-ил}метилсульфонилметил)фенил]-N-метиламин;
(RS)-1-[бис(4-хлорфенил)метил]-3-[(3,5-бистрифторметилфенил)метилсульфонилметил]азетидин;
(R)-1-[бис(4-хлорфенил)метил]-3-[(3,5-бистрифторметилфенил)метилсульфонилметил]азетидин;
(S)-1-[бис(4-хлорфенил)метил]-3-[(3,5-бистрифторметилфенил)метилсульфонилметил]азетидин;
1-[бис(4-хлорфенил)метил]-3-(фенилсульфонилметил)азетидин;
(RS)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]-3-метилазетидин;
(R)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]-3-метилазетидин;
(S)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]-3-метилазетидин;
(RS)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-циклогексилацетамид;
(R)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-циклогексилацетамид;
(S)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-циклогексилацетамид;
(RS)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-изобутилацетамид;
(R)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-изобутилацетамид;
(S)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-изобутилацетамид;
(RS)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-циклопропилметилацетамид;
(R)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-циклопропилметилацетамид;
(S)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-циклопропилметилацетамид;
(RS)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-изопропилацетамид;
(R)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-изопропилацетамид;
(S)-2-{1-[бис(4-хлорфенил)метил]азетидин-3-ил}-2-(3,5-дифторфенил)-N-изопропилацетамид;
(RS)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)-1-метилсульфонилэтил]азетидин;
(R)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)-1-метилсульфонилэтил]азетидин;
(S)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)-1-метилсульфонилэтил]азетидин;
(RS)-1-[бис(4-фторфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(R)-1-[бис(4-фторфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(S)-1-[бис(4-фторфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RS)-1-[(3-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(SS)-1-[(3-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RR)-1-[(3-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(SR)-1-[(3-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RS)-1-[(4-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(SS)-1-[(4-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RR)-1-[(4-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(SR)-1-[(4-пиридил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RS)-5-((4-хлорфенил)-{3-[(3,5-дифторфенил)метилсульфонилметил]азетидин-1-ил}метил)пиримидин;
(SR)-5-((4-хлорфенил)-{3-[(3,5-дифторфенил)метилсульфонилметил]азетидин-1-ил}метил)пиримидин;
(RR)-5-((4-хлорфенил)-{3-[(3,5-дифторфенил)метилсульфонилметил]азетидин-1-ил}метил)пиримидин;
(SS)-5-((4-хлорфенил)-{3-[(3,5-дифторфенил)метилсульфонилметил]азетидин-1-ил}метил)пиримидин;
(SS)-1-[(2-хлорпирид-5-ил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RR)-1-[(2-хлорпирид-5-ил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(RS)-1-[(2-хлорпирид-5-ил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
(SR)-1-[(2-хлорпирид-5-ил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин;
их оптических изомеров и их фармацевтически приемлемых солей с неорганической или органической кислотой.
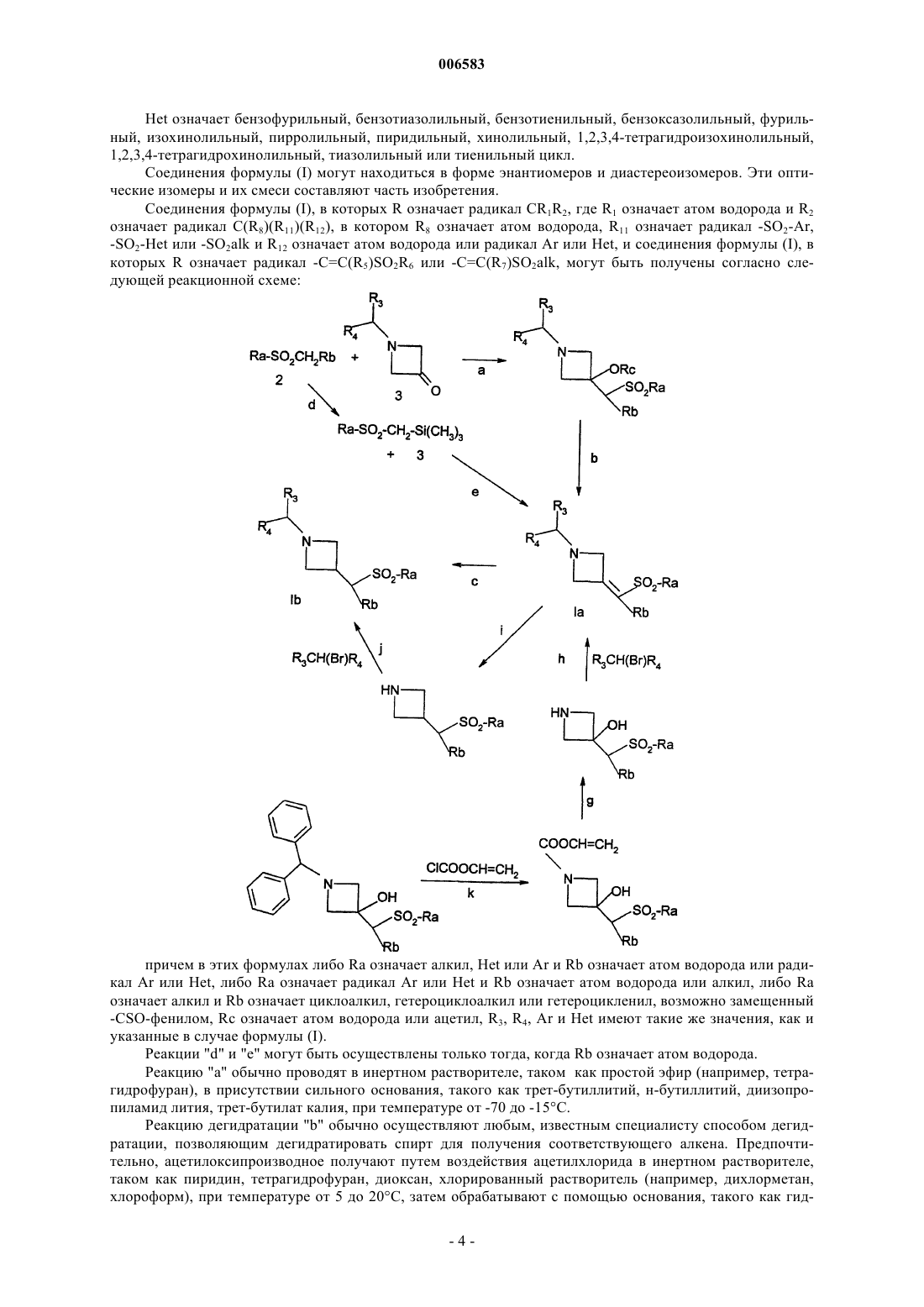
10. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R11)(R12), в котором R8 означает атом водорода, R11 означает радикал -SO2-Ar, -SO2-Het или -SO2alk и R12 означает атом водорода или радикал Ar или Het, отличающийся тем, что восстанавливают производное формулы
в которой Ra означает алкил, радикал Het или Ar и Rb означает атом водорода или радикал Ar или Het, причем алкил, Ar и Het имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
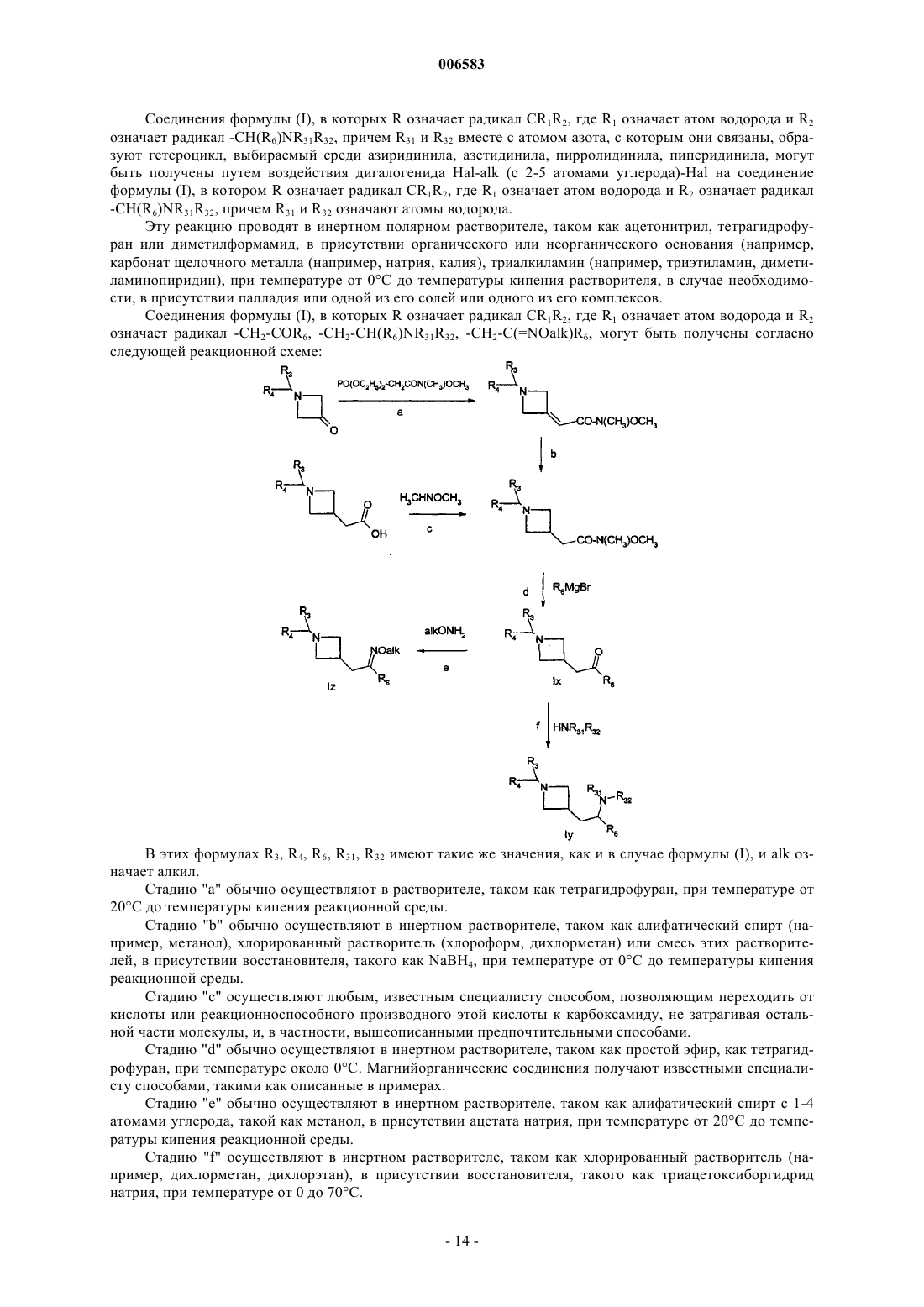
11. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R11)(R12), в котором R8 означает атом водорода, R11 означает радикал -SO2-Ar, -SO2-Het или -SO2alk и R12 означает атом водорода или радикал Ar или Het, отличающийся тем, что производное R3CH(Br)R4 вводят во взаимодействие с производным формулы
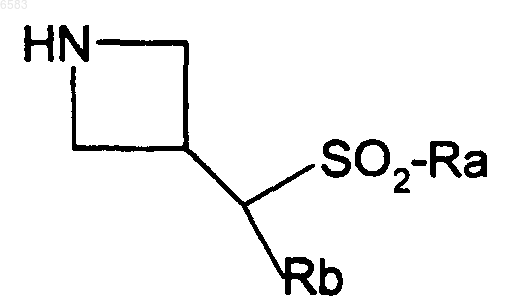
в которой Ra означает алкил, радикал Het или Ar и Rb означает атом водорода или радикал Ar или Het, причем алкил, Ar и Het имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
12. Способ получения соединений формулы (I) по п.1, в которых R означает радикал C=C(R5)SO2R6 или C=C(R7)SO2alk, отличающийся тем, что дегидратируют производное формулы
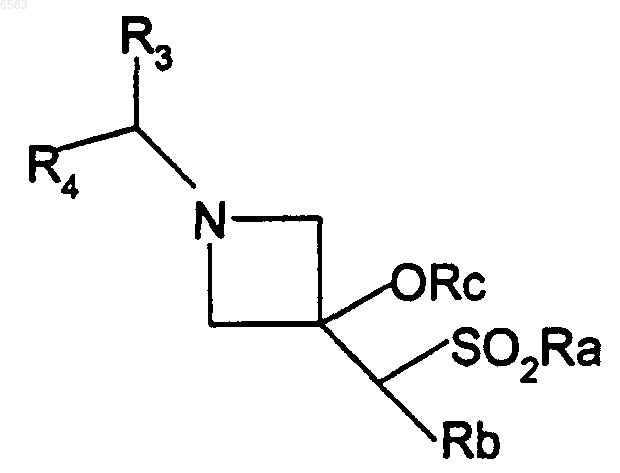
в которой либо Ra означает радикал Ar или Het и Rb означает атом водорода или алкил, либо Ra означает алкил и Rb означает циклоалкил, гетероциклоалкил или гетероцикленил, возможно замещенный -CSO-фенилом; Rc означает атом водорода или ацетил, причем R3, R4, Ar и Het имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
13. Способ получения соединений формулы (I) по п.1, в которых R означает радикал C=C(R5)SO2R6 или C=C(R7)SO2alk, отличающийся тем, что R3CH(Br)R4 вводят во взаимодействие с производным формулы
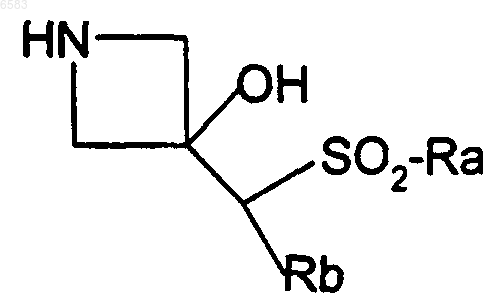
в которой либо Ra означает радикал Ar или Het и Rb означает атом водорода или алкил, либо Ra означает алкил и Rb означает циклоалкил, гетероциклоалкил или гетероцикленил, возможно замещенный -CSO-фенилом; Rc означает атом водорода или ацетил, причем R3, R4, Ar и Het имеют такие же значения, как и в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
14. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R9)(R10), в котором R8 означает атом водорода, R9 означает радикал -CO-NR26R27 и R10 означает радикал Ar или Het, отличающийся тем, что амин HNR26R27, в котором R26 и R27 имеют такие же значения, как в п.1, вводят во взаимодействие с кислотой формулы
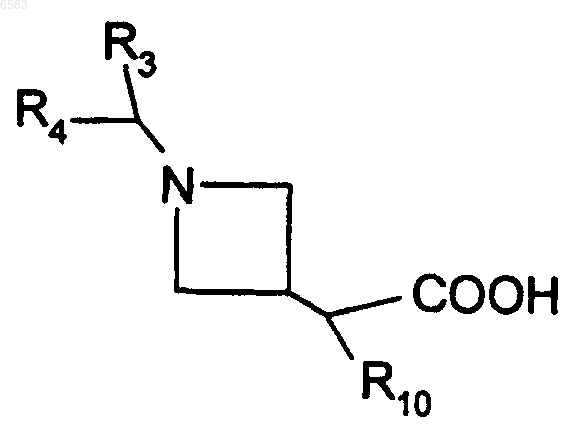
в которой R3, R4 и R10 имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
15. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R9)(R10), в котором R8 означает атом водорода, R9 означает радикал -COOH и R10 означает радикал Ar или Het, отличающийся тем, что гидролизуют соответствующий сложный эфир формулы
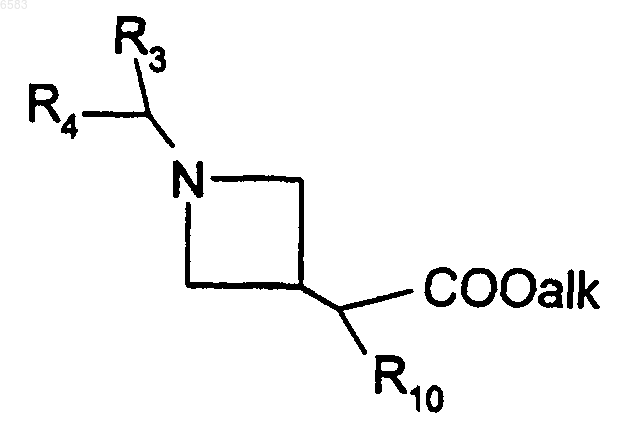
в которой R3, R4 и R10 имеют такие же значения, как в п.1, и alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
16. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R9)(R10), в котором R8 означает атом водорода, R9 означает радикал -COOalk или -CH2OH и R10 означает радикал Ar или Het, отличающийся тем, что восстанавливают соединение формулы
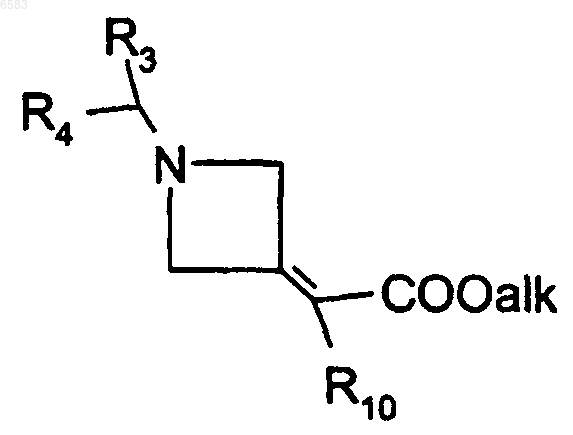
в которой R3, R4 и R10 имеют такие же значения, как в п.1, и alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
17. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R9)(R10), в котором R8 означает атом водорода, R9 означает радикал -NH-CO-NH-alk и R10 означает радикал Ar или Het, отличающийся тем, что амин alkNH2, в котором alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), вводят во взаимодействие с производным формулы
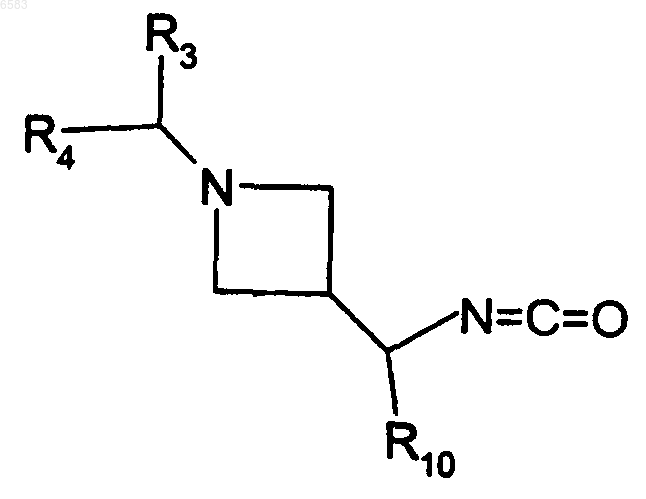
в которой R3, R4 и R10 имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
18. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -C(R8)(R9)(R10), R8 означает атом водорода, R9 означает радикал -CH2-NHR28, R28 означает радикал -CO-NHalk, и R10 означает радикал Ar или Het, отличающийся тем, что производное формулы
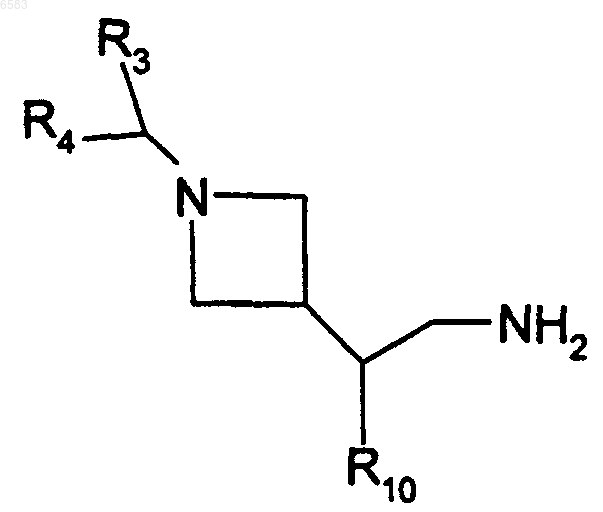
в которой R3, R4 и R10 имеют такие же значения, как в п.1, вводят во взаимодействие с производным RfNCO, в котором Rf означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
19. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, уфх R1 означает атом водорода и R2 означает радикал -C(R8)(R9)(R10), R8 означает атом водорода, R9 означает радикал -CH2-NHR28, R28 означает радикал -CO-alk, циклоалкилкарбонил и R10 означает радикал Ar или Het, отличающийся тем, что производное формулы
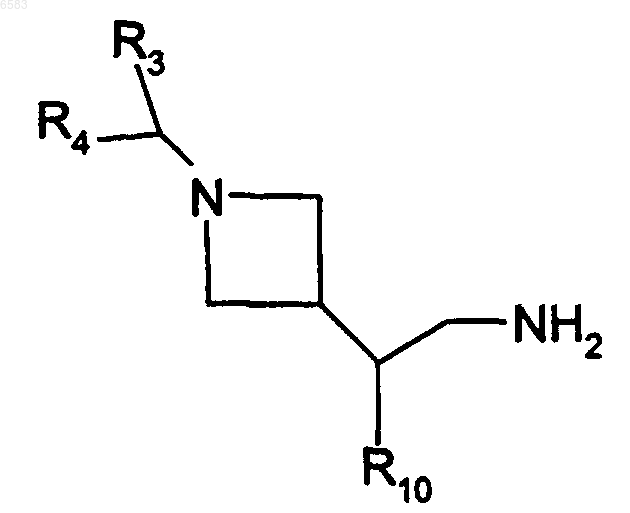
в которой R3, R4 и R10 имеют такие же значения, как в п.1, вводят во взаимодействие с кислотой HOOCRg, в которой Rg означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), циклоалкил(с 3-10 атомами углерода), алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), циклоалкил (с 3-10 атомами углерода), -(CH2)nOH и n равно 1, 2, 3, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
20. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CONR13R14, отличающийся тем, что амин HNR13R14, в котором R13 и R14 имеют такие же значения, как в п.1, вводят во взаимодействие с производным формулы
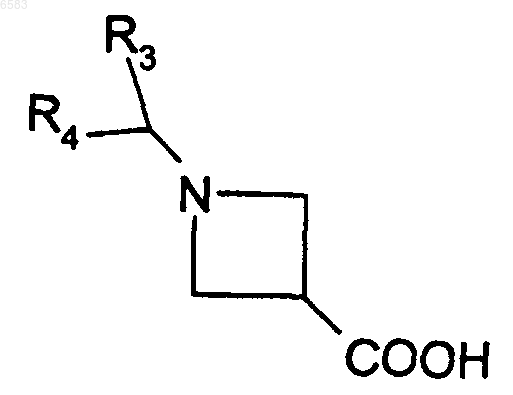
в которой R3 и R4 имеют такие же значения, как в формуле (I), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
21. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -SOR6, отличающийся тем, что окисляют производное формулы
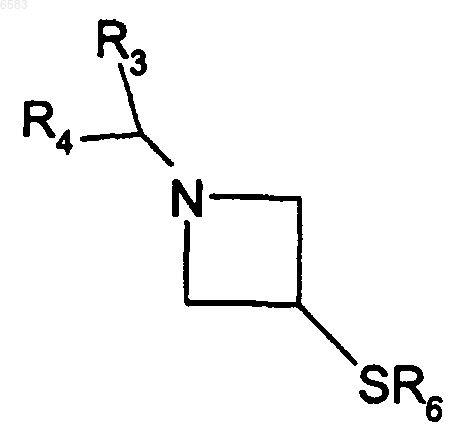
в которой R3, R4 и R6 имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
22. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -SO2R6, отличающийся тем, что окисляют производное формулы

в которой R3, R4 и R6 имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
23. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -COR6 или -CO-циклоалкил, отличающийся тем, что производное формулы
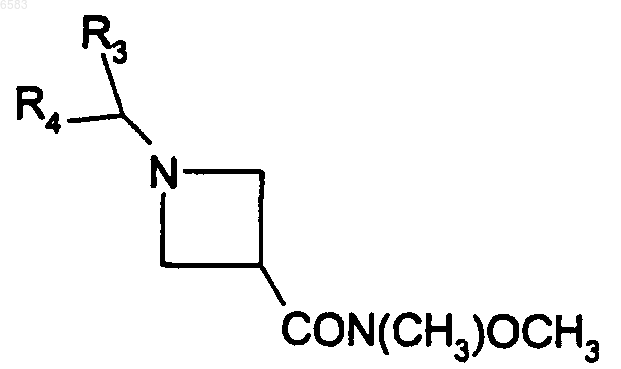
в которой R3, R4 имеют такие же значения, как в п.1, вводят во взаимодействие с производным RhMgBr, в котором Rh имеет такие же значения, как R6 в п.1, или же означает циклоалкил (с 3-10 атомами углерода), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
24. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -C(=NOalk)R6 или -C(=NO-CH2-CH=CH2)R6, отличающийся тем, что производное формулы
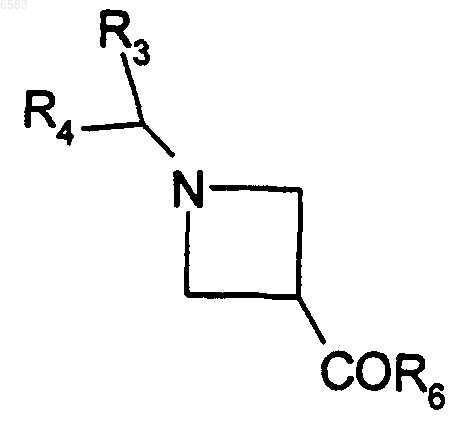
в которой R3, R4 и R6 имеют такие же значения, как в п.1, вводят во взаимодействие с производным RjONH2, в котором Rj означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи) или радикал -CH2-CH=CH2, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
25. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 и R32 означают атомы водорода, отличающийся тем, что гидроксид аммония вводят во взаимодействие с производным формулы

в которой R3, R4, R6 имеют такие же значения, как в п.1, и Ms означает метилсульфонилоксигруппу, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
26. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 означает атом водорода и R32 означает алкил, радикал Ar или -alk-Ar, отличающийся тем, что галогенид HalR31 вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 и R32 означают атомы водорода, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
27. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 и R32 означают алкильные радикалы, радикалы Ar или -alk-Ar, отличающийся тем, что галогенид HalR32 вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 означает атом водорода и R32 означает алкил, радикал Ar или -alk-Ar, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
28. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 означает атом водорода и R32 означает алкил (с 2-6 атомами углерода) или -alk(с 2-6 атомами углерода)-Ar, отличающийся тем, что альдегид RaCHO, в котором Ra означает алкил или -alk-Ar, вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 и R32 означают атомы водорода, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
29. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 означает алкил, радикал Ar или -alk-Ar и R32 означает алкил (с 2-6 атомами углерода) или -alk(с 2-6 атомами углерода)-Ar, отличающийся тем, что альдегид RaCHO, в котором Ra означает алкил или -alk-Ar, вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 означрхт атом водорода и R32 означает алкил, радикал Ar или -alk-Ar, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
30. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 и R32 вместе с атомом азота, с которым они связаны, образуют гетероцикл, выбираемый среди азиридинила, азетидинила, пирролидинила, пиперидинила, отличающийся тем, что дигалогенид Hal-alk(с 2-5 атомами углерода)-Hal вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 и R32 означают атомы водорода, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
31. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NHCONHalk, отличающийся тем, что производное формулы
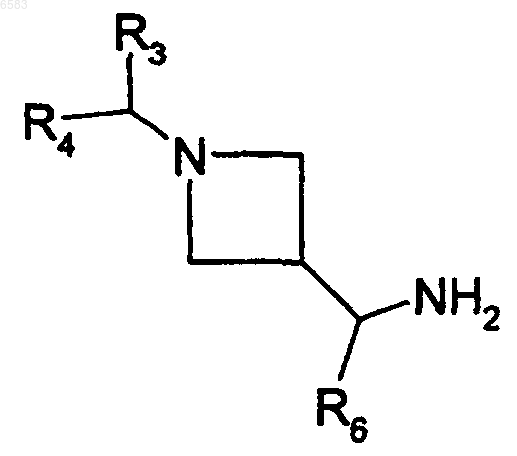
в которой R3, R4 и R6 имеют такие же значения, как в п.1, вводят во взаимодействие с производным alkNCO, в котором alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
32. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NHCOAlk, отличающийся тем, что производное формулы
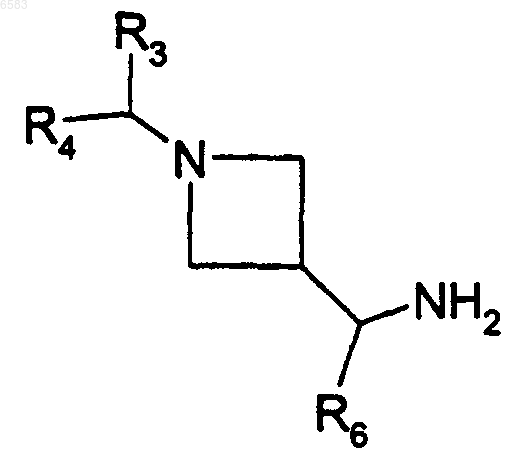
в которой R3, R4 и R6 имеют такие же значения, как в п.1, вводят во взаимодействие с производным AlkCOOH, продукт выделяют и, в случае необходимости, его превращают в соль с неорганической или органической кислотой.
33. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH2-C(=NOalk)R6, отличающийся тем, что производное формулы
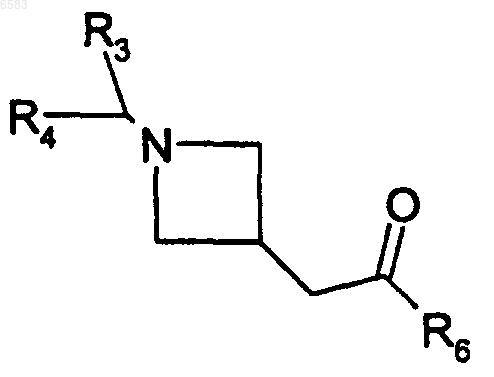
в которой R3 и R4 имеют такие же значения, как в п.1, вводят во взаимодействие с производным формулы alkONH2, в котором alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
34. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает цианогруппу и R2 означает радикал -C(R8)(R11)(R12), в котором R8 означает атом водорода, отличающийся тем, что производное формулы
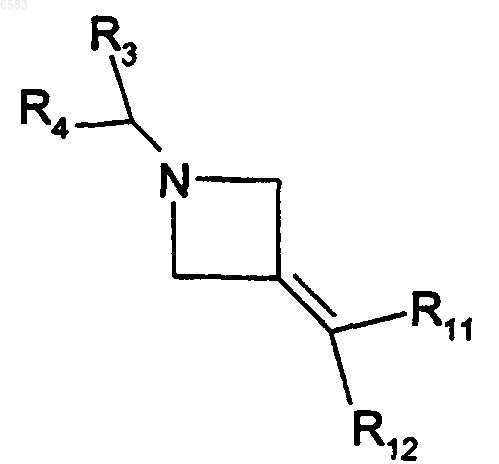
в которой R3, R4, R11 и R12 имеют такие же значения, как в п.1, вводят во взаимодействие с цианидом натрия, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
35. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает радикал -S-alk-NR16R17 и R2 означает радикал -C(R8)(R11)(R12), в котором R8 означает атом водорода, отличающийся тем, что производное формулы
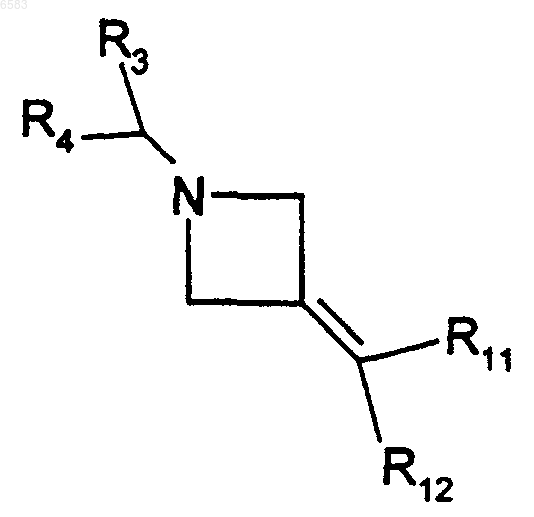
в которой R3, R4, R11 и R12 имеют такие же значения, как в п.1, вводят во взаимодействие с производным HS-alk-NR16R17, в котором alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи) и R16 и R17 имеют такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
36. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает радикал -NHR15 и R2 означает радикал -C(R8)(R11)(R12), в котором R8 означает атом водорода, отличающийся тем, что производное формулы
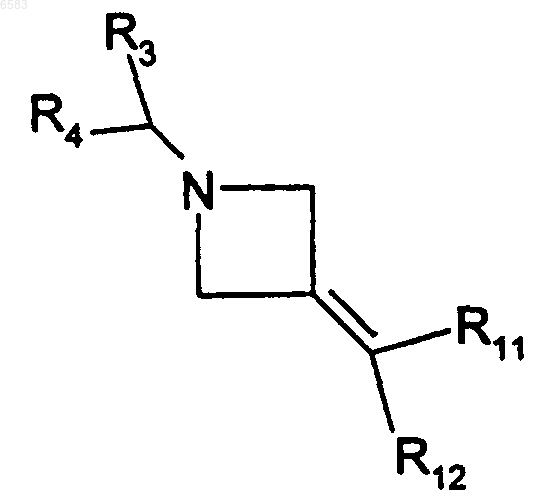
в которой R3, R4, R11 и R12 имеют такие же значения, как в п.1, вводят во взаимодействие с производным H2NR15, в котором R15 имеет такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
37. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает алкил и R2 означает радикал -C(R8)(R11)(R12), в котором R8 означает атом водорода, отличающийся тем, что производное формулы
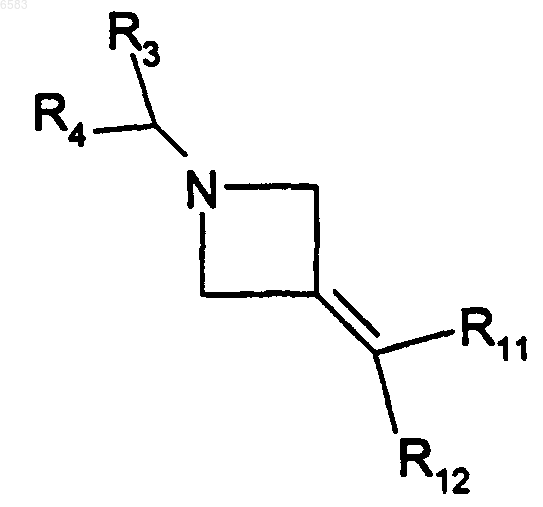
в которой R3, R4, R11 и R12 имеют такие же значения, как в п.1, вводят во взаимодействие с производным alkMHal, в котором alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи) и M означает металл, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
38. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает радикал -NR20R21 и R2 означает радикал -C(R8)(R11)(R12), в котором R8 означает атом водорода, отличающийся тем, что производное формулы
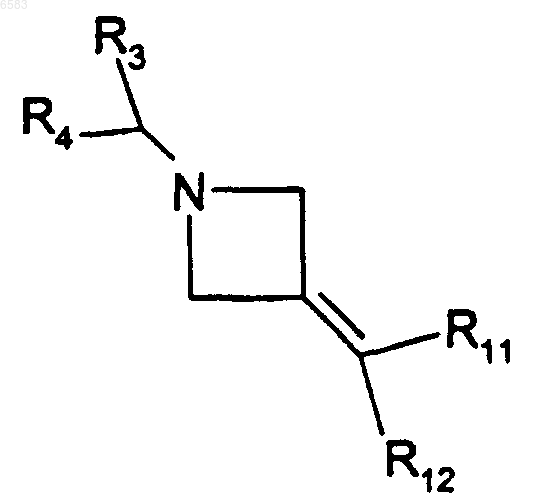
в которой R3, R4, R11 и R12 имеют такие же значения, как в п.1, вводят во взаимодействие с производным HNR20R21, в котором NR20R21 имеет такие же значения, как в п.1, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
39. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает радикал -CH2-NR18R19, R18 и R19 означают атомы водорода, отличающийся тем, что восстанавливают соответствующее соединение формулы (I), в котором R1 означает цианогруппу, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
40. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает радикал -CH2-NR18R19, R18 означает атом водорода и R19 означает алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk, отличающийся тем, что галогенид HalR19, Hal означает галоген, вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает радикал -alk-NR18R19, R18 и R19 означают атом водорода, продукт выделяют и в случрх необходимости его превращают в соль с неорганической или органической кислотой.
41. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает радикал -alk-NR18R19, R18 означает алкил и R19 означает алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk, отличающийся тем, что алкилгалогенид вводят во взаимодействие с соответствующим соединением формулы (I), в котором R означает радикал CR1R2, где R1 означает радикал -alk-NR18R19, R18 означает атом водорода и R19 означает алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
42. Способ получения соединений формулы (I) по п.1, в которых R означает радикал
-C=C(R7)SO2alk, отличающийся тем, что окисляют производное формулы
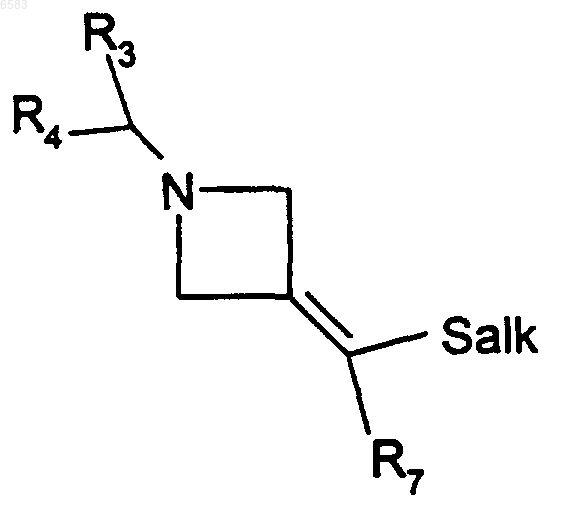
в которой R3, R4 и R7 имеют такие же значения, как и в п.1, и alk означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи), продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
43. Способ получения соединений формулы (I) по п.1, в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, R31 означает атом водорода и R32 означает алкил, отличающийся тем, что соответствующее соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CO-R6, вводят во взаимодействие с амином HNR31R32, в котором R31 означает атом водорода и R32 означает алкил, продукт выделяют и в случае необходимости его превращают в соль с неорганической или органической кислотой.
44. Фармацевтическая композиция для лечения и профилактики расстройств, затрагивающих центральную нервную систему, иммунную систему, сердечно-сосудистую систему, эндокринную систему, дыхательную систему, органы желудочно-кишечного тракта, и расстройств репродуктивной функции, содержащая в качестве действующего начала по меньшей мере одно соединение формулы (I) по любому из пп.1-9.
Текст
006583 Настоящее изобретение относится к производным формулы (I) их солям, их получению и содержащим их лекарственным средствам. В формуле (I)R означает радикал CR1R2, C=C(R5)SO2R6 или С=С(R7)SO2alk; причем либо R1 означает атом водорода и R2 означает радикал -C(R8)(R9)(R10), -С(R8)(R11)(R12), -CO-NR13R14, -CH2-CO-NR13R14, -CH2-CO-R6,-CO-R6, -СО-циклоалкил, -SO-R6, -SO2-R6, -С(ОН)(R12)(R6), -С(ОН)(R6)(алкил), -С(=NOalk)R6, -C(=NOCH2-CH=CH2)R6,-CH2-CH(R6)NR31R32,-CH2-C(=NOalk)R6,-CH(R6)N31N32,-CH(R6)NHSO2alk,-CH(R6)NHCONHalk или -CH(R6)NHCOalk; либо R1 означает алкил, NH-R15, цианогруппу, -S-alk-NR16, R17, -CH2-NR18R19 или -NR20R21 и R2 означает радикал -C(R8)(R11)(R12);R3 и R4, одинаковые или разные, означают либо алкил или циклоалкил; либо ароматический радикал, выбираемый среди фенила, нафтила или инденила, причем эти ароматические радикалы незамещены или замещены одним или несколькими атомами галогена, алкильными, алкоксильными, формильными,гидроксильными, трифторметильными группами, трифторметоксигруппами, группами -CO-alk, цианогруппами, группами -СООН, -COOalk, -CONR22R23, -CO-NH-NR24R25, алкилсульфанильными, алкилсульфинильными, алкилсульфонильными, алкилсульфанилалкильными, алкилсульфинилалкильными,алкилсульфонилалкильными, гидроксиалкильными группами или группами -alk-NR24R25; либо гетероароматический радикал, выбираемый среди бензофурильного, бензотиазолильного, бензотиенильного,бензоксазолильного, хроманильного, 2,3-дигидробензофурильного, 2,3-дигидробензотиенильного, фурильного, имидазолильного, изохроманильного, изохинолильного, пирролильного, пиридильного, пиримидинильного, хинолильного, 1,2,3,4-тетрагидроизохинолильного, тиазолильного, тиенильного циклов,причем эти гетероароматические радикалы могут быть незамещены или замещены одним или несколькими атомами галогена, алкильными, алкоксильными, гидроксильными, трифторметильными группами,трифторметоксигруппами, цианогруппами, группами -СООН, -COOalk, -CO-NH-NR24R25, -CONR22R23,-alk-NR24R25, алкилсульфанильными, алкилсульфинильными, алкилсульфонильными, алкилсульфанилалкильными, алкилсульфинилалкильными, алкилсульфонилалкильными или гидроксиалкильными группами;R5 означает атом водорода или алкил;R8 означает атом водорода или алкил;R12 означает атом водорода или радикал Аr или Het;R13 означает атом водорода или алкил;R16 и R17, одинаковые или разные, означают атом водорода или алкил, или же R16 и R17 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моноили бигетероцикл, возможно содержащий один или несколько других гетероатомов, выбираемых среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами;R18 означает атом водорода или алкил;R19 означает атом водорода или алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил,-SO2alk, -CO-NHalk или -COOalk; или же R18 и R19 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий один или несколько гетероатомов, выбираемых среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами;-NR20R21 означает насыщенный или ненасыщенный 3-8-членный моногетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, азота и серы;R22 и R23, одинаковые или разные, означают атом водорода или алкил, или же R22 и R23 вместе с атомом азота, с которым они связаны, образуют насыщенный 3-10-членный моно- или бигетероцикл,-1 006583 возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами;R24 и R25, одинаковые или разные, означают атом водорода или алкил, -COOalk, циклоалкил, алкилциклоалкил, -alk-O-alk, гидроксиалкил, или же R24 и R25 вместе с атомом азота, с которым они связаны,образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами, радикалами -COalk, -COOalk, -CO-NHalk, -CS-NHalk,оксогруппами, гидроксиалкильными радикалами, радикалами -alk-O-alk, -CO-NH2;R26 и R27, одинаковые или разные, означают атом водорода или алкил, гидроксиалкил, циклоалкил,циклоалкилалкил, -alk-COO-alk, -alk-Ar, -alk-Het, Het, -alk-N(alk)2; R26 и R27 с атомом азота, с которым они связаны, также могут образовывать ненасыщенный или насыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий один или несколько других гетероатомов, выбираемых среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными, алкоксильными радикалами, атомами галогена;R29 и R30, одинаковые или разные, означают атом водорода или алкил, или же R29 и R30 вместе с атомом азота, с которым они связаны, образуют насыщенный 3-10-членный моно- или бигетероцикл,возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами;R31 и R32, одинаковые или разные, означают атом водорода или алкил, Ar или -alk-Ar, или же R31 иalk означает алкильный или алкиленовый радикал;Ar означает фенил или нафтил, возможно замещенный одним или несколькими заместителями, выбираемыми среди атома галогена, алкила, алкоксила, -CO-alk, цианогруппы, -СООН, -COOalk,-CONR22R23, -CO-NH-NR24R25, алкилсульфанила, алкилсульфинила, алкилсульфонила, алкилсульфанилалкила, алкилсульфинилалкила, алкилсульфонилалкила, гидроксиалкила, -alk-NR24R25, -NR24R25, алкилтиоалкила, формила, гидроксила, СF3, ОСF3, Het, -O-alk-NH-циклоалкила или SO2NH2;Het означает ненасыщенный или насыщенный 3-10-членный моно- или бигетероцикл, содержащий один или несколько гетероатомов, выбираемых среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими атомами галогена, алкильными, алкоксильными, алкоксикарбонильными группами, группами -CONR22R23, гидроксильными, гидроксиалкильными группами, оксогруппами или группами SO2NH2. В вышеприведенных и нижеследующих определениях, за исключением противоположного указания, алкильные и алкиленовые радикалы и части и алкоксильные радикалы и части имеют линейную или разветвленную цепь и содержат 1-6 атомов углерода; циклоалкильные радикалы содержат 3-10 атомов углерода и гетероциклоалкильные и гетероцикленильные радикалы содержат 3-10 атомов углерода. Из алкильных радикалов можно назвать метил, этил, н-пропил, изопропил, н-бутил, втор-бутил,изобутил, трет-бутил, пентил, гексил. Из алкоксильных радикалов можно назвать метокси-, этокси-, нпропокси-, изопропокси-, н-бутокси-, изобутокси-, втор-бутокси-, трет-бутокси-, пентилокси-радикал. Из циклоалкильных радикалов можно назвать циклопропил, циклобутил, циклопентил, циклогексил. Гетероциклоалкильными радикалами являются циклоалкильные радикалы, в которых по меньшей мере один из атомов углерода заменен гетероатомом, выбираемым среди атомов азота, серы и кислорода. Из этих радикалов можно назвать пирролидинильный, имидазолидинильный, пиразолидинильный, пиперидильный, пиперазинильный, морфолинильный циклы. Гетероцикленильными радикалами являются циклоалкильные радикалы, в которых по меньшей мере один атом углерода заменен гетероатомом, выбираемым среди атомов кислорода, серы и азота, и которые содержат по меньшей мере одну двойную углерод-углеродную или углерод-азотную связь. Из гетероцикленильных радикалов можно назвать 1,2,3,4-тетрагидропиридинильные, 3,6-дигидропиридильные, 1,2-дигидропиридильные, 1,4-дигидропиридильные, 1,2,3,6-тетрагидропиридинильные,1,4,5,6-тетрагидропиримидинильные, 2-пирролинильные, 3-пирролинильные, 2-имидазолинильные, 2 пиразолинильные, 3,4-дигидро-2 Н-пирановые, дигидрофуранильные и фтордигидрофуранильные циклы. Предпочтительны 3,6-дигидропиридильные циклы. Под термином "галоген" понимают хлор, фтор, бром и иод. Из означающих Het гетероциклов можно назвать следующие гетероциклы: бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил,2,3-дигидробензофурил, 2,3-дигидробензотиенил, фурил, индолинил, индолил, изохроманил, изохинолил, пиперидил, пирролил, пиридил, пиримидинил, хинолил, 1,2,3,4-тетрагидроизохинолил, 1,2,3,4 тетрагидрохинолил, тиазолил, тиенил.-2 006583 Когда R3 и/или R4 независимо означают замещенный фенил, то он предпочтительно является моно-,ди- или тризамещенным. Когда R16 и R17 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Когда R18 и R19 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Образованный с NR20R21 гетероцикл представляет собой предпочтительно азетидинил, пирролидинил, пиперидинил, морфолинил, тиаморфолинил, пиперазинил или имидазолил. Когда R22 и R23 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Когда R24 и R25 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Когда R26 и R27 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Когда R29 и R30 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Когда R31 и R32 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, то он предпочтительно представляет собой азетидинильный, пирролидинильный, пиперидинильный, морфолинильный, тиаморфолинильный или пиперазинильный цикл. Предпочтительно, R означает радикал CR1R2, причем либо R1 означает атом водорода и R2 означает радикал -C(R8)(R11)(R12) или C(R8)(R9)(R10); либо R1 означает алкил и R2 означает радикалR3 и R4, одинаковые или разные, означают либо фенил, незамещенный или замещенный одним или несколькими атомами галогена, алкильными, алкоксильными, трифторметильными группами, трифторметоксигруппами, цианогруппами, группами -CONR22R23, гидроксиалкильными группами или группами-alk-NR24R25; либо гетероароматический радикал, выбираемый среди пиридильного, пиримидинильного,тиазолильного, тиенильного циклов, причем эти гетероароматические радикалы могут быть незамещены или замещены одним или несколькими атомами галогена, алкильными, алкоксильными, гидроксильными, трифторметильными группами, трифторметоксигруппами, цианогруппами, группами -CONR22R23,-alk-NR24R25 или гидроксиалкильными группами;R12 означает атом водорода или радикал Ar или Het;R22 и R23, одинаковые или разные, означают атом водорода или алкил, или же R22 и R23 вместе с атомом азота, с которым они связаны, образуют насыщенный 3-10-членный моно- или бигетероцикл,возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами;R24 и R25, одинаковые или разные, означают атом водорода или алкил, циклоалкил, алкилциклоалкил, гидроксиалкил, или же R24 и R25 вместе с атомом азота, с которым они связаны, образуют насыщенный или ненасыщенный 3-10-членный моно- или бигетероцикл, возможно содержащий другой гетероатом, выбираемый среди атомов кислорода, серы и азота, и возможно замещенный одним или несколькими алкильными радикалами, радикалами -COalk, -COOalk, -CO-NHalk, -CS-NHalk, оксогруппами, группами -CO-NH2;Ar означает фенил или нафтил, возможно замещенный 1 или 2 заместителями, выбираемыми среди атома галогена, алкила, алкоксила, -CO-alk, цианогруппы, -COOalk, -CONR22R23, алкилсульфонила, гидроксиалкила, -alk-NR24R25, -NR24R25, гидроксила, СF3, ОСF3, -O-alk-NH-циклоалкила или SO2NH2;Het означает бензофурильный, бензотиазолильный, бензотиенильный, бензоксазолильный, фурильный, изохинолильный, пирролильный, пиридильный, хинолильный, 1,2,3,4-тетрагидроизохинолильный,1,2,3,4-тетрагидрохинолильный, тиазолильный или тиенильный цикл. Соединения формулы (I) могут находиться в форме энантиомеров и диастереоизомеров. Эти оптические изомеры и их смеси составляют часть изобретения. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R11)(R12), в котором R8 означает атом водорода, R11 означает радикал -SO2-Ar,-SO2-Het или -SO2alk и R12 означает атом водорода или радикал Ar или Het, и соединения формулы (I), в которых R означает радикал -С=С(R5)SO2R6 или -С=С(R7)SO2alk, могут быть получены согласно следующей реакционной схеме: причем в этих формулах либо Ra означает алкил, Het или Ar и Rb означает атом водорода или радикал Ar или Het, либо Ra означает радикал Ar или Het и Rb означает атом водорода или алкил, либо Ra означает алкил и Rb означает циклоалкил, гетероциклоалкил или гетероцикленил, возможно замещенный-СSО-фенилом, Rc означает атом водорода или ацетил, R3, R4, Ar и Het имеют такие же значения, как и указанные в случае формулы (I). Реакции "d" и "е" могут быть осуществлены только тогда, когда Rb означает атом водорода. Реакцию "а" обычно проводят в инертном растворителе, таком как простой эфир (например, тетрагидрофуран), в присутствии сильного основания, такого как трет-бутиллитий, н-бутиллитий, диизопропиламид лития, трет-бутилат калия, при температуре от -70 до -15 С. Реакцию дегидратации "b" обычно осуществляют любым, известным специалисту способом дегидратации, позволяющим дегидратировать спирт для получения соответствующего алкена. Предпочтительно, ацетилоксипроизводное получают путем воздействия ацетилхлорида в инертном растворителе,таком как пиридин, тетрагидрофуран, диоксан, хлорированный растворитель (например, дихлорметан,хлороформ), при температуре от 5 до 20 С, затем обрабатывают с помощью основания, такого как гид-4 006583 роксид щелочного металла (например, гидроксид натрия), карбонат щелочного металла (например, карбонат натрия или калия), амин, такой как триалкиламин (например, триэтиламин), 4-диметиламинопиридин, диаза-1,8-бицикло[5,4,0]ундец-7-ен, при температуре от 0 С до температуры кипения реакционной среды. Промежуточное ацетилоксипроизводное может быть выделено или нет. Ацетилоксипроизводное также может быть получено прямо в реакционной среде реакции "а". Восстановление "с" обычно осуществляют в инертном растворителе, таком как алифатический спирт (с 1-4 атомами углерода) (например, метанол), хлорированный растворитель (например, хлороформ, дихлорметан) или смесь этих растворителей, в присутствии NaBH4, при температуре от 0 С до температуры кипения реакционной среды. Реакцию "d" осуществляют путем воздействия триметилсилилхлорида в инертном растворителе,таком, как простой эфир (например, тетрагидрофуран), в присутствии н-бутиллития, при температуре-70 С. Реакцию "е" обычно проводят в инертном растворителе, таком, как простой эфир (например, тетрагидрофуран), в присутствии сильного основания, такого как трет-бутиллитий, н-бутиллитий, диизопропиламид лития, трет-бутилат калия, при температуре от -70 до -15 С. Реакцию "f" обычно проводят в хлорированном растворителе (например, дихлорметан, хлороформ),при температуре от 0 С до температуры кипения реакционной среды. Гидролиз "g" осуществляют в инертном растворителе, таком как простой эфир (например, диоксан),с помощью соляной кислоты, при температуре около 20 С. Реакции "h" и "j" предпочтительно проводят в инертном растворителе, таком, как ацетонитрил, в присутствии основания, такого как карбонат щелочного металла (например, карбонат калия), при температуре кипения реакционной среды. Реакцию "i" осуществляют в атмосфере водорода, в присутствии катализатора, такого, как палладий или его производные, в инертном растворителе, таком как метанол или этанол, при температуре от 15 С до 60 С. Реакцию "k" проводят в инертном растворителе, таком как хлорированный растворитель (например,дихлорметан, хлороформ), при температуре от 0 С до температуры кипения реакционной смеси. Производные R3 СН(Вr)R4 имеются в продаже или могут быть получены при применении или адаптации способа, описанного W.E. BACHMANN, J. Am. Chem. Soc., 2135 (1933). Обычно соответствующий спирт R3 СНОНR4 бромируют с помощью бромоводородной кислоты в уксусной кислоте при температуре от 0 С до температуры кипения реакционной среды. Соответствующие спирты R3 СНОНR4 имеются в продаже или могут быть получены при применении или адаптации способов, описанных A.C.PLASZ и др., J. Chem. Soc. Chem. Comm., 527 (1972). Промежуточные продукты формулы 2 могут быть получены при применении или адаптации способов, описанных в примерах. В частности, поступают согласно следующим реакционным схемам: причем в этих формулах Hal означает атом галогена и, предпочтительно, атом хлора, брома или иода; Ra и Rb имеют такие же значения, как и указанные выше для производного 2. Реакцию "а" обычно проводят в инертном растворителе, таком как диметилформамид или алифатический спирт с 1-4 атомами углерода, при температуре от 20 до 30 С. Реакции "b" и "е" осуществляют любыми известными способами, позволяющими окислять серосодержащее производное, не затрагивая остальной части молекулы, как способы, описанные М.HUDLICKY, Oxidations in Organic Chemistry, ACS Monograph, 186, 252-263 (1990). Поступают, например,путем воздействия органической надкислоты или соли такой надкислоты (надкарбоновые кислоты или надсульфокислоты, в частности, надбензойная кислота, 3-хлорнадбензойная кислота, 4 нитронадбензойная кислота, надуксусная кислота, трифторнадуксусная кислота, надмуравьиная кислота,мононадфталевая кислота) или неорганических надкислот или соли такой кислоты (например, надиодная-5 006583 кислота или надсерная кислота), в инертном растворителе, таком как хлорированный растворитель (например, хлороформ, дихлорметан), при температуре от 0 до 25 С. Можно также использовать пероксид водорода, в случае необходимости, в присутствии оксида металла (вольфрамат натрия) или периодата(например, периодат натрия), в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, метанол, этанол), уксусная кислота, вода или смесь этих растворителей, при температуре от 0 до 60 С. Также можно воздействовать с помощью трет-бутилгидропероксида в присутствии тетраизопропилата титана в алифатическом спирте с 1-4 атомами углерода (например, метаноле, этаноле) или смеси воды со спиртом, при температуре около 25 С, или с помощью оксонаR (пероксимоносульфат калия) в алифатическом спирте с 1-4 атомами углерода (например, метаноле, этаноле), в присутствии воды, уксусной кислоты или серной кислоты, при температуре около 20 С. Реакцию "с" предпочтительно проводят в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, метанол, этанол), при температуре от 20 С до температуры кипения реакционной среды. Реакцию "d" осуществляют в инертной атмосфере (аргон), при температуре от 50 С до температуры кипения реакционной среды. Реакцию "f" обычно проводят в инертном растворителе, таком как тетрагидрофуран или простой алифатический эфир (например, диэтиловый эфир), при температуре около -70 С. Реакцию "g" обычно осуществляют в инертном растворителе, таком, как диметилформамид, простой алифатический эфир (например, диэтиловый эфир) или алифатический спирт с 1-4 атомами углерода, в присутствии основания (например, гидрида натрия), при температуре от 0 С до 60 С. Производные формулы Rb-CH2-Hal имеются в продаже или могут быть получены при применении или адаптации описанных в примерах способов. В частности, метильное производное или соответствующий спирт галогенируют с помощью галогенирующего агента, такого как бромоводородная кислота,в уксусной кислоте, при температуре около 20 С, или N-бром- или N-хлорсукцинимида в присутствии бензоилпероксида в инертном растворителе, таком как тетрахлорметан, при температуре кипения реакционной среды. Метильные производные или соответствующие спирты имеются в продаже или могут быть получены согласно способам, описанным G.A. BRINE и др., J. Heterocycl. Chem., 26, 677 (1989), иD. NAGARATHNAM, Synthesis, 8, 743 (1992), и в примерах. Азетидиноны формулы 3 могут быть получены при применении или адаптации способов, описанных A.R. KATRITZKY и др., J. Heterocycl. Chem., 271 (1994), или P.R. DAVE, J. Org. Chem., 61, 5453(1996), и в примерах. Обычно поступают согласно следующей реакционной схеме: причем в этих формулах R3 и R4 имеют такие же значения, как и в случае формулы (I), и Hal означает атом хлора или брома. На стадии А предпочтительно работают в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, этанол, метанол), в случае необходимости, в присутствии гидроксида щелочного металла, при температуре кипения реакционной среды. На стадии В восстановление обычно осуществляют с помощью литий-алюминийгидрида в тетрагидрофуране при температуре кипения реакционной среды. На стадии С предпочтительно работают в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, этанол, метанол), в присутствии гидрокарбоната натрия, при температуре от 20 С до температуры кипения реакционной среды. На стадии D окисление осуществляют предпочтительно в диметилсульфоксиде с помощью комплекса триоксида серы с пиридином при температуре около 20 С или с помощью диметилсульфоксида в присутствии оксалилхлорида и триэтиламина при температуре от -70 до -50 С.-6 006583 На стадии Е работают согласно способу, описанному М. GRISAR и др. в J. Med. Chem., 885 (1973). Получают магнийбромпроизводное, затем вводят во взаимодействие с нитрилом в простом эфире, таком как диэтиловый эфир, при температуре от 0 С до температуры кипения реакционной среды. Затем гидролизуют с помощью спирта, промежуточный имин восстанавливают in situ с помощью боргидрида натрия при температуре от 0 С до температуры кипения реакционной среды. Производные R3-CO-R4 имеются в продаже или могут быть получены при применении или адаптации способов, описанных N.G. KUNDER и др., J. Chem. Soc. Perkin Trans, 1, 2815 (1997); М. MORENOMARRAS, Eur. J. Med. Chem., 23 (5), 477 (1988); SKINNER и др., J. Med. Chem., 14 (6), 546 (1971); N.K.HURN, Tet. Lett., 36 (52), 9453 (1995); A. MEDICI и др., Tet. Lett., 24 (28), 2901 (1983); R.D. RIECKE и др.,J. Org. Chem., 62 (20), 6921 (1997); J. KNABE и др Arch. Pharm., 306 (9), 648 (1973); R. CONSONNI и др.,J. Chem. Soc. Perkin Trans, 1, 1809 (1996); патент Франции FR-96-2481 и патент Японии JP-94-261393. Производные R3Br имеются в продаже или могут быть получены при применении или адаптации способов, описанных L. BRANDSMA и др., Synth. Comm., 20 (11), 1697 и 3153 (1990); M. LEMAIRE и др., Synth. Comm., 24 (1), 95 (1994); H. GODA и др Synthesis, 9, 849 (1992); P. BAEUERLE и др., J. Chem.Soc. Perkin Trans., 2, 489 (1993). Производные R4CN имеются в продаже или могут быть получены при применении или адаптации способов, описанных Р. BOUYSSOU и др., J. Het. Chem., 29 (4), 895 (1992); N. SUZUKI и др., J. Chem.Chem., 60 (21), 6895 (1995). Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал C(R8)(R9)(R10), в котором R8 означает атом водорода, R9 означает радикал -CO-NR26R27,-СООН, -COOalk, -CH2OH, -NHCOOalk или -NH-CO-NH-alk и R10 означает радикал Ar или Het, могут быть получены согласно следующей реакционной схеме:-7 006583 причем в этих формулах R3, R4, R10, R26 и R27 имеют такие же значения, как и в случае формулы (I),и alk означает алкил. Производные формулы 4 имеются в продаже или могут быть получены путем этерификации соответствующих кислот, в случае необходимости, в активированной форме, такой как хлорангидрид кислоты. Кислоты имеются в продаже или могут быть получены из соответствующих метильных производных по способу, описанному JP. HANSEN и др., J. Heterocycl., 10, 711 (1973). Реакцию "а" обычно проводят в инертном растворителе, таком как простой эфир (например, тетрагидрофуран), в присутствии сильного основания, такого как трет-бутиллитий, н-бутиллитий, диизопропиламид лития, трет-бутилат калия, при температуре от -70 до -15 С. Реакцию "b" обычно осуществляют любым, известным специалисту способом дегидратации, позволяющим дегидратировать спирт для получения соответствующего алкена и, в частности, вышеописанными способами. Восстановление "с" обычно осуществляют в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода, такой как метанол, хлорированный растворитель, такой как хлороформ,дихлорметан, или смесь этих растворителей в присутствии NaBH4 при температуре от 0 С до температуры кипения реакционной среды. Реакцию "d" осуществляют любым известным специалисту способом, позволяющим переходить от сложного эфира к соответствующей кислоте, не затрагивая остальной части молекулы. Работают предпочтительно в инертном растворителе, таком как диоксан, в присутствии соляной кислоты при температуре кипения реакционной среды. Реакцию "е" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы. Когда используют кислоту, предпочтительно работают в присутствии применяемого в химии пептидов конденсирующего средства, такого как карбодиимид (например, N,N'-дициклогексилкарбодиимид) или карбонил-N,N'-диимидазол, в инертном растворителе, таком как простой эфир(например, тетрагидрофуран, диоксан), амид (диметилформамид) или хлорированный растворитель (например, дихлорметан, 1,2-дихлорэтан, хлороформ), при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси. Когда используют реакционноспособное производное кислоты, можно вводить во взаимодействие ангидрид, смешанный ангидрид или сложный эфир (который может быть выбран среди активированных или нет эфиров кислоты); тогда работают в органической среде, в случае необходимости, в присутствии акцептора кислоты, такого как органическое азотсодержащее основание (например, триалкиламин, пиридин, 1,8-диазабицикло [5,4,0]ундец-7-ен или 1,5 диазабицикло[4,3,0]нон-5-ен), в растворителе, таком как указанный выше, или в смеси этих растворителей, при температуре от 0 С до температуры кипения с обратным холодильником реакционной смеси,либо в двухфазной водно-органической среде в присутствии щелочного или щелочно-земельного основания (гидроксид натрия, гидроксид калия) или карбоната или гидрокарбоната щелочного или щелочноземельного металла, при температуре от 0 С до 40 С. Реакцию "f" осуществляют путем перегруппировки Курциуса в присутствии дифенилфосфоразида и триэтиламина, в толуоле, при температуре около 50 С. В случае реакций "g" и "h" работают непосредственно в реакционной среде стадии "g" при температуре около 20 С. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -C(R8)(R9)(R10), в котором R8 означает атом водорода, R9 означает радикал -CH2-NHR28 и R10 означает радикал Ar или Het, могут быть получены согласно следующей реакционной схеме:-8 006583 В этих формулах R3, R4 и R10 имеют такие же значения, как и в случае формулы (I); Rd означает алкил или фенил; Re означает алкил; Rf означает алкил; Rg означает алкил, циклоалкилалкил, циклоалкил,-(СН 2)nОН, n равно 1, 2, 3. Стадию "а" обычно осуществляют в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода (например, метанол), хлорированный растворитель (например, дихлорметан, дихлорэтан) или тетрагидрофуран, в присутствии основания, такого как NaBH(ОСОСН 3)3, при температуре около 20 С. Стадию "b" обычно осуществляют в инертном растворителе, таком как галогенированный растворитель (например, дихлорметан), в присутствии органического основания, такого как триэтиламин, диметиламинопиридин, при температуре от 0 С до температуры кипения реакционной среды. Стадию "с" обычно осуществляют в инертном растворителе, таком как тетрагидрофуран, диметилформамид, хлорированный растворитель (например, хлороформ, 1,2-дихлорэтан), ароматический растворитель (например, бензол, толуол), при температуре от 10 С до температуры кипения реакционной среды. Стадию "d" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Производные 6 могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4 и R10 имеют такие же значения, как и в случае формулы (I), и Ms означает метилсульфонилоксигруппу. Стадию "а" обычно осуществляют в инертном растворителе, таком как тетрагидрофуран, в присутствии триэтиламина, при температуре от 10 до 20 С. Стадию "b" обычно осуществляют с жидким гидроксидом аммония в метаноле, в автоклаве при температуре около 60 С. Соединения формулы (I), в которой R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CONR13R14, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4, R13 и R14 имеют такие же значения, как и в случае формулы (I), Ms означает метилсульфонилоксигруппу и Et означает этил. Стадию "а" осуществляют в присутствии триэтиламина, в инертном растворителе, таком как простой эфир (например, тетрагидрофуран) при температуре около 0 С. Стадию "b" обычно осуществляют в инертном растворителе, таком как смесь воды и диметилформамида, при температуре от 30 до 75 С.-9 006583 Стадию "с" осуществляют любым, известным специалисту способом, позволяющим переходить от нитрила к соответствующей кислоте, не затрагивая остальной части молекулы. Предпочтительно работают с помощью гидроксида калия в алифатическом спирте с 1-4 атомами углерода (как, например, этанол) или в водной среде, при температуре кипения реакционной среды. Стадию "d" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH2-CONR13R14, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4, R13 и R14 имеют такие же значения, как и в случае формулы (I), и Et означает этил. Реакцию "а" обычно проводят в инертном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как гидрид натрия или карбонат щелочного металла (например, карбонат калия), при температуре от 20 С до температуры кипения реакционной среды. Реакцию "b" обычно осуществляют с помощью NaBH4, в этаноле, при температуре около 0 С. Реакцию "с" осуществляют любым, известным специалисту способом, позволяющим переходить от сложного эфира к соответствующей кислоте, не затрагивая остальной части молекулы. Предпочтительно работают в инертном растворителе, таком как диоксан, в присутствии соляной кислоты при температуре кипения реакционной среды. Реакцию "d" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Промежуточные продукты 7 также могут быть получены путем малонового синтеза согласно следующей реакционной схеме: В этих формулах Ms означает метилсульфонилоксигруппу; R3 и R4 имеют такие же значения, как и в случае формулы (I). Реакцию "а" обычно осуществляют путем воздействия диэтилмалоната в инертном растворителе,таком как тетрагидрофуран, в присутствии свежеприготовленного этилата натрия при температуре кипения реакционной среды. Реакцию "b" обычно проводят в водном растворе соляной кислоты при температуре кипения реакционной среды. Соединения In также могут быть получены согласно следующей реакционной схеме:- 10006583 В этих формулах R3, R4, R13 и R14 имеют такие же значения, как и в случае формулы (I). Стадию "а" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Стадию "b" обычно осуществляют в инертном растворителе, таком как тетрагидрофуран, в присутствии основания, такого как гидрид натрия или карбонат калия, при температуре от 20 С до температуры кипения реакционной смеси. Восстановление в случае стадии "с" обычно осуществляют с помощью NaBH4 в этаноле при температуре около 20 С. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -SOR6 или -SO2R6, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4 и R6 имеют такие же значения, как и в случае формулы (I), и Ms означает метилсульфонилоксигруппу. Стадию "а" обычно осуществляют в инертном растворителе, таком как тетрагидрофуран, в присутствии неорганического основания, такого как гидрид натрия, при температуре от 0 С до температуры кипения реакционной среды. Стадию "b" обычно осуществляют любым, известным специалисту способом окисления серосодержащего производного, как способы, описанные М. HUDLICKY, Oxidations in Organic Chemistry, ACSMonograph, 186, 252-263 (1990). Работают, например, путем воздействия органической надкислоты или соли такой надкислоты (надкарбоновые кислоты или надсульфокислоты, в частности, надбензойная кислота, 3-хлорнадбензойная кислота, 4-нитронадбензойная кислота, надуксусная кислота, трифторнадуксусная кислота, надмуравьиная кислота, мононадфталевая кислота) или неорганических надкислот или соли такой кислоты (например, йодная кислота или надсерная кислота), в инертном растворителе, таком как хлорированный растворитель (например, хлороформ, дихлорметан), при температуре от 0 С до 25 С,или же с помощью оксона в смеси воды со спиртом (метанолом, этанолом). Стадию "с" обычно осуществляют любым, известным специалисту способом окисления сульфинильного производного. Предпочтительно работают путем воздействия органической надкислоты или соли такой надкислоты (надкарбоновые кислоты или надсульфокислоты, в частности, надбензойная кислота, 3-хлорнадбензойная кислота, 4-нитронадбензойная кислота, надуксусная кислота, трифторнадуксусная кислота, надмуравьиная кислота, мононадфталевая кислота), или же с помощью оксона в смеси воды со спиртом (метанолом, этанолом). Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -COR6 или -СО-циклоалкил, могут быть получены согласно следующей реакционной схеме:- 11006583 В этих формулах R3 и R4 имеют такие же значения, как и в случае формулы (I) , и Rh имеет такие же значения, как и R6, или означает циклоалкил с 3-10 атомами углерода. Стадию "а" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Стадию "b" обычно осуществляют в инертном растворителе, таком как простой эфир, как тетрагидрофуран, при температуре около 0 С. Магнийорганические соединения получают известными специалисту способами, такими как способы, описанные в примерах. Соединения формулы (I), в которых R1 означает атом водорода и R2 означает радикал-С(ОН)(R6)(R12), -С(ОН)(R6)(алкил), -C(=NO-СН 2-СН=СН 2)R6 или -С(=NOalk)R6, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4 и R6 имеют такие же значения, как и в случае формулы (I); Ri имеет такие же значения, как и R12, или означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи); и Rj означает алкил (с 1-6 атомами углерода в линейной или разветвленной цепи) или -СН 2-СН=СН 2. Стадию "а" обычно осуществляют в инертном растворителе, таком как алифатический спирт (например, этанол), в присутствии ацетата натрия, при температуре от 20 С до температуры кипения реакционной среды. Стадию "b" обычно осуществляют в инертном растворителе, таком как простой эфир, как тетрагидрофуран, при температуре около 0 С. Магнийорганические соединения получают известными специалисту способами, такими как способы, описанные в примерах. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, в котором R31 и R32 означают атомы водорода, -CH(R6)NHSO2alk,-СН(R6)NHCONHalk или -СН(R6)NHCOR31, могут быть получены согласно следующей реакционной схеме:- 12006583 В этих формулах R3, R4, R6 и R31 имеют такие же значения, как и в случае формулы (I); Ms означает метилсульфонилоксигруппу; alk означает алкил. Реакцию "а" обычно осуществляют с помощью NaBH4 в этаноле, при температуре около 20 С. Реакцию "b" осуществляют в присутствии триэтиламина в инертном растворителе, таком как простой эфир (например, тетрагидрофуран), при температуре около 0 С. Стадию "с" осуществляют с помощью жидкого гидроксида аммония в метаноле, в автоклаве, при температуре около 60 С. Стадию "d" обычно осуществляют в инертном растворителе, таком как галогенированный растворитель (например, дихлорметан) или тетрагидрофуран, в присутствии органического основания, такого как триэтиламин, диметиламинопиридин, при температуре около 20 С. Стадию "е" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Стадию "f" обычно осуществляют в инертном растворителе, таком как тетрагидрофуран, диметилформамид, хлорированный растворитель (например, хлороформ, дихлорэтан), ароматический растворитель (например, бензол, толуол), при температуре от 10 С до температуры кипения реакционной среды. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причем R31 означает атом водорода и R32 означает алкил, Ar или -alkAr, могут быть получены путем воздействия галогенида HalR31 на соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причемR31 и R32 означают атомы водорода. Эту реакцию проводят в инертном полярном растворителе, таком как ацетонитрил, тетрагидрофуран или диметилформамид, в присутствии органического или неорганического основания (например,карбонат щелочного металла (например, натрия, калия), триалкиламин (например, триэтиламин, диметиламинопиридин, при температуре от 0 С до температуры кипения растворителя, в случае необходимости, в присутствии палладия или одной из его солей или одного из его комплексов. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, причем R31 означает атом водорода и R32 означает алкил, могут быть получены путем воздействия соответствующего соединения формулы (I), в котором R означает радикалCR1R2, где R1 означает атом водорода и R2 означает радикал -CO-R6, на амин HNR31R32, в котором R31 означает атом водорода и R32 означает алкил. Эту реакцию обычно проводят в инертном растворителе, таком как хлорированный растворитель(например, дихлорметан, дихлорэтан), в присутствии восстановителя, такого как триацетоксиборгидрид натрия, при температуре от 0 С до 70 С. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, причем R31 и R32 означают алкильные радикалы, Ar или -alk-Ar, могут быть получены путем воздействия галогенида НаlR32 на соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH(R6)NR31R32, причем R31 означает атом водорода и R32 означает алкил, Ar или -alk-Ar. Эту реакцию проводят в инертном полярном растворителе, таком как ацетонитрил, тетрагидрофуран или диметилформамид, в присутствии органического или неорганического основания (например,карбонат щелочного металла (например, натрия, калия), триалкиламин (например, триэтиламин, диметиламинопиридин, при температуре от 0 С до температуры кипения растворителя, в случае необходимости, в присутствии палладия или одной из его солей или одного из его комплексов. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причем R31 означает атом водорода и R32 означает алкил (с 2-6 атомами углерода) или радикал -alk(c 2-6 атомами углерода)-Ar, могут быть получены путем воздействия альдегида RaCHO, в котором Ra означает алкил или -alk-Ar, на соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причем R31 иR32 означают атомы водорода. Эту реакцию проводят в инертном растворителе, таком, как дихлорметан, дихлорэтан, толуол или тетрагидрофуран, при температуре от 0 до 50 С, в присутствии восстановителя, такого как триацетоксиборгидрид натрия или цианоборгидрид натрия. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причем R31 означает алкил, Ar или -alk-Ar и R32 означает алкил (с 2-6 атомами углерода) или радикал -alk(c 2-6 атомами углерода)-Ar, могут быть получены путем воздействия альдегида RaCHO, в котором Ra означает алкил или -alk-Ar, на соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причемR31 означает атом водорода и R32 означает алкил, Ar или -alk-Ar. Эту реакцию проводят в инертном растворителе, таком как дихлорметан, дихлорэтан, толуол или тетрагидрофуран, при температуре от 0 до 50 С, в присутствии восстановителя, такого как триацетоксиборгидрид натрия или цианоборгидрид натрия.- 13006583 Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -СН(R6)NR31R32, причем R31 и R32 вместе с атомом азота, с которым они связаны, образуют гетероцикл, выбираемый среди азиридинила, азетидинила, пирролидинила, пиперидинила, могут быть получены путем воздействия дигалогенида Hal-alk (c 2-5 атомами углерода)-Hal на соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал-СН(R6)NR31R32, причем R31 и R32 означают атомы водорода. Эту реакцию проводят в инертном полярном растворителе, таком как ацетонитрил, тетрагидрофуран или диметилформамид, в присутствии органического или неорганического основания (например,карбонат щелочного металла (например, натрия, калия), триалкиламин (например, триэтиламин, диметиламинопиридин), при температуре от 0 С до температуры кипения растворителя, в случае необходимости, в присутствии палладия или одной из его солей или одного из его комплексов. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает атом водорода и R2 означает радикал -CH2-COR6, -CH2-CH(R6)NR31R32, -CH2-C(=NOalk)R6, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4, R6, R31, R32 имеют такие же значения, как и в случае формулы (I), и alk означает алкил. Стадию "а" обычно осуществляют в растворителе, таком как тетрагидрофуран, при температуре от 20C до температуры кипения реакционной среды. Стадию "b" обычно осуществляют в инертном растворителе, таком как алифатический спирт (например, метанол), хлорированный растворитель (хлороформ, дихлорметан) или смесь этих растворителей, в присутствии восстановителя, такого как NaBH4, при температуре от 0 С до температуры кипения реакционной среды. Стадию "с" осуществляют любым, известным специалисту способом, позволяющим переходить от кислоты или реакционноспособного производного этой кислоты к карбоксамиду, не затрагивая остальной части молекулы, и, в частности, вышеописанными предпочтительными способами. Стадию "d" обычно осуществляют в инертном растворителе, таком как простой эфир, как тетрагидрофуран, при температуре около 0 С. Магнийорганические соединения получают известными специалисту способами, такими как описанные в примерах. Стадию "е" обычно осуществляют в инертном растворителе, таком как алифатический спирт с 1-4 атомами углерода, такой как метанол, в присутствии ацетата натрия, при температуре от 20 С до температуры кипения реакционной среды. Стадию "f" осуществляют в инертном растворителе, таком как хлорированный растворитель (например, дихлорметан, дихлорэтан), в присутствии восстановителя, такого как триацетоксиборгидрид натрия, при температуре от 0 до 70 С.- 14006583 Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает цианогруппу, -S-alkNR16R17, -NHR15, алкил или -NR20R21 и R2 означает радикал -C(R8)(R11)(R12), в котором R8 означает атом водорода, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4, R11, R12, R15, R16 и R17 имеют такие же значения, как и в случае формулы (I);alk означает алкил; Hal означает атом галогена и М означает металл и предпочтительно медь. Стадию "а" предпочтительно осуществляют в полярном растворителе, таком как диметилсульфоксид, при температуре от 20 до 50 С. Стадию "b" предпочтительно осуществляют в инертном растворителе, таком как диметилсульфоксид, тетрагидрофуран, ацетонитрил, в присутствии основания, такого как карбонат щелочного металла(например, карбонат калия) или гидроксид аммония, при температуре от 20 С до температуры кипения реакционной среды. Стадию "с" предпочтительно осуществляют в инертном растворителе, таком как диметилсульфоксид, тетрагидрофуран, ацетонитрил, в присутствии основания, такого как карбонат щелочного металла(например, карбонат калия) или гидроксид аммония, при температуре от 20 С до температуры кипения реакционной среды. Стадию "d" предпочтительно осуществляют в инертном растворителе, таком как простой эфир (диэтиловый эфир), тетрагидрофуран, при температуре от -78 до 20 С. Стадию "е" предпочтительно осуществляют в инертном растворителе, таком как диметилсульфоксид, тетрагидрофуран, ацетонитрил, дихлорметан, дихлорэтан, в присутствии основания, такого, как карбонат щелочного металла (например, карбонат калия) или гидроксид аммония, при температуре от 20C до температуры кипения реакционной среды. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает радикал -alkNR18R19, причем R18 и R19 означают атом водорода, могут быть получены путем восстановления соответствующего соединения формулы (I), в котором R означает радикал CR1R2, где R1 означает цианогруппу. Эту реакцию обычно проводят в инертном растворителе, таком как тетрагидрофуран, диэтиловый эфир, толуол, при температуре от 0 С до температуры кипения реакционной среды, в присутствии восстановителя, такого, как гидрид алюминия. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает радикал -alkNR18R19, причем R18 означает атом водорода и R19 означает алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk, могут быть получены путем воздействия галогенидаHalR19, где Hal означает атом галогена, на соединение формулы (I), в котором R означает радикал CR1R2,где R1 означает радикал -alk-NR18R19, причем R18 и R19 означают атом водорода. Эту реакцию проводят в инертном полярном растворителе, таком как ацетонитрил, тетрагидрофуран или диметилформамид, в присутствии органического или неорганического основания (например,карбоната щелочного металла (например, натрия, калия), триалкиламина (например, триэтиламина, ди- 15006583 метиламинопиридина, при температуре от 0 С до температуры кипения растворителя в случае необходимости в присутствии палладия или одной из его солей или одного из его комплексов. Соединения формулы (I), в которых R означает радикал CR1R2, где R1 означает радикал -alkNR18R19, причем R18 означает алкил и R19 означает алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk, могут быть получены путем воздействия алкилгалогенида на соединение формулы (I), в котором R означает радикал CR1R2, где R1 означает радикал -alk-NR18R19,причем R18 означает атом водорода и R19 означает алкил, циклоалкил, циклоалкилалкил, циклоалкилкарбонил, -SO2alk, -CO-NHalk или -COOalk. Эту реакцию проводят в инертном полярном растворителе, таком как ацетонитрил, тетрагидрофуран или диметилформамид, в присутствии органического или неорганического основания (например,карбоната щелочного металла (например, натрия, калия), триалкиламина (например, триэтиламина, диметиламинопиридина, при температуре от 0 С до температуры кипения растворителя, в случае необходимости, в присутствии палладия или одной из его солей или одного из его комплексов. Соединения формулы (I), в которых R означает радикал CR1R2, где либо R1 означает атом водорода и R2 означает радикал -C(R8)(R9)(R10) или -C(R8)(R11)(R12), либо R1 означает алкил, NH-R15, цианогруппу,-S-alk-NR16R17, -alk-NR18R19 или -NR20R21 и R2 означает радикал -С(R8)(R11)(R12) и R8 означает алкил, могут быть получены путем алкилирования соответствующего соединения формулы (I), в котором R8 означает атом водорода. Эту реакцию предпочтительно осуществляют с помощью основания, такого как гидрид щелочного металла (например, гидрид натрия), амид щелочного металла (например, амид натрия) или металлоорганическое производное, в инертном растворителе, таком как простой алифатический эфир (диэтиловый эфир) или тетрагидрофуран при температуре от -78 до 30 С с помощью алкилирующего агента, такого как алкилгалогенид или алкилсульфонат. Соединения формулы (I), в которых R означает радикал -С=С(R7)SO2alk, могут быть получены согласно следующей реакционной схеме: В этих формулах R3, R4 и R7 имеют такие же значения, как и в случае формулы (I); alk означает алкил и Hal означает атом галогена. Реакцию А обычно проводят в инертном растворителе, таком как простой эфир (например, диэтиловый эфир), в присутствии сильного основания, такого как трет-бутиллитий или н-бутиллитий, при температуре от -70 до -50 С, затем добавляют серу, потом алкилгалогенид (например, иодид, бромид). Реакцию В обычно проводят в инертном растворителе, таком как простой эфир (например, тетрагидрофуран), в присутствии сильного основания, такого как трет-бутиллитий или н-бутиллитий, при температуре от -70 до -50 С, затем добавляют азетидин-3-он, доводят до комнатной температуры и гидролизуют. Реакцию С осуществляют любыми известными способами, позволяющими окислять серосодержащее производное, не затрагивая остальной части молекулы, как способы, описанные выше. Специалисту понятно, что для осуществления вышеописанных способов согласно изобретению может оказаться необходимым введение защитных групп для аминогрупп, гидроксильных групп и карбоксильных групп, чтобы избежать вторичных реакций. Эти группы представляют собой такие группы,которые могут быть удалены, не затрагивая остальной части молекулы. В качестве примеров защитных групп для аминогруппы можно назвать трет-бутилкарбамат или метилкарбамат, которые могут быть регенерированы с помощью иодтриметилсилана или аллильного соединения при использовании катализаторов на основе палладия. В качестве примеров защитных групп для гидроксильной группы можно назвать триэтилсилил, трет-бутилдиметилсилил, которые могут быть регенерированы с помощью тетрабутиламмонийфторида, или же асимметричные ацетали (например, метоксиметил, тетрагидропиранил) с регенерацией с помощью соляной кислоты. В качестве защитных групп для карбоксильных групп можно- 16006583 назвать сложные эфиры (например, аллиловый, бензиловый), оксазолы и 2-алкил-1,3-оксазолины. Другие используемые защитные группы описаны T.W. GREENE и др., "Protecting Groups in Organic Synthesis",второе издание, 1991, John Wiley and Sons. Соединения формулы (I) могут быть очищены обычными известными методами, например, путем кристаллизации, хроматографии или экстракции. Энантиомеры соединений формулы (I) могут быть получены путем расщепления рацематов, например, путем хроматографии на колонке с хиральной фазой согласно W.H. PIRCLE и др., "Асимметрический синтез", том 1, Academic Press (1983), или путем образования солей или путем синтеза из хиральных предшественников. Диастереоизомеры могут быть получены известными классическими методами(кристаллизацией, хроматографией или из хиральных предшественников). Соединения формулы (I) в случае необходимости могут быть превращены в аддитивные соли с неорганической или органической кислотой путем воздействия такой кислоты в органическом растворителе, таком как спирт, кетон, простой эфир или хлорированный растворитель. Эти соли также составляют часть изобретения. В качестве примеров фармацевтически приемлемых солей могут быть названы следующие соли: бензолсульфонат, гидробромид, гидрохлорид, цитрат, этансульфонат, фумарат, глюконат, иодат, изэтионат, малеат, метансульфонат, метилен-бисоксинафтоат, нитрат, оксалат, памоат, фосфат, салицилат,сукцинат, сульфат, тартрат, теофиллинацетат и п-толуолсульфонат. Соединения формулы (I) обладают представляющими интерес фармакологическими свойствами. Эти соединения обладают сильным сродством к каннабиноидным рецепторам и особенно к таковым типа СВ 1. Эти соединения являются антагонистами рецептора СВ 1 и, следовательно, пригодны при лечении и предупреждении нарушений, касающихся центральной нервной системы, иммунной системы, сердечнососудистой или эндокринной системы, дыхательной системы, желудочно-кишечной системы и нарушений в отношении размножения (Hollister, Pharm. Rev., 38, 1-20, (1986); Reny и Sinha, Prog. Drug Res., 36,71-114 (1991); Consroe и Sandyk, в книге "Marijuana/Cannabinoids, Neurobiology and Neurophysiology",459, под ред. L. Murphy и A. Barthe, CRC Press, 1992). Таким образом, эти соединения могут быть использованы для лечения или предотвращения психозов, включая шизофрению, беспокойства, депрессии, эпилепсии, нейродегенерации, церебеллярных и спиноцеребеллярных нарушений, нарушений познавательных способностей, черепно-мозговых травм,приступов паники, периферических невропатий, глауком, мигрени, болезни Паркинсона, болезни Альцгеймера, хореи Хантингтона, синдрома Рейно, дрожаний, компульсивно-навязчивого состояния, старческого слабоумия, тимусных нарушений, синдрома Туретта, замедленной дискинезии, биполярных нарушений, раковых заболеваний, вызванных лекарственными средствами нарушений движения, дистоний,эндотоксемических шоков, геморрагических шоков, гипотензии, бессонницы, иммунологических заболеваний, рассеянного склероза, рвот, астмы, нарушений аппетита (булимия, анорексия), ожирения, нарушений памяти, в случае прерывания лечения хронических заболеваний и злоупотребления алкоголем или лекарственными средствами (как, например, опиаты, барбитураты, cannabis, кокаин, амфетамин, фенциклид, галлюциногены, бензодиазепины), в качестве анальгетиков или потенциализаторов анальгезирующей активности и наркотических и не наркотических средств. Они также могут быть использованы для лечения или предупреждения инбестинального транзита. Сродство соединений формулы (I) к рецепторам cannabis было определено по методу, описанномуJ.E. KUSTER, J.I. STEVENSON, S.J. WARD, Т.Е. D'AMBRA, D.A. HAYCOCK в J. Pharmacol. Exp. Ther.,264, 1352-1363 (1993). В этом тесте IС 50 (ингибирующая на 50% концентрация) соединений формулы (I) ниже или равна 1000 нмоль. Их антагонистическая активность была показана с помощью модели гипотермии, вызываемой агонистом рецепторов cannabis (СР-55940) у мыши, согласно методу, описанному R.G. Pertwee в книге"Marijuana" под ред D.J. Harvey, 84, Оксфорд IRL Press, 263-277 (1985). В этом тесте DE50 (эффективная на 50% доза) соединений формулы (I) ниже или равна 50 мг/кг. Соединения формулы (I) обладают незначительной токсичностью. Их DL50 (летальная на 50% доза) выше 40 мг/кг при введении подкожно в случае мыши. Предпочтительными соединениями формулы (I) являются следующие:(SR)-1-[(2-хлорпирид-5-ил)(4-хлорфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметил]азетидин; их оптические изомеры и их фармацевтически приемлемые соли. Следующие примеры поясняют изобретение.- 18006583 Пример 1. (RS)-1-[Бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин может быть получен, исходя из 1,0 г 1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил) (метилсульфонил)метилен]азетидина в 40 см 3 метанола, к которому добавляют 96 мг боргидрида натрия и перемешивают в течение 3 ч при температуре 20 С. После добавления 100 см 3 дихлорметана, реакционную смесь промывают 2 раза с помощью 50 см 3 воды, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 6 см, диаметр 3 см), элюируя под давлением аргона 0,8 бар с помощью дихлорметана, затем смеси дихлорметана с 1% метанола, и собирая фракции по 80 см 3. Фракции 13-15 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,55 г твердого вещества белого цвета, которое обрабатывают с помощью 50 см 3 диизопропилового эфира, отфильтровывают и высушивают, получая 0,47 г (RS)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидина в виде твердого вещества белого цвета.[Спектр 1H-ЯМР (400 МГц, (СD3)2SO - d6 с добавлением нескольких капель СD3 СОООD-d4, при температуре 353 K)(в м.д.): 2,46 (т, J=7,5 Гц : 1 Н); 2,77 (с : 3H); 3,15 (м : 2 Н); 3,40 (м : 1 Н); 3,49 (т уш.,J=7,5 Гц : 1 Н); 4,46 (с : 1 Н); 4,81 (д, J=9 Гц : 1 Н); 7,05-7,20 (м : 3H); 7,15-7,45 (м : 8 Н)]. 1-[Бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метилен]азетидин может быть получен двумя способами: Способ 1. К раствору 2,94 г 1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил-(RS)]азетидин-3-ола в 250 см 3 дихлорметана при температуре 22 С добавляют 0,65 см 3 метилсульфонилхлорида, затем в течение 15 мин маленькими порциями добавляют 2,42 г 4-диметиламинопиридина; раствор оранжевого цвета перемешивают в течение 2 ч при комнатной температуре. Реакционную смесь промывают 3 раза по 150 см дистиллированной воды и один раз с помощью 150 см 3 насыщенного раствора хлорида натрия, затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 5,5 см, высота 15 см) под давлением аргона 0,5 бар с помощью смеси этилацетата и циклогексана (в соотношении 1:9 по объемам) в качестве элюирующего средства, собирая фракции по 70 см 3. Фракции 15-36 объединяют, затем концентрируют досуха при пониженном давлении(2,7 кПа). Получают 1,86 г меренги белого цвета, которую кристаллизуют из диизопропилового эфира,получая твердое вещество, плавящееся при температуре 190 С. Перекристаллизация из 45 см 3 этанола приводит к получению 1,08 г 1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метилен]азетидина, плавящегося при температуре 206 С. [Спектр 1H-ЯМР (300 МГц; ДМСО-d6, при температуре 300K)(в м.д.): 3,00 (3H, с, SCH3), 3,87 (2 Н, с, NCH2), 4,20 (2 Н, с, NCH2), 4,75 (1 Н, с, NCH), 7,15(2 Н, д, J=8 Гц, 2 СН аром.), 7,30 (5 Н, м, 5 СН аром.), 7,45 (4 Н, д, J=7 Гц, 4 СН аром.)]. К раствору 6,8 г бис(4-хлорфенил)бромметана в 300 см 3 ацетонитрила добавляют 6,75 г гидрохлорида 3-[(3,5-дифторфенил) (метилсульфонил)метил-(RS)]азетидин-3-ола, затем 2,97 г карбоната калия. Реакционную смесь в течение 1 ч кипятят с обратным холодильником, охлаждают до комнатной температуры, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 8,5 см, высота 22 см) под давлением аргона 0,5 бар с помощью смеси этилацетата и циклогексана (в соотношении 25:75 по объемам) в качестве элюирующих средств, собирая фракции по 250 см 3. Фракции 11-48 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 5,3 г 1-[бис(4-хлорфенил) метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил-(RS)]азетидин-3-ола. [Спектр 1H-ЯМР (300 МГц;(СD3)2SO-d6)(в м.д.): 2,00 (с : 3H); 2,94 (с : 3H); 3,25 (м : 2 Н); 3,48 (д, J=9 Гц : 1 Н); 3,80 (д, J=9 Гц : 1 Н); 4,54 (с : 1 Н); 5,34 (с : 1 Н); 7,15 (д, J=8,5 Гц : 2 Н); 7,20-7,40 (м : 8 Н); 7,50 (т уш.,J=9 Гц : 1 Н)]. Бис(4-хлорфенил)бромметан может быть получен согласно методике, описанной W.E. BACHMANN, J. Am. Chem. Soc., 2135 (1933). Гидрохлорид 3-[(3,5-дифторфенил)(метилсульфонил)метил-(RS)]азетидин-3-ола может быть получен следующим образом: к раствору 37 г 3-[(3,5-дифторфенил)(метилсульфонил)метил-(RS)]-1-(винилоксикарбонил)азетидин-3-ола в 160 см 3 диоксана добавляют 160 см 3 6,2 н. раствора хлороводорода в диоксане. После выдерживания в течение 16 ч при комнатной температуре реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток обрабатывают с помощью 320 см 3 этанола, в течение 1 ч кипятят с обратным холодильником и охлаждают на бане со смесью воды и льда. Выделившееся твердое вещество отфильтровывают, промывают диэтиловым эфиром и высушивают при температуре 40 С при пониженном давлении (2,7 кПа). Получают 29,85 г кристаллов белого цвета, температура плавления которых выше 260 С. 3-[(3,5-Дифторфенил)(метилсульфонил)метил-(RS)]-1-(винилоксикарбонил)азетидин-3-ол может быть получен следующим образом: к раствору 60,18 г 1-бензгидрил-3-[(3,5-дифторфенил) (метилсульфонил)метил-(RS)]азетидин-3-ола в 1000 см 3 дихлорметана при температуре 5 С добавляют раствор 14 см 3 винилхлорформиата в 35 см 3 дихлорметана. После выдерживания в течение 20 ч при комнатной температуре реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 11 см, высота 32- 19006583 см) под давлением аргона 0,5 бар с помощью смеси этилацетата и циклогексана (в соотношении 3:7 по объемам) в качестве элюирующих средств, собирая фракции по 1000 см 3. Фракции 8-18 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 37 г 3-[(3,5-дифторфенил)(метилсульфонил) метил-(RS)]-1-(винилоксикарбонил)азетидин-3-ола в виде кристаллов белого цвета,плавящихся при температуре 195 С. 1-Бензгидрил-3-[(3,5-дифторфенил)(метилсульфонил)метил-(RS)]азетидин-3-ол может быть получен следующим образом: к охлажденному до температуры -70 С раствору 6,73 см 3 диизопропиламина в 110 см 3 тетрагидрофурана, в атмосфере аргона, добавляют 29,5 см 3 1,6 н. раствора н-бутиллития в гексане. Спустя 30 мин затем добавляют смесь из 8,7 г 3,5-дифторбензилметилсульфона в 200 см 3 тетрагидрофурана и выдерживают при перемешивании в течение 45 мин при температуре -70 С. Добавляют 10 г 1-бензгидрилазетидин-3-она, растворенные в 60 см 3 тетрагидрофурана, затем перемешивают в течение 20 мин, оставляя смесь возвращаться к комнатной температуре. Реакционную смесь гидролизуют с помощью 400 см 3 насыщенного раствора хлорида аммония, экстрагируют дихлорметаном, промывают 3 раза по 500 см 3 воды, затем с помощью насыщенного раствора хлорида натрия. Органическую фазу сушат над сульфатом магния, фильтруют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток в количестве 19 г обрабатывают диизопропиловым эфиром, из которого он выкристаллизовывается. После отфильтровывания и высушивания получают 15,35 г 1-бензгидрил-3-[(3,5-дифторфенил) (метилсульфонил)метил-(RS)]азетидин-3-ола в виде кристаллов белого цвета. 1-Бензгидрилазетидин-3-он может быть получен по методике, описанной A.R. KATRITZKY и др., J.Heterocycl. Chem., 271 (1994). 3,5-Дифторбензилметилсульфон может быть получен следующим образом: к 33,46 г 3,5 дифторбензилметилсульфида в 318 см 3 воды, 318 см 3 уксусной кислоты и 318 см 3 этанола добавляют,при температуре 5 С, 129,9 г оксонаR. После выдерживания в течение 16 ч при комнатной температуре реакционную смесь разбавляют дихлорметаном, промывают водой и насыщенным раствором хлорида натрия, сушат, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 35,57 г 3,5-дифторбензилметилсульфона в виде кристаллов белого цвета. Т.пл.=135 С. 3,5-Дифторбензилметилсульфид может быть получен следующим образом: исходя из 40 г 3,5 дифторбензилбромида и 16,25 г метилтиолята натрия в диметилформамиде при температуре 60 С, после обработки, получают 33,46 г 3,5-дифторбензилметилсульфида в виде масла желтого цвета. Способ 2. К раствору 2,2 г 3-ацетокси-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил) (метилсульфонил)метил-(RS)]азетидина в 25 см 3 диоксана при комнатной температуре добавляют 0,80 г измельченного гидроксида натрия. После выдерживания в течение 16 ч при комнатной температуре добавляют 50 см 3 воды и 100 см 3 этилацетата. Смесь декантируют, органическую фазу повторно промывают с помощью 100 см 3 воды, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают меренгу белого цвета, которую кристаллизуют из диизопропилового эфира, получая 0,85 г твердого вещества, плавящегося при температуре 190 С. Перекристаллизация из 20 см 3 этанола приводит к получению 0,70 г 1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил) метилен]азетидина, плавящегося при температуре 205 С. К раствору 4,77 г (3,5-дифторбензил)метилсульфона в 70 см 3 тетрагидрофурана, в атмосфере аргона и при температуре -70 С, добавляют 14 см 3 1,6 н. раствора н-бутиллития в гексане. После выдерживания в течение 1 часа при температуре -70 С, добавляют раствор 6,8 г 1-[бис(4-хлорфенил)метил]азетидин-3 она в 30 см 3 тетрагидрофурана, затем, спустя 1 ч, раствор 2,34 см 3 ацетилхлорида в 20 см 3 тетрагидрофурана и температуру реакционной смеси в течение 1 ч повышают до 20 С. Добавляют 50 см 3 воды и 200 см 3 этилацетата. Смесь декантируют, органическую фазу промывают с помощью 100 см 3 воды, 100 см 3 насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 14,4 г 3-ацетокси-1-[бис(4-хлорфенил)метил]-3-[(3,5 дифторфенил)(метилсульфонил)метил-(RS)]азетидина в виде масла желтого цвета. [Спектр 1H-ЯМР (400 МГц, CDCl3)в м.д.):. 2,79 (с : 3H); 3,04 (АВ, J=9 Гц : 2 Н); 3,27 (д, J=9 Гц : 1 Н); 3,45 (с : 1 Н); 3,81 (д, J=9 Гц : 1 Н); 4,32 (с : 1 Н); 4,49 (с : 1 Н); 6,88 (т, J=9 и 2,5 Гц : 1 Н); 7,20-7,35 (м :10 Н)]. 1-[Бис(4-хлорфенил)метил]азетидин-3-он может быть получен согласно следующей методике: к раствору 5,0 см 3 оксалилхлорида в 73 см 3 дихлорметана, охлажденному до температуры -78 С, добавляют раствор 8,1 см 3 диметилсульфоксида в 17,6 см 3 дихлорметана. После выдерживания в течение 0,5 ч при температуре -78 С, приливают раствор 16,0 г 1-[бис(4-хлорфенил)метил]азетидин-3-ола в 50 см 3 дихлорметана. После выдерживания в течение 5 ч при температуре -78 С добавляют по каплям 26,6 см 3 триэтиламина и реакционную смесь оставляют стоять до возврата к комнатной температуре. Спустя 16 ч реакционную смесь промывают 4 раза по 200 см 3 воды, затем с помощью 200 см 3 насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 9,2 см, высота 21 см) под давлением аргона 0,5 бар с помощью смеси этилацетата и циклогексана (в соотношении 40:60 по объемам) в качестве элюирующих средств, собирая фракции по 200 см 3. Фракции 15-25 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа).- 20006583 Получают 8,9 г 1-[бис(4-хлорфенил)метил]азетидин-3-она в виде кристаллов бледно-желтого цвета, плавящихся при температуре 111 С. 1-[Бис(4-хлорфенил)метил]азетидин-3-ол может быть получен по методике, описанной A.R. KATRITZKY и др., J. Heterocycl. Chem., 271 (1994), исходя из 35,5 г гидрохлорида [бис (4 хлорфенил)метил]амина и 11,0 см 3 эпихлоргидрина. Выделяют 9,0 г 1-[бис(4-хлорфенил)метил]азетидин 3-ола. Гидрохлорид [бис(4-хлорфенил)метил]амина может быть получен по способу, описанному М. GRISAR и др., J. Med. Chem., 885 (1973). Пример 2. (-)-1-[Бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил) (метилсульфонил)метил]азетидин и(+)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил]азетидин могут быть получены путем разделения с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии) на колонке с хиральной фазой CHIRALPAK AS (гранулометрия 20 мкм, высота 23 см, диаметр 6 см) 0,52 г полученного согласно примеру 1 рацемата. Элюируя смесью гептана с этанолом (в соотношении 90:10) с расходом 80 см 3/мин и после концентрирования собранных фракций досуха при пониженном давлении (2,7 кПа), получают 110 мг (-)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил] азетидина, [D]=-6,3 (с=0,5 М в метаноле), в виде твердого вещества белого цвета, плавящегося при температуре 178 С, и 134 мг (+)-1-[бис(4-хлорфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил] азетидина, [D]=+5,8 (с=0,5 М в метаноле), в виде твердого вещества белого цвета, плавящегося при температуре 178 С. Пример 3. Смесь 2 диастереоизомерных форм А 1-[4-[(R)-(4-хлорфенил)-3-[(3,5-дифторфенил) метилсульфонилметил-(R)]азетидин-1-илметил]бензил]пирролидина и 1-[4-[(R)-(4-хлорфенил)-3[(3,5-дифторфенил)метилсульфонилметил-(S)]азетидин-1-илметил]бензил]пирролидина может быть получена согласно следующей методике: к раствору 60 мг 1-(R)-[4-(4-хлорфенил)-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидин-1-илметилбензил]пирролидина, изомерной формы А, в 2 см 3 этанола и 2 см 3 дихлорметана добавляют 20 мг боргидрида натрия. После перемешивания в течение 20 ч при температуре 20 С добавляют 0,25 см 3 воды, 20 см 3 дихлорметана, перемешивают и смесь сушат над сульфатом магния, затем фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 7 см, диаметр 1 см), элюируя под давлением аргона 0,1 бар с помощью дихлорметана, затем с помощью смеси дихлорметана и метанола (в соотношении 95:5 по объемам) и собирая фракции по 5 см 3. Фракции 13-18 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 38 мг смеси 2 диастереоизомерных форм А 1-[4-[(R)-(4-хлорфенил)3-[(3,5-дифторфенил)метилсульфонилметил-(R)]азетидин-1-илметил]бензил]пирролидина и 1-[4-[(R)-(4-хлорфенил)3-[(3,5-дифторфенил)метилсульфонилметил-(S)]азетидин-1-илметил]бензил]пирролидина в виде меренги белого цвета. [Спектр 1HЯМР (400 МГц, CDCl3)(в м.д.):. 1,77 (м: 4 Н); 2,40-2,60 (м : 5 Н); 2,67 (с: 3H); 3,10-3,25 (м: 2 Н); 3,38 (м: 1 Н); 3,50-3,70 (м: 3H); 4,24 (с: 1 Н); 4,25 (д, J=11 Гц : 1 Н); 6,83 (т уш., J=9 Гц : 1 Н); 6,94 (м: 2 Н); 7,10-7,35(м : 8 Н)]. 1-(R)-[4-(4-Хлорфенил)-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидин-1-илметилбензил]пирролидин, изомерная форма А, может быть получен согласно следующей методике: к раствору 0,32 г 1-(R)-[4-(хлорметил)фенил]-(4-хлорфенил)метил-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидина, изомерной формы А, и 5 мг иодида натрия в 10 см 3 дихлорметана добавляют 50 мм 3 пирролидина. После перемешивания в течение 20 ч при температуре 20 С к смеси добавляют 50 мм 3 пирролидина, перемешивают в течение 8 ч, затем снова добавляют 50 мм 3 пирролидина и перемешивают в течение 20 ч при температуре 20 С. Реакционную смесь промывают водой, затем органическую фазу сушат над сульфатом магния, концентрируют досуха в вакууме (2,7 кПа). Полученный остаток хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 1,2 см, высота 30 см), под давлением аргона 0,1 бар, элюируя с помощью дихлорметана, затем с помощью смеси дихлорметана и метанола (в соотношении 97,5:2,5 по объемам) и собирая фракции по 3 см 3. Фракции 12-40 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,18 г 1-(R)-[4-(4-хлорфенил)3-[(3,5-дифторфенил)метилсульфонилметилен]азетидин-1-илметилбензил]пирролидина,изомерной формы А, в виде меренги белого цвета; []20 365 нм = -22,50,7 (с=0,5%; дихлорметан). [Спектр 1HЯМР (300 МГц, CDCl3)(в м.д.): 1,78 (м: 4 Н); 2,51 (м: 4 Н); 2,81 (с: 3H); 3,58 (с: 2 Н); 3,84 (м: 2 Н); 4,33 (м: 2 Н); 4,50 (с: 1 Н); 6,84 (т, J=9 и 2,5 Гц : 1 Н); 6,98 (м: 2 Н); 7,20-7,40 (м: 8 Н)]. 1-(R)-[(4-Хлорметил)фенил](4-хлорфенил)метил-3-[(3,5-дифторфенил)метилсульфонилметилен] азетидин, изомерная форма А, может быть получен согласно следующей методике: к раствору 28,0 г смеси 2 диастереоизомеров (форм A), 1-(R)-[(4-хлорметил)фенил](4-хлорфенил)метил-3-[(R)-(3,5 дифторфенил)метилсульфонилметил]азетидин-3-ола и 1-(R)-[(4-хлорметил) фенил](4-хлорфенил)метил-3-[(S)-(3,5-дифторфенил) метилсульфонилметил]азетидин-3-ола, 32 г 4-диметиламинопиридина в 500 см 3 дихлорметана добавляют 12,4 см 3 метилсульфонилхлорида. После перемешивания в течение часа при температуре 10 С, затем в течение часа при температуре 20 С, реакционную смесь промывают с помощью 500 см 3 воды, органическую фазу сушат над сульфатом магния и концентрируют досуха при по- 21006583 ниженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 6 см, высота 30 см), под давлением аргона 0,2 бар, элюируя с помощью дихлорметана и собирая фракции по 250 см 3. Фракции 9-25 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 6,3 г 1-(R)-[(4-хлорметил)фенил](4-хлорфенил)метил-3[(3,5-дифторфенил)метилсульфонилметилен]азетидина, изомерной формы А, в виде меренги белого цвета. Смесь 2 диастереоизомеров (форм А) 1-(R)-[(4-хлорметил)фенил](4-хлорфенил)метил-3-[(R)(3,5-дифторфенил) метилсульфонилметил]азетидин-3-ола и 1-(R)-[(4-хлорметил) фенил](4-хлорфенил) метил-3-[(S)-(3,5-дифторфенил) метилсульфонилметил]азетидин-3-ола может быть получена согласно следующей методике: к раствору 0,20 г смеси 2 диастереоизомеров (форм А) 1-(R)-(4-хлорфенил)[4(гидроксиметил)фенил]метил-3-[(R)-(3,5-дифторфенил)метилсульфонилметил]азетидин-3-ола и 1(R)-(4-хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил] азетидин-3-ола в 10 см 3 дихлорметана добавляют 6 см 3 тионилхлорида. После перемешивания в течение 20 ч при температуре 20 С к реакционной смеси добавляют 5 см 3 водного насыщенного раствора гидрокарбоната натрия, затем перемешивают в течение 15 мин. Смесь декантируют, органическую фазу промывают водой, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении(2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 1,0 см, высота 20 см), под давлением аргона 0,2 бар, элюируя с помощью смеси циклогексана и этилацетата (в соотношении 75:25 по объемам) и собирая фракции по 20 см 3. Фракции 4-7 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,17 г смеси 2 диастереоизомеров(форм А) 1-(R)-[(4-хлорметил)фенил](4-хлорфенил)метил-3-[(R)-(3,5-дифторфенил) метилсульфонилметил]азетидин-3-ола и 1-(R)-[(4-хлорметил) фенил](4-хлорфенил)метил-3-[(S)-(3,5-дифторфенил) метилсульфонилметил]азетидин-3-ола в виде меренги белого цвета. Смесь двух диастереоизомеров (форм A) 1-(R)-(4-хлорфенил)[4-(гидроксиметил)фенил]метил-3[(R)-(3,5-дифторфенил)метилсульфонилметил]азетидин-3-ола и 1-(R)-(4-хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил]азетидин-3-ола может быть получена согласно следующей методике: к поддерживаемому в атмосфере аргона и охлажденному до температуры -30 С раствору 0,58 г смеси 2 диастереоизомеров (форм А) 3-ацетокси-1-(R)-(4-хлорфенил)[4(метоксикарбонил)фенил]метил-3-[(R)-(3,5-дифторфенил)метилсульфонилметил]азетидина и 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил]азетидина в 10 см 3 безводного толуола добавляют 1,6 см 3 1,5 М раствора диизобутилалюминийгидрида в толуоле. После перемешивания в течение 15 мин при температуре -30 С снова добавляют 1,0 см 3 того же самого раствора диизобутилалюминийгидрида, затем смесь оставляют стоять до достижения температуры 0 С. После перемешивания в течение 30 мин к перемешиваемой смеси добавляют 3 см 3 воды и 6 см 3 1 н. раствора гидроксида натрия, после чего экстрагируют с помощью 25 см 3 дихлорметана. Органическую фазу промывают с помощью 5 см 3 воды, 5 см 3 рассола, затем сушат над сульфатом магния и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 1,2 см, высота 30 см), под давлением аргона 0,1 бар,элюируя с помощью смеси циклогексана и этилацетата (в соотношении 50:50 по объемам) и собирая фракции по 30 см 3. Фракции 4-12 объединяют, затем концентрируют досуха при пониженном давлении(2,7 кПа). Получают 0,42 г смеси 2 диастереоизомеров (форм А) 1-(R)-(4-хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(R)-(3,5-дифторфенил)метилсульфонилметил]азетидин-3-ола и 1-(R)-(4-хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил]азетидин-3-ола в виде лака белого цвета. Смесь 2 диастереоизомеров (форм А) 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(R)-(3,5-дифторфенил)метилсульфонилметил]азетидина и 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил]азетидина может быть получена согласно следующей методике: к охлажденному до температуры -60 С раствору 1,0 г(3,5-дифторбензил)метилсульфона в 30 см 3 тетрагидрофурана, в атмосфере аргона, в течение 5 мин приливают 3 см 3 1,6 н. раствора н-бутиллития в гексане. После перемешивания в течение 1 ч при температуре -60 С, затем в течение 30 мин при температуре -30 С, к этой смеси по каплям добавляют предварительно охлажденный до температуры -60 С раствор 1,45 г 1-(R)-(4-хлорфенил)[4-(метоксикарбонил) фенил] метилазетидин-3-она, изомерной формы А, в 15 см 3 тетрагидрофурана. После перемешивания в течение 30 мин при температуре -60 С, затем в течение 30 мин при температуре -30 С, добавляют 0,43 см 3 ацетилхлорида, после чего реакционную смесь оставляют стоять до достижения температуры 0 С. Затем в среду при перемешивании добавляют 40 см 3 воды и 40 см 3 дихлорметана, после чего оставляют стоять для возврата к комнатной температуре и декантируют. Органическую фазу промывают с помощью 20 см 3 воды, затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,0400,063 мм; диаметр 3 см, высота 30 см), элюируя под давлением аргона 0,5 бар с помощью смеси циклогексана и этилацетата (в соотношении 75:25 по объемам) и собирая фракции по 30 см 3. Фракции 21-35 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 1,28 г смеси 2- 22006583 диастереоизомеров (форм А) 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил] метил-3[(R)-(3,5-дифторфенил)метилсульфонилметил]азетидина и 3-ацетокси-1-(R)-(4-хлорфенил)[4(метоксикарбонил)фенил]метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил]азетидина в виде меренги кремового цвета. 1-(R)-(4-Хлорфенил)[4-(метоксикарбонил)фенил]метил азетидин-3-он, изомерная форма А, может быть получен согласно следующей методике: к охлажденному до температуры -60 С раствору 0,55 см 3 оксалилхлорида в 5 см 3 дихлорметана в течение 10 мин приливают 0,90 см 3 диметилсульфоксида. После перемешивания в течение 30 мин при температуре -60 С, к смеси в течение 15 мин добавляют раствор 1,75 г 1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-ола, изомерной формы А, в 20 см 3 дихлорметана. После перемешивания в течение 3 ч при температуре -60 С приливают 2,70 см 3 триэтиламина, затем реакционную среду оставляют до достижения температуры 0 С. Тогда добавляют 20 см 3 воды, перемешивают, затем декантируют. Органическую фазу сушат над сульфатом магния,фильтруют, затем концентрируют досуха при температуре 50 С и при пониженном давлении (2,7 кПа). Полученное масло оранжевого цвета хроматографируют на колонке с силикагелем (гранулометрия 0,060,200 мм; диаметр 2 см, высота 30 см), под давлением аргона 0,5 бар, элюируя с помощью смеси циклогексана и этилацетата (в соотношении 75:25 по объемам) и собирая фракции по 30 см 3. Фракции 2-15 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 1,45 г 1-(R)(4-хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-она, изомерной формы А, в виде меренги желтого цвета. 1-(R)-(4-Хлорфенил)[4-(метоксикарбонил)фенил]метил азетидин-3-ол, изомерная форма А, может быть получен согласно следующей методике: к суспензии 2,0 г метил-(+)-4-[(R)-амино(4 хлорфенил)метил]бензоата в 30 см 3 этанола добавляют 0,605 г гидрокарбоната натрия, затем 0,60 см 3 эпибромгидрина. После перемешивания в течение 20 ч при температуре 60 С реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 3 см, высота 35 см), элюируя под давлением аргона 0,5 бар с помощью смеси циклогексана и этилацетата (в соотношении 70:30 по объемам для фракций 6-10,затем 60:40 для фракций 18-27, затем 50:50) и собирая фракции по 60 см 3. Фракции 15-40 объединяют,затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток обрабатывают с помощью 30 см 3 этанола, затем добавляют 0,20 г гидрокарбоната натрия и 0,2 см 3 эпибромгидрина. После перемешивания в течение 48 ч при температуре 20 С, затем в течение 24 ч при температуре 35 С, смесь фильтруют и фильтрат концентрируют досуха при температуре 60 С и при пониженном давлении (2,7 кПа). Получают 1,76 г 1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-ола, изомерной формы А, в виде пастообразного твердого вещества. Метил-(+)-4-[(R)-амино-(4-хлорфенил)метил]бензоат может быть получен согласно следующей методике: к раствору 9,2 г метил-4-[(RS)-амино(4-хлорфенил)метил]бензоата в 10 см 3 метанола добавляют 2,51 г D-(-)-винной кислоты. Раствор концентрируют досуха при пониженном давлении (2,7 кПа). Полученную меренгу кремового цвета растворяют в 50 см 3 этанола, содержащего 5% воды, и полученный в результате раствор оставляют стоять для кристаллизации в течение 20 ч при температуре 20 С. Кристаллы отфильтровывают, промывают с помощью этанола с 5% воды, отфильтровывают под вакуумом, затем высушивают при пониженном давлении (2,7 кПа). Получают 3,4 г кристаллов белого цвета,которые называют "кристаллы А" [и это название сохраняют в случае последующего получения второго энантиомера метил-(-)-4-[(R)-амино-(4-хлорфенил)метил]бензоата]. Маточные растворы концентрируют досуха и получают меренгу белого цвета в количестве 8,1 г, которую растворяют в 100 см 3 этилацетата. К полученному раствору добавляют 50 см 3 1 н. раствора гидроксида натрия, перемешивают, декантируют. Органическую фазу промывают с помощью 50 см 3 воды, затем сушат над сульфатом магния и концентрируют при пониженном давлении (2,7 кПа). Получают твердое вещество желтого цвета, которое растворяют в 100 см 3 метанола. К полученному раствору добавляют 1,85 г L-(+)-винной кислоты и полученный в результате раствор концентрируют досуха при пониженном давлении (2,7 кПа). Получают меренгу кремового цвета, которую, растворенную один раз в 27 см 3 этанола с 4% воды, оставляют кристаллизоваться в течение 20 ч при температуре 20 С. Кристаллы отфильтровывают, промывают с помощью этанола с 4% воды, отфильтровывают под вакуумом, затем высушивают при пониженном давлении (2,7 кПа). Получают 3,4 г кристалловL-(+)-тартрата метил-(+)-4-[(R)амино-(4-хлорфенил)метил]бензоата,которые перекристаллизуют из 60 см 3 этанола с 5% воды. После отфильтровывания под вакуумом, затем высушивания, получают 2,78 г кристаллов белого цвета, которые растворяют в 50 см 3 этилацетата. Полученный раствор добавляют к 100 см 3 1 н. раствора гидроксида натрия, перемешивают, декантируют. Органическую фазу промывают с помощью 50 см 3 воды, затем сушат над сульфатом магния и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 2,1 г метил-(+)-4-[(R)-амино(4 хлорфенил)метил]бензоата в виде твердого вещества белого цвета. Метил-4-[(RS)-амино(4-хлорфенил)метил]бензоат может быть получен согласно следующей методике: к суспензии 16,3 г метил-4-[(RS)-фталимидо-(4-хлорфенил)метил]бензоата в 200 см 3 метанола добавляют 3,9 см 3 гидразингидрата. После перемешивания в течение 5 ч при температуре кипения с обратным холодильником, затем в течение 20 ч при температуре 20 С, реакционную смесь фильтруют, фильт- 23006583 рат концентрируют досуха при пониженном давлении (2,7 кПа). Полученный остаток обрабатывают смесью из 200 см 3 воды и 200 см 3 этилацетата. После перемешивания в течение 15 мин полученную в результате суспензию фильтруют, фильтрат декантируют при использовании делительной воронки и органическую фазу промывают с помощью 50 см 3 воды, сушат над сульфатом магния и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 8,4 г метил-4-[(RS)-амино(4-хлорфенил) метил]бензоата в виде масла бледножелтого цвета. Метил-4-[(RS)-фталимидо(4-хлорфенил)метил]бензоат может быть получен согласно следующей методике: к раствору 11,6 г метил-4-[(RS)-бром(4-хлорфенил)метил]бензоата в 70 см 3 N,N-диметилформамида добавляют 12,6 г фталимида калия. После перемешивания в течение 3 ч при температуре кипения с обратным холодильником реакционную смесь охлаждают до температуры 20 С, затем добавляют 300 см 3 этилацетата и 300 см 3 воды. После перемешивания смесь декантируют, водную фазу повторно экстрагируют 2 раза по 100 см 3 этилацетата, объединенные органические фазы промывают 2 раза по 400 см 3 воды, затем сушат над сульфатом магния и концентрируют в вакууме при пониженном давлении (2,7 кПа). Получают 16,3 г метил-4-[(RS)-фталимидо(4-хлорфенил)метил]бензоата в виде пастообразного твердого вещества желтого цвета. Метил-4-[(RS)-бром(4-хлорфенил)метил]бензоат может быть получен согласно следующей методике: к раствору 17,4 г метил-4-[(RS)-(4-хлорфенил)(гидрокси)метил]бензоата в 200 см 3 ацетонитрила добавляют 10,18 г N,N'-карбонилдиимидазола и 54,3 см 3 аллилбромида. После перемешивания в течение 30 мин при температуре 20 С реакционную смесь кипятят с обратным холодильником в течение 2 ч, перемешивают в течение 20 ч при температуре 20 С и концентрируют почти досуха при пониженном давлении (2,7 кПа). Смесь, обработанную дихлорметаном, хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 7 см, высота 30 см), под давлением аргона 0,5 бар, элюируя дихлорметаном и собирая фракции по 500 см 3. Фракции 3-6 объединяют, затем концентрируют при пониженном давлении (2,7 кПа). Получают 11,6 г метил-4-[(RS)-бром-(4-хлорфенил)метил]бензоата в виде масла, которое используют таким, какое есть, на следующей стадии. Метил-4-[(RS)-(4-хлорфенил)(гидрокси)метил]бензоат может быть получен согласно следующей методике: к суспензии 2,75 г метил-4-(4-хлорбензоил)бензоата в 200 см 3 метанола при температуре 20 С медленно добавляют маленькими порциями (происходит нагревание среды вплоть до температуры 50 С) 1,21 г боргидрида натрия. После перемешивания в течение 20 ч при температуре 20 С реакционную смесь концентрируют до меньшего объема, затем добавляют 150 см 3 дихлорметана и, при перемешивании, 100 см 3 0,5 н. соляной кислоты. После декантации органическую фазу сушат над сульфатом магния,концентрируют досуха при пониженном давлении (2,7 кПа). Получают 2,5 г метил-4-[(RS)-(4 хлорфенил)(гидрокси)метил]бензоата в виде бесцветного масла, которое медленно кристаллизуется при температуре 20 С и которое используют таким, какое есть, на следующей стадии. Метил-4-(4-хлорбензоил)бензоат может быть получен согласно следующей методике: к охлажденному до температуры -22 С раствору 19,3 г монометилового эфира хлорангидрида терефталевой кислоты в 200 см 3 тетрагидрофурана в атмосфере аргона добавляют 27,4 см 3 три-н-бутилфосфина. После перемешивания в течение 20 мин при температуре -22 С приливают, при поддерживании этой температуры,раствор 4-хлорфенилмагнийбромида (приготовленный из 19,15 г 4-бромхлорбензола, 2,43 г магния и кристалла иода в 100 см 3 диэтилового эфира при температуре кипения с обратным холодильником). После перемешивания в течение 30 мин при температуре -22 С медленно добавляют 150 см 3 1 н. соляной кислоты, оставляют реакционную смесь стоять до достижения температуры 20 С, затем среду разбавляют с помощью 200 см 3 диэтилового эфира. Полученную суспензию белого цвета фильтруют, твердое вещество промывают 2 раза по 50 см 3 воды, затем 2 раза по 50 см 3 диэтилового эфира. После отфильтровывания под вакуумом, затем высушивания при пониженном давлении (2,7 кПа), получают 16,2 г метил 4-(4-хлорбензоил)бензоата в виде твердого вещества белого цвета, плавящегося при температуре 170 С. Пример 4. Смесь 2 диастереоизомерных форм В 1-[4-[(R)-(4-хлорфенил)-3-[(3,5-дифторфенил) метилсульфонилметил-(R)]азетидин-1-илметил]бензил]пирролидина и 1-[4-[(R)-(4-хлорфенил)-3[(3,5-дифторфенил)метилсульфонилметил-(S)]азетидин-1-илметил]бензил]пирролидина может быть получена согласно методике, описанной в примере 3, исходя из 50 мг (+)-1-[4-(R)-(4-хлорфенил)-3[(3,5-дифторфенил)метилсульфонилметилен]азетидин-1-илметилбензил]пирролидина, изомерной формы В, 1,5 см 3 этанола, 1,5 см 3 дихлорметана и 18 мг боргидрида натрия, перемешивая в течение 8 ч при температуре 50 С, затем в течение 48 ч при температуре 20 С. Получают 50 мг смеси 2 диастереоизомерных форм В 1-[4-[(R)-(4-хлорфенил)-3-[(3,5-дифторфенил)метилсульфонилметил-(R)]азетидин-1 илметил]бензил]пирролидина и 1-[4-[(R)-(4-хлорфенил)-3-[(3,5-дифторфенил)метилсульфонилметил(S)] азетидин-1-илметил]бензил]пирролидина в виде меренги белого цвета. [Спектр 1H-ЯМР (300 МГц,CDCl3)(в м.д.): наблюдают смесь диастереоизомеров в соотношении 60:40,1,79 (м: 4 Н); 2,45-2,60 (м: 5 Н); 2,67 (с: 3H); 3,10-3,30 (м: 2 Н); 3,40 (м: 1 Н); 3,57 и 3,60 (2 с : 2 Н в целом); 3,65 (т уш., J=7,5 Гц: 1 Н); 4,26 и 4,30 (2 с : 2 Н в целом); 6,84 (т, J=9 и 2 Гц : 1 Н); 6,96 (м : 2 Н); 7,25-7,40 (м : 8 Н)].(+)-1-[4-(R)-(4-Хлорфенил)-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидин-1-илметилбензил]пирролидин, изомерная форма В, может быть получен согласно методике, описанной в примере 3, исходя из 0,50 г 1-(R)-[4-(хлорметил)фенил](4-хлорфенил)метил-3-[(3,5-дифторфенил) (метилсуль- 24006583 фонил)метилен]азетидина, изомерной формы В, 5 мг иодида натрия, 15 см 3 дихлорметана и 0,190 г пирролидина. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 1,5 см, высота 20 см), под давлением аргона 0,1 бар, элюируя дихлорметаном, затем смесью дихлорметана и метанола (в соотношении 95:5 по объемам) и собирая фракции по 25 см 3. Фракции 20-40 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,28 г (+)-1-[4(R)-(4-хлорфенил)-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидин-1-илметилбензил]пирролидина, изомерной формы В, в виде меренги белого цвета. []20 365 нм = +26,80,8 (с=0,5%; дихлорметан).[Спектр 1H-ЯМР (300 МГц, CDCl3)(в м.д.): 1,78 (м : 4 Н); 2,50 (м : 4 Н); 2,80 (с : 3H); 3,57 (с : 2 Н); 3,84 (м : 2 Н); 4,34 (м : 2 Н); 4,50 (с : 1 Н); 6,84 (т, J=9 и 2,5 Гц : 1 Н); 6,98 (м : 2 Н); 7,20-7,40 (м : 8 Н)]. 1-(R)-[4-(Хлорметил)фенил]-(4-хлорфенил)метил-3-[(3,5-дифторфенил)(метилсульфонил)метилен] азетидин, изомерная форма В, может быть получен согласно методике, описанной в примере 3, исходя из 7,3 г смеси 2 диастереоизомерных форм В 1-(R)-[4-(хлорметил)фенил]-(4-хлорфенил)метил-3[(R)-(3,5-дифторфенил)(метилсульфонил)метил]азетидин-3-ола и 1-(R)-[4-(хлорметил)фенил]-(4-хлорфенил)метил-3-[(S)-(3,5-дифторфенил) (метилсульфонил)метил]азетидин-3-ола, 8,2 г 4-диметиламинопиридина, 150 см 3 дихлорметана и 3,2 см 3 метилсульфонилхлорида. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 3 см, высота 30 см), под давлением аргона 0,2 бар, элюируя дихлорметаном и собирая фракции по 100 см 3. Фракции 15-30 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 2,50 г 1-(R)-[4-(хлорметил) фенил]-(4-хлорфенил)метил-3-[(3,5-дифторфенил)(метилсульфонил)метилен]азетидина, изомерной формы В, в виде меренги белого цвета. Смесь 2 диастереоизомерных форм В 1-(R)-[4-(хлорметил) фенил]-(4-хлорфенил)метил-3-[(R)(3,5-дифторфенил)(метилсульфонил)метил]азетидин-3-ола и 1-(R)-[4-(хлорметил)фенил]-(4-хлорфенил)метил-3-[(S)-(3,5-дифторфенил)метилсульфонилметил]азетидин-3-ола может быть получена согласно методике, описанной в примере 3, исходя из 11,0 г смеси 2 диастереоизомерных форм В 1-(R)4-(хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(R)-(3,5-дифторфенил)(метилсульфонил)метил]азетидин-3-ола и 1-(R)-4-(хлорфенил) [4-(гидроксиметил)фенил]метил-3-[(S)-(3,5-дифторфенил)(метилсульфонил)метил]азетидин-3-ола, 250 см 3 дихлорметана и 3,1 см 3 тионилхлорида. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 3 см, высота 30 см), под давлением аргона 0,2 бар, элюируя смесью циклогексана и этилацетата (в соотношении 70:30 по объемам) и собирая фракции по 50 см 3. Фракции 9-25 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 7,3 г смеси 2 диастереоизомерных форм В 1-(R)-[4(хлорметил)фенил]-(4-хлорфенил)метил-3-[(R)-(3,5-дифторфенил) (метилсульфонил)метил]азетидин-3 ола и 1-(R)-[4-(хлорметил) фенил]-(4-хлорфенил)метил-3-[(S)-(3,5-дифторфенил) (метилсульфонил)метил]азетидин-3-ола в виде меренги белого цвета. Смесь 2 диастереоизомерных форм В 1-(R)-4-(хлорфенил) [4-(гидроксиметил)фенил]метил-3[(R)-(3,5-дифторфенил)(метилсульфонил)метил]азетидин-3-ола и 1-(R)-4-(хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(R)-(3,5-дифторфенил) (метилсульфонил)метил]азетидин-3-ола может быть получена согласно методике, описанной в примере 3, исходя из 18,0 г смеси двух диастереоизомерных форм В 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(R)-(3,5-дифторфенил)(метилсульфонил)метил]азетидина и 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(S)-(3,5-дифторфенил)(метилсульфонил)метил]азетидина, 150 см 3 безводного толуола и 100 см 3 20%-ного раствора диизобутилалюминийгидрида в толуоле. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 3 см, высота 30 см), под давлением аргона 0,1 бар, элюируя смесью циклогексана и этилацетата (в соотношении 50 : 50 по объемам) и собирая фракции по 50 см 3. Фракции 15-30 объединяют, затем концентрируют досуха при пониженном давлении(2,7 кПа). Получают 11,0 г смеси 2 диастереоизомерных форм В 1-(R)-4-(хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(R)-(3,5-дифторфенил) (метилсульфонил)метил]азетидин-3-ола и 1-(R)-4(хлорфенил)[4-(гидроксиметил)фенил]метил-3-[(S)-(3,5-дифторфенил)(метилсульфонил)метил]азетидин-3-ола в виде меренги белого цвета. Смесь 2 диастереоизомерных форм В 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(R)-(3,5-дифторфенил)(метилсульфонил)метил]азетидина и 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(S)-(3,5-дифторфенил)(метилсульфонил)метил]азетидина может быть получена согласно методике, описанной в примере 3, исходя из 11,2 г (3,5-дифторбензил) метилсульфона, 350 см 3 тетрагидрофурана, 34 см 3 1,6 н. раствора н-бутиллития в гексане, 11,2 г 1-(R)(4-хлорфенил)[4-(метоксикарбонил)фенил]метил азетидин-3-она, изомерной формы В, и 5,5 см 3 ацетилхлорида. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 4 см, высота 40 см), элюируя смесью циклогексана и этилацетата (в соотношении 70:30 по объемам) и собирая фракции по 100 см 3. Фракции 10-30 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 21 г еще загрязненной меренги кремового цвета, которую хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 4 см, высота 40 см),- 25006583 элюируя дихлорметаном и собирая фракции по 100 см 3. Фракции 11-30 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 20,0 г смеси 2 диастереоизомерных форм В 3 ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3-[(R)-(3,5-дифторфенил)(метилсульфонил)метил]азетидина и 3-ацетокси-1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метил-3[(S)-(3,5-дифторфенил)(метилсульфонил)метил]азетидина в виде меренги белого цвета. 1-(R)-(4-Хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-он, изомерная форма В, может быть получен согласно методике, описанной в примере 3, исходя из 8,7 см 3 оксалилхлорида, 350 см 3 дихлорметана, 14,2 см 3 диметилсульфоксида, 29,0 г 1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил] метилазетидин-3-ола, изомерной формы В, и 43 см 3 триэтиламина. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 4 см, высота 40 см), элюируя дихлорметаном и собирая фракции по 250 см 3. Фракции 7-25 объединяют, затем концентрируют досуха при пониженном давлении (2,7 кПа). Получают 15,5 г 1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-она, изомерной формы В, в виде масла оранжевого цвета. 1-(R)-(4-Хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-ол, изомерная форма В, может быть получен согласно методике, описанной в примере 3, исходя из 25,5 г метил-(-)-4-[(R)-амино(4 хлорфенил)метил]бензоата, 250 см 3 этанола, 7,9 г гидрокарбоната натрия и 7,7 см 3 эпибромгидрина. Получают 29 г 1-(R)-(4-хлорфенил)[4-(метоксикарбонил)фенил]метилазетидин-3-ола, изомерной формы В, в виде масла желтого цвета. Метил-(-)-4-[(R)-амино(4-хлорфенил)метил]бензоат может быть получен путем осуществления двух последовательных перекристаллизаций кристаллов белого цвета в количестве 3,4 г, называемых"кристаллы А" согласно примеру 3, из 68 см 3 этанола с 5% воды при температуре кипения с обратным холодильником. Полученные кристаллы отфильтровывают, отжимают, затем высушивают при пониженном давлении (2,7 кПа). Получают 2,2 г D-(-)-тартрата метил-(-)-4-[(R)-амино-(4-хлорфенил)метил] бензоата в виде кристаллов белого цвета, которые растворяют в 50 см 3 этилацетата. К полученному раствору добавляют 50 см 3 1 н. раствора гидроксида натрия, перемешивают, затем декантируют. Органическую фазу промывают с помощью 50 см 3 воды, затем сушат над сульфатом магния и концентрируют при пониженном давлении (2,7 кПа). Получают 1,9 г метил-(-)-4-[(R)-амино(4-хлорфенил) метил]бензоата в виде твердого вещества белого цвета, []20 365 нм = -58,11 (с=0,5%). Пример 5. 1-[Бис(тиен-2-ил)метил]-3-[(RS)-(3,5-дифторфенил) метилсульфонилметил]азетидин может быть получен согласно методике, описанной в примере 3, исходя из 0,10 г 1-[бис(тиен-2-ил)метил]3-[(3,5-дифторфенил)метилсульфонилметилен] азетидина, 2 см 3 метанола, 2 см 3 дихлорметана и 25 мг боргидрида натрия, при перемешивании в течение 3 ч при температуре 20 С. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 7 см, диаметр 1 см), элюируя под давлением аргона 0,1 бар дихлорметаном и собирая фракции по 4 см 3. Фракции 2-5 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 83 мг 1-[бис(тиен-2-ил)метил]3-[(RS)-(3,5-дифторфенил)метилсульфонилметил] азетидина в виде твердого вещества белого цвета.[Спектр 1 Н-ЯМР (400 МГц, CDCl3)(в м.д.):. 2,60-2,70 (м: 1 Н); 2,66 (с : 3H); 3,31 (м: 2 Н); 3,40 (м: 1 Н); 3,73 (т уш., J= 7,5 Гц: 1 Н); 4,27 (д, J=11 Гц : 1 Н); 4,92 (с: 1 Н); 6,83 (т, J=9 и 2,5 Гц: 1 Н); 6,85-7,00 (м: 6 Н); 7,21 (м : 2 Н)]. 1-[Бис(тиен-2-ил)метил]-3-[(3,5-дифторфенил) метилсульфонилметилен]азетидин может быть получен согласно методике, описанной в примере 6, исходя из 2,2 г 1-[бис(тиен-2-ил)метил]-3-[(3,5 дифторфенил)метилсульфонилметил-(RS)] азетидин-3-ола, 0,64 см 3 метилсульфонилхлорида, 2,3 г 4 диметиламинопиридина и 75 см 3 дихлорметана; после очистки путем хроматографии и кристаллизации из диизопропилового эфира получают 1,3 г 1-[бис(тиен-2-ил)метил]-3-[(3,5-дифторфенил) метилсульфонилметилен]азетидина в виде кристаллов белого цвета, плавящихся при температуре 165 С. 1-[Бис(тиен-2-ил)метил]-3-[(3,5-дифторфенил) метилсульфонилметил-(RS)]азетидин-3-ол может быть получен согласно следующей методике: к охлажденному до температуры -60 С раствору 1,3 г (3,5 дифторбензил)метилсульфона в 20 см 3 тетрагидрофурана в атмосфере аргона в течение 10 мин добавляют 4 см 3 1,6 н. раствора н-бутиллития в гексане. После перемешивания в течение 45 мин при температуре-70 С в течение 10 мин приливают раствор 1,5 г 1-[бис(тиен-2-ил)метил]азетидин-3-она в 20 см 3 тетрагидрофурана. После перемешивания в течение 3 ч при температуре -70 С реакционную смесь оставляют стоять до возврата к комнатной температуре, затем добавляют 10 см 3 водного насыщенного раствора хлорида аммония. Смесь декантируют, органическую фазу сушат над сульфатом магния, фильтруют,затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток обрабатывают с помощью 20 см 3 смеси циклогексана и этилацетата (в соотношении 60:40 по объемам), полученную суспензию фильтруют, твердое вещество отжимают, затем высушивают на воздухе. Получают 2,2 г 1-[бис(тиен-2 ил) метил]-3-[(3,5-дифторфенил)метилсульфонилметил-(RS)]азетидин-3-ола в виде кристаллов белого цвета, плавящихся при температуре 145 С. 1-[Бис(тиен-2-ил)метил]азетидин-3-он может быть получен согласно методике, описанной в примере 1 (способ 2), исходя из 4 г 1-[бис(тиен-2-ил)метил]азетидин-3-ола, 2,6 см 3 диметилсульфоксида, 7,7 см 3 триэтиламина, 7,7 см 3 оксалилхлорида и 100 см 3 дихлорметана. Полученный остаток очищают путем- 26006583 хроматографии на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 3 см, высота 30 см), используя в качестве элюирующего средства смесь циклогексана и этилацетата (в соотношении 1:1 по объемам). Полученные фракции выпаривают досуха при пониженном давлении (2,7 кПа). Получают 3,2 г 1[бис(тиен-2-ил)метил]азетидин-3-она в виде кристаллов кремового цвета, плавящихся при температуре 70 С. 1-[Бис(тиен-2-ил)метил]азетидин-3-ол может быть получен согласно методике, описанной в примере 3, исходя из 6 г 1-[бис(тиен-2-ил)метил]амина, 2,5 см 3 эпибромгидрина, 2,6 г гидрокарбоната натрия и 50 см 3 этанола. Получают 4 г 1-[бис(тиен-2-ил)метил]азетидин-3-ола в виде кристаллов бежевого цвета,плавящихся при температуре 115 С. 1-[Бис(тиен-2-ил)метил]амин может быть получен следующим образом: в атмосфере аргона, к охлажденной до температуры 10 С суспензии тиен-2-илмагнийбромида (полученной из 1,29 г магния и 3,22 см 3 2-бромтиофена в 75 см 3 диэтилового эфира) добавляют по каплям раствор 5 см 3 тиофен-2 илкарбонитрила в 50 см 3 диэтилового эфира. После кипячения с обратным холодильником в течение 1 ч 30 мин реакционную среду охлаждают до температуры 5 С, затем добавляют по каплям 20 см 3 метанола,суспензию фильтруют, твердое вещество промывают метанолом. Полученный фильтрат представляет собой раствор каштанового цвета. В атмосфере аргона, к этому раствору добавляют в виде нескольких порций 2,45 г боргидрида натрия. Смесь перемешивают при комнатной температуре в течение 16 ч, затем разбавляют этилацетатом и медленно добавляют воду. Органическую фазу отделяют, промывают водой, сушат над сульфатом магния и выпаривают досуха при пониженном давлении (2,7 кПа) при температуре 55 С. Получают масло каштанового цвета, которое хроматографируют на колонке с силикагелем (гранулометрия 0,2-0,063 мм; диаметр 8 см, высота 25 см) и элюируют смесью циклогексана и этилацетата (в соотношении 90:10, затем 85:15, по объемам). Фракции 21-30 выпаривают досуха при пониженном давлении (2,7 кПа). Получают 11 г 1-[бис(тиен-2-ил)метил]амина в виде кристаллического твердого вещества. Пример 6. 1-[Бис(п-толил)метил]-3-[(RS)-метилсульфонилфенилметил] азетидин может быть получен согласно методике, описанной в примере 3, исходя из 0,10 г 1-[бис(п-толил)метил]-3-(метилсульфонилфенилметилен)азетидина, 2 см 3 метанола, 2 см 3 дихлорметана и 25 мг боргидрида натрия. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 7 см,диаметр 1 см), элюируя под давлением аргона 0,1 бар дихлорметаном и собирая фракции по 4 см 3. Фракции 5-10 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 35 мг 1[бис(п-толил)метил]-3-[(RS)-метилсульфонилфенилметил]азетидина в виде твердого вещества белого цвета. [Спектр 1H-ЯМР (300 МГц, CDCl3)(в м.д.):. 2,24 (с : 3H); 2,27 (с : 3H); 2,53 (т, J=7,5 Гц : 1 Н); 2,58(с : 3H); 3,19 (м : 2 Н); 3,49 (м : 1 Н); 3,69 (т уш., J= 7,5 Гц : 1 Н); 4,22 (с :1 Н); 4,28 (д, J=11,5 Гц : 1 Н); 6,957,45 (мультиплеты : 13 Н)]. 1-[Бис(п-толил)метил]-3-(метилсульфонилфенилметилен) азетидин может быть получен согласно следующей методике: к раствору 0,48 г 1-[бис(п-толил)метил]-3-[метилсульфонилфенилметил-(RS)]азетидин-3-ола в 25 см 3 безводного дихлорметана добавляют 0,125 см 3 метилсульфонилхлорида, затем, маленькими порциями, 0,465 г 4-диметиламинопиридина. После перемешивания в течение 20 ч при температуре 20 С реакционную смесь промывают 2 раза по 80 см 3 воды, с помощью 80 см 3 рассола, сушат над сульфатом магния, затем концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,040-0,063 мм; высота 17 см, диаметр 3,2 см),элюируя под давлением аргона 0,5 бар с помощью смеси циклогексана и этилацетата (в соотношении 80:20 по объемам) и собирая фракции по 40 см 3. Фракции 5-8 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток перемешивают с диизопропиловым эфиром, твердое вещество отфильтровывают, отжимают, затем высушивают при пониженном давлении (2,7 кПа). Получают 0,25 г 1-[бис(п-толил)метил]-3-(метилсульфонилфенилметилен)азетидина в виде твердого вещества белого цвета. [Спектр 1H-ЯМР (250 МГц, ДМСО-d6, Т=300 K)(в м.д.):. 2,23 (6 Н, с, 2 Ph-СН 3), 2,98 (3H, с,SСН 3), 3,76 (2 Н, с, NCH2), 4,20 (2 Н, с, NCH2), 5,55 (1 Н, с, NCH), 7,10 (4 Н, д, J=7 Гц, 4 СН аром.), 7,32 (4 Н,д, J=7 Гц, 4 СН аром.), 7,43 (5 Н, с, фенил)]. 1-[Бис(п-толил)метил]-3-[(метилсульфонил)фенилметил-(RS)]азетидин-3-ол может быть получен согласно следующей методике: к раствору 0,59 г бром(бис-п-толил)метана в 20 см 3 ацетонитрила добавляют 0,6 г гидрохлорида 3-[(метилсульфонил) (фенил)метил-(RS)]азетидин-3-ола, затем 0,3 г карбоната калия. После кипячения с обратным холодильником в течение 1 ч 15 мин, реакционную смесь охлаждают до температуры 20 С и фильтруют. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) и остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 4 см,высота 16 см ), элюируя с помощью смеси циклогексана и этилацетата (в соотношении 70:30 по объемам) и собирая фракции по 50 см 3. Фракции 8-13 концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,48 г 1-[бис(п-толил)метил]-3-[(метилсульфонил)(фенил)метил-(RS)]азетидин-3-ола в виде твердого вещества белого цвета. Бром(бис-п-толил)метан может быть получен согласно методике, описанной W.E. BACHMANN, J.- 27006583 Гидрохлорид 3-[(метилсульфонил)фенилметил-(RS)]азетидин-3-ола может быть получен согласно следующей методике: к раствору 2,62 г 3-[(метилсульфонил)(фенил)метил-(RS)]-1-(винилоксикарбонил) азетидин-3-ола в 12,6 см 3 диоксана добавляют 12,6 см 3 6,2 н. раствора хлороводорода в диоксане. После перемешивания в течение 20 ч при температуре 20 С смесь концентрируют досуха при температуре 50 С при пониженном давлении (2,7 кПа). Остаток обрабатывают с помощью 25 см 3 этанола, кипятят с обратным холодильником в течение 1 ч, затем оставляют стоять до возврата температуры к 20 С и фильтруют. Твердое вещество промывают диэтиловым эфиром, затем отжимают и высушивают при пониженном давлении (2,7 кПа). Получают 1,89 г гидрохлорида 3-[(метилсульфонил)фенилметил-(RS)]азетидин-3-ола в виде кристаллов белого цвета. 3-[(Метилсульфонил)(фенил)метил-(RS)]-1-(винилоксикарбонил)азетидин-3-ол может быть получен согласно следующей методике: к охлажденной до температуры +5 С смеси 3,92 г 1-бензгидрил-3[(метилсульфонил)(фенил)метил-(RS)] азетидин-3-ола в 500 см 3 безводного дихлорметана добавляют по каплям раствор 0,99 см 3 винилхлорформиата в 4 см 3 безводного дихлорметана. После перемешивания в течение 48 ч при температуре 20 С, реакционную смесь концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,04-0,06 мм; диаметр 5,6 см, высота 15,5 см), элюируя с помощью смеси циклогексана и этилацетата (в соотношении 70:30 по объемам) и собирая фракции по 50 см 3. Фракции 17-36 концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,9 г 3-[(метилсульфонил)(фенил)метил-(RS)]-1-(винилоксикарбонил) азетидин-3-ола в виде твердого вещества белого цвета. 1-Бензгидрил-3-[(метилсульфонил)(фенил)метил-(RS)] азетидин-3-ол может быть получен согласно методике, описанной в примере 1 (способ 1), исходя из 47 см 3 диизопропиламина, 205,6 см 3 1,6 М раствора н-бутиллития в гексане, 2,2 л тетрагидрофурана, 50 г бензилметилсульфона и 69,6 г 1-бензгидрилазетидин-3-она. Получают 94,3 г 1-бензгидрил-3-[(метилсульфонил)(фенил)метил-(RS)]азетидин-3-ола в виде кристаллов белого цвета. Пример 7. 1-[Бис(3-фторфенил)метил]-3-(RS)-[(3,5-дифторфенил) метилсульфонилметил]азетидин может быть получен согласно методике, описанной в примере 3, исходя из 0,10 г 1-[бис(3-фторфенил) метил]-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидина, 2 см 3 метанола, 2 см 3 дихлорметана и 20 мг боргидрида натрия, при перемешивании в течение 48 ч при температуре 20 С. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 7 см, диаметр 1 см),элюируя под давлением аргона 0,1 бар дихлорметаном и собирая фракции по 4 см 3. Фракции 3-7 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 95 мг 1-[бис(3 фторфенил)метил]-3-(RS)-[(3,5-дифторфенил)метилсульфонилметил] азетидина в виде кристаллов белого цвета. [Спектр 1H-ЯМР (300 МГц; CDCl3)(в м.д.): 2,57 (т, J=7,5 Гц : 1 Н); 2,66 (с: 3H); 3,15-3,30 (м: 2 Н); 3,30-3,50 (м: 1 Н); 3,66 (т уш., J= 7,5 Гц: 1 Н); 4,27 (д, J=11,5 Гц: 1 Н); 4,28 (с: 1 Н); 6,75-7,35 (м: 11 Н)]. 1-[Бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)метилсульфонилметилен]азетидин может быть получен согласно методике, описанной в примере 6, исходя из 1,15 г 1-[бис(3-фторфенил)метил]-3-[(3,5 дифторфенил)(метилсульфонил)метил-(RS)]азетидин-3-ола, 30 см 3 дихлорметана, 0,264 см 3 метилсульфонилхлорида и 0,98 г 4-диметиламинопиридина. После хроматографии на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 2,8 см, высота 25 см), под давлением аргона 1 бар, при использовании смеси этилацетата и циклогексана (в соотношении 15:85 по объемам) в качестве элюирующего средства и собирая фракции по 60 см 3, получают 0,55 г 1-[бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метилен] азетидина в виде твердого вещества белого цвета, плавящегося при температуре 178 С. 1-[Бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил)метил-(RS)]-азетидин-3-ол может быть получен согласно следующей методике: к охлажденной до температуры -60 С смеси диизопропиламина и 10 см 3 тетрагидрофурана в течение 10 мин приливают 3,65 см 3 1,6 М раствора н-бутиллития в гексане, перемешивают в течение 10 мин при температуре -30 С, затем охлаждают до температуры-70 С. После этого в течение 20 мин добавляют раствор 1,2 г (3,5-дифторбензил)метилсульфона в 30 см 3 тетрагидрофурана. После перемешивания в течение 30 мин при температуре -70 С, к смеси в течение 30 мин добавляют раствор 1,5 г 1-[бис(3-фторфенил)метил]азетидин-3-она в 10 см 3 тетрагидрофурана. После перемешивания в течение 2 ч при температуре -70 С реакционную смесь доводят до комнатной температуры, затем добавляют 20 см 3 водного насыщенного раствора хлорида аммония и 100 см 3 дихлорметана. Смесь декантируют, органическую фазу промывают водой, затем сушат над сульфатом магния,фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 3,2 см, высота 30 см), элюируя под давлением аргона 1 бар с помощью смеси этилацетата и циклогексана (в соотношении 20:80 по объемам) и собирая фракции по 60 см 3. Фракции 9-20 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 1,95 г 1-[бис(3-фторфенил)метил]-3-[(3,5-дифторфенил)(метилсульфонил) метил-(RS)]азетидин-3-ола в виде твердого вещества белого цвета, плавящегося при температуре 170 С(разложение). 1-[Бис(3-фторфенил)метил]азетидин-3-он может быть получен согласно методике, описанной в примере 1 (способ 2), исходя из 0,7 см 3 оксалилхлорида, 16 см 3 дихлорметана, 1,12 см 3 диметилсульфок- 28006583 сида, 2 г 1-[бис(3-фторфенил)метил]азетидин-3-ола и 3,7 см 3 триэтиламина. Получают 1,55 г 1-[бис(3 фторфенил) метил]азетидин-3-она в виде масла, которое кристаллизуется при температуре 20 С. 1-[Бис(3-фторфенил)метил]азетидин-3-ол может быть получен согласно методике, описанной A.R.[Бис(3-фторфенил)метил]амин может быть получен следующим образом: к суспензии 1,27 г литийалюминийгидрида в 80 см 3 тетрагидрофурана в атмосфере аргона в течение 30 мин приливают раствор 5,17 г 3,3'-дифторбензофеноноксима в 30 см 3 тетрагидрофурана. После перемешивания в течение 5 ч при кипячении с обратным холодильником добавляют последовательно 1,3 см 3 воды, 1,3 см 3 4 н. раствора гидроксида натрия, 2,6 см 3 воды, затем 50 см 3 этилацетата. После высушивания над сульфатом магния и концентрирования досуха при пониженном давлении (2,7 кПа) получают 4,9 г [бис(3-фторфенил)метил] амина в виде масла желтого цвета. 3,3'-Дифторбензофеноноксим может быть получен согласно следующей методике: к раствору 5,0 г 3,3'-дифторбензофенона в 10 см 3 этанола по каплям добавляют раствор 1,6 г гидроксиламингидрохлорида в 8 см 3 воды, затем маленькими порциями добавляют 1,2 г гидроксида натрия в пастилках. Реакционную смесь, после кипячения с обратным холодильником в течение 10 мин, охлаждают до температуры 20 С, затем подкисляют с помощью 7,5 см 3 4 н. соляной кислоты. Полученный маслянистый осадок, подвергнутый один раз порошкованию, становится твердым веществом белого цвета, которое отфильтровывают, промывают водой, затем высушивают при температуре 35 С при пониженном давлении (2,7 кПа). Получают 5,17 г 3,3'-дифторбензофеноноксима в виде твердого вещества белого цвета. Пример 8. 1-[Бис(4-хлорфенил)метил]-3-(RS)-[3-азетидин-1-илфенил]метилсульфонилметилазетидин может быть получен согласно методике, описанной в примере 3, исходя из 0,10 г 1-[бис(4 хлорфенил)метил]-3-[(азетидин-1-илфенил)метилсульфонилметилен] азетидина, 2 см 3 метанола, 2 см 3 дихлорметана и 30 мг боргидрида натрия, при перемешивании в течение 24 ч при температуре 20 С. Сырой продукт хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 7 см,диаметр 1 см), элюируя под давлением аргона 0,1 бар дихлорметаном и собирая фракции по 4 см 3. Фракции 5-10 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 20 мг 1[бис(4-хлорфенил)метил]-3-(RS)-[3-азетидин-1-илфенил]метилсульфонилметилазетидина в виде лака нечистого белого цвета.[Спектр 1H-ЯМР (300 МГц, СDCl3)(в м.д.): 2,39 (м: 2 Н); 2,50-2,65 (м: 1 Н); 2,60 (с: 3H); 3,20 (м: 2 Н); 3,47 (м: 1 Н); 3,66 (т уш., J=7 Гц: 1 Н); 3,89 (т уш., J=7,5 Гц: 4 Н); 4,20 (д, J=11 Гц: 1 Н); 4,26 (с: 1 Н); 6,35-6,50 (м: 2 Н); 6,67 (д уш., J=7,5 Гц: 1 Н); 7,10-7,40 (м: 9 Н)]. 1-[Бис(4-хлорфенил)метил]-3-[(азетидин-1-илфенил) метилсульфонилметилен]азетидин может быть получен согласно методике, описанной в примере 6, исходя из 0,83 г 1-[бис(4-хлорфенил)метил]-3[(азетидин-1-илфенил)метилсульфонилметил-(RS)]азетидин-3-ола, 20 см 3 дихлорметана, 0,18 см 3 метилсульфонилхлорида и 0,75 г 4-диметиламинопиридина. Получают 0,40 г 1-[бис(4-хлорфенил)метил]-3[(азетидин-1-илфенил) метилсульфонилметилен]азетидина в виде меренги белого цвета. 1-[Бис(4-хлорфенил)метил]-3-[(азетидин-1-илфенил) метилсульфонилметил-(RS)]азетидин-3-ол может быть получен согласно методике, описанной в примере 5, исходя из 1,55 г 1-(3-метилсульфонилметилфенил)азетидина, 5,2 см 3 1,6 М раствора н-бутиллития в гексане, 30 см 3 тетрагидрофурана и 2,11 г 1-[бис(4-хлорфенил)метил]азетидин-3-она. Получают 0,83 г 1-[бис(4-хлорфенил)метил]-3[(азетидин-1-илфенил) метилсульфонилметил-(RS)]азетидин-3-ола в виде твердого вещества цвета охры,плавящегося при температуре 172 С. 1-(3-Метилсульфонилметилфенил)азетидин может быть получен следующим образом: к охлажденной до температуры 0 С смеси 10 см 3 воды, 5 см 3 уксусной кислоты, 1,5 см 3 36 н. серной кислоты и 6,15 г оксона добавляют раствор 1,9 г 1-(3-метилсульфонилметилфенил)азетидина в 10 см 3 этанола. После перемешивания в течение 20 ч при температуре 20 С, к реакционной смеси добавляют 100 см 3 воды, 100 см 3 этилацетата, затем нейтрализуют путем перемешивания с гидрокарбонатом натрия. Полученную смесь декантируют, органическую фазу сушат над сульфатом магния, затем фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 1,55 г 1-(3-метилсульфонилметилфенил)азетидина в виде светлокоричневого смолоподобного вещества. 1-[3-(Метилсульфонилметил)фенил]азетидин может быть получен следующим образом: к раствору 4,6 г 1-иод-3-(метилсульфанилметил)бензола в 60 см 3 тетрагидрофурана в атмосфере аргона добавляют 2,57 г трет-бутилата калия, 0,64 г 1,1'-бис(дифенилфосфино)ферроценилпалладийхлорида, 1,49 г 1,1'бис(дифенилфосфино)ферроцена, 0,12 г иодида меди и 2,0 г азетидина. После кипячения с обратным холодильником в течение 3 ч реакционную смесь охлаждают до комнатной температуры и фильтруют через целит, промывая его затем с помощью 150 см 3 этилацетата. Объединенные фильтрат и служивший для промывки этилацетат подкисляют с помощью 120 см 3 1 н. соляной кислоты, затем декантируют. К водной фазе добавляют 60 см 3 этилацетата, затем подщелачивают с помощью гидрокарбоната натрия и смесь декантируют. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,06-0,200 мм; диаметр 3,5 см, высота 50 см), элюируя под давлением аргона 0,5 бар с помо- 29006583 щью смеси этилацетата и циклогексана (в соотношении 20:80 по объемам) и собирая фракции по 100 см 3. Фракции 1-3 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 1,9 г 1-[3-(метилсульфанилметил)фенил]азетидина в виде масла. 1,1'-Бис(дифенилфосфино)ферроценилпалладийхлорид может быть получен согласно Т. Hayashi и др., в J. Am. Chem. Soc., 106, 158 (1984). 1-Иод-3-(метилсульфанилметил)бензол может быть получен следующим образом: к раствору 25 г 3-иодбензилбромида в 80 см 3 N,N-диметилформамида добавляют 6,4 г метилтиолята натрия. После перемешивания в течение 20 ч при температуре 20 С к реакционной смеси добавляют 250 см 3 воды, 200 см 3 этилацетата и перемешивают, затем декантируют. Органическую фазу промывают 4 раза по 200 см 3 воды, сушат над сульфатом магния, фильтруют, концентрируют досуха при температуре 50 С и пониженном давлении (2,7 кПа). Получают 22 г 1-иод-3-(метилсульфанилметил)бензола в виде смолоподобного вещества. Пример 9. Смесь 2 диастереоизомерных форм А 1-(R)-4-[(4-хлорфенил)3-[(3,5-дифторфенил) метилсульфонилметил-(R)]-3-имидазолилазетидин-1-илметил]бензил-1 Н-имидазола и 1-(R)-4-[(4 хлорфенил)3-[(3,5-дифторфенил)метилсульфонилметил-(S)]-3-имидазолилазетидин-1-илметил]бензил-1 Н-имидазола может быть получена следующим образом: к раствору 50 мг 1-(R)-[4-(хлорметил) фенил](4-хлорфенил)метил-3-[(3,5-дифторфенил) метилсульфонилметилен]азетидина, изомерной формы А, в 1 см 3 дихлорметана добавляют 13,6 мг имидазола. После перемешивания в течение 20 ч при температуре 20 С реакционную смесь прямо хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 7 см, диаметр 1 см), элюируя под давлением аргона 0,1 бар с помощью смеси дихлорметана и метанола (в соотношении 98:2 по объемам) исобирая фракции по 4 см 3. Фракции 4-9 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 20 мг смеси 2 диастереоизомерных форм А 1-(R)-4-[(4-хлорфенил)3-[(3,5-дифторфенил)метилсульфонилметил-(R)]-3-имидазолилазетидин-1-илметил]бензил-1 Н-имидазола и 1-(R)-4-[(4-хлорфенил)-3-[(3,5-дифторфенил) метилсульфонилметил-(S)]-3-имидазолилазетидин-1-илметил]бензил-1 Н-имидазола в виде лака белого цвета. [Спектр 1 Н-ЯМР (300 МГц, CDCl3)(в м.д.): наблюдают смесь диастереоизомеров,2,64 (с: 3H); 3,42 (д, J=8 Гц: 1 Н); 3,50 (д, J=8 Гц:1 Н); 3,75 (м: 1 Н); 4,31 (д уш., J=8 Гц: 1 Н); 4,40 (с: 1 Н); 4,54 и 4,55 (2 с: 2 Н в целом); 4,72 (с: 1 Н); 6,84 (м: 2 Н); 6,87 (с:1 Н); 6,95 (м: 1 Н); 7,11 (с: 1 Н); 7,20-7,40 (м: 12 Н)]. Пример 10. (1-Бензгидрилазетидин-3-ил)фенилметанон-O-метилоксим, смесь 2 изомеров Z и Е, может быть получен следующим образом: к суспензии 0,80 г 1-бензгидрил-3-бензоилазетидина в 30 см 3 этанола добавляют 0,286 г O-метилгидроксиламингидрохлорида и 0,32 г ацетата натрия. После перемешивания в течение 24 ч при температуре кипения с обратным холодильником, реакционную смесь оставляют охлаждаться до комнатной температуры и фильтруют. Фильтрат концентрируют досуха при температуре 50 С при пониженном давлении (2,7 кПа). Остаток обрабатывают с помощью 100 см 3 дихлорметана и к полученному раствору добавляют 20 см 3 воды и 1 н. соляную кислоту при перемешивании вплоть до достижения кислого значения рН. Органическую фазу декантируют, сушат над сульфатом магния, затем фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа). Остаток хроматографируют на колонке с силикагелем (гранулометрия 0,063-0,200 мм; высота 36 см, диаметр 3,8 см),элюируя под давлением аргона 0,5 бар с помощью смеси циклогексана и этилацетата (в соотношении 95:5, 92:8, затем 80:20, по объемам) и собирая фракции по 30 см 3. Фракции 8-14 объединяют и концентрируют досуха при пониженном давлении (2,7 кПа). Получают 0,20 г (1-бензгидрилазетидин-3 ил)фенилметанон-O-метилоксима, смесь 2 изомеров Z и Е, в виде твердого вещества белого цвета.[Спектр 1H-ЯМР (250 МГц, (CD3)2SO - d6)(в м.д.): наблюдают смесь изомеров в соотношении 65 : 35,2,68-3,02 и 3,25-3,90 (мультиплеты : 5 Н в целом); 3,76 и 3,80 (2 с : 3H в целом); 4,26 и 4,38 (2 с : 1 Н в целом); 7,10-7,50 (м :15 Н)]. 1-Бензгидрил-3-бензоилазетидин может быть получен следующим образом: к охлажденному до температуры 0 С раствору 11,5 г N-метокси-N-метиламида (1-бензгидрилазетидин-3-ил) карбоновой кислоты в 350 см 3 тетрагидрофурана в атмосфере аргона по каплям добавляют 112 см 3 1 М раствора фенилмагнийбромида в тетрагидрофуране, затем смесь оставляют стоять до возврата к комнатной температуре. После перемешивания в течение 20 ч при температуре 20 С к реакционной смеси добавляют 400 см 3 водного насыщенного раствора хлорида аммония, затем 250 см 3 этилацетата. После перемешивания смесь декантируют, водную фазу экстрагируют повторно с помощью 250 см 3 этилацетата и обе объединенные органические фазы промывают два раза по 250 см 3 воды, сушат над сульфатом магния, затем фильтруют и концентрируют досуха при температуре 50 С и пониженном давлении (2,7 кПа). Остаток перемешивают с 50 см 3 диизопропилового эфира, суспензию фильтруют, твердое вещество отжимают,затем высушивают при пониженном давлении (2,7 кПа). Получают 9,76 г 1-бензгидрил-3-бензоилазетидина в виде твердого вещества кремового цвета.N-Метокси-N-метиламид (1-бензгидрилазетидин-3-ил) карбоновой кислоты может быть получен следующим образом: к суспензии N,O-диметилгидроксиламингидрохлорида в 250 см 3 дихлорметана при перемешивании добавляют 13,35 г (1-бензгидрилазетидин-3-ил)карбоновой кислоты и 1,0 г гидроксибензотриазолгидрата. К этой смеси, находящейся в атмосфере аргона и охлажденной до температуры +5 С,- 30
МПК / Метки
МПК: C07D 409/12, C07D 403/14, C07D 205/06, C07D 409/14, C07D 409/06, C07D 401/12, C07D 403/10, C07D 401/06, C07D 403/04, C07D 403/06, C07D 205/04
Метки: получения, способ, фармацевтические, производные, азетидина, содержащие, композиции
Код ссылки
<a href="https://eas.patents.su/30-6583-proizvodnye-azetidina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные азетидина, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Фармацевтический дезинфицирующий препарат на основе уснината натрия и лекарственных растений, (его варианты) и способы их изготовления
Следующий патент: Центробежный деаэратор
Случайный патент: Новые соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат