Производные пурина, способ их получения и содержащие их фармацевтические композиции
Формула / Реферат
1. Соединения формулы I
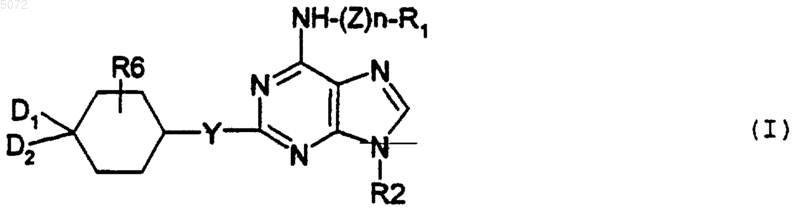
в которой
Z обозначает двухвалентный радикал -CH2-, -SO2-, -CO-, -COO-, -CONH- или - (CH2)2-NR3-;
n обозначает целое число 0 или 1;
R1 выбирают из атома водорода, радикалов арил, -CH2-арил, -SO2-арил, -CO-арил, гетероциклический радикал, -CH2-гетероциклический радикал, алкил и -SO2-алкил;
R2 обозначает возможно замещенный нормальный или разветвленный алкильный радикал, содержащий не более 10 атомов углерода, циклоалкильный радикал или насыщенный или ненасыщенный гетероциклический радикал, образованный не более чем 6 звеньями, из которых одно или несколько звеньев представлены атомом кислорода, атомом серы или радикалом NR3;
Y обозначает атом кислорода, атом серы или радикал NR3;
D1 и D2 либо, одинаковые или разные, выбирают из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 6 атомов углерода, и радикалов NHR5, либо вместе образуют радикал =O или =N-OR4;
R3 обозначает атом водорода, радикал алкил или циклоалкил;
R4 обозначает атом водорода, радикал алкил, циклоалкил или арил;
R5 обозначает атом водорода, радикал алкил, циклоалкил или радикал -COO-t-Bu (БОК);
R6 обозначает атом водорода, атом галогена, радикал гидроксил, радикал алкил, алкокси, нормальный или разветвленный, содержащий не более 6 атомов углерода, или радикал NHR3;
причем все определенные выше циклоалкильные радикалы содержат не более 6 атомов углерода;
все определенные выше алкильные радикалы являются нормальными или разветвленными и содержат не более 6 атомов углерода;
все определенные выше радикалы - циклоалкил, алкил, арил и гетероциклический радикал, могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано, нитро, арил, трифторметил, трифторметокси, алкокси, содержащего не более 6 атомов углерода, радикалов -NHR4, -COR4, -COOR4 и -CONHR4, в которых R4 имеет указанное выше значение, и радикалов с кислотной функцией или изостер кислот, обозначающих свободный, превращенный в соль или этерифицированный карбоксильный радикал, свободный или превращенный в соль радикал тетразолил или радикалы: -SO3H, -PO(OH)2, NH-SO2-CF3, -NH-SO2-NH-V, -NH-SO2-NH-CO-V, -NH-CO-V, -NH-CO-NH-V, -NH-CO-NH-SO2-V, -SO2-NH-V, -SO2-NH-CO-V, SO2-NH-CO-NH-V, -CO-NH-V, -CO-NH-OH, -CO-NH-SO2-V, в которых V обозначает атом водорода, нормальный или разветвленный радикал алкил или алкенил, содержащий не более 6 атомов углерода, радикал фенил или радикал тиазолил, причем обозначающие V радикалы алкил, алкенил и фенил могут быть замещены заместителями, указанными выше для радикалов алкил и арил, все определенные выше арильные и гетероциклические радикалы могут быть также замещены одним или несколькими алкильными радикалами, содержащими не более 6 атомов углерода и, возможно, замещенными радикалом CN или радикалом COOR4, в котором R4 имеет указанное выше значение;
все определенные выше арильные радикалы могут кроме того быть замещены радикалом диоксол, радикалом -S-алкил, содержащим не более 6 атомов углерода, или радикалом арил или циклоалкил, содержащими не более 6 атомов углерода, прерываемые одним или несколькими гетероатомами, выбранными из атомов кислорода, азота и серы;
при этом гетероциклический радикал обозначает насыщенный или ненасыщенный карбоциклический радикал, образованный не более чем 6 звеньями, прерванными одним или несколькими одинаковыми или разными гетероатомами, выбираемыми из атомов кислорода, азота и серы,
при условии, что если Z обозначает -CH2-, n обозначает 0 или 1, R1 обозначает арил, -CH2-арил, гетероциклический радикал, -CH2-гетероциклический радикал или алкил, Y обозначает NR3 и R2, R3, R4 и R5 имеют значения, указанные выше, то либо D1 и D2 образуют вместе радикал =O или =N-OR4, либо один из D1, D2 и R6 отличается от атома водорода, галогена, алкила или алкоксила, причем соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы I.
2. Соединения формулы I, определенной в п.1, соответствующие формуле Ia
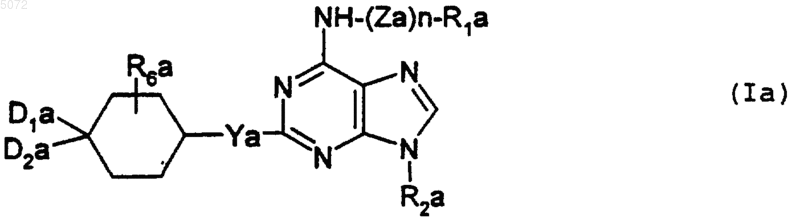
в которой
Za обозначает двухвалентный радикал -CH2-, -SO2-, -CO- или -(CH2)2-NR3a-;
n обозначает целое число 0 или 1;
R1a выбирают из атома водорода и радикалов фенил, -CH2-фенил, -SO2-фенил, -CO-фенил, пиридил, -CH2-пиридил, алкил и -SO2-алкил;
R2a обозначает радикал алкил, циклоалкил или насыщенный или ненасыщенный гетероциклический радикал, образованный 5 звеньями, из которых одно представлено атомом кислорода, атомом серы или радикалом NR3;
Ya обозначает атом кислорода, атом серы или радикал NR3a;
D1a и D2a либо, одинаковые или разные, выбирают из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 6 атомов углерода, и радикалов NHR5a, либо вместе образуют радикал =O или =N-OR4a;
R3a обозначает атом водорода, радикал алкил или циклоалкил;
R4a обозначает атом водорода, радикал алкил, циклоалкил или фенил;
R5a обозначает атом водорода, радикал алкил, циклоалкил или радикал -COO-t-Bu (БОК);
R6a обозначает атом водорода, атом галогена, радикал гидроксил, радикал алкил, алкокси, нормальный или разветвленный, содержащий не более 6 атомов углерода, или радикал NHR3a;
причем все определенные выше циклоалкильные радикалы содержат не более 6 атомов углерода;
все определенные выше алкильные радикалы являются нормальными или разветвленными и содержат не более 6 атомов углерода;
все определенные выше радикалы циклоалкил, алкил и фенил могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано, нитро, арил, трифторметил, трифторметокси, алкокси, содержащего не более 6 атомов углерода, радикалов -NHR4a, -COR4a, -COOR4a и -CONHR4a, в которых R4a имеет указанное выше значение, и радикалов SO3H, PO(OH)2, NH-SO2-CF3, NH-SO2-NH-V, SO2-NH-V и NH-SO2-NH-CO-V, в которых V обозначает атом водорода, радикал фенил, тиазолил, алкил или алкенил, из которых алкил и алкенил являются нормальными или разветвленными и содержащими не более 6 атомов углерода;
все определенные выше фенильные радикалы могут кроме того быть замещенными одним или несколькими радикалами, выбранными из радикала алкил, содержащего не более 6 атомов углерода и возможно замещенного радикалом CN или COOR4a, в котором R4a имеет указанное выше значение, радикала S-алкил, содержащего не более 6 атомов углерода, радикалов арил или циклоалкил, содержащих не более 6 атомов углерода, которые могут быть прерваны одним или несколькими атомами, выбранными из атомов кислорода, азота и серы, и радикала диоксол;
причем названные выше соединения формулы Ia существуют во всех возможных изомерных формах: рацемическшх, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы Ia.
3. Соединения формулы I, определенной в п.1, соответствующие формуле Ib
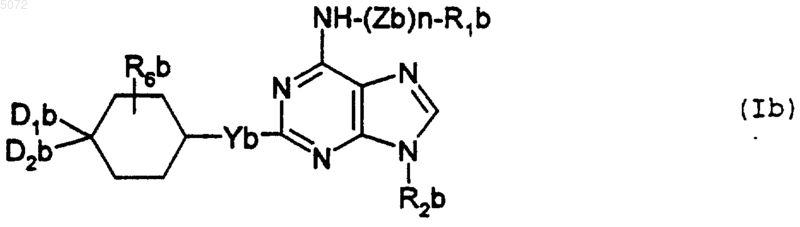
в которой
Zb обозначает двухвалентный радикал -CH2-, -SO2-, -CO- или -(CH2)2-NR3b-;
n обозначает целое число 0 или 1;
R1b выбирают из атома водорода и радикалов: фенил, -CH2-фенил, -CO-фенил, -SO2-фенил, пиридил, -CH2-пиридил, алкил и -SO2-алкил, в которых радикал алкил содержит не более 4 атомов углерода и радикалы алкил и фенил могут быть замещены как указано ниже;
R2b обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикал циклоалкил, содержащий не более 6 атомов углерода, радикал тетрагидрофурил, тетрагидротиенил, пирролинил или пирролидинил;
Yb обозначает атом кислорода или радикал NR3b;
D1b и D2b либо, одинаковые или разные, выбирают из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов NHR5b, либо вместе образуют радикал =O или =N-OR4b;
R3b обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, циклоалкил, содержащий не более 6 атомов углерода, или -CH2-фенил;
R4b обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, фенил, -CH2-фенил или радикал циклоалкил, содержащий не более 6 атомов углерода, возможно замещенный радикалом -NHR3b;
R5b обозначает атом водорода, радикал алкил, циклоалкил, содержащий не более 6 атомов углерода, или радикал -COO-t-Bu (БОК);
причем все определенные выше радикалы циклоалкил, алкил и фенил могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов: гидроксил, циано, нитро, фенила, трифторметила, трифторметокси, алкокси, содержащего не более 4 атомов углерода, карбокси - свободного, в виде соли или этерифицированного, -NHR4b, -COR4b и -CONHR4b, в которых R4b имеет указанное выше значение, и радикалов SO3H, PO(OH)2, NH-SO2-CF3, SO2NH2 и SO2-NH-тиазолил;
все определенные выше радикалы фенил, могут кроме того быть замещенными одним или несколькими радикалами, выбранными из радикала алкил, содержащего не более 4 атомов углерода и возможно замещенного радикалом CN или COOR4b, в котором R4b имеет указанное выше значение, радикала S-алкил, содержащего не более 4 атомов углерода, радикала тетразолил, радикала циклоалкил, который может включать в цикл один или несколько атомов, выбранных из атомов кислорода и азота, и радикала диоксол;
причем названные выше соединения формулы Ib существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы Ib.
4. Соединения формулы I, определенной в п.1, соответствующие формуле Ic
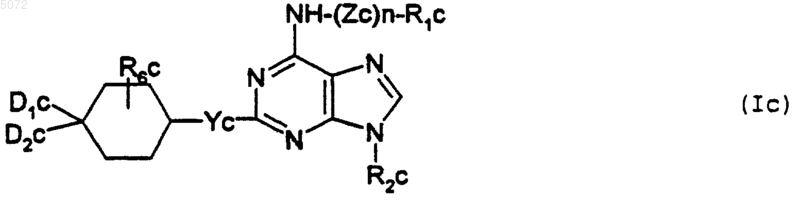
в которой
Zc обозначает двухвалентный радикал -CH2-, -SO2-, -CO-, -(CH2)2-NH-, -(CH2)2-N-алкил, -(CH2)2N-CH2-фенил, в которых радикал фенил, может быть замещен атомом галогена, радикалом: гидроксил, трифторметил, алкокси, содержащим не более 4 атомов углерода, или карбокси - свободным, в виде соли или этерифицированным;
n обозначает целое число 0 или 1;
R1c выбирают из атома водорода и радикалов фенил, -CH2-фенил, -SO2-фенил, -CO-фенил, пиридил, алкил и -SO2-алкил, в которых алкильные радикалы содержат не более 4 атомов углерода и могут быть замещены карбоксирадикалом - свободным, в виде соли или этерифицированным, а все фенильные радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано, нитро, трифторметил, трифторметокси, тиоалкил и алкокси, содержащего не более 4 атомов углерода, алкила, содержащего не более 4 атомов углерода и возможно замещенного радикалом циано, -COOH или COOalk, радикалов фенил, тетразолил, циклоалкил, цикл которого может включать один или несколько атомов кислорода или азота, радикалов -SO2NH2 и SO2-NH-тиазолил, радикалов диоксол, карбокси - свободного, этерифицированного или в виде соли и радикалов -NHR4c и -CONHR4c, у которых R4c обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, или радикал циклогексил, который может быть замещен радикалом NH2;
R2c обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикалы циклопентил, тетрагидрофурил или радикал тетрагидротиенил;
Yс обозначает атом кислорода или радикал -NH или -N-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;
D1c и D2c либо, одинаковые или разные, выбираются из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов -NH2, -NH-COO-t-Bu или -NH-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода, либо вместе образуют радикал =O или =N-O-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;
R6c обозначает атом водорода, атом галогена или гидроксильный радикал;
причем названные выше соединения формулы Ic существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы Ic.
5. Соединения формулы I, определенной в п.1, соответствующие формуле Id
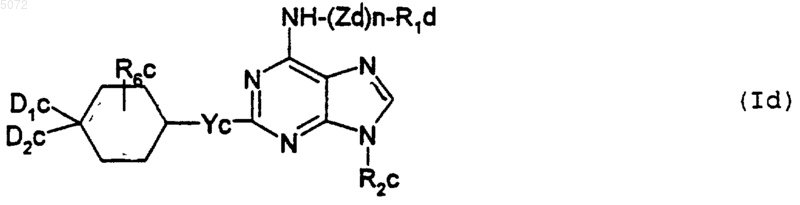
в которой
Zd обозначает двухвалентный радикал -CH2-, -SO2-, -CO-, -(CH2)2NH-, -(CH2)2N-алкил, -(CH2)2N-CH2-фенил, в котором радикал фенил может быть замещен атомом галогена, радикалом гидроксил, трифторметил, алкокси, содержащим не более 4 атомов углерода, или карбокси - свободным, в виде соли или этерифицированным;
n обозначает целое число 0 или 1;
R1d выбирают из атома водорода и радикалов фенил, -CH2-фенил, -SO2-фенил, -CO-фенил, алкил и -SO2-алкил, в которых алкильные радикалы содержат не более 4 атомов углерода и могут быть замещены карбоксирадикалом - свободным, в виде соли или этерифицированным, а все фенильные радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано, нитро, трифторметил, трифторметокси, тиоалкил и алкокси, содержащего не более 4 атомов углерода, алкила, содержащего не более 4 атомов углерода и возможно замещенного радикалом циано или карбокси - свободным или этерифицированным, радикалов морфолинил, фенил, тетразолил, -SO2NH2, SO2-NH-тиазолил, диоксол, карбокси - свободного, этерифицированного или в виде соли, -NHR4c и -CONHR4c, у которых R4c обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, или радикал циклогексил, который может быть замещен радикалом NH2;
R2c обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикалы циклопентил, тетрагидрофурил или радикал тетрагидротиенил;
Yc обозначает атом кислорода или радикал -NH или -N-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;
D1c и D2c либо, одинаковые или разные, выбираются из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов -NH2, -NH-COO-t-Bu или -NH-алкил, в которых нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода, либо вместе образуют радикал =O или =N-O-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;
R6c обозначает атом водорода, атом галогена или гидроксильный радикал;
причем названные выше соединения формулы Id существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы Id.
6. Соединения формулы I, определенные в любом из пп.1-5, представляющие собой следующие соединения:
дигидрохлорид бутилового эфира транс-4-[[[2-[(4-аминоциклогексил)амино]-9-циклопентил-9H-пурин-6-ил]амино]метил]бензойной кислоты,
дигидрохлорид этилового эфира транс-4-[[2-[(4-аминоциклогексил)амино]-9-циклопентил-9H-пурин-6-ил]амино]бензойной кислоты,
тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-[(фенилметил)амино]этил]-9H-пурин-2,6-диамина,
тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-(2-аминоэтил)-9-циклопентил-9H-пурин-2,6-диамина,
тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-[[(4-метоксифенил)метил]амино]этил]-9H-пурин-2,6-диамина,
тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-[2-[[[4-хлор-3-(трифторметил)фенил]метил]амино]этил]-9-циклопентил-9H-пурин-2,6-диамина,
тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[[(дифенилметил)амино]этил]-9H-пурин-2,6-диамина,
тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-[2-[[(4-хлорфенил)метил]амино]этил]-9-циклопентил-9H-пурин-2,6-диамина,
дигидрохлорид этилового эфира транс(± )-4-[[2-[(4-аминоциклогексил)амино]-9-(тетрагидро-3-тиенил)-9H-пурин-6-ил]амино]бензойной кислоты,
дигидрохлорид транс(± )-N2-(4-аминоциклогексил)-9-(тетрагидро-3-тиенил)-N6-[(4-трифторметокси)фенил]-9H-пурин-2,6-диамина,
дигидрохлорид транс(± )-N2-(4-аминоциклогексил)-9-(тетрагидро-3-фуранил)-N6-[(4-трифторметокси)фенил]-9H-пурин-2,6-диамина,
дигидрохлорид транс-N2-(4-аминоциклогексил)-9-(1-этилпропил)-N6-[4-(трифторметокси)фенил]-9H-пурин-2,6-диамина,
дигидрохлорид этилового эфира транс-4-[[2-[(4-аминоциклогексил)амино]-9-(1-этилпропил)-9H-пурин-6-ил]амино]бензойной кислоты.
7. Соединения формулы I, определенные в любом из пп.1-6, представляющие собой следующие соединения:
дигидрохлорид этилового эфира транс-3-[[2-[(4-аминоциклогексил)амино]-9-циклопентил-9H-пурин-6-ил]амино]бензойной кислоты,
тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-[[(3,4-дихлорфенил)метил]амино]этил]-9H-пурин-2,6-диамина,
тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-[[(3,5-дихлорфенил)метил]амино]этил]-9H-пурин-2,6-диамина,
дигидрохлорид транс-4-[[2-[(4-аминоциклогексил)амино]-9-циклопентил-9H-пурин-6-ил]амино]бензолацетонитрила,
дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[4-(4-морфолинил)фенил]-9H-пурин-2,6-диамина,
дигидрохлорид транс-4-[[2-[(4-аминоциклогексил)амино]-9-циклопентил-9H-пурин-6-ил]амино]бензонитрила,
дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-(4-нитрофенил)-9H-пурин-2,6-диамина,
дигидрохлорид транс-N2-(4-аминоциклогексил)-N6-(4-аминофенил)-9-циклопентил-9H-пурин-2,6-диамина,
дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-(4-метоксифенил)-9H-пурин-2,6-диамина,
дигидрохлорид диэтилового эфира транс-5-[[2-[(4-аминоциклогексил)амино]-9-циклопентил-9H-пурин-6-ил]амино]-1,3-бензолдикарбоновой кислоты.
8. Способ получения соединений формулы I, определенной в п.1, отличающийся тем, что соединение формулы II

вводят во взаимодействие с соединением формулы III
R2'-OH (III),
в которой R2' имеет значение, указанное в п.1 для R2, в котором возможные реакционноспособные группы могут быть защищены защитными группами, в результате чего образуется соединение формулы IV

в которой R2' имеет указанное выше значение, после чего соединение формулы IV вводят во взаимодействие с соединением формулы V
NH2-(Z1')n-R1' (V),
в которой R1' имеет значение, указанное в п.1 для R1, и в которой возможные реакционноспособные группы могут быть защищены защитными группами, n обозначает целое число 0 или 1, причем, когда n равно 1, тогда Z1' есть -CH2, в результате чего образуется соединение формулы VIII

в которой R1', R2' и Z1' имеют указанные выше значения; затем соединение формулы VIII подвергают любой из следующих реакций согласно реакциями a), b) или c):
a) либо взаимодействию с соединением формулы XIV

в которой D1', D2', R5' и R6' имеют значения, указанные в п.1 соответственно для D1, D2, R5 и R6, в которых возможные реакционноспособные группы могут быть защищены, с образованием соединения формулы Ix
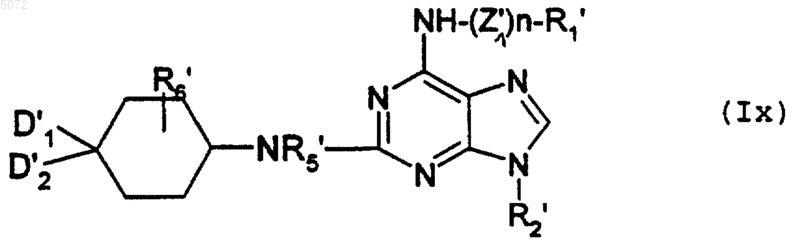
в которой R1', R2', R5', R6', D1' и D2' имеют указанные выше значения, а n обозначает целое число 0 или 1, и когда n обозначает 1, то Z1' обозначает группу -CH2,
при этом соединение формулы Ix соответствует соединению формулы I', в которой Y обозначает -NR5-, а соединения формулы I' имеют значения, указанные выше для соединений формулы I, в которой возможные реакционноспособные функции могут быть защищены защитными группами;
b) либо взаимодействию с соединением формулы XV

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iy
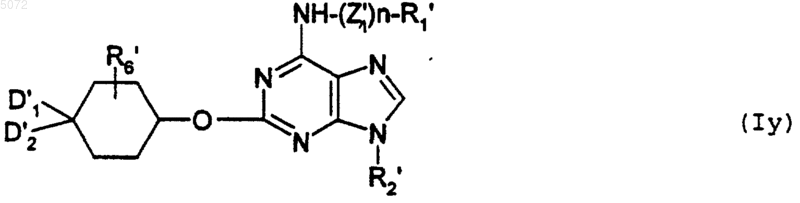
в которой R1', R2', R6', D1', D2' и Z1' имеют указанные выше значения, при этом соединение формулы Iy соответствует соединению определенной выше формулы I', в которой Y обозначает -O-;
c) либо взаимодействию с соединением формулы XVI

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iz
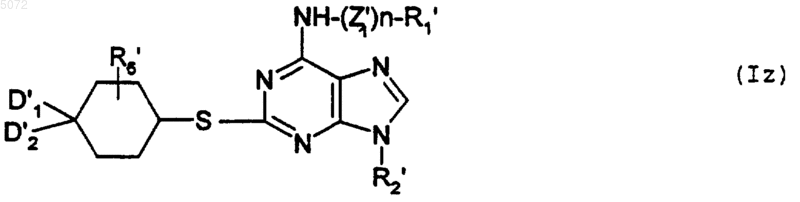
в которой R1', R2', R6', D1', D2' и Z1' имеют указанные выше значения, при этом соединение формулы Iz соответствует соединению определенной выше формулы I', в которой Y обозначает -S-;
соединения формул Ix, Iy и Iz могут быть соединениями формулы I и, для того чтобы получить другие соединения формулы I, можно при желании и при необходимости подвергнуть их одной или нескольким из следующих приведенных в произвольном порядке реакциям превращения:
a) реакции этерификации кислотной функции,
b) реакции омыления сложноэфирной функции в кислотную функцию,
c) реакции окисления алкилтиогруппы в соответствующий сульфоксид или сульфон,
d) реакции превращения кетонной функциив оксимную функцию,
e) реакции восстановления свободной или этерифицированной карбоксильной функции в спиртовую функцию,
f) реакции превращения алкоксильной функции в гидроксильную функцию или гидроксильной функции в алкоксильную функцию,
g) реакции окисления спиртовой функции в альдегидную, кислотную или кетонную функцию,
h) реакции превращения нитрильного радикала в тетразолил,
i) реакции восстановления нитросоединений в аминосоединения,
j) реакции удаления защитных групп, которые могут находиться на защищенных реакционноспособных функциях,
k) реакции солеобразования с минеральной или органической кислотой или с основанием с целью получения соответствующей соли,
l) реакции расщепления рацемических форм в расщепленные продукты, причем полученные таким образом соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных.
9. Способ получения соединений формулы I, определенной в п.1, отличающийся тем, что соединение формулы II

вводят во взаимодействие с соединением формулы III
R2'-OH (III),
в которой R2' имеет значение, указанное в п.1 для R2, в котором возможные реакционноспособные группы могут быть защищены защитными группами, в результате чего образуется соединение формулы IV

в которой R2' имеет указанное выше значение, после чего соединение формулы IV вводят во взаимодействие с соединением формулы VI
NH2-SO2-R1' (VI),
в которой R1' имеет значение, указанное в п.8, в результате чего образуется соединение формулы IX

в которой R1' и R2' имеют указанные выше значения;
которое подвергают реакциям согласно любой из указанных реакций a), b) или c)
a) либо взаимодействию с соединением формулы XIV

в которой D1', D2', R5' и R6' имеют значения, указанные выше, соответственно для D1, D2, R5 и R6, в которых возможные реакционноспособные функции могут быть защищены защитными группами, с образованием соединения формулы Ix
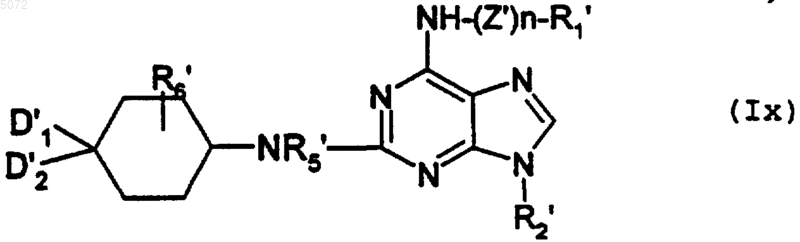
в которой R1', R2', R5', R6', D1' и D2' имеют значения, указанные в п.8, а n обозначает 0 или 1 и, если n обозначает 1, тогда Z' обозначает -SO2,
при этом соединение формулы Ix соответствует соединению формулы I', в которой Y обозначает -NR5-, а соединения формулы I' имеют значения, указанные выше для соединений формулы I, в которой возможные реакционноспособные группы могут быть защищены защитными группами;
b) либо взаимодействию с соединением формулы XV

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iy
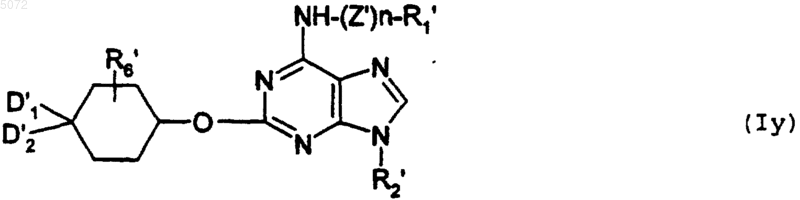
в которой R1', R2', R6', D1', D2' n, Z' имеют указанные выше значения, при этом соединение формулы Iy соответствует соединению определенной выше формулы I', в которой Y обозначает -O-;
c) либо взаимодействию с соединением формулы XVI
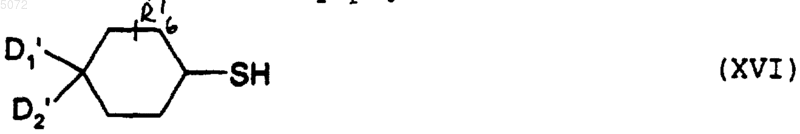
в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iz

в которой R1', R2', n, R6', D1', D2' и Z' имеют указанные выше значения, при этом соединение формулы Iz соответствует соединению определенной выше формулы I', в которой Y обозначает -S-;
соединения формул Ix, Iy и Iz могут быть соединениями формулы I и, для того чтобы получить другие соединения формулы I, можно при желании и при необходимости подвергнуть их одной или нескольким из следующих приведенных в произвольном порядке реакциям превращения:
a) реакции этерификации кислотной функции,
b) реакции омыления сложноэфирной функции в кислотную функцию,
c) реакции окисления алкилтиогруппы в соответствующий сульфоксид или сульфон,
d) реакции превращения кетонной функции в оксимную функцию,
e) реакции восстановления свободной или этерифицированной карбоксильной функции в спиртовую функцию,
f) реакции восстановления алкоксильной функции в гидроксильную функцию или гидроксильной функции в алкоксильную функцию,
g) реакции окисления спиртовой функции в альдегидную, кислотную или кетонную функцию,
h) реакции превращения нитрильного радикала в тетразолил,
i) реакции восстановления нитросоединений в аминосоединения,
j) реакции удаления защитных групп, которые могут находиться на защищенных реакционноспособных функциях,
k) реакции солеобразования с минеральной или органической кислотой или с основанием с целью получения соответствующей соли,
l) реакции расщепления рацемических форм в расщепленные продукты, причем полученные таким образом соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных.
10. Способ получения соединений формулы I, определенной в п.1, отличающийся тем, что соединение формулы II

вводят во взаимодействие с соединением формулы III
R2'-OH (III),
в которой R2' имеет значение, указанное в п.1 для R2, в котором возможные реакционноспособные группы могут быть защищены защитными группами, в результате чего образуется соединение формулы IV

в которой R2' имеет значение, указанное в п.8, после чего соединение формулы IV вводят во взаимодействие с соединением формулы VII
NH2-(CH)2-NH2 (VII),
с получением соединения формулы X

в которой R2' имеет указанное выше значение, после чего соединение формулы X вводят во взаимодействие либо с соединением формулы XI
Cl-SO2-R1" (XI),
в которой R"1 обозначает арил или алкил, указанный для R1, в которых возможные реакционноспособные группы могут быть защищены, с образованием соединения формулы XII
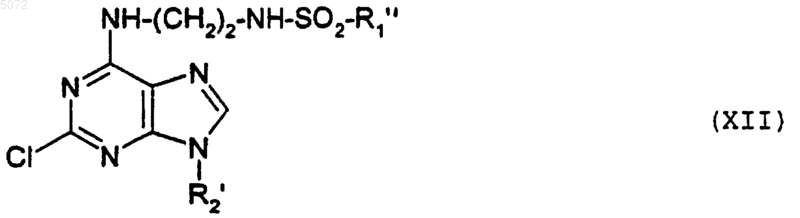
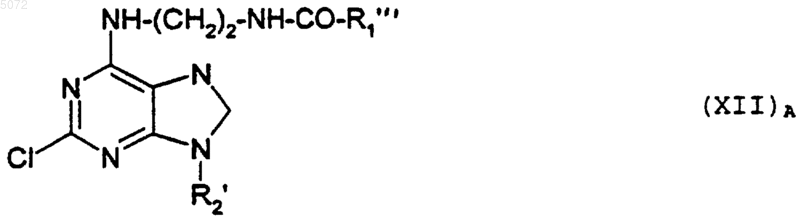
в которой R1" и R2' имеют указанные выше значения;
либо с соединением формулы (XI)A
Cl-CO-R1"' (XI)A
в которой R1'" обозначает арил, указанный для R1, в котором возможные реакционные группы могут быть защищены, с образованием соединения формулы (XII)A
в которой R1"' и R2' имеют указанные выше значения;
либо, в присутствии восстановителя, с соединением формулы XVII
R7-CHO (XVII),
в которой R7 обозначает арил, гетероциклический радикал или алкил, указанные для радикала R1, в которых возможные реакционные группы могут быть защищены, с образованием соединения формулы XIII
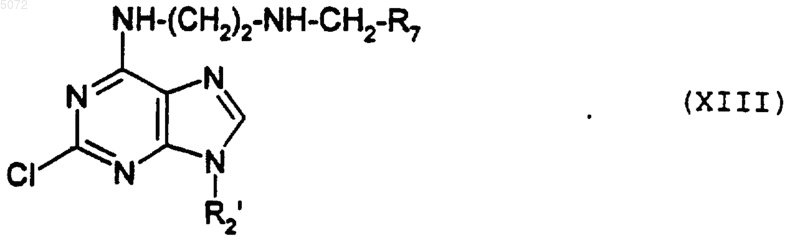
в которой R2' и R7 имеют указанные выше значения;
соединения формулы XII, (XII)A или XIII подвергают реакциям согласно одной из следующих реакций a), b) или c):
a) либо взаимодействию с соединением формулы XIV

в которой D1', D2', R5' и R6' имеют значения, указанные в п.8 соответственно, для D1, D2, R5 и R6, в которых возможные реакционноспособные функции могут быть защищены защитными группами, с образованием соединения формулы Ix
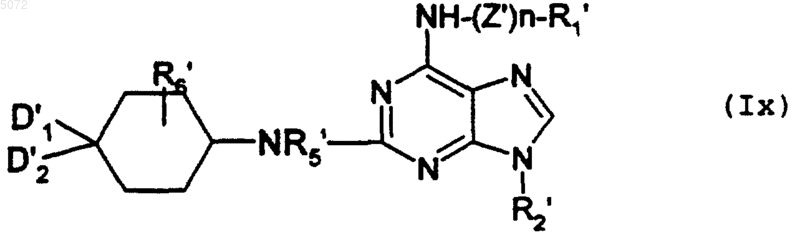
в которой R1', R2', R5', R6', D1' и D2' имеют указанные выше значения и n обозначает 0 или 1, и если n обозначает 1, тогда Z' обозначает -(CH2)2-NH-, при этом соединение формулы Ix соответствует соединению формулы I', в которой Y обозначает -NR5-, а соединения формулы I' имеют значения, указанные выше для соединений формулы I, в которой возможные реакционноспособные группы могут быть защищены защитными группами;
b) либо взаимодействию с соединением формулы XV

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iy
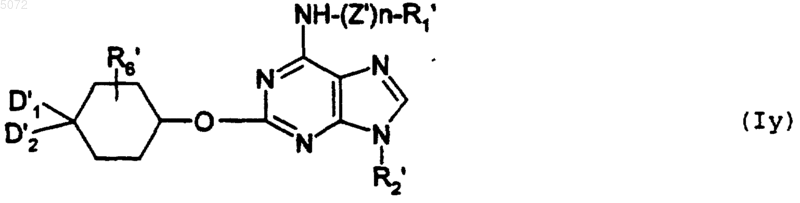
в которой R1', R2', R6', D1', D2', n, Z' имеют указанные выше значения,
при этом соединение формулы Iy соответствует соединению определенной выше формулы I', в которой Y обозначает -O-;
c) либо взаимодействию с соединением формулы XVI

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iz
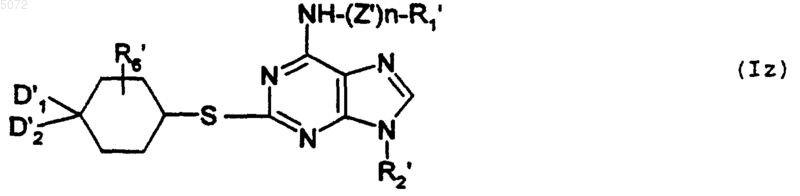
в которой R1', R2', R6', D1', D2', n, Z' имеют указанные выше значения, при этом соединение формулы Iz соответствует соединению определенной выше формулы I', в которой Y обозначает -S-;
соединения формул Ix, Iy и Iz могут быть соединениями формулы I и, для того чтобы получить другие соединения формулы I, можно при желании и при необходимости подвергнуть их одной или нескольким из следующих приведенных в произвольном порядке реакциям превращения:
a) реакции этерификации кислотной функции,
b) реакции омыления сложноэфирной функции в кислотную функцию,
c) реакции окисления алкилтиогруппы в соответствующий сульфоксид или сульфон,
d) реакции превращения кетонной функции в оксимную функцию,
e) реакции восстановления свободной или этерифицированной карбоксильной функции в спиртовую функцию,
f) реакции восстановления алкоксильной функции в гидроксильную функцию или гидроксильной функции в алкоксильную функцию,
g) реакции окисления спиртовой функции в альдегидную, кислотную или кетонную функцию,
h) реакции превращения нитрильного радикала в тетразолил,
i) реакции восстановления нитросоединений в аминосоединения,
j) реакции удаления защитных групп, которые могут находиться на защищенных реакционноспособных функциях,
k) реакции солеобразования с минеральной или органической кислотой или с основанием с целью получения соответствующей соли,
l) реакции расщепления рацемических форм в расщепленные продукты,
причем полученные таким образом соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных.
11. Способ получения соединений формулы I, определенной в п.1, отличающийся тем, что соединение формулы II

вводят во взаимодействие с соединением формулы III
R2'-OH (III),
в которой R2' имеет значение, указанное в п.8 для R2, в котором возможные реакционноспособные группы могут быть защищены защитными группами, в результате чего образуется соединение формулы IV

в которой R2' имеет указанное выше значение, после чего соединение формулы IV вводят во взаимодействие с соединением формулы XVIII
R1'-CO-NH2 (XVIII),
в которой R1' имеет значение, указанное в п.8, с получением соединения формулы M1

в которой R1' и R2' имеют указанные выше значения;
соединение формулы M1 подвергают реакциям в соответствии с любой из следующих реакций a), b) и c):
a) либо взаимодействию с соединением формулы XIV

в которой D1', D2', R5' и R6' имеют значения, указанные в п.8 соответственно для D1, D2, R5 и R6, в которых возможные реакционноспособные функции могут быть защищены защитными группами, с образованием соединения формулы Ix
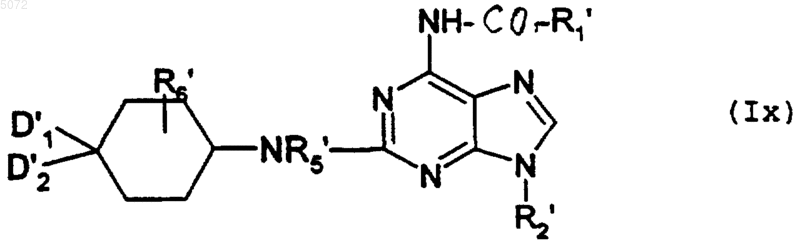
в которой R1', R2', R5', R6', D1' и D2' имеют указанные выше значения, при этом соединение формулы Ix соответствует соединению формулы I', в которой Y обозначает -NR5-, а соединения формулы I' имеют значения, указанные выше для соединений формулы I, в которой возможные реакционноспособные группы могут быть защищены защитными группами;
b) либо взаимодействию с соединением формулы XV

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iy
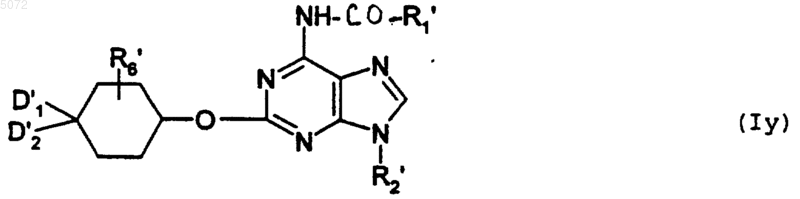
в которой R1', R2', R6', D1', D2' имеют значения, указанные выше,
при этом соединение формулы Iy соответствует соединению определенной выше формулы I', в которой Y обозначает -O-;
c) либо взаимодействию с соединением формулы XVI

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iz

в которой R1', R2', R6', D1', D2' имеют значения, указанные выше,
при этом соединение формулы Iz соответствует соединению определенной выше формулы I', в которой Y обозначает -S-;
соединения формул Ix, Iy и Iz могут быть соединениями формулы I и, для того чтобы получить другие соединения формулы I, можно при желании и при необходимости подвергнуть их одной или нескольким из следующих приведенных в произвольном порядке реакциям превращения:
a) реакции этерификации кислотной функции,
b) реакции омыления сложноэфирной функции в кислотную функцию,
c) реакции окисления алкилтиогруппы в соответствующий сульфоксид или сульфон,
d) реакции превращения кетонной функции в оксимную функцию,
e) реакции восстановления свободной или этерифицированной карбоксильной функции в спиртовую функцию,
f) реакции восстановления алкоксильной функции в гидроксильную функцию или гидроксильной функции в алкоксильную функцию,
g) реакции окисления спиртовой функции в альдегидную, кислотную или кетонную функцию,
h) реакции превращения нитрильного радикала в тетразолил,
i) реакции восстановления нитросоединений в аминосоединения,
j) реакции удаления защитных групп, которые могут находиться на защищенных реакционноспособных функциях,
k) реакции солеобразования с минеральной или органической кислотой или с основанием с целью получения соответствующей соли,
1) реакции расщепления рацемических форм в расщепленные продукты,
причем полученные таким образом соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных.
12. Способ получения соединений формулы I, определенной в п.1, отличающийся тем, что соединение формулы II

вводят во взаимодействие с соединением формулы III
R2'-OH (III),
в которой R2' имеет значение, указанное в п.1 для R2, в котором возможные реакционноспособные группы могут быть защищены, в результате чего образуется соединение формулы IV

в которой R2' имеет указанное выше значение, после чего соединение формулы IV вводят во взаимодействие с аммиаком с получением соединения формулы XIX

в которой R2' имеет указанное выше значение, после чего соединение XIX вводят во взаимодействие или с соединением формулы XX
ClCOOR1' (XX),
в которой R1' имеет указанное в п.8 значение, с образованием соединения формулы M2

в которой R1' и R2' имеют указанные выше значения;
или же с изоцианатом формулы XXI
R1'-N=C=O (XXI),
в которой R1' имеет указанное выше значение, с образованием соединения формулы M3
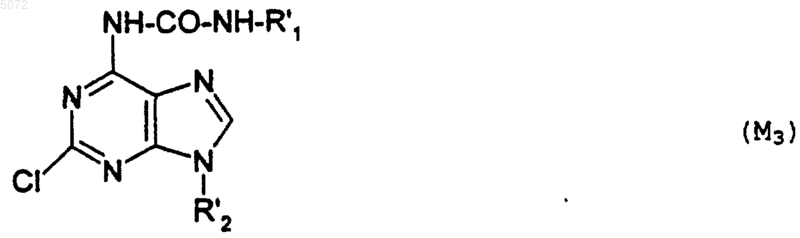
в которой R1' и R2' имеют указанные выше значения;
при этом соединение формулы M2 и M3 могут быть подвергнуты реакциям в соответствии с любой из следующих реакций a), b) или c):
a) либо взаимодействию с соединением формулы XIV

в которой D1', D2', R5' и R6' имеют значения, указанные в п.8 соответственно для D1, D2, R5 и R6, в которых возможные реакционноспособные функции могут быть защищены, с образованием соединения формулы Ix
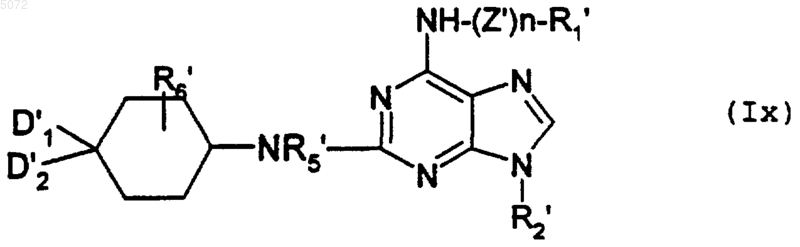
в которой R1', R2', R5', R6', D1' и D2' имеют указанные выше значения и n обозначает 0 или 1 и, если n обозначает 1, то Z' имеет значения, выбранные из радикалов -CONH- и -COO-, возможно защищенных защитными группами,
при этом соединение формулы Ix соответствует соединению формулы I', в которой Y обозначает -NR5-, а соединения формулы I' имеют значения, указанные выше для соединений формулы I, в которой возможные реакционноспособные группы могут быть защищены защитными группами;
b) либо взаимодействию с соединением формулы XV

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iy
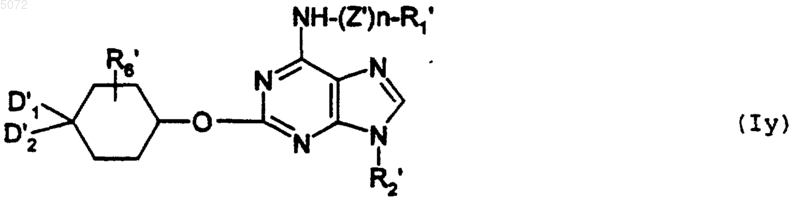
в которой R1', R2', R6', D1', D2', n, Z' имеют указанные выше значения, при этом соединение формулы Iy соответствует соединению определенной выше формулы I', в которой Y обозначает -O-;
c) либо взаимодействию с соединением формулы XVI

в которой D1', D2' и R'6 имеют указанные выше значения, с образованием соединения формулы Iz
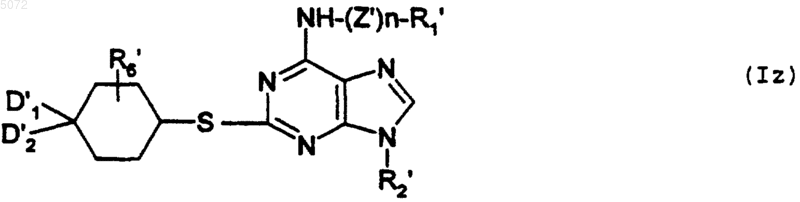
в которой R1', R2', R6', D1', D2', n, Z' имеют указанные выше значения, при этом соединение формулы Iz соответствует соединению определенной выше формулы I', в которой Y обозначает -S-;
соединения формул Ix, Iy и Iz могут быть соединениями формулы I и, для того чтобы получить другие соединения формулы I, можно при желании и при необходимости подвергнуть их одной или нескольким из следующих приведенных в произвольном порядке реакциям превращения:
a) реакции этерификации кислотной функции,
b) реакции омыления сложноэфирной функции в кислотную функцию,
c) реакции окисления алкилтиогруппы в соответствующий сульфоксид или сульфон,
d) реакции превращения кетонной функции в оксимную функцию,
e) реакции восстановления свободной или этерифицированной карбоксильной функции в спиртовую функцию,
f) реакции восстановления алкоксильной функции в гидроксильную функцию или гидроксильной функции в алкоксильную функцию,
g) реакции окисления спиртовой функции в альдегидную, кислотную или кетонную функцию,
h) реакции превращения нитрильного радикала в тетразолил,
i) реакции восстановления нитросоединений в аминосоединения,
j) реакции удаления защитных групп, которые могут находиться на защищенных реакционноспособных функциях,
k) реакции солеобразования с минеральной или органической кислотой или с основанием с целью получения соответствующей соли,
l) реакции расщепления рацемических форм в расщепленные продукты,
причем полученные таким образом соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных.
13. Применение соединений формулы I, определенных по пп.1-7, а также фармацевтически приемлемых солевых аддуктов этих соединений с минеральными и органическими кислотами или с неорганическими и органическими основаниями в качестве лекарственных средств, обладающих антипролиферативными свойствами.
14. Применение соединений формулы I, определенных в пп.1-7, для приготовления лекарственных средств, предназначенных для химиотерапии рака, для лечения псориаза, паразитозов, таких как паразитозы, обусловленные грибками или простейшими, для лечения болезни Альцгеймера или для лечения нейродегенеративных заболеваний, в частности нейронального апоптоза.
15. Фармацевтическая композиция, содержащая в качестве активного начала по меньшей мере одно из лекарственных средств, определенных в п.13.
16. Фармацевтическая композиция по п.15, используемая в качестве антимитотических лекарственных средств, в частности, для химиотерапии рака, а также для лечения псориаза, паразитозов, таких как паразитозы, обусловленные грибками или простейшими, или для лечения болезни Альцгеймера.
17. Фармацевтическая композиция по п.15, используемая в качестве антинейродегенеративных лекарственных средств, в частности, при лечении нейронного апоптоза.
18. Соединения формулы XIII
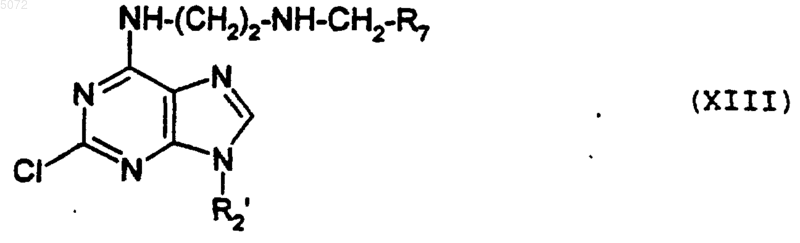
в которой R2' имеет значение, указанное в п.1 для R2, в которых возможные реакционные группы могут быть защищены защитными группами, а R7 обозначает радикал алкил, арил или гетероциклический радикал, указанный для радикала R1, в котором возможные реакционные группы могут быть защищены.
19. Соединения формулы XII

в которой R1" обозначрхт арил или алкил, указанные для радикала R1, в которых возможные реакционноспособные группы могут быть защищены, и R2' имеет значения, указанные в п.1 для R2, в которых возможные реакционные группы могут быть защищены защитными группами.
Текст
1 Настоящее изобретение относится к новым производным пурина, способу их получения,полученным новым промежуточным продуктам,их применению в качестве лекарственных средств, содержащим их фармацевтическим композициям и новому использованию таких производных пурина. Конкретнее, предметом изобретения являются новые производные пурина, обладающие антипролиферативными свойствами, и, в частности, производные пурина, проявляющие ингибиторный эффект в отношении белков - циклин-зависимых киназ, или сокращенно ЦЗК. Это сокращение будет использовано в последующем тексте. Изучение молекулярных механизмов, регулирующих клеточный цикл, позволило выявить регуляторную роль определенных выше ЦЗК. Эти ЦЗК представляют собой белки, состоящие по меньшей мере из двух субъединиц: одной каталитической субъединицы (прототипом которой является cdk2) и одной регуляторной субъединицы (циклин). Известно определенное число ЦЗК. Эти белки образуют белковые комплексы, каждый из которых участвует в одной из фаз клеточного цикла. Существование и роль ЦЗК описаны в многочисленных литературных документах, в качестве примера, можно, в частности, назвать документ WO 97/20842. Были описаны несколько ингибиторов киназ таких как бутиролактон, флавопиридол и 2(2-гидроксиэтиламино)-6-бензиламино-9 метилпурин, называемый оломуцином. Предметом изобретения являются, таким образом, соединения формулы In обозначает целое число 0 или 1;R1 выбирают из атома водорода, радикалов арил, -СН 2-арил, -SO2-арил, -СО-арил, гетероциклический радикал, -СН 2-гетероциклический радикал, алкил и -SO2-алкил;R2 обозначает возможно замещенный нормальный или разветвленный алкильный радикал, содержащий не более 10 атомов углерода,циклоалкильный радикал или насыщенный или ненасыщенный гетероциклический радикал,образованный не более чем 6 звеньями, из которых одно или несколько звеньев представлены атомом кислорода, атомом серы или радикаломY обозначает атом кислорода, атом серы или радикал NR3;D1 и D2 либо, одинаковые или разные, выбирают из атома водорода, гидроксильного ра 005072 2 дикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 6 атомов углерода, и радикалов NHR5, либо вместе образуют радикал =O или =N-OR4;R3 обозначает атом водорода, радикал алкил или циклоалкил;R5 обозначает атом водорода, радикал алкил, циклоалкил или радикал -COO-t-Bu (БОК);R6 обозначает атом водорода, атом галогена, радикал гидроксил, радикал алкил, нормальный или разветвленный алкоксирадикал, содержащий не более 6 атомов углерода, или радикалNHR3; причем все определенные выше циклоалкильные радикалы содержат не более 6 атомов углерода; все определенные выше алкильные радикалы являются нормальными или разветвленными и содержат не более 6 атомов углерода (за исключением особых случаев); все определенные выше радикалы циклоалкил, алкил, арил и гетероциклический радикал могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена,радикалов гидроксил, циано, нитро, арил, трифторметил, трифторметокси, алкокси, содержащего не более 6 атомов углерода, радикаловR4 имеет указанное выше значение и радикалов с кислотной функцией и изостер кислот; все определенные выше арильные и гетероциклические радикалы могут быть также замещены одним или несколькими алкильными радикалами, содержащими не более 6 атомов углерода и, возможно, замещенными радикаломCN или радикалом COOR4, в котором R4 имеет указанное выше значение; все определенные выше арильные радикалы могут, кроме того, быть замещены радикалом диоксол, радикалом -S-алкил, содержащим не более 6 атомов углерода, или радикалом арил или циклоалкил, содержащими не более 6 атомов углерода, прерываемые одним или несколькими гетероатомами, выбранных из атомов кислорода, азота и серы; соединения формулы I существуют во всех возможных изомерных формах: рацемических,энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы I. В соединениях формулы I и в последующем тексте термин нормальный или разветвленный алкильный радикал обозначает радикалы метил, этил, пропил, изопропил, бутил, изобутил,втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил, а также гептил, октил, нонил и 3 децил, а также их нормальные или разветвленные изомеры положения; термин нормальный или разветвленный алкоксирадикал обозначает радикалы метокси,этокси, пропокси, изопропокси, нормальный,вторичный или третичный бутокси, пентокси или гексокси, а также их нормальные или разветвленные изомеры положения; термин атом галогена преимущественно обозначает атом хлора, но может также обозначать атом фтора, брома или йода; термин циклоалкильный радикал обозначает радикалы циклопропил, циклобутил и наиболее предпочтительно радикалы циклопентил и циклогексил; термин арильный радикал обозначает ненасыщенные моноциклические радикалы или радикалы, состоящие из конденсированных карбоциклических циклов. В качестве примеров такого арильного радикала можно назвать радикалы фенил и нафтил; термин гетероциклический радикал обозначает насыщенный или ненасыщенный карбоциклический радикал, образованный не более чем 6 звеньями, прерванными одним или несколькими одинаковыми или разными гетероатомами, выбираемыми из атомов кислорода,азота и серы. Можно, в частности, назвать радикал диоксолан, диоксан, дитиолан, тиооксолан,тиооксан, пиперазинил, пиперазинил, замещенный нормальным или разветвленным алкильным радикалом, содержащим не более 4 атомов углерода, тиенил, такой как 2-тиенил и 3 тиенил, фурил, такой как 2-фурил, пиридил,такой как 2-пиридил, 3-пиридил и 4-пиридил,пиримидил, пирролил, тиазолил, изотиазолил,диазолил, триазолил, тетразолил, тиадиазолил,тиатриазолил, оксазолил, оксадиазолил, 3- или 4-изоксазолил; можно также назвать конденсированные гетероциклические группы, содержащие по меньшей мере один гетероатом, выбранный из серы, азота и кислорода, например бензотиенил, такой как 3-бензотиенил, бензофурил,бензопирролил, бензимидазолил, бензоксазолил,тионафтил, индолил и пуринил. Особенно следует упомянуть радикалы тиенил, такой как 2 тиенил и 3-тиенил, фурил, такой как 2-фурил,тетрагидрофурил, тиенил, тетрагидротиенил,пирролил, пирролинил и пирролидинил. Из насыщенных или ненасыщенных гетероциклических радикалов предпочтительны ненасыщенные гетероциклические радикалы; термин кислотная функция или кислотная изостера обозначает свободный, превращенный в соль или этерифицированный карбоксильный радикал, свободный или превращенный в соль радикал тетразолил или радикалы:NH-SO2-V, в которых V обозначает атом водорода, нормальный или разветвленный радикал алкил или алкенил, содержащий не более 6 атомов углерода, радикал фенил или радикал тиазолил, причем обозначающие V радикалы алкил, алкенил и фенил могут быть замещены заместителями, указанными выше для радикалов алкил и арил в соединениях формулы I. Радикал или радикалы карбокси в соединениях формулы I могут быть превращены в соль или этерифицированы различными известными группами, из которых могут быть, например, названы из солеобразующих соединений: неорганические основания такие, например, как эквивалент натрия, калия, лития, кальция, магния или аммония, или органические основания такие, например, как метиламин, пропиламин,триметиламин, диэтиламин, триэтиламин, N,Nдиметилэтаноламин, трис(гидроксиметил)аминометан, этаноламин, пиридин, пиколин, дициклогексиламин, морфолин, бензиламин, прокаин, лизин, аргинин, гистидин, N-метилглюкамин; из этерифицирующих соединений: алкильные радикалы для образования алкоксикарбонильных групп таких, например, как метоксикарбонил,этоксикарбонил,трет-бутоксикарбонил или бензилоксикарбонил, причем названные алкильные радикалы могут быть замещены радикалами, выбранными, например, из атомов галогена, радикалов гидроксил, алкокси,ацил, ацилокси, алкилтио, амино или арил как,например, в группах хлорметил, гидроксипропил, метоксиметил, пропионилоксиметил, метилтиометил, диметиламиноэтил, бензил или фенетил. Солевые аддукты с минеральными или органическими кислотами соединений формулы I могут, например, быть солями, образованными следующими кислотами: хлористо-водородная,бромистоводородная, йодистоводородная, азотная, серная, фосфорная, пропионовая, уксусная,трифторуксусная, муравьиная, бензойная, малеиновая, фумаровая, янтарная, винная, лимонная, щавелевая, глиоксиловая, аспарагиновая,аскорбиновая, алкилмоносульфоновые кислоты такие, например, как кислоты метансульфоновая, этансульфоновая, пропансульфоновая, алкилдисульфоновые кислоты такие, например,как метандисульфоновая кислота, - и этандисульфоновые кислоты, арилмоносульфоновые кислоты такие как бензолсульфоновая кислота и арилдисульфоновые кислоты. Можно напомнить, что стереоизомерия может быть определена в широком смысле как изомерия соединений, имеющих одинаковые структурные формулы, но различные группы которых по-разному расположены в пространстве, как это, в частности, имеет место в монозамещенных циклогексанах, заместитель в которых может быть в аксиальном или экваториальном положении, и различные возможные 5 вращательные конформации производных этана. Однако существует еще один тип стереоизомерии, который обусловлен различным пространственным расположением заместителей,присоединенных либо у двойных связей, либо на циклах - такую стереоизомерию часто называют геометрической изомерией или цис-трансизомерией. В настоящей заявке термин стереоизомерия используется в его наиболее широком смысле и, следовательно, относится ко всей совокупности указанных выше соединений. Предметом изобретения являются, таким образом, соединения определенной выше формулы I, соответствующие формуле Iаn обозначает целое число 0 или 1;R1a выбирают из атома водорода и радикалов фенил, -СН 2-фенил, -SO2-фенил, -СО-фенил,пиридил, -СН 2-пиридил, алкил и -SO2-алкил;R2a обозначает радикал алкил, циклоалкил или насыщенный или ненасыщенный гетероциклический радикал, образованный 5 звеньями, из которых одно представлено атомом кислорода, атомом серы или радикалом NR3;Ya обозначает атом кислорода, атом серы или радикал NR3a;D1a и D2a либо, одинаковые или разные,выбирают из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 6 атомов углерода, и радикалов NHR5a, либо вместе образуют радикал =O или =N-OR4a;R3a обозначает атом водорода, радикал алкил или циклоалкил;R5a обозначает атом водорода, радикал алкил, циклоалкил или радикал -COO-t-Bu (БОК);R6a обозначает атом водорода, атом галогена, радикал гидроксил, нормальный или разветвленный радикал алкил, алкокси-радикал,содержащие не более 6 атомов углерода или радикал NHR3a; причем все определенные выше циклоалкильные радикалы содержат не более 6 атомов углерода; все определенные выше алкильные радикалы являются нормальными или разветвленными и содержат не более 6 атомов углерода; все определенные выше радикалы циклоалкил, алкил и фенил могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксила, циано, нитро, арила, трифторметила, трифторметокси, алкокси, содержащего не более 6 атомов 6 углерода, радикалов -NHR4a, -COR4a, -COOR4a и -CONHR4a, в которых R4a имеет указанное выше значение, и радикалов SO3 Н, РО(ОН)2,NН-SO2-СF3, NH-SO2-NH-V, SO2-NH-V и NHSO2-NH-CO-V, в которых V обозначает атом водорода, радикал фенил, тиазолил, алкил или алкенил, из которых алкил и алкенил являются нормальными или разветвленными и содержащими не более 6 атомов углерода; все определенные выше фенильные радикалы могут, кроме того, быть замещенными одним или несколькими радикалами, выбранными из радикалов алкил, содержащего не более 6 атомов углерода и возможно замещенного радикалом CN или COOR4a, в котором R4a имеет указанное выше значение, радикала -S-алкил,содержащего не более 6 атомов углерода, радикала арил или циклоалкил, содержащих не более 6 атомов углерода, которые могут быть прерваны одним или несколькими атомами, выбранными из атомов кислорода, азота и серы, и радикала диоксол; названные выше соединения формулы Iа существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулыIа. Предметом настоящего изобретения, более конкретно, являются соединения определенной выше формулы I, соответствующие формуле Ibn обозначает целое число 0 или 1;R1b выбирают из атома водорода и радикалов фенил, -СН 2-фенил, -СО-фенил, -SO2-фенил,пиридил, -СН 2-пиридил, алкил и -SO2-алкил, в которых радикал алкил содержит не более 4 атомов углерода и радикалы алкил и фенил могут быть замещены как указано ниже;R2b обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикал циклоалкил, содержащий не более 6 атомов углерода, радикал тетрагидрофурил, тетрагидротиенил, пирролинил или пирролидинил;Yb обозначает атом кислорода или радикалD1b и D2b либо, одинаковые или разные,выбирают из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов NHR5b, либо вместе образуют радикал =O или =N-OR4b;R3b обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода,циклоалкил, содержащий не более 6 атомов углерода, или -СН 2-фенил;R4b обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода,фенил, -СН 2-фенил или радикал циклоалкил,содержащий не более 6 атомов углерода, возможно замещенный радикалом -NHR3b;R5b обозначает атом водорода, радикал алкил, циклоалкил, содержащий не более 6 атомов углерода или радикал -COO-t-Bu (БОК); причем все определенные выше радикалы циклоалкил, алкил и фенил могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано, нитро, фенил, трифторметил, трифторметокси, алкокси, содержащего не более 4 атомов углерода, карбокси - свободного, в виде соли или этерифицированного, -NHR4b, -COR4b и -CONHR4b, в которых R4b имеет указанное выше значение, и радикалов SO3 Н, РО(ОН)2,NH-SO2-CF3, SO2NH2 и SO2-NН-тиазолил; все определенные выше радикалы фенил,могут кроме того быть замещенными одним или несколькими радикалами, выбранными из радикалов алкил, содержащего не более 4 атомов углерода и возможно замещенного радикаломCN или COOR4b, в котором R4b имеет указанное выше значение, радикала -S-алкил, содержащего не более 4 атомов углерода, радикала тетразолил, радикала циклоалкил, который может включать один или несколько атомов, выбранных из атомов кислорода и азота, и радикала диоксол; названные выше соединения формулы Ib существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулыIb. Предметом настоящего изобретения, еще более конкретно, являются соединения определенной выше формулы I, соответствующие формуле Iс-CH2-, -SO2-, -CO-, -(CH2)2-NH-, -(СН 2)2-Nалкил, -(СН 2)2N-СН 2-фенил, в которых радикалы фенил, могут быть замещены атомом галогена, радикалом гидроксил, трифторметил, алкокси, содержащим не более 4 атомов углерода,или карбокси - свободным, в виде соли или этерифицированным;n обозначает целое число 0 или 1;R1c выбирают из атома водорода и радикалов фенил, -СН 2-фенил,-SO2-фенил, -СО-фенил, пиридил, алкил и SO2-алкил, в которых алкильные радикалы содержат не более 4 атомов углерода и могут быть замещены карбокси-радикалом - свободным, в виде соли или этерифицированным, а все фенильные радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано,нитро, трифторметил, трифторметокси, тиоалкил и алкокси, содержащего не более 4 атомов углерода, алкила, содержащего не более 4 атомов углерода и возможно замещенного радикалом циано, -СООН или COOalk, радикалов фенил, тетразолил, циклоалкил, цикл которого может включать один или несколько атомов кислорода или азота, радикалов -SO2NH2 и SO2NH-тиазолил, радикалов диоксол, карбокси свободного, этерифицированного или в виде соли и радикалов -NHR4c и -CONHR4C, у которых R4c обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода,или радикал циклогексил, который может быть замещен радикалом NH2;R2c обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикалы циклопентил, тетрагидрофурил или радикал тетрагидротиенил;Yc обозначает атом кислорода или радикал-NH или -N-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;D1c и D2c либо, одинаковые или разные,выбираются из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов -NH2, -NH-COO-tBu или -NH-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода, либо вместе образуют радикал =O или =N-O-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;R6c обозначает атом водорода, атом галогена или гидроксильный радикал; причем названные выше соединения формулы Iс существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулыIс. Предметом настоящего изобретения, еще более конкретно, являются соединения определенной выше формулы I, соответствующие формуле Id-СН 2-, -SO2-, -CO-, -(CH2)2NH-, -(СН 2)2-N-алкил,-(СН 2)2-N-СН 2-фенил, в которых радикалы фенил, могут быть замещены атомом галогена,радикалом гидроксил, трифторметил, алкокси,содержащим не более 4 атомов углерода, или карбокси - свободным, в виде соли или этерифицированным;n обозначает целое число 0 или 1;R1d выбирают из атома водорода и радикалов фенил, -СН 2-фенил, -SO2-фенил, -СО-фенил,алкил и -SO2-алкил, в которых алкильные радикалы содержат не более 4 атомов углерода и могут быть замещены карбокси-радикалом свободным, в виде соли или этерифицированным, а все фенильные радикалы могут быть замещены одним или несколькими радикалами,выбранными из атомов галогена, радикалов гидроксил, циано, нитро, трифторметил, трифторметокси, тиоалкил и алкокси, содержащего не более 4 атомов углерода, алкила, содержащего не более 4 атомов углерода и возможно замещенного радикалом циано или карбокси свободным или этерифицированным, радикалов морфолинил, фенил, тетразолил, -SO2NH2, SO2NН-тиазолил, диоксол, карбокси - свободного,этерифицированного или в виде соли, -NHR4 с и-CONHR4c, у которых R4c обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, или радикал циклогексил, который может быть замещен радикалом NH2;R2 с обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикалы циклопентил, тетрагидрофурил или радикал тетрагидротиенил;Yс обозначает атом кислорода или радикал-NH или -N-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;D1c и D2c либо, одинаковые или разные,выбираются из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов -NH2, -NH-COO-tBu или -NH-алкил, в которых нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода, либо вместе образуют радикал =O или =N-O-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;R6c обозначает атом водорода, атом галогена или гидроксильный радикал; причем названные выше соединения формулы Id существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулы 10 Особенно предпочтительны соединения, у которых R5 обозначает циклопентил. Предметом изобретения, который предпочтителен в наибольшей степени, являются соединения определенной выше формулы I,представляющие собой следующие соединения: дигидрохлорид бутилового эфира транс-4(2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]метил]бензойной кислоты,дигидрохлорид этилового эфира транс-42-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]бензойной кислоты,тригидрохлорид тpaнc-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-[(фенилметил) амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-(2-аминоэтил)-9-циклопентил-9 Нпурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(4-метоксифенил)метил]амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид тpaнс-N2-(4-аминоциклогексил)-N6-[2-4-хлор-3-(трифторметил)фенил]метил]амино]этил]-9-циклопентил-9 Нпурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[(дифенилметил) амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-[2-(4-хлорфенил)метил]амино] этил]-9-циклопентил-9 Н-пурин-2,6-диамина,дигидрохлорид этилового эфира транс (+-)4-2-[(4-аминоциклогексил)амино]-9-(тетрагидро-3-тиенил)-9 Н-пурин-6-ил]амино]бензойной кислоты,дигидрохлорид транс(+-)-N2-(4-аминоциклогексил)-9-(тетрагидро-3-тиенил)-N6-[4-(трифторметокси)фенил]-9 Н-пурин-2,6-диамина,дигидрохлорид транс(+-)-N2-(4-аминоциклогексил)-9-(тетрагидро-3-фуранил)-N6-[(4(трифторметокси)фенил]-9 Н-пурин-2,6 диамина,дигидрохлорид тpaнс-N2-(4-аминоциклогексил)-9-(1-этилпропил)-N6-[4-(трифторметокси)фенил]-9 Н-пурин-2,6-диамина,дигидрохлорид этилового эфира транс-42-[(4-аминоциклогексил)амино]-9-(1-этилпропил)-9 Н-пурин-6-ил]амино]бензойной кислоты. Предметом изобретения, который предпочтителен в еще большей степени, являются соединения определенной выше формулы I,представляющие собой следующие соединения: дигидрохлорид этилового эфира транс-32-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]бензойной кислоты,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(3,4-дихлорфенил)]метил]амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(3,5-дихлорфенил)метил]амино]этил]-9 Н-пурин-2,6-диамина, 11 дигидрохлорид транс-4-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин 6-ил]амино]бензолацетонитрила,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[4-(4-морфолинил) фенил]-9 Н-пурин-2,6-диамина,дигидрохлорид транс-4-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин 6-ил]амино]бензонитрила,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-(4-нитрофенил)-9 Нпурин-2,6-диамина,дигидрохлорид транс-N2-(4-аминоциклогексил)-N6-(4-аминофенил)-9-циклопентил-9 Нпурин-2,6-диамина,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-(4-метоксифенил)9 Н-пурин-2,6-диамина,дигидрохлорид диэтилового эфира транс 5-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]-1,3-бензолдикарбоновой кислоты. Можно отметить, что у предпочтительных соединений настоящего изобретения заместители в циклогексильном радикале находится в транс-положении по отношению один к другому. Предметом настоящего изобретения является также способ получения соединений определенной выше формулы 1, отличающийся тем,что соединение формулы II вводят во взаимодействие с соединением формулы III(III),в которой R2' имеет значение, указанное выше для R2, в котором возможные реакционноспособные функции могут быть защищены защитными группами, с получением соединения формулы IV в которой R2' имеет указанное выше значение,после чего соединение формулы IV вводят в реакцию в соответствии с любым из следующих шести вариантов либо, согласно варианту 1,соединение формулы IV вводят во взаимодействие с соединением формулы V(V),в которой R1' имеет значение, указанное в п.1 для R1 и в которой возможные реакционноспособные функции могут быть защищены защитными группами, n обозначает целое число 0 или 1, причем, когда n равно 1, тогда Z1' обозначает-СН 2, с получением соединения формулы VIII в которой R1', R2' и Z1' имеют указанные выше значения; либо, согласно варианту 2, соединение формулы IV вводят во взаимодействие с соединением формулы VI(VI),в которой R1' имеет указанное выше значение и в которой возможные реакционноспособные функции могут быть защищены защитными группами, с получением соединения формулы в которой R1' и R2' имеют указанные выше значения; либо, согласно варианту 3, соединение формулы IV вводят во взаимодействие с соединением формулы VII(VII) с получением соединения формулы X в которой R2' имеет указанное выше значение,после чего соединение формулы Х вводят во взаимодействие либо с соединением формулы(XI),в которой SO2-R1" имеет значения R' и в которой R1' имеет указанное выше значение, с образованием соединения формулы XII в которой R1" и R2' имеют указанные выше значения, либо с соединением формулы (ХI)AR1' имеет указанное выше значение, с образованием соединения формулы (XII)A в которой R1'" и R2' имеют указанные выше значения, либо, в присутствии восстановителя, с соединением формулы XVII(XVII),в которой R7 обозначает арил, гетероциклический радикал или алкил, причем эти радикалы имеют значения, определенные выше в отношении радикала R1, в которых возможные реакционноспособные функции могут быть защищены 13 защитными группами, с образованием соединения формулы XIII в которой R2' и R7 имеют указанные выше значения; либо, согласно варианту 4, соединение формулы IV вводят во взаимодействие с соединением формулы XVIII(XVIII),в которой R1' имеет указанное выше значение, с получением соединения формулы M1 в которой R1' и R2' имеют указанные выше значения; либо, согласно варианту 5 или 6, соединение формулы IV вводят во взаимодействие с аммиаком, с получением соединения формулы в которой R2' имеет указанное выше значение,после чего соединение XIX вводят во взаимодействие, согласно варианту 5, с соединением формулы XX(XX),в которой R1' имеет указанное выше значение, с образованием соединения формулы М 2 в которой R1' и R2' имеют указанные выше значения; или же, согласно варианту 6, с изоцианатом формулы XXI(XXI),в которой R1' имеет указанное выше значение, с получением соединения формулы М 3 в которой R1' и R2' имеют указанные выше значения; при этом соединения формул VIII, IX, XII,XIII, M1, M2 и М 3 могут быть подвергнуты реакциям по любому из приведенных ниже вариантов а), b) и с) а) либо взаимодействию с соединением формулы XIV 14 в которой D1', D2', R3' и R6' имеют значения указанные выше, соответственно, для D1, D2, R5 иR6, в которых возможные реакционноспособные функции могут быть защищены защитными группами, с получением соединения формулы Iх в которой R1', R2', R3', R6', D1' и D2' имеют указанные выше значения, a Z' имеет значение, указанное выше для Z, в котором возможные реакционноспособные функции могут быть защищены защитными группами, при этом соединение формулы Iх соответствует соединению формулы I', в которой Y обозначает -NR5-, а соединения формулы I' имеют значения, указанные выше для соединений формулы I, в которой возможные реакционноспособные функции могут быть защищены защитными группами;b) либо взаимодействию с соединением формулы XV в которой D1' и D2' имеют указанные выше значения, с получением соединения формулы Iy в которой R1', R2', R6', D1', D2' и Z' имеют указанные выше значения, при этом соединение формулы Iу соответствует соединению определенной выше формулы I', в которой Y обозначает-О-; с) либо взаимодействию с соединением формулы XVI в которой D1' и D2' имеют указанные выше значения, с получением соединения формулы Iz в которой R1', R2', R6', D1', D2' и Z' имеют указанные выше значения, и при этом соединение формулы Iz соответствует соединению определенной выше формулы I', в которой Y обозначает -S-; а соединения формул Iх, Iу и Iz, которые могут быть соединениями формулы I и, для того, чтобы получить другие соединения формулыI, можно при желании и при необходимости подвергнуть их одной или нескольким из следующих приведенных в произвольном порядке реакциям превращения:a) реакции этерификации кислотной функции,b) реакции омыления сложноэфирной функции в кислотную функцию, 15c) реакции окисления алкилтиогруппы в соответствующий сульфоксид или сульфон,d) реакции превращения кетонной функции в оксимную функцию,e) реакции восстановления свободной или этерифицированной карбоксильной функции в спиртовую функцию,f) реакции восстановления алкоксильной функции в гидроксильную функцию или гидроксильной функции в алкоксильную функцию,g) реакции окисления спиртовой функции в альдегидную, кислотную или кетонную функцию,h) реакции превращения нитрильного радикала в тетразолил,i) реакции восстановления нитросоединений в аминосоединения,j) реакции удаления защитных групп, которые могут находиться на защищенных реакционноспособных функциях,k) реакции солеобразования с минеральной или органической кислотой или с основанием с целью получения соответствующей соли,1) реакции расщепления рацемических форм в расщепленные продукты, причем полученные таким образом соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных. Можно отметить, что подобного рода реакции превращения одних заместителей в другие заместители могут быть также произведены на исходных соединениях, а также на определенных выше промежуточных соединениях с последующим продолжением синтеза с использованием реакций, указанных в описанном выше способе. В предпочтительных условиях осуществления изобретения описанный выше способ может быть выполнен следующим образом. Взаимодействие соединения формулы II с соединением формулы III с образованием соединения формулы IV может быть произведено в присутствии DEAD (диэтиловый эфир азодикарбоновой кислоты), DIAD (диизопропиловый эфир азодикарбоновой кислоты) или трифенилфосфина (РРh3) в растворителе таком как ТГФ или CH2Cl2, или также ДМФ. Радикал R2 в соединении формулы III обозначает, в частности, радикал алкил, циклоалкил, тетрагидрофурил или тетрагидротиенил. Можно конкретно назвать следующие соединения формулы III: циклопентанол, 3-гидрокситетрагидрофуран, 3-гидрокситетрагидротиофен, 2-гидроксибутанол и 3-гидроксипентанол. Полученные таким образом соединения формулы IV подвергают, в соответствии с определенным выше вариантом 1, действию соединения определенной выше формулы V, в которой n обозначает целое число 0 и Z обозначает радикал -СН 2-, когда n равно 1, в частности в 16 спирте, таком как бутанол, при температуре приблизительно 80 С или в ДМФ с образованием соединения определенной выше формулыVIII. Соединения формулы IV подвергают, в соответствии с вариантом 2, действию соединения определенной выше формулы VI, в которой Z обозначает -SO2, в частности в ТГФ, DME (диметиловом эфире этиленгликоля), Сs2 СО 3,K2 СО 3 или также Na2 СО 3 с образованием соединения определенной выше формулы IX. Соединения формулы IV подвергают, в соответствии с вариантом 3, действию соединения определенной выше формулы VII, в которой Z обозначает радикал -(СH2)2NНR3-, а частности в бутаноле, при температуре приблизительно 75 С в течение приблизительно 2 или 3 час с образованием соединения определенной выше формулы X. Полученное таким образом соединение формулы Х может быть подвергнуто действию соединения определенной выше формулы XI или (ХI)A в DME, Сs2 СО 3 или также в CH2Cl2 иN(Et)3 в течение приблизительно одного часа при комнатной температуре с образованием,соответственно, соединения определенной выше формулы XII или (XII)A. Соединение формулы Х может быть также подвергнуто действию альдегида формулыXVII, в частности в спирте, таком как метанол или этанол, в присутствии NaBH4 или NaBH3CN с образованием соединения определенной выше формулы XIII. Для других значений Z соответствующие продукты получают с использованием вариантов 4, 5 и 6 по следующему способу: соединения формулы IV подвергают, в соответствии с вариантом 4, действию соединения формулы XVIII, в которой Z обозначает СО, с образованием соединения определенной выше формулы M1. Взаимодействие соединения формулы IV с соединением формулы XVIII может быть проведено в тех же условиях, что и условия взаимодействия соединения формулы IV с соединением формулы VI, с образованием соединения формулы IX, в которой Z обозначает SO2. Соединения формулы IV подвергают действию аммиака с образованием соединения формулы XIX. Соединение формулы XIX может быть затем подвергнуто либо, в соответствии с вариантом 5, действию соединения формулыXX, в которой Z обозначает СОО с образованием соединения определенной выше формулы М 2, либо, в соответствии с вариантом 6, действию соединения формулы XXI, в которой Z обозначает CONH с образованием соединения определенной выше формулы М 3. Взаимодействие соединения формулы XIX с соединениями формул XX или XXI может быть проведено в DME или ТГФ в присутствии Сs2 СО 3 или K2 СО 3. 17 Полученные таким образом соединения определенных выше формул VIII, IX, XII,(XII)A, XIII, M1, M2 и М 3 подвергают, в соответствии с вариантом а), действию соединения определенной выше формулы XIV, в которой Y обозначает -NR5, для осуществления реакции конденсации, которая может быть проведена при температуре 140 С: вслед за реакцией конденсации может быть проведена реакция солеобразования в присутствии, например, хлористо-водородной кислоты или также винной, лимонной или метансульфоновой кислоты в спирте, таком, например, как этанол или метанол, с образованием соединений определенной выше формулы Iх. Соединения формулы Iх являются, таким образом, соединениями формулы I, в которой возможные реакционноспособные функции могут быть защищены и в которой Y обозначает-NR5-, как было определено выше. Соединения определенных выше формулVIII, IX, XII, (XII)A, XIII, M1, M2 и М 3 могут быть также подвергнуты, в соответствии с вариантом b), действию соединения определенной выше формулы XV, в которой Y обозначает атом кислорода, для осуществления реакции конденсации, например в присутствии NaH а ТГФ или ДМФ при комнатной температуре или при нагревании: вслед за реакцией конденсации может быть проведена реакция солеобразования в присутствии, например, хлористо-водородной кислоты или также винной, лимонной или метансульфоновой кислоты в спирте, таком, например, как этанол или метанол, с образованием соединений определенной выше формулы Iу. Соединения формулы Iу являются, таким образом, соединениями формулы I, в которой возможные реакционноспособные функции могут быть защищены и в которой Y обозначает-О-, как было определено выше. Соединения определенных выше формулVIII, IX, XII, (ХII)A, XIII, M1, M2 и М 3 могут быть также подвергнуты, в соответствии с вариантом с), действию соединения определенной выше формулы XVI, в которой Y обозначает атом серы, для осуществления реакции конденсации, например в присутствии основания, такого как Na2CO3 или NaH в ТГФ или ДМФ при комнатной температуре или при нагревании: вслед за реакцией конденсации может быть проведена реакция солеобразования в присутствии, например, хлористо-водородной кислоты или также винной, лимонной или метансульфоновой кислоты в спирте, таком, например, как этанол или метанол, с образованием соединений определенной выше формулы Iz. Соединения формулы Iz являются, таким образом, соединениями формулы I, в которой возможные реакционноспособные функции могут быть защищены и в которой Y обозначает-S-, как было определено выше. 18 Аминная функция соединений определенных выше формул Iх, Iу и Iz, защищенных группой БОК или СН 2-фенил, может быть освобождена в обычных, известных специалистам условиях. Реакция омыления может быть проведена в обычных, известных специалистам условиях,таких, например, как в растворителе, таком как метанол или этанол, диоксан или диметоксиэтан в присутствии едкого натра или едкого кали. Реакции восстановления или окисления соединения формулы Iх в соединение формулыI, могут быть проведены известными специалистам способами. В зависимости от значений R1', R2', R5', R6',R3', Z', D1' и D2' соединения формул Iх, Iу и Iz могут быть или не быть соединениями формулыI и могут давать продукты формулы I или быть превращаемыми в другие соединения формулы I в результате одной или нескольких указанных выше реакций от а) до k). Различные реакционноспособные функции, которые могут нести некоторые из соединений, участвующих в названных выше реакциях, могут быть при необходимости защищены: речь, например, идет о радикалах гидроксил,ацил, свободный карбоксил, а также амино и моноалкиламино, которые могут быть защищены подходящими защитными группами. Можно привести следующий, не являющийся исчерпывающим, список примеров защиты реакционноспособных функций: гидроксильные группы могут быть, например, защищены алкильными радикалами,такими как трет-бутил, триметилсилил, третбутилдиметилсилил, метоксиметил, тетрагидропиранил, бензил или ацетил; аминогруппы могут быть, например, защищены радикалами ацетил, тритил, бензил,трет-бутоксикарбонил,бензилоксикарбонил,фталимидо или другими известными в химии пептидов радикалами; ацильные группы, такие как группа формил, могут быть, например, защищены в форме циклических или нециклических кеталей или тиокеталей, таких как диметил- или диэтилкеталь или этилендиоксикеталь, или диэтилтиокеталь, или этилендитиокеталь; кислотные функции описанных выше соединений могут быть при желании амидированы каким-либо первичным или вторичным амином, например в хлористом метилене в присутствии, например, гидрохлорида 1-этил-3(диметиламинопропил)карбодиимида при комнатной температуре; кислотные функции могут быть защищены, например, в форме сложных эфиров, образуемых с помощью легко разлагающихся сложных эфиров таких как бензиловые или третбутиловые сложные эфиры или сложные эфиры,которые известны в химии пептидов. 19 Реакции, которым могут быть подвергнуты соединения определенных выше формул Iх, Iу иIz, могут быть при желании или при необходимости осуществлены как, например, указано ниже.a) Описанные выше соединения могут быть подвергнуты реакциям этерификации по их возможным карбоксильным функциям, которые могут быть проведены с использованием обычных, известных специалистам способов.b) Возможные превращения сложноэфирных функций в кислотную функцию описанных выше соединений могут быть проведены при желании в обычных, известных специалистам условиях, в частности в условиях кислотного или щелочного гидролиза, например едким натром или едким кали в спиртовой среде, такой,например, как метанол, или же в присутствии хлористо-водородной или серной кислоты.c) Возможные алкилтиогруппы описанных выше соединений могут быть при желании превращены в соответствующие сульфоксидную или сульфоновую функции в обычных, известных специалистам условиях, таких, например,как условия, в которых используются надкислоты, такие, например, как надуксусная кислота или м-хлорнадбензойная кислота, или же с использованием озона, оксона, периодата натрия в растворителе, таком, например, как хлористый метилен, или диоксан, при комнатной температуре. Получению сульфоксидной функции может способствовать эквимолярная смесь соединения, содержащего алкилтио-группу, с реагентом, таким, в частности, как надкислота. Получению сульфоновой функции может способствовать смесь соединения, содержащего алкилтио-группу с избытком реактива, такого,например, как надкислота.d) Реакция превращения кетонной функции в оксим может проводиться в обычных, известных специалистам условиях, таких, в частности, как при действии возможно Oзамещенным гидроксиламином в спирте, таком,например, как этанол, при комнатной температуре или при нагревании.e) Возможные свободные или этерифицированные карбоксильные функции описанных выше соединений могут быть при желании восстановлены вспиртовую функцию известным специалистам способом. Возможные этерифицированные карбоксильные функции могут быть при желании восстановлены в спиртовую функцию известным специалистам способом и,в частности, с помощью алюмогидрида лития в растворителе, таком, например, как тетрагидрофуран или также диоксан или диэтиловый эфир. Возможные свободные карбоксильные функции описанных выше соединений могут быть при желании восстановлены в спиртовую функцию,в частности с помощью гидрида бора.f) Возможные алкоксильные функции, такие, в частности, как метокси, описанных выше соединений могут быть при желании превращены в гидроксильную функцию в обычных, известных специалистам условиях, например с помощью трехбромистого бора в растворителе,таком, например, как хлористый метилен, с помощью гидробромида или гидрохлорида пиридина, или бромистоводородной или хлористоводородной кислотой в воде или трифторуксусной кислоте, с обратным холодильником.g) Возможные спиртовые группы описанных выше соединений могут быть при желании превращены в альдегидную или кислотную функции с помощью окисления в обычных, известных специалистам условиях, например действием оксида марганца для получения альдегидов или реактивом Джонса для получения кислот.h) Возможные нитрильные группы описанных выше соединений могут быть при желании превращены в тетразолил в обычных, известных специалистам условиях, например с использованием реакции циклоприсоединения к нитрильной функции азида металла, такого, например, как азид натрия или азид триалкилолова, как это указано в способе, описанном в цитируемой ниже статье:KOZIMA S.coll. Можно отметить, что реакция превращения карбамата в мочевину и, в частности, сульфонилкарбамата в сульфонилмочевину, может быть проведена, например, в кипящем растворителе, таком, например, как толуол, в присутствии подходящего амина. Разумеется, описанные выше реакции могут быть проведены как описано выше или же, в отдельных случаях, с использованием обычных,известных специалистам способов. i) Удаление защитных, таких, например, которые указаны выше, может быть осуществлено в обычных,известным специалистам условиях, в частности кислотным гидролизом с использованием кислоты, такой как хлористо-водородная, бензолсульфоновая или п-толуолсульфоновая, муравьиная или трифторуксусная, или же с использованием каталитического гидрирования. Фталимидная группа может быть удалена действием гидразина. Список различных пригодных для использования защитных групп можно найти, например, в патенте BF 2499995.j) Описанные выше соединения могут быть при желании подвергнуты реакциям солеобразования, например, с минеральными или органическими кислотами или с неорганическими или органическими основаниями с использованием обычных, известных специалистам способов.k) Возможные оптически активные формы описанных выше соединений могут быть полу 21 чены расщеплением рацемических смесей с использованием обычных, известных специалистам способов. Иллюстрации описанных выше реакций даны в приведенных ниже примерах. Определенные выше соединения формулыI, а также их солевые аддукты с кислотами обладают ценными фармакологическими свойствами. Определенные выше соединения настоящего изобретения обладают свойствами высокоселективных ингибиторов киназ. Циклин-зависимые киназы играют центральную роль в инициировании, развитии и завершении событий клеточного цикла и, таким образом, ингибирующие ЦЗК молекулы способны ограничивать нежелательные клеточные пролиферации, такие как пролиферации, имеющие место при раках, псориазах, росте грибов,паразитов (животных, одноклеточных): такие ингибирующие ЦЗК молекулы способны также вмешиваться в регуляцию нейродегенеративных заболеваний таких как болезнь Альцгеймера. Киназы, особенно чувствительные к ингибирующему действию производных настоящего изобретения - это, в частности, cdkl, cdk2, cdk4,cdk5 и cdk7. Соединения настоящего изобретения обладают, таким образом, антимитотическими свойствами. Соединения настоящего изобретения обладают, кроме того, специфической ингибирующей активностью по отношению к киназам и ценными клеточными эффектами, такими как антипролиферативные свойства и, в частности,влияние на апоптоз. Из работ, описанных в литературе, например, в WO 97/20842, известно, что существует взаимоотношение между клеточным циклом и апоптозом. Некоторые из приводящих к апоптозу путей являются зависимыми от киназ. Соединения настоящего изобретения являются, в частности, полезными в терапии опухолей. Соединения изобретения могут также усиливать терапевтическое действие обычно используемых противораковых агентов. При этом соединения формулы I настоящего изобретения обладают прежде всего антимитотическими и антинейродегенеративными свойствами. Эти свойства оправдывают применение этих соединений в терапии, а предметом изобретения являются прежде всего предназначенные для использования в качестве лекарственных агентов определенные выше соединения формулы I, причем соединения формулы I существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами 22 или неорганическими и органическими основаниями названных соединений формулы I. Более конкретно, предметом изобретения являются предназначенные для использования в качестве лекарственных агентов соединения такие, которые определяются формулой Iс-СН 2-, -SО 2-, -СО-, -(CH2)2-NH-, -(СН 2)2-Nалкил, -(СН 2)2-N-СH2-фенил, в которых радикалы фенил, могут быть замещены атомом галогена, радикалом гидроксил, трифторметил, алкокси, содержащим не более 4 атомов углерода,или карбокси - свободным, в виде соли или этерифицированным;n обозначает целое число 0 или 1;R1c выбирают из атома водорода и радикалов фенил, -СН 2-фенил, -SO2-фенил, -СО-фенил,пиридил, алкил и -SO2-алкил, в которых алкильные радикалы содержат не более 4 атомов углерода и могут быть замещены карбоксирадикалом - свободным, в виде соли или этерифицированным, а все фенильные радикалы могут быть замещены одним или несколькими радикалами, выбранными из атомов галогена, радикалов гидроксил, циано, нитро, трифторметил, трифторметокси, тиоалкил и алкокси, содержащего не более 4 атомов углерода, алкила,содержащего не более 4 атомов углерода и возможно замещенного радикалом циано, -СООН или COOalk, радикалов фенил, тетразолил, циклоалкил, цикл которого может включать один или несколько атомов кислорода или азота, радикалов -SO2NH2 и SО 2-NH-тиазолил, радикалов диоксол, карбокси - свободного, этерифицированного или в виде соли и радикалов-NHR4 с и -CONHR4 с, у которых R4 с обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, или радикал циклогексил, который может быть замещен радикаломR2 с обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикалы циклопентил, тетрагидрофурил или радикал тетрагидротиенил;Yс обозначает атом кислорода или радикал-NH или -N-алкил, а котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;D1c и D2c либо, одинаковые или разные,выбираются из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов -NH2, -NH-COO-tBu или -NH-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода, либо вместе образуют радикал =O или =N-O-алкил, в котором нор 23 мальный или разветвленный алкильный радикал содержит до 4 атомов углерода;R6c обозначает атом водорода, атом галогена или гидроксильный радикал; причем названные выше соединения формулы Iс существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулыIс. Предметом настоящего изобретения, еще более конкретно, являются предназначенные для использования в качестве лекарственных агентов соединения формулы I, определенной выше формулой Id-СН 2-, -SО 2-, -СО-, -(CH2)2NH-, -(CH2)2-N-алкил,-(CH2)2-N-СН 2-фенил, в которых радикалы фенил, могут быть замещены атомом галогена,радикалом гидроксил, трифторметил, алкокси,содержащим не более 4 атомов углерода, или карбокси - свободным, в виде соли или этерифицированным;n обозначает целое число 0 или 1;R1d выбирают из атома водорода и радикалов фенил, -СН 2-фенил, -SO2-фенил, -СО-фенил,алкил и -SO2-алкил, в которых алкильные радикалы содержат не более 4 атомов углерода и могут быть замещены карбокси-радикалом свободным, в виде соли или этерифицированным, а все фенильные радикалы могут быть заметены одним или несколькими радикалами,выбранными из атомов галогена, радикалов гидроксил, циано, нитро, трифторметил, трифторметокси, тиоалкил и алкокси, содержащего не более 4 атомов углерода, алкила, содержащего не более 4 атомов углерода и возможно замещенного радикалом циано или карбокси свободным или этерифицированным, радикалов морфолинил, фенил, тетразолил, -SO2NH2, SO2NН-тиазолил в виде соли, диоксол, карбоксисвободного, этерифицированного или в виде соли, -NHR4 с и -CONHR4 с, у которых R4 с обозначает атом водорода, радикал алкил, содержащий не более 4 атомов углерода, или радикал циклогексил, который может быть замещен радикалом NH2;R2 с обозначает нормальный или разветвленный радикал алкил, содержащий не более 6 атомов углерода, радикалы циклопентил, тетрагидрофурил или радикал тетрагидротиенил;Yc обозначает атом кислорода или радикал 24 разветвленный алкильный радикал содержит не более 4 атомов углерода;D1c и D2c либо, одинаковые или разные,выбираются из атома водорода, гидроксильного радикала, нормальных или разветвленных радикалов алкил и алкокси, содержащих не более 4 атомов углерода, и радикалов NH2, -NH-COO-tBu или -NH-алкил, в которых нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода, либо вместе образуют радикал =O или =N-O-алкил, в котором нормальный или разветвленный алкильный радикал содержит не более 4 атомов углерода;R6c обозначает атом водорода, атом галогена или гидроксильный радикал; причем названные выше соединения формулы Id существуют во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также в виде солевых аддуктов с минеральными и органическими кислотами или неорганическими и органическими основаниями названных соединений формулыId. Предметом изобретения, который предпочтителен в наибольшей степени, являются предназначенные для использования в качестве лекарственных агентов соединения определенной выше формулы I, отвечающие следующим формулам: дигидрохлорид бутилового эфира транс-42-[4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]метил]бензойной кислоты,дигидрохлорид этилового эфира транс-42-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]бензойной кислоты,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-[(фенилметил) амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-(2-аминоэтил)-9-циклопентил-9 Нпурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(4-метоксифенил)метил]амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-[2-4-хлор-3-(трифторметил)фенил]метил]амино]этил]-9-циклопентил-9 Нпурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[(дифенилметил) амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-N6-[2-(4-хлорфенил)метил]амино] этил]-9-циклопентил-9 Н-пурин-2,6-диамина,дигидрохлорид этилового эфира транс(+-)4-2-[(4-аминоциклогексил)амино]-9-(тетрагидро-3-тиенил)-9 Н-пурин-6-ил]амино]-бензойной кислоты,дигидрохлорид транс (+-)-N2-(4-аминоциклогексил)-9-(тетрагидро-3-тиенил)-N6-[4-(трифторметокси)фенил]-9 Н-пурин-2,6-диамина, 25 дигидрохлорид транс(+-)-N2-(4-аминоциклогексил)-9-(тетрагидро-3-фуранил)-N6-[(4 трифторметокси)фенил]-9 Н-пурин-2,6-диамина,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-(1-этилпропил)-N6-[4-(трифторметокси)фенил]-9 Н-пурин-2,6-диамина,дигидрохлорид этилового эфира транс-42-[(4-аминоциклогексил)амино]-9-(1-этилпропил)-9 Н-пурин-6-ил]амино]бензойной кислоты. Предметом изобретения, который предпочтителен в еще большей степени, являются предназначенные для использования в качестве лекарственных агентов соединения определенной выше формулы I, отвечающие следующим формулам:- дигидрохлорид этилового эфира транс-32-[(4-аминоциклогексил)амино]-9 циклопентил-9 Н-пурин-6-ил]амино]бензойной кислоты,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(3,4-дихлорфенил)метил]амино]этил]-9 Н-пурин-2,6-диамина,тригидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(3,5-дихлорфенил)метил]амино]этил]-9 Н-пурин-2,6-диамина,дигидрохлорид транс-4-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил] амино]бензолацетонитрила,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[4-(4-морфолинил) фенил]-9 Н-пурин-2,6-диамина,дигидрохлорид транс-4-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил] амино]бензонитрила,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-(4-нитрофенил)-9 Нпурин-2,6-диамина,дигидрохлорид транс-N2-(4-аминоциклогексил)-N6-(4-аминофенил)-9-циклопентил-9 Нпурин-2,6-диамина,дигидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-9 Н-N6-(4-метоксифенил)-9 Н-пурин-2,6-диамина,дигидрохлорид диэтилового эфира транс 5-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]-1,3-бензолдикарбоновой кислоты. Представляющие собой предмет изобретения лекарственные средства находят применение, например, в качестве антимитотиков, в химиотерапии рака, а также при лечении псориаза,паразитозов, обусловленных простейшими или грибками, при лечении болезни Альцгеймера или при лечении нейронного апоптоза. Изобретение распространяется на фармацевтические композиции, содержащие в качестве активного начала по меньшей мере один из определенных выше лекарственных средств. Фармацевтические композиции настоящего изобретения могут также содержать, в случае необходимости, активные начала других антимитотических лекарственных средств, такие, в 26 частности, как лекарственные средства на основе таксола, цисплатины, ДНК-интеркалирующих агентов и других. Фармацевтические композиции могут применяться перорально, парентерально или местно путем нанесения на кожу или слизистые ткани, а также путем внутривенной или внутримышечной инъекций. Названные композиции могут быть твердыми или жидкими и находиться во всех обычно используемых в медицине фармацевтических формах, таких, например, как простые или дражевидные таблетки, пилюли, лепешки, желатиновые капсулы, капли, гранулы, препараты для инъекций, помады, кремы или гели. Они могут быть приготовлены обычными способами. Активное начало может вводиться в обычно применяемые в фармацевтических композициях наполнители, такие как тальк, гуммиарабик,лактоза, крахмал, стеарат магния, масло какао,водные и неводные носители, животные и растительные жировые вещества, парафиновые производные, гликоли, различные увлажняющие агенты, дисперсанты или эмульгаторы,консерванты. Применяемые дозы, зависящие от используемого продукта, объекта лечения и характера заболевания, могут, например, составлять для взрослых от 0,05 до 5 г в сутки или, преимущественно, от 0,1 до 2 г в сутки. Исходным соединением формулы II является известный и поставляемый в продажу 2,6 дихлорпурин. Некоторые из исходных соединений формул III, V, VI, VII, XI, (XI)A, XIV, XV и XVI являются известными и могут быть приобретены или получены с помощью обычных известных методов. Из коммерческих исходных соединений формул III, V, VI, VII, XI, (XI)A, XIV, XV и XVI можно в качестве примера назвать следующие соединения формулы III: циклопентанол, 3 гидрокситетрагидрофуран,3-пропанол,3 гидрокситиофен, а также 2-бутанол. Из коммерческих исходных соединений формулы V могут быть названы гидрохлорид метилового эфира 4-(аминометил)бензойной кислоты, этил-4-аминобензоат, 4-аминобензамид, метил-3-аминобензоат или 3-аминобензамид. В качестве коммерческих продуктов формулы XIV можно назвать транс-1,4-диаминоциклогексан, а также транс-4-аминоциклогексанол. В частности, некоторые исходные соединения могут быть получены из коммерческих продуктов, которые подвергают, например, одной или нескольким описанным в пунктах от а) до l) реакциям, проводимым в условиях, которые также описаны выше. В качестве примера можно также назвать 27 в качестве соединения формулы VI фенилсульфонамид, 3-бромфенилсульфонамид, 4 трет-бутилфенилсульфонамид; в качестве соединения формулы VII этилендиамин; в качестве соединения формулы XI, изопропилсульфонилхлорид, п-метоксифенилсульфонилхлорид, а также трифторметансульфонилхлорид; в качестве соединения формулы (XI)A 4 трифторметилбензоилхлорид, 4-анизоилхлорид,4-хлорбензоилхлорид, 2-хлор-4-нитробензоилхлорид; в качестве соединения формулы XVII бензальдегид, п-метоксибензальдегид, а также пцианобензальдегид. В приведенной ниже экспериментальной части, даются примеры таких исходных соединений. Наконец, предметом настоящего изобретения являются предназначенные для использования в качестве новых промышленных продуктов соединения формул VIII, IX, X, XII, (XII)A, XIII,M1, М 2 и М 3. Таким образом, предметом изобретения конкретно являются фармацевтические композиции, содержащие в качестве активного начала по меньшей мере одно из определенных выше лекарственных средств. Наиболее конкретным предметом изобретения являются определенные выше фармацевтические композиции, отличающиеся тем, что их используют в качестве антимитотических лекарственных средств, в частности для химиотерапии рака, а также для лечения псориаза,паразитозов таких как паразитозы, обусловленные грибками или простейшими, или для лечения болезни Альцгеймера. Наиболее конкретным предметом изобретения являются также определенные выше фармацевтические композиции, отличающиеся тем,что их используют в качестве антинейродегенеративных лекарственных средств, в частности при лечении нейронного апоптоза. Изобретение иллюстрируют, не ограничивая его объема, следующие примеры. Пример 1. Дигидрохлорид бутилового эфира транс-4-2-[(4-аминоциклогексил)амино]-9-циклопентил-9 Н-пурин-6-ил]амино]метил]-бензойной кислоты. Стадия 1. 9-циклопентил-2,6-дихлор-9 Нпурин. Смешивают 378 мг 2,6-дихлорпурина, 5 мл тетрагидрофурана, 0,27 г циклопентанола, 787 мг трифенилфосфина (РРh3) и 0,46 мл DEAD(диэтилазодикарбоксилата) и перемешивают смесь в течение ночи при комнатной температуре, после чего досуха упаривают. Сырой продукт очищают хроматографией на колонке с силикагелем, используя в качестве элюента смеси СH2 Сl2/АсОЕt/циклогексан Стадия 2. Метиловый эфир 4-(2-хлор-9 циклопентил-9 Н-пурин-6-ил)амино]метил]бензойной кислоты. 450 мг полученного в стадии 1 продукта смешивают с 10 мл бутанола, 347 мг гидрохлорида метилового эфира 4-(аминометил)бензойной кислоты и 290 мг карбоната калия,перемешивают смесь при температуре приблизительно 100 С в течение приблизительно 18 ч,оставляют охлаждаться до комнатной температуры, после чего добавляют 15 мл воды, экстрагируют 2x50 мл СН 2 С 12 (хлористый метилен),сушат, фильтруют и упаривают. После этого загущают в диизопропиловом эфире и сушат в вакууме при приблизительно 50 С, получая 526 мг целевого продукта в виде бесцветных кристаллов. Стадия 3. Дигидрохлорид бутилового эфира транс-4-2-[(4-аминоциклогексил)амино]-9 циклопентил-9 Н-пурин-6-ил]амино]метил]бензойной кислоты. 50 мг полученного в стадии 2 продукта смешивают с 4 мл бутанола и 150 мг транс-1,4 диаминоциклогексана и нагревают смесь в течение приблизительно 24 часов при приблизительно 150 С, после чего оставляют охлаждаться до комнатной температуры. Затем добавляют 4 мл этилового эфира, отжимают и промывают эфиром, сушат при комнатной температуре, поглощают 4-мя мл этанола, добавляют 2 мл 1,4 н раствор HCl (хлористо-водородной кислоты) в этаноле и упаривают, получая 25 мг целевого продукта.DEAD (диэтилазодикарбоксилата) и перемешивают смесь в течение ночи при комнатной температуре. После этого вливают в 1 М водный раствор NаН 2 РО 3, трижды экстрагируют 20 мл этилацетата, промывают 20 мл воды, затем 10 мл насыщенного водного раствора NaCl, высушивают и досуха упаривают. После хроматографирования на силикагеле с использованием в качестве элюента смеси хлористого метилена/этилацета/СН 3 СN (75/15/15) и затем повторного хроматографирования на силикагеле с использованием в качестве элюента смеси хлористого метилена с этилацетатом (50/50) получают 878 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. (+-)-2-Хлор-N-(фенилметил)-9(тетрагидро-3-фуранил)-9 Н-пурин-6-амин. 139 мг полученного в стадии 1 продукта смешивают с 2 мл бутанола и 0,06 мл бензиламина, после чего нагревают в течение 5 ч 30 мин при температуре приблизительно 95 С и оставляют охлаждаться до комнатной температуры. Выпавшие кристаллы отжимают, промывают 10 мл изопропилового спирта и сушат в вакууме при температуре примерно 50 С, получая 157 мг целевого продукта в виде кристаллов белого цвета. 30 продукта и доводят температуру смеси в течение приблизительно 5 ч до от 130 до 150 С, после чего оставляют на ночь при комнатной температуре. Поглощают 10 мл воды и 20 мл этилацетата, разделяют на фазы, повторно экстрагируют 2 х 5 мл этилацетата, промывают 10 мл воды и 10 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH4OH) (98/2) добавляют 1,5 мл 1,4 н раствор хлористо-водородной кислоты в этаноле и оставляют кристаллизоваться. Кристаллы разбавляют 2 мл этилацетата, оставляют на 1 ч при комнатной температуре, отжимают и промывают 5 мл этилацетата при температуре приблизительно 50 С, получая 98 мг целевого продукта в виде кристаллов беловато-кремового цвета. Пример 3. (2R,3S)-2,3-дигидроксибутандиоат транс-N2-(4-аминоциклогексил)-9-(1-этилпропил)-N6-(фенилметил)-9 Н-пурин-2,6-диамина. Стадия 1. 2,6-Дихлор-9-(1-этилпропил)9 Н-пурин. Смешивают 1,32 г 2,6-дихлорпурина, 2,75 г трифенилфосфина (РРh3), 35 мл тетрагидрофурана и 1,13 мл (10,5 ммоль) 3-пентанола, перемешивают смесь при комнатной температуре, в течение 15 мин добавляют 1,63 мл (10,5 ммоль)DEAD (диэтилазодикарбоксилата) и перемешивают в течение приблизительно 20 часов при комнатной температуре. После этого вливают в 1 М водный раствор NаН 2 РО 3, трижды экстрагируют 10 мл этилацетата, промывают 10 мл воды, затем 10 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После хроматографирования на силикагеле с использованием в качестве элюента смеси хлористого метилена с этилацетатом (90/10) затем повторного хроматографирования на силикагеле с использованием того же элюента получают 1,12 г целевого продукта в виде кристаллов белого цвета. 31 Стадия 2. 2-Хлор-9-(1-этилпропил)-N(фенилметил)-9 Н-пурин-6-амин. 191 мг полученного в стадии 1 продукта смешивают с 2,5 мл бутанола и 0,115 мл бензиламина, после чего нагревают в течение 5 часов 30 минут при температуре приблизительно 90100 С и оставляют охлаждаться до комнатной температуры. Выпавшие кристаллы отжимают,промывают 10 мл изопропилового спирта и сушат в вакууме при приблизительно 50 С, получая 148 мг целевого продукта в виде кристаллов белого цвета. Стадия 3. (2R,3S)-2,3-Дигидроксибутандиоат транс-N2-(4-амино-циклогексил)-9-(1 этилпропил)-N6-(фенилметил)-9 Н-пурин-2,6 диамина. Смешивают 456 мг транс-1,4-диаминоциклогексана со 131 мг полученного в стадии 2 продукта и доводят температуру смеси в течение 4 ч до 140-150 С, после чего оставляют охлаждаться до комнатной температуры. Разбавляют 5 мл воды и 5 мл этилацетата, разделяют на фазы, повторно экстрагируют 2 х 10 мл этилацетата, промывают 10 мл воды и 5 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH4OH)(98/2) образуют соль с помощью 1 М раствора мезовинной кислоты в этаноле, оставляют смесь кристаллизоваться в течение ночи при комнатной температуре. Кристаллы отжимают и промывают 10 мл этилацетата при температуре приблизительно 50 С, получая 97 мг целевого продукта в виде кристаллов бежево-розового цвета. 32 мл бензиламина, нагревают смесь в течение 4 ч при приблизительно 90-100 С и оставляют на ночь охлаждаться до комнатной температуры. Разбавляют смесь 10 мл изопропилового спирта,оставляют на 1 час при комнатной температуре,отжимают, промывают 20 мл изопропилового спирта и сушат в вакууме при приблизительно 50 С. После очистки на силикагеле с использованием в качестве элюента смеси хлористого метилена с этилацетатом (90/10) и последующей перекристаллизации из минимального количества иэопропилового спирта, сушат в вакууме при приблизительно 50 С и получают 114 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Гидрохлорид транс-9-циклопентил-N2-(4-гидроксициклогексил)-N6-(фенилметил)-9 Н-пурин-2,6-диамина. 1 г транс-1,4-аминоциклогексанола нагревают при перемешивании до температуры 5060 С и добавляют 212 мг полученного в стадии 1 продукта. Доводят температуру смеси а течение приблизительно 4 ч до 140-150 С и оставляют охлаждаться до температуры 100 С. Добавляют 10 мл воды, разделяют на фазы, добавляют 10 мл воды и 20 мл этилацетата и нагревают до температуры приблизительно 70 С,после чего добавляют 10 мл воды и оставляют на ночь при комнатной температуре. После этого разделяют на фазы, экстрагируют повторно 2 х 20 мл хлористого метилена с 20% метанола,объединяют органические фазы, промывают 10 мл воды и 10 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. Растворяют в минимальном количестве этанола, добавляют 1 н раствор хлористоводородной кислоты в этаноле и оставляют кристаллизоваться, после чего разбавляют 5 мл этанола, оставляют на 1 ч при комнатной температуре, отжимают, промывают 10 мл этанола и сушат при температуре приблизительно 50 С,получая 215 мг целевого продукта в виде кристаллов белого цвета.(диэтилазодикарбоксилата) и перемешивают в течение ночи при комнатной температуре. После этого добавляют 10 мл 1 М водного раствора NaH 2PO 4, трижды экстрагируют 10 мл хлористого метилена, промывают 10 мл воды с 5 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После очистки на силикагеле с использованием в качестве элюента смеси хлористого метилена с этилацетатом (75/20) и затем (90/10) загущают при комнатной температуре в 5 мл диизопропилового эфира,отжимают, промывают 5 мл диизопропилового эфира и сушат при комнатной температуре, получая 137 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. 2-Хлop-N-(фенилметил)-9-(тетрагидро-3-тиенил)-9 Н-пурин-6-амин. 120 мг полученного в стадии 1 продукта смешивают с 2 мл бутанола и 0,105 мл бензиламина, нагревают 10 ч при температуре приблизительно 95-100 С, оставляют охлаждаться до комнатной температуры и разбавляют 5 мл изопропилового спирта. После этого отжимают,промывают 5 мл изопропилового спирта и сушат в вакууме при приблизительно 30 С, получая 132 мг целевого продукта в виде кристаллов белого цвета. Стадия 3. Гидрохлорид транс(+-)-N2-(4 аминоциклогексил)-N6-(фенилметил)-9-(тетрагидро-3-тиенил)-9 Н-пурин-2,6-диамина. Нагревают 400 мг транс-1,4-диаминоциклогексана до температуры 60-70 С, добавляют 119 мг полученного в стадии 2 продукта и в течение 3 ч доводят температуру до 130-140 С. После этого оставляют смесь охлаждаться до комнатной температуры, добавляют 5 мл воды, экстрагируют 3 х 10 мл этилацетата, промывают 10 мл воды и 5 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH 4OH) (98/2), образуют соль с помощью 1,4 н раствора хлористоводородной кислоты в этаноле и оставляют смесь на 2 дня кристаллизоваться при комнатной температуре, после чего отжимают,промывают 10 мл этанола и сушат при температуре приблизительно 50 С, получая 112 мг целевого продукта в виде кристаллов беловато-кремового цвета. Пример 6. Дигидрохлорид этилового эфира транс-4-2-[(4-аминоциклогексил)амино]-9 циклопентил-9 Н-пурин-6-ил]амино]-бензойной кислоты. Стадия 1. Этиловый эфир 4-[(2-хлор-9 циклопентил-9 Н-пурин-6-ил]амино]бензойной кислоты. Загружают при комнатной температуре 86 мг полученного в стадии 1 примера 1 продукта,2 мл н-бутанола и 66 мг этилового эфира 4 аминобензойной кислоты, нагревают при перемешивании в течение 7 ч погружением в баню с температурой приблизительно 100 С, оставляют охлаждаться до комнатной температуры, отжимают, промывают этиловым эфиром и сушат в вакууме, получая 74 мг целевого продукта в виде порошка бежевого цвета. Стадия 2. Дигидрохлорид этилового эфира транс-4-2-[(4-аминоциклогексил)амино]-9 циклопентил-9 Н-пурин-6-ил]амино]бензойной кислоты. Нагревают 1,14 г транс-1,4-диаминоциклогексана до приблизительно 150 С, добавляют 386 мг полученного в стадии 1 продукта,перемешивают в течение 3 ч 30 мин и оставляют охлаждаться до комнатной температуры. После этого добавляют 10 мл воды, отжимают, промы 35 вают водой, сушат при температуре приблизительно 50 С, поглощают 110 мг десятью мл метанола, добавляют 4 мл 1,4 н HCl в этаноле,концентрируют до приблизительно 4 мл и оставляют кристаллизоваться. Кристаллы отжимают и промывают этанолом, после чего сушат при температуре приблизительно 50 С, получая 110 мг целевого продукта в виде порошка бежевого цвета. Пример 7. Гидрохлорид транс-N2-(4-аминоциклогексил)-9-циклопентил-N6-[2-(фенилметил)амино]этил]-9 Н-пурин-2,6-диамина. Стадия 1. N-(2-аминоэтил)-2-хлор-9-циклопентил-9 Н-пурин-6-амин. 3 г полученного в стадии 1 примера 1 продукта смешивают с 21 мл бутанола и 7,5 мл 1,2 диаминоэтана и нагревают в течение 3 ч до 75 С, после чего отгоняют растворитель и хроматографируют на силикагеле с использованием в качестве элюента смесь хлористый метилен/метанол/раствор аммиака (85/15/1,5), получая 2,73 г целевого продукта в виде смолы желтого цвета. Стадия 2. 2-Хлор-9-циклопентил-N-[2[(фенилметил)амино]этил]-9 Н-пурин-6-амин. 141 мг полученного в стадии 1 продукта смешивают с 2 мл метанола, 0,07 мл бензальдегида, 0,1 мл уксусной кислоты и 0,055 гNаВН 3 СN и оставляют при комнатной температуре приблизительно на 4 ч, затем добавляют 10 мл AcOEt, промывают 2 х 5 мл воды, затем 5 мл насыщенного водного раствора NaCl, сушат и отгоняют растворитель. После хроматографирования на силикагеле с использованием в качестве элюента смеси СН 2 Сl2/метанол/раствор аммиака (90/10/1) получают 100 мг целевого продукта. Стадия 3. Тригидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[2[(фенилметил)амино]этил]-9 Н-пурин-2,6 диамина. Повторяют последовательность операций стадии 3 примера 1, исходя из 0,090 г продукта, 005072 36 полученного в стадии 2 настоящего примера, и 277 мг транс-1,4-диаминоциклогексана. Смесь в течение 2 ч нагревают при приблизительно 140 С, очищают на фильтрующем элементе с силикагелем, используя смесь СН 2 Сl2/метанол/ раствор аммиака (85/15/1,5). Продукт превращают в соль с помощью 1,4 н HCl в этаноле,получая 70 мг целевого продукта.(DME), 157 мг бензолсульфонамида и 390 мг карбоната цезия (Сs2 СО 3) и перемешивают в течение 2 ч при температуре приблизительно 100 С. Затем добавляют 4 мл 2 н раствор хлористо-водородной кислоты и 4 мл воды, экстрагируют 30 мл этилацетата, высушивают, фильтруют и досуха упаривают, после чего загущают в 5 мл этилового эфира и сушат в вакууме при приблизительно 50 С, получая 237 мг целевого продукта в виде кристаллов бежевого цвета. Стадия 2. Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклопентил-9 Нпурин-6-ил]бензолсульфонамида. Нагревают 570 мг транс-1,4-диаминоциклогексана до температуры приблизительно 140 С, добавляют 188 мг полученного в стадии 1 продукта, смешивают и оставляют при этой температуре приблизительно на 5 ч и затем дают смеси охладиться до комнатной температуры. После этого добавляют 10 мл воды, отжимают и сушат в вакууме при температуре приблизительно 50 С. После хроматографии на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (70/30/1), загущают в 5 мл этилового эфира и сушат при температуре приблизительно 50 С, получая 40 мг целевого продукта в виде кристаллов бурого цвета. Пример 9. (2R,3S)-2,3-Дигидроксибутандиоат транс(+-)-N2-(4-аминоциклогексил)-9-(1 метилпропил)-N6-(фенилметил)-9 Н-пурин-2,6 диамина. Стадия 1. (+-)-2,6-Дихлор-9-(1-метилпропил)-9 Н-пурин. Повторяют последовательность операций стадии 1 примера 3, смешивая 1,32 мг 2,6 дихлорпурина, 2,75 г трифенилфосфина (РРh3),35 мл тетрагидрофурана и 0,96 мл 2-бутанола. Смесь перемешивают при комнатной температуре и добавляют в течение приблизительно 20 мин 1,63 мл DEAD (диэтиловый эфир азодикарбоновой кислоты), после чего перемешивают в течение ночи при комнатной температуре. Затем смесь вливают в 10 мл 1 М раствора NaH2PO4,трижды экстрагируют 10 мл этилацетата, промывают 10 мл воды и затем 5 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После хроматографирования на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат(90/10) и затем повторное хроматографирование на силикагеле с использованием в качестве элюента смеси циклогексан/этилацетат/хлористый метилен (70/15/15) получают 1,27 г целевого продукта в виде кристаллов белого цвета. Стадия 2. (+-)-2-Хлор-9-(1-метилпропил)N-(фенилметил)-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 3, смешивая 161 мг полученного в стадии 1 продукта с 3 мл бутанола и 0,132 мл бензиламина. Смесь нагревают в течение приблизительно 5 ч при температуре приблизительно 90-110 С и оставляют охлаждаться до комнатной температуры и образования кристаллов, разбавляют 10 мл изопропилового спирта, отжимают, промывают 10 мл изопропилового спирта и сушат в вакууме при приблизительно 50 С. После хроматографирования на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат (50/50) получают 179 мг целевого продукта в виде кристаллов белого цвета. Стадия 3. (2R,3S)-2,3-Дигидроксибутандиоат транс(+-)-N2-(4-аминоциклогексил)-9-(1 005072 38 метоксипропил)-N6-(фенилметил)-9 Н-пурин 2,6-диамина. Повторяя последовательность операций стадии 3 примера 3, нагревают 388 мг транс-1,4 диаминоциклогексана до температуры 150 С,добавляют 107 мг полученного в стадии 2 продукта и оставляют смесь в течение приблизительно 17 ч при температуре 140-150 С, после чего оставляют охлаждаться до комнатной температуры. Затем поглощают смесь 10 мл смеси этилацетат/вода (50/50), разделяют фазы, повторно экстрагируют 2 х 10 мл этилацетата, промывают 10 мл воды и 5 мл насыщенного водного раствора хлорида натрия, высушивают и досуха упаривают. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH4OH) 98/2 добавляют 10 мл 1 М раствора винной кислоты в этаноле и оставляют кристаллизоваться. Кристаллы отжимают, промывают 2 х 1 мл этанола и сушат при температуре приблизительно 50 С, получая 78 мг целевого продукта в виде кристаллов бежевого цвета. Пример 10. Дигидрохлорид транс-N-[2-2[(4-аминоциклогексил)амино]-9-циклопентил 9 Н-пурин-6-ил]амино]этил]-4-метилбензолсульфонамида. Стадия 1. N-[2-[(2-Хлор-9-циклопентил 9 Н-пурин-6-ил)амино]этил]-4-метилбензолсульфонамид. 280 мг полученного в стадии 1 примера 7 продукта смешивают с 3 мл хлористого метилена, 0,17 мл NEt3 (триэтиламина) и 230 мг 4 метилбензолсульфонилхлорида и перемешивают в течение приблизительно 0,5 ч при комнатной температуре. Затем добавляют 2 мл воды, экстрагируют 2 х 5 мл хлористого метилена, промывают 5 мл воды, высушивают и упаривают. Остаток загущают в этиловом эфире, отжимают и сушат,получая 345 мг целевого продукта. Стадия 2. Дигидрохлорид транс-N-[2-2[(4-аминоциклогексил)амино]-9-циклопентил 39 9 Н-пурин-6-ил]амино]этил]-4-метилбензолсульфонамид. 320 мг полученного в стадии 1 продукта смешивают с 844 мг транс-1,4-диаминоциклогексана и нагревают в течение приблизительно 3 часов при приблизительно 140 С, после чего опускают температуру до 80 С, добавляют 5 млAcOEt, затем 10 мл горячей воды. Смесь оставляют охлаждаться до комнатной температуры,экстрагируют 2 х 10 мл этилацетата, промывают 10 мл насыщенного водного раствора хлорида натрия и высушивают. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (90/10/1) добавляют 1,5 мл 1,4 н раствора хлористо-водородной кислоты в этаноле, оставляют кристаллизоваться, фильтруют, промывают 5 мл этилового эфира и сушат в вакууме, получая 173 мг целевого продукта в виде кристаллов белого цвета. Пример 11. Дигидрохлорид этилового эфира транс(+-)2-[(4-аминоциклогексил)амино]-9-(тетрагидро-3-фуранил)-9 Н-пурин-6-ил] амино]бензойной кислоты. Стадия 1. Этиловый эфир (+-)-4-2-хлор-9(тетрагидро-3-фуранил)-9 Н-пурин-6-ил]амино] бензойной кислоты. Повторяют последовательность операций стадии 2 примера 2, исходя из 181 мг продукта,полученного в стадии 1 примера 2, и 3 мл бутанола и используя 124 мл этилового эфира 4 аминобензойной кислоты вместо бензиламина. Получают, таким образом, 214 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Дигидрохлорид этилового эфира транс(+-)2-[(4-аминоциклогексил)амино]-9 005072(тетрагидро-3-фуранил)-9 Н-пурин-6-ил]амино] бензойной кислоты. Повторяют последовательность операций стадии 3 примера 2, исходя из 200 мг полученного выше (стадия 1) продукта и 600 мг транс 1,4-диаминоциклогексана. После очистки на силикагеле с использованием в качестве элюента смеси метанол/триэтиламин (95/5), образуют соль 1-2 мл с помощью 1,4 н раствора хлористоводородной кислоты в этаноле, разбавляют 3 мл этилацетата, оставляют на 2 ч при комнатной температуре, отжимают, промывают 5 мл этилацетат и сушат при температуре приблизительно 50 С, получая 110 мг целевого продукта в виде кристаллов бежево-розового цвета. Пример 12. Тригидрохлорид транс-N2-(4 аминоциклогексил)-N6-(2-аминоэтил)-9-циклопентил-9 Н-пурин-2,6-диамина. 160 мг продукта, полученного в стадии 1 примера 7, смешивают с 10 мл бутанола и 690 мг транс-1,4-диаминоциклогексана, нагревают в течение приблизительно 4 дней при приблизительно 150 С. После хроматографирования на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (70/25/05) образуют соль с помощью 1,4 н раствора хлористо-водородной кислоты в этаноле, получая 60 мг целевого продукта. 41 Повторяют последовательность операций стадии 2 примера 2, исходя из 133 мг продукта,полученного в стадии 1 примера 2, и 2 мл бутанола и используя 0,2 мг (1,1 экв.) 3 йодбензолметанамина вместо бензиламина. Получают, таким образом, 208 мг целевого продукта виде кристаллов белого цвета. Стадия 2. (2R,3S)-2,3-Дигидроксибутандиоат транс(+-)-N2-(4-аминоциклогексил)-N6[(3-йодфенил)метил]-9-(тетрагидро-3-фуранил)9 Н-пурин-2,6-диамин. Повторяют последовательность операций стадии 3 примера 2, исходя из 187 мг полученного выше (стадия 1) продукта и 470 мг транс 1,4-диаминоциклогексана. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH4OH)(98/2) и образования соли с помощью 1 М раствора винной кислоты в этаноле, продукт оставляют на ночь при комнатной температуре, отжимают, промывают 10 мл этилацетата и сушат при температуре приблизительно 50 С, получая 137 мг целевого продукта в виде кристаллов бежевого цвета. 42 Загружают при комнатной температуре 240 мг продукта примера 6, 10 мл этанола и затем 1 мл раствора натриевой щелочи и (+-)-2 хлор-N-пропил-9-(тетрагидро-3-фуранил)-9 Нпурин-6-амина, перемешивают смесь в течение приблизительно 20 ч при комнатной температуре, нагревают в течение приблизительно 3 часов при приблизительно 95 С и оставляют на ночь при комнатной температуре, после чего досуха упаривают. Продукт загущают в уксусной кислоте и затем в этиловом эфире, сушат при приблизительно 50 С и получают, таким образом,244 мг целевого продукта в виде кристаллов бежевого цвета. Пример 15. Дигидрохлорид транс(+-)-N2(4-аминоциклогексил)-N6-пропил-9-(тетрагидро-3-фуранил)-9 Н-пурин-2,6-диамина. Стадия 1. (+-)-2-Хлор-N-пропил-9-(тетрагидро-3-фуранил)-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 2, исходя из 181 мг продукта,полученного в стадии 1 примера 2, и 3 мл бутанола с использованием 0,062 мл 1 аминопропана вместо бензиламина. Получают 136 мг целевого продукта в виде кристаллов бежевого цвета. 43 Повторяют последовательность операций стадии 3 примера 2, исходя из 109 мг полученного выше (стадия 1) продукта и 445 мг транс 1,4-диаминоциклогексана. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH4OH)(98/2) образуют соль с помощью 1,4 н раствора хлористо-водородной кислоты в этаноле, получая 78 мг целевого продукта в виде кристаллов. Пример 16. Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклoпeнтил-9Hпypин-6-ил]-4-(1-метилэтил)бензолсульфонамида. Стадия 1. N-2-хлор-9-циклопентил-9 Нпурин-6-ил)амино]-4-(1-метилэтил)бензолсульфонамид. Повторяют последовательность операций стадии 1 примера 8, смешивая 257 мг продукта, полученного в стадии 1 примера 1, 4 мл диметоксиэтана (DME), 390 мг карбоната цезия (Сs2 СО 3) и 199 мг 4-(1-метилэтил)бензолсульфонамида вместо бензолсульфонамида. Смесь перемешивают в течение приблизительно 2 ч 30 мин при температуре приблизительно 100 С, оставляют охлаждаться до комнатной температуры, подкисляют 4 мл 2 н раствора хлористо-водородной кислоты. Продукт далее экстрагируют 2 х 10 мл этилацетата,высушивают, досуха упаривают, кристаллизуют из 5 мл этилового эфира, отжимают и сушат при комнатной температуре, получая 187 мг целевого продукта в виде бесцветных кристаллов. Стадия 2. Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклопентил-9 Нпурин-6-ил]-4-(1-метилэтил)бензолсульфонамида. Повторяют последовательность операций стадии 2 примера 8, нагревая 456 мг транс-1,4 диаминоциклогексана до температуры приблизительно 150 С, после чего добавляют 168 мг полученного выше (стадия 1) продукта, выдерживают при температуре 150 С в течение приблизительно 3 ч 30 мин и оставляют охлаждаться до комнатной температуры. Затем добавляют 10 мл воды, отжимают, промывают 5 мл воды,сушат в вакууме при температуре приблизительно 50 С, подкисляют до рН 4-5, экстрагируют 10 мл этилацетата и досуха упаривают продукт в водной фазе. Продукт растворяют в 5 44 мл этанола, добавляют 5 мл 1,4 н раствора хлористо-водородной кислоты в этаноле, досуха упаривают, загущают в 5 мл этилового эфира,получая 42 мг целевого продукта в виде кристаллов. Пример 17. Тригидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[2-(4 метоксифенил)метил]амино]этил]-9 Н-пурин 2,6-диамина. Стадия 1. 2-Хлор-9-циклопентил-N-[2-(4 метоксифенил)метил]-амино]этил]-9 Н-пурин-6 амин. Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта,полученного в стадии 1 примера 7, 4 мл метанола, 0,2 мл 4-метоксибензальдегида, 0,2 мл уксусной кислоты и 100 мг NаВН 3 СN. Смесь перемешивают в течение приблизительно 6 ч при комнатной температуре, добавляют 10 млAcOEt, промывают 2 х 5 мл воды, затем 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. После хроматографирования на силикагеле с использованием в качестве элюента смеси СН 2 Сl2/метанол/раствор аммиака (90/10/1) получают 208 мг целевого продукта. Стадия 2. Тригидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[2-(4 метоксифенил)метил]амино]этил]-9 Н-пурин 2,6-диамина. Повторяют последовательность операций стадии 3 примера 7, исходя из 186 мг полученного выше (стадия 1) продукта 490 мг транс-1,4 диаминоциклогексана. Смесь нагревают в течение 10 ч при приблизительно 140 С, очищают на силикагеле с использованием в качестве элюента смеси CH2Cl2/MeOH/NH4OH (85/15/1,5),образуют соль с помощью 1,4 н раствора хлористо-водородной кислоты в этаноле, получая 60 мг целевого продукта. Пример 18. Дигидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[2-(7 метокси-1,3-бензодиоксол-5-ил)метил]амино] этил]-9 Н-пурин-2,6-диамин. Стадия 1. 2-Хлор-9-циклопентил-N-[2-(7 метокси-1,3-бензодиоксол-5-ил)метил]амино] этил]-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта,полученного в стадии 1 примера 7, 4 мл метанола, 250 мг 7-метокси-1,3-бензодиоксол-5 карбоксальдегида вместо бензальдегида, 0,2 мл уксусной кислоты и 0,4 мл тетрагидрофурана. Смесь оставляют на 4 ч при комнатной температуре, добавляют 100 мг NaBH3CN и перемешивают при комнатной температуре в течение приблизительно 3 ч. После этого добавляют 10 мл AcOEt, промывают 2 х 5 мл воды, затем 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (90/10/1) получают 311 мг целевого продукта в виде кристаллов бежевого цвета. Стадия 2: Дигидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[2-(7 метокси-1,3-бензодиоксол-5-ил)метил]амино] этил]-9 Н-пурин-2,6-диамин. Повторяют последовательность операций стадии 3 примера 7, исходя из 65 мг полученного выше (стадия 1) продукта и 743 мг транс-1,4 диаминоциклогексана. Нагревают смесь в течение 3 ч при приблизительно 140 С, обрабатывают 10 мл воды и экстрагируют 2 х 10 мл этилацетата, промывают 10 мл насыщенного водного раствора NaCl и высушивают на MgSO4. После образования соли с помощью 1,4 н HCl в этаноле, фильтруют, промывают 5 мл EtOH и 46 сушат при приблизительно 50 С, получая 161 мг целевого продукта. Пример 19. Тригидрохлорид транс-N2-(4 аминоциклогексил)-N6-[2-(4-хлор-3-трифторметил)фенил]метил]амино]этил]-9-циклопентил-9 Н-пурин-2,6-диамина. Стадия 1. 2-Хлор-N-[2-4-хлор-3-(трифторметил)фенил]метил]-амино]этил]-9-циклопентил-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта,полученного в стадии 1 примера 7, 4 мл метанола, 292 мг 4-хлор-3-(трифторметил)бензальдегида вместо бензальдегида и 0,2 мл уксусной кислоты. Смесь перемешивают в течение приблизительно 3 ч при комнатной температуре, добавляют 100 мг NaBH3CN и перемешивают при комнатной температуре в течение приблизительно 3 ч. После этого добавляют 10 млAcOEt, промывают 2x5 мл воды, затем 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (90/10/1) получают 367 мг целевого продукта в виде кристаллов бежевого цвета. Стадия 2: Тригидрохлорид транс-N2-(4 аминоциклогексил)-N6-[2-(4-хлор-3-(трифторметил)фенил]метил]амино]этил]-9-циклопентил-9 Н-пурин-2,6-диамина. Повторяют последовательность операций стадии 3 примера 7, исходя из 320 мг полученного выше (стадия 1) продукта и 770 мг транс 1,4-диаминоциклогексана и нагревая смесь в течение 3 часов при приблизительно 140 С. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака сушат при приблизительно 50 С, получая 166 мг целевого продукта. Пример 20. Тригидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[(дифенилметил]амино]этил-9 Н-пурин-2,6-диамина. Стадия 1. 2-Хлор-9-циклопентил-N-[2[(дифенилметил)амино]этил]-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 7, исходя из 141 мг продукта,полученного в стадии 1 примера 7, 2 мл метанола, 0,7 мл (15 экв.) бензальдегида и 0,1 мл уксусной кислоты. Смесь перемешивают в течение приблизительно 3 ч при комнатной температуре, добавляют 55 мг цианоборогидрида натрия(NaBH3CN) и перемешивают в течение 1 ч при комнатной температуре. После этого добавляют 10 мл AcOEt, промывают 2 х 5 мл воды, затем 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. Продукт, полученный после очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат (70/30),загущают в гексане и получают 143 г целевого продукта. Стадия 2. Тригидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[(дифенилметил)амино]этил]-9 Н-пурин-2,6-диамина. Повторяют последовательность операций стадии 3 примера 7, исходя из 90 мг полученного выше (стадия 1) продукта и 222 мг транс-1,4 диаминоциклогексана и нагревая смесь в течение приблизительно 3 часов при приблизительно 140 С. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (85/25/1,5) образуют соль с помощью 1,4 н НСl в этаноле, фильтруют, промывают 5 мл EtOH и сушат при приблизительно 50 С. Пример 21. Дигидрохлорид транс-4-2[(4-аминоциклогексил)-амино]-9-циклопентил 9 Н-пурин-6-ил]амино]метил]бензойной кислоты. Повторяют последовательность операций стадии 3 примера 1, исходя из 741 мг транс-1,4 диаминоциклогексана. Смесь нагревают до приблизительно 140 С и добавляют 500 мг продукта, полученного в стадии 2 примера 1, после чего оставляют в течение приблизительно 3 ч при 140 С и затем охлаждаться до комнатной температуры. Затем добавляют 5 мл воды,фильтруют, поглощают осадок 10 мл этанола,добавляют 3 мл 1,4 н раствора хлористоводородной кислоты в этаноле, отфильтровывают нерастворимые примеси и досуха упаривают. Остаток загущают в этиловом эфире и сушат при комнатной температуре, получая 45 мг целевого продукта. Пример 22. Тригидрохлорид метилового эфира транс 4-2-2-[(4-аминоциклогексил) амино]-9-циклопентил-9 Н-пурин-6-ил]амино] этил]амино]метил]бензойной кислоты. Стадия 1. Метиловый эфир 4-2-[(2-хлор 9-циклопентил-9 Н-пурин-6-ил]амино]этил] амино]метил]бензойной кислоты. Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта, 49 полученного в стадии 1 примера 1, 4 мл метанола, 230 мг метилового эфира 4-формилбензойной кислоты вместо бензальдегида и 0,2 мл уксусной кислоты. Смесь перемешивают в течение 5 ч при комнатной температуре, добавляют 100 мг NаВН 3 СN и перемешивают при комнатной температуре в течение приблизительно 1 ч. После этого добавляют 10 мл AcOEt, промывают 2 х 5 мл воды, затем 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (95/05/0,5) получают 260 мг целевого продукта. Стадия 2. Тригидрохлорид метилового эфира транс-4-2-2-[(4-аминоциклогексил) амино]-9-циклопентил-9 Н-пурин-6-ил]амино] этил]амино]метил]бензойной кислоты. Повторяют последовательность операций стадии 3 примера 1, исходя из 256 мг полученного выше (стадия 1) продукта и 700 мг транс 1,4-диаминоциклогексана и нагревая смесь в течение приблизительно 4 ч при приблизительно 140 С с последующим экстрагированием 3 х 10 мл этилацетата и промывкой 10 мл насыщенного водного раствора хлорида натрия. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака(85/25/1,5) образуют соль с помощью 1,4 н HCl в этаноле, которую отфильтровывают, промывают 5 мл EtOH и сушат при приблизительно 50 С, получая 70 мг целевого продукта. 50 Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта,полученного в стадии 1 примера 1, 184 мг 4 цианобензальдегида вместо бензальдегида, 4 мл метанола, 0,2 мл уксусной кислоты и 0,5 мл тетрагидрофурана. Смесь перемешивают в течение приблизительно 5 ч при комнатной температуре, добавляют 100 мг NaBH3CN и перемешивают в течение 1 ч при комнатной температуре. Затем добавляют 10 мл AcOEt, промывают 2 х 5 мл воды, затем 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/гидроксиламин(95/05/0,33) получают 347 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Тригидрохлорид транс-N2-(4 аминоциклогексил)-N6-[(4-цианофенил)метил] амино]этил]-9-циклопентил-9 Н-пурин-2,6 диамина. Повторяют последовательность операций стадии 3 примера 7, исходя из 250 мг полученного выше (стадия 1) продукта и 720 мг транс 1,4-диаминоциклогексана и нагревая смесь в течение 4 ч при приблизительно 140 С с последующим поглощением смеси 10 мл воды, экстракцией 3 х 10 мл этилацетата и промывкой 10 мл насыщенного хлорида натрия. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/гидроксиламин (85/15/1,5) образуют соль с помощью 1,4 н HCl в этаноле, фильтруют, промывают 5 мл EtOH и сушат при приблизительно 50 С, получая 222 мг целевого продукта. ЯМР в ДМСО 51 Стадия 1. 2-Хлор-9-циклопентил-N-[2(3,4,5-триметоксифенил)метил]амино]этил]9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта,полученного в стадии 1 примера 7, 275 мг 3,4,5 триметоксибензальдегида вместо бензальдегида,4 мл метанола и 0,2 мл уксусной кислоты. Смесь перемешивают в течение 5 ч при комнатной температуре, добавляют 100 мг NаВН 3 СN и перемешивают при комнатной температуре в течение приблизительно 1 ч. После этого добавляют 10 мл AcOEt, промывают 2 х 5 мл воды,затем 5 мл насыщенного водного раствора NaCl,высушивают и отгоняют растворитель. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака(95/05/0,33) получают 305 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Тригидрохлорид транс-N2-(4 аминоциклогексил)-9-циклопентил-N6-[2-3,4,5 триметоксифенил)метил]амино]этил-9 Н-пурин 2,6-диамина. Повторяют последовательность операций стадии 3 примера 7, исходя из 297 мг полученного выше (стадия 1) продукта и 735 мг транс 1,4-диаминоциклогексана и нагревая смесь в течение 3 ч 30 мин при приблизительно 140 С с последующим выливанием в 10 мл воды, экстрагированием 3 х 10 мл этилацетата и промывкой 10 мл насыщенного хлорида натрия. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (85/25/1,5) образуют соль с помощью 1,4 н HCl в этаноле,которую отфильтровывают, промывают 5 млEtOH и сушат при приблизительно 50 С. 52 тил]амино]этил]-9-циклопентил-9 Н-пурин-2,6 диамина. Стадия 1. 2-Хлор-N-[2-(4-хлорфенил) метил]амино]этил]-9-циклопентил-9 Н-пурин-6 амин. Повторяют последовательность операций стадии 2 примера 7, исходя из 280 мг продукта,полученного в стадии 1 примера 7, 197 мг 4 хлорбензальдегида вместо бензальдегида, 4 мл метанола и 0,2 мл уксусной кислоты. Смесь перемешивают в течение 5 ч при комнатной температуре, добавляют 100 мг NaBH3CN и перемешивают еще в течение приблизительно 1 ч при комнатной температуре. Затем добавляют 10 мл AcOEt, промывают 2 х 5 мл воды, 5 мл насыщенного водного раствора NaCl, высушивают и отгоняют растворитель. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака (95/05/0,33) получают 258 мг целевого продукта. Стадия 2. Тригидрохлорид транс-N2-(4 аминоциклогексил)-N6-[2-(4-хлорфенил)метил]амино]этил]-9-циклопентил-9 Н-пурин-2,6 диамина. Повторяют последовательность операций стадии 3 примера 7, исходя из 242 мг полученного выше (стадия 1) продукта и 680 мг транс 1,4-диаминоциклогексана и нагревая смесь в течение приблизительно 3 ч 30 мин при приблизительно 140 С с последующим выливанием в воду, экстрагированием 3 х 10 мл этилацетата и промывкой 10 мл насыщенного хлорида натрия. После очистки хроматографией на силикагеле с использованием в качестве элюента смеси хлористый метилен/метанол/раствор аммиака(85/15/1,5) образуют соль с помощью 1,4 н НСl в этаноле, которую отфильтровывают, промывают 5 мл EtOH и сушат при приблизительно 50 С. 53 Пример 26. Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклопентил-9Hпурин-6-ил]-3-бромбензолсульфонамида. Стадия 1. 3-Бром-N-2-хлор-9-циклопентил-9 Н-пурин-6-ил]амино]бензолсульфонамид. Повторяют последовательность операций стадии 1 примера 8, исходя из 257 мг продукта,полученного в стадии 1 примера 1, 4 мл диметоксиэтана (DME), 390 мг карбоната цезия(Сs2 СО 3) и 236 мг 3-бромбензолсульфонамида вместо бензолсульфонамида. Смесь перемешивают в течение приблизительно 2 ч 30 мин при температуре приблизительно 100 С и оставляют охлаждаться до комнатной температуры, после чего подкисляют 4 мл 2 н раствором хлористоводородной кислоты, экстрагируют 2 х 10 мл этилацетата, высушивают и досуха упаривают. Продукт загущают в 5 мл этилового эфира, отжимают и сушат при комнатной температуре,получая 356 мг целевого продукта в виде кристаллов бежевого цвета. Стадия 2: Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклопентил-9 Нпурин-6-ил]-3-бромбензолсульфонамида. Повторяют последовательность операций стадии 2 примера 8, нагревая 400 мг транс-1,4 диаминоциклогексана до температуры приблизительно 150 С, после чего добавляют 319 мг полученного выше (стадия 1) продукта и поддерживают температуру 150 С в течение ночи. Затем смесь оставляют охлаждаться до комнатной температуры и хроматографируют на силикагеле, используя в качестве элюента смесьCH2Cl2/MeOH/NH4OH (70/30/1), добавляют после этого 4 мл этанола и 4 мл 1,4 н раствор хлористо-водородной кислоты в этаноле, загущают в 10 мл смеси этиловый эфир/этилацетат (50/50) и сушат в вакууме при температуре приблизительно 50 С, получая 231 мг целевого продукта в виде кристаллов бежевого цвета. 54 Стадия 1. N-2-Хлор-9-циклопентил-9 Нпурин-6-ил]амино]-3-трифторметилбензолсульфонамид. Повторяют последовательность операций стадии 1 примера 8, исходя из 257 мг продукта,полученного в стадии 1 примера 1, 4 мл диметоксиэтана (DME), 390 мг карбоната цезия(Сs2 СО 3) и 225 мг 3-трифторметилбензолсульфонамида вместо бензолсульфонамида. Смесь перемешивают в течение приблизительно 2 ч 30 мин при температуре приблизительно 100 С и оставляют охлаждаться до комнатной температуры, после чего подкисляют 4 мл 2 н раствором хлористо-водородной кислоты, экстрагируют 2 х 10 мл этилацетата, высушивают и досуха упаривают. Продукт загущают в 10 мл этилового эфира, отжимают и сушат при комнатной температуре, получая 273 мг целевого продукта в виде бесцветных кристаллов. Стадия 2. Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклопентил-9 Нпурин-6-ил]-3-(трифторметил)бензолсульфонамида. Повторяют последовательность операций стадии 2 примера 8, нагревая 286 мг транс-1,4 диаминоциклогексана до температуры приблизительно 150 С, после чего добавляют 222 мг полученного выше (стадия 1) продукта, поддерживают температуру 150 С в течение 3 ч,затем при 110 С в течение ночи и при 150 С в течение 2 ч. Далее смесь оставляют охлаждаться до комнатной температуры и хроматографируют на силикагеле, используя в качестве элюента смесь CH2Cl2/MeOH/NH4OH (70/30/1), добавляют после этого 5 мл этанола и 4 мл 1,4 н раствора хлористо-водородной кислоты в этаноле, загущают в 5 мл смеси этиловый эфир/этилацетат(50/50) и сушат в вакууме при температуре приблизительно 50 С, получая 166 мг целевого продукта в виде кристаллов бежевого цвета. 55 Стадия 1. N-2-Хлор-9-циклопентил-9 Нпурин-6-ил]амино]-4-(1,1-диметилэтил)бензолсульфонамид. Повторяют последовательность операций стадии 1 примера 8, исходя из 257 мг продукта,полученного в стадии 1 примера 1, 4 мл диметоксиэтана (DME), 390 мг карбоната цезия(Сs2 СО 3) и 213 мг 4-(1,1-диметилэтил)бензолсульфонамид вместо бензолсульфонамида. Смесь перемешивают в течение приблизительно 4 ч при температуре приблизительно 100 С и оставляют охлаждаться до комнатной температуры, после чего добавляют 4 мл 2 н раствор хлористо-водородной кислоты и 5 мл воды, экстрагируют 40 мл этилацетата, высушивают и досуха упаривают. Продукт загущают в 10 мл этилового эфира, отжимают и сушат при комнатной температуре, получая 253 мг целевого продукта в виде кристаллов бежевого цвета. Стадия 2. Дигидрохлорид транс-N-[2-[(4 аминоциклогексил)амино]-9-циклопентил-9 Нпурин-6-ил]-4-(1,1-диметилэтил)бензолсульфонамида. Повторяют последовательность операций стадии 2 примера 8, нагревая 286 мг транс-1,4 диаминоциклогексана до температуры приблизительно 150 С, после чего добавляют 217 мг полученного выше (стадия 1) продукта, поддерживают температуру 150 С в течение 5 ч. Затем смесь оставляют охлаждаться до комнатной температуры и хроматографируют на силикагеле, используя в качестве элюента смесь хлористый метилен/метанол/раствор аммиака(70/30/1). Продукт растворяют в 10 мл этанола,добавляют 4 мл 1,4 н раствор хлористоводородной кислоты в этаноле, загущают в 10 мл этилового эфира и сушат при комнатной температуре, получая 166 мг целевого продукта в виде кристаллов бежевого цвета. ЯМР в ДМСО Пример 29. Дигидрохлорид транс(+-)-N2(4-аминоциклогексил)-N6-пропил-9-(тетрагидро-3-тиенил)-9 Н-пурин-6-амина. Стадия 1. 2-Хлор-N-пропил-9-(тетрагидро 3-тиенил)-9 Н-пурин-2,6-диамин. Повторяют последовательность операций стадии 2 примера 5, исходя из 160 мг продукта,полученного в стадии 1 примера 5, 3 мл бутанола и, используя 0,100 мл 1-аминопропана вместо бензиламина. Смесь нагревают в течение 24 ч до температуры приблизительно 80-85 С, ос 005072 56 тавляют охлаждаться до комнатной температуры, досуха упаривают, загущают в 10 мл этилацетат при комнатной температуре, отжимают,промывают 10 мл и сушат в вакууме при температуре приблизительно 50 С, получая 123 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Дигидрохлорид транс(+-)-N2-(4 аминоциклогексил)-N6-пропил-9-(тетрагидро-3 тиенил)-9 Н-пурин-2,6-диамина. Повторяют последовательность операций стадии 3 примера 5, исходя из 400 мг транс-1,4 диаминоциклогексана и 106 мг полученного выше (стадия 1) продукта, нагревают смесь в течение приблизительно 6 ч до температуры приблизительно 140-145 С и оставляют ее охлаждаться до комнатной температуры. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака(NH4OH) (98/2) и образования соли с помощью 1,4 н раствора хлористо-водородной кислоты в этаноле получают 30 мг целевого продукта в виде кристаллов бежево-розового цвета. Пример 30. Дигидрохлорид транс (+-)-N2(4-аминоциклогексил)-N6-[(3-йодофенил)метил]-9-(тетрагидро-3-тиенил)-9 Н-пурин-2,6 диамина. Стадия 1. 2-Хлор-N-[(3-йодофенил)метил]9-(тетрагидро-3-тиенил)-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 5, исходя из 160 мг продукта,полученного в стадии 1 примера 5, 3 мл бутанола и используя 0,114 мл 3-йодобензолметанамина вместо бензиламина. Смесь нагревают в течение приблизительно 30 ч до температуры приблизительно 80-85 С, оставляют охлаждаться до комнатной температуры, разбавляют 3 мл изопропилового спирта, выдерживают приблизительно в течение одного часа при температуре близкой к 0 С, отжимают, промывают 5 мл изопропилового спирта и сушат в вакууме при температуре приблизительно 50 С. После очистки на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат (90/10) получают 173 мг целево 57 го продукта в виде кристаллов беловатожелтого цвета. Стадия 2. Дигидрохлорид транс(+-)-N2-(4 аминоциклогексил)-N6-[(3-йодофенил)метил]-9(тетрагидро-3-тиенил)-9 Н-пурин-2,6-диамина. Повторяют последовательность операций стадии 3 примера 5, исходя из 330 мг транс-1,4 диаминоциклогексана и 137 мг полученного выше (стадия 1) продукта, нагревают смесь в течение приблизительно 6 час до температуры приблизительно 140-145 С и оставляют ее охлаждаться до комнатной температуры. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака(NH4OH) (98/2) с последующим образованием соли с помощью 1,4 н раствора хлористоводородной кислоты в этаноле, отжима, промывки и сушки при температуре приблизительно 50 С получают 74 мг целевого продукта в виде кристаллов буровато-розового цвета. Пример 31. Дигидрохлорид транс (+-)-N2(4-аминоциклогексил)-N6-фенил-9-(тетрагидро 3-тиенил)-9 Н-пурин-2,6-диамина. Стадия 1. 2-Хлор-N-фенил-9-(тетрагидро 3-тиенил)-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 5, исходя из 160 мг продукта,полученного в стадии 1 примера 5, 3 мл бутанола и используя 0,055 мл анилина вместо бензиламина. Смесь нагревают в течение 20 ч до температуры приблизительно 80-85 С, оставляют охлаждаться до комнатной температуры, разбавляют 5 мл изопропилового спирта, выдерживают приблизительно 1 ч при температуре близкой к 0 С, отжимают, промывают 5 мл изопропилового спирта и сушат в вакууме при температуре приблизительно 50 С. После очистки на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат (90/10) получают 173 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Дигидрохлорид транс(+-)-N2-(4 аминоциклогексил)-N6-фенил-9-(тетрагидро-3 тиенил)-9 Н-пурин-2,6-диамина. Повторяют последовательность операций стадии 3 примера 5, исходя из 536 мг транс-1,4 диаминоциклогексана и 156 мг полученного 58 выше (стадия 1) продукта, нагревают смесь в течение приблизительно 4 ч 30 мин до температуры приблизительно 140-145 С и оставляют ее охлаждаться до комнатной температуры. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака(NH4OH) (98/2) с последующим образованием соли с помощью 1,4 н раствора хлористоводородной кислоты в этаноле, отжима, промывки и сушки при температуре приблизительно 50 С получают 145 мг целевого продукта в виде кристаллов бежево-розового цвета. Пример 32. Дигидрохлорид этилового эфира транс(+-)-4-2-[(4-аминоциклогексил) амино]-9-(тетрагидро-3-тиенил)-9 Н-пурин-6-ил] амино]бензойной кислоты. Стадия 1. Этиловый эфир 4-2-хлор-9(тетрагидро-3-тиенил)-9 Н-пурин-6-ил]амино] бензойной кислоты. Повторяют последовательность операций стадии 2 примера 5, исходя из 160 мг продукта,полученного в стадии 1 примера 5, 3 мл бутанола и используя 100 мг этилового эфира 4-аминобензойной кислоты вместо бензиламина. Смесь нагревают в течение приблизительно 30 ч до температуры приблизительно 80-85 С, оставляют охлаждаться до комнатной температуры,разбавляют 3 мл изопропилового спирта, выдерживают приблизительно один час при температуре близкой к 0 С, отжимают, промывают 5 мл изопропилового спирта и сушат в вакууме при температуре приблизительно 50 С. После очистки на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат (90/10) получают 202 мг целевого продукта в виде кристаллов беловатокремового цвета. Стадия 2. Дигидрохлорид этилового эфира транс(+-)-4-2-[(4-аминоциклогексил)амино]-9(тетрагидро-3-тиенил)-9H-пурин-6-ил]амино] бензойной кислоты. Повторяют последовательность операций стадии 3 примера 5, исходя из 513 мг транс-1,4 диаминоциклогексана, который нагревают до температуры приблизительно 70-75 С, после чего добавляют 181 мг продукта, полученного в описанной выше стадии 1. Смесь далее нагре 59 вают в течение 4 ч 30 мин до температуры приблизительно 140-145 С и оставляют ее охлаждаться до комнатной температуры. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака(NH4OH) (98/2) с последующим образованием соли с помощью 1,4 н раствора хлористоводородной кислоты в этаноле, отжима, промывки 10 мл этанола и сушки при температуре приблизительно 50 С получают 150 мг целевого продукта в виде кристаллов белого цвета. Пример 33. Дигидрохлорид транс(+-)-N2(4-аминоциклогексил)-9-(тетрагидро-3-тиенил)N6-[4-(трифторметокси)фенил]-9 Н-пурин-2,6 диамина. Стадия 1. 2-Хлор-9-(тетрагидро-3-тиенил)N-[4-(трифторметокси)-фенил]-9 Н-пурин-6 амин. Повторяют последовательность операций стадии 2 примера 5, исходя из 160 мг продукта,полученного в стадии 1 примера 5, 3 мл бутанола и используя 0,081 мл 4-(трифторметокси) бензиламина вместо бензиламина. Смесь нагревают в течение приблизительно 20 ч до температуры приблизительно 80-85 С, оставляют охлаждаться до комнатной температуры, разбавляют 3 мл изопропилового спирта, выдерживают приблизительно один час при температуре близкой к 0 С, отжимают, промывают 5 мл изопропилового спирта и сушат в вакууме при температуре приблизительно 50 С. После очистки на силикагеле с использованием в качестве элюента смеси хлористый метилен/этилацетат(90/10) получают 203 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Дигидрохлорид транс(+-)-N2-(4 аминоциклогексил)-9-(тетрагидро-3-тиенил)N6-[4-(трифторметокси)фенил]-9 Н-пурин-2,6 диамина. Повторяют последовательность операций стадии 3 примера 5, исходя из 186 мг полученного выше (стадия 1) продукта и 513 мг транс 1,4-диаминоциклогексана. Смесь нагревают в течение 4 ч 30 мин до температуры приблизительно 140-145 С и оставляют ее охлаждаться до комнатной температуры. После очистки на силикагеле с использованием в качестве элюен 005072(98/2) с последующим образованием соли с помощью 1,4 н раствора хлористо-водородной кислоты в этаноле, отжима, промывки 10 мл этанола и сушки при температуре приблизительно 50 С получают 117 мг целевого продукта в виде кристаллов бежевого цвета. Пример 34. Дигидрохлорид транс (+-)-N2(4-аминоциклогексил)-N6-фенил-9-(тетрагидро 3-фуранил)-9 Н-пурин-2,6-диамина. Стадия 1. (+-)-2-Хлор-N-фенил-9-(тетрагидро-3-фуранил)-9 Н-пурин-6-амин. Повторяют последовательность операций стадии 2 примера 2, исходя из 200 мг (0,77 ммоль) продукта, полученного в стадии 1 примера 2, и 3 мл бутанола и используя 0,088 мл(0,96 ммоль) анилина вместо бензиламина, получают 213 мг целевого продукта в виде кристаллов белого цвета. Стадия 2. Дигидрохлорид транс(+-)-N2-(4 аминоциклогексил)-N6-фенил-9-(тетрагидро-3 фуранил)-9 Н-пурин-2,6-диамина. Повторяют последовательность операций стадии 3 примера 2, исходя из 198 мг полученного выше (стадия 1) продукта и 716 мг транс 1,4-диаминоциклогексана. После очистки на силикагеле с использованием в качестве элюента смеси метанол/раствор аммиака (NH4OH)(98/2) с последующим образованием соли с помощью 1,4 н раствора хлористо-водородной кислоты в этаноле получают 169 мг целевого продукта в виде бежево-розовых кристаллов.
МПК / Метки
МПК: A61P 25/28, A61K 31/52, C07D 473/16
Метки: способ, содержащие, пурина, композиции, получения, фармацевтические, производные
Код ссылки
<a href="https://eas.patents.su/30-5072-proizvodnye-purina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пурина, способ их получения и содержащие их фармацевтические композиции</a>












