Производные n-(арилсульфонил)бета-аминокислот, содержащие замещенную аминометильную группу, способ их получения и содержащие их фармацевтические композиции
Номер патента: 6430
Опубликовано: 29.12.2005
Авторы: Гуга Жан, Феррари Бернар, Сарран Лионель, Мюно Иветт, Перро Пьер
Формула / Реферат
1. Соединение формулы

где R1 представляет собой фенилвинильную группу; фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; нафтильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; тетрагидронафтильную группу; нафто[2,3-d][1,3]диоксол-6-ильную группу; гетероциклический радикал, выбранный из хинолила, изохинолила, 1-бензофур-2-ила, 2,1,3-бензоксадиазол-4-ила, 2,1,3-бензотиадиазол-4-ила, 1,3-бензотиазол-2-ила, 1-бензотиофен-2-ила, 1H-пиразол-4-ила, тиен-2-ила, 5-изоксазолтиен-2-ила, бензотиен-2-ила, тиено[3,2-c]пирид-2-ила; причем указанные гетероциклические радикалы не замещены или замещены один или более чем один раз группами R6, которые могут быть одинаковыми или разными;
R2 представляет собой водород или (C1-C4)алкильную группу, а R3 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R7, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, 2,1,3-бензотиадиазол-5-ила, 2,1,3-бензоксадиазол-5-ила, бензотиофен-5-ила, 2,3-дигидробензо[1,4]диоксин-6-ила, бензофурила, дигидробензофурила, 1,3-тиазол-2-ила, фурила и тиенила, причем указанный гетероциклический радикал не замещен или замещен один или более чем один раз атомом галогена или (C1-C4)алкильной группой;
или альтернативно R2 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, пиридила и инданила, а R3 представляет собой водород;
R4 представляет собой группу -CONR8R9; группу -CSNR8R9; группу -COR13; фенильную группу, которая не замещена или замещена один или более чем один раз группами R10; гетероциклический радикал, выбранный из пиридила, имидазолила, фурила, бензимидазолила, бензотиазол-2-ила и бензо[1,3]-диоксол-5-ила, причем указанные радикалы не замещены или замещены одной или более чем одной метильной группой или одним или более чем одним атомом галогена;
R5 представляет собой группу -CH2NR11R12 или -CH2N(O)NR11R12;
R6 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; 2-фторэтоксигруппу; трифторметокси, метилендиокси или дифторметилендиоксигруппу;
R7 представляет собой атом галогена; (C1-C4)алкильную группу; фенильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; бензилоксигруппу; трифторметоксигруппу;
R8 и R9, каждый независимо, представляет собой водород; (C1-C4)алкильную группу; (C3-C7)циклоалкильную группу; (C3-C7)циклоалкил(C1-C4)алкильную группу; w-(C1-C4)диалкиламино(C2-C4)алкильную группу;
или альтернативно R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из пирролидинила, морфолин-4-ила, тиоморфолин-4-ила, азепин-1-ила, пиперидила, не замещенного или замещенного одним или более чем одним атомом галогена либо одной или более чем одной (C1-C4)алкильной, (C1-C4)алкокси или трифторметильной группой, 3,4-дигидропиперид-1-ила, циклогексилспиро-4-пиперид-1-ила и пиперазинила, не замещенного или замещенного одной или более чем одной (C1-C4)алкильной группой;
R10 представляет собой атом галогена; (C1-C4)алкильную группу; гидроксигруппу; (C1-C6)алкоксигруппу; R10 также может представлять собой группу -CH2NR11R12, когда R5 представляет собой группу -CH2NR11R12, указанные группы в таком случае являются одинаковыми;
R11 и R12, каждый независимо, представляет собой водород; (C1-C6)алкильную группу; (C2-C4)алкенильную группу; (C3-C7)циклоалкильную группу; (C3-C7)циклоалкил(C1-C4)алкильную группу; w-гидрокси(C2-C4)алкиленовую группу; w-метокси(C2-C4)алкиленовую группу; w-трифторметил-(C2-C4)алкиленовую группу; w-галогено(C2-C4)алкиленовую группу;
или альтернативно R11 и R12 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический гетероциклический радикал, выбранный из азетидинила, пирролидинила, морфолин-4-ила, тиоморфолин-4-ила, пиперид-1-ила, пиперазин-1-ила, 1,2,3,6-тетрагидропирид-1-ила, 2,3,4,5-тетрагидропиридиния, декагидрохинолила, декагидроизохинолила, тетрагидроизохинолила, октагидро-1H-изоиндолила, (C4-C6)циклоалкилспиропиперидила, 3-азабицикло[3.1.0]гексила и 7-азабицикло[2.2.1]гептан-7-ила, не замещенного или замещенного один или более чем один раз атомом галогена либо (C1-C4)алкильной, гидроксильной, (C1-C4)алкокси, трифторметильной, дифторметиленовой или фенильной группой;
R13 представляет собой фенильную, тиазол-2-ильную или пиридильную группу;
а также его соли с минеральными или органическими кислотами, и/или их сольваты, и/или их гидраты.
2. Соединение формулы по п.1
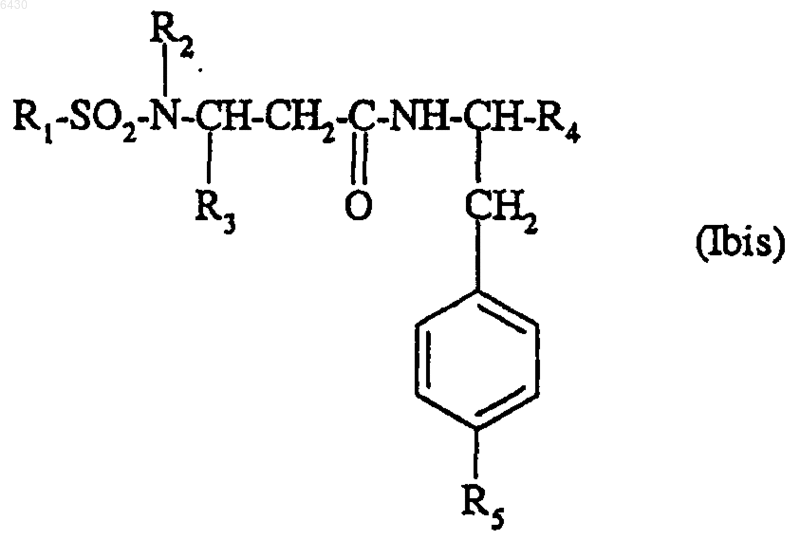
где R1 представляет собой фенилвинильную группу; фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; нафтильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; тетрагидронафтильную группу; гетероциклический радикал, выбранный из хинолила, 1-бензофур-2-ила, 2,1,3-бензоксадиазол-4-ила, 2,1,3-бензотиадиазол-4-ила, 1,3-бензотиазол-2-ила, 1-бензтиофен-2-ила, 1H-пиразол-4-ила, тиен-2-ила, 5-изоксазолтиен-2-ила, бензотиен-2-ила, тиено[3,2-c]пирид-2-ила; нафто[2,3-d][1,3]диоксол-6-ила; причем указанные гетероциклические радикалы не замещены или замещены один или более чем один раз группами R6, которые могут быть одинаковыми или разными;
R2 представляет собой водород или (C1-C4)алкильную группу, а R3 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R7, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, который не замещен или замещен по положению 2 двумя атомами фтора; 2,1,3-бензотиадиазол-5-ила; 2,3-дигидробензо[1,4]диоксин-6-ила; 1,3-тиазол-2-ила; 1-бензофур-2-ила; 1-бензофур-5-ила; фурила; тиен-2-ила; тиен-3-ила;
или R2 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила; пиридила; инданила; а R3 представляет собой водород;
R4 представляет собой группу -CONR8R9; фенильэую группу, которая не замещена или замещена один или более чем один раз группами R10; гетероциклический радикал, выбранный из пиридила, имидазолила, фурила, бензимидазолила, бензотиазол-2-ила и бензо[1,3]диоксол-5-ила, причем указанные радикалы не замещены или замещены метилом;
R5 представляет собой группу -CH2NR11R12;
R6 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; 2-фторэтоксигруппу; трифторметокси, метилендиокси или дифторметилендиоксигруппу;
R7 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; бензилоксигруппу; трифторметоксигруппу;
R8 и R9, каждый независимо, представляет собой водород; (C1-C4)алкильную группу; (C3-C7)циклоалкильную группу; (C3-C7)циклоалкил(C1-C4)алкильную группу; w-(C1-C4)диалкиламино(C2-C4)алкильную группу;
или R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из пирролидинила, пиперидила, морфолин-4-ила, тиоморфолин-4-ила, пиперазин-1-ила, 4-метилпиперазин-1-ила, 4-метилпиперид-1-ила, 2-метилпиперид-1-ила, 4,4-диметилпиперид-1-ила, 4,4-дифторпиперид-1-ила, 4-трифторметилпиперид-1-ила, 3,4-дигидропиперид-1-ила, азепин-1-ила и цикпогексилспиро-4-пиперид-1-ила;
R10 представляет собой атом галогена; (C1-C4)алкильную группу; гидроксильную группу; (C1-C6)алкоксигруппу; R10 также может представлять собой группу -CH2NR11R12, когда R5 представляет собой группу -CH2NR11R12, указанные группы в таком случае являются одинаковыми;
R11 и R12, каждый независимо, представляет собой водород; (C1-C6)алкильную группу; (C2-C4)алкенильную группу; (C3-C7)циклоалкильную группу; (C3-C7)циклоалкил(C1-C4)алкильную группу; w-гидрокси(C2-C4)алкиленовую группу; w-метокси(C2-C4)алкиленовую группу; w-трифторметил-(C2-C4)алкиленовую группу; w-галогено(C2-C4)алкиленовую группу;
или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический гетероциклический радикал, выбранный из азетидинила, пирролидинила, морфолин-4-ила, тиоморфолин-4-ила, пиперид-1-ила, пиперазин-1-ила, 1,2,3,6-тетрагидропирид-1-ила, декагидрохинолила, декагидроизохинолила, октагидро-1H-изоиндолила, (C4-C6)циклоалкилспиропиперидила и 3-азабицикло[3.1.0]гексила, не замещенного или замещенного один или более чем один раз атомом галогена либо (C1-C4)алкильной, гидроксильной, (C1-C4)алкокси, трифторметильной, дифторметиленовой или фенильной группой;
а также его соли с минеральными или органическими кислотами, и/или их сольваты, или их гидраты.
3. Соединение формулы (I) по п.1 или 2, где R1 представляет собой 2,4-дихлор-3-метилфенильную, нафтильную, 6-метоксинафт-2-ильную, 3-метилбензотиофен-2-ильную, 3-метил-5-хлорбензотиофен-2-ильную, 3-метил-5-метоксибензотиофен-2-ильную, 3-метил-6-метоксибензотиофен-2-ильную или 3-метил-1-бензофур-2-ильную группу.
4. Соединение формулы (I) по п.1 или 2, где R2 представляет собой водород, а R3 представляет собой бензо[1,3]диоксол-5-ильную или фенильную группу, не замещенную или замещенную галогеном.
5. Соединение формулы (I) по п.1 или 2, где R4 представляет собой группу -CONR8R9 и -NR8R9 представляет собой радикал ди(C1-C4)алкиламино, пирролидинил или пиперидил, не замещенный или замещенный один или два раза метилом или галогеном.
6. Соединение формулы (I) по п.1 или 2, где R5 представляет собой группу -CH2NR11R12, в которой -NR11R12 представляет собой радикал этилизобутиламино, этилизопропиламино, этил-трет-бутиламино, диизопропиламино, циклопентилметиламино или циклопентилэтиламино либо радикал пиперидил, не замещенный или замещенный один или более чем один раз метилом или галогеном.
7. Соединение по п.1 или 2 формулы
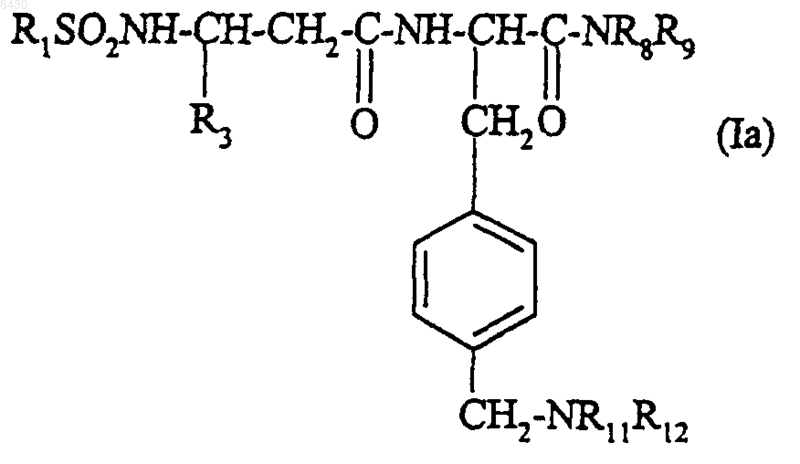
где R1 представляет собой 2,4-дихлор-3-метилфенильную, нафтильную, 6-метоксинафт-2-ильную, 3-метилбензотиофен-2-ильную, 3-метил-5-хлорбензотиофен-2-ильную, 3-метил-5-метоксибензотиофен-2-ильную, 3-метил-6-метоксибензотиофен-2-ильную или 3-метил-1-бензофур-2-ильную группу;
R3 представляет собой бензо[1,3]диоксол-5-ильную или фенильную группу, не замещенную или замещенную галогеном;
R8 и R9 вместе с атомом азота, к которому они присоединены, образуют радикал ди(C1-C4)алкиламино, пирролидинил или пиперидил, не замещенный или замещенный один или два раза метилом или галогеном;
R11 и R12 вместе с атомом азота, к которому они присоединены, образуют радикал этилизобутиламино, этилизопропиламино, этил-трет-бутиламино, диизопропиламино, циклопентилметиламино или циклопентилэтиламино либо радикал пиперидил, не замещенный или замещенный один или более чем один раз метилом или галогеном;
а также его соли с минеральными или органическими кислотами, и/или их сольваты, или их гидраты.
8. Соединение по п.1, выбранное из
(R,R) 2-((3-(1,3-бензодиоксол-5-ил)-3-(((6-метокси-2-нафтил)сульфонил)амино)пропаноил)амино)-3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 2-((3-(1,3-бензодиоксол-5-ил)-3-((2-нафтилсульфонил)амино)пропаноил)амино)-3-(4-((циклопентил(этил)амино)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-2-((3-(((6-метокси-2-нафтил)сульфонил)амино)-3-фенилпропаноил)амино)-N-изопропил-N-метилпропанамида;
(R,R) 2-((3-(1,3-бензодиоксол-5-ил)-3-(((6-метокси-2-нафтил)сульфонил)амино)пропаноил)амино)-3-(4-((трет-бутил(этил)амино)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 2-((3-(1,3-бензодиоксол-5-ил)-3-(((3-метил-1-бензтиофен-2-ил)сульфонил)амино)пропаноил)амино)-3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-2-((3-(((5-метокси-3-метил-1-бензотиофен-2-ил)сульфонил)амино)-3-фенилпропаноил)амино)-N-изопропил-N-метилпропанамида;
(R,R) N-(4-((2,6-цис-диметил-1-пиперидил)метил)бензил)-3-(((6-метокси-2-нафтил)сульфонил)амино)-3-фенил-N-(1-пиперидилкарбонил)пропанамида;
(R,R) 2-((3-(4-хлорфенил)-3-(((6-метокси-2-нафтил)сульфонил)амино)пропаноил)амино)-3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-2-((3-(((6-метокси-2-нафтил)сульфонил)амино)-3-фенилпропаноил)амино)-N,N-диэтилпропанамида;
(R,R) 2-((3-(3-фторфенил)-3-(((6-метокси-2-нафтил)сульфонил)амино)пропаноил)амино)-3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 2-((3-(1,3-бензодиоксол-5-ил)-3-(((3-метил-1-бензофур-2-ил)сульфонил)амино)пропаноил)амино)-3-(4-((2,6-цис-диметил-1-пиперидил)метил)фенил)-N-изопропил-N-метилпропанамида;
(R,R) 2-((3-(1,3-бензодиоксол-5-ил)-3-((2-нафтилсульфонил)амино)пропаноил)амино)-3-(3-((трет-бутил(этил)амино)метил)фенил)-N-изопропил-N-метилпропанамшфр;
(R,R) 3-(4-(7-азабицикло[2.2.1]гепт-7-илметил)фенил)-2-((3-(1,3-бензодиоксол-5-ил)-3-(((6-метоксинафтил)сульфонил)амино)пропаноил)амино)-N-изопропил-N-метилпропанамида;
а также его соли, и/или их сольваты, и/или их гидраты.
9. Способ получения соединения формулы (I) по п.1, его солей, и/или их сольватов, или их гидратов, при котором кислоту или функциональное производное этой кислоты формулы
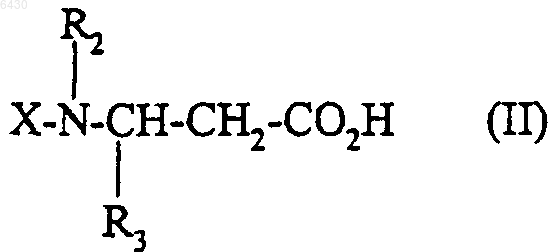
где R2 и R3 такие, как они определены для соединения формулы (I) в п.1, X представляет собой либо водород, либо группу R1SO2-, в которой R1 такой, как он определен для соединения формулы (I) в п.1, либо N-защитную группу, подвергают взаимодействию с соединением формулы
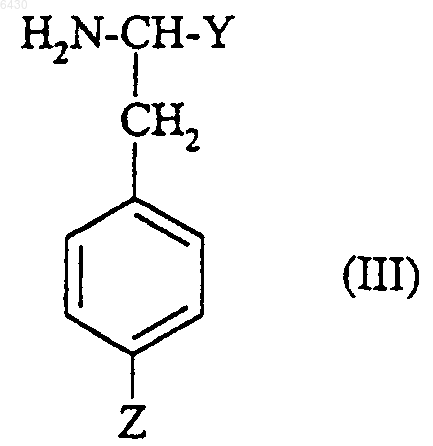
где Y представляет собой R4, как он определен для соединения формулы (I) в п.1, и Z представляет собой R5, как он определен для соединения формулы (I) в п.1, при условии, что когда Y представляет собой фенил, замещенный группой -CH2NR11R12, Z представляет собой группу -CH2NR11R12, при этом R11 и R12 такие, как они определены для соединения формулы (I) в п.1,
с получением соединения формулы
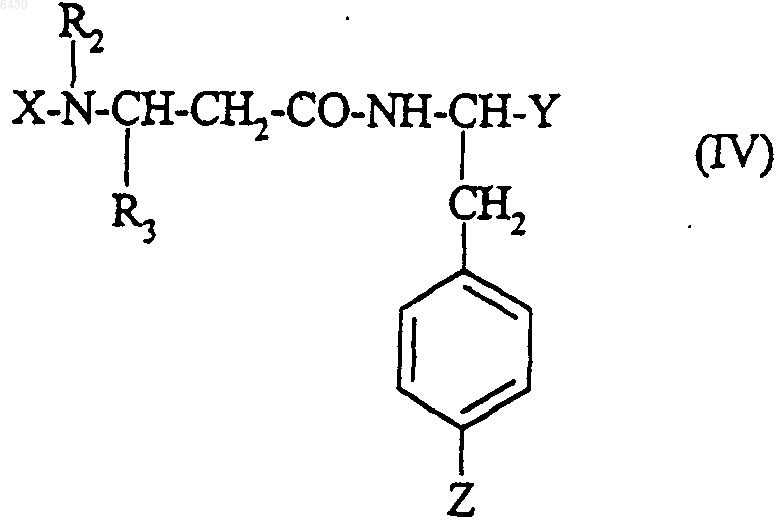
и когда X = H, полученное соединение подвергают взаимодействию с сульфонилгалогенидом формулы
R1SO2-Hal (VI)
где Hal представляет собой галоген;
когда X представляет собой N-защитную группу, эту группу удаляют и полученное соединение подвергают взаимодействию с сульфонилгалогенидом формулы (VI).
10. Способ получения соединения формулы (I) по п.1, его солей, и/или их сольватов, или их гидратов, при котором кислоту или функциональное производное этой кислоты формулы
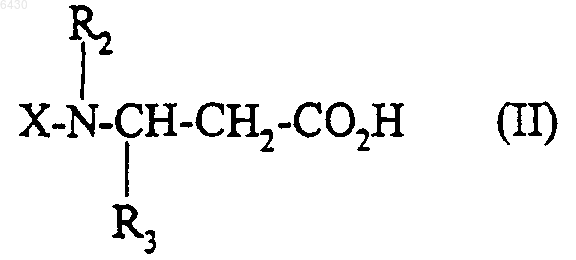
где R2 и R3 такие, как они определены для соединения формулы (I) в п.1, X представляет собой либо водород, либо группу R1SO2-, в которой R1 такой, как он определен для соединения формулы (I) в п.1, либо N-защитную группу, подвергают взаимодействию с соединением формулы
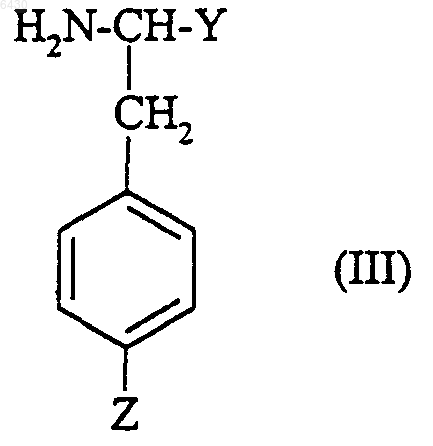
где Y представляет собой (C1-C4)алкоксикарбонил и Z представляет собой R5, как он определен для соединения формулы (I) в п.1, с получением соединения формулы

и это соединение формулы (IV) подвергают обработке согласно следующим стадиям:
когда X = H, его подвергают взаимодействию с сульфонилгалогенидом формулы
R1SO2-Hal (VI)
где Hal представляет собой галоген;
когда X представляет собой N-защитную группу, эту группу удаляют и полученное таким образом соединение подвергают взаимодействию с сульфонилгалогенидом формулы (VI);
(C1-C4)алкоксикарбонил, представляющий Y, подвергают гидролизу и полученную таким образом кислоту или функциональное производное этой кислоты формулы

подвергают взаимодействию с соединением формулы
HNR8R9 (VIII)
где R8 и R9 такие, как они определены для соединения формулы (I) в п.1.
11. Способ получения соединения формулы (I) по п.1, его солей, и/или их сольватов, или их гидратов, при котором кислоту или функциональное производное этой кислоты формулы
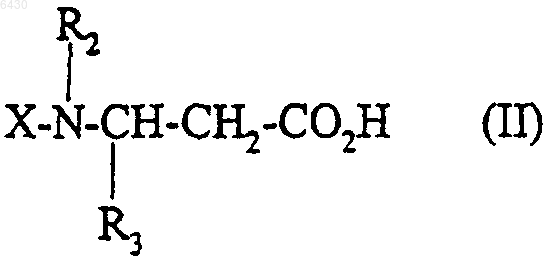
где R2 и R3 такие, как они определены для соединения формулы (I) в п. 1, X представляет собой либо водород, либо группу R1SO2-, в которой R1 такой, как он определен для соединения формулы (I) в п.1, либо N-защитную группу, подвергают взаимодействию с соединением формулы
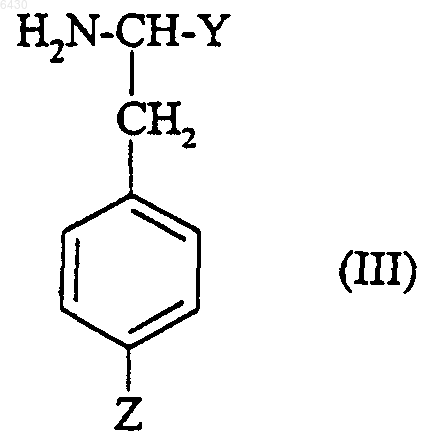
где Y представляет собой R4, как он определен для соединения формулы (I) в п.1, и Z представляет собой группу -CN, при условии, что Y не является фенилом, замещенным группой -CH2NR11R12,
с получением соединения формулы

и это соединение формулы (IV) подвергают обработке согласно следующим стадиям:
когда X = H, его подвергают взаимодействию с сульфонилгалогенидом формулы
R1SO2-Hal (VI)
где Hal представляет собой галоген;
когда X представляет собой N-защитную группу, эту группу удаляют и полученное таким образом соединение подвергают взаимодействию с сульфонилгалогенидом формулы (VI);
группу -CN, представляющую Z, превращают в R5.
12. Способ получения соединения формулы (I) по п.1, его солей, и/или их сольватов, или их гидратов, при котором кислоту или функциональное производное этой кислоты формулы
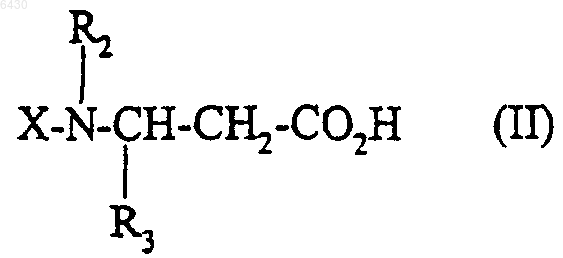
где R2 и R3 такие, как они определены для соединения формулы (I) в п.1, X представляет собой либо водород, либо группу R1SO2-, в которой R1 такой, как он определен для соединения формулы (I) в п.1, либо N-защитную группу, подвергают взаимодействию с соединением формулы
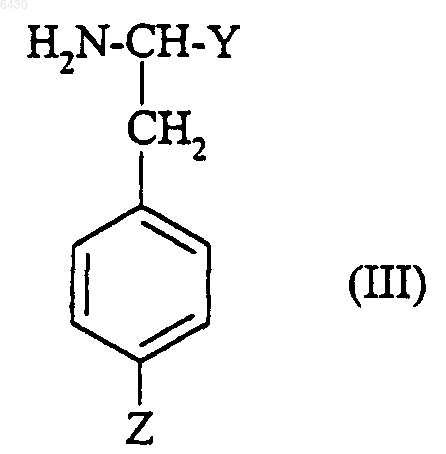
где Y представляет собой (C1-C4)алкоксикарбонил и Z представляет собой группу -CN,
с получением соединения формулы
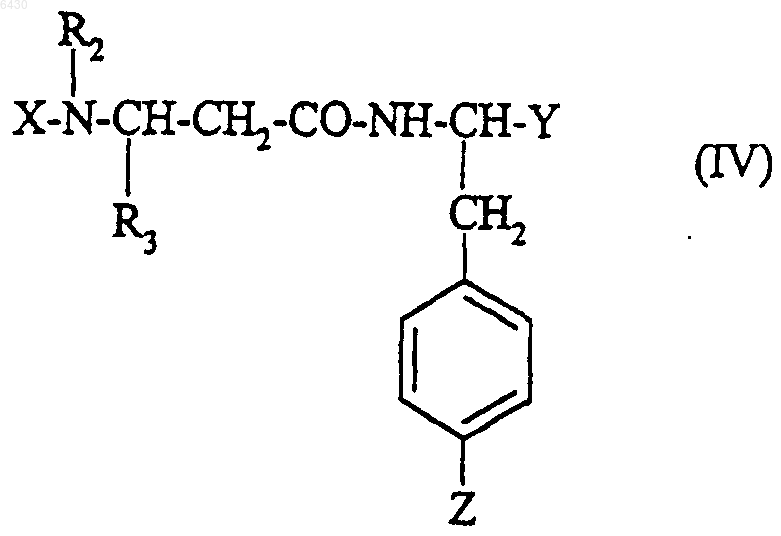
и это соединение формулы (IV) подвергают обработке согласно следующим стадиям:
когда X = H, его подвергают взаимодействию с сульфонилгалогенидом формулы
R1SO2-Hal (VI)
где Hal представляет собой галоген;
когда X представляет собой N-защитную группу, эту группу удаляют и полученное таким образом соединение подвергают взаимодействию с сульфонилгалогенидом формулы (VI);
(C1-C4)алкоксикарбонил, представляющий Y, подвергают гидролизу и полученную таким образом кислоту или функциональное производное этой кислоты формулы
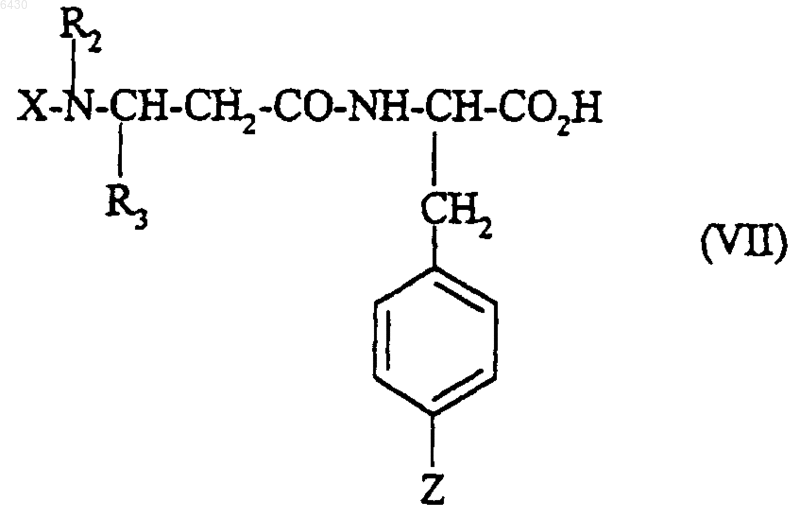
подвергают взаимодействию с соединением формулы
HNR8R9 (VIII)
где R8 и R9 такие, как они определены для соединения формулы (I) в п.1;
группу -CN, представляющую Z, превращают в R5.
13. Соединение формулы
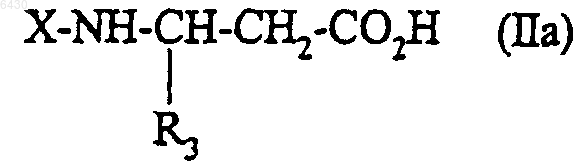
где X представляет собой водород или N-защитную группу;
R3 представляет собой гетероциклический радикал, выбранный из (2,2-дифтор)бензо[1,3]диоксол-5-ила, 3-изопропилфенила, 3-трифторметоксифенила, 2,1,3-бензоксадиазол-5-ила, бензотиофен-5-ила, 1-бензофур-6-ила, 1-бензофур-4-ила, 1-бензофур-3-метил-5-ила, 2,3-дигидробензофур-4-ила;
а также его соли с минеральными или органическими кислотами, в рацемической форме или в форме чистых энантиомеров.
14. Соединение формулы
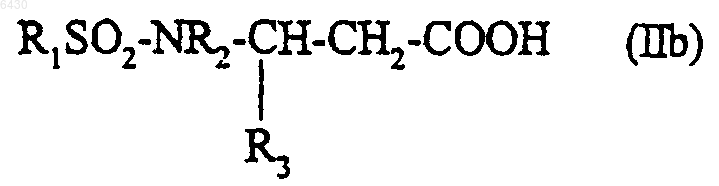
где R1 представляет собой фенилвинил; гетероцикл, выбранный из 1-бензофур-2-ила, 2,1,3-бензоксадиазол-4-ила, 2,1,3-бензотиадиазол-4-ила, 1,3-бензотиазол-2-ила, 1-бензотиофен-2-ила, 1H-пиразол-4-ила, тиен-2-ила, 5-изоксазолтиен-2-ила, бензотиен-2-ила, тиено[3,2-c]пирид-2-ила и нафто[2,3-d][1,3]диоксол-6-ила; причем указанные гетероциклы не замещены или замещены один или более чем один раз группами R6, которые могут быть одинаковыми или разными;
R2 представляет собой водород или (C1-C4)алкил, а R3 представляет собой фенил, который не замещен или замещен один или более чем один раз группами R7, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, который не замещен или замещен по положению 2 двумя атомами фтора; 2,1,3-бензотиадиазол-5-ила; 2,1,3-бензоксадиазол-5-ила; бензотиофен-5-ила; 2,3-дигидробензо[1,4]диоксин-6-ила; 1-бензофур-2-ила; 1-бензофур-5-ила; 1-бензофур-6-ила; 1-бензофур-4-ила; 1-бензофур-3-метил-5-ила; 2,3-дигидробензофур-4-ила; 1,3-тиазол-2-ила; фурила; тиен-2-ила; тиен-3-ила;
или R2 представляет собой фенил, который не замещен или замещен один или более чем один раз группами R6, которые могут быть одинаковыми или разными; бензо[1,3]диоксол-5-ил; пиридил; инданил; и R3 представляет собой водород;
R6 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; 2-фторэтоксигруппу; трифторметокси, метилендиокси или дифторметилендиоксигруппу;
R7 представляет собой атом галогена; (C1-C4)алкильную группу; фенильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; бензилоксигруппу; трифторметоксигруппу;
при условии, что когда R1 представляет собой 2,1,3-бензотиадиазол-4-ил, R3 является отличным от фурила;
а также его соли с минеральными или органическими кислотами в рацемической форме или в форме чистых энантиомеров.
15. Соединение формулы

где R4 представляет собой группу -CONR8R9; группу -CSNR8R9; группу -COR13; фенильную группу, которая не замещена или замещена один или более чем один раз группами R10; гетероциклический радикал, выбранный из пиридила, имидазолила, фурила, бензимидазолила, бензотиазол-2-ила и бензо[1,3]диоксол-5-ила, причем указанные радикалы не замещены или замещены метилом;
R5 представляет собой группу -CH2NR11R12 или -CH2N(O)NR11R12;
R8 и R9, каждый независимо, представляет собой водород; (C1-C4)алкильную группу; (C3-C7)циклоалкильную группу; (C3-C7)циклоалкил(C1-C4)алкильную группу; w-(C1-C4)диалкиламино(C2-C4)алкильную группу;
или альтернативно R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из пирролидинила, пиперидила, морфолин-4-ила, тиоморфолин-4-ила, пиперазин-1-ила, 4-метилпиперазин-1-ила, 4-метилпиперид-1-ила, 2-метилпиперид-1-ила, 4,4-диметилпиперид-1-ила, 4,4-дифторпиперид-1-ила, 4-трифторметилпиперид-1-ила, 4-метоксипиперид-1-ила, 3,4-дигидропиперид-1-ила, азепин-1-ила и циклогексилспиро-4-пиперид-1-ила;
R10 представляет собой атом галогена; (C1-C4)алкильную группу; гидроксигруппу; (C1-C6)алкоксигруппу; R10 также может представлять собой группу -CH2NR11R12, когда R5 представляет собой группу -CH2NR11R12, указанные группы в таком случае являются одинаковыми;
R11 и R12, каждый независимо, представляет собой водород; (C1-C6)алкильную группу; (C2-C4)алкенильную группу; (C3-C7)циклоалкильную группу; (C3-C7)циклоалкил(C1-C4)алкильную группу; w-гидрокси(C2-C4)алкиленовую группу; w-метокси(C2-C4)алкиленовую группу; w-трифторметил-(C2-C4)алкиленовую группу; w-галогено(C2-C4)алкиленовую группу;
или альтернативно R11 и R12 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический гетероциклический радикал, выбранный из азетидинила, пирролидинила, морфолин-4-ила, тиоморфолин-4-ила, пиперид-1-ила, пиперазин-1-ила, 1,2,3,6-тетрагидропирид-1-ила, 2,3,4,5-тетрагидропиридиния, декагидрохинолила, декагидроизохинолила, тетрагидроизохинолила, октагидро-1H-изоиндолила, (C4-C6)циклоалкилспиропиперидила, 3-азабицикло[3.1.0]гексила и 7-азабицикло[2.2.1]гептан-7-ила, не замещенный или замещенный один или более чем один раз атомом галогена либо (C1-C4)алкильной, гидроксильной, (C1-C4)алкокси, трифторметильной или дифторметиленовой группой;
R13 представляет собой фенильную, тиазол-2-ильную или пиридильную группу;
а также его соли с минеральными или органическими кислотами, в рацемической форме или в форме чистых энантиомеров.
16. Фармацевтическая композиция, содержащая в качестве активного начала соединение по одному из пп.1-8 или одну(один) из его фармацевтически приемлемых солей, и/или их сольватов, и/или гидратов.
17. Лекарство, отличающееся тем, что оно состоит из соединения по любому из пп.1-8.
18. Применение соединения по одному из пп.1-8 либо одной(одного) из его фармацевтически приемлемых солей, и/или их гидратов, и/или сольватов для изготовления лекарств, предназначенных для лечения брадикининзависимой патологии.
19. Применение по п.18 для изготовления лекарств, предназначенных для лечения воспалительных патологий и персистирующих или хронических воспалительных заболеваний.
Текст
Настоящее изобретение относится к новым производным N-(арилсульфонил)-аминокислот, содержащим замещенную аминометильную группу, к их получению и содержащим их фармацевтическим композициям. Эти композиции обладают аффинитетом к брадикининовым рецепторам (ВК). Брадикинин представляет собой нонапептид, принадлежащий, как и каллидин, к кининовому классу, и демонстрирует физиологическую активность в сердечно-сосудистой области и в качестве медиатора при воспалении и боли. Охарактеризованы некоторые брадикининовые рецепторы B1 и B2 рецепторы (D. Regoli et. al.,Pharmacol. Rev., 1980, 32, 1-46). Более конкретно, B2 рецепторы являются рецепторами для брадикинина и каллидина: они широко распространены и обнаруживаются, как правило, в большинстве тканей; В 1 рецепторы являются рецепторами, специфичными для [des-Arg9]брадикинина и [des-Arg10]каллидина: они индуцируются во время воспалительных процессов. Клонированы брадикининовые рецепторы различных видов, в частности человеческие рецепторы:B1 рецептор (J.G. Menke et al., J. Biol. Chem., 1994, 269 (34), 21583-21586); B2 рецептор (J.F. Hess, Biochem. Biophys. Res. Commun., 1992, 184, 260-268). В заявке на патент WO 97/25315 описаны соединения формулы где RI, RII, RIII, RIV, RV, RVI, RVII, RVIII, RIX, RX и RXI имеют различные значения. Эти соединения демонстрируют аффинитет к брадикининовым рецепторам. В настоящее время обнаружены новые соединения, которые демонстрируют аффинитет к брадикининовым рецепторам с селективностью в отношении B1 брадикининовых рецепторов, которые являются антагонистами B1 брадикининовых рецепторов и которые демонстрируют преимущества в их абсорбции. Эти соединения могут быть использованы для приготовления лекарств, которые полезны для лечения и предупреждения любой патологии, в которую вовлечены брадикинин и B1 рецепторы, в особенности воспалительных патологий и персистирующих или хронических воспалительных заболеваний. Таким образом, согласно одному из его аспектов объектом настоящего изобретения являются соединения формулы где R1 представляет собой фенилвинильную группу; фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; нафтильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; тетрагидронафтильную группу; нафто[2,3-d][1,3]диоксол-6 ильную группу; гетероциклический радикал, выбранный из хинолила, изохинолила, 1-бензофур-2-ила,2,1,3-бензоксадиазол-4-ила, 2,1,3-бензотиадиазол-4-ила, 1,3-бензотиазол-2-ила, 1-бензотиофен-2-ила, 1 Нпиразол-4-ила, тиен-2-ила, 5-изоксазолтиен-2-ила, бензотиен-2-ила, тиено[3,2-с]пирид-2-ила; причем указанные гетероциклические радикалы не замещены или замещены один или более чем один раз группами R6, которые могут быть одинаковыми или разными;R2 представляет собой водород или (С 1-С 4)алкильную группу иR3 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R7, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, 2,1,3-бензотиадиазол-5-ила, 2,1,3-бензоксадиазол-6-ила, бензотиофен-5-ила, 2,3-дигидробензо[1,4]диоксин-6-ила, бензофурила, дигидробензофурила, 1,3-тиазол-2-ила,фурила и тиенила, причем указанный гетероциклический радикал не замещен или замещен один или более чем один раз атомом галогена или (С 1-С 4)алкильной группой; или альтернативно R2 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, пиридила и инданила, и R3 представляет собой водород;R4 представляет собой группу -CONR8R9; группу -CSNR8R9; группу -COR13; фенильную группу, которая не замещена или замещена один или более чем один раз группами R10; гетероциклический радикал,выбранный из пиридила, имидазолила, фурила, бензимидазолила, бензотиазол-2-ила и бензо[1,3]диоксол-5-ила, причем указанные радикалы не замещены или замещены одной или более чем одной метильной группой или одним или более чем одним атомом галогена;R5 представляет собой группу -СН 2NR11R12 или -CH2N(O)NR11R12;R6 представляет собой атом галогена; (С 1-С 4)алкильную группу; трифторметильную группу; (С 1 С 4)алкоксигруппу; 2-фторэтоксигруппу; трифторметокси, метилендиокси или дифторметилендиоксигруппу;R7 представляет собой атом галогена; (С 1-C4)алкильную группу; фенильную группу; трифторметильную группу; (С 1-C4)алкоксигруппу; бензилоксигруппу; трифторметоксигруппу;R8 и R9, каждый независимо, представляет собой водород; (С 1-C4)алкильную группу; (С 3 С 7)циклоалкильную группу; (С 3-С 7)циклоалкил(С 1-C4)алкильную группу; -(С 1-C4)диалкиламино(C2C4)алкильную группу; или альтернативно R8 и R9 вместе с атомом азота, к которому они присоединены, образуют гетероциклический радикал, выбранный из пирролидинила, морфолин-4-ила, тиоморфолин-4-ила, азепин-1 ила, пиперидила, не замещенного или замещенного одним или более чем одним атомом галогена либо одной или более чем одной (С 1-C4)алкильной, или (С 1-C4)алкокси, или трифторметильной группой, 3,4 дигидропиперид-1-ила, циклогексилспиро-4-пиперид-1-ила и пиперазинила, не замещенного или замещенного одной или более чем одной (С 1-C4)алкильной группой;R10 представляет собой атом галогена; (С 1-C4)алкильную группу; гидроксигруппу; (С 1 С 6)алкоксигруппу; R10 также может представлять собой группу -CH2NR11R12, когда R5 представляет собой группу -CH2NR11R12, указанные группы в таком случае являются одинаковыми;R11 и R12, каждый независимо, представляет собой водород; (С 1-С 6)алкильную группу; (C2C4)алкенильную группу; (С 3-С 7)циклоалкильную группу; (С 3-С 7)циклоалкил(С 1-C4)алкильную группу; гидрокси(C2-C4)алкиленовую группу; -метокси(C2-C4)алкиленовую группу; -трифторметил-(C2-C4) алкиленовую группу; -галогено(C2-C4)алкиленовую группу; или альтернативно R11 и R12 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический гетероциклический радикал, выбранный из азетидинила, пирролидинила, морфолин-4-ила, тиоморфолин-4-ила, пиперид-1-ила, пиперазин-1-ила, 1,2,3,6-тетрагидропирид-1 ила, 2,3,4,5-тетрагидропиридиния, декагидрохинолила, декагидроизохинолила, тетрагидроизохинолила,октагидро-1 Н-изоиндолила, (C4-С 6)циклоалкилспиропиперидила, 3-азабицикло[3.1.0]гексила и 7-азабицикло[2.2.1]гептан-7-ила, не замещенного или замещенного один или более чем один раз атомом галогена либо (С 1-C4)алкильной, гидроксильной, (С 1-C4)алкокси, трифторметильной, дифторметиленовой или фенильной группой;R13 представляет собой фенильную, тиазол-2-ильную или пиридильную группу; а также их соли с минеральными или органическими кислотами, и/или их сольваты, или их гидраты. Термин галоген означает атом фтора, хлора, брома или иода. Термины алкил, алкилен и алкокси, соответственно, означают линейный или разветвленный алкильный радикал, линейный или разветвленный алкиленовый радикал либо линейный или разветвленный алкокси радикал. Соединения формулы (I) содержат по меньшей мере один асимметричный атом углерода, и чистые энантиомеры или диастереомеры, а также их смеси в любых пропорциях являются объектами данного изобретения. Объектом настоящего изобретения предпочтительно являются соединения формулы где R1 представляет собой фенилвинильную группу; фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; нафтильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; тетрагидронафтильную группу; гетероциклический радикал, выбранный из хинолила, 1-бензофур-2-ила, 2,1,3-бензоксадиазол-4-ила, 2,1,3-бензотиадиазол-4-ила, 1,3-2 006430 бензотиазол-2-ила, 1-бензтиофен-2-ила, 1H-пиразол-4-ила, тиен-2-ила, 5-изоксазолтиен-2-ила, бензотиен 2-ила, тиено[3,2-с]пирид-2-ила; нафто[2,3-d][1,3]диоксол-6-ила; причем указанные гетероциклические радикалы не замещены или замещены один или более чем один раз группами R6, которые могут быть одинаковыми или разными;R2 представляет собой водород или (C1-C4)алкильную группу иR3 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R7, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, который не замещен или замещен по положению 2 двумя атомами фтора; 2,1,3-бензотиадиазол-5-ила; 2,3-дигидробензо[1,4]диоксин-6-ила; 1,3-тиазол-2-ила; 1-бензофур-2 ила; 1-бензофур-5-ила; фурила; тиен-2-ила; тиен-3-ила; или R2 представляет собой фенильную группу, которая не замещена или замещена один или более чем один раз группами R6, которые могут быть одинаковыми или разными; гетероциклический радикал,выбранный из бензо[1,3]диоксол-5-ила; пиридила; инданила; и R3 представляет собой водород;R4 представляет собой группу -CONR8R9; фенильную группу, которая не замещена или замещена один или более чем один раз группами R10; гетероциклический радикал, выбранный из пиридила, имидазолила, фурила, бензимидазолила, бензотиазол-2-ила и бензо[1,3]диоксол-5-ила, причем указанные радикалы не замещены или замещены метилом;R5 представляет собой группу -CH2NR11R12;R6 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1C4)алкоксигруппу; 2-фторэтоксигруппу; трифторметокси, метилендиокси или дифторметилендиоксигруппу;R7 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1C4)алкоксигруппу; бензилоксигруппу; трифторметокси группу;R10 представляет собой атом галогена; (C1-C4)алкильную группу; гидроксильную группу; (C1 С 6)алкоксигруппу; R10 также может представлять собой группу -CH2NR11R12, когда R5 представляет собой группу -CH2NR11R12, указанные группы в таком случае являются одинаковыми;R11 и R12, каждый независимо, представляет собой водород; (C1-С 6)алкильную группу; (С 2C4)алкенильную группу; (С 3-С 7)циклоалкильную группу; (С 3-С 7)циклоалкил(C1-C4)алкильную группу; гидрокси(C2-C4)алкиленовую группу; -метокси(C2-C4)алкиленовую группу; -трифторметил-(C2C4)алкиленовую группу; -галогено(C2-C4)алкиленовую группу; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический гетероциклический радикал, выбранный из азетидинила, пирролидинила, морфолин-4 ила, тиоморфолин-4-ила, пиперид-1-ила, пиперазин-1-ила, 1,2,3,6-тетрагидропирид-1-ила, декагидрохинолила, декагидроизохинолила, октагидро-1 Н-изоиндолила, (C4-С 6)циклоалкилспиропиперидила и 3 азабицикло[3.1.0]гексила, не замещенного или замещенного один или более чем один раз атомом галогена либо (C1-C4)алкильной, гидроксильной, (С 1-C4)алкокси, трифторметильной, дифторметиленовой или фенильной группой; а также их соли с минеральными или органическими кислотами, и/или их сольваты, или их гидраты. Более того, некоторые значения заместителей являются предпочтительными. Таким образом, соединения формулы (I), которые являются предпочтительными, представляют собой соединения, в которых по меньшей мере один из заместителей имеет значение, определенное нижеR5 такие, как они определены для соединения формулы (I); б) R2 представляет собой водород, и предпочтительно R3 представляет собой бензо[1,3]диоксол-5 ильную или фенильную группу, которая не замещена или замещена галогеном; R1, R4 и R5 такие, как они определены для соединения формулы (I); в) R4 представляет собой группу -CONR8R9, и предпочтительно -NR8R9 представляет собой ди(C1C4)алкиламинорадикал, более конкретно N-метилизопропильный радикал; пирролидинильную или пиперидильную группу, которая не замещена или замещена один или два раза метилом или галогеном;R1, R2, R3 и R5 такие, как они определены для соединения формулы (I);-3 006430 г) R5 представляет собой группу -CH2NR11R12, в которой -NR11R12 представляет собой радикал этилизобутиламино, этилизопропиламино, этил-трет-бутиламино, диизопропиламино, циклопентилметиламино или циклопентилэтиламино либо радикал пиперидил, не замещенный или замещенный один или более чем один раз метилом или галогеном; R1, R2, R3 и R4 такие, как они определены для соединения формулы (I). Таким образом, настоящее изобретение относится к соединениям формулыR3 представляет собой бензо[1,3]диоксол-5-ильную или фенильную группу, которая не замещена или замещена галогеном;R8 и R9 вместе с атомом азота, к которому они присоединены, образуют радикал ди(С 1C4)алкиламино, пирролидинил или пиперидил, не замещенный или замещенный один или два раза метилом или галогеном;R11 и R12 вместе с атомом азота, к которому они присоединены, образуют радикал этилизобутиламино, этилизопропиламино, этил-трет-бутиламино, диизопропиламино, циклопентилметиламино или циклопентилэтиламино либо радикал пиперидил, не замещенный или замещенный один или более чем один раз метилом или галогеном; а также их соли с минеральными или органическими кислотами, и/или их сольваты, или их гидраты. В частности, особенно предпочтительны соединения формулы (Ia), имеющие (R,R)-конфигурацию. Более конкретно, объектом настоящего изобретения является соединение, выбранное из(R,R) 3-(4-(7-азабицикло[2.2.1]гепт-7-илметил)фенил)-2-3-(1,3-бензодиоксол-5-ил)-3-6-метоксинафтил)сульфонил)амино)пропаноил)амино)-N-изопропил-N-метилпропанамида; а также его соли с минеральными или органическими кислотами, и/или их сольваты, или их гидраты. Согласно еще одному из его аспектов настоящее изобретение относится к способу получения соединений формулы (I), их солей, и/или их сольватов, либо их гидратов, при котором кислоту или функциональное производное этой кислоты формулы где R2 и R3 такие, как они определены для соединения формулы (I), X представляет собой либо водород,либо группу R1-SO2-, в которой R1 такой, как он определен для соединения формулы (I), либо Nзащитную группу, подвергают взаимодействию с соединением формулы где Y представляет собой либо R4, как он определен для соединения формулы (I), либо (С 1C4)алкоксикарбонил, и Z представляет собой либо R5, как он определен для соединения формулы (I), либо группу -CN, при условии, что когда Y представляет собой R4, который представляет собой фенил, замещенный группой -CH2NR11R12, Z представляет собой R5, который представляет собой группу-CH2NR11R12, при этом R11 и R12 такие, как они определены для соединения формулы (I); и когда Х = R1SO2-, Y = R4 и Z = R5, получают ожидаемое соединение формулы (I); либо когда ХR1SO2-, и/или YR4, и/или ZR5, то есть когда по меньшей мере одна из групп X,Y и Z представляет собой, соответственно, Х = Н или N-защитная группа, Y = (C1-C4)алкоксикарбонил, Z =-CN, полученное таким образом соединение формулы подвергают обработке согласно одной или более чем одной из следующих стадий: когда Х представляет собой N-защитную группу, эту группу удаляют и полученное таким образом соединение формулы(VI) где Hal представляет собой галоген; когда Y представляет собой (C1-C4)алкоксикарбонил, его подвергают гидролизу и полученную таким образом кислоту или функциональное производное этой кислоты формулы(VIII) где R8 и R9 такие, как они определены для соединения формулы (I);-5 006430 когда Z представляет собой группу -CN, эту группу превращают в R5. Возможно, полученное таким образом соединение превращают в одну из его солей с минеральными или органическими кислотами. В ходе любой из стадий способа получения соединений формулы (I) или их промежуточных соединений формулы (II), (III), (IV), (V) или (VII) может оказаться необходимым и/или желательным защитить реакционноспособные или чувствительные функциональные группы, такие как амин, гидроксильные или карбоксильные группы, присутствующие на любой из описанных молекул. Такое введение защиты может быть выполнено с использованием традиционных защитных групп, таких как описанные в ProtectiveGroups in Organic Chemistry, J.F.W. McOmie, Ed. Plenum Press, 1973 и в Protective Groups in Organic Synthesis, T.W. Greene and P.G.M. Wutts, published by John Wiley and Sons, 1991. Удаление защитных групп может быть выполнено на подходящей последующей стадии с использованием способов, известных специалистам в данной области техники, которые не затрагивают остальной части описываемой молекулы. Возможно используемые N-защитные группы представляют собой стандартные N-защитные группы, которые хорошо известны специалистам в данной области техники, такие как, например, третбутоксикарбонильная, флуоренилметоксикарбонильная, бензильная, тритильная или бензилоксикарбонильная группа. Соединения формулы (I) или соединения формулы (IV) могут быть получены в форме смеси изомеров или в оптически чистой форме. Для получения оптически чистых соединений можно либо разделить изомеры с помощью известных в органической химии методов, либо использовать в качестве исходных материалов оптически чистые соединения формул (II) и (III) и затем осуществлять, где целесообразно,нерацемизирующие методы синтеза, которые по существу известны. На стадии (а) способа соединения формулы (I) или соединения формулы (IV) получают с использованием стандартных методов пептидной химии, например описанных в The Peptide Ed. E. Gross and J.Meienhofer, Academic Press, 1979, 1, 65-104. Известные методы делают возможным осуществление сочетания пептидов без рацемизации углеродных атомов каждой составляющей аминокислоты; кроме того,известно, что -замещенные -аланины, для которых хиральный углерод не является соседним с карбоксильной группой, не подвержены рацемизации (Ann. Rev. Biochem., 1986, 55, 855-878). Более того, в заявке на патент ЕР 236 163 описываются способы, сохраняющие хиральность каждой аминокислоты. Таким образом, на стадии (а) способа по данному изобретению функциональное производное кислоты (II), которое может быть использовано, представляет собой функциональное производное, которое взаимодействует с аминами, такое как ангидрид, смешанный ангидрид, хлорангидрид или активированный сложный эфир, такой как 2,5-диоксопирролидин-1-иловый эфир, п-нитрофениловый эфир или бензотриазол-1-иловый эфир. Когда используют 2,5-диоксопирролидин-1-иловый эфир кислоты (II), взаимодействие с амином(III) осуществляют в растворителе, таком как N,N-диметилформамид, в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, при температуре между 0 С и комнатной температурой. Когда используют хлорангидрид, взаимодействие осуществляют в растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, N-метилморфолин или N,Nдиизопропилэтиламин, при температуре между -60 С и комнатной температурой. Когда используют смешанный ангидрид кислоты (II), то этот ангидрид получают in situ путем взаимодействия (C1-C4)алкилхлорформиата с кислотой формулы (II) в растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, при температуре между -70 и 50 С, и его подвергают взаимодействию с амином формулы (III) в растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, при температуре между 0 С и комнатной температурой. Когда используют саму кислоту формулы (II), способ осуществляют в присутствии агента сочетания, используемого в пептидной химии, такого как 1,3-дициклогексилкарбодиимид или бензотриазол-1 илокситрис(диметиламино)фосфония гексафторфосфат либо бензотриазол-1-ил-N,N,N',N'-тетраметилурония тетрафторборат, в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-этилморфолин, в растворителе, таком как дихлорметан, ацетонитрил или N,N-диметилформамид,либо в смеси этих растворителей, при температуре между 0 С и комнатной температурой. Таким образом получают либо непосредственно соединение формулы (I), либо соединение формулы (IV), в котором по меньшей мере одна из групп X, Y и Z представляет собой, соответственно Х = Nзащитная группа, Y = (C1-C4)алкоксикарбонил, Z = -CN, и которое превращают с помощью одной или более чем одной реакции с использованием стандартных способов, хорошо известных специалистам в данной области техники, в соединение формулы (I). Очевидно, что если для превращения соединения формулы (IV) в соединение формулы (I) требуется несколько реакций, то последовательность этих реакций определяется таким образом, чтобы не воздействовать на другие заместители описываемой молекулы. Если в соединении формулы (IV) Х представляет собой N-защитную группу, то эту группу удаляют в соответствии со способами, хорошо известными специалистам в данной области техники. Например,если Х представляет собой трет-бутоксикарбонильную группу, то ее удаляют действием кислоты, такой как соляная кислота или трифторуксусная кислота, например, в растворителе, таком как метанол, этило-6 006430 вый эфир, диоксан, тетрагидрофуран или дихлорметан, при температуре между 0 С и комнатной температурой. Затем полученный таким образом амин формулы (V) подвергают взаимодействию с сульфонилгалогенидом формулы (VI) (предпочтительно хлоридом) в присутствии основания, такого как гидроксид щелочного металла (например, гидроксид натрия или гидроксид калия) или органическое основание (например, триэтиламин, диизопропилэтиламин или N-метилморфолин), в растворителе, таком как диоксан,дихлорметан или ацетонитрил, в присутствии или в отсутствие активатора, такого как диметиламинопиридин (DMAP); взаимодействие также может быть осуществлено в пиридине в присутствии или в отсутствие DMAP. Взаимодействие осуществляют при температуре между 0 С и комнатной температурой. Получают либо соединение формулы (I), либо соединение формулы (IV), в котором Х = R1SO2-. Если в соединении формулы (IV) Y представляет собой (С 1-C4)алкоксикарбонил, то его гидролизуют в кислой или щелочной среде в соответствии со способами, известными специалистам в данной области техники. Затем полученную таким образом кислоту формулы (VII) подвергают взаимодействию с соединением формулы (VIII) в условиях, описанных ранее для использования соединения формулы (II). Получают либо соединение формулы (I), либо соединение формулы (IV), в котором R4 = -CONR8R9. Если в соединении формулы (IV) Z представляет собой цианогруппу, то эту группу превращают в группу R5 в соответствии со стандартными способами, которые хорошо известны специалистам в данной области техники. Например, восстановление группы -CN дает либо соединение формулы (I), либо соединение формулы (IV), где R5 = -CH2NH2. Это восстановление может быть осуществлено с использованием водорода в присутствии катализатора, такого как никель Raney, в растворителе, таком как метанол, толуол, диоксан, или смеси этих растворителей, смешанном с водным аммиаком, при температуре между комнатной температурой и 50 С. Группа -CN может быть превращена в группу R5 = -CH2NR11R12 согласно представленной ниже схеме 1. Схема 1 На стадии a1 схемы 1 восстановление нитрильного производного формулы (IV) до альдегида формулы (IX) осуществляют в соответствии со способами, известными специалистам в данной области техники, такими как, например, способ, описанный в Synth. Commun., 1990, 20(3), 459-467. Способ, описанный в Farmaco, Ed. Sci., 1988, 43(7/8), 597-612, также может быть использован при условии, что в соединении формулы (IV) Х не является N-защитной группой, которая лабильна в кислой среде. Затем, на стадии b1 соединение формулы (X) приводят во взаимодействие с альдегидом формулы(IX) в присутствии или в отсутствие кислоты, такой как уксусная кислота, в растворителе, таком как метанол, дихлорметан или 1,2-дихлорэтан, с образованием in situ промежуточного имина, который восстанавливают химически, используя, например, цианоборгидрид натрия, триацетоксиборгидрид натрия или боргидрид натрия. Кроме того, группа -CN может быть превращена в группу R5 согласно представленной ниже схеме 2. На стадии а 2 схемы 2 цианогруппу восстанавливают в соответствии со способами, описанными ранее. Затем, на стадии b2 полученный таким образом амин превращают в спирт формулы (XI) в соответствии со способами, известными специалистам в данной области техники, например, под действием нитрита натрия в водной среде, в растворителе, таком как диоксан, и при температуре между комнатной температурой и 110 С. На стадии с 2 спирт формулы (XI) обрабатывают метансульфонилхлоридом в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан, и при температуре между 0 С и температурой дефлегмации растворителя. Таким образом, получают соединение формулы (XII), в котором W = Cl или O-SO2 СН 3 в зависимости от используемых реакционных условий. На стадии d2, если используют соединение формулы (XII), в котором W = Cl, осуществляют взаимодействие с соединением формулы (X) в присутствии основания, такого как гидрид натрия, в растворителе, таком как тетрагидрофуран, N,N-диметилформамид, ацетонитрил, толуол или 2-пропанол, и при температуре между комнатной температурой и 100 С. Если используют соединение формулы (XII), в котором W = О-SO2 СН 3, то осуществляют взаимодействие с соединением формулы (X) в присутствии или в отсутствие основания, такого как триэтиламин, в растворителе, таком как этанол, N,N-диметилформамид, ацетонитрил или дихлорметан, и при температуре между 0 С и 100 С. На стадии е 2 сложный эфир восстанавливают с помощью восстанавливающего агента, такого какNaBH4 или LiAlH4. Соединение по изобретению формулы (I), в котором R5 представляет собой группу -CH2-N(O)R11R12, получают из аналогичного соединения формулы (I), в котором R5 представляет собой группу-CH2-NR11R12, а другие заместители являются идентичными, и взаимодействие осуществляют под действием окисляющего агента, такого как мета-хлорпербензойная кислота. Окончательно получают соединения формулы (I) по изобретению. Полученные таким образом соединения формулы (I) выделяют в форме свободного основания или в форме соли в соответствии со стандартными методиками. Если соединения формулы (I) получают в форме свободного основания, то образование соли осуществляют путем обработки выбранной кислотой в органическом растворителе. Обработка свободного-8 006430 основания, растворенного, например, в простом эфире, таком как диэтиловый эфир, или в спирте, таком как 2-пропанол либо метанол, или в ацетоне, или в дихлорметане, или в этилацетате, или в ацетонитриле,раствором выбранной кислоты в одном из вышеупомянутых растворителей дает соответствующую соль,которую выделяют в соответствии со стандартными методиками. Таким образом, например, получают гидрохлорид, гидробромид, сульфат, гидросульфат, дигидрофосфат, метансульфонат, оксалат, малеат, сукцинат, фумарат, 2-нафталинсульфонат, бензолсульфонат или паратолуолсульфонат. По окончании реакции соединения формулы (I) могут быть выделены в форме одной из своих солей, например хлоргидрида; в этом случае, при необходимости, свободное основание может быть получено путем нейтрализации указанной соли минеральным или органическим основанием, таким как гидроксид натрия или триэтиламин, либо карбонатом или бикарбонатом щелочного металла, таким как карбонат или бикарбонат натрия либо калия. Соединения формулы (VI) известны или их получают в соответствии с известными способами. Например, 2,4-дихлор-3-метилбензолсульфонилхлорид получают в соответствии со способом, описанным вJ. Am. Chem. Soc., 1940, 62, 511-512. 2-Хинолинсульфонилхлорид и 5,6,7,8-тетрагидронафталин-2 сульфонилхлорид получают в соответствии со способом, описанным в WO 97/25315. 6-Метоксинафталин-2-сульфонилхлорид получают в соответствии с J. Оrg. Chem., 1992, 57, 2631-2641. 3-Метилбензотиенил-2-сульфонилхлорид получают в соответствии с J. Het. Chem., 1988, 25, 639-641. Соединения формулы (VIII) известны или их получают в соответствии с известными способами. Соединения формулы (X) известны или их получают в соответствии с известными способами. Соединения формулы (II), в которых R2 представляет собой водород или (C1-C4)алкил, в рацемической форме или в форме чистых энантиомеров известны (табл. I) или их получают в соответствии с известными способами, такими как описанные в WO 97/25315. Таблица I Соединения формулы (II), в которых R3 представляет собой водород, могут быть получены с помощью известных способов. Возможно, например, использовать способ, описанный ниже на схеме 3, где R'- 10006430 представляет собой (С 1-C4)алкил, и Рr представляет собой N-защитную группу, например третбутоксикарбонильную или флуоренилметоксикарбонильную группу. Схема 3 На стадии а 3 схемы 3 соединение формулы (XIII) подвергают взаимодействию с эфиром акриловой кислоты формулы (XIV), что дает соединение формулы (XV). Взаимодействие осуществляют в присутствии кислоты, такой как уксусная кислота, и при температуре дефлегмации реакционной смеси. На стадии b3 соединение (XV) подвергают взаимодействию с сульфонилгалогенидом формулы (VI) в присутствии основания, такого как гидроксид натрия, гидроксид калия или 4-диметиламинопиридин, в растворителе, таком как диоксан или пиридин, и при температуре между комнатной температурой и 60 С. На стадии с 3 полученный таким образом сложный эфир формулы (XVI) гидролизуют в соответствии со способами, известными специалистам в данной области техники, что дает ожидаемое соединение формулы (II), в котором Х = R1SO2-. Альтернативно, на стадии d3 аминоэфир формулы (XV) защищают в соответствии со способами,известными специалистам в данной области техники, например, с помощью трет-бутоксикарбонильной или флуоренилметоксикарбонильной группы. На стадии е 3 полученный таким образом сложный эфир формулы (XVII) гидролизуют в соответствии с известными способами, что дает соединение формулы (II), в котором Х представляет собой защитную группу. Альтернативно, согласно стадии f3 сложный эфир формулы (XV) гидролизуют в кислой или щелочной среде, что дает соединение формулы (II). Соединения формулы (III), в которых Y представляет собой (С 1-C4)алкоксикарбонил или группуR4 = CONR8R9, и Z = -CN, известны или их получают в соответствии с известными способами, такими как описанные в WO 97/25315, ЕР 0614911 или ЕР 0236164. Другие соединения формулы (III), в которых Y представляет собой R4, и Z = -CN, получают в соответствии с представленной ниже схемой 4. Схема 4- 11006430 На стадии а 4 схемы 4 бензофенонимин подвергают взаимодействию с амином формулы (XVIII), что дает соединение формулы (XIX). Взаимодействие осуществляют в растворителе, таком как дихлорметан,хлороформ или этилацетат, при температуре между комнатной температурой и 50 С и в присутствии или в отсутствие основания, такого как триэтиламин. На стадии b4 соединение формулы (XIX) обрабатывают сильным основанием, таким как бутиллитий, трет-бутилат калия или диизопропиламид лития, что дает карбанион, который подвергают взаимодействию с 4-(бромметил)бензонитрилом. Взаимодействие осуществляют в растворителе, таком как тетрагидрофуран, при температуре между и -78 С и комнатной температурой. Путем обработки в кислой среде удаляют бензгидрилиденовую Nзащитную группу, что дает ожидаемое соединение формулы (III). Кроме того, соединения формулы (XIX) могут быть получены в соответствии со способами, описанными в Bull. Soc. Chim. Fr., 1973, 2985, 2987, 2988; J. Am. Chem. Soc., 1982, 104 (3), 730 или Tetrahedron Lett., 1996, 1137. Соединения формулы (XVIII) известны или их получают в соответствии с известными способами. Например, соединения формулы (XVIII) могут быть получены в соответствии с представленной ниже схемой 5. Схема 5 На стадии а 5 схемы 5 соединение формулы (XX) подвергают взаимодействию с азидом натрия, что дает соединение формулы (XXI). Взаимодействие осуществляют в растворителе, таком как диметилсульфоксид, при температуре между 0 С и комнатной температурой. На стадии b5 соединение формулы (XXI) восстанавливают до соединения формулы (XVIII) в соответствии со способами, известными специалистам в данной области техники. Кроме того, соединения формулы (XVIII) могут быть получены в результате восстановления нитрила формулы R4CN, например, под действием LiAlH4. Соединения формулы (III), в которых Y представляет собой (C1-C4)алкоксикарбонил и Z представляет собой R5, как определено для соединения формулы (I), получают в соответствии с представленной ниже схемой 6, где R' представляет собой (С 1-C4)алкил. Схема 6 На стадии а 6 схемы 6 соединение формулы (XXII) подвергают взаимодействию с a,a'-дибром-пксилолом (XXIII) в соответствии со способом, описанным в Tetrahedron Asymmetry, 1992, 3 (5), 637-650. На стадии b6 полученное таким образом соединение формулы (XXIV) подвергают взаимодействию с соединением формулы (X), что дает соединение формулы (XXV). Взаимодействие осуществляют в присутствии основания, такого как карбонат или бикарбонат щелочного металла (карбонат калия, карбонат натрия или бикарбонат натрия), в растворителе, таком как N,N-диметилформамид, ацетонитрил, дихлорметан или толуол, и при температуре между комнатной температурой и 100 С.- 12006430 На стадии с 6 N-защитную группу удаляют под действием кислоты, такой как, например, соляная кислота. Кроме того, соединения формулы (III), в которых Y представляет собой R4 = CONR8R9, получают в соответствии с представленной ниже схемой 7, где R' представляет собой (С 1-C4)алкил. Схема 7 На стадии а 7 амин соединения формулы (III) защищают с помощью трет-бутоксикарбонильной группы и полученный таким образом сложный эфир затем гидролизуют в соответствии со стандартными способами (стадия b7); полученную таким образом кислоту формулы (XXVII) далее подвергают взаимодействию с соединением формулы (VIII) в соответствии со способами, описанными ранее (стадия с 7), и с полученного соединения формулы (XXVIII) снимают защиту в кислой среде (стадия d7). Соединения формулы (III), в которых Y представляет собой R4 и Z представляет собой R5, как определено для соединения формулы (I), получают в соответствии с представленной ниже схемой 8. На стадии а 8 схемы 8 соединение формулы (XIX) подвергают взаимодействию с метил-4(бромметил)бензоатом в присутствии основания, такого как трет-бутилат калия или диизопропиламид лития, в растворителе, таком как тетрагидрофуран, при температуре между -78 С и комнатной температурой. Путем обработки в кислой среде удаляют бензгидрилиденовую защитную группу. На стадии b8 амин формулы (XXIX) защищают посредством взаимодействия с ди-третбутилдикарбонатом. На стадии с 8 полученный таким образом сложный эфир формулы (XXX) восстанавливают до спирта формулы (XXXI). Восстановление осуществляют в присутствии восстанавливающего агента, такого как алюмогидрид лития, боргидрид натрия или диизобутилалюминийгидрид, в растворителе, таком как тетрагидрофуран или толуол, и при температуре между -78 С и комнатной температурой. Спирт формулы (XXXI) подвергают взаимодействию на стадии d8 с метансульфонилхлоридом в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан или тетрагидрофуран, и при температуре между 0 С и точкой дефлегмации растворителя. На стадии е 8 полученное таким образом соединение формулы (XXXII) подвергают взаимодействию с соединением формулы (X) в присутствии или в отсутствие основания, такого как триэтиламин, в растворителе, таком как этанол, N,N-диметилформамид, ацетонитрил, толуол или дихлорметан, и при температуре между 0 и 100 С.- 14006430 На стадии f8 N-защитную группу полученного таким образом соединения формулы (XXXIII) удаляют путем обработки в кислой среде. Соединения формулы (III), где Y представляет собой либо (С 1-C4)алкоксикарбонил, либо R4, который представляет собой группу -CONR8R9, гетероциклический радикал или фенил, который не замещен или замещен группой, отличной от группы -CH2NR11R12, и Z представляет собой R5 = -CH2NR11R12, также могут быть получены в соответствии с представленной ниже схемой 9. Схема 9 На стадии а 9 схемы 9 амин соединения формулы (III) защищают в соответствии с традиционными способами. На стадии b9 нитрил формулы (XXXIV) восстанавливают до альдегида формулы (XXXV) в соответствии со способом, описанным в Synth. Commun., 1990, 20(3), 459-467. Затем, на стадии с 9 соединение формулы (X) подвергают взаимодействию с альдегидом формулы(XXXV) в присутствии или в отсутствие кислоты, такой как уксусная кислота, в растворителе, таком как метанол, дихлорметан или 1,2-дихлорэтан, с образованием in situ промежуточного имина, который восстанавливают химически, используя, например, цианоборгидрид натрия, триацетоксиборгидрид натрия или боргидрид натрия. Окончательно на стадии d9 N-защитную группу соединения формулы (XXXVI) удаляют путем обработки в кислой среде. Амины формулы (X) известны или их получают в соответствии со способами, описанными ниже. Кроме того, соединение формулы (XXXV) может быть превращено в соединение формулы(XXXVI) в соответствии со следующей далее реакционной схемой. На стадии а 9 а осуществляют восстановительное аминирование в присутствии восстанавливающего агента, такого как NаНВ(ОАс)3. Затем либо проводят алкилирование с помощью алкилгалогенида, например иодида (стадия b9 а), либо проводят еще одно восстановительное аминирование путем взаимодействия с карбонильным производным формулы R12O (стадия с 9 а), при этом R12O представляет собой диалкилкетон или алкилальдегид. Так, например, обработка соединения (XXXVa), в котором R11 представляет собой циклопропил, ацетоном дает соединение (XXXVI), в котором R11 является циклопропилом и R12 является изопропилом. В случае, когда Y представляет собой алкоксикарбонильную группу, соединение (III), в котором Y представляет собой группу CONR8R9, может быть получено в соответствии с представленной ниже схемой 10. Схема 10-CH2NR11R12, и Z представляет собой R5 = -CH2NR11R12, получают в соответствии с представленной ниже схемой 11. Стадии а 11 и b11 осуществляют в соответствии со способами, описанными на схеме 5. Стадию с 11 осуществляют в соответствии со способом, описанным на стадии а 4 схемы 4. Стадии от d11 до i11 осуществляют в соответствии со способами, описанными на стадиях от а 8 доf8 схемы 8. Соединения формулы (III), в которых R4 представляет собой группу COR13, могут быть получены в соответствии с представленной ниже схемой. На стадии а 12 N,О-диметилгидроксиламин гидрохлорид подвергают взаимодействию в присутствии агента сочетания, а на стадии b12 добавляют литиевое производное соединения R13H, полученное в результате воздействия бутиллития на соединение R13H. Затем способ осуществляют в соответствии со стадиями b9, с 9 и d9 схемы 9, что дает соединение формулы (III) из соединения формулы (ХХХХI). Соединения формулы (III), в которых R4 представляет собой группу CSNR8R9, могут быть получены в результате воздействия реагента Лавессона (Lawesson) на аналогичное соединение формулы (III), в котором R4 представляет собой группу CONR8R9, а другие заместители идентичны (Tetrahedron, 1985, 41(22), 5061-5087). Оптически чистые соединения формулы (111) могут быть получены путем разделения рацемических смесей с помощью стандартных способов, таких как способ, использующий оптически активные агенты или ферменты. Например, когда в соединении формулы (III) Y представляет собой группу-CONR8R9 или (C1-C4)алкоксикарбонил и Z = CN, то могут быть использованы способы, описанные в WO 97/25315; когда в соединении формулы (III) Y представляет собой пиридил и Z = CN, то могут быть использованы способы, описанные в Tetrahedron, 1995, 51/46, 12731-12744 или в Synthesis, 1996,8, 991996. Среди соединений формул (II) и (III) некоторые являются новыми и составляют еще один аспект изобретения. Соединения формулы где Х представляет собой водород или N-защитную группу;R3 представляет собой гетероциклический радикал, выбранный из (2,2-дифтор)бензо[1,3]диоксол-5 ила, 3-изопропилфенила, 3-трифторметоксифенила, 2,1,3-бензоксадиазол-5-ила, бензтиофен-5-ила, 1 бензофур-6-ила, 1-бензофур-4-ила, 1-бензофур-3-метил-5-ила, 2,3-дигидробензофур-4-ила; а также их соли с минеральными или органическими кислотами, в рацемической форме или в форме чистых энантиомеров являются новыми и составляют еще один аспект настоящего изобретения. Соединения формулы где R1 представляет собой фенилвинил; гетероцикл, выбранный из хинолила, 1-бензофур-2-ила, 2,1,3 бензоксадиазол-4-ила, 2,1,3-бензотиадиазол-4-ила, 1,3-бензотиазол-2-ила, 1-бензотиофен-2-ила, 1Hпиразол-4-ила, тиен-2-ила, 5-изоксазолтиен-2-ила, бензотиен-2-ила, тиено[3,2-с]пирид-2-ила; нафто[2,3d][1,3]диоксол-6-ила; причем указанные гетероциклы не замещены или замещены один или более чем один раз группами R6, которые могут быть одинаковыми или разными;R2 представляет собой водород или (C1-C4)алкил, и R3 представляет собой фенил, который не замещен или замещен один или более чем один раз группами R7, которые могут быть одинаковыми или разными; гетероциклический радикал, выбранный из бензо[1,3]диоксол-5-ила, который не замещен или замещен по положению 2 двумя атомами фтора; 2,1,3-бензотиадиазол-5-ила; 2,1,3-бензоксадиазол-5-ила; бензотиофен-5-ила; 2,3-дигидробензо[1,4]диоксин-6-ила; 1-бензофур-2-ила; 1-бензофур-5-ила; 1- 19006430 бензофур-6-ила; 1-бензофур-4-ила; 1-бензофур-3-метил-5-ила; 2,3-дигидробензофур-4-ила; 1,3-тиазол-2 ила; фурила; тиен-2-ила; тиен-3-ила; или R2 представляет собой фенил, который не замещен или замещен один или более чем один раз группами R6, которые могут быть одинаковыми или разными; бензо[1,3]диоксол-5-ил; пиридил; инданил; и R3 представляет собой водород;R6 представляет собой атом галогена; (C1-C4)алкильную группу; трифторметильную группу; (C1C4)алкоксигруппу; 2-фторэтоксигруппу; трифторметокси, метилендиокси или дифторметилендиоксигруппу;R7 представляет собой атом галогена; (C1-C4)алкильную группу; фенильную группу; трифторметильную группу; (C1-C4)алкоксигруппу; бензилоксигруппу; трифторметоксигруппу; и также их соли с минеральными или органическими кислотами, в рацемической форме или в форме чистых энантиомеров являются новыми и образуют часть изобретения. Соединения формулы где R4 представляет собой группу -CONR8R9; группу CSNR8R9; группу COR13; фенил, который не замещен или замещен один или более чем один раз группами Rio; гетероциклический радикал, выбранный из пиридила, имидазолила, фурила, бензимидазолила, бензотиазол-2-ила и бензо[1,3]диоксол-5-ила, причем указанные радикалы не замещены или замещены метилом;R5 представляет собой группу -СH2NR11R12 или -CH2N(O)NR11R12;R10 представляет собой атом галогена; (C1-C4)алкильную группу; гидроксильную группу; (C1 С 6)алкоксигруппу; R10 также может представлять собой группу -CH2NR11R12, когда R5 представляет собой группу -CH2NR11R12, указанные группы в таком случае являются одинаковыми;R11 и R12, каждый независимо, представляет собой водород; (C1-С 6)алкильную группу; (C2C4)алкенильную группу; (С 3-С 7)циклоалкильную группу; (С 3-С 7)циклоалкил(C1-C4)алкильную группу; гидрокси(C2-C4)алкиленовую группу; -метокси(C2-C4)алкиленовую группу; -трифторметил-(C2-C4) алкиленовую группу; -галогено(C2-C4)алкиленовую группу; или R11 и R12 вместе с атомом азота, к которому они присоединены, образуют моноциклический или бициклический гетероциклический радикал, выбранный из азетидинила, пирролидинила, морфолин-4 ила, тиоморфолин-4-ила, пиперид-1-ила, пиперазин-1-ила, 1,2,3,6-тетрагидропирид-1-ила, 2,3,4,5-тетрагидропиридиния, декагидрохинолила, декагидроизохинолила, тетрагидроизохинолила, октагидро-1 Низоиндолила, (C4-С 6)циклоалкилспиропиперидила, 3-азабицикло[3.1.0]гексила и 7-азабицикло[2.2.1] гептан-7-ила, не замещенный или замещенный один или более чем один раз атомом галогена либо (C1C4)алкильной, гидроксильной, (С 1-C4)алкокси, трифторметильной или дифторметиленовой группой;R13 представляет собой фенильную, тиазол-2-ильную или пиридильную группу; и также их соли с минеральными или органическими кислотами, в рацемической форме или в форме чистых энантиомеров являются новыми и образуют часть изобретения. Аффинитет соединений по изобретению к брадикининовым B1 рецепторам измеряют на суспензиях мембран клеток MRC5 с использованием методики, сходной с методикой, описанной K.Н. Schneck et al. вEur. J. Pharmacol., 1994, 266. 277-282. В этом тесте аффинитет [des-Arg9]брадикинина имеет величину между 10-6 и 10-7 М, аффинитет [des-Аrg10]каллидина равен 210-9 М; а соединения по изобретению показывают аффинитет, варьирующий до 10-9 М. Аффинитет выражают в величинах IC50, при этом IC50 представляет собой концентрацию, которая ингибирует 50% специфического связывания [des-Аrg10]каллидин-тритированного лиганда с рецепторами клеток MRC5. Аффинитет соединений по изобретению к брадикининовым Bz рецептором измеряют на суспензиях мембран клеток MRC5 с использованием методики, сходной с методикой, описанной D.G. Sawutz et al. вEur. J. Pharmacol., 1992, 227. 309-315. В этом тесте аффинитет брадикинина, выраженный в величинахIC50, лежит в области 10-9 М, тогда как соединения по изобретению не показывают никакого аффинитета к брадикининовым B2 рецепторам в концентрации 10-6 М. Антагонистический эффект соединений по изобретению измеряли in vitro путем ингибирования сокращения торакальной аорты у кролика, индуцированного введением [des-Аrg9]брадикинина, после предварительной инкубации ткани в течение 20 ч в буфере Кребса, насыщенном смесью СO2/O2, согласно адаптированной методике, описанной L. Levesque et al., Br. J. Pharmacol., 1993, 109, 1254-1262. Кроме того, антагонистический эффект соединений по изобретению измеряли по высвобождению[3H]инозитфосфата MRC5 фибробластами в культуре после включения [3H]миоинозита в течение 48 ч в соответствии с методикой, описанной F. Oury Donat et al., J. Neurochem., 1994, 62 (4), 1399-1407. Антагонистический эффект выражают как процент ингибирования высвобождения [3H]инозитфосфата, индуцированного [des-Аrg10]каллидином в концентрации 10-8 М, на MRC5 фибробластах, предварительно инкубированных в течение 4 ч в присутствии IL1 в концентрации 0,5 мкг/мл. Кишечную абсорбцию соединений по изобретению изучали in vitro на модели монослоя САСО-2 клеток согласно адаптированной методике, описанной Т. Lindmark et al., J. Pharmacol. Exp. Therap., 1995,275 (2), 958-964. Более того, ряд соединений по изобретению исследовали in vivo на животных моделях. Антиноцицептивный эффект исследовали на модели невропатической боли у крыс после введения соединения по изобретению в дозе 30 мг/кг перорально (согласно протоколу, описанному в Pain, 2000,86, 265-271). Обнаружено, что соединение по изобретению в дозе от 1 до 30 мг/кг перорально ингибирует позднюю фазу ноцицепции, индуцированной формалином, у мышей (Pain, 1987, 203-204), что является признаком воздействия на воспалительную боль. На модели термальной гипералгезии, индуцированной УФ-облучением, у крыс (Brit. Med. J., 1993,110, 1441-1444) были продемонстрированы антигипералгезивные эффекты соединения по изобретению в дозе от 1 до 3 мг/кг перорально. Соединения по изобретению могут быть полезны для лечения и предупреждения многих патологий,в частности воспалительных патологий, персистирующих или хронических воспалительных заболеваний(Drug News and Perspectives, 1994, 10 (7), 603-611), нейрогенного воспаления, боли (Brit. J. Pharmacol.,1993, 110, 193-198), хронических болей, невропатий, септического шока, ожогов (Pain, 1993, 53, 191-197),ран, заболеваний дыхательных путей, астмы, синдрома системного воспалительного ответа, отека (Brit. J.Pharmacol., 1995, 114, 1005-1013), церебрального отека, ангиогенеза (Brit. J. Pharmacol., 1993, 109, 14-17),инфекционного диабета I типа (Abst. 14th Intern. Symp. on Kinins, C49, Denver Colorado, 10-15 Sept. 1995),диабетической васкулопатии, вентрикулярной гипертрофии, фиброза легких и системного прогрессирующего склероза. Могут быть упомянуты, например,воспаление, боль в костях, мышечная боль, суставная боль, лицевая боль, фибромиалгия, гипералгезия, боль, ассоциированная с раком, периоперационная боль, менструальная боль, головные боли, зубная боль, гинекологическая боль, мигрени; гиперактивность дыхательных путей при астме, атопическая или неатопическая астма, аллергическая или неаллергическая астма, бронхит, пневмокониоз, хронические обструктивные заболевания дыхательных путей, плеврит, хронические обструктивные заболевания легких, ринит вирусной или аллергической природы; пост-капиллярная резистентность, диабет, диабетическая васкулопатия, диабетические симптомы,ассоциированные с инсулитом (например: гипергликемия, диурез, протеинурия); септический шок; болезнь Альцгеймера, черепно-мозговая травма; артрит, ревматоидный артрит, воспалительные заболевания суставов, атеросклероз, рассеянный склероз; заболевания пищеварительной системы, заболевания мочевыводящей системы, цистит, панкреатит,нефрит, энтероколит, язвенный колит, слизистый колит, болезнь Крона, заболевания печени; патологии глазного аппарата, увеит, ретинит, глаукома; кожные заболевания, такие как атопические заболевания, экзема, псориаз, дерматит, чесотка; выпадение волос. Более того, соединения по изобретению полезны благодаря своему антипролиферативному действию на раковые клетки; своему воздействию на нейродегенеративные заболевания, миелиновую дегенерацию, дегенеративные заболевания вирусного происхождения; своему кардиопротекторному действию. Кроме того, соединения по изобретению полезны в качестве миорелаксантов, релаксантов гладкой мускулатуры, спазмов желудочно-кишечного тракта и матки. В более широком смысле соединения по изобретению могут быть полезны для лечения или предупреждения любой патологии, в которой фундаментальную роль играет брадикинин и которые обозначают здесь ниже как брадикининзависимые патологии.- 21006430 Соединения по настоящему изобретению являются особенно активными началами фармацевтических композиций, токсичность которых совместима с их применением в качестве лекарств. Вышеупомянутые соединения формулы (I) могут быть использованы в суточных дозах от 0,01 до 100 мг на кг массы тела млекопитающего, которое должно быть подвергнуто лечению, предпочтительно в суточных дозах от 0,1 до 50 мг/кг. Для человека доза предпочтительно может изменяться в интервале от 0,5 до 4000 мг в сутки и более конкретно от 2,5 до 1000 мг в зависимости от возраста индивидуума,который должен быть подвергнут лечению, или типа лечения: профилактического или лечебного. В целях применения их в качестве лекарств соединения формулы (I), как правило, вводят в виде единиц дозирования. Указанные единицы дозирования предпочтительно готовят в виде фармацевтических композиций, в которых активное начало смешано с фармацевтическим эксципиентом. Таким образом, согласно другим его аспектам настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала соединение формулы (I) или его фармацевтически приемлемую соль, и/или их сольват, или их гидрат. В фармацевтических композициях по настоящему изобретению для перорального, сублингвального, распылительного, подкожного, внутримышечного, внутривенного, трансдермального, местного или ректального введения активные начала могут быть введены животным и человеку в стандартных формах введения, в виде смеси со стандартными фармацевтическими носителями. Соответствующие стандартные формы введения включают в себя пероральные формы, такие как таблетки, гелевые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для сублингвального и трансбуккального введения, аэрозоли, формы для местного введения, имплантаты, формы для подкожного, внутримышечного, внутривенного, интраназального или внутриглазного введения и формы для ректального введения. Если готовят твердую композицию в форме таблеток, то активное начало, микронизированное или немикронизированное, смешивают с фармацевтическим носителем, который может состоять из разбавителей, таких как, например, лактоза, микрокристаллическая целлюлоза, крахмал, и веществами, оптимизирующими технологические процессы, например, связывающими веществами (поливинилпирролидон,гидроксипропилметилцеллюлоза и т.д.), скользящими веществами, например диоксидом кремния, и смазывающими веществами, например стеаратом магния, стеариновой кислотой, глицерилтрибегенатом или стеарилфумаратом натрия. В препарат могут быть добавлены такие увлажняющие агенты или поверхностно-активные вещества, такие как лаурилсульфат натрия. Таблетки могут быть изготовлены с помощью различных технологий: прямым таблетированием,сухим гранулированием, влажным гранулированием или гранулированием плавлением. Таблетки могут быть без покрытия или иметь сахарное покрытие (например, сахарозное), либо быть покрытыми различными полимерами или другими подходящими материалами. Таблетки могут иметь немедленное, отсроченное или замедленное высвобождение за счет изготовления полимерных матриц или путем использования в пленочном покрытии специфических полимеров. Препарат в виде гелевой капсулы получают простым смешиванием активного начала с сухими фармацевтическими носителями (простым смешиванием или сухим, влажным гранулированием либо гранулированием плавлением) или с жидкими либо полутвердыми фармацевтическими носителями. Гелевые капсулы могут быть мягкими или твердыми, с пленочным или каким-либо иным покрытием с тем, чтобы иметь немедленное, продленное или отсроченное высвобождение (например, посредством энтеросолюбильной формы). Препарат в форме сиропа или эликсира может содержать активное начало вместе с подсластителем,предпочтительно безкалорийным подсластителем, метилпарабеном и пропилпарабеном в качестве антисептика и, кроме того, корригентом и подходящим красителем. Водно-дисперсионные порошки или гранулы могут содержать активное начало в виде смеси с диспергаторами, увлажняющими агентами или суспендирующими агентами, например с поливинилпирролидоном, и, кроме того, с подсластителями или усилителями вкуса. Для ректального введения используют суппозитории, которые готовят со связывающими веществами, плавящимися при ректальной температуре, например с маслом какао или полиэтиленгликолями. Водные суспензии, изотонические физиологические растворы или стерильные инъецируемые растворы, содержащие фармакологически приемлемые диспергаторы и/или солюбилизирующие агенты,например пропиленгликоль или бутиленгликоль, используют для парентерального, интраназального или внутриглазного введения. Так, для приготовления водного раствора для внутривенного введения может быть использован сорастворитель, такой как, например, спирт, в частности этанол или гликоль, такой как полиэтиленгликоль или пропиленгликоль, и гидрофильное поверхностно-активное вещество, такое как Tween 80. Для приготовления масляного раствора для внутримышечной инъекции активное начало может быть растворено с триглицеридом или эфиром глицерина. Для местного введения могут быть использованы кремы, мази, гели или глазные капли.- 22006430 Для трансдермального введения могут быть использованы пластыри в многослойной форме или в форме резервуара, в котором активное начало может находиться в спиртовом растворе. Для введения путем ингаляции используют аэрозоль, содержащий, например, триолеат сорбитана или олеиновую кислоту и, кроме того, трихлорфторметан, дихлорфторметан, дихлортетрафторэтан или любой другой биологически совместимый газ-пропеллент; также может быть использована система, содержащая только активное начало или активное начало, скомбинированное с эксципиентом, в форме порошка. Кроме того, активное начало может быть в форме комплекса с циклодекстрином, например -, или -циклодекстрином, 2-гидроксипропилциклодекстрином или метилциклодекстрином. Активное начало также может быть изготовлено в виде препарата в форме микрокапсул или микросфер, возможно с одним или более чем одним носителем или одной добавкой. Среди форм замедленного высвобождения, которые полезны в случае длительного лечения, могут быть использованы имплантаты. Их можно изготовить в форме масляной суспензии или в форме суспензии микросфер в изотонической среде. В каждой единице дозирования активное начало формулы (I) присутствует в количествах, которое адаптировано для предусмотренных суточных доз. Как правило, каждая единица дозирования подходящим образом скорректирована в соответствии с дозировкой и предполагаемым типом введения, например таблетками, гелевыми капсулами и им подобным, саше, ампулами, сиропами и им подобным или каплями, так что такая единица дозирования содержит от 0,5 до 1000 мг активного начала и предпочтительно от 2,5 до 250 мг, необходимых для введения от одного до четырех раз в сутки. Композиции по настоящему изобретению могут содержать вместе с упомянутыми выше соединениями формулы (I), их фармацевтически приемлемой солью, и/или их сольватом, или их гидратом другие активные начала, которые могут быть полезны в лечении осложнений или заболеваний, упомянутых выше. Например, фармацевтическая композиция по настоящему изобретению может содержать антагонист брадикининового B2 рецептора в комбинации с соединением по настоящему изобретению. Согласно еще одному из его аспектов настоящее изобретение относится к применению соединений формулы (I), или их фармацевтически приемлемой соли, и/или их сольвата, или их гидрата для изготовления лекарств, предназначенных для лечения любой патологии, в которую вовлечены брадикинин и B1 рецепторы. Согласно еще одному своему аспекту настоящее изобретение относится к применению соединений формулы (I), или их фармацевтически приемлемой соли, и/или их сольвата, или их гидрата для изготовления лекарств, предназначенных для лечения воспалительных патологий и персистирующих или хронических воспалительных заболеваний. В разделах Подготовительные примеры и Примеры использованы следующие сокращения: эфир - диэтиловый эфир изоэфир - диизопропиловый эфирHCl (газ) в диэтиловом эфире т.пл. - точка плавления КТ - комнатная температура- 23006430 За исключением тех мест, где упомянуто особо, спектры протонного ядерного магнитного резонанса (ЯМР) регистрировали при 200 МГц в DMSO-d6, возможно содержащем TFA, и соотнесены с DMSO при 2,5 млн-1 от тетраметилсилана. Химические сдвигиуказаны в млн-1.s: синглет; bs: широкий синглет; ds: сдвоенный синглет; d: дублет; bd: широкий дублет; dd: сдвоенный дублет; t: триплет; q: квартет; qt: квинтет; mt: мультиплет; неразр.: неразрешенный пик; sept: септет. Если в настоящем описании указывается только ЯМР, то это означает, что спектр ЯМР, зарегистрированный в вышеуказанных условиях, согласуется с ожидаемой структурой. Для масс-спектров указано значение МH+. Подготовительные примеры Подготовительный пример 1.1. 3-(Нафталин-2-сульфониламино)-3-фенилпропионовая кислота.NaOH, порциями добавляют 5,6 г 2-нафталинсульфонилхлорида, поддерживая значение рН 10,5-10,8 путем добавления 1 н. NaOH, и смесь перемешивают в течение 2 ч при КТ. Реакционную смесь разбавляют, добавляя 400 мл воды, подкисляют до рН 2 добавлением 2 н. НCl и экстрагируют ЕtOАс, органическую фазу промывают буферным раствором KHSO4/K2SO4, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. После растирания в гептане и высушивания под вакуумом получают 7,33 г ожидаемого продукта; т.пл. = 126-129 С. ЯМР:(млн-1): 2.55-2.70: mt: 2H; 4.70: t: 1H; 6.85-8.15: не разреш.: 12 Н. Подготовительный пример 1.2. 3-[Метил(нафталин-2-сульфонил)амино]-3-фенилпропионовая кислота.A). 3-(трет-Бутоксикарбониламино)-3-фенилпропионовая кислота. 8,3 мл триэтиламина добавляют к смеси 8,3 г 3-амино-3-фенилпропионовой кислоты в 35 мл воды и 5 мл диоксана с последующим добавлением в течение 30 мин раствора 12,8 г ди-трет-бутилдикарбоната в 25 мл диоксана и смесь перемешивают в течение ночи при КТ. Реакционную смесь разбавляют водой,водную фазу промывают эфиром, подкисляют до рН 2,5 путем добавления 2 н. HCl, экстрагируют ЕtOАс,органическую фазу промывают водой, насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Получают 12,4 г ожидаемого продукта. Б). 3-(N-трет-Бутоксикарбонилметиламино)-3-фенилпропионовая кислота. 0,27 г 80%-ного гидрида натрия в масле порциями добавляют к смеси 0,795 г соединения, полученного на предыдущей стадии, и 0,62 мл метилиодида в 10 мл THF и смесь перемешивают в течение ночи при КТ. Реакционную смесь разбавляют ЕtOАс, добавляют воду и смесь подкисляют до рН 2 добавлением 1 н. HCl. После разделения фаз путем расслоения органическую фазу промывают водой, насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Получают 0,82 г ожидаемого продукта.B). 3-(Метиламино)-3-фенилпропионилтрифторацетат. Смесь 0,81 г соединения, полученного на предыдущей стадии, и 12 мл TFA в 10 мл DCM перемешивают в течение 55 мин при КТ. Реакционную смесь концентрируют под вакуумом, остаток переводят в DCM и растворитель выпаривают под вакуумом. Остаток растворяют в эфире, добавляют гептан до точки осаждения, растворитель декантируют и полученную смолу высушивают. Получают 0,86 г ожидаемого продукта в виде пены. Г). 3-[Метил(нафталин-2-сульфонил)амино]-3-фенилпропионовая кислота. 5 мл 1 н. NaOH добавляют к смеси 0,85 г соединения, полученного на предыдущей стадии, в 5 мл диоксана с последующим добавлением порциями 0,698 г 2-нафталинсульфонилхлорида, поддерживая рН при 10-11 добавлением 1 н. NaOH, смесь перемешивают в течение 2 ч при КТ. Реакционную смесь разбавляют водой, водную фазу промывают эфиром и подкисляют до рН 2, добавляя 1 н. HCl, экстрагируют ЕtOАс, органическую фазу промывают водой, насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Получают 0,65 г ожидаемого продукта в виде пластичного материала. Подготовительный пример 1.3. 3-(3-Метилфенил)-3-(нафталин-2-сульфониламино)пропионовая кислота.- 24006430 А). 3-Амино-3-(3-метилфенил)пропионовая кислота. 11,8 мл 3-метилбензальдегида добавляют к смеси 10,4 г малоновой кислоты и 15,4 г ацетата аммония в 150 мл 2-метоксиэтанола и смесь нагревают в течение ночи при 80 С. После охлаждения до КТ образовавшийся осадок отфильтровывают с отсасыванием, промывают эфиром и высушивают. Получают 6,8 г ожидаемого продукта. ЯМР:(млн-1): 2.25: s: 3H; от 2.80 до 3.05: mt: 2H; 4.55: t: 1H; от 7.10 до 7.30: не разреш.: 4 Н. Б). 3-(3-Метилфенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. 10 мл 1 н. NaOH добавляют к суспензии 1,79 г соединения, полученного на предыдущей стадии, в 25 мл диоксана с последующим добавлением порциями 2,26 г 2-нафталинсульфонилхлорида, поддерживая рН при 10,5-12 путем добавления 1 н. NaOH, смесь перемешивают в течение 2 ч при КТ. Реакционную смесь разбавляют водой, водную фазу промывают ЕtOАс и подкисляют до рН 1, добавляя 6 н. HCl, экстрагируют ЕtOАс, органическую фазу промывают насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. После кристаллизации из гептана получают 3,37 г ожидаемого продукта. Подготовительный пример 1.4. 3-(3,4-Диметилфенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. А). 3-Амино-3-(3,4-диметилфенил)пропионовой кислоты гидрохлорид. Смесь 5 г 3,4-диметилбензальдегида, 3,88 г малоновой кислоты и 5,74 г ацетата аммония в 50 мл ЕtOН кипятят с обратным холодильником в течение 5 ч. После охлаждения до КT образовавшийся осадок отфильтровывают с отсасыванием и промывают ЕtOН. Осадок переводят в смесь DCM/1 н. HCl, нерастворившийся материал отфильтровывают, фильтрат декантируют, кислотную водную фазу концентрируют под вакуумом до начала осаждения и охлаждают до 0 С, а образовавшийся осадок отфильтровывают с отсасыванием. Осадок переводят в смесь DCM/MeOH (6:4; о/о), высушивают над Na2SO4 и растворители выпаривают под вакуумом. Остаток переводят в эфир и образовавшийся осадок отфильтровывают с отсасыванием после растирания. Получают 3,01 г ожидаемого продукта; т.пл. = 192 С (разл.). Б). 3-(3,4-Диметилфенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. Раствор 1,98 г 2-нафталинсульфонилхлорида в 15 мл диоксана добавляют по каплям к смеси 2 г соединения, полученного на предыдущей стадии, и 17,4 мл 1 н. NaOH в 20 мл диоксана и смесь перемешивают в течение ночи при КТ. Реакционную смесь нейтрализуют до рН 7, добавляя 1 н. HCl, и концентрируют под вакуумом. Остаток переводят в смесь ЕtOАс/насыщенный NаНСО 3, образовавшийся осадок отфильтровывают с отсасыванием и переводят в смесь DCM/1 н. HCl, органическую фазу высушивают над Na2SO4 после разделения фаз путем расслаивания и растворитель выпаривают под вакуумом. Получают 1,66 г ожидаемого продукта; т.пл. = 122 С (разл.). Подготовительный пример 1.5. 3-(3,5-Диметоксифенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. А). 3-Амино-3-(3,5-диметоксифенил)пропионовая кислота. Смесь 5 г 3,5-диметоксибензальдегида, 3,13 г малоновой кислоты и 4,64 г ацетата аммония в 50 мл ЕtOН кипятят с обратным холодильником в течение 5 ч. Реакционную смесь концентрируют под вакуумом, остаток переводят в воду, нерастворившийся материал отфильтровывают, фильтрат промываютDCM и водную фазу концентрируют под вакуумом. Остаток переводят в воду и еще раз концентрируют под вакуумом. Остаток переводят в ЕtOН и растворитель выпаривают под вакуумом. Получают 2,96 г ожидаемого продукта. Б). 3-(3,5-Диметоксифенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. 1,01 г 2-нафталинсульфонилхлорида порциями добавляют к смеси 1 г соединения, полученного на предыдущей стадии, и 4,5 мл 1 н. NaOH в 15 мл диоксана и смесь перемешивают в течение ночи при КТ. Реакционную смесь разбавляют водой и промывают ЕtOАс, водную фазу подкисляют до рН 1, добавляя концентрированную HCl, и экстрагируют эфиром, органическую фазу промывают 1 н. HCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Получают 1,41 г ожидаемого продукта; т.пл. = 190 С. Подготовительный пример 1.6. 3-(3,4-Диметоксифенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. А). 3-Амино-3-(3,4-диметоксифенил)пропионовая кислота, гидрохлорид. Смесь 5 г 3,4-диметоксибензальдегида, 3,131 г малоновой кислоты и 4,64 г ацетата аммония в 50 мл ЕtOН кипятят с обратным холодильником в течение 5 ч. После охлаждения до КТ образовавшийся осадок отфильтровывают с отсасыванием. Осадок переводят в воду, подкисляют до рН 2, добавляя 1 н. HCl,водную фазу промывают DCM и концентрируют под вакуумом. Остаток переводят в воду и еще раз концентрируют под вакуумом. Остаток переводят в ЕtOН и упаривают под вакуумом. Получают 2,99 г ожидаемого продукта. Б). 3-(3,4-Диметоксифенил)-3-(нафталин-2-сульфониламино)пропионовая кислота. Это соединение получают в соответствии с методикой, описанной на стадии (Б) подготовительного примера 1.5, исходя из 1 г соединения, полученного на предыдущей стадии, и 7,65 мл 1 н. NaOH в 15 мл диоксана. Получают 1,33 г ожидаемого продукта. Подготовительный пример 1.7. 3-(Бензо[1,3]диоксол-5-ил)-3-(нафталин-2-сульфониламино)пропионовая кислота. А). 3-Амино-3-(бензо[1,3]диоксол-5-ил)пропионовая кислота. Это соединение получают в соответствии с методикой, описанной в Biorg. Med. Chem., 1994, 2 (9),881. Б). 3-(Бензо[1,3]диоксол-5-ил)-3-(нафталин-2-сульфониламино)пропионовая кислота. 1 н. NaOH добавляют к суспензии 2,16 г соединения, полученного на предыдущей стадии, в 40 мл диоксана до тех пор, пока значение рН не станет равным 11,8, с последующим добавлением порциями 2,33 г 2-нафталинсульфонилхлорида, и смесь перемешивают в течение 2 ч при КТ, поддерживая рН при 10,5-11,5 добавлением 1 н. NaOH. Реакционную смесь разбавляют равным объемом воды и промывают ЕtOАс, водную фазу подкисляют до рН 1,5, добавляя 6 н. HCl, и экстрагируют ЕtOАс, органическую фазу промывают буфером KHSO4/K2SO4, насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. После кристаллизации из гептана получают 3,9 г ожидаемого продукта; т.пл. = 173-175 С. ЯМР:(млн-1): 2.45-2.60: mt: 2H; 4.65: q: 1H; 5.40-5.70: mt: 2H; 6.45-6.65: mt: 3H; 7.55-7.75: mt: 3H; 7.90-8.10: mt: 4H; 8,35: bd: 1H. Подготовительный пример 1.8. 3-(2,3-Дигидробензо[1,4]диоксин-6-ил)-3-(нафталин-2-сульфониламино)пропионовая кислота. А). 3-Амино-3-(2,3-дигидробензо[1,4]диоксин-6-ил)пропионовая кислота. Смесь 5 г 2,3-дигидробензо[1,4]диоксин-6-карбальдегида, 3,17 г малоновой кислоты и 4,69 г ацетата аммония в 50 мл EtOH кипятят с обратным холодильником в течение 5 ч. Реакционную смесь оставляют охлаждаться до КТ, образовавшийся осадок отфильтровывают отсасыванием и промывают EtOH и затем водой. После высушивания под вакуумом получают 1,965 г ожидаемого продукта. Б). 3-(2,3-Дигидробензо[1,4]диоксин-6-ил)-3-(нафталин-2-сульфониламино)пропионовая кислота. Это соединение получают в соответствии с методикой, описанной на стадии (Б) подготовительного примера 1.5, исходя из 1 г соединения, полученного на предыдущей стадии, 4,5 мл 1 н. NaOH, 15 мл диоксана и 1,02 г 2-нафталинсульфонилхлорида. После кристаллизации из гексана получают 0,876 г ожидаемого продукта. Подготовительный пример 1.9. 3-(2,3-Дигидробензо[1,4]диоксин-6-ил)-3-(5,6,7,8-тетрагидронафталин-2-сульфониламино)пропионовая кислота. Раствор 0,570 г 5,6,7,8-тетрагидронафталин-2-сульфонилхлорида в 15 мл диоксана по каплям добавляют к смеси 0,5 г соединения, полученного на стадии (А) подготовительного примера 1.8, и 4,5 мл 1 н. NaOH в 20 мл диоксана и смесь перемешивают в течение 4 ч при КТ. Реакционную смесь концентрируют под вакуумом, остаток переводят в 1 н. NaOH и промывают DCM, водную фазу подкисляют до рН 1 добавлением концентрированной HCl и экстрагируют DCM, органическую фазу промывают насыщенным раствором NaCl и высушивают над Na2SO4, растворитель выпаривают под вакуумом. Получают 0,5 г ожидаемого продукта. Подготовительный пример 1.10. 3-[(2,4-Дихлор-3-метилбензолсульфонил)фениламино]пропионовая кислота. А). 2,4-Дихлор-3-метилбензолсульфонилхлорид. Это соединение получают в соответствии с методикой, описанной в J. Am. Chem. Soc., 1940, 62,511-512. Б). Метил 3-(фениламино)пропионат. Смесь 20 мл анилина, 22 мл метилакрилата и 2 мл уксусной кислоты кипятят с обратным холодильником в течение 8 ч. После концентрирования реакционной смеси под вакуумом полученное масло дистиллируют при пониженном давлении (т.кип. = 132 С при 333,3 Па и затем т.кип. = 110 С при 6,66 Па). Полученный продукт переводят в гексан и образовавшийся осадок отфильтровывают отсасыванием. Получают 25 г ожидаемого продукта. В). Метил 3-[(2,4-дихлор-3-метилбензолсульфонил)фениламино]пропионат. Смесь 1,5 г соединения, полученного на стадии (А), 1,03 г соединения, полученного на стадии (Б), и 0,08 г DMAP в 20 мл пиридина перемешивают в течение 1 ч при КТ. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют ЕtOАс, органическую фазу промывают буферным раствором с рН 2, насыщенным раствором NaCl и высушивают над Na2SO4, растворитель выпаривают под вакуумом. Получают 2,32 г ожидаемого продукта. Г). 3-[(2,4-Дихлор-3-метилбензолсульфонил)фениламино]пропионовая кислота. 8,7 мл 1 н. КОН добавляют к раствору 2,32 г соединения, полученного на предыдущей стадии, в 10 мл ЕtOН и 10 мл диоксана и смесь перемешивают в течение ночи при КТ. Реакционную смесь концентрируют под вакуумом, остаток переводят в насыщенный раствор NаНСО 3, водную фазу промывают эфиром, подкисляют до рН 1 добавлением 1 н. HCl и экстрагируют DCM, органическую фазу промывают водой и высушивают над Na2SO4, растворитель выпаривают под вакуумом. Получают 0,912 г ожидаемого продукта. ЯМР:(млн-1): 2.35: t: 2 Н; 2.5: s: 3H; 4.0: t: 2H; от 7.15 до 7.4: не разреш.: 5 Н; от 7.45 до 7.65: q: 2H; от 12.2 до 12.5: bs: 1H. Подготовительный пример 1.11. 2,5-Диоксопирролидин-1-ил 3-(нафталин-2-сульфониламино)-3 фенилпропионат. 1,13 г 1,3-дициклогексилкарбодиимида добавляют к смеси 1,78 г соединения, полученного в подготовительном примере 1.1, и 0,578 г N-гидроксисукцинимида в 15 мл DMF и смесь перемешивают в течение ночи при КТ. После отфильтровывания отсасыванием образовавшейся 1,3-дициклогексилмочевины фильтрат разбавляют водой и экстрагируют ЕtOАс, органическую фазу промывают насыщенным раствором NаНСО 3, насыщенным раствором NaCl и высушивают над Na2SO4, растворитель выпаривают под вакуумом. Получают 1,81 г ожидаемого продукта. Подготовительный пример 1.12. 3-Фенил-3-(хинолин-2-сульфониламино)пропионовая кислота. Это соединение получают в соответствии с методикой, описанной в подготовительном примере 3.13 международной заявки на патент WO 97/25315. Подготовительный пример 1.13. (R) 3-(N-Вос)Амино-3-(бензо[1,3]диоксол-5-ил)пропионовая кислота. А). (R) 3-(Фенилацетил)амино-3-(бензо[1,3]диоксол-5-ил)пропионовая кислота. 20 г гидрохлорида 3-амино-3-(бензо[1,3]диоксол-5-ил)пропионовой кислоты помещают в 10 мл ацетона, 30 мл воды и 38 мл TEA при -5 С и по каплям добавляют 14 мл фенилацетилхлорида в 20 мл ацетона с последующим перемешиванием в течение 2 ч при -5 С. Ацетон концентрируют. Водную фазу промывают Et2 О и нерастворившийся материал удаляют фильтрованием. Фазы еще раз разделяют посредством расслаивания и водную фазу промывают Et2O и затем подкисляют 1 н. HCl до рН 2. Полученную в результате этого фазу выливают в DCM и при этом образуется осадок. Осадок отфильтровывают отсасыванием и промывают DCM. Получают 24 г ожидаемого продукта. Б). (R) 3-Амино-3-(бензо[1,3]диоксол-5-ил)пропионовая кислота HCl. 4 г соединения с предыдущей стадии помещают в 150 мл воды. Добавляют 12,23 мл 1 н. КОН и смесь перемешивают в течение 15 мин при КТ. рН раствора составляет приблизительно 11; добавляют АсОН и рН подводят до 7,50,1. Добавляют 250 мкл пенициллинамидазы и смесь перемешивают в течение ночи при КТ, поддерживая рН 7,50,1. Смесь подкисляют до рН 2 добавлением 1 н. HCl и затем промывают EtOAc. Водную фазу нагревают до 65 С с активным растительным углем в течение 5 мин. Полученную смесь фильтруют через Celite, водную фазу промывают Et2O, затем концентрируют досуха и упаривают. Остаток переводят в смесь MeOH/DCM (6:4; о/о), нерастворившийся материал (минеральный) далее удаляют, органическую фазу высушивают над сульфатом натрия и концентрируют. Получают 1,75 г ожидаемого продукта. ЯМР:(млн-1): 2.7-3.1: mt: 2 Н; 4.4: не разреш.: 1 Н; 6.0: s: 2H; 6.9: q: 2H; 7.1: s: 1H. В). (R) 3-(N-Вос)Амино-3-(бензо[1,3]диоксол-5-ил)пропионовая кислота. 1,30 г соединения, полученного на предыдущей стадии, помещают в 20 мл диоксана и 20 мл воды; добавляют 1,8 мл TEA и затем 1,54 г (Вос)2O и смесь перемешивают в течение ночи при КТ. Реакционную смесь разбавляют водой, промывают Et2O и затем подкисляют до рН 2 путем добавленияKHSO4/K2SO4. Полученную смесь экстрагируют EtOAc и затем промывают насыщенным растворомNaCl. Получают 0,850 г ожидаемого продукта. 25D = +54 (с = 0,5; МеОН). Действуя в соответствии со способами, описанными выше, получают соединения формулы (II),приведенные ниже в табл. III. Таблица III
МПК / Метки
МПК: C07D 295/18, A61K 31/40, C07C 237/30
Метки: содержащие, аминометильную, группу, способ, n-(арилсульфонил)бета-аминокислот, получения, композиции, производные, замещенную, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-6430-proizvodnye-n-arilsulfonilbeta-aminokislot-soderzhashhie-zameshhennuyu-aminometilnuyu-gruppu-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные n-(арилсульфонил)бета-аминокислот, содержащие замещенную аминометильную группу, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Композиция для предупреждения или восстановления возрастных функциональных дефицитов у млекопитающих и способ ее применения
Следующий патент: Азотосодержащие соединения в качестве ингибиторов коррозии
Случайный патент: Система сбора данных по распределительной электросети переменного тока












