Ингибиторы тирозинкиназы
Номер патента: 5812
Опубликовано: 30.06.2005
Авторы: Хоффман Вилльям Ф., Хангейт Рэндалл В., Фрэли Марк Э., Аррингтон Кеннет Л., Ким Юнтае, Хартман Джордж Д., Билодо Марк Т.
Формула / Реферат
1. Соединение формулы I

или его фармацевтически приемлемая соль или стереоизомер,
где Z представляет группу
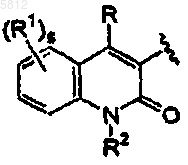
a равно 0 или 1;
b равно 0 или 1;
m равно 0, 1 или 2;
s равно 1 и
t равно 1;
R1 и R5 представляют H;
R2 и R3 представляют H;
R4 выбран из
1) OC1-C6алкилен-NR7R8,
2) (C=O)aC0-C6алкилен-Q, где Q представляет H, OH, CO2H или OC1-C6 алкил,
3) OC0-C6алкиленгетероциклила, необязательно, замещенного заместителями от одного до трех, выбранными из R6a,
4) C0-C6 алкилен-NR7R8,
5) (C=O)NR7R8 и
6) OC1-C3алкилен-(C=O)NR7R8;
R6a выбран из
1) (C=O)rOs(C1-C6)алкила, где r равно 0 или 1 и s имеет значение, определенное выше,
2) Or(C1-C3)перфторалкила, где r равно 0 или 1,
3) (C0-C6)алкилен-S(O)mRa, где r равно 0, 1 или 2,
4) оксо,
5) OH,
6) галогена,
7) CN,
8) (C2-C6)алкенила,
9) (C2-C6)алкинила,
10) (C3-C6)циклоалкила,
11) (C0-C6)алкиленарила,
12) (C0-C6)алкиленгетероциклила,
13) (C0-C6)алкилен-N(Rb)2,
14) C(O)Ra,
15) (C0-C6)алкилен-CO2Ra,
16) C(O)H и
17) (C0-C6)алкилен-CO2H,
причем указанный алкил, алкенил, алкинил, циклоалкил, арил и гетероциклил, необязательно, замещен заместителями вплоть до трех, выбранными из Rb, OH, (C1-C6)алкокси, галогена, CO2H, CN, O(C=O)C1-C6алкила, оксо и N(Rb)2; и
R7 и R8, независимо, выбраны из
1) H,
2) (C=O)ObC1-C6алкила,
3) (C=O)ObC3-C6циклоалкила,
4) (C=O)Obарила,
5) C(=O)Obгетероциклила,
6) C1-C6алкила,
7) арила,
8) C2-C6алкенила,
9) C2-C6алкинила,
10) гетероциклила,
11) C3-C6циклоалкила,
12) SO2Ra и
13) (C=O)NRb2,
причем указанный алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил, необязательно, замещен одним или несколькими заместителями, выбранными из R6a, или R7 и R8 могут быть взяты вместе с азотом, к которому они присоединены, с образованием моноциклического или бициклического гетероцикла с 5-7 членами в каждом кольце, необязательно, содержащего, кроме азота, один или два дополнительных гетероатома, выбранных из N, O и S, причем указанный моноциклический или бициклический гетероцикл, необязательно, замещен одним или несколькими заместителями, выбранными из R6a,
Ra представляет (C1-C6)алкил, (C3-C6)циклоалкил, арил или гетероциклил и
Rb представляет H, (C1-C6)алкил, арил, гетероциклил, (C3-C6)циклоалкил, (C=O),OC1-C6алкил, (C=O)C1-C6алкил или S(O)2Ra;
причем указанный выше арил является любым стабильным моноциклическим или бициклическим углеродным кольцом, содержащим до 7 атомов углерода в каждом кольце, причем по крайней мере одно кольцо является ароматическим; и
указанный выше гетероцикл является 5-10-членным ароматическим или неароматическим гетероциклом, содержащим от 1 до 4 гетероатомов, выбранных из O, N, S, и включает бициклические группы.
2. Соединение по п.1, выбранное из
3-{5-[3-(4-метилпиперазин-1-ил)пропокси]-1H-индол-2-ил}-1H-хинолин-2-она;
3-[5-{2-[(2-метоксиэтил)амино]этокси}-1H-индол-2-ил]-2(1H)-хинолинона;
3-[5-(2-{(2-метоксиэтил)[(2-метокси-5-пиримидинил)метил]амино}этокси)-1H-индол-2-ил]-2(1H)-хинолинона;
3-(5-{[(2S,4R)-4-метоксипирролидинил]метокси}-1H-индол-2-ил)-2(1H)-хинолинона;
3-[5-({(2S,4R)-4-метокси-1-[(2-метил-5-пиримидинил)метил]пирролидинил}метокси)-1H-индол-2-ил]-2(1H)-хинолинона;
этилового эфира 1-(2-{[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]окси}этил)-4-пиперидинкарбоновой кислоты;
1-(2-{[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]окси}этил)-4-пиперидинкарбоновой кислоты;
3-[(2S,4R)-4-метокси-2-({[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]окси}метил)пирролидинил]пропановой кислоты;
3-[5-(4-метансульфонилпиперазин-1-илметил)-1H-индол-2-ил]-1H-хинолин-2-она;
3-[5-(4-метансульфонил-1-оксипиперазин-1-илметил)-1H-индол-2-ил]-1H-хинолин-2-она;
3-[5-(4-ацетилпиперазин-1-илметил)-1H-индол-2-ил]-1H-хинолин-2-она;
N-циклопропил-N-[2-(2-оксо-1,2-дигидрохинолин-3-ил)-1H-индол-5-илметил]метансульфонамида;
3-[5-(1-пиперазинилкарбонил)-1H-индол-2-ил]-2(1H)-хинолинона;
3- {5-[(4-метил-1-пиперазинил)карбонил]-1H-индол-2-ил}-2(1H)-хинолинона;
трифторацетат 1-{[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]карбонил}-4-пиперидин-аминия;
трифторацетат 1-({[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]окси}ацетил)пиперазин-4-иния;
3-{5-[2-(1,1-диоксидо-4-тиоморфолинил)-2-оксоэтокси]-1H-индол-2-ил}-2(1H)-хинолинона;
N-{[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]метил}-4-пиперидинкарбоксамида;
3-{5-[1-(4-морфолинил)этил]-1H-индол-2-ил}-2(1H)-хинолинона;
3-{5-[1-(1-пирролидинил)этил]-1H-индол-2-ил}-2(1H)-хинолинона;
3-{5-[1-(4-ацетил-1-пиперазинил)этил]-1H-индол-2-ил}-2(1H)-хинолинона;
3-(5-{1-[4-(метилсульфонил)-1-пиперазинил]этил}-1H-индол-2-ил)-2(1H)-хинолинона;
4-амино-N-[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]-1-пиперидинкарбоксамида и
4-амино-N-{[2-(2-оксо-1,2-дигидро-3-хинолинил)-1H-индол-5-ил]метил}-1-пиперидинкарбоксамида
или его фармацевтически приемлемой соли или стереоизомера.
3. Фармацевтическая композиция для лечения или профилактики у млекопитающего заболевания или состояния, зависимого от тирозинкиназы, включающая соединение по п.1 и фармацевтически приемлемый носитель.
4. Композиция по п.3, дополнительно включающая второе соединение, выбранное из
1) модулятора рецептора эстрогена,
2) модулятора рецептора андрогена,
3) модулятора рецептора ретиноида,
4) цитотоксического агента,
5) антипролиферативного агента,
6) ингибитора пренилпротеинтрансферазы,
7) ингибитора HMG-CoA-редуктазы,
8) ингибитора ВИЧ-протеазы,
9) ингибитора обратной транскриптазы и
10) другого ингибитора развития кровеносных сосудов.
5. Композиция по п.4, где вторым соединением является другой ингибитор развития кровеносных сосудов, выбранный из группы, состоящей из ингибитора тирозинкиназы, ингибитора, полученного из эпидермы фактора роста, ингибитора, полученного из фибробластов фактора роста, ингибитора, полученного из тромбоцитов фактора роста, ингибитора MMP (матричной металлопротеазы), блокатора интегрина, интерферона-a , интерлейкина-12, пентозанполисульфата, ингибитора циклооксигеназы, карбоксиамидотриазола, комбретастатина A-4, скваламина, 6-O-(хлорацетилкарбонил)фумагиллола, талидомида, ангиостатина, тропонина-1 и антител к VEGF.
6. Композиция по п.4, где вторым соединением является модулятор рецептора эстрогена, выбранэыщ из тамоксифена и ралоксифена.
7. Применение соединения по п.1 для получения фармацевтической композиции для лечения или профилактики у млекопитающего заболевания или состояния, зависимого от тирозинкиназы, такого как рак, заболевания, которое включает развитие кровеносных сосудов, ретинальное новообразование кровеносных сосудов, диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна, воспалительное заболевание, заболевание, связанное с костной патологией.
8. Применение по п.7, где рак выбран из раковых заболеваний головного мозга, мочеполового тракта, лимфатической системы, желудка, гортани и легкого.
9. Применение по п.7, где рак выбран из гистиоцитарной лимфомы, адренокарциномы легких, мелкоклеточных раковых заболеваний легких, панкреатического рака, гиобластом и карциномы молочной железы.
10. Применение по п.7, где заболеванием, связанным с развитием кровеносных сосудов, является глазное заболевание.
11. Применение по п.7, где воспалительное заболевание выбрано из ревматоидного артрита, псориаза, контактного дерматита и аллергических реакций замедленного типа.
12. Применение по п.7, где заболевание, связанное с костной патологией, выбрано из остеосаркомы, остеоартрита и рахита, который включает введение терапевтически эффективного количества соединения по п.1.
13. Применение по пп.8 и 9, дополнительно предусматривающее радиационную терапию.
14. Применение по пп.8 и 9, дополнительно предусматривающее введение соединения, выбранного из
1) модулятора рецептора эстрогена,
2) модулятора рецептора андрогена,
3) модулятора рецептора ретиноида,
4) цитотоксического агента,
5) антипролиферативного агента,
6) ингибитора пренилпротеинтрансферазы,
7) ингибитора HMG-CoA-редуктазы,
8) ингибитора ВИЧ-протеазы,
9) ингибитора обратной транскриптазы и
10) другого ингибитора развития кровеносных сосудов.
15. Применение по пп.8 и 9, дополнительно предусматривающее комбинацию радиационной терапии и введение соединения, выбранного из
1) модулятора рецептора эстрогена,
2) модулятора рецептора андрогена,
3) модулятора рецептора ретиноида,
4) цитотоксического агента,
5) антипролиферативного агента,
6) ингибитора пренилпротеинтрансферазы,
7) ингибитора HMG-CoA-редуктазы,
8) ингибитора ВИЧ-протеазы,
9) ингибитора обратной транскриптазы и
10) другого ингибитора развития кровеносных сосудов.
16. Применение по пп.8 и 9, дополнительно предусматривающее введение паклитаксела или трастузумаба.
17. Применение по пп.8 и 9, дополнительно предусматривающее введение антагониста GPIIb/IIIa.
18. Применение по п.17, где антагонистом GPIIb/IIIa является тирофибан.
19. Применение соединения по п.1 для получения фармацевтической композиции для уменьшения или профилактики повреждения ткани после церебрального ишемического приступа.
Текст
005812 Данная заявка заявляет приоритет по 35 U.S.С.119(е) из предварительной заявки США 60/160356,зарегистрированной 19 октября 1999 г. Настоящее изобретение относится к соединениям, которые ингибируют, регулируют и/или модулируют трансдукцию сигнала тирозинкиназы, композициям, которые содержат данные соединения, и способам использования их для лечения тирозинкиназазависимых заболеваний и состояний, таких как развитие кровеносных сосудов, рак, рост опухоли, атеросклероз, связанная с возрастом дегенерация желтого пятна, диабетическая ретинопатия, воспалительные заболевания и тому подобное у млекопитающих. Тирозинкиназы являются классом ферментов, которые катализируют перенос концевого фосфата аденозинтрифосфата к остаткам тирозина в белковых субстратах. Считается, что тирозинкиназы посредством фосфорилирования субстрата играют важную роль в трансдукции сигнала для ряда клеточных функций. Хотя точный механизм трансдукции сигнала все еще является неясным, обнаружено, что тирозинкиназы являются важными факторами, способствующими пролиферации клеток, карциногенезу и дифференциации клеток. Тирозинкиназы можно классифицировать как тирозинкиназы рецепторного типа или нерецепторного типа. Тирозинкиназы рецепторного типа имеют внеклеточную, трансмембранную и внутриклеточную часть, тогда как тирозинкиназы нерецепторного типа являются полностью внутриклеточными. Тирозинкиназы рецепторного типа состоят из большого числа трансмебранных рецепторов с разной биологической активностью. Фактически, было идентифицировано приблизительно двадцать различных подсемейств тирозинкиназ рецепторного типа. Одно подсемейство тирозинкиназ, обозначенное как подсемейство HER, включает EGFR, HER2, HER3 и HER4. Лиганды данного подсемейства рецепторов включают эпителиальный фактор роста, TGF-, амфирегулин, HB-EGF, бетацеллулин и герегулин. Другим подсемейством указанных тирозинкиназ рецепторного типа является подсемейство инсулина, которое включает INS-R, IGF-IR и IR-R. Подсемейство PDGF включает PDGF и рецепторы, CSFIR, c-kit и FLK-II. Затем имеется семейство FLK, которое включает рецептор домена вставки киназы (KDR), киназу-1 фетальной печени (FLK-1), киназу-4 фетальной печени (FLK-4) и fms-подобную тирозинкиназу-1(flt-1). Семейства PDGF и FLK обычно рассматриваются вместе вследствие сходства данных двух групп. Для подробного обсуждения тирозинкиназ рецепторного типа см. публикацию Plowman et al., DNP 7(6):334-339, 1994, которая включается, таким образом, в качестве ссылки. Тирозинкиназы нерецепторного типа также включают многочисленные подсемейства, в том числеSrc, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack и LIMK. Каждое из указанных подсемейств далее подразделяется на различающиеся рецепторы. Например, подсемейство Src является одним из самых больших и включает Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr и Yrk. Подсемейство Src ферментов было связано с онкогенезом. Для более подробного обсуждения тирозинкиназ нерецепторного типа см. публикацию Bolen Oncogene, 8:2025-2031 (1993), которая, таким образом, включается в качестве ссылки. Тирозинкиназы как рецепторного типа, так и нерецепторного типа принимают участие в клеточных сигнальных путях, приводящих к различным патогенным состояниям, в том числе раку, псориазу и гипериммунным ответным реакциям. Было предположено, что несколько тирозинкиназ рецепторного типа и связанные с ними факторы роста играют роль в развитии кровеносных сосудов, хотя некоторые могут активировать развитие сосудов непрямым действием (Mustonen and Alitalo, J. Cell Biol. 129:895-898, 1995). Одной такой тирозинкиназой рецепторного типа является киназа-1 фетальной печени или FLK-1. Человеческим аналогом FLK-1 является содержащий домен вставки киназы рецептор KDR, который известен также в качестве рецептора 2 фактора роста васкулярных эндотелиальных клеток или VEGFR-2, поскольку он связывает VEGF с высоким сродством. Наконец, мышиная версия данного рецептора также была названа NYK (Oelrichs etal., Oncogene 8(1):11-15, 1993). VEGF и KDR являются парой лиганд-рецептор, которая играет огромную роль в пролиферации васкулярных эндотелиальных клеток и образовании и прорастании кровеносных сосудов, называемое образованием и развитием сосудов и развитием кровеносных сосудов соответственно. Развитие кровеносных сосудов характеризуется чрезмерной активностью васкулярного эндотелиального фактора роста (VEGF). VEGF фактически состоит из семейства лигандов (Klagsburn andD'Amore, Cytokine and Growth Factor Reviews 7:259-270, 1996). VEGR связывается с высоким сродством с транс-мембранным рецептором KDR тирозинкиназы и родственной fms-подобной тирозинкиназой-1,известной также как Flt-1, или рецептором 1 фактора роста васкулярных эндотелиальных клеток(VEGER-1). Эксперименты с клеточными культурами и нокаут-генами показывают, что каждый рецептор вносит вклад в различные аспекты развития кровеносных сосудов. KDR опосредует митогенную функцию VEGF, тогда как Fit-1, по-видимому, модулирует немитогенные функции, такие как функции,связанные с клеточной адгезией. Ингибирование KDR, таким образом, опосредует уровень митогенной активности VEGF. Фактически, было обнаружено, что рост опухоли является чувствительным к антиангиогенным действиям антагонистов рецептора VEGF (Kim et al., Nature 362, pp. 841-844, 1993). Твердые опухоли, следовательно, можно лечить ингибиторами тирозинкиназы, так как указанные опухоли зависят от развития кровеносных сосудов для образования кровеносных сосудов, необходимых-1 005812 для обеспечения их роста. Указанные твердые опухоли включают гистиоцитарную лимфому, раковые заболевания головного мозга, мочеполового пути, лимфатической системы, желудка, гортани и легких,включая аденокарциному легких и мелкоклеточный рак легких. Дополнительные примеры включают раковые заболевания, в которых наблюдается сверхэкспрессия или активация Raf-активирующих онкогенов (например, K-ras, erb-B). Такие раковые заболевания включают панкреатическую карциному и карциному молочной железы. В соответствии с этим, ингибиторы указанных тирозинкиназ являются полезными для профилактики и лечения пролиферативных заболеваний, зависящих от данных ферментов. Ангиогенная активность VEGF не ограничивается опухолями. VEGF является причиной большей части ангиогенной активности, индуцированной в сетчатке или около сетчатки при диабетической ретинопатии. Такой васкулярный рост в сетчатке приводит к визуальной дегенерации, достигая высшей точки при слепоте. мРНК и белок глазного VEGF увеличиваются из-за таких состояний, как окклюзия ретинальной вены у приматов и пониженные уровни рО 2 у мышей, которые приводят к образованию новых сосудов. Внутриглазные инъекции моноклональных антител против VEGF или иммунослияний рецептора VEGF ингибируют образование новых глазных сосудов на моделях как приматов, так и грызунов. Независимо от причины индуцирования VEGF у человека с диабетической ретинопатией, ингибирование глазного VEGF является полезным при лечении такого заболевания. Экспрессия VEGF также значительно повышается в гипоксических зонах опухолей животных и человека, соседних с областью некроза. VEGF также позитивно регулируется экспрессией онкогенов ras,raf, src и мутантного р 53 (все из которых имеют отношение к рассматриваемому раку). Моноклональные антитела против VEGF ингибируют рост опухолей человека у голых мышей. Хотя те же самые опухолевые клетки продолжают экспрессировать VEGF в культуре, антитела не уменьшают их митотический коэффициент. Таким образом, происходящий из опухоли VEGF не функционирует в качестве аутокринного митогенного фактора. Следовательно, VEGF содействует росту опухоли in vivo стимуляцией развития кровеносных сосудов посредством хемотактической и митогенной активности его паракринных васкулярных эндотелиальных клеток. Указанные моноклональные антитела ингибируют также в типичном случае рост раковых опухолей прямой кишки человека с менее значительным образованием кровеносных сосудов у мышей с атимией и уменьшают число опухолей, возникающих из инокулированных клеток. Вирусная экспрессия VEGF-связывающей конструкции Flk-1, Flt-1, гомолога рецептора мышиногоKDR, усеченного для исключения цитоплазматических доменов тирозинкиназы, но сохраняющего мембранный якорь, фактически устраняет рост трансплантируемой глиобластомы у мышей посредством доминантного негативного механизма образования гетеродимера трансмембранными рецепторами VEGF эндотелиальных клеток. Эмбриональные стволовые клетки, которые обычно растут в виде твердых опухолей у голых мышей, не продуцируют обнаруживаемые опухоли, если оба аллеля VEGF разрушаются. Взятые вместе, приведенные данные показывают роль VEGF в росте солидных опухолей. ИнгибированиеKDR или Flt-1 вовлекается в патологические развития кровеносных сосудов, и указанные рецепторы являются полезными при лечении заболеваний, в которых развитие кровеносных сосудов является частью общей патологии, например воспаления, диабетического ретинального новообразования кровеносных сосудов, а также различных форм рака, поскольку известно, что рост опухоли зависит от развития кровеносных сосудов (Weidner et al., N. Engl. J. Med., 324, pp. 1-8, 1991). В соответствии с этим идентификация небольших соединений, которые специфически ингибируют,регулируют и/или модулируют трансдукцию сигнала тирозинкиназ, желательна и является целью данного изобретения. Настоящее изобретение относится к соединениям, которые способны ингибировать, модулировать и/или регулировать трансдукцию сигнала тирозинкиназ как рецепторного типа, так и нерецепторного типа. Одно из воплощений настоящего изобретения иллюстрируется соединением формулы I и его фармацевтически приемлемыми солями и стереоизомерами Соединения настоящего изобретения являются полезными при ингибировании киназ и иллюстрируются соединением формулы I-2 005812 или его фармацевтически приемлемой солью или стереоизомером, где где Z представляет группуR4 выбран из 1) OC1-C6 алкилен-NR7R8,2) (С=O)аС 0-С 6 алкилен-Q, где Q представляет Н, ОН, СО 2 Н или OC1-C6 алкил,3) OC0-C6 алкиленгетероциклила, необязательно, замещенного заместителями от одного до трех,выбранными из R6a,4) С 0-С 6 aлкилeн-NR7R8,5) (C=O)NR7R8 и 6) OC1-C3 алкилен-(С=О)NR7R8;R6a выбран из 1) (С=O)rOs(C1-С 6)алкила, где r равно 0 или 1, и s имеет значение определенное выше,2) Or(C1-С 3)перфторалкила, где r равно 0 или 1,3) (C0-С 6)алкилен-S(O)mRa, где m равно 0, 1 или 2,4) оксо,5) ОН,6) галогена,7) CN,8) (С 2-С 6)алкенила,9) (С 2-С 6)алкинила,10) (C3-С 6)циклоалкила,11) (C0-С 6)алкиленарила,12) (C0-С 6)алкиленгетероциклила,13) (С 0-С 6)алкилен-N(Rb)2,14) C(O)Ra,15) (С 0-С 6)алкилен-СО 2Ra,16) С(О)Н и 17) (С 0-С 6)алкилен-СO2 Н,причем указанный алкил, алкенил, алкинил, циклоалкил, арил и гетероциклил, необязательно, замещен заместителями вплоть до трех, выбранными из Rb, ОН, (C1-С 6)алкокси, галогена, СО 2 Н, CN, O(C=O)C1-С 6 алкила, оксо и N(Rb)2; и R7 и R8, независимо, выбраны из 1) Н,2) (C=O)ObC1-С 6 алкила,3) (С=О)ОbC3-С 6 циклоалкила,4) (С=О)Оbарила,5) С (=O)Оbгетероциклила,6) C1-С 6 алкила,7) арила,8) C2-С 6 алкенила,9) C2-С 6 алкинила,10) гетероциклила,11) C3-С 6 циклоалкила,12) SO2Ra и 13) (C=O)NRb2,причем указанный алкил, циклоалкил, арил, гетероциклил, алкенил и алкинил, необязательно, замещен одним или несколькими заместителями, выбранными из R6a, илиR7 и R8 могут быть взяты вместе с азотом, к которому они присоединены, с образованием моноциклического или бициклического гетероцикла с 5-7 членами в каждом кольце, необязательно, содержащего, кроме азота, один или два дополнительных гетероатома, выбранных из N, О и S, причем указанный моноциклический или бициклический гетероцикл, необязательно, замещен одним или несколькими за-3 005812 местителями, выбранными из R6a. Ra представляет (C1-С 6)алкил, (C3-С 6)циклоалкил, арил или гетероциклил иRb представляет Н, (C1-С 6)алкил, арил, гетероциклил, (С 3-С 6)циклоалкил, (C=O)OC1-С 6 алкил,(C=O)C1-С 6 алкил или S(O)2Ra; причем указанный выше арил является любым стабильным моноциклическим или бициклическим углеродным кольцом, содержащим до 7 атомов углерода в каждом кольце, причем по крайней мере одно кольцо является ароматическим; и указанный выше гетероцикл является 5-10-членным ароматическим или неароматическим гетероциклом, содержащим от 1 до 4 гетероатомов, выбранных из О, N, S, и включает бициклические группы. Предпочтительным воплощением является соединение, выбранное из 3-5-[3-(4-метилпиперазин-1-ил)пропокси]-1 Н-индол-2-ил-1 Н-хинолин-2-она; 3-(5-2-[(2-метоксиэтил)амино]этокси-1 Н-индол-2-ил)-2(1 Н)-хинолинона; 3-[5-(2-(2-метоксиэтил)[(2-метокси-5-пиримидинил)метил]аминоэтокси)-1 Н-индол-2-ил]-2(1 Н)хинолинона; 3-(5-[(2S,4R)-4-метоксипирролидинил]метокси-1 Н-индол-2-ил)-2(1 Н)-хинолинона; 3-[5-2S,4R)-4-метокси-1-[(2-метил-5-пиримидинил)метил]пирролидинилметокси)-1 Н-индол-2 ил]-2(1 Н)-хинолинона; этилового эфира 1-(2-[2-(2-оксо-1,2-дигидро-3-хинолинил)-1 Н-индол-5-ил]оксиэтил)-4-пиперидинкарбоновой кислоты; 1-(2-[2-(2-оксо-1,2-дигидро-3-хинолинил)-1 Н-индол-5-ил]оксиэтил)-4-пиперидинкарбоновой кислоты; 3-[(2S,4R)-4-метокси-2-([2-(2-оксо-1,2-дигидро-3-хинолинил)-1 Н-индол-5-ил]оксиметил)пирролидинил]пропановой кислоты; 3-[5-(4-метансульфонилпиперазин-1-илметил)-1 Н-индол-2-ил]-1 Н-хинолин-2-она; 3-[5-(4-метансульфонил-1-оксипиперазин-1-илметил)-1 Н-индол-2-ил]-1 Н-хинолин-2-она; 3-[5-(4-ацетилпиперазин-1-илметил)-1 Н-индол-2-ил]-1 Н-хинолин-2-она;N-[2-(2-оксо-1,2-дигидро-3-хинолинил)-1 Н-индол-5-ил]метил-4-пиперидинкарбоксамида; 3-5-[1-(4-морфолинил)этил]-1 Н-индол-2-ил-2(1 Н)-хинолинона; 3-5-[1-(1-пирролидинил)этил]-1 Н-индол-2-ил-2(1 Н)-хинолинона; 3-5-[1-(4-ацетил-1-пиперазинил)этил]-1 Н-индол-2-ил-2(1 Н)-хинолинона; 3-(5-1-[4-(метилсульфонил)-1-пиперазинил]этил-1 Н-индол-2-ил)-2(1 Н)-хинолинона; 4-амино-N-[2-(2-оксо-1,2-дигидро-3-хинолинил)-1 Н-индол-5-ил]-1-пиперидинкарбоксамида и 4-амино-N-[2-(2-оксо-1,2-дигидро-3-хинолинил)-1 Н-индол-5-ил]метил-1-пиперидинкарбоксамида или его фармацевтически приемлемой соли или стереоизомера. В объем настоящего изобретения включена также фармацевтическая композиция, которая включает соединение формулы I, как описано выше, и фармацевтически приемлемый носитель. Настоящее изобретение включает также способ лечения или профилактики рака у млекопитающего, нуждающегося в таком лечении, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I. Предпочтительные раковые заболевания для лечения выбраны из раковых заболеваний молочной железы, мочеполовых путей, лимфатической системы, желудка, гортани и легких. Другой группой предпочтительных форм рака являются гистиоцитарная лимфома, адренокарцинома легких, мелкоклетчатые раковые заболевания легких, панкреатический рак, гиобластомы и карцинома молочной железы. Включено также применение соединений 1 для получения фармацевтической композиции для лечения или профилактики заболевания, в которое вовлекается развитие кровеносных сосудов, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. Таким заболеванием, в которое вовлекается развитие кровеносных сосудов,являются глазные болезни, такие как ретинальное новообразование кровеносных сосудов, диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна и тому подобное. В объем настоящего изобретения включено также применение соединений 1 для получения фармацевтической композиции для лечения или профилактики воспалительных заболеваний, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. Примерами таких воспалительных заболеваний являются ревматоидный артрит,псориаз, контактный дерматит, аллергические реакции замедленного типа и тому подобное.-4 005812 Включено также применение соединений 1 для получения фармацевтической композиции для лечения или профилактики зависимого от тирозинкиназы заболевания или состояния у млекопитающего,включающий введение пациенту-млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. Терапевтическое количество варьируется в соответствии с определенным заболеванием и определяется специалистом в данной области без излишнего экспериментирования. Лечение или профилактики ретинального новообразования кровеносных сосудов, который включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, также включен в объем настоящего изобретения. Применение соединений 1 для получения фармацевтической композиции для лечения или профилактики глазных болезней, таких как диабетическая ретинопатия и связанная с возрастом дегенерация желтого пятна, также являются частью изобретения. В объем настоящего изобретения включено также применение соединений 1 для получения фармацевтической композиции для лечения или профилактики воспалительных заболеваний,таких как ревматоидный артрит, псориаз, контактный дерматит и аллергические реакции замедленного типа, а также для лечения или профилактики заболеваний, связанных с костной патологией, выбранных из остеосаркомы, остеоартрита и рахита. Изобретение включает также использование заявленных соединений в комбинации со вторым соединением, выбранным из 1) модулятора рецептора эстрогена,2) модулятора рецептора андрогена,3) модулятора рецептора ретиноида,4) цитотоксического агента,5) антипролиферативного агента,6) ингибитора пренилпротеинтрансферазы,7) ингибитора HMG-CoA-редуктазы,8) ингибитора ВИЧ-протеазы,9) ингибитора обратной транскриптазы и 10) другого ингибитора развития кровеносных сосудов. Предпочтительные ингибиторы развития кровеносных сосудов выбраны из группы, состоящей из ингибитора тирозинкиназы, ингибитора полученного из эпидермы фактора роста, ингибитора полученного из фибробластов фактора роста, ингибитора полученного из тромбоцитов фактора роста, ингибитора ММР (матричной металлопротеазы), блокатора интегрина, интерферона-, интерлейкина-12, пентозанполисульфата, ингибитора циклооксигеназы, карбоксиамидотриазола, комбретастатина А-4, скваламина, 6-O-(хлорацетилкарбонил)фумагиллола, талидомида, ангиостатина, тропонина-1 и антител кVEGF. Предпочтительными модуляторами рецептора эстрогена являются тамоксифен и ралоксифен. В объем изобретения включено также применение соединений 1 для получения фармацевтической композиции для лечения рака, включающий введение терапевтически эффективного количества соединения формулы I в комбинации с радиационной терапией и/или в комбинации с соединением, выбранным из 1) модулятора рецептора эстрогена,2) модулятора рецептора андрогена,3) модулятора рецептора ретиноида,4) цитотоксического агента,5) антипролиферативного агента,6) ингибитора пренилпротеинтрансферазы,7) ингибитора HMG-CoA-редуктазы,8) ингибитора ВИЧ-протеазы,9) ингибитора обратной транскриптазы и 10) другого ингибитора развития кровеносных сосудов. Еще одним воплощением изобретения является применение соединений 1 для получения фармацевтической композиции для лечения рака, включающий введение терапевтически эффективного количества соединения формулы I в комбинации с паклитакселом или трастузумабом. В объем изобретения включенo также применение соединений 1 для получения фармацевтической композиции для ослабления или профилактики повреждения ткани после церебрального ишемического приступа, включающий введение терапевтически эффективного количества соединения формулы I. Эти и другие аспекты изобретения будут очевидны из содержащихся в нем постулатов."Зависимые от тирозинкиназы заболевания или состояния" относятся к патологическим состояниям, которые зависят от активности одной или нескольких тирозинкиназ. Тирозинкиназы либо непосредственно, либо опосредованно принимают участие в путях трансдукции сигнала различных клеточных активностей, включая пролиферацию, адгезию и миграцию, и дифференциацию. Заболевания, связанные с активностями тирозинкиназ, включают пролиферацию опухолевых клеток, патологическое образование новых сосудов, которое обеспечивает рост солидых опухолей, глазное образование новых сосудов(диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна и тому подобное) и воспаление (псориаз, ревматоидный артрит и тому подобное). Соединения настоящего изобретения могут иметь асимметричные центры, хиральные оси и хиральные плоскости (как описано в: E.L. Eliel and S.H. Wilen, Stereochemistry of Carbon Compounds, JohnWiley and Sons, New York, 1994, pages 1119-1190) и существуют в виде рацематов, рацемических смесей и в виде индивидуальных диастереомеров, причем в настоящее изобретение включены все возможные изомеры и их смеси, включая оптические изомеры. Кроме того, описанные в нем соединения могут существовать в виде таутомеров и обоих таутомерных форм и имеется в виду, что они включены в объем изобретения, даже если изображена только одна таутомерная структура. Например, подразумевается, что любое указание на приведенное ниже соединение А включает таутомерную структуру В и, наоборот, а также их смеси. Когда любой изменяющийся радикал (например, R4, R6, R6a и так далее) присутствует более чем один раз в любой составной части, ее определение в каждом случае не зависит от каждого другого случая. Кроме того, комбинации заместителей и изменяющихся радикалов являются допустимыми, только если такие комбинации приводят к стабильным соединениям. Линии, проведенные к циклическим системам от заместителей, указывают, что приведенная связь может быть присоединена к любому из способных замещаться атомов кольца. Если циклическая система является полициклической, имеется в виду, что связь присоединена к любому из подходящих атомов углерода только на проксимальном кольце. Понятно, что заместители и модели замещения в соединениях данного изобретения могут быть выбраны специалистом в данной области техники для получения соединений, которые являются химически стабильными и которые можно легко синтезировать способами, известными в данной области, а также способами, приведенными ниже, из легко доступных исходных материалов. Если заместитель сам замещен более чем одной группой, должно быть понятно, что несколько упомянутых групп могут быть на одном и том же углероде или разных углеродах, пока получается стабильная структура. Фраза "необязательно замещенный одним или несколькими заместителями" должна быть использована так, чтобы быть эквивалентной фразе "необязательно замещенный по меньшей мере одним заместителем", в таких случаях предпочтительное воплощение будет иметь от нуля до трех заместителей. Имеется в виду, что используемый здесь термин "алкил" включает насыщенные алифатические углеводородные группы как с разветвленной, так и неразветвленной цепью, имеющие определенное число атомов углерода. Например, установлено, что C1-С 10, как в "C1-С 10 алкиле", включает группы, имеющие 1,2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода в неразветвленной или разветвленной структуре. Например,"C1-С 10 алкил" конкретно включает метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил,пентил, гексил, гептил, октил, нонил, децил и так далее. Термин "циклоалкил" означает моноциклическую насыщенную алифатическую углеводородную группу, имеющую определенное число атомов углерода. Например, "циклоалкил" включает циклопропил, метилциклопропил, 2,2-диметилциклобутил, 2 этилциклопентил, циклогексил и так далее."Алкокси" представляет либо циклическую, либо нециклическую алкильную группу с указанным числом атомов углерода, присоединенную через кислородный мостик. "Алкокси", следовательно, включает определения вышеуказанного алкила и циклоалкила. Если число атомов углерода не указывается, термин "алкенил" относится к неароматическому углеводородному радикалу, неразветвленному, разветвленному или циклическому, содержащему от 2 до 10 атомов углерода и по меньшей мере одну углерод-углеродную двойную связь. Предпочтительно присутствует одна углерод-углеродная двойная связь, но могут присутствовать вплоть до четырех неароматических углерод-углеродных двойных связей. Таким образом, "C2-С 6 алкенил" означает алкенильный радикал, имеющий от 2 до 6 атомов углерода. Алкенильные группы включают этенил, пропенил, бутенил, 2 метилбутенил и циклогексенил. Неразветвленная, разветвленная или циклическая часть алкенильной группы может содержать двойную связь и может быть замещенной, если указывается замещенная алкенильная группа. Термин "алкинил относится к углеводородному радикалу, неразветвленному, разветвленному или циклическому, содержащему от 2 до 10 атомов углерода и по меньшей мере одну углерод-углеродную тройную связь. Могут присутствовать вплоть до трех углерод-углеродных тройных связей. Таким образом, "С 2-С 6 алкинил" означает алкинильный радикал, имеющий от 2 до 6 атомов углерода. Алкинильные группы включают этинил, пропинил, бутинил, 3-метилбутинил и так далее. Неразветвленная, разветвленная или циклическая часть алкинильной группы может содержать тройные связи и может быть замещенной, если указывается замещенная алкинильная группа.-6 005812 В некоторых случаях заместители могут быть определены в диапазоне углеродов, которые включают нуль, такие как (C0-С 6)алкиленарил. Если принимается, что арил представляет фенил, то данное определение должно включать сам фенил, а также -CH2Ph, -СН 2 СН 2 Рh, СН(СН 3)СН 2 СН(СН 3)Ph и так далее. Имеется в виду, что используемый здесь "арил" означает любое стабильное моноциклическое или бициклическое углеродное кольцо, содержащее вплоть до 7 атомов в каждом кольце, где по меньшей мере одно кольцо является ароматическим. Примеры таких арильных элементов включают фенил, нафтил, тетрагидронафтил, инданил, бифенил, фенантрил, антрил и аценафтил. В случаях, когда арильный заместитель является бициклическим и одно кольцо является неароматическим, понятно, что присоединение происходит через ароматическое кольцо. Термин "гетероарил", используемый здесь, представляет стабильное моноциклическое или бициклическое кольцо с атомами углерода в каждом кольце вплоть до 7 атомов, где по меньшей мере одно кольцо является ароматическим и содержит от 1 до 4 гетероатомов, выбранных из группы, состоящей из О, N и S. Гетероарильные группы в объеме данного определения включают, но не ограничиваются ими,акридинил, карбазолил, циннолинил, хиноксалинил, пиразолил, индолил, бензотриазолил, фуранил, тиенил, бензотиенил, бензофуранил, хинолинил, изохинолинил, оксазолил, изоксазолил, индолил, пиразинил, пиридазинил, пиридинил, пиримидинил, пирролил, тетрагидрохинолин. Понятно также, что как в случае приведенного ниже определения гетероцикла, "гетероарил" включает также N-оксидное производное любого азотсодержащего гетероарила. В случаях, когда гетероарильный заместитель является бициклическим и одно кольцо является неароматическим или не содержит гетероатомы, понятно, что присоединение происходит через ароматическое кольцо или через кольцо, содержащее гетероатом соответственно. Имеется в виду, что, как принято специалистами в данной области, термин "галоген", используемый здесь, включает хлор, фтор, бром и иод. Имеется в виду, что термин "гетероцикл" или "гетероциклил", используемый здесь, означает 5-10-членный ароматический или неароматический гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, состоящей из О, N и S, и включает бициклические группы. "Гетероциклил", следовательно, включает вышеуказанные гетероарилы, а также их дигидро- и тетрагидроаналоги. Следующие примеры "гетероциклила" включают, но не ограничиваются следующими гетероциклилами: бензоимидазолил, бензофуранил, бензофуразанил, бензопиразолил, бензотриазолил, бензотиофенил, бензоксазолил, карбазолил, карболинил, циннолинил, фуранил, имидазолил,индолинил, индолил, индолазинил, индазолил, изобензофуранил, изоиндолил, изохинолил, изотиазолил,изоксазолил, нафтпиридинил, оксадиазолил, оксазолил, оксазолин, изоксазолин, оксетанил, пиранил,пиразинил, пиразолил, пиридазинил, пиридопиридинил, пиридазинил, пиридил, пиримидил, пирролил,хиназолинил, хинолил, хиноксалинил, тетрагидропиранил, тетразолил, тетразолопиридил, тиадиазолил,тиазолил, тиенил, триазолил, азетидинил, 1,4-диоксанил, гексагидроазепинил, пиперазинил, пиперидинил, пирролидинил, морфолинил, тиоморфолинил, дигидробензоимидазолил, дигидробензофуранил, дигидробензотиофенил, дигидробензоксазолил, дигидрофуранил, дигидроимидазолил, дигидроиндолил,дигидроизооксазолил, дигидроизотиазолил, дигидрооксадиазолил, дигидрооксазолил, дигидропиразинил, дигидропиразолил, дигидропиридинил, дигидропиримидинил, дигидропирролил, дигидрохинолинил, дигидротетразолил, дигидротиадиазолил, дигидротиазолил, дигидротиенил, дигидротриазолил, дигидроазетидинил, метилендиоксибензоил, тетрагидрофуранил и тетрагидротиенил и их N-оксиды. Присоединение гетероциклильного заместителя может осуществляться через атом углерода или через гетероатом. Алкильные, алкенильные, алкинильные, циклоалкильные, арильные, гетероарильные и гетероциклильные заместители могут быть замещенными или незамещенными, если не указано конкретно иное. Например, (С 1-С 6)алкил может быть замещен одним, двумя или тремя заместителями, выбранными из ОН, оксо, галогена, алкокси, диалкиламино или гетероциклила, такого как морфолинил, пиперидинил и так далее. В этом случае, если одним заместителем является оксо и другим является ОН, в определение включены следующие группы: -(С=O)СН 2 СН(ОН)СН 3, -(С=О)ОН, -СН(ОН)СН 2 СН(О) и так далее. Фармацевтически приемлемые соли соединений данного изобретения включают общепринятые нетоксичные соли соединений данного изобретения, образуемые неорганическими или органическими кислотами. Общепринятые нетоксичные соли включают, например, соли, полученные из неорганических кислот, таких как хлористо-водородная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и тому подобное, а также соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памоевая,малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая, трифторуксусная и тому подобное. В некоторых случаях R7 и R8 имеют такие значения, что они могут быть взяты вместе с азотом, к которому они присоединены, с образованием моноциклического или бициклического гетероцикла с 5-7 членами в каждом кольце, необязательно, содержащего, кроме азота, один или два дополнительных гетероатома, выбранных из N, О и S, причем указанный гетероцикл, необязательно, замещен одним или несколькими заместителями, выбранными из R6a. Примеры гетероциклов, которые, таким образом, могут-7 005812 быть образованы, включают, но не ограничиваются следующими гетероциклами, принимая во внимание,что гетероцикл, необязательно, замещен одним или несколькими заместителями, выбранными из R6a: Предпочтительно R1 представляет Н. Предпочтительным является также определение R2 и R3 как Н. Предпочтительно R5 представляет Н. Предпочтительными гетероциклильными заместителями являются заместители, показанные только что, плюс пиридин, пиримидин, пиразин, пиридазин, тетраметиленсульфон, бутиролактон, тетрагидрофуран, фуран, индол и тиофен. Предпочтительно t равно 1 и R4 является заместителем в 5 положении индола в соответствии со следующей схемой нумерации: Предпочтительно R4 представляет OС 1-С 6 алкиленNR7R8, (С=О)аС 0-С 6 алкилен-Q, где Q представляет Н, ОН, СО 2 Н или OС 1-С 6 алкил, ОС 0-С 6 алкиленгетероциклил, необязательно, замещенный заместителями от одного до трех, выбранных из R6a, С 0-С 6 алкиленNR7R8, (C=O)NR7R8 или OC1-C3 алкилен (С=О)NR7R8. Очень предпочтительно R4 представляет C1-С 3aлкилeнNR7R8. Предпочтительно R7 и R8 имеют такое значение, что они должны быть взяты вместе с азотом, к которому они присоединены, с образованием моноциклического 5-7-членного гетероцикла, необязательно, содержащего, кроме азота, один или два дополнительных гетероатомов, выбранных из N, О и S, причем указанный гетероцикл, необязательно, замещен одним или несколькими заместителями, выбранными из R6a. Фармацевтически приемлемые соли соединений настоящего изобретения можно синтезировать из соединений настоящего изобретения, которые содержат основную или кислотную часть, общепринятыми химическими способами. Обычно соли основных соединений получают либо ионообменной хроматографией, либо взаимодействием свободного основания со стехиометрическими количествами или с избытком требуемой солеобразующей неорганической или органической кислоты в подходящем растворителе или различных комбинациях растворителей. Аналогично этому, соли кислотных соединений получают взаимодействием с подходящим неорганическим или органическим основанием. Соединения настоящего изобретения можно получить посредством реакций, показанных на следующих схемах, в добавление к другим стандартным манипуляциям, которые известны в литературе или указаны в качестве примеров в экспериментальных процедурах. Эти схемы, следовательно, не ограничиваются перечисленными соединениями или любыми конкретными заместителями, используемыми для иллюстративных целей. Нумерация заместителя, как показано на схемах, не обязательно коррелирует с нумерацией, использованной в формуле изобретения.-8 005812 Схемы Как показано на схеме А, хинолиновый реагент А-2 можно синтезировать известными методиками,указанными в Marsais, F.; Godard, A.; Queguiner, G.J. Heterocyclic Chem. 1989, 26, 1589-1594. Производные с изменяющимся замещением можно получить посредством модификации данной процедуры и использования стандартных синтетических протоколов, известных в данной области. Кроме того, на схеме 1 показано получение индольного промежуточного продукта А-6. Схема В иллюстрирует один возможный протокол для сочетания индольного и хинолонового промежуточных продуктов для получения требуемых соединений. Схема С иллюстрирует один возможный синтетический путь для синтеза соединения настоящего изобретения, 3-(5-метокси-1 Н-пирроло[2,3c]пиридин-2-ил)-1 Н-хинолин-2-она, с-6. Схема D показывает синтез иоднафтиридинов и иодпиридопиридинов. Образовавшиеся подсоединения можно сочетать с подходящей индолбороновой кислотой, как указано в других схемах, для получения требуемого продукта. Исходные хлорсоединения можно получить по способу, указанному D.J. Полезность Настоящие соединения можно использовать в качестве фармацевтических агентов для млекопитающих, особенно для людей, при лечении заболеваний, зависимых от тирозинкиназ. Такие заболевания включают пролиферацию опухолевых клеток, патологическое образование новых сосудов (или развитие кровеносных сосудов), которые способствуют росту солидных опухолей, образование новых глазных сосудов (диабетическая ретинопатия, связанная с возрастом дегенерация желтого пятна и тому подобное) и воспаление (псориаз, ревматоидный артрит и тому подобное). Соединения данного изобретения можно вводить пациентам для использования при лечении рака. Настоящие соединения ингибируют развитие кровеносных сосудов опухолей, тем самым воздействуя на рост опухолей (J. Rak et al. Cancer Research, 55:4575-4580, 1995). Способность данных соединений действовать против развития кровеносных сосудов является также пригодной при лечении некоторых форм слепоты, связанных с ретинальным новообразованием кровеносных сосудов. Описанные соединения являются также пригодными при лечении некоторых заболеваний, связанных с костной патологией, таких как остеокарцинома, остеоаритрит и рахиты, известные также в качестве онкогенной остеомаляции. (Hasegawa et al., Skeletal Radiol., 28, pp. 41-45, 1999; Gerber et al., NatureMedicine, Vol. 5,6, pp. 623-628, June 1999). И поскольку VEGF непосредственно стимулирует резорбцию остеокластических костей посредством KDR/Flk-1, экспрессированных в зрелых остеокластах(FEBS Let. 473:161-164 (2000); Endocrinology, 141:1667 (2000, настоящие соединения являются также полезными при лечении и профилактике состояний, относящихся к резорбции костей, таких как остеопороз и болезнь Педжета. Заявленные соединения можно также использовать для ослабления или предотвращения повреждения ткани, которое имеет место после случаев церебральной ишемии, таких как удар, снижением церебрального отека, повреждения ткани и реперфузионного повреждения после ишемии (Drug News Perspect 11: 265-270 (1998); J. Clin. Invest. 104:1613-1620 (1999. Соединения данного изобретения можно вводить млекопитающим, предпочтительно людям, либо отдельно, либо, что предпочтительно, в комбинации с фармацевтически приемлемыми носителями или разбавителями, необязательно, с известными адъювантами, такими как квасцы, в фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Соединения можно вводить перорально или парентерально, включая внутривенный, внутримышечный, внутрибрюшинный, подкожный, ректальный и местный пути введения. Для перорального использования химиотерапевтического соединения по данному изобретению соединение можно ввести, например, в форме таблеток или капсул или в виде водного раствора или суспензии. В случае таблеток для перорального использования носители, которые обычно используют,включают лактозу и кукурузный крахмал и обычно добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул пригодные разбавители включают лактозу и высушенный кукурузный крахмал. Когда для перорального использования требуются водные суспензии, активный ингредиент смешивают с эмульгирующими и суспендирующими агентами. При желании можно добавить некоторые подслащивающие агенты и/или корригенты. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного использования обычно получают стерильные растворы активного ингредиента, и рН растворов следует регулировать подходящим образом и растворы нужно забуферить.- 11005812 Для внутривенного введения общую концентрацию растворенных веществ следует регулировать, чтобы сделать препарат изотоническим. Соединения настоящего изобретения можно также вводить совместно с другими хорошо известными терапевтическими агентами, которые выбирают по их конкретной пригодности против подвергаемого лечению состояния. Например, в случае связанных с костным нарушением, комбинации, которые будут пригодными, включают комбинации с антирезорбционными бисфосфонатами, такими как алендронат и ризедронат; блокаторами интегрина (дальнейшие определения даны ниже), такими как 3-антагонисты; конъюгированными эстрогенами, используемыми в гормональной заместительной терапии, такими как PREMPRO, PREMARIN и ENDOMETRION; селективными модуляторами рецептора эстрогена (SERMs), такими как ралоксифен, дролоксифен, СР-336156 (Pfizer) и лазофоксифен; ингибиторами катепсина К и ингибиторами АТФ-протонных насосов. Настоящие соединения пригодны также в комбинации с известными противораковыми агентами. Такие известные противораковые агенты включают следующие агенты: модуляторы рецептора эстрогена, модуляторы рецептора андрогена, модуляторы рецептора ретиноидов, цитотоксические агенты, антипролиферативные агенты, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-CoA-редуктазы,ингибиторы ВИЧ-протеазы, ингибиторы обратной транскриптазы и другие ингибиторы развития кровеносных сосудов."Модуляторы рецептора эстрогена" относятся к соединениям, которые препятствуют связыванию эстрогена с рецептором или ингибируют такое связывание независимо от механизма. Примеры модуляторов рецептора эстрогена включают, но не ограничиваются ими, тамоксифен, ралоксифен, идоксифен,LY353381, LY117081, торемифен, фульвестрант, 4-[7-(2,2-диметил-1-оксопропокси-4-метил-2-[4-[2-(1 пиперидинил)этокси]фенил]-2 Н-1-бензопиран-3-ил]фенил-2,2-диметилпропаноат, 2,4-динитрофенилгидразон 4,4'-дигидроксибензофенона и SH646."Модуляторы рецептора андрогена" относятся к соединениям, которые препятствуют связыванию андрогена с рецептором или ингибируют такое связывание независимо от механизма. Примеры модуляторов рецептора андрогена включают финастерид и другие ингибиторы 5-редуктазы, нилутамид, флутамид, бикалутамид, лиарозол и абиратеронацетат."Модуляторы рецептора ретиноидов относится к соединениям, которые препятствуют связыванию ретиноидов с рецептором или ингибируют такое связывание независимо от механизма. Примеры таких модуляторов рецептора ретиноидов включают бексаротен, третиноин, 13-цис-ретиноевую кислоту, 9 цис-ретиноевую кислоту, -дифторметилорнитин, ILX23-7553, транс-N-(4'-гидроксифенил)ретинамид,N-4-карбоксифенилретинамид."Цитотоксические агенты" относятся к соединениям, которые вызывают гибель клеток, главным образом, препятствием непосредственно функционированию клеток или ингибируют клеточный миоз или препятствуют клеточному миозу, включая алкилирующие агенты, факторы некроза опухолей, интеркалаторы, ингибиторы микротубулина и ингибиторы топоизомеразы. Примеры цитотоксических агентов включают, но не ограничиваются ими, тирапазимин, сертенеф,кахектин, ифозфамид, тазонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдульцит,ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин, импросульфан тозилат, трофосфамид, нимустин, диброспидий хлорид, пумитера, лобаплатин, сатраплатин,профиромицин, цисплатин, ирофульвен, дексифосфамид, цис-аминдихлор(2-метилпиридин)платина,бензилгуанин, глюфосфамид, GPX100, (транс, транс, транс)-бис-мю-(гексан-1,6-диамин)-мю(диаминплатина(II)]бис[диамин(хлор)платина(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, бисантрен,митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-деамино-3'морфолино-13-деоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755 и 4 деметокси-3-деамино-3-азиридинил-4-метилсульфонилдаунорубицин. Примеры ингибиторов микротубулина включают паклитаксел, виндезинсульфат, 3',4'-дидегидро-4'деокси-8'-норвинкалеукобластин, доцетаксол, ризоксин, доластатин, мивобулин изетионат, ауристатин,цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4 метоксифенил)бензолсульфонамид, ангидровинбластин, трет-бутиламид N,N-диметил-L-валил-L-валилN-метил-L-валил-L-пролил-L-пролина, TDX258 и BMS188797. Некоторыми примерами ингибиторов топоизомеразы являются топотекан, гикаптамин, тринотекан,рубитекан, 6-этоксипропионил-3',4'-О-экзо-бензилиденхартреузин, 9-метокси-N,N-диметил-5-нитропиразоло[3,4,5-kl]акридин-2(6 Н)пропанамин,1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил 1 Н,12 Н-бензо[de]пирано-[3',4':b,7]индолизино[1,2b]хинолин-10,13(9 Н,15 Н)дион, луртотекан, 7-[2-(Nизопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942, этопозидфосфат,тенипозид, собузоксан, 2'-диметиламино-2'-деоксиэтопозид, GL331, N-[2-(диметиламино)этил]-9 гидрокси-5,6-диметил-6 Н-пиридо[4,3-b]-карбазол-1-карбоксамид, азулакрин, (5 а,5ab,8 аа,9b)-9-[2-[N-[2(диметиламино)этил]-N-метиламино]этил]-5-[4-гидрокси-3,5-диметоксифенил]-5,5 а,6,8,8 а,9-гексагидрофуро(3',4':6,7)нафто-2,3-d)-1,3-диоксол-6-он,2,3-(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо"Антипролиферативные агенты" включают также моноклональные антитела к факторам роста другие, чем антипролиферативные агенты, перечисленные как "ингибиторы развития кровеносных сосудов",такие как трастузумаб и гены-супрессоры опухолей, такие как р 53, которые можно получить посредством переноса опосредованного рекомбинантным вирусом гена (см., например, патент США 6069134). Ингибиторы "HMG-CoA-редуктазы" относятся к ингибиторам 3-гидрокси-3-метилглутарил-СоАредуктазы. Соединения, которые обладают ингибирующей активностью для HMG-CoA-редуктазы, можно легко идентифицировать посредством использования анализов, хорошо известных в данной области. См., например, анализы, описанные или цитированные в патенте США 4231938, столбец 6, и WO 84/02131 на pp. 30-33. Термины "HMG-CoA-редуктазы ингибитор" и "ингибитор HMG-CoA-редуктазы" имеют одинаковое значения, когда их используют здесь. Примеры ингибиторов HMG-CoA-редуктазы, которые можно использовать, включают, но не ограничиваются ими, ловастатин (MEVACOR; см. патенты США 4231938; 4294926; 4319039), симвастатин (ZOCOR; см. патенты США 4444784; 4820850; 4916239), правастатин (PRAVACHOL; см. патенты 4346227; 4537859; 4410629; 5030447 и 5180589), флувастатин (LESCOL; см. патенты США 5354772, 4911165; 4929437; 5189164, 5118853, 5290946; 5356896), аторвастатин (LIPITOR; см. патенты США 5273995; 4681893; 5489691; 5342952) и церивастатин (известный также как ривастатин и BAYCHOL; см. патент США 5177080). Структурные формулы указанных и дополнительных ингибиторов HMG-CoA-редуктазы, которые можно использовать в настоящих способах, описаны на стр. 87 публикации М. Yalpani, "Cholesterol Lowering Drugs", Chemistry and Industry, pp. 85-89 (5 February 1996) и патентах США 4782084 и 4885314. Термин ингибитор HMG-CoA-редуктазы, используемый здесь, включает все фармацевтически приемлемые формы лактонов и соответствующих им кислот, образованных размыканием кольца (т.е. где кольцо лактона размыкается с образованием свободной кислоты),а также формы солей и эфиров соединений, которые обладают ингибирующей активностью для HMGCoA-редуктазы, и, следовательно, использование таких солей, эфиров, кислот, образованных размыканием кольца, и лактонов включается в объем настоящего изобретения. Иллюстрация лактоновой части и соответствующей ей формы кислоты, образованной размыканием кольца, приводится ниже как структуры I и II. В ингибиторах HMG-CoA-редуктазы, где может существовать форма кислоты, образованной размыканием кольца, соли и эфиры можно предпочтительно получить из кислоты, образованной размыканием кольца, и все такие формы включены в значение используемого здесь термина "ингибитор HMGCoA-редуктазы". Ингибитор HMG-CoA-редуктазы предпочтительно выбран из ловастатина и симвастатина, очень предпочтительным является симвастатин. Здесь термин "фармацевтически приемлемые соли" в отношении ингибитора HMG-CoA-редуктазы будет означать нетоксичные соли соединений, используемых в данном изобретении, которые обычно получают взаимодействием свободной кислоты с- 13005812 подходящим органическим или неорганическим основанием, особенно основаниями, образованными из таких катионов, как натрий, калий, алюминий, кальций, литий, магний, цинк и тетраметиламмоний, а также такие соли, образованные из аминов, таких как аммоний, этилендиамин, N-метилглюкамин, лизин,аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенетиламин, 1-п-хлорбензил-2-пирролидин-1'-илметилбензимидазол, диэтиламин, пиперазин и трис(гидроксиметил)аминометан. Следующие примеры солей ингибиторов HMG-CoA-редуктазы могут включать, но не ограничиваются ими, ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальцийэдетат, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид,эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изотионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат,памоат, пальмитат, пантотенат, фосфат/дифосат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид и валерат. Сложноэфирные производные описанных соединений, являющихся ингибиторами HMG-CoAредуктазы, могут действовать в качестве пролекарств, которые при абсорбции в кровоток теплокровного животного могут расщепляться таким образом, чтобы высвободить лекарственное средство, что позволяет лекарственному средству повысить терапевтическую эффективность."Ингибитор пренилпротеинтрансферазы" относится к соединению, которое ингибирует любой один или любую комбинацию ферментов тренилпротеинтрансфераз, включая фарнезилпротеин-трансферазу(FPTaзa), тип I геранилгеранилпротеинтрансферазы (GGPTaзa-I) и тип II геранилгеранилпротеинтрансферазы (GGPTaзa-II, называемая также Rab GGPTaзой). Примеры ингибирующих пренилпротеинтрансферазу соединений включают -6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)хинолинон,(-)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3 хлорфенил)-1-метил-2(1 Н)-хинолинон, (+)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)-метил]-4(3-хлорфенил)-1-метил-2(1 Н)-хинолинон,5(S)-н-бутил-1-(2,3-диметил-фенил)-4-[1-(4-цианобензил)-5 имидазолилметил]-2-пиперазинон, (S)-1-(3-хлорфенил)-4-[1-(4-цианобензил)-5-имидазолилметил]-5-[2(этансульфонил)метил]-2-пиперазинон, 5(S)-н-бутил-1-(2-метил-фенил)-4-[1-(4-цианобензил)-5-имидазолилметил]-2-пиперазинон,1-(3-хлорфенил)-4-[1-(4-цианобензил)-2-метил-5-имидазолилметил]-2 пиперазинон,1-(2,2-дифенилэтил)-3-[N-(1-(4-цианобензил)-1 Н-имидазол-5-илэтил)карбамоил]пиперидин,4-5-[4-гидроксиметил-4-(4-хлорпиридин-2-илметил)пиперидин-1-илметил]-2-метилимидазол-1 илметилбензонитрил, 4-5-[4-гидроксиметил-4-(3-хлорбензил)пиперидин-1-илметил]-2-метилимидазол 1-илметилбензонитрил,4-3-[4-(2-оксо-2 Н-пиридин-1-ил)бензил]-3 Н-имидазол-4-илметилбензонитрил, 4-3-[4-(5-хлор-2-оксо-2 Н-[1,2']бипиридин-5'-илметил]-3 Н-имидазол-4-илметилбензонитрил, 43-[4-(2-оксо-2 Н-[1,2']бипиридин-5'-илметил]-3 Н-имидазол-4-илметилбензонитрил,4-[3-(2-оксо-1 фенил-1,2-дигидропиридин-4-илметил)-3 Н-имидазол-4-илметил]бензонитрил,18,19-дигидро-19-оксо 5 Н,17 Н-6,10:12,16-диметено-1 Н-имидазо[4,3-c][1,11,4]диоксаазациклононадецин-9-карбонитрил,19,20-дигидро-19-оксо-5 Н-18,21-этано-12,14-этено-6,10-метено-22 Н-бензо[d]имидазо[4,3-k]-[1,6,9,12] оксатриазациклооктадецин-9-карбонитрил,19,20-дигидро-19-оксо-5 Н,17 Н-18,21-этано-6,10:12,16-диметено-22 Н-имидазо[3,4-h][1,8,11,14]оксатриазациклоэйкозин-9-карбонитрил и -19,20-дигидро-3 метил-19-оксо-5 Н-18,21-этано-12,14-зтено-6,10-метено-22 Н-бензо[d]имидазо[4,3-k][1,6,9,12]оксатриазациклооктадецин-9-карбонитрил. Другие примеры ингибиторов пренилпротеинтрансферазы можно найти в следующих публикациях и патентах: W0 96/30343, WO 97/18813, WO 97/21701, W0 97/23478, WO 97/38665, WO 98/28980, WO 98/29119, WO 95/32987, патенте США 5420245, патенте США 5523430, патенте США 5532359,патенте США 5510510, патенте США 5589485, патенте США 5602098, публикации Европейского патента 0618221, публикации Европейского патента 0675112, публикации Европейского патента 0604181, публикации Европейского патента 0696593, WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572, W0 95/10514, патенте США 5,661,152, WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535, WO 95/25086, WO 96/05529, WO 96/06138, WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456, WO 96/22278, WO 96/24611, WO 96/24612, WO 96/05168, WO 96/05169, WO 96/00736, патенте США 5,571,792, WO 96/17861, WO 96/33159, WO 96/34850, W0 96/34851, WO 96/30017, WO 96/30018, WO 96/30362, WO 96/30363, W0 96/31111, WO 96/31477, WO 96/31478, WO 96/31501, WO 97/00252, W0 97/03047, WO 97/03050, WO 97/04785, W0 97/02920, WO 97/17070, WO 97/23478, W0 97/26246, WO 97/30053, WO 97/44350, WO 98/02436, и патенте США 5532359. Роль ингибитора пренилпротеинтрансферазы в развитии кровеносных сосудов см., например, в European J. ofCancer, Vol. 35,9, pp. 1394-1401 (1999). Примеры ингибиторов ВИЧ-протеазы включают ампренавир, абакавир, CGP-73547, CGP-61755,DMP-450, индинавир, нелфинавир, типранавир, ритонавир, сакуинавир, АВТ-378, AG 1776 и BMS232632. Примеры ингибиторов обратной транскриптазы включают делавиридин, эфавиренц, GS-840, HB"Ингибиторы развития кровеносных сосудов" относятся к соединениям, которые ингибируют образование новых кровеносных сосудов независимо от механизма. Примеры ингибиторов развития крове- 14005812 носных сосудов включают, но не ограничиваются ими, ингибиторы тирозинкиназы, такие как ингибиторы рецепторов Flt-1 (VEGFR1) и Flk-1/KDR (VEGFR20) тирозинкиназы, ингибиторы выделенных из эпидермы, выделенных из фибробластов или выделенных из тромбоцитов факторов роста, ингибиторы ММР (матричной металлопротеазы), блокаторы интегрина, интерферон-, интерлейкин-12, пентозанполисульфат, ингибиторы циклооксигеназы, включая нестероидные противовоспалительные средства(NSAIDs), подобные аспирину и ибупрофену, а также селективные ингибиторы циклооксигеназы-2, подобные целекоксибу и рофекоксибу (PNAS, Vol. 89, р. 7384 (1992); JNCI, Vol. 69, р. 475 (1982); Arch.II (см. Fernandez et al., J. Lab. Clin. Med. 105:141-145 (1985 и антитела к VEGF (см. Nature Biotechnology,Vol. 17, pp. 963-968 (October 1999); Kim et al., Nature, 362, 841-844 (1993. Другие примеры ингибиторов развития кровеносных сосудов включают, но не ограничиваются ими, эндостатин, украин, ранпирназу, IM862, 5-метокси-4-[2-метил-3-(3-метил-2-бутенил)оксиранил]-1 оксаспиро[2,5]окт-6-ил(хлорацетил)карбамат, ацетилдинаналин, 5-амино-1-3,5-дихлор-4-(4-хлорбензоил)фенил]метил]-1 Н-1,2,3-триазол-4-карбоксамид, СМ 101, скваламид, комбрет-астатин, RPI4610,NX31838, сульфатированный фосфат маннопентаозы, 7,7-(карбонилбис[имино-N-метил-4,2-пирролокарбонилимино[N-метил-4,2-пиррол]карбонилимино]бис-(1,3-нафталиндисульфонат) и 3-[(2,4-диметилпиррол-5-ил)метилен]-2-индолинон (SU5416). Используемые выше "блокаторы интегрина" относятся к соединениям, которые селективно создают антагонизм, ингибируют или противодействуют связыванию физиологического лиганда с v3 интегрином, к соединениям, которые селективно создают антагонизм, ингибируют или противодействуют связыванию физиологического лиганда с v5-интегрином, к соединениям, которые создают антагонизм, ингибируют или противодействуют связыванию физиологического лиганда как с v3-интегрином,так и v5-интегрином, и к соединениям, которые создают антагонизм, ингибируют или противодействуют активности конкретного интегрина(ов), экспрессированного на эндотелиальных клетках капилляров. Термин относится также к антагонистам интегринов v6, v8, 11, 21, 51, 61 и 64. Термин относится также к антагонистам любой комбинации интегринов v3, v5, v6, v8, 11, 21, 51,61 и 64. Некоторые определенные примеры ингибиторов тирозинкиназы включают N-(трифторметилфенил)-5-метилизоксазол-4-карбоксамид, 3-[(2,4-диметилпиррол-5-ил)метилиденил)индолин-2-он,17-(аллиламино)-17-деметоксигелданамицин,4-(3-хлор-4-фторфениламино)-7-метокси-6-[3-(4-морфолинил)пропокси]хиназолин, N-(3-этинилфенил)-6,7-бис-(2-метоксиэтокси)-4-хиназолинамин, BIBX1382,2,3,9,10,11,12-гексагидро-10-(гидроксиметил)-10-гидрокси-9-метил-9,12-эпокси-1 Н-дииндоло[1,2,3fg:3',2',1'-kl]пирроло[3,4-i][1,6]бензодиазоцин-1-он, SH268, генистеин, STI571, СЕР 2563, 4-(3-хлорфениламино)-5,6-диметил-7 Н-пирроло[2,З-d]пиримидин-метансульфонат, 4-(3-бром-4-гидроксифенил) амино-6,7-диметоксихиназолин, 4-(4'-гидроксифенил)амино-6,7-диметоксихиназолин, SU6668, STI571A,N-4-хлорфенил-4-(4-пиридилметил)-1-фталазинамин и EMD121974. Данные соединения являются также полезными как таковые или в комбинации с антагонистами рецептора фибриногена тромбоцитов (GP IIb/IIIa), такими как тирофибан, для ингибирования метастаз злокачественных клеток. Опухолевые клетки могут активировать тромбоциты в значительной степени посредством генерации тромбина. Эта активация ассоциирована с высвобождением VEGF. ВысвобождениеVEGF увеличивает метастазы посредством увеличения экстравазации в местах адгезии к васкулярному эндотелию (Amirkhosravi, Platelets, 10, 285-292, 1999). Поэтому настоящие соединения можно использовать как таковые или в комбинации с антагонистами GP IIb/IIIa) для ингибирования метастаз. Примеры других антагонистов рецептора фибриногена включают абциксимаб, эптифибатид, сибрафибан, ламифибан, лотрафибан, кромобифан и СТ 50352. Если такие продукты комбинаций изготовлены в виде установленной дозы, в них используют соединения данного изобретения в диапазоне доз, описанных ниже, вместе с другим фармацевтически активным агентом в пределах его одобренного диапазона доз. Соединения данного изобретения можно в альтернативном случае использовать последовательно с известным фармацевтически приемлемым агентом(ами), когда готовая препаративная форма в виде комбинации является непригодной. Термин "введение" и его варианты (например, "введение" соединения) в отношении к соединению изобретения означает введение соединения или пролекарства соединения в организм животного, нуждающегося в таком лечении. Когда соединение изобретения или его пролекарство изготовляют в комбинации с одним или несколькими другими активными агентами (например, цитотоксическим агентом и так далее), понятно, что термин "введение" и его варианты, каждый, включают одновременное и последовательное введение соединения или его пролекарства и других агентов. Имеется в виду, что используемый здесь термин "композиция" содержит продукт, включающий оп- 15005812 ределенные ингредиенты в определенных количествах, а также любой продукт, который является результатом полученной непосредственным или непрямым способом комбинации определенных ингредиентов в определенных количествах. Термин "терапевтически эффективное количество", используемый здесь, означает, что количество активного соединения или фармацевтического агента, который вызывает биологическую или медицинскую ответную реакцию в ткани, системе, организме животного или человека, устанавливается исследователем, ветеринаром, врачом или другим клиницистом. Термин "лечение рака" или "терапия рака" относится к введению млекопитающему, пораженному злокачественным образованием, и относится к действию, которое облегчает злокачественное состояние уничтожением злокачественных клеток, но также действию, которое приводит к ингибированию роста и/или метастаз ракового образования. Настоящее изобретение включает также фармацевтическую композицию, пригодную при лечении рака, включающую терапевтически эффективное количество соединений настоящего изобретения с фармацевтически приемлемыми носителями, или разбавителями, или без них. Подходящие композиции данного изобретения включают водные растворы, включающие соединения данного изобретения и фармакологически приемлемые носители, например физиологический раствор, при уровне рН, например, 7,4. Растворы можно ввести в кровоток пациента местной инъекцией болюса. Когда соединение по настоящему изобретению вводят в организм человека, суточная доза будет обычно определяться прописью врача с дозировкой, обычно изменяющейся в соответствии с возрастом,массой и ответной реакцией конкретного пациента, а также серьезностью симптомов пациента. В одном приведенном в качестве примера применении млекопитающему, подвергаемому лечению вследствие заболевания раком, вводят подходящее количество соединения. Введение осуществляют в количестве между приблизительно 0,1 и приблизительно 60 мг/кг массы тела в день, предпочтительно от 0,5 до приблизительно 40 мг/кг массы тела в день. Анализы Соединения настоящего изобретения, описанные в примерах, испытывали с применением анализов,описанных ниже, и было обнаружено, что они обладают ингибирующей киназу активностью. Другие анализы являются известными в литературе и могут быть легко проведены специалистом в данной области (см., например, Dhanabal et al. Cancer Res. 59:189-197; Xin et al., J. Biol. Chem. 274:9116-9121; SheuI. Анализ рецепторной киназы VEGF Активность рецепторной киназы VEGF измеряют введением меченого радиоактивным изотопом фосфата в субстрат поли(глутаминовая кислота, тирозин, 4:1) (pEY). Фосфорилированный продукт pEY улавливают на мембранном фильтре и включение меченого радиоактивным изотопом фосфата количественно определяют сцинтилляционным счетом. Материалы Рецепторная киназа VEGF. Домены внутриклеточной тирозинкиназы человека KDR (Terman, B.I. et al. Oncogene (1991) vol. 6,pp. 1677-1683) и Flt-1 (Shibuya, M. et al. Oncogene (1990) vol. 5, pp. 519-524) были клонированы как слитые белки гена глутатион-S-трансферазы (GST). Это осуществляли клонированием цитоплазматического домена киназы KDR, как в рамочном слиянии при карбоксильном конце гена GST. Растворимые рекомбинантные слитые белки домена GST-киназы были экспрессированы в клетках насекомого Spodopterafrugiperda (Sf21) (Invitrogen) с использованием вектора экспрессии вакуловируса (pAcG2T, Pharmingen). Другие используемые материалы и их составы были следующими. Буфер для лизиса: 50 мМ Трис, рН 7,4, 0,5 М NaCl, 5 мМ DTT, 1 мМ ЭДТУ, 0,5% тритон Х-100,10% глицерин, 10 мг/мл каждого лейпептина, пепстатина и апротинина, и 1 мМ фенилметилсульфонилфторид (все от Sigma). Буфер для промывки: 50 мМ Трис, рН 7,4, 0,5 М NaCl, 5 мМ DTT, 1 мМ ЭДТУ, 0,05% тритон Х-100,10% глицерин, 10 мг/мл каждого лейпептина, пепстатина и апротинина, и 1 мМ фенилметилсульфонилфторид. Буфер для диализа: 50 мМ Трис, рН 7,4, 0,5 М NaCl, 5 мМ DTT, 1 мМ ЭДТУ, 0,05% тритон Х-100,50% глицерин, 10 мг/мл каждого лейпептина, пепстатина и апротинина, и 1 мМ фенилметилсульфонилфторид. Буфер для реакции 10 Х: 200 мМ Трис, рН 7,4, 1,0 М NaCl, 50 мМ МnС 12, 10 мМ DTT и 5 мг/мл бычьего сывороточного альбумина (Sigma). Буфер для разведения фермента: 50 мМ Трис, рН 7,4, 0,1 М NaCl, 1 мМ DTT, 10% глицерин, 100 мг/мл BSA. Субстрат 10X: 750 мкг/мл поли(глутаминовая кислота, тирозин, 4:1) (Sigma). Раствор для остановки взаимодействия: 30% трихлоруксусная кислота, 0,2 М пирофосфат натрия- 16005812 Планшеты для фильтрования: 96-луночный планшет со стеклянным волокном GF/C MilliporeMAFC NOB. Способ А. Очистка белка. 1. Клетки Sf21 инфицировали рекомбинантным вирусом при множественности инфекции 5 вирусных частиц/клетку и выращивали при 27 С в течение 48 ч. 2. Все стадии проводили при 4 С. Инфицированные клетки собирали центрифугированием при 1000g и лизировали при 4 С в течение 30 мин с 1/10 объемом буфера для лизиса с последующим центрифугированием при 100000g в течение 1 ч. Супернатант затем пропускали через колонку глутатионовой сефарозы (Pharmacia), уравновешенной в буфере для лизиса, и промывали 5 объемами того же самого буфера и затем 5 объемами буфера для промывки. Рекомбинантный белок GST-KDR элюировали системой буфер для промывки/10 мМ восстановленный глутатион (Sigma) и диализовали против буфера для диализа. В. Анализ рецепторной киназы VEGF. 1. Добавляют 5 мкл ингибитора или контроля к смеси для анализа в 50% ДМСО. 2. Добавляют 35 мкл реакционной смеси, содержащей 5 мкл буфера, для реакции 10 Х, 5 мкл 25 мМ АТФ/10 мкКи [33 Р]АТФ (Amersham) и 5 мкл субстрата 10 Х. 3. Начинают взаимодействие добавлением 10 мкл KDR (25 нМ) в буфере для разведения фермента. 4. Проводят смешивание и инкубирование при комнатной температуре в течение 15 мин. 5. Останавливают взаимодействие добавлением 50 мкл раствора для остановки взаимодействия. 6. Проводят инкубирование в течение 15 мин при 4 С. 7. Переносят 90 мкл аликвоту в планшет для фильтрования. 8. Аспирируют и промывают 3 раза раствором для промывания. 9. Добавляют 30 мкл коктейля для сцинтилляции, герметизируют планшет и подсчет проводят в сцинтилляционном счетчике Wallac Microbeta.II. Анализ митогенеза эндотелиальных клеток пупочной вены человека Эндотелиальные клетки пупочной вены человека (HUVECs) в культуре пролиферируют в ответ на обработку VEGF и их можно использовать в качестве системы для анализа, чтобы количественно определить влияния киназных ингибиторов KDR на стимуляцию VEGF. В описанном анализе находящиеся в покое монослои HUVEC обрабатывают наполнителем или испытуемым соединением за 2 ч до добавления VEGF или основного фактора роста фибробластов (bFGF). Митогенную ответную реакцию на VEGF или bFGF определяют измерением включения [3 Н]-тимидина в клеточную ДНК. МатериалыHUVECs: HUVECs, замороженные в виде изолятов первичных культур, получали от Clonetics Corp. Клетки выдерживают в среде для эндотелиального роста (EGM; Clonetics) и используют для митогенных анализов, описанных в приведенных ниже пассажах 3-7. Культуральные планшеты: 96-луночные полистирольные планшеты для культур тканей NUNCLON(NUNC 167008). Среда для анализа: модифицированная по способу Дульбекко среда Игла, содержащая 1 г/мл глюкозы (low-glucose DMEM; Mediatech) плюс 10% (об./об.) фетальной бычьей сыворотки (Clonetics). Испытуемые соединения: рабочие исходные растворы испытуемых соединений разводят последовательно в 100% диметилсульфоксиде (МДСО) до концентрации, которая в 400 раз выше, чем их требуемые конечные концентрации. Конечные разведения до концентрации 1X проводят непосредственно в среде для анализа непосредственно перед добавлением клеток. Факторы роста 10 Х: растворы VEGF165 (500 нг/мл; RD Systems) и bFGF (10 нг/мл; RD Systems) человека получают в среде для анализа. 10 Х [3 Н]-тимидин: [метил-3 Н]тимидин (20 Ки/ммоль; Dupont-NEN) разводят до 80 мкКи/мл вDMEM с низкой концентрацией глюкозы. Среда для промывания клеток: сбалансированный солевой раствор Ханка (Mediatech), содержащий 1 мг/мл бычьего сывороточного альбумина (Boehringer-Mannheim). Раствор для лизиса клеток: 1 н. NaOH, 2% (мас./об.) Na2 СО 3. Способ 1. Монослои HUVEC, выдержанные в EGM, получают трипсинизацией и высевают при плотности 4000 клеток на 100 мкл среды для анализа в 96-луночных планшетах. Рост клеток задерживают в течение 24 ч при 37 С в увлажненной атмосфере, содержащей 5% СО 2. 2. Среду для задержки роста заменяют на 100 мкл среды для анализа, содержащей либо наполнитель (0,25% [об./об.] ДМСО) или испытуемое соединение с требуемой конечной концентрацией. Все определения проводят в трех повторах. Клетки затем инкубируют при 37 С с 5% СО 2 течение 2 ч, чтобы позволить испытуемым соединениям проникнуть в клетки. 3. После 2-часового периода предварительной обработки клетки стимулируют добавлением 10 мкл/лунку либо среды для анализа, раствора VEGF 10X либо раствора bFGF 10X. Клетки затем инкуби- 17005812 руют при 37 С и 5% СО 2. 4. Спустя 24 ч в присутствии факторов роста добавляют 10 Х [3 Н]-тимидин (10 мкл/лунку). 5. Через три дня после добавления [3 Н]-тимидина среду удаляют отсасыванием и клетки промывают два раза средой для промывания клеток (400 мкл/лунку, затем 200 мкл/лунку). Промытые, сросшиеся клетки затем солюбилизируют добавлением раствора для лизиса клеток (100 мкл/лунку) и нагревают до 37 С в течение 30 мин. Лизаты клеток переносят в 7-мл стеклянные пробирки для сцинтилляции, содержащие 150 мкл воды. Добавляют коктейль для сцинтилляционного счета (5 мл/пробирку) и связанную с клетками радиоактивность определяют жидкостной сцинтилляционной спектроскопией. На основании вышеприведенных анализов можно сделать выод, что соединения формулы I являются ингибиторами VEGF и, следовательно, являются пригодными для ингибирования развития кровеносных сосудов, например, при лечении глазной болезни, например диабетической ретинопатии, и при лечении раковых заболеваний, например солидных опухолей. Данные соединения ингибируют VEGFстимулированный митогенез васкулярных эндотелиальных клеток человека в культуре с величинами IC50 между 0,001 и 5,0 мкМ. Данные соединения проявляют также селективность относительно родственных тирозинкиназ (например, семейства FGFR1 и Src; связь между киназами Src и киназами VEGFR см. вEliceiri et al., Molecular Cell, Vol. 4, pp. 915-924, December 1999). Примеры Нижеследующие примеры раскрывают настоящее изобретение. Используемые конкретные материалы, типы и условия являются иллюстративными для изобретения, при этом не ограничивая его разумный объем. Схема 1 2-Хлор-3-иодхинолин (1-2). Суспензию 3-(2-хлор(хинолинбороновой кислоты (1-1, 5,05 г, 24,3 ммоль, 1 экв., полученный способом Marsais, F; Godard, A.; Queguiner, G.J. Heterocyclic Chem. 1989, 26, 1589-1594) и Nиодсукцинимида (5,48 г, 24,4 ммоль, 1,00 экв.) в ацетонитриле (300 мл) перемешивают при 23 С в темноте в течение 20 ч. Реакционную смесь концентрируют досуха и образовавшееся желтое твердое вещество распределяют между насыщенным водным раствором бикарбоната натрия и дихлорметаном. Органический слой промывают водой, затем сушат над сульфатом магния и концентрируют, при этом получая 2 хлор-3-иодхинолин в виде бледно-желтого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)8,67 (с, 1 Н), 7,99 (шир. д, 1 Н, J = 8,4 Гц), 7,75 (шир. т, 1 Н, J = 7,7 Гц),7,72 (шир. д, 1 Н, J= 7,8 Гц), 7,57 (шир. т, 1 Н, J = 7,6 Гц). 5-(трет-Бутилдиметилсиланилокси)-1 Н-индол (1-4). Раствор 5-гидроксииндола 1-3 (5,50 г, 41,3 ммоль, 1 экв.), трет-бутилдиметилсилилхлорида (7,47 г,49,6 ммоль, 1,20 экв.) и имидазола (7,03 г, 103 ммоль, 2,50 экв.) в N,N-диметилформамиде (20 мл) перемешивают при 23 С в течение 20 ч. Реакционную смесь концентрируют и остаток распределяют между этилацетатом и водой. Органический слой промывают водой (3 х), затем сушат над сульфатом магния и- 18005812 концентрируют. Остаток очищают флэш-колоночной хроматографией (40% дихлорметан в гексане, затем 60% дихлорметан в гексане), при этом получая 5-(трет-бутилдиметилсиланилокси)-1H-индол в виде бесцветного масла, которое отверждается при стоянии. 1 Н ЯМР (400 МГц, CDCl3)8,00 (шир. с, 1 Н), 7,22 (д, 1 Н, J = 8,7 Гц), 7,17 (т, 1 Н, J = 2,8 Гц), 7,06 (д,1 Н, J = 2,3 Гц), 6,76 (дд, 1 Н, J = 8,6, 2,3 Гц), 6,44 (м, 1 Н), 1,00 (с, 9 Н), 0,19 (с, 6 Н). трет-Бутиловый эфир 5-(трет-бутилдиметилсиланилокси)индол-1-карбоновой кислоты (1-5). Раствор 5-(трет-бутилдиметилсиланилокси)-lH-индол 1-4 (10,2 г, 41,3 ммоль, 1 экв.), ди-третбутилкарбоната (14,4 г, 66,0 ммоль, 1,60 экв.) и 4-диметиламинопиридина (1,01 г, 8,25 ммоль, 0,200 экв.) в дихлорметане (100 мл) перемешивают при 23 С в течение 20 ч. Реакционную смесь концентрируют и остаток очищают флэш-колоночной хроматографией (40% дихлорметан в гексанах), при этом получая трет-бутиловый эфир 5-(трет-бутилдиметилсиланилокси)индол-1-карбоновой кислоты (1-5) в виде бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3)7,96 (шир. д, 1 Н, J = 7,5 Гц), 7,54 (шир. д, 1 Н, J = 3,1 Гц), 6,98 (д, 1 Н, J= 2,4 Гц), 6,83 (дд, 1 Н, J = 9,0, 2,4 Гц), 6,45 (д, 1 Н, J = 3,7 Гц), 1,66 (с, 9 Н), 1,00 (с, 9 Н), 0,20 (с, 6 Н). 1-(трет-Бутоксикарбонил)-5-[трет-бутил(диметил)силил]окси-1 Н-индол-2-илбороновая кислота(1-6). Раствор трет-бутиллития в пентане (1,7 М, 20,7 мл, 35,2 ммоль, 1,20 экв.) добавляют к раствору трет-бутилового эфира 5-(трет-бутилдиметилсиланилокси)индол-1-карбоновой кислоты (1-5, 10,2 г, 29,3 ммоль, 1 экв.) в тетрагидрофуране (100 мл) при -78 С. Образовавшийся светло-коричневый раствор перемешивают при -78 С в течение 30 мин, затем добавляют триметилборат (6,67 мл, 58,7 ммоль, 2,00 экв.). Образовавшуюся смесь нагревают до 0 С, затем разбавляют насыщенным водным раствором хлорида аммония (100 мл) и этиловым эфиром (200 мл). Водный слой делают кислотным водным 10% раствором гидросульфата калия. Органический слой отделяют, затем промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют. Остаточное желтое твердое вещество растирают с гексаном, при этом получая 1-(трет-бутоксикарбонил)-5-[трет-бутил(диметил)силил]окси-1 Н-индол-2 илбороновую кислоту (1-6) в виде не совсем белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)7,84 (д, 1 Н, J = 8,9 Гц), 7,37 (с, 1 Н), 7,01 (д, 1 Н, J = 2,4 Гц), 6,97 (шир. с,2 Н), 6,88 (дд, 1 Н, J = 9,0, 2,4 Гц), 1,73 (с, 9 Н), 1,00 (с, 9 Н), 0,20 (с, 6 Н). трет-Бутил-5-[трет-бутил(диметил)силил]окси-2-(2-хлор-3-хинолинил)-1 Н-индол-1-карбоксилат(1-7). Освобожденную от кислорода смесь 1-(трет-бутоксикарбонил)-5-[трет-бутил(диметил) силил]окси-1 Н-индол-2-бороновой кислоты 1-6 (4,10 г, 10,5 ммоль, 1 экв.), 2-хлор-3-иодхинолина (1-2,3,64 г, 12,6 ммоль, 1,20 экв.), фосфата калия (6,67 г, 31,4 ммоль, 3,00 экв.) и тетракис(трифенилфосфин)палладия (0,605 г, 0,524 ммоль, 0,050 экв.) в диоксане (100 мл) нагревают при 90 С в течение 20 ч. Реакционную смесь охлаждают, затем распределяют между смесью воды и этилацетата. Органический слой отделяют, промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют. Остаток очищают флэш-колоночной хроматографией (20% раствор дихлорметана в гексане,плавно изменяющийся до 90% дихлорметана в гексане), при этом получая трет-бутил-5-[третбутил(диметил)силил]окси-2-(2-хлор-3-хинолинил)-1 Н-индол-1-карбоксилат (1-7) в виде пены рыжевато-коричневого цвета. 1 Н ЯМР (400 МГц, CDC13)8,16 (с, 1 Н), 8,15 (д, 1 Н, J = 9,0 Гц), 8,07 (д, 1 Н, J = 8,2 Гц), 7,86 (д, 1 Н,J = 7,8 Гц), 7,77 (шир. т, 1 Н, J = 8,4 Гц), 7,60 (шир. т, 1 Н, J = 8,1 Гц), 7,03 (д, 1 Н, J = 2,4 Гц), 6,92 (дд, 1 Н,J= 9,0, 2,4 Гц), 6,55 (с, 1 Н), 1,26 (с, 9 Н), 1,02 (с, 9 Н), 0,23 (с, 6 Н). трет-Бутил-2-(2-хлор-3-хинолинил)-5-гидрокси-1 Н-индол-1-карбоксилат (1-8). Раствор трет-бутил-5-[трет-бутил(диметил)силил]окси-2-(2-хлор-3-хинолинил)-1 Н-индол-1 карбоксилата 1-7 (2,50 г, 4,91 ммоль, 1 экв.) и тригидрофторида триэтиламина (3,60 мл, 22,1 ммоль, 4,50 экв.) в ацетонитриле (100 мл) перемешивают при 23 С в течение 20 ч. Реакционную смесь концентрируют и остаток распределяют между насыщенным водным раствором бикарбоната натрия и этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и концентрируют, при этом получая трет-бутил-2-(2-хлор-3-хинолинил)-5-гидрокси-1 Н-индол-1-карбоксилат (1-8) в виде пены рыжевато-коричневого цвета. 1 Н ЯМР (400 МГц, CDCl3)8,18 (д, 1H, J = 9,0 Гц), 8,17 (с, 1 Н), 8,07 (д, 1 Н, J = 8,4 Гц), 7,86 (д, 1 Н, J(978 мг, 3,00 ммоль, 3,00 экв.) в N,N-диметилформамиде (5 мл) нагревают при 50 С в течение 2 ч. Реакционную смесь концентрируют и остаток распределяют между водой и этилацетатом. Органический слой промывают водой, затем насыщенным раствором соли, сушат над сульфатом магния и концентрируют, при этом получая бледно-желтую пену. Пену растворяют в смеси 1:1 воды и уксусной кислоты (60- 19005812 мл) и образовавшийся раствор нагревают при 110 С в течение 12 ч. Реакционную смесь концентрируют и остаток перемешивают в водном насыщенном растворе бикарбоната натрия, что дает рыжеватокоричневое твердое вещество. Рыжевато-коричневое твердое вещество фильтруют, затем суспендируют в теплом этаноле (220 мл) и фильтруют, при этом получая 3-[5-(2-пиперидин-1-илэтокси)-1 Н-индол-2 ил]-1 Н-хинолин-2-он (1-9) в виде желтого твердого вещества. Фильтрат в этаноле концентрируют и остаток очищают флэш-колоночной хроматографией (5% этанол, насыщенный аммиаком, в этилацетате), при этом получая дополнительное количество 1-9. 1H ЯМР (400 МГц, (CD3)2SO)12,14 (с, 1 Н), 11,41 (с, 1 Н), 8,50 (с, 1 Н), 7,73 (шир. д, 1 Н, J = 7,9 Гц),7,51 (шир. т, 1 Н, J = 7,6 Гц), 7,41 (д, 1 Н, J = 8,6 Гц), 7,37 (шир. д, 1 Н, J = 8,2 Гц), 7,24 (шир. т, 1 Н, J = 7,7 Гц), 7,21 (шир. с, 1 Н), 7,06 (шир. с, 1 Н), 6,76 (дд, 1 Н, J = 8,6, 2,2 Гц), 4,06 (т, 2 Н, J = 5,9 Гц), 2,67 (т, 3 Н, J= 5,5 Гц), 2,45 (шир. м, 4 Н), 1,51 (шир. м, 4 Н), 1,39 (шир. м, 2 Н). Соединения от 1-10 до 1-19, указанные ниже, и соединения от 1-20 до 1-55, приведенные ниже в табл. 1, получают простыми модификациями протоколов, описанных выше. Алкилгалогениды, используемые в следующих примерах, были либо коммерчески доступными, либо полученными алкилированием соответствующего амина либо 1-бром-2-хлорэтаном в присутствии карбоната калия в ацетоне способом Miyahara, M.; Sueyoshi, S.; Kamiya, S. Chera. Pharm. Bull. 1985, 33, 5557-5561, либо 1-бром-3 хлорпропаном в бензоле по способу Adams and Whitmore J. Am. Chem. Soc. 1945, 67, 735. В некоторых случаях мезилаты коммерчески доступных или легко доступных спиртов получают (MsCl, Et3N) и используют вместо соответствующих алкилхлоридов. 3-[5-(2-Пирролидин-1-илэтокси)-1 Н-индол-2-ил]-1 Н-хинолин-2-он (1-10).- 26005812 10% Pd/C (840 мг) добавляют к раствору (150 мл) 3-(5-2-[бензил(2-метоксиэтил)амино]этокси-1 Ниндол-2-ил)-2(1 Н)-хинолинона, соединение 1-27 (84 0 мг, 1,8 ммоль), в EtOAc (150 мл) и образовавшуюся смесь перемешивают под давлением водорода из баллона в течение 18 ч. Катализатор удаляют фильтрованием и фильтрат концентрируют, при этом получая желтое твердое вещество, которое очищают хроматографией на колонке с диоксидом кремния. Элюирование с градиентом от EtOAc до 25% раствораNH3-EtOH/EtOAc дает 3-(5-2-[(2-метоксиэтил)амино]этокси-1 Н-индол-2-ил)-2(1 Н)-хинолинон (2-1) в виде желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)11,05 (с, 1 Н), 9,65 (шир. с, 1 Н), 8,32 (с, 1 Н), 7,67 (д, 1 Н, J = 8 Гц), 7,51(168 мг, 0,8 ммоль) в DCE (25 мл) перемешивают в условиях окружающей среды в течение 18 ч. Реакционную смесь концентрируют и остаток распределяют между EtOAc и насыщенным раствором NaНСО 3. Органический слой промывают насыщенным раствором соли, сушат над MgSO4 и концентрируют. Остаток суспендируют в этиловом эфире с помощью обработки ультразвуком, затем фильтруют и сушат на воздухе, при этом получая 3-[5-(2-(2-метоксиэтил)[(2-метокси-5-пиримидинил)метил]аминоэтокси)1 Н-индол-2-ил]-2(1 Н)-хинолинон (2-2) в виде желтого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)11,05 (с, 1 Н), 9,60 (с, 1 Н), 8,53 (с, 2 Н), 8,33 (с, 1 Н), 7,68 (д, 1 Н, J = 8 Гц),7,52 (т, 1 Н, J = 8 Гц), 7,34 (д, 1 Н, J = 8 Гц), 7,27 (т, 1 Н, J = 8 Гц), 7,22 (д, 1 Н, J = 8 Гц), 7,05 (с, 1 Н), 6,96 (с,1 Н), 6,86 (дд, 1 Н, J = 8,2 Гц), 4,13 (т, 2 Н, J = 6 Гц), 4,01 (с, 3 Н), 3,80 (с, 2 Н), 3,53 (т, 2 Н, J = 6 Гц), 3,34 (с,3 Н), 3,01 (т, 2 Н, J = 6 Гц), 2,84 (т, 2 Н, J = 6 Гц). Соединения от 2-3 до 2-12 в табл. 2 получали простыми модификациями к описанным выше протоколам. Выбранные ЯМР-спектры для 2-3 и 2-4 были следующими: 2-3, 1 Н ЯМР (400 МГц, CDCl3)11,05(2S, 4R)-1-[(Бензилокси)карбонил]-4-метокси-2-пирролидинкарбоновая кислота (3-2). Гидрид натрия (543 мг, 22,6 ммоль, 2,00 экв.) осторожно добавляют к раствору (2S,4R)-1[(бензилокси)карбонил]-4-гидрокси-2-пирролидинкарбоновой кислоты (3-1, 3,00 г, 11,3 ммоль, 1 экв.) в ТГФ (100 мл) при 0 С и образовавшуюся смесь перемешивают в течение 20 мин. Добавляют иодметан(2,11 мл, 33,9 ммоль, 3,00 экв.) и смесь нагревают до 23 С и перемешивают в течение 20 ч. Реакционную смесь затем разбавляют насыщенным раствором бикарбоната натрия, промывают этилацетатом (2100 мл). Водный слой затем подкисляют 1 н. раствором НСl до рН 3 и экстрагируют этилацетатом (100 мл). Данный органический слой затем сушат над сульфатом натрия и концентрируют, при этом получая(2S,4R)-1-[(бензилокси)карбонил]-4-метокси-2-пирролидинкарбоновую кислоту (3-2) в виде светложелтого масла. 1 Н ЯМР (4 00 МГц, СDСl3) основной ротамер:7,40-7,25 (шир. м, 5 Н), 5,20 (с, 2 Н), 4,52 (т, 1 Н, J = 7,4 Гц), 4,00 (м, 1 Н), 3,67 (дд, 1 Н, J = 11,4, 2,8 Гц), 3,57 (дд, 1 Н, J = 11,4, 4,6 Гц), 3,32 (с, 3 Н), 2,34 (м, 2 Н). Бензил-(2S,4R)-2-(гидроксиметил)-4-метокси-1-пирролидинкарбоксилат (3-3). Раствор комплекса боран-тетрагидрофуран в ТГФ (1 М, 53,0 мл, 53,0 ммоль, 3,50 экв.) добавляют к раствору (2S,4R)-1-[(бензилокси)карбонил]-4-метокси-2-пирролидинкарбоновой кислоты (3-2, 4,23 г,15,1 ммоль, 1 экв.) в ТГФ (200 мл) при 0 С. Образовавшуюся смесь нагревают до 23 С и перемешивают в течение 1 ч. Избыточный боран осторожно гасят водой. Смесь затем распределяют между смесью 1:1- 29005812 насыщенного раствора карбоната натрия и насыщенного раствора соли (300 мл) и этилацетатом (300 мл). Органический слой сушат над сульфатом натрия и концентрируют. Остаток очищают флэш-колоночной хроматографией (сначала 100% гексан, постепенно изменяющийся до 100% EtOAc), при этом получая бензил-(2S,4R)-2-(гидроксиметил)-4-метокси-1-пирролидинкарбоксилат (3-3) в виде бесцветного масла. 1 Н ЯМР (300 МГц, CDCl3) основной ротамер:7,37-7,25 (шир. м, 5 Н), 5,18 (д, 1 Н, J = 12,4 Гц), 5,13(0,394 мл, 2,8 3 ммоль, 1,50 экв.) в дихлорметане (30 мл) при 0 С. Образовавшуюся смесь нагревают до 23 С и перемешивают в течение 1 ч. Реакционную смесь распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном (240 мл). Объединенные органические слои сушат над сульфатом натрия и концентрируют. Остаток очищают флэш-колоночной хроматографией (сначала 100% гексан, постепенно изменяющийся до 100% EtOAc), при этом получая бензил-(2S,4R)-4-метокси-2[(метилсульфонил)окси]метил-1-пирролидинкарбоксилат (3-4) в виде светло-желтого масла. 1 Н ЯМР (300 МГц, CDCl3) основной ротамер:7,37-7,25 (шир. м, 5 Н), 5,17 (д, 1 Н, J = 11,8 Гц), 5,10(д, 1 Н, J = 11,8 Гц), 4,65 (дд, 1 Н, J = 8,3, 3,8 Гц), 4,24 (шир. м, 2 Н), 3,95 (м, 1 Н), 3,68 (шир. д, 1 Н, J = 12,0 Гц), 3,45 (дд, 1 Н, J = 12,0, 4,4 Гц), 3,30 (с, 3 Н), 2,88 (с, 3 Н), 2,39 (м, 1 Н), 2,12 (м, 1 Н). трет-Бутил-5-2S,4R)-1-[(бензилокси)карбонил]-4-метокси-пирролидинилметокси)-2-(2-хлор-3 хинолинил)-1 Н-индол-1-карбоксилат (3-5). Смесь бензил-(2S,4R)-4-метокси-2-[(метилсульфонил)окси]метил-1-пирролидинкарбоксилата (34, 380 мг, 1,11 ммоль, 1 экв.), 2-В (437 мг, 1,11 ммоль, 1,00 экв.) и карбоната цезия (433 мг, 1,33 ммоль,1,20 экв.) в ДМФ (5,0 мл) нагревают при 70 С в течение 3 ч. Реакционную смесь распределяют между водой и этилацетатом (250 мл). Объединенные органические слои сушат над сульфатом натрия и концентрируют. Остаток очищают флэш-колоночной хроматографией (сначала 100% гексан, постепенно изменяющийся до 40% EtOAc в гексане), при этом получая трет-бутил-5-2S,4R)-1-[(бензилокси) карбонил]-4-метоксипирролидинилметокси)-2-(2-хлор-3-хинолинил)-1 Н-индол-1-карбоксилат (3-5). 1 Н ЯМР (400 МГц, CDCl3) основной ротамер:8,17 (м, 2 Н), 8,08 (д, 1 Н, J = 8,5 Гц), 7,87 (шир. д,1 Н, J = 8,6 Гц), 7,78 (т, 1 Н, J = 8,4 Гц), 7,61 (т, 1 Н, J= 8,4 Гц), 7,38-7,22 (шир. м, 5 Н), 7,10 (шир. с, 1 Н),6,94 (шир. м, 1 Н), 6,56 (с, 1 Н), 5,17 (шир. с, 2 Н), 4,35 (шир. м, 2 Н), 4,16 (шир. м, 2 Н), 3,60 (шир. м, 2 Н),3,34 (с, 3 Н), 2,88 (с, 3 Н), 2,32 (м, 1 Н), 2,23 (м, 1 Н). трет-Бутил-2-(2-хлор-3-хинолинил)-5-[(2S,4R)-4-метоксипирролидинил]метокси-1 Н-индол-1 карбоксилат (3-6). Смесь трет-бутил-5-2S,4R)-1-[(бензилокси)карбонил]-4-метоксипирролидинилметокси)-2-(2 хлор-3-хинолинил)-1 Н-индол-1-карбоксилата (3-5, 295 мг, 0,459 ммоль, 1 экв.) и 10% палладия на угле(200 мг, 0,188 ммоль, 0,410 экв.) в этаноле (10 мл) перемешивают в атмосфере водорода из баллона в течение 1,5 ч. Катализатор фильтруют на подушке целита и промывают этанолом (20 мл). Фильтрат концентрируют и остаток очищают жидкостной хроматографией с обращенной фазой (градиент смеси Н 2 О/СН 3 СN/присутствует 0,1% ТФУ), при этом получая трет-бутил-2-(2-хлор-3-хинолинил)-5-[(2S,4R)4-метоксипирролидинил]метокси-1 Н-индол-1-карбоксилат (3-6). 1 Н ЯМР (300 МГц, CD3OD)8,41 (с, 1 Н), 8,23 (д, 1 Н, J = 9,3 Гц), 8,02 (шир. т, 2 Н, J = 7,1 Гц), 7,86(шир. т, 1 Н, J = 7,9 Гц), 7,70 (шир. т, 1 Н, J = 8,1 Гц), 7,25 (д, 1 Н, J = 2,4 Гц), 7,09 (дд, 1 Н, J= 9,0, 2,7 Гц),6,73 (с, 1 Н), 4,45 (м, 1 Н), 4,23 (шир. м, 3 Н), 3,51 (шир. д, 1 Н, J = 12,7 Гц), 3,41 (дд, 1 Н, J = 12,7, 3,4 Гц),3,40 (с, 3 Н), 2,47 (м, 1 Н), 2,06 (м, 1 Н). 3-(5-[(2S,4R)-4-Метоксипирролидинил]метокси-1 Н-индол-2-ил)-2(1 Н)-хинолинон (3-7). Раствор трет-бутил-2-(2-хлор-3-хинолинил)-5-[(2S,4R)-4-метоксипирролидинил]метокси-1 Ниндол-1-карбоксилата (6-6, 29 мг, 0,057 ммоль) нагревают в смеси 8:1 уксусной кислоты и воды (5 мл) при 90 С в течение 1,5 ч. Реакционную смесь охлаждают и концентрируют и остаток очищают жидкостной хроматографией с обращенной фазой (градиент смеси Н 2 О/СН 3 СN/присутствует 0,1% ТФУ), при этом получая 3-(5-[(2S,4R)-4-метоксипирролидинил]метокси-1 Н-индол-2-ил)-2(1 Н)-хинолинон (3-7) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, CD3OD)8,45 (с, 1 Н), 7,75 (д, 1 Н, J = 7,8 Гц), 7,53 (шир. т, 1 Н, J = 7,8 Гц), 7,38(д, 1 Н, J = 8,9 Гц), 7,38 (д, 1 Н, J = 8,1 Гц), 7,29 (шир. т, 1 Н, J = 7,3 Гц), 7,19 (с, 1 Н), 7,17 (д, 1 Н, J = 2,4 Гц),6,89 (дд, 1 Н, J = 8,8, 2,4 Гц), 4,39 (дд, 1 Н, J = 10,2, 2,8 Гц), 4,25 (м, 1 Н), 4,20 (м, 1 Н), 4,14 (м, 1 Н), 3,49 (дд,1 Н, J = 13,9, 6,9 Гц), 3,41 (дд, 1 Н, J = 12,6, 3,6 Гц), 3,39 (с, 3 Н), 2,45 (шир. дд, 1 Н, J = 13,9, 6,5 Гц), 2,05 (м,1 Н). Соединения от 3-8 до 3-21, приведенные ниже в табл. 3, получены простыми модификациями протоколов, описанных выше. Для примеров от 3-13 до 3-15 (2R,4R)-1-[(бензилокси)карбонил]-4-гидрокси 2-пирролидинкарбоновую кислоту использовали в качестве исходного материала. Для примеров от 3-17
МПК / Метки
МПК: C07D 401/14, A61K 31/495
Метки: ингибиторы, тирозинкиназы
Код ссылки
<a href="https://eas.patents.su/30-5812-ingibitory-tirozinkinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы тирозинкиназы</a>
Предыдущий патент: Способ получения циталопрама
Следующий патент: Безводный кристаллический тиотропийбромид, способ его получения и его применение для получения лекарственного средства
Случайный патент: Поверхностная обработка органического полимерного материала












