Безводный кристаллический тиотропийбромид, способ его получения и его применение для получения лекарственного средства
Формула / Реферат
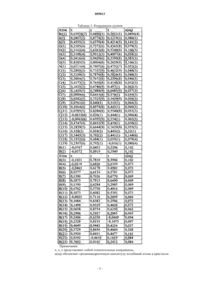
1. Безводный кристаллический тиотропийбромид, имеющий моноклинную элементарную ячейку со следующими параметрами: a = 10,4336(2) Е, b = 11,3297(3) Е, c = 17,6332(4) Е, a = 90ш, b = 105,158(2)ш и g = 90ш (объем ячейки равен 2011,89(8) Е3).
2. Способ получения безводного кристаллического тиотропийбромида по п.1 путем сушки кристаллического моногидрата тиотропийбромида при температуре выше 50шC, предпочтительно при температуре в интервале от 60 до 100шC, и при пониженном давлении.
3. Способ по п.2, отличающийся тем, что продолжительность сушки составляет от 15 мин до 24 ч.
4. Способ получения безводного кристаллического тиотропийбромида по п.1 путем выдержки кристаллического моногидрата тиотропийбромида в присутствии осушителя в течение 12-96 ч.
5. Безводный кристаллический тиотропийбромид, получаемый способом по пп.2, 3 или 4.
6. Применение кристаллического моногидрата тиотропийбромида для получения безводного кристаллического тиотропийбромида.
7. Лекарственное средство, отличающееся тем, что оно содержит безводный кристаллический тиотропийбромид по п.1 или 5.
8. Лекарственное средство по п.7, отличающееся тем, что оно представляет собой порошок для ингаляции.
9. Порошок для ингаляции, отличающийся тем, что он содержит безводный кристаллический тиотропийбромид по п.1 или 5 в смеси с физиологически совместимым вспомогательным веществом.
10. Порошок для ингаляции по п.9, отличающийся тем, что вспомогательное вещество выбрано из группы, включающей глюкозу и лактозу.
11. Применение безводного кристаллического тиотропийбромида по п.1 или 5 в качестве активного компонента для получения лекарственного средства, предназначенного для лечения заболеваний, при которых использование антихолинергического средства может оказывать эффективное терапевтическое действие.
12. Применение по п.11, отличающееся тем, что указанными заболеваниями являются астма или хроническое обструктивное заболевание легких.
Текст
Настоящее изобретение относится к кристаллическому (1,2,4,5,7)-7-[(гидроксиди-2 тиенилацетил)окси]-9,9-диметил-3-окса-9-азониатрицикло[3.3.1.02,4]нонанбромиду в безводной форме, к способу его получения, а также к его применению для получения лекарственного средства, прежде всего для получения лекарственного средства, обладающего антихолинергическим действием. Предпосылки создания изобретения Соединение (1,2,4,5,7)-7-[(гидроксиди-2-тиенилацетил)окси]-9,9-диметил-3-окса-9-азониатрицикло[3.3.1.02,4]нонанбромид известно из заявки ЕР 418716 А 1 и имеет следующую химическую структуру Это соединение обладает ценными фармакологическими свойствами и известно под наименованием тиотропийбромид (BA679BR). Тиотропийбромид представляет собой высокоэффективное антихолинергическое средство и поэтому может оказывать эффективное терапевтическое действие при лечении астмы или хронического обструктивного заболевания легких (ХОЗЛ). Тиотропийбромид вводят в организм преимущественно путем ингаляции. При этом могут использоваться соответствующие порошки для ингаляции, расфасованные в пригодные для этой цели капсулы(ингалетки) и вводимые с помощью соответствующих ингаляторов для порошков. Альтернативно этому для ингаляционного введения действующего вещества в организм могут также использоваться соответствующие аэрозоли для ингаляции. К подобным аэрозолям относятся также порошковые аэрозоли для ингаляции, которые в качестве пропеллента содержат, например, HFA134a, HFA227 или их смесь. Для получения указанных выше отвечающих необходимым требованиям составов, применяемых для ингаляционного введения лекарственного действующего вещества, используется технология, базирующаяся на различных параметрах, которые, в свою очередь, связаны со свойствами лекарственного действующего вещества. В случае лекарственных средств, которые подобно тиотропийбромиду применяют в виде порошков для ингаляции или аэрозолей для ингаляции, кристаллическое действующее вещество, используемое для приготовления соответствующей композиции, представлено в измельченной(микронизированной) форме. Поскольку для фармацевтического качества лекарственной композиции во всех случаях требуется обеспечить наличие неизменной кристаллической модификации, к стабильности и к свойствам кристаллического действующего вещества предъявляются повышенные требования. Наиболее целесообразно при этом получать действующее вещество в виде единообразной кристаллической модификации с четко определенными параметрами. Целесообразно далее получать действующее вещество в такой кристаллической форме, которая не проявляет склонности к полиморфизму. Помимо указанных выше требований, предъявляемых к действующим веществам, в целом следует учитывать и тот факт, что любое изменение твердофазного состояния лекарственного средства, способствующее улучшению его физической и химической стабильности, позволяет достичь существенных преимуществ перед обладающими меньшей стабильностью формами того же самого лекарственного средства. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача получить тиотропийбромид в новой стабильной кристаллической форме, которая удовлетворяла бы указанным выше высоким требованиям, предъявляемым к лекарственному действующему веществу. Подробное описание изобретения При создании изобретения было установлено, что тиотропийбромид в зависимости от выбора условий, которые можно использовать для очистки полученного в промышленном масштабе сырого продукта, образуется в различных кристаллических модификациях. Так, в частности, было установлено, что возможность целенаправленного получения подобных различных модификаций в значительной мере определяется выбором используемых для кристаллизации растворителей, а также выбором технологических условий проведения процесса кристаллизации. При создании изобретения неожиданно было установлено, что исходя из моногидрата тиотропийбромида, который можно получать в кристаллической форме за счет выбора особых условий проведения реакции, можно получить тиотропийбромид в безводной кристаллической модификации, которая удовлетворяет указанным выше высоким требованиям и тем самым позволяет решить положенную в основу изобретения задачу. В соответствии с этим в настоящем изобретении предлагается подобный безводный кристаллический тиотропийбромид. Под используемым в контексте настоящего описания названием"ангидрат тиотропийбромида" подразумевается предлагаемый в изобретении кристаллический тиотропийбромид в безводной форме. Еще одним объектом настоящего изобретения является способ получения безводного тиотропийбромида в кристаллической форме. Этот способ отличается тем, что тиотропийбромид, полученный, например, по методу, описанному в ЕР 418716 А 1, растворяют в воде, полученную смесь нагревают и затем при медленном охлаждении кристаллизуют гидрат тиотропийбромида. Из полученного таким путем кристаллического моногидрата тиотропийбромида можно затем путем сушки получать безводный кристаллический тиотропийбромид. В соответствии с этим в настоящем изобретении предлагается также безводный кристаллический тиотропийбромид, получаемый описанным выше способом. Объектом настоящего изобретения является более подробно описанный ниже способ получения безводного кристаллического тиотропийбромида, исходя из его кристаллического моногидрата. Для получения кристаллического моногидрата в соответствии с настоящим изобретением тиотропийбромид,полученный, например, по методу, описанному в ЕР 418716 А 1, необходимо растворить в воде, нагреть полученный раствор, подвергнуть его очистке с использованием активированного угля и после отделения активированного угля медленно кристаллизовать моногидрат тиотропийбромида при медленном же охлаждении. Из этого кристаллизата за счет осторожного нагревания до температуры выше 50 С, предпочтительно до температуры в интервале от 60 до 100 С, наиболее предпочтительно от 70 до 100 С, при пониженном давлении, предпочтительно в высоком вакууме, в течение периода времени, составляющего от 15 мин до 24 ч, предпочтительно от 20 мин до 12 ч, получают безводную форму. Согласно изобретению предпочтительно работают следующим образом. Сначала в реакторе соответствующих размеров тиотропийбромид, полученный, например, по описанному в ЕР 418716 А 1 методу, смешивают с растворителем. В качестве такого растворителя используют воду в количестве от 0,4 до 1,5 кг, предпочтительно от 0,6 до 1 кг, наиболее предпочтительно примерно 0,8 кг, на моль используемого тиотропийбромида. Полученную смесь нагревают при перемешивании, предпочтительно до температуры выше 50 С, наиболее предпочтительно до температуры выше 60 С. Выбор максимального значения температуры определяется температурой кипения используемого растворителя, т.е. воды. Смесь при этом предпочтительно нагревать до температуры порядка 80-90 С. Затем в эту смесь добавляют сухой или увлажненный водой активированный уголь. Активированный уголь предпочтительно использовать в количестве от 10 до 50 г,более предпочтительно от 15 до 35 г, наиболее предпочтительно примерно 25 г на 1 моль используемого тиотропийбромида. При необходимости активированный уголь до его добавления к содержащему тиотропийбромид раствору взмучивают в воде. Для подобного взмучивания активированного угля воду используют в количестве от 70 до 200 г, предпочтительно от 100 до 160 г, наиболее предпочтительно примерно 135 г на 1 моль используемого титропийбромида. Если активированный уголь до его добавления к содержащему тиотропийбромид раствору сначала взмучивают в воде, то его целесообразно затем промывать тем же количеством воды. После добавления активированного угля смесь продолжают перемешивать при постоянной температуре в течение 5-60 мин, предпочтительно в течение 10-30 мин, наиболее предпочтительно в течение приблизительно 15 мин, после чего полученную смесь фильтруют для отделения от нее активированного угля. Затем фильтр дополнительно промывают водой. С этой целью воду используют в количестве от 140 до 400 г, предпочтительно от 200 до 320 г, наиболее предпочтительно примерно 270 г, на 1 моль используемого тиотропийбромида. Далее фильтрат медленно охлаждают предпочтительно до температуры 20-25 С. Охлаждение предпочтительно проводить со скоростью, составляющей от 1 до 10 С каждые 10-30 мин, более предпочтительно от 2 до 8 С каждые 10-30 мин, наиболее предпочтительно от 3 до 5 С каждые 10-20 мин, особенно предпочтительно от 3 до 5 С каждые приблизительно 20 мин. После охлаждения до температуры 20-25 С фильтрат при необходимости можно дополнительно охладить до температуры ниже 20 С, наиболее предпочтительно до температуры порядка 10-15 С. После охлаждения смесь для полного завершения процесса кристаллизации перемешивают в течение промежутка времени, составляющего от 20 мин до 3 ч, предпочтительно от 40 мин до 2 ч, наиболее предпочтительно примерно один час. Образовавшиеся кристаллы затем отделяют от растворителя путем обычной фильтрации или вакуум-фильтрации. Если полученные кристаллы требуется подвергнуть дополнительной стадии промывки, то в качестве промывочного растворителя целесообразно использовать воду или ацетон. Такой растворитель для промывки полученных кристаллов моногидрата тиотропийбромида можно использовать в количестве от 0,1 до 1,0 л, предпочтительно от 0,2 до 0,5 л, наиболее предпочтительно примерно 0,3 л, на 1 моль используемого тиотропийбромида. При необходимости такую стадию промывки можно провести повторно. В завершение полученный продукт сушат под вакуумом или в токе нагретого циркулирующего воздуха до остаточного содержания воды, равного 2,5-4,0%. Из полученного таким путем кристаллического моногидрата тиотропийбромида в результате тщательной сушки при температуре выше 50 С, предпочтительно в интервале от 60 до 100 С, особенно предпочтительно от 70 до 100 С, при пониженном давлении, предпочтительно в высоком вакууме, в течение промежутка времени, составляющего от 15 мин до 24 ч, предпочтительно от 20 мин до 12 ч, наиболее предпочтительно от 30 мин до 6 ч, получают безводную форму. Под пониженным давлением особенно предпочтительно подразумевается давление вплоть до 510-2 бар, предпочтительно 110-2 бар, наиболее пред-2 005813 почтительно 510-3 бар. Особенно предпочтительно вышеуказанную операцию по обезвоживанию с получением ангидрата проводить при давлении порядка 110-3 бар или менее. Альтернативой получению безводной формы путем вышеуказанной сушки при повышенной температуре и при пониженном давлении может быть ее получение в результате выдержки кристаллического моногидрата тиотропийбромида в присутствии соответствующего осушителя, предпочтительно высушенного силикагеля, при комнатной температуре в течение 12-96 ч, предпочтительно 18-72 ч, наиболее предпочтительно по меньшей мере в течение 24 ч. С целью сохранения на длительный период достигнутого обезвоженного состояния полученную таким путем безводную форму в зависимости от размера частиц целесообразно хранить в более или менее сухих условиях. В случае крупнокристаллического безводного тиотропийбромида, получаемого, например, описанным выше способом, для сохранения обезвоженного состояния приемлемым является хранение при относительной влажности менее 75% (комнатная влажность). В микронизированном виде, т.е. в случае материала со значительно увеличенной площадью поверхности, поглощение влаги при определенных условиях может происходить уже и при более низкой относительной влажности. Поэтому для сохранения безводной формы в микронизированном виде рекомендуется эту безводную форму тиотропийбромида хранить в присутствии высушенного силикагеля до того момента, когда начнется его дальнейшая переработка с целью получения требуемого порошка для ингаляции, содержащего наряду с тиотропийбромидом соответствующие вспомогательные вещества(например лактозу). Объектом настоящего изобретения является в соответствии с этим безводный кристаллический тиотропийбромид, получаемый описанным выше способом. Изобретение относится далее к применению кристаллического моногидрата тиотропийбромида для получения кристаллического тиотропийбромида в безводной форме. Определение характеристик кристаллического моногидрата тиотропийбромида Получаемый описанным выше способом моногидрат тиотропийбромида, который служит в качестве исходного материала для получения предлагаемого в изобретении безводного кристаллического тиотропийбромида, исследовали с помощью ДСК (дифференциальная сканирующая калориметрия). На полученной для моногидрата тиотропийбромида ДСК-диаграмме имеются два характерных сигнала. Первый из них, сравнительно широкий эндотермический сигнал, лежащий в диапазоне от 50 до 120 С, обусловлен обезвоживанием моногидрата тиотропийбромида до безводной формы. Второй, сравнительно четкий эндотермический максимум, приходящийся на температуру 2305 С, связан с расплавлением субстанции, сопровождаемым разложением. Эти данные были получены с помощью прибора MettlerDSC 821, а для их обработки использовали пакет программ STAR фирмы Mettler. Данные получали при скорости нагрева 10 К/мин. Поскольку плавление моногидрата тиотропийбромида сопровождается его разложением (инконгруэнтный процесс плавления), выявленная температура плавления в существенной степени зависит от скорости нагрева. При меньших скоростях нагрева процесс плавления/разложения наблюдается при значительно более низких температурах; так, например, при скорости нагрева 3 К/мин указанный процесс наблюдается при температуре 2205 С. Помимо этого в некоторых случаях может наблюдаться расщепление пика плавления. При этом подобное расщепление пика плавления становится тем выраженнее, чем меньше скорость нагрева при проведении ДСК-исследования. Характеристики получаемого описанным выше способом моногидрата тиотропийбромида, служащего исходным материалом для получения предлагаемого в изобретении безводного кристаллического тиотропийбромида, определяли с помощью ИК-спектроскопии. Экспериментальные данные получали с помощью ИК-спектрометра с фурье-преобразованием (ИКФП-спектрометр) фирмы Nicolet и обрабатывали с использованием разработанного фирмой Nicolet пакета программ OMNIC, версия 3.1. Измерения проводили с использованием 2,5 мкмолей моногидрата тиотропийбромида в 300 мг КВr. Данные для некоторых основных полос полученного ИК-спектра приведены ниже в табл. 1. Таблица 1. Соотнесение характерных полос Характеристики получаемого описанным выше способом моногидрата тиотропийбромида, служащего исходным материалом для получения предлагаемого в изобретении безводного кристаллического тиотропийбромида, определяли также рентгеноструктурным анализом. Интенсивность дифракции рентгеновских лучей измеряли с помощью 4-кружного дифрактометра типа AFC7R (Rigaku) с использованием монохроматического Кизлучения меди. Для уточнения структурных особенностей и детализации кристаллической структуры использовали прямые методы (программа SHELXS86) и FMLQ-детализацию(программа TeXsan). Экспериментальные данные касательно кристаллической структуры, уточнения ее особенностей и ее детализации представлены ниже в табл. 2. Таблица 2. Экспериментальные данные, полученные по результатам структурного анализа кристаллов моногидрата тиотропийбромида А. Характеристики кристалла Эмпирическая формула[C19H22NO4S2]Br x H2O Формульная масса 472,43+18,00 Цвет, форма кристалла Бесцветный, призматическая Размеры кристалла 0,2x0,3x0,3 мм Сингония Моноклинная Тип решетки Примитивная Пространственная группаV = 2096,96 3 Количество структурных ячеек, соответствующих 4 химической формуле вещества Б. Измерение интенсивности Дифрактометр= 1,54178(монохроматическое СuКизлучение) Напряжение, сила тока 50 кВ, 100 мА Угол между падающим и отраженным лучами 6 Соединение кристаллов Насыщенные водяным паром капилляры Расстояние между кристаллом и детектором 235 мм Размеры отверстия детектора 3,0 мм по вертикали и горизонтали Температура 18 С Определение постоянных решетки 25 рефлексов (50,8256,2) Тип сканирования 2 120 2mах Количество циклов измерения 5193 Количество независимых рефлексов 3281 (Rint =0,051) Поправки Поляризация по Лоренцу поглощение (коэффициенты светопропускания 0,56-1,00) потери в кристалле 10,47% В. Детализация структуры Рефлексы (13I) 1978 Переменная 254 Отношение рефлексы/параметр 7,8R-показатели: R, Rw 0,062, 0,066 По результатам проведенного рентгеноструктурного анализа было установлено, что кристаллический моногидрат тиотропийбромида имеет простую моноклинную ячейку следующих размеров: а = 18,0774 , b = 11,9711 , с = 9,9321 ,= 102,691, V = 2096,96 3. По результатам представленного выше рентгеноструктурного анализа были определены приведенные ниже в табл. 3 координаты атомов. Примечание: х, е, z представляют собой относительные координаты,u(eq) обозначает среднеквадратичную амплитуду колебаний атома в кристалле.-5 005813 Определение характеристик безводного кристаллического тиотропийбромида Как указывалось выше, исходя из кристаллического моногидрата тиотропийбромида, можно получать предлагаемый в изобретении безводный кристаллический тиотропийбромид. Кристаллическую структуру безводного тиотропийбромида анализировали на основе данных рентгеновской порошковой дифрактометрии высокого разрешения (синхротронное излучение) с помощью основанного на реальном пространстве подхода в соответствии с так называемым методом "моделируемого отжига" ("simulated annealing"). Параметры кристаллической структуры уточняли путем последующего анализа по методу Ритвелда. Экспериментальные данные, полученные для безводного кристаллического тиотропийбромида, представлены в табл. 4. Таблица 4. Экспериментальные данные, полученные по результатам структурного анализа кристаллического моногидрата тиотропийбромида (безводного) ФормулаZ 4 Рассчитанная плотность [г/см 3] 1,56 2,0-20 2 (диапазон) [] 0,003 Интервал [2] Время подсчета/шаг [с] 3 Длина волны [] 0,7000 В соответствии с этим настоящее изобретение относится к безводному кристаллическому тиотропийбромиду, отличающемуся наличием элементарной ячейки со следующими параметрами: а=10,4336(2) ,b=11,3297(3) , с=17,6332 , =90, =105,158(2) и =90 (объем ячейки = 2011,89(8) 3). Кристаллическую структуру безводной формы тиотропийбромида можно представить в виде слоистой структуры. Между образованными тиотропийбромидом слоями локализованы бромид-ионы. Структуру безводного кристаллического тиотропийбромида исследовали путем рентгеновской порошковой дифрактометрии высокого разрешения при комнатной температуре на Национальной установке с источником синхротронного излучения (Брукхейвенская национальная лаборатория (BrookhavenNational Laboratory), США) на измерительной станции Х 3 В 1 ( = 0,700 ). Для проведения этого эксперимента образец кристаллического моногидрата тиотропийбромида помещали в капилляр из кварцевого стекла диаметром 0,7 мм. Для удаления воды образец нагревали в соответствующей печи до 80 С при пониженном давлении. Структурные особенности безводного кристаллического тиотропийбромида определяли в соответствии с так называемым методом "моделируемого отжига". С этой целью использовали пакет программ DASH, разработанный Cambridge Crystallographic DataCenter (CCDC, Кембридж, Великобритания). Координаты атомов, определенные для безводного кристаллического тиотропийбромида по результатам описанного выше эксперимента, приведены ниже в табл. 5. В приведенной выше таблице значения "Uизо" представляют собой изотропные температурные коэффициенты. Так, например, эти значения в рентгеноструктурном анализе монокристаллов соответствуют значениям u(eq). В табл. 6 представлены данные о рефлексах (кристаллографические индексы h, k, l), присутствующих на порошковой рентгенограмме, полученной для безводного кристаллического тиотропийбромида.-7 005813 Таблица 6. Экспериментальные данные, полученные по результатам структурного анализа безводного кристаллического тиотропийбромида Поскольку предлагаемая в изобретении безводная форма обладает фармацевтической эффективностью, еще одним объектом настоящего изобретения является также применение безводного кристаллического тиотропийбромида в качестве лекарственного средства. Предназначенное для ингаляционного вве-8 005813 дения лекарственное средство, прежде всего порошок для ингаляции, в состав которого входит представленный в настоящем изобретении безводный кристаллический тиотропийбромид, можно получать известными из уровня техники методами. В этом отношении можно, например, сослаться на заявку DE-A1792207. В соответствии с этим в настоящем изобретении предлагается также порошок для ингаляции,отличающийся тем, что он содержит безводный кристаллический тиотропийбромид. Учитывая высокую эффективность тиотропийбромида в состав описанных выше порошков для ингаляции наряду с собственно действующим веществом предпочтительно включать также физиологически совместимые вспомогательные вещества. В качестве примера таких физиологически совместимых вспомогательных веществ, которые могут использоваться для получения порошков для ингаляции, можно назвать моносахариды (например глюкозу или арабинозу), дисахариды (например лактозу, сахарозу,мальтозу), олиго- и полисахариды (например декстраны), полиспирты (например сорбит, маннит, ксилит), соли (например хлорид натрия, карбонат кальция) или смеси этих вспомогательных веществ между собой. Предпочтительно применять моно-или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в форме их гидратов. Особенно предпочтительным согласно изобретению является применение в качестве вспомогательного вещества лактозы, наиболее предпочтительно применение моногидрата лактозы. Максимальная средняя крупность частиц вспомогательных веществ, применяемых в предлагаемых в изобретении порошках для ингаляции, которые содержат безводный кристаллический тиотропийбромид, составляет вплоть до 250 мкм, предпочтительно от 10 до 150 мкм, наиболее предпочтительно от 15 до 80 мкм. При определенных условиях может оказаться целесообразным примешивать к указанным выше вспомогательным веществам их же фракции с меньшей средней крупностью частиц, составляющей от 1 до 9 мкм. Подобные вспомогательные вещества с меньшей крупностью их частиц также выбирают из описанной выше группы применяемых в порошках для ингаляции вспомогательных веществ. Предпочтительные содержащие предлагаемый в изобретении ангидрат тиотропийбромида порошки для ингаляции отличаются тем, что входящее в их состав вспомогательное вещество представляет собой смесь различных его фракций, одна из которых представлена в виде частиц большей крупности, средний размер которых составляет от 17 до 50 мкм , наиболее предпочтительно от 20 до 30 мкм, а другая - в виде частиц меньшей крупности, средний размер которых составляет от 2 до 8 мкм , наиболее предпочтительно от 3 до 7 мкм. При этом под средним размером, соответственно средней крупностью частиц в контексте настоящего изобретения подразумевается размер 50% всех частиц, объемное распределение которых по крупности измеряли с помощью лазерного дифрактометра методом сухого диспергирования. Предпочтительными являются те порошки для ингаляции, в которых на долю вспомогательного вещества,представленного в виде частиц меньшей крупности, приходится от 3 до 15%, наиболее предпочтительно от 5 до 10%, от общего количества вспомогательного вещества. Ниже более подробно описан один из возможных способов получения предпочтительных согласно изобретению порошков для ингаляции. Сначала из исходных материалов, взятых в необходимых мерных количествах, приготавливают смесь различных фракций вспомогательного вещества, одна из которых представлена в виде частиц большей крупности, а другая - в виде частиц меньшей крупности. Затем из полученной смеси разнородных по крупности фракций вспомогательного вещества и действующего вещества получают предлагаемые в изобретении порошки для ингаляции. Если порошок для ингаляции предусматривается вводить в организм с помощью ингалеток с использованием пригодных для этой цели ингаляторов, то после получения порошка для ингаляции изготавливают содержащие его капсулы. Предлагаемые в изобретении порошки для ингаляции получают смешением в определенной пропорции фракции вспомогательного вещества, представленной в виде частиц большей крупности, с его же фракцией, представленной в виде частиц меньшей крупности, и последующим смешением полученных таким путем смесей разнородных по крупности фракций вспомогательного вещества с действующим веществом. Для получения смеси вспомогательных веществ, состоящей из вспомогательного вещества с частицами большей крупности и вспомогательного вещества с частицами меньшей крупности, эти вспомогательные вещества, представленные в виде частиц большей и меньшей крупности, загружают в соответствующий смеситель. Оба этих компонента предпочтительно подавать в смеситель через ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать вспомогательное вещество, представленное в виде частиц большей крупности, а затем подавать в него вспомогательное вещество, представленное в виде частиц меньшей крупности. При такой технологии смешения оба компонента смеси предпочтительно подавать отдельными порциями, загружая в смеситель сначала часть вспомогательного вещества с частицами большей крупности, а затем попеременно добавляя в него вспомогательные вещества, представленные в виде частиц меньшей и большей крупности. При получении смеси вспомогательных веществ наиболее предпочтительным является поочередное, послойное просеивание обоих компонентов. В этом случае оба компонента предпочтительно просеивать поочередно слоями, количество которых для каждого компонента составляет по 15-45, предпочтительно по 20-40,слоев. Оба вспомогательных вещества можно смешивать между собой уже в процессе подачи обоих этих-9 005813 компонентов в смеситель. Более предпочтительно, однако, начинать смешение обоих компонентов смеси только после их послойного просеивания. После приготовления смеси вспомогательных веществ эту смесь и действующее вещество загружают в соответствующий смеситель. Средняя крупность частиц используемого действующего вещества составляет от 0,5 до 10 мкм, предпочтительно от 1 до 6 мкм, наиболее предпочтительно от 2 до 5 мкм. Оба этих компонента предпочтительно подавать в смеситель через ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать смесь вспомогательных веществ, а затем подавать в него действующее вещество. При такой технологии смешения оба компонента смеси предпочтительно подавать отдельными порциями. При приготовлении смеси, состоящей из смеси вспомогательных веществ и действующего вещества, наиболее предпочтительным является поочередное,послойное просеивание обоих компонентов. В этом случае оба компонента предпочтительно просеивать поочередно слоями, количество которых для каждого компонента составляет по 25-65, предпочтительно по 30-60, слоев. Смесь вспомогательных веществ можно смешивать с действующим веществом уже в процессе подачи обоих этих компонентов в смеситель. Более предпочтительно, однако, начинать смешение обоих компонентов только после их послойного просеивания. Полученную таким путем порошковую смесь при необходимости можно повторно одно- или многократно пропускать через ситовый гранулятор и затем каждый раз после очередного просеивания подвергать ее дальнейшему процессу смешения. Получаемые описанным выше способом порошки для ингаляции содержат тиотропий в количестве предпочтительно примерно от 0,001 до 2% в смеси с физиологически совместимым вспомогательным веществом. Предпочтительными являются такие порошки для ингаляции, которые содержат тиотропийбромид в количестве от 0,04 до 0,8% в смеси с физиологически безвредным вспомогательным веществом и которые отличаются тем, что вспомогательное вещество представляет собой смесь из вспомогательного вещества, представленного в виде частиц большей крупности, средний размер которых составляет от 15 до 80 мкм, и вспомогательного вещества, представленного в виде частиц меньшей крупности,средний размер которых составляет от 1 до 9 мкм, при этом на долю вспомогательного вещества, представленного в виде частиц меньшей крупности, приходится от 1 до 20% от всего количества вспомогательного вещества. К предпочтительным согласно изобретению относятся порошки для ингаляции, содержание в которых тиотропийбромида составляет от 0,08 до 0,64%, наиболее предпочтительно от 0,16 до 0,4%. Поскольку в составе описанных выше порошков для ингаляции согласно изобретению используется безводный кристаллический тиотропийбромид, предпочтительное содержание ангидрата тиотропийбромида в таких порошковых смесях составляет от 0,0012 до 2,41%. Равным образом предпочтительны порошки для ингаляции, содержащие ангидрат тиотропийбромида в количестве от 0,048 до 0,96%. Особый интерес согласно изобретению представляют порошки для ингаляции, содержание в которых ангидрата тиотропийбромида составляет от 0,096 до 0,77%, наиболее предпочтительно от 0,19 до 0,48%. В контексте настоящего изобретения указанные в процентах данные представляют собой во всех случаях массовые проценты (мас.%). В соответствии с другим, равным образом предпочтительным вариантом осуществления изобретения порошки для ингаляции, содержащие ангидрат тиотропийбромида, можно далее получать исходя из порошков для ингаляции, получаемых на основе кристаллического моногидрата тиотропийбромида. Такие порошки содержат кристаллический моногидрат тиотропийбромида в количестве от 0,0012 до 2,5%,предпочтительно от 0,05 до 1%, более предпочтительно от 0,1 до 0,8%, наиболее предпочтительно от 0,2 до 0,5%, и их предпочтительно получать аналогично описанному выше способу. Эти, содержащие кристаллический моногидрат тиотропийбромида порошки для ингаляции при получении из них порошков для ингаляции,содержащих предлагаемый в изобретении ангидрат тиотропийбромида, можно до либо предпочтительно после их расфасовки в соответствующие капсулы для ингаляции подвергать сушке при температуре выше 60 С, предпочтительно при температуре в интервале от 65 до 100 С, наиболее предпочтительно от 70 до 100 С, при пониженном давлении, предпочтительно в высоком вакууме, в течение промежутка времени, составляющего от 15 мин до 24 ч, предпочтительно от 20 мин до 12 ч, наиболее предпочтительно от 30 мин до 6 ч. Под пониженным давлением в данном случае подразумевается давление, величина которого достигает 510-2 бар, предпочтительно 110-2 бар, наиболее предпочтительно 510-3 бар. Указанное выше обезвоживание до ангидрата наиболее предпочтительно проводить при давлении порядка 110-3 бар или менее. Учитывая наличие у тиотропийбромида антихолинергического действия, еще одним объектом настоящего изобретения является применение безводного кристаллического тиотропийбромида для получения лекарственного средства, предназначенного для лечения заболеваний, при которых применение антихолинергического средства может оказывать эффективное терапевтическое действие. Предпочтительно при этом применять предлагаемый в изобретении безводный кристаллический тиотропийбромид для получения лекарственного средства, предназначенного для лечения астмы или ХОЗЛ.- 10005813 Ниже способ получения безводного кристаллического тиотропийбромида проиллюстрирован на примере его синтеза. Следует, однако, отметить, что в этом примере синтеза рассмотрен только один из возможных вариантов осуществления изобретения, не ограничивающий его объем. Пример синтеза А) Получение кристаллического моногидрата тиотропийбромида В реактор заливают 25,7 кг воды и добавляют 15,0 кг тиотропийбромида. Смесь нагревают до 8090 С и перемешивают при этой температуре до образования прозрачного раствора. Одновременно с этой операцией в 4,4 кг воды суспендируют увлажненный водой активированный уголь (0,8 кг), эту смесь добавляют к содержащему тиотропийбромид раствору и дополнительно промывают 4,3 кг воды. Полученную таким путем смесь перемешивают по меньшей мере в течение 15 мин при 80-90 С и затем подают через обогреваемый фильтр в аппарат с рубашкой, предварительно нагретой до температуры 70 С. Фильтр дополнительно промывают 8,6 кг воды. Затем содержимое аппарата охлаждают со скоростью 35 С/20 мин до температуры 20-25 С. Далее аппарат охлаждают до 10-15 С с помощью холодной воды и завершают кристаллизацию путем последующего перемешивания по меньшей мере в течение одного часа. Кристаллизат выделяют с помощью сушилки с нутч-фильтром и затем выделенную суспензию кристаллов промывают 9 л холодной воды (10-15 С) и холодным ацетоном (10-15 С). Полученные кристаллы сушат при 25 С в течение 2 ч в токе азота. Выход: 13,4 кг моногидрата тиотропийбромида (86% от теории). Б) Получение безводного кристаллического тиотропийбромида Из полученного описанным выше методом кристаллического моногидрата тиотропийбромида путем тщательной сушки при 80-100 С и при пониженном давлении, предпочтительно в высоком вакууме(при давлении порядка 110-3 бар или менее), в течение по меньшей мере 30 мин получают безводную форму. Альтернативой получению безводной формы путем такой сушки при 80-100 С в вакууме может быть ее получение путем выдержки кристаллического моногидрата тиотропийбромида в присутствии высушенного силикагеля при комнатной температуре в течение по меньшей мере 24 ч. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Безводный кристаллический тиотропийбромид, имеющий моноклинную элементарную ячейку со следующими параметрами: а = 10,4336(2) , b = 11,3297(3) , с = 17,6332(4) ,= 90,= 105,158(2) и= 90 (объем ячейки равен 2011,89(8) 3). 2. Способ получения безводного кристаллического тиотропийбромида по п.1 путем сушки кристаллического моногидрата тиотропийбромида при температуре выше 50 С, предпочтительно при температуре в интервале от 60 до 100 С, и при пониженном давлении. 3. Способ по п.2, отличающийся тем, что продолжительность сушки составляет от 15 мин до 24 ч. 4. Способ получения безводного кристаллического тиотропийбромида по п.1 путем выдержки кристаллического моногидрата тиотропийбромида в присутствии осушителя в течение 12-96 ч. 5. Безводный кристаллический тиотропийбромид, получаемый способом по пп.2, 3 или 4. 6. Применение кристаллического моногидрата тиотропийбромида для получения безводного кристаллического тиотропийбромида. 7. Лекарственное средство, отличающееся тем, что оно содержит безводный кристаллический тиотропийбромид по п.1 или 5. 8. Лекарственное средство по п.7, отличающееся тем, что оно представляет собой порошок для ингаляции. 9. Порошок для ингаляции, отличающийся тем, что он содержит безводный кристаллический тиотропийбромид по п.1 или 5 в смеси с физиологически совместимым вспомогательным веществом. 10. Порошок для ингаляции по п.9, отличающийся тем, что вспомогательное вещество выбрано из группы, включающей глюкозу и лактозу. 11. Применение безводного кристаллического тиотропийбромида по п.1 или 5 в качестве активного компонента для получения лекарственного средства, предназначенного для лечения заболеваний, при которых использование антихолинергического средства может оказывать эффективное терапевтическое действие. 12. Применение по п.11, отличающееся тем, что указанными заболеваниями являются астма или хроническое обструктивное заболевание легких.
МПК / Метки
МПК: C07D 451/10, A61K 31/46, A61P 11/06
Метки: безводный, применение, лекарственного, получения, кристаллический, тиотропийбромид, средства, способ
Код ссылки
<a href="https://eas.patents.su/12-5813-bezvodnyjj-kristallicheskijj-tiotropijjbromid-sposob-ego-polucheniya-i-ego-primenenie-dlya-polucheniya-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Безводный кристаллический тиотропийбромид, способ его получения и его применение для получения лекарственного средства</a>
Предыдущий патент: Ингибиторы тирозинкиназы
Следующий патент: Твердая термоформируемая фармацевтическая композиция для контролируемого высвобождения ивабрадина
Случайный патент: Выдувная пленка, способ ее получения, применение и изделие