S-замещенные тиоловые эфиры 11&beta-бензальдоксимэстра-4,9-диенугольной кислоты, способ их получения и содержащие эти соединения фармацевтические композиции
Номер патента: 2766
Опубликовано: 29.08.2002
Авторы: Шуберт Герд, Элгер Вальтер, Ринг Свен, Шнайдер Биргит, Кауфманн Гюнтер
Формула / Реферат
1. S-замещенные тиоловые эфиры 11b -бензальдоксимэстра-4,9-диенугольной кислоты общей формулы I
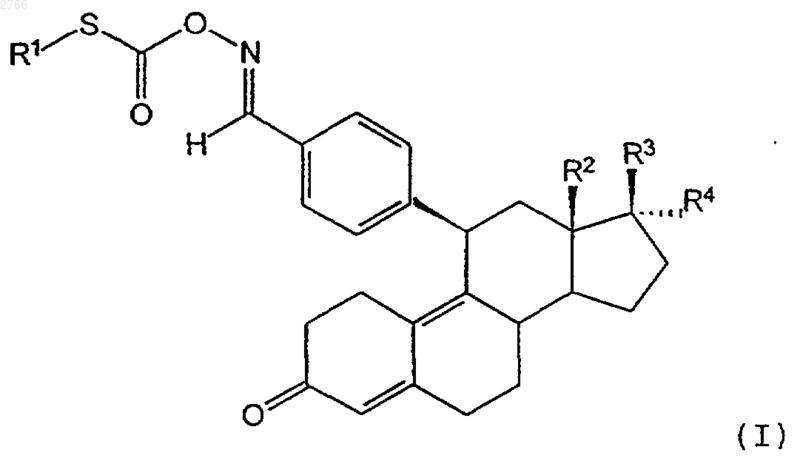
в которой R1 представляет собой алкильный остаток с 1-10 атомами углерода, арильный остаток с 6-10 атомами углерода или алкиларильный либо арилалкильный остаток, каждый соответственно с 7-10 атомами углерода,
R2 представляет собой алкильный остаток с 1-3 атомами углерода или атом водорода,
R3 представляет собой гидроксильную группу, O-алкильную группу с 1-10 атомами углерода, O-арильную группу с 6-10 атомами углерода, O-аралкильную либо O-алкиларильную группу, каждую соответственно с 7-10 атомами углерода, остаток -OCOR5, -OCONHR5 или -OCOOR5, где R5 обозначает атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,
R4 представляет собой атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода, остаток -(CH2)nCH2Y,
где n обозначает 0, 1 или 2,
Y обозначает атом фтора, хлора, брома, либо иода, циано-, амино-, азидо-, либо родановую группу или остаток -OR6, -SR6, -(CO)SR6 или -(СО)OR6,
где R6 обозначает атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,
или обозначает остаток -COR5, где R5 имеет указанные выше значения,
остаток -OR5 или -ОCOR5, где R5 имеет указанные выше значения,
остаток-(СН2)m-СН=СН(СН2)p-R6, где m обозначает 0, 1, 2 или 3, р обозначает 0, 1 или 2 и R6 имеет указанные выше значения или представляет собой остаток -OR5 или -OCOR5, где R5 имеет указанные выше значения,
остаток -(CH2)oCуCR7, где о обозначает 0, 1 или 2 и
R7 обозначает атом водорода, атом фтора, хлора, брома либо иода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,
или представляет собой остаток -OR5, где R5 имеет указанные выше значения, либо остаток -OCOR5, где R5 имеет указанные выше значения, либо остаток -CH2OR5, где R5 имеет указанные выше значения, или остаток -СуССН2ОН, или
R3 и R4, оба вместе, образуют произвольно замещенное пяти- либо шестичленное кольцо, по меньшей мере, с одним атомом углерода и 0-4 гетероатомами, выбранными из группы, включающей кислород, серу, селен, теллур, азот, фосфор, кремний и германий,
и их фармацевтически приемлемые соли.
2. Соединения по п.1, отличающиеся тем, что R1 представляет собой алкильный остаток с 1-6 атомами углерода.
3. Соединения по любому из предыдущих пунктов, отличающиеся тем, что R2 представляет собой метальную или этильную группу.
4. Соединения по любому из предыдущих пунктов, отличающиеся тем, что R3 представляет собой гидроксильную группу.
5. Соединения по любому из пп.1-3, отличающиеся тем, что R3 представляет собой O-алкильную группу с 1-6 атомами углерода.
6. Соединения по любому из предыдущих пунктов, отличающиеся тем, что R4 представляет собой остаток -OR5 или -OCOR5, где R5 обозначает алкильную группу с 1-6 атомами углерода.
7. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(CH2)m-CH=CH(CH2)p-R6, где m обозначает 1 и р обозначает 1, а R6 представляет собой алкильную группу с 1-6 атомами углерода или остаток -OR5 либо -OCOR5, где R5 обозначает атом водорода или алкильную группу с 1-6 атомами углерода.
8. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(СН2)m-СН=СН(CH2)p-R6, где m обозначает 0 и р обозначает 1, а R6 представляет собой остаток -OR5 либо -OCOR5, где R5 обозначает атом водорода или алкильную группу с 1-6 атомами углерода.
9. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(СН2)oСуСR7, где о обозначает 1, а R7 обозначает алкильную группу с 1-6 атомами углерода либо остаток -OCOR5 или остаток -CH2OR5, где R5 представляет собой алкильную группу с 1-6 атомами углерода или атом водорода.
10. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(CH2)nCH2Y, где n обозначает 0 или 1, Y обозначает атом фтора, хлора, брома либо иода, циано-, амино-, азидо- либо родановую группу, или остаток -OR6 либо -SR6, -(CO)SR6 либо -(СО)OR6, где R6 представляет собой атом водорода или алкильную группу с 1-10 атомами углерода.
11. Соединения по любому из пп.1-3, отличающиеся тем, что R3 и R4 оба вместе образуют произвольно замещенное пяти- либо шестичленное кольцо, по меньшей мере, с одним атомом углерода и 0-4 гетероатомами, при этом гетероатомы выбраны из группы, включающей кислород, серу и азот.
12. Соединения по п.11, отличающиеся тем, что образуется пятичленное кольцо, содержащее 1 или 2 гетероатома.
13. Соединения по п.12, отличающиеся тем, что кольцо представляет собой гетероцикл, образованный из группы, включающей оксазолидинон, оксазолинон, тиазолидинон, тиазолинон, имидазолидинон, имидазолинон, 1,3-диоксоланон, 1,3-диоксоленон, 1,3-оксатиоланон, 1,3-оксатиоленон, пирролидинон, пирролинон, оксазолидинтион, оксазолинтион, тиазолидинтион, тиазолинтион, имидазолидинтион, имидазолинтион, диоксолантион, лирролидинтион и пирролинтион.
14. Соединения по п.13, отличающиеся тем, что пятичленное кольцо представляет собой оксазолидин-2-он или оксазолидин-2-тион.
15. Соединения по п.1, а именно
4-[17b -метокси-17a -(метоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(метоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -метокси-17a -(метоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -метокси-17a -(метоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Z)-[О-(этилтио)карбонил]оксим,
4-[17b -метокси-17a -(этоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(метоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[O-(н-пропилтио)карбонил]оксим,
4-[17b -метокси-17a -(н-пропоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(н-пропоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(метоксиметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(Z)-(3-гидроксипропенил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(Е)-(3-гидроксипропенил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -метокси-17a -(3-гидрокси-1-пропинил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(азидометил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(хлорметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -этокси-17a -(хлорметил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(цианометил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(этилтиометил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(этилтиометил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,
4-[17b -этокси-17a -(метилтиометил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -[(этилтиокарбонил)метил]-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим,
4-[17b -гидрокси-17a -(аминометил)-3-оксоэстра-4,9-диен-11b -ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим и
(17R)-4-{3-оксоэстра-4,9-диен-17-спиро-5'-оксазолидин-2'-он-11b -ил}бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим.
16. Способ получения S-замещенных тиоловых эфиров 11b -бензальдоксимэстра-4,9-диенугольной кислоты общей формулы I
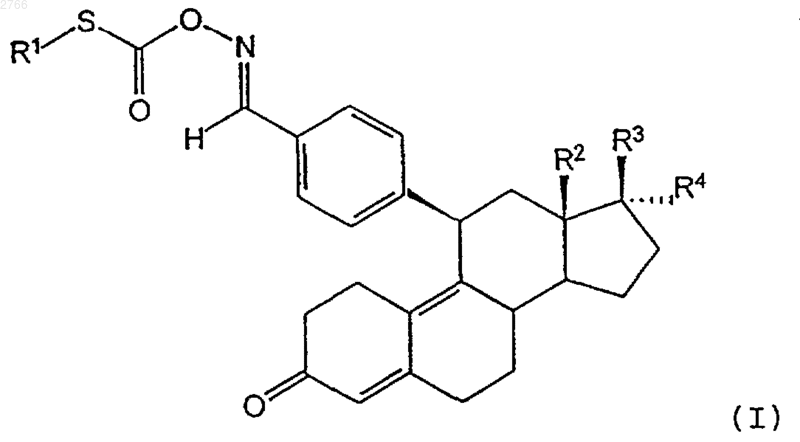
в которой R2, R3 и R4 имеют значения, указанные в п.1, отличающийся тем, что соединение общей формулы II
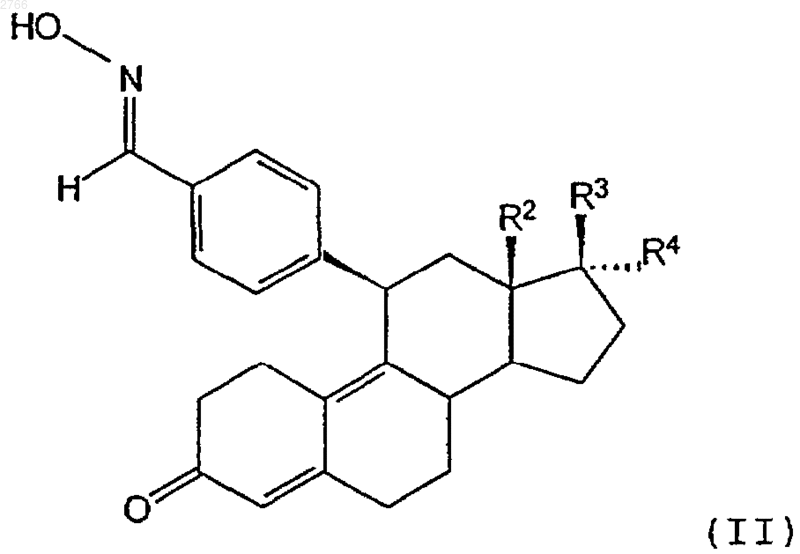
в которой R2, R3 и R4 имеют те же значения, что и R2, R3 и R4 в формуле I, известным образом подвергают в растворителе взаимодействию с производным муравьиной кислоты формулы III
Nuc-(CO)-SR1, III
где R1 имеет значения, указанные в п.1, a Nuc обозначает нуклеофил, и затем переводят в соединение общей формулы I.
17. Способ по п.16,отличающийся тем, что в качестве растворителя применяют третичный амин, а реакцию осуществляют при температуре в интервале от 20 до 80шС.
18. Способ по п.17, отличающийся тем, что осуществляют взаимодействие с тиоэфирами хлормуравьиной кислоты в пиридине или триэтиламине при температуре в интервале от 20 до 40шС.
19. Фармацевтические композиции, отличающиеся тем, что они содержат в своем составе, по меньшей мере, одно соединение по любому из пп.1-15.
20. Применение соединений по любому из пп.1-15 для лечения эндометриоза, Uterus myomatosus, дисменореи и предменструального синдрома, для индукции обратимой аменореи без дефицита эстрогенов и для гормонозаместительной терапии (ГЗТ) в климактерический период, при необходимости в сочетании с эстрогенами.
21. Применение соединений по любому из пп.1-15 для получения противозачаточных средств.
Текст
1 Настоящее изобретение относится к новымS-замещенным тиоловым эфирам 11 бензальдоксимэстра-4,9-диенугольной кислоты общей формулы I и к их фармацевтически приемлемым солям, а также к способу получения этих соединений и к содержащим их фармацевтическим композициям. Из заявок ЕР-А 0648778 и ЕР-А 0648779 известны сложные эфиры, эфиры угольной кислоты и уретаны 11-бензальдоксимэстра-4,9 диенов. Описанные в этих публикациях соединения обладают антигестагенным действием. Антигестагены представляют собой стероиды, которые подобно прогестерону и другим гестагенным субстанциям проявляют высокую степень сродства к рецептору прогестерона. Однако в отличие от них они не приводят к типичным физиологическим эффектам, воспринимаемым и преобразуемым рецептором прогестерона. Скорее имеет место вытеснение прогестерона из места его связывания с рецептором и подавление его действия. Из научной литературы по данному вопросу известно, что при этом наряду с вытеснением прогестерона из места его связывания решающую роль играют нарушения функции рецептора по отношению к регуляции генов (Klein-Hitpass L., Cato A.C.B., Henderson(1992), стр. 146); McDonnell D.P., Trends Endocrinol. Metab. 6 (1995), стр.133-138). Касательно последнего аспекта следует отметить отличия известных антагонистов, таких например, как ZK 98299 (онапристон) (выложенная заявка DE 3504421) и RU 486 (мифепристон) (ЕР-А 0057115), на молекулярном уровне (антагонисты типа I и типа II), которые состоят в том, что в случае антагонистов типа I(например онапристона) гормонорецепторный комплекс более не способен вовсе или способен лишь к неустойчивому связыванию с восприимчивыми по отношению к гормонам элементами ДНК, тогда как тип II (например RU 486) такую способность сохраняет (Klein-Hitpass и др.). Антигестагены, еще не утратившие способности связывать рецепторы с ДНК, могут обладать действием, сходным с прогестероном, тогда как при нарушении такого связывания рецептора с ДНК это невозможно. Модуляцию активности отдельных антагонистов прогестерона по отношению к регуляции генов можно осуществлять также с помощью механизмов, которые сначала активно воздействуют на рецепторный белок. Результаты проведенных исследований подтвердили, что актив 002766 2 ность комплексов антагонист-рецептор по отношению к регуляции генов стимулируется циклическим АМФ. При наличии высоких концентраций цАМФ в тканях наблюдается активация комплексов антагонист-рецептор, при низких же концентрациях указанная активность рецептора остается подавленной. Проявление соответствующих феноменов обусловлено, как очевидно, также спецификой субстанций. Образование высоких концентраций цАМФ (in vitro) приводит у некоторых антигестагенов к частичному агонистическому действию, у других же субстанций стимулировать соответствующие эффекты с помощью цАМФ не удается (Sartorius C.A., Tung L., Takimoto G.S., Horwitz K.B., J.Biol. Chem 268 (1993), стр. 9262-9266; Sobek L.,Kaufmann G., Schubert О. и Oettel M., Материалы 79-й ежегодной конференции Общества эндокринологии, 3-452, стр. 549 (1997. Различия на молекулярном уровне находят свое отражение и в фармакодинамических свойствах антагонистов прогестерона. Эти различные фармакодинамические свойства можно проиллюстрировать на примере субстанций,таких как онапристон и мифепристон (RU 486),исчерпывающе охарактеризованных in vivo и inVan Look P.F.H., 1994, стр. 303-328]. В регуляции жизнедеятельности органов,участвующих в процессах воспроизведения,прогестерон играет решающую роль. Сказанное относится к морфологическим процессам перестройки генитального тракта и молочных желез,к регуляции гормонов передней доли гипофиза и половых органов или к подавлению, соответственно активации процесса родов. Указанные функции по-разному реагируют на прогестерон. Процессы, происходящие при очень низком уровне прогестерона, заслуживают с учетом фармакологии антигестагенов особого внимания и изучения. "Чистые" антагонисты прогестерона типа I позволяют добиться таких эффектов, которых невозможно достичь ни при какой дозировке антагонистов, обладающих частичным агонистическим действием. Если такое в принципе и возможно, то лишь при условии, что порог для достижения соответствующего эффекта низок, иными словами, этот порог ниже частичной агонистической активности используемого антагониста прогестерона. С другой же стороны, существует возможность добиться с помощью антагонистов прогестерона типа II таких эффектов, которые стимулируются не подавлением, а активацией рецептора прогестерона. При одной и той же дозировке этого антагониста подавляются функции прогестерона, наблюдаемые при его высоких концентрациях в тканях. В качестве примера, подтверждающего первый из указанных случаев, можно назвать 3 секрецию простагландинов маткой у морской свинки в цикле. Эта секреция к концу цикла стимулируется вследствие наиболее низкого уровня содержания прогестерона в крови. И только чистые антагонисты прогестерона типа I способны подавить секрецию простагландинов маткой у морских свинок настолько, чтобы полностью предотвратить инволюцию желтого телаP.F.H., 1994, стр. 303-328). Обладающие частичным агонистическим действием субстанции подавляют этот процесс в малой степени или не подавляют его вовсе. Антагонист прогестерона RU 486 оказывает у человека различное воздействие на функции размножения, что является важным для применения в терапии. Указанная субстанция подавляет эффективность прогестерона в такой степени, что ее использование во время беременности может привести к выкидышу. Это приводящее к выкидышу или вызывающее боли свойство проявляется в еще большей степени при одновременном или последовательном лечении простагландином (Van Look P.F.A., Bygdeman M., Oxf. Rev. Reprod. Biol. 11 (1989), стр. 1-60; Elger W., Neef G., Beier S., Fhnrich M.,Grundel M. и др., Current Concepts in FertilityVan Look P.F.H., 1994, стр. 303-328). Достаточно полное объяснение таких эффектов можно обосновать, исходя из регулирующей беременность функции прогестерона во время беременности. Вместе с тем, RU 486 и другие антигестагены обусловливают эффекты, при которых механизм удаления прогестерона не так однозначно надежен. Сказанное относится в первую очередь к эффектам в тех фазах цикла, в которых уровень содержания прогестерона в крови очень низок. В этой связи следует особо отметить два феномена: подавление овуляции (Croxatto H.B.,Salvatierra A.M., Croxatto H.D., Fuentealba A.,Hum. Reprod. 8 (1993), стр. 201-207) и подавление индуцированной эстрогенами пролиферации эпителия половых органов, прежде всего пролиферации эндометрия (Wolf J.P., Hsiu J.G.,Anderson T.L., Ulmann A., Baulieeu E.E. иHodgen G.D., FertilitySterility 52 (1989), стр. 1055-1060). Такие эффекты играют главную роль при решении проблемы применения антигестагенов, прежде всего для противоовуляционной стратегии в целях контроля репродуктивной способности (фертильности), для воспроизводимого провоцирования аменореи, например,при терапии эндометриоза, и для подавления в процессе заместительной терапии эстрогенами в климактерический период нежелательных эффектов, обусловленных наличием эстрогенов в эндометрии. Для применения в терапии антагонистов типа II, таких как RU 486, абортивное и 4 вызывающее боли действие при одновременном проявлении агонистических по отношению к прогестерону и прежде всего противоовуляционных и подавляющих пролиферацию свойств,является очевидным недостатком. С учетом вышеизложенного в основу изобретения была положена задача получить соединения, с помощью которых можно было бы устранить указанные недостатки. Эта задача решается благодаря тому, что удалось получить соединения общей формулы I представленные в п.1 формулы изобретения, и их фармацевтически приемлемые соли, а также разработать способ их получения. В изобретении предлагаются также фармацевтические композиции, содержащие в своем составе одно из соединений общей формулы I или одну из его фармацевтически приемлемых солей. Объектом настоящего изобретения в соответствии с этим являются S-замещенные тиоловые эфиры 11-бензальдоксимэстра-4,9-диенугольной кислоты общей формулы IR1 представляет собой алкильный остаток с 110 атомами углерода, арильный остаток с 6-10 атомами углерода или алкиларильный либо арилалкильный остаток, каждый соответственно с 7-10 атомами углерода,R2 представляет собой алкильный остаток с 1-3 атомами углерода или атом водорода,R 3 представляет собой гидроксильную группу, O-алкильную группу с 1-10 атомами углерода, O-арильную группу с 6-10 атомами углерода, O-аралкильную либо O-алкиларильную группу, каждую соответственно с 7-10 атомами углерода, остаток -OCOR 5 ,-OCONHR5 или -OCOOR5,гдеR5 обозначает атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,R4 представляет собой атом водорода, алкильную группу с 1-10 атомами углерода,арильную группу с 6-10 атомами углерода,аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,остаток -(СН 2)nСН 2Y, 5 гдеn обозначает 0, 1 или 2,Y обозначает атом фтора, хлора, брома либо иода, циано-, амино-, азидо- либо родановую группу или остаток -OR6, -SR6, -(CO)SR6 или -(СО)OR6,гдеR6 обозначает атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода, или обозначает остаток -COR5, где R5 имеет указанные выше значения,остаток -OR5 или -OCOR5, где R5 имеет указанные выше значения, остаток -(СН 2)mСН=СН(СН 2)p-R6,гдеR6 имеет указанные выше значения или представляет собой остаток -OR5 или -OCOR5,где R5 имеет указанные выше значения,остаток -(CH2)oCCR7,где о обозначает 0, 1 или 2 иR7 обозначает атом водорода, атом фтора,хлора, брома либо иода, алкильную группу с 110 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода, или представляет собой остаток -OR5, где R5 имеет указанные выше значения, либо остаток -OCOR5, где R5 имеет указанные выше значения, либо остаток -CH2OR5, гдеR5 имеет указанные выше значения, или остатокR3 и R4 оба вместе образуют произвольно замещенное пяти- либо шестичленное кольцо, по меньшей мере, с одним атомом углерода и 0-4 гетероатомами, выбранными из группы, включающей кислород, серу, селен, теллур, азот, фосфор, кремний и германий. Предпочтительны соединения, в которыхR1 представляет собой алкильную группу с 1-6 атомами углерода. К предпочтительным относятся также соединения, в которых R2 представляет собой метильную либо этильную группу. Предпочтительно далее, чтобы R3 представлял собой гидроксильную группу или О-алкильную группу с 1-6 атомами углерода. Особенно предпочтительными являются соединения, в которых R4 представляет собой остаток -OR5 или OCOR5, где R5 обозначает алкильную группу с 1-6 атомами углерода. Согласно изобретению предпочтительно далее, чтобы R4 представлял собой остаток -(СН 2)mСН=СН(СН 2)p-R6, гдеR6 представляет собой алкильную группу с 16 атомами углерода либо группу -OR5 или -OCOR5,гдеR5 обозначает атом водорода или алкильную группу с 1-6 атомами углерода. К предпочтительным согласно изобретению соединениям относятся, кроме того, те из них, в которых R4 представляет собой остаток -(СН 2)mСН=СН(СН 2)p-R6, гдеR 6 представляет собой группу -OR 5 илиR5 обозначает атом водорода или алкильную группу с 1-6 атомами углерода. Особенно предпочтительными являются также соединения, в которых R4 представляет собой остаток -(CH2)oCR7, где о обозначает 1 иR7 обозначает алкильную группу с 1-6 атомами углерода или остаток -OCOR5 либо остаток -CH2OR5,гдеR5 представляет собой алкильную группу с 1-6 атомами углерода или атом водорода. Кроме того, согласно изобретению предпочтительны соединения, в которых R4 представляет собой остаток -(СН 2)nСН 2Y, гдеn обозначает 0 или 1, Y обозначает атом фтора, хлора, брома либо иода, циано-, амино-,азидо- либо родановую группу,или представляет собой остаток -OR6 либо 6-SR , -(CO)SR6 либо -(СО)OR6, где R6 обозначает атом водорода или алкильную группу с 1-10 атомами углерода. Согласно изобретению к предпочтительным относятся далее такие соединения, которые отличаются тем, что R3 и R4 оба вместе образуют произвольно замещенное пяти- либо шестичленное кольцо, по меньшей мере, с одним атомом углерода и 0-4 гетероатомами, при этом гетероатомы выбраны из группы, включающей кислород, серу и азот. Особенно предпочтительны при этом соединения, в которых образуется пятичленное кольцо, содержащее 1 или 2 гетероатома. Особенно предпочтительны такие соединения по изобретению, в которых кольцо представляет собой гетероцикл, образованный из группы, включающей оксазолидинон, оксазолинон, тиазолидинон, тиазолинон, имидазолидинон, имидазолинон, 1,3-диоксоланон, 1,3 диоксоленон, 1,3-оксатиоланон, 1,3-оксатиоленон, пирролидинон, пирролинон, оксазолидинтион, оксазолинтион, тиазолидинтион, тиазолинтион, имидазолидинтион, имидазолинтион, диоксолантион, пирролидинтион и пирролинтион. Еще более предпочтительными являются при этом соединения, в которых пятичленное кольцо представляет собой оксазолидин-2-он или оксазолидин-2-тион. К наиболее предпочтительным относятся следующие соединения:(17R)-4-3-оксоэстра-4,9-диен-17-спиро-5'оксазолидин-2'-он-11-илбензальдегид-1-(Е)[О-(этилтио)карбонил]оксим. Объектом настоящего изобретения является также способ получения предлагаемых соединений общей формулы I. Предлагаемый в изобретении способ получения S-замещенных тиоловых эфиров 11 бензальдоксимэстра-4,9-диенугольной кислоты общей формулы I в которой R2, R3 и R4 имеют указанные выше значения, отличается тем, что соединение общей формулы II в которой R2, R3 и R4 имеют те же значения, что и R2, R3 и R4 в формуле I, известным образом подвергают в растворителе взаимодействию с производным муравьиной кислоты формулы IIIIII 1 где R имеет указанные выше значения, a Nuc обозначает нуклеофил, и затем переводят в соединение общей формулы I. Предпочтителен при этом вариант способа,в котором в качестве растворителя используют третичный амин, а реакцию осуществляют при температуре в интервале от 20 до 80 С. Особенно предпочтителен вариант способа, в котором осуществляют взаимодействие с тиоэфирами хлормуравьиной кислоты в пиридине или в триэтиламине при температуре в интервале от 20 до 40 С. Исходные соединения общей формулы II получают, если не указано иное, в соответствии с рекомендациями согласно заявкам ЕР-А 0648778 или ЕР-А 0648779. Процесс получения фармацевтически приемлемых солей осуществляют по известной технологии. В качестве обычных физиологически приемлемых неорганических и органических кислот в этих целях используют среди прочих соляную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту, щавелевую кислоту, малеиновую кислоту, фумаровую кислоту, молочную кислоту, винную ки 9 слоту, яблочную кислоту, лимонную кислоту,салициловую кислоту, адипиновую кислоту и бензойную кислоту. Другие пригодные для использования в указанных целях кислоты описаны, например, в Fortschritte der Arzneimittelforschung, том 10, стр. 224-225, изд-во BirkhuserPharmaceutical Sciences, том 66, стр.1-5 (1977). Кислотно-аддитивные соли получают, как правило, по известной технологии путем смешения свободного основания либо его растворов с соответствующей кислотой либо с ее растворами в органическом растворителе, например в низшем спирте, таком как метанол, этанол, н-пропанол либо изопропанол, или в низшем кетоне, таком как ацетон, метилэтилкетон либо метилизобутилкетон, или в простом эфире,таком как диэтиловый эфир, тетрагидрофуран либо диоксан. Для более успешного осаждения кристаллов могут использоваться также смеси названных растворителей. Кроме того, можно получать и физиологически приемлемые водные растворы кислотно-аддитивных солей соединений формулы I с использованием в этих целях водного раствора соответствующей кислоты. Кислотно-аддитивные соли соединений общей формулы I по известной технологии, например с помощью щелочей или ионообменников, могут переводиться в свободное основание. Из свободного основания взаимодействием с неорганическими или органическими кислотами, прежде всего с такими, которые способны образовывать применимые в терапевтике соли,можно получать еще и другие соли. Эти или же иные соли нового соединения, как например пикрат, могут использоваться также для очистки свободного основания за счет перевода этого свободного основания в соль, его отделения и последующего повторного его выделения из соли. Еще одним объектом настоящего изобретения являются фармацевтические композиции,отличающиеся тем, что они содержат в своем составе, по меньшей мере, одно из соединений общей формулы I. Объектом настоящего изобретения являются также лекарственные средства, предназначенные для орального, ректального, подкожного, внутривенного или внутримышечного введения и содержащие в своем составе наряду с обычными носителями и разбавителями, по меньшей мере, одно из соединений общей формулы I в качестве активного вещества. Лекарственные средства согласно изобретению изготавливают в зависимости от методики введения в соответствующей дозировке и по известной технологии, используя в этих целях обычные твердые либо жидкие носители и/или разбавители и традиционно применяемые в фармацевтике вспомогательные вещества. Предпочтительные композиции целесообразно выпускать в лекарственной форме, пригодной 10 для орального приема. Такими лекарственными формами являются, например, таблетки, таблетки с пленочным покрытием, драже, капсулы,пилюли, порошки, растворы и суспензии, а также формы пролонгированного действия. Очевидно, что можно получать композиции, предназначенные для парентерального введения, такие как растворы для инъекций. Кроме указанных, в качестве примера следует назвать также композиции в виде суппозиториев. Соответствующие таблетки могут изготавливаться, например, путем смешения активного вещества с известными вспомогательными веществами, такими в частности, как декстроза,сахар, сорбит, маннит, поливинилпирролидон,разрыхлители, такие как кукурузный крахмал или альгиновая кислота, со связующими, такими как крахмал или желатин, с веществами,придающими скользкость, такими как стеарат магния или тальк, и/или с агентами, обеспечивающими эффект пролонгирования, такими как карбоксилполиметилен, карбоксиметилцеллюлоза, ацетофталат целлюлозы или поливинилацетат. Таблетки могут состоять также из нескольких слоев. Соответствующим образом можно изготавливать драже, покрывая оболочкой сердцевину, сформированную аналогично сердцевине таблеток, с использованием обычных в этих целях материалов, таких например, как поливинилпирролидон или шеллак, гуммиарабик,тальк, диоксид титана или сахар. Оболочка драже может при этом состоять из нескольких слоев, для чего могут применяться такие же вспомогательные вещества, что и для таблеток. Для улучшения вкуса к растворам или суспензиям, содержащим активное вещество по изобретению, можно примешивать такие вещества, как сахарин, цикламат либо сахар, и/или ароматизаторы, такие как ванилин или апельсиновый экстракт. Помимо названных можно вводить добавки вспомогательных суспендирующих агентов, таких как натрийкарбоксиметилцеллюлоза, или консервантов, таких как пгидроксибензойная кислота. Для изготовления капсул активное вещество можно смешивать с носителями, такими как молочный сахар или сорбит, после чего инкапсулировать. Суппозитории изготавливают, например,путем смешения активного вещества с соответствующими носителями, такими как нейтральные жиры или полиэтиленгликоль либо его производные. Предлагаемые в изобретении соединения общей формулы I связываются на рецепторе прогестерона (ср. табл. 1) и по сравнению с RU 486 обладают заметно сниженным антиглюкокортикоидным действием, что подтверждается снижением эффективности связывания глюкокортикоидов на рецепторе in vitro (ср. табл. 1). 11 Таблица 1. Связывание S-замещенных тиоловых эфиров 11-бензальдоксимэстра-4,9-диенугольной кислоты с рецептором Соединение из Относительная связыОтносительная связыпримера вающая аффинность в вающая аффинность в пересчете на моль (ОСА пересчете на моль (ОСА в %) рецептора прогесте- в %) рецептора глюкорона прогестерон = 100% кортикоида дексаметазон = 100% 1. (J 1241) 159 49 2. (J 1247) 185 52 3. (J 1042) 164 42 4. (J 1234) 144 53 5. (J 1240) 77 20 6. (J 1245) 64 22 7. (J 1230) 42 2 8. (J 1244) 74 32 для сравнения(онапристон) Примечание: J 867 означает 11-[4-(гидроксиминометил)фенил]-17-метокси-17-метоксиметилэстра 4,9-диен-3-он (ЕР-А 0648778 и ЕР-А 0648779). Таблица 2. Абортивное действие на ранней стадии беременности (5-7-й день) у крысы после подкожного введения [0,2 мл/животное/день в бензоилбензоате/касторовом масле (объемное соотношение 1:4)] Соединение из Доза Полное подавление примера Неожиданным образом было установлено,что субстанции по изобретению, обладающие высокой степенью сродства к рецептору прогестерона(см. табл. 1), оказались полностью неспособными или только лишь при очень высокой дозировке прервать беременность у крыс на ранней стадии. И даже при максимально высокой дозировке субстанции по изобретению (как например J 1042) оказались неспособны прервать беременность у морских свинок (см. табл. 3). Таблица 3. Абортивное действие после подкожного введения на 43-44-й день беременности у морских свинок Субстанция из Доза Полное подавление примера Несмотря на высокую степень сродства к рецептору соединения по изобретению не оказывают никакого ингибирующего воздействия на лютеолиз (образование желтого тела яичника). Неожиданным является то, что соединения формулы I обладают противоовуляционной и аналогичной прогестерону активностью у морских свинок. В отличие от действия онапристона, который у морских свинок в менструальном цикле несмотря на высокий уровень прогестерона в крови индуцирует пролиферацию и ороговение эпителия влагалища, эффективность предлагаемых в изобретении соединений (несмотря на низкий уровень прогестерона в крови), проявляющуюся в полном подавлении пролиферации этого эпителия и в повышении слизистости, следует рассматривать как фактор доминантности прогестерона. В этой структуре эффект субстанций по изобретению соответствует эффекту исследовавшихся параллельно гестагенов (прогестерона, соответственно левоноргестрела). В отношении других показателей, полученных на морских свинках, можно провести четкую границу между действием соединений формулы I по изобретению как против "чистых" антагонистов типа I (онапристона), так и против агонистов (прогестерона). Онапристон приводит к крайне низкому уровню простагландина в крови, тогда как прогестерон и левоноргестрел в отличие от него способствуют усилению и увеличению продолжительности секреции РGF2 в матке, что находит свое отражение в повышении уровня F-метаболита простагландина(PGMF-уровень) в крови. PGMF представляет собой долгоживущий главный метаболит образуемого эндометрием РGF2. При сравнении с контрольными животными, исследовавшимися в менструальном цикле в фазе лютеолиза, и животными, обработанными гестагеном, было установлено, что соединения по изобретению приводят к снижению PGFM-уровня. Однако показатели PGFM-уровня оказываются не столь низкими, как у животных, обработанных онапристоном. При тестировании на кроликах, проводившемся в тесте Макфейла, субстанции по изобретению проявили трансформаторную активность и неожиданно антитрансформаторную активность в сочетании с прогестероном. Исследования в экспериментах на животных подтверждают, что предлагаемые в изобретении антагонисты прогестерона обладают столь сильным частичным агонистическим действием на рецепторе прогестерона, благодаря которому абортивные эффекты более не проявляются. В отличие от этого неожиданно было установлено и наличие важных для терапии 13 свойств, таких в частности, как подавление секреции простагландинов маткой, подавление пролиферативных процессов в тканях генитального тракта и противоовуляционные свойства. Для описанного в настоящей заявке активного вещества предлагается название "мезопрогестин", поскольку понятие антигестаген подразумевает согласно общепринятому определению также наличие абортивных свойств, которые у соединений по изобретению во время экспериментов на животных не были обнаружены. Предлагаемые в изобретении соединения представляют собой высокоаффинные, высокоселективные модуляторы стероидных рецепторов. Прежде всего они являются агонистами или антагонистами рецепторов прогестерона и андрогенов. Еще одним объектом настоящего изобретения в соответствии с вышеизложенным является применение предлагаемых соединений общей формулы I для лечения эндометриоза.Uterus myomatosus, дисменореи и предменструального синдрома, для индукции обратимой аменореи без дефицита эстрогенов и для гормонозаместительной терапии (ГЗТ) в климактерический период, при необходимости в сочетании с эстрогенами. Согласно изобретению предусматривается также применение в целях получения противозачаточных средств. Предлагаемые соединения общей формулыI показаны согласно изобретению также к применению в следующих случаях: при нарушениях менструального кровотечения, при геморрагии, для контроля фертильности и модуляции фертильности, при миомах, лейомиоме, остеопорозе, акне (угрях), при опухолях, таких как опухоли груди, опухоли эндометрия, опухоли яичников, при эндометриозе, гиперплазии простаты, при опухолях предстательной железы,при облысении, обусловленном гормонами, а также при андрогенных заболеваниях и явлениях выпадения. Ниже изобретение более подробно поясняется на примерах. Общие рекомендации по синтезу S-замещенных производных 11-бензальдоксимэстра-4,9-диена К 2 ммолям 4-[17-замещенный-17 замещенный-3-оксоэстра-4,9-диен-11-ил]бензальдегид-(Е или Z) оксима в 10 мл пиридина добавляют 3 ммоля соответствующего S-алкил(арилового) эфира хлормуравьиной кислоты. Затем перемешивают при комнатной температуре до завершения полного превращения, сливают в воду и выпавший осадок отфильтровывают с помощью вакуум-фильтра, после чего промывают водой и сушат. Для очистки сырой продукт хроматографируют и/или перекристаллизовывают. Пример 1. 4-[17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим.H-ЯМР: [CDCl3; ТМС] (, част./млн): 0,54 (s,3H, Н-18); 1,37 (t, 3H, J = 7,2 Гц, SСН 2 СН 3); 1,61 (s,1H, ОН); 2,95 (q, 2H, J = 4,5 и 14,7 Гц СН 2 СН 3); 3,30 и 3,59 (2d, 2H, J = 12 Гц, 17-CH2N3); 4,45 (d, 1H, J = 6,9 Гц, Н-11); 5,80 (s, 1H, H-4); 7,29 (d, 2H, J = 8,4 Гц, Н-2'); 7,64 (d, 2H, J = 8,4 Гц, Н-3'); 8,32 (s, 1H,CH=N-OC=OSC2H5). Получение исходного соединения Стадия А. 1 г 4-[3,3-диметокси-5-гидрокси-17(S)спироэпоксиэстр-9-ен-11-ил]бензальдегид-1 этиленкеталя суспендируют в 50 мл этиленгликоля и перемешивают с 1 г азида натрия при 100 С в течение 2,5 ч. Затем охлажденный раствор сливают при перемешивании в воду, осадок отфильтровывают с помощью вакуумфильтра, промывают до нейтрального состояния и сушат. Таким путем получают 870 мг 4- [17 азидометил-3,3-диметокси-5,17-дигидроксиэстр-9-ен-11-ил]бензальдегид-1-этиленкеталя в виде пенистого вещества светло-коричневого цвета, которое непосредственно используют на последующей стадии. 1H-ЯМР: [СDСl3; ТМС]: 0,47 (s, 3 Н, Н-18); 1,87 (s, 1H, ОН); 3,21 и 3,23 (2s, в каждом случае 3 Н, ОСН 3); 3,22 и 3,54 (2d, 2H, J = 10,8 Гц,CH2N3); 4,0-4,16 (2m, 4H, этиленкеталь); 4,29 (d,1H, J = 7,2 Гц, Н-11); 4,68 (s, 1H, ОН); 5,76 (s,1H, СН-кеталь); 7,23 (d, 2H, J = 8,4 Гц, Н-2'); 7,38 (d, 2H, J = 8,4 Гц, Н-3'). Стадия Б. 650 мг 4-[17-азидометил-3,3-диметокси 5,17-дигидроксиэстр-9-ен-11-ил]бензальдегид-1-этиленкеталя подвергают в 12 мл ацетона и 1,2 мл воды при комнатной температуре взаимодействию со 155 мг п-толуолсульфокислоты. По истечении 2 ч нейтрализуют водным аммиаком, при этом выпадает осадок, который отфильтровывают с помощью вакуумфильтра и сушат. В завершение осуществляют(s, 3 Н, Н-18); 2,04 (s, 1H, ОН); 3,31 и 3,60 (2d,2H, J = 12,3 Гц, 17-СH2N3); 4,48 (d, 1H, J = 7,2 Гц, Н-11), 5,81 (s, 1H, H-4); 7,37 (d, 2H, J = 8,4 Гц, Н-2'); 7,82 (d, 2H, J = 8,4 Гц, Н-3'); 9,98 (s, 1H СНО). Стадия В. 495 мг 4-[17-азидометил-17-гидрокси-3 оксоэстра-4,9-диен-11-ил]бензальдегида подвергают реакции в 5 мл пиридина и 80 мг гидрохлорида гидроксиламина в течение 3 ч при комнатной температуре. Затем сливают в ледяную воду и образовавшийся бесцветный осадок отфильтровывают с помощью вакуум-фильтра,сушат и очищают посредством хроматографии. Таким путем получают 380 мг 4-[17 азидометил-17-гидрокси-3-оксоэстра-4,9-диен 11-ил]бензальдегид-(Е)-оксима.H-ЯМР: [СDСl3; ТМС]: 0,55 (s, 3 Н, Н-18); 1,35 и 1,37 (2t, 2x3H, СН 2 СН 3); 2,13 (s, 1H, ОН); 2,40 (s, 3 Н, SCH3); 2,87-2,99 (m, 4H, 2 хСН 2 СН 3); 4,20 и 4,34 (2d, 2H, J = 10,8 Гц, 17-СН 2 ОСН 3); 4,43 (d, 1H, J = 6,9 Гц, Н-11); 5,80 (s, 1H, H-4); 7,27 (d, 2H, J = 8,1 Гц, Н-2'); 7,64 (d, 2H, J = 8,4 Гц, Н-3'); 8,32 (s, 1H, CH=N-OC=OSCH3). Получение исходного соединения Стадия А. 3 г 4-[3,3-диметокси-5-гидрокси-17(S)спироэпоксиэстр-9-ен-17-ил]бензальдегид-1 этиленкеталя нагревают в 65 мл метилпирролидона в течение 5 ч до 110 С вместе с 22 мл 2 н.NaOH, после чего сливают в ледяную воду. Далее экстрагируют уксусным эфиром, органическую фазу промывают до нейтрального состояния, сушат и упаривают под вакуумом. Темное масло очищают посредством хроматографии,получая в результате 1,13 г 4- [3,3-диметокси 5,17-дигидрокси-17-(гидроксиметил)эстр-9 ен-11-ил]бензальдегид-1-этиленкеталя в виде пенистого вещества бледно-желтого цвета, которое непосредственно используют на последующей стадии. 1 18 Стадия Б. 1,13 г 4-[3,3-диметокси-5,17-дигидрокси-17-(гидроксиметил)эстр-9-ен-11-ил]бензальдегид-1-этиленкеталя растворяют в 17 мл ТГФ и перемешивают вместе с 2 мл воды и 260 мг п-толуолсульфокислоты в течение 4 ч при комнатной температуре. Затем под вакуумом концентрируют до половины объема и раствор сливают при перемешивании в ледяную воду. Далее дважды экстрагируют уксусным эфиром,органическую фазу промывают до нейтрального состояния, сушат и упаривают под вакуумом. Сырой продукт несколько раз перекристаллизовывают из уксусного эфира, получая в результате 308 мг 4-[17-гидрокси-17-(гидроксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегида.H-ЯМР: [СDСl3; ТМС]: 0,53 (s, 3 Н, Н-18); 3,4 и 3,8 (2m, 2H, СH2 О, 4,65 d и 4,95 d после добавления TAI: J = 12,0 Гц); 4,43 (d, 1H, J = 7,2 Гц, Н-11); 5,80 (s, 1H, Н-4); 7,38 (d, 2H, J = 8,1 Гц, Н-2'); 7,81 (d, 2H, J = 8,4 Гц, Н-3'); 9,97 (s,1H, CH=O). Стадия В. 752 мг 4-[17-гидрокси-17-(гидроксиметил)-3-оксоэстра-4,9-диен-11-ил]бензальдегида подвергают в 8 мл пиридина в атмосфере аргона в течение 40 мин при комнатной температуре при перемешивании взаимодействию со 128 мг гидрохлорида гидроксиламина. Затем раствор сливают в ледяную воду, осадок отфильтровывают с помощью вакуум-фильтра,промывают и сушат. В результате получают 690 мг 4-[17-гидрокси-17-(гидроксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-(Е)оксима.H-ЯМР: [CDCl3; ТМС]: 0,55 (s, 3 Н, Н-18); 1,29 (t, 3 Н, J = 7,2 Гц, SCH2 СН 3); 1,37 (t, 3 Н, J = 7,2 Гц, SCH2CH3); 2,60 (q, 2H, J = 7,2 Гц и J = 14,7 Гц, SСН 2 СН 3); 2,71 и 2,96 (2d, 2H, J = 12,9 Гц, 17-СН 2SC2 СН 3); 2,85 (s, 1H, ОН); 2,95 (m,2H, SCH2CH3); 4,44 (d, 1H, J = 7,2 Гц, H-11); 5,79 (s, 1H, H-4); 7,27 (d, 2H, J = 8,4 Гц, Н-2'); 7,63 (d, 2H, J = 8,4 Гц, Н-3'); 8,32 (s, 1H,CH=NOR). Получение исходного соединения Стадия А. 1,48 г 4-[3,3-диметокси-5-гидрокси-17(S)спироэпоксиэстр-9-ен-11-ил]бензальдегид-1 этиленкеталя нагревают вместе с 500 мг тиоэтанолята натрия в 15 мл ДМСО при перемешивании в течение 2 ч до 80 С. Затем сливают в ледяную воду, отфильтровывают с помощью вакуум-фильтра и промывают до нейтрального состояния. После сушки получают 1,47 г 4-[3,3 диметокси-5,17-дигидрокси-17-(этилтиометил)эстр-9-ен-11-ил]бензальдегид-1-этиленкеталя в виде сырого продукта коричневого цвета, который непосредственно используют на последующей стадии. Стадия Б. 1,47 г 4-[3,3-диметокси-5,17-дигидрокси-17-(этилтиометил)эстр-9-ен-11-ил]бензальдегид-1-этиленкеталя подвергают в 15 мл ацетона взаимодействию со 140 мг птолуолсульфокислоты в течение 4 ч при комнатной температуре. Затем сливают в водный раствор бикарбоната, отфильтровывают с помощью вакуум-фильтра и промывают до нейтрального состояния. Выпавший осадок (1,24 г) очищают посредством хроматографии. Таким путем получают 640 мг 4-[17-этилтиометил 17-гидрокси-3-оксоэстра-4,9-диен-11-ил]бензальдегида.H-ЯМР: [CDCl3; ТМС]: 0,54 (s, 3 Н, Н-18); 1,29 (t, 3 Н, SСН 2 СН 3); 2,61 (m, 2H, SСН 2 СН 3); 2,88 (s, 1H, ОН); 2,71 и 2,95 (2d, 2H, J = 12,9 Гц,CH2S); 4,48 (d, 1H, J = 7,2 Гц, H-11); 5,80 (s,1H, H-4); 7,37 (d, 2H, J = 8,1 Гц, H-2'); 7,81 (d,2H, J = 8,4 Гц, Н-3'); 9,98 (s, 1H, СН=O). Стадия В. 392 мг 4-[17-гидрокси-17-этилтиометил 3-оксоэстра-4,9-диен-11-ил]бензальдегида подвергают в 20 мл пиридина взаимодействию с 20 61 мг гидрохлорида гидроксиламина при комнатной температуре в течение 3,5 ч. Затем сливают в ледяную воду и образовавшийся бесцветный осадок отфильтровывают с помощью вакуум-фильтра, промывают водой до нейтрального состояния и сушат под вакуумом. 560 мг сырого продукта очищают посредством хроматографии и перекристаллизовывают из ацетона. В результате получают 335 мг 4-[17 гидрокси-17-этилтиометил-3-оксоэстра-4,9 диен-11-ил]бензальдегид-(Е)-оксима.H-ЯМР: [СDСl3; ТМС]: 0,53 (s, 3H, Н-18); 1,37 (t, 3H, J = 7,5 Гц, SСН 2 СН 3); 2,95 (q, 2H,SCH2CH3); 3,81 (d, 1H, J = 11,7 Гц, 17-CH2S-); 4,43 (d, 1H, J = 6,6 Гц, Н-11); 4,52 (d, 1H, J = 11,7 Гц, 17-CH2S-); 4,54 (s, 1H, NH); 5,80 (s,1H, H-4); 7,28 (d, 2H, J = 8,4 Гц, H-2'); 7,63 (d,4H, J = 8,4 Гц, Н-3'); 8,32 (s, 1H, CH=N). Получение исходного соединения Стадия А. 1,86 г 4-[17-хлорметил-17-гидрокси-3 оксоэстра-4,9-диен-11-ил]бензальдегида подвергают в 50 мл CH2Cl2 взаимодействию с 0,76 мл трихлорацетилизоцианата в течение одного часа при комнатной температуре. После добавления водного раствора NH4Cl фазы разделяют. Органическую фазу промывают до нейтрального состояния, сушат и упаривают под вакуумом. В результате получают 4-[17-хлорметил-17(трихлорацетилкарбамоил)-3-оксоэстра-4,9 диен-11-ил]бензальдегид в виде пенистого вещества, которое растворяют с помощью метиленхлорида. Затем этот раствор перемешивают совместно с 10 г оксида алюминия (Woelm superI, основный) в течение 5 ч при комнатной температуре. После этого отфильтровывают и экстрагируют метиленхлоридом и метанолом. Растворитель выпаривают и пенистое вещество 21 коричневого цвета очищают посредством хроматографии на силикагеле. Таким путем получают 850 мг (17R)-4-(3-оксоэстра-4,9-диен-17 спиро-5'-оксазолидин-2'-он-11-ил)бензальдегида. 173 С разложение(широкий s, 1H, NCONHC = OCCl3). Стадия Б. 440 мг (17R)-4-(3-оксоэстра-4,9-диен-17 спиро-5'-оксазолидин-2'-он-11-ил)бензальдегида подвергают в 10 мл пиридина в течение 4 ч при комнатной температуре взаимодействию с 70 мг гидрохлорида гидроксиламина. Затем сливают в ледяную воду, осадок отфильтровывают с помощью вакуум-фильтра, сушат и очищают посредством хроматографии. После перекристаллизации из ацетона/метил-трет-бутилового эфира получают 180 мг (17R)-4-(3 оксоэстра-4,9-диен-17-спиро-5'-оксазолидин-2'он-11-ил)бензальдегид-1-(Е)-оксима.H-ЯМР: [ДМСО; ТМС]: 0,47 (s, 3 Н, Н-18); 3,97 (d, 1H, J = 10,8 Гц, 17-СН 2NH-); 4,46 (d,1H, J = 6,3 Гц, H-11); 4,58 (d, 1H, J = 11,4 Гц,17-СН 2NН-); 4,59 (s, 1H, NH); 5,69 (s, 1H, H-4); 6,3 и 6,5 (широкий s, NH); 7,21 (d, 2H, J = 8,1 Гц,Н-2'); 7,51 (d, 4H, J = 8,4 Гц, Н-3'); 8,08 (s, 1H,CH=N), 11,17 (s, 1H, ОН). Пример 11. Определение аффинности рецептора. Аффинность рецептора определяли конкурентным связыванием специфически связывающего 3 Н-меченого гормона (изотопного индикатора) и тестируемого соединения с рецепторами в цитозоле из клеток-мишеней органов животных. Целью при этом являлись насыщение рецептора и достижение химического рав 002766 22 новесия. Для исследования были выбраны следующие условия инкубации. Рецептор прогестерона: маточный цитозоль инициированного эстрадиолом кролика,после хранения при -30 С. Буфер для гомогенизации и инкубации:TED-буфер 20 мМ трис/HCl, рН=7,4, 1 мМ этилендиаминотетраацетат, 2 мМ дитиотреитол с 250 мМ сахарозой. Изотопный индикатор: 3H-ORG 2058, 5 нм. Сравнительная субстанция: прогестерон. Рецептор глюкокортикоида: цитозоль тимуса крысы после адреналэктомии; тимус после хранения при -30 С. Буфер: TED. Изотопный индикатор: 3 Н-дексаметазон,20 нм. Сравнительная субстанция: дексаметазон. По завершении инкубации рецепторной фракции, изотопного индикатора и конкурента в течение 18 ч при 0-4 С проводили разделение связанного и свободного стероида путем примешивания активированного угля/декстрана (в соотношении 1%:0,1%), центрифугирования и выявления связанной с рецептором 3Hактивности в надосадочной жидкости. На основании данных, полученных в сериях с различной концентрацией, определяли IC50 для сравнительной субстанции и тестируемого соединения, а в качестве коэффициента обоих показателей (х 100%) определяли относительную молярную аффинность. Пример 12. Подавление беременности у крысы на ранней стадии. Самок крысы весом 180-200 г спаривали на стадии проэструса (предтечки). При обнаружении на следующий день сперматозоидов в области влагалища отсчет времени беременности начинали с этого дня (день 1 (d1. Обработку крыс тестируемой субстанцией или носителем проводили с использованием 0, 2 мл бензоилбензоата/касторового масла (в объемном соотношении 1:4) при подкожном введении в период с 5-го по 7-ой день (d5-d7), аутопсию осуществляли на 9-ый день в отсутствие боли. Рог матки препарировали и исследовали на ненарушенные или поврежденные места нидации (места укрепления оплодотворенного яйца на стенке матки). Показатели, характеризующие полное подавление беременности у различных групп, представлены в табл. 2. Пример 13. Подавление беременности на поздней стадии у беременных морских свинок. Беременных морских свинок обрабатывали тестируемой субстанцией на 43-44-й день беременности. Тестируемую субстанцию вводили подопытным животным в масляном растворе(0,2-2,0 мл бензилбензоата/касторового масла в объемном соотношении 1:4) подкожно один раз в день на 43-й и 44-й день. Контрольных животных обрабатывали только носителем. В период беременности за животными велись наблюдения 23 вплоть до 50-го дня, прежде всего при этом отмечали и регистрировали случаи выкидышей и отслоения плаценты. Пример 14. Тест на антилютеолиз/тест на подавление овуляции у морских свинок в менструальном цикле. Этот тест основан на том, что прогестерон к концу цикла стимулирует секрецию простагландинов маткой. Подавление указанной функции у морских свинок приводит к персистенцииCorpora lutea (к антилютеолизу). Антагонисты рецептора прогестерона с частичной агонистической активностью проявляют в этом тесте незначительную (ср. RU 486) антилютеолитическую эффективность либо не проявляют ее вовсе. Агонистическую активность по отношению к прогестерону также можно подтвердить тем же экспериментальным путем, определяя, во-первых, противоовуляционную активность и выявляя, во-вторых, типичные эффекты прогестерона в генитальном тракте. Таким образом, указанный тест позволяет осуществить важную для терапевтической практики типизацию антагонистов прогестерона,представив их в качестве "чистых" либо "агонистических" субстанций. Морских свинок обрабатывали в период с 10-го по 17-ый день цикла тестируемой субстанцией. На 10-й день перед обработкой субстанцией, равно как и в последующие дни вплоть до аутопсии определяли концентрации прогестерона в сыворотке (Elger W., Neef G.,Beier S., Fhnrich M., Grundel M. и др., CurrentConcepts in Fertility Regulation and Reproduction,под ред. Puri C.P. и Van Look P.F.H., 1994, стр. 303-328). Пример 15. Тест Макфейла на половонезрелых женских особях кролика. Эндометрий половонезрелых кроликов реагирует на гестагены типичной гистологической трансформацией. Этот фактор и положен в основу теста Макфейла. Указанный тест использовали с целью установить, обладают ли субстанции, являющиеся объектом настоящего изобретения, аналогичными прогестерону свойствами. Наряду с этим при одновременной обработке животных предельно трансформирующей дозой прогестерона исследовали частичное антагонистическое действие этих субстанций. Действие в тесте Макфейла оценивали по балльной "шкале Макфейла" с градацией от 1 до 4, при этом балл 4 соответствует максимальной степени трансформации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. S-замещенные тиоловые эфиры 11 бензальдоксимэстра-4,9-диенугольной кислоты общей формулы I в которой R1 представляет собой алкильный остаток с 1-10 атомами углерода, арильный остаток с 6-10 атомами углерода или алкиларильный либо арилалкильный остаток, каждый соответственно с 7-10 атомами углерода,R2 представляет собой алкильный остаток с 1-3 атомами углерода или атом водорода,R3 представляет собой гидроксильную группу, O-алкильную группу с 1-10 атомами углерода, O-арильную группу с 6-10 атомами углерода, O-аралкильную либо O-алкиларильную группу, каждую соответственно с 710 атомами углерода, остаток -OCOR5, OCONHR5 или -OCOOR5, где R5 обозначает атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,R4 представляет собой атом водорода, алкильную группу с 1-10 атомами углерода,арильную группу с 6-10 атомами углерода,аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,остаток -(CH2)nCH2Y,где n обозначает 0, 1 или 2,Y обозначает атом фтора, хлора, брома,либо иода, циано-, амино-, азидо-, либо родановую группу или остаток -OR6, -SR6, -(CO)SR6 или -(СО)OR6,где R6 обозначает атом водорода, алкильную группу с 1-10 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,или обозначает остаток -COR5, где R5 имеет указанные выше значения,остаток -OR5 или -ОCOR5, где R5 имеет указанные выше значения,остаток-(СН 2)m-СН=СН(СН 2)p-R6, гдеm обозначает 0, 1, 2 или 3, р обозначает 0,1 или 2 и R6 имеет указанные выше значения или представляет собой остаток -OR5 или OCOR5, где R5 имеет указанные выше значения,остаток -(CH2)oCCR7, где о обозначает 0,1 или 2 иR7 обозначает атом водорода, атом фтора,хлора, брома либо иода, алкильную группу с 110 атомами углерода, арильную группу с 6-10 атомами углерода, аралкильную либо алкиларильную группу, каждую соответственно с 7-10 атомами углерода,или представляет собой остаток -OR5, где 5R имеет указанные выше значения, либо остаток -OCOR5, где R5 имеет указанные выше зна 25 чения, либо остаток -CH2 OR 5 , где R 5 имеет указанные выше значения, или остатокR3 и R4, оба вместе, образуют произвольно замещенное пяти- либо шестичленное кольцо,по меньшей мере, с одним атомом углерода и 04 гетероатомами, выбранными из группы,включающей кислород, серу, селен, теллур,азот, фосфор, кремний и германий,и их фармацевтически приемлемые соли. 2. Соединения по п.1, отличающиеся тем,что R1 представляет собой алкильный остаток с 1-6 атомами углерода. 3. Соединения по любому из предыдущих пунктов, отличающиеся тем, что R2 представляет собой метальную или этильную группу. 4. Соединения по любому из предыдущих пунктов, отличающиеся тем, что R3 представляет собой гидроксильную группу. 5. Соединения по любому из пп.1-3, отличающиеся тем, что R3 представляет собой Oалкильную группу с 1-6 атомами углерода. 6. Соединения по любому из предыдущих пунктов, отличающиеся тем, что R4 представляет собой остаток -OR5 или -OCOR5, где R5 обозначает алкильную группу с 1-6 атомами углерода. 7. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(CH2)m-CH=CH(CH2)p-R6, где m обозначает 1 и р обозначает 1, а R6 представляет собой алкильную группу с 1-6 атомами углерода или остаток -OR5 либо -OCOR5, где R5 обозначает атом водорода или алкильную группу с 1-6 атомами углерода. 8. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(СН 2)m-СН=СН(CH2)p-R6, где m обозначает 0 и р обозначает 1, а R6 представляет собой остаток -OR5 либо -OCOR5, где R5 обозначает атом водорода или алкильную группу с 1-6 атомами углерода. 9. Соединения по любому из пп.1-5, отличающиеся тем, что R 4 представляет собой остаток -(СН 2 )o ССR7 , где о обозначает 1, аR 7 обозначает алкильную группу с 1-6 атомами углерода либо остаток -OCOR 5 или остаток -CH2 OR 5, где R 5 представляет собой алкильную группу с 1-6 атомами углерода или атом водорода. 10. Соединения по любому из пп.1-5, отличающиеся тем, что R4 представляет собой остаток -(CH2)nCH2Y, где n обозначает 0 или 1, Y обозначает атом фтора, хлора, брома либо иода,циано-, амино-, азидо- либо родановую группу,или остаток -OR6 либо -SR6, -(CO)SR6 либо (СО)OR6, где R6 представляет собой атом водорода или алкильную группу с 1-10 атомами углерода. 11. Соединения по любому из пп.1-3, отличающиеся тем, что R3 и R4 оба вместе обра 002766 26 зуют произвольно замещенное пяти- либо шестичленное кольцо, по меньшей мере, с одним атомом углерода и 0-4 гетероатомами, при этом гетероатомы выбраны из группы, включающей кислород, серу и азот. 12. Соединения по п.11, отличающиеся тем, что образуется пятичленное кольцо, содержащее 1 или 2 гетероатома. 13. Соединения по п.12, отличающиеся тем, что кольцо представляет собой гетероцикл,образованный из группы, включающей оксазолидинон, оксазолинон, тиазолидинон, тиазолинон, имидазолидинон, имидазолинон, 1,3 диоксоланон, 1,3-диоксоленон, 1,3-оксатиоланон, 1,3-оксатиоленон, пирролидинон, пирролинон, оксазолидинтион, оксазолинтион, тиазолидинтион, тиазолинтион, имидазолидинтион,имидазолинтион, диоксолантион, пирролидинтион и пирролинтион. 14. Соединения по п.13, отличающиеся тем, что пятичленное кольцо представляет собой оксазолидин-2-он или оксазолидин-2-тион. 15. Соединения по п.1, а именно 4-[17-метокси-17-(метоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(метилтио)карбонил]оксим,4-[17-гидрокси-17-(метоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(метилтио)карбонил]оксим,4-[17-метокси-17-(метоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(этилтио)карбонил]оксим,4-[17-метокси-17-(метоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Z)[О-(этилтио)карбонил]оксим,4-[17-метокси-17-(этоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(этилтио)карбонил]оксим,4-[17-гидрокси-17-(метоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[O-(н-пропилтио)карбонил]оксим,4-[17-метокси-17-(н-пропоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(метилтио)карбонил]оксим,4-[17-гидрокси-17-(н-пропоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(этилтио)карбонил]оксим,4-[17-гидрокси-17-(метоксиметил)-3 оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)[О-(этилтио)карбонил]оксим,4-[17-гидрокси-17-(Z)-(3-гидроксипропенил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)-[О-(метилтио)карбо-нил]оксим,4-[17-гидрокси-17-(Е)-(3-гидроксипропенил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)-[О-(метилтио)карбонил]оксим,4-[17-метокси-17-(3-гидрокси-1 пропинил)-3-оксоэстра-4,9-диен-11-ил]бензальдегид-1-(Е)-[О-(этилтио)карбонил]оксим, 27(17R)-4-3-оксоэстра-4,9-диен-17-спиро-5 оксазолидин-2'-он-11-илбензальдегид-1-(Е)[О-(этилтио)карбонил]оксим. 16. Способ получения S-замещенных тиоловых эфиров 11-бензальдоксимэстра-4,9 диенугольной кислоты общей формулы I 28 в которой R2, R3 и R4 имеют значения, указанные в п.1, отличающийся тем, что соединение общей формулы II в которой R2, R3 и R4 имеют те же значения, что и R2, R3 и R4 в формуле I, известным образом подвергают в растворителе взаимодействию с производным муравьиной кислоты формулы IIIIII 1 где R имеет значения, указанные в п.1, a Nuc обозначает нуклеофил, и затем переводят в соединение общей формулы I. 17. Способ по п.16, отличающийся тем, что в качестве растворителя применяют третичный амин, а реакцию осуществляют при температуре в интервале от 20 до 80 С. 18. Способ по п.17, отличающийся тем, что осуществляют взаимодействие с тиоэфирами хлормуравьиной кислоты в пиридине или триэтиламине при температуре в интервале от 20 до 40 С. 19. Фармацевтические композиции, отличающиеся тем, что они содержат в своем составе, по меньшей мере, одно соединение по любому из пп.1-15. 20. Применение соединений по любому из пп.1-15 для лечения эндометриоза, Uterus myomatosus, дисменореи и предменструального синдрома, для индукции обратимой аменореи без дефицита эстрогенов и для гормонозаместительной терапии (ГЗТ) в климактерический период, при необходимости в сочетании с эстрогенами. 21. Применение соединений по любому из пп.1-15 для получения противозачаточных средств.
МПК / Метки
МПК: A61P 5/46, A61K 31/565, C07J 41/00
Метки: тиоловые, кислоты, s-замещенные, эти, соединения, фармацевтические, 11&beta-бензальдоксимэстра-4,9-диенугольной, способ, композиции, эфиры, получения, содержащие
Код ссылки
<a href="https://eas.patents.su/15-2766-s-zameshhennye-tiolovye-efiry-11beta-benzaldoksimestra-49-dienugolnojj-kisloty-sposob-ih-polucheniya-i-soderzhashhie-eti-soedineniya-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">S-замещенные тиоловые эфиры 11&beta-бензальдоксимэстра-4,9-диенугольной кислоты, способ их получения и содержащие эти соединения фармацевтические композиции</a>
Следующий патент: Ингибиторы тромбина
Случайный патент: Синергетические гербицидные композиции и способы их применения












