Сульфонамиды гидроксидифенилмочевины в качестве антагонистов рецептора ил-8
Номер патента: 5210
Опубликовано: 30.12.2004
Авторы: Дзин Кви, Палович Майкл Р., Виддаусон Кэтрин Л., Макклеланд Брент В.
Формула / Реферат
1. Соединение формулы (I)
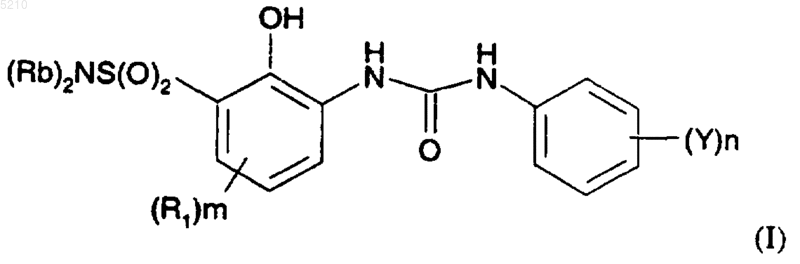
где Rb независимо представляет собой водород, OC1-5алкил, C1-5алкил, C3алкенил, бензил, C3-5циклоалкил, C3-5циклоалкил-C1-5алкил, пиридил, 5-6-членный гетероциклил или 5-6-членный гетероциклил-C1-4алкил, содержащие в кольце атом азота и/или атом кислорода, где все указанные группы могут быть необязательно замещены одной-тремя группами, независимо выбранными из галогена, C1-4алкила, амино, моно- или ди-C1-4алкилзамещенного амино, гидрокси, OC1-4алкила, бензилокси, C(O)OH, C(O)OC1-4алкила, NHC(O)OC1-4алкила, S(O)m'C1-4алкила и C(O)NH(галогензамещенного фенила);
либо два заместителя Rb, взятые вместе с атомом азота, к которому они присоединены, могут образовывать 4-6-членное кольцо, необязательно содержащее в кольце помимо атома азота группы NH, NC(O)OC1-4алкил, O, S, SO или SO2, и необязательно замещенное группой, независимо выбранной из гидроксиC1-4алкила, C1-4алкоксиC1-4алкила, C(O)OH и C(O)OC1-4алкила;
m равно 1;
m' равно 0, 1 или 2;
n равно 1 или 2;
R1 независимо выбран из галогена или C1-4алкокси;
Y представляет собой галоген, C1-4алкокси, C1-4алкилендиокси, фенилокси или бензилокси;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой галоген.
3. Соединение по п.2, где R1 независимо представляет собой фтор, хлор или бром.
4. Соединение по п.1, где Y представляет собой галоген.
5. Соединение по п.4, где Y независимо представляет собой фтор, хлор или бром.
6. Соединение по п.1, где Rb представляет собой водород, C1-4алкил или C1-4алкил, замещенный C(O)OH или C(O)ORa.
7. Соединение по п.1, где Y представляет собой галоген, n равно 1 или 2, R1 представляет собой галоген и Rb независимо представляет собой водород, C1-4-алкил или C1-4алкил, замещенный C(O)OH или C(O)ORa.
8. Соединение по п.1, выбранное из группы, состоящей из
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2-бромфенил)мочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-бензиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-бензиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N",N"-диметиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N",N"-диметиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-метиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-метиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(метоксикарбонилметил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(метоксикарбонилметил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(карбоксиметил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(карбоксиметил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2-хлорфенил)мочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-фенилмочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2-феноксифенил)мочевины;
N-[2-гидрокси-3-[N"-(2-карбоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(изопропиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(изопропиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(изопропиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2-метоксифенил)мочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2,3-метилендиоксифенил)мочевины;
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2-бензилоксифенил)мочевины;
N-[2-гидрокси-3-(N"-аллиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-трифторэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-фениламиносульфонил)-4-метоксифенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-фениламиносульфонил)-4-метоксифенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-метоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-метоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(4-морфолинилсульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(4-морфолинилсульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[3-(трет-бутоксикарбониламино)пропил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[3-(трет-бутоксикарбониламино)пропил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
трифторацетата N-[2-гидрокси-3-[N"-(3-аминопропил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-(3-аминопропил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
трифторацетата N-[2-гидрокси-3-[N"-(3-аминопропил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[2-(трет-бутоксикарбониламино)этил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-аминоэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[4-(трет-бутоксикарбонил)пиперазин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[4-(трет-бутоксикарбонил)пиперазин-1-ил]сульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
трифторацетата N-[2-гидрокси-3-(1-пиперазинилсульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
трифторацетата N-[2-гидрокси-3-(пиперазин-1-илсульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(3-метилтиопропил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(3-метилтиопропил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
калиевой соли N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2,3-дихлорфенил)мочевины;
натриевой соли N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N",N"-ди-(2-метоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N",N"-ди-(2-метоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[2-(диметиламино)этил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[2-(диметиламино)этил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[3-(метилсульфонил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[3-(метилсульфонил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[2-(морфолинил)этил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[2-(морфолинил)этил]аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[2-(4-морфолинил)этил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(4-тиоморфолинилсульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(4-тиоморфолинилсульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N",N"-ди-(2-гидроксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N",N"-ди-(2-гидроксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[3-(метилсульфинил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[3-(метилсульфинил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-[(1-трет-бутоксикарбонилпиперидин-4-ил)метил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-[(1-трет-бутоксикарбонилпиперидин-4-ил)метил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)-мочевины;
N-[2-гидрокси-3-(1-оксидотиоморфолиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(1-оксидотиоморфолиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
трифторацетата N-[2-гидрокси-3-[N"-[(пиперидин-4-ил)метил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[(пиперидин-4-ил)метил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(1-азетидинилсульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(1-азетидинилсульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(1-азетидинилсульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
калиевой соли N-[2-гидрокси-3-(N",N"-диметиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
натриевой соли N-[2-гидрокси-3-(N",N"-диметиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопропиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопропиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопропиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-пропиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-пропиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-пропиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-этиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-этиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-этиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-гидроксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-гидроксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[[(2-бромфениламино)карбокси]этил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-бензилоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопропилметиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопропилметиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопропилметиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-метокси-N"-метиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-метокси-N"-метиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-метокси-N"-метиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-пирролидинилсульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-пирролидинилсульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-пирролидинилсульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(4-пиридиниламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(4-пиридиниламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[[2-(тетрагидро-2-фуранил)метил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[2-(тетрагидро-2-фуранил)метил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[[(2R)-(тетрагидро-2-фуранил)метил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[(2R)-(тетрагидро-2-фуранил)метил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[[(2S)-(тетрагидро-2-фуранил)метил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[(2S)-(тетрагидро-2-фуранил)метил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопентиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопентиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-циклопентиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-изоксазолидиниламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-изоксазолидиниламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-изоксазолидиниламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N"-тетрагидроизоксазолиламиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(N"-тетрагидроизоксазолиламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(N"-тетрагидроизоксазолиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-изопропоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-изопропоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-изопропоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-этоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-этоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-этоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[[N"-(2-метоксикарбонил)азетидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[N"-(2-метоксикарбонил)азетидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[[N"-(2-карбокси)азетидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[3-(4-морфолинил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[3-(4-морфолинил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-[3-(4-морфолинил)пропил]аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(метоксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(гидроксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(метоксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(гидроксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(метоксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(гидроксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(метоксикарбонил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[[S-(-)-2-(карбокси)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(трет-бутил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-[N"-(трет-бутил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(трет-бутил)аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-(5-амино-5-карбоксипентил)аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-(5-амино-5-карбоксипентил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[N"-(5-амино-5-карбоксипентил)аминосульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(1,1-диоксидотиоморфолиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-(1,1-диоксидотиоморфолиносульфонил)-4-хлорфенил]-N'-(2-бромфенил)мочевины;
N-[2-гидрокси-3-(1,1-диоксидотиоморфолиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-[N"-[2-(трет-бутоксикарбониламино)этил]аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины;
N-[2-гидрокси-3-[N"-(2-аминоэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины трифторацетата;
N-[2-гидрокси-3-[N"-[2-(трет-бутоксикарбониламино)этил]аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
трифторацетата N-[2-гидрокси-3-[N"-(2-аминоэтил)аминосульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(N",N"-диметиламиносульфонил)-4-хлорфенил]-N'-(2-хлорфенил)мочевины;
N-[2-гидрокси-3-(аминосульфонил)-4-хлорфенил]-N'-(2-бром-3-фторфенил)мочевины;
N-[2-гидрокси-3-(аминосульфонил)-4-хлорфенил]-N'-(2-хлор-3-фторфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[(1-этилпирролидин-2-ил)метиламиносульфонил]-4-хлорфенил]-N'-(2-бромфенил)мочевины;
гидрохлорида N-[2-гидрокси-3-[(1-этилпирролидин-2-ил)метиламиносульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины и
гидрохлорида N-[2-гидрокси-3-[(1-этилпирролидин-2-ил)метиламиносульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины,
или его фармацевтически приемлемых солей.
9. Соединение по п.8, выбранное из группы, состоящей из
N-(2-гидрокси-3-аминосульфонил-4-хлорфенил)-N'-(2,3-дихлорфенил)мочевины,
N-[2-гидрокси-3-[[S-(-)-(2-метоксиметил)пирролидин-1-ил]сульфонил]-4-хлорфенил]-N'-(2-хлорфенил)мочевины,
N-[2-гидрокси-3-(N"-изоксазолидиниламиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины,
N-[2-гидрокси-3-(1-оксидотиоморфолиносульфонил)-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины и
N-[2-гидрокси-3-[N",N"-ди-(2-метоксиэтил)аминосульфонил]-4-хлорфенил]-N'-(2,3-дихлорфенил)мочевины.
10. Соединение по п.9, где указанное соединение находится в виде натриевой соли.
11. Соединение по п.10, где указанное соединение находится в виде калиевой соли.
12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11 и его фармацевтически приемлемый носитель или разбавитель.
13. Способ лечения опосредованного хемокином заболевания у млекопитающих, где указанный хемокин связывается с рецептором ИЛ-8a или b, заключающийся во введении указанному млекопитающему эффективного количества соединения формулы (I) по любому из пп.1-11.
14. Способ по п.13, где указанное млекопитающее подвержено опосредованному хемокином заболеванию, выбранному из атопического дерматита, остеоартрита, ревматоидного артрита, астмы, хронического обструктивного заболевания легких, респираторного дистресс-синдрома взрослых, воспалительного заболевания кишечника, болезни Крона, язвенного колита, инсульта, септического шока, рассеянного склероза, эндотоксического шока, псориаза, сепсиса, вызываемого грамотрицательными бактериями, синдрома токсического шока, повреждения при сердечной и почечной реперфузии, гломерулонефрита, тромбоза, реакции "трансплантат против хозяина", болезни Альцгеймера, отторжения аллотрансплантата, малярии, рестиноза, ангиогенеза, атеросклероза, остеопороза, гингивита и нежелательного высвобождения гемопоэтических стволовых клеток, заболеваний, вызываемых респираторными вирусами, герпесвирусами и вирусами гепатита, менингита, энцефалита, вызваемого герпесвирусом, васкулита ЦНС, травматического повреждения головного мозга, опухолей ЦНС, подпаутинной геморрагии, травмы, вызванной хирургическим вмешательством, кистозного фиброза, преждевременных родов, кашля, зуда, интерстициального пневмонита, гиперчувствительности, артрита, индуцированного кристаллами, артрита Лайма, прогрессирующей костеобразующей фибродисплазии, острого и хронического панкреатита, острого алкогольного гепатита, некротизирующего энтероколита, хронического синусита, увеита, полимиозита, васкулитов, угрей, язвы желудка и двенадцатиперстной кишки, глютеновой болезни, эзофагита, глоссита, обструкции дыхательных путей, гиперчувствительности дыхательных путей, облитерирующего бронхиолита, вызывающего пневмонию, бронхиэктаза, бронхиолита, облитерирующего бронхиолита, хронического бронхита, легочного сердца, одышки, эмфиземы, гиперкапнии, чрезмерного расширения легкого, гипоксемии, гипоксии, сокращения объема легкого после хирургического вмешательства, пульмонарного фиброза, пульмонарной гипертензии, гипертрофии правого желудочка, саркоидоза, заболевания малых дыхательных путей, нарушения процесса вентиляции-перфузии, стридора и волчанки.
15. Соединение, выбранное из группы, состоящей из соединений нижеприведенных формул (II), (III), (IV), (V) и (VI)
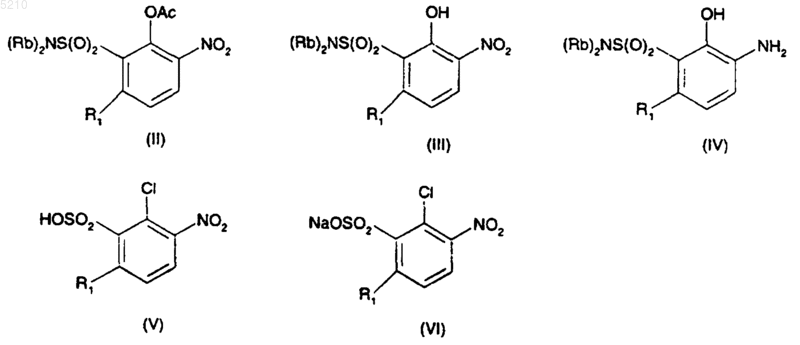
где R1 не является водородом.
16. Способ преобразования хлорсодержащего соединения формулы (VII) в фенол формулы (III) путем взаимодействия с ацетатом натрия и 18-краун-6 с последующим гидролизом серной кислотой и метанолом
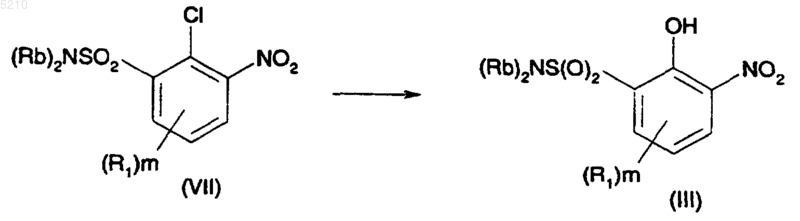
где R представляет собой H или Na и R1 является таким, как он определен выше в п.1.
17. Способ преобразования хлорсодержащего соединения формулы (VII) в фенол формулы (III) путем взаимодействия указанного хлорсодержащего соединения с гидридом натрия и водой в ТГФ

где R представляет H или Na и R1 является таким, как он определен выше в п.1.
18. Способ преобразования соединения формулы (VIII) в нитросоединение формулы (IX) путем взаимодействия производного сульфоновой кислоты с азотной кислотой в серной кислоте
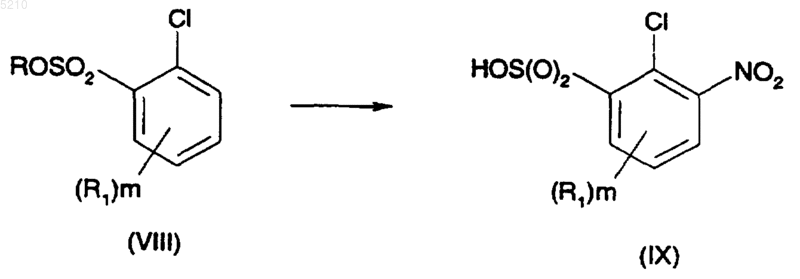
где R представляет H или Na и R1 является таким, как он определен выше в п.1.
Текст
1 Область, к которой относится изобретение Настоящее изобретение относится к новым сульфонамидзамещенным производным дифенилмочевины, к фармацевтическим композициям, к способам их получения и к их использованию для лечения заболеваний, опосредованных ИЛ-8, GRO, GRO, GRO, NAP-2 и ENA-78. Предпосылки создания изобретения Интерлейкин-8 (ИЛ-8) имеет много разных названий, таких как аттрактант/белок активации-1 нейтрофилов (NAP-1), происходящий от моноцитов фактор хемотаксиса нейтрофилов(NAF) и фактор хемотаксиса Т-клеточных лимфоцитов. Интерлейкин-8 является аттрактантом для нейтрофилов, базофилов и субсерии Тклеток. Он продуцируется большинством ядеросодержащих клеток, включая макрофаги,фибробласты, эндотелиальные или эпителиальные клетки, экспонированные ФНО, ИЛ-1,ИЛ-1 или LPS, и самими нейтрофилами при их экспонировании LPS или факторами хемотаксиса, такими как FMLP. M.Baggiolini et al.,J.Clin.Invest, 84, 1045 (1989); J.Schroder et al., J.GRO, GRO, GRO и NAP-2 также принадлежат к семейству хемокинов. Подобно ИЛ 8, эти хемокины также имеют разные названия. Так,например,GROобозначаютсяal., J. Immunol. 148, 451 (1992). Все хемокины семейства, которые обладают мотивом ELR,расположенным непосредственно перед мотивом СХС, связываются с рецептором в ИЛ-8(CXCR2). ИЛ-8, GRO, GRO, GRO, NAP-2 и ENA78 стимулируют ряд функций in vitro. Было показано, что они обладают хемоаттрактантными свойствами по отношению к нейтрофилам, а ИЛ-8 и GRO обнаруживают хемотаксическую активность по отношению к Т-лимфоцитам и базофилам. Кроме того, ИЛ-8 может индуцировать высвобождение гистамина из базофилов как у нормальных индивидуумов, так и у аллергиков. GRO- и ИЛ-8 могут, кроме того, индуцировать высвобождение фермента из лизосом и стимулировать "дыхательную вспышку" нейтрофилов. Было также показано, что ИЛ-8 усиливает поверхностную экспрессию. Мас-1(CD11b/CD18) на нейтрофилах без синтеза белка de novo. Это может приводить к увеличению адгезии нейтрофилов на эндотелиальные клетки сосудов. Многие известные заболевания характеризуются массивной нейтрофильной инфильтрацией. Поскольку ИЛ-8 и GRO, GRO,GRO, NAP-2 стимулируют аккумуляцию и ак 005210 2 тивацию нейтрофилов, то эти хемокины участвуют в индуцировании широкого ряда острых и хронических воспалительных расстройств,включая псориаз и ревматоидный артрит, М.al., Lancet 341, 643 (1993). Кроме того, хемокины ELR (хемокины, содержащие аминокислотный мотив ELR, расположенный непосредственно перед мотивом СХС) также принимают участие в ангиостазе. Strieter et al., Science 258,1798 (1992).In vitro, ИЛ-8, GRO, GRO, GRO и NAP2 индуцируют изменение формы нейтрофилов,хемотаксис, высвобождение гранул и "дыхательную вспышку" путем связывания и активации рецепторов, принадлежащих к семейству сопряженных с G-белком рецепторов с семью трансмембранными доменами и, а в частности,путем связывания с рецепторами ИЛ-8, а особенно с рецептором ИЛ-8 (CXCR2). Thomas etal., Science 253, 1278 (1991). Ранее были получены непептидны низкомолекулярные антагонисты для членов этого семейства рецепторов. См. обзор R. Freidinger "Progress in Drug Resears,Vol.40, pp.33-98; Birkhaser Verlag, Basel 1993. Следовательно, рецептор для ИЛ-8 представляет собой многообещающую цель для разработки новых противовоспалительных агентов. Были охарактеризованы два высокоаффинных рецептора для ИЛ-8 (с гомологией 77%): ИЛ-8R, который связывается только с ИЛ-8 с высокой степенью аффинности, и ИЛ 8R, который обладает высокой степенью аффиности по отношению к ИЛ-8, а также по отношению к GRO, GRO, GRO и NAP-2. См.(1992); LaRosa et al., J. Biol. Chem., 267,25402(1992); и Gayle et al., J. Biol. Chem., 268,7283 (1993). В этой связи, задача получения соединений, способных связываться с рецепторами ИЛ 8 илии необходимых для лечения вышеуказанных заболеваний, остается актуальной. Поэтому, состояния, ассоциированные с повышенным продуцированном ИЛ-8 (который ответственен за хемотаксис нейтрофилов и субсерии Тклеток в области воспаления), могут быть улучшены с помощью соединений, которые являются ингибиторами связывания с рецептором ИЛ-8. Краткое описание изобретения Настоящее изобретение относится к способу лечения заболевания, опосредованного хемокинами, где указанным хемокином является хемокин, связывающийся с рецептором ИЛ 3 8 или , и где указанный способ предусматривает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В частности, указанным хемокином является ИЛ-8. Настоящее изобретение также относится к способу ингибирования связывания ИЛ-8 с его рецепторами у млекопитающих, нуждающихся в этом, где указанный способ предусматривает введение указанному млекопитающему эффективного количества соединения формулы (I). Настоящее соединение также относится к новым соединениям формулы (I) и к фармацевтическим композициям, содержащим соединение формулы (I) и фармацевтически приемлемый носитель или разбавитель. Соединения формулы (I), используемые в настоящем изобретении, имеют структуру где Rb независимо представляет собой водород,ОС 1-5 алкил, C1-5 алкил, С 3 алкенил, бензил, С 3-5 циклоалкил, С 3-5 циклоалкил-С 1-5 алкил, пиридил,5-6-членный гетероциклил или 5-6-членный гетероциклил-С 1-4 алкил, содержащие в кольце атом азота и/или атом кислорода, где все указанные группы могут быть необязательно замещены одной-тремя группами, независимо выбранными из галогена, С 1-4 алкила, амино, моноили ди-С 1-4 алкилзамещенного амино, гидрокси,ОС 1-4 алкила, бензилокси, С(О)ОН, С(О)ОС 1-4 алкила, NHC(О)ОС 1-4 алкила, S(О)m'С 1-4 алкила и С(O)NH(галогензамещенного фенила); либо два заместителя Rb, взятые вместе с атомом азота, к которому они присоединены,могут образовывать 4-6-членное кольцо, необязательно содержащее в кольце, помимо атома азота, группы NH, NC(O)ОС 1-4 алкил, О, S, SO или SO2, и необязательно замещенное группой,независимо выбранной из гидроксиС 1-4 алкила,С 1-4 алкоксиС 1-4 алкила, С(О)ОН и С(О)ОС 1-4 алкила;R1 независимо выбран из галогена или С 1-4 алкокси;Y представляет собой галоген, С 1-4 алкокси,С 1-4 алкилендиокси, фенилокси или бензилокси; или его фармацевтически приемлемая соль. Подробное описание изобретения Соединения формулы (I) могут быть также использованы в ветеринарии для лечения млекопитающих, то есть не человека, и нуждающихся в ингибировании ИЛ-8 или других хемокинов, которые связываются с рецепторами ИЛ 8 или . Опосредованными хемокинами заболеваниями животных, требующими терапевти 005210 4 ческого лечения или профилактики, являются патологические состояния, указанные в настоящем описании в разделе "Методы лечения". Настоящее изобретение относится к соединениям формулы (I), имеющим структуру где Rb независимо представляет собой водород, ОС 1-5 алкил, С 1-5 алкил, С 3 алкенил, бензил,С 3-5 циклоалкил, С 3-5 циклоалкил-С 1-5 алкил, пиридил, 5-6-членный гетероциклил или 5-6 членный гетероциклил-С 1-4 алкил, содержащие в кольце атом азота и/или атом кислорода, где все указанные группы могут быть необязательно замещены одной-тремя группами, независимо выбранными из галогена, С 1-4 алкила, амино,моно- или ди-С 1-4 алкилзамещенного амино,гидрокси, ОС 1-4 алкила, бензилокси, С(О)ОН,С(O)ОС 1-4 алкила, NHC(О)ОС 1-4 алкила, S(О)m'С 1-4 алкила и С(О)NH(галогензамещенного фенила); либо два заместителя Rb, взятые вместе с атомом азота, к которому они присоединены,могут образовывать 4-6-членное кольцо, необязательно содержащее в кольце, помимо атома азота, группы NH, NC(О)ОС 1-4 алкил, О, S, SO или SO2, и необязательно замещенное группой,независимо выбранной из гидроксиС 1-4 алкила,С 1-4 алкоксиС 1-4 алкила, С(О)ОН и С(О)ОС 1-4 алкила;R1 независимо выбран из галогена или С 1-4 алкокси;Y представляет собой галоген, С 1-4 алкокси,С 1-4 алкилендиокси, фенилокси или бензилокси; или его фармацевтически приемлемая соль. Предпочтительно, R1 представляет собой галоген, такой как фтор, хлор или бром. Предпочтительно, Y представляет собой галоген, такой как фтор, хлор или бром. Предпочтительно, Rb представляет собой водород, С 1-4 алкил или С 1-4 алкил, замещенный С(О)ОН или C(O)ORa. Предпочтительно, Y представляет собой галоген, n равно 1 или 2, R1 представляет собой галоген и Rb независимо представляет собой водород, C1-4-алкил или С 1-4 алкил, замещенный С(О)ОН или C(O)ORa. Иллюстративные соединения формулы (I) выбраны из группы, состоящей из:N-[2-гидрокси-3-[(1-этилпирролидин-2-ил)метиламиносульфонил]-4 хлорфенил]-N'-(2-хлорфенил)мочевины. Указанные выше соединения могут быть в виде фармацевтически приемлемых солей. Подходящие фармацевтически приемлемые соли хорошо известны специалистам, и такими солями являются основные соли неорганических и органических кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, этансульфоновая кислота, уксусная кислота, яблочная кислота, винная кислота, лимонная кислота, молочная кислота, щавелевая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, бензойная кислота, салициловая кислота,фенилуксусная кислота и миндальная кислота. Кроме того, фармацевтически приемлемые соли соединений формулы (I) могут быть также образованы фармацевтически приемлемым катионом. Подходящие фармацевтически приемлемые катионы хорошо известны специалистам, и такими катионами являются щелочные катионы,щелочноземельные катионы, катионы аммония и катионы четвертичного аммония. Используемые здесь термины означают:"C1-10 алкил" или "алкил" - прямые или разветвленные группы, состоящие из 1-10 атомов углерода, если длина цепи не указана конкретно, включая, но не ограничиваясь ими, метил,этил, н-пропил, изопропил, н-бутил, втор-бутил,изобутил, трет-бутил, н-пентил и т.п.;"циклоалкил" - циклическая группа, состоящая, предпочтительно, из 3-5 атомов углерода, включая, но не ограничиваясь ими, циклопропил, циклопентил, циклогексил и т.п.;"алкенил" - во всех случаях, если длина цепи не указана конкретно, означает прямую или разветвленную группу, состоящую из 2-10 атомов углерода, включая, но не ограничиваясь ими, этенил, 1-пропенил. 2-пропенил, 2-метил 1-пропенил, 1-бутенил, 2-бутенил и т.п.;"гетероциклил" (как таковой или в любой комбинации, такой как "гетероциклилалкил") 5-6-членная насыщенная или частично ненасыщенная кольцевая система, в которой одно или несколько колец содержит один или несколько гетероатомов, выбранных из группы, состоящей из N, О или S, включая, но не ограничиваясь ими, пирроллидин, пиперидин, пиперазин, морфолин, тетрагидропиран, тиоморфолин или имидазолидин. Кроме того, сера может быть, но"гетероциклилалкил" - C1-10 алкил, определенный выше, и связанный с гетероциклильной группами, определенными выше, если это не оговорено особо;"сульфинил" - оксид S(O) соответствующего сульфида, термин "тио" означает сульфид,а термин "сульфонил" означает полностью окисленную группу S(O)2. Настоящее изобретение относится также к фармацевтической композиции, содержащей соединение общей формулы (I) и его фармацевтически приемлемый носитель или разбавитель. Изобретение относится также к способу лечения опосредованного хемокином заболевания у млекопитающих, где указанный хемокин связывается с рецептором ИЛ-8 или , заключающийся во введении указанному млекопитающему эффективного количества соединения формулы (I). Указанное опосредованное хемокином заболевание может быть заболеванием, выбранным из атопического дерматита, остеоартрита,ревматоидного артрита, астмы, хронического обструктивного заболевания легких, респираторного дистресс-синдрома взрослых, воспалительного заболевания кишечника, болезни Крона, язвенного колита, инсульта, септического шок, рассеянного склероза, эндотоксического шока, псориаза, сепсиса, вызываемого грамотрицательными бактериями, синдрома токсического шока, повреждения при сердечной и почечной реперфузии,гломерулонефрита,тромбоза, реакции "трансплантат против хозяина", болезни Альцгеймера, отторжения аллотрансплантата, малярии, рестиноза, ангиогенеза, атеросклероза, остеопороза, гингивита и нежелательного высвобождения гемопоэтических стволовых клеток, заболеваний, вызываемых респираторными вирусами, герпесвирусами и вирусами гепатита, менингита, энцефалита, вызываемого герпес-вирусом, васкулита ЦНС, травматического повреждения головного мозга, опухолей ЦНС, подпаутинной геморрагии, травмы, вызванной хирургическим вмешательством, кистозного фиброза, преждевременных родов, кашля, зуда, интерстициального пневмонита, гиперчувствительности, артрита,индуцированного кристаллами, артрита Лайма,прогрессирующей костеобразующей фибродисплазии, острого и хронического панкреатита,острого алкогольного гепатита, некротизирующего энтероколита, хронического синусита,увеита, полимиозита, васкулитов, угрей, язвы желудка и двенадцатиперстной кишки, глютеновой болезни, эзофагита, глоссита, обструкции дыхательных путей, гиперчувствительности дыхательных путей, облитерирующего бронхиолита, вызывающего пневмонию, бронхиэктаза, бронхиолита, облитерирующего бронхиолита, хронического бронхита, легочного сердца, 005210 14 одышки, эмфиземы, гиперкапнии, чрезмерного расширения легкого, гипоксемии, гипоксии,сокращения объема легкого после хирургического вмешательства, пульмонарного фиброза,пульмонарной гипертензии, гипертрофии правого желудочка, саркоидоза, заболевания малых дыхательных путей, нарушения процесса вентиляции-перфузии, стридора и волчанки. Настоящее изобретение относится также к промежуточным для синтеза соединений формулы (I) соединениям, в частности, к соединениям, выбранным из группы, состоящей из соединений нижеприведенных формул (II), (III),(IV), (V) и (VI) где R1 не является водородом. Предложен также способ преобразования хлорсодержащего соединения формулы (VII) в фенол формулы (III) путем взаимодействия с ацетатом натрия и 18-краун-6 с последующим гидролизом серной кислотой и метанолом где R представляет собой Н или Na и R1 является таким, как он определен выше. Предложен также способ преобразования хлорсодержащего соединения формулы (VII) в фенол формулы (III) путем взаимодействия указанного хлорсодержащего соединения с гидридом натрия и водой в ТГФ: где R представляет Н или Na, и R1 является таким, как он определен выше. Предложен также способ преобразования соединения формулы (VIII) в нитросоединение формулы (IX) путем взаимодействия производного сульфоновой кислоты с азотной кислотой в серной кислоте где R представляет Н или Na и R1 является таким, как он определен выше. Способы получения Соединения формул (I)-(VII) могут быть получены способами синтеза, некоторые из которых проиллюстрированы на нижеследующих схемах. Синтез, показанный на этих схемах,может быть осуществлен для получения соединений формул (I)-(VII), имеющих различные группы R, R1 и Z, которые являются реакционноспособными, с использованием необязательных соответствующим образом защищенных заместителей для обеспечения совместимости с реакциями, описанными ниже. В этих случаях после снятия защиты получают соединения,имеющие, в основном, описанную структуру. После получения мочевины с кольцами могут быть получены другие соединения указанных формул в соответствии со стандартными методами, применяемыми для взаимного превращения функциональных групп. Схема 1 орто-положении по отношению к нитрогруппе,может быть селективно гидролизован с использованием соли уксусной кислоты, такой как ацетат натрия, в присутствии краун-эфира, такого как 18-краун-6, с образованием ацетата 4, схема 1. Ацетатная группа может быть гидролизована в кислотных условиях в спиртовом растворителе, таком как метанол или этанол, в присутствии каталитического количества кислоты с образованием фенола 5, схема 1. Нитрогруппа может быть восстановлена в условиях, хорошо известных специалистам, таких как использование водорода и палладия-на-угле, хлорида олова в метаноле, цинка в уксусной кислоте или тиоле,с образованием соответствующего анилина 5,схема 1. Затем указанный анилин может быть подвергнут реакции сочетания с коммерчески доступным изоцианатом или тиоизоцианатом с образованием нужной мочевины или тиомочевины. Альтернативно, нужные изоцианаты могут быть получены путем конденсации амина с трифосгеном в присутствии основания (такого как карбонат калия) или взаимодействие карбоновой кислоты с дифенилфосфоразидом в присутствии основания (такого как триэтиламин). Схема 2f) RCNO, ДМФ. Нужная 4-хлор-N-(3-сульфонамидо-2-гидроксифенил)-N"-фенилмочевина может быть синтезирована из коммерчески доступного 2,6 дихлортиофенола способом, показанным на схеме 1. Тиол может быть окислен в соответствующий сульфонилгалогенид с использованием галогенирующего агента, такого как NCS, NBS,Сl2 или Вr2, в присутствии протонного растворителя, такого как вода, уксусная кислота или спирт или их комбинации. Выход может быть увеличен, если в реакционную смесь включен буферный агент, такой как ацетат натрия или калия, а реакцию проводят при комнатной температуре или ниже. Затем соответствующий сульфонилгалогенид может быть конденсирован с амином в присутствии основания, такого как пиридин, триэтиламин, карбонат калия или гидрид натрия, с образованием аналогичного сульфонамида 2, представленного на схеме 1. Дихлорсульфонамид 2, схема 1, может быть подвергнут нитрованию с использованием сильной кислоты, такой как азотная кислота в серной кислоте, с образованием ароматического нитросоединения 3, схема 1. Хлор, находящийся вb) NaH R"X. Если сульфонамид 1, схема 2 (3, схема 1),не содержит функциональные группы R'=R"=H,то, если это необходимо, функциональная группа может быть введена путем алкилирования. Указанный сульфонамид депротонируют с использованием основания, такого как гидрид натрия, а затем алкилируют с использованием алкилгалогенида, такого как бензилбромид или метилиодид, с образованием соединения 2, схема 2. Указанный сульфонамид затем может быть алкилирован повторно с использованием гидрида натрия и другого алкилгалогенида с образованием соединения 3, схема 2. Затем полученное соединение может быть преобразовано в нужную мочевину способом,показанным на схеме 1. Схема 3d) PCl5, РОСl3 е) NHR'R", Et3N. Альтернативный способ получения соединения 5, схема 3 (3, схема 1) показан выше, на схеме 3, где коммерчески доступный 2,6 дихлортиол может быть окислен в сульфонилгалогенид с использованием галогенирующего агента, такого как NCS, NBS, хлор или бром, в присутствии протонного растворителя, такого как спирт, уксусная кислота или вода. Указанный сульфонилгалогенид может быть гидролизован с использованием гидроксида металла,такого как гидроксид натрия или калия, с образованием соответствующей соли сульфоновой кислоты. Затем эта соль сульфоновой кислоты может быть подвергнута нитрованию в условиях нитрования, таких как в присутствии азотной кислоты в растворителе - сильной кислоте, такой как серная кислота, с образованием нитрофенилсульфоновой кислоты 3, схема 3. Указанная сульфоновая кислота 3, схема 3, может быть преобразована в сульфонамид 5, схема 3, трехстадийным методом, предусматривающим образование соли металла с использованием основания, такого как гидроксид натрия, гидрид натрия или карбонат натрия, с образованием соединения 4, схема 3. Затем, указанную сульфоновую кислоту преобразуют в сульфонилхлорид с использованием PCl5 с РОСl3 в качестве растворителя. Затем указанный сульфонилхлорид может быть преобразован в соответствующий сульфонамид с использованием нужного аминаNHR'R" в триэтиламине при температурах в пределах от -78 до 60 С с образованием соответствующего сульфонамида 5, схема 3 (3, схема 1). Указанный сульфонамид 5, схема 3, может быть затем обработан по способу, показанному на схеме 1. Этот метод не ограничивается получением 2,6-дихлорфенилтиола, и он может быть также использован для получения 2,6 дифторфенилтиола, 2,6-дибромфенилтиола и 2,6-дииодфенилтиола. Галогены в данных соединениях могут быть преобразованы в соответствующие циано-, амино-, тиол- или алкоксисоединения реакциями нуклеофильного замещения с использованием нуклеофилов, таких как алкилтиоляты, алкоксиды, амины и цианиды. В указанные галогены могут быть также введены функциональные группы реакцией сочетания с палладием и реакцией карбонилирования, хорошо известными специалистам, с образованием соответствующего амид-, карбонил-,алкенил-, алкил-, фенил- и гетероциклилзамещенных продуктов, если это необходимо в соответствии с формулами (I)-(VII). Новые промежуточные соединения настоящего изобретения включают соединения формул (II), (III), (IV), (V), (VI) и (VII) где R1 не является водородом. Стадии синтеза новых соединений, описанных в настоящей заявке, предусматривают преобразование хлорсодержащего соединения формулы (VII) в фенол формулы (III) с использованием ацетата натрия и 18-краун-6 с последующим гидролизом серной кислотой и метанолом, и аналогичное преобразование достигается в одну стадию с использованием гидрида натрия и воды в ТГФ. Вторая стадия синтеза новых соединений предусматривает нитрование сульфоновой кислоты или натриевой соли формулы (VIII) в нитросоединение формулы (IX) с использованием азотной кислоты в серной кислоте. где R представляет Н или Na и R1 такой, как указано выше. Примеры синтеза Настоящее изобретение описано в нижеследующих примерах, которые приводятся лишь в иллюстративных целях, и не должны рассматриваться как ограничивающие объем настоящего изобретения. Все температуры даны в градусах Цельсия, все растворители имеют самую высокую степень чистоты, а все реакции проводят в безводных условиях в атмосфере аргона, если это не оговорено особо. В данных примерах, все температуры даны в градусах Цельсия (С). Масс-спектры получали на масс-спектрометре VG Zab методом бомбардировки быстрыми атомами, если это не оговорено особо. 1 Н-ЯМР-спектры (называемые далее "ЯМР") регистрировали при 250 МГц на спектрометре Bruker AM 250 или Am 400. Спектральные линии имеют следующие обозначения: с=синглет,д=дублет,т=триплет,кв.=квартет, а шир. означает широкий сигнал."Нас." означает насыщенный раствор, "экв." означает количество молярного эквивалента реагента по отношению к главному реагенту. Очистка, выход и спектральные характеристики для каждого отдельного соединения указаны ниже."ммоль"), N-хлорсукцинимид (37,28 г, 279 ммоль) и ацетат калия (2,29 г, 27,9 ммоль). Полученную смесь перемешивают при 0 С, а затем нагревают до комнатной температуры в течение ночи. После этого данную смесь разбавляют 200 мл дихлорметана и промывают водой (100 мл х 3). Органический слой сушат (Na2SO4) и концентрируют с получением нужного продукта(т, 1 Н). 2,6-Дихлорбензолсульфонамид. Раствор 2,6-дихлорбензолсульфонилхлорида (10,50 г, 42,77 ммоль) в 100 мл пиридина по каплям добавляют в 100 мл пиридина, барботируя через раствор безводный газообразный аммиак. Через 4 ч при 0 С данную смесь подкисляют до рН 1 6 н водной НСl, затем экстрагируют этилацетатом. Затем объединенный органический слой сушат (Na2SO4) и концентрируют с получением нужного продукта (8,69 г,90%). ЭИ-МС (m/z) 225,0, 227,1 (М-). 2,6-Дихлор-3-нитробензолсульфонамид. В раствор 2,6-дихлорбензолсульфонамида(7,8 г, 34,5 ммоль) в 30 мл концентрированной серной кислоты при 0 С, по каплям добавляют азотную кислоту (1,74 мл, 41,4 ммоль). Полученную смесь перемешивают при 0 С в течение 2 ч, затем добавляют 200 мл воды, в результате чего образовывался осадок. Полученную смесь фильтруют. Белое твердое вещество собирают,промывают водой и сушат в вакууме, в результате чего получают нужный продукт (7,17 г,76%). 1H-ЯМР (ДМСО-d6):8,25 (с, 2 Н), 8,20 (д,2 Н), 7,92 (д, 1 Н). 2-Ацетил-6-хлор-3-нитробензолсульфонамид. Раствор 2,6-дихлор-3-нитробензолсульфонамида (2,04 г, 7,5 ммоль), ацетата калия (2,21 г,22,5 ммоль) и 18-краун-6 (5,95 г, 22,5 ммоль) в 50 мл диметилсульфоксида нагревают до 45 С в течение 7 дней. Полученную смесь подкисляют до 1 н водной НСl, затем экстрагируют этилацетатом. Затем органический слой концентрируют с получением неочищенного продукта. После колоночной хроматографии на силикагеле с элюированием смесью этилацетат/гексан/уксусная кислота (50/49/1 об/об/об) получают нужный продукт (1,67 г, 76%). ЭИМС (m/z) 293,1, 295,1 (М-). 6-Хлор-2-гидрокси-3-нитробензолсульфонамид.(0,5 мл) в метаноле кипятят с обратным холодильником в течение 20 ч. Растворитель выпаривают. Остаток разбавляют этилецетатом и промывают водой. Затем органический слой сушат (Na2SO4) и концентрируют, в результате чего получают нужный продукт (1,0 г, 68%). ЭИ-МС (m/z) 251,1, 253,2 (М-). 3-Амино-6-хлор-2-гидроксибензолсульфонамид. К раствору 6-хлор-2-гидрокси-3-нитробензолсульфонамида (1,1 г, 4,36 ммоль) в этилацетате добавляют 10% Pd/C (500 мг). Полученную смесь продувают аргоном, а затем перемешивают в атмосфере водорода, подаваемого из баллона, в течение 4 ч при комнатной температуре. Эту смесь фильтруют через целит, и целит промывают этанолом. Растворитель выпаривают с получением нужного продукта (0,9 г, 93%). ЭИМС (m/z) 221,1, 223,1 (М-).N-(4-Хлор-2-гидрокси-3-аминосульфонил)N'-(2,3-дихлорфенил)мочевина. Раствор 3-амино-6-хлор-2-гидроксибензолсульфонамида (0,88 г, 3,9 ммоль) и 2,3 дихлорфенилизоцианата (0,62 мл, 4,6 ммоль) в 5 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан(30/70-50/50 об/об) и последующей перекристализации из дихлорметана и гексана получают нужный продукт (1,18 г, 74%). Т.пл. 241-242 С.N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/ гексанN-(4-Хлор-2-гидрокси-3-аминосульфонилфенил)-N'-(2,3-дихлорфенил)мочевины натриевая соль. К раствору N-(4-хлор-2-гидрокси-3-аминосульфонилфенил)-N'-(2,3-дихлорфенил)мочевины (1,47 г, 59 ммоль) в 150 мл ацетона добавляют 2,46 мл водного раствора NaOH (1,45 М). Смесь перемешивают в течение 16 ч при комнатной температуре и растворитель выпаривают. Остаток перекристаллизовывают из ацетона и дихлорметана с получением нужного продукта (1,41 г, 91 %). 1H-ЯМР (ДМСО-d6):9,27(469 мг, 3,39 ммоль) и бензилбромида (0,24 мл,2,0 ммоль) в 20 мл N,N-диметилформамида нагревают до 75 С в течение 24 ч. Смесь подкисляют 1 н водной НCl, а затем экстрагируют этилацетатом. Растворитель концентрируют с получением неочищенного продукта. После колоночной хроматографии на силикагеле с элюированием смесью этилацетат/гексан/уксусная кислота (50/49/1, об/об/об) получают нужный продукт (274 мг, 42%). ЭИ-МС (m/z) 383,3,385,3 (M-).N-бензил-2-ацетил-6-хлор-3-нитробензолсульфонамида (225 мг, 0,59 ммоль),0,1 мл хлортриметилсилана и 2 капель дымящей серной кислоты в этаноле нагревают до температуры перегонки в течение 20 ч. Растворитель выпаривают. Остаток разбавляют этилацетатом и промывают водой. Органический слой сушат(Na2SO4) и концентрируют с получением нужного продукта (189 мг, 94%). 1H-ЯМР (ДМСОd6) : 7,92 (д, 1 Н), 7,18 (м, 5 Н), 6,93 (д,1 Н), 4,15N-Бензил-3-амино-6-хлор-2-гидроксибензолсульфонамид. К раствору N-бензил-6-хлор-2-гидрокси-3 нитробензолсульфонамида (180 мг, 0,52 ммоль) в этилацетате добавляют 10% Pd/C (70 мг). Смесь продувают аргоном, а затем перемешивают в атмосфере водорода, подаваемого из баллона, в течение 1 ч при комнатной температуре. Полученную смесь фильтруют через целит и целит промывают метанолом. Растворитель выпаривают с получением нужного продуктаN-[3-(N"-Бензиламиносульфонил)-4-хлор 2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. Раствор N-бензил-3-амино-6-хлор-2-гидроксибензолсульфонамида (54 мг, 0,17 ммоль) и 2,3-дихлорфенилизоцианата (34 мкл, 0,26 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (60/40, об/об) получают нуж 005210N-[3-(N"-Бензиламиносульфонил)-4-хлор 2-гидроксифенил]-N'-(2-бромфенил)мочевина. Раствор N-бензил-3-амино-6-хлор-2-гидроксибензолсульфонамида (80 мг, 0,26 ммоль) и 2 бромфенилизоци-аната (47 мкл, 0,38 ммоль) в 2 мл N,N-диме-тилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексанN,N-Диметил-6-хлор-2-гидрокси-3-нитробензолсульфонамид. К смеси 2-ацетил-6-хлор-3-нитробензолсульфонамида (300 мг, 1,02 ммоль) и гидрида натрия (122 мг, 3,06 ммоль) в 10 мл N,Nдиметилформамида добавляют иодметан (0,64 мл, 10,2 ммоль). Смесь перемешивают при комнатной температуре в течение 20 ч. Полученную смесь подкисляют 1 н водной НCl, а затем экстрагируют этилацетатом. Растворитель концентрируют с получением неочищенного продукта. После колоночной хроматографии на силикагеле с элюированием смесью этилацетат/гексан/ уксусная кислота (50/49/1, об/об/об) получают нужный продукт (140 мг, 49%). 1H-ЯМРN,N-Диметил-3-амино-6-хлор-2-гидроксибензолсульфонамид. К раствору N,N-диметил-6-хлор-2-гидрокси-3-нитробензолсульфонамида (140 мг, 0,50 ммоль) в этилацетате добавляют 10% Pd/C (50 мг). Смесь продувают аргоном, а затем перемешивают в атмосфере баллонного водорода под давлением в течение 1,5 ч при комнатной температуре. Полученную смесь фильтруют через целит и целит промывают метанолом. Растворитель выпаривают с получением нужного продукта (100 мг, 80%). 1H-ЯМР (ДМСО-d6) : 6,87N,N-диметил-3-амино-6-хлор-2 гидроксибензолсульфонамида (80 мг, 0,32 ммоль) и 2,3-дихлорфенилизоцианата (50 мкл,0,38 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного 23 продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (20/80, об/об) и последующей перекристаллизации из этилацетата и гексана получают нужный продукт (63 мг, 45%). 1HЯMP (ДМСО-d6) : 10,51 (с, 1 Н), 9,34 (с, 1 Н),9,27 (с, 1 Н), 8,29 (д, 1 Н), 7,32 (м, 2 Н), 7,16 (д,1 Н), 2,87 (с, 6 Н).N,N-диметил-3-амино-6-хлор-2 гидроксибензолсульфонамида (80 мг, 0,32 ммоль) и 2-бромфенилизоцианата (47 мкл, 0,38 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (20/80, об/об) и последующей перекристаллизации из этилацетата и гексана получают нужный продукт (88 мг, 62%). ЭИМС (m/z) 446,2, 448,3, 450,3 (М-). Примеры 6 и 7. Получение N-[4-хлор-2 гидрокси-3-(N"-метиламиносульфонил)фенил]N'-(2,3-дихлорфенил)мочевины и N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3-(N"-метиламиносульфонил)фенил]мочевины.N-Метил-2-ацетил-6-хлор-3-нитробензолсульфонамид. К смеси 2-ацетил-6-хлор-3-нитробензолсульфонамида (300 мг, 1,02 ммоль) и гидрида натрия (53 мг, 1,32 ммоль) в 10 мл N,N-диметилформамида добавляют иодметан (70 мкл, 1,12 ммоль). Смесь перемешивают при комнатной температуре в течение 66 ч. Полученную смесь подкисляют 1 н водной НCl, а затем экстрагируют этилацетатом. Растворитель концентрируют с получением неочищенного продукта. После колоночной хроматографии на силикагеле с элюированием смесью этилацетат/гексан/ уксусная кислота (50/49/1, об/об/об) получают нужный продукт (185 мг, 59%). ЭИ-МС (m/z) 307,3, 309,3 (М-).N-Метил-6-хлор-2-гидрокси-3-нитробензолсульфонамид. Раствор N-метил-2-ацетил-6-хлор-3-нитробензолсульфонамида (170 мг, 0,55 ммоль), 0,5 мл хлортриметилсилана и 3 капель дымящей серной кислоты в этаноле кипятят с обратным холодильником в течение 20 ч. Растворитель выпаривают. Остаток разбавляют этилацетатом и промывают водой. Органический слой сушат(Na2SO4) и концентрируют с получением нужного продукта (160 мг, 100%). ЭИ-МС (m/z) 265,2, 267,2 (М-). 24 Смесь продувают аргоном, а затем перемешивают в атмосфере водорода, подаваемого из баллона, в течение 1,5 ч при комнатной температуре. Смесь фильтруют через целит и этот целит промывают метанолом. Растворитель выпаривают с получением нужного продукта (160 мг, 100%). 1H-ЯМР (ДМСО-d6) : 7,95 (шир.с,1 Н), 6,85 (д, 1 Н), 6,79 (д, 1 Н), 2,48 (д, 3 Н).N-[4-хлор-2-гидрокси-3-(N"-метиламиносульфонил)фенил]-N'-(2,3-дихлорфенил)мочевина. Раствор N-диметил-3-амино-6-хлор-2-гидроксибензолсульфонамида (70 мг, 0,29 ммоль) и 2,3-дихлорфенилизоцианата (57 мкл, 0,44 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 66 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (30/70, об/об) получают нужный продукт (60 мг, 49%, три стадии). ЭИ-МСN'-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3(N"-метиламиносульфонил)фенил]мочевина. Раствор N-метил-3-амино-6-хлор-2-гидроксибензолсульфонамида (70 мг, 0,29 ммоль) и 2 бромфенилизоцианата (55 мкл, 0,44 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 66 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан(30/70, об/об) получают нужный продукт (85 мг,67%, три стадии). ЭИ-МС (m/z) 432,3, 434,2,436,3 (М-). Примеры 8, 9, 10 и 11. Получение N-[4 хлор-2-гидрокси-3-[N"-[2-(метоксикарбонил)метил]аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевины, N-[3-[N"-(2-карбоксиметил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевины, N-(2-бромфенил)-N'[4-хлор-2-гидрокси-3-[N"-[2-(метоксикарбонил) метил]аминосульфонил]фенил]мочевины и N(2-бромфенил)-N'-[3-[N"-(2-карбоксиметил)аминосульфонил]-4-хлор-2-гидроксифенил]мочевины.N-[2-(метоксикарбонил)метил]-2-ацетил-6 хлор-3-нитробензолсульфонамид. К смеси 2-ацетил-6-хлор-3-нитробензолсульфонамида (300 мг, 1,02 ммоль) и гидрида натрия (81 мг, 2,02 ммоль) в 10 мл N,Nдиметилформамида добавляют метилбромацетат (106 мкл, 1,12 ммоль). Полученную смесь нагревают до 80 С в течение 20 ч, а затем добавляют дополнительное количество гидрида натрия (81 мг, 2,02 ммоль) и перемешивают при комнатной температуре в течение 66 ч. Полученную смесь подкисляют 1 н водной HCl, a затем экстрагируют этилацетатом. Растворитель концентрируют с получением неочищенного 25 продукта. После колоночной хроматографии на силикагеле с элюированием смесью этилацетат/гексан/уксусная кислота (60/39/1, об/об/об) получают нужный продукт (350 мг, 95%). 1HЯМР (ДМСО-d6) : 7,76 (д, 1 Н), 6,12 (д, 1 Н),4,57 (с, 2 Н), 3,66 (с, 3 Н), 2,22 (с, 3 Н).(350 мг, 0,95 ммоль), 0,5 мл хлортриметилсилана и 3 капель дымящей серной кислоты в метаноле кипятят с обратным холодильником в течение 20 ч. Растворитель выпаривают. Остаток разбавляют этилацетатом и промывают водой. Органический слой сушат (Na2SO4) и концентрируют с получением нужного продукта (182 мг, 59%). ЭИ-МС (m/z) 323,0, 325,0 (М-).(170 мг, 0,52 ммоль) в этилацетате добавляют 10% Pd/C (80 мг). Смесь продувают водородом,а затем перемешивают в атмосфере водорода,подаваемого из баллона, в течение 3 ч при комнатной температуре. Смесь фильтруют через целит и этот целит промывают метанолом. Растворитель выпаривают с получением смеси нужного продукта и примеси. Эту смесь используют в следующей стадии без дополнительной очистки. 1H-ЯМР (ДМСО-d6) : 8,68 (м, 1 Н),6,85 (д,1 Н), 6,79 (д,1 Н), 3,83 (с,2 Н), 3,53 (с,3H).(0,26 ммоль) и 2,3-дихлорфенилизоцианата (41 мкл, 0,31 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (40/60, об/об) получают нужный продукт (35 мг, 28%, две стадии). ЭИ-МСN-[3-[N"-(2-карбоксиметил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. Смесь N-[4-хлор-2-гидрокси-3-[N"-[2-(метоксикарбонил)метил]аминосульфонил]фенил]N'-(2,3-дихлорфенил)мочевины (20 мг, 0,041 ммоль) и моногидрата гидроксида лития (40 мг,0,95 ммоль) в 5 мл метанола (95%) перемешивают при комнатной температуре в течение 20 ч. Полученную смесь подкисляют 1 н водной НСl, в результате чего образуется осадок. Затем полученную смесь фильтруют, белое твердое вещество собирают и сушат в вакууме, в резуль 005210 26 тате чего получают нужный продукт (15 мг,78%). ЭИ-МС (m/z) 465,9, 467,9, 469,9 (М-).(0,26 ммоль) и 2-бромфенилизоцианата (38 мкл,0,31 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (30/70, об/об) получают нужный продукт (40 мг, 31%, две стадии). ЭИ-МСN-(2-Бромфенил)-N'-[3-[N"-(2-карбоксиметил)аминосульфонил]-4-хлор-2-гидроксифенил] мочевина. Смесь N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3-[N"-[2-(метоксикарбонил)метил]аминосульфонил]фенил]мочевины (15 мг, 0,03 ммоль) и моногидрата гидроксида лития (20 мг,0,48 ммоль) в 5 мл метанола (95%) перемешивают при комнатной температуре в течение 20 ч. Полученную смесь подкисляют 1 н водной НСl, в результате чего образуется осадок. Затем полученную смесь фильтруют, белое твердое вещество собирают и сушат в вакууме, в результате чего получают нужный продукт (10 мг,70%). ЭИ-МС (m/z) 476,1, 478,1, 490,1 (М-). Способами, аналогичными описанным выше, было дополнительно получено следующее соединение. Пример 12. N-(4-Хлор-2-гидрокси-3-аминосульфонилфенил)-N'-(2-хлорфенил)мочевина. Раствор 3-амино-6-хлор-2-гидрокси-3-гидроксибензолсульфонамида (40 мг, 0,18 ммоль) и 2-хлорфенилизоцианата (33 мг, 0,22 ммоль) в 1 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 18 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (30/70, об/об) и последующей перекристаллизацией из ацетона и гексана получают нужный продукт (30 мг, 44%). ЭИ-МС (m/z) 374,3, 376,1 (М-). Пример 13. Получение N-(4-хлор-2-гидрокси-3-аминосульфонилфенил)-N'-фенилмочевины. В соответствии с общей методикой получения мочевины, описанной в примере 12, 3 амино-6-хлор-2-гидроксибензолсульфонамид(40 мг, 0,18 ммоль) и фенилизоцианат (32 мг,0,27 ммоль) подвергают реакции сочетания с получением нужной мочевины (25 мг, 41%). ЭИ-МС (m/z) 340,3, 342,3 (М-). 27 Пример 14. N-(4-хлор-2-гидрокси-3-аминосульфонилфенил)-N'-(2-феноксифенил)мочевина. В соответствии с общей методикой получения мочевины, описанной в примере 12, 3 амино-6-хлор-2-гидроксибензолсульфонамид(46 мг, 0,22 ммоль) подвергают реакции сочетания с получением нужной мочевины (41 мг, 52(2,1 Н), 9,11 (с, 1 Н), 8,18 (м, 4 Н), 7,41 (м, 2 Н),7,04 (м, 8 Н), 6,84 (д,1 Н). Примеры 15 и 16. Получение N-[4-хлор-2 гидрокси-3-[N"-2-(метоксиэтил)аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевины натриевой соли и N-(2-бромфенил)-N'-[4-хлор-2 гидрокси-3-[N"-2-(метоксиэтил)аминосульфонил]фенил]мочевины. Ниже описана общая методика получения сульфонамида.N-2-(Метоксиэтил)-2,6-дихлор-3-нитробензосульфонамид. В раствор 2,6-дихлор-3-нитробензосульфонилхлорида (600 мг, 2,06 ммоль) в 15 мл дихлорметана при -78 С по каплям добавляют раствор 2-метоксиэтиламина (153 мг, 2,06 ммоль) и триэтиламина (770 мкл, 5,15 ммоль) в 10 мл дихлорметана. Смесь нагревают до комнатной температуры и перемешивают в течение 16 ч. Полученную смесь подкисляют 1 н водной НCl до рН 1, а затем экстрагируют этилацетатом. Объединенный органический слой концентрируют с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (30/70, об/об) получают нужный продукт (640 мг, 94%). ЭИ-МС (m/z) 327,1, 329,1(М-). Ниже описан общий метод гидролиза дихлорсульфонамида с образованием фенола.(27 мкл, 1,49 ммоль) нагревают до 35 С при выдерживании в атмосфере аргона в течение 3 дней. За ходом реакции следят с помощью 1HЯМР. Если реакция не завершена, то к смеси добавляют 0,1 экв. воды. Если реакция почти завершена, на что указывает 1 Н-ЯМР, то растворитель выпаривают. Остаток разбавляют этилацетатом и промывают 1 н водной НCl. Рстворитель концентрируют с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан/уксусная кислота(270 мг, 98%). ЭИ-МС (m/z) 309,1, 311,1 (M-). Ниже описан общий метод гидрирования нитросоединения с образованием анилина.(100 мг). Смесь продувают аргоном, а затем перемешивают в атмосфере водорода, подаваемого из баллона, в течение 3 ч при комнатной температуре. Смесь фильтруют через целит и этот целит промывают метанолом. Растворитель выпаривают с получением нужного продукта (210 мг, 89%). ЭИ-МС (m/z) 281,1, 283,1 (М-). Ниже описан общий метод получения мочевины.N-(2-метоксиэтил)-3-амино-6 хлор-2-гидрокси-3-гидроксибензолсульфонамида (772 мг, 2,75 ммоль) и 2,3-дихлорфенилизоцианата (560 мг, 3,03 ммоль) в 2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 18 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (30/70,об/об) и перекристаллизации из ацетона и гексана получают нужный продукт (720 мг, 56%). Элементный анализ: вычислено С, 41,00%; Н,4,44%; N, 8,96%; найдено: С, 40,77%; Н, 3,28%;N, 8,83%. Ниже описан общий метод получения натриевой соли.N-[4-Хлор-2-гидрокси-3-[N"-(2-метоксиэтил)аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевины натриевая соль. К раствору N-[4-хлор-2-гидрокси-3-[N"-(2 метоксиэтил)аминосульфонил]фенил]-N'-(2,3 ди-хлорфенил)мочевины (307 мг, 0,66 ммоль) в 30 мл ацетона добавляют 1,20 мл водного раствора NaOH (0,54 М). Смесь перемешивают в течение 16 ч при комнатной температуре и растворитель выпаривают. Остаток перекристаллизовывают из ацетонитрила с получением нужного продукт (288 мг, 89%). 1H-ЯМР (ДМСО-d6)N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3[N"-(2-метоксиэтил)аминосульфонил]фенил]мочевина. В соответствии с общей методикой получения мочевины, описанной в примере 15, N-(2 метоксиэтил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (140 мг, 0,50 ммоль) и 2 бромфенилизоцианат (119 мг, 0,60 ммоль) подвергают реакции сочетания с получением нужной мочевины (174 мг, 72 %). ЭИ-МС (m/z) 476,0, 478,0, 479,9 (М-).a) N-(3-Этоксикарбонилэтил)-2,6-дихлор 3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,5 г, 5,17 ммоль), этиловый эфир -аланина (0,95 мл, 6,2 ммоль) и триэтиламин (1,8 мл, 12,9 ммоль) подвергают реакции с образованием нужного продукта (1,8 г, 94 %). ЭИ-МС (m/z) 370 (М-Н)-.b) N-(3-Карбоксиэтил)-6-хлор-2-гидрокси 3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-(3-этоксикарбонилэтил)-2,6-дихлор-3-нитробензолсульфонамид (1,82 г, 4,9 ммоль), NaH (60%, 588 мг, 14,7 ммоль) и воду (106 мг, 5,88 ммоль) подвергают реакции с образованием нужного продукта (1,0 г, 63 %). ЭИ-МС (m/z) 323,5 (М-Н)-.c) N-(3-Карбоксиэтил)-3-амино-6-хлор-2 гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-(3-карбоксиэтил)-6-хлор-2-гидрокси-3-нитробензолсульфонамид (100 мг, 0,3 ммоль) восстанавливают водородом в присутствии Pd/C (100 мг) с получением нужного продукта (62 мг, 68 %). ЭИ-МС (m/z) 293,5 (М-Н)-.N-[4-Хлор-2-гидрокси-3-(3-карбоксиэтиламиносульфонил)фенил]-N'-(2-бромфенил) мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-(3 карбоксиэтил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (62 мг, 0,21 ммоль) и 2-бромфенилизоцианат (42 мг, 0,21 ммоль) подвергают реакции сочетания с получением нужной мочевины (35 мг, 34 %). ЭИ-МС (m/z) 491,7 (М-Н)-. Примеры 18, 19 и 20. Получение N-(2 бромфенил)-N'-[4-хлор-2-гидрокси-3-(изопропиламиносульфонил)фенил]мочевины,N-[4 хлор-2-гидрокси-3-(изопропиламиносульфонил) фенил]-N'-(2-хлорфенил)мочевины и N-[4-хлор 2-гидрокси-3-(изопропиламиносульфонил)фенил]-N'-(2,3-дихлорфенил)мочевины.N-Изопропил-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,5 г, 5,17 ммоль), изопропиламин (0,44 мл, 5,17 ммоль) и триэтиламин (1,08 мл, 7,76 ммоль) подвергают реакции с образованием нужного продукта (1,3 г, 81 %). ЭИ-МС (m/z) 312 (М-Н)-.(89 мг, 4,98 ммоль) подвергают реакции с образованием нужного продукта (0,7 г, 57 %). ЭИМС (m/z) 293,5 (М-Н)-.(0,7 г, 2,38 ммоль) восстанавливают водородом в присутствии Pd/C (0,7 г) с получением нужного продукта (0,62 мг, 98 %). ЭИ-МС (m/z) 263,5d) N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3-(изопропиламиносульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-изопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (220 мг, 0,88 ммоль) и 2-бромфенилизоцианат (174 мг, 0,88 ммоль) подвергают реакции сочетания с получением нужной мочевины (110 мг, 29 %). ЭИ-МС (m/z) 461,7 (М-Н)-.e) N-[4-хлор-2-гидрокси-3-(изопропиламиносульфонил)фенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nизопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (188 мг, 0,75 ммоль) и 2,3 дихлорфенилизоцианат (141 мг, 0,75 ммоль) подвергают реакции сочетания с получением нужной мочевины (104 мг, 32%). ЭИ-МС (m/z) 451,7 (М-Н)-.f) N-[4-хлор-2-гидрокси-3-(изопропиламиносульфонил)фенил]-N'-(2-хлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nизопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (220 мг, 0,88 ммоль) и 2-хлорфенилизоцианат (135 мг, 0,88 ммоль) подвергают реакции сочетания с получением нужной мочевины (110 мг, 32%). ЭИ-МС (m/z) 417,1 (МН)-. Пример 21. N-(4-Хлор-2-гидрокси-3-аминосульфонил)-N'-(2-метоксифенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 12, 3 амино-6-хлор-2-гидроксибензолсульфонамид(33 мг, 0,22 ммоль) подвергают реакции сочетания с получением нужной мочевины (23 мг,34%). ЭИ-МС (m/z) 370,3, 372,1 (М-). Пример 22. N-(4-Хлор-2-гидрокси-3-аминосульфонилфенил)-N'-(2,3-метилендиоксифенил)мочевина 2,3-(метилендиокси)бензойная кислота. Раствор 2,3-(метилендиокси)бензальдегида(160 мг, 1,06 ммоль), карбоната калия (960 мг,6,9 ммоль) и 2,4 мл пероксида водорода (30-32 мас.% раствора в воде) в 10 мл метанола пере 31 мешивают в течение 16 ч при комнатной температуре. Смесь промывают диэтиловым эфиром. Водный слой подкисляют 1 н вод. НСl до рН 1,а затем экстрагируют этилацетатом. Органический слой сушат над MgSO4, а затем концентрируют с получением нужного продукта (170 мг,96 %). ЭИ-МС (m/z) 164,8 (М-).N-(4-Хлор-2-гидрокси-3-аминосульфонилфенил)-N'-(2,3-метилендиоксифенил)мочевина. Смесь 2,3-(метилендиокси)бензойной кислоты (170 мг, 1,02 ммоль), дифенилфосфорилазида (338 мг, 1,23 ммоль) и триэтиламина (0,17 мл, 1,23 ммоль) перемешивают при комнатной температуре в течение 3 дней. Смесь концентрируют. К остатку в 1 мл N,N-диметилформамида добавляют 3-амино-6-хлор-2-гидроксибензолсульфонамид (40 мг, 0,18 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 ч. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (50/50,об/об) получают нужный продукт (40 мг, 10%). ЭИ-МС (m/z) 386,2, 388,2 (М-). Пример 23. N-(2-Бензилоксифенил)-N'-(4 хлоро-2-гидрокси-3-аминосульфонилфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 12, 3 амино-6-хлор-2-гидроксибензолсульфонамид(52 мг, 0,23 ммоль) и 2-бензилоксифенилизоцианат (40 мг, 0,17 ммоль) подвергают реакции сочетания с получением нужной мочевины(84 мг, 0,61 ммоль) и аллилбромида (0,18 мл, 2,0 ммоль) в 3 мл N,N-диметилформамида нагревают до 60 С в течение 4 дней. Смесь подкисляют 1 н водной НСl а затем экстрагируют этилацетатом. Растворитель концентрируют с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан/уксусная кислота (50/49/1, об/об/об) получают нужный продукт (40 мг, 12%). ЭИ-МС (m/z) 333,3, 335,2N-Аллил-6-хлор-2-гидрокси-3-нитробензолсульфонамид. Раствор N-аллил-2-ацетил-6-хлор-3-нитробензолсульфонамида (30 мг, 0,09 ммоль), 0,1 мл хлортриметилсилана и 2 капель дымящей серной кислоты в этаноле кипятят с обратным холодильником в течение 20 ч. Растворитель выпаривают. Остаток разбавляют этилацетатом и промывают водой. Органический слой сушат(Na2SO4) и концентрируют с получением нужного продукта (26 мг, 100%). 1H-ЯMP (MeOD 005210N-Аллил-3-амино-6-хлор-2-гидроксибензолсульфонамид. Раствор N-аллил-6-хлор-2-гидрокси-3-нитробензолсульфонамида (25 мг, 0,09 ммоль) и дигидрата хлорида олова (II) (101 мг, 0,44 ммоль) в 5 мл этанола перемешивают при комнатной температуре. Смесь концентрируют,остаток разбавляют этилацетатом и 10% воднымNаНСО 3. Органический слой сушат над Na2SO4 и концентрируют с получением неочищенного продукта (20 мг), который используют в следующей стадии без очистки. ЭИ-МС (m/z) 263,1,265,2 (М-).N-[3-(N"-Аллиламиносульфонил)-4-хлор 2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. Раствор неочищенного N-аллил-3-амино-6 хлор-2-гидроксибензолсульфонамида (20 мг) и 2,3-дихлорфенилизоцианата (12 мкл, 0,09 ммоль) в 1 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 20 ч. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан (30/70, об/об) и перекристаллизации из ацетона и гексана получают нужный продукт (10 мг, 29%, для двух стадий). ЭИ-МС(m/z) 450,2, 452,2, 454,1 (М-). Пример 25. Получение N-4-хлор-2-гидрокси-3-(N"-2-трифторэтил)аминосульфонил] фенил]-N'-(2,3-дихлорфенил)мочевины. 2,6-Дихлор-3-нитробензолсульфоновая кислота. Гидрат гидроксида лития (12,64 г, 0,301 ммоль) добавляют к раствору 2,6-дихлорбензолсульфонилхлорида (35,53 г, 0,146 моль) в МеОН (600 мл) и реакционную смесь оставляют на 3 ч при комнатной температуре для перемешивания. Реакционную смесь фильтруют для удаления суспендированных твердых веществ, а затем концентрируют. Полученное твердое вещество сушат в вакууме в течение ночи для удаления любого остаточного МеОН. Затем твердое вещество растворяют в H2SO4 (300 мл) и охлаждают на ледяной бане. К вышеуказанной реакционной смеси в течение 90 мин медленно добавляют раствор H2SO4 (35 мл) и НNO3 (13,2 мл). Реакционную смесь нагревают до комнатной температуры в течение ночи, а затем медленно выливают в ледяную воду (1200 мл) и экстрагируют EtOAc. Объединенные органические слои сушат (МgSO4) и концентрируют с получением 2,6-дихлор-3-нитробензолсульфоновой кислоты (44,35 г, 99%) в виде дигидрата. ЭИ-МС (m/z) 270 (М-Н)-. 2,6-Дихлор-3-нитробензолсульфонилхлорид. Гидроксид калия (12,07 г, 0,215 моль) добавляют к раствору дигидрата 2,6-дихлор-3 33 нитробензолсульфоновой кислоты (44,35 г,0,144 моль) в МеОН (850 мл), и реакционную смесь оставляют на 14 ч при комнатной температуре для перемешивания. Реакционную смесь концентрируют и полученное твердое вещество сушат в вакууме в течение ночи. К этому веществу добавляют PCl5 (30,00 г, 0,144 моль), а затем POCl3 (475 мл) и смесь кипятят с обратным холодильником в течение ночи. Затем реакционную смесь охлаждают до комнатной температуры и концентрируют. Полученную смесь растворяют в EtOAc и охлаждают на ледяной бане. К реакционной смеси медленно добавляют кусочки льда для гашения какого-либо остаточного PСl5. После прекращения выделения пузырьков добавляют воду и реакционную смесь экстрагируют EtOAc. Органический слой сушатN-(2-Трифторэтил)-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общим методом получения сульфонамида, описанным в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(560 мг, 1,93 ммоль), гидрохлорид 2-трифторэтиламина (261 мг, 1,93 ммоль) и триэтиламин (0,89 мг, 5,79 ммоль) подвергают реакции с образованием нужного продукта (490 мг, 72N-(2-Трифторэтил)-6-хлор-2-гидрокси-3 нитробензолсульфонамид. К раствору N-(2-трифторэтил)-2,6-дихлор 3-нитробензолсульфонамида (130 мг, 0,36 ммоль) в 5 мл тетрагидрофурана добавляют 60%NaH (43 мг, 1,08 ммоль) и метанол (15 мкл, 0,36 ммоль). Смесь перемешивают в течение 16 ч при комнатной температуре. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан/ уксусная кислота (49/50/1, об/об/об) получают нужный продукт (44 мг, 33%). ЭИ-МС (m/z) 333,1, 335,1 (М-).N-(2-Трифторэтил)-3-амино-6-хлор-2-гидроксибензолсульфонамид. В соответствии с общей методикой гидрирования, описанной в примере 15, N-(2-трифторэтил)-6-хлор-2-гидрокси-3-нитробензолсульфонамид (40 мг, 0,12 ммоль) восстанавливают водородом и 10% Pd/C (20 мг) с получением нужного продукта (36 мг, 100%). ЭИ-МСN-[4-Хлор-2-гидрокси-3-[N"-(2-трифторэтил)аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общей методикой получения мочевины, описанным в примере 15, N-(2 трифторэтил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (36 мг, 0,12 ммоль) и 2,3-дихлорфенилизоцианат (27 мг, 0,14 ммоль) подвергают реакции сочетания с образованиемN-Фенил-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(540 мг, 1,85 ммоль), анилин (173 мг, 1,85 ммоль) и триэтиламин (0,61 мл, 5,55 ммоль) подвергают реакции с получением нужного продукта (130 мг, 20%). 1H-ЯМР (MeOD-d4) : 7,65 (д, 1 Н), 7,58 (д, 1 Н), 7,40 (д, 2 Н), 7,15 (м,3H).N-Фенил-2-гидрокси-6-метокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-фенил-2,6 дихлор-3-нитробензолсульфонамид (130 мг,0,37 ммоль), 60% NaH (44 мг, 1,11 ммоль) и метанол (15 мкл, 0,37 ммоль) подвергают реакции. Неочищенную смесь (70 мг) используют в следующей стадии без очистки.N-фенил-2-гидрокси-6-метокси-3-нитробензолсульфонамид (70 мг) восстанавливают водородом в присутствии Pd/C (35 мг). Неочищенную смесь используют в следующей стадии без очистки.N-(2,3-Дихлорфенил)-N'-[2-гидрокси-4-метокси-3-(N"-фениламиносульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенный N-фенил-3-амино-2-гидрокси-6-метоксибензолсульфонамид и 2,3-дихлорфенилизоцианат (43 мг, 0,23 ммоль) подвергают реакции сочетания с получением нужной мочевиныN-(2-Бромфенил)-N'-[2-гидрокси-4-метокси-3-(N"-фениламиносульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенныйN-фенил-3-амино-2-гидрокси-6 метоксибензолсульфонамид и 2-бромфенилизоцианат (46 мг, 0,23 ммоль) подвергают реакции сочетания с получением нужной мочевины (5,0 мг, 5,6 %). ЭИ-МС (m/z) 490,1, 492,1 (М)-. Примеры 30 и 31. Получение N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3-(4-морфолинилсульфонил)фенил]мочевины и N-[4-хлор-2-гид 35 рокси-3-(4-морфолинилсульфонил)фенил]-N'(2,3-дихлорфенил)мочевины 2,6-дихлор-1-(4 морфолинилсульфонил)-3-нитробензол. В соответствии с общей методикой получения сульфонамида, описанной в примере 15, 2,6 дихлор-3-нитробензолсульфонилхлорид (500 мг,1,72 ммоль), морфолин (150 мг, 1,72 ммоль) и триэтиламин (479 мкл, 3,44 ммоль) подвергают реакции с получением нужного продукта (430 мг,73%). ЖХ-МС (m/z) 341,0 (М-). 6-Хлор-2-гидрокси-1-(4-морфолинилсульфонил)-3-нитробензол. В соответствии с общим методом гидролиза, описанным в примере 15, 2,6-дихлор-1-(4 морфолинилсульфонил)-3-нитробензол (410 мг,1,20 ммоль), 60% NaH (144 мг, 3,6 ммоль) и воду (26 мкл, 1,44 ммоль) подвергают реакции с получением нужного продукта (220 мг, 57%). ЭИ-МС (m/z) 321,1, 323,1 (М-). 4-Хлор-2-гидрокси-3-(4-морфолинилсульфонил)анилин. В соответствии с общим методом гидрирования, описанным в примере 15, неочищенный 6-дихлор-2-гидрокси-1-(4-морфолинилсульфонил)-3-нитробензол (210 мг, 0,65 ммоль) восстанавливают водородом в присутствии Pd/C(100 мг) с получением нужного продукта (180 мг, 95%). 1 Н-ЯМР (МеОD-d4) : 6,28 (м, 2 Н),3,68 (т, 4 Н), 3,30 (т, 4 Н).N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3(4-морфолинилсульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(4-морфолинилсульфонил)анилин(90 мг, 0,31 ммоль) и 2-бромфенилизоцианат (46 мкл, 0,37 ммоль) подвергают реакции сочетания с получением нужной мочевины (81 мг, 53 %). ЭИ-МС (m/z) 487,76, 489,75, 491,74 (М)-.N-[4-Хлор-2-гидрокси-3-(4-морфолинилсульфонил)фенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(4-морфолинилсульфонил)анилин(70 мкл, 0,37 ммоль) подвергают реакции сочетания с получением нужной мочевины (77 мг,52 %). ЭИ-МС (m/z) 477,68, 479,72, 481,63 (М)-. Примеры 32 и 36. Получение N-[3-[N"-[3(трет-бутоксикарбониламино)пропил]аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевины и N'-[3-[N"-(3-аминопропил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевины трифторацетата.N-[3-(трет-Бутоксикарбониламино)пропил]-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,0 г, 3,44 ммоль), трет-бутил-N-(3-аминопропил) карбамат (0,60 мг, 3,44 ммоль) и триэтиламин(960 мкл, 6,88 ммоль) подвергают реакции с получением нужного продукта (1,44 г, 98%). ЭИ-МС (m/z) 426,1, 428,1, 430,1 (М-Н)-.N-[3-(трет-Бутоксикарбониламино)пропил]-6-хлор-2-гидрокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-[3-(третбутоксикарбониламино)пропил]-2,6-дихлор-3 нитробензолсульфонамид (450 мг, 1,05 ммоль),60% NaH (168 мг, 4,2 ммоль) и воду (21 мкл,1,15 ммоль) подвергают реакции с получением нужного продукта (250 мг, 58%). ЭИ-МС (m/z) 408,1, 410,1 (М-Н)-.N-[3-(трет-Бутоксикарбониламино)пропил]-3-амино-6-хлор-2-гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-[3-(третбутоксикарбониламино)пропил]-6-хлор-2-гидрокси-3-нитробензолсульфонамид (250 мг, 0,61 ммоль) восстанавливают водородом в присутствии Pd/C (100 мг) с получением нужного продукта (220 мг, 95%). 1H-ЯМР (MeOD-d4) : 6,82N-[3-[N"-[3-(трет-Бутоксикарбониламино) пропил]аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[3(трет-бутоксикарбониламино)пропил]-3-амино 6-хлор-2-гидроксибензолсульфонамид (110 мг,0,29 ммоль) и 2,3-дихлорфенилизоцианат (65 мкл, 0,35 ммоль) подвергают реакции сочетания с получением нужной мочевины (90 мг, 55 %). ЭИ-МС (m/z) 565,64, 567,74, 569,60 (М). Ниже описана общая методика удаления защитной группы Воc.(33 мг, 0,058 ммоль) в 1 мл трифторуксусной кислоты перемешивают при комнатной температуре в течение 30 мин. Затем растворитель концентрируют. Остаток разбавляют метанолом, затем концентрируют. Эту процедуру повторяют два раза и получают неочищенный продукт. После перекристаллизации из метанола и воды получают нужный продукт (23 мг, 68%). ЭИ-МС (m/z) 466,7, 468,8, 470,8 (М)-. Примеры 33, 34 и 35. Получение N-(2 бромфенил)-N'-[3-[N"-[3-(трет-бутоксикарбониламино)пропил]аминосульфонил]-4-хлор-2 гидроксифенил]мочевины; N-[3-[N"-(3-аминопропил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2-бромфенил)мочевины трифторацетата и N-[3-[N"-[3-(аминопропил)]аминосульфо 37 нил]-4-хлор-2-гидроксифенил]-N'-(2-бромфенил)мочевины гидрохлорида N-(2-бромфенил)N'-[3-[N"-[3-(трет-бутоксикарбониламино)пропил]аминосульфонил]-4-хлор-2-гидроксифенил] мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[3(трет-бутоксикарбониламино)пропил]-3-амино 6-хлор-3-гидроксибензолсульфонамид (110 мг,0,29 ммоль) и 2-бромфенилизоцианат (69 мкл,0,35 ммоль) подвергают реакции сочетания с получением нужной мочевины (140 мг, 84%). ЭИ-МС (m/z) 575,53, 577,61, 579,62 (М)-.N'-[3-[N"-(3-Аминопропил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2-бромфенил)мочевины трифторацетат. В соответствии с общей процедурой удаления защитной группы Вос, описанной в примере 15, N-(2-бромфенил)-N'-[3-[N"-[3-(трет-бутоксикарбониламино)пропил]аминосульфонил]-4-хлор-2-гидроксифенил]мочевину (21 мг,0,036 ммоль) перемешивают в 1 мл трифторуксусной кислоты и получают нужный продукт(33 мг, 0,058 ммоль) в 1 мл 4,0 М НСl в 1,4 диоксане перемешивают при комнатной температуре в течение 10 мин. Затем растворитель концентрируют. После перекристаллизации из ацетона и гексана получают нужный продукт(45 мг, 85 %). ЖХ-МС (m/z) 477,0 (М)+. Примеры 37 и 38. Получение N-(2 бромфенил)-N'-[3-[N"-[2-(трет-бутоксикарбониламино)этил]аминосульфонил]-4-хлор-2 гидроксифенил]мочевины и N-[3-[N"-(2-аминоэтил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2-бромфенил)мочевины. трет-Бутил-N-(2-аминоэтил)карбамат. Раствор этилендиамина (3,0 г, 49,9 ммоль),ди-трет-бутилдикарбамата (3,63 г, 16,6 ммоль) и триэтиламина (6,95 мл, 49,9 ммоль) в 100 мл дихлорметана перемешивают при комнатной температуре в течение 16 ч. Смесь фильтруют для удаления твердого вещества, образовавшегося в процессе реакции. Фильтрат промывают водой, сушат над МgSO4, концентрируют и сушат в вакууме, в результате чего получают нужный продукт (1,79 г, 67%). ЖХ-МС (m/z) 160,97 (М-).N-[2-(трет-бутоксикарбониламино)этил]2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,0 г, 3,44 ммоль), трет-бутил-N-(2-аминоэтил) кар 005210 38 бамат (0,6 г, 3,44 ммоль) и триэтиламин (0,72 мкл, 5,16 ммоль) подвергают реакции с получением нужного продукта (1,29 г, 90%). 1H-ЯМРN-[2-(трет-Бутоксикарбониламино)этил]-6 хлор-2-гидрокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-[2-(третбутоксикарбониламино)этил]-2,6-дихлор-3-нитробензолсульфонамид (1,63 г, 3,94 ммоль),60% NaH (630 мг, 15,8 ммоль) и воду (71 мкл,3,94 ммоль) подвергают реакции с получением нужного продукта (200 мг, 13%). 1H-ЯМРN-[2-(трет-Бутоксикарбониламино)этил]-3 амино-6-хлор-2-гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-[2-(третбутоксикарбониламино)этил]-6-хлор-2-гидрокси-3-нитробензолсульфонамид (200 мг, 0,51 ммоль) восстанавливают водородом в присутствии Pd/C (100 мг) с получением нужного продукта (170 мг, 92%). 1H-ЯMP (MeOD-d4) : 6,84N-(2-Бромфенил)-N'-[3-[N"-[2-(трет-бутоксикарбониламино)этил]аминосульфонил]-4 хлор-2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[2(трет-бутоксикарбониламино)пропил]-3-амино 6-хлор-3-гидроксибензолсульфонамид (170 мг,0,47 ммоль) и 2-бромфенилизоцианат (92 мг,0,47 ммоль) подвергают реакции сочетания с получением нужной мочевины (120 мг, 49 %). ЖХ-МС (m/z) 560,0 (М)+.N-[3-[N"-(2-Аминоэтил)аминосульфонил]4-хлор-2-гидроксифенил]-N'-(2-бромфенил)мочевины трифторацетат. В соответствии с общей процедурой удаления защитной группы Воc, описанной в примере 15, N-(2-бромфенил)-N'-[3-[N"-[2-(третбутоксикарбониламино)этил]аминосульфонил]4-хлор-2-гидроксифенил]мочевину (80 мг, 0,14 ммоль) перемешивают в 1 мл трифторуксусной кислоты и получают нужный продукт (22 мг, 34%). ЖХ-МС (m/z) 465,0 (M)+. Примеры 39 и 42. Получение N-(2 бромфенил)-N'-[3-4-(трет-бутоксикарбонил) пиперазин-1-ил]сульфонил]-4-хлор-2-гидроксифенил]мочевины и N-(2-бромфенил)-N'-[4-хлор 2-гидрокси-3-(пиперазин-1-ил)сульфонилфенил]мочевины трифторацетата. 1-[4-(трет-Бутоксикарбонил)пиперазин-1 ил]сульфонил-2,6-дихлор-3-нитробензол. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(500 мг, 1,72 ммоль), трет-бутил-1-пиперазинкарбоксилат (320 мг, 1,72 ммоль) и триэти 39 ламин (479 мкл, 3,44 ммоль) подвергают реакции с получением нужного продукта (650 мг,84%). ЖХ-МС (m/z) 440,2 (М+). 1-[4-(трет-Бутоксикарбонил)пиперазин-1 ил]сульфонил-6-хлор-2-гидрокси-3-нитробензол. В соответствии с общим методом гидролиза, описанным в примере 15, 1-[4-(трет-бутоксикарбонил)пиперазин-1-ил]сульфонил-2,6-дихлор-3-нитробензолсульфонамид (200 мг, 0,45 ммоль), 60% NaH (54 мг, 1,35 ммоль) и воду (8 мкл, 0,45 ммоль) подвергают реакции с получением нужного продукта (60 мг, 32%). ЭИ-МС(m/z) 420/1, 422, 1 (M+). 3-[4-(трет-Бутоксикарбонил)пиперазин-1 ил]сульфонил-4-хлор-2-гидроксианилин. В соответствии с общим методом гидрирования, описанным в примере 15, 1-[4-(третбутоксикарбонил)пиперазин-1-ил]сульфонил-6 хлор-2-гидрокси-3-нитробензол (256 мг, 0,61 ммоль) восстанавливают водородом в присутствии Pd/C (120 мг) с получением нужного продукта (220 мг, 93%). 1H-ЯМР (MeOD-d4) : 6,84N-(2-Бромфенил)-N'-[3-4-(трет-бутоксикарбонил)]пиперазин-1-ил]сульфонил-4-хлор-2 гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3-[4(трет-бутоксикарбонил)пиперазин-1-ил]сульфонил-4-хлор-2-гидроксианилин (110 мг, 0,28 ммоль) и 2-бромфенилизоцианат (67 мг, 0,34 ммоль) подвергают реакции сочетания с получением нужной мочевины (60 мг, 36 %). Элементный анализ: вычислено С, 44,80%; Н,4,44%; N, 9,50%; найдено: С, 44,65%; Н, 4,15%;N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3(пиперазин-1-ил)сульфонилфенил]мочевины трифторацетат. В соответствии с общей процедурой удаления защитной группы Вос, описанной в примере 36, N-(2-бромфенил)-N'-[3-4-(трет-бутоксикарбониламино)пиперазин-1-ил]сульфонил]4-хлор-2-гидроксифенил]мочевину (10 мг, 0,019 ммоль) перемешивают в 1 мл трифторуксусной кислоты и получают нужный продукт (5 мг, 49N-[3-4-(трет-Бутоксикарбонил)пиперазин-1-ил]сульфонил]-4-хлор-2-гидроксифенил]N'-(2,3-дихлорфенил)мочевина. В соответствии с общей методикой получения мочевины, описанной в примере 15, 3-[4 005210(трет-бутоксикарбонил)пиперазин-1-ил]сульфонил]-4-хлор-2-гидроксианилин (110 мг, 0,28 ммоль) и 2,3-дихлорфенилизоцианат (64 мкл,0,34 ммоль) подвергают реакции сочетания с получением нужной мочевины (34 мг, 25 %). ЭИ-МС (m/z) 576,65, 578,65, 580,67 (М)-.N-[4-Хлор-2-гидрокси-3-(пиперазин-1-ил) сульфонилфенил]-N'-(2,3-дихлорфенил)мочевины трифторацетат. В соответствии с общей процедурой удаления защитной группы Воc, описанной в примере 36, N-[3-4-(трет-бутоксикарбониламино) пиперазин-1-ил]сульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевину (20 мг,0,034 ммоль) перемешивают в 1 мл трифторуксусной кислоты и получают нужный продуктN-(3-Метилтиопропил)-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (2 г,6,88 ммоль), 3-(метилтио)пропиламин (0,72 мг,6,88 ммоль) и триэтиламин (1,92 мл, 13,76 ммоль) подвергают реакции с получением нужного продукта (2,07 г, 82%). 1H-ЯМР (MeOD-d4)(330 мг, 8,13 ммоль) и воду (59 мкл, 3,25 ммоль) подвергают реакции с получением нужного продукта (650 мг, 69%). ЭИ-МСN-(3-Метилтиопропил)-3-амино-6-хлор-2 гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-(3-метилтиопропил)-6-хлор-2-гидрокси-3-нитробензолсульфонамид (300 мг, 0,88 ммоль) восстанавливают водородом в присутствии Pd/C (120 мг) с получением нужного продукта (250 мг, 91%). 1HЯМР (MeOD-d4) : 6,84 (м, 2 Н), 6,77 (д, 1 Н),2,93 (т, 2 Н), 2,40 (т, 1 Н), 1,89 (с, 3H), 1,63 (м,2 Н).N-[4-Хлор-2-гидрокси-3-[N"-(3-метилтиопропил)аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-(3 метилтиопропил)-3-амино-6-хлор-2-гидроксибензосульфонамид (250 мг, 0,80 ммоль) и 2,3 дихлорфенилизоцианат (182 мг, 0,97 ммоль) подвергают реакции сочетания с получением нужной мочевины (278 мг, 70 %). 1H-ЯMPN-[4-Хлор-2-гидрокси-3-[N"-[3-(метилсульфонил)пропил]аминосульфонил]фенил]-N'(2,3-дихлорфенил)мочевина. Раствор N-[4-хлор-2-гидрокси-3-[N"-(3-метилсульфонил)фенил]-N'-(2,3-дихлорфенил)мочевины (50 мг, 0,10 ммоль) и оксона (93 мг, 0,15 ммоль) в ацетонитриле (13 мл) и воде (7 мл) перемешивают в течение 3 ч при комнатной температуре. Смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/гексан/уксусная кислота (49/50/1,об/об/об) и последующей перекристаллизации из ацетона и гексана получают нужный продукт(2 мл) перемешивают в течение 3 дней при комнатной температуре. Полученную смесь разбавляют этилацетатом и промывают водой с получением неочищенного продукта. После перекристаллизации из ацетона и гексана получают нужный продукт (42 мг, 81%). 1H-ЯМР (ДМСОd6) : 9,32 (с, 1 Н), 9,27 (с, 1 Н), 8,59 (с, 1 Н), 8,29N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3[N"-(3-метилтиопропил)аминосульфонил]фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-(3 метилтиопропил)-3-амино-6-хлор-2-гидрокси 005210 42 бензосульфонамид (250 мг, 0,80 ммоль) и 2 бромфенилизоцианат (191 мг, 0,97 ммоль) подвергают реакции сочетания с получением нужной мочевины (300 мг, 74 %). 1H-ЯMP (MeODd4) : 8,28 (д, 1 Н), 7,91 (д, 1 Н), 7,58 (д, 1 Н), 7,32N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3[N"-[3-(метилсульфонил)пропил]аминосульфонил]фенил]мочевина. В соответствии с процедурой окисления,описанной в примере 51, N-(2-бромфенил)-N'[4-хлор-2-гидрокси-3-[N"-(3-метилсульфонил)] фенил]мочевину (50 мг, 0,10 ммоль) и оксон (91 мг, 0,15 ммоль) подвергают реакции с получением нужного продукта (41 мг, 77%). Элементный анализ: найдено: С, 33,58%; Н, 3,37%; N,7,59%; вычислено: С, 37,75%; Н, 3,54%; N,7,77%.N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3[N"-[(3-метилсульфинил)пропил]аминосульфонил]фенил]мочевина. В соответствии с процедурой окисления,описанной в примере 51, N-(2-бромфенил)-N'[4-хлор-2-гидрокси-3-[N"-(3-метилсульфонил)] фенил]мочевину (50 мг, 0,10 ммоль) и периодат натрия (25 мг, 0,12 ммоль) подвергают реакции с получением нужного продукта (8 мг, 16%). ЖХ-МС (m/z) 526,0 (M+). Примеры 47, 58, 48 и 59. Получение N-(2 бромэтил)-N'-[4-хлор-3-[N",N"-ди-(2-метоксиэтил)]аминосульфонил]мочевины, N-(2-бромэтил)-N'-[4-хлор-3-[N",N"-ди-(2-гидроксиэтил) аминосульфонил]-2-гидроксифенил]мочевины,N-[4-хлор-3-[N",N"-ди-(2-метоксиэтил)аминосульфонил]-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевины и N-[4-хлор-3-[N",N"-ди-(2 гидроксиэтил)аминосульфонил]-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевины.N,N-Ди-(3-метоксиэтил)-2,6-дихлор-3 нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(830 мг, 6,26 ммоль) и триэтиламин (1,7 мл,12,52 ммоль) подвергают реакции с получением нужного продукта (2,16 мг, 89%). ЖХ-МС (m/z) 387,2 (М+).N,N-Ди-(2-метоксиэтил)-3-амино-6-хлор-2 гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N,N-ди-(3-ме 43 токсиэтил)-6-дихлор-2-гидрокси-3-нитробензолсульфонамид (100 мг, 0,27 ммоль) восстанавливают водородом в присутствии Pd/C (50 мг) с получением нужного продукта (80 мг, 87%). 1HЯМР (МеОD-d4) : 6,85 (м, 2 Н), 3,58 (т, 4 Н), 3,47N-(2-Бромфенил)-N'-[4-хлор-3-[N",N"-ди(3-метоксиэтил)аминосульфонил]-2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N,Nди-(3-метоксиэтил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (40 мг, 0,12 ммоль) и 2 бромфенилизоцианат (23 мкл, 0,12 ммоль) подвергают реакции сочетания с получением нужной мочевины (39 мг, 61 %). ЭИ-МС (m/z) 534,6,536,6 (М)-.N-(2-бромфенил)-N'-[4-хлор-3[N",N"-ди-(2-гидроксиэтил)аминосульфонил]-2 гидроксифенил]мочевины (9,9 мг, 0,018 ммоль) и бромида алюминия (4,2 мг, 0,018 ммоль) в 2 мл этантио перемешивают в течение 16 ч при комнатной температуре. Смесь разбавляют этилацетатом, затем промывают 1 н вод. НCl,органический слой сушат над MgSO4 и концентрируют. После перекристаллизации из ацетона и метанола получают нужный продукт (4 мг,44%). 1H-ЯМР (MeOD-d4) : 8,30 (д, 1 Н), 7,92 (д,1 Н), 7,59 (д, 1 Н), 7,33 (т, 1 Н), 7,07 (д, 1 Н), 7,01N-[4-Хлор-3-[N",N"-ди-(2-метоксиэтил) аминосульфонил]-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N,Nди-(2-метоксиэтил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (40 мг, 0,12 ммоль) и 2,3 дихлорфенилизоцианат (22 мкл, 0,12 ммоль) подвергают реакции сочетания с получением нужной мочевины (55 мг, 87 %). 1H-ЯМРN-[4-Хлор-3-[N",N"-ди-(2-гидроксиэтил) аминосульфонил]-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевина. В соответствии с процедурой снятия защитной группы, описанной в примере 58, N-[4 хлор-3-[N",N"-ди-(2-метоксиэтил)аминосульфонил]-2-гидроксифенил]-N'-(2,3-дихлорфенил) мочевину (15 мг, 0,028 ммоль) и бромид аммония (18,7 мг, 0,07 ммоль) подвергают реакции с получением нужного продукта (2 мг, 14%). ЖХМС (m/z) 500,0 (М+). Примеры 49 и 50. Получение N-(2-бромфенил)-[4-хлор-3-[N"-[2-(диметиламино)этил]аминосульфонил]-2-гидроксифенил]мочевины гидрохлорида и N-[4-хлор-3-[N"-[2-(диметиламино)N-[2-(Диметиламино)этил]-2,6-дихлор-3 нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(121 мг, 1,38 ммоль) и триэтиламин (0,39 мл,2,76 ммоль) подвергают реакции с получением неочищенного продукта (480 мг), который затем подвергают гидролизу без очистки. ЖХ-МСN-[2-(Диметиламино)этил]-6-хлор-2-гидрокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-[2-(диметиламино)этил]-2,6-дихлор-1-(3-нитробензолсульфонамид) (480 мг), 60% NaH (168 мг, 4,2 ммоль) и воду (25 мкл, 1,4 ммоль) подвергают реакции. Неочищенный продукт (80 мг) используют в следующей стадии без очистки. ЭИ-МС (m/z) 321,98, 323,96 (М+).N-[2-(диметиламино)этил]-6-хлор-2-гидрокси-3 нитробензолсульфонамид (80 мг) восстанавливают водородом в присутствии 10% Pd/C (40 мг) с получением неочищенного продукта (70 мг),который без очистки используют для получения мочевины.N-(2-Бромфенил)-N'-[4-хлор-3-[N"-[2(диметиламино)этил]аминосульфонил]-2 гидроксифенил]мочевины гидрохлорид. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[2(диметиламино)этил]-3-амино-6-хлор-2-гидроксибензолсульфонамид (35 мг) и 2-бромфенилизоцианат (28 мкл, 0,14 ммоль) подвергают реакции сочетания с получением нужной мочевины (12 мг, 20 % для 4 стадий). ЭИ-МС (m/z) 490,7, 492,7, 494,7 (М)-.N-[4-Хлор-3-[N"-[2-(диметиламино)этил] аминосульфонил]-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевины гидрохлорид. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[2(диметиламино)этил]-3-амино-6-хлор-2-гидроксибензолсульфонамид (35 мг) и 2,3-дихлорфенилизоцианат (26 мкл, 0,14 ммоль) подвергают реакции сочетания с получением нужной мочевины (5,8 мг, 10 %, для четырех стадий). ЭИ-МС (m/z) 428,80, 484,78 (М+). Примеры 53, 54 и 55. Получение N-[4 хлор-2-гидрокси-3-[N"-[2-(морфолинил)этил] аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевины гидрохлорида, N-[4-хлор-2-гидрокси 3-[N"-[2-(морфолинил)этил]аминосульфонил] фенил]-N'-(2-хлорфенил)мочевины гидрохлорида и N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3 45N-[2-(морфолинил)этил]-2,6-дихлор-3 нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(269 мг, 2,07 ммоль) и триэтиламин (0,58 мл,4,13 ммоль) подвергают реакции с получением неочищенного продукта (593 мг, 75%). ЖХ-МСN-[2-(морфолинил)этил]-6-хлор-2-гидрокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-[2-(морфолинил)этил]-2,6-дихлор-1-(-3-нитробензолсульфонамид) (400 мг, 1,04 ммоль), 60% NaH (125 мг, 3,12 ммоль) и воду (23 мкл, 1,25 ммоль) подвергают реакции с получением неочищенного продукта (600 мг), который используют в стадии гидрирования без очистки. ЭИ-МС (m/z) 363,95, 365,94 (M-).N-[2-(морфолинил)этил]-6-хлор-2-гидрокси-3 нитробензолсульфонамид (300 мг) восстанавливают водородом в присутствии 10% Pd/C (80 мг) с получением неочищенного продукта (300 мг),который без очистки используют для получения мочевины. ЭИ-МС (m/z) 338,93, 340,98 (M+).N-[4-Хлор-2-гидрокси-3-[N"-[2-(морфолинил)этил]аминосульфонил]фенил]-N'-(2,3-дихлорфенил)мочевины гидрохлорид. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенный N-[2-(морфолинил)этил]-3-амино-6 хлор-2-гидроксибензолсульфонамид (150 мг) и 2,3-дихлорфенилизоцианат (49 мкл, 0,26 ммоль) подвергают реакции сочетания с получением нужной мочевины (23 мг, 15 %, для 3 стадий). ЭИ-МС (m/z) 522,72, 524,65, 526,70 (М+).N-[4-хлор-2-гидрокси-3-[N"-[2-(морфолинил)этил]аминосульфонил]-2-гидроксифенил]N'-(2-хлорфенил)мочевины гидрохлорид. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенный N-[2-(морфолинил)этил]-3-амино-6 хлор-2-гидроксибензолсульфонамид (183 мг) и 2-хлорфенилизоцианат (40 мг, 0,26 ммоль) подвергают реакции сочетания с получением нужной мочевины (50 мг, 39 %, для 3 стадий). ЖХМС (m/z) 489,2 (M+).N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3N"-[2-[4-(морфолинил)этил]аминосульфонил] фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[2(морфолинил)этил]-3-амино-6-хлор-2-гидроксибензолсульфонамид (150 мг) и 2-бромфенил 005210 46 изоцианат (51 мг, 0,26 ммоль) подвергают реакции сочетания с получением нужной мочевины(10 мг, 7 %, для 3 стадий). ЭИ-МС (m/z) 535,64,537,56, 539,61 (М+). Примеры 56 и 57. Получение N-[4-хлор-2 гидрокси-3-(4-тиоморфолинилсульфонил)фенил]-N'-(2,3-дихлорфенил)мочевины и N-(2 бромфенил)-N'-[4-хлор-2-гидрокси-3-(4-тиоморфолинилсульфонил)фенил]мочевины. 2,6-Дихлор-3-нитро-1-(4-тиоморфолинилсульфонил)бензол. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (2,0 г, 6,88 ммоль), тиоморфолин (710 мг, 6,88 ммоль) и триэтиламин (1,92 мл, 13,76 ммоль) подвергают реакции с получением нужного продукта (2,30 мг, 94%). 1H-ЯМР (MeOD-d4) : 7,95 (д,1 Н), 7,85 (д,1 Н), 3,68 (т,4 Н), 2,69 (т,4 Н). 6-Хлор-2-гидрокси-3-нитро-1-(4-тиоморфолинилсульфонил)бензол. В соответствии с общим методом гидролиза, описанным в примере 15, 2,6-дихлор-3 нитро-1-(4-тиоморфолинилсульфонил)бензол(330 мг, 33%). ЭИ-МС (m/z) 336,89, 338,93 (М-). 4-Хлор-2-гидрокси-3-(4-тиоморфолинилсульфонил)анилин. В соответствии с общим методом гидрирования, описанным в примере 15, 6-хлор-2 гидрокси-3-нитро-1-(4-тиоморфолинилсульфонил)-бензол (330 мг, 0,97 ммоль) восстанавливают водородом и 10% Pd/C (1500 мг) с получением неочищенного продукта (240 мг, 80%). 1HЯМР (MeOD-d4) : 7,08 (д, 1 Н), 6,98 (д, 1 Н), 3,59N-[4-Хлор-2-гидрокси-3-(4-тиоморфолинилсульфонил)-N-(2,3-дихлорфенил)]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(4-тиоморфолинилсульфонил) анилин (120 мг, 0,36 ммоль) и 2,3-дихлорфенилизоцианат (68 мкл, 0,36 ммоль) подвергают реакции сочетания с получением нужной мочевины (50 мг, 28 %). 1H-ЯМР (MeOD-d4) : 8,31 (м,1 Н), 8,05 (м, 1 Н), 7,26 (м, 2 Н), 7,08 (м, 1 Н), 3,61N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3(4-тиоморфолинилсульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(4-тиоморфолинилсульфонил) анилин (120 мг, 0,26 ммоль) и 2-бромфенилизоцианат (72 мг, 0,36 ммоль) подвергают реакции сочетания с получением нужной мочевины (110 мг, 60 %). 1H-ЯМР (ДМСО-d6) : 9,25N-[(1-трет-бутоксикарбонилпиперидин-4 ил)метил]-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,2 г, 4,13 ммоль), N-(трет-бутоксикарбонил)-4 аминометилпиперидин (0,88 г, 4,13 ммоль) и триэтиламин (0,86 мл, 6,20 ммоль) подвергают реакции с получением нужного продукта (1,52 г,79%). ЖХ-МС (m/z) 468,2 (M+).(41 мкл, 2,27 ммоль) подвергают реакции с получением нужного продукта (495 мг, 58%). ЭИМС (m/z) 447,92, 449,84 (М+). 48 мг) используют в следующей стадии без очистки. 1H-ЯMP (MeOD-d4) : 6,86 (м, 2 Н), 4,00 (д,2 Н), 2,83 (м, 3H), 2,78 (м, 2 Н), 1,60 (м, 3H), 1,44N-(2-Бромфенил)-N'-[3-[N"-[(1-трет-бутоксикарбонилпиперидин-4-ил)метил]аминосульфонил]-4-хлор-2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенный N-[(1-трет-бутоксикарбонилпиперидин-4-ил)метил]-3-амино-6-хлор-2-гидроксибензолсульфонамид (230 мг) и 2-бромфенилизоцианат (129 мг, 0,65 ммоль) подвергают реакции сочетания с получением нужной мочевины (110 мг, 30 % для двух стадий). ЖХ-МС (m/z) 619,0N-(2-бромфенил)-N'[3-[N"-[(1 трет-бутоксикарбонилпиперидин-4-ил)метил] аминосульфонил]-4-хлор-2 гидроксифенил]мочевины (27 мг, 0,044 ммоль) в 1,0 мл 4,0 н НСl в 1,4-диоксане перемешивают в течение 10 мин при комнатной температуре. Смесь концентрируют. После перекристаллизации из ацетона и гексана получают нужный продукт (16 мг, 65%). ЖХ-МС (m/z) 519,2 (М+).N-[3-[N"-[(1-трет-бутоксикарбонилпиперидин-4-ил)метил]аминосульфонил]-4-хлор-2 гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенный N-[(1-трет-бутоксикарбонил-пиперидин-4-ил)метил]-3-амино-6-хлор-2-гидроксибензолсульфонамид (230 мг) и 2,3-дихлорфенилизоцианат (122 мкл, 0,65 ммоль) подвергают реакции сочетания с получением нужной мочевины (100 мг, 29 % для двух стадий). 1H-ЯMPN-[4-Хлор-2-гидрокси-3-[N"-[(пиперидин 4-ил)метил]аминосульфонил]фенил]-N'-(2,3 дихлорфенил)мочевины трифторацетат. В соответствии с общей методикой снятия защитной группы Воc, описанной в примере 36,N-[3-[N"-N-[(1-трет-бутоксикарбонилпиперидин-4-ил)метил]аминосульфонил]-4-хлор-2 гидроксифенил]-N'-(2,3-дихлорфенил)мочевину(20 мг, 0,033 ммоль) перемешивают в трифторуксусной кислоте с получением нужного продукта (9 мг, 44%). ЖХ-МС (m/z) 509,0 (М+). Примеры 64, 140, 65 и 141. Получение N[4-хлор-2-гидрокси-3-(1-оксидотиоморфолиносульфонил)фенил]-N'-(2,3-дихлорфенил)мочевины, N-[4-хлор-2-гидрокси-3-(1-оксидотиоморфолиносульфонил)фенил]-N'-(2,3-дихлорфенил) мочевины натриевой соли, N-(2-бромфенил)-[4 хлор-2-гидрокси-3-(1-оксидотиоморфолиносульфонил)фенил]мочевины и N-[4-хлор-2-гид 49 рокси-3-(1-оксидотиоморфолиносульфонил) фенил]-N'-(2-хлорфенил)мочевины. 6-Хлор-2-гидрокси-3-нитро-1-(1-оксидотиоморфолиносульфонил)бензол. Раствор 6-хлор-2-гидрокси-3-нитро-1-(4 тиоморфолиносульфонилбензола) (100 мг, 0,30 ммоль) и периодата натрия (95 мг, 0,44 ммоль) в ацетонитриле (10 мл) и воде (2 мл) перемешивают в течение 3 дней при комнатной температуре. Смесь разбавляют этилацетатом и промывают водой, сушат над MgSO4 и концентрируют с получением нужного продукта (106,4 мг,100%). ЭИ-МС (m/z) 352,89, 354,87 (М-). 4-Хлор-2-гидрокси-3-(1-оксидотиоморфолиносульфонил)анилин. В соответствии с общим методом гидрирования, описанным в примере 15, 6-хлор-2-гидрокси-3-нитро-1-(1-оксидотиоморфолиносульфонил) бензол (103 мг, 0,29 ммоль) восстанавливают водородом и 10% Pd/C (59 мг) с получением нужного продукта (89 мг, 95%). ЖХ-МСN-[4-Хлор-2-гидрокси-3-(1-оксидотиоморфолиносульфонил)фенил]-N'-(2,3-дихлорфенил) мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(1-оксидотиоморфолиносульфонил)анилин (117 мг, 0,35 ммоль) и 2,3-дихлорфенилизоцианат (72 мг, 0,38 ммоль) подвергают реакции сочетания с получением нужной мочевины (79 мг, 44 %). 1H-ЯМР (ДМСО-d6) : 9,34N-[4-Хлор-2-гидрокси-3-(1-оксидотиоморфолиносульфонил)фенил]-N'-(2,3-дихлорфенил) мочевины натриевая соль. В соответствии с общим методом получения соли, описанным в примере 15, N-[4-хлор-2 гидрокси-3-(1-оксидотиоморфолиносульфонил) фенил]-N'-(2,3-дихлорфенил)мочевину (275 мг,0,53 ммоль) и 0,50 н вод. NaOH (1,06 мг, 0,53 ммоль) подвергают реакции с получением нужной натриевой соли (250 мг, 87 %). 1H-ЯМРN-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3(1-оксидотиоморфолиносульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(1-оксидотиоморфолиносульфонил)анилин (88 мг, 0,27 ммоль) и 2-бромфенилизоцианат (65 мг, 0,33 ммоль) подвергают реакции сочетания с получением нужной мочевины (65 мг, 46 %). ЖХ-МС (m/z) 524,2 (М+). 50 В соответствии с общим методом получения мочевины, описанным в примере 15, 4-хлор 2-гидрокси-3-(1-оксидотиоморфолиносульфонил)анилин (117 мг, 0,35 ммоль) и 2-хлорфенилизоцианат (58 мг, 0,28 ммоль) подвергают реакции сочетания с получением нужной мочевины (58 мг, 35 %). ЖХ-МС (m/z) 478,0 (М+). Примеры 68, 69 и 70. Получение N-[3-(1 азетидинилсульфонил)-4-хлор-2-гидроксифенил]-N'-(2-бромфенил)мочевины, N-[3-(1-азетидинилсульфонил)-4-хлор-2-гидроксифенил]-N'(2-хлорфенил)мочевины и N-[3-(1-азетидинилсульфонил)-4-хлор-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевины. 1-(Азетидин-1-ил)сульфонил-2,6-дихлор-3 нитробензол. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,0 г, 3,44 ммоль), гидрохлорид азетидина (320 мг,3,44 ммоль) и триэтиламин (1,44 мл, 10,32 ммоль) подвергают реакции с получением нужного продукта (510 мг, 48%). 1H-ЯМР (MeODd4) : 7,94 (д, 1 Н), 7,79 (д, 1 Н), 4,16 (т, 4 Н), 2,29(510 мг, 1,64 ммоль), 60% NaH (197 мг, 4,92 ммоль) и воду (35 мкл, 1,97 ммоль) подвергают реакции с получением нужного продукта (240 мг, 50%). 1(240 мг, 0,82 ммоль) восстанавливают водородом и Pd/C (100 мг) с получением нужного продукта (210 мг, 100%). 1H-ЯМР (MeOD-d4) : 6,91N-[3-1-(Азетидинсульфонил)-4-хлор-2 гидроксифенил]-N'-(2-бромфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3(азетидин-1-ил)сульфонил-4-хлор-2-гидроксианилин (215 мг, 0,82 ммоль) и 2-бромфенилизоцианат (195 мкл, 0,98 ммоль) подвергают реакции сочетания с получением нужной мочевины (69 мг, 18 %). ЖХ-МС (m/z) 462,0 (М+).N-[3-1-(Азетидинсульфонил)-4-хлор-2 гидроксифенил]-N'-(2-хлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3(азетидин-1-ил)сульфонил-4-хлор-2-гидроксианилин (215 мг, 0,82 ммоль) и 2-хлорфенилизоцианат (134 мг, 0,9 ммоль) подвергают 51 реакции сочетания с получением нужной мочевины (200 мг, 54 %). ЖХ-МС (m/z) 416,0 (М+).N-[3-1-(азетидинсульфонил)-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3(азетидин-1-ил)сульфонил-4-хлор-2-гидроксианилин (235 мг, 0,9 ммоль) и 2,3-дихлорфенилизоцианат (169 мкл, 0,9 ммоль) подвергают реакции сочетания с получением нужной мочевины (160 мг, 40 %). ЖХ-МС (m/z) 450,0 (М+). Пример 71. N-(2-Бромфенил)-N'-[4-хлор-3(N",N"-диметиламино-сульфонил)-2-гидроксифенил]мочевины калиевая соль. В соответствии с общей методикой, описанной в примере 15, получают N-(2-бромфенил)-N'-[4-хлор-3-(N",N"-диметиламиносульфонил)-2-гидроксифенил]мочевины калиевую соль; 1H-ЯМР (ДМСО-d6) : 9,20 (с, 1 Н), 8,99 (с,1 Н), 7,82 (д, 1 Н), 7,66 (д, 1 Н), 7,57 (д, 1 Н), 7,29N-Циклопропил-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(1,39 г, 4,78 ммоль), циклопропиламин (273 мг,4,78 ммоль) и триэтиламин (1,0 мл, 7,17 ммоль) подвергают реакции с получением нужного продукта (1,15 г, 77%).1H-ЯMP (MeOD-d4) : 7,72 (м, 2 Н), 7,65 (д, 1 Н), 2,34 (м, 1 Н), 0,75 (м,4 Н).N-Циклопропил-6-хлор-2-гидрокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-циклопропил 2,6-дихлор-3-нитробензолсульфонамид (1,15 г,3,70 ммоль), 60% NaH (444 мг, 11,1 ммоль) и воду (67 мкл, 3,70 ммоль) подвергают реакции с получением нужного продукта (740 мг, 68%).N-Циклопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-циклопропил-6-хлор-2-гидрокси-3-нитробензолсульфонамид (740 мг, 2,53 ммоль) восстанавливают водородом и 10% Pd/C (80 мг) с получением нужного продукта (660 мг, 99%). 1H-ЯMPN-(2-Бромфенил)-N'-[4-хлор-3-(N"-циклопропиламиносульфонил)-2-гидроксифенилмочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-циклопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (220 мг, 0,84 ммоль) и 2-бромфенилизоцианат (199 мг, 1,01 ммоль) подвергают реакции сочетания с получением нужной мочевины (135 мг, 35 %). ЖХ-МС (m/z) 462,0N-[4-Хлор-3-(N"-циклопропиламиносульфонил)-2-гидроксифенил]-N'-(2-хлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-циклопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (220 мг, 0,84 ммоль) и 2-хлорфенилизоцианат (155 мг, 1,01 ммоль) подвергают реакции сочетания с получением нужной мочевины (150 мг, 43 %). ЖХ-МС (m/z) 416,2 (М+).N-[4-Хлор-3-(N"-циклопропиламиносульфонил)-2-гидроксифенил]-N'-(2,3-дихлорфенил) мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-циклопропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (220 мг, 0,84 ммоль) и 2,3-бромфенилизоцианат (190 мг, 1,01 ммоль) подвергают реакции сочетания с получением нужной мочевины (176 мг, 46%). ЖХ-МС (m/z) 452,0N-Пропил-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,3 г, 4,48 ммоль), пропиламин (264 мг, 4,48 ммоль) и триэтиламин (0,94 мл, 6,72 ммоль) подвергают реакции с получением нужного продукта (1,0 г,71%).1H-ЯMP (МеОD-d4) : 7,92 (д, 1 Н), 7,78 (д,1 Н), 3,00 (т, 2 Н), 1,50 (м, 2 Н), 0,88 (т, 3H).(58 мкл, 3,19 ммоль) подвергают реакции с получением нужного продукта (650 мг, 69%). ЖХМС (m/z) 295,0 (М+).(650 мг, 2,2 ммоль) восстанавливают водородом и 10% Pd/C (320 мг) с получением нужного продукта (560 мг, 96%). 1H-ЯMP (MeOD-d4) : 6,83N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3(N"-пропиламиносульфонил)фенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nпропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (186 мг, 0,71 ммоль) и 2-бромфенилизоцианат (140 мг, 0,71 ммоль) подвергают реакции сочетания с получением нужной мочевины (149 мг, 46 %). ЖХ-МС (m/z) 464,0 (М+).N-[4-Хлор-2-гидрокси-3-(N"-пропиламиносульфонил)фенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nпропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (186 мг, 0,71 ммоль) и 2,3-дихлорфенилизоцианат (133 мг, 0,71 ммоль) подвергают реакции сочетания с получением нужной мочевины (259 мг, 81 %). ЖХ-МС (m/z) 452,0 (М+).N-[4-Хлор-2-гидрокси-3-(N"-пропиламиносульфонил)фенил]-N'-(2-хлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-пропил-3-амино-6-хлор-2-гидроксибензолсульфонамид (180 мг, 0,71 ммоль) и 2-хлорфенилизоцианат (108 мг, 0,71 ммоль) подвергают реакции сочетания с получением нужной мочевины (148 мг, 50%). ЖХ-МС (m/z) 418,2 (M+). Примеры 79, 80 и 81. Получение N-(2 бромфенил)-N'-[4-хлор-3-(N"-этиламиносульфонил)-2-гидроксифенил]мочевины, N-[4-хлор-3(N"-этиламиносульфонил)-2-гидроксифенил]N'-(2-хлорфенил)мочевины и N-[4-хлор-3-(N"этиламиносульфонил)-2-гидроксифенил]-N'(2,3-дихлорфенил)мочевины.N-Этил-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлоридN-Этил-6-хлор-2-гидрокси-3-нитробензолсульфонамид. В соответствии с общим методом гидролиза, описанным в примере 15, N-этил-2,6-дихлор 3-нитробензолсульфонамид (1,16 г, 3,88 ммоль),60% NaH (466 мг, 11,64 ммоль) и воду (70 мкл,3,88 ммоль) подвергают реакции. Неочищенный продукт (1,34 г) используют в следующей стадии без очистки. 1H-ЯМР (MeOD-d4) : 8,07 (д,1 Н), 7,25 (д, 1 Н), 3,05 (кв., 2 Н), 1,12 (т, 3H).N-Этил-3-амино-6-хлор-2-гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-этил-6-хлор 2-гидрокси-3-нитробензолсульфонамид (1,34 г) восстанавливают водородом и 10% Pd/C (400 мг) с получением нужного продукта (800 мг,82%, для двух стадий). 1H-ЯМР (MeOD-d4) : 6,85 (д, 1 Н), 6,78 (д, 1 Н), 2,85 (кв., 2 Н), 0,95 (т,3H).N-(2-Бромфенил)-N'-[4-хлор-3-(N"-этиламиносульфонил)-2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nэтил-3-амино-6-хлор-2-гидроксибензолсульфонамид (266 мг, 1,06 ммоль) и 2-бромфенилизоцианат (211 мг, 1,06 ммоль) подвергают реакции сочетания с получением нужной мочевины (211 мг, 44 %). ЖХ-МС (m/z) 450,0 (М+).N-[4-Хлор-3-(N"-этиламиносульфонил)-2 гидроксифенил]-N'-(2-хлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nэтил-3-амино-6-хлор-2-гидроксибензолсульфонамид (266 мг, 1,06 ммоль) и 2-хлорфенилизоцианат (163 мг, 1,06 ммоль) подвергают реакции сочетания с получением нужной мочевины (142 мг, 33 %). ЖХ-МС (m/z) 4,0 (M+).N-[4-Хлор-3-(N"-этиламиносульфонил)-2 гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, Nэтил-3-амино-6-хлор-2-гидроксибензолсульфонамид (266 мг, 1,06 ммоль) и 2,3-дихлорфенилизоцианат (200 мг, 1,06 ммоль) подвергают реакции сочетания с получением нужной мочевины (193 мг, 41%). ЖХ-МС (m/z) 440,0 (М+). Примеры 82 и 136. Получение N-(2-бромфенил)-N'-[3-[N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4-хлор 2-гидроксифенил]мочевины и N-[3-[N"-(2-амино-5-карбоксипентил)аминосульфонил]-4-хлор 2-гидроксифенил]-N'-(2-бромфенил)мочевины трифторацетата. 55 В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (2,0 г, 6,88 ммоль), Boc-Lys-OMe-ацетат (2,206 г,6,88 ммоль) и триэтиламин (2,4 мкл, 17,2 ммоль) подвергают реакции с получением нужного продукта (1,25 г, 35%). 1H-ЯMP (МеOD-d4) : 7,93 (д, 1 Н), 7,78 (д, 1 Н), 4,02 (м, 1 Н), 3,70 (с,3H), 3,04 (т, 2 Н), 1,69 (м, 2 Н), 1,50 (м, 4 Н), 1,43(1,2 г, 2,33 ммоль), 60% NaH (379 мг, 9,32 ммоль) и воду (84 мкл, 4,66 ммоль) подвергают реакции с получением нужного продукта (850 мг, 76%). 1H-ЯМР (MeOD-d4) : 8,05 (д, 1 Н),7,22 (д, 1 Н), 4,00 (м, 1 Н), 3,01 (т, 2 Н), 1,72 (м,2 Н), 1,50-165 (м, 4 Н), 1,44 (с, 9 Н).(204 мг, 0,42 ммоль) восстанавливают водородом и 10% Pd/C (100 мг) с получением нужного продукта (189 мг, 100%). 1H-ЯМР (MeOD-d4) : 6,84 (м, 1 Н), 4,08 (м, 1 Н), 2,92 (т, 2 Н), 1,75 (м,2 Н), 1,55 (м, 4 Н), 1,44 (с, 9 Н).N-(2-бромфенил)-N'-[3-[N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4-хлор-2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[5(трет-бутоксикарбониламино)-5-карбоксипентил]-3-амино-6-хлор-3-гидроксибензолсульфонамид (189 мг, 0,42 ммоль) и 2-бромфенилизоцианат (84 мг, 0,42 ммоль) подвергают реакции сочетания с получением нужной мочевиныN-[3-[N"-(2-Амино-5-карбоксипентил) аминосульфонил]-4-хлор-2-гидроксифенил]-N'(2-бромфенил)мочевины трифторацетат. В соответствии с общей процедурой удаления защитной группы Вос, описанной в примере 36, N-(2-бромфенил)-N'-[3-[N"-[5-(третбутоксикарбониламино)-5-карбоксипентил] аминосульфонил]-4-хлор-2-гидроксифенил]мочевину (108 мг, 0,17 ммоль) перемешивают в 1 мл трифторуксусной кислоты и получают нужный продукт (75 мг, 66 %). ЖХ-МС (m/z) 551,2N-[3-[N"-[5-(трет-Бутоксикарбониламино)5-карбоксипентил]аминосульфонил]-4-хлор-2 гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-[5(трет-бутоксикарбониламино)-5-карбоксипентил]-3-амино-6-хлор-2-гидроксибензолсульфонамид (233 мг, 0,518 ммоль) и 2,3-дихлорфенилизоцианат (98 мг, 0,518 ммоль) подвергают реакции сочетания с получением нужной мочевины (100 мг, 30 %). ЖХ-МС (m/z) 641,2 (М)+.N-[3-[N"-(5-Амино-5-карбоксипентил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3 дихлорфенил)мочевины трифторацетат. В соответствии с общей процедурой удаления защитной группы Воc, описанной в примере 36, N-[3-[N"-[5-(трет-бутоксикарбониламино)-5-карбоксипентил]аминосульфонил]-4 хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил) мочевину (108 мг, 0,17 ммоль) перемешивают в 1 мл трифторуксусной кислоты и получают нужный продукт (78 мг, 74 %). ЖХ-МС (m/z) 541,0 (М+). Примеры 84 и 85. Получение N-(2-бромфенил)-N'-[4-хлор-2-гидрокси-3-[N"-(2-гидроксиэтил)]аминосульфонил]мочевины и N-(2 бромфенил)-N'-[3-[N"-(2-(бромфениламино) карбокси]этил]аминосульфонил]-4-хлор-2-гидроксифенил]мочевины. 2-Бензилоксиэтиламин. К раствору этаноламина (5 г, 81,8 ммоль) в 100 мл сухого ТГФ добавляют 60% NaH (3,27 г,81,8 ммоль) при комнатной температуре. Смесь кипятят с обратным холодильником в течение 30 мин, а затем добавляют бензилхлорид (9,32 г,75,6 ммоль). Полученную смесь кипятят с обратным холодильником в течение 3 ч. Смесь концентрируют, а остаток разбавляют 1 н вод. НСl и экстрагируют дихлорметаном. Водный слой доводят до рН 14 добавлением 10% вод.NaOH, а затем экстрагируют дихлорметаном. Органический экстракт сушат над MgSO4 и концентрируют с получением нужного продуктаN-(2-Бензилоксиэтил)-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (2,0 г, 6,88 ммоль), 2-бензилоксиэтиламин (1,04 г,6,88 ммоль) и триэтиламин (1,92 мкл, 13,76 ммоль) подвергают реакции с получением нужного продукта (2,31 г, 83%). 1H-ЯМР (MeOD-d4)(2,31 г, 5,71 ммоль), 60% NaH (683 мг, 17,1 ммоль) и воду (103 мкл, 5,72 ммоль) подвергают реакции с получением нужного продукта (1,70 г,77%). ЖХ-МС (m/z) 387,5 (М+).N-(2-Бензилоксиэтил)-3-амино-6-хлор-2 гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, N-(2-бензилоксиэтил)-6-хлор-2-гидрокси-3-нитробензолсульфонамид (366 мг, 0,95 ммоль) восстанавливают водородом и Pd/C (170 мг). Неочищенный продукт (265 мг) используют в следующей стадии без очистки.N-(2-Бромфенил)-N'-[4-хлор-2-гидрокси-3[N"-(2-гидроксиэтил)]аминосульфонил]мочевина и N-(2-бромфенил)-N'-[3-[N"-(2-бромфениламино)карбокси]этил]аминосульфонил]-4-хлор 2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, неочищенныйN-(2-гидроксиэтил)-3-амино-6 хлор-3-гидроксибензолсульфонамид (265 мг) и 2-бромфенилизоцианат (187 мг, 0,95 ммоль) подвергают реакции сочетания с получением нужной мочевины 84 (54 мг, 12 % для двух стадий). ЖХ-МС (m/z) 466,0 (М)+; и мочевины 85N-(2-Бензилоксиэтил)-3-амино-6-хлор-2 гидроксибензолсульфонамид. Смесь N-(2-бензилоксиэтил)-6-хлор-2-гидрокси-3-нитробензолсульфонамида (157 мг, 0,41 ммоль) в ТГФ (15 мл) и 5% вод. NaHCO3 (10 мл) перемешивают при комнатной температуре и 0,2 г порциями добавляют дитионит натрия (1,5 г). Смесь подкисляют 1 н вод. НСl и экстрагируют этилацетатом. Органический слой сушат над MgSO4 и концентрируют с получением нужного продукта (120 мг, 82%). ЖХ-МС (m/z) 357,0 (М+).N-[3-[N"-(2-Бензилоксиэтил)аминосульфонил]-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, N-(2 бензилоксиэтил)-3-амино-6-хлор-3-гидроксибензолсульфонамид (119 мг, 0,33 ммоль) и 2,3 дихлорфенилизоцианат (44 мг, 0,23 ммоль) подвергают реакции сочетания с получением нуж 005210N-[3-(N"-(2-Гидроксиэтил)аминосульфонил)-4-хлор-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. К раствору N-[3-(N"-(2-бензилоксиэтил) аминосульфонил)-4-хлор-2-гидроксифенил]-N'(2,3-дихлорфенил)мочевины (46 мг, 0,08 ммоль) в 3 мл дихлорметана добавляют иодтриметилсилан (38 мг, 0,19 ммоль). Смесь перемешивают в течение 16 ч при комнатной температуре. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетат/ гексан (60/40, об/об) получают нужный продуктN-Циклопропилметил-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,5 г, 5,2 ммоль), гидрохлорид аминометилциклопропана (0,56 мл, 5,2 ммоль) и триэтиламин (1,8 мл, 12,9 ммоль) подвергают реакции с получением нужного продукта (1,28 мг, 84%). ЖХ-МС(0,85 г, 2,6 ммоль), 80% NaH (0,23 г, 9,8 ммоль) и воду (56 мкл, 3,1 ммоль) подвергают реакции с получением нужного продукта (0,58 г, 72%). ЖХ-МС (m/z) 307 (М+). 3-Амино-6-хлор-N-циклопропилметил-2 гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, 6-хлор-Nциклопропилметил-2-гидрокси-3-нитробензолсульфонамид (0,1 г, 3,2 ммоль) восстанавливают водородом и 10% Pd/C (0,1 г) с получением нужного продукта (0,08 г, 89%). ЖХ-МС (m/z) 277 (М+).N-(2-Бромфенил)-N'-[4-хлор-3-(N"-циклопропилметиламиносульфонил)-2-гидроксифенил]мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3-амино-6-хлор-N-циклопропилметил-2-гидроксибензолсульфонамид (0,23 г, 0,77 ммоль) и 2-бромфенилизоцианат (100 мкл, 0,81 ммоль) подвергают реакции сочетания с получением нужной мочевины (0,19 г, 52 %). ЖХ-МС (m/z) 474 (М+).N-[4-хлор-3-(N"-циклопропилметиламиносульфонил)-2-гидроксифенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3 амино-6-хлор-N-циклопропилметил-2-гидроксибензолсульфонамид (0,23 г, 0,77 ммоль) и 2,3 дихлорфенилизоцианат (100 мкл, 0,76 ммоль) подвергают реакции сочетания с получением нужной мочевины (0,19 г, 53 %). ЖХ-МС (m/z) 464 (М+).N-[4-Хлор-3-(N"-циклопропилметиламиносульфонил)-2-гидроксифенил]-N'-(2,3-хлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, 3 амино-6-хлор-N-циклопропилметил-2-гидроксибензолсульфонамид (0,23 г, 0,77 ммоль) и 2 хлорфенилизоцианат (95 мкл, 0,79 ммоль) подвергают реакции сочетания с получением нужной мочевины (0,07 г, 21%). ЖХ-МС (m/z) 430(N-Метокси-N-метил)-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид (1,5 г, 5,2 ммоль), гидрохлорид N,O-диметилгидроксиламина (0,52 мл, 5,3 ммоль) и триэтиламин (2,0 мл, 14,3 ммоль) подвергают реакции с получением нужного продукта (1,04 г, 63%). ЖХ-МС (m/z) 315 (М+).(1,0 г, 3,2 ммоль), 80% NaH (0,30 г, 9,6 ммоль) и воду (58 мкл, 3,2 ммоль) подвергают реакции с получением нужного продукта (0,66 г, 69%). ЖХ-МС (m/z) 297 (М+).(N-Метокси-N-метил)-3-амино-6-хлор-2 гидроксибензолсульфонамид. В соответствии с общим методом гидрирования, описанным в примере 15, (N"-метоксиN-метил)-6-хлор-2-гидрокси-3-нитробензолсульфонамид (0,66 г, 2,2 ммоль) восстанавливают водородом и 10% Pd/C (0,66 г) с получением нужного продукта (0,50 г, 85%). ЖХ-МС (m/z) 266,8 (М+). 60 В соответствии с общим методом получения мочевины, описанным в примере 15, (N"метокси-N"-метил)-3-амино-6-хлор-N-2-гидроксибензолсульфонамид (0,15 г, 0,56 ммоль) и 2 бромфенилизоцианат (69 мкл, 0,56 ммоль) подвергают реакции сочетания с получением нужной мочевины (0,12 г, 45 %). ЖХ-МС (m/z) 464N-[4-Хлор-2-гидрокси-3-(N"-метокси-N"метиламиносульфонил)фенил]-N'-(2,3-дихлорфенил)мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, (N"метокси-N"-метил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (0,15 г, 0,56 ммоль) и 2,3 дихлорфенилизоцианат (74 мкл, 0,56 ммоль) подвергают реакции сочетания с получением нужной мочевины (0,086 г, 34 %). ЖХ-МС (m/z) 454 (М+).N-(2-Хлорфенил)-N'-[4-хлор-2-гидрокси-3(N"-метокси-N"-метиламиносульфонил)фенил] мочевина. В соответствии с общим методом получения мочевины, описанным в примере 15, (N"метокси-N"-метил)-3-амино-6-хлор-2-гидроксибензолсульфонамид (0,15 г, 0,56 ммоль) и 2 хлорфенилизоцианат (68 мкл, 0,56 ммоль) подвергают реакции сочетания с получением нужной мочевины (0,077 г, 33%). ЖХ-МС (m/z) 420(N-Пирролидинил)-2,6-дихлор-3-нитробензолсульфонамид. В соответствии с общей методикой получения сульфонамида, описанной в примере 15,2,6-дихлор-3-нитробензолсульфонилхлорид(1,51 г, 5,2 ммоль), пирролидин (435 мкл, 5,2 ммоль) и триэтиламин (1,1 мл, 7,8 ммоль) подвергают реакции с получением нужного продукта (1,16 г, 68%). ЖХ-МС (m/z) 325 (М+).(74 мкл, 4,1 ммоль) подвергают реакции с получением нужного продукта (0,94 г, 69%). ЖХ-МС
МПК / Метки
МПК: C07D 207/10, C07C 273/00, A61K 31/17
Метки: антагонистов, рецептора, ил-8, качестве, сульфонамиды, гидроксидифенилмочевины
Код ссылки
<a href="https://eas.patents.su/30-5210-sulfonamidy-gidroksidifenilmocheviny-v-kachestve-antagonistov-receptora-il-8.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонамиды гидроксидифенилмочевины в качестве антагонистов рецептора ил-8</a>
Предыдущий патент: Гликозидирование индолкарбазола с применением межфазного катализа
Следующий патент: Полициклоалкилпурины в качестве антагонистов аденозиновых рецепторов
Случайный патент: Устройство для доставки жидкости и способ работы впрыскивающего устройства


































