Трициклические соединения
Номер патента: 2322
Опубликовано: 25.04.2002
Авторы: Сузуки Коджи, Ёшида Макото, Сейши Такаши, Такаи Харуки, Ямагата Тсуёши, Кумазава Тошиаки, Атсуки Каору, Карасава Акира, Аоно Шигеру
Формула / Реферат
1. Трициклическое соединение общей формулы (I)
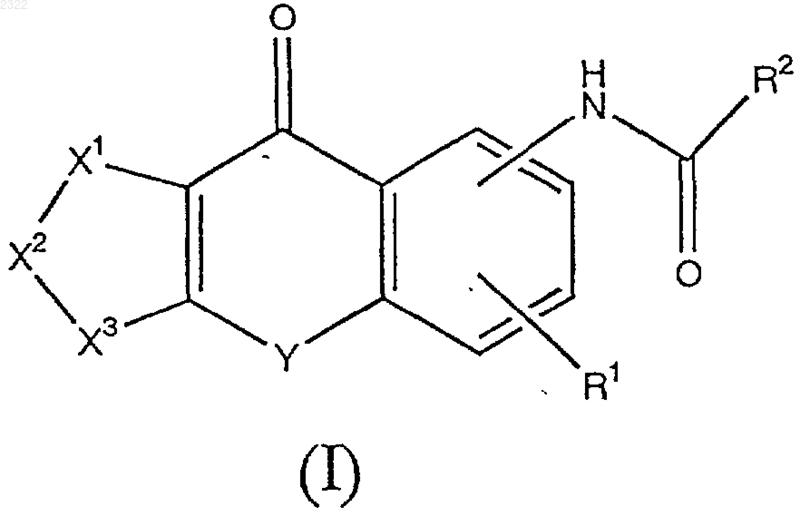
в которой
R1 означает водород, замещенный или незамещенный (С1-С6)алкил, замещенный или незамещенный (С1-С6)алкокси или галоген,
Х1-Х2-Х3 означает CR5=CR6-CR7=CR8 (где R5, R6, R7 и R8, которые могут быть одинаковыми или различными, каждый означает водород, замещенный или незамещенный (С1-С6)алкил, гидрокси, замещенный или незамещенный (С1-С6)алкокси, нитро, амино, моно(С1-С6) алкиламино, ди(С1-С6)алкиламино, замещенный или незамещенный (С1-С6)алканоиламино или галоген), N(O)m=CR5-CR6=CR7 (где R5, R6 и R7 имеют значения, указанные выше, a m означает 0 или 1), CR5=CR6-N(O)m=CR7 (где R5, R6, R7 и m имеют значения, указанные выше), CR5=CR6-CR7=N(O)m (где R5, R6, R7 и m имеют значения, указанные выше), CR5=CR6-O (где R5 и R6 имеют значения, указанные выше), CR5=CR6-S (где R5 и R6 имеют значения, указанные выше), O-CR7=CR8 (где R7 и R8 имеют значения, указанные выше), S-CR7=CR8 (где R7 и R8 имеют значения, указанные выше) или O-CR7=N (где R7 имеет значения, указанные выше);
R2 означает водород, замещенный или незамещенный (С1-С6)алкил, замещенный или незамещенный (С2-С6)алкенил, трифторметил, замещенный или незамещенный (С1-С6)алкокси, амино, замещенный или незамещенный моно(С1-С6)алкиламино, замещенный или незамещенный ди(С1-С6)алкиламино, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный аралкиламино, замещенный или незамещенный ариламино, замещенную или незамещенную алициклическую гетероциклическую группу, замещенную или незамещенную азотсодержащую гетероциклическую группу или
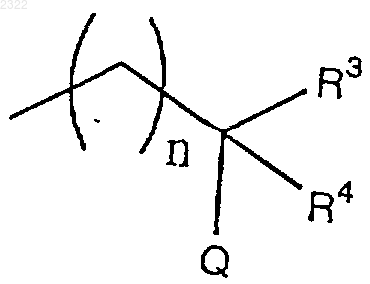
(где n означает 0 или 1, R3 и R4, которые могут быть одинаковыми или различными, каждый означает водород, замещенный или незамещенный (С1-С6)алкил, замещенный или незамещенный циклический алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил или трифторметил или R3 и R4 вместе образуют циклический алкил и Q означает гидрокси, замещенный или незамещенный (С1-С6)алкокси, амино или галоген), и
Y означает -CH2SO2-, -SCH2-, -SOCH2- или -SO2CH2-;
и когда R2 не означает замещенный или незамещенный (С1-С6)алкил, то
Y может означать -ОСН2,
и их фармацевтически приемлемые соли.
2. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где R1 означает водород, замещенный или незамещенный (С1-С6)алкокси или галоген.
3. Трициклическое соединение или его фармацевтически приемлемая соль по п.2, где R1 означает водород.
4. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где Y означает -CH2SO2-, -SO2CH2- или -ОСH2-.
5. Трициклическое соединение или его фармацевтически приемлемая соль по п.4, где Y означает -CH2SO2- или -SO2CH2-.
6. Трициклическое соединение или его фармацевтически приемлемая соль по п.5, где Y означает -CH2SO2-.
7. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где X1-X2-XЗ означает S-CR7=CR8 (где R7 и R8 имеют значения, указанные выше).
8. Трициклическое соединение или его фармацевтически приемлемая соль по п.7, где R1 означает водород, а Y означает -CH2SO2-.
9. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где Х1-Х2-X3 означает CR5=CR6-CR7=CR8 (где R5, R6, R7 и R8 имеют значения, указанные выше).
10. Трициклическое соединение или его фармацевтически приемлемая соль по п.9, где R1 означает водород, а Y означает -CH2SO2-.
11. Трициклическое соединение или его фармацевтически приемлемая соль по любому из пп.1-10, где R2 означает
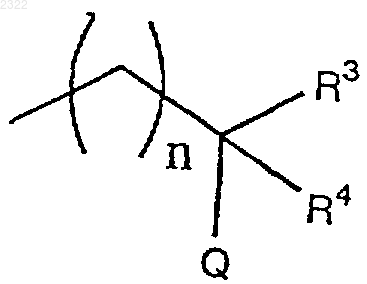
(где n, R3, R4 и Q имеют значения, указанные выше).
12. Трициклическое соединение или его фармацевтически приемлемая соль по п.11, гдеn означает 0.
13. Трициклическое соединение или его фармацевтически приемлемая соль по п.12, где R3 означает метил, R4 означает трифторметил, а Q означает гидрокси.
14. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где R1 означает водород, Y означает -CH2SO2-, X1-X2-X3 означает S-CR7=CR8 (где R7 и R8 имеют значения, указанные выше), R3 означает метил, R4 означает трифторметил, a Q означает гидрокси.
15. Фармацевтическая композиция, представляющая собой трициклическое соединение или его фармацевтически приемлемую соль по п.1.
Текст
1 Область техники Настоящее изобретение относится к трициклическим соединениям, обладающим свойством продлевать промежутки между мочеиспусканиями, вызванными наполнением мочевого пузыря, и к фармацевтически приемлемым солям этих соединений. Эти соединения применяются для лечения или облегчения поллакиурии, недержания мочи, неотложного мочеиспускания и ощущения остаточной мочи, вызванныx рядом заболеваний или состояний, такими как нейрогенный мочевой пузырь и неустойчивый мочевой пузырь. Уровень техники В опубликованной японской заявке 286915/93 (ЕР 524781) описаны производные Nзамещенного пропанамида, которые применяются для лечения недержания мочи. Описание изобретения В основу настоящего изобретения была положена задача по поиску новых трициклических соединений для применения в качестве терапевтических агентов при поллакиурии и недержании мочи. В соответствии с этим настоящее изобретение относится к трициклическим соединениям общей формулы (I)R1 означает водород, замещенный или незамещенный (низш.) алкил, замещенный или незамещенный (низш.) алкокси или галоген,Х 1-Х 2-Х 3 означает CR5=CR6-CR7=CR8 (где 5R , R6, R7 и R8 могут быть одинаковыми или различными и каждый означает водород, замещенный или незамещенный (низш.) алкил, гидрокси, замещенный или незамещенный (низш.) алкокси, нитро, амино, моно (низш.) алкиламино, ди(низш.) алкиламино, замещенный или незамещенный (низш.) алканоиламино или галоген), N(O)m=CR5-CR6=CR7 (где R5, R6 и R7 имеют значения, указанные выше, a m означает 0 или 1), CR5=CR6-N(O)m=CR7 (где R5, R6, R7 и m имеют значения, указанные выше), CR5=CR6CR7=N(O)m (где R5, R6, R7 и m имеют значения,указанные выше), CR5=CR6-O (где R5 и R6 имеют значения, указанные выше), CR5=CR6-S (гдеR2 означает водород, замещенный или незамещенный (низш.) алкил, замещенный или незамещенный (низш.) алкенил, трифторметил,замещенный или незамещенный (низш.) алкокси, амино, замещенный или незамещенный моно(низш.) алкиламино, замещенный или неза 002322 2 мещенный ди(низш.) алкиламино, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный аралкиламино, замещенный или незамещенный ариламино, замещенную или незамещенную алициклическую гетероциклическую группу, замещенную или незамещенную азотсодержащую гетероциклическую группу или(где n означает 0 или 1, R3 и R4 могут быть одинаковыми или различными и каждый означает водород, замещенный или незамещенный(низш.) алкил, замещенный или незамещенный циклический алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил или трифторметил или R3 и R4 вместе образуют циклический алкил и Q означает гидрокси,замещенный или незамещенныйR2 означает водород, замещенный или незамещенный (низш.) алкенил, трифторметил,замещенный или незамещенный (низш.) алкокси, амино, замещенный или незамещенный моно(низш.) алкиламино, замещенный или незамещенный ди(низш.) алкиламино, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный аралкиламино, замещенный или незамещенный ариламино, замещенную или незамещенную алициклическую гетероциклическую группу, замещенную или незамещенную азотсодержащую гетероциклическую группу или(где n, R3, R4 и Q имеют значения, указанные выше), то Y означает -ОСН 2-,и к фармацевтически приемлемым солям указанных соединений. Ниже соединения общей формулы (I) обозначаются как соединения (I), и то же самое относится к соединениям с другими номерами формул. При наименовании каждой из групп в общей формуле (I) (низш.) алкил означает линейные или разветвленные алкильные группы, содержащие от 1 до 6 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил,1,2,2-триметилпропил и т.п. Галоген означает фтор, хлор, бром или иод. Алкильный остаток в(низш.) алкокси-, моно(низш.) алкиламино- и ди(низш.) алкиламиногруппах имеет те же значения, что и вышеуказанный (низш.) алкил. 3 от 1 до 6 атомов углерода, такие как формил,ацетил, пропаноил, бутаноил, пентаноил, 2,2 диметилпропаноил и т.п. (Низш.) алкенил означает линейные или разветвленные алкенилгруппы, содержащие от 1 до 6 атомов углерода, такие как винил, аллил, 1-пропенил, метакрил, 1 бутенил, кротил, пентенил, гексенил и т.п. Арил означает фенил, нафтил и т.п., а гетероарил означает пиридил, фурил, тиенил, хинолил, имидазолил, бензимидазолил, тиазолил и т.п. Аралкил означает аралкильные группы, содержащие от 7 до 12 атомов углерода, такие как бензил,фенэтил, нафтилметил и т.п. Алициклическая гетероциклическая группа означает тетрагидрофурил, тетрагидротиенил, хроманил и т.п. Азотсодержащая гетероциклическая группа означает гетероциклическое кольцо с 1-2 атомами азота,которое может включать другие гетероатомы,такие как О и S, причем упомянутый атом азота связан с соседней карбонильной группой. Азотсодержащая гетероциклическая группа включает, например, пирролидинил, пиперазинил, пиперидино, морфолино, тиоморфолино и оксазолил. Циклический алкил означает циклические алкильные группы, содержащие от 3 до 8 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил,циклооктил и т.п. Замещенный (низш.) алкил, замещенный(низш.) алкокси, замещенный моно(низш.) алкиламино, замещенный ди(низш.) алкиламино,замещенный (низш.) алканоиламино, замещенный (низш.) алкенил и замещенный циклический алкил каждый имеет от 1 до 3 одинаковых или различных заместителя. Примерами заместителей являются гидрокси, галоген, нитро,амино, моно(низш.) алкиламино, ди(низш.) алкиламино и (низш.) алкокси. Галоген имеет значения, указанные выше. Алкильная группа в моно(низш.) алкиламино, ди(низш.) алкиламино и (низш.) алкокси имеет значения, указанные выше для (низш.) алкила. Замещенный арил, замещенный гетероарил, замещенный аралкил, замещенный аралкиламино и замещенный ариламино каждый имеет от 1 до 3 одинаковых или различных заместителя. Примерами заместителей являются (низш.) алкил, гидрокси, амино и галоген. (Низш.) алкил и галоген имеют значения, указанные выше для(низш.) алкила и галогена соответственно. Замещенная алициклическая гетероциклическая группа и замещенная азотсодержащая гетероциклическая группа каждая имеет от 1 до 3 одинаковых или различных заместителя. Примерами заместителей являются (низш.) алкил,гидрокси и галоген. (Низш.) алкил и галоген имеют значения, указанные выше для (низш.) алкила и галогена соответственно. Для R1 предпочтительны водород, замещенный или незамещенный (низш.) алкокси и галоген. Более предпочтителен водород.-CH2SO2-,-SO2CH2- и -ОСН 2-. Более предпочтительна группа -CH2SO2-. Для Х 1-Х 2-X3 предпочтительны S-CR7=CR8CR5=CR6-CR7=CR8 (где R5, R6, R7 и R8 имеют значения, указанные выше). Более предпочтительна группа S-CR7=CR8 (где R7 и R8 имеют значения, указанные выше). Для R2 предпочтительна группа Фармацевтически приемлемые соли соединений (I) включают фармацевтически приемлемые кислотно-аддитивные соли. Примерами фармацевтически приемлемых кислотноаддитивных солей являются аддитивные соли неорганических кислот, такие как гидрохлорид,гидробромид, гидроиодид, нитрат, сульфат,фосфат и т.п., аддитивные соли органических кислот, такие как формиат, ацетат, бензоат, малеат, фумарат, сукцинат, тартрат, цитрат, оксалат, глиоксилат, аспартат, метансульфонат,этансульфонат, бензолсульфонат и т.п. Ниже описаны способы получения соединений (I). Способ 1. Соединение (Iа), т.е. соединение (I), в котором Y означает -ОСН 2-, и соединение (Ib), т.е. соединение (I), в котором Y означает -SCH2-,могут быть получены по следующей последовательности реакций.(В формулах Z означает О или S, a R1, R2 и Х 1 Х 2-Х 3 имеют значения, указанные выше.) Соединение (Iа) и соединение (Ib) могут быть получены обработкой соединения (II) эквивалентным количеством галогенирующего агента, такого как тионилхлорид или оксалилхлорид в инертном растворителе, таком как дихлорметан, дихлорэтан, тетрахлорэтан или диметилацетамид, при температуре от -20 С до 0 С в течение промежутка времени от 5 мин до 12 ч и последующим взаимодействием полученного вещества с соединением (III) при температуре от 0 С до температуры кипения растворителя в течение промежутка времени от 5 мин до 24 ч или взаимодействием коммерчески доступного ангидрида или хлорангидрида, соответст 5 вующего соединению (II), с соединением (III) в указанных выше условиях. Соединение (Iв), т.е. соединение (I), в котором Y означает -SOCH2-, может быть также получено обработкой соединения (Ib), т.е. соединения (I), в котором Y означает -SCH2-, эквивалентным количеством окисляющего агента,такого как 3-хлорпербензойная кислота, в растворителе, таком как дихлорметан или хлороформ, при температуре от 0 С до температуры кипения используемого растворителя в течение 1-24 ч по известному методу. В качестве исходного соединения (II) можно использовать коммерчески доступный реагент или получать его по методике, описанной в J. Chem. Soc., 2329 (1951). Исходное соединение (III) можно получить по методике,описанной в способе 2. Способ 2. Соединение (III) может быть получено по следующей последовательности реакций.(В формулах R1 Х 1-Х 2-Х 3 и Z имеют значения,указанные выше.) Соединение (V) может быть получено восстановлением нитрогруппы в соединении (IV) восстанавливающим агентом, таким как восстановленное железо, в смешанном растворителе,представляющим собой смесь воды с растворителем, таким как метанол или этанол, при температуре от комнатной до температуры кипения растворителя в течение 1-24 ч и последующим взаимодействием полученного амина с ацетилирующим агентом, таким как уксусный ангидрид или ацетилхлорид в инертном растворителе,таком как тетрагидрофуран, диоксан, диметилформамид, диметилацетамид или дихлорметан,в присутствии основания, такого как пиридин,триэтиламин или диизопропилэтиламин, при температуре от 0 С до температуры кипения растворителя в течение 1-24 ч. В качестве исходного соединения (IV) можно использовать коммерчески доступный реагент или получать 6 его по методике, описанной в J. Org. Chem., т. 52, 129 (1987); Syn. Commun., т. 24, 1789 (1994) и др. Соединение (VII) может быть получено нагреванием соединения (V) и натриевой соли,полученной из соединения (VI), в отсутствии растворителя или взаимодействием соединения(V) с вышеупомянутой натриевой солью в инертном растворителе, таком как тетрагидрофуран, диметилформамид, диметилацетамид,диметилсульфоксид, толуол или ксилол, при температуре от 0 С до температуры кипения растворителя в течение 1-24 ч. Соединение (Iаа), т.е. соединение (I), в котором Y означает -ОСН 2-, a R2 означает метил, и соединение (Iba), т.е. соединение (I), в которомY означает -SCH2-, a R2 означает метил, может быть получено обработкой соединения (VII) ангидридом трифторуксусной кислоты в инертном растворителе, таком как дихлорметан, 1,2 дихлорэтан, тетрахлорэтан, нитробензол, сероуглерод или орто-дихлорбензол, при температуре от -15 С до комнатной температуры по методу, описанному в опубликованной японской заявке 91040/90 (ЕР 345747) и др., с образованием ангидрида соответствующей кислоты и последующей циклизацией полученного ангидрида без выделения из растворителя в присутствии 0,1 эквивалента кислоты Льюиса, такой как диэтилэфират трифторида бора, хлорид алюминия или тетрахлорид титана, или протонной кислоты, такой как серная кислота, трифторуксусная кислота, метансульфокислота или трифторметансульфокислота, при температуре от 0 С до температуры кипения используемого растворителя. Соединение (III) может быть получено кипячением с обратным холодильником соединения (Iаа) или соединения (Iba) в присутствии концентрированной хлористо-водoродной кислоты в смешанном растворителе, представляющим собой смесь воды с растворителем,таким как метанол или этанол, или без растворителя. Соединение (III) можно также синтезировать, проводя вышеуказанные реакции в различной последовательности. Иными словами,соединение (VIII) можно синтезировать взаимодействием соединения (IV) с натриевой солью,приготовленной из соединения (VI) по методу получения соединения (VII) из соединения (V). Соединение (IX) можно получить реакцией циклизации соединения (VIII) по методу получения соединения (Iаа) и соединения (Iba) из соединения (VII). Соединение (III) можно получить восстановлением нитрогруппы соединения(IX) по методу восстановления нитрогруппы в соединении (IV). Способ 3. Соединение (VII) может быть также получено по следующей последовательности реакций. 8 натрия или гидроксид калия, при температуре от комнатной температуры до температуры кипения используемого растворителя в течение промежутка времени от 5 мин до 24 ч. Соединение (XIV) может быть получено обработкой соединения (XII) по способу получения соединения (VII) из соединения (XIII). Способ 4. Соединение (Id), т.е. соединение (I), в котором Y означает -CH2SO2-, и соединение (Iе),т.е. соединение (I), в котором Y означает-SOCH2-, могут быть получены по следующей последовательности реакций.(В формулах R1, Х 1-X2-Х 3 и Z имеют значения,указанные выше.) Соединение (XI) может быть получено кипячением с обратным холодильником соответствующего исходного соединения (X) в виде коммерчески доступного реагента, такого как этиловый эфир 2-нитро-6-метилбензойной кислоты, в растворителе, таком как четыреххлористый углерод или 1,2-дихлорэтан, в присутствии инициатора свободных радикалов, такого как азобисизобутиронитрил (АИБН), и бромирующего агента, такого как N-бромсукцинимид(НБС), в течение 1-24 ч по известному методу. Соединение (XII) может быть получено взаимодействием соединения (XI) с соединением (VI) в инертном растворителе, таком как дихлорметан, тетрагидрофуран, диметилформамид, диметилацетамид или диметилсульфоксид,в присутствии основания, такого как триэтиламин, метоксид натрия или карбонат калия, при температуре от -20 С до температуры кипения используемого растворителя в течение 1-24 ч. Соединение (XIII) может быть получено восстановлением нитрогруппы соединения (XII) восстанавливающим агентом, таким как восстановленное железо в смешанном растворителе,представляющим собой смесь воды с растворителем, таким как метанол или этанол, при температуре от комнатной до температуры кипения растворителя в течение 1-24 ч и последующим взаимодействием полученного амина с ацетилирующим агентом, таким как уксусный ангидрид или ацетилхлорид в инертном растворителе,таком как тетрагидрофуран, диоксан, диметилформамид, диметилацетамид или дихлорметан,в присутствии основания, такого как пиридин,триэтиламин или диизопропиламин, при температуре от 0 С до температуры кипения используемого растворителя в течение 1-24 ч. Соединение (VII) может быть получено гидролизом соединения (XIII) в смешанном растворителе, представляющим собой смесь воды с растворителем, таким как метанол, этанол, диоксан или тетрагидрофуран, в присутствии основания, такого как гидроксид лития, гидроксид(В формулах R1, R2 и Х 1-X2-X3 имеют значения,указанные выше.) Соединение (Id) и соединение (Iе) можно получить обработкой соединения (XV) или соединения (Ib) двумя или более эквивалентами окисляющего агента, такого как 3-хлорпербензойная кислота или гексагидрат монопероксифталата магния, в инертном растворителе, таком как дихлорметан, хлороформ, 1,2-дихлорэтан или 1,1,2,2-тетрахлорэтан, при температуре от 0 С до температуры кипения растворителя в течение 1-24 ч. Если Х 1-Х 2-X3 в соединении (XV) или в соединении (Ib) означает N=CR5-CR6=CR7 (гдеR5, R6 и R7 имеют значения, указанные выше),то соединение (Id) или соединение (Iе), где атом азота в цикле находится в окисленной форме,т.е. Х 1-Х 2-Х 3 означает NO=CR5-CR6=CR7 (где(где R5, R6 и R7 имеют значения, указанные выше), можно синтезировать за счет изменения условий реакции, включая количество окисляющего агента и температуру реакции. Способ 5. Соединение (XV) может быть получено по следующей последовательности реакций.(В формулах R1, R2 и Х 1-X2-X3 имеют значения,указанные выше.) Соединение (XVI) может быть получено кипячением с обратным холодильником соответствующего исходного соединения, такого как метиловый эфир 2-метилбензойной кислоты,метиловый эфир 2-метилникотиновой кислоты или метиловый эфир 3-метилтиофен-2 карбоновой кислоты, в растворителе, таком как четыреххлористый углерод или 1,2-дихлорэтан,в присутствии инициатора свободных радикалов, такого как азобисизобутиронитрил (АИБН),и бромирующего агента, такого как Nбромсукцинимид (НБС), в течение 1-24 ч по известному методу. Соединение (XVIII) может быть получено взаимодействием коммерчески доступного реагента, представляющего собой производное аминотиофенола (XVII), такое как 3-аминотиофенол, с вышеупомянутым соединением (XVI) в инертном растворителе, таком как дихлорметан,тетрагидрофуран, диметилформамид, диметилацетамид или диметилсульфоксид, в присутствии основания, такого как триэтиламин, метоксид натрия или карбонат калия, при температуре от -20 С до температуры кипения используемого растворителя в течение 1-24 ч. Соединение (XIX) может быть получено взаимодействием соединения (XVIII) с ацетилирующим агентом, таким как уксусный ангидрид или ацетилхлорид, в инертном растворителе,таком как тетрагидрофуран, диоксан, диметилформамид, диметилацетамид, дихлорметан или диметилсульфоксид, в присутствии основания,такого как пиридин, триэтиламин или диизопропилэтиламин, при температуре от -20 С до температуры кипения используемого растворителя в течение 1-24 ч. Соединение (XX) может быть получено сначала гидролизом соединения (XIX) в смешанном растворителе, представляющим собой смесь воды с таким растворителем, как метанол,этанол, диоксан или тетрагидрофуран, в присутствии основания, такого как гидроксид лития,гидроксид натрия или гидроксид калия, при температуре от комнатной до температуры кипения используемого растворителя в течение промежутка времени от 5 мин до 24 ч с после 002322 10 дующей обработкой полученной карбоновой кислоты ангидридом трифторуксусной кислоты в инертном растворителе, таком как дихлорметан, 1,2-дихлорэтан, тетрахлорэтан, нитробензол, сероуглерод или орто-дихлорбензол, при температуре от -15 С до комнатной температуры по методу, описанному в опубликованной японской заявке 91040/90 (ЕР 345747) и др., с образованием ангидрида соответствующей кислоты, а затем циклизацией полученного ангидрида без выделения из растворителя в присутствии 0,1-1 эквивалента кислоты Льюиса, такой как диэтилэфират трехфтористого бора, хлорид алюминия или тетрахлорид титана, или протонной кислоты, такой как серная кислота, трифторуксусная кислота, метансульфокислота или трифторметансульфокислота, при температуре от 0 С до температуры кипения используемого растворителя. Соединение (XXI) может быть получено из соединения (XX) по методу получения соединения (III) из соединения (Iаа) (способ 2). Соединение (XV) может быть получено из соединения (XXI) по методу, описанному в способе 1. Если R2 означает амино, замещенный или незамещенный моно(низш.) алкиламино,замещенный или незамещенный ди(низш.) алкиламино, замещенный или незамещенный аралкиламино, замещенный или незамещенный ариламино либо замещенную или незамещенную азотсодержащую гетероциклическую группу, то целевое соединение может быть синтезировано сначала превращением соединения(XXI) в соответствующий карбамат в инертном растворителе, таком как тетрагидрофуран, при температуре от 0 до 25 С взаимодействием с фенилхлорформиатом или паранитрофенилхлорформиатом по методу, описанному в J.Med. Chem., т. 39, 304 (1996) и др., с последующим взаимодействием полученного карбамата с соответствующим амином при той же температуре. В каждом вышеописанном способе промежуточные и целевые соединения выделяют и очищают обычными методами очистки, используемыми в органическом синтезе, например,фильтрованием, экстракцией, промыванием,высушиванием, концентрированием, перекристаллизацией и различными видами хроматографии. Промежуточные соединения могут использоваться на последующих стадиях без очистки. Некоторые соединения (I) могут существовать в форме стереизомеров, таких как геометрические изомеры или оптические изомеры. Все возможные изомеры, включая вышеуказанные изомеры и их смеси, включены в объем настоящего изобретения. В тех случаях, когда необходимо получить соль соединения (I) и соединение образуется в форме такой соли, то эта соль может быть очищена как таковая. В случае если соединение (I) получено в свободной форме и необходимо получить его соль, соединение (I) растворяют или суспендируют в соответствующем растворителе и добавляют кислоту, получая таким путем соль, которую далее выделяют и очищают. Соединения (I) могут существовать в виде аддуктов с водой и различными растворителями, и такие аддукты также включены в объем настоящего изобретения. Примеры соединений (I) приведены в таблицах 1-3. 15 Предпочтительные варианты осуществления изобретения Свойства соединений (I) как лечебных средств в отношении поллакиурии и недержания мочи описаны ниже. В последующих примерах 1 и 2 тестирования величина IC50 означает концентрацию, при которой исследуемые соединения вызывают 50%-ную релаксацию максимальной ответной реакции (чувствительности) детрузора. Пример 1 тестирования. В качестве подопытных животных используют самцов морских свинок-альбиносов Хартли (весом 350-550 г). Каждое животное забивают путем обескровливания после анестезии пентобарбиталом натрия. Нижний отдел брюшной полости вскрывают и локализуют мочевой пузырь. Соединительную и жировую ткань вокруг мочевого пузыря удаляют, а пузырь промывают. Затем рассекают билатеральные тазовые нервы на поверхности абдоминальной части мочевого пузыря и пузырь извлекают на входе мочеточника. Мочевой пузырь промывают буферным раствором Кребса-Хенселяйта (состав(мМ): 118 NaCl, 4,7 KCl, 1,2 MgSO4, 1,2 КН 2 РO4,2,5 СаСl2, 25 NаНСО 3, 11,1 D-глюкоза), а затем на марлевой салфетке, пропитанной буферным раствором, помещают в чашку Петри. Свод и мочепузырный треугольник отрезают. Тыльную часть пузыря разрезают вертикально по центру ножницами и распластывают на марлевой салфетке. Слизистую оболочку удаляют. Тыльную часть пузыря разрезают вертикально на 6 полосок шириной примерно 2,0 мм и длиной примерно 10 мм. Каждую полоску закрепляют одним концом на пластиковом стержне и помещают в баню (для органов) объемом 20 мл, содержащую раствор Кребса-Хенселяйта, который поддерживают при 37 С и интенсивно продувают газовой смесью, состоящей из 5% СО 2 и 95% О 2. Величину рН раствора поддерживают на уровне 7,4. Другой конец полоски привязывают шелковой нитью к датчику для измерения механического смещения (Nihon Koden TB611T). Датчик связан с полиграфом (Nihon Koden AP-621G), а изменение натяжения регистрируется самописцем (Yokogawa, тип 3066). Шкала полиграфа откалибрована (цена деления 0,5 г/см). После инкубации ткани в буферном растворе в течение 15 мин без предварительной нагрузки ее выдерживают в натянутом состоянии в течение 1 ч. Начальное натяжение составляет 1,5 г, а затем оно уменьшается до 1 г. Полоски уравновешивают до тех пор, пока сокращение не станет постоянным и натяжение не составит 1 г. После уравновешивания в баню добавляют КСl(до конечной концентрации 50 ммоль/л) и через 10 мин ткань промывают. Добавление КСl к ткани производят с интервалами 30 мин, а затем ткань промывают через 10 мин; КСl добавляют 16 до тех пор, пока натяжение, вызываемое КСl, не станет постоянным. Когда ткань будет подготовлена к сокращению на постоянную величину при добавлении КСl и расслаблению до равновесного состояния при промывании, в буферный раствор вновь добавляют КСl (50 ммоль/л). По достижении тканью равновесного состояния и после получения базовой линии вводят исследуемое соединение в интегральном режиме (с полулогарифмическим инкрементом). При каждой концентрации продолжительность контакта составляет 30 мин. Активность соединений выражают как максимальную степень релаксации(%) относительно натяжения, вызванного агонистом. Результаты приведены в таблице 4. В последующем примере испытания проводят при другой концентрации КСl. Пример 2 тестирования. Полоски ткани мочевого пузыря получают аналогично примеру 1 тестирования и измеряют натяжение препаратов. После того, как натяжение ткани достигнет равновесного состояния (1 г), добавляют КСl (до конечной концентрации 15 ммоль/л). После появления ритмичного сокращения в ответ на добавление КСl ткань промывают, а затем снова добавляют КСl (15 ммоль/л). По достижении постоянной величины ритмичного сокращения, вызванного добавлением КСl, добавляют исследуемое соединение также в интегральном режиме (с полулогарифмическим инкрементом). При каждой концентрации продолжительность контакта составляет 15-30 мин. Активность соединений выражают как максимальную степень релаксации (%) относительно натяжения, вызванного агонистом. Результаты приведены в таблице 4. Таблица 4 Соед. 17 Действие соединений по настоящему изобретению можно также проиллюстрировать нижеописанным методом, который используется для определения свойства соединений увеличивать интервалы между мочеиспусканием. Пример 3 тестирования. В качестве подопытных животных используют самцов крыс (весом 200-300 г) линии SD. Каждое животное анестезируют внутрибрюшинным введением нембутала (50 мг/кг). Волосяной покров на брюшной части, бедрах и затылочной части сбривают и открытые места дезинфецируют 70%-ным этанолом. Надрезая бедро, обнажают левую бедренную артерию,чтобы ввести в нее катетер. Катетер, заполненный физиологическим раствором, содержащим гепарин (1000 ед./мл), вводят в артерию на 2-3 см таким образом, чтобы его верхний конец находился в брюшной артерии. Противоположный конец катетера, выходящий в затылочной части,запаивают и плотно фиксируют на коже. В мочевой пузырь катетер имплантируют по методу(1986). Мочевой пузырь обнажают посредством среднего чревосечения (лапаротомии). С целью проделать небольшое отверстие делают небольшой надрез в своде мочевого пузыря. В мочевой пузырь вводят катетер с физиологическим раствором и закрепляют шелковой лигатурой. Другой конец катетера пропускают под кожей троакаром и выводят на затылочной части. Экспонированный конец катетера запаивают и плотно фиксируют на коже. На брюшные мышцы и кожу накладывают швы и подопытных животных выводят из состояния анестезии. Крыс взвешивают через 24-48 ч после операции. Каждую крысу помещают в клетку Боллмана (фирма Natsume seisakusho, Япония) и исследование проводят при частичном ограничении движения. Артериальный катетер связан с датчиком для измерения кровяного давления(Nihon Koden DX-300). Катетер в мочевом пузыре соединен полиэтиленовыми трубками(ПЭ 50) со шприцевым насосом для подачи физиологического раствора, датчиком для измерения давления и трехходовым краном. Испытание начинают с внутрипузырной инфузии физиологического раствора (0,05 мл/мин), которое продолжается в течение всего испытания. Изменение кровяного давления, частоты биения сердца и внутрипузырного давления регистрируют на многоканальном самописце (полиграфе) (фирма Nihon Koden, Япония). Подопытному животному дают возможность прийти в состояние равновесия (примерно 60-120 мин), пока режим мочеиспускания не станет постоянным. В этот момент замеряют базовое значение каждого контролируемого параметра и крысе принудительно пероральным путем вводят исследуемое соединение (носитель: 0,3%-ная карбоксиметилцеллюлоза в физиологическом растворе) в дозе 1 мг/кг массы тела. Влияние со 002322 18 единения на контролируемые параметры наблюдают в течение 5 ч после введения. В качестве контрольного соединения используют кромакалим. Интервал сокращения (сердечной мышцы), системное кровяное давление, частоту биения сердца измеряют в течение 5 ч после введения соединения с перерывами в 1 ч и выражают в относительных величинах по сравнению с теми значениями, которые наблюдают до введения и которые принимают за 100. Результаты приведены в таблицах 5 и 6. Таблица 5 Интервал сердечных сокращений (%) 1000 13815 16616 1706 18116 20321 1000 1168 1365 1499 1435 1396 1000 12315 13511 14410 16019 16016 1000 1169 13812 15617 15516 15517 1000 12923 12310 14312 13516 1305 1000 1149 1397 13611 145 6 16715 1000 14011 12117 16019 16925 16925 1000 1089 1409 14012 14813 16317 1000 1188 1377 1457 1528 1687 1000 12710 1397 1336 1403 1453 Таблица 6 Интервал Частота Кровяное сердечных Соед. Доза Время сердечных давление Соединение (I) можно получать в общепринятых фармацевтических формах, таких как таблетки, капсулы и сиропы, и вводить перорально или парентерально внутримышечной инъекцией, внутривенной инъекцией, капельным вливанием или ректально в форме суппозиториев. Для изготовления этих фармацевтических форм для перорального или парентерального введения используют общеизвестные методы. Например, препараты могут содержать различные эксципиенты, замасливатели, свя 20 зующие агенты, дезынтегрирующие агенты,изотонирующие агенты, эмульгаторы и т.п. Примерами используемых носителей является вода, дистиллированная вода для инъекций,физиологический раствор, глюкоза, фруктоза,сахароза, маннит, лактоза, крахмал, целлюлоза,метилцеллюлоза,сульфоксиметилцеллюлоза,гидроксипропилцеллюлоза, альгиновая кислота,тальк, цитрат натрия, карбонат кальция, гидрофосфат кальция, стеарат магния, мочевина, силиконовые смолы, сложные эфиры жирных кислот с сорбитаном, а также сложные эфиры жирных кислот с глицерином. Эффективная доза и график введения соединения (I) варьируют в зависимости от метода введения, возраста и веса тела пациента, типа или степени заболевания, подлежащего лечению, и т.д., но в основном при пероральном введении соединение (I) вводят взрослому пациенту в дозе от 0,01 мг до 1 г, предпочтительно от 0,05 мг до 50 мг, однократно или несколько раз в день. При парентеральном введении, таком как внутривенная инъекция, доза соединения (I) для взрослого человека составляет от 0,001 до 100 мг, предпочтительно от 0,01 до 10 мг, однократно или несколько раз в день. Однако следует отметить, что доза может изменяться в зависимости от различных условий, как указано выше. Некоторые варианты осуществления изобретения проиллюстрированы на приведенных ниже примерах получения исходных соединений (базовые примеры) и соединений по изобретению. В базовых примерах и примерах положение резонансных линий в протонном спектре ядерного магнитного резонанса (ЯМР) приводится в 1/1000000 ед. (ч./млн), соответствующих сдвигу линии в область поля с меньшей напряженностью относительно стандартного вещества (тетраметилсилана). Для характеристики формы линий используют следующие сокращения: s -синглет, d - дублет, t - триплет, q - квартет, m - мультиплет, ушир. - уширенный. Базовый пример 1. Метиловый эфир 3-(3 аминофенилтиометил)тиофен-2-карбоновой кислоты. К раствору 3-аминотиофенола (2,3 г, 18,7 ммоля) и триэтиламина (3,12 мл, 22,4 ммоля) в дихлорметане (30 мл) при охлаждении льдом медленно добавляют метиловый эфир 3 бромметилтиофен-2-карбоновой кислоты (6,24 г, 22,4 ммоля), а затем перемешивают в течение 30 мин. По завершении реакции к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, а затем сушат над безводным сульфатом магния. Затем осушитель отделяют фильтрованием и органический слой концентрируют при пониженном 21 давлении. Полученное маслоподобное вещество очищают хроматографией на колонке с силикагелем (гексан/этилацетат, 7/1), получая метиловый эфир 3-(3-аминофенилтиометил)тиофен-2 карбоновой кислоты в виде масла (4,82 г, 92%). 1(s, 1H), 6,71 (d, 1H, J=7,9 Гц), 7,02 (t, 1H, J=7,9 Гц), 7,05 (d, 1H, J=5,3 Гц), 7,37 (d, 1H, J=5,3 Гц). Базовый пример 2. Метиловый эфир 3-(3 ацетамидофенилтиометил)тиофен-2-карбоновой кислоты. Амин (4,81 г, 17,3 ммоля), полученный в примере 1, растворяют в дихлорметане (50 мл) и к полученному раствору при охлаждении льдом добавляют триэтиламин (2,87 мл, 20,7 ммолей) и уксусный ангидрид (1,78 мл, 19,0 ммолей), а затем перемешивают в течение 2 ч. По завершении реакции к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, а затем сушат над безводным сульфатом магния. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении, получая метиловый эфир 3-(3-ацетамидофенилтиометил) тиофен-2-карбоновой кислоты (5,25 г, 95%). 1(30 мл), к полученному раствору добавляют 2 М водный раствор гидроксида натрия (30 мл), а затем перемешивают при 60 С в течение 1 ч. Затем реакционную смесь концентрируют и добавляют 1 М водный раствор хлористоводородной кислоты до рН 3. Выпавшее в осадок белое твердое вещество отделяют фильтрованием, тщательно промывают водой и сушат,получая 3-(3-ацетамидофенилтиометил)тиофен 2-карбоновую кислоту (4,06 г, 77%). 1[3,2-с] [1] бензотиепин-10-он (соединение Б). Карбоновую кислоту (3,0 г, 9,9 ммоля), полученную в примере 3, суспендируют в дихлометане (30 мл), к полученному раствору при охлаждении льдом по каплям добавляют ангидрид трифторуксусной кислоты (2,24 мл, 15,9 22 ммоля) и перемешивают при комнатной температуре в течение 2 ч. Затем реакционную смесь вновь охлаждают льдом, добавляют диэтилэфират трифторида бора (0,5 эквивалента) и полученную смесь перемешивают при комнатной температуре в течение ночи. По завершении реакции дихлорметановый слой последовательно промывают водой, 5%-ным водным раствором бикарбоната натрия, насыщенным водным раствором хлорида натрия, а затем сушат над безводным сульфатом магния. Осушитель отделяют фильтрованием, органический слой концентрируют при пониженном давлении. Полученное маслоподобное вещество очищают хроматографией на колонке с силикагелем (хлороформ/метанол, 100/1), получая 9-ацетамидо 4,10-дигидротиено[3,2-с] [1] бензотиепин-10-онH-ЯМР (ДМСО-d6) : 2,09 (s, 3 Н), 4,17 (s,2H), 7,15 (d, 1H, J=5,3 Гц), 7,60 (d, 1H, J=8,9 Гц),7,91 (d, 1H, J=5,3 Гц), 7,95 (s, 1H), 7,97 (d, 1H,J=8,9 Гц), 10,34 (ушир., 1H). Базовый пример 5. 9-Амино-4,10-дигидротиено[3,2-с][1]бензотиепин-10-он. 9-ацетамидо-4,10-дигидротиено[3,2-с] [1] бензотиепин-10-он (0,74 г, 2,5 ммоля), полученный в примере 4, в смеси метанола (15 мл) с концентрированной хлористо-водородной кислотой (15 мл) кипятят с обратным холодильником в течение 1 ч. Затем реакционную смесь сливают в насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом (25 мл). Органический слой промывают насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. Осушитель отделяют фильтрованием и органический слой концентрируют при пониженном давлении, получая 9-амино-4,10-дигидротиено[3,2-с][1]бензотиепин-10-он в виде желтого твердого вещества (0,6 г, 99%). 1(ушир., 1H), 6,63 (d, 1H, J=8,2 Гц), 6,92 (d, 1H,J=5,0 Гц), 6,95 (d, 1H, J=8,2 Гц), 7,10 (t, 1H, J=8,2 Гц), 7,51 (d, 1H, J=5,0 Гц). Базовый пример 6. 7-Амино-4,10-дигидротиено[3,2-с][1]бензотиепин-10-он. Работая по существу аналогично базовому примеру 5, но заменяя 9-ацетамидо-4,10 дигидротиено[3,2-с][1]бензотиепин-10-он на 7 ацетамидо-4,10-дигидротиено[3,2-с] [1] бензотиепин-10-он, полученный в примере 4, получают 7-амино-4,10-дигидротиено[3,2-с][1]бен 23 зотиепин-10-он в виде белого твердого вещества(d, 1H, J=8,6 Гц). Базовый пример 7. 9-(3,3,3-Трифтор-2 гидрокси-2-метилпропаноиламино)-4,10-дигидротиено[3,2-с][1]бензотиепин-10-он. 3,3,3-трифтор-2-гидрокси-2-метилпропановую кислоту (0,79 г, 5,0 ммолей) растворяют в диметилацетамиде (10 мл), при -15 С добавляют тионилхлорид (0,36 мл, 5,0 ммоля) и перемешивают при температуре в интервале от -15 до-5 С в течение 1 ч. К полученной смеси добавляют 9-амино-4,10-дигидротиено[3,2-с][1] бензотиепин-10-он (0,62 г, 2,5 ммоля), полученный в примере 5, и перемешивают в течение ночи при комнатной температуре. Затем реакционную смесь концентрируют при пониженном давлении и полученный маслоподобный остаток растворяют в этилацетате (50 мл). Органический слой последовательно промывают 5%-ным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, а затем сушат над безводным сульфатом магния. Осушитель отделяют фильтрованием, органический слой концентрируют при пониженном давлении. Полученный маслоподобный остаток очищают хроматографией на колонке с силикагелем (гексан/этилацетат, 5/1) и после растирания с гексаном получают 9-(3,3,3-трифтор-2 гидрокси-2-метилпропаноиламино)-4,10 дигидротиено[3,2-с] [1] бензотиепин-10-он (0,60 г, 63%). 1(ушир., 1H). Базовый пример 8. 5-Ацетамидофталид. 5-Аминофталид (10 г, 67,05 ммоля) растворяют в тетрагидрофуране (100 мл) и к полученному раствору добавляют триэтиламин(18,64 г, 134 ммоля). К полученной смеси при охлаждении льдом по каплям добавляют уксусный ангидрид (12,61 мл, 134 ммоля), а затем перемешивают при комнатной температуре в течение 3 ч. После добавления 5%-ного водного раствора бикарбоната натрия выпавшее в осадок белое твердое вещество отделяют фильтрованием, несколько раз промывают водой и сушат,получая 5-ацетамидофталид (12,45 г, 97%). 1H-ЯМР (ДМСО-d6) : 2,09 (s, 3 Н), 5,33 (s,2H), 7,54 (d, 1H, J=8,2 Гц), 7,80 (d, 1H, J=8,2 Гц),8,20 (s, 1H), 10,25 (ушир., 1H). Базовый пример 9. 3-Ацетамидо-6-(4-метоксифеноксиметил)бензойная кислота. 4-метоксифенол (1,95 г, 15,7 ммоля) обрабатывают 28%-ным метоксидом натрия (15,7 ммоля) в метаноле (30 мл) при комнатной тем 002322 24 пературе в течение 30 мин. По завершении реакции растворитель выпаривают, получая феноксид натрия. Полученный феноксид натрия и 5-ацетамидофталид (3,0 г, 15,7 ммоля), полученный в примере 8, кипятят с обратным холодильником в ксилоле (30 мл) в течение 14 ч. Затем реакционную смесь выливают в воду и дважды промывают эфиром (30 мл). В водный слой добавляют 1 М хлористо-водородную кислоту до рН 3 и выпавший осадок отделяют фильтрованием, получая 3-ацетамидо-6-(4 метоксифеноксиметил) бензойную кислоту (2,49 г, 51%). 1(ушир., 1H). Базовый пример 10. 9-Ацетамидо-2 метокси-6,11-дигидродибенз[b,е]оксепин-11-он. Работая по существу аналогично базовому примеру 4, но заменяя 3-(3-ацетамидофенилтиометил)тиофен-2-карбоновую кислоту на 3 ацетамидо-6-(4-метоксифенилоксиметил) бензойную кислоту, полученную в примере 9, получают 9-ацетамидо-2-метокси-6,11-дигидродибенз[b,е]оксепин-11-он (выход 87%). 1H-ЯМР (СDСl3) : 2,20 (s, 3 Н), 3,85 (s,3 Н), 5,11 (s, 2H), 6,98 (d, 1H, J=8,9 Гц), 7,10 (d,1H, J=8,9 Гц), 7,32 (d, 1H, J=8,3 Гц), 7,61 (ушир.,1H), 7,66 (s, 1H), 8,09 (d, 1H, J=8,3 Гц). Базовый пример 11. 9-Амидо-2-метокси 6,11-дигидродибенз[b,e]оксепин-11-он. 9-Ацетамидо-2-метокси-6,11-дигидродибенз[b,е]оксепин-11-он (0,93 г, 3,1 ммоля), полученный в примере 10, в смеси концентрированной хлористо-водородной кислотой (15 мл) с метанолом (15 мл) кипятят с обратным холодильником в течение 1 ч. По завершении реакции по методике, в основном аналогичной базовому примеру 5, получают 9-амино-2-метокси 6,11-дигидробенз[b,е]оксепин-11-он(s, 1H), 6,98 (d, 1H, J=8,9 Гц), 7,10 (d, 1H, J=8,9 Гц), 7,32 (d, 1H, J=8,9 Гц), 7,66 (s, 1H). Базовый пример 12. (S)-3,3,3-Трифтор-2 гидрокси-2-метилпропионовая кислота. К раствору 3,3,3-трифтор-2-гидрокси-2 метилпропионовой кислоты (13,0 г, 82,3 ммоля) в этаноле (60 мл) добавляют по каплям (S)-(-)-1 фенетиламин (9,97 г, 82,3 ммоля) при 0 С и перемешивают при комнатной температуре в течение 1 ч. Затем полученную смесь концентрируют при пониженном давлении, получая при этом соль в виде белых кристаллов. Полученную соль шестикратно перекристаллизовывают из смеси бутанол/толуол (1/9) (60 мл), получая соль (S,S)-соль (S)-3,3,3-трифтор-2-гидрокси 2-метилпропионовой кислоты с фенеетилами 25 ном (3,85 г, 13,8 ммоля, 97% энантиомерной формы). Оптическую чистоту определяют методом 1H-ЯМР. Полученную соль (S,S) растворяют в 2 М соляной кислоте, добавляют диэтиловый эфир и перемешивают при комнатной температуре в течение 1 ч. Органический слой последовательно промывают водой, насыщенным водным раствором хлористого натрия и сушат над безводным сульфатом натрия. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении, получая (S)-3,3,3-трифтор-2-гидрокси-2 метилпропионовую кислоту в виде белых кристаллов (2,13 г, 13,5 ммоля, выход S-формы: 32%). 1H-ЯМР (СDСl3) : 1,65 (s, 3 Н). Базовый пример 13. (R)-3,3,3-Трифтор-2 гидрокси-2-метилпропионовая кислота. Работая по существу аналогично базовому примеру 12, но заменяя (S)-(-)-1-фенетиламин на (R)-(-)-1-фенэтиламин, получают (R)-3,3,3 трифтор-2-гидрокси-2-метилпропионовую кислоту. 1H-ЯМР (СDСl3) : 1,65 (s, 3 Н). Базовый пример 14. (S)-9-(3,3,3-Трифтор 2-гидрокси-2-метилпропаноиламино)-4,10 дигидротиено[3,2-с][1]бензотиепин-10-он. Работая по существу аналогично базовому примеру 7, из 9-амино-4,10-дигидротиено[3,2 с][1]бензотиепин-10-она (0,56 г, 2,26 ммоля),полученного в примере 5, и (S)-3,3,3-трифтор-2 гидрокси-2-метилпропионовой кислоты (0,72 г,4,52 ммоля), полученной в примере 12, получают (S)-9-(3,3,3-трифтор-2-гидрокси-2-метилпропаноиламино)-4,10-дигидротиено[3,2-с][1]бензотиепин-10-он (0,87 г, 99%). 1(ушир., 1H). Базовый пример 15. (R)-9-(3,3,3-Трифтор 2-гидрокси-2-метилпропаноиламино)-4,10 дигидротиено[3,2-с][1]бензотиепин-10-он. Работая по существу аналогично базовому примеру 7, из 9-амино-4,10-дигидротиено[3,2 с][1]бензотиепин-10-она (0,37 г, 1,49 ммоля),полученного в примере 5, и (R)-3,3,3-трифтор-2 гидрокси-2-метилпропановой кислоты (0,47 г,2,97 ммоля), полученной в примере 13, получают (R)-9-(3,3,3-трифтор-2-гидрокси-2-метилпропаноиламино)-4,10-дигидротиено[3,2-с][1]бензотиепин-10-он (0,57 г, 99%). 1 26 К раствору 3-метокситиофенола (0,54 г,0,48 ммоля) и триэтиламина (0,43 мл, 0,59 ммоля) в дихлорметане (30 мл) при охлаждении льдом медленно добавляют метил-2-бромметил 6-нитробензоат (1,45 г, 5,3 ммоль), а затем перемешивают в течение 3 ч. По завершении реакции к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия. Органический слой последовательно промывают насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлористого натрия и сушат над безводным сульфатом магния. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении. Полученное маслоподобное вещество очищают хроматографией на колонке с силикагелем (гексан/этилацетат,7/1), получая метил-2-(3-метоксифенилтиометил)-6-нитробензоат (1,29 г, 99%). 1H-ЯМР (CDCl3) : 3,74 (s, 3 Н), 3,92 (s,3H), 4,20 (s, 2H), 6,76 (ddd, 1H, J=7,9 Гц, 2,0 Гц,1,0 Гц), 6,80 (t, 1H, J=2,0 Гц), 6,86 (ddd, 1H,J=7,9 Гц, 2,0 Гц, 1,0 Гц), 7,17 (t, 1H, J=7,9 Гц),7,44 (d, 1H, J=7,9 Гц), 7,56 (dd, 1H, J=7,9 Гц, 1,0 Гц), 7,97 (dd, 1H, J=7,9 Гц, 1,0 Гц). Базовый пример 17. 2-(3-Метоксифенилтиометил)-6-нитробензойная кислота. Метил-2-(3-метоксифенилтиометил)-6 нитробензоат (0,96 г, 2,88 ммоля), полученный в примере 16, растворяют в метаноле (10 мл), к полученному раствору добавляют 4 М водный раствор гидроксида натрия (10 мл) и кипятят с обратным холодильником в течение 2 ч. По завершении реакции реакционную смесь концентрируют и значение рН доводят до 3 добавлением водного раствора хлористо-водородной кислоты в концентрации 1 моль/л, получая 2-(3 метоксифенилтиометил)-6-нитробензойную кислоту, которая выпадает в осадок в виде белого твердого вещества (0,85 г, 92%). 1H-ЯМР (ДМСО-d6) : 3,71 (s, 3 Н), 4,38 (s,2H), 6,75-6,80 (m, 1H), 6,85-6,92 (m, 2H), 7,20 (t,1H, J=7,6 Гц), 7,59 (t, 1H, J=7,9 Гц), 7,75 (d, 1H,J=7,9 Гц), 7,97 (d, 1H, J=7,9 Гц), 14,01 (ушир.,1H). Базовый пример 18. 3-Метокси-10-нитро 6,11-дигидродибензо[b,е]тиепин-11-он. 2-(3-метоксифенилтиометил)-6-нитробензойную кислоту (0,92 г, 2,88 ммоля), полученную в примере 17, суспендируют в хлористом метилене (30 мл) и к полученной суспензии добавляют трифторуксусный ангидрид (0,81 мл,5,76 ммоля) с последующим перемешиванием при комнатной температуре в течение 2 ч. Реакционную смесь охлаждают льдом, добавляют эфират трифторида бора (0,13 мл, 1,06 ммоля) и выдерживают в течение 1 ч. По завершении реакции к реакционной смеси добавляют насыщенный водный раствор бикарбоната натрия. Органический слой последовательно промывают насыщенным водным раствором бикарбона 27 та натрия, насыщенным водным раствором хлористого натрия и сушат над безводным сульфатом магния. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении. Полученное маслоподобное вещество очищают хроматографией на колонке с силикагелем (гексан/этилацетат,6/1), получая в результате 3-метокси-10-нитро 6,11-дигидродибензо[b,е] тиепин-11-он (0,40 г,46%). 1H-ЯМР (СDСl3) : 3,84 (s, 3 Н), 4,07 (s,2H), 6,75 (d, 1H, J=2,3 Гц), 6,91 (dd, 1H, J=8,9 Гц,2,0 Гц), 7,50-7,54 (m, 2H), 7,92 (dd, 1H, J=5,9 Гц,3,6 Гц), 7,98 (d, 1H, J=8,9 Гц). Пример 1-1. 5,5-Диоксо-9-(3,3,3-трифтор 2-гидрокси-2-метилпропаноиламино)-4,10 дигидротиено[3,2-с][1]бензотиепин-10-он (соединение 1-1). 9-(3,3,3-трифтор-2-гидрокси-2-метилпропаноиламино)-4,10-дигидротиено[3,2-с][1] бензотиепин-10-он (0,3 г, 0,77 ммоля), полученный в примере 7, растворяют в дихлорметане (30 мл), к полученному раствору при охлаждении льдом добавляют 3-хлорпербензойную кислоту(0,67 г, 3,5 эквивалента), а затем перемешивают при комнатной температуре в течение 3 ч. По завершении реакции реакционную смесь последовательно промывают 5%-ным водным раствором сульфита натрия, 5%-ным водным раствором бикарбоната натрия, насыщенным водным раствором хлористого натрия и сушат над безводным сульфатом магния. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении. Полученный маслоподобный остаток очищают хроматографией на колонке с силикагелем (гексан/этилацетат, 3/1), получая после растирания с изопропиловым эфиром соединение 1-1 (0,21 г,64%). 1H-ЯМР (CDCl3) : 1,74 (s, 3 Н), 4,68 (s,2 Н), 7,03 (d, 1H, J=5,1 Гц), 7,74 (d, 1H, J=5,1 Гц),7,76 (d, 1H, J=8,3 Гц), 7,97-8,03 (m, 2 Н), 8,67 (d,1H, J=8,3 Гц), 10,80 (ушир., 1H). В последующих примерах 1-21-24, 1261-47, 1-531-55, 2-12-12 и 3-13-32 целевые соединения получают по методике, в основном аналогичной примеру 1-1, нo заменяя 9(3,3,3-трифтор-2-гидрокси-2-метилпропаноиламино)-4,10-дигидротиено[3,2-с][1]бензотиепин 10-он на соответствующее производное трициклического бензотиепина. В примерах 1-51, 1-52 и 2-10 целевые соединения получают по методике, в основном аналогичной примеру 1-50, но заменяя исходное соединение из примера 1-50, а именно, 3-метокси-10-(3,3,3-трифтор-2-гидрокси-2-метилпропаноиламино)-6,11-дигидродибензо[b,е]тиепин-11-он, на соответствующее производное трициклического бензотиепина. Пример 1-2. 5,5-Диоксо-7-(3,3,3-трифтор 2-гидрокси-2-метилпропаноиламино)-4,10 002322(S)-9-(3,3,3-Трифтор-2-гидрокси-2 метилпропаноиламино)-4,10-дигидротиено[3,2 с][1]бензотиепин-10-он (1,07 г, 2,26 ммоля), полученный в примере 14, растворяют в дихлорметане (40 мл), к полученному раствору при охлаждении льдом добавляют 3-хлорпербензойную кислоту (1,95 г, 3,5 эквивалента) и перемешивают при комнатной температуре в течение 3 ч. По завершении реакции реакционную смесь последовательно промывают 5%-ным водным раствором сульфита натрия, 5%-ным водным раствором бикарбоната натрия и насыщенным раствором хлористого натрия и сушат над безводным сульфатом магния. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении. Полученный маслоподобный остаток очищают хроматографией на колонке с силикагелем (гексан/этилацетат, 3/1), получая после растирания с изопропиловым эфиром соединение 1-25 (0,71 г, 75%).H-ЯМР (ДMCO-d6) : 1,52 (s, 3 Н), 5,43 (s,2H), 7,68 (s, 1H), 7,83-7,94 (m, 2H), 7,99-8,07 (m,1H), 9,16 (s, 1H), 10,79 (ушир., 1 Н). Пример 1-48. 2-Метокси-9-(3,3,3-трифтор 2-гидрокси-2-метилпропаноиламино)-6,11 дигидродибензо[b,е]оксепин-11-он (соединение 1-48). 3,3,3-трифтор-2-гидрокси-2-метилпропановую кислоту (0,73 г, 4,63 ммоля) растворяют в диметилацетамиде (8 мл), при -15 С добавляют тионилхлорид (0,36 мл, 4,63 ммоля), а затем перемешивают при температуре в интервале от-15 до -5 С в течение 1 ч. К реакционной смеси добавляют 9-амино-2-метокси-6,11-дигидродибензо[b,е]оксепин-11-он (0,59 г, 2,32 ммоля),полученный в примере 11, и перемешивают в течение ночи при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении и полученный маслоподобный остаток растворяют в этилацетате (25 мл). Органический слой промывают последовательно 5%-ным водным раствором бикарбоната натрия,насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом магния. После отделения осушителя фильтрованием органический слой концентрируют при пониженном давлении. Полученное маслоподобное вещество очищают хроматографией на колонке с силикагелем (гексан/этилацетат, 3/1), получая при последующим растирании с изопропиловым эфиром соединение 1-48 (выход: 87%). 1[b,е]тиепин-11-он, (0,36 г, 1,2 ммоля), полученный в примере 18, в смеси воды с этанолом (20 мл) кипятят с обратным холодильником в присутствии восстановленного железа (0,36 г) и хлорида железа (III) (40 мг) в течение 2 ч. По завершении реакции реакционную смесь фильтруют в горячем состоянии и фильтрат упаривают при пониженном давлении, получая неочищенный 10-амино-3-метокси-6,11 дигидродибензо[b,е]тиепин-11-он (1,2 ммоля). Сырой продукт без дополнительной очистки добавляют к хлорангидриду, полученному из 3,3,3-трифтор-2-гидрокси-2-метилпропановой кислоты (0,38 г, 2,39 ммоля) и тионилхлорида(0,36 мл, 2,39 ммоля) в диметилацетамиде (10 мл) по методике, описанной в примере 1-48, и полученную смесь перемешивают при комнатной температуре в течение 6 ч. После окончания реакции продукт реакции очищают по методике,описанной в примере 1-48, получая соединение 1-49 (0,32 г, выход: 65%). 1(d, 1H, J=5,1 Гц), 7,90 (d, 1H, J=7,9 Гц), 8,65 (d,1H, J=7,9 Гц), 10,20 (ушир., 1H). Пример 1 препарата (таблетки). Таблетки следующего состава изготавливают общепринятым методом: Соединение 1-25 5 мг Лактоза 60 мг 1 44 Картофельный крахмал Поливиниловый спирт Стеарат магния Дегтярный пигмент Пример 2 препарата (порошок). Порошок следующего состава приготовляют общепринятым методом: Соединение 1-1 5 мг Лактоза 200 мг Пример 3 препарата (сироп). Сироп следующего состава приготовляют общепринятым методом: Соединение 1-25 5 мг Очищенный сахар 40 г Этилпарагидроксибензоат 40 мг Пропилпарагидроксибензоат 10 мг Клубничный ароматизатор 0,1 мл Воду добавляют до доведения объема до 100 мл. Промышленная применимость В настоящем изобретении предлагаются новые трициклические соединения, которые могут найти применение в качестве терапевтических средств при лечении поллакиурии и недержания мочи. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Трициклическое формулы (I)R1 означает водород, замещенный или незамещенный (С 1-С 6)алкил, замещенный или незамещенный (С 1-С 6)алкокси или галоген,Х 1-Х 2-Х 3 означает CR5=CR6-CR7=CR8 (где 5 6R , R , R7 и R8, которые могут быть одинаковыми или различными, каждый означает водород,замещенный или незамещенный (С 1-С 6)алкил,гидрокси, замещенный или незамещенный (С 1 С 6)алкокси, нитро, амино, моно(С 1-С 6) алкиламино, ди(С 1-С 6)алкиламино, замещенный или незамещенный (С 1-С 6)алканоиламино или галоген), N(O)m=CR5-CR6=CR7 (где R5, R6 и R7 имеют значения, указанные выше, a m означает 0 или 1), CR5=CR6-N(O)m=CR7 (где R5, R6, R7 и m имеют значения, указанные выше), CR5=CR6CR7=N(O)m (где R5, R6, R7 и m имеют значения,указанные выше), CR5=CR6-O (где R5 и R6 имеют значения, указанные выше), CR5=CR6-S (гдеR2 означает водород, замещенный или незамещенный (С 1-С 6)алкил, замещенный или незамещенный (С 2-С 6)алкенил, трифторметил,замещенный или незамещенный (С 1-С 6)алкокси,амино, замещенный или незамещенный моно(С 1-С 6)алкиламино, замещенный или незамещенный ди(С 1-С 6)алкиламино, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный аралкиламино, замещенный или незамещенный ариламино, замещенную или незамещенную алициклическую гетероциклическую группу, замещенную или незамещенную азотсодержащую гетероциклическую группу или(где n означает 0 или 1, R3 и R4, которые могут быть одинаковыми или различными, каждый означает водород, замещенный или незамещенный (С 1-С 6)алкил, замещенный или незамещенный циклический алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил или трифторметил или R3 и R4 вместе образуют циклический алкил и Q означает гидрокси, замещенный или незамещенный-SO2CH2-; и когда R2 не означает замещенный или незамещенный (С 1-С 6)алкил, тоY может означать -ОСН 2,и их фармацевтически приемлемые соли. 2. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, гдеR1 означает водород, замещенный или незамещенный (С 1-С 6)алкокси или галоген. 3. Трициклическое соединение или его фармацевтически приемлемая соль по п.2, гдеR1 означает водород. 4. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где Y означает -CH2SO2-, -SO2CH2- или -ОСH2-. 5. Трициклическое соединение или его фармацевтически приемлемая соль по п.4, где Y означает -CH2SO2- или -SO2CH2-. 46 6. Трициклическое соединение или его фармацевтически приемлемая соль по п.5, где Y означает -CH2SO2-. 7. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, гдеX1-X2-XЗ означает S-CR7=CR8 (где R7 и R8 имеют значения, указанные выше). 8. Трициклическое соединение или его фармацевтически приемлемая соль по п.7, гдеR1 означает водород, а Y означает -CH2SO2-. 9. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, где Х 1-Х 2-X3 означает CR5=CR6-CR7=CR8 (где R5,R6, R7 и R8 имеют значения, указанные выше). 10. Трициклическое соединение или его фармацевтически приемлемая соль по п.9, гдеR1 означает водород, а Y означает -CH2SO2-. 11. Трициклическое соединение или его фармацевтически приемлемая соль по любому из пп.1-10, где R2 означает(где n, R3, R4 и Q имеют значения, указанные выше). 12. Трициклическое соединение или его фармацевтически приемлемая соль по п.11, гдеn означает 0. 13. Трициклическое соединение или его фармацевтически приемлемая соль по п.12, гдеQ означает гидрокси. 14. Трициклическое соединение или его фармацевтически приемлемая соль по п.1, гдеR1 означает водород, Y означает -CH2SO2-, X1X2-X3 означает S-CR7=CR8 (где R7 и R8 имеют значения, указанные выше), R3 означает метил,R4 означает трифторметил, a Q означает гидрокси. 15. Фармацевтическая композиция, представляющая собой трициклическое соединение или его фармацевтически приемлемую соль по п.1.
МПК / Метки
МПК: A61K 31/38, C07D 313/12
Метки: трициклические, соединения
Код ссылки
<a href="https://eas.patents.su/24-2322-triciklicheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические соединения</a>
Предыдущий патент: Полимер этилена, пленка и способ полимеризации
Следующий патент: Усовершенствованная лопасть для перемещения текучей среды и механизм вращения
Случайный патент: Устройство для бедного шлаками извлечения жидкой стали из распределителя или разливочного ковша при открывании донного литника












