Способ получения дроспиренона (6&beta, 7β 15&beta, 16&beta – диметилен -3 – оксо -17α-прегн- 4 -ен-21,17-карболактона, drsp) и 6&beta,7β15&beta,16&beta – диметилен -5&beta-гидрокси -3- оксо – 17&alpha – андростан – 21,17 – карболактон (zk 90965) в качестве промежуточного продукта
Формула / Реферат
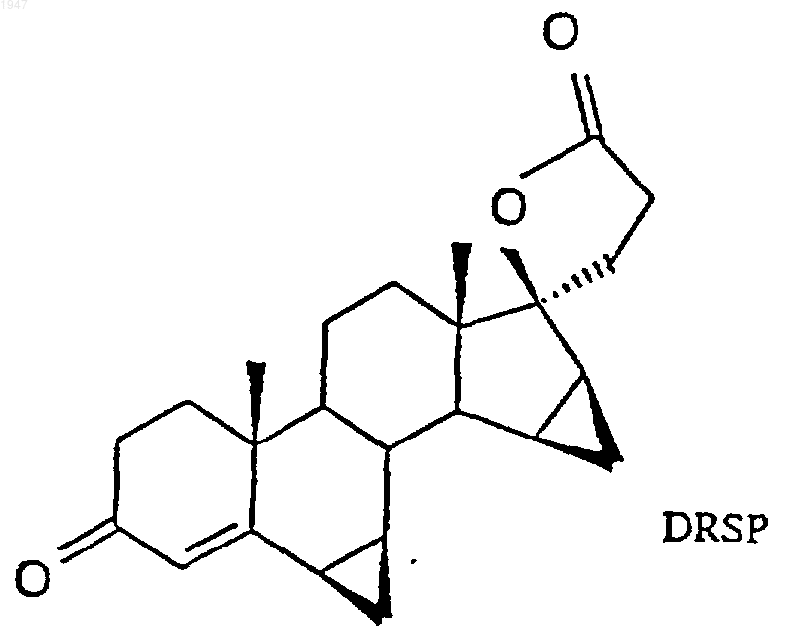
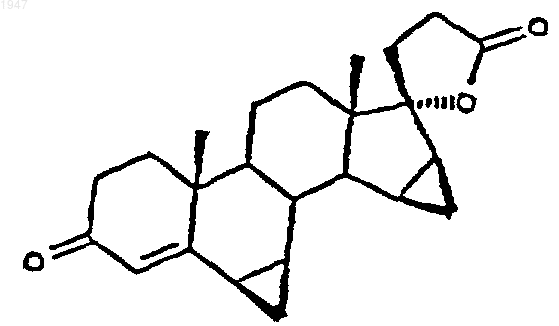
1. Способ получения дроспиренона (6b,7b;15b,16b-диметилен-3-оксо-17a-прегн-4-ен-21,17-карболактон DRSP)
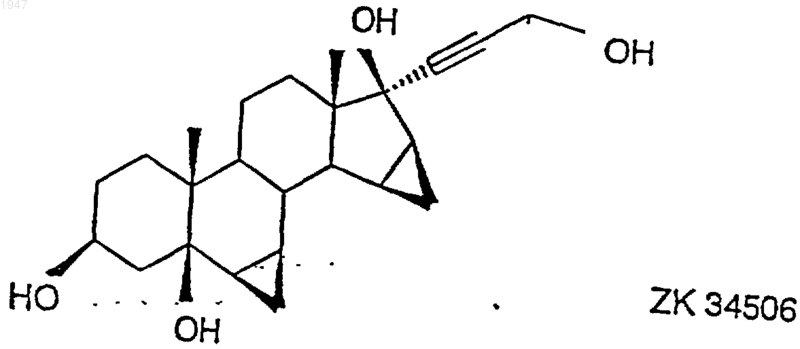
осуществляемый каталитическим гидрированием 17a-(3-гидрокси-1-пропинил)-6b,7b;15b,16b-диметилен-5b-андростан-3b,5,17b-триола (ZK 34506)
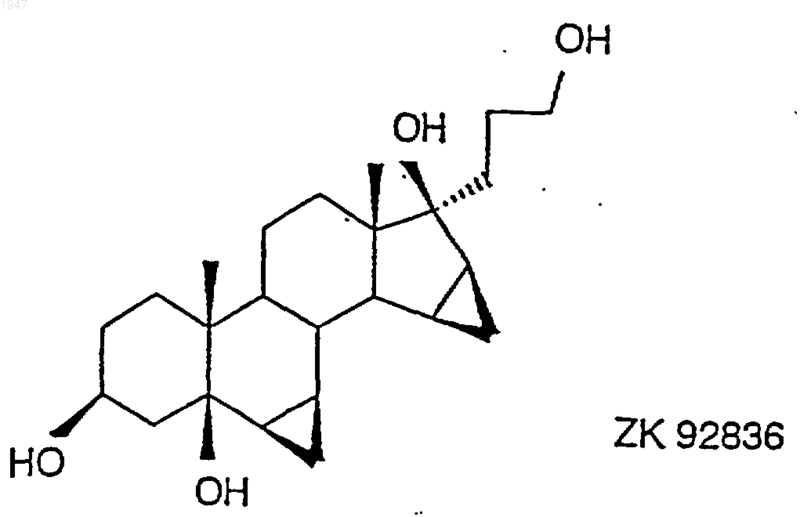
с получением 17a-(3-гидрокси-1-пропил)-6b,7b;15b,16b-диметилен-5b-андростан-3b,5,17b-триола (ZK 92836)
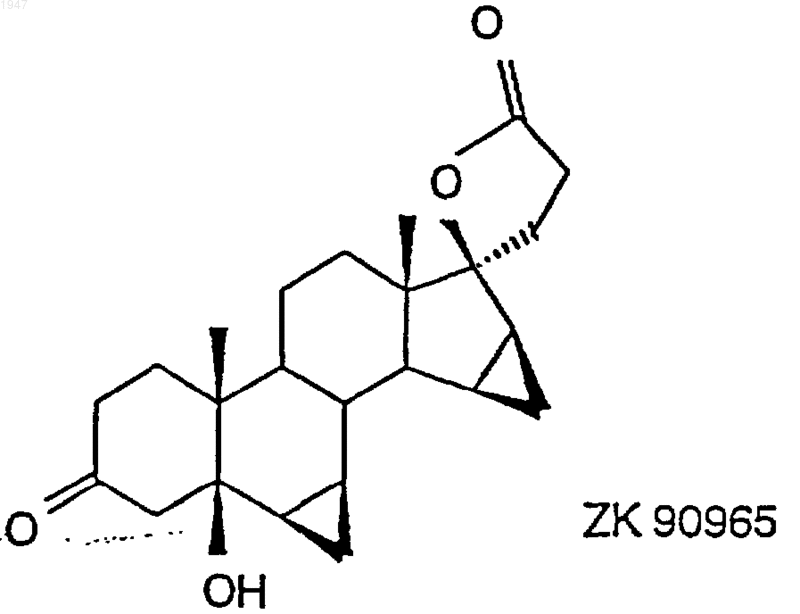
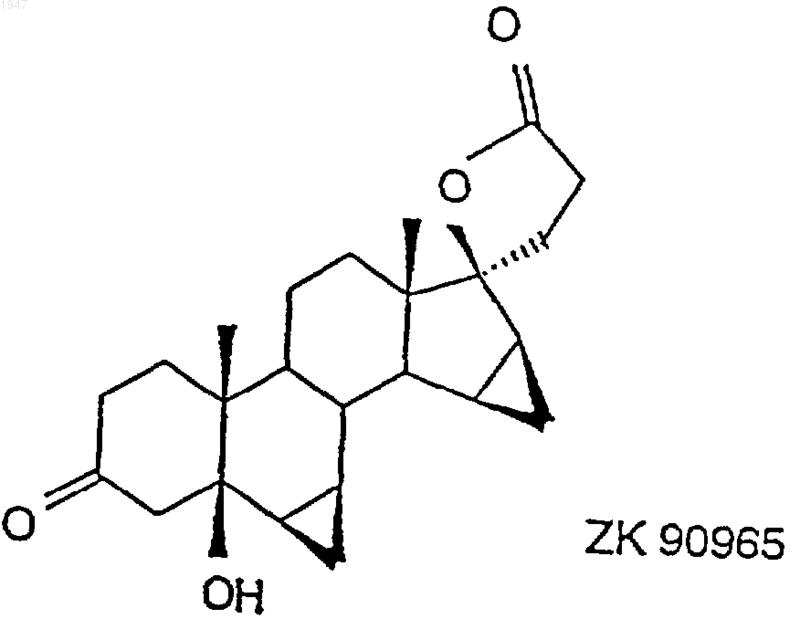
окислением в присутствии соли рутения до 6b,7b;15b,16b-диметилен-5b-гидрокси-3-оксо-17a-андростан-21,17-карболактона (ZK 90965)
и последующим отщеплением воды.
2. 6b,7b;15b,16b-диметилен-5b-гидрокси-3-оксо-17a-андростан-21,17-карболактон (ZK 90965)
3. Способ получения дроспиренона по п.1, отличающийся тем, что получают продукт, содержащий менее 0,2% загрязняющих примесей изолактона
и образующегося под воздействием кислоты на 6,7-метиленовую группу 6,7-продукта размыкания кольца.
4. Дроспиренон, получаемый способом по п.1, отличающийся тем, что он содержит менее 0,2% загрязняющих примесей изолактона

и образующегося под воздействием кислоты на 6,7-метиленовую группу 6,7-продукта размыкания кольца.
Текст
1 Настоящее изобретение относится к способу получения дроспиренона (6,7;15,16 диметилен-3-оксо-17-прегн-4-ен-21,17-карболактона, DRSP), а также к промежуточному продукту 6,7;15,16-диметилен-5-гидрокси-3-оксо-17-андростан-21,17-карболактону(ZK 90965). Дроспиренон (6,7;15,16-диметилен-3 оксо-17-прегн-4-ен-21,17-карболактон, DRSP,INN) уже с давних пор известен в качестве стероидного активного вещества (см. заявки Германии DE 2652761 С 2 и DE 3022337 А 1), и последние четыре стадии процесса получения осуществляют по так называемому способу получения продукта в одном аппарате, в котором после гидрирования диметиленпропинола ZK 34506 ни один из получаемых на промежуточных стадиях продуктов - диметиленпропанол и 5OH-DRSP - не выделяют (см. нижеследующую схему). Диметиленпропинол ZK 34506 гидрируют в тетрагидрофуране водородом в присутствии палладия на угле до диметиленпропанола ZK 92836. Полученный таким путем гидрогенизационный раствор, содержащий пропанол ZK 92836 в качестве главного продукта и варьирующиеся доли лактола, без выделения и промежуточной переработки превращают в дроспироенон ZK 30595 (DRSP). С этой целью сначала проводят замену растворителя, а именно вместо тетрагидрофурана используют диметилформамид, а затем пропанол при 40 С окисляют дихроматом пиридиния (ДХП), применяя последний в избытке 3,7 эквивалента, до смеси изDRSP и 5OH-DRSP. 5 ОН-функция в продукте окисления проявляет стабильность по отношению к кислотам, кислотам Льюиса и оснoвным условиям при повышенных температурах, поскольку во всех случаях благодаря образованию -4,5-ненасыщенного кетона в дроспиреноне получают термодинамически стойкий продукт. Элиминирование -ОН-функции в 5-OH-DRSP приводит к термодинамически более стойкому дроспиренону, каковой процесс до настоящего времени подавить не удавалось. 2 Указанная выше смесь содержит, как правило, варьирующиеся количества обоих компонентов, причем 5OH-DRSP, являющийся преимущественно основным компонентом,представлен в соотношении 2-3:1. На последней стадии последовательного осуществления способа получения продукта в одном аппарате двухкомпонентную смесь за счет добавления полуконцентрированной соляной кислоты переводят в сырой DRSP. В нижеследующей таблице представлены последние четыре рабочие смеси. Смесь Выход сырого Чистота (по продукта (%) 100%-ной шкале) 537201 57,2 98,9 202 63,7 99,09 203 46,5 99,18 204 58,3 98,81 Всего Средний выход: 56,4 Средняя чистота: 98.9 Таким образом, при использовании всех рабочих смесей, исходя из диметиленпропинола, в среднем получают сырой DRSP с теоретическим выходом порядка 56% и со степенью чистоты согласно ЖХВР 98,9%. С учетом вышеизложенного в основу изобретения была положена задача разработать новый способ получения дроспиренона с более высокой избирательностью и более простой по его осуществлению по сравнению с таковым из уровня техники и, кроме того, экологически более безвредный (без окисления триоксидом хрома). Указанная задача реализуется согласно техническому решению, представленному в пунктах формулы изобретения. Объектом изобретения является способ получения дроспиренона осуществляемый каталитическим гидрированием 17-(3-гидрокси-1-пропинил)-6,7;15,16 диметилен-5-андростан-3,5,17-триола (ZK 34506) последующим окислением с помощью коммерчески доступных солей рутения, таких какRuCl3, RuO2, KRuO4, K2RuO4, предпочтительно,однако, в присутствии каталитических количеств RuCl3 (1 мол.%), и обычных простых окислителей, таких как трет-бутилгидропероксид, N-метилморфолин-N-оксид, M2S2O8 и последующим отщеплением воды. Ключевой реакцией согласно изобретению является катализованное рутением окисление диметиленпропанола ZK 92836 до 5OH-DRSPZK 90965 и последующее элиминирование воды с получением дроспиренона ZK 30595, которые осуществляют по двухстадийному способу. Аналогично способу, известному из уровня техники, в способе по изобретению диметиленпропинол ZK 34506 гидрируют в тетрагидрофуране водородом в присутствии палладия на угле. Затем в гидрогенизационном растворе производят замену растворителя, используя вместо тетрагидрофурана ацетонитрил. Этот ацетонитрильный раствор целенаправленно окисляют каталитическим количеством трихлорида рутения (1 мол.%) и 3 эквивалентами бромата натрия при температуре в интервале 4060 С до 5OH-DRSP. Несмотря на большую лабильность 5OH-DRSP по отношению к кислотам, кислотам Льюиса, как, например, соединения хрома, применяемые в старом промышленном способе, к сильным основаниям или высоким температурам, причину которой во 4 всех случаях следует усматривать в высокоактивной тенденции к образованию термодинамически более стабильного -4,5-ненасыщенного кетона, благодаря вышеуказанному выбору условий реакции удается осуществлять избирательный синтез 5OH-DRSP, исключая при этом образование дроспироенона. 5OH-DRSP может быть выделен простым (в техническом отношении) путем: осаждением воды из реакционного раствора. Выход продукта, получаемого по завершении обеих стадий - гидрирования и последующего окисления - составляет от 68 до 75%. Согласно опытным данным заявителя было установлено, что для разложения дроспироенона под действием кислоты существуют два возможных пути. Первый из них заключается в том, что дроспироенон в кислых условиях легко переводят в эпимерный изолактон ZK 35096 Второй побочный продукт образуется под действием НСl на 6,7-метиленовую группу, что и приводит вследствие размыкания цикла к продукту ZK 95673. Оба побочных продукта в условиях реакции, осуществляемой по новому способу, "оттесняются" настолько, что их присутствие наблюдается лишь в количестве порядка 0,2%. При элиминировании достигают выхода продукта 96% от теории. Тем самым общий выход,который обеспечивает новый способ, составляет 65-72% от теории. Еще одно очень существенное преимущество предлагаемого способа по сравнению с уровнем техники касается экологии. Так, в частности, применявшиеся до настоящего времени токсичные соединения хрома, которые использовали до сих пор в виде солей пиридиния, в данном случае дихромата пиридиния, для окисления и которые затем в виде их растворов должны направляться на утилизацию, удалось заменить каталитическими количествами металла. Кроме того, теперь обеспечена возмож 5 ность применяемую смесь ацетонитрил/вода путем азеотропной перегонки возвращать в производственный цикл, так что и в этом отношении не следует опасаться угрозы окружающей среде. Еще одним объектом изобретения является промежуточный продукт: 6,7;15,16-диметилен-5-гидрокси-3 оксо-17-андростан-21,17-карболактон(ZK 90965). Примеры 6,7;15,16-диметилен-5-гидрокси-3 оксо-17-андростан-21,17-карболактон. 50 г 17-(3-гидрокси-1-пропинил)-6,7; 15,16-диметилен-5-андростан-3,5,17-триола гидрируют в 1000 мл ТГФ в присутствии 10 г палладия на угле (10%) и 3 мл пиридина до поглощения 2 эквивалентов водорода. Затем катализатор отфильтровывают и раствор концентрируют досуха, получая в результате 52,7 г 7-(3-гидрокси-1-пропил)-6,7;15,16-диметиленандростан-3,5,17-триола,который без очистки подвергают дальнейшему превращению. 50,2 г 7-(3-гидрокси-1-пропил)-6,7;15,16-диметилен-5-андростан-3,5,17-триола суспендируют в 250 мл ацетонитрила и нагревают до 45 С. К этой суспензии по каплям добавляют 0,52 г трихлорида рутения, растворенных в 10 мл воды, и 62,46 г бромата натрия, растворенных в 250 мл воды. Далее перемешивают в течение 2 ч при 50 С, после чего раствор резко охлаждают за счет добавления 1000 мл воды. Затем добавляют 200 мл этилацетата, фазы разделяют и водную фазу экстрагируют 600 мл этилацетата. Объединенные органические фазы сушат над сульфатом натрия, после чего концентрируют досуха. В результате получают 43,44 г 6,7;15,16-диметилен-5-гидрокси-3 оксо-17-андростан-21,17-карболактона в виде сырого продукта. Путем перекристаллизации из ацетона/изоэфира получают 35,7 г 6,7;15,16-диметилен-5-гидрокси-3-оксо-17-андростан-21,17-карболактона с температурой плавления 216-218 С. Удельное вращение составляет 65,6.(Линия для натрия, с =1,02 в СHСl3). 6,7;15,16-диметилен-3-оксо-17 прегн-4-ен-21,17-карболактон. 28 г 6,7;15,16-диметилен-5-гидрокси-3-оксо-17-андростан-21,17-карболактона суспендируют в 280 мл ТГФ и затем смешивают с 10 мол.%, 1,5 г п-толуолсульфокислоты. По истечении 30 мин добавляют 125 мл насыщенного раствора NaCl и 8,2 мл 1 н. раствора NaOH. После разделения фаз органическую фазу сушат над сульфатом натрия и концентрируют досуха,получая в результате 25,67 г 6,7;15,16 диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон в виде сырого продукта, чистота которо 001947 6 го согласно ЖХВР составляет 93%. Последующую очистку можно осуществлять посредством хроматографии. Температура плавления субстанции, подвергнутой хроматографии, составляет 197,5-200 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения дроспиренона осуществляемый каталитическим гидрированием 17-(3-гидрокси-1-пропинил)-6,7;15,16 диметилен-5-андростан-3,5,17-триола (ZK 34506) окислением в присутствии соли рутения до 6,7;15,16-диметилен-5-гидрокси-3-оксо 17-андростан-21,17-карболактона (ZK 90965) 8 и образующегося под воздействием кислоты на 6,7-метиленовую группу 6,7-продукта размыкания кольца. 4. Дроспиренон, получаемый способом по п.1, отличающийся тем, что он содержит менее 0,2% загрязняющих примесей изолактона 3. Способ получения дроспиренона по п.1,отличающийся тем, что получают продукт, содержащий менее 0,2% загрязняющих примесей изолактона и образующегося под воздействием кислоты на 6,7-метиленовую группу 6,7-продукта размыкания кольца.
МПК / Метки
МПК: C07J 53/00
Метки: диметилен, получения, дроспиренона, продукта, 15&beta, 17&alpha, ен-21,17-карболактона, андростан, оксо, карболактон, способ, качестве, 16&beta, промежуточного, 21,17, 17α-прегн, 6&beta,7β15&beta,16&beta, 5&beta-гидрокси, 7&beta, drsp, 6&beta, 90965
Код ссылки
<a href="https://eas.patents.su/5-1947-sposob-polucheniya-drospirenona-6beta-7beta-15beta-16beta-dimetilen-3-okso-17alpha-pregn-4-en-2117-karbolaktona-drsp-i-6beta7beta15beta16beta-dimetilen-5beta-gidroksi-3-okso-17alph.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения дроспиренона (6&beta, 7β 15&beta, 16&beta – диметилен -3 – оксо -17α-прегн- 4 -ен-21,17-карболактона, drsp) и 6&beta,7β15&beta,16&beta – диметилен -5&beta-гидрокси -3- оксо – 17&alpha – андростан – 21,17 – карболактон (zk 90965) в качестве промежуточного продукта</a>









