α-гидрокси, -амино и галоидные производные β-сульфонилгидроксамовых кислот в качестве ингибиторов матриксных металлопротеиназ
Номер патента: 3585
Опубликовано: 26.06.2003
Авторы: Варпехоски Марта А., Маджора Линда Луиза, Митчелл Марк Аллен, Харпер Дональд Э.
Формула / Реферат
1. Соединение формулы I
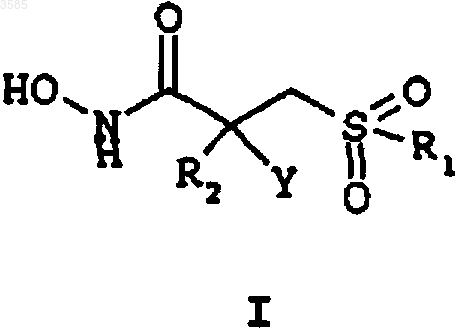
или его фармацевтически приемлемая соль,
где R1 представляет собой фенил, замещенный C1-4акилом, C1-4 алкокси, галогеном или фенилом;
R2 представляет собой фенилсульфонилметил, замещенный C1-4алкилом, C1-4алкокси, галогеном или фенилом; или представляет собой группу -CH2NHC(=O)R3, где R3 представляет собой C5-6циклоалкил или фенил, необязательно замещенный C1-4алкокси;
Y представляет собой -OH.
2. Соединение по п.1, которое представляет собой
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил)пропионамид,
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фторбензолсульфонил)пропионамид,
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-н-бутилбензолсульфонил)пропионамид,
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)пропионамид,
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-бензолкарбониламино)пропионамид,
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-N-(циклопентилкарбонил)амино]пропионамид или
N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-(4-метоксибензолкарбонил)амино)пропионамид.
3. Соединение формулы 8
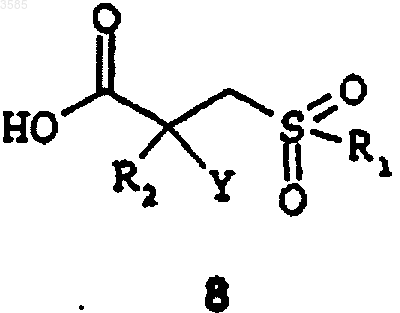
или его фармацевтически приемлемая соль, где R1, R2 и Y такие, как указано в п.1.
4. Соединение по п.3, которое представляет собой
2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фторбензолсульфонил)пропионовую кислоту,
2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-н-бутилбензолсульфонил)пропионовую кислоту или
2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)пропионовую кислоту.
5. Способ ингибирования матриксной металлопротеиназы, включающий введение пациенту в случае необходимости эффективного количества соединения по п.1.
6. Способ по п.5, где указанная матриксная металлопротеиназа включает стромелизин, коллагеназу или желатиназу.
7. Способ по п.5, где эффективное количество соединения по п.1 вводят в фармацевтической композиции перорально, парентерально или местно.
8. Способ по п.5, где указанное соединение вводят в количестве приблизительно от 0,1 до 100 мг/кг веса тела/день.
9. Способ лечения человека, страдающего от или предрасположенного к заболеванию, включающему деградацию соединительной ткани, который включает введение пациенту в случае необходимости эффективного количества соединения по п.1.
10. Способ по п.9, где заболеванием, связанным с деградацией соединительной ткани, является остеоартрит, ревматоидный артрит, септический артрит, остеопения, остеопороз, опухолевое метастазирование (инвазия и рост), периодонтит, гингивит, изъязвление роговицы, изъязвление кожи, язва желудка, воспаление или астма.
11. Способ по п.9, где эффективное количество соединения по п.1 вводят в фармацевтической композиции перорально, парентерально или местно.
12. Способ по п.9, где указанное соединение вводят в количестве приблизительно от 0,1 до 100 мг/кг веса тела/день.
13. Фармацевтическая композиция, которая содержит эффективное для ингибирования матриксной металлопротеиназы количество соединения по п.1 и фармацевтически приемлемый носитель.
14. Применение соединения по п.1 в качестве лекарственного средства.
15. Применение соединения по п.1 для производства лекарственного средства для ингибирования матриксной металлопротеиназы у человека, страдающего от или предрасположенного к заболеванию, включающему в себя деградацию соединительной ткани.
16. Применение по п.15, где указанная матриксная металлопротеиназа включает коллагеназу, стромелизин или желатиназу.
17. Применение по п.15, где заболеванием, связанным с деградацией соединительной ткани, является остеоартрит, ревматоидный артрит, септический артрит, остеопения, остеопороз, опухолевое метастазирование (инвазия и рост), периодонтит, гингивит, изъязвление роговицы, изъязвление кожи или язва желудка.
Текст
1 Данное изобретение относится к новым гидрокси, амино и галоидным производным сульфонилгидроксамовых кислот, к фармацевтическим композициям, содержащим их, и к способу их применения. Соединения согласно изобретению являются ингибиторами матриксных металлопротеиназ, вовлеченных в деградацию тканей. Нарушение целостности соединительной ткани происходит при многих патологических процессах, включая остеоартрит, ревматоидный артрит, септический артрит, остеопении,такие как остеопороз, опухолевый метастаз (инвазия и рост), периодонтит, гингивит, изъязвление роговицы, кожное изъязвление, язва желудка, воспаление, астма и другие заболевания, связанные с разрушением соединительной ткани. Хотя распространенность этих заболеваний в развитых странах высока, не существует терапии, которая предупреждает происходящее повреждение тканей. Целый ряд научных данных указывает на то, что неконтролируемая активность матриксных металлопротеиназ (MMPs) соединительной ткани ответственна за повреждение, и в результате целью терапевтического вмешательства становится ингибирование этих ферментов (см. Маtrisian, L.M., Bases, Vol. 14,рр. 445-463 (1992); Emonard, H. et al., CellularRheumatic, Vol. 49, pp. 469-479 (1990. Производные гидроксамовых кислот представляют собой класс известных терапевтически активных ингибиторов MMPs, и в данной области имеются многочисленные публикации, в которых описан целый ряд производных гидроксамовых кислот. Например, в европейском патенте 0606046 A1 описывает арилсульфонамидзамещенные гидроксамовые кислоты, полезные в качестве ингибиторов матриксных металлопротеиназ. В международных заявкахWO 95/35275 и WO 95/35276 описаны сульфонамидные производные гидроксамовых кислот и карбоновых кислот, полезные в качестве ингибиторов матриксных металлопротеиназ. Все эти ссылки относятся к сульфонамидным гидроксамовым кислотам. Соединения данного изобретения являются новыми и отличаются от всех других сульфонамидных гидроксамовых кислот тем, что обычный атом азота замещен атомом углерода. В изобретении предложены производные сульфонилгидроксамовых кислот. Соединения согласно изобретению ингибируют различные ферменты из семейства матриксных металлопротеиназ, преимущественно стромелизин и желатиназу, и, следовательно,полезны для лечения вызванных матриксными металлоэндопротеиназами заболеваний, таких как остеопороз, опухолевое метастазирование 2 желудка, воспаление, астма и другие заболевания, связанные с разрушением соединительной ткани. В заявке на европейский патентЕР 07080386 А 1 описаны ингибиторы матриксных металлопротеиназ, полезные при лечении млекопитающих, болезненное состояние которых облегчается путем ингибирования таких матриксных металлопротеиназ. В международной заявкеWO 97/24117 описаны соединения замещенного арила, гетероарила, арилметила или гетероарилметилгидроксамовых кислот, особенно полезные для ингибирования продукции или физиологических эффектов TNF при лечении пациента,имеющего заболевание, связанное с физиологически вредным избытком фактора некроза опухоли (TNF). В международной заявке на патентPCT/US 97/16348 описаны -сульфонилгидроксамовые кислоты как ингибиторы матриксных металлопротеиназ. Соединения данного изобретения являются новыми и отличаются от вышеупомянутых гидроксамовых кислот тем, что они имеют гидрокси-, аминогруппу или фтор в -положении и два атома водорода в -положении гидроксаматной группы. В данном изобретении предлагаются новые соединения формулы I или его фармацевтически приемлемые соли, гдеR2 представляет собой фенилсульфонилметил, замещенный C1-4 алкилом, C1-4 алкокси,галогеном или фенилом; или представляет собой группу -СН 2NНС(=O)R3, где R3 представляет собой C5-6 циклоалкил или фенил, необязательно замещенный C1-4 алкокси;Y представляет собой -ОН. Соединения данного изобретения ингибируют различные ферменты из семейства матриксных металлопротеиназ, преимущественно стромелизин и желатиназу, и, следовательно,полезны для лечения заболеваний, вызванных матриксными металлсодержащими эндопротеиназами. Подробное описание изобретения В случае необходимости, соединения данного изобретения могут быть превращены в их соли в соответствии с общепринятыми способами. Термин фармацевтически приемлемые соли относится к солям присоединения кислот,полезным при введении соединений этого изо 3 бретения, и включают в себя гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, ацетат,пропионат, лактат, мезилат, малеат, малат, сукцинат, тартрат, соль лимонной кислоты, 2 гидроксиэтилсульфонат, фумарат и подобные. Эти соли могут быть в гидратированной форме. Некоторые из соединений данного изобретения могут образовывать соли металлов, таких как натрий, калий, кальций и магний, и их объединяют термином фармацевтически приемлемые соли. Соединения формулы I данного изобретения содержат хиральный центр в -положении гидроксамовых кислот, по существу, существуют два энантиомера или рацемическая смесь обоих. Данное изобретение относится к обоим энантиомерам, так же как и к смесям, содержащим оба изомера. Кроме того, в зависимости от заместителей, дополнительные хиральные центры и другие изомерные формы могут присутствовать в любой из R2-групп, и данное изобретение охватывает все возможные стереоизомеры и геометрические формы в этой группе. Примерами соединений по данному изобретению являются следующие:N-гидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-(4-метоксибензолкарбонил)амино)пропионамид. Соединения данного изобретения могут быть приготовлены согласно способу, обсуждаемому ниже. В схеме I R1 и R2 представляют собой группы, описанные выше. Замещенные эфиры малоновой кислоты 2 либо получают коммерчески, либо могут быть быстро получены из структуры 1 с помощью способов, хорошо известных специалистам в данной области. Например, реакция энолата структуры 1, образованного соответствующим основанием в соответствующем растворителе с алкилирующим агентом R2-1 (1 является бромом, хлором, тозилатом, мезилатом, эпоксидами и так далее),обеспечивает требуемые замещенные эфиры 2(1955). Соединение 2 гидролизуется до монокарбоновой кислоты 3 посредством реакции с одним эквивалентом соответствующего основания, такого как гидроокись щелочного металла в соответствующем растворителе при температурах от 0 до 30 С. В присутствии формальдегида и пиперидина в соответствующем растворителе,таком как пиридин, этанол, диоксан при температуре кипения, соединение 3 превращается в акриловые эфиры 4. Во многих случаях акриловые эфиры 4 коммерчески доступны. Акриловые эфиры 4 можно превратить в эфиры глицидной кислоты 5 путем окисления метахлорнадбензойной кислотой (МСРВА) при кипячении с обратным холодильником в этилендихлориде в присутствии ингибитора радикальных реакций, такого как 4,4-тиобис-(6-тбутил-3-метил фенол). См. J.C.S. Chem. Comm.,pp. 64-65 (1972). Тиол (H-SR1) добавляют к эфиру глицидной кислоты при комнатной температуре, чтобы получить эфиры сульфокислоты 6 в присутствии основания, такого как гидрид натрия в сухом THF (тетрагидрофуране) или карбонат калия в толуоле, или третичный амин в хлороформе. Получающиеся в результате сульфиды 6 легко окисляются до сульфонов 7 с помощью окисляющего агента, такого как МСРВА в соответствующем растворителе, таком как хлористый метилен, или, используя перекись водорода, в уксусной кислоте в качестве растворителя. Альтернативно, глицидные эфиры 5 можно превращать в сульфоны 7 непосредственно путем реакции натриевых солей сульфиновой кислоты в растворителях, таких как DMF(диметилформамид) или толуол. Сложные эфиры можно гидролизовать посредством хорошо известных в данной области способов, таких как использование 6N НСl и кипячения с обратным холодильником в течение 10-20 ч или использование иодтриметилсилана в хлороформе, или посредством омыления водной щелочью в спиртовых растворах при 0 С до комнатной температуры, чтобы получить свободные кислоты 8. Связывание кислот 8 с солянокислым гидроксиламином с образованием гидроксаматов 10 можно осуществить несколькими способами,хорошо известными специалистам в данной области. Например, кислоты 8 можно активировать хлорэтилформатом в сухом THF или подобном совместимом растворителе, или с помощью карбодиимидного конденсирующего агента, такого как EDC в присутствии или отсутствии НОВТ в DMF и хлористом метилене. В обоих случаях необходим третичный амин. Последующая реакция активированной кислоты 8 с гидроксиламином дает требуемые производные гидроксамовых кислот. Альтернативно,кислоты 8 можно конденсировать, используя те же самые реагенты, которые описаны выше, или используя два эквивалента EDC в водном THF с 5 бензилзащищенным солянокислым гидроксиламином, чтобы получить защищенные гидроксаматы 9. Соединения 9 часто легче очищаются и могут быстро расщепляться гидрогенолизом до свободных гидроксаматов 10 с помощью палладиевого катализатора в спиртовых растворителях. Другие защищенные гидроксаматы такие как трет-бутилгидроксиламин также используют, и свободную гидроксамовую кислоту можно получить обработкой трифторуксусной кислотой. Во втором способе получения соединений согласно изобретению, в частности, подходящем для соединений формулы I, где группа R2 содержит гетероатомы, используют коммерчески доступные бромметиловые эфиры акриловой кислоты, такие как 11, которые представлены на схеме II. Обработка 11 тиолами дает соединения 12. Реакцию можно проводить в диоксане, этаноле, толуоле или другом подходящем растворителе при комнатной температуре или кипячении с обратным холодильником в присутствии основания, такого как двууглекислый натрий или пиперидин. См. Annelen, Vol. 564,рр. 73-78 (1949). Эфир 11 также может быть прямо превращен в сульфон 13 путем обработки натриевыми солями сульфиновой кислоты вDMF, толуоле, метаноле или другом подходящем растворителе при комнатной температуре или кипячении с обратным холодильником в присутствии или отсутствии йодистого натрия в качестве катализатора. См.: Tetrahedron Lett.,Vol. 28, рр. 813-816 (1987). Сульфиды 12 или сульфоны 13 можно окислить до глицидных эфиров 14 путем окисления достаточным количеством МСРВА при кипячении с обратным холодильником в этилендихлориде в присутствии ингибитора радикальных реакций, такого как 4,4'-тиобис-(6-трет-бутил-3-метилфенол),как упомянуто выше. Глицидные эфиры 14 реагируют с нуклеофильными соединениями W-H или их солями щелочных металлов (где W представляет собой группу, присоединенную через гетероатом, такой как кислород, азот, сера или галоген) с образованием гидроксиэфиров 7(R2=CH2-W). Эти реакции проводят в метаноле,DMF, толуоле или других соответствующих растворителях при комнатной температуре или кипячении с обратным холодильником. В качестве примера такой реакции см.Tetrahedron, Vol. 51, рр. 11841-11854 (1995). Нуклеофильному присоединению к глицидным эфирам способствуют координационными ионами, такими как Мg2+ или другие виды, такие как алкоксиды титана. См. Tetrahedron Lett., Vol. 28, рр. 44354436 (1987) и J. Org. Chem., Vol. 50, рр. 15601563 (1985). Соединения 7 могут быть превращены в гидроксамовые кислоты 10 согласно способам, представленных в схеме 1. Альтернативно, при вышеописанных условиях бромметиловые эфиры акриловой кислоты 11 реагируют сначала с нуклеофилами W-H или их солями 6 щелочных металлов с образованием акриловых эфиров 4, где R2 представляет собой -CH2W. Согласно способам, представленным на схеме 1,соединения 4 можно превращать в гидроксамовые кислоты 10, где R2 означает -CH2W. Схема 3 иллюстрирует особый случай схемы 2, когда глицидные эфиры 14 взаимодействуют с тиолом или тиолатом как с нуклеофиломW-H или его солью щелочного металла с образованием -гидрокси эфиров (R2 = -CH2-S-R4). Реакцию проводят в THF, толуоле или другом подходящем растворителе с тиолом и соответствующим основанием, таким как гидрид натрия или карбонат калия при комнатной температуре или кипячении с обратным холодильником. Эти эфиры могут быть окислены до биссульфоновых эфиров 15 с помощью МСРВА в хлористом метилене или перекиси водорода в уксусной кислоте. Альтернативно,биссульфоновые эфиры 15 получают непосредственно из глицидных эфиров 14 посредством реакции с натриевыми солями сульфиновой кислоты в DMF, толуоле, метаноле или другом приемлемом растворителе при комнатной температуре или кипячении с обратным холодильником в присутствии или отсутствии йодистого натрия в качестве катализатора. Гидролиз биссульфоновых эфиров 15 до карбоновых кислот 8(R2 = -CH2-S(O)2-R4) и последующее превращение в гидроксамовые кислоты 10 (R2 = -CH2S(O)-R4) осуществляют в соответствии со способами, представленными в схеме 1. В особом случае, когда R1 такой же как R4, получающиеся гидроксамовые кислоты являются ахиральными молекулами. Другой вариант схемы 2 представлен на схеме 4, где глицидный эфир 14 реагирует с соединением нитрила R3 СN в присутствии кислого катализатора, предпочтительно бортрифторидэтератом в хлористом метилене, с образованием оксазолиновых эфиров. См. Recueil desTravaux Chimiques des Pays-Bas, Vol. 111, pp. 6974 (1992). Реакцию проводят в течение нескольких дней при комнатной температуре. Оксазолиновые эфиры 16 гидролизуются до гидрокси эфиров 7 (R2 = -CH2-NHCOR) в присутствии кислот, предпочтительно щавелевой кислоты с обратным холодильником в этаноле. Последующее превращение эфиров 7 в гидроксамовые кислоты 10 R2 = -CH2-NHCOR3) осуществляют способами, описанными в схеме 1. Схема 5 иллюстрирует способ, с помощью которого получают соединения данного изобретения, содержащие гетероциклический фрагмент. Глицидные эфиры 14 реагируют с третбутоксикарбонил (Воc)-защищенным аминоакрилонитрилом, например, согласно способам схемы 4, с образованием сначала оксазолиновых эфиров 17, а затем -гидрокси эфиров 18 R2 =-CH2-NHCOCH2NHBoc). Удаление защиты Вос 7 группы трифторуксусной кислотой с последующей реакцией амина с ацилирующим агентом, таким как этилхлорформат в растворителе таком как хлористый метилен в присутствии третичного аминного основания, такого как триэтиламин, и последующее внутримолекулярное ацилирование амидного азота используют для получения соединения 19, содержащего,например, кольцо гидантоина. Превращение соединений 19 в гидроксамовые кислоты 20 осуществляют способами, представленными на схеме 1. С помощью подобных реакций, хорошо известных в данной области, и используя другие легко доступные производные нитрилов и ацилирующие или акилирующие агенты, можно получать соединения 19, содержащие другие азотсодержащие гетероциклы, и превращать их в соединения данного изобретения. На схеме 6 представлен способ получения соединений формулы I, где Y = -NH2 или -NHR4,через глицидные эфиры 5. Так, реакция глицидных эфиров 5 с азидом натрия в водном этаноле дает азидоспирты 21. Кипячение с обратным холодильником азидоспиртов с трифенилфосфином в ацетонитриле приводит к образованию азиридинов 22. Азиридины подвергают раскрытию кольца с помощью тиола. HSR1 (с последующим окислением с помощью МСРВА до сульфона) или солей сульфиновой кислоты, с получением -аминоэфиров. Этой реакции способствует использование бортрифторидэтерата как катализатора на основе кислоты Льюиса в хлористом метилене. См.: J. Org. Chem., Vol. 60,р. 790 (1995). Соединения 23 превращают в аминокислоты 24, а затем в гидроксаматы 25 способами, представленными на схеме 1. Аминогруппы соединений 22, 23, 24 или 25 могут быть защищены Вос-группой или другой аминозащищающей группой способами, хорошо известными специалистам в данной области. Получение соединений формулы I, где Y =F, можно проводить согласно способам, представленным на схеме 7. -Гидроксиэфиры 7 превращают в -фторэфиры 26, применяя диэтиламиносеры трифторид (DAST) в растворителе, таком как хлористый метилен, при температурах от 0 С до комнатной температуры. См.J. Оrg. Chem., Vol. 40, р. 574 (1975). Соединения 26 превращают в -фторгидроксамовые кислоты 27 согласно способам, представленным в схеме 1. Химический процесс на схемах 1-7 происходит через ахиральные или рацемические интермедиаты, а чистые энантиомеры конечных продуктов получают разделением интермедиатов 5-9,14-19, 21-24 или 26 или конечных продуктов 10, 20, 25 или 27 с помощью хиральной хроматографии или классических способов получения производных, таких как образование хиральных солей интермедиатов карбоновых кислот, таких как 8 или 24. 8 В данном изобретении предлагаются новые соединения формулы 8 или их фармацевтически приемлемые соли, гдеR1, R2 и Y являются такими, как описано выше. Примеры соединений формулы 8 представляют собой следующее: 2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фторбензолсульфонил)пропионовую кислоту,2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-н-бутилбензолсульфонил) пропионовую кислоту или 2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)пропионовую кислоту. Фармацевтические композиции данного изобретения готовят, комбинируя соединения формулы I этого изобретения с твердым или жидким фармацевтически приемлемым носителем и, возможно, с фармацевтически приемлемыми адьювантами и наполнителями, применяя стандартные и общепринятые технологии. Твердые формы композиций включают в себя порошки, таблетки, диспергируемые гранулы,капсулы и суппозитории. Твердый носитель может быть, по меньшей мере, одним веществом, которое также может функционировать как растворитель, вкусовое вещество, солюбилизатор, смазка, суспендирующий агент, смазывающее вещество, дезинтегрирующий таблетку агент и инкапсулирующий агент. Инертные твердые носители включают в себя карбонат магния, стеарат магния, тальк, сахар, лактозу,пектин, декстрин, крахмал, желатин, целлюлозные материалы, воск с низкой температурой плавления, масло какао и подобное. Жидкие формы композиций включают в себя растворы,суспензии и эмульсии. Например, они могут быть растворами соединений данного изобретения, растворенных в воде, в системах водапропиленгликоль и вода-полиэтиленгликоль,возможно содержащими общепринятые красящие вещества, вкусовые добавки, стабилизаторы и загустители. Фармацевтичекую композицию готовят с помощью общепринятых технологий. Предпочтительно композиция представлена в виде однократной дозы, содержащей эффективное количество активного компонента, который представляет собой соединения формулы I согласно изобретению. Количество активного компонента, который представляет собой соединения формулы I согласно изобретению, в фармацевтической композиции и ее одноразовой дозированной форме можно изменять и устанавливать в зависимости от определенного способа применения 9 эффективности данного соединения и требуемой концентрации. Обычно количество активного компонента колеблется от 5 до 90 вес.% композиции. При терапевтическом применении для лечения пациента, страдающего от или предрасположенного к заболеваниям, при которых имеет место разрушение соединительной ткани, или для ингибирования различных ферментов из семейства матриксных металлопротеиназ,включая коллагеназу, стромелизин и желатиназу, соединения или их фармацевтические композиции вводят перорально, парентерально и/или местно, в дозе, которая позволит достичь и поддерживать концентрацию, которая является количеством или уровнем в крови активного компонента у пациента, подвергающегося лечению, которое оказывается эффективным для ингибирования таких ферментов. Обычно эффективное количество активного соединения колеблется в пределах от 0,1 до 100 мг/кг. Понятно, что дозировки можно изменять в зависимости от потребностей пациента, тяжести поражения соединительной ткани, которое лечат, и конкретных используемых соединений. Также ясно, что начальная дозировка может быть назначена и выше вышеупомянутого верхнего уровня, для быстрого достижения требуемого уровня в крови, или же начальная доза может быть ниже оптимальной, а еженедельную дозу можно прогрессивно увеличивать в ходе лечения в зависимости от определенной ситуации. Если необходимо, суточную дозу делят на многократные дозы введения, например, от двух до четырех раз в день. Соединения данного изобретения ингибируют различные ферменты из семейства матриксных металлопротеиназ, преимущественно стромелизин и желатиназу, и, следовательно,они полезны для лечения вызванных матриксными металло-эндопротеиназами заболеваний,таких как остеоартрит, ревматоидный артрит,септический артрит, остеопении, такие как остеопороз, опухолевое метастазирование (инвазия и рост), периодонтит, гингивит, изъязвление роговицы, изъязвление кожи, язва желудка, воспаление, астма и другие заболевания, связанные с деградацией соединительной ткани. Такие заболевания и состояния хорошо известны и легко диагностируются врачом-специалистом. Фармацевтические композиции для парентерального введения обычно содержат фармацевтически приемлемое количество соединений формулы I в виде растворимой соли (соль присоединения кислот или основная соль), растворенной в фармацевтически приемлемом жидком носителе, таком, например, как вода для инъекций и подходящий забуференный изотонический раствор, имеющий рН около 3,5-6. Приемлемые забуферивающие агенты включают в себя, кроме прочего, например, тринатрийортофосфат, бикарбонат натрия, цитрат натрия, N 003585 10 метилглюкамин, L(+)-лизин и L(+)-аргинин. Обычно соединения формулы I растворяют в носителе в количестве, достаточном, чтобы обеспечить фармацевтически приемлемую вводимую концентрацию в пределах приблизительно от 1 до 400 мг/мл. Полученную жидкую фармацевтическую композицию нужно вводить с тем расчетом, чтобы получить вышеупомянутую эффективную ингибирующую дозировку. Соединения формулы I согласно изобретению успешно вводят перорально в твердой и жидкой дозированных формах. Соединения данного изобретения и их получение становятся более понятными благодаря следующим примерам, которые предназначены для иллюстрации изобретения, но не ограничивают его. Пример 1. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил)пропионамида. Стадия 1. Получение этилового эфира 2[(4-метоксибензолтио)метил]акриловой кислоты. К смеси этилбромметилакрилата (1,6 г, 8,3 ммоль) и 1,0 мл (8,1 ммоль) 4-метокситиофенола в этаноле, охлаждаемой на бане ледвода, добавляют по каплям и при перемешивании 8 мл 1 М водного раствора бикарбоната натрия. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 6 ч. Затем смесь концентрируют, обрабатывают этилацетатом и дважды промывают водной 10% хлористо-водородной кислотой и один раз солевым раствором. Смесь сушат над сульфатом натрия и упаривают в вакууме до светло-желтого масла. Хроматография на силикагеле с элюированием метиленхлоридом дает указанное в заголовке соединение в виде бесцветного масла. 1H ЯМР(СDСl3)7,33, 6,82, 6,07, 5,32, 4,2,3,78, 3,63, 1,31. Стадия 2. Получение этилового эфира 2-(4 метоксибензолсульфонил)метилоксиранкарбоновой кислоты. К этиловому эфиру 2-[(4-метоксибензолсульфонил)метил]акриловой кислоты (38,4 г,0,152 ммоль) в 200 мл этилендихлорида добавляют небольшое количество ингибитора радикалов 4,4'-тиобис-(6-трет-бутил-3-метилфенола)(МСРВА, 154 г) добавляют порциями в течение приблизительно 45 мин. Реакционная смесь становится тяжелой белой взвесью. Для облегчения перемешивая, добавляют еще этилендихлорид(150 мл). Реакционную смесь кипятят с обратным холодильником в течение ночи, затем охлаждают и концентрируют при пониженном давлении. Остаток смешивают с этилацетатом(250 мл) и водным сульфатом натрия. Затем медленно добавляют твердый бикарбонат калия. 11 Фазы разделяют и водную фазу экстрагируют дополнительным количеством этилацетата (100 мл). Объединенные органические фазы промывают несколькими порциями водного бикарбоната калия, затем насыщенным солевым раствором и, наконец, сушат над сульфатом магния. Фильтрация и упаривание дают сырой продукт в виде бледно-желтого масла. Хроматография на силикагеле с градиентным элюированием от 40 до 60% этилацетатом в гексане дает указанное в заголовке соединение. Т.пл. 77-79 С; 1H ЯМР (DМSО-d6)7,78, 7,16, 4,11, 4,04,3,85, 3,73, 2,95, 1,16. 13 С ЯМР (DМSО-d6)168,4, 164,3, 132,3,131,0, 115,3, 62,5, 58,5, 56,6, 53,2, 51,6, 14,6. Стадия 3. Получение этилового эфира 2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-фенилбензолтио)пропионовой кислоты. Гидрид натрия (0,212 г, 60% в масле) помещают в колбу и промывают гексаном. Гексан декантируют. Бифенилмеркаптан (0,82 г, 5,3 ммоль) добавляют в виде раствора в сухом тетрагидрофуране (25 мл). Происходит вспенивание и образуется гетерогенная смесь. Реакцию перемешивают в течение 5 мин при комнатной температуре, а затем добавляют раствор этилового эфира 2-(4-метоксибензолсульфонил) метилоксиранкарбоновой кислоты (1,46 г, 4,9 ммоль) в 25 мл сухого тетрагидрофурана. Смесь, которая опять становится желтой, перемешивают в течение ночи при комнатной температуре. Реакцию гасят 1 н. НСl и тетрагидрофуран удаляют при пониженном давлении. Продукт экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, фильтруют, концентрируют и хроматографируют на силикагеле с получением указанного в заголовке соединения в виде белого твердого продукта. 1H ЯМР (СDСl3)7,81, 7,6-7,35, 6,98, 4,11,3,98, 3,87, 3,68, 3,28, 1,21. Стадия 4. Получение этилового эфира 2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-фенилбензолсульфонил)пропионовой кислоты. К раствору этилового эфира 2-гидрокси-2[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолтио)пропионовой кислоты (0,99 г, 2 ммоль) в 100 мл хлористого метилена добавляют твердый МСРВА (1,3 г, 68 мас.%). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Метиленхлорид удаляют при пониженном давлении и остаток распределяют между этилацетатом и водным сульфитом натрия. Органическую фазу промывают несколькими порциями водного бикарбоната калия, чтобы удалить м-хлорбензойную кислоту. Затем промывают солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют с получением указанного в заголовке соединения в виде белого твердого продукта.H ЯМР (СDСl3)7,92, 7,80-7,72, 7,6, 7,47,6,97, 4,29, 3,97, 3,86-3,58, 1,36. Стадия 5. Получение 2-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил)пропионовой кислоты. К раствору этилового эфира 2-гидрокси-2[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил)пропионовой кислоты(0,70 г, 1,3 ммоль) в 25 мл метанола добавляют гидроксид натрия (25 ммоль в 10 мл воды). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч и затем гасят добавлением 25 мл 1 н. НСl. Метанол удаляют при пониженном давлении и продукт экстрагируют несколькими порциями этилацетата. Органическую фазу промывают солевым раствором, сушат над сульфатом магния, фильтруют и концентрируют с получением указанного в заголовке соединения в виде белого твердого продукта. 1H ЯМР (СDСl3)7,95, 7,82-7,72, 7,617,46, 6,98, 3,86, 3,86-3,70. Стадия 6. Получение N-бензилокси-2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-фенилбензолсульфонил)пропионамида. К 2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил)пропионовой кислоте (0,6 г, 1,2 ммоль) в 50 мл метиленхлорида добавляют моногидрат 1 гидроксибензотриазола (0,185 г, 1,36 ммоль),гидрохлорид O-бензилгидроксиламина (0,218 г,1,36 ммоль), диизопропилэтиламин (0,177 г,1,36 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC, 0,262 г, 1,36 ммоль) в таком порядке. Прозрачный бесцветный раствор перемешивают в течение ночи при комнатной температуре. Метиленхлорид удаляют при пониженном давлении и остаток распределяют между этилацетатом и водой. Органическую фазу промывают несколькими порциями 1 н. НСl и затем водным бикарбонатом калия. Сушат над сульфатом магния, фильтруют, концентрируют и хроматографируют на силикагеле. Элюирование с помощью этилацетат:гексан 1:1 дает указанное в заголовке соединение в виде белого твердого продукта. 1H ЯМР (СDСl3)7,95, 7,83-7,74, 7,5-7,25,7,01, 4,99, 3,88, 4,0-3,6. Стадия 7. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-фенилбензолсульфонил)пропионамида. Смесь N-бензилокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил)пропионамида (0,152 г), 10% палладия на углероде и 50 мл абсолютного этанола под давлением 20 psi водорода перемешивают в течение ночи при комнатной температуре. Смесь фильтруют через пад целита, промывая этанолом и этилацетатом. Концентрирова 13 ние фильтрата дает указанное в заголовке соединение. Т. пл. 72-76 С (размягчение), 120-125 СH ЯMP (DMSO-d6)7,9-7,6, 7,55-7,40, 7,17,0, 3,82, 3,9-3,7. Стадия 8. Разделение рацемического Nгидрокси-2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фенилбензолсульфонил) пропионамида методом хиральной хроматографии с получением энантиомера А и энантиомера В. Хиральную хроматографию проводят на препаративной колонке Chiralpak AD 5,050 см, элюируя метанолом при 70 мл/мин. Полученные в результате этой хроматографии два образца отдельно растворяют в метаноле, перемешивают с активированным древесным углем,фильтруют через целит и упаривают досуха с получением очищенных энантиомера А и энантиомера В. Пример 2. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-фторбензолсульфонил)пропионамида. В соответствии с основным методом, описанным в примере 1 (стадии 1-7), и проводя несущественные модификации, но исходя из пфторфенилмеркаптана на стадии 3 вместо бифенилмеркаптана, получают указанное в заголовке соединение. Т. пл. 85-90 С (размягчение), 110-115 СH ЯMP (DMSO-d6)10,6, 8,86, 7,92-7,87,7,75-7,72, 7,46-7,40, 7,11-7,08, 5,64, 3,85-3,69. Пример 3. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-н-бутилбензолсульфонил)пропионамида. В соответствии с основным методом, описанным в примере 1 (стадии 1-7), и проводя несущественные модификации, но исходя из п-нбутилфенилмеркаптана на стадии 3 вместо бифенилмеркаптана, получают указанное в заголовке соединение. Т.пл. 63-68 С (размягчение), 150-160 СH ЯМР (DМSО-d6)10,6, 7,76-7,71, 7,437,40, 7,11-7,08, 5,6, 3,75-3,72, 2,70-2,65, 1,601,55, 1,35-1,27, 0,93-0,88. Пример 4. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил) метил]-3-(4-метоксибензолсульфонид)пропионамида. В соответствии с основным методом, описанным в примере 1 (стадии 1-7), и проводя несущественные модификации, но исходя из пметоксифенилмеркаптана на стадии 3 вместо бифенилмеркаптана, получают указанное в заголовке соединение в виде белого твердого продукта.C ЯMP (DMSO-d6)166,6, 163,5, 13,1,130,7, 114,7, 73,5, 62,0, 56,2; ИК (пленка) см-1 3417, 3342, 3316, 3102,3077, 1682, 1597, 1581, 1520, 1498, 1324, 1295,1271, 1257, 1150, 1089, 1074. Рассчитано для C18H21NO9S2: С 47,05, Н 4,61, N 3,05,найдено: С, 47,01, Н, 4,56, N, 3,07. Пример 5. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-бензолкарбониламино)пропионамида. Стадия 1. Получение этилового эфира 2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-бензолкарбониламино)пропионовой кислоты. Этиловый эфир 2-(4-метоксибензолсульфонил)метилоксиранкарбоновой кислоты (из примера 1, стадия 2, 0,3 г, 1 ммоль), эфират трифторида бора (0,495 мл, 4,0 ммоль) и бензонитрил (0,36 мл, 4,0 ммоль) растворяют в 40 мл метиленхлорида. Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение трех дней с добавлением два раза 0,50 мл эфирата трифторида бора. Растворитель удаляют при пониженном давлении. Остаток растворяют в этилацетате и промывают насыщенным бикарбонатом натрия и солевым раствором и сушат над сульфатом магния. Неочищенный продукт растворяют в 40 мл абсолютного этанола. Добавляют щавелевую кислоту (0,30 г, 3,3 ммоль) и раствор нагревают при 65 С в течение 19 ч. Растворитель удаляют при пониженном давлении. Маслянистый остаток растворяют в этилацетате и промывают насыщенным раствором бикарбоната натрия и солевым раствором и сушат над сульфатом магния. Хроматография на силикагеле с элюированием этилацетатом:гексаном 1:1 дает указанное в заголовке соединение в виде белого твердого продукта. 1MC (ES+) 422,1 (M+H), (ES-) 420,1 (М-Н). Стадия 2. Получение 2-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-(N-бензолкарбониламино)пропионовой кислоты. Раствор этилового эфира 2-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-(N-бензолкарбониламино)пропионовой кислоты (0,27 г) в 4 мл метанола перемешивают с 1 мл 1 н. гидроксида натрия в течение 3 ч. Реакционную смесь подкисляют 1 н. НСl и растворитель удаляют при пониженном давлении. Остаток дважды растирают в теплом этилацетате. Этилацетат удаляют, получая указанное в заголовке соединение в виде белого твердого продукта.MC (ES+) 394,1 (M+H), (ES-) 392,1 (М-Н). Стадия 3. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-бензолкарбониламино)пропионамида. 2-Гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-бензолкарбониламино)пропионовую кислоту (0,25 г, 0,63 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,24 г, 1,26 ммоль), гидрохлорид гидроксиламина (0,066 г, 0,95 ммоль) и 5 мл 1 метил-2-пирролидинона перемешивают в атмосфере азота при комнатной температуре в течение 4 ч. Добавляют диэтиловый эфир (100 мл) и смесь перемешивают в течение ночи. Эфир декантируют от масляного остатка. Масло дополнительно дважды промывают эфиром и затем хроматографируют на силикагеле, элюируя 20% гексаном и 4% уксусной кислотой в этилацетате. Указанное в заголовке соединение получают в виде белого порошка. 1MC (ES-) 406,9 (М-Н); МС с высоким разрешением (EI),рассчитано для C18H20N2O7S+H1 409,1069,найдено 409,1076. Пример 6. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-[N-(циклопентилкарбонил)амино]пропионамида. Следуя основному методу, описанному в примере 5 (стадии 1-3), и проводя несущественные модификации, но исходя из циклопентанкарбонитрила на стадии 1 вместо бензонитрила, указанное в заголовке соединение получают в виде белого твердого продукта. 1MC(ES+) 401,1 (М+Н), (ES-) 399,1 (М-Н) МС с высоким разрешением (EI),рассчитано для C17H24N2O7S+H1 401,1382,найдено 401,1378. Пример 7. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-(4-метоксибензолкарбонил)амино) пропионамида. Стадия 1. Получение 2-гидрокси-2-[(4 метоксибензолсульфонил)метил]-3-(N-(4 метоксибензолкарбонил)амино)пропионовой кислоты. Следуя основному методу, описанному в примере 5 (стадии 1 и 2), и проводя несущественные модификации, исходя из 4-метоксибензонитрила на стадии 1 вместо бензонитрила,получают указанное в заголовке соединение в виде белого твердого продукта. 1 16 Стадия 2. Получение N-гидрокси-2 гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-(4-метоксибензолкарбонил)амино) пропионамида. 2-Гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(N-(4-метоксибензолкарбонил) амино)пропионовую кислоту (100 мг, 0,24 ммоль), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (68 мг, 0,35 ммоль),гидрохлорид O-трет-бутилгидроксиламина (118 мг, 0,944 ммоль) и 4-метилморфолин (131 мг,0,354 ммоль) растворяют в 20 мл метиленхлорида. Реакционную смесь перемешивают в атмосфере азота в течение 6 ч. Растворитель удаляют при пониженном давлении и остаток растворяют в этилацетате. Органический слой промывают 1 н. гидросульфатом натрия, 5% бикарбонатом натрия и насыщенным солевым раствором и сушат над сульфатом магния. Растворитель удаляют с получением 71 мг белого твердого продукта, который перекристаллизовывают из метанола. Трет-бутилзащитную группу удаляют обработкой 50% трифторуксусной кислотой в метиленхлориде в течение 24 ч. Растворители удаляют и неочищенный продукт очищают с помощью хроматографии с обращенной фазой на колонке С 18 Vydac, используя элюирующую систему вода/ацетонитрил с получением указанного в заголовке соединения в виде белого твердого продукта. 1MC с высоким разрешением (EI),рассчитано для C19H22N2O8S + H1 439,1175,найдено 439,1195. Пример 8. Исследование биологической активности. Ингибирующую активность оценивают по одному или более ферментов ММР (стромелизину, желатиназе и коллагеназе) in vitro, используя флуоресцентный анализ концентрации частиц. Ингибитор связывает ММР-ферменты, что предотвращает деградацию субстрата стромелизином, желатиназой или коллагеназой. Субстрат присоединяют к флуоресцеину и фрагменту биотина. Интактный субстрат затем связывается с покрытой авидином частицей через фрагмент биотина. Частицу один раз промывают и сушат,флуоресцентный сигнал возникает после того как флуоресцентная группа связывается с частицей. В отсутствие ингибитора субстрат расщепляется ММР-ферментами и флуоресцентная группа удаляется, поэтому флуоресцентный сигнал нельзя определить. Исследуемые соединения растворяют в DMSO до требуемой концентрации, затем растворы разбавляют до 1:5 ММР-буфером (50 мМ трис-HCl, рН 7,5; 150 мМ NaCl, 0,02% NaN3). Готовят серии двукратных разведений каждого соединения. Концентрированный активированный раствор фермента переносят в каждую плашку исследуемых со 17 единений и смеси инкубируют при комнатной температуре в течение 15 мин. Затем после оттаивания субстрат ММР добавляют во все плашки и плашки инкубируют в темноте в течение 1-3 ч при комнатной температуре. На данном этапе субстратную смесь смешивают с 0,1% частицами полистирола, покрытыми авидином. Через 15 мин после фильтрации и промывания гранул измеряют величину флуоресценции и рассчитывают значение Ki. Результаты ингибирования для соединений этого изобретения представлены в таблице. Полагают, что соединения с более низким значением Ki являются наиболее эффективными ингибиторами ММР. Полагают, что соединение с Ki менее 15 мкМ против стромелизина будет проявлять терапевтическое действие при поражениях соединительной ткани. Таблица Константы ингибирования ММР (Ki, мкМ) для соединений согласно изобретению Пример или его фармацевтически приемлемая соль,где R1 представляет собой фенил, замещенный C1-4 акилом, C1-4 алкокси, галогеном или фенилом;R2 представляет собой фенилсульфонилметил, замещенный C1-4 алкилом, C1-4 алкокси,галогеном или фенилом; или представляет собой группу -CH2NHC(=O)R3, где R3 представляет собой С 5-6 циклоалкил или фенил, необязательно замещенный C1-4 алкокси; или его фармацевтически приемлемая соль, гдеR1, R2 и Y такие, как указано в п.1. 4. Соединение по п.3, которое представляет собой 2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-фторбензолсульфонил)пропионовую кислоту,2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-н-бутилбензолсульфонил)пропионовую кислоту или 2-гидрокси-2-[(4-метоксибензолсульфонил)метил]-3-(4-метоксибензолсульфонил)пропионовую кислоту. 5. Способ ингибирования матриксной металлопротеиназы, включающий введение пациенту в случае необходимости эффективного количества соединения по п.1. 6. Способ по п.5, где указанная матриксная металлопротеиназа включает стромелизин, коллагеназу или желатиназу. 7. Способ по п.5, где эффективное количество соединения по п.1 вводят в фармацевтиче 22 ской композиции перорально, парентерально или местно. 8. Способ по п.5, где указанное соединение вводят в количестве приблизительно от 0,1 до 100 мг/кг веса тела/день. 9. Способ лечения человека, страдающего от или предрасположенного к заболеванию,включающему деградацию соединительной ткани, который включает введение пациенту в случае необходимости эффективного количества соединения по п.1. 10. Способ по п.9, где заболеванием, связанным с деградацией соединительной ткани,является остеоартрит, ревматоидный артрит,септический артрит, остеопения, остеопороз,опухолевое метастазирование (инвазия и рост),периодонтит, гингивит, изъязвление роговицы,изъязвление кожи, язва желудка, воспаление или астма. 11. Способ по п.9, где эффективное количество соединения по п.1 вводят в фармацевтической композиции перорально, парентерально или местно. 12. Способ по п.9, где указанное соединение вводят в количестве приблизительно от 0,1 до 100 мг/кг веса тела/день. 13. Фармацевтическая композиция, которая содержит эффективное для ингибирования матриксной металлопротеиназы количество соединения по п.1 и фармацевтически приемлемый носитель. 14. Применение соединения по п.1 в качестве лекарственного средства. 15. Применение соединения по п.1 для производства лекарственного средства для ингибирования матриксной металлопротеиназы у человека, страдающего от или предрасположенного к заболеванию, включающему в себя деградацию соединительной ткани. 16. Применение по п.15, где указанная матриксная металлопротеиназа включает коллагеназу, стромелизин или желатиназу. 17. Применение по п.15, где заболеванием,связанным с деградацией соединительной ткани, является остеоартрит, ревматоидный артрит,септический артрит, остеопения, остеопороз,опухолевое метастазирование (инвазия и рост),периодонтит, гингивит, изъязвление роговицы,изъязвление кожи или язва желудка.
МПК / Метки
МПК: C07C 317/44, A61K 31/165, A61P 19/04
Метки: металлопротеиназ, ингибиторов, матриксных, качестве, амино, beta;-сульфонилгидроксамовых, галоидные, alpha;-гидрокси, производные, кислот
Код ссылки
<a href="https://eas.patents.su/12-3585-alpha-gidroksi-amino-i-galoidnye-proizvodnye-beta-sulfonilgidroksamovyh-kislot-v-kachestve-ingibitorov-matriksnyh-metalloproteinaz.html" rel="bookmark" title="База патентов Евразийского Союза">α-гидрокси, -амино и галоидные производные β-сульфонилгидроксамовых кислот в качестве ингибиторов матриксных металлопротеиназ</a>
Следующий патент: Кормовая добавка для рыб
Случайный патент: Гербицидная композиция












