Производные гигромицина а в качестве антибактериальных агентов
Формула / Реферат
1. Соединение формулы
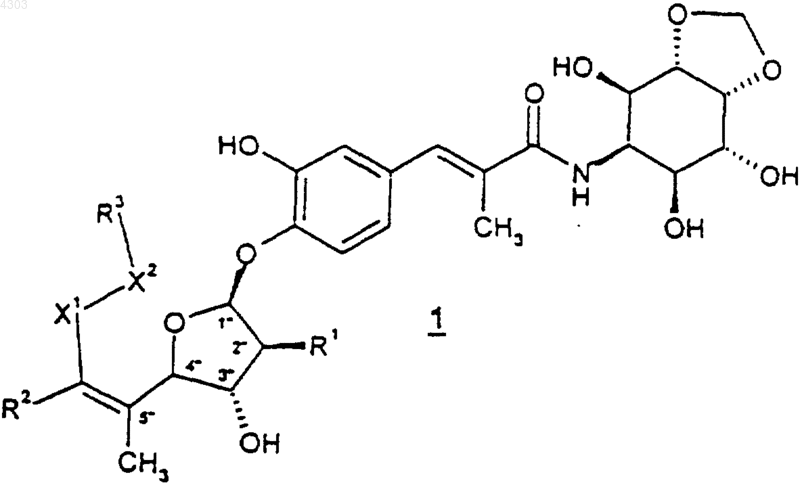
или его фармацевтически приемлемые соль, пролекарство или сольват,
где каждый X1 представляет собой -CR6R7- и X2 представляет собой O;
R1 представляет собой H или OH;
R2 представляет собой H или C1-C6алкил;
каждый R3 независимо выбран из H, -(CR6R7)t(C6-C10арил), -(CR6R7)t(4-10-членный гетероцикл), -C(O)(CR6R7)t(C6-C10арил) и -C(O)NR6(CR6R7)t(C6-C10арил), где t представляет собой целое число в диапазоне от 0 до 1, и арильные группировки вышеупомянутых групп R3 возможно замещены 1-3 группами R4;
каждый R4 независимо выбран из C1-C10алкила, галогено, циано, трифторметила, C1-C6алкокси, -(CR6R7)m(C6-C10арил) и -C(O)(CR6R7)m(C6-C10арил), где m представляет собой 0;
каждый R6 и R7 представляет собой H.
2. Соединение по п.1, где R3 представляет собой -(CR6R7)t(C6-C10арил), где t такой, как определено выше, а указанная арильная группа возможно замещена одной группой R4.
3. Соединение по п.2, где указанная арильная группа представляет собой фенильную группу, возможно замещенную одной группой R4.
4. Соединение по п.1, где R3 представляет собой -(CR6R7)t(4-10-членный гетероцикл), где t представляет собой 0.
5. Соединение по п.4, где указанная гетероциклическая группа представляет собой пиридильную группу.
6. Соединение по п.1, где R3 представляет собой -C(O)(CR6R7)t(C6-C10арил), где t равно 0, а указанная арильная группа возможно замещена одной группой R4.
7. Соединение по п.6, где указанная арильная группа представляет собой фенильную группу, возможно замещенную одной группой R4.
8. Соединение по п.1, где R3 представляет собой -C(O)NR6(CR6R7)t(C6-C10арил), где t представляет собой 0.
9. Соединение по п.8, где указанная арильная группа представляет собой фенильную группу.
10. Соединение по п.1, выбранное из группы, состоящей из
3-(4-((2S,3S,4S,5R)-3,4-дигидрокси-5-(3-гидрокси-1-метил-(1E)-пропенил)-тетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-бензилокси-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(3-хлорбензилокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(бифенил-2-илметокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-трет-бутилбензилокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-фторбензилокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира бензойной кислоты;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира 4-метоксибензойной кислоты;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира 2-фторбензойной кислоты;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира 3-хлорбензойной кислоты;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира 4-трифторметилбензойной кислоты;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира бензилкарбаминовой кислоты;
3-((2S,3S,4S,5R)-3,4-дигидрокси-5-(2-гидрокси-4-(2-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-илкарбамоил)-(1E)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2E)-бут-2-енилового эфира фенилкарбаминовой кислоты;
3-(4-((2S,3S,4S,5R)-5-(3-(3-хлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(3-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(3,5-дифторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-хлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-хлор-3-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(3,5-дихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(пиридин-3-илокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(3-хлор-4-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5S)-5-(3-(3-метоксифенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,4-дихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,4-дифторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,6-дифторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-фтор-2-пропилфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-фенокси-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-бензилфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-бензоил-4-хлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-цианофенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(индан-4-илокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-хлор-2-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,6-дихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-5-фторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,3,4-трихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,3-дихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,5-дихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,5-дихлорфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлорфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-фторфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,4-дихлорфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-5-фторфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-3,5-дифторфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-3,5-дифторфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,4,5-трихлорфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2,4,5-трихлорфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-фтор-2-трифторметилфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(4-фтор-2-трифторметилфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-трифторметилфенокси)-1-метил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-трифторметилфенокси)-1-метил-(1E)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1,2-диметил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,3S,4S,5R)-5-(3-(2-хлорфенокси)-1,2-диметил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1-метил-(1Z)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2,3-дихлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2,3,4-трихлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2,4,5-трихлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2,5-дихлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(3-хлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(3-фторфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2,4-дифторфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2-хлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2,4-дихлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2-хлор-5-фторфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2-хлор-3,5-дифторфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(3,5-дифторфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(3-фтор-4-хлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида;
3-(4-((2S,4S,5R)-5-(3-(2-фтор-4-хлорфенокси)-1-метил-(1E)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-((3aS,4R,5R,6S,7R,7aR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2E)-акриламида и
фармацевтически приемлемых солей вышеупомянутых соединений.
11. Фармацевтическая композиция для лечения бактериальной инфекции, протозойной инфекции или расстройства, связанного с бактериальной инфекцией или протозойной инфекцией, у млекопитающего, рыбы или птицы, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
12. Способ получения соединения формулы
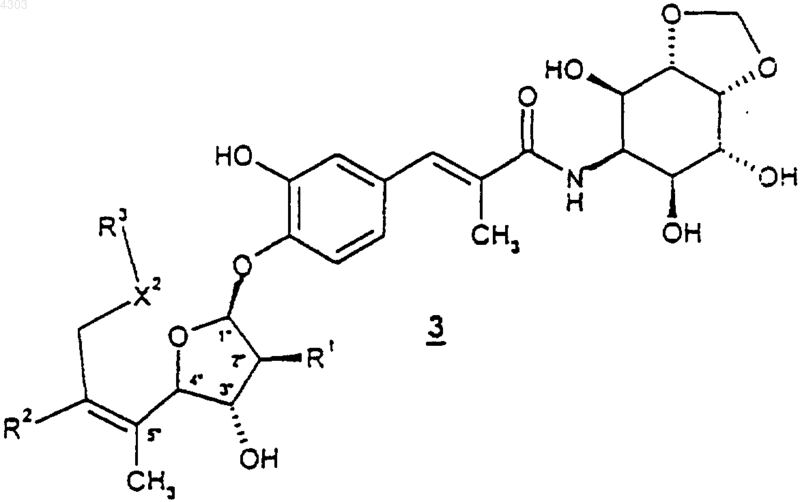
или его фармацевтически приемлемых соли или сольвата,
где X2 представляет собой O;
R1 представляет собой H или OH;
R2 представляет собой H или C1-C6алкил;
R3 представляет собой -(CR6R7)t(C6-C10арил), где t представляет собой целое число от 0 до 1, а арильная группировка вышеупомянутой группы R3 возможно замещена 1-3 группами R4;
каждый R4 независимо выбран из C1-C10алкила, галогено, циано, трифторметила, C1-C6алкокси, -(CR6R7)m(C6-C10арил) и -C(O)(CR6R7)m(C6-C10арил), где m представляет собой 0;
каждый R6 и R7 представляет собой H;
при котором соединение формулы
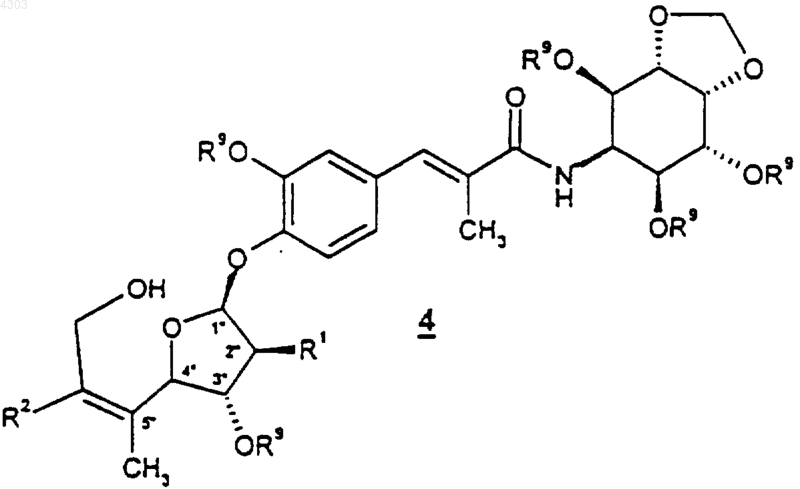
где R1 и R2 такие, как определено выше, при условии, что если R1 представляет собой гидрокси, он защищен в виде -OR9, a R9 представляет собой защитную группу гидроксила, обрабатывают соединением формулы H-X2-(CR6R7)t(C6-C10арил), где t равно 0, а X2, R6 и R7 такие, как определено выше, в присутствии трифенилфосфина и диэтилового эфира азодикарбоновой кислоты, с последующим снятием защиты с R9-защищенных гидроксигрупп.
13. Способ по п.12, где R9 представляет собой силильную группу.
Текст
1 Предпосылки изобретения Данное изобретение относится к новым производным гигромицина А, которые полезны в качестве антибактериальных и антипротозойных агентов у млекопитающих, включая человека, а также у рыбы и птиц. Данное изобретение также относится к фармацевтическим композициям, содержащим эти новые соединения, и к способам лечения бактериальных и протозойных инфекций у млекопитающих, рыбы и птиц путем введения новых соединений млекопитающим, рыбам и птицам, нуждающимся в таком лечении. Гигромицин А представляет собой полученный ферментацией природный продукт,впервые выделенный из Streptomyces hygroscopicus в 1953 г. В качестве антибиотика гигромицин А обладает активностью против патогенов человека, и сообщают, что он обладает сильной in vitro активностью против Serpulina(Treponema) hyodysenteriae, которая вызывает дизентерию свиней. Некоторые ссылки относятся к полусинтетическим модификациям гигромицина А, включая следующее: о получении из 5"-кетона гигромицина А производного 2,4 динитрофенилгидразона сообщается в K. IsonoIsono et al., там же также упоминается тиосемикарбазон в 5"; о восстановлении 5"-кетона гигромицина А до 5"-спирта сообщается в R.L.Hecker et al., Bioorg. Med. Chem. Lett. 1993, 3,295; фуранозные аналоги упоминаются в В.Н.Jaynes et al., Bioorg. Med. Chem. Lett. 1993, 3,1531 и В.Н. Jaynes et al., J. Antibiot. 1992, 45,1705; аналоги с ароматическим кольцом упоминаются в S.J. Hecker et al., Bioorg. Med. Chem.Chem. Lett. 1992, 2, 533; аминоциклитольные аналоги упоминаются в S.J. Hecker et al., Bioorg.al., Bioorg. Med. Chem. Lett. 1992, 2, 1043. Производные гигромицина А по настоящему изобретению обладают широким спектром активности против как грамотрицательных и грамположительных бактерий, так и простейших. Производные гигромицина А также описаны и заявлены в предварительных заявках на патент США под номерами 60/084042 (подана 4 мая 1998 г.) и 60/084058 (подана 4 мая 1998 г.), причем обе эти предварительные заявки США включены сюда полностью путем ссылки. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям формулы и к их фармацевтически приемлемым солям и сольватам, где каждый X1 выбран из -CR6R7-, -S(O)n-, гдеn представляет собой число от 0 до 2, -NR6- и связи, и X2 выбран из -CR6R7-, -S(O)n-, где n представляет собой число от 0 до 2, -NR6-, О и связи, за исключением того, что (а) если либоX1, либо X2 представляет собой S или S(O), тогда другая группировка (X1 или X2) представляет собой -CR6R7- или связь; (б) если либо X1,либо X2 представляет собой SО 2, тогда другая группировка (X1 или X2) представляет собойX1 должен представлять собой -CR6R7-;R2 представляет собой Н, C1-С 6 алкил или галогено, причем вышеупомянутая алкильная группа R2 возможно замещена 1 или 2 группамиR4; или если X2 представляет собой -NR6-, тогда R3 и X2 могут быть взяты вместе с образованием 5-12-членного кольца, причем указанное кольцо является насыщенным или частично ненасыщенным с двойными углерод-углеродными связями в количестве до 3, при этом атомы углерода указанного кольца возможно замещены 1-3 группами R4, и это кольцо возможно содержит до 2 дополнительных гетерогруппировок (в дополнение к группировке X2, которая представляет собой -NR6-), выбранных из О, S(O)j,где j представляет собой целое число от 0 до 2, и-NR6-, при условии, что два атома О, два атомаS, атом О и S, атом N и О и атом N и S не соединены непосредственно друг с другом; каждый R3 независимо выбран из Н, C1 С 10 алкила, -(СR6R7)t(С 6-С 10 арил), -(СR6R7)t(4-10 членный гетероцикл), -C(О)(СR6R7)t(С 6-С 10 арил), -C(O)(СR6R7)t(4-10-членный гетероцикл),-C(O)NR6(СR6R7)t(C6-C10apил) и -С(O)NR6(СR6R7)t(4-10-членный гетероцикл), где t представляет собой целое число в диапазоне от 0 до 5, причем указанная алкильная группа возможно содержит 1 или 2 гетерогруппировки, выбранные из О,-S(O)j-, где j представляет собой целое число в диапазоне от 0 до 2, и -NR6-, при условии, что два атома О, два атома S, атом О и S, атом N и О и атом N и S не соединены непосредственно друг с другом; группировки -(СR6R7)t- вышеупомянутых групп R3 возможно включают в себя двойную или тройную углерод-углеродную связь, причем t представляет собой целое число от 2 до 5; а гетероциклические и арильные 3 группировки вышеупомянутых групп R3 возможно замещены 1-5 группами R4; каждый R4 независимо выбран из C1-С 10 алкила, С 2-С 10 алкенила, С 2-С 10 алкинила, галогено, циано, нитро, трифторметила, трифторметокси, азидо, гидрокси, C1-С 6 алкокси, -C(O)R5,-C(O)OR5, -NR6C(O)OR8, -OC(O)R5, -NR6SO2R8,-SO2NR5R6, -NR6C(O)R5, -CONR5R6, -NR5R6,-S(О)j(СR6R7)m(С 6-С 10 арил), -S(O)j(C1-С 6 алкил),-(СR6R7)m(C6-С 10 арил), -О(СR6R7)m(C6-С 10 арил),-NR6(СR6R7)m(С 6-С 10 арил), -(СR6R7)m(4-10-членный гетероцикл), -C(О)(СR6R7)m(С 6-С 10 арил) и-C(O)(CR6R7)m(4-10-члeнный гетероцикл), где m представляет собой целое число от 0 до 4, j представляет собой целое число от 0 до 2, а указанные алкильные, алкенильные, алкинильные,арильные и гетероциклические группировки вышеупомянутых групп R4 возможно замещены 1-3 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -NR6SO2R8, -SO2NR5R6,-C(O)R5, -C(O)OR5, -OC(O)R5, -NR6C(O)OR8,-NR6C(O)R5, -C(O)NR5R6, -NR5R6, -OR5, C1 С 10 алкила, -(СR6R7)m(C6-С 10 арил) и (СR6R7)m(410-членный гетероцикл), где m представляет собой целое число от 0 до 4; каждый R5 независимо выбран из Н, C1-С 10 алкила, -(СR6R7)m(С 6-С 10 арил) и -(СR6R7)m(4-10 членный гетероцикл), где m представляет собой целое число от 0 до 4, а вышеупомянутые заместители R5, за исключением Н, возможно замещены 1-3 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -C(O)R6,-C(O)OR6, -OC(O)R6, -NR6C(O)R7, -C(O)NR6R7,-NR6R7, гидрокси, C1-С 6 алкила и С 1-С 6 алкокси; каждый R6 и R7 независимо представляет собой Н, -С(O)(С 1-С 6 алкил), С 1-С 6 алкил или фторо; иR8 не является Н. Конкретные воплощения указанных соединений формулы 1 включают в себя такие, гдеX1 представляет собой -СН 2-, а X2 представляет собой О. Другие конкретные воплощения указанных соединений формулы 1 включают в себя такие,где X1 представляет собой -СН 2-, X2 представляет собой О, а R3 представляет собой-(СR6R7)t(С 6-С 10aрил), где t такое, как определено выше, R6 и R7 оба представляют собой Н, а указанная арильная группа возможно замещена 1-4 группами R4. В более конкретном воплощении указанная арильная группа представляет собой фенильную группу, возможно замещенную 1-4 группами R4. Другие конкретные воплощения указанных соединений формулы 1 включают в себя такие,где X1 представляет собой -СН 2-, X2 представляет собой О, а R3 представляет собой 4 как определено выше, R6 и R7 оба представляют собой Н, а указанная гетероциклическая группа возможно замещена 1-4 группами R4. В более конкретном воплощении указанная гетероциклическая группа представляет собой пиридильную группу или бензотиазолильную группу,возможно замещенную 1-4 группами R4. Другие конкретные воплощения указанных соединений формулы 1 включают в себя такие,где X1 представляет собой -СН 2-, X2 представляет собой О, и R3 представляет собой-С(O)(СR6R7)t(С 6-С 10 арил), где t такое, как определено выше, R6 и R7 оба представляют собой Н,а указанная арильная группа возможно замещена 1-4 группами R4. В более конкретном воплощении указанная арильная группа представляет собой фенильную группу, возможно замещенную 1-4 группами R4. Другие конкретные воплощения указанных соединений формулы 1 включают в себя такие,где X1 представляет собой -СН 2-, X2 представляет собой О, и R3 представляет собой-C(O)NR6(СR6R7)t(C6-C10apил), где t такое, как определено выше, R6 и R7 оба представляют собой Н, а указанная арильная группа возможно замещена 1-4 группами R4. В более конкретном воплощении указанная арильная группа представляет собой фенильную группу, возможно замещенную 1-4 группами R4. Конкретные предпочтительные соединения формулы 1 включают такие, которые выбраны из группы, состоящей из 3-(4-2S,3S,4S,5R)-3,4-дигидрокси-5-(3 гидрокси-1-метил-(1 Е)-пропенил)тетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,3S,4S,5R)-5-(3-бензилокси-1 метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,3S,4S,5R)5-(3-(3-хлорбензилокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,3S,4S,5R)-5-(3-(бифенил-2-илметокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,3S,4S,5R)-5-(3-(4-трет-бутилбензилокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,3S,4S,5R)-5-(3-(4-фторбензилокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокси 5 тетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира бензойной кислоты; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира 4 метоксибензойной кислоты; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира 2 фторбензойной кислоты; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира 3 хлорбензойной кислоты; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира 4-трифторметилбензойной кислоты; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира бензилкарбаминовой кислоты; 3-2S,3S,4S,5R)-3,4-дигидрокси-5-(2 гидрокси-4-(2-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5 илкарбамоил)-(1 Е)-пропенил)фенокси)тетрагидрофуран-2-ил)-(2 Е)-бут-2-енилового эфира фенилкарбаминовой кислоты; 3-(4-2S,3S,4S,5R)-5-(3-(3-хлорфенокси)1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,3S,4S,5R)-5-(3-(3-фторфенокси)1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригироксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,3S,4S,5R)-5-(3-(3,5-дифторфенокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 004303 10 3-(4-2S,3S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1,2-диметил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)4,6,7-тригидроксигексагидробензо(1,3)диоксол 5-ил)-(2 Е)-акриламида; 3-(4-2S,3S,4S,5R)-5-(3-(2-хлорфенокси)1,2-диметил-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1-метил-(1Z)-пропенил)-4-гидpoкcитeтpaгидpoфypaн-2-илoкcи)-3-гидpoкcифeнил)-2 мeтил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2-хлор-4-фторфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидрокси фенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо(1,3)диоксол-5-ил)(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(2,3-дихлор-4-фторфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2,3,4-трихлорфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2,4,5-трихлорфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2,5-дихлорфенокси)1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(3-хлорфенокси)-1 метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метилN-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(3-фторфенокси)-1 метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метилN-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2,4-дифторфенокси)1-метил-(1 Е)-пропенил)-4-гидpoкcитeтpaгидpoфypaн-2-илoкcи)-3-гидpoкcифeнил)-2-мeтил-N 11 3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(2-хлорфенокси)-1 метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(2,4-дихлорфенокси)1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(2-хлор-5-фторфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2-хлор-3,5-дифторфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(3,5-дифторфенокси)1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламида; 3-(4-2S,4S,5R)-5-(3-(3-фтор-4-хлорфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; 3-(4-2S,4S,5R)-5-(3-(2-фтор-4-хлорфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламида; и фармацевтически приемлемых солей вышеупомянутых соединений. Другие конкретные воплощения настоящего изобретения включают следующие соединения: 3-(4-(2S,3S,4S,5R)-5-[3-(бензотиазол-6 илокси)-1-метил-(1 Е)-пропенил]-3,4-дигидрокситетрагидрофуран-2-илокси-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо[1,3]диоксол-5-ил)акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(бензотиазол-6 илокси)-1-метил-(1Z)-пропенил]-3,4-дигидрокситeтpaгидpoфypaн-2-илoкси-3-гидроксифенил)-2-мeтил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо[1,3]диоксол-5-ил)акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(2-хлорпиридин-3 илокси)-1-метил-(1 Е)-пропенил]-3,4-дигидро 004303 14 3-4-[(2S,3S,4S,5R)-3,4-дигидрокси-5-(1 метил-2-фенилсульфамоил-(1Z)-винил)тетрагидрофуран-2-илокси]-3-гидроксифенил-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)акриламид; 3-4-[(2S,3S,4S,5R)-5-(2-фтор-1-метил-3 фенокси-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси]-3-гидроксифенил-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)акриламид; 3-4-[(2S,3S,4S,5R)-5-(2-фтор-1-метил-3 фенокси-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси]-3-гидроксифенил-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)акриламид и фармацевтически приемлемые соли и сольваты указанных соединений. Данное изобретение также относится к фармацевтической композиции для лечения расстройства, выбранного из бактериальной инфекции, протозойной инфекции и расстройств, связанных с бактериальными инфекциями или протозойными инфекциями, у млекопитающего, рыбы или птицы, содержащей терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Данное изобретение также относится к способу лечения расстройства, выбранного из бактериальной инфекции, протозойной инфекции и расстройств, связанных с бактериальными инфекциями или протозойными инфекциями, у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу получения соединений формулы и его фармацевтически приемлемых солей и сольватов, гдеR2 представляет собой Н, С 1-С 6 алкил или галогено, причем вышеупомянутая алкильная группа R2 возможно замещена 1 или 2 группамиR3 представляет собой -(СR6R7)t(С 6-С 10 арил), где t представляет собой целое число от 0 15 до 5, а арильная группировка вышеупомянутой группы R3 возможно замещена 1-5 группами R4; каждый R4 независимо выбран из С 1-С 10 алкила, С 2-С 10 алкенила, C2-С 10 алкинила, галогено, циано, нитро, трифторметила, трифторметокси, азидо, гидрокси, C1-С 6 алкокси, -C(O)R5,-C(O)OR5, -NR6C(O)OR8, -OC(O)R5, -NR6SO2R8,-SO2NR5R6, -NR6C(O)R5, -C(O)NR5R6, -NR5R6,-S(О)j(СR6R7)m(С 6-С 10 арил), -S(O)j(С 1-С 6 алкил),-(СR6R7)m(С 6-С 10 арил), -О(СR6R7)m(С 6-С 10 арил),-NR6(СR6R7)m(С 6-С 10 арил), -(СR6R7)m(4-10-членный гетероцикл), -C(О)(СR6R7)m(С 6-С 10 арил) и-С(O)(СR6R7)m(4-10-членный гетероцикл), где m представляет собой целое число от 0 до 4, j представляет собой целое число от 0 до 2, а указанные алкильные, алкенильные, алкинильные,арильные и гетероциклические группировки вышеупомянутых групп R4 возможно замещены 1-3 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -NR6SO2R8, -SO2NR5R6,-C(O)R5, -C(O)OR5, -OC(O)R5, -NR6C(O)OR8,-NR6C(O)R5, -C(O)NR5R6, -NR5R6, -OR5, C1-С 10 алкила, -(CR6R7)m(C6-C10apил) и -(СR6R7)m(4-10 членный гетероцикл), где m представляет собой целое число от 0 до 4; каждый R5 независимо выбран из Н, С 1-С 10 алкила, -(СR6R7)m(С 6-С 10 арил) и -(СR6R7)m(4-10 членный гетероцикл), где m представляет собой целое число от 0 до 4, а вышеупомянутые заместители R5, за исключением Н, возможно замещены 1-3 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, трифторметокси, азидо, -C(O)R6,-C(O)OR6, -OC(O)R6, -NR6C(O)R7, -С(O)NR6R7,-NR6R7, гидрокси, C1-С 6 алкила и C1-С 6 алкокси; каждый R6 и R7 независимо представляет собой Н, -С(O)(С 1-С 6 алкил), C1-С 6 алкил или фторо; иR8 не представляет собой Н; при котором соединение формулы где R1 и R2 такие, как определено выше, при условии, что если R1 представляет собой гидрокси, он защищен как -OR9, a R9 представляет собой защитную группу гидроксила, такую как силильная группа, обрабатывают соединением формулы Н-Х 2-(СR6R7)t(С 6-С 10 арил), где X2, R6,R7 и t такие, как определено выше, в присутствии трифенилфосфина и диэтилового эфира азодикарбоновой кислоты, с последующим снятием защиты с R9-защищенных гидроксигрупп. 16 Термин "лечение", как он используется здесь, если не указано иначе, означает реверсирование, облегчение, ингибирование течения или предупреждение расстройства или состояния, к которому такой термин применяется, или одного или более чем одного симптома такого расстройства или состояния. Термин "лечение",как он используется здесь, относится к акту лечения, как это "лечение" определено непосредственно выше. Если не указано иначе, термины или фразы"бактериальная(ые) инфекция(и)", "протозойная(ые) инфекция(и)" и "расстройства, связанные с бактериальными инфекциями или протозойными инфекциями", как они используются здесь, включают в себя следующее: пневмонию,средний отит, синусит, бронхит, тонзиллит и мастоидит, связанные с инфекцией Streptococcusfaecalis, E. faecium, E. casselflavus, S. epidermidis,S. haemolyticus или Peptostreptococcus spp.; фарингит, ревматическую атаку и гломерулонефрит, связанные с инфекцией Streptococcus pyogenes, стрептококками групп С и G, Corynebacterium diphtheriae или Actinobacillus haemolyticum; инфекции дыхательных путей, связанные с инфекцией Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae,Haemophilus influenzae или Chlamydia pneumoniae; инфекции крови и тканей, включающие эндокардит и остеомиелит, вызванные S. aureus,S. haemolyticus, Е. faecalis, E. faecium, E. durans,включая штаммы, устойчивые к известным антибактериальным средствам, таким как, но не ограничиваясь ими, бета-лактамы, ванкомицин,аминогликозиды, хинолоны, хлорамфеникол,тетрациклины и макролиды; неосложненные инфекции и абсцессы кожи и мягких тканей и послеродовую лихорадку, связанные с инфекцией Staphylococcus aureus, коагулазоотрицательными стафилококками (то есть S. epidermidis, S.Bartonella henselae; неосложненные острые инфекции мочевых путей, связанные с инфекциейStaphylococcus aureus, коагулазоотрицательными видами стафилококков или Enterococcus spp; уретрит и цервицит; венерические заболевания,связанные с инфекцией Chlamydia trachomatis,Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrheae; токсинные заболевания, связанные с инфекцией S.aureus (пищевая интоксикация и токсический шок) или стрептококками групп А, В и С; язвы,связанные с инфекцией Helicobacter pylori; системные лихорадочные синдромы, связанные с инфекцией Borrelia recurrentis; болезнь Лайма,связанную с инфекцией Borrelia burgdorferi;pneumoniae. Бактериальные инфекции, и протозойные инфекции, и расстройства, связанные с такими инфекциями, которые можно лечить или предупреждать у животных, включают в себя следующее: респираторное заболевание коров,связанное с инфекцией Р. haemolytica, P. multocida, Mycoplasma bovis или Bordetella spp.; кишечное заболевание коров, связанное с инфекцией E. coli или простейшими (то есть кокцидиями, криптоспоридиями, и так далее); мастит молочных коров, связанный с инфекцией S.Fusobacterium necrophorum или Bacteroides nodosus; коровий инфекционный конъюнктивит,связанный с инфекцией Moraxella bovis; преждевременный выкидыш у коров, связанный с инфекцией простейшими (то есть неоспорами); инфекцию мочевых путей у собак и кошек, связанную с инфекцией Е. соli; инфекции кожи и мягких тканей у собак и кошек, связанные с инфекцией S. epidermidis, S. intermedius, коагулазоотр. Staphylococcus или Р. multocida; и зубные или ротовые инфекции у собак и кошек, связанные с инфекцией Alcaligenes spp., BacteroidesPrevotella. Другие бактериальные инфекции и протозойные инфекции, и расстройства, связанные с такими инфекциями, которые можно лечить или предупреждать способом по настоящему изобретению, упоминаются в J. Р. Sanfordapy", 26th Edition, (Antimicrobial Therapy, Inc.,1996). Соединения по настоящему изобретению могут быть активными против бактерий и простейших и сопутствующих состояний, на которые ссылаются выше, или конкретных штаммов бактерий и простейших, на которые ссылаются выше. Термин "галогено", как он используется здесь, если не указано иначе, включает фторо,хлоро, бромо или иодо. Предпочтительные галогеногруппы представляют собой фторо, хлоро и бромо. Термин "алкил", как он используется здесь, если не указано иначе, включает насыщенные моновалентные углеводородные радикалы, имеющие прямые, циклические или разветвленные группировки. Понятно, что для того, чтобы указанная алкильная группа включала в себя циклические группировки, она должна содержать по меньшей мере три атома углерода. Термин "арил", как он используется здесь,если не указано иначе, включает органический радикал, полученный из ароматического углеводорода путем удаления одного водорода, как,например, фенил или нафтил. Термин "4-10-членный гетероцикл", как он используется здесь, если не указано иначе,включает в себя ароматические и неароматические гетероциклические группы, содержащие один или более чем один гетероатом, каждый из которых выбран из О, S и N, причем каждая гетероциклическая группа имеет от 4 до 10 атомов в своей кольцевой системе. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в своей кольцевой системе, а ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в своей кольцевой системе. Гетероциклические группы включают в себя бензоконденсированные кольцевые системы и кольцевые системы, замещенные одной или более чем одной оксогруппировкой. Примером 4-членной гетероциклической группы является азетидинил(полученный из азетидина). Примером 5 членной гетероциклической группы является тиазолил, а примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил,оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Нпиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3,1,0]гексанил, 3-азабицик 19 ло[4,1,0]гептанил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил,оксазолил, изотиазолил, пирролил, хинолинил,изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил,тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеупомянутые группы, как полученые из соединений, перечисленных выше, могут быть С-присоединенными или Nприсоединенными, где это возможно. Например, группа, полученная из пиррола, может представлять собой пиррол-1-ил (N-присоединенный) или пиррол-3-ил (С-присоединенный). Фраза "фармацевтически приемлемая соль(соли)", как она используется здесь, если не указано иначе, включает в себя соли кислотных или основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются основными по своей природе,способны к образованию широкого ряда солей с различными неорганическими и органическими кислотами. Кислоты, которые могут быть использованы для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы,как, например, соли гидрохлорид, гидробромид,гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат,пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат и памоат [то есть 1,1'-метиленбис-(2-гидрокси-3-нафтоат)]. В дополнение к кислотам, упомянутым выше, соединения по настоящему изобретению, которые включают в себя основную группировку, такую как аминогруппа, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Те соединения по настоящему изобретению, которые являются кислотными по природе, способны к образованию солей оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочноземельных металлов и, в частности, кальциевые,магниевые, натриевые и калиевые соли соединений по изобретению. 20 Соединения по настоящему изобретению имеют асимметрические центры и, следовательно, существуют в различных энантиомерных и диастереомерных формах. Данное изобретение относится к применению всех оптических изомеров и стереоизомеров соединений по настоящему изобретению и их смесей и ко всем фармацевтическим композициям и способам лечения, которые могут использовать или содержать их. В этом отношении данное изобретение включает в себя как Е, так и Z конфигурации группировки СХ 1R2. Соединения формулы 1 могут также существовать в виде таутомеров. Данное изобретение относится к применению всех таких таутомеров и их смесей. Настоящее изобретение включает в себя соединения по настоящему изобретению и их фармацевтически приемлемые соли, где один или более чем один водород, углерод или другой атом заменен на свой изотоп. Такие соединения могут быть полезны в качестве исследовательских и диагностических средств в фармакокинетических исследованиях метаболизма и в анализах связывания. Подробное описание изобретения Получение соединений по настоящему изобретению проиллюстрировано на следующей схеме. Схема Соединения по настоящему изобретению легко получить. Со ссылкой на схему, проиллюстрированную выше, исходное соединение формулы 2 представляет собой гигромицин А,который может быть получен в соответствии с методиками, известными специалистам в данной области, как, например, путем ферментацииStreptomyces hygroscopicus NRRL 2388. Метилкетон в положении 4" на фуранозном сахаре молекулы гигромицина А может существовать в конфигурации S (гигромицин А) или конфигурации R (эпигигромицин) на фуранозном сахаре. При использовании опубликованных протоколов в качестве модели для ферментации и выделения гигромицина А (патент США 3100176; Antibiotic Chemotherapy (1953)3:12681278, 1279-1282), продукт гигромицин представляет собой смесь приблизительно 3:1 гигромицина А (4"-(S)эпимер) с бета-ориентиро 21 ванным метилкетоном на фуранозном сахаре,как нарисовано, и эпигигромицина. Из литературы известно (Journal of Antibiotics 33(7), 695704, 1980), что чистый гигромицин А будет превращаться в эпигигромицин в щелочных растворах. Путем тщательного регулирования рН на уровне ниже 6,9 во время ферментации и подвергания воздействию рН, температуры и растворителя во время процесса очистки, конечный выделенный продукт может быть улучшен до соотношения гигромицин А: эпигигромицин по меньшей мере 14:1. С использованием этого материала могут быть получены по существу отдельные изомеры, производные от 4"(S)гигромицина, для применения в качестве матриц для дальнейшей модификации путем синтеза. Гигромицин А, обогащенный 4"-(S) эпимером, получают путем ферментации Streptomyces hygroscopicus NRRL2388 или его мутантов в среде с рН, регулируемым на уровне менее чем 6,9, предпочтительно от 6,2 до 6,7, в течение этого процесса. Данная среда содержит усвояемые источники углерода, азота и микроэлементов, известные специалистам в данной области. Ферментация проходит при температуре примерно 25-35 С, предпочтительно примерно 29 С. Ферментацию контролируют, например, с помощью высокоэффективной жидкостной хроматографии. Культивирование продолжают до тех пор, пока выход соединения не достигнет максимума, обычно в течение периода примерно от 3 до 10 дней, предпочтительно примерно от 4 до 6 дней. Образование эпигигромицина сводят к минимуму в ходе процесса очистки с помощью водного буфера (а не незабуференной воды) и регулирования рН активных потоков до примерно 6,0. Образование эпигигромицина также сводят к минимуму путем сведения к минимуму времени, в течение которого выделенный материал подвергают действию высоких температур. Таким образом, если необходимо уменьшить концентрации растворителей, предпочтительно разбавлять активные потоки водным буфером и избегать использования роторного выпаривания при повышенных температурах. Также в качестве средства для избежания высоких температур может быть использована колонна со смолой для концентрирования активного раствора перед конечной стадией очистки, для того чтобы уменьшить объем раствора, который нужно кипятить. Конечная стадия очистки в данном способе представляет собой концентрирование активных фракций до твердых веществ с помощью вакуума и температуры бани примерно 3550 С. Период, в течение которого раствор подвергают повышенным температурам, может быть сведен к минимуму путем кипячения по стадиям. Соединение формулы 1, где R2 такой, как определено выше, X1 представляет собой СН 2, 004303X2 представляет собой О, а R3 представляет собой Н, можно получить из соответствующих(карбэтоксиэтилиден)трифенилфосфоран могут быть подвергнуты взаимодействию с гигромицином А для получения ненасыщенного этилового эфира. На этой стадии гидроксигруппы гигромицина А могут быть соответствующим образом защищены, например в виде их силильных эфиров, с помощью соответствующего реагента, такого как триэтилсилилхлорид (TESCl),триметилсилилхлорид (TMSCl) или третбутилдиметилсилилхлорид (TBDMSCl) и аминного основания, такого как имидазол или пиридин. Данное соединение можно затем восстановить, например, с помощью диизобутилалюминийгидрида, и снятие защиты с гидроксильных групп может быть осуществлено благодаря применению кислоты, такой как уксусная кислота, или фторид-иона как, например, TBAF(тетрабутиламмонийфторид). Соединения формулы 1, где R1 представляет собой Н, и где R2 такой, как определено выше, X1 представляет собой CH2, X2 представляет собой О, а R3 представляет собой Н, можно получить из соответствующих ,-ненасыщенных эфирных промежуточных соединений,полученных в результате олефинирования по Виттигу, Хорнеру-Эммонсу или Петерсону С-5" кетона 2"-дезоксипентазащищенного гигромицина А. В данном способе гигромицин А получают путем защиты всех гидроксигрупп гигромицина А, за исключением гидрокси при 2" углероде (С-2"), в виде их силильных эфиров благодаря использованию соответствующего реагента, такого как триэтилсилилхлорид (TESCl),триметилсилилхлорид (TMSCl) или тpeтбутилдиметилсилилхлорид (TBDMSCl). Предпочтительный способ представляет собой 10 экв. TBDMSCl и имидазола в N,N-диметилформамиде (ДМФ) при температуре 25-40 С в течение 12-36 ч. 2"-Дезоксипентазащищенный гигромицин А затем получают путем удаления гидроксигруппы, используя способ Бартона(Barton et al., J. Chem. Soc., Perkin Trans. /1975,1574). Предпочтительным способом в данном случае является способ Гену-Деллака (GenuDellac et al., Carbohydrate Res. 1991, 216, 249). Вышеупомянутый ,-ненасыщенный эфир можно затем получить посредством олефинирования по Виттигу, Хорнеру-Эммонсу или Петерсону С-5" кетона 2"-дезоксипентазащищенного гигромицина А. Например, (карбэтоксиметилен)трифенилфосфоран или (карбэтоксиэтилиден)трифенилфосфоран может быть подвергнут взаимодействию с гигромицином А с получением ненасыщенного этилового эфира. Дан 23 ное соединение можно затем восстановить, например, с помощью диизобутилалюминийгидрида, и снятие защиты с гидроксильных групп может быть осуществлено с помощью кислоты,такой как уксусная кислота, или фторид-иона,как, например, TBAF. Соединение формулы 1, где R1 и R2 такие,как определено выше, X1 представляет собой СН 2, X2 представляет собой О, а R3 представляет собой -С(O)(СR6R7)t(C6-С 10 арил), где R6, R7 и"t" такие, как определено выше, можно получить посредством ацилирования защищенного гигромициналлилового спирта, описанного выше, например, путем обработки указанного спирта с использованием Х-С(O)(СR6R7)t(С 6 С 10 арил), где Х представляет собой уходящую группу, такую как Cl, Вr или N-гидроксисукцинимид (NНS)-эфир, в присутствии основания, такого как гидрид натрия, триэтиламин или трет-бутилат калия. Защитные группы могут затем быть удалены, как указано выше. Соединение формулы 1, где R1 и R2 такие,как определено выше, X1 представляет собой СН 2, X2 представляет собой О, а R3 представляет собой -(СR6R7)t(С 6-С 10 арил), где R6, R7 и t такие, как определено выше, можно получить посредством алкилирования защищенного гигромициналлилового спирта, описанного выше,например путем обработки указанного спиртаX-(СR6R7)t(С 6-С 10 арил), где Х представляет собой уходящую группу, такую как Сl, Вr или мезилат, в присутствии основания, такого как гидрид натрия, триэтиламин или тpeт-бутилат калия. Защитные группы можно затем удалить,как описано выше. Соединение формулы 1, где R1 и R2 такие,как определено выше, X1 представляет собойR6 и R7 такие, как определено выше, можно получить посредством реакции Мицунобу. Защищенный гигромициналлиловый спирт, полученный как описано выше, подвергают реакции Мицунобу с применением НО-(СR6R7)t(С 6-С 10 арил) или HS-(СR6R7)t(С 6-С 10 арил), опосредованной трифенилфосфином и диэтиловым эфиром азодикарбоновой кислоты, как описано вD.L. Hughes, Org. Reactions (1992) 42 335. С полученного эфира или тиоэфира можно затем снять защиту, как описано выше, или, в случае тиоэфира, окислить, например с помощью mСРВА (3-хлорпероксибензойная кислота), а затем снять защиту, как описано выше. Соединение формулы 1, где R1 и R2 такие,как определено выше, X1 представляет собой СН 2, X2 представляет собой О, а R3 представляет собой -С(O)NR6(СR6R7)t(С 6-С 10 арил), где R6,R7 и "t" такие, как определено выше, может быть получено путем подвергания взаимодействию защищенного гигромициналлилового спирта, полученного как описанного выше, с изоцианатом ОСNR6(СR6R7)t(С 6-С 10 арил) в толуоле 24 при температурах от 40 до 110 С, предпочтительно при 50-80 С. Добавление диметиламинопиридина и триэтиламина в реакционную смесь может быть предпочтительным. Защитные группы могут затем быть удалены как описано выше. Соединение формулы 1, где R1 и R2 такие,как определено выше, X1 представляет собой СН 2, X2 представляет собой N, а R3 такой, как определено выше, при условии, что азот не является соседним с карбонильной функциональностью, может быть получено путем восстановительного аминирования защищенного гигромицин-альдегида, полученного путем окисления вышеупомянутого аллилового спирта: (1) аллиловый спирт можно окислить, например, с использованием условий Сверна (Swern), как описано в Т Tidwell, Org. Reactions (1990) 39 297,(2) и объединить с HN(R6)-R3 в инертном растворителе, и затем (3) обработать восстановителем, таким как NaBH4, NаВН(ОАс)3 (Ас представляет собой ацетил) или NaCNBH3. R6 может быть введен как часть HN(R6)-R3 на стадии (2) или введен после стадии (3), где использовалиH2NR3, путем алкилирования, например с помощью основания, такого как гидрид натрия или трет-бутилат калия, и алкилирующего агента, такого как R6-X, где Х представляет собой Вr, Сl или метансульфонат. Соединение формулы 1, где R1 и R2 такие,как определено выше, X1 представляет собойNR6, а R3 представляет собой -(СR6R7)t(С 6 С 10 арил), где R6, R7 и "t определены выше, может быть получено путем олефинирования по Петерсону, как описано в D. Аgеr, Оrg. Reactions(1990) 38 1. Например, кетон защищенный гигромицин, полученный путем осуществления взаимодействия соответствующего реагента,такого как триэтилсилилхлорид (TESCl), триметилсилилхлорид(TMSCl) или третбутилдиметилсилилхлорид (TBDMS) и имидазол или пиридин, с гигромицином А, может быть подвергнут взаимодействию с TMSCH(R2)-X1-X2-R3 (TMS=тетраметилсилан) в присутствии сильного основания, например диизопропиламида лития или бутиллития. Когда промежуточный -гидроксисилан стабилен,олефин может быть образован путем дальнейшей реакции с сильным основанием, например гидридом натрия или калия. Защитные группы могут затем быть удалены как указано выше. ТМS-СН(R2)-Х 1-X2-R3, где X1 представляет собой S или S(O)n, может быть получен из триметилсилилметилсульфида, например путем осуществления взаимодействия с соответствующим электрофилом, в присутствии аминного основания, такого как триэтиламин или пиридин. Тиол может быть окислен с помощью m-СРВА до сульфона. TMS-CH(R2)-X1-X2-R3, где X1 представляет собой S(O)n, а X2 представляет собойNR6, может быть получен из хлорангидрида 25 триметилсилилметансульфоновой кислоты и соответствующего амина, НN(R6)-(СR6R7)t(С 6 С 10 арил). Соединение формулы 1, где R1 и R2 определены выше, X1 представляет собой С, и где X2 представляет собой N, а X2 и R3 взяты вместе,как описано выше, может быть получено путем осуществления взаимодействия HNR6R3 с защищенным гигромициналлилмезилатом, в присутствии аминного основания, такого как триэтиламин или пиридин. Защищенный гигромициналлилмезилат может быть получен путем осуществления взаимодействия защищенного гигромициналлилового спирта, описанного выше, с хлорангидридом метансульфоновой кислоты, в присутствии аминного основания, такого как триэтиламин или пиридин. Соединения по настоящему изобретению имеют асимметрические атомы углерода. Соединения, имеющие смесь изомеров по одному или более чем одному центру, будут существовать в виде диастереомерных смесей, которые могут быть разделены на содержащиеся в них отдельные диастереомеры на основе их физикохимических различий с помощью способов, известных специалистам в данной области, например с помощью хроматографии или фракционной кристаллизации. Все такие изомеры,включая смеси диастериомеров, рассматриваются как часть изобретения. Соединения по настоящему изобретению,которые являются основными по природе, способны к образованию широкого ряда различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто желательно сначала выделить из реакционной смеси соединение по настоящему изобретению в виде фармацевтически неприемлемой соли, а затем просто превратить последнее обратно в свободное основание с помощью обработки щелочным реагентом и затем превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот основных соединений по настоящему изобретению легко получают путем обработки основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получают желаемую твердую соль. Желаемая соль кислоты можно также осадить из раствора свободного основания в органическом растворителе путем добавления к этому раствору соответствующей минеральной или органической кислоты. Те соединения по настоящему изобретению, которые являются кислотными по природе, способны к образованию солей оснований с 26 различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочноземельных металлов, и в частности соли натрия и калия. Все эти соли получают с помощью традиционных методик. Химические основания, которые используют в качестве реагентов для приготовления фармацевтически приемлемых солей оснований по настоящему изобретению, представляют собой реагенты, которые образуют нетоксичные соли оснований с кислотными соединениями по настоящему изобретению. Такие нетоксичные соли оснований включают в себя соли, полученные с такими фармакологически приемлемыми катионами, как натрий, калий,кальций и магний, и т.д. Эти соли могут легко быть получены путем обработки соответствующих кислотных соединений водным раствором,содержащим алкоголят желаемого щелочного металла или гидроксид металла, и затем выпаривания полученного раствора до сухости,предпочтительно при пониженном давлении. Или же их также можно получить путем смешения вместе растворов низших спиртов кислотных соединений и алкоголята желаемого щелочного металла или гидроксида металла, и затем выпаривания полученного раствора до сухости тем же самым способом, что и ранее. В любом случае предпочтительно используют стехиометрические количества реагентов, для того чтобы быть уверенными в полноте реакции и максимальных выходах желаемого конечного продукта. Антибактериальная активность соединений по настоящему изобретению против бактериальных патогенов демонстрируется способностью соединений ингибировать рост определенных штаммов патогенов. Анализ Анализ, описанный ниже, использует традиционные методику и критерии интерпретации и имеет целью предложить направление химических модификаций, которые могут привести к соединениям с антибактериальной активностью против чувствительных и резистентных к лекарству организмов, включая, но не ограничиваясь ими, резистентность к бета-лактамам, макролидам и ванкомицину. В данном анализе набор бактериальных штаммов составляют таким образом, чтобы он включал в себя ряд патогенных видов - мишеней, включающих в себя представителей бактерий, резистентных к антибиотикам. Использование этого набора дает возможность определить взаимосвязь химическая структура/активность в отношении эффективности и спектра активности. Данный анализ осуществляют в микротитрационных планшетах и интерпретируют в соответствии с PerformanceTests - Sixth Edition: Approved Standard. опубликованным под руководством Национального Комитета Клинических Лабораторных Стандар 27 тов (NCCLS); для сравнения штаммов используют минимальную ингибирующую концентрацию (МИК). Соединения сначала растворяют в диметилсульфоксиде (DMSO) с получением маточных растворов. Активность соединений по настоящему изобретению также можно оценить в соответствии с методикой репликатора Стирса (Steers),которая представляет собой стандартный способ бактериального тестирования in vitro, описанный в Steers at al., Antibiotics and Chemotherapy 1959, 9, 307. Активность in vivo соединений по настоящему изобретению можно определить с помощью традиционных исследований защиты животных, обычно проводимых на грызунах, которые хорошо известны специалистам в данной области. В соответствии с одной in vivo моделью,соединения оценивают на эффективность на мышиных моделях острой бактериальной инфекции. Предложен слeдующий пример одной такой in vivo системы. Мышей (мыши CF1 смешанного пола; 18-20 г) распределяют в клетки после их прибытия и дают им акклиматизироваться 1-2 дня перед тем как ввести в исследование. Острую инфекцию вызывают путем интраперитонеальной инокуляции бактерий(Staphylococcus aureus штамм 01 А 1095), суспендированных в 5% стерильном свином желудочном слизистом секрете. Инокулят получают путем выращивания культуры в течение ночи при 37 С на кровяном агаре, сбора полученной поверхностной культуры с помощью стерильного бульона с сердечно-мозговым экстрактом и доведения этой суспензии до мутности, которая при разведении 1:10 5% стерильным свиным желудочным слизистым секретом давала бы 100% летальность. Мышей (10 на группу) обрабатывают подкожно в момент времени 0,5 ч и 4 ч после провокационной пробы. В каждое исследование включены соответствующие необработанные(ванкомицин или миноциклин и т.д.) контроли. Процент выживания записывали после 4 дневного периода наблюдения; PD50 (мг/кг/доза,рассчитанная для защиты 50% инфицированных животных) определяли с помощью пробитметода (probit method). Соединения по настоящему изобретению и их фармацевтически приемлемые соли (ниже:"активные соединения"), можно вводить посредством перорального, парентерального, местного или ректального путей при лечении бактериальных и протозойных инфекций. В общем,эти соединения наиболее желательно вводить в дозировках, варьирующих от примерно 0,2 мг на кг массы тела в сутки (мг/кг/сутки) до примерно 200 мг/кг/сутки однократными или разделенными дозами (то есть от 1 до 4 доз в сутки), хотя отклонения будут обязательно иметь 28 место в зависимости от вида, массы и состояния субъекта, которого лечат, и конкретного выбранного пути введения. Однако наиболее желательно применять уровень дозировки, который находится в диапазоне от примерно 3 мг/кг/сутки до примерно 60 мг/кг/сутки. Отклонения могут, тем не менее, иметь место в зависимости от вида млекопитающего, рыбы или птицы, которых лечат, и их индивидуальных реакций на указанное лекарственное средство, а также от типа выбранного фармацевтического препарата и периода времени и интервала, с которыми такое введение осуществляют. В некоторых случаях уровни дозировки ниже нижней границы вышеуказанного диапазона могут быть более чем достаточными, в то время как в других случаях еще большие дозы могут быть использованы, не вызывая каких-либо вредных побочных эффектов, при условии что такие большие дозы сначала разделены на несколько маленьких доз для введения в течение суток. Активные соединения можно вводить сами по себе или в комбинации с фармацевтически приемлемыми носителями или разбавителями путями, указанными ранее, и такое введение может быть осуществлено в однократных или множественных дозах. Более конкретно, активные соединения можно вводить в большом разнообразии различных лекарственных форм, то есть их можно комбинировать с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек,пастилок, твердых леденцов, порошков, спреев,кремов, целебных мазей, суппозиториев, желе,гелей, паст, лосьонов, мазей, водных суспензий,инъекционных растворов, эликсиров, сиропов и тому подобного. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители, и так далее. Более того, пероральные фармацевтические композиции можно подходящим образом подслащивать и/или корректировать их вкус и запах. В общем,активные соединения присутствуют в таких лекарственных формах на уровнях концентраций,варьирующих от примерно 5,0% до примерно 70 мас.%. Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, гидроортофосфат кальция и глицин, можно применять с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный или маниоковый крахмал), альгиновая кислота и некоторые сложные силикаты, вместе со связующими веществами для гранулирования, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Дополнительно,смазывающие агенты, такие как стеарат магния,лаурилсульфат натрия и тальк, часто очень полезны для целей таблетирования. Твердые ком 29 позиции подобного типа могут также быть использованы как наполнители в желатиновых капсулах; предпочтительные в этом отношении материалы также включают лактозу, или молочный сахар, а также полиэтиленгликоли высокой молекулярной массы. Когда для перорального введения желательны водные суспензии и/или эликсиры, активное соединение может быть объединено с различными подслащивающими агентами или корригентами, красящими веществами или красками, и, если желательно, также с эмульгирующим и/или суспендирующим агентом, вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин и различными подобными их комбинациями. Для парентерального введения, могут быть использованы растворы активного соединения либо в кунжутном масле или в арахисовом масле, либо в водном этаноле или пропиленгликоле. Применение производного циклодекстринов,такого как сульфобутиловый эфир -циклодекстрина, натриевая соль (патент США 5134127) может также быть предпочтительным. Водные растворы должны быть подходящим образом забуферены, если необходимо, и жидкий разбавитель сначала доведен до изотоничности. Эти водные растворы подходят для целей внутривенных инъекций. Масляные растворы подходят для целей внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко осуществимо с помощью стандартных фармацевтических методик, известных специалистам в данной области. Кроме того, активные соединения по настоящему изобретению также возможно вводить местно, и это может быть сделано с помощью кремов, желе, гелей, паст, пластырей, мазей и тому подобного, в соответствии со стандартной фармацевтической практикой. Для введения животным, отличным от людей, таким как крупный рогатый скот или домашние животные, активные соединения можно вводить в корм животных или перорально в виде композиции для вливания в ротовую полость. Активные соединения могут также быть введены в форме липосомальных систем доставки, таких как маленькие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы из множества фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Активные соединения могут также быть связаны с растворимыми полимерами как носителями нацеливаемого лекарственного средства. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидфенил, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоиловыми ос 004303 30 татками. Кроме того, активные соединения могут быть связаны с классом биоразрушаемых полимеров, полезных в достижении контролируемого высвобождения лекарства, например, с полимером молочной кислоты, полигликолевой кислоты, сополимеров полимеров молочной кислоты и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно-связанными или амфифильными блок-сополимерами гидрогелей. Настоящее изобретение далее описано и проиллюстрировано получениями и примерами,описанными ниже. В получениях и примерах"к.т." обозначает комнатную температуру или температуру окружающей среды, которая представляет собой температуру в диапазоне примерно от 20 до 25 С. Получение 1. Пять (5) мл замороженной партии (хранимой при -80 С в смеси 20% глицерина/80% инокуляционной среды) культуры Streptomyces hygroscopicus NRRL 2388 использовали для инокуляции 1 л гигромициновой посевной средыHubinger (Hubinger) 7 г/л, твердые вещества кукурузного экстракта Roquette 3 г/л, SheffieldChemical P2000 1 капля/колба, соевое масло Colfax 2 капли/колба, рН до 7,0 до автоклавирования) в 2,8 л колбе Фернбаха (Fernbach). Культуру выращивали в течение 3 дней при 29 С с перемешиванием при 200 об./мин на шейкере с 2 дюймовой (5,04 см) орбитой. Эту выращенную культуру использовали для инокуляции 8 л стерильной гигромициновой ферментационной среды (карбонат кальция Albaglos 1 г/л, SheffieldP2000 1 мл/л, СоСl2-6 Н 2 О Baker 0,002 г/л, соевое масло Colfax 2 мл/л, cerelose 10 г/л, NaCl 5 г/л,рН до 7,0 до автоклавирования) в 14 л сосуде-ферментаторе (New Brunswick Microferm, New Brunswick, New Jersey), снабженном двумя 4,75-дюймовыми (12, 065 см) мешалками Rushton на расстоянии 3,75 дюймов (9,535 см) друг от друга. Содержимое ферментатора инкубировали при 29 С со скоростью аэрации 8 л/мин и при перемешивании при 800 об./мин. Чтобы свести к минимуму образование эпигигромицина рН поддерживали между 6,5 и 6,9 в течение 126 ч, затем от 6,2 до 6,6 с помощьюH2SO4 (15%) в течение оставшегося периода. Собирали продукты ферментации после 143 ч суммарной инкубации. В это время соотношение гигромицина А к эпигигромицину составляло 31:1. 31 6 л содержимого ферментатора вышеуказанной ферментации центрифугировали при 8000 об./мин в течение приблизительно 15 мин. После центрифугирования осадок отбрасывали и супернатант (с рН 6,4, с помощью ВЭЖХ проанализировали, что он содержит приблизительно 4,12 г (gms, грамм) активности гигромицина А) загружали на колонку, заполненную 500 г смолы XAD-16 (Rohm and Haas (Philadelphia,Pennsylvania. Смолу заранее уравновешивали двумя объемами пустой колонки 25 мМ гидрофосфата натрия, рН 6,0 ("буфер"). После загружения колонку промывали 2 объемами пустой колонки буфера и 2 объемами пустой колонки смеси буфер/метанол в соотношении 80/20 и активность элюировали 5 объемами пустой колонки смеси буфер/метанол в соотношении 50/50. Фракции анализировали с помощью ВЭЖХ и объединяли фракции, содержащие большую долю активности (2,730 г гигромицина А). Часть этого элюата с XAD-16 (приблизительно 800 мг гигромицина А) разбавляли до 10% метанола путем добавления 1,8 л буфера и загружали на 100 мл колонку CG-161 (TosoHass(Montgomeryville, Pennsylvania, которая была уравновешена 4 объемами пустой колонки смеси буфер/метанол в соотношении 90/10. Продукт элюировали 6 объемами пустой колонки смеси буфер/метанол в соотношении 50/50. Фракции анализировали с помощью ВЭЖХ и активные фракции объединяли. Объединенную фракцию упаривали до сухости и проанализировали, что твердые вещества имели приблизительно 65% чистоты по массе. Небольшую часть этих твердых веществ передавали на анализ. Примерно 500 мг этих твердых веществ смешивали с 500 мл воды и 500 мл этилацетата и перемешивали в течение 20 мин. Два слоя разделяли и часть водного слоя сушили с получением твердых веществ, которые, как было проанализировано, имели приблизительно 52% чистоту по массе. И те, и другие твердые вещества (34945280-1 и 281-1) анализировали с помощью ЯМР(ядерно-магнитный резонанс) и ТСХ (тонкослойная хроматография) и обнаружили, что они содержат активность гигромицина А. Кроме того, ЯМР показал, что соотношение гигромицин А/эпигигромицин составляет приблизительно 15:1. Получение 2. Пять (5) мл замороженной партии (хранимой при -80 С в смеси 20% глицерина/80% инокуляционной среды) культуры Streptomyces hygroscopicus NRRL 2388 использовали для инокуляции 1 л гигромициновой инокуляционной среды (СРС International Inc. cerelose 13 г/л,крахмал Hubinger 7 г/л, твердые вещества кукурузного экстракта Roquette 3 г/л, NZ Амин YTT 7 г/л, СоСl26 Н 2 О Baker 0,002 г/л, KН 2 РО 4 0,7 32 г/л, MgSO47H2O 1,3 г/л, сульфат аммония 0,7 г/л, пеногаситель Dow Chemical P2000 1 капля/колба, соевое масло Colfax 2 капли/колба, рН до 7,0 до автоклавирования) в 2,8 л колбе Фернбаха. Культуру выращивали в течение 2-3 дней при 29 С при перемешивании при 200 об./мин. на шейкере с 2-дюймовой (5,04 см) орбитой. Два ферментатора из нержавеющей стали, объемом по 500 галлонов (1893,5 л), загружали 380400 галлонами (1438,3-1514 л) гигромициновой сбраживаемой среды (карбонат кальция MineralInc. 2 г/л, СРС International Inc. cerelose 10 г/л,NaCl Cargill Inc. 5 г/л). Среду стерилизовали паром с избыточным давлением 20 фунтов на квадратный дюйм (psig) (138 кПа) в течение 60 мин в ферментаторах. Затем среду охлаждали с помощью охлаждающего змеевика в ферментаторах, рН подводили до 6,5-6,7. Условия в ферментаторах создавали такие, что скорость воздушного потока составляла 20 стандартных кубических футов в минуту (0,56 м 3/мин), температура составляла 28 С, избыточное давление в отводном канале составляло 5 фунтов на квадратный дюйм (34,5 кПа), а рН поддерживали между 6,5-6,7 25% гидроксидом натрия и 98% серной кислотой. Скорости перемешивания в этих двух ферментаторах варьировали так, чтобы поддерживать уровень растворенного кислорода более 20% от уровня насыщения, как определяли в содержимом ферментатора непосредственно перед инокуляцией. После установки контрольных условий ферментатора пять колб Фернбаха с инокулятом объединяли стерильным образом в 8 л аспирационной бутыли. Этот инокулят затем использовали для инокуляции одного номинального ферментера на 500 галлонов(1893,5 л) как описано выше. Эту процедуру повторяли, используя 4 л инокулята, так что один ферментатор получил 4 л инокулята, и один ферментатор получил 5 л инокулята. Каждый ферментер работал в течение приблизительно 114 ч, время, через которое ферментацию прекращали. РН содержимого ферментатора доводили до 6,3, используя 98% серную кислоту и переносили из ферментаторов для выделения. Содержимое двух ферментаторов, упоминаемое выше (рН=6,3, имеющие соотношение гигромицина А к эпигигромицину, составляющее приблизительно 51:1) фильтровали на керамической системе фильтрации. Фильтрат(1450 гА, 506 галлон (1915 л) вносили в 70 галлонную (265 л) колонку со смолой XAD-16. Колонку предварительно уравновешивали 4 объемами пустой колонки буферного раствора с фосфатом натрия при рН 6,0 ("буфер"). После 33 загружения колонку промывали 2 объемами пустой колонки буфера и 2 объемами пустой колонки смеси буфер/метанол в соотношении 80/20. Активность затем элюировали с колонки в 10 фракциях (приблизительно 50 галлонов(189 л) каждая) раствора буфер/метанол с соотношением 50/50. Активные фракции (приблизительно 1240 гА) объединяли и разбавляли до конечной концентрации 10% метанола путем добавления 1200 галлонов (4542 л) буфера. Использование разбавления (а не роторного выпаривания) для уменьшения концентрации метанола позволило использовать более низкие температуры с тем, чтобы свести к минимуму количества эпигигромицина, которые имеют тенденцию к увеличению при более высоких температурах. Половину этого раствора загрузили на 40-литровую колонку CG-161 (предварительно уравновешенную 4 объемами пустой колонки раствора буфер/метанол в соотношении 90/10). После загрузки колонку промывали 4 объемами пустой колонки смеси буфер/метанол в соотношении 80/20 и элюировали 5,5 объемами пустой колонки смеси буфер/метанол в соотношении 50/50. После регенерации и повторного уравновешивания колонки вторую половину активности загружали на колонку и элюировали как описано выше. Объединенные фракции с обоих циклов работы (120 л, приблизительно 1051 гА) разбавляли до 10% метанола путем добавления буфера. Последнее повторно загружали на регенерированную и повторно уравновешенную колонку со смолой CG-161. Как только активность адсорбировалась на колонке, ее элюировали 4 объемами пустой колонки метанола. Данная стадия служила как для уменьшения солей, так и для увеличения концентрации образца перед окончательным выпариванием. Объединенные фракции с заключительной колонки CG-161 выпаривали до сухости с получением в сумме приблизительно 1 кгА активности гигромицина А. Соотношение гигромицина А к эпигигромицину в конечных твердых веществых составляло примерно 14,5:1. Экспериментальные методики для примеров Получение 5"-аллилового спирта 1. Получение Е-аллилового спирта посредством реакции Виттига. Способ А. Раствор гигромицина А (1 экв.) и карбоэтоксиметилентрифенилфосфорана (2 экв.) в ДМФ (диметилформамид) (прблизительно 0,5 М по гигромицину) оставляли перемешиваться при 70 С в течение 5 ч и охлаждаться до комнатной температуры. Добавили имидазол (12 экв.) и тpeт-бутилдиметилсилилхлорид (12 экв.) и данную реакционную смесь оставляли перемешиваться при 80 С в течение 15 ч. Реакционную смесь разбавляли гексанами и диэтиловым эфиром (приблизительно 1:1), промывали водой,затем насыщенным раствором хлорида натрия,сушили над сульфатом магния, фильтровали и 34 концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле,элюируя 10% этилацетатом в гексанах. Раствор этилового эфира гигромицина А (1 экв.) в метиленхлориде (приблизительно 0,1 М) при -78 С обрабатывали диизобутилалюминийхлоридом (4 экв.). После обработки насыщенной сегнетовой солью и нагревания до комнатной температуры реакционную смесь разбавляли метиленхлоридом, промывали насыщенным хлоридом аммония, затем насыщенным хлоридом натрия, сушили над сульфатом магния,фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. 2. Получение Е- и Z-аллилового спирта посредством реакции Петерсона. Способ Б. Раствор гигромицина А (1 экв.), третбутилдиметилсилилхлорида (12 экв.) и имидазола (12 экв.) в ДМФ (концентрация гигромицина 0,25 М) перемешивали при 80 С в течение 20 ч. После удаления ДМФ при пониженном давлении полученный остаток экстрагировали диэтиловым эфиром. Объединенные эфирные экстракты промывали водой, затем насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле, элюируя 10% этилацетатом в гексанах. Раствор этил(триметилсилил)ацетата (4 экв.) в ТГФ (тетрагидрофуран) (приблизительно 0,4 М по этил(триметилсилил)ацетату) при -78 С обрабатывали диизопропиламидом лития (3,5 экв.). Через 30 мин добавляли раствор максимально силилированного гигромицина А (1 экв.) в ТГФ (приблизительно 0,5 М). Через 15 мин реакционную смесь разбавляли этилацетатом и насыщенным раствором хлорида аммония. Органический слой промывали насыщенным раствором хлоридом аммония, затем насыщенным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Раствор этого неочищенного этилового эфира (1 экв.) в метиленхлориде (приблизительно 0,1 М) при -78 С обрабатывали диизобутилалюминийгидридом (8 экв.). После обработки насыщенной сегнетовой солью и нагревания до комнатной температуры реакционную смесь разбавляли метиленхлоридом, промывали насыщенным хлоридом аммония, затем насыщенным хлоридом натрия, сушили над сульфатом магния,фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах, с получением смеси Е-и Zаллиловых спиртов. 35 Способ В. Раствор гигромицина А (1 экв.), третбутилдиметилсилилхлорида (12 экв.) и имидазола (12 экв.) в ДМФ (концентрация гигромицина 0,25 М) перемешивали при 80 С в течение 20 ч. После удаления ДМФ при пониженном давлении полученный остаток экстрагировали диэтиловым эфиром. Объединенные эфирные экстракты промывали водой, затем насыщенным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле, элюируя 10% этилацетатом в гексанах. Раствор метил-2-(триметилсилил)пропионата (5 экв.) в ТГФ (приблизительно 0,2 М в метил-2-(триметилсилил)пропионата) при -78 С обрабатывали диизопропиламидом лития (4 экв.). Через 30 мин добавляли раствор максимально силилированного гигромицина А (1 экв.) в ТГФ (приблизительно 0,4 М). Через 15 мин реакционную смесь разбавили этилацетатом и насыщенным раствором хлорида аммония. Органический слой промывали насыщенным раствором хлоридом аммония, затем насыщенным раствором хлоридом натрия, сушили над сульфатом магния, фильтровали и концентрировали. Раствор этого неочищенного этилового эфира(1 экв.) в метиленхлориде (приблизительно 0,1 М) при -78 С обрабатывали диизобутилалюминийгидридом (8 экв.). После обработки насыщенным раствором сегнетовой соли и нагревания до комнатной температуры реакционную смесь разбавляли метиленхлоридом, промывали насыщенным раствором хлорида аммония, затем насыщенным раствором хлорида натрия,сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле,элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах с получением смеси Е- и Z-аллиловых спиртов. Получение защищенных 5"-аллиловых производных Способ Г (примеры 2-6). Силилированный гигромицин Ааллиловый спирт (1 экв.) в диоксане (приблизительно 0,03 М) обрабатывали соответствующим бензилгалогенидом (5 экв.) и трет-бутилатом калия (2 экв.). После завершения (приблизительно 10 мин) реакционные смеси разбавляли этилацетатом и 0,05 М буферным раствором фосфат-гидроксид натрия, рН 7,0. Органические слои промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния,фильтровали и концентрировали. Неочищенные продукты очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. 36 С персилированных аллиловых эфиров снимали защиту и очищали способом 3. Способ Д (примеры 7-11). Силилированный гигромициналлиловый спирт (1 экв.) в метиленхлориде (приблизительно 0,03 М) обрабатывали соответствующим бензоилгалогенидом (4 экв.) и триэтиламином (10 экв.). После завершения (приблизительно от 30 минут до 1 ч) реакционную смесь разбавляли метиленхлоридом и 0,05 М буферным раствором фосфат-гидроксид натрия, рН 7,0. Органические слои сушили над сульфатом магния, фильтровали и концентрировали. Неочищенные продукты очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. С персилированных аллиловых эфиров снимали защиту и очищали способом 3. Способ Е (примеры 12, 13). Силилированный гигромициналлиловый спирт (1 экв.) в толуоле (приблизительно 0,03 М) обрабатывали соответствующим изоцианатом (5 экв.) и триэтиламином (3 экв.). После завершения (приблизительно от 30 мин до 4 ч) реакционную смесь разбавляли этилацетатом и 0,05 М буферным раствором фосфат-гидроксид натрия, рН 7,0. Органические слои промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенные продукты очищали с помощью хроматографии на силикагеле,элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. С персилированных аллилкарбаматов снимали защиту и очищали способом З. Способ Ж (примеры 14-57). Силилированный гигромициналлиловый спирт (1 экв.) в толуоле (приблизительно 0,03 М) обрабатывали соответствующим фенолом (35 экв.), трифенилфосфином (3-5 экв.) и диэтиловым эфиром азодикарбоновой кислоты (3-5 экв.). После завершения (приблизительно от 30 мин до 2 ч) реакционные смеси разбавляли этилацетатом и 0,05 М буферным раствором фосфат-гидроксид натрия, рН 7,0. Органические слои промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния,фильтровали и концентрировали. В тех случаях, когда способы Б, В или К были использованы для получения аллилового спирта, смеси Е- и Z-олефинов разделяли в этот момент с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. С неочищенных (из способа А) или чистых аллиловых эфиров (из способов Б или В) снимали защиту и очищали способом З. Получение 5"-аллиловых производных 37 Способ З. Силильные группы удаляли путем обработки раствора 5"-модифицированного гексасилилгигромицина А в ТГФ (приблизительно 0,1 М) раствором Нрвпиридин/пиридин/ТГФ в течение 35-40 ч при комнатной температуре. Реакционные смеси разбавляли этилацетатом, обрабатывали твердым NаНСО 3, фильтровали,концентрировали и очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% метанола в метиленхлориде до 33% метанола в метиленхлориде. Получение 5"-аллил-2"-дезоксиспирта 1. Получение 2"-дезокси-Е-аллилового спирта посредством реакции Виттига. Способ И. Раствор гигромицина А (1 экв.) в диметилформамиде (ДМФ, 0,1 М) обрабатывали имидазолом (10 экв.) и трет-бутилдиметилсилилхлоридом (10 экв.) при 35 С в течение 1416 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом (ЕtOАс). Объединенные экстракты сушили над МgSO4 и концентрировали. Продукт получали после хроматографии, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 15% этилацетата в гексанах. Раствор этого соединения (1 экв.) в дихлорэтане обрабатывали фенилтионохлорформиатом (3 экв.), пиридином (5 экв.) и диметиламинопиридином (0,05 экв.) при комнатной температуре в течение 2-3 дней. В конце этого периода времени реакционную смесь разбавляли метиленхлоридом, промывали 0,5 н. HCl, насыщенным бикарбонатом натрия и затем рассолом. Органические остатки сушили над МgSO4 и концентрировали. Желаемый 2"-тионокарбонат получали после хроматографии, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 10% этилацетата в гексанах. Раствор вышеуказанного 2"-тионокарбоната (1 экв.) в толуоле (0,1 М) обрабатывали ,'-азобис(изобутиронитрилом) (1 экв.) и гидридом три-нбутилолова (3 экв.) при 90 С в течение 2 ч. Реакционную смесь концентрировали и хроматографировали, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 10% этилацетата в гексанах, с получением желаемого 2"дезоксикетона. Раствор пента-силилзащищенного гигромицина А (1 экв.) и карбоэтоксиметилентрифенилфосфорана (2 экв.) в ДМФ (приблизительно 0,5 М по гигромицину) оставляли перемешиваться при 70 С в течение 12 ч и оставляли охлаждаться до комнатной температуры. Добавили имидазол (1 экв.) и тpeт-бутилдиметилсилилхлорид (1 экв.) и реакционную смесь оставляли перемешиваться при 70 С в течение 4 ч. Реакционную смесь разбавляли гексанами и диэтиловым эфиром (приблизительно 1:1), промывали водой, затем насыщенным раствором хлорида натрия, сушили над сульфатом магния,фильтровали и концентрировали. Неочищенный 38 продукт очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. Раствор этилового эфира гигромицина А (1 экв.) в метиленхлориде (приблизительно 0,1 М) при -78 С обрабатывали диизобутилалюминийгидридом (4 экв.). После обработки насыщенной сегнетовой солью и нагревания до комнатной температуры реакционную смесь разбавляли метиленхлоридом, промывали насыщенным хлоридом аммония, затем насыщенным хлоридом натрия, сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах. 2. Получение 2-дезокси- Е- и Z-аллиловых спиртов посредством реакции Петерсона. Способ К. Раствор гигромицина А (1 экв.) в диметилформамиде (ДМФ, 0,1 М) обрабатывали имидазолом (10 экв.) и трет-бутилдиметилсилилхлоридом (10 экв.) при 35 С в течение 1416 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом (ЕtOАс). Объединенные экстракты сушили над МgSO4 и концентрировали. Продукт получали после хроматографии, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 15% этилацетата в гексанах. Раствор этого соединения (1 экв.) в дихлорэтане обрабатывали фенилтионохлорформиатом (3 экв.), пиридином (5 экв.) и диметиламинопиридином (0,05 экв.) при комнатной температуре в течение 2-3 дней. В конце этого периода времени реакционную смесь разбавляли метиленхлоридом, промывали 0,5 н. HCl, насыщенным бикарбонатом натрия и затем рассолом. Органические фазы сушили над МgSO4 и концентрировали. Желаемый 2"-тионокарбонат получали после хроматографии, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 10% этилацетата в гексанах. Раствор вышеуказанного 2"-тионокарбоната (1 экв.) в толуоле (0,1 М) обрабатывали ,'-азобис(изобутиронитрилом) (1 экв.) и гидридом три-нбутилолова (3 экв.) при 90 С в течение 2 ч. Реакционную смесь концентрировали и хроматографировали, элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 10% этилацетата в гексанах, с получением желаемого 2"дезоксикетона. Раствор этил(триметилсилил)ацетата (4 экв.) в ТГФ (приблизительно 0,4 М по этил(триметилсилил)ацетату) при -78 С обрабатывали диизопропиламидом лития (3,5 экв.). Через 30 мин добавили раствор 2"-дезокси персилированного гигромицина А (1 экв.) в ТГФ (приблизительно 0,5 М). Через 15 мин реакционную смесь разбавляли этилацетатом и насыщенным раствором хлорида аммония. Органический слой промывали насыщенным раствором хло 39 рида аммония, затем насыщенным раствором хлорида натрия, сушили над сульфатом магния,фильтровали и концентрировали. Раствор этого неочищенного этилового эфира (1 экв.) в метиленхлориде (приблизительно 0,1 М) при -78 С обрабатывали диизобутилалюминийгидридом(8 экв.). После обработки насыщенной сегнетовой солью и нагревания до комнатной температуры реакционную смесь разбавляли метиленхлоридом, промывали насыщенным хлоридом аммония, затем насыщенным хлоридом натрия,сушили над сульфатом магния, фильтровали и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле,элюируя со ступенчатым градиентом от 5% этилацетата в гексанах до 33% этилацетата в гексанах с получением смеси Е- и Z-аллиловых спиртов. Получение 2"-дезокси-5"-аллиловых производных Примеры 58-73 получали аналогичным образом, что и примеры 14-57. Защищенные производные 2"-дезокси-5"-аллиловые эфиры получали, применяя способ Ж, и затем снимали защиту, применяя способ З. Следующие соединения были получены с использованием способов синтеза, описанных выше: 3-(4-2S,3S,4S,5R)-3,4-дигидрокси-5-(3 гидрокси-1-метил-(1 Е)-пропенил)тетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)-акриламид; 3-(4-2S,3S,4S,5R)-5-(3-бензилокси-1 метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)акриламид; 3-(4-2S,3S,4S,5R)-5-(3-(3-хлорбензилокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксибензо(1,3)диоксол-5-ил)-(2 Е)акриламид; 3-(4-2S,3S,4S,5R)-5-(3-(бифенил-2 илметокси)-1-метил-(1 Е)-пропенил)-3,4 дигидpoкcитeтpaгидpoфypaн-2-илoкcи)-3 гидpoкcифeнил)-2-мeтил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо(1,3)диоксол-5-ил)(2 Е)-акриламид; 3-(4-2S,3S,4S,5R)-5-(3-(4-трет-бутилбензилокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-мeтил-N-3aS,4R,5R,6S,7R,7aR)-4,6,7 тpигидpoкcибeнзo(1,3)диoкcoл-5-ил)-(2 Е)акриламид; 3-(4-2S,3S,4S,5R)-5-(3-(4-фторбензилокси)-1-метил-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 004303 46 фуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламид; 3-(4-2S,4S,5R)-5-(3-(2,4-дихлорфенокси)1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламид; 3-(4-2S,4S,5R)-5-(3-(2-хлор-5-фторфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламид; 3-(4-2S,4S,5R)-5-(3-(2-хлор-3,5-дифторфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламид; 3-(4-2S,4S,5R)-5-(3-(3,5-дифторфенокси)1-метил-(1 Е)-пропенил)-4-гидpoкcитeтpaгидpoфypaн-2-илoкcи)-3-гидpoкcифeнил)-2-мeтил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламид; 3-(4-2S,4S,5R)-5-(3-(3-фтор-4-хлорфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидрокси гексагидробензо(1,3)диоксол-5-ил)-(2 Е)-акриламид; 3-(4-2S,4S,5R)-5-(3-(2-фтор-4-хлорфенокси)-1-метил-(1 Е)-пропенил)-4-гидрокситетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо(1,3)диоксол-5-ил)-(2 Е)акриламид. Следующие соединения могут быть получены специалистом в данной области, с использованием общих и конкретных способов синтеза, описанных выше: 3-(4-(2S,3S,4S,5R)-5-[3-(бензотиазол-6 илокси)-1-метил-(1 Е)-пропенил]-3,4-дигидрокситетрагидрофуран-2-илокси-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо[1,3]диоксол-5-ил)акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(бензотиазол-6 илокси)-1-метил-(1Z)-пропенил]-3,4-дигидрокситетрагидрофуран-2-илокси-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо[1,3]диоксол-5-ил)акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(2-хлорпиридин-3 илокси)-1-метил-(1 Е)-пропенил]-3,4-дигидрокситетрагидрофуран-2-илокси-3-гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо[1,3]диоксол-5-ил)акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(2-хлорпиридин-3 илокси)-1-метил-(1Z)-пропенил]-3,4-дигидрокситетрагидрофуран-2-илокси-3-гидроксифе 47 нил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7 тригидроксигексагидробензо[1,3]диоксол-5 ил)акриламид; 3-[4-2S,3S,4S,5R)-5-3-[2,4-дихлор-6(метоксииминометил)фенокси]-1-метил-(1 Е)пропенил-3,4-дигидрокситетрагидрофуран-2 илокси)-3-гидроксифенил]-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)-акриламид; 3-[4-2S,3S,4S,5R)-5-3-[2,4-дихлор-6(метоксииминометил)фенокси]-1-метил-(1Z)пропенил-3,4-дигидрокситетрагидрофуран-2 илокси)-3-гидроксифенил]-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)-акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(2-ацетил-4,6 дихлорфенокси)-1-метил-(1 Е)-пропенил]-3,4 дигидрокситетрагидрофуран-2-илокси-3 гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3] диоксол-5-ил)-(2 Е)-акриламид; 3-(4-(2S,3S,4S,5R)-5-[3-(2-ацетил-4,6 дихлорфенокси)-1-метил-(1Z)-пропенил]-3,4 дигидрокситетрагидрофуран-2-илокси-3 гидроксифенил)-2-метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо 49 3-4-[(2S,3S,4S,5R)-5-(2-фтор-1-метил-3 фенокси-(1 Е)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси]-3-гидроксифенил-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)акриламид; 3-4-[(2S,3S,4S,5R)-5-(2-фтор-1-метил-3 фенокси-(1Z)-пропенил)-3,4-дигидрокситетрагидрофуран-2-илокси]-3-гидроксифенил-2 метил-N-3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксигексагидробензо[1,3]диоксол-5-ил)-(2 Е)акриламид. Каждое из вышеуказанных соединений,которое было получено или может быть получено согласно способам синтеза, описанным выше, входит в объем настоящего изобретения. Кроме того, соединения, приведенные в таблице ниже, также входят в объем настоящего изобретения. Таблица 1 56 или его фармацевтически приемлемые соль,пролекарство или сольват,где каждый X1 представляет собой -CR6R72 и X представляет собой О;R2 представляет собой Н или С 1-С 6 алкил; каждый R3 независимо выбран из Н,6 7-C(O)NR (СR R )t(С 6-С 10 арил), где t представляет собой целое число в диапазоне от 0 до 1, и арильные группировки вышеупомянутых группR3 возможно замещены 1-3 группами R4; каждый R4 независимо выбран из С 1-С 10 алкила, галогено, циано, трифторметила, С 1-С 6 алкокси, -(СR6R7)m(С 6-С 10 арил) и -C(O)(СR6R7)m(С 6-С 10 арил), где m представляет собой 0; каждый R6 и R7 представляет собой Н. 2. Соединение по п.1, где R3 представляет собой -(СR6R7)t(С 6-С 10 арил), где t такой, как определено выше, а указанная арильная группа возможно замещена одной группой R4. 3. Соединение по п.2, где указанная арильная группа представляет собой фенильную группу, возможно замещенную одной группойR4. 4. Соединение по п.1, где R3 представляет собой -(СR6R7)t(4-10-членный гетероцикл), где t представляет собой 0. 5. Соединение по п.4, где указанная гетероциклическая группа представляет собой пиридильную группу. 6. Соединение по п.1, где R3 представляет собой -C(O)(СR6R7)t(С 6-С 10 арил), где t равно 0, а указанная арильная группа возможно замещена одной группой R4. 7. Соединение по п.6, где указанная арильная группа представляет собой фенильную группу, возможно замещенную одной группойR4. 8. Соединение по п.1, где R3 представляет собой -C(O)NR6(СR6R7)t(С 6-С 10 арил), где t представляет собой 0. 9. Соединение по п.8, где указанная арильная группа представляет собой фенильную группу. 10. Соединение по п.1, выбранное из группы, состоящей из 3-(4-2S,3S,4S,5R)-3,4-дигидрокси-5-(3 гидрокси-1-метил-(1 Е)-пропенил)тетрагидрофуран-2-илокси)-3-гидроксифенил)-2-метил-N3 аS,4R,5R,6S,7R,7 аR)-4,6,7-тригидроксибензо
МПК / Метки
МПК: C07H 15/203, A61K 31/70, A61P 31/04
Метки: гигромицина, агентов, качестве, антибактериальных, производные
Код ссылки
<a href="https://eas.patents.su/30-4303-proizvodnye-gigromicina-a-v-kachestve-antibakterialnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гигромицина а в качестве антибактериальных агентов</a>
Предыдущий патент: β-карболиновые лекарственные продукты
Следующий патент: Новые ароматические амиды, замещенные рибозой, способ их получения и их применение в качестве лекарств
Случайный патент: Рукоятка лыжной палки