β-карболиновые лекарственные продукты
Номер патента: 4302
Опубликовано: 26.02.2004
Авторы: Хартоэр Керри Дж., Крэл Марта А., Стивенсон Грегори А., Андерсон Нил Р.
Формула / Реферат
1. Свободная лекарственная форма в виде частиц соединения, имеющего формулу
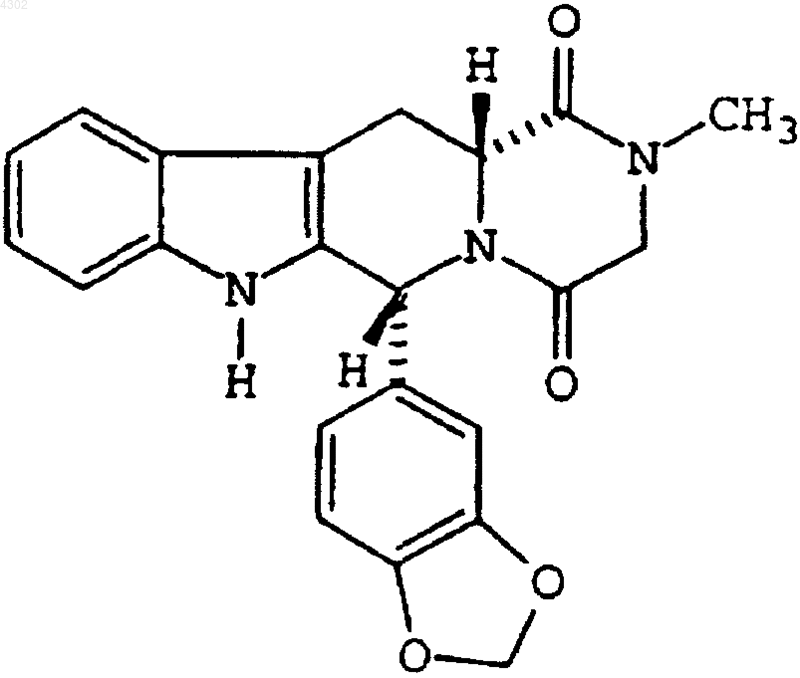
и его фармацевтически приемлемых солей и сольватов, включающая частицы соединения, по меньшей мере 90% которых имеют размер меньше чем приблизительно 40 мкм.
2. Свободная лекарственная форма в виде частиц по п.1, отличающаяся тем, что по меньшей мере 90% частиц имеют размер меньше чем приблизительно 25 мкм.
3. Свободная лекарственная форма в виде частиц по п.1, отличающаяся тем, что по меньшей мере 90% частиц имеют размер меньше чем приблизительно 15 мкм.
4. Свободная лекарственная форма в виде частиц по п.1, отличающаяся тем, что по меньшей мере 90% частиц имеют размер меньше чем приблизительно 10 мкм.
5. Фармацевтическая композиция, включающая свободную лекарственную форму в виде частиц по п.1 и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов.
6. Фармацевтическая композиция по п.5, отличающаяся тем, что свободное лекарственное средство находится полностью в форме частиц.
7. Способ лечения половой дисфункции у пациента, предусматривающий введение пациенту терапевтически эффективного количества композиции, включающей свободную лекарственную форму в виде частиц по п.1 и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов.
8. Способ по п.7, отличающийся тем, что половая дисфункция является мужской эректильной дисфункцией.
9. Способ по п.7, отличающийся тем, что половая дисфункция является нарушением женского полового возбуждения.
10. Фармацевтическая композиция, включающая
(a) свободную лекарственную форму соединения, имеющего формулу
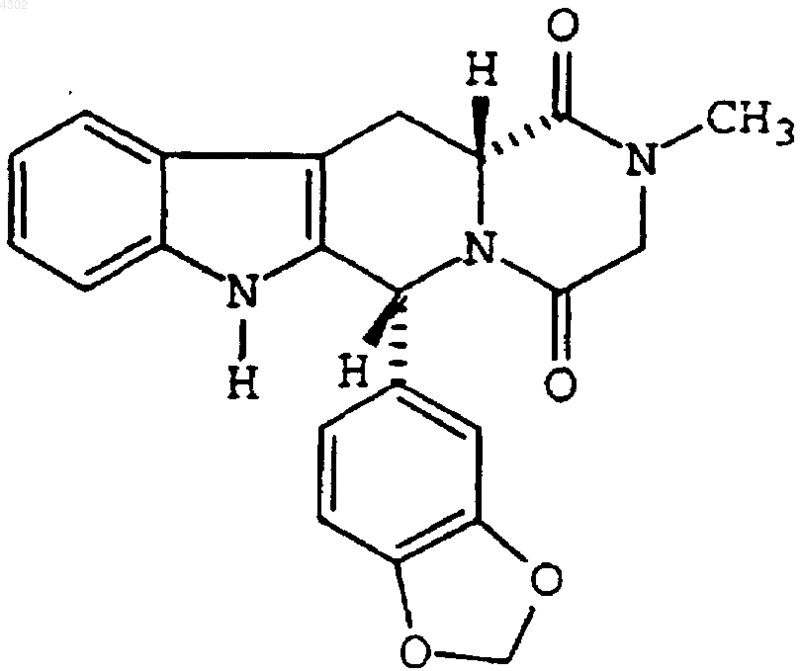
и его фармацевтически приемлемые соли и сольваты и
(b) один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов,
причем композиция имеет величину Cmax от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгЧч/л, измеренную с использованием дозы соединения 10 мг.
11. Композиция по п.10, отличающаяся тем, что она имеет Cmax от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгЧч/л.
12. Фармацевтическая композиция, включающая
(a) соединение, имеющее формулу
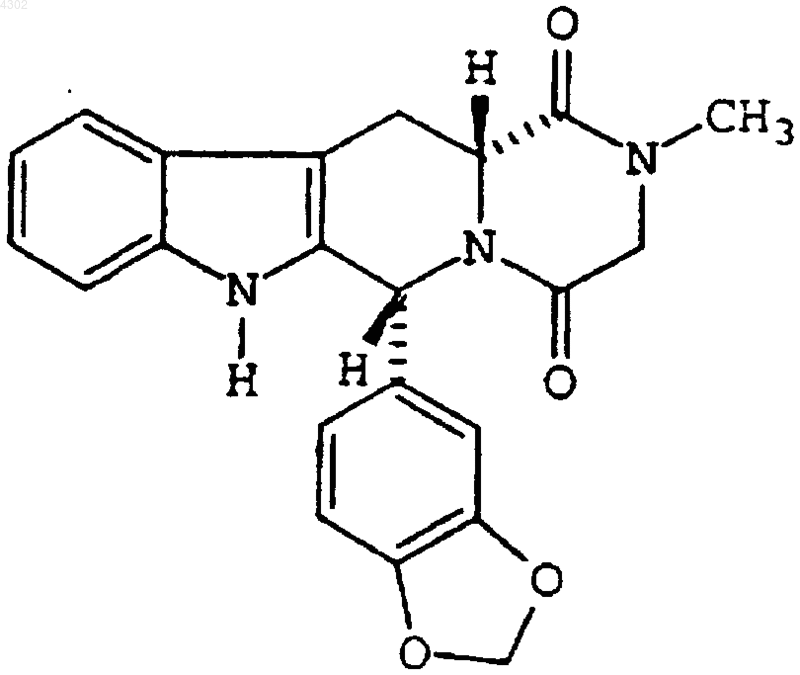
и его фармацевтически приемлемые соли и сольваты и
(b) один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов,
причем композиция имеет величину Cmax от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгЧч/л, измеренную с использованием дозы соединения 10 мг.
13. Фармацевтическая композиция, включающая
(a) свободную лекарственную форму соединения, имеющего формулу
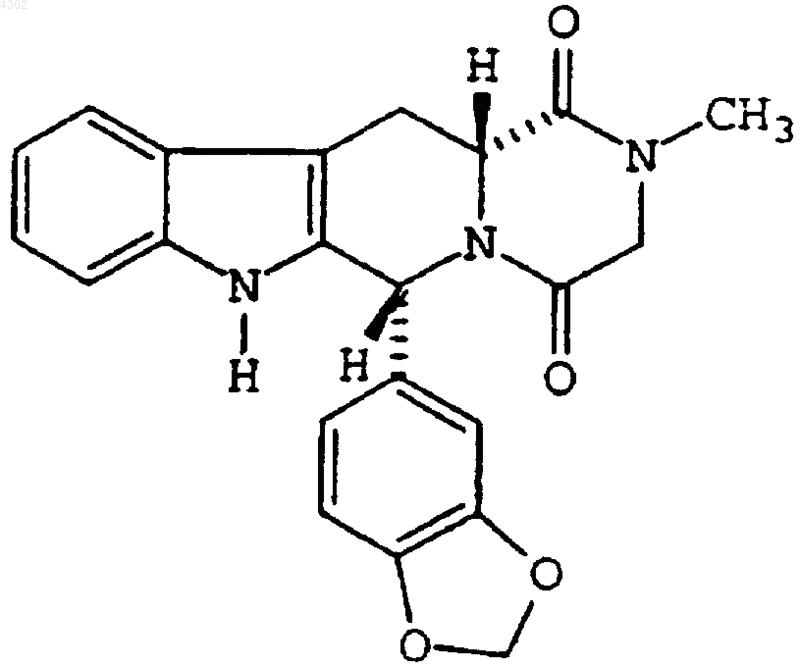
и его фармацевтически приемлемые соли и сольваты, причем по меньшей мере 90% частиц имеют размер меньше чем приблизительно 10 мкм, и
(b) один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов,
и ее биоэквивалентные композиции.
14. Способ изготовления свободной лекарственной формы в виде частиц по п.1, предусматривающий размалывание твердой свободной формы соединения для образования частиц соединения, по меньшей мере 90% которых имеют размер меньше чем приблизительно 40 мкм.
15. Способ изготовления фармацевтической композиции, включающей свободную лекарственную форму в виде частиц по п.1, предусматривающий
(a) размалывание твердой свободной формы соединения для образования частиц соединения, по меньшей мере 90% частиц которых имеют размер меньше чем приблизительно 40 мкм; и
(b) смешивание частиц с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами.
16. Фармацевтическая композиция, полученная смешиванием частиц соединения, имеющего формулу
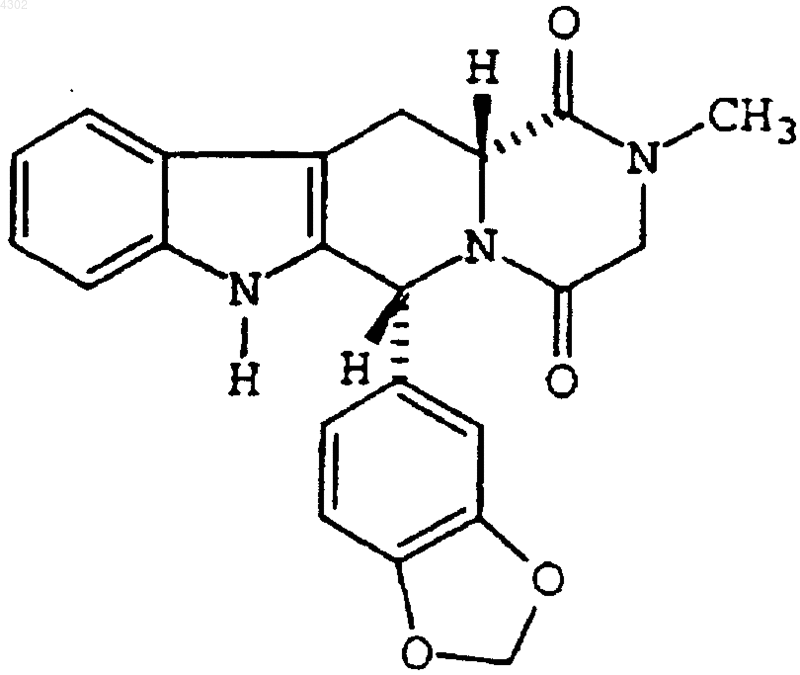
или его фармацевтически приемлемой соли или сольвата с одним или более фармацевтически приемлемыми носителем, разбавителем или эксципиентом, в которой частицы соединения имеют d 90=40 или меньше.
17. Применение частиц свободной формы соединения, имеющего формулу
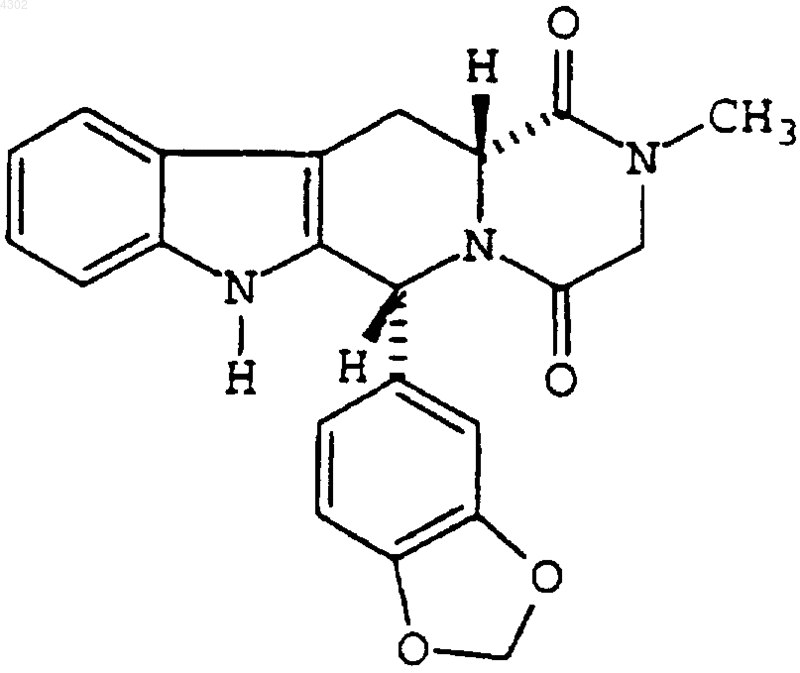
где по меньшей мере 90% частиц имеют размер меньше чем приблизительно 40 мкм, для изготовления лекарственного препарата для лечения половой дисфункции.
18. Применение по п.17, где половая дисфункция это мужская эректильная дисфункция.
19. Применение по п.17, где половая дисфункция это нарушение женского полового возбуждения.
20. Применение частиц свободной формы соединения, имеющего формулу
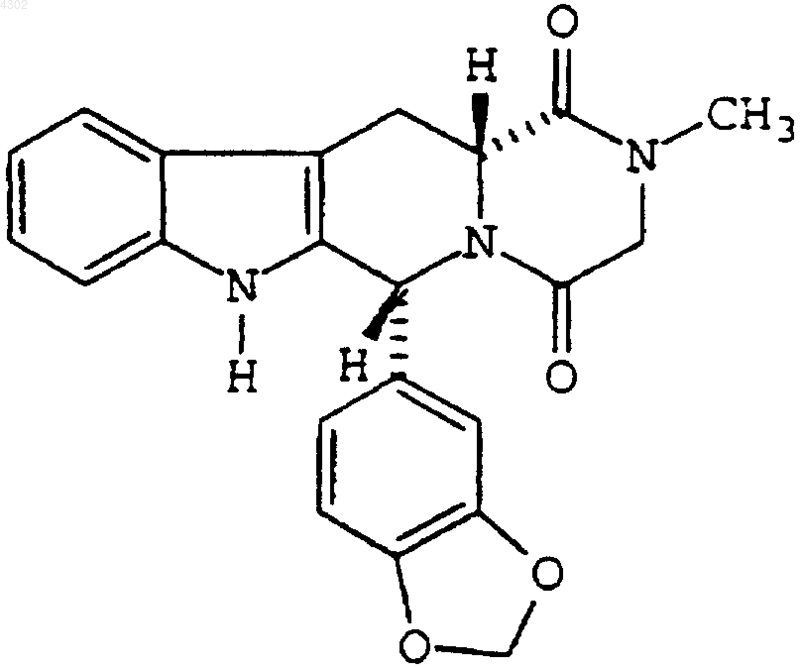
которое имеет величину Cmax от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгЧч/л, измеренную с использованием дозы соединения 10 мг, для изготовления лекарственного препарата для лечения половой дисфункции.
21. Применение по п.20, где половая дисфункция это мужская эректильная дисфункция.
22. Применение по п.20, где половая дисфункция это нарушение женского полового возбуждения.
23. Применение по любому из пп.17-22, где лекарственный препарат составляется для орального введения до максимальной ежедневной дозы 20 мг в день.
Текст
1 Перекрестная ссылка на близкие заявки Данная заявка притязает на преимущество предварительной заявки на патент с регистрационным 60/147048, зарегистрированной 3 августа 1999. Область изобретения Настоящее изобретение относится к области фармацевтической и органической химии и к-карболиновому соединению, которое можно использовать при лечении различных медицинских показаний, где требуется ингибирование специфичной для цГМФ (циклический гуанозинмонофосфат) ФДЭ (фосфодиэстеразы) типа 5. Более конкретно, настоящее изобретение предлагает свободную лекарственную форму частиц -карболина с диапазоном размера частиц, позволяющим получить однородную готовую препаративную форму стабильных фармацевтических композиций, особенно композиций, обеспечивающих желательные свойства биологической доступности, не достигнутые до сих пор в данной области. Предпосылки создания изобретения Биологические, физиологические и клинические действия ингибиторов специфичной для циклического гуанозин-3',5'-монофосфата фосфодиэстеразы (цГМФ-специфичная ФДЭ) предполагает их использование при различных болезненных состояниях, в которых необходима модуляция гладкой мышцы, почечной, гемостатической, воспалительной и/или эндокринной функции. цГМФ-специфичная фосфодиэстераза типа 5 (ФДЭ 5) является основным цГМгидролизующим ферментом в васкулярной гладкой мышце, и была описана его экспрессия в пещеристом теле полового члена (Taher et al.,J. Urol., 149:285A (1993. Таким образом, ФДЭ 5 представляет собой притягивающую мишень при лечении половой дисфункции (Murray,DNP 6(3): 150-156 (1993. В патенте США 5859006 Daugan описывается класс -карболиновых соединений и фармацевтические композиции, содержащие карболины, которые можно использовать при лечении состояний, при которых необходимо ингибирование ФДЭ 5. В публикации РСТ WO 97/03675 описывается использование данного класса -карболиновых соединений при лечении половой дисфункции. Плохая растворимость многих карболиновых соединений, которые можно использовать в качестве ингибиторов ФДЭ 5, побуждает разработку препаратов совместного осаждения, как описано в публикации РСТ WO 96/38131 и патенте США 5985326 Butler. Говоря кратко, например, были получены продукты совместного осаждения -карболина и полимерного фталата гидроксипропилметилцеллюлозы, затем осадки были размолоты, смешаны с эксципиентами и смеси спрессованы в таблетки для перорального введения. Исследования, од 004302 2 нако, показали, что появляются трудности в получении точно воспроизводимых партий продукта совместного осаждения, которые делают использование продукта совместного осаждения менее чем идеальным в фармацевтических готовых препаративных формах. Кроме того, клинические исследования,включающие введение таблеток продукта совместного осаждения, предварительно показали,что максимальная концентрация в крови карболинового соединения достигается спустя время от 3 до 4 ч с еще точно не определенным средним временем начала терапевтического действия. При лечении половой дисфункции,такой как мужская эректильная дисфункция или нарушение женского полового возбуждения,однако, часто для индивидуумов, для которых требуется более немедленные и/или менее пролонгированные действия, часто желательным является более быстрое достижение максимальной концентрации в крови вместе с большей перспективой быстрого начала терапевтического эффекта. В соответствии с этим, в данной области продолжает оставаться потребность в перорально вводимых -карболиновых соединениях и содержащих -карболины фармацевтических композициях, обладающих способностью обеспечить терапевтическое действие в пределах требуемой или, по меньшей мере, приемлемой временной рамки. Краткое изложение сущности изобретения Настоящее изобретение предлагает препараты в виде частиц свободной лекарственной формы -карболинового соединения, имеющего специфические и определенные характеристики размера частиц. Определенный размер частиц делает возможным получение однородной готовой препаративной формы стабильных фармацевтических композиций. В частности, настоящее изобретение предлагает композиции, которые проявляют быстрое достижение максимальной концентрации в крови ингибитора ФДЭ 5 и/или быстрое начало терапевтического ингибирующего ФДЭ 5 действия. Настоящее изобретение предлагает соединение, имеющее формулу (I) и его фармацевтически приемлемые соли и сольваты, где соединение является свободным лекарственным средством в форме частиц и где,по меньшей мере, 90% частиц имеют размер меньше, чем приблизительно 40 мкм (микрон),и предпочтительно меньше, чем 30 мкм. Очень 3 предпочтительные формы в виде частиц карболинового соединения (I) содержат по меньшей мере 90% частиц размером меньше,чем 25 мкм. Очень предпочтительными формами свободного соединения (I) являются формы,в которых 90% частиц имеют размер меньше,чем 10 мкм. Настоящее изобретение предлагает, следовательно, свободную форму -карболинового соединения и композиции, содержащие карболиновое соединение, которые можно использовать в эффективной терапии состояний, в которых ингибирование ФДЭ 5 обеспечивает благотворное действие. Свободная форма карболинового соединения (I) имеет такой размер частиц, что начало благотворных действий по ингибированию ФДЭ 5 проявляется в относительно короткое время после перорального введения. Настоящее изобретение далее относится к фармацевтическим композициям, включающим соединение (I) в виде частиц и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Изобретение далее предлагает использование соединения(I) и фармацевтических композиций для лечения половой дисфункции, например мужской эректильной дисфункции и нарушения женского полового возбуждения. Альтернативно настоящее изобретение предлагается для использования вышеописанных форм соединения (I) в виде частиц для изготовления лекарственных препаратов для лечения половой дисфункции. Конкретные состояния, которые можно лечить соединением и композициями настоящего изобретения, включают, но не ограничиваются ими, мужскую эректильную дисфункцию и женскую половую дисфункцию, например, женское нарушение возбуждения, известное также как нарушение женского полового возбуждения. В соответствии с этим, одним аспектом настоящего изобретения является предложение свободной лекарственной формы в виде частиц соединения (I) и его фармацевтически приемлемых солей и сольватов, включающей частицы соединения, по меньшей мере 90% которых имеют размер меньше, чем приблизительно 40 мкм. Другим аспектом настоящего изобретения является предложение фармацевтической композиции, включающей частицы свободной лекарственной формы соединения (I), имеющегоd90 меньше, чем 40, и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов, и способ изготовления композиции. Еще одним аспектом настоящего изобретения является предложение способа лечения половой дисфункции у пациентов, нуждающихся в этом, включающего введение пациенту, 004302 4 нуждающемуся в этом, терапевтически эффективного количества композиции, включающей частицы свободной лекарственной формы соединения (I), имеющего d90 меньше, чем 40, и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. Половой дисфункцией может быть, например,мужская эректильная дисфункция или нарушение женского возбуждения. Еще одним аспектом настоящего изобретения является предложение фармацевтической композиции, включающей (а) свободную лекарственную форму соединения (I) и его фармацевтически приемлемых солей и сольватов и (b) один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов,где композиция имеет величину Сmах приблизительно от 180 до приблизительно 280 мкг/л или величину AUC (0-24) приблизительно от 2280 до приблизительно 3560 мкгч/л, измеренную с использованием дозы соединения 10 мг. Композиция может быть твердой, суспензией или раствором. Другим аспектом настоящего изобретения является предложение фармацевтической композиции, включающей (а) соединение (I) и его фармацевтически приемлемые соли и сольваты и (b) один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов, где композиция имеет величину Сmаx приблизительно от 180 до приблизительно 280 мкг/л и величину AUC (0-24) приблизительно от 2280 до приблизительно 3560 мкгч/л, измеренную с использованием дозы соединения 10 мг. Композиция может быть твердой или суспензией. Другим аспектом настоящего изобретения является предложение фармацевтической композиции, включающей (а) свободную лекарственную форму соединения (I) и его фармацевтически приемлемых солей и сольватов, где по меньшей мере 90% частиц имеют размер меньше, чем приблизительно 10 мкм, и (b) один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов и ее биоэквивалентных композиций. Композиция может быть твердой или суспензией. Эти и другие аспекты настоящего изобретения будут более очевидными из следующего подробного описания изобретения. Краткое описание графического материала Чертеж содержит графики зависимости % растворенного соединения (I) от времени и иллюстрации характеристик растворения in vitro соединения (I) при изменении размера частиц. Подробное описание изобретения Для целей заявленного изобретения, как раскрыто и описано здесь, следующие термины и аббревиатуры имеют следующие значения. Термин лечение включает профилактику, снижение, прекращение или движение в об 5 ратном направлении развития или серьезности состояния или симптомов, которые подвергают лечению. Как таковое, настоящее изобретение включает, при необходимости, как терапевтическое, так и профилактическое введение. Термин эффективное количество означает количество соединения (I) или композиции,содержащей соединение (I), которое эффективно при лечении представляющего интерес состояния или симптома. Эффективное количество соединения для лечения половой дисфункции у мужчин, является количеством, достаточным для обеспечения и поддержания эрекции, способной гарантировать проникновение внутрь партнера. Эффективное количество соединения(I) для лечения женской половой дисфункции,особенно женского нарушения полового возбуждения, является количеством, достаточным для усиления способности женщины достигать или поддерживать возбужденное состояние. Термин свободное лекарственное средство относится к твердым частицам соединения(I), не встроенным однородно в полимерный продукт совместного осаждения. Термин суспензия относится к жидкой композиции, содержащей свободные лекарственные частицы соединения (I). Термин раствор относится к жидкой композиции, имеющей растворенное в ней соединение (I). Термин сольват включает одну или несколько молекул соединения (I), ассоциированных с одной или несколькими молекулами растворителя, например воды или уксусной кислоты. Термин пероральная дозированная лекарственная форма используют в общем смысле для обозначения фармацевтических продуктов,вводимых через рот. Специалистами в данной области признано, что твердые пероральные дозированные лекарственные формы включает такие формы, как таблетки, капсулы и аэрозоли. Термин фармацевтически приемлемый означает носители, эксципиенты, разбавители,формы солей соединения (I) и другие ингредиенты готовой препаративной формы, которые совместимы со всеми другими ингредиентами композиции и не являются вредными для индивидуума, которого лечат данной композицией. Номенклатура, описывающая размер частиц соединения (I), обычно упоминается и обозначается здесь как d90. Например, d90 40(или d90=40) означает, что по меньшей мере 90% частиц имеют размер меньше, чем 40 мкм. Как указано, настоящее изобретение предлагает соединение структурной формулы (I) и его фармацевтически приемлемые соли и сольваты, отличающиеся тем, что указанное соединение является свободным лекарственным соединением в форме частиц, где по меньшей мере 90% частиц имеют размер меньше, чем приблизительно 40 мкм.[2',1':6,1]пиридо[3,4-b]индол-1,4-дионом,как описано в патенте США 5859006 Daugan, и представленного структурной формулой (I) с целью получения частиц, имеющих размер в конкретном узком диапазоне, повышается способность его к образованию фармацевтической композиции, и в результате можно получить фармацевтические композиции, которые имеют повышенную биологическую доступность активного ингредиента, т.е. соединения (I). Настоящее изобретение включает частицы свободного соединения (I), где по меньшей мере 90% частиц свободного лекарственного средства имеют размер частиц меньше, чем приблизительно 40 мкм (т.е. d90=40) и предпочтительно меньше чем 30 мкм. Более предпочтительно по меньшей мере 90% частиц имеют размер меньше чем 25 мкм, еще более предпочтительно меньше чем 15 мкм, и для достижения полного преимущества настоящего изобретения, d90 составляет меньше чем 10 мкм. Предполагаются также частицы, имеющие d90 в нанометровом диапазоне (например, приблизительно 200 нм или меньше, или приблизительно 50 нм или меньше). Однако с частицами нанометрового размера соединения (I) трудно оперировать, из них трудно получить препараты и они имеют тенденцию агрегироваться. Следовательно,предпочтительный диапазон d90 для частиц свободного соединения (I) составляет приблизительно от 1 до приблизительно 40 мкм. Свободное лекарственное средство, предпочтительно, является кристаллическим. Однако, предполагаются также аморфные и частично аморфные формы соединения (I), и они включаются в настоящее изобретение. Знакомым с методиками процесса измельчение должно быть понятно, что ограничение,установленное по размеру 90% или более частиц с использованием обычных методик размалывания, является признаком для дальнейшего отличия частиц соединений изобретения от частиц, имеющих более широкое распределение размера частиц. Из-за варьирования в размере,встречающегося во всем веществе, уменьшенном по размеру способом измельчения, выражение различий в размере частиц таким образом, 7 как описано здесь, легко воспринимается специалистом в данной области. Настоящее изобретение предлагает также фармацевтические композиции, включающие указанное соединение (I) в виде частиц и один или несколько фармацевтически приемлемых эксципиентов, разбавителей или носителей. Эксципиент, разбавитель или носитель может быть твердым компонентом или жидким компонентом композиции. В соответствии с этим,фармацевтические композиции, содержащие частицы свободного соединения (I), могут быть твердой композицией или могут быть суспензией частиц свободного соединения (I) в жидком эксципиенте, разбавителе или носителе. Соединение структурной формулы (I) можно получить в соответствии с принятыми методиками, такими как методики, подробно описанные в патенте США 5859006, включенном здесь в качестве ссылки. Получение соединения структурной формулы (I) конкретно предлагается в патенте США 5859006. Способы определения размера частиц хорошо известны в данной области. Например,можно использовать общий способ патента США 4605517, включенного здесь в качестве ссылки. Нижеследующее представляет собой описание одного неограничивающего способа. При получении соединения настоящего изобретения в виде частиц соединение структурной формулы (I) в его исходном состоянии сначала характеризуют по размеру с использованием инструмента, приспособленного для измерения диаметра эквивалентного сферического объема, например лазерного рассеивающего анализатора распределения размера частицHoriba или эквивалентного инструмента. В типичном случае предполагается, что репрезентативный образец соединения структурной формулы (I) включает, в его исходном состоянии,частицы, имеющие d90 диаметр эквивалентного сферического объема приблизительно от 75 до приблизительно 200 мкм при широком распределении размера частиц. После получения характеристики по размеру в его исходном состоянии свободное лекарственное соединение затем размалывают,например, с использованием стержневой мельницы в подходящих условиях скорости вращения мельницы и скорости подачи сырья, для получения частиц с величиной размера в вышеуказанных пределах настоящего изобретения. Мониторинг эффективности размалывания проводят посредством отбора проб и использования лазерного рассеивающего анализатора распределения размера частиц Horiba LA910 и конечный размер частиц подтверждают аналогичным способом. Если первое пропускание через мельницу является недостаточным для получения требуемого распределения размера частиц, тогда проводят одно или несколько дополнительных пропусканий. Другие методологии для по 004302 8 лучения частиц, как описано здесь, являются легко доступными, в том числе различные методики размалывания, такие как использующие молотковую или струйную мельницу. Частицы соединения (I) в исходном состоянии, а также после размалывания или после применения других способов уменьшения размера частиц имеют неправильную форму. Поэтому необходимо характеризовать частицы посредством размера, отличающегося от истинного размера, такого как толщина или длина,например, измерением свойства, такого как интенсивность и угол преломленного света, и соотносить это измерение с диаметром известных сферических частиц, у которых измерено то же самое свойство. Частицам, таким образом, приписывают эквивалентный сферический диаметр. Величины, найденные при получении характеристик большого числа неизвестных частиц, можно нанести на график как зависимость кумулятивной частоты от диаметра, или по другим способам, массы от диаметра, обычно принимая процентные заниженные величины для кумулятивной частоты или массы. Это дает характеристическую кривую, представляющую распределение размеров частиц образца, т.е. кривую кумулятивного процентного распределения заниженных величин. Величины можно считывать непосредственно из кривой или, в альтернативном случае, измерения наносят на вероятностную бумагу для логарифмического нормального распределения для получения прямой линии, величины можно считывать из указанной линии. Таким образом найденный d90 диаметр эквивалентного сферического объема является статистическим представлением 90% точки на графике кумулятивной частоты. Как указано,d90 диаметр эквивалентного сферического объема частиц размолотого соединения формулы (I) оценивают с использованием лазерного рассеивающего анализатора распределения размера частиц Horiba LA910 или другого такого инструмента, принятого специалистами в данной области. С использованием такого инструмента получают величины для суспензии частиц неизвестного размера, и мониторинг инструмента проводят с использованием контрольного образца, имеющего частицы в диапазоне размеров,ожидаемого на основе статистического анализа контрольного образца. Размер частиц соединения (I) до изготовления из него фармацевтической композиции можно измерить, например, следующим способом. Анализ распределения размеров частиц проводят лазерным рассеивающим способом на небольшом образце размолотого материала,который суспендируют приблизительно в 180 мл раствора диспергатора. До суспендирования образца получают раствор диспергатора, содержащий 0,1% Спана 80 в циклогексане и предварительно насыщенный соединением (I). Раствор 9 диспергатора фильтруют через микропористый мембранный фильтр 0,2 мкм для получения не содержащего частицы раствора диспергатора. Образец затем добавляют к раствору диспергатора до достижения приемлемого уровня затемнения лазерного луча, в этой точке измеряют распределение размера частиц. Проводят измерения как минимум в трех повторностях, чтобы а) обеспечить получение более достоверных измерений и b) проверить эквивалентный отбор образца суспендированного материала. Результаты автоматически регистрируют и демонстрируют графически для получения зависимости кумулятивного % заниженного размера от диаметра и процента частоты от диаметра образца. Из этого получают величину d90 диаметра эквивалентного сферического объема (величина 90% кумулятивного заниженного размера). Соединение структурной формулы (I) в форме свободных частиц в указанных выше пределах можно затем смешать с эксципиентами, разбавителями или носителями, в зависимости от того, которые из них необходимы, чтобы обеспечить получение, например, сухих порошков, аэрозолей, суспензий, заполненных суспензионной или твердой композицией капсул и прессованных таблеток в качестве пероральных дозированных лекарственных форм соединения(I). Можно определить также размер частиц свободного соединения (I) в фармацевтической композиции. Например, предполагается что d90 размер частиц соединения (I) можно определить либо в приготовленной дозированной лекарственной форме, либо в виде частиц свободного лекарственного средства микроскопическим способом. Сначала композицию делят на ее индивидуальные компоненты или из композиции выделяют, по меньшей мере, соединение (I). Специалисты в данной области знают методики разделения, которые сохраняют размер частиц соединения (I) во время выделения соединения(I) из композиции. Например, водорастворимые компоненты композиции можно растворить в воде, в результате чего остаются совсем не растворимые частицы соединения (I) без изменения размера частиц соединения (I). Нерастворенные частицы можно затем изучить под микроскопом. Кристаллическое соединение (I) можно визуально отличить от аморфных ингредиентов композиции. Размер частиц соединения (I) определяют визуальным осмотром и сравнением со стандартизированными частицами известного размера. Чтобы быть уверенным, что определяется размер частиц соединения (I), для анализа частиц и подтверждения их идентичности как соединения (I),можно использовать инфракрасный микроскоп. Для изготовления таблеток можно использовать любые фармацевтически приемлемые эксципиенты. Таблетки в типичном случае со 004302 10 держат приблизительно от 1 до приблизительно 20 мг соединения (I). Так, например, соединение формулы (I) в виде частиц можно смешать с обычно признанными как безопасные фармацевтическими эксципиентами, в том числе жидкими разбавителями, твердыми разбавителямиPharm. Assoc. (1994). Предпочтительные твердые эксципиенты включают лактозу, гидроксипропилцеллюлозу, лаурилсульфат натрия, микрокристаллическую целлюлозу, тальк, коллоидный диоксид кремния, крахмал, стеарат магния,стеариновую кислоту и натриевую соль кроскармеллозы. Жидкие эксципиенты включают,например, пропиленгликоль, глицерин и этанол. Фармацевтические композиции получают стандартными методиками изготовления фармацевтических композиций, как описано в Remington's Pharmaceutical Sciences, 18th Ed. (1990),Mack Publishing Co., Easton, PA. Такие методики включают, например, мокрое гранулирование с последующей сушкой, размалыванием и прессованием в таблетки с покрытием пленкой или без покрытия; сухое гранулирование с последующим размалыванием, прессованием в таблетки с покрытием пленкой или без покрытия; сухое смешивание с последующим прессованием в таблетки с покрытием пленкой или без покрытия; получение формованных таблеток; саше; суспензий; мокрое гранулирование, сушку и наполнение в желатиновые капсулы; наполнение сухой смеси в желатиновые капсулы или наполнение суспензии в желатиновые капсулы. Твердые композиции обычно имеют идентифицирующие маркеры, которые наносят не способом печати или печатают на поверхности. Суммарные активные ингредиенты в таких фармацевтических композициях составляют от 0,1 до 99,9%, предпочтительно приблизительно от 1 до 10 мас.% композиции. Относительный массовый процент эксципиентов предпочтительно является следующим: Кол-во, мас.% Соединение (I) от 1 до 6 Лактоза (разбавитель) от 50 до 75 Гидроксипропилцеллюлоза от 1 до 5(связующее/разбавитель) Натриевая соль кроскармеллозы от 3 до 10(дезинтегрирующее средство) Лаурилсульфат натрия от 0 до 5(смачивающий агент) Микрокристаллическая целлюлоза от 5 до 50 Конкретная доза соединения (I), введенного по данному изобретению, конечно, определяется конкретными условиями данного случая, 11 включая, например, путь введения, качество жизни пациента и патологическое состояние,которое подергают лечению. Типичная суточная доза имеет уровень нетоксичной дозы приблизительно от 1 до приблизительно 20 мг/день соединения (I). Предпочтительные суточные дозы обычно составляют приблизительно от 1 до приблизительно 20 мг/день, особенно, 5, 10 и 20 мг таблетки, введенные, если необходимо. Композиции данного изобретения можно вводить различными путями, подходящими для конкретных дозированных лекарственных форм,их предпочтительно вводят пероральным путем. До введения данные соединения предпочтительно изготовляют в виде фармацевтических композиций. Выбор дозы определяется штатным врачом больницы. Продукт совместного осаждения соединение (I)/фталат гидроксипропилметилцеллюлозы получают обычно способом, указанным в патенте США 5985326 Butler. После получения совместного осадка его размалывают для получения частиц, имеющих относительно большой размер и относительно широкое распределение размера частиц, т.е. d50=200 мкм. Совместный осадок подвергают регулируемому растворению при значении рН, при котором не происходит высвобождения соединения (I) из полимерного компонента продукта совместного осаждения. Авторами заявки обнаружено, что совместный осадок содержал часть свободной лекарственной формы соединения (I), не включенной в полимер совместного осадка. В клинических исследованиях (см. пример 2) авторы заявки далее обнаружили, что уровни соединения (I) в крови через 30 мин после введения определяются свободным лекарственным средством, присутствующим в композициях продукта совместного осаждения. Данные результаты являются неожиданными ввиду патента США 5985326 Butler,который относится к способу получения твердой дисперсии соединения (I) в виде продукта совместного осаждения. Описанный способ и продукт совместного осаждения патента США 5985326 Butler относятся к получению твердой дисперсии плохо растворимого в воде лекарственного средства, которое имеет повышенную биологическую доступность по сравнению со свободными частицами плохо растворимого в воде лекарственного средства. Следовательно, в патенте США 5985326 Butler сделана попытка избежать свободную форму лекарственного средства. В патенте США 5985326Butler в общем описывается размалывание продукта совместного осаждения, но имеется недостаток, заключающийся в отсутствии описания размера частиц продукта совместного осаждения после размалывания и, особенно, отсутствии описания либо присутствия свободной лекарственной формы соединения (I) либо, если 12 она присутствует, размера частиц свободной лекарственной формы соединения (I). На основе данных высказываний был сделан вывод, что бимодальную доставку соединения (I) можно достичь быстрой доставкой свободного лекарственного средства с последующей более медленной доставкой лекарственного средства при рН-чувствительном высвобождении из частиц полимерного продукта совместного осаждения. Эти наблюдения, в свою очередь, обусловливали возможность того, что быструю доставку лекарственного средства можно было осуществить композициями, включающими соединение (I) полностью в свободной лекарственной форме, при условии, что может быть достигнута подходящая стабильность и что размер частиц лекарственного средства регулируют в хорошо установленном диапазоне для изготовления композиции. В соответствии с этим соединение (I) в фармацевтических композициях настоящего изобретения предпочтительно включается полностью в виде свободного лекарственного средства в форме частиц, но в альтернативном случае композиция может содержать комбинацию свободного лекарственного средства в форме частиц и формы внедренного лекарственного средства для бимодальной доставки лекарственного средства. Свободное лекарственное средство предпочтительно составляет больше, чем 75% (очень предпочтительно, больше, чем 90%) соединения (I) в таких композициях. В одном осуществлении настоящего изобретения свободная лекарственная форма соединения (I) и фармацевтически приемлемые эксципиенты, разбавители и носители присутствуют в фармацевтической композиции, которая имеет величину Сmаx (т.е. максимально наблюдаемая концентрация соединения (I) в плазме) приблизительно от 180 до приблизительно 280 мкг/л (микрограммов/литр) или AUC (0-24) (т.е. площадь под кривой концентрации в плазме во время от 0 до 24 ч) приблизительно от 2280 до приблизительно 3560 мкгч/л (мкгч/л), измеренную с использованием 10 мг дозы соединения. В предпочтительном осуществлении композиция имеет величину Сmах приблизительно от 180 до приблизительно 280 мкг/л и AUC (0-24) приблизительно от 2280 до приблизительно 3560 мкгч/л, измеренную с использованием 10 мг дозы соединения. В данном осуществлении композиция может быть твердой, например, в виде таблетки или порошка, когда используют твердые разбавители, носители и/или эксципиенты, или суспензией, например, капсулированной в мягком геле, или раствором при использовании жидких носителей, разбавителей и/или носителей. Сmax и AUC (0-24) определяли анализом соединения (I) в плазме с использованием проверенного способа ЖХ/МС/МС с нижним пре 13 делом количества 0,5 нг/мл. Анализируемые вещества и внутренний стандарт, т.е. [13 С][2 Н 3]изотоп соединения (I), экстрагировали из плазмы способом экстракции твердой фазы 3 мл картриджами Empore SD C2, использующими 150 мкл смеси 90:10 метанол:вода. Анализируемые вещества разделяли с использованием высокоэффективной жидкостной хроматографии с колонкой Penomenex Luna фенилгексил (4,6 мм х 100 мм, 5 мкм) и с использованием в качестве подвижной фазы смеси вода:ацетонитрил(положительные ионы) при атмосферном давлении (APCI). Должно быть понятно, что Сmаx и AUC (024) в плазме зависят от дозы. Например, композиция, содержащая 20 мг дозу соединения (I),будет иметь Сmаx и AUC (0-24) приблизительно в 2 раза выше, чем композиция, содержащая 10 мг дозу. Аналогично этому композиция, содержащая 5 мг дозу соединения (I), будет иметь величины Сmах и AUC (0-24), составляющие приблизительно половину величины композиции, содержащей 10 мг дозу. В соответствии с этим настоящее изобретение включает, например, композиции, содержащие 20 мг дозу соединения (I), имеющего Сmах приблизительно от 360 до приблизительно 560 мкг/л и/или AUC (0-24) приблизительно от 4560 до приблизительно 7120 мкгч/л, и композицию, содержащую 5 мг дозу соединения (I),имеющего Сmах приблизительно от 90 до приблизительно 140 и/или AUC (0-24) приблизительно от 1140 до приблизительно 1780 мкгч/л. Специалисты в данной области знакомы с методиками, в которых Сmах и AUC (0-24) композиций, содержащих дозу соединения (I), отличающуюся от 10 мг, можно сравнить с Сmах иAUC (0-24) композиции, содержащей 10 мг дозу соединения (I), или стандартизировать по ним. В другом осуществлении композиция, содержащая соединение (I) либо в виде только свободного лекарственного средства, либо в виде свободного лекарственного средства, смешанного с продуктом совместного осаждения соединения (I), и фармацевтически приемлемые эксципиенты, разбавители и носители, имеет Стах приблизительно от 180 до приблизительно 280 мкг/л и AUC (0-24) приблизительно от 2280 до приблизительно 3650 мкгч/л. В данном осуществлении композиция может быть твердой или суспензией. Еще одним осуществлением настоящего изобретения является фармацевтическая композиция, содержащая терапевтически эффективное количество частиц соединения (I) и фармацевтически приемлемые носители, разбавители и эксципиенты, где по меньшей мере 90% час 004302 14 тиц соединения (I) имеют размер меньше, чем приблизительно 10 мкм, и ее биоэквивалентные композиции. Термин биоэквивалентные композиции определяется здесь как композиция,имеющая Сmах приблизительно от 180 до приблизительно 280 мкг/л и AUC (0-24) приблизительно от 2280 до приблизительно 3560 мкгч/л,измеренные с использованием 10 мг дозы частиц соединения (I), имеющих d90=10, и подвергаемого испытанию человека. Сmах и AUC (0-24) определяют способами,хорошо известными специалисту в данной области, с использованием, например, людей,приматов, собак, кроликов или грызунов (например, крыс, мышей, морских свинок и хомячков) в качестве испытуемых субъектов для установления биоэквивалентности. Предпочтительными испытуемыми животными являются люди и собаки. Настоящее изобретение можно легче понять при рассмотрении следующих иллюстративных примеров, в которых: пример 1 относится к характеристикам растворимости in vitro свободной лекарственной формы соединения (I) с различным размером частиц; примеры 2 и 3 относятся к испытаниям in vivo фармацевтических композиций, включающих форму частиц по изобретению, по сравнению с композициями,включающими продукт совместного осаждения,и по сравнению с соединением (I) с относительно большим размером частиц, и примеры 4 и 5 относятся к фармацевтическим композициям,использующим свободное лекарственное средство в виде частиц по изобретению при различных эффективностях доз. Пример 1. Испытания на растворимость in vitro проводили с использованием соединения (I), которое было обработано размалыванием его в форме частиц исходного состояния (d90=75-200 мкм) в препараты частиц, имеющих следующие величины d90 (микроны): партия 1, d90=4; партия 2, d90=22; партия 3, d90=55; партия 4,d90=65; партия 5, d90=73 и партия 6, d90=116. Для создания различных партий использовали другие методики размалывания. Например, партию 1 получали с использованием струйной мельницы плоскопараллельного типа 12 дюймов, работающей со скоростью подачи 28-30 кг/ч и с достаточным давлением размалывания для получения материала с d90=4. Партию 2 получали в универсальной мельнице Alpine(стержневые пластины) и работающей при скорости приблизительно 10000 об./мин. Партии оценивали in vitro точным взвешиванием приблизительно 10 мг сыпучего лекарственного средства в пробирке для испытания,добавлением 1 мл очищенной воды и обработкой ультразвуком в течение вплоть до 2 мин,чтобы быть уверенным в том, что порошок был увлажнен. Суспензию лекарственного средства затем переносили в устройство-сосуд для растворения, содержащий 1000 мл водного 0,5% лаурилсульфата натрия при 37 С. Пробирку для испытания промывали несколькими аликвотами нагретой среды для растворения и аликвоты добавляли обратно в сосуд для растворения. Скорость перемешивания была 50 об./мин и образцы отбирали через 5, 10, 20 и 30 мин и затем анализировали ВЭЖХ. Результаты приведены на чертеже, они показывают, что имеет место повышенное растворение in vitro соединения (I) с частицами меньшего размера. Пример 2. Улучшение в биологической доступности и воспроизводимости фармацевтических препаратов, которое стало доступным благодаря настоящему изобретению, демонстрируют in vivo с участием людей. Следующая табл. 1 демонстрирует фармацевтические композиции, полученные, как в примерах 4 и 5, со свободным лекарственным средством в виде частиц, имеющих d90 8,4 мкм, по сравнению с композицией,включающей совместный осадок соединения (I) с фталатом гидроксипропилметилцеллюлозы(совместный осадок). В каждом случае таблетированная композиция была предназначена для доставки 10 мг дозы соединения (I). Таблица 1 Оценка in vivo Фармацевтическая композиция Свободное лекарственное средство соединения (I) Совместный осадок соединения (I) Композиция, включающая свободную лекарственную форму в виде частиц, имеющаяd90 8,4, демонстрировала значительно улучшенный Тmах по сравнению с композицией, содержащей продукт совместного осаждения (Тmах является величиной времени, необходимого для достижения пиковых уровней лекарственного средства в крови, и показателем ускоренного начала действия). Готовая препаративная форма свободного лекарственного средства в виде частиц соответственно имела более высокую скорость абсорбции соединения (I) в плазме, обеспечивая средний геометрический уровень его в плазме за 30 мин 51 нг/мл (нанограммы на миллилитр) по сравнению с 29 нг/мл для готовой препаративной формы продукта совместного осаждения. Пример 3. Было проведено исследование для определения биоэквивалентности таблеток, содержащих соединение (I) с разными размерами частиц. Таблетки содержали соединение (I) с размером частиц d90=8,4 мкм, d90=20 мкм илиd90=52 мкм. Исследование было открытым, рандомизированным, перекрестным по трем периодам исследования, проведенным с участием двадцати 16 четырех (24) здоровых мужчин-субъектов возраста от 18 до 65 лет, разделенных на две группы по 12 субъектов. В каждом из трех периодов обработки вводили одну 10 мг пероральную дозу с 180 мл воды и сравнивали фармакокинетические данные таблеток, содержащих соединение (I) с разными размерами частиц. После дозированного введения субъекты подвергались отбору проб крови для фармакокинетических измерений. Имелся интервал, по меньшей мере, 10 дней между дозированным введением в каждый период обработки, чтобы исключить присутствие любого остаточного соединения (I) из предыдущего периода обработки. Оценку после исследования проводили через период между 7 и 14 днями после последнего дозированного введения. Соединение (I) было адсорбировано относительно быстро после перорального дозированного введения готовых препаративных форм с размером частиц d90=52, 30 и 8,4 мкм. Однако скорость и степень абсорбции соединения (I) повышалась с уменьшением размера частиц. Сравнение данных Сmаx и AUC (0-24) показало,что различие в абсорбции между готовыми препаративными формами с частицами разных размеров было больше всего очевидным на протяжении первых 24 ч после дозированного введения. Используемый здесь Сmax определяют как максимально наблюдаемую концентрацию соединения (I) в плазме и AUC (0-24) определяют как площадь под кривой зависимости концентрации в плазме от времени от 0 до 24 ч. Как Сmаx, так и AUC (0-24) являются хорошо известными и понятными переменными величинами для специалистов в данной области. Что касается Cmax, готовые препаративные формы с d90=52 мкм и d90=20 мкм не были биоэквивалентными с готовой препаративной формой с d90=8,4 мкм, потому что 90% уровень достоверности (Сl) был за пределами ограничений эквивалентности от 0,8 до 1,25. В частности, Cmax был на 36 и 23% ниже для готовых препаративных форм с 52 и 20 мкм соответственно, по сравнению с готовой препаративной формой 8,4 мкм. Готовая препаративная форма с 52 мкм также не была эквивалентна готовой препаративной форме с 8,4 мкм в отношении величины AUC (0-24), которая была на 23% ниже, чем у готовой препаративной формы с 8,4 мкм. Готовые препаративные формы с 20 и 8,4 мкм были биоэквивалентными в отношенииAUC (1-24). Готовые препаративные формы с 8,4, 20 и 52 мкм были биоэквивалентными в отношении AUC, т.е. площади под кривой зависимости концентрации в плазме от времени при времени от нуля до бесконечности. Исследование показало, что скорость абсорбции соединения (I), основанная на Cmax иtmax (т.е. время для достижения максимально наблюдаемой концентрации лекарственного средства в плазме) была медленнее для готовых 17 препаративны форм с 52 мкм по сравнению с готовой препаративной формой с 8,4 мкм. Как указано выше, значение Cmax не было равным по величине для готовых препаративных форм с 52 и 20 мкм по сравнению с готовой препаративной формой с 8,4 мкм. Среднее tmax было на 1 ч больше для готовой препаративной формы с 52 мкм, но было одинаковым для готовых препаративных форм с 20 и 8,4 мкм. В следующей таблице суммируются различные фармакокинетические параметры соединения (I) после перорального введения одной 10 мг дозы готовых препаративных форм с размером частиц d90 52, 20 и 8,4 мкм. Данное исследование показало, что уменьшение размера частиц соединения (I) в соответствии с настоящим изобретением оказывает влияние in vivo на скорость абсорбции соединения (I) из твердой дозированной лекарственной формы и, следовательно, на биологическую доступность соединения (I). Например, из статистического анализа tmax для готовой препаративной формы с 52 мкм наступало значительно (т.е. на 1 ч) позже, чем для готовой препаративной формы с 8,4 мкм. Не существовало значительного различия в tmax между готовыми препаративными формами с 20 и 8,4 мкм. В соответствии с этим начало терапевтического полезного действия, относящегося к соединению(I), после введения наступает значительно быстрее для готовых препаративных форм с 8,4 и 20 мкм по сравнению с готовой препаративной формой с 52 мкм. Помимо растворения и абсорбции in vivo другим важным аспектом физических свойств препаратов -карболина в виде частиц по настоящему изобретению является влияние на различные единичные операции процесса получения лекарственного продукта. Хотя спецификация размера частиц гарантирует совместимую доставку молекулы лекарственного средства к местам абсорбции в желудочно-кишечном тракте, она обеспечивает также лучшее регулирование во время процесса изготовления таблеток. Следующие примеры готовых препаративных форм являются только иллюстративными и не предназначаются для ограничения объема настоящего изобретения. Пример 4. Следующий состав использовали для получения конечной дозированной лекарственной формы таблетки, обеспечивающей 10 мг соединения (I) 18 Ингредиент Компоненты для грануляции Соединение (I) (партия 1, d90 4) Моногидрат лактозы Моногидрат лактозы(очень мелкая, EF) Натриевая соль кроскармеллозы Гидроксипропилцеллюлоза (EF) Лаурилсульфат натрия Наружные порошки Микрокристаллическая целлюлоза(Granular-102) Натриевая соль кроскармеллозы Стеарат магния (растительный) Всего Для изготовления таблеток используют очищенную воду USP. Воду удаляют во время обработки, в конечных таблетках остаются минимальные уровни воды. Таблетки изготовляют с использованием способа мокрой грануляции. Последовательное описание способа следующее. Соединение (I) и эксципиенты, которые следует гранулировать,надежно просеивают. Соединение (I) смешивают в сухом состоянии с моногидратом лактозы(высушен распылением), гидроксипропилцеллюлозой, натриевой солью кроскармеллозы и моногидратом лактозы. Образовавшуюся порошкообразную смесь гранулируют с водным раствором гидроксипропилцеллюлозы и лаурилсульфата натрия с использованием грануляции Powrex или другой подходящей грануляции с высоким сдвигом. Для достижения требуемой конечной точки можно добавить дополнительное количество воды. Для рассредоточения продукта мокрой грануляции и ускорения сушки можно использовать мельницу. Продукт мокрой грануляции сушат с использованием либо сушильной установки с псевдоожиженным слоем либо сушильной печи. После сушки материал можно просеять для исключения любых больших агломератов. Микрокристаллическую целлюлозу, натриевую соль кроскармеллозы и стеарат магния надежно просеивают и добавляют к сухим, сортированным по размеру гранулам. Указанные эксципиенты и сухой продукт грануляции смешивают до достижения однородности с использованием барабанного бункера, ленточно-винтовой мешалки или другого подходящего смешивающего устройства. Процесс смешивания можно разделить на две фазы. Микрокристаллическую целлюлозу, натриевую соль кроскармеллозы и высушенный продукт грануляции добавляют в смеситель и смешивают во время первой фазы с последующим добавлением стеарата магния к указанному продукту грануляции и второй фазы смешивания. Смешанный продукт грануляции затем прессуют в таблетки с использованием ротационной таблеточной машины. Сердцевины табле 19 ток покрывают водной суспензией смеси подходящего цвета в чане для покрытия (например,Acella Cota). Покрытые таблетки можно слегка припудрить тальком для улучшения характеристик манипулирования с таблетками. Таблетки заполняют в пластиковые контейнеры (30 таблеток/контейнер) и сопровождают листовкой-вкладышем, описывающим безопасность и эффективность готовой препаративной формы. Пример 5. Следующий состав используют посредством аналогичных процедур для получения конечной дозированной лекарственной формы таблетки, обеспечивающей 5,0 и 20 мг соединения (I). Ингредиент Компоненты для грануляции Соединение (I) (партия 1, d90 4) Моногидрат лактозы Моногидрат лактозы(высушен распылением) Гидроксипропилцеллюлоза Натриевая соль кроскармеллозы Гидроксипропилцеллюлоза (EF) Лаурилсульфат натрия Наружные порошки Микрокристаллическая целлюлоза(Granular-102) Натриевая соль кроскармеллозы Стеарат магния (растительный) Всего Принципы, предпочтительные осуществления и режимы операции настоящего изобретения были описаны в приведенном выше описании. Изобретение, которое предназначается здесь для защиты, однако, не должно истолковываться как ограничиваемое описанными конкретными формами, поскольку они должны рассматриваться как иллюстративные, а не ограничительные. Специалистом в данной области могут быть сделаны варианты и изменения, не выходящие за пределы сущности данного изобретения. 20 2. Свободная лекарственная форма в виде частиц по п.1, отличающаяся тем, что по меньшей мере 90% частиц имеют размер меньше чем приблизительно 25 мкм. 3. Свободная лекарственная форма в виде частиц по п.1, отличающаяся тем, что по меньшей мере 90% частиц имеют размер меньше чем приблизительно 15 мкм. 4. Свободная лекарственная форма в виде частиц по п.1, отличающаяся тем, что по меньшей мере 90% частиц имеют размер меньше чем приблизительно 10 мкм. 5. Фармацевтическая композиция, включающая свободную лекарственную форму в виде частиц по п.1 и один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. 6. Фармацевтическая композиция по п.5,отличающаяся тем, что свободное лекарственное средство находится полностью в форме частиц. 7. Способ лечения половой дисфункции у пациента, предусматривающий введение пациенту терапевтически эффективного количества композиции, включающей свободную лекарственную форму в виде частиц по п.1 и один или более фармацевтически приемлемых носителей,разбавителей или эксципиентов. 8. Способ по п.7, отличающийся тем, что половая дисфункция является мужской эректильной дисфункцией. 9. Способ по п.7, отличающийся тем, что половая дисфункция является нарушением женского полового возбуждения. 10. Фармацевтическая композиция, включающая(а) свободную лекарственную форму соединения, имеющего формулу ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Свободная лекарственная форма в виде частиц соединения, имеющего формулу и его фармацевтически приемлемых солей и сольватов, включающая частицы соединения, по меньшей мере 90% которых имеют размер меньше чем приблизительно 40 мкм. и его фармацевтически приемлемые соли и сольваты и(b) один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов,причем композиция имеет величину Сmах от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгч/л, измеренную с использованием дозы соединения 10 мг. 11. Композиция по п.10, отличающаяся тем, что она имеет Сmаx от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгч/л. 16. Фармацевтическая композиция, полученная смешиванием частиц соединения,имеющего формулу и его фармацевтически приемлемые соли и сольваты и(b) один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов,причем композиция имеет величину Сmаx от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгч/л, измеренную с использованием дозы соединения 10 мг. 13. Фармацевтическая композиция, включающая(а) свободную лекарственную форму соединения, имеющего формулу или его фармацевтически приемлемой соли или сольвата с одним или более фармацевтически приемлемыми носителем, разбавителем или эксципиентом, в которой частицы соединения имеют d 90=40 или меньше. 17. Применение частиц свободной формы соединения, имеющего формулу и его фармацевтически приемлемые соли и сольваты, причем по меньшей мере 90% частиц имеют размер меньше чем приблизительно 10 мкм, и(b) один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов,и ее биоэквивалентные композиции. 14. Способ изготовления свободной лекарственной формы в виде частиц по п.1, предусматривающий размалывание твердой свободной формы соединения для образования частиц соединения,по меньшей мере 90% которых имеют размер меньше чем приблизительно 40 мкм. 15. Способ изготовления фармацевтической композиции, включающей свободную лекарственную форму в виде частиц по п.1, предусматривающий(а) размалывание твердой свободной формы соединения для образования частиц соединения по меньшей мере 90% частиц которых имеют размер меньше чем приблизительно 40 мкм; и(b) смешивание частиц с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами. где по меньшей мере 90% частиц имеют размер меньше чем приблизительно 40 мкм, для изготовления лекарственного препарата для лечения половой дисфункции. 18. Применение по п.17, где половая дисфункция это мужская эректильная дисфункция. 19. Применение по п.17, где половая дисфункция это нарушение женского полового возбуждения. 20. Применение частиц свободной формы соединения, имеющего формулу которое имеет величину Сmаx от приблизительно 180 до приблизительно 280 мкг/л и AUC (0-24) от приблизительно 2280 до приблизительно 3560 мкгч/л, измеренную с использованием дозы соединения 10 мг, для изготовления лекарственного препарата для лечения половой дисфункции. 21. Применение по п.20, где половая дисфункция это мужская эректильная дисфункция. 22. Применение по п.20, где половая дисфункция это нарушение женского полового возбуждения. 23. Применение по любому из пп.17-22, где лекарственный препарат составляется для орального введения до максимальной ежедневной дозы 20 мг в день.
МПК / Метки
МПК: A61K 31/4985, A61P 15/10
Метки: лекарственные, beta;-карболиновые, продукты
Код ссылки
<a href="https://eas.patents.su/13-4302-beta-karbolinovye-lekarstvennye-produkty.html" rel="bookmark" title="База патентов Евразийского Союза">β-карболиновые лекарственные продукты</a>
Предыдущий патент: Новые производные тиазолидиндиона в качестве противодиабетических средств
Следующий патент: Производные гигромицина а в качестве антибактериальных агентов
Случайный патент: Способ удаления cos из потока синтез-газа, включающего h2s и cos












