Производные гигромицина
Номер патента: 3305
Опубликовано: 24.04.2003
Авторы: Джефсон Мартин Раймонд, Брайти Кэтрин Элизабет, Гухан Субраманян Сэм, Маккормик Эллен Лестер, Линде Роберт Джеральд II
Формула / Реферат
1. Соединение формулы
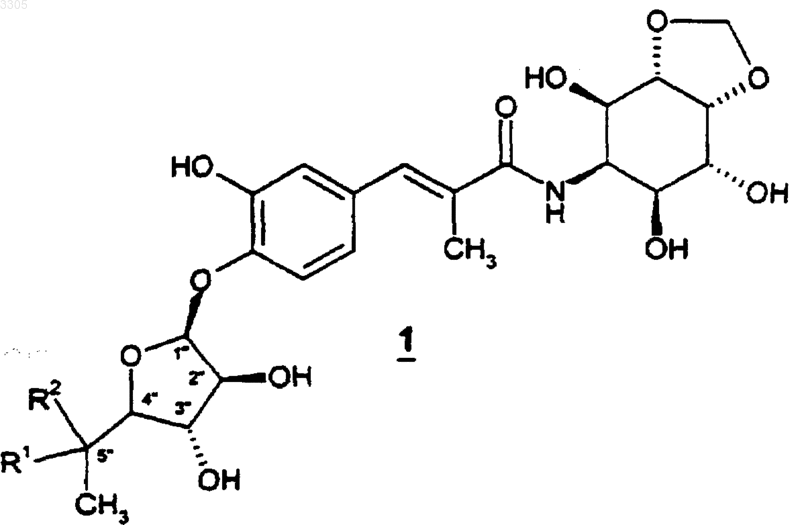
или его фармацевтически приемлемая соль, пролекарство или сольват, где
R1 представляет собой H и R2 представляет собой -NR3R4, -NR4C(O)R3, -OC(O)NR3R4 или -OR3;
или R1 и R2, взятые вместе, образуют =N-OR3, =CR4R3, =CR4C(O)R3, =CR4C(O)OR3 или =CR4C(O)NR3R4;
каждый R3 независимо выбран из H, C1-C10алкила, C2-C10алкенила, -(CH2)t(C3-C10циклоалкила), -(CH2)t(C6-C10арила) и -(CH2)t(4-10-членного гетероцикла), где t является целым числом в пределах от 0 до 5, указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из O, -S(O)j-, где j является целым числом в пределах от 0 до 2, и -N(R7)-, при условии, что два атома O, два атома S или атом O и S не соединены друг с другом непосредственно; указанные циклоалкильная, арильная и гетероциклическая группы R3 необязательно конденсированы с бензольным кольцом, C5-C6насыщенной циклической группой, или 4-10-членной гетероциклической группой; -(CH2)t-группы указанных выше групп R3 необязательно содержат двойную или тройную связь углерод-углерод, где t является целым числом между 2 и 5; и указанные выше группы R3, исключая H, но включая любые необязательно конденсированные кольца, указанные выше, являются необязательно замещенными 1-5 группами R5, при условии, что R3 не является H, метилом или этилом, где R1 представляет собой H и R2 представляет собой -OR3;
каждый R4 является независимо H или C1-C10алкилом;
каждый R5 независимо выбран из C1-C10алкила, C3-C10циклоалкила, галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -OR6, -C(O)R6, -C(O)OR6, -NR7C(O)OR9, -OC(O)R6, -NR7SO2R9, -SO2NR6R7, -NR7C(O)R6, -C(O)NR6R7, -NR6R7, -S(O)j(CH2)m(C6-C10арила), -S(O)j(C1-C6алкила), где j является целым числом в пределах от 0 до 2, -(CH2)m(C6-C10арила), -O(CH2)m(C6-C10арила), -NR7(CH2)m(C6-C10арила) и -(CH2)m(4-10-членного гетероцикла), где m является целым числом в пределах от 0 до 4; указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из O, -S(O)j-, где j является целым числом в пределах от 0 до 2, и -N(R7)-, при условии, что два атома O, два атома S или атом O и S не соединены друг с другом непосредственно; указанные циклоалкильная, арильная и гетероциклическая группы R5 необязательно конденсированы с C6-C10арильной группой, C5-C8 насыщенной циклической группой или 4-10-членной гетероциклической группой; и указанные алкильная, циклоалкильная, арильная и гетероциклическая группы R5 необязательно замещены 1-5 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -NR7SO2R9, -SO2NR6R7, -C(O)R6, -C(O)OR6, -OC(O)R6, -NR7C(O)OR6, -NR7C(O)R6, -C(O)NR6R7, -NR6R7, -OR6, C1-C10алкила, -(CH2)m(C6-C10арила) и -(CH2)m(4-10-членного гетероцикла), где m является целым числом в пределах от 0 до 4;
каждый R6 независимо выбран из H, C1-C10алкила, C3-C10циклоалкила, -(CH2)m(C6-C10арила) и -(CH2)m(4-10-членного гетероцикла), где m является целым числом в пределах от 0 до 4; указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из O, -S(O)j-, где j является целым числом в пределах от 0 до 2, и -N(R7)-, при условии, что два атома O, два атома S или атом O и S не соединены друг с другом непосредственно; указанные циклоалкильная, арильная и гетероциклическая группы R6 необязательно конденсированы с C6-C10арильной группой, C5-C8насыщенной циклической группой или 4-10-членной гетероциклической группой; и указанные выше заместители R6, за исключением H, необязательно замещены 1-5 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо, -C(O)R7, -C(O)OR7, -OC(O)R7, -NR7C(O)R8, -C(O)NR7R8, -NR7R8, гидрокси, C1-C6алкила и C1-C6алкокси;
каждый R7 и R8 представляет собой независимо H или C1-C6алкил и
R9 выбран из заместителей, указанных при определении R6, за исключением H.
2. Соединение по п.1, где R1 и R2, взятые вместе, образуют =N-OR3 и R3 представляет собой C1-C4алкил, C2-C4алкенил, -(CH2)t(C6-C10арил) или -(CH2)t(4-10-членный гетероцикл), где t является целым числом в пределах от 0 до 3, гетероциклическая группа необязательно конденсирована с бензольным кольцом, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой и указанные выше группы R3, включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из нитро, галогена, C1-C3алкокси, C1-C4алкила, трифторметила, ацетамидо, трет-бутоксикарбониламино, трет-бутоксикарбониламинометила, трет-бутоксикарбонила, -NR6R7, фенила, циклогексила, карбокси, аминометила, дифторметокси, трифторметокси, циано, пиперидинила, морфолино, фенокси и фенилтио.
3. Соединение по п.1, где R1 и R2, взятые вместе, образуют =N-OR3 и R3 представляет собой -(CH2)t(C6-C10арил) или -(CH2)t(4-10-членный гетероцикл), где t является целым числом в пределах от 0 до 3, гетероциклическая группа необязательно конденсирована с бензольным кольцом, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, и указанные выше группы R3, включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из нитро, галогена, C1-C3алкокси, C1-C4алкила, трифторметила, ацетамидо, трет-бутоксикарбонила, трет-бутоксикарбониламино, -NR6R7, фенила, циклогексила, карбокси, трет-бутоксикарбониламинометила, аминометила, дифторметокси, трифторметокси, циано, пиперидинила, морфолино, фенокси и фенилтио.
4. Соединение по п.1, где R1 представляет собой H, R2 представляет собой -NR3R4, R4 представляет собой H или метил и R3 представляет собощ - (CH2)t(C6-C10 арил) или -(CH2)t(4-10-членный гетероцикл), где t является целым числом в пределах от 0 до 2, и группа R3 необязательно замещена 1-5 заместителями, независимо выбранными из галогена, C1-C3 алкокси, C1-C4 алкила и трифторметила.
5. Соединение по п.1, где R1 представляет собой H, R2 представляет собой -NR4C(O)R3, R4 представляет собой H и R3 представляет собой C3-C6циклоалкил, -(CH2)t(C6-C10арил) или -(CH2)t(4-10-членный гетероцикл), где t является целым числом в пределах от 0 до 2, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, гетероциклическая группа необязательно конденсирована с бензольным кольцом, и указанные выше R3 группы, включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-C3алкокси, C1-C4алкила и трифторметила.
6. Соединение по п.1, где R1 и R2, взятые вместе, образуют =CR4C(O)OR3 или =CR4C(O)NR3R4, R4 представляет собой H и R3 представляет собой H, C1-C6алкил, C3-C5циклоалкил, -(CH2)t(4-10-членный гетероцикл) или -(CH2)t(C6-C10арил), где t является целым числом в пределах от 0 до 2, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, гетероциклическая группа необязательно конденсирована с бензольным кольцом, и указанные выше группы R3, исключая H, но включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-C3алкокси, C1-C4алкила, -NR6R7 и трифторметила.
7. Соединение по п.1, где R1 представляет собой H, R2 представляет собой -OR3 и R3 представляет собой C1-C4алкил, -(CH2)t(4-10-членный гетероцикл) или -(CH2)t(C6-C10арил), где t является целым числом в пределах от 1 до 2, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, гетероциклическая группа необязательно конденсирована с бензольным кольцом, и указанные выше группы R3, включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-C3алкокси, C1-C4алкила, циклогексила, циано, трифторметила, бензилокси и трифторметила.
8. Соединение по п.1, где R1 представляет собой H, R2 представляет собой =OC(O)NR3R4, R4 представляет собой H и R3 представляет собой -(CH2)t(C6-C10арил), где t является целым числом в пределах от 0 до 2, и группа R3 необязательно замещена 1-5 заместителями, независимо выбранными из галогена, C1-C3алкокси, C1-C4алкила и трифторметила.
9. Соединение по п.1, где указанное соединение является выбранным из группы, включающей
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-фторфенил)метил] оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-фторфенил)метил] оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(бензофуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(бензофуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-фенилметилоксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-фенилметилоксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,4-дихлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,4-дихлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-пиридинил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-(4-морфолинил)фенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[циклогексилметил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,4-дихлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(фуран-3-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(фуран-3-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил)-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(1,3-бензодиоксол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(1,3-бензодиоксол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-циклогексилфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабино-гексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-аминофенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[[(4-аминометил)фенил]метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[3-(4-хлорфенил)пропил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O-[3-(4-хлорфенил)пропил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-(трифторметокси)фенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-(1-пиперидинил)фенил)метил]оксим;
5-деокси-5-[(3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[2-(фенилтио)этил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси)-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(бензофуран-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(бензофуран-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2-фенилпиримидин-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-фтор-4-метоксифенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозитол, (E)-O-[(3,4-дигидро-2H-1-бензопиран-4-ил)метил]оксим;
5-деокси-5-[[3-[4-[(5,6-дидеокси-5-метил(фенилметил)амино-a-L-галактофураноз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(5,6-дидеокси-5-фениламино-a-L-галактофураноз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(6-деокси-5-O-[(3,4-дихлорфенил)метил]-b-D-алтрофураноз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(фуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(5-метил-b-D-арабиногепт-5-(E)-енофуранурон-1-иловая кислота)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, сложный этиловый эфир;
5-деокси-5-[[3-[4-[[N-(фуран-2-ил)метил]-(5-метил-b-D-арабиногепт-5-(E)-енофуранурон-1-иламид)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[3-(фенил)пропил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(2-пропен-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(2-пропен-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-метилфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-метоксифенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-(трифторметил)фенил)метил]оксим;
5-деокси-5-[(3-[4-[(6-деокси-5-O-[(4-хлорфенил)метил]-b-D-алтрофураноз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропеил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[дифенилметил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-5-фенилкарбамат-b-D-алтрофураноз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(6-деокси-5-[(3,4-дихлорфенил)метил]карбамат-b-D-алтрофураноз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-4-фторфенил)метил] оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-5-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексафураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-5-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(5-хлор-2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(5-хлор-2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,5-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,5-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-хлор-3-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-хлор-3-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-хлор-1,3-бензодиоксол-6-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-хлор-1,3-бензодиоксол-6-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(5-хлор-1,3-бензодиоксол-6-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(5-хлор-1,3-бензодиоксол-6-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-хлор-1,3-бензодиоксол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-хлор-1,3-бензодиоксол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,3-дигидробензофуран-6-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,3-дигидробензофуран-6-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,3-дигидробензофуран-5-ил)метил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,3-дигидробензофуран-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(1,2,3,4-тетрагидронафталин-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(1,2,3,4-тетрагидронафталин-1-ил)оксим;
5-деокси-5-[(3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(7-хлор-1,2,3,4-тетрагидронафталин-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(7-хлор-1,2,3,4-тетрагидронафталин-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(7-фтор-1,2,3,4-тетрагидронафталин-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(7-фтор-1,2,3,4-тетрагидронафталин-1-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(8-хлор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(8-хлор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(6-хлор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(6-хлор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(8-фтор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(8-фтор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(6-фтор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(6-фтор-3,4-дигидро-2H-1-бензопиран-4-ил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(хинолин-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(хинолин-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(хинолин-3-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(хинолин-3-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[4-(фенилметил)фенилметил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[4-(фенилметил)фенилметил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[4-(фенокси)фенилметил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[4-(фенокси)фенилметил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,5-дихлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,5-дихлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(фенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(фенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(3-хлор-4-фторфенил)оксим;
5-деокси-5-[[3-[4-[(4-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(3-хлор-4-фторфенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,1,3-бензоксадиазол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,1,3-бензоксадиазол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,3,5,6-тетрафторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,3,5,6-тетрафторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,3-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,3-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-фенилфуран-3-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-фенилфуран-3-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-фенилфуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-фенилфуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,3-дифтор-6-метоксифенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,3-дифтор-6-метоксифенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлортиофен-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлортиофен-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(5-хлортиофен-2-ил) метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(5-хлортиофен-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-2,6-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-2,6-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[1-(3-хлорфенил)этил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-O-неоинозит, (Z)-O-(3-дифторметоксифенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(3-дифторметоксифенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(4-дифторметоксифенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(4-дифторметоксифенил)оксим
и фармацевтически приемлемые соли и сольваты указанных соединений.
10. Соединение по п.1, где указанное соединение является выбранным из группы, включающей
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(1,3-бензодиоксол-5-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(бензофуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,5-дихлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,5-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,5-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-2-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-хлор-3-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)- пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-хлор-3-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(4-хлорфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(4-фенилфуран-2-ил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-5-фторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(3,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,3-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,4-дифторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(2,3,5,6-тетрафторфенил)метил]оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-(3-хлор-4-фторфенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-(3-хлор-4-фторфенил)оксим;
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(5-хлортиофен-2-ил)метил]оксим
и фармацевтически приемлемые соли и сольваты указанных соединений.
11. Фармацевтическая композиция для лечения бактериальной инфекцшш, инфекции, вызванной одноклеточными организмами, или заболевания, связанного с бактериальной инфекцией или инфекцией, вызванной одноклеточными организмами, у млекопитающих, рыб или птиц, которая содержит терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
12. Способ лечения бактериальной инфекции, инфекции, вызванной одноклеточными организмами, или заболевания, связанного с бактериальной инфекцией или инфекцией, вызванной одноклеточными организмами, у млекопитающих, рыб или птиц, который включает введение указанным млекопитающим, рыбам или птицам терапевтически эффективного количества соединения по п.1.
13. Способ получения соединения по п.1, где R1 и R2, взятые вместе, образуют =N-OR3, который включает обработку гигромицина A с помощью гидроксиламина формулы H2N-OR3 или соли указанного соединения, где R3 является таким, как определено в п.1, в инертном растворителе, необязательно в присутствии основания, если используют соль гидроксиламина, при температуре в пределах от около 0 до 65шC.
14. Способ по п.13, где указанный инертный растворитель представляет собой метанол, этанол или пиридин или смесь указанных выше растворителей, указанное основание является Na2CO3 или K2CO3, и указанная температура находится в пределах от 0 до 25шC.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к новым производным гигромицина А, которые могут использоваться в качестве противобактериальных и противопротозойных агентов для млекопитающих, включая человека, а также для рыб и птиц. Настоящее изобретение также относится к фармацевтическим композициям, содержащим эти новые производные, и к новым способам лечения бактериальных инфекций и инфекций,вызванных одноклеточными организмами, у млекопитающих, рыб и птиц путем введения новых производных млекопитающим, рыбам и птицам, при необходимости такого лечения. Гигромицин А представляет собой полученный в результате ферментации природный продукт, впервые выделенный из Streptomyceshygroscopicus в 1953. В качестве антибиотика гигромицин А обладает активностью против патогенов людей и, как сообщается, обладает сильной активностью in vitro против Serpulina(Treponema) hyodysenteriae, которая вызывает дизентерию у свиней. Способ получения композиции, содержащей гигромицин и эпигигромицин, из Corynebacterium equi описан вY. Wakisaka et at., J. Antibiotics 1980, 23, 7. Несколько ссылок относятся к полусинтетическим модификациям гигромицина А, включая следующие: преобразование 5"кетона гигромицина А до 2,4-динитрофенилгидразона описано К.K. Isono et al., ibid., также описан тиосемикарбазон в 5" положении; восстановление 5" кетона гигромицина А до 5"-спирта описано R.L. Mann и D.O. Woolf, ibid., а также в S.J. Hecker et. al.,Bioorg. Med. Chem. Lett. 1992, 2, 533 и S.J.Hecker et al, Bioorg. Med. Chem. Lett. 1993, 3,295; фуранозные аналоги описаны В.Н. Jaynes etJaynes et al., J. Antibiot. 1992, 45, 1705; ароматические кольцевые аналоги описаны S.J. Heckeret al., Bioorg. Med. Chem. Lett. 1993, 3, 289, и С.В. Cooper et al., Bioorg. Med. Chem. Lett. 1997,1, 1747; энамидные аналоги описаны S.J. Heckeret al., Bioorg. Med. Chem. Lett. 1992, 2, 533; аминоциклитольные аналоги описаны S.J. Hecker etHecker et. al., Bioorg. Med. Chem. Lett. 1992, 2,1043. Производные гигромицина А по настоящему изобретению обладают активностью как против грамотрицательных, так и против грамположительных бактерий и одноклеточных организмов. Поданная одновременно с настоящей заявкой, предварительная заявка на патент США 60/084058, зарегистрированная 4 мая 1998 года, озаглавленная "2"-Deoxy Hygromycin Derivatives" (номер досье патентного поверенного 2 Краткое описание изобретения Настоящее изобретение относится к соединениям формулы и к их фармацевтически приемлемым солям,пролекарствам и сольватам, где=CR4C (O) NR3R4; каждый R независимо выбран из Н, C1-С 10 алкила, С 2-С 10 алкенила, -(СН 2)t(С 3-С 10 циклоалкила), -(СН 2)t(С 6-С 10 арила), и -(CH2)t(4-10 членного гетероцикла), где t является целым числом в пределах от 0 до 5, указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из О, -S(O)j-, где j является целым числом в пределах от 0 до 2, и-N(R7)-, при условии, что два атома О, два атомаS или атом О и S не являются соединенными друг с другом непосредственно; указанные циклоал-кильная, арильная и гетероциклическая группы R3 необязательно конденсированы с бензольным кольцом, C5-C8 насыщенной циклической группой или 4-10-членной гетероциклической группой; -(CH2)t- группы указанных выше групп R3 необязательно включают двойную или тройную связь углерод-углерод, где t является целым числом между 2 и 5; и указанные выше группы R3, исключая Н, но включая любые необязательно конденсированные кольца,указанные выше, необязательно замещены 1-5 группами R5, при условии, что R3 не является Н,метилом или этилом, где R1 представляет собой Н и R2 представляет собой -OR3; каждый R4 является независимо Н или C1 С 10 алкилом; каждый R5 независимо выбран из C1-С 10 алкила, С 3-С 10 циклоалкила, галогена, циано,нитро, трифторметила, дифторметокси, трифторметокси, азидо, -OR6, -C(O)R6, -С(О)OR6,-OC(O)R6,-NR7SO2R9,-NR7C(O)OR9,6 7 7 6 6 7-SO2NR R , -NR C(O)R , -C(O)NR R , -NR6R7,-S(O)j(CH2)m(C6-C10 арила), -S(O)j(C1-C6 алкила),где j является целым числом в пределах от 0 до 2, -(СН 2)m(С 6-С 10 арила), -O(СН 2)m(С 6-С 10 арила),-NR7(CH2)m(C6-C10 арила) и -(СН 2)m(4-10 членного гетероцикла), где m является целым числом в пределах от 0 до 4; указанная алкильная группа необязательно включает 1 или 2 гетерогруппы,выбранные из О, -S(O)j-, где j является целым числом в пределах от 0 до 2, и -N(R7)-, при условии, что два атома О, два атома S или атом О 3 и S не соединены друг с другом непосредственно; указанные циклоалкильная, арильная и гетероциклическая группы R5 необязательно конденсированы с С 6-С 10 арильной группой, C5-C8 насыщенной циклической группой или 4-10,членной гетероциклической группой; и указанные алкильная, циклоалкильная, арильная и гетероциклическая группы R5 необязательно замещены 1-5 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, дифторметокси, трифторметокси, азидо,-SO2NR6R7,-C(O)R6,-NR7SO2R9,6 6 7 9-С(О)OR , -OC(O)R , -NR C(O)OR , -NR7C(O)R6,-C(O)NR6R7, -NR6R7, -OR6, C1-C10 алкила,-(СН 2)m(С 6-С-10 арила) и -(СН 2)m(4-10-членного гетероцикла), где m является целым числом в пределах от 0 до 4; каждый R6 независимо выбран из Н, C1-С 10 алкила, С 3-С 10 циклоалкила, -(СН 2)m(С 6-С 10 арила) и -(СН 2)m(4-10 членного гетероцикла), где m является целым числом в пределах от 0 до 4; указанная алкильная группа необязательно включает 1 или 2 гетерогруппы, выбранные из О, -S(O)j-, где j является целым числом в пределах от 0 до 2, и -N(R7)- при условии, что два атома О, два атома S, или атом О и S не являются соединенными друг с другом непосредственно; указанные циклоалкильная, арильная и гетероциклическая группы R6 необязательно конденсированы с С 6-С 10 арильной группой, C5-C8 насыщенной циклической группой, или 4-10,членной гетероциклической группой; и указанные выше заместители R6, за исключением Н,необязательно замещены 1-5 заместителями,независимо выбранными из галогена, циано,нитро, трифторметила, дифторметокси, триф-С(О)OR7,торметокси,азидо,-C(O)R7,7 7 8 7 8-OC(O)R , -NR C(O)R , -C(O)NR R , -NR7R8,гидрокси, C1-C6 алкила и C1-C6 алкокси; каждый R7 и R8 представляет собой независимо Н или C1-С 6 алкил иR9 выбран из заместителей, указанных при определении R6, за исключением Н. Предпочтительные соединения формулы 1 включают такие, где R1 и R2, взятые вместе, образуют =N-OR3 и R3 представляет собой C1-C4 алкил, С 2-С 4 алкенил, -(СН 2)t(С 6-С 10 арил) или-(CH2)t(4-10 членный гетероцикл) , где t является целым числом в пределах от 0 до 3, гетероциклическая группа необязательно конденсирована с бензольным кольцом, арильная группа необязательно конденсирована с 5- или 6 членной гетероциклической группой, и указанные выше группы R3, включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из нитро, галогена, С 1-С 3 алкокси, C1-C4 алкила, трифторметила, ацетамидо,трет-бутоксикарбониламино,третбутоксикарбониламинометила, трет-бутоксикарбонила, -NR6R7,фенила, циклогексила, карбокси, аминометила, 003305 4 дифторметокси, трифторметокси, циано, пиперидинила, морфолино, фенокси и фенилтио. Другие предпочтительные соединения формулы 1 включают такие соединения, где R1 и R2, взятые вместе, образуют =N-OR3 и R3 представляет собой -(СН 2)t(С 6-С 10 арил) или-(СН 2)t(4-10-членный гетероцикл), где t является целым числом в пределах от 0 до 3, гетероциклическая группа необязательно конденсирована с бензольным кольцом, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, и указанные выше группы R3, включая указанные необязательно конденсированные группы, необязательно замещен 1-5 заместителями, независимо выбранными из нитро, галогена, C1-С 3 алкокси, C1-C4 алкила, трифторметила, ацетамидо, третбутоксикарбонила, трет-бутоксикарбониламино,-NR6R7, фенила, циклогексила, карбокси, третбутоксикарбониламинометила,аминометила,дифторметокси, трифторметокси, циано, пиперидинила, морфолино, фенокси и фенилтио. Другие предпочтительные соединения формулы 1 включают такие соединения, где R1 представляет собой Н, R2 представляет собой-(СН 2)t(4-10-членный гетероцикл), где t является целым числом в пределах от 0 до 2, и группа R3 необязательно замещена 1-5 заместителями,независимо выбранными из галогена, C1-С 3 алкокси, C1-C4 алкила и трифторметила. Другие предпочтительные соединения формулы 1 включают такие соединения, где R1 представляет собой Н, R2 представляет собойt является целым числом в пределах от 0 до 2,арильная группа необязательно конденсирована с 5- или 6- членной гетероциклической группой,гетероциклическая группа необязательно конденсирована с бензольным кольцом и указанные выше R3 группы, включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-С 3 алкокси, C1-C4 алкила и три-фторметила. Другие предпочтительные соединения формулы 1 включают такие соединения, где R1 и R2, взятые вместе, образуют =CR4C(O)OR3 или-(СН 2)t(C6-C10 арил), где t является целым числом в пределах от 0 до 2, арильная группа необязательно конденсирована с 5 или 6 членной гетероциклической группой, гетероциклическая группа необязательно конденсирована с бензольным кольцом и указанные выше группы R3,исключая Н, но, включая указанные необязательно конденсированные группы необязатель 5 но замещенными 1-5 заместителями, независимо выбранными из галогена, C1-С 3 алкокси, C1C4 алкила, -NR6R7 и трифторметила. Другие предпочтительные соединения формулы 1 включают такие соединения, где R1 представляет собой Н, R2 представляет собой(С 6-С 10 арил), где t является целым числом в пределах от 1 до 2, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, гетероциклическая группа необязательно конденсирована с бензольным кольцом, и указанные выше группы R3,включая указанные необязательно конденсированные группы, необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-С 3 алкокси, C1-C4 алкила, циклогексила, циано, трифторметила, бензилокси и трифторметила. Другие предпочтительные соединения формулы 1 включают такие соединения, где R1 представляет собой Н, R2 представляет собой-OC(O)NR3R4, R4 представляет собой Н и R3 представляет собой -(СН 2)t(C6-C10 арил), где t является целым числом в пределах от 0 до 2, и группа R3 необязательно замещена 1-5 заместителями, независимо выбранными из галогена,C1-С 3 алкокси, C1-C4 алкила и трифторметила. Конкретные предпочтительные соединения формулы 1 включают соединения, выбранные из группы, включающей: 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3-фторфенил) метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(3-фторфенил) метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(бензофуран-2 ил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиВ-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(бензофуран-2 ил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-фенилметилоксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2 003305 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(3-дифторметоксифенил)оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-(4-дифторметоксифенил)оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(4-дифторметоксифенил)оксим; и фармацевтически приемлемые соли и сольваты указанных соединений. В более конкретном воплощении, настоящее изобретение включает следующие соединения: 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-узол-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(1,3-бензодиоксол-5-ил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(3-хлорфенил) метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3-хлорфенил) метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(3-фторфенил) метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3-фторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(бензофуран-2 ил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3,5-дихлорфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3,5-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3-хлор-5-фторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(3,4-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3,4-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(2,3-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-[(2,4-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(2,4-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(2,3,5,6-тетрафторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(3-хлор-4-фторфенил)оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(3-хлор-4-фторфенил)оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(5-хлортиофен 2-ил)метил]оксим; и фармацевтически приемлемые соли и сольваты указанных соединений. Настоящее изобретение также относится к фармацевтической композиции для лечения заболевания, выбранного из бактериальной инфекции, инфекции, вызванной одноклеточными организмами, и заболеваний, связанных с бактериальными инфекциями или инфекциями, вызванными одноклеточными организмами, у млекопитающих, рыб или птиц, которые включают терапевтически эффективное количество соеди 19 нения формулы 1 или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя. Настоящее изобретение также относится к способу лечения заболевания, выбранного из бактериальной инфекции, инфекции, вызванной одноклеточными организмами, и заболеваний,связанных с бактериальными инфекциями или инфекциями, вызванными одноклеточными организмами, у млекопитающих, рыб или птиц,которые включают введение указанным млекопитающим, рыбам или птицам терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу получения композиции, включающей гигромицин А и эпигигромицин, где отношение гигромицина А к эпигигромицину составляет,по меньшей мере, 10:1, который включает ферментацию Streptomyces hygroscopicus в средах,имеющих значение рН, меньшее, чем 6,9, при температуре в пределах от 25 до 35 С. В предпочтительном воплощении указанного способа указанная Streptomyces hygroscopicus представляет собойNRRL2388 или ее мутант, указанные значения рН находятся в пределах от 6,2 до 6,1, указанная температура составляет около 29 С, и отношение гигромицина А к эпигигромицину составляет, по меньшей мере, 14:1. В дальнейшем аспекте указанного выше способа, рН указанной композиции поддерживается от 6,0 до 6,4, предпочтительно около 6,0, и температура указанной композиции в процессе очистки указанного гигромицина А с получением масла поддерживается в диапазоне значений температуры от 25 до 35 С. Термин "способ лечения", как он используется здесь, если не указано иного, обозначает обращение хода, облегчение, замедление развития или предотвращение заболевания или состояния, к которому относится такой термин,или одного или нескольких симптомов такого заболевания или состояния. Термин "лечение",как он используется здесь, относится к акту лечения, где "способ лечения" определен непосредственно выше. Как они используются здесь, если не указано иного, термины или фразы "бактериальная инфекция (инфекции)", "инфекция (инфекции),вызванная одноклеточными организмами", и"заболевания, связанные с бактериальными инфекциями или инфекциями, вызванными одноклеточными организмами" включают следующие: пневмония, воспаление среднего уха, синусит, бронхит, тонзилит и мастоидит, связанные с инфекциями Streptococcus pneumoniae,Haemophilus influenzae, Moraxella catarrhalis,Staphylococcus aureus, Enterococcus faecalis, E.haemolyticus, E. faecalis, E. faecium, E. durans,включая штаммы, устойчивые по отношению к известным противобактериальным агентам, таким как, но не ограничиваясь ими, беталактамы, ванкомицин, аминогликозиды, хинолоны, хлорамфеникол, тетрациклины и макролиды; не осложненные инфекции и абсцессы кожи и мягких тканей и родильная горячка, связанная с инфекцией Staphylococcus aureus, коагуляза-негативными стафилококками (то есть, S.epidermidis, S. hemolyticus, и тому подобное),Streptococcus pyogenes, Streptococcus agalactiae,группы стрептококков C-F (стрептококки с микроскопическими колониями) , зеленящие стрептококки, Corynebacterium minutissimum,Clostridium spp. или Bartonella henselae; не осложненные острые инфекции мочеполовой системы, связанные с инфекцией Staphylococcusaureus, коагуляза-негативных видов стафилококков или Enterococcus spp.; уретрит и воспаление шейки матки; заболевания, передаваемые половым путем, связанные с инфекцией Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrheae; токсические заболевания, связанные с инфекцией S. aureus (пищевое отравление и синдром токсического шока), или стрептококков Групп А, В, и С; язвы, связанные с инфекцией Helicobacter pylori; синдромы системной лихорадки, связанные с инфекцией Borrelia recurrentis; болезнь Лайма, связанная с инфекцией Borrelia burgdorferi; конъюктивит, кератит и дакриоцистит, связанные с инфекциейaureus, S. pneumoniae, S. pyogenes, H. influenzae или Listeria spp.; рассеянное комплексное заболевание Mycobacterium avium (MAC), связанное с инфекцией Mycobacterium avium или Mycobacterium intracellulare; инфекции, вызываемыеjejuni; желудочно-кишечные заболевания, вызываемые простейшими организмами, связанные с инфекцией Cryptosporidium spp.; одонтогенная инфекция, связанная с инфекцией зеленящих стрептококков; стойкий кашель, связанный с инфекцией Bordetella pertussis; газовая гангрена,связанная с инфекцией Clostridium регfringens или Bacteroides spp.; и атеросклероз или сердечно-сосудистое заболевание, связанные с инфекцией Helicobacter pylori или Chlamydia pneumoniae. Бактериальные инфекции и инфекции, вы 21 званные одноклеточными организмами, и заболевания, связанные с такими инфекциями, которые могут быть излечены или предотвращены у животных, включают следующие: бычье респираторное заболевание, связанное с инфекцией P.nodosus; воспаление глаз у коров, связанное с инфекцией Moraxella bovis; выкидыши у коров,связанные с инфекцией, вызванной простейшими организмами (то есть neosporium); инфекции кожи и мягких тканей у собак и кошек, связанные с инфекцией S. epidermidis, S. intermedius,коагуляза-негативными Staphylococcus или P.multocida; и инфекционные заболевания зубов и полости рта у собак и кошек, связанные с инфекцией Alcaligenes spp., Bacteroides spp., Clostridium spp., Enterobacter spp., Eubacterium, Peptostreptococcus, Porphyromonas или Prevotella. Другие бактериальные инфекции и инфекции,вызванные одноклеточными организмами, и заболевания, связанные с такими инфекциями,которые могут быть излечены или предотвращены согласно способу по настоящему изобретению, упоминаются в J. P. Sanford et al., "TheEdition (Antimicrobial Therapy, Inc., 1996). Термин "галоген", как он используется здесь, если не указано иного, включает фтор,хлор, бром или йод. Предпочтительные галогеновые группы представляют собой фтор, хлор и бром. Термин "алкил", как он используется здесь, если не указано иного, включает насыщенные одновалентные углеводородные радикалы, имеющие прямые или разветвленные цепи. Указанная алкильная группа может содержать одну или две двойные или тройные связи. Понятно, что для того, чтобы указанная алкильная группа содержала двойную или тройную связь углерод-углерод, необходимо присутствие в указанной алкильной группе, по меньшей мере, двух атомов углерода. Термин "арил", как он используется здесь,если не указано иного, включает органический радикал, полученный из ароматического углеводорода путем удаления одного атома водорода, такой как фенил или нафтил. 22 Термин "4-10-членный гетероцикл", как он используется здесь, если не указано иного,включает ароматические и неароматические гетероциклические группы, содержащие один или несколько гетероатомов, каждый выбран из О, S и N, где каждая гетероциклическая группа содержит 4-10 атомов в своей кольцевой системе. Неароматические гетероциклические группы включают группы, имеющие только 4 атома в их кольцевой системе, но ароматические гетероциклические группы должны иметь, по меньшей мере, 5 атомов в их кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы и кольцевые системы, замещенные одним или несколькими оксогруппами. Примером 4-членной гетероциклической группы является азетиди-нил (полученный из азетидина). Примером 5-членной гетероциклической группы является тиазолил, и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино,тиоксанил, пиперазинил, азетидинил, оксетанил,тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил,1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3 пирролинил, индолинил, 2 Н-пиранил, 4 Нпиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3 азабицикло-[3.1.0]гексанил, 3-азабицикло-[4.1.0] гептил, 3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил,пиразолил, триазолил, пиразинил, тетразолил,фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил,фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил, и фуропиридинил. Вышеуказанные группы, когда их получают из соединений, перечисленных выше,могут быть С-присоединенными или Nприсоединенными там, где это возможно. Например, группа, получаемая из пиррола, может быть пиррол-1-илом (N-присоединенная) или пиррол-3-илом (С-присоединенная). Фраза "фармацевтически приемлемая соль(соли)", как она используется здесь, если не указано иного, включает соли кислотных или основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются основными по природе, способны об 23 разовывать множество разнообразных солей с различными неорганическими и органическими кислотами. Кислоты, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей, таких основных соединений представляют собой кислоты, которые образуют нетоксичные кислотно-аддитивные соли, то есть соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидройодид,нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат,битартрат, аскорбат, сукцинат, малеат, гентисинат, фумарат, глюконат, глюкуронат, сахарат,формиат, бензоат, глютамат, метансульфонат,этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [то есть, 1,1'-метилен-бис-(2 гидрокси-3-нафтоат)] соли. Соединения по настоящему изобретению, которые содержат основной остаток, такой как аминогруппа, могут образовывать фармацевтически приемлемые соли с различными аминокислотами, в дополнение к кислотам, рассмотренным выше. Те соединения по настоящему изобретению, которые являются кислотными по природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или соли щелочноземельных металлов и, в частности, кальциевые,магниевые, натриевые и калиевые соли соединений по настоящему изобретению. Соединения по настоящему изобретению имеют асимметричные центры и поэтому существуют в различных энантиомерных и диастереомерных формах. Настоящее изобретение относится к использованию всех оптических изомеров и стереоизомеров соединений по настоящему изобретению и их смесей, и ко всем фармацевтическим композициям и способам для лечения, которые могут использовать или содержать их. В этом отношении, настоящее изобретение включает как Е, так и Z конфигурации группы -OR3, присоединенной к азоту, где R1 иR2 берутся вместе как оксимный радикал формулы =N-OR3. Соединения формулы 1 могут также существовать в виде таутомеров. Настоящее изобретение относится к использованию всех таких таутомеров и их смесей. Объектом настоящего изобретения также являются изотопномеченные соединения и их фармацевтически приемлемые соли, которые являются идентичными соединениям, перечисленным в формуле 1, но в действительности один или несколько атомов в них заменены атомом, имеющим атомную массу или массовое число, отличные от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению,включают изотопы водорода, углерода, азота, 003305 24 кислорода, фосфора, фтора и хлора, такие как Н, 3 Н, 13 С, 14 С, 15N, 18 О, 17 О, 35S, 18F и 36 Сl, соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат указанные выше изотопы и/или другие изотопы или другие атомы, находятся в рамках настоящего изобретения. Определенные изотопно-меченные соединения по настоящему изобретению, например, те, в которых содержатся радиоактивные изотопы, такие как 3 Н и 14 С, могут использоваться в исследованиях распределения лекарственного средства и/или субстрата в тканях. Тритиевые, то есть, 3 Н, и содержащие углерод 14, то есть 14 С изотопы, являются особенно предпочтительными, благодаря простоте их получения и определения. Далее, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2 Н, могут обеспечивать определенные терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например, увеличения времени полужизни in vivo или пониженных требований к дозировке, и, следовательно, могут оказаться предпочтительными в определенных обстоятельствах. Изотопно-меченные соединения формулы 1 по настоящему изобретению и их пролекарства могут, как правило, быть получены путем осуществления способов, описанных ниже в схемах и/или в примерах и примерах получения, путем замещения не изотопномеченного реагента легко доступным изотопномеченным реагентом. Настоящее изобретение также относится к фармацевтическим композициям, содержащим пролекарства соединений формулы 1, и к способам лечения бактериальных инфекций путем введения пролекарств соединений формулы 1. Соединения формулы 1, имеющие свободные амино, амидо, гидрокси или карбоксильные группы, могут быть преобразованы в пролекарства. Пролекарства включают соединения, в которых аминокислотный остаток или полипептидная цепь из двух или нескольких (например,двух, трех или четырех) аминокислотных остатков является ковалентно связанным через амидную или эфирную связь со свободной амино,гидроксигруппой или группой карбоновой кислоты соединений формулы 1. Аминокислотные остатки включают, но не ограничиваются ими,20 встречающихся в природе аминокислот,обычно обозначаемых символами из трех букв,а также включают 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин,норвалин, бета-аланин, гамма-аминомасляную кислоту, цитрулин, гомоцистеин, гомосерин,орнитин и метионин сульфон. Также указываются дополнительные типы пролекарств. Например, свободные карбоксильные группы могут быть преобразованы в виде амидов или алкиловых сложных эфиров. Амид 2 25 ные и сложноэфирные остатки могут включать группы, содержащие, но не ограничивающиеся ими, функциональные группы эфиров, аминов и карбоновых кислот. Свободные гидроксигруппы могут быть преобразованы с использованием групп, включающих, но не ограничивающихся ими, гемисукцинаты, фосфатные сложные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как указано в D. Fleisher, R.Bong, B.H. Stewart, Advanced Drug Delivery Reviews (1996) 19, 115. Карбаматные пролекарства гидрокси и аминогрупп также включаются, когда они являются карбонатными пролекарствами и сульфатными сложными эфирами гидроксигрупп. Преобразование гидроксигрупп в виде (ацилокси)метиловых и (ацилокси)этиловых простых эфиров, где ацильная группа может быть алкиловым сложным эфиром, необязательно замещенным группами, включающими,но не ограничивающимися ими, функциональные группы простых, эфиров, аминов и карбоновых кислот, или где ацильная группа является сложным эфиром аминокислоты, как описано выше, также включается в изобретение. Пролекарства этого типа описаны в R.P. Robinson etal., J. Medicinal Chemistry (1996) 39, 10. Селективное введение боковых цепей пролекарств может быть осуществлено на гидроксигруппах ядра молекулы гигромицина А. Например, может осуществляться избыточное силилирование шести гидроксигрупп гигромицина А, например, с помощью трет-бутилдиметилсилилхлорида. Воздействие на гексасилильное производное карбоната калия в метаноле при комнатной температуре селективно удаляет фенольную силильную группу, делая возможной дальнейшую селективную модификацию в этом положении. В другом примере, неполное силилирование гигромицина А (смотри PC 10186, R.Linde, 2"-deoxy hygromycin A derivatives, предварительная заявка на патент США 60/084058, подана 4 мая 1998) предусматривает пентасилильное производное, в котором гидроксигруппа С-2" является свободной. Селективное ацилирование, алкилирование и тому подобное, могут осуществляться на этом производном для присоединения пролекарства в С-2". Подробное описание изобретения Получение соединений по настоящему изобретению иллюстрируется на следующей схеме: Соединения по настоящему изобретению получаются легко. Обращаясь к схеме, приве 003305 26 денной выше, исходным соединением формулы 2 является гигромицин А, который может быть получен способами, известными специалистам в данной области, такими как ферментацияStreptomyces hygroscopicus NRRL 2388. Метилкетон в 4"-м положении фуранозном сахаре молекулы гигромицина А может существовать на фуранозном сахаре в S конфигурации (гигромицин А) или R конфигурации (эпигигромицин). Когда в качестве модели ферментации и выделения гигромицина А используют опубликованные протоколы (патент США 3100176; Antibiotic Chemotherapy (1953)3:1268-1278, 12791282), получаемый гигромицин представляет собой смесь, примерно 3:1, гигромицина A (4"(S) эпимер), с бета-ориентированным метилкетоном на фуранозном сахаре, как представлено на схеме, и эпигигромицина. Является известным из литературы (Journal of Antibiotics 33(7),695-704, 1980), что чистый гигромицин А преобразуется в эпигигромицин в щелочных растворах. Путем тщательного поддержания рН ниже 6,9 во время ферментации и контроля рН,температуры и времени соприкосновения с растворителем во время процесса очистки, конечный выделенный продукт может быть улучшен до отношения гигромицин А : эпигигромицин,равного, по меньшей мере, 14:1. Используя этот материал, по существу, чистые изомеры, полученные из 4"-(S)гигромицина, могут быть получены для использования в качестве шаблонов для дальнейшей синтетической модификации. Гигромицин А, обогащенный 4"-(S)эпимером, получают путем ферментации Streptomyces hygroscopicus NRRL2388 или его мутантов, в средах с рН, поддерживаемым меньшим,чем 6,9, предпочтительно от 6,2 до 6,7, во время всего процесса. Среда содержит источники усваиваемого углерода, азота и микроэлементов,которые известны специалистам в данной области. Ферментация происходит при температуре около 25-35 С, предпочтительно около 29 С. Ферментацию отслеживают, например, с помощью высокоэффективной жидкостной хроматографии. Инкубирование продолжают до тех пор,пока выход соединений не достигнет максимума, как правило, в течение периода времени примерно от 3 до 10 дней, предпочтительно от около 4 до 6 дней. Образование эпигигромицина сводится к минимуму в процессе очистки путем использования водного буферного раствора (а не чистой воды без буфера) и поддержания рН активных потоков около 6,0. Образование эпигигромицина также сводится к минимуму путем сведения к минимуму времени, в течение которого выделенный материал подвергается воздействию повышенных температур. Таким образом, там,где является необходимым понижение концентраций растворителей, является предпочтительным разбавлять активные потоки с помощью водного буферного раствора и исключать ис 27 пользование выпаривания в роторном испарителе при повышенных температурах. Кроме того,в качестве средства против использования повышенных температур может быть использована колонка со смолой для концентрирования активного раствора перед стадией конечной очистки с целью уменьшения объема раствора,который должен подвергаться кипячению. Конечная стадия очистки в процессе представляет собой концентрирование фракций активного вещества до твердого продукта с использованием вакуума и температуры бани около 35-50 С. Период, в течение которого раствор подвергается действию повышенных температур, может быть сведен к минимуму путем кипячения в несколько стадий. Соединения формулы 1, где R1 и R2, взятые вместе, образуют оксим формулы =NOR3, где R3 является таким, как определено выше, могут быть получены путем обработки гигромицина А(соединение формулы 2) гидроксиламином формулы R3ONH2 с использованием свободного основания или соли гидроксиламина, предпочтительно свободного основания гидроксиламина. Взаимодействие осуществляют в инертном растворителе, таком как метанол, этанол или пиридин, с добавлением основания, такого какNa2 СО 3 или К 2 СО 3, если используют соль, например, соль НСl, гидроксиламина при температуре в пределах от примерно 0 до 65 С, предпочтительно от 0 до 25 С. Гидроксиламин формулы R3ONH2 может быть получен с использованием одной или нескольких процедур, описанных в Bioconjugate Chemistry (1990), 2, 96;Journal of Pharmaceutical Science (1969) 58, 138; и Chem. Pharm. Bull (1967) 15, 345. Соединения формулы 1, где R1 представляет собой Н и R2 представляет собой -NR3R4,где R3 и R4 являются такими, как определено выше, могут быть синтезированы путем восстановительного аминирования по кетонной связи С-5" гигромицина А. Объединение R4NH2 и гигромицина А в инертном растворителе и обработка восстанавливающим агентом, таким какNaBH4, NaBH(OAc)3 (Ас представляет собой ацетил) или NaCNBH3, дает продукт с R3 = Н. Для преобразования R3 в группу, иную, чем Н,может быть осуществлено второе восстановительное аминирование с помощью соответствующего альдегида или кетона формулыRCH2- или RR'CH-, и R' и R являются любыми из остатков, определенных в качестве части R3,которые могут быть присоединены через метиленовую группу, такие как алкильная, арилалкильная, или гетероциклическая алкильная группа). Может быть использована реакция Эшвейлера-Кларка для введения метильной группы в качестве заместителя R3. Для создания амидной группы, где, например, R1 представляет собой Н, и R2 представляет собой -NR4C(O)R3, как описано выше, может быть введен амин форму 003305 28 лы -NHR4, а затем может быть введен ацильный остаток формулы -C(O)R3 путем обработки промежуточного вещества активированной формой карбоновой кислоты, такой как R3COCl или R3C(O)OC(O)R3, или путем использования агента для амидного связывания, такого как 2 этокси-1-этоксикарбонил-1,2-дигидрохинолина(EEDQ), 1,1'-карбонилдиимидазола (CDI), или карбодиимида, такого как 1,3-дициклогексилкарбодиимид (DCC). В процессе указанных выше процедур любая из гидроксильных групп гигромицина А, которые преобразованы в сложный эфир, могут быть высвобождены на конечной стадии удаления защиты с использованием К 2 СО 3 в метаноле. Соединения формулы 1, где R1 представляет собой Н, и R2 представляет собой-NR4C(O)R3, где R4 представляет собой Н, и R3 является таким, как определено выше, могут быть получены путем использования первичного амина, полученного от восстановительного аминирования гигромицина А эквивалентом аммония, например, путем использования ацетата аммония и натрий цианоборгидрида или натрий триацетоксиборгидрида. Альтернативно,этот первичный амин может быть получен через соответствующий азид: 1) гидроксигруппы гигромицина А могут быть защищены, например,как их TBDMS (трет-бутилдиметилсилильные) производные, например, путем воздействияTBDMSC1 и аминового основания, такого как имидазол или пиридин; 2) С-5" кетон гигромицина А затем восстанавливают, например, боргидридом натрия в метаноле, с получением персилилированного 5"-гидрокси гигромицина; 3) полученный спирт преобразуют в мезилат, например, путем воздействия метансульфонилхлорида и триэтиламина; 4) мезилат замещают азидом, например, путем использования азида натрия в N,N-диметилформамиде (ДМФ); и 5) азид восстанавливают до первичного амина путем использования, например, трифенилфосфина с последующим гидролизом в водной фазе. Взаимодействие первичного амина с активированной формой R3C(O)OH, например,R3C(O)Cl или R3C(О)ОС(О)R3, дает соответствующий амид. Альтернативно, могут быть использованы реагенты для амидного связывания с R3C(O)OH, например, 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC), диэтилфосфорилцианид (DEPC), DCC, CD1 или EEDQ. В конце концов, все защитные группы удаляются путем использования кислоты, такой как уксусная кислота, фтористый водород, комплекса фтористый водород-пиридин или фторидного иона, такого как тетрабутиламмоний фторид(TBAF) . Для включения группы R4, иной, чем Н,амид, указанный выше, может быть алкилирован после защиты любых свободных гидроксильных групп, например, в виде силиловых простых эфиров. Алкилирование может быть 29 осуществлено с помощью основания и алкилирущего агента, такого как гидрид натрия и соответствующий бромид формулы R4-Br. Затем осуществляют удаление защиты у гидроксильной группы с помощью кислоты, такой как уксусная кислота, фтористый водород, комплекса фтористый водород-пиридин или фторидного иона, такого как тетрабутиламмоний фторид (TBAF). Альтернативно, может быть осуществлено восстановительное аминирование гигромицина А или на его защищенного производного с помощью R4H2, опосредованное с помощью триацетоксиборгидрида натрия или цианоборгидрида натрия. Полученный вторичный амин может быть ацилирован так, как описано выше, с помощью активированной формы R3C(O)OH,или подвергают взаимодействию с R3C(O)OH с использованием реагента для амидного связывания. Затем, как описано выше, осуществляют удаление защиты у гидроксильной группы. Соединения формулы 1, где R1 представляет собой Н, и R2 представляет собой-OC(O)NR3R4, могут быть получены путем взаимодействия персилилированного 5"-гидроксигигромицина А с изоцианатом R3NCO в толуоле при температуре от 40 до 110 С, предпочтительно 50-80 С. Может быть удобным добавление диметиламинопиридина и триэтиламина к реакционной смеси. Продукт этой реакции, который имеет R4, равный Н, может быть алкилирован с получением R4, равного C1-С 10 алкилу, с использованием основания, такого как гидрид натрия, и алкилирующего агента, такого как бромид формулы R4-Br. Затем осуществляют удаление защиты у гидроксильной группы путем использования кислоты, такой как уксусная кислота, фтористый водород, комплекса фтористый водород-пиридин, или фторидного иона,такого как тетрабутиламмоний фторид (TBAF). Соединения формулы 1, где R1 представляет собой Н, и R2 представляет собой -OR3, гдеR3 представляет собой алкильную группу или замещенную алкильную группу, могут быть получены путем алкилирования соответствующего спирта гигромицина А. В этом способе гидроксигруппы гигромицина А являются соответствующим образом защищенными, например, в виде их силильных простых эфиров, с использованием соответствующего реагента,такого как триэтилсилилхлорид (TESC1), триметилсилилхлорид (TMSC1) или TBDMS, и аминового основания, такого как имидазол или пиридин. С-5" кетонный остаток затем восстанавливают с использованием раствора соответствующего восстанавливающего агента, такого как боргидрид натрия, в метаноле. Полученный спирт может затем быть алкилирован с помощью R3-X, где X представляет собой удаляемую группу, такую как Сl, Br или метансульфонат, в присутствии основания, такого как гидрид натрия или калий трет-бутоксид. Защитные груп 003305 30 пы затем удаляют с помощью кислоты, такой как уксусная кислота, фтористый водород, комплекса фтористый водород-пиридин, или фторидного иона, такого как тетрабутиламмоний фторид (TBAF). Соединения формулы 1, где R1 представляет собой Н, и R2 представляет собой -OR3, гдеR3 является ароматическим или гетероциклическим остатком, могут быть получены путем реакции Мицунобу. Защищенный гигромициновый спирт, полученный так, как описано выше,подвергают реакции Мицунобу с R3OH, опосредованной с помощью трифенилфосфина и диэтилазодикарбоксилата, как описано D.L.Hughes, Org. Reactions (1992) 42, 335. Полученный простой эфир затем освобождают от защиты так, как описано выше . Альтернативно, когда R1 представляет собой Н, и R2 представляет собой -OR3, где R3 является ароматическим или гетероциклическим остатком, защищенный гигромициновый спирт может быть преобразован в удаляемую группу,например, бромидное или мезилатное производное. Защитная группа может затем быть заменена R3OH с использованием основания, такого как гидрид натрия, трет-бутоксид калия или карбонат калия. Соединения формулы 1, где R1 и R2, взятые вместе, образуют =CR4C(O)R3, =CR4C(O)OR3 или =CR4C (О) NR3R4, где R3 и R4 являются такими, как определено выше, могут быть получены с помощью соответствующих промежуточных ,-ненасыщенных сложных эфиров,полученных при олефинировании Виттига или Хорнера-Эммонса-Виттига С-5" кетона гигромицина А. Например, (карбоэтоксиметилен) трифенилфосфоран или (карбоэтоксиэтилиден)трифенилфосфоран может взаимодействовать с гигромицином А с получением ненасыщенного этилового сложного эфира. Гидролиз этого сложного эфира, например, водным раствором гидроксида натрия, дает соответствующую карбоновую кислоту (R1 и R2, взятые вместе, образуют =СНС(О)ОН). В этом случае гидроксильные группы гигромицина могут быть защищены, например, в виде их ТЕS илиTBDMS простых эфиров, как описано выше. Для получения сложных эфиров, описанных выше, эта карбоновая кислота может быть этерифицирована с помощью R3OH, например, путем воздействия DCC и DМАР, или CDI и основного катализатора, такого как этоксид натрия. Соединения формулы 1, где R1 и R2, взятые вместе, образуют =CR4C(O)NR3R4, могут быть получены путем обработки указанного выше промежуточного соединения карбоновой кислоты (R1 и R2, взятые вместе, образуют =СНС(O) ОН) с амином формулы R3NH2 с использованием агента для амидного связывания, такого как 31 путем алкилирования, например, с помощью основания, такого как гидрид натрия или третбутоксид калия, и алки-лирующего агента, такого как R4-X, где X представляет собой Вг, С 1 или метансульфонат. Соединение формулы 1 (R1 и R2, взятые вместе, образуют =CR4C(O)R3) могут быть получены либо путем прямой реакции Виттига или Хорнера-Эммонса гигромицина А, либо защищенной формы гигромицина А, например,с соответствующим R3C(O)CHR4-PPh3 (Ph является фенилом) или R3C(О)CHR4-P=O(OEt)2 (Et является этилом) реагентом. Олефинирование может быть осуществлено способами, описанными J. Boutagy и R. Thomas, Chem. Rev. (1974) 74, 87 и В.Е. Maryanoff et al., Chem. Rev. (1989) 89, 863. Альтернативно, защищенное соединение ненасыщенной карбоновой кислоты и гигромицина А может быть преобразовано в его амид Вайнреба, например, путем обработки CDI и N,O-диметилгидроксиламином. Этот амид затем может взаимодействовать с R3-M, где М является ионом металла, такого как Li, илиMgBr, с образованием кетона, в соответствии со способом S. Nahm и S.M. Weinreb, Tet. Lett.(1981) 22, 39. Соединения формулы 1, где R1 и R2, взятые вместе, образуют =CR4R3, где R3 и R4 являются такими, как определено выше, могут быть получены путем реакции Виттига или ХорнераЭммонса имида R4-CH (PPh3)-R3 или R4-CH(P=O(OEt)2)-R3 гигромицином А или его защищенным производным, в котором гидроксильные группы модифицированы, например, в виде их силильных простых эфиров, таких как TES или TBDMS, как описано выше. Защитные группы затем могут быть удалены, как описано выше. Альтернативно, в качестве промежуточного соединения может быть использован С-5" гомологический кетон или альдегид гигромицина А. Эти соединения могут быть путем реакции Виттига или Хорнера-Эммонса с оксигенированной трифенилфосфониевой солью или фосфораном, таким как Ph3P-C(R3)OMe (Me представляет собой метил). Полученный эфир енола может быть гидролизирован с помощью слабой кислоты, такой как уксусная кислота или разбавленная НСl, для получения альдегида или кетона. Альдегид или кетон могут затем взаимодействовать с металлоорганическим соединением R4M, где М является, например, Li, илиMgBr, с получением соответствующего спирта,который может быть дегидратирован под воздействием метансульфонилхлорида с получением соответствующего олефина. Удаление защиты, как описано выше, затем дает соединение формулы 1, где R1 и R2, взятые вместе, образуют=CR4R3. Соединение формулы 1, где R1 и R2, взятые вместе, образуют =CR4R3, и R4 представляет собой арил или гетероарил, и R3 не равен водо 003305 32 роду, могут быть получены с использованием каталитического способа на палладии. Преобразование защищенного кетона СН 3-СН (COR3)гидро в енолтрифлат может быть осуществлено по способу P.J. Stang и W. Treptow, Synthesis(1980) 283. Енолтрифлат затем может быть соединен в каталитическом процессе на палладии типа Сузуки или Стилла с арильными или гетероарильными борными кислотами R4B(OH)2 или различными видами арилолова, например,R4SnMe3 или R4SnBu3, с получением ненасыщенных арильных производных. Реакции сочетания Сузуки могут быть осуществлены так, как описано N. Miyaura и A. Suzuki, Chem. Rev.(1995) 95 2457. Реакции Стилла осуществляют с использованием условий, описанных V. Farina etal., Org. Reactions (1997) 50 1. Удаление защиты,как описано выше, затем дает конечное соединение. Соединения по настоящему изобретению имеют асимметричные атомы углерода. Соединения, имеющие смесь изомеров в одном или нескольких центрах, будут существовать в виде диастереомерных смесей, которые могут быть разделены на их индивидуальные диастереомеры на основе их физико-химических различий с помощью способов, известных специалистам в данной области, например, путем хроматографии или фракционной кристаллизации. Все такие изомеры, включая смеси диастереомеров,рассматриваются как часть настоящего изобретения. Соединения по настоящему изобретению,которые являются основными по природе, способны образовывать большое количество различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, часто является желательным на практике сначала выделить соединение по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто преобразовать последнюю вновь в соединение в виде свободного основания путем обработки щелочным реагентом, и затем преобразовать последнее свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений по настоящему изобретению легко получают путем обработки основного соединения, по существу, эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. При осторожном выпаривании растворителя легко получается желаемая твердая соль. Желаемая кислая соль может также быть высажена из раствора свободного основания в органическом растворителе путем добавления к раствору соответствующей минеральной или органической кислоты. 33 Те соединения по настоящему изобретению, которые являются кислотными по природе, способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или соли щелочноземельных металлов и, в частности, соли натрия и калия. Все эти соли получают с помощью стандартных методик. Химические основания,которые используются в качестве реагентов для получения фармацевтически приемлемых основных солей по настоящему изобретению,представляют собой те вещества, которые образуют нетоксичные основные соли с кислыми соединениями по настоящему изобретению. Такие нетоксичные основные соли включают соли, полученные из таких фармакологически приемлемых катионов, как натрий, калий, кальций и магний, и тому подобное. Эти соли могут быть легко получены путем обработки соответствующего кислотного соединения водным раствором, содержащим желаемый алкоксид щелочного металла или гидроксид металла, и затем выпариванием полученного раствора досуха,предпочтительно, при пониженном давлении. Альтернативно, они также могут быть получены путем смешивания вместе растворов кислотных соединений в низших алканолах и желаемого алкоксида щелочного металла или гидроксида металла, а затем выпаривания полученного раствора досуха таким же способом, как описано ранее. В любом случае, предпочтительно используют стехиометрические количества реагентов с целью обеспечения завершенности реакции и максимальных выходов желаемого конечного продукта. Противобактериальная активность соединений по настоящему изобретению против бактериальных патогенов демонстрируется с помощью способности соединений ингибировать рост определенных штаммов патогенов. Исследования В исследованиях, описанных ниже, используют обычную методологию и критерии интерпретации, и они разработаны для обеспечения директив для химических модификаций,которые могут вести к соединениям с противобактериальной активностью в отношении восприимчивых и устойчивых к лекарственным средствам организмов, включая, но не ограничиваясь этим, устойчивость к бета-лактаму,макролиду и ванкомицину. В исследованиях собрана панель бактериальных штаммов с целью включения разнообразных видов патогенов,являющихся мишенями, включая представителей бактерий, устойчивых к антибиотикам. Использование этой панели делает возможным определение соотношения химическая структура/активность в отношении сильнодействия и спектра активности. Исследование производят в кюветах для микротитрования, и они интерпретируются согласно Performance Standards for(NCCLS) guidelines; минимальная ингибирующая концентрация (MIC) используется для сравнения штаммов. Соединения сначала растворяют в диметилсульфоксиде (ДМСО) в виде исходных растворов. Активность соединения по настоящему изобретению также может быть оценена с помощью репликаторного (пипеточного) методаSteers, который является стандартным методом для тестирования бактерий in vitro, описаннымSteers et al., Antibiotics and Chemotherapy 1959,9, 307. Активность соединения по настоящему изобретению in vivo может быть определена с помощью обычных исследований по защите животных, хорошо известных специалистам в данной области, как правило, проводимых на грызунах. Согласно одной модели in vivo, эффективность соединения оценивают на мышиных моделях острой бактериальной инфекцией. Пример одной из таких систем in vivo осуществляют следующим образом. Мышей (мыши CF1 обоих полов; 18-20 г) расселяют по клеткам при их получении, и им дают возможность акклиматизироваться в течение 1-2 дней перед использованием в исследованиях. Острая инфекция создается путем внутрибрюшинной инокуляции бактерийaureus,штамм 01 А 1095), суспендированных в 5% стерильной желудочной слизи свиней. Вакцину приготавливают путем проращивания культуры в течение ночи при 37 С на агаре с кровью, сбора выросших на поверхности бактерий с помощью стерильного бульона с сердечно-мозговым экстрактом, и доведения этой суспензии до мутности, которая после разбавления 1:10 в 5% стерильной желудочной слизи свиньи должна обеспечивать 100% смертность. Мышей (по 10 в группе) обрабатывают подкожно через 0,5 и 4 ч после инфицирования. Соответствующие необработанные (инфицированные, но необработанные) и положительные(ванкомицин или миноциклин, и тому подобное) контроли включаются в каждое исследование. Процент выживших регистрируют через период наблюдения в 4 дня; значение PD50(мг/кг/доза, вычисленное для защиты 50% инфицированных животных) определяют с помощью пробит-метода. Соединения по настоящему изобретению и их фармацевтически приемлемые соли (здесь и далее "активные соединения") могут вводиться пероральным, парентеральным, местным или ректальным путем при лечении бактериальных инфекций и инфекций, вызванных простейшими одноклеточными организмами. Как правило, эти соединения наиболее желательно вводить в дозах, находящихся в пределах от около 0,2 мг на 35 кг массы тела в день (мг/кг/день) до около 200 мг/кг/день в одной или разделенными дозами(то есть, от 1 до 4 доз в день), хотя обязательно должны быть отклонения, в зависимости от вида, массы и состояния субъекта, подвергающегося лечению, и конкретного выбранного способа лечения. Однако уровень дозы, который находится в пределах от около 3 мг/кг/день до около 60 мг/кг/день, является наиболее желательным при использовании. Отклонения, тем не менее, могут случаться, в зависимости от видов млекопитающих, рыб или птиц, подвергающихся лечению, их индивидуальной реакции на указанное лекарственное средство, а также от типа выбранного фармацевтического препарата и от периода времени и интервала, при которых происходит такое введение. В некоторых случаях уровни дозы, более низкие чем нижний предел указанного диапазона, могут быть более чем адекватными, в то время как в других случаях могут быть использованы еще более высокие дозы, не оказывая при этом никаких вредных побочных эффектов, при условии, что такие более высокие дозы сначала разделяются на несколько малых доз для введения в течение дня. Активные соединения могут быть введены сами по себе или в сочетании с фармацевтически приемлемыми носителями или растворителями с помощью способов, указанных ранее, и такое введение может осуществляться в виде одной или нескольких доз. Более конкретно,активные соединения могут вводиться в виде разнообразных различных дозированных форм,то есть они могут объединяться с различными фармацевтически приемлемыми инертными носителями в виде таблеток, капсул, лепешек,драже, леденцов, порошков, спрэев, кремов,мазей, суппозиториев, желе, гелей, паст, примочек, притираний, водных суспензий, растворов для инъекций, эликсиров, сиропов и тому подобное. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и тому подобное. Более того,фармацевтические композиции для перорального введения могут быть соответствующим образом подслащены и/или ароматизированы. Как правило, активные соединения присутствуют в таких дозированных формах при уровнях концентрации, находящихся в пределах от около 5,0 до около 70 мас.%. Для перорального введения таблетки, содержащие различные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальций фосфат и глицин, могут быть использованы вместе с различными разрыхлителями, такими как крахмал(и, предпочтительно, крахмал из кукурузы, картофеля или тапиоки), альгиновая кислота и некоторые комплексные силикаты, вместе со связующими для грануляции, подобными поли 003305 36 винилпирролидону, сахарозе, желатину и смоле акации. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, часто бывают очень полезными для целей таблетирования. Твердые композиции подобного типа также могут быть использованы в качестве наполнителей в желатиновых капсулах; предпочтительные материалы в этом отношении также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда водные суспензии и/или эликсиры,являются желательными для перорального введения, активное соединение может быть объединено с различными подслащающими или ароматизирующими агентами, красящим материалом или красителями, и, если это желательно, также с эмульсифицирующими и/или суспендирующими агентами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль,глицерин и их подобные различные сочетания. Для парентерального введения могут быть использованы растворы активного соединения либо в кунжутном, либо в арахисовом масле,или в водном растворе этанола или пропиленгликоля. Использование производного циклодекстрина, такого как р-циклодекстринсульфобутилового простого эфира, натриевой соли(смотри патент США 5134127) также может быть преимущественным. Водные растворы должны быть дополнены соответствующим буфером, если это необходимо, и жидкий разбавитель сначала должен быть доведен до изотоничности. Эти водные растворы являются пригодными для использования в целях внутривенных инъекций. Масляные растворы являются пригодными для использования в целях внутрисуставных, внутримышечных и подкожных инъекций. Получение всех этих растворов в стерильных условиях легко осуществляется с помощью стандартных фармацевтических методик, известных специалисту в данной области. Кроме того, является также возможным введение активного соединения по настоящему изобретению наружно, и это может быть осуществлено посредством кремов, желе, гелей, паст,пластырей, мазей и тому подобного, в соответствии с обычно фармацевтической практикой. Для введения животным иным, чем люди,таким как крупный рогатый скот или домашние животные, активные соединения могут вводиться с кормом животных или перорально в виде композиции для вливания. Активные соединения могут вводиться в виде систем доставки на основе липосом, таких как малые однослойные липосомы, большие однослойные липосомы и многослойные липосомы. Липосомы могут формироваться из множества фосфолипидов, таких как холестерин,стеариламин или фосфатидилхолины. Активные соединения могут быть также сопряжены с растворимыми полимерами в качестве носителей для направленной доставки ле 37 карств. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидфенил, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоильными остатками. Более того, активные соединения могут быть связаны с классом биологически разрушаемых полимеров, пригодных для использования при достижении контролируемого высвобождения лекарства, например, с полимолочной кислотой, полигликолевой кислотой,сополимерами полимолочной и полигликолевой кислоты, полиэпсилон капролактоном, полигидроксимасляной кислотой, полиортоэфирами,полиацеталями, полидигидропиранами, полицианоакрилатами и поперечно-связанными или амфипатическими блок-сополимерами гидрогелей . Настоящее изобретение далее описывается и иллюстрируется в примерах получения и примерах, описанных ниже. В получениях и примерах, "комнатная температура" обозначает комнатную температуру или температуру окружающей среды, которая является температурой в пределах около 20-25 С. Пример получения 1. Пять (5) мл замороженной порции (хранящейся при -80 С в 20% глицерина/80% инокуляционной среды) культуры Streptomyces hygroscopicus NRRL 2388 используют для инокуляции 1 л инокуляционной среды для гигромицина (Corn Products Corp., церелоза 13 г/л,Hubinger крахмал 7 г/л, Roquette твердые остатки после получения кукурузного экстракта 3 г/л,Sheffield Brand Products NZ Amine YTT 7 г/л,Baker CoCl26H2O 0,002 г/л, KH2PO4 0,7 г/л,MgSO47H2O 1,3 г/л, сульфат аммония 0,7 г/л,Dow Chemical подавитель пены Р 2000 1 капля/ колбу, Colfax соевое масло 2 капли/колбу, рН доводится до 7,0 перед обработкой в автоклаве) в 2,8 л колбе Фернбаха. Культуру проращивают в течение 3 дней при 29 С при перемешивании при 200 об/мин в шейкере с ходом в 2 дюйма (5 см). Эта пророщенная культура используется для инокуляции 8 л стерильной ферментационной среды для гигромицина (Albaglos карбонат кальция 1 г/л, Sheffield Brand Products NZ AmineYTT 5 г/л, Hubinger's крахмал 20 г/л, Archer Daniels Midland Nutrisoy мука 10 г/л, Dow Chemical подавитель пены Р 2000 1 мл/л, Baker CoCl26H2 О 0,002 г/л, Colfax соевое масло 2 мл/л, церелоза 10 г/л, NaCl 5 г/л, рН доводится до 7,0 перед обработкой в автоклаве) в 14-литровом ферментере со встряхиванием (New Brunswick Microferm, New Brunswick, New Jersey) , снабженном двумя 4,75-дюймовыми (12 см) мешалкамиRushton, расположенных на расстоянии 3,75 дюймов (9,5 см) друг от друга. Бульон инкубируют при 29 С со скоростью аэрации со скоростью 8 л/мин и при перемешивании при 800 об/мин. Чтобы свести к минимуму образование эпигигромицина, значение рН поддерживают в 38 пределах между 6,5 и 6,9 в течение 126 ч, затем между 6,2-6,6, с помощью H2SO4 (15%) в течение остального процесса. Продукт ферментации собирают после 143 ч общей инкубации. В этот момент времени отношение гигромицина А к эпигигромицину составляет 31:1. Шесть литров питательной среды указанной выше ферментации центрифугируют при 8000 об/мин в течение примерно 15 мин. После центрифугирования лепешку извлекают и супернатант (при рН, равном 6,4, согласно оценкам с помощью ВЭЖХ содержит примерно 4,12 г активности гигромицина А) загружают в колонку, набитую 500 г смолы XAD-16 (Rohm andHaas (Philadelphia, Pennsylvania. Смолу предварительно уравновешивают двумя объемами набивки 25 мМ раствором динатрийфосфата, рН 6,0 ("буфер"). После загрузки колонку промывают 2 объемами набивки буфера и 2 объемами набивки смеси буфер/метанол 80/20, и активность элюируют 5 объемами набивки смеси буфер/метанол 50/50. Фракции исследуют с помощью ВЭЖХ, и порции, содержащие основную часть активности (2,730 г гигромицина А),объединяют. Часть этого элюата от XAD-16 (примерно 800 мг гигромицина А) разбавляют до 10% метанола путем добавления 1,8 л буфера и загружают в 100 мл колонку CG-161 (TosoHaas(Montgomeryville, Pennsylvania, которую уравновешивают 4 объемами набивки смеси буфер/ метанол 90/10. Продукт элюируют 6 объемами набивки смеси буфер/метанол 50/50. Фракции анализируют с помощью ВЭЖХ и активные фракции объединяют. Объединенные фракции выпаривают досуха, и твердый продукт, согласно исследованиям, является чистым примерно на 65 мас.%. Небольшую часть этого твердого продукта переносят для исследования. Около 500 мг твердого продукта смешивают с 500 мл воды и 500 мл этилацетата и перемешивают в течение 20 мин. Два слоя разделяют и часть водного слоя высушивают с получением твердого продукта, который, согласно исследованиям, является чистым на примерно 52 мас.%. Оба твердых продукта ( 34945-2801 и 281-1) исследуются с помощью ЯМР и ТСХ и, как обнаружено, содержат активность гигромицина А. Кроме того, ЯМР показывает отношение гигромицин А/эпигигромицин, примерно равное 15:1. Пример получения 2. Пять (5) мл замороженной порции (хранящейся при -80 С в 20% глицерина/80% инокуляционной среды) культуры Streptomyces hyqroscopicus NRRL 2388 используют для инокуляции 1 л инокуляционной среды для гигромицина (СРС International Inc. церелоза 13 г/л,Hubinger крахмал 7 г/л, Roquette твердые остатки после получения кукурузного экстракта 3 г/л,NZ Amine YTT 7 г/л, Baker СоСl26 Н 2O 0,002 г/л, КН 2 РO4 0,7 г/л, MgSO47H2O 1,3 г/л, сульфат 39 аммония 0,7 г/л, Dow Chemical подавитель пены Р 2000, 1 капля/колбу, Colfax соевое масло 2 капли/колбу, рН доводится до 7,0 перед обработкой в автоклаве) в 2,8 л колбе Фернбаха. Культуру проращивают в течение от 2 до 3 дней при 29 С при перемешивании со скоростью 200 об/мин в шейкере с ходом в 2 дюйма (5 см). Два ферментера из нержавеющей стали объемом пятьсот галлонов (1900 л) загружают 380-400 галлонами (1445-1520 л) ферментационной среды для гигромицина (Mineral Technologies карбонат кальция 1 г/л, Sheffield Brand Products NZAmine YTT 5 г/л, Hubinger крахмал 20 г/л,Archer Daniels Midland Co. соевая мука 10 г/л,Dow Chemical подавитель пены P2000 1 мл/л,Baker СоСl26 Н 2O 0,002 г/л, Colfax Inc. соевое масло 2 г/л, СРС International Inc. церелоза 10 г/л, Cargill Inc. NaCl 5 г/л) . Среду стерилизуют при давлении пара в ферментерах 20 фунтов на квадратный дюйм (1240 г/кв.см) в течение 60 мин. После охлаждения среды с использованием охлаждающих змеевиков в ферментерах, значение рН доводится до 6,5-6,7. Условия в ферментерах подбираются таким образом, что скорость потока составляет 20 стандартных кубических футов в минуту (560 л/мин), температура составляет 28 С, давление от вентилятора составляет 5 фунтов на квадратный дюйм (310 г/кв.см), и рН поддерживается в пределах между 6,5-6,7 с помощью 25% гидроксида натрия и 98% серной кислоты. Скорости перемешивания в двух ферментерах изменяются таким образом,чтобы поддерживать уровень растворенного кислорода, больший, чем 20% от уровня насыщения, измеренного в среде непосредственно перед инокуляцией. При установке контрольных условий ферментера, пять колб Фернбаха с инокулятом объединяют стерильным способом в 8 л аспирационной бутыли. Этот инокулят затем используют для инокуляции отдельного, работающего в заданных условиях ферментера объемом пятьсот галлонов (1900 л), как описано выше. Эта процедура повторяется с использованием 4 л инокулята, так что один ферментер получает четыре литра инокулята, и один ферментер получает пять литров инокулята. Каждый ферментер работает в течение приблизительно 114 ч, после чего ферментация прекращается. Значение рН питательной среды доводят до 6,3 с использованием 98% серной кислоты и ее транспортируют из ферментеров для извлечения. Содержимое двух ферментеров, упомянутых выше, (рН=6,3, отношение гигромицина А к эпигигромицину приблизительно 51:1), фильтруется на керамической фильтрационной системе. Фильтрат (1450 г А, 506 галлонов (1923 л загружают в колонну со смолой XAD-16, объемом 70 галлонов (266 л) . Эту колонну предварительно уравновешивают 4 объемами набивки раствора тринатрийфосфатного буфера при рН 6,0 ("буфер"). После загрузки, колонну промы 003305 40 вают 2 объемами набивки буфера и 2 объемами набивки смеси буфер/метанол 80/20. Затем активность последовательно элюируют из колонны в 10 фракциях (приблизительно 50 галлонов каждая (190 л раствора буфер/метанол 50/50. Активные фракции (примерно 1240 г А) объединяют и разбавляют до конечной концентрации 10% метанола с помощью добавления 1200 галлонов (4560 л) буфера. Использование разбавления (вместо испарения на роторном испарителе) для понижения концентрации метанола делает возможным использование более низких температур, с тем, чтобы свести к минимуму количества эпигигромицина, которые имеют тенденцию к увеличению при более высоких температурах. Половину этого раствора загружают в колонну CG-161, объемом 40 л (предварительно уравновешивают 4 объемами набивки раствора буфер/метанол 90/10). После загрузки колонну промывают 4 объемами набивки смеси буфер/метанол 80/20 и элюируют 5,5 объемами набивки смеси буфер/метанол 50/50. После регенерации и повторного уравновешивания колонны, в колонну загружается вторая половина активности и элюируется так, как описано выше. Объединенные фракции от обоих процессов(120 л, приблизительно 1051 г А) разбавляют до 10% метанола путем добавления буфера. Их повторно загружают в регенерированную и повторно уравновешенную колонку со смолой CG161. Как только активность адсорбируется на колонне, ее элюируют 4 объемами набивки метанола. Эта стадия служит как для уменьшения количества солей, так и для увеличения концентрации образца перед конечным выпариванием. Объединенные фракции после конечного прохождения колонки CG-161 выпаривают досуха с получением всего примерно 1 кг А активности гигромицина А. Отношение гигромицина А к эпигигромицину в конечном твердом продукте составляет около 14,5:1. Экспериментальные процедуры для примеров В случаях, где конечная очистка осуществляется с использованием хроматографии на силикагеле, и системы элюентов, содержащей более чем 10% метанола, прошедший хроматографию продукт извлекают в смеси хлороформа: метанола: концентрированного гидроксида аммония 89:10:1 и фильтруют или растворяют в метаноле и пропускают через 0,45 мкМ фильтр. Удаление растворителя в вакууме дает конечный продукт. В процедурах ниже, трет-ВОС относится к "трет-бутоксикарбонилу". Получение простых эфиров 5"-оксимов Получение гидроксиламиновых реагентов для синтеза простых эфиров оксимов Примеры 1-92, 1 А-116 А. Большинство используемых гидроксиламиновых реагентов являются либо коммерчески доступными (как правило, в виде соли кислоты),либо получают из соответствующего спирта или 41 галогенида с помощью способов, представленных ниже. 1) Получение фталимидзащищенных бензиловых или алифатических гидроксиламинов. Из спирта: используют реакцию Мицунобу с диэтилазодикарбоксилатом и трифенилфосфином для связывания N-гидроксифталимида и исходного материала спирта согласно процедуре Е. Grochowski и J. Jurczak, Synthesis (1976) 682. Из бромида или хлорида: взаимодействиеN-гидроксифталимида (1 эквивалент) с галогенидом исходного продукта (1,2-2 эквивалента) осуществляют в растворе ДМСО с использованием карбоната калия (0,6-2 эквивалента) в качестве основания. Взаимодействие осуществляют при комнатной температуре, как правило,при перемешивании, в течение ночи. Выливая реакционную смесь в холодную воду, получают осадок, который отфильтровывают с получением фталимидзащищенного гидроксиламина. Во многих случаях у этого продукта сразу удаляют защиту; может быть также использована хроматография на силикагеле с использованием смесей этилацетата-гексана для очистки фталимидзащищенного гидроксиламина. 2) Удаление фталимидной защитной группы с получением бензилового или алифатического гидроксиламина: Удаление защиты у фталимидзащищенного гидроксиламина производят путем взаимодействия с гидразингидратом (1-2 эквивалента) в растворе этанола при температурах в пределах от комнатной температуры до температуры дефлегмации, в течение периода в пределах от 30 мин до периода в течение ночи. Реакционную смесь отфильтровывают и фильтрат концентрируют. Этот сырой продукт может быть передан на следующую стадию как есть или может быть подвергнут дальнейшей очистке. Смешивание сырого продукта с хлороформом, удаление твердых продуктов путем фильтрования и удаление растворителя из фильтрата удаляет дополнительный фталгидразид. Альтернативно,чистый продукт растворяют в 1 н. соляной кислоте и промывают эфиром или этилацетатом. Водный слой подщелачивают насыщенным раствором карбоната калия и экстрагируют эфиром или этилацетатом. Осушка конечных органических слоев и удаление растворителя дает продукт, гидроксиламин. 3) Получение O-арилгидроксиламинов. Замещенные фенолы преобразуют в соответствующие O-арилгидроксиламины с помощью использования мезитиленсульфонилгидроксиламина, как описано Y. Endo, К. Shudo и Т. Okamoto, Synthesis (1980) 461. Получение разнообразных исходных продуктов на основе спиртов и галогенидов для использования в синтезе гидроксиламинов Как правило, производные бензилового спирта могут быть преобразованы в соответст 003305 42 вующие бензилбромиды, если это желательно, с помощью обработки 48% НВr при 65 С в течение 1-4 ч. В ряде случаев исходные продукты, спирты, получают путем восстановления коммерчески доступных соединений с более высокой степенью окисления. 4-Циклогексилбензойная кислота (примеры 46, 47) и 3-хлор-2-фторбензойная кислота (примеры 13A, 14A) восстанавливают с помощью литийалюминийгидрида (22,3 эквивалента) в тетрагидрофуране с получением соответствующего спирта. 3-(4-Хлорфенил)пропионовую кислоту (примеры 56, 57),3,4-дигидро-2 Н-1-бензопиран-2-карбоновую кислоту (примеры 36 А, 37 А), 4-хлор-3 сульфамоилбензойную кислоту (пример 76 А), 3 хлортиофен-2-карбоновую кислоту (примеры 85 А, 86 А), 5-хлортиофен-2-карбоновую кислоту(примеры 91 А, 92 А) и 2,6-диметилбензойную кислоту (примеры 98 А, 99 А) восстанавливают до соответствующих спиртов с использованием диборана (1,1-2 эквивалента) в тетрагидрофуране при температуре от 0 С до комнатной температуры в течение 5-18 ч. 2-Фтор-6-метоксибензонитрил гидролизируют до 2-фтор-6-метоксибензойной кислоты путем обработки 30% водным раствором КОН с обратным холодильником, и кислоту восстанавливают до 2-фтор-6 метоксибензилового спирта (пример 80 А) с помощью диборана, как указано выше. 3-Трифторметоксибензальдегид (примеры 62, 68), 3-цианобензальдегид (пример 63), бензофуран-2-карбоксальдегид (примеры 65, 66), 1,4-бензодиоксан 6-карбоксальдегид (примеры 83, 84), 3-фтор-4 метоксибензальдегид (примеры 85, 86), 6-фтор 4-хроманон (примеры 16 А, 17 А), 3-хлор-4 фторбензальдегид (примеры 19 А, 22 А), хинолин-3-карбоксальдегид (примеры 23 А, 24 А), 4 хлор-3-фторбензальдегид (примеры 25 А, 26 А),2,3-(метилендиокси)бензальдегид(примеры 28 А, 29 А), 2,4-дихлорбензальдегид (примеры 45 А, 47 А), 2-хлор-4-фторбензальдегид (примеры 46 А, 48 А), 2-фтор-6-(трифторметила)бензальдегид (примеры 66 А, 67 А), 2,3-дифторбензальдегид (примеры 68 А, 69 А), 2-(дифторметокси)бензальдегид (примеры 93 А, 94 А) и 6 хлорхроманон (примеры 102 А, 103 А) восстанавливают до спиртовых соединений с использованием боргидрида натрия (1-2 эквивалента) в тетрагидрофуране или метаноле при температуре 0 С или комнатной температуре. Сульфат магния (4 эквивалента) в метиленхлориде обрабатывают концентрированной серной кислотой (1 эквивалент), затем, последовательно, 4-хлорметилбензойной кислотой (1 эквивалент) и трет-бутанолом (5,1 эквивалента). Перемешивание в течение ночи при комнатной температуре дает трет-бутиловый сложный эфир (пример 36). 4-Амино-3,5-дихлорбензойную кислоту Nацетилируют путем обработки ацетилхлоридом 43 90 С в течение 4 ч. Охлажденную реакционную смесь выливают в холодную воду, резко охлаждают и отфильтровывают с получением ацетамидного производного. Восстановление карбоновой кислоты осуществляют с помощью литийалюминийгидрида (2 эквивалента) в тетрагидрофуране при 0 С в течение 2 ч с получением N-(2,6-дихлор-4-гидроксиметилфенил)ацетамида (пример 51). 3-(Аминометил)бензиловый спирт и 4(аминометил)бензиловый спирт разделяют путем восстановления 3- и 4-цианобензальдегида с использованием диборана (4-5 эквивалентов) в ТГФ при комнатной температуре в течение ночи. Аминогруппы 3-(аминометил) бензилового спирта (примеры 8 А и 9 А) и 4-(аминометил)бензилового спирта (пример 55) , а также 3 аминобензилового спирта (пример 54) защищают в виде N-трет-ВОС производных путем обработки с помощью ди-трет-бутилдикарбоната(1,1 эквивалента) в ТГФ при нагревании с обратным холодильником до тех пор, пока исходное аминосоединение не израсходуется. Взаимодействие этил 4-фторбензоата с раствором пиперидина (3 эквивалента) в ацетонитриле осуществляют путем отгонки с обратным холодильником в течение 4 дней. Разбавление холодной реакционной смеси несколькими объемами воды дает осадок, который отфильтровывают с получением этил 4-(пиперидин-1-ил)бензоата. Восстановление сложного эфира литийалюминий гидридом (2 эквивалента) в тетрагидрофуране дает соответствующий спирт (примеры 71, 72). 5-Гидроксиметилбензофуран (примеры 79,80) получают по способу К. Hiroya, К. Hashimura и К. Ogasawara, Heterocycles (1994) 38,2463. 2-Фенилпиримидин-5-карбоксальдегид(примеры 81, 82) получают по способу J. T.Gupton, J. E. Gall, S. W. Riesinger et al., J. Heterocyclic Chemistry (1991) 28, 1281. Альдегид восстанавливают до соответствующего спирта с использованием раствора боргидрида натрия в метаноле. 3-Гидроксиметил-4-фенилфуран (примеры 6 А, 7 А) получают по способу В. А Кеау и J-L. J.Heterocyclic Chemistry, (1986) 23, 1805. Восстановление альдегида затем осуществляют с помощью раствора боргидрида натрия (1 эквивалент) в ТГФ при 0 С с получением 4-хлор-1,3 бензодиоксол-5-метанола (примеры 30 А, 31 А).(1996) 21, 4261. Восстановление с помощью раствора боргидрида натрия в метаноле дает 3 хлор-2,6-дифторбензиловый спирт, который преобразуют в 3-хлор-2,6-дифторбензилбромид(примеры 38 А, 39 А) путем обработки 48% НВr при 65 С в течение 3 ч. Обработка подобным же образом 2,3,5,6-тетрафтортолуола дает 2,3,5,6 тетрафтор-4-метилбензилбромид (примеры 40 А,41 А), и 3,5-дифтортолуол подобным же образом преобразуется в 2,6-дифтор-4-метилбензилбромид (примеры 63 А, 64 А). 3,4-Дифторанизол подобным же образом преобразуется в 2,3 дифтор-6-(метокси)бензилбромид(примеры 74 А, 75 А), и 1-фтор-3-(трифторметокси)бензол преобразуют в 2-фтор-6-(трифторметокси)бензилбромид (примеры 77 А, 78 А). 2-Хлор-6(трифторметокси)бензиловый спирт (примеры 89 А, 90 А) получают подобным же способом, за исключением того, что в реакции формилирования используют литийдиизопропиламид, а не нбутиллитий. Ванилин преобразуют в 7-хлорбензодиоксол-5-карбоксальдегид с помощью способа Т-Т. Jong, P.G. Williard и J.P. Porwoll, J. OrganicChemistry (1984) 49, 735. Восстановление с помощью раствора боргидрида натрия (1 эквивалент) в метаноле при комнатной температуре затем дает 7-хлор-1,3-бензодиоксол-5-метанол(примеры 51 А, 52 А). В этом случае преобразование в реагент для гидроксиламина осуществляют с помощью мезилатного производного,которое получают с помощью способа R.K.Inami и Т. Shiba, Bull. Chem. Soc. Jpn., (1985) 58,352. Альдегид восстанавливают в соответствующий спирт с использованием раствора боргидрида натрия в этаноле. Соответствующее 2 хлорметилтиазольное производное (примеры 104 А, 105 А) получают путем обработки спирта с помощью раствора тионилхлорида (4 эквивалента) в метиленхлориде при комнатной температуре в течение 2-5 ч. 45 2,4-Дифторпропиофенон восстанавливают до соответствующего спирта (примеры 106 А,107 А) с использованием раствора боргидрида натрия в этаноле. 1-(3-Хлор-2,6-дифторфенил)этанол и другие производные фенилэтанола (примеры 108 А 116 А) получают путем обработки соответствующего производного бензальдегида раствором метилмагний-бромида (1 эквивалент) в ТГФ при комнатной температуре. Эти спирты затем преобразуют в соответствующие бензилбромиды путем обработки 48% HBr в течение 1-4 ч. Получение простых эфиров оксимов Способы (А - I) Примеры 1-92, 1 А-116 А. Способ А. Раствор гигромицина А (1 эквивалент) и гидрохлоридную соль соответствующего гидроксиламина (1-2,2 эквивалента) в метаноле (примерно 0,1 М в гигромицине А) обрабатывают карбонатом натрия (1,1-1,2 эквивалента на эквивалент гидроксиламино-вой соли) и нагревают с обратным холодильником в течение от 15 мин до 2 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформа/гидроксида аммония. Реакционную смесь затем охлаждают до комнатной температуры и концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J-N. Способ В. Раствор гигромицина А (1 эквивалент) и гидрохлоридную соль соответствующего гидроксиламина (1-2,2 эквивалента) в метаноле (примерно 0,1 М в гигромицине А) обрабатывают карбонатом натрия (1,1-1,2 эквивалента на эквивалент гидроксиламиновой соли) и нагревают с обратным холодильником в течение 18 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/ хлороформа/гидроксида аммония. Реакционную смесь затем охлаждают до комнатной температуры и концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J-N. Способ С. Раствор гигромицина А (1 эквивалент) и свободного основания соответствующего гидроксиламина (1-2,2 эквивалентов) в метаноле(примерно 0,1 М в гигромицине А) нагревают с обратным холодильником в течение 18 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформ/ гидроксида аммония. Реакционную смесь затем охлаждают до комнатной температуры и концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J - N. Способ D. Раствор гигромицина А (1 эквивалент) и свободное основание соответствующего гидро 003305 46 ксиламина (1-2,2 эквивалента) в метаноле (примерно 0,1 М в гигромицине А) нагревают с обратным холодильником в течение 5-6 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформа/гидроксида аммония. Реакционную смесь затем охлаждают до комнатной температуры и концентрируют в вакууме. Сырой продукт очищают помощью одного из способов J-N. Способ Е. Раствор гигромицина А (1 эквивалент) и свободное основание соответствующего гидроксиламина (1-2,2 эквивалента) в метаноле (примерно 0,1 М в гигромицине А) перемешивают при комнатной температуре в течение 18 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформа/гидроксида аммония. Реакционную смесь затем концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J-N. Способ F. Раствор гигромицина А (1 эквивалент) и свободное основание соответствующего гидроксиламина (1-2,2 эквивалента) в метаноле (примерно 0,1 М в гигромицине А) перемешивают при комнатной температуре в течение 1-5 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформа/гидроксида аммония. Реакционную смесь затем концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J-N. Способ G. Отдельные растворы гигромицина А (1 эквивалент) и свободного основания соответствующего гидроксиламина (1-2,2 эквивалента) в метаноле (конечная концентрация, 0,5-0,1 М в гигромицин А) объединяют при 0 С и нагревают до комнатной температуры в течение 1-2 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформа/гидроксида аммония. Реакционную смесь затем концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J-N. Способ Н. Раствор гигромицина А (1 эквивалент) и свободного основания соответствующего гидроксиламина (1-2,2 эквивалента) в метаноле(конечная концентрация, 0,5-0,1 М в гигромицине А) перемешивают при 0 С в течение 2-3 ч. За взаимодействием может следовать тонкослойная хроматография с использованием элюентов метанола/хлороформа или метанола/хлороформа/гидроксида аммония. Реакционную смесь затем концентрируют в вакууме. Сырой продукт очищают с помощью одного из способов J-N. Способ I. Субстрат (смотри таблицы для использованного субстрата) растворяют в триф 47 торуксусной кислоте при концентрации около 0,1 М и дают возможность перемешиваться при комнатной температуре в течение 15 мин, после чего сразу удаляют в вакууме всю трифторуксусную кислоту. Добавляют несколько объемов раствора хлороформа: метанола: концентрированного гидроксида аммония 89:10:1, и летучие продукты удаляют в вакууме. Нейтрализацию повторяют, и концентрируют в вакууме с получением сырого продукта. Очистка простых эфиров оксимов Способы (J - N-1) Способ J. Очистку осуществляют с помощью хроматографии на силикагеле. Сырой продукт обычно предварительно адсорбируется на силикагеле путем добавления сухого силикагеля к раствору продукта в метаноле с последующим полным удалением растворителя. Колоночное элюирование осуществляют с использованием раствора метанола в хлороформе, обычно, от 5 до 20%,часто, с использованием ступенчатого градиента. Способ К. Очистку осуществляют с помощью хроматографии на силикателе. Сырой продукт обычно предварительно адсорбируется на силикагеле путем добавления сухого силикагеля к раствору продукта в метаноле с последующим полным удалением растворителя. Колоночное элюирование осуществляют с использованием раствора метанола в метиленхлориде, обычно, от 5 до 20%, часто, с использованием ступенчатого градиента. Способ L. Очистку осуществляют с помощью хроматографии на силикагеле. Сырой продукт обычно предварительно адсорбируется на силикагеле путем добавления сухого силикагеля к раствору продукта в метаноле с последующим полным удалением растворителя. Колоночное элюирование осуществляют с использованием тройного раствора хлороформ: метанол: гидроксид аммония состава в пределах от 289:10:1 до 39:10:1, в зависимости от значений Rf продуктов и исходных материалов. Колонки, как правило, используют ступенчатый градиент. В случае примера 55 конечная концентрация элюента в колонке составляет 73:25:2. Способ М. Очистку осуществляют с помощью хроматографии на силикагеле. Сырой продукт обычно предварительно адсорбируется на силикагеле путем добавления сухого силикагеля к раствору продукта в метаноле с последующим полным удалением растворителя. Элюирование колонки осуществляют с использованием тройного раствора метиленхлорид: метанол: гидроксид аммония в пределах от 322:10:1 до 56:10:1, часто, с использованием ступенчатого градиента. Способ N. 48 Очистку осуществляют с помощью хроматографии с обращенной фазой на C18, элюируя раствором метанол-вода от 10 до 100%, в зависимости от значений Rf продуктов и исходных материалов. В колонках обычно используют ступенчатый градиент. Способ N-1 Очистку осуществляют с помощью хроматографии с обращенной фазой на C18, с элюированием смесью ацетонитрила и 10 мМ калийфосфатного буфера, рН 7. Выделенные компоненты представляют собой продукты из реакционной смеси, получаемые в небольших количествах из эпигигромицина (альфа стереоизомер при С-4"), присутствующего в исходном материале гигромицина. Получение 5"-аминов. Примеры 93-101 Способы (О-R) для получения аминовых производных Способ О. Раствор гигромицина А в метаноле (0,1 М) обрабатывают амином (1 эквивалент) и перемешивают при комнатной температуре в течение 10 мин. Добавляют уксусную кислоту (3 эквивалента), а затем триацетооксиборгидрид натрия(3 эквивалента), и реакционную смесь перемешивают в течение еще 24 ч. После обработки небольшим объемом водного насыщенного раствора бикарбоната натрия растворители удаляют в вакууме. Остаток очищают с помощью хроматографии на силикагеле и элюируют смесью хлороформ: метанол: гидроксид аммония состава в пределах от 89:10:1 до 70:28:2, часто, с использованием ступенчатого градиента. Способ Р. Раствор гигромицина А в метаноле (0,1 М) обрабатывают амином (2-4 эквивалента) и перемешивают при комнатной температуре в течение 1 ч. В случае, когда образование имина происходит в виде осадка, добавляют 3 ангстремные молекулярные сита и смесь перемешивают в течение ночи. Затем добавляют боргидрид натрия (1-2 эквивалента) и реакционную смесь перемешивают в течение 2-24 ч. После обработки небольшим объемом водного насыщенного раствора бикарбоната натрия (и удаления сит, если они присутствуют, путем фильтрования) растворители удаляют и остаток очищают с помощью хроматографии на силикагеле, и элюируют смесью хлороформ: метанол: гидроксид аммония состава в пределах от 89:10:1 до 80:19:1. Способ Q. Аминовое производное гигромицина А в воде (0,1 М) обрабатывают формальдегидом (5 эквивалентов), затем муравьиной кислотой (10 эквивалентов) и перемешивают при 90 С в течение 5 ч, а затем в течение 48 ч при комнатной температуре. После добавления насыщенного водного раствора бикарбоната натрия реакционную смесь перемешивают, а затем прозрачный супернатант декантируют. Оставшийся ос 49 таток очищают с помощью колоночной хроматографии с использованием в качестве элюента смеси хлороформ: метанол: гидроксид аммония в отношении 80:19:1. Способ R. Раствор гигромицина А в метаноле (0,1 М) обрабатывают анилином (4 эквивалента) и размельченными 3-ангстремными молекулярными ситами и перемешивают при 50 С в течение 2 ч или в течение ночи при 70 С. Затем реакционную смесь охлаждают до комнатной температуры, добавляют боргидрид натрия (1-2 эквивалента) и продолжают перемешивание при комнатной температуре в течение 2-48 ч. Добавляют небольшой объем насыщенного водного раствора бикарбоната натрия, сита удаляют с помощью фильтрования и фильтрат концентрируют в вакууме. Сырой остаток очищают с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента смеси хлороформ: метанол: гидроксида аммония 80:19:1. Получение 5"-амидов. Примеры 102-104 Получение амидных производных. Способы S - Т Синтез персилилированного 5"-аминогигромицина Аa) Раствор гигромицина А, трет-бутилдиметилсилилхлорида (12 эквивалентов) и имидазола (12 эквивалентов) в ДМФ (концентрация гигромицина равна 0,25 М) перемешивают при 80 С в течение 20 ч. После удаления ДМФ при пониженном давлении полученный остаток экстрагируют диэтиловым эфиром. Объединенные эфирные экстракты промывают водой, затем насыщенным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют. Сырой продукт очищают с помощью хроматографии на силикагеле и элюируют смесью этилацетата/гексана 10%.b) Раствор персилилированного гигромицина А в смеси метанол: тетрагидрофуран 1:1(0,2 М) обрабатывают боргидридом натрия (0,5 эквивалента) и перемешивают при комнатной температуре в течение 18 ч. После удаления растворителей при пониженном давлении остаток растворяют в хлороформе, промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом натрия, фильтруют и концентрируют с получением сырого персилилированного 5"-спирта. Очистку осуществляют с помощью колоночной хроматографии и элюируют смесью этилацетат/гексан 10-20%. Последующий анализ сложных эфиров Мошера показывает, что стереоизомер в положении 5" имеет конфигурацию R.(2 эквивалента) и перемешивают при комнатной температуре в течение 24 ч. Реакционную смесь затем выливают в воду и экстрагируют метиленхлоридом. Объединенные органические слои 50 сушат над сульфатом натрия, фильтруют и концентрируют в вакууме с получением 5"мезилата.d) 5"-Мезилат в ДМФ (0,2 М) обрабатывают азидом натрия (10 эквивалентов) и перемешивают при 95 С в течение 18 ч. Реакционную смесь выливают в воду, экстрагируют диэтиловым эфиром, промывают насыщенным солевым раствором, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой 5"азид очищают с помощью хроматографии на силикагеле и элюируют смесью этилацетат/ гексан 10%.e) Раствор 5"-азида и трифенилфосфина (3 эквивалента) в толуоле (концентрация 5"-азида равна 0,2 М) перемешивают при 105 С в течение 18 ч. Толуол удаляют при пониженном давлении и заменяют тетрагидрофураном/водой(10/1) (концентрация производного гигромицина равна 0,1 М), и перемешивают при 75 С в течение 5 ч. Реакционную смесь выливают в воду и экстрагируют диэтиловым эфиром. Объединенные органические слои промывают насыщенным солевым раствором, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на силикагеле и элюируют смесью 20% этилацетат/гексан с получением персилилированного 5"-амино гигромицина А. Способ S.a) Персилилированный 5"-аминогигромицин А и соответствующую карбоновую кислоту (2 эквивалента) перемешивают вместе сEEDQ (1-этоксикарбонил-2-этокси-1,2-дигидрохинолин, 2 эквивалента) в ТГФ при 70 С в течение трех часов (концентрация персилилированного гигромицина равна 0,1 М). Реакционную смесь выливают в воду и экстрагируют эфиром. Объединенные органические слои промывают 5% раствором карбоната натрия, водой и насыщенным раствором хлорида натрия. После сушки над сульфатом натрия, органические экстракты отфильтровывают и концентрируют с получением остатка, который подвергают хроматографии на силикагеле с использованием смеси этилацетата и гексана, с получением желаемого амида в виде его персилилзащищенного производного.b) Все силильные группы удаляют путем обработки раствором 5"-модифицированного гексасилилгигромицина А (1 эквивалент, 0,1 М) с помощью 1 М раствора тетрабутиламмонийфторида (TBAF, 10 эквивалентов) в ТГФ при комнатной температуре в течение 14-24 ч. ТГФ удаляют в вакууме и сырой продукт растворяют в смеси воды и метанола. Этот раствор/суспензию вводят в колонку со смолой Dowex(50x4-400) (10-30 г смолы/ммоль TBAF, которая преобразуется в ОН форму путем обработки 0,10,2 н. гидроксидом натрия и затем промывают одним объемом колонки (CV) воды). Колонку элюируют под действием силы тяжести 1-3 CV 51 воды до тех пор, пока не удалят TBAF, и затем элюируют 50% водным метанолом с помощью давления азота, получая желаемый амидный продукт. Если требуется дополнительная очистка, производят хроматографию на силикагеле(способ J-N). Способ Т. Раствор соответствующей карбоновой кислоты (1,2 эквивалента) в тетрагидрофуране обрабатывают DEPC (диэтилфосфорилцианид,1,2 эквивалента) и триэтиламином (1,2 эквивалента) и реакционную смесь перемешивают в течение 10 мин. Добавляют персилилированный 5"-аминогигромицин А (1 эквивалент) (конечная концентрация гигромицинового производного равна 0,17 М), и реакцию оставляют при комнатной температуре в течение 48 ч. Реакционную смесь выливают в воду и экстрагируют эфиром. Объединенные органические слои промывают водным карбонатом натрия, водой и насыщенным раствором хлорида натрия, затем сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на силикагеле с использованием смеси этилацетата и гексана. Удаление защиты силилированного амида с помощью TBAF осуществляется так, как в способе S, стадия b. Получение 5"-эфиров, карбаматов. Примеры 105-131 Способы (U - Z). Алкилирование или ацилирование персилилированного 5"-гидрокси гигромицина А(смотри примеры разделов 102-104, процедуры а и b) достигают по способу от U до Y, и силильные группы после этого удаляют с использованием способа S, стадия b. Способ U для получения бензиловых простых эфиров 5"-гигромицина А. Гидрид натрия (60% дисперсия в минеральном масле, 10 эквивалентов) суспендируют в высушенной в печи круглодонной колбе и промывают 3 раза гексаном. Остаток гексана удаляют в вакууме и в колбу при комнатной температуре добавляют тетрагидрофуран (ТГФ)(концентрация персилилированного 5"-гигромицина А равна 0,1 М), персилилированный 5"гидрокси гигромицин А (1 эквивалент) и бензилбромид (10 эквивалентов). Полученную суспензию нагревают при 50 С в течение 1-4 ч. Реакционную смесь охлаждают до комнатной температуры, гасят водой и затем экстрагируют два раза хлороформом (СНСl3) . Объединенные органические слои промывают насыщенным солевым раствором, сушат над MgSO4 и концентрируют до полутвердого продукта, который затем подвергают хроматографии (SiO2, 5-15%EtOAc: толуол или EtOAc: гексан) (EtOAc относится к этилацетату) с получением желаемого простого эфира. Способ V. 52 Трет-Сутоксид калия (5 эквивалентов 1 М раствора в ТГФ) добавляют при комнатной температуре к раствору персилилированного 5"гидрокси гигромицина А (1 эквивалент) и бензилбромида (10 эквивалентов) в ТГФ (0,1 М в персилилированном 5"-гидроксигигромицине А). Реакцию завершают через 15 мин. Реакцию гасят с помощью добавления воды и продукт экстрагируют хлороформом. Объединенные органические экстракты сушат над MgSO4, концентрируют в вакууме и подвергают хроматографии (SiO2, 5-15% EtOAc: толуол илиEtOAc:гексан) с получением желаемого продукта. Способ W. Трет-бутоксид калия (2 эквивалента 1 М раствора в ТГФ) при комнатной температуре добавляют по каплям в течение 5 мин к раствору персилилированного 5"-гидроксигигромицина А (1 эквивалент) и бензилбромида (5 эквивалентов) в диоксане (0,1 М в персилилированном 5"-гидроксигигромицине). Реакция завершается через 15 мин. Реакцию гасят с помощью добавления воды и продукт экстрагируют в хлороформе. Объединенные органические экстракты сушат над МgSО 4, концентрируют в вакууме и подвергают хроматографии (SiO2, 515% ЕtОАс: толуол или EtOAc:гексан) с получением желаемого продукта. Способ X. Фенилизоцианат (7 эквивалентов) добавляют к раствору персилилированного 5"-гидроксигигромицина А (1 эквивалент) в толуоле(0,05 М в персилилированном 5"-гидроксигигромицине) и нагревают до 60 С в течение 1224 ч. Сырую реакционную смесь концентрируют и подвергают хроматографии (SiO2, 5-15%EtOAc:толуол или EtOAc:гексан) с получением силилированного продукта. Способ Y. Бензилизоцианат (7 эквивалентов) получают по способу Sigurdsson, S. Th.; Seeger, В.;Kutzke; U.; и Eckstein F., J. Org. Chem. (1996) 61,3883. Его добавляют к раствору персилилированного 5"-гидроксигигромицина А (1 эквивалент), диметиламинопиридина (0,2 эквивалента) и триэтиламина (4 эквивалента) в толуоле (0,05 М в персилилированном 5"-гидроксигигромицине), и нагревают до 70 С в течение 12-24 ч. Сырую реакционную смесь концентрируют и подвергают хроматографии (SiO2, 5-7% EtOAc: гексан) с получением силилированного продукта. Способ Z. Персилилированный 5"-гидроксигигромицин А обрабатывают К 2 СО 3 (1,3 эквивалента) в метаноле (0,1 М) и перемешивают 14-20 ч. Метанол удаляют в вакууме, и остаток извлекают в 1:1 EtOAc:гексане и воде. Органические слои промывают NаНСО 3 и насыщенным солевым раствором, сушат над MgSО 4 и концентрируют. Без дальнейшей очистки этот продукт затем 53 обрабатывают раствором аллилбромида (1-3 эквивалента) и К 2 СO3 (1,4 эквивалента) в ДМФ(0,1 М) в течение 14-24 ч. Реакционную смесь выливают в гексан и промывают водой. Органические слои сушат над MgSO4, фильтруют и концентрируют до белой пены, состоящей из аллил-защищенной фенольной гидроксильной группы, которую используют без дальнейшей очистки. 5"-Спирт алкилируют с помощью бензилоксихлорметилового эфира в условиях способа X. Аллильную группу удаляют с использованием способа Jaynes, В. Н., Elliot, N. С. и Schicho, D.L.J. Antibiot. (1992) 45, 1705. Силильные группы затем удаляют с использованием способа S, стадия b. Получение 5"-олефинов. Примеры 132-140 Получение олефиновых производных. Способы АА-ЕЕ Способ АА. Раствор гигромицина А и (карбоэтоксиметилен)трифенилфосфорана (2 эквивалента) в ДМФ (0,1 М в гигромицине А) перемешивают при 70 С в течение 15 ч. ДМФ удаляют при пониженном давлении и полученный остаток подвергают хроматографии на силикагеле со смесью хлороформа, метанола и гидроксида аммония (80:19:1) с получением ненасыщенного сложного эфира примера 132. Способ ВВ. Этиловый сложный эфир из примера 132 растворяют в воде и тетрагидрофуране (1:1) (0,25 М), обрабатывают гидроксидом натрия (3 эквивалента) и перемешивают при комнатной температуре в течение 6 ч. После удаления тетрагидрофурана при пониженном давлении, рН доводят до 4 с помощью добавления 1 н. НСl. Водный раствор концентрируют досуха при пониженном давлении и полученный остаток перемешивают с МеОН и отфильтровывают. Фильтрат концентрируют с получением карбоновой кислоты примера 133. Способ СС. Раствор карбоновой кислоты по примеру 133, DCC (дицикло-гексилкарбодиимид, 1 эквивалент) и НОВТ (гидроксибензотриазол, 1 эквивалент) в ДМФ (0,25 М) обрабатывают соответствующим амином (1 эквивалент) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. После удаления ДМФ при пониженном давлении полученное масло подвергают хроматографии на силикагеле с использованием смеси хлороформа, метанола и гидроксида аммония (89:10:1) с получением желаемого амида. Способ DD. Смесь карбоновой кислоты по примеру 133 и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида (1 эквивалент) в ДМФ (0,25 М) обрабатывают соответствующим амином (1 эквивалент) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. После удаления ДМФ при пониженном давлении, остаток очищают с помощью хроматогра 003305 54 фии на силикагеле с использованием хлороформа, метанола и гидроксида аммония при концентрациях в пределах от 89:10:1 до 80:19:1. Способ ЕЕ. Продукт по примеру 133 в диметилформамиде (0,25 М) обрабатывают EEDQ (1 этоксикарбонил-2-этокси-1,2-дигидрохинолин,1,2-2 эквивалента) и соответствующим амином(1 эквивалент) и перемешивают при 70 С в течение ночи. После охлаждения реакционную смесь либо концентрируют в вакууме с получением сырого продукта для очистки, либо реакционную смесь выливают в хлороформ и полученный твердый продукт отфильтровывают с получением сырого продукта. Конкретные соединения, полученные согласно указанным выше способам, представлены ниже в таблицах. В таблицах "Ex." означает пример, "Mol Wt" обозначает молекулярную массу, "Stereo" означает стереоизомерию оксимового остатка (Е или Z), "Pro" означает способ,используемый для получения соединения и"Mass Spec" означает данные масс-спектрометрии. С использованием конкретных и общих химических реакций, описанных выше, соединения, перечисленные ниже, могут быть получены аналогичным же образом. Каждое из соединений, перечисленных ниже, является частью настоящего изобретения и обладает активностью против бактериальных инфекций. Литературные ссылки или информация по приготовлению приводятся для используемого спирта или галогенида, если такие исходные материалы не являются коммерчески доступными. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Е)-О-[(2,3-дигидробензофуран-6-ил)метил]оксим. 6-Бензофуранкарбоксальдегид может быть получен с помощью способа A.S. Tasker et al., J.Med. Chem. (1997) 40, 322. Восстановление альдегида с помощью боргидрида натрия и гидрирования двойной связи над палладием на угле дает 2,3-дигидро-6-бензофуранметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Z)-O-[(2,3-дигидробензофуран-6-ил)метил]оксим. 6-Бензофуранкарбоксальдегид может быть получен с помощью способа A.S. Tasker et al., J.Med. Chem. (1997) 40, 322. Восстановление альдегида с помощью боргидрида натрия и гидрирование двойной связи над палладием на угле дает 2,3-дигидро-6-бензофуранметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2 55O-метилен-D-неоинозит,(Е)-О-[(2,3-дигидро бензофуран-5-ил)метил]оксим. Восстановление 2,3-дигидро-5-бензофуранкарбоксальдегида с помощью боргидрида натрия дает 2,3-дигидро-5-бензофуранметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Z)-О-[(2,3-дигидробензофуран-5-ил)метил]оксим. Восстановление 2,3-дигидро-5-бензофуранкарбоксальдегида с помощью боргидрида натрия дает 2,3-дигидро 5-бензофуранметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(1,2,3,4-тетрагидронафталин-1-ил)оксим. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(1,2,3,4-тетрагидронафталин-1-ил)оксим. 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(7-хлор-1,2,3,4 тетрагидронафталин-1-ил)оксим. 7-Хлор-3,4-дигидро-1(2 Н)-нафталинон может быть получен с помощью способа W.M.Owton и М. Brunavs, Syn. Comm. (1991) 21, 981. Восстановление с помощью боргидрида натрия дает 7-хлор-1,2,3,4-тетрагидро-1-нафталинол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(7-хлор-1,2,3,4 тетрагидронафталин-1-ил)оксим. 1-Хлор-3,4-дигидро-1(2 Н)-нафталинон может быть получен по способу W.M. Owton и М. Brunavs, Syn. Comm. (1991) 21, 981. Восстановление с помощью боргидрида натрия дает 7 хлор-1,2,3,4-тетрагидро-1-нафталинол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(7-фтор-1,2,3,4 тетрагидронафталин-1-ил)оксим. 7-Фтор-3,4-дигидро-1(2 Н)-нафталинон может быть получен по способу W.M. Owton и М. Brunavs, Syn. Comm. (1991) 21, 981. Восстановление с помощью боргидрида натрия дает 7 фтор-1,2,3,4-тетрагидро-1-нафталинол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(7-фтор-1,2,3,4 тетрагидронафталин-1-ил)оксим. 7-Фтор-3,4-дигидро-1(2 Н)-нафталинон может быть получен по способу W.M. Owton и М. Brunavs, Syn. Comm. (1991) 21, 981. Восста 003305 56 новление с помощью боргидрида натрия дает 7 фтор-1,2,3,4-тетрагидро-1-нафталинол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Е)-О-(8-хлор-3,4 дигидро-2 Н-1-бензопиран-4-ил)оксим. Способ по G. Ariamala и К.К. Balasubramanian, Tet. Lett.(1988) 29, 3487 может быть использована для получения 8-хлор-2,3-дигидро-4 Н-1-бензопиран-4-она; восстановление с помощью боргидрид натрия затем дает 8-хлор-3,4-дигидро-2 Н-1 бензопиран-4-ол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(8-хлор-3,4-дигидро-2 Н-1-бензопиран-4-ил)оксим. Способ по(1988) 29, 3487 может быть использована для получения 8-хлор-2,3-дигидро-4 Н-1-бензопиран-4-она; восстановление с помощью боргидрида натрия затем дает 8-хлор-3,4-дигидро-2 Н 1-бензопиран-4-ол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Е)-О-(8-фтор-3,4 дигидро-2 Н-1-бензопиран-4-ил)оксим. Способ по R. Sarges et al., J. Med. Chem. (1988) 31, 230 может быть использована для получения 8 фтор-2,3-дигидро-4 Н-1-бензопиран-4-она; восстановление с помощью боргидрида натрия затем дает 8-фтор-3,4-дигидро-2 Н-1-бензопиран 4-ол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(8-фтор-3,4-дигидро-2 Н-1-бензопиран-4-ил)оксим. Способ поR. Sarges et al., J. Med. Chem. (1988) 31, 230 может быть использована для получения 8-фтор 2,3-дигидро-4 Н-1-бензопиран-4-она; восстановление с помощью боргидрида натрия затем дает 8-фтор-3,4-дигидро-2 Н-1-бензопиран-4-ол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[4-(фенилметил) фенилметил]оксим. Восстановление 4-(фенилметил)бензойной кислоты с помощью диборана дает 4-(фенилметил)бензолметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[4-(фенилметил) фенилметил]оксим. Восстановление 4-(фенилметил)бензойной кислоты с помощью диборана дает 4-(фенилметил)бензолметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифе 57 нил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Е)-O-[4-(фенокси) фенилметил]оксим. Восстановление 4-феноксибензальдегида с помощью боргидрида натрия дает 4-феноксибензолметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[4-(фенокси)фенилметил]оксим. Восстановление 4-феноксибензальдегида с помощью боргидрида натрия дает 4-феноксибензолметанол. 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(3-дифторметоксифенил)оксим; 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(3-дифторметоксифенил)оксим; 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(4-дифторметоксифенил)оксим; 5-Деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(4-дифторметоксифенил)оксим; Большинство примеров в табл.1 показывают наличие стереоизомеров С-4 с оксимным остатком в бета-ориентации, это обозначено в столбце Stereo.
МПК / Метки
МПК: C07H 15/203, A61P 31/00, C12P 19/44, A61K 31/70
Метки: производные, гигромицина
Код ссылки
<a href="https://eas.patents.su/30-3305-proizvodnye-gigromicina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гигромицина</a>
Предыдущий патент: Клатраты дегидроэпиандростерона и соответствующие фармацевтические композиции
Случайный патент: Укупорочное средство для сосуда с жидкостью












