Незамещенные тиеноизоксазолфенокси этил- и пропилпроизводные, используемые как антагонисты d4
Формула / Реферат
1. Соединение формулы I
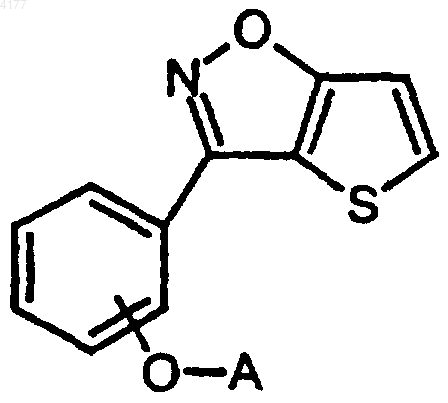
его фармацевтически приемлемая соль или стереоизомер, в которых
A означает C2-3алкилен-N(R1)(R2) или 1-(фенилметил)пирролидин-3-ил;
R1 означает (CH2)nQ, CH2CH(OH)Q, CH(CH3)Q, 1,2,3,4-тетрагидронафтил, инданил или адамантил, в которых
Q означает тиенил, фенил, фуранил, нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1H-пиразоло[4,3-c]пиридил, и
Q возможно замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, S(O)2NH2, трифторметила или циано, и
n равно 1 или 2;
R2 означает H или C1-6алкил; или
R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-c]пиридинил, 1,4-диокса-8-азоспиро[4,5]деканил, пиперазинил, морфолинил, пиперидинил, пирролидинил, азоканил, азепанил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1H-b -карболинил или 8-азабицикло[3.2.1]октанил, каждый из которых может быть моно- или независимо дизамещенным галогеном, C1-6алкилом, C1-6алкокси, C(O)фенилом, OH, CN, O-фенилом или (CH2)mZ,
Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и
Z, CH(OH)фенил, или O-фенил возможно замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, трифторметила, S(O)2NH2 или циано, и
m равно 0 или 1.
2. Соединение по п.1, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют пиперазинил.
3. Соединение по п.2, которое представляет собой 3-{3-[3-(4-пиримидин-2-илпиперазин-1-ил)пропокси]фенил}тиено[2,3-d]изоксазол.
4. Соединение по п.2, которое представляет собой 3-{3-[3-(4-фенилпиперазин-1-ил)пропокси]фенил}тиено[2,3-d]изоксазол.
5. Соединение по п.2, которое представляет собой 3-(3-{3-[4-(4-фторфенил)пиперазин-1-ил]пропокси}фенил)тиено[2,3-d]изоксазол.
6. Соединение по п.2, которое представляет собой 3-(3-{3-[4-(2-фторфенил)пиперазин-1-ил]пропокси}фенил)тиено[2,3-d]изоксазол.
7. Соединение по п.2, которое представляет собой 3-{3-[2-(4-фенилпиперазин-1-ил)этокси]фенил}тиено[2,3-d]изоксазол.
8. Соединение по п.1, в котором R1 означает инданил.
9. Соединение по п.8, которое представляет собой индан-2-ил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
10. Соединение по п.8, которое представляет собой индан-1-ил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
11. Соединение по п.8, которое представляет собой индан-1-ил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
12. Соединение по п.8, которое представляет собой индан-2-ил-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
13. Соединение по п.1, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют 1,2,3,4-тетрагидроизохинолинил.
14. Соединение по п.13, которое представляет собой 2-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]-1,2,3,4-тетрагидроизохинолин.
15. Соединение по п.13, которое представляет собой 2-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]-1,2,3,4-тетрагидроизохинолин.
16. Соединение по п.1, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют азепанил.
17. Соединение по п.16, которое представляет собой 3-[3-(2-азепан-1-илэтокси)фенил]тиено[2,3-d]изоксазол.
18. Соединение по п.1, в котором R1 представляет собой адамантил.
19. Соединение по п.18, которое представляет собой адамантан-1-ил-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
20. Соединение по п.18, которое представляет собой адамантан-1-ил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
21. Соединение по п.1, в котором Q представляет тиенил, фенил или пиридил; или R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют морфолинил, пиперидинил, пирролидинил или азоканил.
22. Соединение по п.21, которое представляет собой 1-фенил-2-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропиламино]этанол.
23. Соединение по п.21, которое представляет собой 4-{2-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропиламино]этил}бензолсульфонамид.
24. Соединение по п.1, в котором
A означает C2-3алкилен-N(R1)(R2);
R1 означает (CH2)nQ;
n равно 1;
R2 означает H;
Q означает тиенил, фенил или пиридил; или
R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют морфолинил, пиперидинил, пирролидинил или азоканил.
25. Соединение по п.24, в котором Q означает тиенил.
26. Соединение по п.25, которое представляет собой [3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]тиофен-2-илметиламин.
27. Соединение по п.25, которое представляет собой [2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]тиофен-2-илметиламин.
28. Соединение по п.25, которое представляет собой [2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]тиофен-3-илметиламин.
29. Соединение по п.25, которое представляет собой [3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]тиофен-3-илметиламин.
30. Соединение по п.24, в котором Q означает фенил.
31. Соединение по п.30, которое представляет собой бензил-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
32. Соединение по п.30, которое представляет собой бензил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
33. Соединение по п.30, которое представляет собой (2-метоксибензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
34. Соединение по п.30, которое представляет собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
35. Соединение по п.30, которое представляет собой (2,6-дифторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
36. Соединение по п.30, которое представляет собой (2,6-дифторбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
37. Соединение по п.30, которое представляет собой (2-фторбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
38. Соединение по п.30, которое представляет собой (4-фторбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
39. Соединение по п.30, которое представляет собой (4-хлорбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
40. Соединение по п.30, которое представляет собой (4-метоксибензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
41. Соединение по п.30, которое представляет собой 4-{[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропиламино]метил}бензолсульфонамид.
42. Соединение по п.30, которое представляет собой (4-хлорбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
43. Соединение по п.30, которое представляет собой (4-метилбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
44. Соединение по п.30, которое представляет собой (3,4-дихлорбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
45. Соединение по п.30, которое представляет собой (2,4-дифторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
46. Соединение по п.30, которое представляет собой [2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]-(4-трифторметилбензил)амин.
47. Соединение по п.30, которое представляет собой (2-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-ил-фенокси)этил]амин.
48. Соединение по п.30, которое представляет собой (2-хлорбензил)-[2-(3-тиеню[2,3-d]изоксазол-3-илфенокси)этил]амин.
49. Соединение по п.30, которое представляет собой (3-метоксибензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
50. Соединение по п.30, которое представляет собой (3,4-дифторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
51. Соединение по п.30, которое представляет собой (4-метилбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
52. Соединение по п.30, которое представляет собой (2-хлорбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
53. Соединение по п.30, которое представляет собой (3-метоксибензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
54. Соединение по п.30, которое представляет собой (3,4-дифторбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
55. Соединение по п.30, которое представляет собой (2,4-дифторбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
56. Соединение по п.30, которое представляет собой [3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]-(2-трифторметилбензил)амин.
57. Соединение по п.30, которое представляет собой [3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]-(4-трифторметилбензил)амин.
58. Соединение по п.30, которое представляет собой (4-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
59. Соединение по п.30, которое представляет собой [2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]-(2-трифторметилбензил)амин.
60. Соединение по п.30, которое представляет собой бензил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
61. Соединение по п.24, в котором Q означает пиридил.
62. Соединение по п.61, которое представляет собой пиридин-3-илметил-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
63. Соединение по п.61, которое представляет собой пиридин-3-илметил-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин.
64. Соединение по п.24, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют пиперидинил.
65. Соединение по п.64, которое представляет собой 3-[3-(3-пиперидин-1-илпропокси)фенил]тиено[2,3-d]изоксазол.
66. Соединение по п.64, которое представляет собой 3-{3-[2-(4-фенилпиперидин-1-ил)этокси]фенил}тиено[2,3-d]изоксазол.
67. Соединение по п.64, которое представляет собой 3-[3-(2-пиперидин-1-илэтокси)фенил] тиено[2,3-d]изоксазол.
68. Соединение по п.64, которое представляет собой 3-{3-[2-(4-метилпиперидин-1-ил)этокси]фенил}тиено[2,3-d]изоксазол.
69. Соединение по п.64, которое представляет собой 3-{3-[2-(4-пропилпиперидин-1-ил)этокси]фенил}тиено[2,3-d]изоксазол.
70. Соединение по п.24, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют пирролидинил.
71. Соединение по п.70, которое представляет собой 3-[3-(2-пирролидин-1-илэтокси)фенил] тиено[2,3-d]изоксазол.
72. Соединение по п.24, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют азоканил.
73. Соединение по п.72, которое представляет собой 3-[3-(2-азокан-1-илэтокси)фенил]тиено[2,3-d]изоксазол.
74. Соединение по п.24, в котором R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют морфолинил.
75. Соединение по п.1, в котором A представляет собой 1-(фенилметил)пирролидин-3-ил.
76. Соединение по п.75, которое представляет собой (S)-(+)-3-[3-(1-бензилпирролидин-3-илокси)фенил]тиено[2,3-d]изоксазол.
77. Соединение по п.75, которое представляет собой (R)-(-)-3-[3-(1-бензилпирролидин-3-илокси)фенил]тиено[2,3-d]изоксазол.
78. Способ антогонизирования действия допамина на рецептор D4, включающий в себя введение соединения по п.1 пациенту, нуждающемуся в этом.
79. Способ по п.78, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
80. Композиция, содержащая соединение по п.1 в смеси с инертным носителем.
81. Композиция по п.80, в которой названный инертный носитель является фармацевтическим носителем.
82. Способ лечения психозов, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
83. Способ по п.82, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
84. Способ лечения дефицита внимания, связанного с гиперактивностью, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
85. Способ по п.84, отличающийся тем, что соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
86. Способ лечения обсессивно-компульсивного расстройства, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
87. Способ по п.86, отличающийся тем, что соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
88. Способ лечения злоупотребления лекарством, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
89. Способ по п.88, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
90. Способ лечения лекарственной зависимости, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
91. Способ по п.90, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
92. Способ лечения болезни Паркинсона, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
93. Способ по п.92, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
94. Способ лечения паркинсонизма, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
95. Способ по п.94, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
96. Способ лечения поздней дискинезии, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
97. Способ по п.96, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
98. Способ лечения синдрома Жиля де ля Туретта, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
99. Способ по п.98, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
100. Способ лечения кондуктивного расстройства, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
101. Способ по п.100, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
102. Способ лечения оппозиционного вызывающего расстройства, включающий в себя введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1.
103. Способ по п.102, отличающийся тем, что вводят соединение, представляющее собой (3-фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амин.
104. Способ получения соединения формулы I
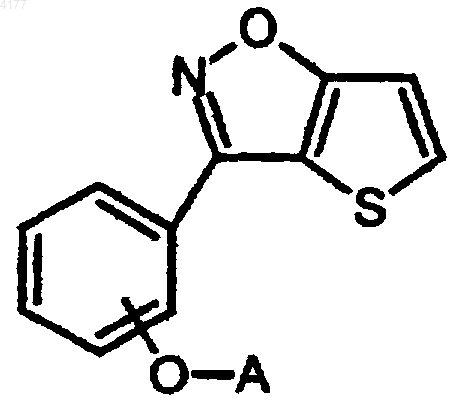
его фармацевтически приемлемой соли или стереоизомера, в которых
A означает C2-3алкилен-N(R1)(R2);
R1 означает (CH2)nQ, CH2CH(OH)Q, CH(CH3)Q, 1,2,3,4-тетрагидронафтил, инданил или адамантил, в которых
Q означает тиенил, фенил, фуранил, нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1H-пиразоло[4,3-c]пиридил и
Q возможно замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, S(O)2NH2, трифторметила или циано, и
n равно 1 или 2;
R2 означает H или C1-6алкил; или
R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-c]пиридинил, 1,4-диокса-8-азоспиро[4,5]деканил, пиперазинил, морфолинил, пиперидинил, пирролидинил, азоканил, азепанил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1H-b -карболинил или 8-азабицикло[3,2,1]октанил, каждый из которых может быть моно- или независимо дизамещенным галогеном, C1-6алкилом, C1-6алкокси, C(O)фенилом, OH, CN, O-фенилом или (CH2)mZ,
Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и
Z, CH(OH)фенил или O-фенил возможно замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, трифторметила, S(O)2NH2 или циано, и
m равно 0 или 1;
включающий взаимодействие реагента формулы II
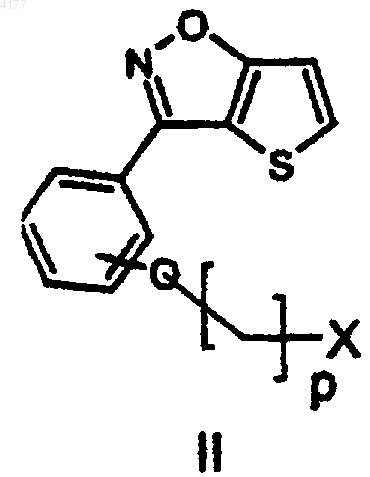
в которой
X означает Br, Cl или I и
p равно 2 или 3;
с реагентом формулы III
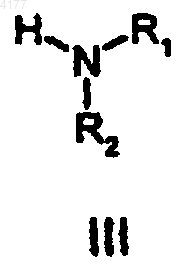
в которой R1 и R2 являются такими, как определено для формулы I;
с получением соединения формулы I.
105. Способ получения соединения формулы I
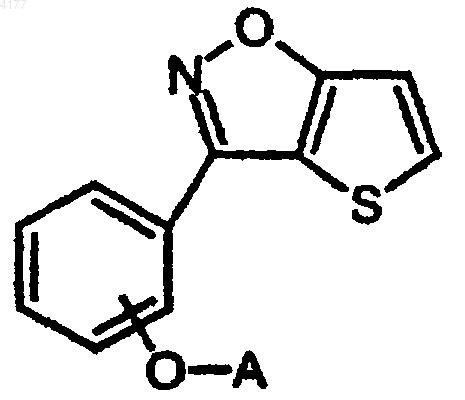
его фармацевтически приемлемой соли или стереоизомера, в которых
A означает 1-(фенилметил)пирролидин-3-ил;
включающий взаимодействие соединения формулы II
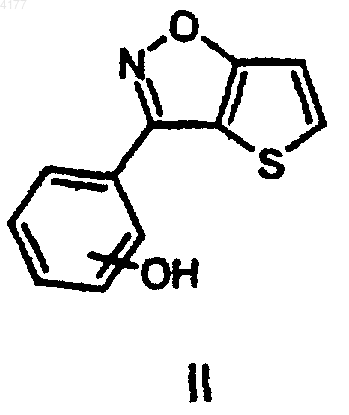
с реагентом формулы III
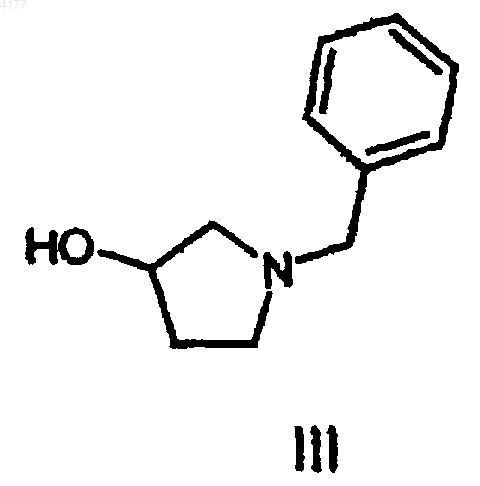
с получением соединения формулы I.
106. Способ получения соединения формулы I
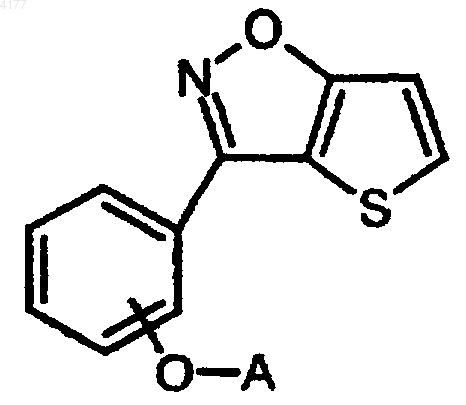
его фармацевтически приемлемой соли или стереоизомера, в которых
A означает C2-3алкилен-N(R1)(R2);
R1 означает (CH2)nQ, CH2CH(OH)Q, CH(CH3)Q, 1,2,3,4-тетрагидронафтил, инданил или адамантил, в которых
Q означает тиенил, фенил, фуранил, нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1H-пиразоло[4,3-c]пиридил и
Q возможно замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, S(O)2NH2, трифторметила или циано, и
n означает 1 или 2;
R2 означает H или C1-6алкил; или
R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-c]пиридинил, 1,4-диокса-8-азоспиро[4,5]деканил, пиперазинил, морфолинил, пиперидинил, пирролидинил, азоканил, азепанил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1H-b -карболинил или 8-азабицикло[3,2,1]октанил, каждый из которых может быть моно- или дизамещенным независимо галогеном, C1-6алкилом, C1-6алкокси, C(O)фенилом, OH, CN, O-фенилом или (CH2)mZ,
Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и
Z, CH(OH)фенил, O-фенил возможно замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, трифторметила, S(O)2NH2 или циано, и
m равно 0 или 1;
включающий взаимодействие соединения формулы II

с реагентом формулы III
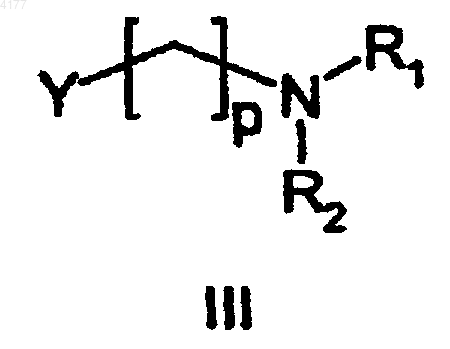
в которой R1 и R2 являются такими, как определено для формулы I;
p равно 2 или 3 и
Y означает Br, Cl, I, арилсульфонат или алкилсульфонат,
с получением соединения формулы I.
107. Способ получения соединения формулы I
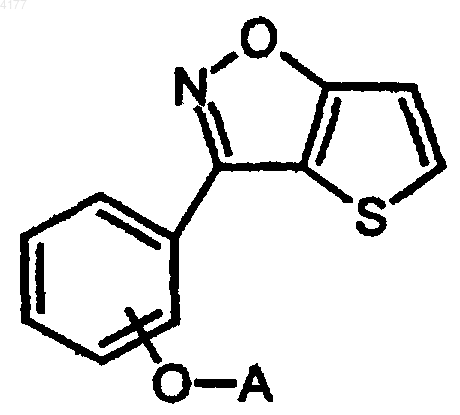
его фармацевтически приемлемой соли или стереоизомера, в которых
A означает C2-3алкилен-N(R1)(R2);
R1 означает (CH2)nQ, CH2CH(OH)Q, CH(CH3)Q, 1,2,3,4-тетрагидронафтил, инданил или адамантил, в которых
Q означает тиенил, фенил, фуранил, нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1H-пиразоло[4,3-c]пиридил и
Q возможно замещен одним или двумя фрагментами, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, S(O)2NH2, трифторметила или циано, и
n означает 1 или 2;
R2 означает H или C1-6алкил; или
R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-c]пиридинил, 1,4-диокса-8-азоспиро[4,5]деканил, пиперазинил, морфолинил, пиперидинил, пирролидинил, азоканил, азепанил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1H-b -карболинил или 8-азабицикло[3,2,1]октанил, каждый из которых может быть моно- или дизамещенным независимо галогеном, C1-6алкилом, C1-6алкокси, C(O)фенилом, OH, CN, O-фенилом или (CH2)mZ,
Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и
Z, CH(OH)фенил, O-фенил возможно замещены одним или двумя фрагментами, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, трифторметила, S(O)2NH2 или циано, и
m равно 0 или 1;
включающий восстановление соединения формулы
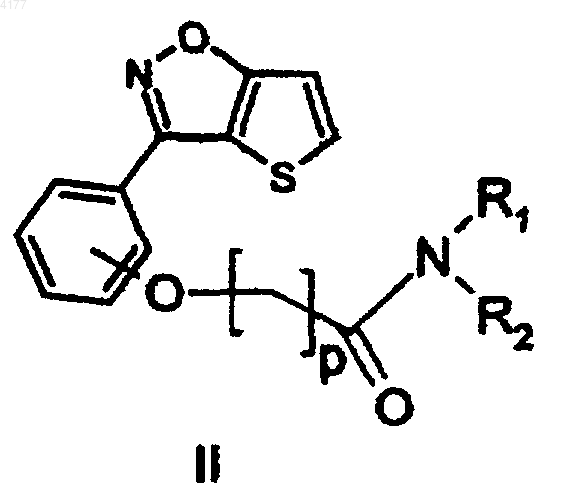
в которой p равно 1 или 2; и
R1 и R2 являются такими, как определено для формулы I с получением соединения формулы I.
108. Соединение формулы
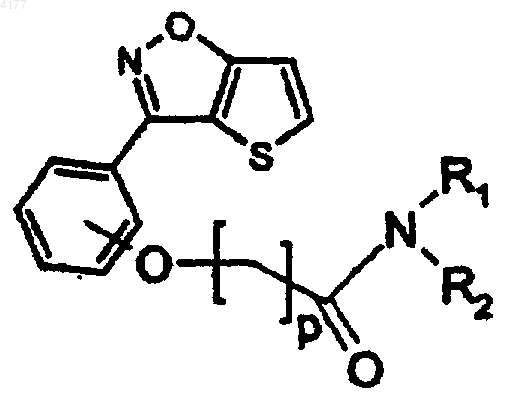
в которой p равно 1 или 2; и
R1 означает (CH2)nQ, CH2CH(OH)Q, CH(CH3)Q, 1,2,3,4-тетрагидронафтил, инданил адамантил, в которых
Q означает тиенил, фенил, фуранил, нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1H-пиразоло[4,3-c]пиридил и
Q возможно замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, S(O)2NH2, трифторметила или циано, и
n означает 1 или 2;
R2 означает H или C1-6алкил; или
R1 и R2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-c]пиридинил, 1,4-диокса-8-азаспиро[4,5]деканил, пиперазинил, морфолинил, пиперидинил, пирролидинил, азоканил, азепанил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1H-b -карболинил или 8-азабициклю[3,2,1]октанил, каждый из которых может быть моно- или дизамещенным независимо галогеном, C1-6алкилом, C1-6алкокси, C(O)фенилом, OH, CN, O-фенилом или (CH2)mZ,
Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и
Z, CH(OH)фенил, O-фенил возможно замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6алкила, C1-6алкокси, гидрокси, трифторметила, S(O)2NH2 или циано, и
m равно 0 или 1.
109. Соединение формулы
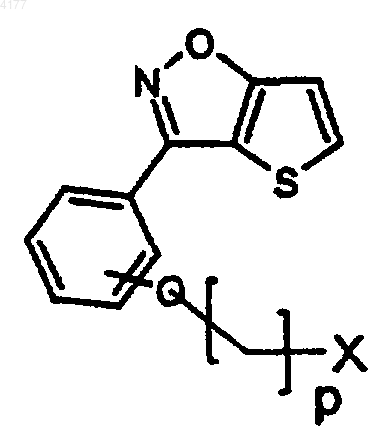
в которой X означает Br, Cl или I; и
p равно 2 или 3.
Текст
1 Данное изобретение относится к соединениям формулы I, используемым в качестве терапевтических средств для лечения патологических состояний посредством противодействия стимуляции рецептора D4, например, дефицита внимания, связанного с гиперактивностью, обсессивно-компульсивного расстройства и психозов. Изобретение также относится к промежуточным соединениям, способу получения соединений и способам применения соединений. Относительно новая наука - молекулярная биология предоставляет возможность нового проникновения в механизмы заболеваний ЦНС посредством выделения и клонирования подтипов рецептора. Таким образом, тогда как в более ранних функциональных исследованиях были охарактеризованы только два подтипа рецептора допамина, в настоящее время идентифицированы пять отдельных подтипов. Допаминовый рецептор D4 впервые был клонирован в 1991 г.Van Tol, Seeman, Civelli, et al. и было показано,что он локализован в лимбических зонах головного мозга, зонах, связанных с познавательным и эмоциональным поведением (Van Tol, H.H.M.,Bunzow, J.R.; Guan, H-C.; Sunahara, R.K.; P.affinity for the antipsychotic clozapine. Nature 1991, 350, 610). Рецептор D4 также локализован в лобной доле коры головного мозга, что подразумевает его роль в познавательной и исполнительной функции. Кроме того, сообщено, что избирательный антагонист D4 - NGD-94-1, вызывал улучшение поведения грызунов в тесте на пассивное уклонение и повышение эффективности в тесте пространственного водного лабиринта.New York, 1997). В описанных исследованиях эффекты названного соединения соответствовали анатомической локализации рецептора D4 в коре головного мозга, гиппокампе и таламусе. Для понимания возможной роли рецептора в заболевании были проведены исследования генетической связи и ассоциации уровнем полиморфизма. Описано, что имеется позитивная ассоциация между полиморфизмом семи единиц повторов и рядом клинических состояний, которые характеризуются высокой степенью сопутствующих патологических процессов, таких как дефицит внимания, связанный с гиперактивностью, и обсессивно-компульсивные расстройства-тики (Cruz, С. Et al., Increased prevalence of 2 Одним из наиболее значительных полиморфизмов в допаминовом рецепторе D4 является непостоянное количество тандемных повторов 48 пар оснований в третьей цитоплазматической петле. Выявлены индивидуумы с 2-10 тандемными повторами. Интересно, что описанный полиморфизм является приматспецифическим и не наблюдался у грызунов,позволяя предположить, что описанные полиморфизмы представляют собой результат сравнительно недавней эволюции (Asghari, V. et al.,Dopamine D4 receptor repeat: analysis of different(1994) Mol. Pharm. 46: 364-373). Рецептор D4 человека с семью единицами повторов имеет ряд уникальных свойств, которые отличают его от других полиморфизмов D4. Этот вариант D4.7 проявлял в 2-3 раза более низкое сродство к эндогенному лигандному допамину, чем вариант D4.2 (EC50 = 40 нМ против 15 нМ); однако, функциональное значение такого низкого сродства еще не выяснено. Дефицит внимания, связанный с гиперактивностью (в дальнейшем ADHD) Дефицит внимания, связанный с гиперактивностью (ADHD) является заболеванием, которое поражает 3-5% детей школьного возраста. Данное заболевание является широко распространенным, затрагивая вплоть до 50% детей с психическими заболеваниями. Заболевание также может возникать у совершеннолетних,поражая 1-3% взрослых. Диагноз ADHD устанавливают по трем основным критериям: невнимательность, гиперактивность и импульсивность. Приблизительно у 50-70% детей школьного возраста с диагнозом ADHD симптомы проявляются до середины подросткового периода и почти у одной трети некоторые признаки расстройства сохраняются в состоянии зрелости. Показано, что полиморфизм гена допаминового рецептора D4 ассоциирован с ADHD. У пациентов, страдающих ADHD, наблюдали значительное увеличение частоты появления формы рецептора D4 с 7-кратными повторами, варианта, который является специфическим для приматов (LaHoste, G.J.; Swanson, J.M.; Wigal,S.B.; Glabe, C., Wigal, Т.; King, N.; Kennedy, J.L.;Mol. Psychiatry 1996, 1, 121). Интересно, что избыток аллеля D4.7 ассоциирован также с чертой характера "поиск новизны"; индивидуумы,оцениваемые выше среднего по этой шкале,характеризуются как импульсивные, исследующие, непостоянные, легковозбудимые, вспыльчивые и сумасбродные (Ebstein, R.P. et al.; Dopamine D4 receptor (D4DR) exon III polymorphismures of Novelty Seeking. Nature Genetics. 1996,12, 81). Описанный вариант рецептора D4 может давать неконтролируемый ответ на допамин,что, возможно, означает увеличение функции этого рецептора a) Van Tol, H.H.M.; Wu, С.М.;Eds.; Academic Press: New York, 1997). Поэтому,приведенные результаты позволяют предположить, что антагонист D4 может быть эффективным при лечении ADHD без видимой склонности к побочным эффектам при текущей лекарственной терапии. У больных ADHD также наблюдается повышенная частота заболеваемости кондуктивным расстройством и оппозиционным вызывающим расстройством. Кондуктивное расстройство является нарушением, при котором пациент проявляет повторяющийся и устойчивый характер поведения, при котором нарушаются основные права других или главные, соответствующие возрасту общественные нормы или правила. Подобные реакции подпадают под четыре основные группировки: агрессивное поведение, которое причиняет или грозит физическим ущербом другим людям или животным,неагрессивное поведение, которое приводит к потере собственности или убытку, обману или воровству и серьезным нарушениям правил. Оппозиционное вызывающее расстройство представляет собой расстройство, при котором пациент проявляет некоторые особенности поведения, наблюдаемые при кондуктивном расстройстве (например, неповиновение и противодействие авторитетным личностям), однако,при оппозиционном расстройстве не наблюдают устойчивого характера более серьезных форм поведения, когда нарушаются основные требования других или соответствующие возрасту общественные нормы или правила. Хотя дети сADHD часто проявляют повышенную активность и импульсивное поведение, которое может быть разрушительным, такое поведение само собой не нарушает соответствующих возрасту общественных норм и поэтому обычно не удовлетворяет критериям кондуктивного расстройства. Не имеется никаких определенных данных относительно числа копий гена на геноме для описанных состояний, которые являются относительно невосприимчивыми к имеющейся фармакотерапии. Если нарушения нейротрансмиссии D4 вовлечены в патогенез ADHD, возможно, что нарушения D4 также играют роль в описанных состояниях.(в дальнейшем OCD) Обсессивно-компульсивное расстройство является неврозом, характеризующимся наличием повторяющихся идей и фантазий (навязчивые состояния) и повторяющихся побуждений или действий (компульсивные побуждения), которые пациенты осознают как болезненное состояние и по отношению к которому они чувствуют сильную внутреннюю резистентность. В США установлено, что приблизительно четыре миллиона пациентов пораженыOCD, однако, меньше, чем половине поставлен диагноз и проводится лечение. Такой же вариант гена допаминового рецептора D4 с семью повторами был получен, что показывает его повышенную распространенность у больных, страдающих обсессивнокомпульсивным расстройством с тиками (Cruz,С. et al., Increased prevalence of the seven-repeatClin Neuropharmacol. 18: S143-153). Также описано, что подростки с OCD плюс тики оказываются более склонными к проявлению интенсивных и агрессивных навязчивых состояний, чем пациенты без тиков (Cruz, С. et al., Increasedprevalence of the seven-repeat variant of the dopamin D4 receptor gene in patients with obsessivecompulsive disorder with tics. Neurosci. Lett. 1997,231, 1. Van Tol, H.H.M. (1995) Clin Neuropharmacol. 18: S143-153). Как упоминали ранее, показано, что описанный вариант D4 дает неконтролируемый ответ на допамин. Таким образом,OCD также может быть расстройством, ассоциированным с увеличением функции на рецепторе D4, которая будет отвечать на лечение избирательными антагонистами D4. Шизофрения Шизофрения является тяжелым психическим заболеванием, затрагивающим по оценкам 1% населения мира. Патофизиология заболевания точно неизвестна, возможно, патофизиологический процесс ведет к расстройству допаминэргических невральных систем посредством плохо понимаемых взаимодействий атомных,метаболических и генетических нарушений. Больной шизофренией страдает от психотических симптомов, в общих чертах распределяемых по категориям как позитивные, негативные или познавательные. Позитивные симптомы включают в себя бреды, галлюцинации, неразумные страхи и расстройство мышления. Негативные или дефицитные симптомы включают в себя социальную абстиненцию, снижение деятельности, сниженную или несоответствующую эмоциональную реакцию, невыраженность речи,заметный недостаток инициативы или активности и неспособность испытывать удовольствие. Познавательные симптомы включают в себя снижение внимания, беглости речи, недостаточ 5 ность воспроизводимой памяти или исполнительной функции. После открытия в 1950-е годы клинической антипсихотической активности хлорпромазина, фармакологический антагонизм центральных допаминовых рецепторов остается единственным доказанным средством лечения шизофрении. Это подтверждается использованием ряда веществ с различными химическими структурами, которые, как было установлено,проявляют антагонизм к допаминовому рецептору D2 и оказывают благоприятное клиническое действие. При использовании способов молекулярной биологии, за последнее время были открыты два семейства допаминовых рецепторов, а именно семейство допамина D1 (подтипы D1 иD5 рецептора) и семейство допамина D2 (подтипы D2, D3 и D4 рецептора). Показано, что все клинически эффективные антипсихотические агенты связывают названные подтипы рецептора с различным сродством (Corbett, R. et al.,1997; Iloperidone: Preclinical Profile and earlyclinical evaluation. CNS Drugs Reviews 3(2): 120147). Показано, что ряд недавно введенных в употребление антипсихотических лекарственных средств со сниженной предрасположенностью к экстрапирамидальным побочным эффектам имеет большее сродство к подтипу D4 допаминового рецептора по сравнению с подтипомD2 допаминового рецептора. Отмеченное более высокое сродство к рецептору D4 по сравнению с рецептором D2 может содействовать действию таких лекарственных средств, имеющих более высокую эффективность и меньшую предрасположенность к побочным эффектам, чем традиционные обычные антипсихотические лекарственные средства (Seeman, P., Corbett, R. and Vanfor D4 receptors. Neuropsychopharmacology 16 (2): 93-135). Поэтому соединения с селективным сродством к D4 могут быть эффективными в отношении шизофрении, не вызывая побочных эффектов, ассоциированных с блокадой рецептора D2. Злоупотребление лекарством/лекарственная зависимость Повторное введение грызунам психостимуляторов, таких как d-амфетамин, вызывает прогрессирующее и длительно сохраняющееся повышение таких реакций, как двигательная активность, феномена, известного как поведенческая сенсибилизация или обратная толерантность. Такая устойчивая гиперчувствительность к психостимуляторам наблюдалась также у человека и, как полагают, лежит в основе привыкания к чрезмерному употреблению лекарственных средств (Robinson, Т.Е. and Berridge, К. С. 1993 The neural basis of drug craving:Research Reviews 18: 247-291). Мезолимбическая допаминовая система играет решающую 6 роль в развитии привыкания к чрезмерному употреблению лекарственных средств. Развитие поведенческой сенсибилизации к амфетамину,как полагают, отражает нейроадаптивные биохимические и геномные ответы, запускаемые в результате первого воздействия психостимулятором. Постсинаптическая нейропластичность приводит к изменениям количества допаминовых рецепторов и чувствительности. Функция семейства D2 допаминового рецептора (подтипов D2, D3 и D4 рецептора) изменяется в результате введения амфетамина. Показано, что постоянное введение грызунам селективного антагониста допаминового рецептора D4 останавливает развитие поведенческой сенсибилизации наd-амфетамин, указывая, что селективные антагонисты допамина D4 могут быть эффективными при лечении злоупотребления лекарственным средством (Feldpausch D.L. et al., 1998 TheTherapeutics 266: 497-508). Роль рецептора D4 в развитии злоупотребления лекарством и лекарственной зависимости подтверждена описаниями избытка длинных аллелей (главным образом, 7 повторов) полиморфизма 3 экзона D4 у наркоманов и, возможно, у алкоголиков (Ebstein R.P., Belmaker R.H. 1997 Saga of an adventure gene: novelty seeking,substance abuse and the dopamine D4 receptorAddiction Biology 3:473-81). Длинные аллели полиморфизма 3 экзона D4 также могут быть ассоциированы с повышенной трудностью прекращения курения, что может быть связано с привыканием к чрезмерному употреблению никотина (Shields PG, Lerman С. Audrain J., et al. 1998 Dopamine D4 receptors and the risk of cigarette smoking in African-Americans and Caucasians. Cancer Epidemiology, BiomarkersPrevention 7:453-8). Болезнь Паркинсона/паркинсонизм Болезнь Паркинсона является прогрессирующим нарушением движения, характеризующимся тремором, ригидностью и брадикинезией. Другие проявления включают в себя депрессию, деменцию (особенно при прогрессирующем заболевании) и психоз (особенно как осложнение допаминэргической терапии). Болезнь Паркинсона поражает приблизительно 0,1% населения, обычно развиваясь после 50 7 лет. Главная патология заключается в утрате допаминэргических нейронов компактной зоны в черном веществе. Основное лечение состоит в назначении предшественников допамина или агонистов, однако, такое лечение является частично эффективным и связано с побочными эффектами, включая дискинезию, психоз и артериальную гипотензию. Антихолинэргические лекарственные средства используются периодически, но они имеют ограниченную эффективность и плохо переносятся. Традиционные антипсихотические лекарственные средства (нейролептики) блокируют допаминовый рецептор D2 и обычно вызывают симптомы болезни Паркинсона, "паркинсонизма" дозазависимым способом, соответствующим эффективности их D2-блокады. Синтез допамина в дорзальном полосатом теле мыши увеличивался у D4-"нокаутных" мышей (Rubinstein M., Phillips T.J., Bunzow J.R., etsupersensitive to ethanol, cocaine, and methamphetamine. Cell 90:991-1001). Это позволяет предположить, что антагонист D4 может проявлять эффективность при лечении болезни Паркинсона как при лечении основных симптомов,так и при лечении как психиатрических, так и двигательных побочных эффектов, возникающих при использовании стандартных допаминэргических терапий. Некоторые исследования позволили предположить благоприятное действие нетипичного антипсихотического клозапина не только при лечении индуцированного леводопом психоза,но также при лечении собственно паркинсонических симптомов, особенно дрожания. Полученные результаты рассмотрены Factor и Friedman (Factor S.A., Friedman J.H. 1997 The emerging role of clozapine in the treatment of movementdisorders. Movement Disorders 12:483-96). Клозапин, кроме известной блокады D4, проявляет активность в отношении многих других рецепторов, особенно серотонинового 5-HT2 и мускаринового рецепторов ацетилхолина. Маловероятно, что антихолинэргические эффекты объясняют эффективность клозапина, так как антихолинэргические не-ответчики драматически реагировали на клозапин. Тогда как это может быть отчасти обусловлено антагонизмом к 5HT2; при исследовании пациентов с болезнью Паркинсона замена клозапина оланзапином,мощным антагонистом 5-НТ 2 (хотя и с более высоким сродством к допаминовому D2, чем клозапин), была связана с увеличением паркинсонических симптомов (Friedman J.H., GoldsteinNeuropharmacol 21:285-8). Описано, что дискинезии и дистонии, связанные с использованием леводопа, также имели положительную динамику при применении клозапина (Factor S.A., 004177Movement Disorders 12: 483-96). Дальнейшим подтверждением возможной роли рецептора D4 в болезни Паркинсона оказалось сообщение о повышенной частоте появления длинных (6 повторов) аллелей полиморфизма 3 экзона D4 при болезни ПаркинсонаD4 receptor exon 3 repeat polymorphism with Parkinsons-disease. Clinical Genetics 54:33-8). Поздняя дискинезия (в дальнейшем TD) Поздняя дискинезия представляет собой нарушение движений, состоящее из непроизвольных хорееподобных, атетоидных или ритмичных движений языка, челюсти или конечностей, которое развивается как результат (обычно хронического) применения нейролептиков и обычно сохраняется даже после отмены названных лекарственных средств. Общая частота заболевания индуцированной нейролептиками поздней дискинезией у пациентов, которые получали продолжительное лечение нейролептиками, оценена как 20-30% (American PsychiatricMental Disorders, Fourth edition. Washington, DC,American Psychiatric Association, 1994). Повышенные концентрации рецептора D4 выявлены в некоторых аутопсийных исследованиях больных шизофренией (обычно леченных традиционными нейролептиками длительное время) (Lahti R.A., Roberts R.C., Cochrane E.V.,et al. 1998 Direct determination of dopamine D4Pharmacol 286:R3-5). Показана активация рецептора D2 при длительном применении нейролептического галоперидола в исследованиях как на животных, так и на человеке (Schroder J., Silvestri S., Bubeck В., et al. 1998 D2 dopamine receptor up-regulation, treatment response, neurological soft signs, and extrapyramidal side effects intomography in the drug-naive state and after neuroleptic treatment. Biol. Psychiatry 43:660-5). Применение упомянутых лекарственных средств также может быть ответственным за активацию рецептора D4. Улучшение при TD показано при применении клозапина (Bassitt D.P., Louza-Neto M.R. 1998 Clozapine efficacy in tardive dyskinesia inschizophrenic patients. European Archives of PsychiatryClinical Neuroscience 248:209-11), лекарственного средства с выраженным антагонизмом к D4. Несмотря на то, что клозапин проявляет другие фармакологические эффекты,особенно блокирование рецептора 5 НТ 2, в на 9 стоящее время не установлено влияние на TD антагонистов рецептора 5HT2/D2, таких как рисперидон или оланзапин. Интерес может представлять то, что хроническая блокада D4 также может вызывать позднюю дискинезию, однако,такое осложнение развивается чрезвычайно редко у больных, леченных клозапином. Синдром Жиля де ля Туретта(в дальнейшем TS) Синдром Жиля де ля Туретта, состояние проявляемое двигательными и голосовыми тиками и с распространением приблизительно 0,5% (обычно у подростков), наблюдается с повышенной частотой у больных ADHD и/илиOCD и у членов семей больных с названными заболеваниями. Применение стимулирующих лекарственных средств (которые увеличивают синаптические концентрации допамина) у пациентов с ADHD связано с повышенной частотой тиков и возможно TS (Erenberg G., Cruse R.P.,Rothner A.D. 1985 Gille de la Tourette's syndrome:Effects of stimulant drugs.Neurology 35:1346-8). Описана повышенная частота появления аллеляAmerican Journal of Human Genetics 59:644-52), а галоперидол (D2/D4-допаминовый антагонист) эффективен при регулировании тиков. Краткое изложение изобретения Данное изобретение относится к соединению формулы I его фармацевтически приемлемой соли или стереоизомеру, в которых А означает С 2-3 алкилен-N(R1)(R2) или 1(фенилметил)пирролидин-3-ил;Q возможно замещен одним или двумя заместителями, независимо выбранными из галогена,C1-6 алкила,C1-6 алкокси,гидрокси,S(O)2NH2, трифторметила или циано, и 1,2,3,4-тетрагидро-1 Нкарболинил или 8-азабицикло[3,2,1]октанил, каждый из которых может быть моно- или дизамещенным независимо галогеном, C1-6 алкилом, C1-6 алкокси, С(О)фенилом, ОН, CN, O-фенилом или (CH2)mZ,Z представляет бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, иZ, СН(ОН)фенил или O-фенил возможно замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила,C1-6 алкокси,гидрокси,трифторметила,S(O)2NH2 или циана, иm равно 0 или 1. Изобретение также относится к фармацевтической композиции, содержащей соединение формулы I в количестве, эффективном, чтобы противодействовать стимуляции рецептора D4,и фармацевтически приемлемый носитель. Кроме того, изобретение относится к применению соединений формулы I в качестве антагонистов рецептора D4 для лечения патологических состояний, опосредованных ингибированием рецептора D4. Упомянутые состояния включают в себя, например, дефицит внимания,связанный с гиперактивностью, обсессивнокомпульсивное расстройство, психозы, злоупотребление лекарством, лекарственную зависимость, болезнь Паркинсона, паркинсонизм,позднюю дискинезию, синдром Жиля де ля Туретта, кондуктивное расстройство и оппозиционное вызывающее расстройство. Изобретение относится к промежуточным соединениям и способам получения соединений формулы I. Подробное описание данного изобретения Используемые в описании термины имеют следующие значения: а). Термин Фармацевтически приемлемые соли означает или аддитивную соль кислоты,или аддитивную соль основания, которая совместима с лечением пациентов предполагаемым способом. Фармацевтически приемлемая аддитивная соль кислоты представляет собой любую нетоксичную аддитивную соль органической или неорганической кислоты основных соединений, представленных формулой I, или любых их промежуточных соединений. Примерами неорганических кислот, которые образуют соответствующие соли,являются хлористоводородная, бромисто-водородная, серная и фосфорная кислоты и металлические соли кислоты, такие как двузамещенный ортофосфат натрия и бисульфат калия. Примерами органических кислот, которые образуют соответствующие соли, являются моно-, ди- и трикарбоновые кислоты. Примерами таких кислот являются уксусная, гликолевая, молочная, пировиноградная, малоновая, янтарная, глутаровая,фумаровая, яблочная, винная, лимонная, аскор 11 биновая, малеиновая, гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная,коричная, салициловая, 2-феноксибензойная, птолуолсульфоновая кислота и сульфоновые кислоты, такие как метансульфоновая кислота,нафталинсульфоновая кислота и 2-гидроксиэтансульфоновая кислота. Могут быть образованы любые соли моно- или дикислот, и такие соли могут существовать в или гидратной, сольватной, или, по существу, безводной форме. Вообще аддитивные соли кислот этих соединений лучше растворяются в воде и различных гидрофильных органических растворителях. Кроме того, по сравнению с их формами свободных оснований, аддитивные соли кислот, в основном, демонстрируют более высокие точки плавления. Термин Фармацевтически приемлемые аддитивные соли основания означает нетоксические аддитивные соли органических или неорганических оснований соединений формулы(I) или любых их промежуточных соединений. Примерами являются гидроокиси щелочных металлов или щелочно-земельных металлов,таких как гидроокиси натрия, калия, кальция,магния или бария; аммиак и алифатические,алициклические или ароматические органические амины, такие как метиламин, триметиламин и пиколин. Критерии выбора соответствующей соли известны специалистам в данной области.b). "Стереоизомеры" является обычным термином для всех изомеров индивидуальных молекул, которые различаются только по ориентации их атомов в пространстве. Стереоизомеры включают в себя зеркальные изомеры (энантиомеры), геометрические (цис/транс) изомеры и изомеры соединений, имеющих больше одного хирального центра, которые не являются зеркальными изображениями друг друга (диастереоизомеры).c). Используемый в описании термин алкил означает алкильный, с разветвленной или прямой цепью (моновалентный) или алкиленовый (дивалентный) углеводородный радикал,содержащий определенное число атомов углерода в алкильной цепи, например, C1-6 алкил означает алкил или алкилен, с разветвленной или прямой цепью, включающей 1, 2, 3, 4, 5, 6 атомов углерода, или содержащей их в интервале,например, C1-2, C1-3, C1-4, C1-5, C2-3, С 2-4, С 2-5, С 2-6,С 3-4, С 3-5, С 3-6, С 4-5, С 4-6, С 5-6 и так далее, не ограничиваясь вышеперечисленным.d). Пациент означает теплокровное животное, такое как, например, крыса, мыши, собаки, кошки, морские свинки и приматы, такие как человек.e). Лечить или лечение означает облегчение симптомов, устранение этиологии симптомов или временно, или постоянно, либо предупреждение, либо замедление появления 12 симптомов названного нарушения или состояния.f). Терапевтически эффективное количество подразумевает количество соединения,которое эффективно при лечении названного нарушения или состояния.g). Фармацевтически приемлемый носитель представляет собой нетоксичный растворитель, диспергатор, наполнитель, адъювант или другое вещество, который смешивается с активным ингредиентом для того, чтобы способствовать образованию фармацевтической композиции, т.е. дозированной формы, допускающей введение пациенту. Одним примером такого носителя является фармацевтически приемлемое масло, обычно используемое для парентерального введения.h). Психозы означают состояния, при которых пациент ощущает основное психическое расстройство органического и/или эмоционального происхождения, характеризующееся психическим расстройством личности и потерей контакта с реальностью, часто с бредом, галлюцинациями или иллюзиями. Типичные примеры психотических заболеваний включают в себя шизофрению, шизофренияподобное нарушение,шизоафферентное нарушение, бредовое расстройство, кратковременное психотическое расстройство, острое психотическое расстройство,психотическое расстройство, не определенное точно и индуцированное веществом психотическое расстройство. См. Diagnostic and Statisticali). Дефицит внимания/гиперактивность или ADHD означает состояние, при котором пациент проявляет устойчивый характер приступов невнимания и/или гиперактивностиимпульсивности, которые оказываются более частыми и тяжелыми, чем обычно наблюдаемые у индивидуумов сопоставимого уровня развития. Термин включает в себя ADHD комбинированного типа, ADHD преимущественно типа дефицита внимания и ADHD преимущественно гиперактивного-импульсивного типа.j). "Кондуктивное расстройство" подразумевает расстройство, при котором пациент проявляет периодический и устойчивый характер поведения, при котором нарушаются основные требования других или основные соответствующие возрасту общественные нормы или правила. Названные формы поведения относятся к четырем главным группам: агрессивное поведение, которое причиняет или угрожает физическим ущербом другим людям или животным, неагрессивное поведение, которое является причиной потери собственности или повреждения, обмана или воровства и серьезных нарушений правил. 13 у пациента появляются некоторые особенности поведения, наблюдаемые при кондуктивном расстройстве (например, неповиновение и сопротивление авторитентным личностям), однако, оно не включает в себя устойчивые особенности более серьезных форм поведения, при которых нарушены или основные требования других или соответствующие возрасту общественные нормы и правила.l). "Обсессивно-компульсивное расстройство" или "OCD" означает состояние, при котором пациент испытывает повторяющиеся навязчивые состояния или компульсивные побуждения, которые оказываются достаточно тяжелыми, протяженными по времени (т.е. требуют более часа в день) или вызывают заметный дистресс или значительное ухудшение. Навязчивые состояния представляют собой устойчивые идеи, мысли, мотивации или представления,которые ощущаются как инвазивные и несоответствующие и которые вызывают заметный страх и дистресс. Компульсивные побуждения представляют собой повторяющиеся поступки(например, мытье рук, наведение порядка, контролирование) или психические действия (например, моление, подсчитывание, повторение слов безмолвно), целью которых является предупреждение или снижение страха и дистресса,но не получение удовольствия или удовлетворения.m). "Лекарственная зависимость" означает состояние, при котором пациент проявляет неадекватное отношение к применению лекарственного вещества, ведущее к клинически значительному ухудшению или дистрессу. Появляется привычка повторяемого самостоятельного введения препарата, что обычно приводит к толерантности, абстиненции и компульсивному побуждению принятия лекарственного средства.n). "Злоупотребление веществом" означает состояние, при котором пациент демонстрирует неадекватное отношение к применению вещества, проявляющееся повторяющимися и значительными неблагоприятными последствиями,связанными с повторным применением веществ. Может возникать неспособность выполнять основные обязанности, повторное применение в ситуациях, при которых оно становится физически опасным, вызывая многочисленные правовые проблемы и повторяющиеся общественные и межличностные проблемы. В отличие от "лекарственной зависимости", критерии для "злоупотребления веществами" не включают в себя толерантность, абстиненцию или характер компульсивного побуждения к применению, а вместо этого включают только вредные последствия при повторном применении. о). "Болезнь Паркинсона" означает медленно прогрессирующее неврологическое состояние, характеризующееся тремором, ригидностью, брадикинезией и постуральной неус 004177 14 тойчивостью. Другие проявления включают в себя депрессию и деменцию. р). "Паркинсонизм" означает состояние,при котором пациент проявляет ларкинсонические признаки или симптомы (т.е. дрожание,мышечную ригидность или акинезию), которые развиваются в связи с применением нейролептических лекарственных средств.q). "Индуцированная нейролептиками поздняя дискинезия" означает нарушение, характеризуемое непроизвольными движениями языка, челюсти, туловища или конечностей,которое развивается в связи с применением нейролептических лекарственных средств. Непроизвольные движения могут быть хорееподобными, атетоидными и ритмичными.r). "Синдром Жиля де ля Туретта" означает состояние, проявляющееся двигательными и голосовыми тиками. (Тик представляет собой внезапное, быстрое, повторяющееся, неритмичное, стереотипное двигательное движение или вокализацию). Нарушение вызывает заметный дистресс или значительное ухудшение в общественной, профессиональной или других важных областях деятельности. Начало развивается в возрасте до восемнадцати лет и нарушение не обусловлено физиологическими эффектами вещества или общим состоянием здоровья.s). Если не определено особо, "галоид" или в котором Аr представляет фенил, возможно замещенный одним или более заместителями из группы, состоящей из галогена, нитро или C1 С 6 алкила. Брозил означает радикал, в котором Аr представляет п-бромбензол. "Нозил" означает радикал, в котором Аr соответствует пнитробензолу. "Тозил" означает радикал, в котором Аr представляет п-толуол.u). Сложный сульфоновый эфир означает радикал в котором R представляет C1-С 6 алкил или фенил, возможно замещенный одним или более заместителями из группы, состоящей из галогена, нитро или C1-С 6 алкила. Сложный сульфоновый эфир представляет, например, брозилат,нозилат, тозилат и мезилат.v). Параллельный синтез является термином, используемым для описания одновременного синтеза от десятков до миллионов соединений в растворе или в твердой фазе. Ключевой характеристикой, которая отличает названный подход от серийных способов, является то, что он не утилизирует смеси. Применяемые в описании термины, использованные для описания определенных химических фрагментов, определены с помощью соответствующих химических рисунков, которые представлены ниже Особыми аспектами изобретения являются названные соединения формулы I, представленные в табл. 1. Предпочтительный аспект изобретения составляет соединение формулы I, в которой R1 иR2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют пиперазинил, 1,2,3,4 тетрагидроизохинолинил или азепанил. Другой предпочтительный аспект изобретения составляет соединение формулы I, в которой R1 означает адамантил. В следующем предпочтительном аспекте изобретения представлено соединение формулыI, в которой R1 означает инданил. В еще одном аспекте изобретения предусмотрено соединение формулы I, в которой А представляет 1-(фенилметил)пирролидин-3-ил. Более предпочтительный аспект изобретения составляет соединение формулы I, в которой Q означает тиенил, фенил или пиридил; или 16 Еще один более предпочтительный аспект изобретения составляет соединение формулы I,в которой А означает С 2-3 алкилен-N(R1)(R2); R1 означает (CH1)nQ; n равно 1; R2 означает Н; Q означает тиенил, фенил или пиридил, или R1 иR2 вместе с атомом азота, к которому R1 и R2 присоединены, образуют морфолинил, пиперидинил, пирролидинил или азоканил. Наиболее предпочтительные аспекты изобретения составляют соединения формулы I,представленные в табл. 1, которые проявляют повышенное сродство к D4. Аддитивные соли кислот соединения формулы I, которые являются наиболее подходящими, получены из фармацевтически приемлемых кислот, и включают в себя, например, соединения, образованные неорганическими кислотами, например, хлористо-водородной, серной или фосфорной кислотами, и органическими кислотами, например, янтарной, малеиновой,уксусной или фумаровой кислотой. Другие фармацевтически неприемлемые соли, например, оксалаты, можно использовать, например при выделении соединений формулы I для лабораторного применения, или для последующего превращения в фармацевтически приемлемые аддитивные соли кислот. Также в объем изобретения включены сольваты и гидраты соединений изобретения. Превращение данной соли соединения в требуемую соль соединения достигали посредством стандартных способов, при которых водные растворы данной соли обрабатывали раствором основания, например, карбонатом натрия или гидроокисью калия, чтобы освободить свободное основание, которое затем экстрагировали в соответствующий растворитель, такой как простой эфир. Потом свободное основание выделяли из водной порции, высушивали и обрабатывали необходимой кислотой для получения требуемой соли. Соединения данного изобретения можно получить посредством способов, подобных способам, известным в данной области. Схемы I, Ia,Ib и II иллюстрируют способы синтеза соединений формулы I. Если синтез исходного вещества не приведен, исходное вещество или является известным, поставляемым коммерчески, или может быть получено с помощью общепринятых способов. Патенты США цитируются в описании и включены в него в качестве ссылки.n равно 2 или 3; R означает C1-6 алкил; R3 означает (СН 2)yQ, CH2CH(OH)Q, СН(СН 3)Q, инданил,1,2,3,4-тетрагидронафтил или адамантил, в которых Q представляет тиенил, фенил, фуранил,нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1 Н-пиразоло[4,3-с]пиридил и Q, возможно,замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила,C1-6 алкокси, гидрокси, S(O)2NH2, трифторметила или циано, и у равно 1 или 2: R4 означает Н или C1-6 алкил; или R3 и R4 вместе с атомом азота, к которому R3 и R4 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-с]пиридинил,1,4-диокса-8-азаспиро[4,5]деканил,пиперазинил, морфолинил, пиперидинил, пирролидинил,азепанил,азоканил,1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1 Н-бета-карболинил или 8-азабицикло[3,2,1]октанил, каждый из которых может быть моно- или независимо дизамещенным галогеном, C1-6 алкилом, C1-6 алкокси, С(О)фенилом, ОН, CN, O-фенилом или(CH2)mZ, Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и Z, СН(ОН)фенил или O-фенил, возможно,замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила,C1-6 алкокси,гидрокси,трифторметила,S(O)2NH2 или циано; m равно 0 или 1.I; n равно 1 или 2; R3 означает (СН 2)yQ,CH2CH(OH)Q, СН(СН 3)Q, инданил, 1,2,3,4 тетрагидронафтил или адамантил, в которых Q представляет тиенил, фенил, фуранил, нафтил,пиридил, индолил, индазолил, циклогексил, 1,2 метилендиоксифенил,циклогексенил,1 Нпиразоло[4,3-с]пиридил и Q, возможно, замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкокси, гидрокси, трифторметила, S(O)2NH2 или циано, и у равно 1 или 2; R4 означает Н илиC1-6 алкил; или R3 и R4 вместе с атомом азота, к которому R3 и R4 присоединены, образуют 4,5,6,7-тетрагидротиено[3,2-с]пиридинил, 1,4 диокса-8-азаспиро[4,5]деканил,пиперазинил,морфолинил, пиперидинил, пирролидинил, азепанил, азоканил, 1,2,3,4-тетрагидроизохинолинил, 1,2,3,4-тетрагидро-1 Н-бета-карболинил или 8-азабицикло[3,2,1]октанил, каждый из которых может быть моно- или независимо дизамещенным галогеном, C1-6 алкилом, C1-6 алкокси,С(О)фенилом, ОН, CN, O-фенилом или (СН 2)mZ,Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил,1,2-метилендиоксифенил или фенил, и Z,СН(ОН)фенил или O-фенил, возможно, замещены одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила, C1-6 алкокси, гидрокси, трифторметила, S(O)2NH2 или циано; m равно 0 или 1. Схема I(b)(CH2)yQ, СН 2 СН(ОН)Q, СН(СН 3)Q, инданил,1,2,3,4-тетрагидронафтил или адамантил, в которых Q представляет тиенил, фенил, фуранил,нафтил, пиридил, индолил, индазолил, циклогексил, 1,2-метилендиоксифенил, циклогексенил, 1H-пиразоло[4,3-с]пиридил и Q, возможно,замещен одним или двумя заместителями, независимо выбранными из галогена, C1-6 алкила,C1-6 алкокси,гидрокси,трифторметила,S(O)2NH2 или циано, и у равно 1 или 2: R4 означает Н или C1-6 алкил; или R3 и R4 вместе с атомом азота, к которому R3 и R4 присоединены,образуют 4,5,6,7-тетрагидротиено[3,2-с]пиридинил, 1,4-диокса-8-азаспиро[4.5]деканил, пиперазинил, морфолинил, пиперидинил, пирролидинил, азепанил, азоканил, 1,2,3,4-тетрагидроизохинолинил,1,2,3,4-тетрагидро-1 Н-бетакарболинил или 8-азабицикло[3,2,1]октанил,каждый из которых может быть моно- или независимо дизамещенным галогеном, C1-6 алкилом,C1-6 алкокси, С(О)фенилом, ОН, CN, O-фенилом или (CH2)mZ, Z означает бензизоксазолил, индазолил, бензизотиазолил, бензтиенил, пиримидинил, пиридил, 1,2-метилендиоксифенил или фенил, и Z, СН(ОН)фенил, фенил или O-фенил,возможно, замещены одним или двумя заместителями, независимо выбранными из галогена,C1-6 алкила, C1-6 алкокси, гидрокси, трифторметила, S(O)2NH2 или циано; m равно 0 или 1. Схема II По схеме I, на стадии А, анион соответственно замещенного тиофена структуры 2 может быть ацилирован подходящим замещенным га 004177 20 логенангидридом структуры 3, чтобы получить соответствующий кетон структуры 4. Например, соответствующий замещенный тиофен структуры 2 может быть металлирован при 5 С, используя, например, фениллитий или литийдиизопропиламид, для образования аниона. Анион можно ацилировать посредством реакции с подходящим галогенангидридом структуры 3. Например, соответствующий галогенангидрид в подходящем апротонном растворителе,таком как тетрагидрофуран, охлаждали до-70 С. Затем литиевое промежуточное соединение можно по каплям добавлять к хлорангидриду кислоты в течение от 1 до 3 ч. Полученный кетон структуры 4 можно выделить из реакционной смеси посредством экстракции, известной в данной области. Очистку кетона структуры 4 можно осуществить с помощью хроматографии на колонке с оксидом алюминия, элюируя подходящим растворителем, таким как гексан, или смесью растворителей, таких как смесь простого эфира и гексана. Дальнейшую очистку можно произвести посредством ваккумной перегонки и/или перекристаллизации. На стадии В соответствующий кетон структуры 4 и гидрохлорид гидроксиламина вводили в реакцию, чтобы получить соответствующий оксим структуры 5. Например, соответствующий кетон структуры 4 и гидрохлорид гидроксиламина могут вступать в реакцию с подходящим апротонным растворителем, таким как пиридин. Данный растворитель также может действовать в реакции как основание. Обычно реагирующие вещества перемешивали вместе при комнатной температуре в течение ночи с последующим нагреванием при температуре приблизительно 100 С-105 С в течение от 1 до 4 ч. Полученный оксим структуры 5 можно выделить из реакционной смеси посредством экстракции, известной в данной области. Затем неочищенный оксим структуры 5 может быть очищен перекристаллизацией. На стадии С оксим структуры 5 циклизовали подходящими реагентами, чтобы получить соответствующий фенилизоксазол структуры 6. Например, оксим структуры 5 можно обработать подходящим основанием, таким как гидрооксид калия, катализатором, таким как хлорид меди, и протонным растворителем, таким как 2-этоксиэтанол. Обычно реагирующие вещества перемешивали и нагревали вместе при температуре приблизительно 105-110 С в атмосфере азота в течение от 2 до 6 ч. Полученный изоксазол структуры 6 можно выделить из реакционной смеси посредством экстракции, известной в данной области. Затем неочищенный фенилизоксазол структуры 6 можно очистить хроматографией. На стадии D соединение фенилизоксазола структуры 6 деалкилировали подходящими реа 21 гентами, чтобы получить соответствующее соединение фенилизоксазола структуры 7. Например, фенилизоксазол структуры 6 можно обрабатывать подходящим деалкилирующим реагентом, таким как трибромид бора. Другие альтернативные реагенты включают в себя гидрохлорид пиридина или трихлорид бора. Обычно реагирующие вещества перемешивали и нагревали вместе при температуре приблизительно 135-140 С в атмосфере азота в течение от 4 до 9 ч. Полученный фенилизоксазол структуры 7 можно выделять из реакционной смеси посредством экстракции, известной в данной области. Затем неочищенный фенилизоксазол структуры 7 можно очистить хроматографией. На стадии Е соответствующий фенилизоксазол структуры 7 и подходящий алкилгалогенид структуры 8 вводили в реакцию, чтобы получить соответствующий галогеналкоксифенилизоксазол структуры 9. Например, соответствующий фенилизоксазол структуры 7 и подходящий алкилгалогенид структуры 8 могут вступать в реакцию в присутствии карбоната калия. Обычно реагирующие вещества перемешивали при кипячении с обратным холодильником в атмосфере азота в течение от 5 ч до периода времени в течение ночи. Полученный галогеналкоксифенилизоксазол структуры 9 может быть выделен из реакционной смеси посредством экстракции, известной в данной области. Затем неочищенный галогеналкоксифенилизоксазол структуры 9 можно очистить хроматографией. На стадии F соответствующий галогеналкоксифенилизоксазол структуры 9 и подходящий амин структуры 10 вводили в реакцию,чтобы получить соответствующий аминоалкоксифенилизоксазол структуры 1. Например, соответствующий галогеналкоксифенилизоксазол структуры 9 и подходящий амин структуры 10 могут вступать в реакцию в присутствии карбоната калия в подходящем безводном, апротонном растворителе, таком как ацетонитрил. Обычно реагирующие вещества перемешивали и нагревали вместе при температуре приблизительно от 65 до 80 С в атмосфере азота в течение от 16,5 до 30 ч. Полученный аминоалкоксифенилизоксазол структуры 1 может быть выделен из реакционной смеси посредством экстракции, известной в данной области и являются обычными, полученный аминоалкоксифенилизоксазол структуры 1 выделяли, удаляя растворитель, посредством непосредственного нанесения на колонку с силикагелем и элюцирования подходящим растворителем или смесью растворителей. Далее неочищенный аминоалкоксифенилизоксазол структуры 1 можно очистить хроматографией,образованием соли или перекристаллизацией. На стадии G соответствующий фенилизоксазол структуры 7 и пирролидин структуры 11 22 вводили в реакцию, чтобы получить соответствующий пирролидинилоксифенилизоксазол структуры 12. Например, соответствующий фенилизоксазол структуры 7 и пирролидин структуры 11 могут вступать в реакцию в присутствии трифенилфосфина и диэтилазокарбоксилата в подходящем безводном апротонном растворителе,таком как тетрагидрофуран. Обычно реагирующие вещества перемешивали при комнатной температуре в атмосфере азота в течение от 4 ч до периода времени в течение ночи. Полученный пирролидинилоксифенилизоксазол структуры 12 можно извлечь из реакционной смеси посредством экстракции, известной в данной области. Затем неочищенный пирролидинилоксифенилизоксазол структуры 12 может быть очищен хроматографией. Альтернативно по схеме I(а), на стадии Н соответствующий алкилгалогенид структуры 8 и подходящий амин структуры 2 вводили в реакцию для образования галогеналкиламина структуры 9. Например, соответствующий алкилгалогенид структуры 8 и подходящий амин структуры 2 могут вступать в реакцию в присутствии основания, выбранного специалистом в данной области, такого как плавленый ацетат натрия. Обычно реагирующие вещества перемешивали и нагревали с обратным холодильником в течение нескольких часов. Полученный галогеналкиламин структуры 9 извлекали из реакционной смеси посредством экстракции, известной в данной области. Затем неочищенный галогеналкиламин структуры 9 может быть очищен перегонкой, хроматографией или также экстракцией,известными в данной области. На стадии I, соответствующий галогеналкиламин структуры 9 и подходящий фенилизоксазол структуры 10 вводили в реакцию, чтобы получить соответствующий аминоалкоксифенилизоксазол структуры 1. Например, подходящий фенилизоксазол структуры 10 можно вводить в реакцию в присутствии гидрооксида натрия в подходящем апротонном растворителе, таком как дихлорметан, для образования соответствующей натриевой соли фенилизоксазола структуры 10. Затем соответствующую натриевую соль структуры 10 смешивали с подходящим галогеналкиламином структуры 9 в подходящем апротонном растворителе, таком как толуол. Обычно реагирующие вещества перемешивали и нагревали с обратным холодильником в течение приблизительно 24 ч. Затем реакционную смесь можно охладить и профильтровать, чтобы выделить аминоалкоксифенилизоксазол структуры 1. Затем неочищенный аминоалкоксифенилизоксазол структуры 1 может быть очищен хроматографией, перекристаллизацией или образованием соли. На стадии J соответствующий амин структуры 2 можно ввести в реакцию с подходящим 23 соединением структуры 3, чтобы получить соответствующее соединение структуры 5, в условиях аналогичных условиям, которые приведены на схеме II, стадии Е. На стадии К как альтернатива стадии J соответствующее соединение структуры 4 и подходящий амин структуры 2 вводили в реакцию,чтобы получить соответствующее соединение структуры 5. Например, соответствующее соединение структуры 4 может быть связано с соответствующим амином структуры 2 в присутствии подходящего связывающего агента, такого как 1,3-дициклогексилкарбодиимид, и подходящего апротонного, безводного растворителя, такого как дихлорметан. Подходящее основание, такое как 1-гидроксибензотиазол гидрат, может оказаться необходимым при применении определенных связывающих реагентов. Обычно реагирующие вещества перемешивали в течение приблизительно 2,0 ч при температуре от -35 до-30 С. Неочищенное соединение структуры 5 может быть выделено способами, известными специалистам в данной области. На стадии L соответствующее соединение структуры 5 может вступать в реакцию с соответствующим фенилизоксазолом структуры 6 с образованием соответствующего соединения структуры 7 в условиях, аналогичных условиям,приведенным на схеме II, стадии F. На стадии М соответствующее соединение структуры 7 может быть восстановлено подходящим восстанавливающим агентом, таким как комплекс боран-тетрагидрофуран или комплекс боран-диметилсульфид, чтобы получить соответствующий алкоксифенилизоксазол структуры 1 в условиях, аналогичных условиям, приведенным на схеме II, стадии G. В качестве второй альтернативы на схемеI(b), стадии N подходящий амин структуры 2 и подходящий галогеноспирт структуры 3 вводили в реакцию, чтобы получить соответствующий гидроксиалкиламин структуры 4. Например, подходящий амин структуры 2 может вступать в реакцию в присутствии воды в подходящем протонном растворителе, таком как 2-хлорэтанол. Обычно реагирующие вещества перемешивали и нагревали вместе в течение 5 ч. Обычно смесь охлаждали, а затем добавляли гидрооксид натрия с последующим дополнительным нагреванием в течение 30 мин. Полученный гидроксиалкиламин структуры 4 может быть выделен из реакционной смеси экстракцией, известной в данной области. Воду можно удалить, а гидроксиалкиламин структуры 4 можно очистить при перегонке или хроматографией. На стадии O соединение гидроксиалкиламина структуры 4 и подходящий галогенид сложного сульфонатного эфира структуры 5 вводили в реакцию, чтобы получить соответствующий сложный сульфонатный эфир алкил 004177 24 амина структуры 6. В случае, когда R4=H, может требоваться защитная группа на амине. Для соответствующих защитных групп см. ProtectiveGreene, et al. John Wiley and Sons, Inc., включенную в описание в качестве ссылки. Например, соответствующий гидроксиалкиламин структуры 4 и соответствующий галогенид сложного сульфонатного эфира структуры 5 могут вступать в реакцию в присутствии триэтиламина в подходящем апротонном растворителе, таком как дихлорметан. Обычно реагирующие вещества перемешивали при комнатной температуре. Полученный сложный сульфонатный эфир алкиламина структуры 6 может быть выделен из реакционной смеси экстракцией, известной в данной области. Затем неочищенный сульфонатный эфир алкиламина структуры 6 можно очистить хроматографией. На стадии Р соответствующий сложный сульфонатный эфир алкиламина структуры 6 и соответствующий фенилизоксазол структуры 7 вводили в реакцию, чтобы получить соответствующий аминоалкоксифенилизоксазол структуры 1. Например, соответствующий сложный сульфонатный эфир алкиламина структуры 6 и соответствующий фенилизоксазол структуры 7 могут вступать в реакцию в присутствии карбоната калия в подходящем апротонном растворителе, таком как ацетонитрил. Обычно реагирующие вещества перемешивали и нагревали вместе при 75 С в течение ночи. Полученный аминоалкоксифенилизоксазол структуры 1 может быть выделен из реакционной смеси экстракцией, известной в данной области. Неочищенный аминоалкоксифенилизоксазол структуры 1 может быть очищен хроматографией, образованием соли или перекристаллизацией. Исходные вещества, используемые в общих способах синтеза, описанных в схемах I,I(а), I(b) II, могут быть легко получены специалистами в данной области, если не отмечено особо в разделе примеров. Профиль связывания D4 данными соединениями свидетельствует об их эффективности в качестве фармацевтических препаратов, которые могут применяться как нейролептики для лечения различных состояний, в которые вовлечена стимуляция рецептора D4, как, например,для лечения страхов и шизофрении. Соответственно, в других аспектах, данное изобретение относится к фармацевтическим композициям для лечения связанных с D4 патологических состояний, содержащих соединение формулы I в количестве, эффективном, чтобы противодействовать стимуляции рецептора D4, вместе с фармацевтически приемлемым носителем. В следующих аспектах, изобретение относится к способу лечения патологических состояний, для которых показан антагонист D4, который включает в себя стадию введения пациенту соедине 25 ния формулы II в количестве, эффективном для противодействия стимуляции рецептора D4, и его фармацевтически приемлемого носителя. Для применения в медицине, соединения данного изобретения можно вводить в стандартной фармацевтической композиции. Поэтому, в следующих аспектах данного изобретения обеспечивают фармацевтическими композициями, содержащими фармацевтически подходящий носитель и соединение формулы I или его фармацевтически приемлемую соль, сольват или гидрат в количестве, эффективном, чтобы противодействовать стимуляции рецептора D4. При лечении пациента, пораженного описанным выше состоянием, соединение формулы(I) можно вводить в любой форме или способом,который сделает соединение биодоступным в терапевтически эффективных количествах,включая перорально, сублингвально, трансбуккально, подкожно, внутримышечно, внутривенно, трансдермально, интраназально, ректально,местно и тому подобное. Специалисты в области приготовления композиций могут установить надлежащую форму и способ введения в зависимости от особых характеристик соединения,выбранного для состояния или заболевания,которое следует лечить, стадии заболевания,состояния пациента и других относящихся к делу обстоятельств. Для примера см. Remingtons Pharmaceutical Sciences, 18th Edition, MackPublishing Co. (1990), включенное в описание в качестве ссылки. Соединения формулы I можно вводить одни или в форме фармацевтической композиции в комбинации с фармацевтически подходящими носителями, соотношения и природа которых определяются растворимостью и химическими свойствами выбранного соединения, выбором способа введения, стандартной фармацевтической практикой и другими относящимися к делу критериями. Соединения данного изобретения можно вводить перорально, например, в форме таблеток, пастилок, капсул, эликсиров, суспензий,растворов, сиропов, облаток, жевательных резинок и тому подобного и могут содержать один или более из следующих адъювантов: связующие вещества, такие как микрокристаллическая целлюлоза, трагакантовая камедь или желантин; наполнители, такие как крахмал или лактоза,диспергаторы, такие как альгиновая кислота,примогель, кукурузный крахмал и тому подобное; смазки, такие как стеарат магния или стеротекс; вещества, обеспечивающие скольжение,такие как коллоидный диоксид кремния; и могут быть добавлены подсластители, такие как сахароза и сахарин и ароматическое вещество,такое как мята перечная, метилсалицилат или апельсиновый аромат. Если дозированной стандартной формой является капсула, она может содержать помимо веществ вышеприведенного типа, жидкий носитель, такой как полиэтилен 004177 26 гликоль или жирные масла. Другие стандартные дозированные формы могут содержать другие различные вещества, которые модифицируют физическую форму дозированной единицы, например, покрытия. Таким образом, таблетки или пилюли могут быть покрыты сахаром, шеллаком или другими энтеросолюбильными покрывающими веществами. Помимо данных соединений, сироп может содержать сахарозу в качестве подсластителя, и определенные консерванты, красители, окрашивающие и вкусовые вещества. Соединения формулы (I) данного изобретения также можно наносить местно, и в таком случае носитель может соответственно включать в себя раствор, мазевую или гелевую основу. Основа, например, может включать в себя вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. Растворы и суспензии также могут включать в себя один или более следующих адъювантов: стерильные разбавители, такие как вода для инъекций, физиологический раствор, плавленные масла, полиэтиленгликоли, глицерин,пропиленгликоль или другие синтетические растворители; противобактериальные вещества,такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие вещества,такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и вещества для регулирования тонуса, такие как хлорид натрия или декстроза. Парентеральные препараты могут быть заключены в ампулы, шприцы одноразового применения или в ампулы с многократной дозой. Диапазон доз, в котором соединения формулы I проявляют свою способность действовать терапевтически, может варьироваться в зависимости от отдельного заболевания или состояния, требующих лечения, и их тяжести,пациента, композиции, других основных патологических состояний, которыми страдает пациент, и других лекарственных средств, которые сопутственно вводят пациенту. Вообще,соединения формулы I будут проявлять их терапевтическую активность в дозах приблизительно от 0,001 до 100 мг/кг массы пациента/день. Примеры Следующие примеры представляют типичные синтезы, которые описаны в схемах I,I(a), I(b) и II. Эти примеры предназначены только для иллюстрирования и не ограничивают объем данного изобретения. Используемые в описании следующие термины имеют указанные значения: г означает граммы; ммоль означает миллимоли; мл означает миллилитры; С означает градусы Цельсия; TLC относится к тонкослойной хроматографии (ТСХ);"LC/MS" относится к жидкостной хроматогра 27 фии - масс-спектрометрии; "APCI" относится к химической ионизации при атмосферном давлении; "mp" относится к точке плавления; "ppm" относится к частям на миллион; "TMS" относится к тетраметилсилану; "GC/MS" относится к газовой хроматографии/масс-спектрометрии;XL-300 при 300 МГц 1H и 75 МГц для 13 С. Все химические сдвиги представлены в частях на миллион относительно TMS-стандарта. GC/MS выполняли, используя модель Hewlett Packard 5972 при следующих параметрах: колонка HP 5MS 30 м, внутренний диаметр 0,25 мм, толщина слоя 0,25 мкм; скорость нагревания - 50 С в течение 1 мин, затем 20 С/мин вплоть до 300 С; температура ввода 250 С; температура определения 280 С. Масс-спектр получали на спектрометре Finnigan Mat TSQ 700. Микроанализ осуществляли на Robertson Microlit, Madison,NJ. Для стадий С, Е, F, G и Н: спектр ЯМР регистрировали, используя спектрометр Gemini 300. Спектр ИК регистрировали на Mattson Galaxy 500 FTIR. Масс-спектр определяли на спектрометре Finnigan МАТ 4600. Элементный анализ выполняли на Robertson Microlit, Inc., Madison, NJ. Стадия А. Получение (3-бромтиофен-2-ил)-(3-метоксифенил)метанона (схема II, соединение 4). 3-Бромтиофен (1,5 кг, 9,2 моль) и дихлорметан (10 л) смешивали в 22-литровой, 3 горловой колбе, снабженной мешалкой, термометром, капельной воронкой и непрерывной подачей азота. Перемешиваемую смесь охлаждали (-5 С) при непрерывном продувании азота и добавлении по каплям хлорида титана (IV)(3,0 кг, 15,8 моль) в течение 30 мин. Температура в конце добавления составляла -5 С. Для охлаждения (0 С) раствора добавляли раствор манизоилхлорида (1,73 кг, 10,1 моль) в дихлорметане (2,5 л) в течение 60 мин. Ход реакции контролировали посредством GC/MS (время удерживания: 2=2,2 мин, 3=5,1 мин, 4=21,4 мин). Идентичная реакция проходила в то же самое 28 время в отдельном устройстве. Через 20 ч реакционные смеси переносили в 30-галонный(hastelloy) реактор, содержащий перемешиваемую, охлаждаемую льдом воду (40 кг). Перемешивали в течение 30 мин, фазы разделяли и нижнюю органическую фазу промывали 10% раствором гидроокиси натрия (20 л). Основную(рН 10), водную фазу экстрагировали дихлорметаном (6 л), органические экстракты объединяли, высушивали (МgSO4, 1 кг), фильтровали и фильтрационный осадок промывали дихлорметаном (5 л). Объединенные фильтраты концентрировали (35 С/100 торр), чтобы получить неочищенное соединение в виде масла (6,25 кг). В 22-литровой колбе, неочищенное соединение разбавляли трет-бутилметиловым эфиром (6 л). В раствор вносили затравку и оставляли стоять при 5 С в течение 64 ч. После образования кристаллов продукта, фильтровали и промывали холодным (5 С) трет-бутилметиловым эфиром(2 л) и высушивали (25 С), чтобы получить конечный требуемый продукт 4 (3,785 кг, выход 69%). 1 Гидрохлорид гидроксиламина (1,77 кг,25,5 моль), 4 (3,785 кг, 12,6 моль) и пиридин (12 л) смешивали в 22-литровой, 3-горловой колбе,снабженной мешалкой, термометром, нагревающей сеткой и непрерывной подачей азота. Смесь смешивали и нагревали, поддерживая температуру при 80 С. Ход реакции контролировали, используя GC/MS (время удерживания: 5=16,4 мин, 4=21,4 мин). Реакция должна завершиться через 7 ч. Перемешиваемую смесь охлаждали до температуры окружающей среды в течение ночи. Реакционную смесь разбавляли дихлорметаном (20 л) и промывали 3N НСl (220 л) (рН второй промывки был кислым). Органическую фазу промывали водой (310 л) (рН второй промывки был нейтральным) высушивали (1 кг MgSO4), фильтровали и фильтрационный осадок промывали дихлорметаном (6 л). Фильтрат упаривали (35 С/100 торр), чтобы получить неочищенное соединение (4,9 кг). Неочищенное соединение растворяли в горячем(80 С) толуоле (4 л). Перемешиваемый раствор медленно охлаждали до температуры окружающей среды, а затем поддерживали при 5 С в течение 16 ч. Продукт отфильтровывали, про 29 мывали холодным (5 С) толуолом (2 л) и высушивали на воздухе, чтобы получить конечное,требуемое соединение 5 (3,45 кг, выход 87%). 1 5 (50 г, 0,16 моль), карбонат калия (33 г,0,24 моль) и иодид меди (2,0 г, 0,011 моль) в изопропиловом спирте (0,5 л) смешивали и нагревали с обратным холодильником в течение 2,5 ч. Анализ GC/MS аликвоты, внесенной в воду и экстрагированной этилацетатом, показал полное превращение. Смесь охлаждали (40 С) и добавляли воду (4 л), содержащую гидроокись аммония (0,1 л). Через 0,5 ч твердое вещество собирали и промывали водой (2 л). Твердое вещество высушивали на воздухе и собирали соединение в виде желтовато-коричневого твердого вещества (35,9 г). Твердое вещество растворяли (оставалось некоторое количество не растворенного) в этилацетате (0,3 л) и обрабатывали активированным углем. Смесь фильтровали через целит и концентрировали, чтобы получить конечное требуемое соединение 6 (32,9 г, выход 89%). Стадия D. Получение 3-тиено[2,3-d]изоксазол-3-илфенола (схема II, соединение 7). Раствор 6 (139,4 г, 0,6 моль) в дихлорметане (3,15 л) перемешивали в 12-литровой, 3 горловой колбе, снабженной мешалкой, термометром, капельной воронкой и непрерывной подачей азота. Раствор охлаждали и температуру поддерживали от -12 до -5 С, пока добавляли трибромид бора (450 г, 1,8 моль) в течение периода времени 36 мин. Реакционную смесь перемешивали при -5 С в течение 12 мин, а затем удаляли охлаждающую баню и перемешивали при температуре окружающей среды. Реакцию контролировали, используя тонкослойную хроматографию (силикагель фирмы Merck, дихлорметан, Rf 6=0,71; Rf 7=0,19). Реакция завершалась через 15 ч (температура куба = 15,4 С). Перемешиваемую смесь охлаждали до-10 С и такую температуру сохраняли при добавлении метанола (835 мл, 20,7 моль) в течение 15 мин. Смесь перемешивали в течение дополнительных 15 мин и добавляли 25% гидроокись натрия (715 г) в течение 50 мин при сохранении температуры от -10 до 0 С. В конце добавления 30 рН составлял 7,25. Метанол и дихлорметан удаляли при 30 С/7 торр, что приводило к желтовато-коричневому твердому веществу, суспендированному в водной фазе. Твердое вещество отфильтровывали, промывали водой и высушивали (35 С/7 торр), чтобы получить конечное,требуемое соединение 7 (129,1 г, выход 99%). 1 Амин 8 (5,0 г, 40 ммоль) в толуоле (50 мл) смешивали с карбонатом калия (7,0 г) в воде (25 мл). 2-Хлорацетилхлорид (9) (5,0 г, 44 ммоль) добавляли через шприц в течение 5 мин. Через 1 ч GC/MS показала полное превращение в органическую фазу. Органическую фазу промывали водой (20 мл), высушивали (МgSO4) и концентрировали до масла. Добавляли немного затравочных кристаллов, чтобы индуцировать полную кристаллизацию и собирали конечное требуемое соединение 10 (7,8 г, 97%). Точка плавления 53-55 С. 1 7 (16 г, 74 ммоль), 10 (15,5 г, 77 ммоль),карбонат калия (20,3 г, 147 ммоль) и иодид натрия (2,3 г, 15,3 ммоль) в ацетоне (300 мл) смешивали и нагревали с обратным холодильником в течение 22 ч. GC/MS показала полное превращение. Реакционную смесь вливали в смесь этилацетата (1 л), гептана (0,2 л) и воды (1 л). Слои разделяли и органическую фазу промывали насыщенным солевым раствором (0,5 л), высушивали (MgSO4) и концентрировали. Твердое вещество растворяли в горячем толуоле (200 мл) и оставляли стоять на всю ночь. Твердое вещество собирали и высушивали на воздухе, чтобы получить конечное требуемое соединение 11(M+H) (100), 285 (7), 207 (10), 109 (9). Аналитический расчет для C20H15N2O3FS: С, 62,82; Н, 3,95; N, 7,33. Обнаружено; С, 62,70; Н, 3,76; N, 7,21. Стадии G и Н. Получение малеата (3-фторбензил)-[2-(3 тиено[2,3-d]изоксазол-3-илфенокси)этил]амина К раствору 11 (4,0 г, 10,5 ммоль) в THF (20 мл) добавляли комплекс 10 М боранметилсульфид в тетрагидрофуране (3,2 мл, 32 ммоль) и нагревали (60 С) в течение 2 ч. ВЭЖХ-анализ показал смесь 2:1 комплекса борана структуры 1 и свободного амина структуры 1. Раствор охлаждали (25 С) и добавляли метанол (6 мл) в течение 10 мин, что приводило к экзотермии до 48 С. Добавляли диэтилентриамин (4 мл) и нагревали (60 С) в течение 1 ч. Анализ ВЭЖХ продемонстрировал полное превращение до свободного амина. Смесь охлаждали (45 С), концентрировали (40 С/20 торр) и добавляли тетрагидрофуран (15 мл), метанол (10 мл) и гидроокись натрия (3 М раствор, 10 мл). Перемешивали в течение 1 ч и концентрировали. К остатку добавляли этилацетат (50 мл), гептан (10 мл) и насыщенный солевой раствор (15 мл). Органическую фазу отделяли и добавляли силикагель (8 г). Через 1 ч смесь фильтровали и силикагель промывали этилацетатом (200 мл). Фильтрат концентрировали, чтобы получить неочищенный продукт 1 (3,05 г, выход 79%,чистота по ВЭЖХ 95%). Неочищенный продукт 1 растворяли в горячем изопропиловом спирте(10 мл), добавляли малеиновую кислоту (1,0 г,8,6 ммоль) в изопропиловом спирте (10 мл) и охлаждали. Предпочтительные солевые формы также включают в себя мезилат (из метансульфоновой кислоты в тетрагидрофуране) и соль хлористо-водородной кислоты (из хлористоводородной кислоты в ацетонитриле). Через 2 ч твердое вещество собирали и высушивали в вакуумной печи (60 С/10 торр) в течение 4 ч, чтобы получить конечное, требуемое соединение 1 а(3,39 г, выход 67%, чистота по ВЭЖХ 97,9%). Точка плавления 144-145 С; 1 Н ЯМР (d6-DMSO)8.20 (д, 1, J = 5 Hz). 7.63-7.20 (м, 9), 6.02 (с, 2), 4.37 (м, 2), 4.29 (с, 2),3.40 (м, 2); 19 3-Фторбензиламин (5,0 г, 0,0400 моль),плавленный ацетат натрия (3,28 г, 0,0400 моль) и 1,2-дибромэтан (7,51 г, 0,0400 моль) смешивали и кипятили с обратным холодильником в течение нескольких часов. Смесь вливали в воду и добавляли карбонат натрия для создания основного рН. Непрореагировавший 1,2 дибромэтан удаляли перегонкой. Оставшийся остаток экстрагировали простым эфиром и упаривали, чтобы получить конечное, требуемое соединение. Соединение может образовывать соль хлористо-водородной кислоты. Стадия I. Получение Дихлорметан добавляли к 3-тиено[2,3-d] изоксазол-3-илфенолу (10 г, 0,046 моль) или соответственно замещенному 3-тиено[2,3-d] изоксазол-3-илфенолу, известному в данной области, и перемешивали с гидроокисью натрия(1 М; 28 мл) для образования натриевой соли. Смешивали натриевую соль 3-тиено[2,3-d] изоксазол-3-илфенола,(2-бромэтил)-(3-фторбензил)амин (37,5 г, 0,161 моль) в толуоле (100 мл) и нагревали (с обратным холодильником) в течение 24 ч. Реакционную смесь оставляли для охлаждения, фильтровали и выпаривали растворитель, чтобы получить конечное, требуемое соединение. Соединение может быть очищено перегонкой при пониженном давлении. Пример 1(В). Альтернативное получение (3 фторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амина (схема 1(b), соединение 1). Смешивали 3-фторбензиламин (31,1 г,0,248 моль), 2-хлорэтанол (10 г, 0,124 моль) и воду (30 г, 1,66 моль) и нагревали на паровой бане в течение 5 ч. Добавляли гидроокись натрия (15 г, 0,373 моль) для охлаждения раствора и полученную смесь нагревали на паровой бане в течение 30 мин. Для растворения неорганических солей добавляли воду (50 мл) и двухфазную смесь дважды экстрагировали 25 мл и 13 мл порциями бензола. Экстракты объединяли и воду удаляли соперегонкой с бензолом через модифицированную колбу Кляйзена. Конечное,требуемое соединение можно очистить дальнейшей перегонкой. Стадия О. Получение 2-[трет-бутоксикарбонил-(3 фторбензил)амино]этилового эфира толуол-4 сульфоновой кислоты (схема I(b), соединение 6). п-Толуолсульфонилхлорид (0,71 г, 3,71 ммоль) порциями добавляли к смеси диметилэтилового эфира (3-фторбензил)-(2-гидроксиэтил)карбаминовой кислоты (1 г, 3,71 ммоль),полученного из 2-(3-фторбензиламино)этанола посредством способов, известных в данной области, триэтиламина (0,751 г, 7,4 ммоль) и дихлорметана (6 мл). Полученную суспензию энергично перемешивали в течение ночи при комнатной температуре. Добавляли воду (10 мл), органический слой отделяли, а водный слой дважды экстрагировали дихлорметаном (5 мл). Органические слои объединяли и промывали лимонной кислотой (5 мл, 20% в воде), высушивали над сульфатом натрия и растворитель упаривали, чтобы получить конечное, требуемое соединение. Конечное соединение может быть очищено хроматографией. Стадия Р. Получение (3-фторбензил)-[2-(3-тиено[2,3d]изоксазол-3-илфенокси)этил]амина Указанное в заголовке соединение получали из смеси 2-[трет-бутоксикарбонил-(3-фторбензил)амино]этилового эфира толуол-4-суль 004177 34 фоновой кислоты и 3-тиено[2,3-d]изоксазол-3 илфенола по существу так, как описано в примере 3, схема I, стадия F. Специалистам в данной области ясно, что у азота может быть снята защита в результате кислотного гидролиза, чтобы получить конечное, требуемое соединение. Пример 2. Получение 3-тиено[2,3-d] изоксазол-3-илфенола (схема I, соединение 7). Стадия А. Получение (3-бромтиофен-2-ил)-(3-метоксифенил)метанона (схема I, соединение 4). Фениллитий (210 мл,0,44 моль) по каплям добавляли к охлажденной смеси (5 С) 3 бромтиофена (66 г, 0,40 моль) и эфира (400 мл) в течение 2 ч для образования литиевого промежуточного соединения тиофена. Смесь литиевого промежуточного соединения тиофена добавляли к охлажденной (-70 С) смеси TNF и м-метоксибензоилхлорида в течение 3 ч, затем реакционную смесь гасили водой и экстрагировали простым эфиром. Эфир промывали 10%NaOH и водой, высушивали (МgSO4), фильтровали и упаривали, чтобы получить масло. Масло очищали посредством хроматографии на колонке (оксид алюминия), элюируя гексаном вплоть до 50% эфира в гексане. Продукт перегоняли в вакууме и перекристаллизовывали (простой эфир:гексан), чтобы получить указанное в заголовке соединение (89,1 г, выход 75%), точка плавления 40 С. Стадия В. Получение оксима (3-бромтиофен-2-ил)(3-метоксифенил)метанона (схема I, соединение 5).(40 мл) перемешивали в течение ночи при комнатной температуре, а затем смесь нагревали(100-105 С) в течение 4 ч. TLC (DCM) показала,что реакция завершена. Реакционную смесь гасили водой и экстрагировали простым эфиром(3 раза). Эфирную фазу промывали НСl (3N) и водой, высушивали (MgSO4), фильтровали и концентрировали, чтобы получить масло, которое затвердевало. Твердое вещество перекристаллизовывали из смеси простой эфир:гексан,чтобы получить указанное в заголовке соединение (6,4 г, выход 87%), точка плавления 102103 С.(3,6 г, 0,064 моль, растворенного в 10 мл воды) и 2-этоксиэтанола (40 мл) кипятили с обратным холодильником в атмосфере азота в течение 1 ч при 105-110 С. Добавляли хлорид меди (0,16 г,0,0016 моль), после чего реакционная смесь становилась темно-коричневого цвета. Реакционную смесь нагревали в течение дополнительных 4 ч. TLC показала, что реакция закончена. Добавляли воду и органическую порцию экстрагировали в эфир. Эфирную фазу промывали водой, высушивали (MgSO4), фильтровали и концентрировали до получения масла. Масло очищали хроматографией на колонке (оксид алюминия) и элюировали 15% эфиром в гексане,чтобы получить белые кристаллы. Кристаллы перекристаллизовывали из смеси простой эфир:гексан для получения указанного в заголовке соединения (5 г, выход 68%), точка плавления 51-52 С. Стадия D. Получение 3-тиено[2,3-d]изоксазол-3-илфенола (схема I, соединение 7). Объединяли и перемешивали в атмосфере азота при 140 С смесь 3-(3-метоксифенил) тиено[2,3-d]изоксазола (8 г, 0,035 моль) и гидрохлорида пиридина (80 г, 0,69 моль) в течение 9 ч. TLC (этилацетат:дихлорметан) показала,что реакция закончена. Реакционную смесь охлаждали до комнатной температуры и вливали в воду. Органическую фазу экстрагировали в смесь этилацетат:эфир (50:50) и один раз промывали НСl (3N), высушивали (МgSO4) и упаривали, чтобы получить масло. Масло очищали хроматографией на колонке (силикагель), элюируя 5% этилацетатом в дихлорметане для получения твердого вещества. Твердое вещество перекристаллизовывали (простой эфир:гексан),чтобы получить указанное в заголовке соединение в виде оранжевого/желтовато-коричневого твердого вещества (3 г, выход 40%), точка плавления 114-116 С. Пример 3. Получение (R)-(-)-3-[3-(1 бензилпирролидин-3-илокси)фенил]тиено[2,3-d] изоксазола гидрохлорида и (3-фторбензил)-[2(3-тиено[2,3-d]изоксазол-3-илфенокси)этил] амина гидрохлорида. 3-Тиено[2,3-d]изоксазола-3-илфенол (8,5 г,39,1 ммоль), карбонат калия (10,8 г, 78,1 ммоль) и 1,2-дибромэтан (65 мл, 754 ммоль) смешивали и нагревали с обратным холодильником в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры в течение ночи. TLC(50% этилацетат в гептане) показала, что осталось еще некоторое количество исходного вещества. Реакционную смесь кипятили с обратным холодильником в течение дополнительных 3 ч. 1,2-Дибромэтан удаляли вакуумной перегонкой (45 С). Реакционную смесь разбавляли водой (300 мл) и экстрагировали этилацетатом(2 х 150 мл). Объединенные экстракты промывали водой (150 мл), насыщенным хлоридом натрия (150 мл), высушивали (MgSO4) и концентрировали (в вакууме), чтобы получить соединение 12 в виде черного остатка. Черный остаток очищали хроматографией на колонке(силикагель) (30% этилацетат в гептане). Соответствующие фракции объединяли, чтобы получить янтарное масло, которое затвердевало,чтобы предоставить указанное в заголовке соединение в виде желтовато-коричневого твердого вещества (8,52 г, выход 67%). Схема I - стадия Е. Получение 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола и 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола (схема I, соединение 9). Смесь 3-тиено[2,3-d]изоксазол-3-илфенола (10,0 г, 46,0 ммоль), карбоната калия (12,7 г,92,0 ммоль), 1-бром-3-хлорпропана (11,4 мл,115 ммоль) и N-метилпирролидина (70 мл) перемешивали и нагревали (90-95 С) в атмосфере азота в течение 18 ч. Реакционную смесь охлаждали и вливали в воду (500 мл) и экстрагировали этилацетатом (1 х 200 мл и 1 х 100 мл). Этилацетатные экстракты объединяли и промывали 5% водным хлоридом натрия (3 х 200 мл) и концентрировали в вакууме, чтобы получить темно-коричневое масло. Неочищенный продукт очищали посредством хроматографии на силикагеле [дихлорметан:гептан/(50:50)] для получения указанных в заголовке соединений(6,5 г) в виде янтарного масла. Полученное янтарное масло являлось смесью 3-[3-(3-бромпропокси)фенил]тиено[2,3-d]изоксазола (2,21 г,6,65 ммоль) и 3-[3-(3-хлорпропокси)фенил] 37 тиено[2,3-d]изоксазола (3,77 г, 12,8 ммоль), что было установлено посредством ЯМР. Схема I - стадия F. Получение (3-фторбензил)-[2-(3-тиено[2,3d]изоксазол-3-илфенокси)этил]амина гидрохлорида (схема I, соединение 1).[2,3-d]изоксазола (8,70 г, 26,0 ммоль), 3 фторбензиламина (15,0 г, 120 ммоль), карбоната калия (9,30 г, 67,3 ммоль) и ацетонитрила (безводный, 90 мл) перемешивали и нагревали при 75 С в течение ночи. Реакционную смесь охлаждали при комнатной температуре. TLC (DCM) показала, что реакция завершена. Реакционную смесь разбавляли этилацетатом (200 мл), фильтровали и концентрировали, чтобы получить соединение 1 (свободное основание) в виде вязкого, янтарного масла. Масло очищали хроматографией (3:1/этилацетат:гептан) и подкисляли хлористо-водородной кислотой/эфир в смеси этанол:хлороформ (200 мл:300 мл) до рН = 2,3. Полученную суспензию фильтровали, упаривали и перекристаллизовывали (250 мл метанола,чтобы предоставить указанное в заголовке соединение (5,85 г, 54%) в виде белого порошка,который высушивали (60 С, 1,0 мм Нg) в течение 6 ч. Микроанализ (С, Н, N) соответствовал конечному, требуемому продукту. Точка плавления 217-220 С. Схема I - стадия G. Получение К раствору (комнатная температура) 3 тиено[2,3-d]изоксазол-3-илфенола (500 мг, 2,30 ммоль), R-(+)-1-бензил-3-пирролидина (417 мг,2,35 ммоль), трифенилфосфина (604 мг, 2,30 ммоль) и безводного тетрагидрофурана (5 мл) добавляли диэтилазадикарбоксилат (409 мг),2,35 ммоль) в атмосфере азота и перемешивали в течение ночи. Реакционную смесь концентрировали (в вакууме) до остатка. Остаток вносили в эфир (40 мл), промывали 5% NaOH (20 мл) и насыщенным солевым раствором (20 мл), высушивали (MgSO4), фильтровали и упаривали (в вакууме), чтобы получить оранжевый остаток. Оранжевый остаток очищали хроматографией на колонке (50% этилацетат в гептане). Соответствующие фракции объединяли и концентрировали для получения оранжевого масла(597 мг, выход 69%). Свободное основание растворяли в горячем этаноле, охлаждали (комнатная температура) и подкисляли НСl в эфире до рН приблизительно 2-3. Реакционную смесь концентрировали (в вакууме), чтобы получить оранжевое масло, растирали (этилацетат) и перекристаллизовывали (метанол:этилацетат) для получения указанного в заголовке соединения в виде кристаллов (325 мг, выход 34%). Микроанализ (С, Н, N) соответствовал конечному,требуемому соединению, []D21=+28,9 (метанол,с=0,985). Точка плавления=169-170 С. Схема I - стадия G. Получение (R)-(-)-3-[3-(1-бензилпирролидин-3-илокси)фенил]тиено[2,3-d]изоксазола гидрохлорида (схема I, соединение 12). Указанное в заголовке соединение получали из S-(-)-1-бензил-3-пирролидина, трифенилфосфина и диэтилазокарбоксилата в основном так, как описано выше в примере 1, схема I, стадия В. Микроанализ (С, Н, N) соответствовал конечному,требуемому соединению.[]D21=+26,3 (метанол, с=0,985). Точка плавления=168-170 С. Примеры 4-17. Примеры 4-17 выполнены с использованием способов параллельного синтеза. Экспериментальные условия подробно описаны для примера 4, для примеров 5-17 отмечены некоторые изменения в способах. Пример 4. Получение (2-фторбензил)-[3(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил] амина (схема I, соединение 1).(80 С) в течение 30 ч. Реакционную смесь охлаждали и концентрировали для получения остатка. Остаток очищали хроматографией на колонке (силикагель) (этилацетат). Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение (0,36 г, выход 94%) в виде масла. Очистка посредством LC/MS (APCI)=100% области,[М+Н]+ = 383 г/моль. Смесь 3-(3-гидроксифенил)тиено[2,3-d] изоксазол (3 г, 13,8 ммоль), N-метилпирролидинона (25 мл), дробленного карбоната калия (2 экв., 3,8 г, 27,6 ммоль) и 1-бром-3-хлорпропана(1,25 экв., 2,72 г, 17,25 ммоль) перемешивали и нагревали до 90 С в атмосфере N2. Через 1 ч добавляли дополнительные 1,25 экв. 1-бром-3 хлорпропана и смесь нагревали в течение дополнительных 16 ч. Реакционную смесь вливали в воду (125 мл) и экстрагировали этилацетатом(125 мл). Этилацетатный экстракт промывали водой 3 х 50 мл и концентрировали в вакууме. Неочищенный продукт разделяли на силикагеле(50 г) с этилацетатом и чистые фракции объединяли, концентрировали, чтобы получить 3 г янтарного масла, которое по данным ЯМР и ВЭЖХ оказалось смесью 57:32 3-[3-(3-хлорпропокси)фенил]тиено[2,3-d]изоксазол : 3-[3-(3 бромпропокси)фенил]тиено[2,3-d]изоксазол. Полученный материал использовали на следующей стадии. Бензиламин (7 г, 65 ммоль) добавляли к перемешиваемой смеси 3-[3-(3 хлорпропокси)фенил]тиено[2,3-d]изоксазола(57% чистоты по ВЭЖХ) (3 г, 13 ммоль) и дробленного карбоната калия (5,4 г, 39,0 ммоль) в Nметилпирролидиноне (20 мл) при комнатной температуре. Реакционную смесь нагревали до 110 С. Через 2 ч реакционную смесь охлаждали,вливали в воду и экстрагировали этилацетатом(3 х 100 мл). Объединенные экстракты промывали 5% водным хлоридом натрия и концентрировали в вакууме. Неочищенный продукт разделяли на силикагеле с этилацетатом, чтобы получить бензил-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил]амин (2,11 г, выход 49%, чистота по ВЭЖХ 99%) в виде янтарного масла. Свободное основание растворяли (1,9 г, 5,2 ммоль) в этиловом спирте (20 мл) и подкисляли 37% НСl. Соединение кристаллизовали из этилового спирта при 5 С с последующим высушиванием при 90 С/8 ч, чтобы получить 1,69 г Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола,4-фторбензиламина и карбоната калия по существу так, как описано выше в примере 4. Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил]тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси)фенил] тиено[2,3-d]изоксазола, 4-хлорбензиламина и карбоната калия по существу так, как описано выше в примере 4. Чистота по данным LC/MS Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола,4-метоксибензиламина и карбоната калия по существу так,как описано выше в примере 4. Соответствующие фракции объединяли и концентрировали,чтобы получить указанное в заголовке соединение (0,44 г, выход 100%) в виде твердого вещества. Чистота по данным LC/MS (APCI)=100% области, [М+Н]+=395 m/е. Пример 8. Получение [3-(3-тиено[2,3-d] изоксазол-3-илфенокси)пропил]тиофен-2-илметиламина (схема I, соединение 1). Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола, 2-тиофенметиламина и карбоната калия по существу так, как описано выше в примере 4. Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола, 3-тиофенметиламина и карбоната калия по существу так, как описано выше в примере 4. Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола, 3-(аминометил) пиридина и карбоната калия по существу так,как описано выше в примере 4. Соответствующие фракции объединяли и концентрировали,чтобы получить указанное в заголовке соединение (0,28 г, выход 77%) в виде масла. Чистота по данным LC/MS (APCI)=98% области,[М+Н]+=366 m/е. Пример 11. Получение 1-фенил-2-[3-(3 тиено[2,3-d]изоксазол-3-илфенокси)пропиламина]этанол (схема I, соединение 1). Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола,2-амино-1 фенилэтанола и карбоната калия по существу так, как описано выше в примере 4, за исключением того, что колонку элюировали смесью дихлорметан: метанол (95:5). Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение(0,62 г, выход 100%) в виде твердого вещества. Чистота по данным LC/MS (APCI)=100% области, [M+H]+=395 m/е. Пример 12. Получение 3-3-[3-(4 фенилпиперазин-1-ил)пропокси]фенилтиено Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола,1-фенилпиперазина и карбоната калия по существу так, как описано выше в примере 4, за исключением того, что колонку элюировали смесью дихлорметан:метанол (98:2). Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение (0,36 г, выход 94%) в виде масла. Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение (0,50 г, выход 100%) в виде твердого вещества. Чистота по данным Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола, 1-(4-фторфенил) пиперазина и карбоната калия по существу так,как описано выше в примере 4, за исключением того, что колонку элюировали смесью дихлорметан:метанол (99:1). Соответствующие фракции объединяли и концентрировали, чтобы по 43 лучить указанное в заголовке соединение (0,44 г, выход 100%) в виде твердого вещества. Чистота по данным LC/MS (APCI)=100% области,[М+H]+=438 m/е. Пример 14. Получение 3-(3-3-[4-(2-фторфенил)пиперазин-1-ил]пропоксифенил)тиено Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил]тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси)фенил] тиено[2,3-d]изоксазола, 1-(2-фторфенил)пиперазина и карбоната калия по существу так, как описано выше в примере 4, за исключением того, что колонку элюировали смесью дихлорметан:метанол (98:2). Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение (0,45 г, выход 100%) в виде твердого вещества. Чистота по данным Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола, 2-(пиримидин) пиперазина дихлорида и карбоната калия по существу так, как описано выше в примере 4, за исключением того, что колонку элюировали 50% этилацетатом в гептане. Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение(0,50 г, выход 100%) в виде твердого вещества. Чистота по данным LC/MS (APCI)=100% области, [M+H]+=422 m/е. Пример 16. Получение 4-[3-(3-тиено[2,3d]изоксазол-3-илфенокси)пропиламино]метил бензолсульфонамида (схема I, соединение 1). Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил] тиено[2,3-d]изоксазола, 3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола, 4-(аминометил) 44 бензолсульфонамида гидрохлорида моногидрата и карбоната калия по существу так, как описано выше в примере 4, за исключением того,что колонку элюировали смесью с постепенно повышающейся концентрацией растворителей дихлорметан:метанол (95:5). Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение(0,12 г, выход 27%) в виде твердого вещества. Чистота по данным LC/MS (APCI)=100% области, [М+Н]+=444 m/е. Пример 17. Получение 4-2-[3-(3-тиено Указанное в заголовке соединение получали из смеси 3-[3-(3-бромпропокси)фенил]тиено[2,3-d]изоксазола,3-[3-(3-хлорпропокси) фенил]тиено[2,3-d]изоксазола,4-(аминоэтил) бензолсульфонамида и карбоната калия по существу так, как описано выше в примере 4, за исключением того, что колонку элюировали смесью с постепенно повышающейся концентрацией растворителей дихлорметан:метанол(90:10). Соответствующие фракции объединяли и концентрировали, чтобы получить указанное в заголовке соединение (0,16 г, выход 35%) в виде твердого вещества. Чистота по данным LC/MS(APCI)=96% области, [М+Н]+=458 m/е. Примеры 18-26. Примеры 18-26 выполняли с использованием способов параллельного синтеза. Экспериментальные условия подробно описаны для примера 18, для примеров 19-26 отмечены некоторые изменения в условиях способов. Пример 18. Получение (2-метоксибензил)[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил] амина (схема I, соединение 1).(0,28 г, 2 ммоль), 2-метоксибензиламин (0,686 г,5 ммоль) и ацетонитрил (безводный, 4 мл) смешивали и нагревали при 75 С в течение 16,5 ч. Реакционную смесь охлаждали и фильтровали через силикагелевый картридж Waters Sep-Pak(1 г), используя этилацетат. Соответствующие фракции объединяли и концентрировали, чтобы получить остаток. Остаток очищали хромато 45 графией на колонке (10 г силикагеля), используя ступенчатый градиент от 60% этилацетата в гептане до 100% этилацетата, для получения указанного в заголовке соединения (342 мг, выход 90%). Очистка по LC/MS (APCI)=99% области, [М+Н]+=381 m/е. Пример 19. Получение (4-фторбензил)-[2(3-тиено[2,3-d]изоксазол-3-илфенокси)этил] амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 4-фторбензиламина и ацетонитрила по существу так, как описано выше в примере 18 за исключением того,что колонку элюировали, используя градиент растворителя от 40% этилацетата в гептане до 100% этилацетата. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 4-хлорбензиламина и ацетонитрила по существу так, как описано выше в примере 18 за исключением того,что колонку элюировали, используя градиент растворителя от 40% этилацетата в гептане до 100% этилацетата. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3-фторбензиламина и ацетонитрила по существу так, как описано выше в примере 18 за исключением того,что колонку элюировали, используя градиент растворителя от 40% этилацетата в гептане до 100% этилацетата. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 4-метилбензиламина и ацетонитрила по существу так, как описано выше в примере 18. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3,4-дихлорбензиламина и ацетонитрила по существу так, как описано выше в примере 18 за исключением того,что колонку элюировали смесью растворителей с постепенным повышением концентрации от 40% этилацетата в гептане до 100% этилацетата. Чистота по LC/MS (APCI)=100%, [М+Н]+=419. Пример 24. Получение [2-(3-тиено[2,3-d] изоксазол-3-илфенокси)этил]тиофен-3-илметиламина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, тиофен-3-илметиламина (полученного согласно SyntheticMetals, 26 (1988) 153-168) и ацетонитрила по существу так, как описано выше в примере 18 за исключением того, что воду (40 мл) добавляли в реакционную смесь до нагревания. Чистота по 47 Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, С-тиофен-2-илметиламина и ацетонитрила по существу так,как описано выше в примере 18 за исключением того, что колонку элюировали, используя смесь с постепенным повышением концентрации растворителя от 40% этилацетата в гептане до 100% этилацетата. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3-(аминометил) пиридина и ацетонитрила по существу так, как описано выше в примере 18 за исключением того, что фильтрацию с носителя Waters Sep-Pak осуществляли 10% метанолом в дихлорметане, а колонку элюировали, используя смесь с постепенным повышением концентрации растворителя от 2% метанола в дихлорметане до 6% метанола в дихлорметане. Чистота по LC/MS(5,0 мл) смешивали и нагревали при 75 С в течение ночи. Реакционную смесь охлаждали и фильтровали через картридж Waters Sep-Pak с 1 г силикагеля (этилацетат). Соответствующие фракции объединяли и концентрировали, чтобы получить остаток. Остаток очищали колоночной хроматографией (10 г силикагель), элюируя смесью с постепенным повышением концентрации растворителя от 10% этилацетата в дихлорметане до 20% этилацетата в дихлорметане. Свободное основание растворяли в этаноле и подкисляли хлористо-водородной кислотой/эфир, концентрировали до липкого остатка,растирали (метанол:этилацетат) и собирали порошок. Порошок перекристаллизовывали (метанол:этилацетат), чтобы получить указанное в(0,345 г, 2,50 ммоль), 4-фенилпиперидин (0,595 г, 3,69 ммоль) и ацетонитрил (5,0 мл) смешивали и нагревали при 65 С в течение ночи. Реакционную смесь охлаждали и фильтровали через картридж Waters Sep-Pak с 1 г силикагеля (этилацетат). Соответствующие фракции объединяли и концентрировали, чтобы получить остаток. Остаток очищали колоночной хроматографией(10 г силикагеля), элюируя смесью 60% этилацетата в дихлорметане. Свободное основание растворяли в хлороформе и подкисляли хлористо-водородной кислотой/эфир, концентрировали до бежевой пленки и перекристаллизовывали(метанол:этилацетат), чтобы получить указанное в заголовке соединение в виде белых кристаллов (0,366 г, 67%). Микроанализ (С, Н, N) соответствовал конечному, требуемому соединению. Точка плавления = 185-187 С. Пример 29. Получение [2-(3-тиено[2,3-d] изоксазол-3-илфенокси)этил]-(2-трифторметилбензил)амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола (0,250 г, 0,771 ммоль), карбоната калия (0,205 г, 1,48 ммоль), 2-(трифторметил) бензиламина (0,676 мг, 3,86 ммоль) и ацетонитрила (4,0 мл) по существу так, как описано выше в примере 18 за исключением того, что реакцию проводили в течение ночи, а соединение очищали на колонке, используя градиент растворителей от 5% этилацетата в дихлорметане до 10% метанола в этилацетате, чтобы получить указанное в заголовке соединение (0,11 г, выход 96%). Чистота по LC/MS (APCI)=99%,[М+Н]+=419. Примеры 30-34. Примеры 30-34 выполнены с использованием способов параллельного синтеза. Экспе 49 риментальные условия подробно описаны в примере 18, некоторые изменения в способах отмечены для примеров 30-34. Пример 30. Получение 3-[3-(2-пиперидин 1-илэтокси)фенил]тиено[2,3-d]изоксазола (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, пиридина и ацетонитрила по существу так, как описано выше в примере 18 за исключением того, что реакцию проводили в течение ночи, а соединение очищали посредством хроматографии на колонке, используя смесь с постепенным повышением концентрации растворителей от 5% этилацетата в дихлорметане до 10% метанола в этилацетате. Чистота по LC/MS (APCI)=98%, [M+H]+=329. Пример 31. Получение (2,4-дифторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси) этил]амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2,4-дифторбензиламина и ацетонитрила по существу так,как описано выше в примере 18, за исключением того, что реакцию проводили в течение ночи,а соединение очищали посредством хроматографии на колонке, используя смесь с постепенным повышением концентрации растворителей от 5% этилацетата в дихлорметане до 10% метанола в этилацетате. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2,6-дифторбензиламина и ацетонитрила по существу так, как описано выше в примере 18, за исключением того,что реакцию проводили в течение ночи, а со 004177 50 единение очищали посредством хроматографии на колонке, используя смесь с постепенным повышением концентрации растворителей от 5% этилацетата в дихлорметане до 10% метанола в этилацетате. Чистота по LC/MS (APCI)=99%,[М+Н]+=387. Пример 33. Получение адамантан-1-ил-[2(3-тиено[2,3-d]изоксазол-3-илфенокси)этил] амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 1-адамантанамина и ацетонитрила по существу так, как описано выше в примере 18, за исключением того, что реакцию проводили в течение ночи, а соединение очищали посредством хроматографии на колонке, используя смесь с постепенным повышением концентрации растворителей от 5% этилацетата в DCM до 10% метанола в этилацетате. Чистота по LC/MS (APCI)=97%,[M+H]+=395. Пример 34. Получение [2-(3-тиено[2,3-d] изоксазол-3-илфенокси)этил]-(4-трифторметилбензил)амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 4-(трифторметил) бензиламина и ацетонитрила по существу так,как описано выше в примере 18, за исключением того, что реакцию проводили в течение ночи,а соединение очищали посредством хроматографии на колонке, используя смесь с постепенным повышением концентрации растворителей от 5% этилацетата в дихлорметане до 10% метанола в этилацетате. Чистота по LC/MS(APCI)=98%, [М+Н]+=419. Примеры 35-39. Примеры 35-39 выполняли с использованием способов параллельного синтеза. Экспериментальные условия подробно описаны для примера 35, для примеров 36-39 отмечены некоторые изменения в способах. Пример 35. Получение (2-фторбензил)-[2(3-тиено[2,3-d]изоксазол-3-илфенокси)этил] амина (схема I, соединение 1).(0,341 г, 2,47 ммоль), 2-фторбензиламин (0,626 г, 5,0 ммоль) и ацетонитрил (5,0 мл) смешивали и нагревали при 80 С в течение ночи. Реакционную смесь охлаждали и фильтровали через картридж Waters Sep-Pak с 1 г силикагеля (этилацетат). Соответствующие фракции объединяли и концентрировали, чтобы получить остаток. Остаток очищали хроматографией на колонке(10 г силикагеля), элюируя смесью растворителей с постепенным повышением концентрации от 40% этилацетата в гептане до 100% этилацетата, чтобы получить указанное в заголовке соединение (0,378 г, выход 83%). Чистота по Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2-хлорбензиламина и ацетонитрила по существу так, как описано выше в примере 35. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3-метоксибензиламина и ацетонитрила по существу так, как описано выше в примере 35, за исключением того,что колонку элюировали смесью растворителей с постепенным повышением концентрации от 50% этилацетата в гептане до 100% этилацетата. Чистота по LC/MS (APCI)=99%, [M+H]+=381. Пример 38. Получение (3,4-дифторбензил)-[2-(3-тиено[2,3-d]изоксазол-3-илфенокси)этил]амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3,4-дифторбензиламина и ацетонитрила по существу так, как описано выше в примере 35. Чистота по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 1-аминоиндана и ацетонитрила по существу так, как описано выше в примере 35. Чистота по LC/MS (APCI)=99%, [M+H]+=377. Примеры 40-44. Примеры 40-44 выполняли, используя способы параллельного синтеза. Экспериментальные условия подробно описаны для примера 40,для примеров 41-44 отмечены некоторые изменения в способах. Пример 40. Получение 3-3-[2-(4-метилпиперидин-1-ил)этокси]фенилтиено[2,3-d] изоксазола (схема I, соединение 1).(0,22 г, 1,59 ммоль), 4-метилпиперидин (0,382 г,3,85 ммоль) и ацетонитрил (4,0 мл) смешивали и нагревали при 75 С в течение ночи. Реакционную смесь охлаждали и фильтровали через картридж Waters Sep-Pak с 1 г силикагеля (этилацетат). Остаток очищали посредством хроматографии (10 г силикагеля), используя градиентное элюирование, начиная от дихлорметана до 10% метанола в дихлорметане, чтобы получить указанное в заголовке соединение (0,254 г, выход 96%) в виде янтарного масла. Чистота по Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 4-N-пропилпиперидина и ацетонитрила по существу так, как описано выше в примере 40. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, пирролидина и ацетонитрила по существу так, как описано выше в примере 40. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, гексаметиленимина и ацетонитрила по существу так, как описано выше в примере 40. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, гептаметиленимина и ацетонитрила по существу так, как описано выше в примере 40. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, и бензиламина в двух отдельных реакциях, используя ацетонитрил и 90% водный ацетонитрил соответственно,по существу так, как описано выше в примере 18, за исключением того, что реакционные смеси фильтровали через силикагель, 2 г, (этилацетат, затем дихлорметан). Соответствующие фракции объединяли и концентрировали. Очистку проводили посредством хроматографии на колонке с силикагелем. Колонку элюировали,используя ступенчатый градиент от 50% этилацетата в гептане до 100% этилацетата, чтобы получить указанное в заголовке соединение Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, и N-фенилпиперазина по существу так, как описано выше в примере 27, за исключением того, что свободное основание высушивали, чтобы получить указанное в заголовке соединение (350 мг, 66%). Точка плавления = 91-93 С. Микроанализ (С, Н,N) соответствовал конечному соединению. Пример 47. Получение бензил-[2-(3 тиено[2,3-d]изоксазол-3-илфенокси)этил]амина гидрохлорида (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, и бензиламина по существу так, как описано выше в примере 27 за исключением следующего. Реакционную смесь нагревали при 70 С, а колонку элюировали, используя ступенчатый градиент от 75% этилацетата в гептане до 100% этилацетата. Свободное основание растворяли в смеси этанол:хлороформ и подкисляли, чтобы получить твердое вещество. Твердое вещество перекри 55 сталлизовывали (метанол:этилацетат), для получения указанного в заголовке соединения в виде белого порошка (0,374 г, 62%). Точка плавления = 202-204 С. Микроанализ (С, Н, N) соответствовал конечному соединению. Пример 48. Получение (4-метилбензил)-[3(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил] амина (схема I, соединение 1).(0,326 г, 2,36 ммоль), 4-метилбензиламин (0,606 г, 5,00 ммоль) и ацетонитрил (5,0 мл) смешивали и нагревали (75 С) в течение ночи. Реакционную смесь охлаждали и фильтровали через картридж Waters Sep-PAK с 1 г силикагеля(этилацетат). Соответствующие фракции объединяли и концентрировали, чтобы получить остаток. Остаток растворяли в 50% этилацетате в дихлорметане и хроматографировали на силикагеле (10 г), используя этилацетат, для получения указанного в заголовке соединения (356 мг,выход 80%). Очистка по LC/MS (APCI)=98,[M+H]+=379. Пример 49. Получение (2-хлорбензил)-[3(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил] амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2-хлорбензиламина и ацетонитрила по существу так, как описано выше в примере 48, за исключением того,что неочищенный продукт растворяли в DCM и очищали, используя ступенчатый градиент от 50% этилацетата в гептане до 100% этилацетата. Очистка по LC/MS (APCI)=98%, [M+H]+=399. Пример 50. Получение (3-метоксибензил)[3-(3-тиено[2,3-d]изоксазол-3-илфенокси) пропил]амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3-метоксибензиламина и ацетонитрила по существу так, как описано выше в примере 48. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 3,4-дифторбензиламина и ацетонитрила по существу так, как описано выше в примере 48. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 1-аминоиндана и ацетонитрила по существу так, как описано выше в примере 48. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2-аминоиндана и ацетонитрила по существу так, как описано выше в примере 48. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 1,2,3,4-тетрагидроизохинолина и ацетонитрила по существу так, как описано выше в примере 48, за исключением того, что неочищенный продукт растворяли в DCM и очищали, используя ступенчатый Указанное в заголовке соединение получали из 3-[3-(2-бромэтокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2-аминоиндана по существу так, как описано выше в примере 27,за исключением следующего: Колонку элюировали, используя ступенчатый градиент от 50% этилацетата в гептане до 100% этилацетата. Свободное основание растворяли в смеси этанол/хлороформ и подкисляли, чтобы получить желтовато-коричневое твердое вещество. Твердое вещество перекристаллизовывали для получения указанного в заголовке соединения в виде не совсем белого порошка (0,295 г, 46%). Точка плавления = 214-218 С. Микроанализ (С, Н, N) соответствовал конечному соединению. Пример 56. Получение адамантан-1-ил-[3(3-тиено[2,3-d]изоксазол-3-илфенокси)пропил] амина (схема I, соединение 1).(0,205 г, 1,48 ммоль), 1-адамантанамин (0,560 г,3,70 ммоль) и ацетонитрил (4,0) смешивали и нагревали при 75 С в течение ночи. Реакционную смесь охлаждали и фильтровали через картридж Waters Sep-Pak из силикагеля (1 г) (этилацетат). Соответствующие фракции объединяли и концентрировали, чтобы получить остаток. Остаток очищали хроматографией на колонке(10 г силикагеля), используя ступенчатый градиент от 40% этилацетата в дихлорметане до 100% этилацетата и до 20% метанола в этилацетате, для получения указанного в заголовке соединения (132 мг, 44%). Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] 58 изоксазола, карбоната калия, пиперидина и ацетонитрил по существу так, как описано в примере 56. Очистка по LC/MS (APCI) = 98%,[M+H]+=343. Пример 58. Получение (2,4-дифторбензил)-[3-(3-тиено[2,3-d]изоксазол-3-илфенокси) пропил]амина (схема I, соединение 1). Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2,4-дифторбензиламина и ацетонитрил по существу так, как описано в примере 56. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2,6-дифторбензиламина и ацетонитрил по существу так,как описано в примере 56. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 2-(трифторметил) бензиламина и ацетонитрил по существу так,как описано в примере 56. Очистка по LC/MS Указанное в заголовке соединение получали из 3-[3-(2-бромпропокси)фенил]тиено[2,3-d] изоксазола, карбоната калия, 4-(трифторметил) бензиламина и ацетонитрила по существу так, 59 как описано в примере 56. Очистка по LC/MS Продукт из примера 24, [2-(3-тиено[2,3-d] изоксазол-3-илфенокси)этил]тиофен-3-илметиламин, (205 мг, 0,575 ммоль) растворяли в этаноле (5 мл) и подкисляли эфир-НСl. Раствор разбавляли простым эфиром (10 мл) и выдерживали в течение 3 ч при комнатной температуре,чтобы получить 180 мг указанного в заголовке соединения в виде желтовато-коричневого порошка. Точка плавления = 202-204 С. Микроанализ (С, Н, N) соответствовал конечному,требуемому соединению. Исследование связывания рецептора Оценивали рецептор D4-связывающее сродство соединений по их способности снижать связывание 3H-спиперона по сравнению с контрольным соединением клозапином. Эффективность испытываемого соединения в снижении связывания 3H-спиперона прямо коррелировала с его связывающим сродством к рецептору. Получение рецептора D4 Клетки НЕК 298 (эмбриональные почки человека), стабильно трансфицированные рецептором D4 человека (подтип D4.2), выращивали в NUNC-клеточных факториях в течение 5 дней (75% конфлюэнтность) без смены среды и снимали верзеном (приблизительно 19 мг клеток на клеточный факториальный планшет). Затем клетки центрифугировали на центрифугеGS3) и осадки быстро замораживали в жидком азоте и хранили при -80 С до использования для исследования связывания. При использовании в исследованиях, клетки оттаивали на льду в течение 20 мин, а затем к ним добавляли 10 мл инкубационного буфера (50 мМ трис, 1 MMEDTA, 4 MM MgCl2, 5 мМ KCl, 1,5 мМ CaCl2,120 мМ NaCl, pH 7,4). Затем клетки встряхивали вращением, чтобы суспендировать осадок, и гомогенизировали в гомогенизаторе Kinematica СН-6010 Kriens-LU, в течение 15 с при установке 7. Концентрацию рецепторного белка определяли, используя анализ с ВСА Пирса (Pierce). Исследование общего связывания спиперона Инкубацию начинали добавлением 100 мкл (50 мкг белка) гомогената мембран к раствору 300 мкл инкубационного буфера и 100 мкл (0,25 нМ конечная концентрация) 3Hспиперона (90 Ки/ммоль, Amersham, разбавленного в боросиликанированных стеклянных ампулах) в 96-луночные полипропиленовые план 004177 60 шеты (1 мл на лунку). Планшеты встряхивали вращением и инкубировали при комнатной температуре в течение 90 мин. Реакцию связывания останавливали фильтрованием, используя харвестер модели Packard. Образцы фильтровали в вакууме через планшеты-фильтры из стекловолокна (Whatman GF/B), предварительно вымачиваемых в течение 2 ч в 0,3% полиэтиленимине (PEI) в 50 мМ трис-буфере (pH 7,4). Затем фильтры 6 раз промывали 7 мл охлажденного льдом 50 мМ трис-буфера (pH 7,4). Фильтровальные планшеты высушивали в течение ночи и добавляли 35 мкл микросцинт-O (Packard). Планшеты закрывали и считали в счетчикеPackard Top Count (3 мин на лунку). Исследование неспецифического связывания D4 Инкубацию начинали добавлением 100 мкл (50 мкг белка) гомогената мембран к раствору 200 мкл инкубационного буфера, 100 мкл 3H-спиперона (90 Ки/ммоль, Amersham, разбавленного в боросиликанированных стеклянных ампулах до конечной концентрации 0,25 нМ) и 100 мкл (30 мкл конечная концентрация) свежего допамина (Research Biochemicals Inc., защищенного от света и растворенного в инкубационном буфере) в 96-луночные полипропиленовые планшеты (1 мл на лунку). Планшеты встряхивали вращением и инкубировали при комнатной температуре в течение 90 мин, после чего реакцию связывания останавливали фильтрованием. Фильтры промывали и считали, используя такой же способ, как в вышеописанном исследовании общего связывания, чтобы установить величину неспецифического связывания(NSB). Исследование "замещенного" связывания Инкубацию начинали добавлением в 96 луночные полипропиленовые планшеты (1 мл на лунку) 100 мкл (50 мкг белка) гомогената мембран к раствору 200 мкл инкубационного буфера, 100 мкл (0,25 нМ конечная концентрация) 3H-спиперона (90 Ки/ммоль, Amersham, разбавленного в боросиликанированных стеклянных ампулах) и 100 мкл тестируемого соединения,которое готовили из 1 мМ образца, растворенного в DMSO и хранившегося при -20 С в полипропиленовых ампулах для низкотемпературного хранения до разведения инкубационным буфером в 96-луночных планшетах. Планшеты встряхивали вращением и инкубировали при комнатной температуре в течение 90 мин, после чего реакцию связывания останавливали фильтрованием. Фильтры промывали и считали, чтобы установить величину "замещенного" связывания, используя такой же способ, как при вышеописанном анализе общего связывания. Расчеты Испытываемые соединения первоначально анализировали при концентрациях 1 и 0,1 мкМ,а затем в диапазоне концентраций, выбранных так, чтобы средняя доза вызывала приблизи
МПК / Метки
МПК: A61K 31/40, C07D 498/04, A61P 25/18
Метки: этил, пропилпроизводные, тиеноизоксазолфенокси, антагонисты, незамещенные, используемые
Код ссылки
<a href="https://eas.patents.su/30-4177-nezameshhennye-tienoizoksazolfenoksi-etil-i-propilproizvodnye-ispolzuemye-kak-antagonisty-d4.html" rel="bookmark" title="База патентов Евразийского Союза">Незамещенные тиеноизоксазолфенокси этил- и пропилпроизводные, используемые как антагонисты d4</a>


































