Конъюгаты, используемые в лечении рака предстательной железы
Номер патента: 2066
Опубликовано: 24.12.2001
Авторы: Гарски Виктор М., Дефео-Джоунз Дебора, Фенг Донг-Мей
Формула / Реферат
1. Конъюгат, применяемый в лечении рака предстательной железы, который включает в себя цитотоксический агент, связанный с олигопептидом, где олигопептид включает в себя последовательность аминокислот, которая избирательно расщепляется посредством протеолитического действия свободного специфического антигена простаты, и где средствами связывания является ковалентная связь или связывание осуществляется через химический линкер, причем указанная последовательность включает в себя, по меньшей мере, одну циклическую аминокислоту, имеющую гидрофильный заместитель;
или его фармацевтически приемлемую соль.
2. Конъюгат по п.1, в котором цитотоксический агент является представителем класса цитотоксических агентов, выбранных из следующих классов:
a) лекарственных средств семейства антрациклинов,
b) алкалоидных лекарственных средств из барвинка,
c) митомицинов,
d) блеомицинов,
e) цитотоксических нуклеозидов,
f) лекарственных средств семейства птеридинов,
g) дииненов,
h) эстрамустина,
i) циклофосфамида,
j) таксанов и
k) подофиллотоксинов,
или их фармацевтически приемлемой соли.
3. Конъюгат по п.1, в котором цитотоксический агент выбирается из следующих цитотоксических агентов:
a) доксорубицина,
b) карминомицина,
c) даунорубицина,
d) аминоптерина,
e) метотрексата,
f) метоптерина,
g) дихлорметотрексата,
h) митомицина С,
i) порфиромицина,
j) 5-фторурацила,
k) 6-меркаптопурина,
l) цитозинарабинозида,
m) подофиллотоксина,
n) этопозида,
о) фосфата этопозида,
р) мелфалана,
q) винбластина,
r) винкристина,
s) лейрозидина,
t) виндезина,
u) эстрамустина,
v) цисплатины,
w) циклофосфамида,
х) таксола, и
y) лейрозина,
или их фармацевтически приемлемой соли.
4. Конъюгат по п.2, в котором цитотоксический агент выбирается из доксорубицина и винбластина или их цитотоксических производных.
5. Конъюгат по п.2, в котором цитотоксическим агентом является доксорубицин или его цитотоксическое производное.
6. Конъюгат по п.1, в котором олигопептид включает в себя олигомер, выбранный из
| a) HaaXaaSerTyrGlnISerSer | (Последовательность ь 1); |
| b) HaaTyrGlnISerSer | (Последовательность ь 2); |
| с) HaaXaaLysTyrGlnISerSer | (Последовательность ь 3); |
| d) HaaXaaLysTyrGlnISerSer | (Последовательность ь 4); |
| e) HaaXaahArgTyrGlnISerSer | (Последовательность ь 5); |
| f) HaaXaahArgChaGlnISerSer | (Последовательность ь 6); |
| g) HaaXaaSerTyrGlnISerXaa | (Последовательность ь 7); |
| h) HaaTyrGlnISerXaa | (Последовательность ь 8); |
| i) HaaXaaSerChgGlnISerXaa | (Последовательность ь 9); |
| j) HaaChgGlnISerXaa | (Последовательность ь 10); |
где Наа представляет собой циклическую аминокислоту, замещенную гидрофильным фрагментом, Хаа означает любую аминокислоту, hArg означает гомоаргинин, Cha представляет собой циклогексилаланин и Chg означает циклогексилглицин.
7. Конъюгат по п.1, в котором олигопептид включает в себя олигомер, выбранный из
| a) HaaXaaSerTyrGlnISerSer | (Последовательность ь 11); |
| b) HaaXaaSerTyrGlnISerAla | (Последовательность ь 12); |
| с) AlaHaaXaaSerTyrTyrISer | (Последовательность ь 13); |
| d) AlaAsnHaaXaaSerTyrGlnISer | (Последовательность ь 14); |
| e) HaaXaaSerTyrGlnISerSerThr | (Последовательность ь 15); |
| f) HaaTyrGlnISerSerThr | (Последовательность ь 16); |
| g) HaaXaaSerTyrGlnISerSerSer | (Последовательность ь 17); |
| h) HaaTyrGlnISerSerSer | (Последовательность ь 18); |
| i) HaaXaaLysTyrGlnISerSerSer | (Последовательность ь 19); |
| j) HaaXaahArgTyrGlnISerSerSer | (Последовательность ь 20); |
| k) HaaXaaSerTyrGlnISerSerLeu | (Последовательность ь 21); |
| l) HaaTyrGlnISerSerLeu | (Последовательность ь 22); |
| m) HaaXaaSerTyrGlnISerLeu | (Последовательность ь 23); |
| n) HaaTyrGlnISerLeu | (Последовательность ь 24); |
| p) HaaXaaSerTyrGlnISerNle | (Последовательность ь 25); |
| q) HaaTyrGlnISerNle | (Последовательность ь 26); |
| r) HaaXaaSerTyrGlnISerTIC | (Последовательность ь 27); |
| s) HaaTyrGlnISerTIC | (Последовательность ь 28); |
| t) HaaXaaSerChgGlnISerLeu | (Последовательность ь 29); |
| u) HaaChgGlnISerLeu | (Последовательность ь 30); |
| v) HaaXaaSerChgGlnISerNle | (Последовательность ь 31); |
| w) HaaChgGlnISerNle | (Последовательность ь 32); |
| x) HaaXaaSerChgGlnISerTIC | (Последовательность ь 33); |
| у) HaaChgGlnISerTIC | (Последовательность ь 34); |
| z) hArgChgGlnISerLeu | (Последовательность ь 35); |
| aa) hArgTyrGlnISerLeu | (Последовательность ь 36). |
8. Конъюгат по п.1, в котором олигопептид включает в себя олигомер, выбранный из
| a) 4-HypXaaSerTyrGlnISerSer | (Последовательность ь 37); |
| b) 4-HypXaaSerTyrGlnISerAla | (Последовательность ь 38); |
| с) Ala4-HypXaaSerTyrTyrISer | (Последовательность ь 39); |
| d) AlaAsn4-HypXaaSerTyrGlnISer | (Последовательность ь 40); |
| е) 4-HypXaaSerTyrGlnISerSerThr | (Последовательность ь 41); |
| f) 4-HypTyrGlnISerSerThr | (Последовательность ь 42); |
| g) 4-HypXaaSerTyrGlnISerSerSer | (Последовательность ь 43); |
| h) 4-HypTyrGlnISerSerSer | (Последовательность ь 44); |
| i) 4-HypXaaLysTyrGlnISerSerSer | (Последовательность ь 45); |
| j) 4-HypXaahArgTyrGlnISerSerSer | (Последовательность ь 46); |
| k) 4-HypXaaSerTyrGlnISerSerLeu | (Последовательность ь 47); |
| l) 4-HypTyrGlnISerSerLeu | (Последовательность ь 48); |
| m) 4-HypXaaSerTyrGlnISerLeu | (Последовательность ь 49); |
| n) 4-HypTyrGlnISerLeu | (Последовательность ь 50); |
| p) 4-HypXaaSerTyrGlnISerNle | (Последовательность ь 51); |
| q) 4-HypTyrGlnISerNle | (Последовательность ь 52); |
| r) 4-HypXaaSerTyrGlnISerTIC | (Последовательность ь 53); |
| s) 4-HypTyrGlnISerTIC | (Последовательность ь 54); |
| t) 4-HypXaaSerChgGlnISerLeu | (Последовательность ь 55); |
| u) 4-HypChgGlnISerLeu | (Последовательность ь 56); |
| v) 4-HypXaaSerChgGlnISerNle | (Последовательность ь 57); |
| w) 4-HypChgGlnISerNle | (Последовательность ь 58); |
| x) 4-HypXaaSerChgGlnISerTIC | (Последовательность ь 59); |
| y) 4-HypChgGlnISerTIC | (Последовательность ь 60); |
где 4-Hyp означает 4-гидроксипролин, Хаа представляет собой любую аминокислоту, hArg означает гомоаргинин, Cha означает циклогексилаланин, и Chg представляет собой циклогексилглицин.
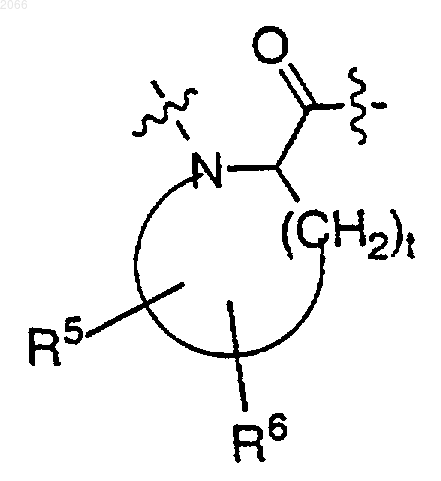
9. Конъюгат по п.1, в котором циклическая аминокислота, имеющая гидрофильный заместитель, выбирается из

где
R5 выбирается из НО- и C1-C6 алкокси;
R6 выбирается из водорода, галогена, C1-C6 алкила, НО- и C1-C6 алкокси; и
t равно 3 или 4.
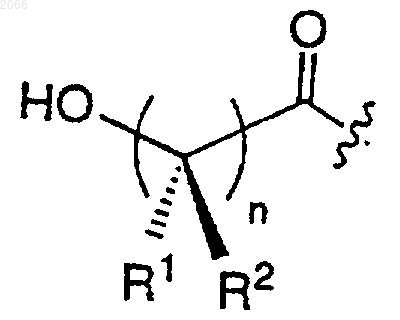
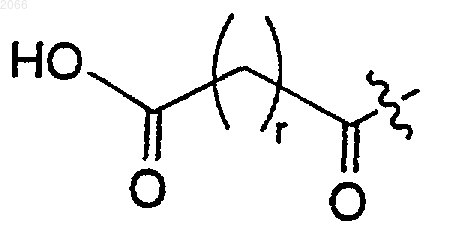
10. Конъюгат, который применяется в лечении рака простаты, формулы I

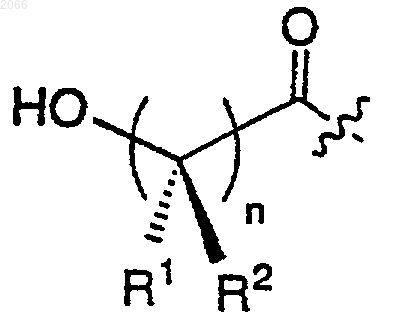
в котором олигопептид представляет собой такой олигопептид, который избирательно узнается свободным специфическим антигеном простаты (РSА) и проявляет способность протеолитически расщепляться под действием ферментативной активности свободного специфического антигена простаты, где олигопептид включает в себя циклическую аминокислоту формулы
и где С-концевая карбонильная группа ковалентно связывается с аминогруппой доксорубицина;
R выбирается из
a) водорода,
b) -(С=O)R1a,
с)
d)

е)
R1 и R2 независимо выбираются из водорода, ОН, C1-C6 алкила, C1-C6 алкокси, C1-C6 аралкила и арила;
R1a означает C1-C6 алкил, гидроксилированный арил, полигидроксилированный арил или арил,
R5 выбирается из НО- и C1-C6 алкокси;
R6 выбирается из водорода, галогена, C1-C6 алкила, НО- и C1-C6 алкокси; и
n равно 1, 2, 3 или 4;
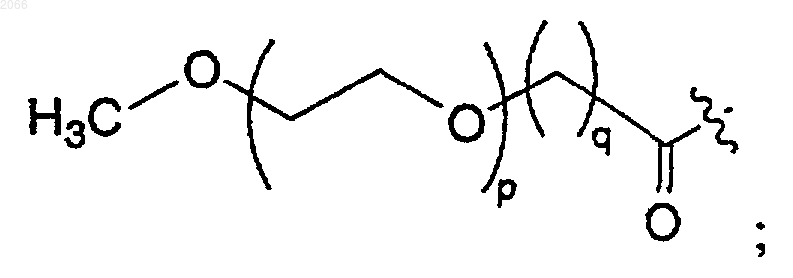
р равно нулю или целому числу между 1 и 100;
q равно 0 или 1, при условии, что если р равно нулю, то q равно 1;
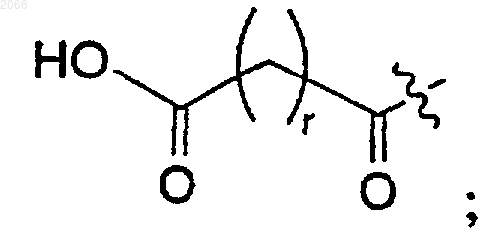
r равно целому числу между 1 и 10; и
t равно 3 или 4;
или их фармацевтически приемлемой соли.
11. Конъюгат по п.10, в котором циклическая аминокислота представляет собой
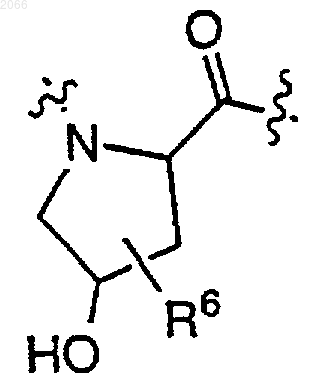
R выбирается из
a) водорода,
b) -(C=O)R1a,
c)
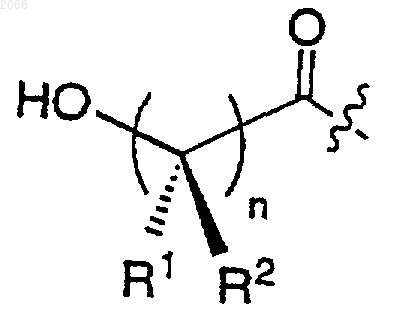
d)
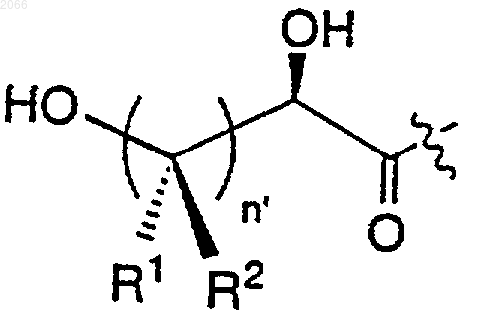
е)
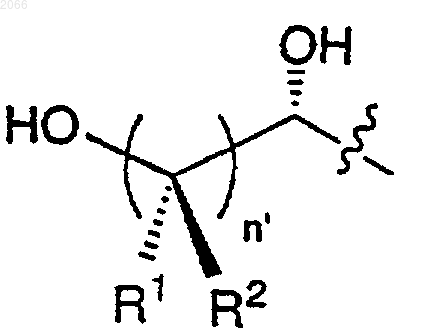
f)
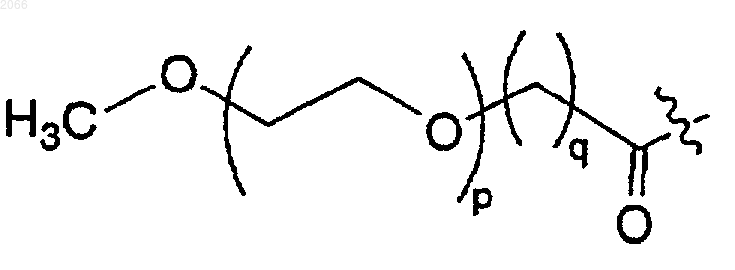
g)
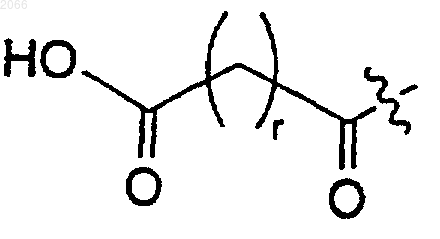
R1 и R2 независимо выбираются из водорода, C1-C6 алкила и арила;
R1a означает C1-C6 алкил или арил,
n равно 1, 2, 3 или 4;
n' равно 0, 1, 2 или 3;
р равно нулю или целому числу между 1 и 14;
q равно 0 или 1, при условии, что если р равно нулю, то q равно 1;
r равно целому числу между 1 и 10; и
t равно 3;
или их оптичесъшщ изомер или фармацевтически приемлемую соль.
12. Конъюгат по п.10, в котором олигопептид является олигомером, который включает в себя аминокислотную последовательность, выбранную из
| a) 4-HypXaaSerTyrGlnISerSer | (Последовательность ь 37); |
| b) 4-HypXaaSerTyrGlnISerAla | (Последовательность ь 38); |
| с) Ala-4-HypXaaSerTyrTyrISer | (Последовательность ь 39); |
| d) AlaAsn4-HypXaaSerTyrGlnISer | (Последовательность ь 40); |
| e) 4-HypXaaSerTyrGlnISerSerThr | (Последовательность ь 41); |
| f) 4-HypTyrGlnISerSerThr | (Последовательность ь 42); |
| g) 4-HypXaaSerTyrGlnISerSerSer | (Последовательность ь 43); |
| h) 4-HypTyrGlnISerSerSer | (Последовательность ь 44); |
| i) 4-HypXaaLysTyrGlnISerSerSer | (Последовательность ь 45); |
| j) 4-HypXaahArgTyrGlnISerSerSer | (Последовательность ь 46); |
| k) 4-HypXaaSerTyrGlnISerSerLeu | (Последовательность ь 47); |
| l) 4-HypTyrGlnISerSerLeu | (Последовательность ь 48); |
| m) 4-HypXaaSerTyrGlnISerLeu | (Последовательность ь 49); |
| n) 4-HypTyrGlnISerLeu | (Последовательность ь 50); |
| p) 4-HypXaaSerTyrGlnISerNle | (Последовательность ь 51); |
| q) 4-HypTyrGlnISerNle | (Последовательность ь 52); |
| r) 4-HypXaaSerTyrGlnISerTIC | (Последовательность ь 53); |
| s) 4-HypTyrGlnISerTIC | (Последовательность ь 54); |
| t) 4-HypXaaSerChgGlnISerLeu | (Последовательность ь 55); |
| u) 4-HypChgGlnISerLeu | (Последовательность ь 56); |
| v) 4-HypXaaSerChgGlnISerNle | (Последовательность ь 57); |
| w) 4-HypChgGlnISerNle | (Последовательность ь 58); |
| x) 4-HypXaaSerChgGlnISerTIC | (Последовательность ь 59); |
| y) 4-HypChgGlnISerTIC | (Последовательность ь 60); |
где 4-Hyp означает 4-гидроксипролин, Хаа означает любую аминокислоту, hArg представляет собой гомоаргинин, Cha означает циклогексилаланин, и Chg означает циклогексилглицин;
или их оптический изомер или фармацевтически приемлемую соль.
13. Конъюгат по п.12, в котором Хаа означает аланин или изолейцин, или их оптический изомер или фармацевтически приемлемую соль.
14. Конъюгат по п.10, который выбирается из
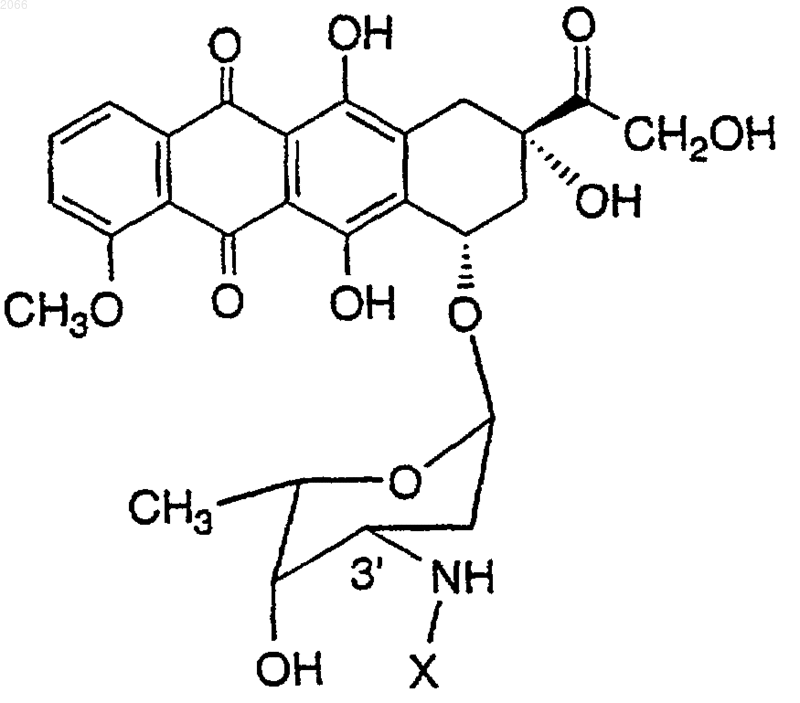
где X означает
| Последовательность ь | |
| Сукцинил-(4-Hyp)ASChgQ-SV-DOX (3') | 75 |
| Глутарил-(4-Hyp)ASChgQ-SV-DOX (3') | 76 |
| Глутарил-(4-Нур)ASChgQ-SI-DOX (3') | 77 |
| Сукцинил-(4-Нур)SSChgQ-SI-DOX (3') | 78 |
| Сукцинил-(4-Hyp)ASChgQ-SI-DOX (3') | 79 |
| Сукцинил-(4-Нур) ASChgQ-SAbu-DOX (3') | 80 |
| Глутарил-(4-Нур)SSChgQ-SI-DOX (3') | 81 |
| Глутарил-(4-Нур)SSChgQ-SL-DOX (3') | 82 |
| ПЭГ(2)-(4-Нур)SSChgQ-SL-DOX (3') | 83 |
| Сукцинил-(4-Нур)ASChgO-SThi-DOX (3') | 84 |
| ПЭГ(4)-(4-Hyp)SSChgQ-SL-DOX (3') | 85 |
| ПЭГ(2)-(4-Нур)ASChgQ-SThi-DOX (3') | 86 |
| Сукцинил-3,4-(диОН)PASChgQ-SL-DOX(3') | 87 |
| Maлонил-(4-Hyp)ASChgQ-SL-DOX (3') | 88 |
или их оптический изомер или фармацевтически приемлемую соль.
15. Конъюгат по п.10, который представляет собой
| Последовательность ь | |
| Сукцинил-(4-тpaнс-L-Hyp)ASChgQ-SV-DOX (3') | 75 |
| Глутарил-(4-тpaнс-L-Hyp)ASChgQ-SV-DOX (3') | 76 |
| Глутарил-(4-тpaнс-L-Hyp)ASChgQ-SI-DOX (3') | 77 |
| Сукцинил-(4-тpaнс-L-Hyp)SSChgQ-SI-DOX (3') | 78 |
| Сукцинил-(4-тpaнс-L-Hyp)ASChgQ-SI-DOX (3') | 79 |
| Сукцинил-(4-тpaнс-L-Hyp)ASChgQ-SAbu-DOX (3') | 80 |
| Глутарил-(4-тpaнс-L-Hyp)SSChgQ-SI-DOX (3') | 81 |
| Глутарил-(4-транс-L-Нур)SSChgQ-SL-DOX (3') | 82 |
| ПЭГ(2)-(4-тpaнс-L-Hyp)SSChgQ-SL-DOX (3') | 83 |
| Сукцинил-(4-тpaнс-L-Hyp)ASChgQ-SThi-DOX (3') | 84 |
| ПЭГ(4)-(4-тpaнс-L-Hyp)SSChgQ-SL-DOX (3') | 85 |
| ПЭГ(2)-(4-тpaнс-L-Hyp)ASChgQ-SThi-DOX (3') | 86 |
| Сукцинил-3,4-(диОН)PASChgQ-SL-DOX (3') | 87 |
| Малонил-(4-тpaнс-L-Hyp)ASChgQ-SL-DOX (3') | 88 |
или их оптический изомер или фармацевтически приемлемую соль.
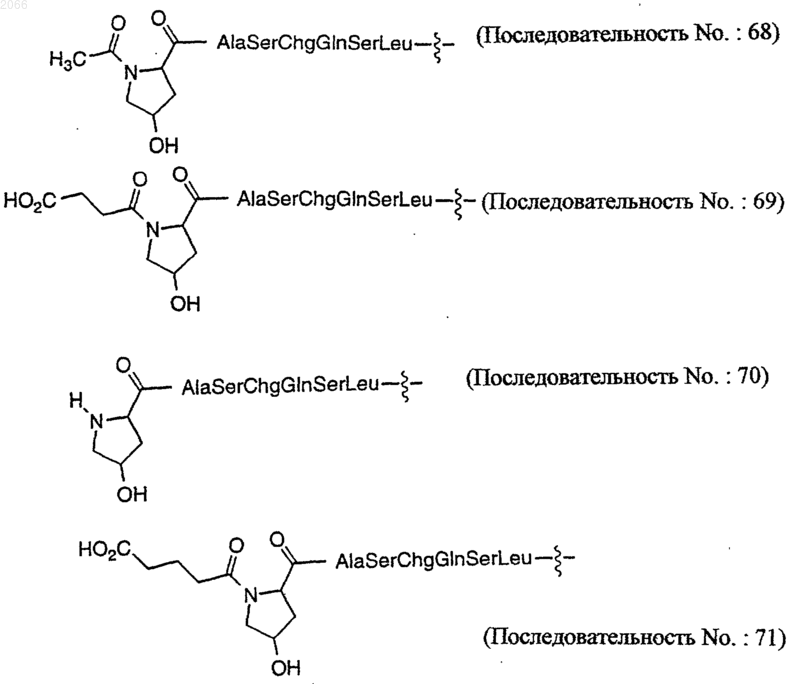
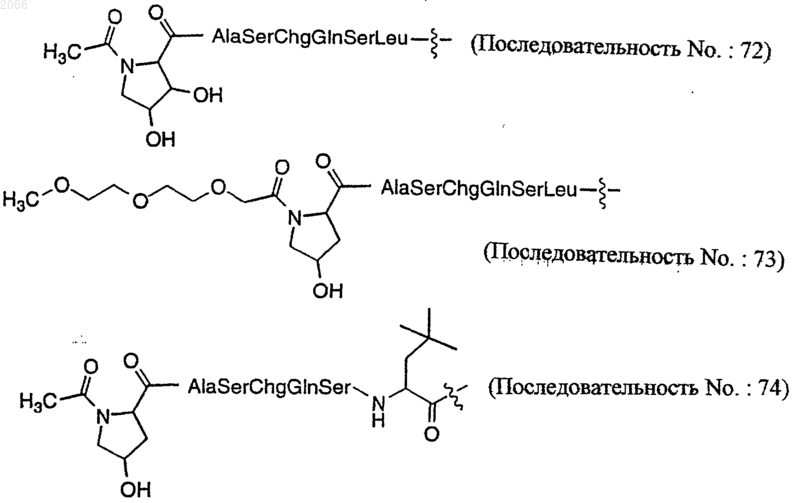
16. Конъюгат по п.10, который представляет собой
[N-Ac-(4-тpaнс-L-Hyp)]-Ala-Ser-Chg-Gln-Ser-Leu-Dox (последовательность ь 68)
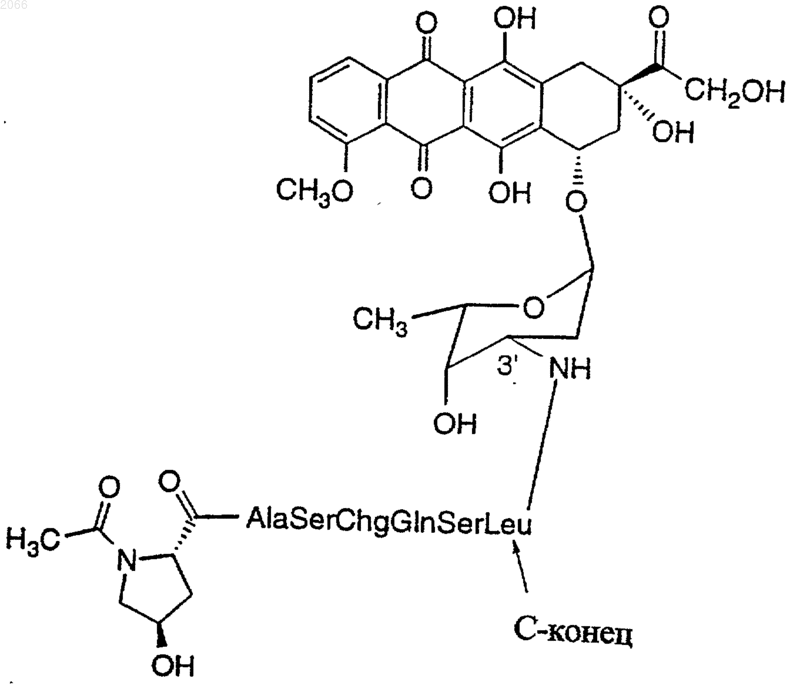
или их оптический изомер или фармацевтически приемлемую соль.
17. Конъюгат по п.10, который представляет собой
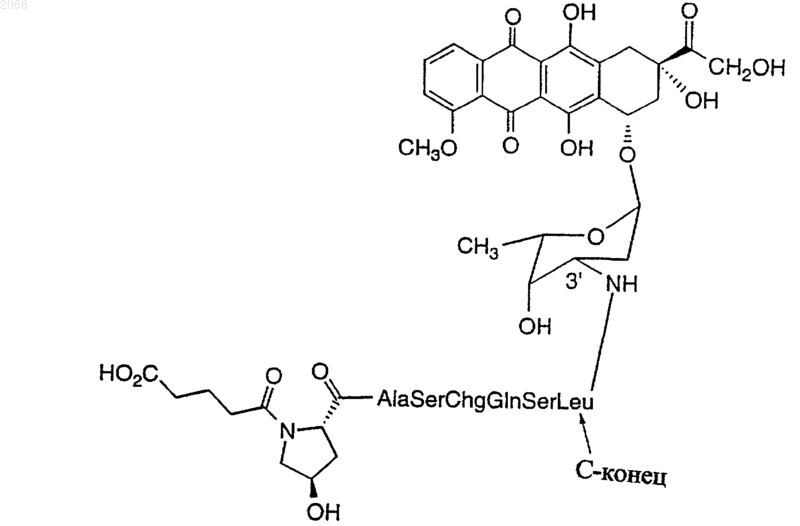
(Последовательность ь: 71)
или его оптический изомер или фармацевтически приемлемую соль.
18. Конъюгат по п.10, который представляет собой
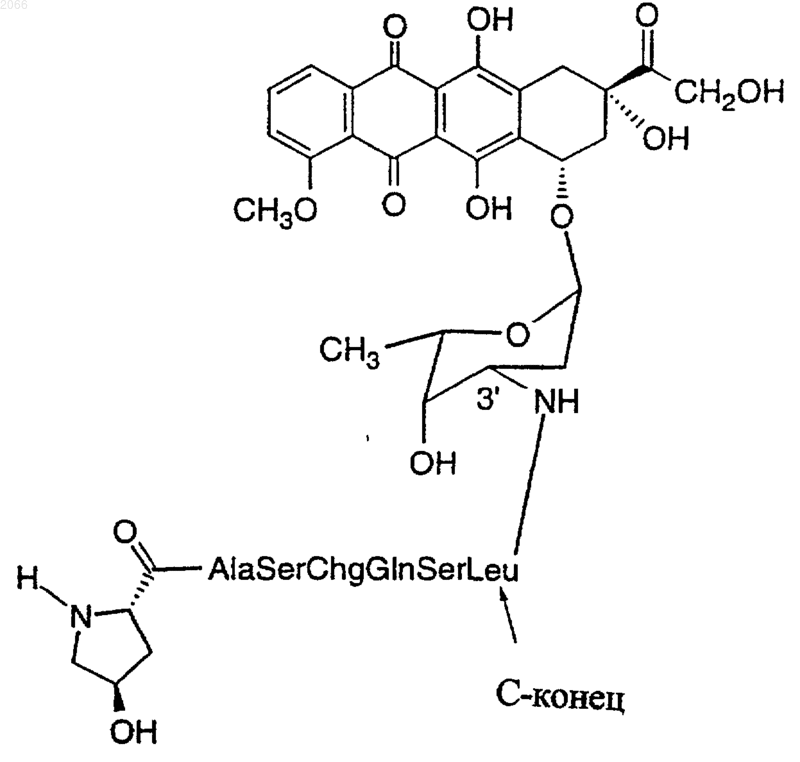
(Последовательность No.: 70)
или его оптический изомер или фармацевтически приемлемую соль.
19. Конъюгат по п.1 формулы II
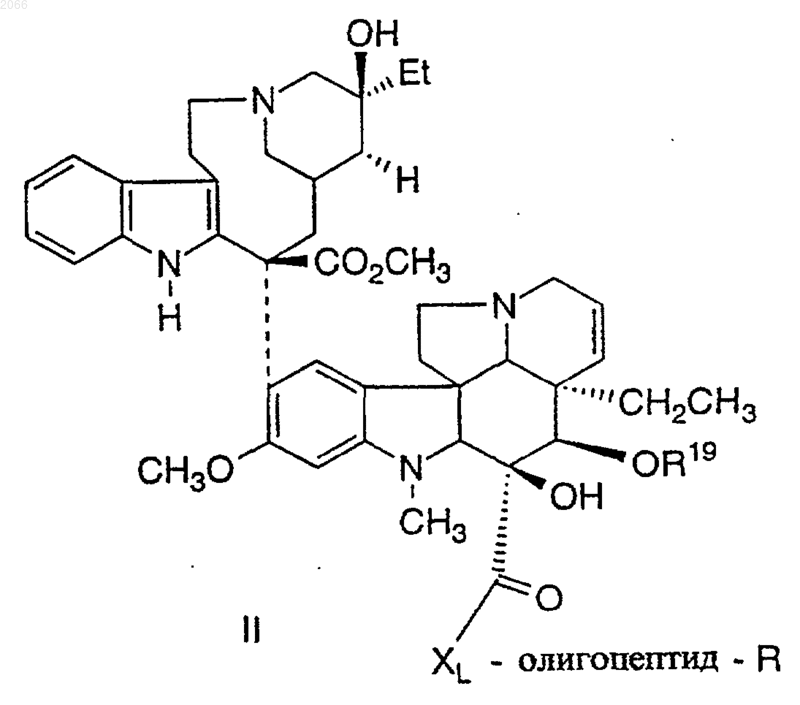
в котором олигопептид представляет собой такой олигопептид, который избирательно узнается свободным специфическим антигеном простаты (PSA) и который проявляет способность протеолитически расщепляться под действием ферментативной активности свободного специфического антигена простаты, и этот олигопептид включает в себя циклическую аминокислоту формулы
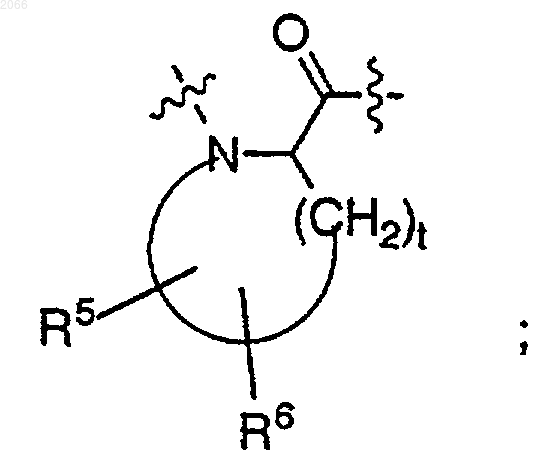
XL означает -NH-(CH2)u-NH-
R выбирается из
a) водорода,
b) -(C=O)R1a,
с)
d)
е)
R1 и R2 независимо выбираются из водорода, ОН, C1-C6 алкила, C1-C6 алкокси, C1-C6 аралкила и арила;
R1a означает C1-C6 алкил, гидроксилированный арил, полигидроксилированный арил или арил,
R19 представляет собой водород, (C1-C3 алкил)-СО или хлорзамещенный (C1-C3 алкил)-СО3;
n равно 1, 2, 3 или 4;
р равно нулю или целому числу между 1 и 100;
q равно 0 или 1, при условии, что если р равно нулю, то q равно 1;
r равно 1, 2 или 3;
t равно 3 или 4;
u равно 1, 2, 3, 4 или 5,
или их фармацевтически приемлемую соль.
20. Конъюгат по п.16, который выбирается из
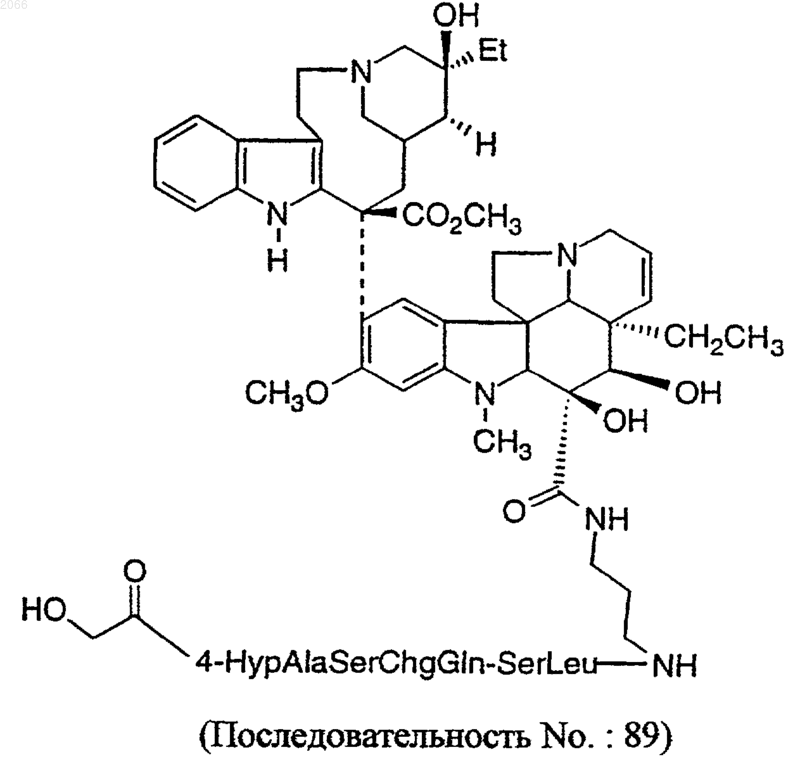
или его фармацевтически приемлемую соль или оптический изомер.
21. Конъюгат по п.1 формулы III
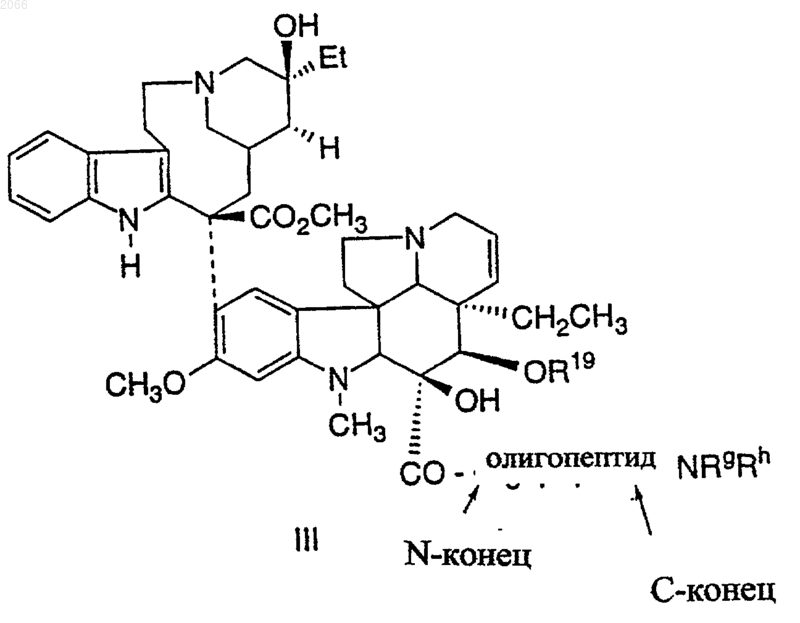
в котором олигопептид представляет собой такой олигопептид, который избирательно узнается свободным специфическим антигеном простаты (PSA) и который проявляет способность протеолитически расщепляться под действием ферментативной активности свободного специфического антигена простаты, и этот олигопептид включает в себя циклическую аминокислоту формулы

Rg и Rh независимо выбираются из водорода, C1-C6алкила, C1-C6алкил-ОН, -C1-C6алкил-ди-ОН, -C1-C6алкил-три-ОН и
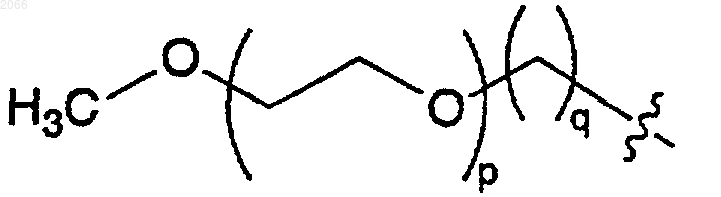
при условии, что, по меньшей мере, один Rd и Re не являются водородом или C1-C6-алкилом, или
Rg и Rh соединяются с образованием -СН2СН2ОСН2СН2-дирадикала;
R19 означает водород, (C1-C3 алкил)-СО или хлорзамещенный (C1-C3 алкил)-СО;
р равно нулю или целому числу между 1 и 100;
q равно 0 или 1, при условии, что если р равно нулю, то q равно 1;
или его фармацевтически приемлемую соль.
22. Конъюгат по п.18, который представляет собой
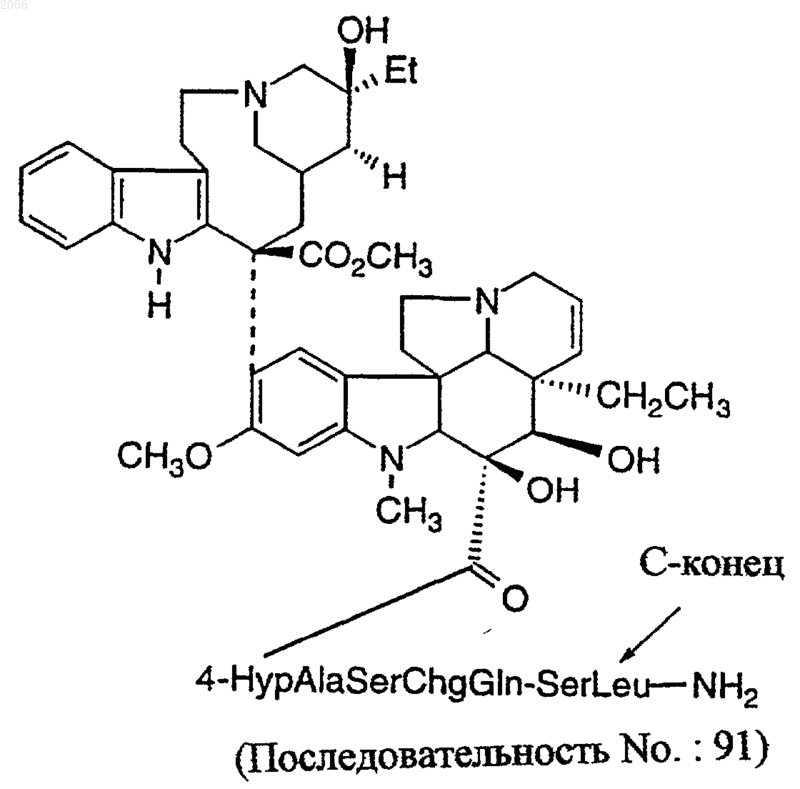
или его фармацевтически приемлемую соль.
23. Фармацевтическая композиция, включающая в себя фармацевтический носитель и диспергированное в нем соединение по п.1 в терапевтически эффективном количестве.
24. Фармацевтическая композиция, включающая в себя фармацевтический носитель и диспергированное в нем соединение по п.10 в терапевтически эффективном количестве.
25. Фармацевтическая композиция, включающая в себя фармацевтический носитель и диспергированное в нем соединение по п.14 в терапевтически эффективном количестве.
26. Фармацевтическая композиция, включающая в себя фармацевтический носитель и диспергированное в нем соединение по п.17 в терапевтически эффективном количестве.
27. Способ лечения рака простаты, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.23.
28. Способ лечения рака простаты, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.24.
29. Способ лечения рака простаты, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.25.
30. Способ лечения рака простаты, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.26.
31. Способ лечения доброкачественной гиперплазии предстательной железы, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.23.
32. Способ лечения доброкачественной гиперплазии предстательной железы, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.24.
33. Способ лечения доброкачественной гиперплазии предстательной железы, который включает в себя введение млекопитающему в случае необходимости терапевтически эффективного количества композиции п.25.
34. Способ лечения доброкачественной гиперплазии предстательной железы, который включает в себя введение млекопитающему в случрх необходимости терапевтически эффективного количества композиции п.26.
35. Фармацевтическая композиция, полученная путем комбинирования соединения по п.1 и фармацевтически приемлемого носителя.
36. Способ приготовления фармацевтической композиции, включающий в себя комбинирование соединения по п.1 и фармацевтически приемлемого носителя.
Текст
1 В 1994 году рак предстательной железы,как и ожидали, диагностировался у 200 000 мужчин в США, и в результате предположительно 38 000 американских мужчин может умереть от этого заболевания (Garnic, M.B. 1994, The Dilemmas of Prostate Cancer. ScientificAmerican, April: 72-81). Таким образом, рак простаты является наиболее часто диагностируемым злокачественным заболеванием (кроме рака кожи) у мужчин в США и второй ведущей причиной смертных случаев от рака (после рака легких) в этой группе. Специфический антиген простаты (PSA) представляет собой гликопротеин, состоящий из одной цепи, с массой 33 kDa, который продуцируется почти исключительно эпителием простаты человека и обнаруживается в количестве от 0,5 до 2,0 мг/мл в семенной жидкости человекаCancer 48:1229; Papsidero, L., Kuriyama, M.,Wang, M., et al. (1981). JNCI 66:37; Qui, S.D.,Young, C.Y.F., Bihartz, D.L., et al. (1990), J. Urol. 144:1550; Wang, M.C., Valenzuela, L.A., Murphy,G.P., et al. (1979). Invest. Urol. 17:159). Единственный углеводный компонент присоединяется к остатку аспарагина в 45-ом положении, и общая молекулярная масса его составляет от 2 до 3 kDa. PSA представляет собой протеазу с химотрипсиноподобной специфичностью (Christensson, A., Laurell, С.В., Lilja, H. (1990). Eur.PSA главным образом ответственен за растворение гелевой структуры, образованной при эякуляции с помощью протеолиза основных белков в образованном из спермы геле, семеногелина I и семеногелина II, а также фибронектина (Lilja, H. (1985). J.Clin. Invest. 76:1899; Lilja,H., Oldbring, J., Rannevik, G., et al. (1987). J.Clin.Biol. Reprod. 39:499). Протеолиз гелеобразующих белков, вызванный посредством PSA, производит несколько растворимых фрагментов семеногелина I и семеногелина II и растворимых фрагментов фибронектина с разжижением эякулята и освобождением поступательно движущегося сперматозоида (Lilja, H., Laurell, С.В.(1984). Scand. J. Clin. Lab. Invest. 44:447; McGee,R.S., Herr, J.C. (1987). Biol. Reprod. 37:431). Кроме того, PSA посредством протеолиза может расщеплять IGFBP-3 (белок 3, связывающий инсулиноподобный фактор роста) и тем самым вызывать специфическую стимуляцию роста клеток, секретирующих PSA, с помощью IGFPSA в комплексе с альфа 1-антихимотрипсином представляет собой преобладающую молекулярную форму PSA сыворотки и может составлять вплоть до 95% определяемого PSA сыворотки (Christensson, A., Bjork, Т., Nilsson, О.,et al. (1993). J. Urol. 150:100-105; Lilja, H.,Christensson, A., Dahlen, U. (1991). Clin. Chem. 37:1618-1625; Stenman, U.H., Leinoven, J.,Alfthan, H., et al. (1991). Cancer Res. 51:222-226). Ткань предстательной железы (нормальная,доброкачественная гиперпластическая или злокачественная ткань) участвует главным образом в высвобождении зрелой, ферментативно активной формы PSA, поскольку эта форма требуется для образования комплекса с альфа 1 антихимотрипсином (Mast, A.E., Enghild, J.J.,Pizzo, S.V., et al. (1991). Biochemistry 30:17231730; Perlmutter, D.H., Glover, G.I., Rivetna, M.,et al., (1990)/Proc. Natl. Acad. Sci. USA 87:37533757). Поэтому в микроокружении клеток предстательной железы, секретирующих PSA, этот антиген, как полагают, процессируется и секретируется в зрелой энзиматически активной форме, не связанной с какой-либо молекулой ингибитора. PSA также образует стабильные комплексы с альфа 2-макроглобулином, но поскольку это приводит к инкапсулированию PSA и к полной потере эпитопов PSA, значение образования этого комплекса in vivo неясно. Свободная, нескомплексованная форма PSA составляет минорную фракцию PSA сыворотки(1993). J. Urol. 150:100-105; Lilja. H., Christensson, A., Dahlen, U. (1991). Clin. Chem. 37:16181625). Размер этой формы PSA сыворотки подобен размеру PSA семенной жидкости (Lilja. H.,Christensson, A., Dahlen, U. (1991). Clin. Chem. 37:1618-1625), но до сих пор неизвестно, может ли свободная форма PSA сыворотки быть зимогеном; внутренне расщепленной, неактивной формой зрелого PSA; или формой PSA, проявляющей ферментативную активность. Однако кажется маловероятным, что свободная формаPSA сыворотки проявляет ферментативную активность, так как имеется значительный (от 100 до 1000 раз) молярный избыток непрореагировавших альфа 1-антихимотрипсина и альфа 2 макроглобулина в сыворотке по сравнению с определяемыми в сыворотке уровнями свободной формы PSA с молекулярной массой 33 kDa(1993). J. Urol. 150:100-105; Lilja, H., Christensson, A., Dahlen, U. (1991). Clin. Chem. 37:16181625). Измерение уровня PSA в сыворотке производят для наблюдения за ходом лечения аденокарциномы простаты (Duffy, M.S. (1989). Ann.and Kimura, H. (1989). J. Lab. Clin. Med. 113:541548), хотя упомянутые выше нормальные концентрации PSA в сыворотке наблюдались также и при доброкачественной гиперплазии предстательной железы, и при последующем хирургическом повреждении простаты (Lilja, H., Christensson, A., Dahlen, U. (1991). Clin. Chem. 37:1618-1625). Также известно, что метастазы предстательной железы секретируют иммунологически реактивный PSA, так как PSA в боль 3 ших количествах определяется в сыворотке больных с удаленной предстательной железой,свидетельствуя тем самым о широком распространении метастатического рака простаты(Ford, T.F., Butcher, D.N., Masters, R.W., et al.,(1985). Brit. J. Urology 57:50-55). Следовательно,цитостатическое соединение, которое может быть активировано посредством протеолитической активности PSA, должно быть специфическим для клеток простаты, а также специфическим для секретирующих PSA метастазов предстательной железы. Целью этого изобретения является обеспечение новой противораковой композицией,применяемой в лечении рака предстательной железы, которая включает олигопептиды, избирательно расщепляемые при протеолитическом действии свободного специфического антигена простаты (PSA) и который включает в себя циклическую аминокислоту, имеющую гидрофильный заместитель, в соединении с цитотоксическим агентом. Другой целью данного изобретения является обеспечение способа лечения рака простаты, включающий введение новой противораковой композиции. Обнаружены химические конъюгаты,включающие олигопептиды, имеющие аминокислотные последовательности, которые подвергаются избирательному протеолитическому расщеплению под действием свободного специфического антигена простаты (PSA), и включающие циклическую аминокислоту, имеющую гидрофильный заместитель, и известные цитотоксические агенты. Подобные конъюгаты применяют в лечении рака предстательной железы и доброкачественной гиперплазии предстательной железы (ВРН). Настоящее изобретение связано с новыми противораковыми композициями, используемыми для лечения рака предстательной железы. Подобные композиции включают в себя олигопептиды, ковалентно связанные прямо или через химический линкер с цитотоксическим агентом. Олигопептиды выбираются из олигомеров, которые избирательно узнаются свободным специфическим антигеном простаты (PSA) и проявляют способность протеолитически расщепляться благодаря ферментативной активности свободного специфического антигена простаты. Подобная комбинация олигопептида и цитотоксического агента может быть названа конъюгатом. Конъюгаты настоящего изобретения далее характеризуются включением циклической аминокислоты, имеющей гидрофильный заместитель как часть олигопептидов, причем вышеуказанная циклическая аминокислота вносит вклад в растворимость конъюгата в воде. В качестве неограничивающего примера подобные гидрофильные циклические аминокислоты включают в себя гидроксилированный, поли 002066 4 гидроксилированный и алкоксилированный пролин и фрагменты пипеколиновой кислоты. Идеально, когда цитотоксическая активность цитотоксического агента в значительной степени снижается или отсутствует в тех случаях, когда олигопептид, содержащий участок протеолитического расщепления посредствомPSA, связывается прямо или через химический линкер с цитотоксическим агентом и является интактным. Идеальным является также то, что цитотоксическая активность цитотоксического агента в значительной степени увеличивается или возвращается к уровню активности немодифицированного цитотоксического агента при протеолитическом расщеплении присоединенного олигопептида в участке расщепления. Кроме того, предпочтительнее, когда олигопептид выбирается из олигопептидов, которые не расщепляются или расщепляются с гораздо меньшей скоростью в присутствии других, отличных от PSA, протеолитических ферментов по сравнению с расщеплением олигопептидов в присутствии свободного ферментативно активного PSA. По вышеуказанным причинам желательно,чтобы олигопептид содержал короткую пептидную последовательность, предпочтительнее менее десяти аминокислот. Более предпочтительный олигопептид содержит семь или шесть аминокислот. Поскольку конъюгат предпочтительно содержит короткую аминокислотную последовательность, на растворимость конъюгата может влиять в значительной степени гидрофобный характер цитотоксического агента как компонента конъюгата. Кроме того, гидрофильные заместители на циклической аминокислоте данных конъюгатов выбираются для того, чтобы компенсировать или уменьшить подобный гидрофобный вклад цитотоксического агента. Хотя это и не является необходимым для практического применения этого аспекта изобретения, предпочтительный вариант изобретения представляет собой конъюгат, в котором олигопептид и химический линкер, если он имеется, отщепляются от цитотоксического агента под действием протеолитической активности свободного PSA и любых других нативных протеолитических ферментов, присутствующих в близлежащей ткани, тем самым представляя цитотоксический агент, или цитотоксический агент, который сохраняет часть олигопептидной линкерной единицы, но остается при этом цитотоксическим, физиологическому окружению у места протеолитического расщепления. Фармацевтически приемлемые соли конъюгатов также включаются. Понятно, что олигопептид, конъюгированный с цитотоксическим агентом либо через прямую ковалентную связь, либо через химический линкер, не должен быть олигопептидом,который лучше всех узнается свободным PSA и легче всех протеолитическим путем расщепляется свободным PSA. Таким образом, олигопептид, который отбирается для включения в подобную противораковую композицию, будет выбираться как по его способности к избирательному протеолитическому расщеплению под действием свободного PSA, так и по цитотоксической активности конъюгата, состоящего из цитотоксического агента и остатка пептида(или, что было бы идеально, может оказаться немодифицированным цитотоксическим агентом), который образуется в результате подобного протеолитического действия PSA. ТерминPSA, означает большую скорость расщепления компонента олигопептида настоящего изобретения под действием свободного PSA по сравнению с расщеплением олигопептида, который содержит случайную последовательность аминокислот. Поэтому олигопептидный компонент настоящего изобретения является предпочтительным субстратом для свободного PSA. Термин "избирательный" указывает также на то,что при протеолитическом действии свободногоPSA олигопептид расщепляется между двумя определенными аминокислотами в олигопептиде. Олигопептидные компоненты настоящего изобретения избирательно узнаются свободным специфическим антигеном простаты (PSA) и проявляют способность к протеолитическому расщеплению под действием ферментативной активности свободного специфического антигена простаты. Подобные олигопептиды содержат олигомер, выбранный из где Наа означает циклическую аминокислоту,замещенную гидрофильной группировкой, Хаа означает любую аминокислоту, hArg означает гомоаргинин, Cha представляет собой циклогексилаланин, и Chg представляет собой циклогексилглицин. В варианте настоящего изобретения олигопептид включает в себя олигомер, который выбирается из В более предпочтительном варианте настоящего изобретения олигопептид включает в себя олигомер, выбранный из где 4-Нур означает 4-гидроксипролин, Хаа означает любую аминокислоту, hArg означает гомоаргинин, Cha представляет собой циклогексилаланин и Chg представляет собой циклогексилглицин. Предпочтительно, когда Хаа в предпочтительном варианте выбирается из Ala, Ser и Ilе. Фраза "олигомеры, которые включают в себя аминокислотную последовательность",которая использовалась здесь выше, и в другом месте в подробном описании сущности изобретения означает олигомеры, состоящие из 3-100 аминокислотных остатков и включающие в состав своих аминокислотных последовательностей, описанную специфическую аминокислотную последовательность и поэтому протеолитически расщепляющиеся внутри описанной аминокислотной последовательности под действием свободного PSA. Предпочтительно олигомер состоит из 5-10 аминокислотных остатков. Таким образом, например, следующий олигомер:hArgSer4-HypChgGln-ISerLeu (Последовательность 61) включает в себя аминокислотную последовательность: 4-HypChgGlnISerLeu (Последовательность 56); и поэтому должен войти в настоящее изобретение. Специалист в области пептидной химии должен легко оценить, что определенные аминокислоты в биологически активном олигопептиде можно заменить другими гомологичными,изостерными и/или изоэлектронными аминокислотами, причем биологическая активность исходного олигопептида сохраняется в модифицированном олигопептиде. Определенные неприродные и модифицированные природные аминокислоты могут быть использованы для замены соответствующих природных аминокислот в олигопептидах настоящего изобретения. Таким образом, например, тирозин может быть заменен на 3-иодтирозин, 2-метилтирозин,3-фтортирозин, 3-метилтирозин и тому подобное. Следующий перечень аминокислотных замен приводится с целью иллюстрации, но не ограничения настоящего изобретения: Исходная аминокислота Аlа Аrg Таким образом, например, следующие олигопептиды могут быть синтезированы с помощью техники, хорошо известной специалистам в данной области, и, как предполагается,они должны расщепляться протеолитическим путем посредством свободного PSA, когда они включены в состав конъюгата согласно изобретению. Включение символа "I" в аминокислотную последовательность указывает на точку в последовательности, где олигопептид протеолитически расщепляется посредством свободногоPSA. Соединения настоящего изобретения могут иметь асимметрические центры и быть в виде рацематов, рацемических смесей и в виде индивидуальных диастереомеров, со всеми возможными изомерами, включая оптические изомеры, включенные в настоящее изобретение. 8 Если не указано особо, то названные аминокислоты имеют "L" стереоконфигурацию. Следующие аббревиатуры используются в описании и таблицах для обозначения указанных аминокислот и некоторых группировок: гомоаргинин гомотирозин циклогексилаланин 4-аминометилфенилаланин 2-(4,6-диметилпиримидинил)лизинO-метилтирозин 1,2,3,4-тетрагидро-3-изохинолинкарбоновая кислота 1,3-диаминопропан трифторуксусная кислота уксусная кислота 3-пиридилаланин 4-гидроксипролин альфа-аминомасляная кислота тиенилаланин Хорошо известно в данной области и предполагается в настоящем изобретении, что пептидные терапевтические агенты, такие как данные конъюгаты олигопептида с цитотоксическим агентом, имеют концевую аминогруппу любого олигопептидного заместителя, защищенную подходящей защитной группой, такой как ацетильная, бензоильная, пивалоильная и тому подобное. Такая защита концевой аминогруппы снижает или исключает ферментативное расщепление подобных пептидных терапевтических агентов под действием аминопептидаз,которые имеются в плазме крови теплокровных животных. Подобные защитные группы также включают в себя гидрофильные блокирующие группы, которые выбираются на основании наличия гидрофильной функции. Блокирующие группы,которые увеличивают гидрофильность конъюгатов и поэтому повышают растворимость конъюгатов в воде, включают в себя в качестве неограничивающего примера гидроксилированный алконоил, полигидроксилированный алканоил, гидроксилированный ароил, полигидроксилированный ароил, полиэтиленгликоль, гликозилаты, сахара и крон-эфиры. N-концевые группы неприродных аминокислот могут также улучшать подобную ферментативную деградацию аминопептидазами. Предпочтительно N-концевая защитная группа выбирается изa) водорода,b) незамещенного или замещенного арила,незамещенного или замещенного гетероцикла,С 3-С 10 циклоалкила, С 2-С 6 алкенила, С 2-С 6 алкинила, галогена, С 2-С 6 перфторалкила, R3O-,(R3)2NC(O)-,R32N-C(NR3)-,RЗC(O)NR3-,4 3R4OC(O)NR3-,c) незамещенного С 1-6 алкила,d) замещенного С 1-6 алкила, где заместитель на замещенном С 1-6 алкиле выбирается из незамещенного или замещенного арила, незамещенного или замещенного гетероцикла, С 3 С 10 циклоалкила, С 2-С 6 алкенила, С 2-С 6 алкинила, R3O-, R4S(O)mNH, R3C(O)NR3-, (R3)2NC(O)-,R32N-C(NR3)-, CN, R3C(О)-, N3, -N(R3)2 и-(CH2)s-, где один из атомов углерода необязательно замещается группой, выбранной из О, S(O)m, -NC(O)-, NH и N(COR4)-;n равно 1, 2, 3 или 4; р равно нулю или целому числу между 1 и 100;r равно целому числу между 1 и 10; иs равно 3, 4 или 5. Предпочтительно r равно 1, 2 или 3. Олигопептиды данных конъютатов содержат циклическую аминокислоту, замещенную гидрофильной группировкой, которая ранее была обозначена как "Наа" и может быть представлена формулой представляет собой циклический фрагмент с амином, имеющий 5 или 6 членов в кольце, таких как циклический амин, который может быть необязательно связан с фенильным или циклогексильным кольцом. Примеры подобного цик 002066 10 лического фрагмента с амином включают в себя в качестве неограничивающего примера следующие специфические структуры Конъюгаты настоящего изобретения могут иметь асимметрические центры и быть в виде рацематов, рацемических смесей и индивидуальных диастереомеров, со всеми возможными изомерами, включая оптические изомеры,включенные в настоящее изобретение. Когда любая вариабельная (например, арил, гетероцикл, R3 и т.д.) группировка имеет место более одного раза в любой составной части, ее определение на каждом местоположении является независимым от каждого другого местоположения. Например, HO(CR1R2)2-представляет собой НОСH2 СН 2-, НОСН 2 СН(ОН)-, НОСН(СН 3)СН(ОН)-, и т.д. Кроме того, комбинации заместителей и/или вариабельных группировок являются допустимыми, только если подобные комбинации приводят к стабильным соединениям. Когда используется в данном изобретении"алкил" и алкильная часть аралкила и подобные термины, предполагается включение как разветвленных, так и с прямой цепью насыщенных алифатических углеводородных групп, имеющих определенное число атомов углерода; термин "алкокси" представляет собой алкильную группу с указанным числом углеродных атомов,связанную через кислородный мостик. Когда используется в данном изобретении"циклоалкил", то предполагается включение неароматических циклических углеводородных групп, имеющих определенное число атомов углерода. Примеры циклоалкильных групп включают в себя циклопропил, циклобутил,циклопентил, циклогексил и тому подобное."Алкенильные" группы включают в себя такие группы, которые имеют определенное число углеродных атомов и имеют одну или несколько двойных связей. Примеры алкенильных групп включают в себя винил, аллил, изопропенил, пентенил, гексенил, гептенил, циклопропенил, циклобутенил, циклопентенил, циклогексенил, 1-пропенил, 2-бутенил, 2-метил-2 бутенил, изопренил, фарнезил, геранил, геранилгеранил и тому подобное."Алкинильные" группы включают в себя такие группы, которые имеют определенное число атомов углерода и имеют тройные связи. Примеры алкинильных групп включают в себя ацетилен, 2-бутинил, 2-пентинил, 3-пентинил и тому подобное."Галоген, или "гало", используемые в изобретении, означают фтор, хлор, бром и иод. Используемые в изобретении "арил" и арильная часть аралкила и ароила означают любое стабильное моноциклическое или бицикли 11 ческое углеродное кольцо, состоящее из вплоть до 7 членов в каждом кольце, где, по меньшей мере, одно кольцо является ароматическим. Примеры подобных арильных элементов включают в себя фенил, нафтил, тетрагидронафтил,инданил, бифенил, фенантрил, антрил или аценафтил. Термин гетероцикл или гетероциклический, когда используется в данном изобретении,означает стабильное 5- или 7-членное моноциклическое или стабильное 8-11-членное бициклическое гетероциклическое кольцо, которое является либо насыщенным, либо ненасыщенным, и которое состоит из атомов углерода и из от одного до четырех гетероатомов, выбранных из группы, состоящей из N, О и S и включающей в себя любую бициклическую группу, в которой любое из вышеуказанных гетероциклических колец связано с бензольным кольцом. Гетероциклическое кольцо может быть присоединено к любому гетероатому или углеродному атому, что приводит к созданию стабильной структуры. Примеры подобных гетероциклических элементов включают в себя в качестве неограничивающего примера азепинил, бензимидазолил, бензизоксазолил, бензофуразанил, бензопиранил, бензотиопиранил, бензофурил, бензотиазолил, бензотиенил, бензоксазолил, хроманил, циннолинил, дигидробензофурил, дигидробензотиенил,дигидробензотиопиранил,дигидробензотиопиранил сульфон, фурил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолил, изохроманил, изоиндолинил,изохинолинил, изотиазолидинил, изотиазолил,морфолинил, нафтиридинил, оксадиазолил, 2 оксоазепинил, оксазолил, 2-оксопиперазинил, 2 оксопиперидинил, 2-оксопирролидинил, пиперидил, пиперазинил, пиридил, пиразинил, пиразолидинил, пиразолил, пиридазинил, пиримидинил, пирролидинил, пирролил, хиназолинил,хинолинил, хиноксалинил, тетрагидрофурил,тетрагидроизохинолинил,тетрагидрохинолинил, тиаморфолинил, тиаморфолинил сульфоксид, тиазолил, тиазолинил, тиенофурил, тиенотиенил и тиенил. Когда используются в данном изобретении термины "замещенный C1-8 алкил", "замещенный арил" и "замещенный гетероцикл", это означает, что они включают в себя фрагменты,содержащие от 1 до 3 заместителей, кроме сайта прикрепления к основе соединения. Подобные дополнительные заместители выбираются из F,Сl, Вr, СF3, NH2, N(С 1-С 6 алкил)2, NO2, CN, (С 1 С 6 алкил)O-, -ОН, (С 1-С 6 алкил)S(O)m-, (С 1-С 6 алкил)С(O)NН-, H2N-C(NH)-, (С 1-С 6 алкил) С(О)-, (С 1-С 6 алкил)ОС(О)-, N3, (С 1-С 6 алкил) ОС(O)NН- и С 1-С 20 алкил. Термин "целое число между 1 и 10" означает числа 1 и 10, а также целые числа между ними. Термин "целое число между 1 и 100" означает числа 1 и 100, а также целые числа между ними."ПЭГ" представляет собой определенный полиэтиленгликоль,содержащий заместители,имеющие обозначенное число этиленоксисубъединиц. Таким образом, термин ПЭГ (2) представляет собой и термин ПЭГ (6) представляет собой Используемый здесь термин "(2R) (2,3 дигидроксипропионил)" представляет собой следующую структуру Используемый здесь термин "(2R,3S) 2,3,4 тригидроксибутаноил" означает следующую структуру Поскольку конъюгаты согласно изобретению могут быть использованы для модификации данного биологического ответа, цитотоксический агент не должен истолковываться как ограничивающий пример классических химических терапевтических агентов. Например, цитотоксический агент может быть белком или полипептидом, обладающим желательной биологической активностью. Подобные белки могут включать в себя, например, токсин, такой как абрин, рицин А, экзотоксин pseudomonas или токсин дифтерии; белок, такой как фактор некроза опухоли, -интерферон, -интерферон,фактор роста нервов, фактор роста, полученный из тромбоцитов, тканевой активатор плазминогена; или такие модификаторы биологического ответа как, например, лимфокины, интерлейкин 1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин 6 ("IL-6"), колониестимулирующий фактор гранулоцитов макрофагов ("GM-CSF"), колониестимулирующий фактор гранулоцитов ("GCSF") или другие факторы роста. 13 Предпочтительные цитотоксические агенты включают в себя в основном алкилирующие агенты, антипролиферативные агенты, тубулинсвязывающие агенты и тому подобное. Предпочтительные классы цитотоксических агентов включают в себя, например, антрациклиновое семейство лекарственных средств, лекарственные средства из барвинка, митомицины, блеомицины, цитотоксические нуклеозиды, таксаны,птеридиновое семейство лекарств, диинены и подофиллотоксины. Особенно используемые члены этих классов включают в себя, например,доксорубицин, карминомицин, даунорубицин,аминоптерин, метотрексат, метоптерин, дихлорметотрексат, митомицин С, порфиромицин, 5 фторурацил, 6-меркаптопурин, цитозинарабинозид, родофиллотоксин или производные подофиллотоксина, такие как этопозид или фосфат этопозида, мелфалан, винбластин, винкристин,лейрозидин, виндезин, лейрозин, таксол и тому подобное. Другие применяемые цитотоксические агенты включают эстрамустин, цисплатин и циклофосфамид. Специалист в данной области может произвести химические модификации желаемого цитотоксического агента, чтобы сделать реакции этого соединения более подходящими с целью получения конъюгатов согласно изобретению. Самая предпочтительная группа цитотоксических агентов для настоящего изобретения включает в себя лекарственные средства со следующей формулой: Группа метотрексата формулы (1) в которой R12 означает амин или гидрокси;R7 означает водород или метил;R9 означает гидрокси или элемент, который заканчивается солью карбоновой кислоты; Группа митомицина формулы (2) в которой R10 означает водород или метил; Группа блеомицина формулы (3) в которой R13 означает водород или метил;R14 означает метил или тиенил; или фосфатная соль соединения; Алкалоидная группа лекарств из барвинка формулы (8)R18 означает Н, и один из R16 и R17 представляет собой этил, а другой означает Н или ОН; когда R17 и R18 берутся вместе с углеродами, к которым они присоединены, они образуют кольцо окиси этилена, в котором R16 означает этил; 15 в которой R21 означает основание одной из формул Самыми предпочтительными лекарственными средствами являются антрациклиновые антибиотики формулы (10), описанные ранее. Специалисту в данной области ясно, что эта структурная формула включает в себя соединения, которые являются лекарствами или производными лекарств и которые приобрели в этой области общие и тривиальные названия. В таблице 1 представлен ряд антрациклиновых лекарств и их общие и тривиальные названия, и эти лекарства особенно предпочтительны для использования в настоящем изобретении.NHCOCF3 а дауномицин является альтернативным названием даунорубицинаb адриамицин является альтернативным названием доксорубицина Из показанных в таблице 1 соединений самыми предпочтительными цитотоксическими агентами являются доксорубицин, винбластин и дезацетилвинбластин. Доксорубицин (также обозначается здесь как "DOX") является таким антрациклином формулы (10), в котором Ra означает -СН 2OН, Rb означает -ОСН 3, Rc означает Конъюгат олигопептида с цитотоксическим агентом настоящего изобретения, в котором цитотоксический агент представляет собой предпочтительный цитотоксический агент доксорубицин, может быть описан общей формулой, представленной нижеa) водорода,b) -(C=O)R1a,c) в которой олигопептид является таким олигопептидом, который избирательно узнается с помощью свободного специфического антигена простаты (PSA) и способен расщепляться протеолитическим путем благодаря ферментативной активности свободного специфического антигена простаты, где олигопептид включает в себя циклическую аминокислоту формулы и где С-концевой карбонил ковалентно связан с амином доксорубицина;R1 и R2 независимо выбираются из водорода, ОН, C1-C6 алкила, C1-С 6 алкокси, C1-С 6 аралкила и арила;R1a означает C1-С 6 алкил, гидроксилированный арил, полигидроксилированный арил или арил,R5 выбирается из НО- и C1-C6 алкокси;n равно 1, 2, 3 или 4; р равно нулю или целому числу между 1 и 100;r равно целому числу между 1 и 10; иt равно 3 или 4; или фармацевтически приемлемая соль соединения. В предпочтительном варианте конъюгата олигопептида с цитотоксическим агентом: циклическая аминокислота представляет собойR1 и R2 независимо выбираются из водорода, C1-C6 алкила и арила;n' равно 0, 1, 2 или 3; р равно нулю или целому числу между 1 и 14;r равно целому числу между 1 и 10; иt равно 3; или оптический изомер или фармацевтически приемлемая соль соединения. Следующие соединения представляют собой конкретные примеры конъюгата олигопептида с цитотоксическим агентом настоящего изобретения 20 ной активности свободного специфического антигена простаты, где олигопептид включает в себя циклическую аминокислоту формулы или оптический изомер или фармацевтически приемлемая соль соединения. Конъюгат олигопептида с цитотоксическим агентом настоящего изобретения, где цитотоксическим агентом является предпочтительный цитотоксический агент винбластин или дезацетилвинбластин, может быть описан общей формулой II, представленной ниже: в которой олигопептид является таким олигопептидом, который избирательно узнается с помощью свободного специфического антигена простаты (PSA) и способен расщепляться протеолитическим путем благодаря ферментативR1 и R2 независимо выбираются из водорода, ОН, C1-C6 алкила, C1-C6 алкокси, C1-C6 аралкила и арила;R1a означает C1-C6 алкил, гидроксилированный арил, полигидроксилированный арил или арил,R19 означает водород, (C1-C3 алкил)-СО или хлорзамещенный (C1-C3 алкил )-СО 3;n равно 1, 2, 3 или 4; р равно нулю или целому числу между 1 и 100;u равно 1, 2, 3, 4 или 5,или фармацевтически приемлемая соль соединения. Другой вариант конъюгата олигопептида с цитотоксическим агентом настоящего изобретения, где цитотоксическим агентом является предпочтительный цитотоксический агент винбластин или дезацетилвинбластин, может быть описан общей формулой III, представленной ниже в которой олигoпептид является таким олигопептидом, который избирательно узнается с помощью свободного специфического антигена простаты (PSA) и способен расщепляться протеолитическим путем благодаря ферментатив 21 ной активности свободного специфического антигена простаты, и этот олигопептид включает в себя циклическую аминокислоту формулы при условии, что, по крайней мере, один Rd и Re не представлены водородом или C1-C6-алкилом,илиR19 означает водород, (C1-C3 алкил)-СО,или хлорзамещенный (C1-C3 алкил)-СО; р равно нулю или целому числу между 1 и 100;q равно 0 или 1, при условии, что если р равно нулю, то q равно 1; или фармацевтически приемлемая соль соединения. Следующие соединения представляют собой специфические примеры конъюгата олигопептида с дезацетилвинбластином настоящего изобретения или оптический изомер или фармацевтически приемлемая соль соединения."пептидами") настоящего изобретения могут быть синтезированы из составляющих их аминокислот с помощью подходящей техники пептидного синтеза, предпочтительно посредством твердофазного метода. Затем пептиды очищаются с помощью ВЭЖХ в обращенной фазе. Общепринятые способы пептидного синтеза приводятся, например, в следующих работах: Schroeder et al., "The Peptides", vol. I. Academic Press 1965; Bodansky et al., "Peptide Synthesis", Interscience Publishers, 1966; McOmiePeptide Synthesis", Second Edition, Pierce Chemical Company, 1984. Методические указания из этих работ включены в описание в виде ссылок. Соответствующая замещенная циклическая аминокислота, имеющая гидрофильный заместитель, которую можно включить в конъюгаты настоящего изобретения с помощью общепринятых способов пептидного синтеза, является сама по себе коммерчески доступной или легко синтезируется посредством хорошо известных в данной области методов или описанных в данном изобретении. Таким образом, синтез замещенных пролинов описывается в следующих статьях и ссылках, приведенных здесь:Med. Chem., 34:457-461 (1991). Методические указания из этих работ включены в описание в виде ссылок. Фармацевтически приемлемые соли соединений этого изобретения включают в себя подходящие нетоксичные соли соединений этого изобретения, которые образуются из нетоксичных неорганических или органических кислот. Например, подобные подходящие нетоксичные соли включают в себя такие, которые получены из неорганических кислот, таких как соляная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и тому подобное, и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная,глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфокислота, метансульфокислота, этандисульфокислота,щавелевая,изэтионовая,трифторуксусная и тому подобное. Конъюгаты настоящего изобретения, которые включают в себя олигопептид, содержащий участок расщепления посредством PSA, и цитотоксический агент, могут подобным образом синтезироваться способами, хорошо известны 23 ми в медицинской химии. Например, свободная аминогруппа цитотоксического агента может быть ковалентно связана с карбоксиконцевой группой олигопептида с образованием амидной связи. Подобным образом амидная связь может быть образована путем ковалентного связывания аминогруппы олигопептида и карбоксильной группы цитотоксического агента. С этой целью реагент, такой как 2-(1 Н-бензотриазол-1 ил)-1,3,3-тетраметилуроний гексафторфосфат(известный как HBTU) и гидрат 1 гидроксибензотриазола (известный как НОВТ),дициклогексилкарбодиимид (DDC), N-этил-N(3-диметиламинопропил)карбодиимид (EDC),дифенилфосфорилазид (DPPA), бензотриазол-1 ил-окси-трис-(диметиламино)фосфоний гексафторфосфат (ВОР) и тому подобное, используется в сочетании или индивидуально. Кроме того, конъюгат настоящего изобретения может быть образован посредством непептидной связи между участком расщепленияPSA и цитотоксическим агентом. Например,цитотоксический агент может быть ковалентно связан с карбоксильной концевой группой олигопептида через гидроксильную группу на цитотоксическом агенте с образованием эфирной связи. Для этой цели используется реагент, такой как сочетание HBTU и НОВТ, сочетание ВОР и имидазола, сочетание DCC и DMAP, и тому подобное. Карбоновая кислота также может быть активирована путем образования нитрофенилового эфира или тому подобное, и реагировать в присутствии DBU (1,8-диазобицикло[5,4,0]ундек-7-ен). Конъюгат настоящего изобретения может быть образован путем связывания олигопептида с цитотоксическим агентом через линкер. Подобные линкеры включают в себя, например,дирадикальный бискарбонилалкил, тем самым аминогруппа цитотоксического агента связывается с линкером с образованием амидной связи,и концевая аминогруппа олигопептида связывается с другим концом линкера также с образованием амидной связи. В противоположность этому, когда используется в качестве линкера дирадикальный диаминоалкил, то карбонильная группа цитотоксического агента ковалентно связывается с одним из аминов линкера, в то время как другой амин линкера ковалентно связывается с С-концом олигопептида. Также используются другие подобные линкеры, которые стабильны в физиологических условиях, когда не присутствует свободный PSA, но расщепляются при действии PSA на участке протеолитического расщепления. Кроме того, используется такой линкер, когда при протеолитическом расщеплении участка посредством PSA он остается связанным с цитотоксическим агентом, а цитотоксическая активность подобного цитотоксического производного агента после расщепления не снижается в значительной степени по 24 сравнению с немодифицированным цитотоксическим агентом. Специалист в данной области понимает,что в синтезе соединений согласно изобретению требуется защитить различные реактивные функциональные группы исходных соединений и промежуточных соединений, в то время как желаемая реакция выполняется на других частях молекулы. По окончании желаемых реакций или в любое желаемое время подобные защитные группы обычно удаляются, например, посредством гидролиза или гидрогенолиза. Подобные стадии защиты и снятия защиты являются обычными в органической химии. Специалисты в данной области ссылаются на ProtectiveSons, NY, NY (1981) для методических указаний в отношении защитных группировок, которые могут использоваться в приготовлении соединений настоящего изобретения. Только в качестве примера, применяемые для аминогрупп защитные группировки могут включать в себя, например, C1-C10 алканоильные группировки, такие как формильную, ацетильную, дихлорацетильную, пропиональную,гексаноильную, 3,3-диэтилгексаноильную, хлорбутильную и тому подобное; C1-C10 алкоксикарбонильные и C5-C15 арилоксикарбонильные группировки, такие как трет-бутоксикарбонильную, бензилоксикарбонильную, аллилоксикарбонильную, 4-нитробензилоксикарбонильную, флуоренилметилоксикарбонильную и циннамоилоксикарбонильную; гало-(C1-C10)алкоксикарбонильную,такую как 2,2,2 трихлорэтоксикарбонильную; и C1-C15 арилалкильные и алкенильные группировки, такие как бензильную, фенэтильную, аллильную, тритильную и тому подобное. Другими обычно используемыми для аминогрупп защитными группировками являются группировки в форме енаминов, полученных с -кетоэфирами, такими как метил- или этилацетоацетат. Группировки, применяемые для защиты карбоксильных групп, включают в себя, например, C1-C10 алкильные группировки, такие как метильную, трет-бутильную, децильную; галоC1-C10 алкильные,такие как 2,2,2 трихлорэтильную и 2-иодэтильную; C5-C15 арилалкильные, такие как бензильную, 4 метоксибензильную, 4-нитробензильную, трифенилметильную, дифенилметильную; C1-С 10 алканоилоксиметильные группировки, такие как ацетоксиметильную, пропионоксиметильную и тому подобное; и группировки, такие как фенацетильную, 4-галофенацетильную, аллильную,диметилаллильную, три-(C1-C3 алкил)силильную, а также такие как триметилсилильную, п-толуолсульфонилэтильную, -п-нитрофенилтиоэтильную, 2,4,6-триметилбензильную,25 метилтиоэтильную, фталимидометильную, 2,4 динитро-фенилсульфенильную, 2-нитробензгидрильную и родственные группировки. Подобным образом группировки, применяемые для защиты гидроксигрупп, включают в себя, например, формильную группу, хлорацеильную, бензильную, бензгидрильную, тритильную группы, 4-нитробензильную, триметилсилильную, фенацильную, трет-бутильную,метоксиметильную,тетрагидропиранильную группы и тому подобное. В отношении предпочтительного варианта олигопептида, связанного с антрациклиновым антибиотиком доксорубицином, следующие схемы реакций иллюстрируют синтез конъюгатов настоящего изобретения. Реакционная схема VI иллюстрирует получение конъюгатов, применяемых в настоящем способе лечения, в которых олигопептиды связаны с алкалоидным цитотоксическим агентом из барвинка винбластином. Присоединение Nконца олигопептида к винбластину проиллюстрировано в (S.P.Kandukuri et al. J. Med. Chem. 28:1079-1088 (1985. Реакционная схема VII иллюстрирует получение конъюгатов олигопептидов настоящего изобретения и алкалоидного цитотоксического агента из барвинка винбластина, в которых винбластин связывается с С-концом олигопептида. Далее иллюстрируется только использование в качестве линкера 1,3-диаминопропана; другие связующие элементы между карбонилом винбластина и С-концом олигопептида также находятся в поле зрения. Кроме того, схема VII иллюстрирует синтез конъюгатов, в которых гидроксигруппа в С-4-положении реацетилируется после добавления линкера. Заявители обнаружили, что конъюгат с дезацетилвинбластином также эффективен и может быть получен путем исключения стадий, показанных в реакционной схеме VII, а именно защиты первичного амина линкера и реакции промежуточного соединения с уксусным ангидридом и последующего снятия защиты с амина. Конъюгирование олигопептида при других положениях и функциональных группах винбластина может легко выполнить 27 любой специалист в данной области и, как предполагают, эти соединения также можно использовать в лечении рака простаты. Понятно, что могут быть получены такие конъюгаты, используемые в настоящем способе лечения, у которых N-конец олигопептида,включающего в себя циклическую аминокислоту с гидрофильным заместителем, связывается с одним цитотоксическим агентом, таким как винбластин, в то время как С-конец связывается с другим цитотоксическим агентом, которым может быть тот же самый агент или отличный от него цитотоксический агент, как доксорубицин. Реакционная схема VIII иллюстрирует синтез подобного конъюгата с полицитотоксическим агентом. Подобный полицитотоксический конъюгат может иметь преимущества над конъюгатом, содержащим только один цитотоксический агент. 29 Конъюгаты согласно изобретению состоящие из олигопептида и цитотоксического агента, вводятся больному в форме фармацевтической композиции, которая включает в себя конъюгат настоящего изобретения и фармацевтически приемлемый носитель, инертный наполнитель или разбавитель. Под используемым термином "фармацевтически приемлемый" подразумеваются те агенты, которые применяются в лечении или диагностике теплокровных животных, включая, например, человека, лошадь,свинью, крупный рогатый скот, мышь, собаку,кошку или других млекопитающих, а также птиц или других теплокровных животных. Предпочтительным способом введения является парентеральный, особенно внутривенный, внутримышечный, подкожный, внутрибрюшинный или внутрилимфатический способ. Подобные композиции могут быть получены с использованием носителей, разбавителей или наполнителей, известных специалистам в данной области. В этом отношении см. Remington's Pharmaceutical Sciences, 16th ed., 1980, Mack Publishing Company, edited by Osol et al. Подобные композиции могут включать в себя белки, такие как сывороточные белки, например, человеческий сывороточный альбумин, буферы или буферные вещества, такие как фосфаты, другие соли или электролиты и тому подобное. Подходящие разбавители могут включать в себя, например, стерилизованную воду, изотонический раствор соли,разбавленную водную декстрозу, многоатомный спирт или смеси подобных спиртов, например,глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное. Композиции могут содержать консерванты, такие как фенэтиловый спирт,метил и пропил парабены, тимеросал и тому подобное. Если необходимо, композиция может включать в себя примерно от 0,05% до 0,20% по весу антиоксиданта, такого как метабисульфит натрия или бисульфит натрия. Используемый термин "композиция" предполагает включение продукта, содержащего специфические ингредиенты в соответствующих количествах, а также любой продукт, который представляет собой результат, прямо или косвенно, комбинации специфических ингредиентов в соответствующих количествах. Композицию, предназначенную для внутривенного введения, предпочтительно получают таким образом, что количество введенного больному конъюгата составляет примерно от 0,01 до 1 г конъюгата. Предпочтительно, чтобы вводимое количество заключалось в пределах примерно от 0,2 до 1 г конъюгата. Конъюгаты согласно изобретению эффективны в широком диапазоне дозировок, в зависимости от таких факторов как степень заболевания, которое подвергается лечению, или биологическое действие, которое модифицируется, способ введения конъюгата, возраст, вес и состояние больного, а также другие факторы, которые должен опреде 002066 30 лять лечащий врач. Таким образом, количество введенного любому данному больному конъюгата должно определяться на индивидуальной основе. Специалистам в данной области очевидно,что хотя специфические реагенты и реакционные условия описаны в следующих примерах, в зависимости от характера и сферы изобретения могут быть внесены модификации. Следующие препараты и примеры приводятся для иллюстрирования изобретения и являются неограничивающими примерами изобретения. Примеры Пример 1. Получение олигопептидов, которые включают в себя участок расщепления посредством PSA. Защищенные олигопептиды получают путем твердофазного синтеза, используя двойной протокол для введения аминокислот на автоматический пептидный синтезатор Applied Biosystems модель 430 А. Снятие защиты и удаление пептида с носителя в колонке достигается обработкой жидкой фтористо-водородной кислотой. Олигопептиды очищают с помощью препаративной ВЭЖХ в обращенной фазе на колонке с силикагелем С 18, используя для элюции градиент водной 0,1%-ной трифтористоводородной кислоты и ацетонитрила. Идентичность и гомогенность олигопептидов подтверждают с помощью анализа аминокислотного состава, ВЭЖХ и масс-спектрального анализа,основанного на быстрой бомбардировке атомов. Олигопептиды, полученные этим способом, показаны в таблице 2. Таблица 2 ПоВремя расщепления до Пептид/конъюгат пептида след. 50% субстрата посредс DOX 4-транс-L-Нур означает транс-4-гидроксиL-пролин Дегидро-Рrо означает 3,4-дегидро-Lпролин. Пример 2. Оценка распознавания олигопептидов свободным PSA. Олигопептиды, полученные, как описано в примере 1, отдельно растворяют в буфере для расщепления посредством PSA (12 мМ трис(гидроксиметил)аминометан рН 8,0, 25 мМNaCl, 0,5 мМ CaCl2) и раствор добавляют к PSA при молярном отношении 100 к 1. Альтернативно используемый для расщепления посредствомPSA буфер представляет собой 50 мМ трис(гидроксиметил)аминометан рН 7,4, 140 мМ NaCl. Реакцию останавливают через разные интервалы времени путем добавления ТФУ до конечной концентрации 1% (объем/объем). Или же реакцию останавливают 10 мМ ZnCl2. Реакционную смесь анализируют с помощью ВЭЖХ с обращенной фазой на колонке с силикагелем С 18, используя градиент водного 0,1%=ной ТФУ и ацетонитрила. Результаты определения показаны в таблице 2. Таблица 2 показывает время (в минутах), требуемое для расщепления 50% упомянутых олигопептидов посредством ферментативно активного свободного PSA. Олигопептиды, содержащие свободные аминогруппы (т.е. включающие hArg, Orn, Lys, или 3PAL), тестируют как соли ТФУ. Все другие олигопептиды тестируют как нейтральные соединения. Пример 3. Получение [N-Ac-(4-тpaнс-LHyp)]-Ala-Ser-Chg-Gln-Ser-Leu-Dox (последовательность 68) Стадия A: [N-Ас-(4-транс-L-Нур(Вzl]-AlaSer(Bzl)Chg-Gln-Ser(Bzl)Leu-PAM смола (3-1). Начиная с 0,5 ммоль (0,67 г) Boc-Leu-PAM смолы, защищенный пептид синтезируют на пептидном синтезаторе типа 430 А ABI. По условиям реакции используют 4-кратный избыток(2 ммоль) каждой следующей защищенной аминокислоты: Boc-Ser(Bzl), Boc-Gln, Boc-Chg,Boc-Ala, N-Boc-(4-транс-L-Нур(Bzl. Связывание достигается путем активации с помощьюDCC и НОВТ в метил-2-пирролидиноне. Уксусную кислоту используют для введения Nконцевой ацетильной группы. Удаление Восгруппы выполняют, используя 50%-ную ТФУ в метиленхлориде и соль ТФУ нейтрализуют диизопропилэтиламином. По окончании синтеза смолу с пептидом высушивают и получают промежуточное соединение 3-1. Стадия В: [N-Ac-(4-тpaнс-L-Hyp)]-Ala-SerChg-Gln-Ser-Leu-OH (3-2). Смолу с защищенным пептидом (3-1), 1,2 г обрабатывают фтористо-водородной кислотой(20 мл) в течение 1 ч при 0 С в присутствии анизола (2 мл). После упаривания фтористоводородной кислоты, остаток промывают эфиром, фильтруют и экстрагируют водой (200 мл). Фильтрат лиофилизируют и получают промежуточное соединение (3-2). Стадия С: [N-Ac-(4-тpaнс-L-Hyp)]-Ala-SerChg-Gln-Ser-Leu-Dox. 32 Вышеописанное промежуточное соединение (3-2), 1,157 г (1,45 ммоль) растворяют в диметилсульфоксиде (DMSO) (30 мл) и разбавляют DMF (30 мл). К этому раствору добавляют гидрохлорид доксорубицина, 516 мг (0,89 ммоль) с последующим добавлением 0,310 мл диизопропилэтиламина (DIEA) (1,78 ммоль). Раствор охлаждают (0 С) при перемешивании и добавляют 0,276 мл дифенилфосфорилазида(DPPA) (1,28 ммоль). Через 30 мин дополнительно добавляют 0,276 мл (1,28 ммоль) DPPA и доводят рН до 7,5 (по рН-бумаге) с помощьюDIEA. рН охлажденной реакционной смеси(0 С) поддерживают при 7,5 с помощью DIEA в течение следующих 3-х ч, и реакционную смесь перемешивают при 0-4 С в течение ночи. После 18 ч реакционную смесь (установлено с помощью аналитической ВЭЖХ, система А, что реакция завершается) концентрируют до консистенции масла. Очистку сырого продукта проводят с помощью препаративной ВЭЖХ, буфер А=0,1% NН 4 ОАс-вода; В=СН 3 СN. Сырой продукт растворяют в 400 мл 100% буфера А,фильтруют и очищают с помощью ВЭЖХ с обращенной фазой на ротационной компрессионной колонке (Waters, Delta-Pak, 15 мкМ, 100). Используют ступенчатый градиент от 100% А до 60% А при скорости потока 75 мл/мин Анализ аминокислотного состава 1: Теоретический Найдено Аlа (1) 1,00 В таблице 3 представлены другие конъюгаты пептида с доксорубицином, которые получают по описанным в примере 3 способам, но с использованием соответствующих аминокислотных остатков и блокировки группы ацилирования. Таблица 3 Время расщепления По 50% субПептид/конъюгат пептида с DOX след страта по средством Стадия A: [N-глутарил(ОFm)-(4-транс-LНур)]-Аlа-Ser-Сhg-Gln-Ser-Leu-PAM (смола). Начиная с 0,5 ммоль (0,67 г) Boc-Leu-PAM смолы, защищенный пептид синтезируют на пептидном синтезаторе типа 430 А ABI. По условиям реакции используют 4-кратный избыток(2 ммоль) каждой следующей защищенной аминокислоты: Fmoc-Ser(tBu), Fmoc-Gln(Trt), FmocChg, Fmoc-Ala, Воc-(4-транс-L-Нур). Связывание достигается путем активации с помощьюDCC и НОВТ в метил-2-пирролидиноне. Промежуточное соединение флуорениловый эфир глутаровой кислоты [глутарил(OFm)] используют для введения N-концевой глутарильной группы. Удаление Fmoc группы выполняют с применением 20%-ного пиперидина. Группировки, защищающие карбоксильные группы,Воc, Trt и tBu, удаляют обработкой 50%-ной ТФУ в метиленхлориде. Соль ТФУ нейтрализуют диизопропилэтиламином. По окончании синтеза смолу с пептидом высушивают с получением соединения, указанного в заглавии. Стадия В: [N-глутарил(OFm)-(4-тpaнс-LHyp)]-Ala-Ser-Chg-Gln-Ser-Leu-OH. 34 Смолу с защищенным пептидом из стадии А, 1,2 г, обрабатывают HF (20 мл) в течение 1 ч при 0 С в присутствии анизола (2 мл). После упаривания HF остаток промывают эфиром,фильтруют и экстрагируют DMF. Экстракт (75 мл) концентрируют досуха и растирают с водой в порошок. Нерастворимый продукт фильтруют и высушивают с получением соединения, указанного в заглавии. Стадия С: [N-глутарил(ОFm)-(4-транс-LНур)]-Аlа-Ser-Сhg-Gln-Ser-Leu-Dox. Полученное выше промежуточное соединение из стадии В (1,33 г, 1,27 ммоль) растворяют в DMSO (6 мл) и DMF (69 мл). К раствору добавляют гидрохлорид доксорубицина, 599 г(1,03 ммоль), а затем добавляют 376 мкл диизопропилэтиламина (2,16 ммоль). Раствор при перемешивании охлаждают (0 С) и добавляют 324 мкл дифенилфосфорилазида (DPPA) (1,5 ммоль). После 30 мин добавляют дополнительно 324 мкл DPPA и доводят рН до 7,5 (по рНбумаге) с помощью диизопропилэтиламина(DIEA). рН охлажденной (0 С) реакционной смеси поддерживают при 7,5 с DIEA в течение следующих 3 ч, и смесь перемешивают при 04 С в течение ночи. После 18 ч реакционную смесь (окончание реакции контролируют с помощью аналитической ВЭЖХ, система А) концентрируют и получают соединение, указанное в заглавии, в виде масла. Стадия D: [N-глутарил-(4-тpaнс-L-Hyp)]Ala-Ser-Chg-Gln-Ser-Leu-Dox. Вышеупомянутый продукт из стадии С растворяют в DMF (54 мл), охлаждают (0 С) и добавляют 14 мл пиперидина. Раствор концентрируют досуха, и остаток очищают с помощью препаративной ВЭЖХ. (А=0,1% NН 4 ОАс-вода; В=СН 3 СN). Сырой продукт растворяют в 100 мл 80%-ного буфера А, фильтруют и очищают с помощью ВЭЖХ на силикагеле С 18 в обращенной фазе на ротационной компрессионной колонке (Waters, Delta-Pak, 15 микрон, 100). Для элюции используют ступенчатый градиент от 80% А до 67% А при скорости потока 75 мл/мин(оценено с помощью ВЭЖХ, система А) объединяют и лиофилизируют. Далее продукт очищают, используя вышеупомянутую колоночную ВЭЖХ. Буфер А=15% уксусная кислота-вода; В=15% уксусная кислота-метанол. Продукт растворяют в 100 мл смеси буферов 20% В и 80% А. Для элюции используют ступенчатый градиент от 20% В до 80% В при скорости потока 75 мл/мин (УФ=260 нм). Гомогенные фракции продукта (оценено с помощью ВЭЖХ, система А) объединяют, концентрируют и лиофилизируют с получением очищенного соединения,указанного в заглавии.Vydac 15 см 218 ТР 5415, С 18 Градиент от 95:5 (А: В) до 5:95 (А:В) в течение 45 мин. А=0,1% ТФУ/вода,В=0,1% ТФУ ацетонитрил Скорость потока: 1,5 мл/мин Длина волны: 214 нм, 254 нм Время удерживания: Доксорубицин=13,66 мин Анализ аминокислотного состава 1: Теоретический Аlа (1)Gln превращается в Glu В таблице 4 представлены другие конъюгаты пептида с доксорубицином, полученные по описанным в примере 4 способам, но использующие соответствующие аминокислотные остатки и блокировку групп ацетилированием. Таблица 4 Последовательность Стадия A: Fmoc-(4-транс-L-Hyp(Bzl)-AlaSer(Bzl)Chg-Gln-Ser(Bzl)Leu-PAM смола. Начиная с 0,5 ммоль (0,67 г) Boc-Leu-PAM смолы, защищенный пептид синтезируют на пептидном синтезаторе типа 430 А ABI. По условиям реакции используют 4-кратный избыток(2 ммоль) каждой следующей защищенной аминокислоты: Boc-Ser(Bzl), Boc-Gln, Boc-Chg,Boc-Ala, N-Boc-(4-транс-L-Нур(Вzl. Связывание достигается путем активации с помощьюDCC и НОВТ в метил-2-пирролидиноне. FmocOSu активации с помощью DCC и НОВТ в метил-2-пирролидиноне. Fmoc-Osu (сукцинамидный эфир Fmoc) используют для введения Nконцевой защитной группы. Удаление Воc группы выполняют с использованием 50%=ной ТФУ в метиленхлориде и соль ТФУ нейтрализуют диизопропилэтиламином. По окончании синтеза смолу с пептидом высушивают и получают промежуточное соединение, указанное в заглавии. Стадия В: Fmoc-(4-транс-L-Нур)-Ala-SerChg-Gln-Ser-Leu-OH. Смолу с защищенным пептидом из стадии А, 1,1 г, обрабатывают HF (20 мл) в течение 1 ч при 0 С в присутствии анизола (2 мл). После упаривания HF остаток промывают эфиром,фильтруют и экстрагируют водой (200 мл). Фильтрат лиофилизируют с получением промежуточного соединения, указанного в заглавии. Стадия С: Fmoc-(4-транс-L-Нур)-Ala-SerChg-Gln-Ser-Leu-Dox. Промежуточное соединение из стадии В,0,274 г, растворяют в DMSO (10 мл) и разбавляют DMF (10 мл). К раствору добавляют гидрохлорид доксорубицина, 104 мг, с последующим добавлением 62 мкл диизопропилэтиламина. Раствор охлаждают (0 С) при перемешивании и добавляют 56 мкл дифенилфосфорилазида(DPPA). После 30 мин добавляют дополнительно 56 мкл DPPA и доводят рН до 7,5 (по рНбумаге) с помощью диизопропилэтиламина(DIEA). рН охлажденной (0 С) реакционной смеси поддерживают при 7,5 с помощьюDIEA. После 4 ч реакционную смесь (окончание реакции контролируют с помощью ВЭЖХ, система А) концентрируют до консистенции масла. Условия ВЭЖХ, система А Стадия D: (4-транс-L-Hyp)-Ala-Ser-ChgGln-Ser-Leu-Dox. Вышеупомянутый продукт из стадии С растворяют в DMF (10 мл), охлаждают (0 С) и добавляют 4 мл пиперидина. Раствор концен 37 трируют досуха и очищают с помощью препаративной ВЭЖХ. (А=0,1% NН 4OАс-вода;B=CH3CN). Сырой продукт растворяют в 100 мл 90%=ного буфера А, фильтруют и очищают с помощью ВЭЖХ с силикагелем С 18 в обращенной фазе на ротационной компрессионной колонке (Waters, Delta-Pak, 15 микрон, 100). Для элюции используют ступенчатый градиент от 90% А до 65% А при скорости потока 75 мл/мин Анализ аминокислотного состава 1: Теоретический Найдено А 1 а (1) 1,00 Пример 6. Оценка распознавания конъюгатов олигопептида с доксорубицином с помощью свободного PSA. Конъюгаты, полученные как описано в примерах 3-5, отдельно растворяют в буфере для расщепления посредством PSA (12 мМ трис(гидроксиметил)аминометан рН 8,0, 25 мМNaCl, 0,5 мМ CaCl2) и раствор добавляют к PSA при молярном отношении 100 к 1. Или же используемый для расщепления посредством PSA буфер представляет 50 мМ трис(гидроксиметил) аминометан рН 7,4, 140 мМ NaCl. Реакцию останавливают после разных интервалов времени путем добавления ТФУ до конечной концентрации 1% (объем/объем). Или же реакцию оста 002066 38 навливают 10 мМ ZnCl2. Реакционную смесь анализируют с помощью ВЭЖХ в обращенной фазе на колонке с силикагелем С 18, используя градиент водного 0,1%-ной ТФУ и ацетонитрила. Результаты определения показаны в таблице 3. Таблица 3 показывает время (в минутах), требуемое для расщепления 50% упомянутых конъюгатов олигопептида с цитотоксическим агентом посредством ферментативно активного свободного PSA. Если соль не указана для конъюгата, то тестируют свободный конъюгат. Конъюгаты олигопептида с цитотоксическим агентом, описанные в примерах 4 и 5, оценивали на время (в минутах), требуемое для расщепления 50% oлигопептида посредством ферментативно активного свободного PSA и 50% расщепления достигается для этих конъюгатов менее,чем за 2 часа. Пример 7. Анализ цитотоксичности пептидных производных доксорубицина in vitro. Цитотоксичность конъюгатов расщепляемого олигопептида с доксорубицином, полученных как описано в примерах 3 и 4, по отношению к линии клеток, которые, как известно, погибают при действии немодифицированного доксорубицина, проверяли с помощью анализаAlamar Blue. В частности, культуру опухолевых клеток простаты LNCap (которая экспрессирует ферментативно активный PSA) или клетки DuPRO в 96-луночном планшете разбавляют средой (минимально поддерживающая средаДульбекко [МЕМ-]), содержащей различные концентрации данного конъюгата (конечный объем лунки планшета составляет 200 мкл). Клетки инкубируют в течение 3 дней при 37 С,добавляют в лунку 20 мкл Alamar Blue. Далее клетки инкубируют и анализируемые планшеты прочитывают на аппарате для прочтения планшетов типа EL-310 ELISA при двух длинах волн 570 и 600 нм при 4 и 7 ч после добавленияAlamar Blue. Затем вычисляют относительный процент жизнеспособности при разных концентрациях конъюгата против контрольных культур (без конъюгата). Результаты этого определения показаны в таблице 5. Если соль не указана, то тестируют свободный конъюгат. Таблица 5 Последовательность Пример 8. Эффективность конъюгатов пептида с цитотоксическим агентом in vivo. Клетки LNCaP.FGC или DuPRO-1 обрабатывают трипсином, ресуспендируют в ростовой среде и центрифугируют в течение 6 мин при 200 хg. Клетки ресуспендируют в свободной от сыворотки среде МЕМ- и считают. Соответствующий объем этого раствора, содержащего нужное число клеток, затем переносят в коническую центрифужную пробирку, центрифугируют как ранее и ресуспендируют в соответствующем объеме охлажденной смеси 1:1 МЕМи Матригеля (Collaborative Biomedical Products,New Bedford, Mass.). Суспензию держат на льду до тех пор, пока не инокулируют животных. Мышей самцов Harlan Sprague Dawley (1012 недель) держат без анестезии и инокулируют посредством 0,5 мл клеточной суспензии на левом боку путем подкожного введения с помощью иглы 22G. Мышам вводили либо 5 х 105 клетокLNCaP.FGC. После инокуляции опухолевыми клетками мышей обрабатывают согласно одному из двух протоколов. Протокол А: через день после клеточной инокуляции животным вводят внутрибрюшинным путем 0,1-0,5 мл тестируемого конъюгата,доксорубицина или контроля (стерильной воды). Дозировки конъюгата и доксорубицина вначале составляют максимальное нелетальное количество, однако могут последовательно снижаться. Одинаковые дозы вводятся при 24 часовом интервале в течение 5 дней. После 10 дней, у мышей берут образцы крови и в сыворотке определяют уровень PSA. Подобные уровни PSA сыворотки определяют при 5-10 дневных интервалах. В конце 5,5 недель мышей забивают и измеряют вес любых имеющихся опухолей и вновь определяют уровень PSA сыворотки. Вес животных определяют в начале и конце анализа. Протокол В: через 10 дней после клеточной инокуляции у животных отбирают образцы крови и определяют уровни PSA сыворотки. Затем животных группируют согласно уровнямPSA сыворотки. Через 14-15 дней после клеточной инокуляции животным вводят внутрибрюшинным путем 0,1-0,5 мл тестируемого конъюгата, доксорубицина или контроля (стерильной воды). Одинаковые дозы вводятся при 24 часовом интервале в течение 5 дней. УровниPSA сыворотки определяют при 5-10-дневных интервалах. В конце 5,5 недель мышей забивают и измеряют вес любых имеющихся опухолей и вновь определяют уровень PSA сыворотки. Вес животных определяют в начале и конце анализа. Протокол С: через день после клеточной инокуляции животным вводят внутрибрюшинным путем 0,1-0,5 мл тестируемого конъюгата,доксорубицина или контроля (стерильной воды). Дозировки конъюгата и доксорубицина вначале составляют максимальное нелетальное количество, однако могут последовательно снижаться. Одинаковые дозы вводятся при 7 дневных интервалах в течение 5 последовательных недель. Уровни PSA сыворотки определяют 40 немедленно до или во время забоя мышей. В конце 5,5 недель мышей забивают и измеряют вес любых имеющихся опухолей и вновь определяют уровень PSA сыворотки. Вес животных определяют в начале и конце анализа. Пример 9. Определение протеолитического расщепления конъюгатов посредством эндогенных протеаз, но не PSA, in vitro. Стадия А: приготовление тканевых экстрактов, обладающих протеолитической активностью. Все процедуры выполняют при 4 С. Подходящих животных забивают и удаляют соответствующие ткани и хранят в жидком азоте. Замороженную ткань измельчают в порошок,используя ступку и пестик, и порошкообразную ткань переносят в гомогенизатор типа PotterElvejeh и добавляют 2 объема буфера А (50 мМ триса, содержащего 1,15% KCl, pH 7,5). Ткань разрушают 20-ю ходами поршня, используя вначале неплотно прилегающий пестик, а затем плотно прилегающий пестик. Гомогенат центрифугируют при 10,000 хg в качающемся бакетном роторе (НВ 4-5), осадок отбрасывают и супернатант центрифугируют при 100,000 хg (Ti 70). Супернатант (цитозоль) сохраняют. Осадок ресуспендируют в буфере В (10 мМ EDTA, содержащей 1,15% KCl, pH 7,5), используя тот же объем, что используют выше с буфером А. Суспензию гомогенизируют вdounce-гомогенизаторе и раствор центрифугируют при 100,000xg. Супернатант отбрасывают и осадок (мембранный) ресуспендируют в буфере С (10 мМ буфера калий фосфатного, содержащего 0,25 М сахарозы, pH 7,4), используя 1/2 объема, используемого выше, и гомогенизируют в dounce-гомогенизаторе. Содержание белка в двух растворах (цитозольном и мембранном) определяют, используя метод Бредфорда. Анализируемые аликвоты затем удаляют и замораживают в жидком азоте. Аликвоты хранят при -70 С. Стадия В: определение протеолитического расщепления. Для каждой временной точки 20 мкг конъюгата пептида с доксорубицином и 150 мкг тканевого белка, полученного как описано в стадии А и определенного по Бредфорду в реакционном буфере, помещают в раствор буфера(50 мМ Триса, 140 мМ NaCl, pH 7,2) с конечным объемом 200 мкл. Реакцию проводят в течение 0, 30, 60, 120 и 180 мин и затем останавливают немедленно погружением на 90 с в кипящую воду. Продукты реакции анализируют с помощью ВЭЖХ, используя колонку VYDAC C18 15 см и элюирующий раствор вода/ацетонитрил (от 5 до 50% ацетонитрила свыше 30 мин). Перечень последовательностей(II) Название изобретения: конъюгаты, используемые в лечении рака предстательной железы(2) Информация для последовательности 1:(2) Информация для последовательности 2:(2) Информация для последовательности 3:(2) Информация для последовательности 4:(2) Информация для последовательности 5:(2) Информация для последовательности 6:(2) Информация для последовательности 7:(2) Информация для последовательности 8:(2) Информация для последовательности 9:(2) Информация для последовательности 10:(2) Информация для последовательности 11:(2) Информация для последовательности 12:(2) Информация для последовательности 13:(2) Информация для последовательности 14:(2) Информация для последовательности 15:(2) Информация для последовательности 16:(2) Информация для последовательности 17:(2) Информация для последовательности 18:(2) Информация для последовательности 19:(2) Информация для последовательности 20:(2) Информация для последовательности 21:(2) Информация для последовательности 22:(2) Информация для последовательности 23:(2) Информация для последовательности 24:(2) Информация для последовательности 25:(D) Другая информация: циклическая аминокислота, замещенная гидрофильной группировкой А) Имя/ключ: Другое(2) Информация для последовательности 26:(2) Информация для последовательности 27:(2) Информация для последовательности 28:(2) Информация для последовательности 29:(2) Информация для последовательности 30:(2) Информация для последовательности 31:(2) Информация для последовательности 32:(2) Информация для последовательности 33:(2) Информация для последовательности 34(2) Информация для последовательности 35:(2) Информация для последовательности 36:(2) Информация для последовательности 37:(2) Информация для последовательности 38:(2) Информация для последовательности 39:(2) Информация для последовательности 40:(2) Информация для последовательности 41:(2) Информация для последовательности 42:(2) Информация для последовательности 43:(2) Информация для последовательности 44:(2) Информация для последовательности 45:(2) Информация для последовательности 46:(2) Информация для последовательности 47:(2) Информация для последовательности 48:(2) Информация для последовательности 49:(2) Информация для последовательности 50:(2) Информация для последовательности 51:(2) Информация для последовательности 52:(2) Информация для последовательности 53:(2) Информация для последовательности 54:(2) Информация для последовательности 55:(2) Информация для последовательности 56:(2) Информация для последовательности 57:(2) Информация для последовательности 58:(2) Информация для последовательности 59:(2) Информация для последовательности 60:(2) Информация для последовательности 61:(2) Информация для последовательности 62:
МПК / Метки
МПК: A61P 13/08, A61K 47/48
Метки: конъюгаты, рака, предстательной, лечении, железы, используемые
Код ссылки
<a href="https://eas.patents.su/30-2066-konyugaty-ispolzuemye-v-lechenii-raka-predstatelnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты, используемые в лечении рака предстательной железы</a>
Предыдущий патент: Цветной магнитный тонер и способ его изготовления
Следующий патент: Чрескожная терапевтическая система
Случайный патент: Способ определения ориентации датчика для электромагнитной разведки












