Усеченные рецепторы фактора некроза опухолей, фармацевтические композиции на их основе и способы применения указанных факторов и композиций
Формула / Реферат
1. Усеченный рецептор фактора некроза опухолей (sTNFR), имеющий следующую формулу: R1-[Cys19-Cys103]-R2, где [Cys19-Cys103] представляет собой аминокислотные остатки с 19 по 103 sTNFR-I последовательности SEQ ID NO:2, приведенной на фиг. 1, R1 обозначает метионилированную или неметионилированную аминогруппу Cys19, или аминоконцевой аминокислотный остаток, или последовательность, выбранные из группы, включающей

a R2 обозначает карбоксигруппу Cys103 или карбоксиконцевой аминокислотный остаток или последовательность, выбранные из группы
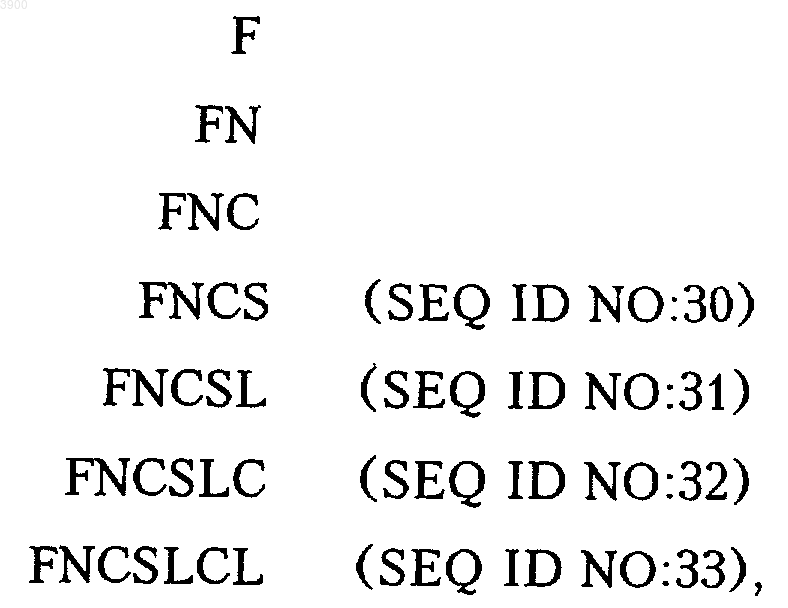
или его варианты и производные, полученные, как раскрыто в описании, причем когда R1 обозначает метионилированную или неметионилированную аминогруппу аминокислотной последовательности VCPQGKYIHPQNNSIC или ее N-концевого усеченного на 1-15 остатков варианта, то R1-[Cys19-Cys103]-R2 не является дополнительным вариантом с формулой R1-[Cys19-Cys103]-FCCSLCL-R3, где R3 обозначает карбоксильную группу аминокислотной последовательности Asn111-Asn161, приведенной на фиг. 1, или усеченного по карбоксиконцевому участку варианта последовательности Asn111-Asn161, приведенной на фиг. 1.
2. Усеченный рецептор фактора некроза опухолей по п.1, выбранный из группы, включающей

3. Усеченный рецептор фактора некроза опухолей (sTNFR), имеющий следующую формулу: R4-[Cys32-Cys115]-R5, где [Cys32-Cys115] представляет собой аминокислотные остатки от Cys32 до Cys115 последовательности SEQ ID NO:35, приведенной на фиг. 8, R4 обозначает метионилированную и неметионилированную аминогруппу Cys32 или аминоконцевой аминокислотный остаток или последовательность, выбранные из группы, включающей

![]()
а R5 обозначает карбоксигруппу Cys115 или карбоксиконцевой аминокислотный остаток или последовательность, выбранные из группы, включающей
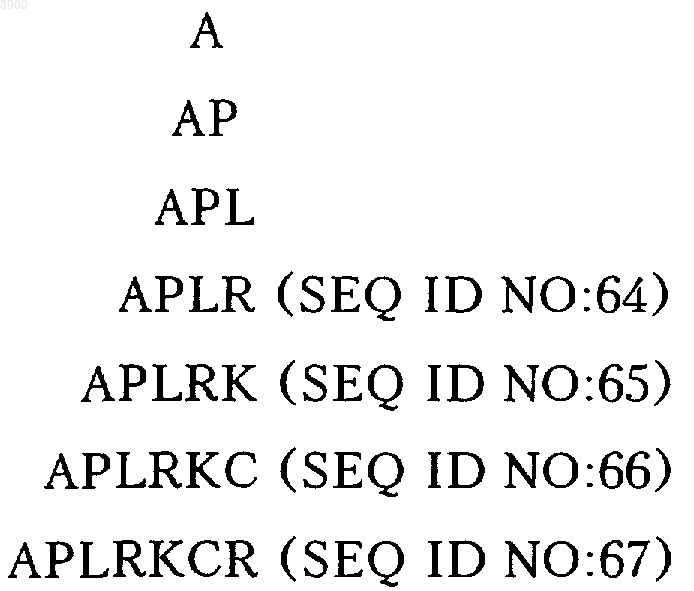
или его варианты и производные, полученные, как раскрыто в описании, причем когда R4 обозначает метионилированную или неметионилированную аминогруппу аминокислотной последовательности TCRLREYYDQTAQMC или ее N-концевого усеченного на 1-15 остатков варианта, то R4-[Cys32-Cys115]-R5 не является дополнительным вариантом с формулой R4-[Cys32-Cys115]-APRLKCR-R6, где R6 обозначает карбоксильную группу аминокислотной последовательности Pro123-Thr179, приведенной на фиг. 8, или усеченного по карбоксиконцевому участку варианта последовательности Pro123-Thr179, приведенной на фиг. 8.
4. Усеченный рецептор фактора некроза опухолей по любому из пп.1-3, отличающийся тем, что имеет негликозилированную аминокислотную последовательность.
5. Усеченный рецептор фактора некроза опухолей по любому из пп.1-3, отличающийся тем, что имеет гликозилированную аминокислотную последовательность.
6. Усеченный рецептор фактора некроза опухолей по любому из пп.1-5, отличающийся тем, что он конъюгирован с водорастворимым полимером.
7. Усеченный рецептор фактора некроза опухолей по п.6, отличающийся тем, что водорастворимый полимер представляет собой полиэтиленгликоль.
8. Поливалентный рецептор фактора некроза опухолей, содержащий по меньшей мере один из рецепторов, по любому из пп.1-7.
9. Поливалентный рецептор фактора некроза опухолей по п.8, отличающийся тем, что он содержит димер усеченного рецептора по п.3.
10. Поливалентный рецептор фактора некроза опухолей по п.8, имеющий формулу R1-X-R2, где X обозначает линкер, причем указанный линкер является водорастворимым полимером, и R1 и R2 являются биологически активными молекулами, ковалентно связанными с указанным водорастворимым полимером, при том, что по меньшей мере один из компонентов R1 и R2 представляет собой усеченный рецептор фактора некроза опухолей по любому из пп.1-5.
11. Поливалентный рецептор по п.10, отличающийся тем, что водорастворимый полимер является полиэтиленгликолем.
12. Поливалентный рецептор по п.11, отличающийся тем, что усеченный рецептор выбран из группы, включающей sTNFR-I 2.6 D/C105db иsTNFR-I 2.6 D/C106db.
13. Полинуклеотид, кодирующий рецептор фактора некроза опухолей по любому из пп.1-3, выбранный из группы, включающей
полинуклеотид с последовательностью, представленной на фиг. 2 (SEQ ID NO:3);
полинуклеотид с последовательностью, представленной на фиг. 3 (SEQ ID NO:5);
полинуклеотид с последовательностью, представленной на фиг. 4 (SEQ ID NO:7);
полинуклеотид с последовательностью, представленной на фиг. 5 (SEQ ID NO:11);
полинуклеотид с последовательностью, представленной на фиг. 6 (SEQ ID NO:9);
полинуклеотид с последовательностью, представленной на фиг. 7 (SEQ ID NO:13);
полинуклеотид с последовательностью, которая вырождена по отношению к кодирующим областям указанных последовательностей.
14. Вектор, содержащий полинуклеотид по п.13, функционально связанный с последовательностью, контролирующей экспрессию.
15. Штамм прокариотической клетки-хозяина, содержащий полинуклеотид по п.13 или вектор по п.14.
16. Штамм эукариотической клетки-хозяина, содержащий полинуклеотид по п.13 или вектор по п.14.
17. Способ получения усеченного рецептора фактора некроза опухолей, предусматривающий выращивание штаммов клеток-хозяев по п.15 или 16 в условиях, обеспечивающих экспрессию указанного усеченного рецептора фактора некроза опухолей (sTNFR) клетками-хозяевами, и выделение его.
18. Способ по п.17, отличающийся тем, что указанные клетки-хозяева являются клетками E.coli.
19. Способ по п.17, отличающийся тем, что указанные клетки-хозяева являются клетками яичника китайского хомячка.
20. Усеченный рецептор фактора некроза опухолей по любому из пп.1-7, отличающийся тем, что он получен рекомбинантным методом.
21. Способ получения фармацевтической композиции, заключающийся в том, что терапевтически эффективное количество рецептора фактора некроза опухолей по любому из пп.1-7 или 20 или поливалентный рецептор фактора некроза опухолей по пп.8-12, смешивают с одним или несколькими фармацевтически приемлемыми носителями.
22. Фармацевтическая композиция, содержащая усеченный рецептор фактора некроза опухолей по любому из пп.1-7 или 20, в сочетании с фармацевтически приемлемым носителем.
23. Фармацевтическая композиция, содержащая поливалентный рецептор фактора некроза опухолей по любому из пп.8-12, в сочетании с фармацевтически приемлемым носителем.
24. Фармацевтическая композиция по п.22 или 23, отличающаяся тем, что она является композицией непрерывного высвобождения.
25. Фармацевтическая композиция по любому из пп.22-24, отличающаяся тем, что она лиофилизирована.
26. Способ лечения TNF-обусловленных заболеваний, предусматривающий введение больному усеченного рецептора фактора некроза опухолей по любому из пп.1-7 или 20 или поливалентного рецептора по любому из пп.8-12.
27. Способ по п.26, отличающийся тем, что TNF-обусловленное заболевание представляет собой диабет, гиперальгезию, воспалительное заболевание кишечника, ишемическое и реперфузионное повреждение или ревматические заболевания.
28. Способ по п.27, отличающийся тем, что ревматическое заболевание выбрано шч группы, включающей ревматоидный артрит, остеоартрит, ювенильный артрит, анкилозирующий спондилит, дерматомиозит, псориатический артрит, склеродермию, синдром Шегрена и васкулит.
29. Способ по любому из пп.26-28, отличающийся тем, что усеченный или поливалентный рецептор фактора некроза опухолей вводятся внутривенно, внутримышечно, внутрикожно, подкожно, внутрисуставно или вливанием.
30. Способ по любому из пп.26-29, отличающийся тем, что усеченный или поливалентный рецептор фактора некроза опухолей вводится до, совместно или после введения противовоспалительного средства.
31. Способ по п.30, отличающийся тем, что противовоспалительное средство выбирают из группы, включающей нестероидные противовоспалительные средства, кортикостероиды, медленнодействующие противоревматические препараты и препараты, модифицирующие заболевание.
32. Способ по п.30, отличающийся тем, что противовоспалительным средством является ингибитор интерлейкина-1 (IL-1), выбранный из антагониста рецептора интерлейкина-1 (IL-1ra) или растворимого IL-1 рецептора.
33. Применение усеченного рецептора фактора некроза опухолей по пп.1-7 или 20 или поливалентного рецептора по пп.8-12 для приготовления препарата для лечения TNF-обусловленных заболеваний.
34. Применение усеченного рецептора фактора некроза опухолей по пп.1-7 или 20 или поливалентного рецептора по пп.8-12 для приготовления препарата для лечения диабета, гиперальгезии, воспалительного заболевания кишечника, ишемических и реперфузионных повреждений и ревматических заболеваний.
35. Применение по п.34, отличающееся тем, что ревматическое заболевание выбрано из группы, включающей ревматоидный артрит, остеоартрит, ювенильный артрит, анкилозирующий спондилит, дерматомиозит, псориатический артрит, склеродермию, синдром Шегрена и васкулит.
36. Применение по любому из пп.33-35, при котором указанный препарат вводится внутривенно, внутримышечно, внутрикожно, подкожно, внутрисуставно или вливанием.
37. Применение по любому из пп.33-36, при котором указанный препарат вводится до, совместно или после введения противовоспалительного средства.
38. Применение по п.37, при котором противовоспалительное средство выбирается из группы, включающей нестероидные противовоспалительные средства кортикостероиды, медленнодействующие противоревматические препараты и препараты, модифицирующие заболевание.
39. Применение по п.37, при котором противовоспалительное средство является ингибитором интерлейкина-1 (IL-1), выбранным из антагониста рецептора интерлейкина-1 (IL-1ra) или растворимого IL-1 рецептора.
40. Набор для получения водных белковых композиций, содержащий первый контейнер с рецептором фактора некроза опухолей по любому из пп.1-7 и второй контейнер с физиологически приемлемым растворителем.
41. Способ по п.31, отличающийся тем, что противовоспалительным средством является метотрексат.
42. Применение по п.38, отличающееся тем, что противовоспалительным средством является метотрексат.
43. Фармацевтическая композиция по любому из пп.22-25, отличающаяся тем, что дополнительно включает противовоспалительное средство.
44. Фармацевтическая композиция по п.43, отличающаяся тем, что противовоспалительное средство выбрано из нестероидных противовоспалительных средств, кортикостероидов, медленно действующих противоревматических препаратов и препаратов, модифицирующих заболевание.
45. Фармацевтическая композиция по п.44, отличающаяся тем, что противовоспалительным средством является метотрексат.
46. Фармацевтическая композиция по п.43, отличающаяся тем, что противовоспалительным средством является ингибитор интерлейкина-1 (IL-1), выбранный из антагониста рецептора интерлейкина-1 (IL-1ra) или растворимого IL-1 рецептора.
47. Фармацевтическая композиция по п.46, отличающаяся тем, что антагонист рецептора интерлейкина-1 (IL-1ra) содержит последовательность человеческого белка IL-1ra.
Текст
1 Область, к которой относится изобретение Настоящее изобретение относится к области терапии воспаления. Более конкретно настоящее изобретение относится к усеченным рецепторам фактора некроза опухолей(sTNFRs). Предпосылки изобретения Воспаление - защитная реакция организма в ответ на механические повреждения, инфекцию или антигенную стимуляцию. Воспалительная реакция может протекать по патологическому типу; когда она запущена неадекватным стимулом, таким как аутоантиген, то развивается необычным образом или продолжается после устранения повреждающих агентов. При том что этиология воспаления изучена слабо, в последнее время получен большой объем информации о молекулярных аспектах воспаления. Эти исследования привели к идентификации отдельных цитокинов, которые активно участвуют в медиации воспаления. Цитокинами называют внеклеточные белки, которые модифицируют поведение клеток, в особенности тех клеток, которые находятся вблизи области синтеза и высвобождения цитокинов. Факторы некроза опухолей (TNFs) представляют собой класс цитокинов, продуцируемых клетками различных типов, включая моноциты и макрофаги. Ранее было описано по меньшей мере дваTNFs, в частности, TNF-альфа (TNF-) и TNFбета (TNF- или лимфотоксин), каждый из которых активен в виде трехмерной молекулы и инициирует передачу клеточного сигнала, связываясь с перекрестными рецепторами (Engelmann et al., (1990) J.Biol.Chem., 265:1449714504). Ряд данных свидетельствует о роли TNFи TNF- как главных цитокинов воспаления. Эти известные TNFs оказывают важное физиологическое воздействие на многочисленные и различные клетки-мишени, участвующие в воспалительном ответе на такие различные стимулы, как инфекция и повреждение. Эти белки стимулируют фибробласты и синовиальные клетки к секреции латентной коллагеназы и простагландина Е 2, а также стимулируют остеоцитные клетки к резорбции кости. Эти белки повышают поверхностные адгезивные свойства эндотелиальных клеток по отношению к нейтрофилам. Они также индуцируют генерацию эндотелиальными клетками коагулирующей активности и снижают их способность лизировать тромбы. Кроме того, они "перенацеливают" активность адипоцитов с запасания липидов посредством подавления экспрессии фермента липопротеинлипазы. TNFs индуцируют в гепатоцитах синтез такого класса белков, которые известны как "реактанты острой фазы" и которые действуют на гипоталамус как пирогеныal., (1987), Cell. 50:555; Waage et al., (1987), Lancet, 1(8529): 355). Результаты доклинических испытаний, проведенных на различных моделях воспаления на животных, включая модель ревматоидного артрита, дают основания рассматривать подавление TNF в качестве одного из главных компонентов прогрессии заболевания и его остроты (Dayer et al., (1994), European Cytokine Network, 5(6): 563-571 и Feldmann et al.,(1995), Annals Of The New York Academy of Sciences, 66:272-278). Кроме того, недавние предварительные клинические испытания ингибиторов TNF на больных ревматоидным артритом дали обнадеживающие результаты (Rankin et al.,(1995), British Journal of Rheumatology, 3(4): 4334-4342: Elliot et al., (1995), Lancet, 344:11051110: Таk et al., (1996), Arthritis and Rheumatism,29:1077-1081; Paleolog et al., (1996), Arthritis andRheumatism, 39:1082-1091). Из уровня техники известны белковые ингибиторы TNF. В заявке ЕР 308378 описан белок, полученный из мочи больных с лихорадкой, обладающий ингибиторной по отношению к TNF активностью. По-видимому, эффект данного белка обусловлен конкурентным механизмом на уровне рецептора. Описанный в заявке ЕР 308378 белок был выделен в достаточно чистом виде, что давало возможность охарактеризовать его N-конец. В данной работе, однако, не приводится какой-либо последовательности ДНК и не описывается ингибитор TNF, полученный методами генетической инженерии. Из уровня техники известны также ингибиторы TNF, полученные методами генетической инженерии. Например, в заявках ЕР 393438 и ЕР 422339 приведены аминокислотные и нуклеотидные последовательности зрелого рекомбинантного человеческого "30 кД ингибитораsTNFR-I), а также зрелого рекомбинантного человеческого "40 кД ингибитора" (известного также как р 75-рецептор и как sTNFR-II), a также его модифицированные формы, в частности,фрагменты, функциональные производные и варианты. В заявках ЕР 393438 и ЕР 422339 описаны также способы выделения генов, кодирующих ингибиторы, клонирование гена в соответствующем векторе и типе клеток и экспрессия гена для получения ингибиторов. Была показана способность зрелого рекомбинантного человеческого 30 кД ингибитора TNF и зрелого рекомбинантного человеческого 40 кД ингибитора TNF подавлять TNF (ЕР 393438, ЕР 422339,публикация РСТWO 92/16221 и публикация РСТWO 95/34326).sTNFR-I и sTNFR-II являются членами суперсемейства рецепторов фактора роста нервов/фактора некроза опухолей (NGF/TNF), к которому относятся рецептор фактора роста нервов (NGF), антиген В-клеток CD40, 4-1 ВВ,антиген Т-клеток крысы MRC OХ 40, антигенFas и антигены CD27 и CD30 (Smith et al.,(1990), Science, 248:1019-1023). Наиболее консервативной чертой, характерной для всей группы этих рецепторов, представленных на клеточной поверхности, является богатый цистеином внеклеточный лигандсвязывающий домен, который может быть разделен на четыре повторяющиеся структуры приблизительно в сорок аминокислот и который содержит 4-6 остатков цистеина в высоко консервативных положениях (Smith et al., (1990),supra). В патенте ЕР 393438 описаны 40 кДа ингибитор TNF 51 и 40 кДа ингибитор TNF 53,которые представляют собой усеченные версии полноразмерного рекомбинантного белкового 40 кДа ингибитора TNF по 51 или 53 аминокислотному остатку соответственно, и карбоксиконец зрелого белка оказывается удаленным. Соответственно, для квалифицированного специалиста становится понятно, что четвертый домен как 30 кДа ингибитора TNF, так и 40 кДа ингибитора не является необходимым для ингибирования TNF. В действительности, это положение было подтверждено различными группами исследователей. Были получены производные 30 кДа и 40 кДа ингибиторов TNF с делениями доменов, при этом производные, лишенные четвертого домена, сохраняли полную TNFсвязывающую активность, производные без первого, второго или третьего домена соответственно не сохраняли TNF-связывающей активности (Corcoran et al., (1994) Eur.J.Biochem.,223:831-840: Chih-Hsuen et al., (1995), The Journal of Biological Chemistry, 270(6):2874-2878;Scallon et al., (1995), Cytokine, 7(8):759-770). Из-за относительно низкого ингибирования цитотоксичности, проявляемого 30 кДа ингибитором TNF и 40 кДа ингибитором TNF(Butler et al., (1994), Cytokine, 6(6):616-623), различными группами исследователей были получены димеры белков-ингибиторов TNF (Butler etal., (1994), supra; и Martin et al., (1995),Exp.Neurol., 131:221-228). Однако димеры могут вызывать антительный ответ (Martin et al.,(1995), supra; Fischer et al., (1996), The NewEngland Journal of Medicine, 334(26):1697-1702). Задачей настоящего изобретения является создание функционально активных усеченныхsTNFRs. Эта и другие задачи настоящего изобретения будут очевидны из приведенного ниже описания. Краткое описание изобретения Настоящее изобретение направлено на получение функционально активных усеченных форм sTNFR-I и sTNFR-II соответственно, которые обозначаются как "усеченные sTNFR(s)". Усеченные sTNFRs представляют собой модифицированные формы sTNFR-I и sTNFR-II, которые не содержат четвертого домена (аминокислотные остатки Thr127-Asn161 sTNFR-I и аминокислотные остатки Pro141-Тhr179 sTNFR-II); 4 части третьего домена (аминокислотные остаткиLeu1 - Cys32 sTNFR-II). Эти новые ингибиторы TNF (в частности,TNF и TNF) имеют широкую применимость. Согласно настоящему изобретению к усеченным sTNFRs относятся белки, представленные формулой R1-[Cys19-Cys103]-R2 и R4-[Cys32Cys115]-R5. Данные белки являются усеченными формами sTNFR-I и sTNFR-II соответственно. Формула R1-[Cys19-Cys103]-R2' обозначает один или более белков, в котором [Cys19-Cys103] представляет остатки от 19 до 103 sTNFR-I, при этом для облегчения сравнения использована схема нумерации аминокислотных остатков,приведенная на фиг. 1 (SEQ ID NO:2), a R1 обозначает метионилированную и неметионилированую аминогруппу Cys19 или аминотерминальный аминокислотные остатки, выбранные из группыa R2 обозначает карбоксигруппу Cys103 или карбоксиконцевой аминокислотный остаток, выбранный из группы а также их вариантов и производных, полученных, как раскрыто в описании, включенных в объем изобретения, когда R1 обозначает метионилированную или неметионилированную аминогруппу в аминокислотной последовательности VCPQGKYIHPQNNSIC или ее N-концевого усеченного на 1-15 остатков варианта, 5 при том, что белок R1-[Суs19-Суs103]-R2 не является дополнительным вариантом с формулойR1-[Cys19-Cys103]-FNCSLCL-R3, и где R3 обозначает карбоксильную группу аминокислотной последовательности Asn111-Asn161, приведенной на фиг. 1, или ее карбоксиконцевой усеченный вариант. К примерам усеченных sTNFR-I, относящихся к настоящему изобретению, относятся следующие молекулы:(обозначаемого также как sTNFR-I 2.3D/d15), а также их метионилированные и неметионилированные формы, их варианты и производные. Таким образом, формула R4-[Cys32-Cys115]R5 обозначает один или более белков, в котором[Cys32-Cys115] представляет остатки от Cys32 доCys115 sTNFR-I, при этом для облегчения сравнения использована схема нумерации аминокислотных остатков, приведенная на фиг. 8Cys32 или аминотерминальные аминокислотные остатки, выбранные из группыa R5 обозначает карбоксигруппу Cys115 или карбокситерминальный аминокислотный остаток а также их вариантов, включенных в объем изобретения, когда R4 обозначает метионилированную или неметионилированную аминогруппу в аминокислотной последовательностиTCRLREYYDQTAQMC или ее N-терминального усеченного на 1-15 остатков варианта при том, что белок R4-[Cys32- Cys115]-R5 нe является дополнительным вариантом с формулой R4[Cys32- Cys115]-APRLKCR-R6, и где R6 обозначает карбоксильную группу аминокислотной последовательности Рrо 123-Thr179, приведенной на фиг. 8, или ее карбокситерминально усеченный вариант. Согласно одному из аспектов настоящего изобретения усеченные sTNFRs могут быть получены в гликозилированных или негликозилированных формах. Усеченные sTNFRs получают методами генетической инженерии. При альтернативном варианте осуществления изобретения усеченные sTNFRs могут быть получены и методами химического синтеза или сочетанием методов химического синтеза и методов генетической инженерии. Согласно другому аспекту настоящего изобретения, усеченные sTNFRs можно дериватизировать путем присоединения к усеченнымsTNFRs водорастворимого полимера. Например,усеченные sTNFRs можно конъюгировать с одной или несколькими молекулами полиэтиленгликоля с тем, чтобы улучшить фармакокинетические показатели путем повышения эффективного молекулярного веса молекулы. Другим аспектом настоящего изобретения являются различные полинуклеотиды, кодирующие усеченные sTNFRs. К приемлемым нуклеотидным последовательностям относятся последовательности, приведенные на чертежах,а также вырожденные последовательности и природные аллельные варианты. Данные нуклеотидные и аминокислотные последовательности можно использовать для экспрессии усеченных sTNFRs в эукариотических и прокариотических клетках-хозяевах, и при этом продукт 7 экспрессии или его производное характеризуются способностью модулировать активностьTNF. К другому аспекту настоящего изобретения относятся векторы, содержащие кодирующие усеченные sTNFRs полинуклеотиды, функционально связанные с последовательностями,обеспечивающими амплификацию и/или контролирующими экспрессию. Для экспрессии усеченных sTNFRs такими векторами могут быть трансформированы или трансфицированы как прокариотические, так и эукариотические клетки-хозяева. В объем настоящего изобретения также включены методы рекомбинантного получения усеченных sTNFRs при том, что клетки-хозяева, содержащие такие полинуклеотиды, выращивают на приемлемой питательной среде и экспрессируемые клетками усеченныеsTNFRs выделяют из клеток-хозяев и/или из питательной среды. Другим аспектом настоящего изобретения являются фармацевтические композиции, включающие усеченные sTNFRs или их производные. Обычно усеченные sTNFRs или их производные вводят в композицию в сочетании с фармацевтически приемлемыми носителями. Для облегчения производства, хранения, обращения, доставки и/или повышения эффективности усеченных sTNFRs или их производных в состав композиций могут входить другие разнообразные материалы. Другой аспект настоящего изобретения относится к способам модуляции активности TNF. В частности, TNF-обусловленные заболевания(например, заболевания, обусловленные TNFи/или TNF-) можно лечить, вводя больному терапевтически эффективные количества усеченных sTNFRs или их производных. Полинуклеотиды, кодирующие усеченныеsTNFRs, могут также применяться для целей клеточной или генной терапии. Полученные согласно настоящему изобретению усеченные sTNFRs особенно удобны для получения больших количеств белка. Например,sTNFR-I в аминокислотной последовательности 111-126 (аминокислоты Asn111-Gly)126 имеет один сайт деаминирования. Считается, что отсутствие этого сайта должно усиливать биохимическую стабильность очищенного белка,снижая количество возможных продуктов деградации и повышая стабильность белков при хранении. Усеченные sTNFRs имеют меньше дисульфидных мостиков, чем ранее описанные белки-ингибиторы TNF. Например, sTNFR-I содержит два дисульфидных мостика в аминокислотной последовательности 111-126 и три дисульфидных мостика в аминокислотной последовательности 127-161; sTNFR-II содержит дисульфидные мостики между Cis121 и Cis139,Cis142 и Cis157, Cis163 и Cis178. Сниженное число дисульфидных мостиков важно потому, что 8 большее число таких связей может затруднить процесс переукладки белка. Удивительно, но усеченные sTNFRs имеют меньше сайтов антигенных эпитопов, чем ранее описанные белкиингибиторы TNF (например, укороченная формаsTNFR-I, содержащая первые три домена, имеет неоэпитопы, чье появление обусловлено экспонированием отдельных остатков, см. примерIII), что приводит к сравнительно сниженной антигенности, но не уменьшает значительно скорость клиренса при повторных введениях. Сниженная иммуногенность усеченных sTNFRs,как ожидается, может оказаться положительным свойством при лечении TNF-обусловленных заболеваний, в частности хронических воспалительных заболеваний. Дополнительные аспекты и преимущества настоящего изобретения станут очевидны квалифицированному специалисту при рассмотрении следующего описания, которое детализирует применение настоящего изобретения. Краткое описание чертежей Многочисленные аспекты и преимущества настоящего изобретения станут очевидны при анализе следующих чертежей. На фиг. 1 представлена нуклеотидная последовательность (SEQ ID NO:1), кодирующаяsTNFR-I человека. Приведена также аминокислотная последовательность (SEQ ID NO:2) Asp1Asn161. На фиг. 2 представлена нуклеотидная последовательность (SEQ ID NO:3), кодирующаяNH2-MDSVCPQKYIHPQNNSIC-[Cys19-Cys105]FC-COOH (обозначаемого также как sTNFR-I 2.6D/C105). Приведена также аминокислотная последовательность (SEQ ID NO:4) NН 2MDSVCPQKYIHPQNNSIC-[Cys19-Cys105]-FCCOOH. На фиг. 3 представлена нуклеотидная последовательность (SEQ ID NO:5), кодирующаяsTNFR-I 2.6D/C106). Приведена также аминокислотная последовательность (SEQ ID NO:6)NН 2-MDSVCPQKYIHPQNNSIC-[Cys19-Cys105]FNCSL-COOH. На фиг. 4 представлена нуклеотидная последовательность (SEQ ID NO:7), кодирующаяNH2-MDSVCPQKYIHPQNNSIC-[Cys19-Cys105]FN-COOH (обозначаемого также как sTNFR-I 2.6D/N105). Приведена также аминокислотная последовательность (SEQ ID NO:8) NН 2MDSVCPQKYIHPQNNSIC-[Cys19-Cys105]-FNCOOH. На фиг. 5 представлена нуклеотидная последовательность (SEQ ID NO:11), кодирующаяNH2-MYIHPQNNSIC-[Cys19-Cys105]-FNCSLCOOH (обозначаемого также как sTNFR-I 2.3D/d8). Приведена также аминокислотная последовательность (SEQ ID NO:12) NH2MYIHPQNNSIC-[Cys19-Cys105]-FNCSL-COOH. 9 На фиг. 6 представлена нуклеотидная последовательность (SEQ ID NO:9), кодирующая(обозначаемого также как sTNFR-I 2.3D/d18). Приведена также аминокислотная последовательность(SEQ ID NO:10) NH2-M-[Cys19-Cys105]-FNCSLCOOH. На фиг. 7 представлена нуклеотидная последовательность (SEQ ID NO: 13), кодирующая(обозначаемого также как sTNFR-I 2.3D/d15). Приведена также аминокислотная последовательность (SEQ ID NO:14)NH2-MSIS-[Cys19-Cys105]FNCSL-COOH. На фиг. 8 представлена нуклеотидная последовательность (SEQ ID NO:34), кодирующаяLeu1-Thr179 зрелого рекомбинантного sTNFR-II человека. Приведена также аминокислотная последовательность (SEQ ID NO:35) Leu1-Thr179. На фиг. 9 представлены данные по измерению степени отеков, индуцированных при использовании модели реактивации артрита с помощью продуктов клеточной стенки стрептококка, как описано в примере II. На фиг. 10 представлены плазменные профили sTNFR-I 4D/C105 у здоровых павианов после двухминутного внутривенного введения 0.2 мг/кг, как описано в примере III. На фиг. 11 представлены плазменные профили sTNFR-I 3D/C105db у здоровых павианов после двухминутного внутривенного введения 0.2 мг/кг, как описано в примере III. На фиг. 12 представлены плазменные профили sTNFR-I 2.6D/C105db у здоровых павианов после двухминутного внутривенного введения 0.2 мг/кг, как описано в примере III. На фиг. 13 представлены взаимосвязи между дозой и клиренсом для различных димерных конструктов sTNFR-I, как описано в примере III. Подробное описание изобретения Настоящее изобретение основано на неожиданном наблюдении, что sTNFR-I и sTNFRII могут быть уменьшены в размере с удалением не только четвертого домена, но и части третьего домена и, дополнительно, части первого домена, сохраняя при этом биологическую активность и обладая пониженной антигенностью. По меньшей мере, по следующим причинам получение указанных биологически активных усеченных sTNFRs или их производных может представлять определенные преимущества. Вопервых, эти молекулы имеют на один меньше потенциальных дестабилизирующих сайтов деаминирования. Во-вторых, эти молекулы содержат меньше дисульфидных мостиков, что потенциально облегчает переукладку и очистку. В-третьих, эти молекулы имеют сниженное количество сайтов потенциальных антигенных эпитопов. Термин "усеченные sTNFR(s)" объединяет одну или несколько биологически активных 10 синтетических или рекомбинантных молекул с формулой R1-[Cys19-Cys103]-R2 или R4-[Cys32Cys115]-R5, а также их вариантов (включая инсерционные варианты, варианты с заменами и делециями), как описано далее. Термин "биологически активный" означает, что усеченные sTNFRs обладают сходнымиTNF-ингибирующими свойствами, но не обязательно теми же самыми свойствами и не обязательно в той же степени, что и sTNFR-I и/илиsTNFR-II. Вообще говоря, усеченные sTNFRs и их производные способны ингибировать TNF. Биологические тесты на активность усеченныхsTNFRs описаны далее в примере II. Выбор конкретных TNF-ингибирующих свойств, которые представляют интерес, зависит от способа применения усеченных sTNFRs. Согласно одному из аспектов настоящего изобретения усеченные sTNFRs предпочтительно получать с использованием рекомбинантных технологий в клеточных системах бактерий,клеток млекопитающих или насекомых, при этом усеченные sTNFRs могут представлять собой как гликозилированные, так и негликозилированные формы белка. Альтернативно, усеченные sTNFRs могут быть синтезированы химически. Наиболее предпочтительные в настоящее время способы получения описаны более подробно ниже. Усеченные sTNFRs могут быть выделены и очищены в форме, по существу, свободной от присутствия другого (т.е. не усеченных sTNFRs) белкового материала. Предпочтительно усеченные sTNFRs на 80% свободны от других белков,которые могут присутствовать в препаратах в силу способа, используемого для производства усеченных sTNFRs. Более предпочтительно усеченные sTNFRs на 90% свободны от других белков, особенно предпочтительно на 95% свободны от других белков и наиболее предпочтительно более чем на 98% свободны от других белков. Однако понятно, что нужный белок можно сочетать с другими активными ингредиентами, химическими композициями и/или приемлемыми фармацевтическими составами перед введением, как описано более подробно ниже. Усеченные sTNFRs. Согласно одному из основных вариантов осуществления настоящего изобретения, к усеченным sTNFRs относятся белки, представленные формулой R1-[Cys19-Cys103]-R2, в которой[Cys19-Cys103] представляет остатки от 19 до 103sTNFR-I, при этом для облегчения сравнения использована схема нумерации аминокислотных остатков, приведенная на фиг. 1 (SEQ ID NO:2),a R1 обозначает метионилированную и неметионилированную аминогруппу Cys19 или аминотерминальный аминокислотные остатки, выбранные из группыa R2 обозначает карбоксигруппу Cys103 или карбокситерминальные аминокислотные остатки,выбранные из группы а R5 обозначает карбоксигруппу Cys115 или карбокситерминальный аминокислотный остаток(остатки), выбранный из группы и их варианты и производные, полученные, как раскрыто в описании, включенные в объем изобретения, когда R1 обозначает метионилированную или неметионилированную аминогруппу в аминокислотной последовательностиVCPQGKYIHPQNNSIC или ее N-концевой усеченный на 1-15 остатков вариант при том, что белок R1-[Cys19-Cys103]-R2 не является дополнительным вариантом с формулой R1-[Cys19Cys103]-FNCSLCL-R3, и где R3 обозначает карбоксильную группу аминокислотной последовательности Asn111-Asn161, приведенной на фиг. 1,или ее карбоксиконцевой усеченный вариант. Согласно другому основному варианту осуществления настоящего изобретения усеченные sTNFRs могут представлять собой белки,обозначаемые следующей формулой: R4-[Cys32Cys115]-R5, в которой [Cys32-Cys115] представляет остатки от Cys32 до Cys115 sTNFR-II, при этом для облегчения сравнения использована схема нумерации аминокислотных остатков, приведенная на фиг. 8 (SEQ ID NO:35), a R4 обозначает метионилированную и неметионилированную аминогруппу Cys32 или аминотерминальные аминокислотные остатки, выбранные из группы и их варианты, также включенные в объем изобретения, когда R4 обозначает метионилированную или неметионилированную аминогруппу в аминокислотной последовательностиTCRLREYYDQTAQMC или ее N-терминального усеченного на 1-15 остатков варианта при том, что белок R4-[Cys32-Cys115]-R5 нe является дополнительным вариантом с формулой R4[Cys32-Cys115]-APRLKCR-R6, и где R6 обозначает карбоксильную группу аминокислотной последовательности Рrо 123-Thr179, приведенной на фиг. 8, или ее карбокситерминально усеченный вариант. К другому аспекту настоящего изобретения относятся один или несколько вариантовsTNFR(s)" включает один или несколько природных аллельных вариантов R1-[Cys19-Cys103]R2 и R4-[Cys32-Cys115]-R5 и один или несколько других вариантов белков, в которых аминокислоты были делегированы ("делеционные варианты"), вставлены ("варианты с дополнениями") или заменены ("варианты с заменами") остатками в аминокислотной последовательности R1[Cys19-Cys103]-R2 или R4-[Cys32-Cys115]-R5. 13 Делеции аминокислотной последовательности обычно варьируют в пределах 20 аминокислотных остатков, более типично - от 1 до 10 аминокислотных остатков и наиболее типично от 1 до 5 остатков с тем, чтобы не нарушалась укладка белка. Рассматриваются N-терминальные, С-терминальные и внутренние внутрипоследовательные делеции. Общее количество делеций и/или последовательных делеций выбирают таким образом, чтобы сохранить четвертичную структуру белка в задействованном домене, т.е. поперечные сшивки цистеина. Делеции в аминокислотной последовательности R1-[Cys19-Cys103]-R2 и в аминокислотной последовательности R4-[Cys32-Cys115]-R5 могут быть произведены в областях низкой гомологии с последовательностями других членов семейства рецепторов NGF/TNF в группе поверхностных мембранных белков клетки. Делеции в аминокислотной последовательности R1[Cys19-Cys103]-R2 и в аминокислотной последовательности R4-[Cys32-Cys115]-R5 могут быть произведены в областях существенной гомологии с последовательностями других членов семейства рецепторов NGF/TNF и в этом случае будут более значительно модифицировать биологическую активность. В частности, сходство последовательностей членов семейства рецепторов NGF/TNF особенно велико в области, соответствующей двум первым дисульфидным петлям домена 1, всему домену 2 и первой дисульфидной петле домена 3 (Banner et al.,(1993), Cell, 73:431-445). Например, двумя делеционными вариантами R1-[Cys19-Cys103]-R2 являются Rt-[Суs19(Тhr20)-Суs103]-R2 и R1[Cys19(Cys19-Lys21)-Cys103]-R2, где R1 и R2 определены выше. Например, тремя делеционными вариантами R4-[Cys32-Cys115]-R5 являются R4[Cys32-(Cys115)-Cys115]-R5; R4-[Cys32-(Cys115Lys115)-Cys103]-R5 и R4-[Cys32-(Cys115-Arg113)Cys115]-R5, где R4 и R5 определены выше. Добавления к аминокислотной последовательности могут включать амино- и/или карбокситерминальные слияния, варьирующие по длине от одного остатка до сотни и более остатков,а также внутренние внутрипоследовательные вставки единичного или множественных аминокислотных остатков. Внутренние вставки обычно варьируют по размеру от 1 до 10 аминокислотных остатков, более типично - от 1 до 5 аминокислотных остатков и наиболее типично - от 1 до 3 аминокислотных остатков. К вариантам с аминотерминальными добавлениями относятся добавление метионина(например, для обеспечения непосредственной экспрессии белка в рекомбинантной бактериальной клеточной культуре) или же добавление дополнительного аминокислотного остатка или последовательности. Другим примером аминотерминальной инсерции является слияние с сигнальной последовательностью, а также с други 003900 14 ми пре-пропоследовательностями, для облегчения секреции белка из рекомбинантных клетокхозяев. Для прокариотических клеток-хозяев,которые не распознают и не процессируют нативные сигнальные последовательности sTNFRI или sTNFR-II, эти сигнальные последовательности можно заменить прокариотическими сигнальными последовательностями, выбранными,например, из группы, включающей лидерные последовательности щелочной фосфатазы, пенициллиназы или термостабильного энтеротоксина II. Для клеток дрожжей сигнальную последовательность можно выбрать, например, из группы, включающей лидерные последовательности дрожжевой инвертазы, альфа фактора или щелочной фосфатазы. Для экспрессии в клетках млекопитающих нативные сигнальные последовательности sTNFR-I или sTNFR-II (ЕР 393 438 и ЕР 422 339) вполне приемлемы, хотя могут оказаться удобны и другие сигнальные последовательности млекопитающих (например, последовательности, полученные от других членов семейства рецепторов NGF/TNF). Варианты с карбокситерминальными добавлениями не предусматривают добавления одного или нескольких аминокислотных остатков, что приводило бы к реконструкции sTNFRI или sTNFR-II соответственно. Понятно, что варианты с карбокситерминальными добавлениями не предусматривают добавления одного или нескольких карбоксикислотных остатков,что приводило бы к реконструкции третьего домена или четвертого домена sTNFR-I илиsTNFR-II. К примерам вариантов с добавлениями по карбоксиконцу относятся химерные белки, полученные в результате слияния R1-[Cys19Cys103]-R2 или R4-[Cys32-Cys115]-R5 с полным или частичным константным доменом тяжелой или легкой цепи иммуноглобулина человека. Такие химерные белки являются предпочтительными,поскольку иммуноглобулиновая часть представляет все домены за исключением первого домена константной области тяжелой цепи иммуноглобулинов человека, таких как IgG, IgA,IgM или IgE, особенно IgG, т.е. IgG2 или IgG3. Для квалифицированного специалиста очевидно, что любую аминокислоту каждой иммуноглобулиновой части можно делетировать или заменить другой или другими аминокислотами,одна или несколько аминокислот могут быть добавлены при том, что TNF-связывающая часть сохраняет способность связывать TNF, а иммуноглобулиновая часть сохраняет одно или несколько своих характерных свойств. Другую группу вариантов представляют варианты с заменами аминокислот. В случае этих вариантов по меньшей мере один аминокислотный остаток R1-[Cys19-Cys103]-R или R2[Суs32-Суs115]-R4 удален и на его место вставлен другой остаток. К вариантам с заменами относятся аллельные варианты, характеризующиеся природными заменами в нуклеотидной после 15 довательности в популяции данного вида, которые могут приводить или не приводить к заменам аминокислот. Квалифицированный специалист может использовать любую информацию,доступную о связывающем или активном сайте полипептида, при выборе возможных сайтов мутаций. Один из методов идентификации аминокислотных остатков или областей для мутагенеза белков назван "аланин-сканирующим мутагенезом" (Cunningham and Wells (1989), Science,244:1081-1085, работа упоминается в настоящем описании в качестве ссылки). При данном подходе идентифицируют аминокислотный остаток или группу "целевых" остатков (например, такие заряженные остатки, как Arg, Asp, His, Lys,Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином) для изменения взаимодействия аминокислот с окружающей водной средой внутри или вне клетки. Такие остатки, проявляющие функциональную чувствительность к заменам, затем "вычищают" путем введения дополнительных или альтернативных остатков в места замен. Таким образом,сайт для введения модификации в аминокислотную последовательность оказывается предетерминированным и для оптимизации проведения мутации в данном сайте проводят сканирование аланина или случайный мутагенез, а полученный вариант полипептида скринируют в отношении оптимального сочетания нужной активности и степени этой активности. К сайтам, представляющим особый интерес для заместительного мутагенеза, относятся те сайты, в которых обнаруживаемые в R1[Cys19-Cys103]-R2 и R4-[Cys32-Суs115]-R5 аминокислоты существенно отличаются по наличию боковых цепей, заряду и/или гидрофобности отsTNFR-подобных белков, таких как sTNFRs других биологических видов или других членов семейства NGF/TNF рецептора. Также представляют интерес сайты, в которых конкретные остатки идентичны таковым в sTNFR-1-подобных белках и в sTNFR-IIподобных белках. Эти положения обычно важны для сохранения биологической активности белка. Например, квалифицированному специалисту понятно, что до настоящего изобретения эффекты усечения sTNFR-I и sTNFR-II на их трехмерные структуры были непредсказуемы. Однако с учетом приведенных в настоящем описании результатов, квалифицированный специалист может уяснить, что принципы разработки стратегии для получения вариантов могут отчасти определяться информацией, полученной ранее для полноразмерных sTNFR-I иsTNFR-II. Соответственно подобная информация относительно sTNFR-I была опубликованаAsp82 в домене 2 и остатки Туr92, Ser63 в домене 3 были идентифицированы как потенциально важные для стабилизации структуры доменов 1,2 и 3 соответственно. Остатки Рrо 12 и His55 были идентифицированы как потенциально взаимодействующие с Ser86-Туr87 субъединицы СTNF. Остатки Glu45-Phe49 были идентифицированы как образующие петлю, которая потенциально взаимодействует с остатками Leu29-Arg32 субъединицы A TNF. Остаток Gly48 был идентифицирован как потенциально взаимодействующий с Asn19-Pro20 субъединицы A TNF. Остатки His58-Leu60 были идентифицированы как "образующие" протяженную конформацию цепи; кроме того, была показана потенциальная возможность взаимодействия боковых цепей остатков Arg31-Ala33 субъединицы A TNF с остатком His58 sTNFR-I, который специфически взаимодействует с остатком Arg31. ОстаткиLys64-Arg66 были идентифицированы как "образующие" протяженную конформацию цепи; кроме того, была показана потенциальная возможность взаимодействия боковых цепей и основных цепей указанных остатков с остаткамиTNF. Остаток Met69 был идентифицирован как потенциально взаимодействующий с остатком Туr115 субъединицы A TNF. Остатки His94Phe101 были идентифицированы как образующие петлю, которая взаимодействует с остаткамиTNF и остаток Gln102 sTNFR-I специфически взаимодействует с остатком Pro113 субъединицы А TNF. Соответственно для квалифицированного специалиста очевидно, что исходно данные сайты модифицируют путем замен, вводимых относительно консервативным способом. Такие консервативные замены приведены в табл. 1 под заголовком "Предпочтительные замены". Если подобные замены приводят к изменению биологической активности, то далее проводят более существенные замены ("Возможные замены"). Могут быть также произведены и/или другие добавления или делеции с последующим скринингом полученных полипептидов. Таблица 1 Замены аминокислот Исходный Предпочтительные Возможные замены остаток замены Аlа (А) При осуществлении таких замен на эквивалентные необходимо учитывать гидропатический индекс аминокислот. Для каждой аминокислоты характерен свой гидропатический индекс, определяемый на основе ее гидрофобности и характеристик заряда: изолейцин (+4.5); валин(+1.8); глицин (-0.4); треонин (-0.7); серин (-0.8); триптофан (-0.9); тирозин (-1.3); пролин (-1.6); гистидин (-3.2); глутамат (-3.5); глутамин (-3.5); аспартат (-3.5); аспарагин (-3.5); лизин (-3.9) и аргинин (-4.5). Из уровня техники известна важность гидропатического индекса аминокислот в поддержании биологической функции белка, связанной с его взаимодействием с другими молекулами(Kyte and Doolittle (1982), J. Mol. Biol., 157:105131, работа упоминается в настоящем описании в качестве ссылки). Известно, что отдельные аминокислоты могут быть заменены другими аминокислотами с аналогичным гидропатическим индексом с сохранением биологической активности белка. При осуществлении замен с учетом гидропатического индекса предпочтительными являются замены аминокислот, чьи гидропатические индексы находятся в интервале 2, особенно предпочтительны - в интервале 1 и еще более предпочтительны - в интервале 0,5. Из уровня техники также известно, что замены подобных аминокислот могут быть эффективно осуществлены на основе гидрофильности, особенно тогда, когда полученный в результате биологически функциональный эквивалентный белок или пептид, как в настоящем случае, предназначен для иммунологического применения. Как указано в патенте США 4,554,101,упоминаемого в настоящем описании в качестве ссылки, наивысшая средняя локальная гидрофильность белка, определяемая гидрофильностью прилегающих аминокислот, коррелирует с его иммуногенностью и антигенностью, т.е. с биологическими свойствами белка. Как указано в патенте США 4,554,101,для аминокислотных остатков характерны следующие значения гидрофильности: аргинин(-1.8); изолейцин (-1.8); тирозин (-2.3); фенилаланин (-2.5); триптофан (-3.4). При произведении замен, основанных на сходных значениях гидрофильности, предпочтительны замены аминокислот, чьи значения гидрофильности находятся в пределах 2, особенно предпочтительны в пределах 1 и еще более предпочтительны в пределах 0.5. В патенте США 4,554,101 также описаны идентификация и получение эпитопов из первичных аминокислотных последовательностей на основе гидрофильности. С помощью методов, изложенных в патенте США 4,554,101 квалифицированный специалист способен идентифицировать эпитопы в таких аминокислотных последовательностях, как описываемые здесь последовательности sTNFRs. Эти области обозначаются также как "ядерные эпитопные области". Многочисленные научные публикации посвящены предсказанию вторичной структуры и идентификации эпитопов на основе анализа аминокислотных последовательностей (ChouAreas Mol. Biol., 47:45-148; Chou and Fasman,Ann. Rev. Biochem., 47:251-276 и Chou and Fasman (1979) Biophys. J., 26:367-384, работы упоминаются в настоящем описании в качестве ссылок). Кроме того, в настоящее время доступны компьютерные программы, которые помогают предсказывать антигенные районы и ядерные эпитопные области белков. Примерами могут служить программы, основанные на анализе Джеймсона-Вулфа (Jameson and Wolf (1998),Comput. Appl. Biosci., 4(1):181-186 и Wolf et al.,(1988), Comput. Appl. Biosci., 4(1): 187-191, работы упоминаются в настоящем описании в качестве ссылок), программа PepPlot (Brutlag etal., (1990), CABS, 6:237-245 и Weinberger et al.,(1985), Science, 228:740-742, работы упоминаются в настоящем описании в качестве ссылок),и другие новые программы для предсказания четвертичной структуры белков (Fetrow andBryant (1993), Biotechnology, 11:479-483, работа упоминается в настоящем описании в качестве ссылки). Консервативные модификации аминокислотной последовательности (и соответствующие модификации кодирующей ее нуклеотидной последовательности) R1-[Cys19-Cys103]-R2 и R4[Cys32- Cys115]-R5 могут привести к образованию белков с аналогичными функциональными и химическими характеристиками. Наоборот, существенные модификации функциональных и/или химических свойств R1[Cys19-Cys103]-R и R2-[Cys32-Суs115]-R3 могут быть достигнуты отбором замен, которые зна 19 чительно различаются по эффекту на поддержание (а) структуры полипептидного каркаса в области замены, например, сохранение плоской или спиральной структуры; (б) изменяют заряд или гидрофобность белка в сайте замены или (в) добавляют боковую цепь. Встречающиеся в природе остатки подразделяют на несколько групп на основе общих свойств боковой цепи: 1. Гидрофобные: Met, Ala, Val, Leu, Ile; 2. Нейтральные гидрофильные: Cys, Ser,Thr; 3. Кислые: Asp, Glu; 4. Основные: Asn, Gln, His, Lys, Arg; 5. Ароматические: Тrр, Туr, Phe; 6. Остатки, влияющие на ориентацию цепи: Gly, Pro. К неконсервативным заменам могут относиться замены одного из членов группы на другой. Такие заменяющие остатки могут вводиться в области R1-[Cys19-Cys103]-R2 и R4-[Cys32Cys115]-R5 гомологичные или не гомологичные с другими представителями семейства рецептораNGF/TNF. К конкретным мутациям в последовательностях R1-[Cys19-Cys103]-R2 и R4-[Cys32-Cys115]R5 относятся замены неприродной аминокислоты на N-конце, С-конце или в любом месте белка, который модифицирован добавлением Nсвязанного или O-связанного углевода. Подобные модификации могут оказаться особенно полезны, поскольку добавление аминокислоты(например, цистеина) может создавать преимущество при связывании с водорастворимым полимером с образованием производного, как описано ниже. См., например, фиг. 5, где природный Asn105 в sTNFR-I заменен на Cys, чтобы облегчить присоединение молекулы полиэтиленгликоля (пример I). Кроме того, последовательности R1-[Cys19103Cys ]-R2 и R4-[Cys32-Cys115]-R5 могут быть модифицированы добавлением или удалением Nсвязанного или O-связанного сайта гликозилирования. Аспарагинсвязанный сайт гликозилирования представляет собой трипептидную последовательность, которая специфически распознается соответствующими клеточными ферментами гликозилирования. Эти трипептидные последовательности имеют структуру Asn-XaaThr или Asn-Xaa-Ser, где Хаа может быть любой аминокислотой кроме Pro. Предсказанные или фактические остатки аспарагина в sTNFR-I находятся в положениях 14, 105 и 111. Предсказанные или фактические остатки аспарагина вsTNFR-II находятся в положениях 149 и 171. Разнообразные аминокислотные замены или делеции могут быть произведены для модификации или удаления N-связанного или Oсвязанного сайта гликозилирования, что приведет к изменению гликозилирования белка. В конкретном варианте осуществления изобретения варианты существенно гомологичны аминокислотной последовательности R1 003900[Cys19-Cys103]-R2 или R4-[Cys32-Суs115]-R5. Термин "существенно гомологичны" означает степень гомологии, которая обычно превышает 70%, более предпочтительно превышает 80%,еще более предпочтительно превышает 90% и наиболее предпочтительно составляет 95%. Процент гомологии вычисляют, как процент аминокислотных остатков, обнаруживаемых в меньшей из двух последовательностей при сопоставлении с идентичными аминокислотными остатками в сравниваемой последовательности,при том, что четыре пробела на 100 аминокислот могут быть введены для облегчения такого сопоставления, как описано Dayhoff in Atlas ofProtein Sequence and Structure, 5:124 (1972), National Biochemical Research Foundation, Washington, D.C., (работа упоминается в настоящем описании в качестве ссылки). Существенно гомологичными считаются также усеченные варианты sTNFRs, которые могут быть выделены посредством перекрестной реактивности с антителами к аминокислотной последовательностиSEQ ID NO:2 и SEQ ID NO:35 соответственно,или такие варианты, чьи гены могут быть выделены гибридизацией с ДНК SEQ ID NO:1 или(обозначаемый также как sTNFR-I 2.3D/d15) как в метионилированной, так и в неметионилированной форме, а также их варианты и производные. Получение вариантов усеченных sTNFRs более подробно описано ниже. Подобные варианты могут быть получены введением соответствующих нуклеотидных замен в ДНК, кодирующие усеченные sTNFRs, или же химическим синтезом in vitro нужных усеченных sTNFRs. Как очевидно квалифицированному специалисту могут быть произведены многочисленные комбинации делеций, инсерций и замен при том, что окончательные варианты усеченныхsTNFRs будут сохранять биологическую активность. Методы мутагенеза, позволяющие заменить, вставить или делетировать один или несколько нужных аминокислотных остатков, хо 21 рошо известны из уровня техники (например,патент США 4,518,584, упоминаемый в настоящем описании в качестве ссылки). Имеется две главных переменных при конструировании каждого варианта: локализация сайта мутации и природа мутации. При конструировании каждого варианта локализация каждого сайта мутации и природа каждой мутации определяются биохимическими характеристиками, которые хотят изменить. Каждый мутационный сайт может быть модифицирован индивидуально или серийно, например, (1) первоначальной заменой каких-либо консервативных остатков и затем, в зависимости от полученного результата, введением более радикальной замены; (2) делецией конкретного аминокислотного остатка или (3) инсерцией одного или нескольких аминокислотных остатков вблизи выбранного сайта. Квалифицированным специалистом с учетом приведенного описания могут быть получены химически модифицированные производные усеченных sTNFRs. С использованием гликозилированных, негликозилированных или дегликозилированных усеченных sTNFRs можно получить конъюгаты. Обычно используют негликозилированные усеченные sTNFRs. К приемлемым для дериватизации усеченных sTNFRs химическим веществам относятся водорастворимые полимеры. Водорастворимые полимеры предпочтительны, поскольку связанный с ними белок не будет преципитировать в водной среде, в частности в физиологической среде организма. Предпочтительно полимер должен быть фармацевтически приемлемым для приготовления терапевтического продукта или композиции. Квалифицированный специалист сможет выбрать нужный полимер с учетом изложенных соображений и в зависимости от того будет ли конъюгат полимер/белок применяться терапевтически и, если будет, с учетом желаемой дозы,времени циркуляции и устойчивости к протеолизу. К удобным, клинически приемлемым водорастворимым полимерам относятся (но не ограничиваются перечисленными) полиэтиленгликоль (ПЭГ), полиэтиленгликольпропиональдегид, сополимеры этиленгликоля/пропиленгликоля, монометоксиполиэтиленгликоль, карбоксиметилцеллюлоза, декстран, поливиниловый спирт (PVA), поливинилпирролидон, поли 1,3-диоксолан, поли-1.3.6-триоксан, сополимер этилена и малеинового ангидрида, поли-аминокислоты (в виде гомополимеров или случайных сополимеров), поли(п-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля (PPG) и другие полиалкиленовые оксиды, сополимеры полипропиленоксида/ этиленоксида, полиоксиэтилированные полиолы(POG) (например, глицерол) и другие полиоксиэтилированные полиолы, полиоксиэтилированный сорбитол или полиоксиэтилированная глюкоза, колониковые кислоты или другие углевод 003900 22 ные полимеры, фиколл или декстран и смеси указанных соединений. В понятие "полиэтиленгликоль" входит любая форма полиэтиленгликоля, использованная для дериватизации других белков, например, моно-(C1-C10)алкокси- или арилоксиполиэтиленгликоль. Полиэтиленгликольпропиональдегид может иметь преимущества для производства из-за его стабильности в воде. Водорастворимые полимеры могут иметь любой молекулярный вес и быть разветвленными или неразветвленными. Обычно водорастворимые полимеры имеют средний молекулярный вес около 2-100 кД (термин "около" означает,что в препарате водорастворимого полимера некоторые молекулы будут весить больше, некоторые меньше, в сравнении с указанным молекулярным весом). Средний молекулярный вес каждого водорастворимого полимера находится в пределах от около 5 до 50 кД, более предпочтительно от 12 до 40 кД и наиболее предпочтительно составляет от 20 до 35 кД. Обычно, чем выше молекулярный вес и чем больше разветвлен полимер, тем выше отношение полимер : белок. В зависимости от желательного терапевтического профиля (например, продолжительности контролируемого высвобождения; возможных эффектов на биологическую активность; простоты обращения; степени (или отсутствия ее) антигенности и других известных эффектов водорастворимого полимера на терапевтический белок) могут применяться полимеры с другим молекулярным весом. Водорастворимые полимеры должны прикрепляться к белку с учетом возможного влияния на функциональные и антигенные домены белка. В целом, может быть проведена химическая дериватизация в любых приемлемых условиях для реакции белка с молекулой активированного полимера. Активирующие группы, которые могут быть использованы для превращения полимера в активную молекулу, включают следующие группы: сульфон, малеимид, сульфгидрил, тиол,трифлат, тресилат, азидирин, оксиран и 5 пиридил. Водорастворимые полимеры обычно присоединяются к белку через - или аминогруппы аминокислот или реакционноспособную тиоловую группу, но считается также,что водорастворимая группа может быть присоединена к любой реакционноспособной группе белка, которая достаточно реакционна для присоединения водорастворимой группы в приемлемых условиях реакции. Так, водорастворимый полимер может быть ковалентно связан с белком через реакционноспособную группу, например, свободную амино- или карбоксильную группу. К аминокислотным остаткам, имеющим свободную аминогруппу, относятся остатки лизина и N-терминальные аминокислотные остатки. Свободную карбоксильную 23 группу имеют остатки аспарагиновой кислоты,глутаминовой кислоты и С-терминальные аминокислотные остатки. К остаткам со свободной тиоловой группой относятся остатки цистеина. Методы получения белков, конъюгированных с водорастворимыми полимерами, обычно предусматривают два этапа: (а) реакцию белка с водорастворимым полимером в условиях, при которых белок оказывается соединенным с одним или более водорастворимым полимером, и(б) выделение продукта реакции. Условия реакции для каждого случая конъюгации могут быть выбраны среди известных из уровня техники и соответственно модифицированы, но обязательно должны исключать или ограничивать такие значения параметров реакции (температуры,присутствия растворителей, значения рН), которые могли бы инактивировать подлежащий модификации белок. В целом, оптимальные условия реакции определяют для каждого конкретного случая, исходя из известных параметров и желаемого результата. Например, чем выше отношение водорастворимый полимер : конъюгат белка, тем выше выход конъюгированного продукта. Оптимальное отношение (в смысле эффективности реакции, когда не имеется избытка не прореагировавших белка или полимера) определяется такими факторами, как желаемая степень дериватизации (например, моно-,ди-, три- и т.д.), молекулярный вес выбранного полимера, разветвленность или неразветвленность полимера, а также условиями реакции. Отношение водорастворимого полимера (например, ПЭГа) к белку обычно колеблется в пределах от 1:1 до 100:1. Один или более очищенный конъюгат может быть получен из каждой смеси стандартными методами очистки, к которым среди прочих относятся диализ, высаливание, ультрафильтрация, ионообменная хроматография, гель-фильтрация и электрофорез. При желании может быть получен химически модифицированный по N-концу белок. Выбирают водорастворимый полимер соответствующего молекулярного веса, разветвленности и т.п., определяют соотношение водорастворимого полимера и белка (или пептида) в реакционной смеси, тип осуществляемой реакции и метод выделения выбранного химически модифицированного по N-концу белка. Метод получения препарата химически модифицированного по N-концу белка (например, разделение, при необходимости, данной формы и других монодериватизированных форм) может представлять собой очистку N-терминально химически модифицированного белка из популяции молекул химически модифицированного белка. Избирательная N-терминальная химическая модификация может быть проведена путем восстановительного алкилирования, при котором используется различающаяся реакционная способность различных типов первичных аминогрупп (лизина против N-терминальных), доступных для 24 дериватизации в конкретном белке. В соответствующих условиях реакции достижима существенная селективная дериватизация белка поN-концу с полимером, содержащим карбонильную группу. Например, можно избирательно прикрепить водорастворимый полимер к Nконцу белка проведением реакции при таком значении рН, которое позволяет использовать преимущество в разнице между рКа аминогруппы остатков лизина и -аминогруппыN-терминального остатка белка. При такой избирательной дериватизации прикрепление водорастворимого полимера к белку контролируемо: конъюгация с полимером происходит преимущественно по N-концу белка без существенной модификации других реакционноспособных групп, таких как аминогруппы боковых цепей лизина. Для проведения восстановительного алкилирования водорастворимый полимер может принадлежать к одному из описанных выше типов и должен иметь один реакционноспособный альдегид для связывания с белком. Может быть использован полиэтиленгликольпропиональдегид, содержащий единственный реактивный альдегид. В настоящем изобретении конкретно заявлен химически дериватизированный белок,включая его моно- или поли- (например, 2-4) ПЭГ-производные. Пэгирование может быть проведено с помощью любой известной из уровня техники реакции. Методы получения ПЭГированного белкового продукта обычно предусматривают два этапа: (а) реакцию белкового продукта с полиэтиленгликолем (например, реакционноспособным эфиром или альдегидным производным ПЭГа) в условиях, при которых белок оказывается соединенным с одной или более группами ПЭГа, и (б) выделение продукта (или продуктов) реакции. В целом,оптимальные условия реакции определяют для каждого конкретного случая, исходя из известных параметров и желаемого результата. Имеется ряд дополнительных методов,доступных квалифицированному специалистуCourt, Friern Barnet Lane, London N20 OLD, UK); ЕР 0154316; ЕР 0401384; WO 92/16221; WO 95/34326 и другие публикации, упоминаемые в настоящем описании в качестве ссылок). В частности, пэгирование может быть осуществлено посредством реакций ацилирования или алкилирования с реакционноспособной молекулой полиэтиленгликоля. Таким образом,к заявленным в настоящем изобретении белковым продуктам относятся также и пэгированные белки, в которых группы ПЭГа присоединены через ацильные или алкильные группы. Эти 25 продукты могут быть монопэгированными или полипэгированными (например, содержать 2-6,а предпочтительно 2-5 групп ПЭГа). Группы ПЭГа обычно присоединяются к белку через или -аминогруппы аминокислот, но считается также, что группы ПЭГа могут быть присоединены к любой аминогруппе белка, которая в достаточной степени реакционноспособна для присоединения группы ПЭГ в приемлемых условиях реакции. При пэгировании ацилированием обычно происходит реакция активных эфирных производных полиэтиленгликоля (ПЭГ) с белком. Для реакции ацилирования выбранный полимер (или полимеры) должны обладать одной реакционноспособной эфирной группой. Для проведении реакции пэгирования может быть использована любая из известных или обнаруженных впоследствии реакционноспособных молекул ПЭГ. Предпочтительным активированным эфиром ПЭГ является ПЭГ, этерифицированный Nгидроксисукцинимидом (NHS). Считается, что термин "ацилирование" включает без ограничений следующие типы связей между терапевтическим белком и таким водорастворимым полимером, как ПЭГ: амидную, карбаматную, уретановую и им подобные (см. Chamow (1994), Bioconugate Chem., 5(2):133-140). Условия реакции могут быть выбраны среди известных из уровня техники условий реакций пэгирования и соответственно модифицированы, но должны исключать такие значения параметров реакции(температуры, присутствия растворителей, значения рН), которые могли бы инактивировать подлежащий модификации белок. Пэгирование ацилированием обычно приводит к получению пилипэгированного белка. Предпочтительно связующим звеном является амид. Также предпочтительно, чтобы полученный продукт был, по существу, (например,95%) моно-, ди- или трипэгированным. Однако могут образовываться формы с более высокой степенью пэгирования, число которых зависит от конкретных условий реакции. При желании более очищенные пэгированные формы могут быть отделены от смеси (в частности, не прореагировавшего ПЭГа) стандартными методами очистки, к которым среди прочих относятся диализ, высаливание, ультрафильтрация, ионообменная хроматография, гель-фильтрация и электрофорез. Для пэгирования алкилированием обычно требуется реакция терминального альдегидного производного ПЭГа с белком в присутствии восстанавливающего агента. Для восстановительной реакции алкилирования выбранный полимер (полимеры) должен иметь одну реакционноспособную альдегидную группу. Примером реакционноспособного альдегида ПЭГ служит полиэтиленгликольпропиональдегид, который стабилен в воде, или его моно-C1-C10 003900 26 алкокси- или арилоксипроизводные (см. патент США 5,252,714, упоминаемый в настоящем описании в качестве ссылки). Пэгирование алкилированием может также приводить к получению полипэгированного белка. Можно подобрать условия реакции для предпочтительного пэгирования только аминогрупп на N-конце белка (т.е. получения монопэгированного белка). При монопэгировании и полипэгировании группы ПЭГа предпочтительно связываются с белком через -СН 2-NНгруппы. С учетом роли -СН 2-группы такой тип связи обозначается, как "алкильная" связь. Восстановительное алкилирование для получения, по существу, гомогенной популяции продукта монополимер/белок обычно включает два этапа: (а) реакцию белка с реакционноспособной молекулой ПЭГа в условиях восстановительного алкилирования при значении рН, обеспечивающем избирательную модификацию аминогрупп на аминоконце данного белка, и (б) выделение продукта (или продуктов) реакции. Дериватизация путем восстановительного алкилирования использует преимущество в разнице между рКа аминогрупп остатков лизина и аминогруппы N-терминального остатка белка(рКа представляет собой такое значение рН, при котором 50% аминогрупп протонировано, а 50%- нет). Реакцию проводят при таком значении рН,которое позволяет использовать преимущество в разнице между рКа -аминогруппы остатков лизина и -аминогруппы N-терминального остатка белка. Вообще, если значение рН ниже,требуется больший избыток полимера по сравнению с белком (т.е. чем меньше доступных Nтерминальных реакционноспособных -аминогрупп, тем больше полимера требуется для достижения оптимальных условий). Если значение рН выше, то соотношение полимера и белка не обязательно должно быть таким высоким (т.е. доступно больше реакционноспособных групп,соответственно требуется меньше молекул полимера). Для целей настоящего изобретения значение рН обычно находится в пределах 3-9,предпочтительно 3-6. Для восстановительного алкилирования восстанавливающий агент должен быть стабилен в водном растворе и предпочтительно восстанавливать только Шиффово основание, образовавшееся на начальных этапах восстановительного алкилирования. Подходящие восстанавливающие агенты могут быть выбраны из группы, включающей борогидрид натрия, цианоборогидрид натрия, диметиламин боран, триметиламин боран и пиридин боран. Особенно удобным восстанавливающим агентом является цианоборогидрид. Другие параметры реакции, такие как растворитель, время реакции, температуры и способ очистки продуктов, определяют конкретно для каждого случая,основываясь на опубликованной информации по 27 дериватизации белков водорастворимыми полимерами. При такой избирательной дериватизации прикрепление водорастворимого полимера (содержащего такую реакционноспособную группу, как альдегид) к белку контролируемо: конъюгация с полимером происходит преимущественно по N-концу белка без существенной модификации других реакционноспособных групп,таких как аминогруппы боковых цепей лизина. Препарат обычно состоит более чем на 90% из конъюгата монополимер/белок, более типично более чем на 95% из конъюгата монополимер/белок, при этом оставшаяся часть молекул в реакцию не вступила (т.е. белок без полимерных групп). В конкретном варианте осуществления изобретения неразветвленный монометоксиполиэтиленгликольальдегид со средним молекулярным весом около 20 кД или около 33 кД(т.е. между 30 и 35 кД), или четвертичный бутилполиэтиленгликольальдегид со средним молекулярным весом около 33 кД (т.е. между 30 и 35 кД) конъюгирован посредством восстановительного алкилирования с sTNFR-I 2.6D/N105. Пэгирование может быть также осуществлено при использовании водорастворимых полимеров, имеющих по меньшей мере одну реакционноспособную гидроксигруплу (например,полиэтиленгликоля). При этом водорастворимый полимер вступает в реакцию с реагентом,обладающим карбонильной, нитрильной или сульфоновой группой, для конверсии гидроксильной группы в реакционноспособный акцептор Михаэля, образуя тем самым "активированный линкер", пригодный для модифицирования различных белков с получением улучшенных биологически активных конъюгатов."Реакционноспособный карбонил, нитрил или сульфон" означает карбонильную, нитрильную или сульфоновую группу, с которой связана вторая карбоновая группа с образованием реакционноспособного сайта для тиолспецифического связывания второго углерода карбонильной, нитрильной или сульфоновой группы (WO 92/16221). Активированные линкеры могут быть монофункциональными, бифункциональными или многофункциональными. К реагентам, имеющим реакционноспособные сульфоновые группы, которые могут быть использованы при осуществлении указанных методов, относятся (без ограничений перечисленными) хлоросульфон,винилсульфон и дивинилсульфон. В специфическом варианте осуществления изобретения водорастворимый полимер активирован акцептором Михаэля. В заявке WO 95/13312 описаны, inter alia, водорастворимые сульфон-активированные полиэтиленгликоли,которые высоко избирательно связываются с тиоловыми группами вместо аминогрупп на молекулах или поверхностях. Эти производные 28 ПЭГа устойчивы к гидролизу при нахождении длительное время в водной среде и к рН 11 или ниже, а также образуют связи с молекулами, что приводит к образованию гидролитически стабильных конъюгатов. Соединение ПЭГа и биологически активной молекулы достигается за счет связывания сульфоновой группы и тиоловой группы, что приводит к образованию структуры PEG-SO2-CH2-CH2-S-W, где W обозначает биологически активную молекулу, и где сульфоновая группа представлена винилсульфоном или активным этилсульфоном. Особенно полезны две гомобифункциональные производные, а именно ПЭГ-бис-хлоросульфон и ПЭГ-бисвинилсульфон. В опубликованной международной заявкеUS 96/19459, включенной в настоящее описание в качестве ссылки, описаны способы получения сульфон-активированных линкеров путем получения соединения, имеющего реакционноспособную гидроксильную группу, и конверсии гидроксильной группы в реакционноспособный акцептор Михаэля с образованием активированного линкера. При этом в качестве растворителя для конверсии используется тетрагидрофуран(THF). В опубликованной международной заявке US 96/19459, приведенной в настоящем описании в качестве ссылки, описан процесс очистки активированных линкеров с применением хроматографии гидрофобного взаимодействия для разделения линкеров на основе размера и функции концевой группы. В частности, в настоящем изобретении рассматриваются следующие экспрессированные в прокариотах молекулы, которые химически дериватизированы с присоединением моноили поли- (т.е. 2-4) групп ПЭГа: sTNFR-I 2.6D/C105, sTNFR-I 2.6D/C106, sTNFR-I 2.6D/N105, sTNFR-I 2.3D/d8, sTNFR-I 2.3D/d18 и sTNFR-I 2.3D/d15, в метионилированной или неметионилированной форме, а также их варианты и производные. Поливалентные формы. Можно сконструировать поливалентные формы, т.е. молекулы, содержащие более чем одно активное начало. В одном из вариантов осуществления изобретения молекула может обладать множественными сайтами связывания фактора некроза опухолей для лиганда TNF (т.е. комбинация усеченных продуктов sTNFR). Дополнительно, молекула может обладать по меньшей мере одним сайтом связывания фактора некроза опухолей и в зависимости от желаемых характеристик поливалентной формы одним сайтом связывания другой молекулы (например, комбинация по меньшей мере одного усеченного продукта sTNFR и по меньшей мере одного антагониста рецептора интерлейкина-1(IL-1ra), как описано ниже). В конкретном варианте осуществления изобретения поливалентные формы могут быть сконструированы, например, путем химическо 29 го соединения по меньшей мере одного усеченного продукта sTNFR с любым клинически приемлемым линкером (т.е. водорастворимым полимером, как описано выше). В принципе, линкер не должен вносить новую иммуногенность,или, в силу присутствия новых аминокислотных остатков, изменять гидрофобность или баланс зарядов в структуре, что могло бы отрицательно сказаться на ее биораспределении и клиренсе. Такие полимеры, при использовании их в качестве линкеров, могут быть гомополимерами, случайными или "блоковыми" сополимерами и терполимерами, основанными на перечисленных выше мономерах, с неразветвленной или разветвленной цепью, с заменами или без замен. Полимер может иметь любую длину и молекулярный вес, но эти характеристики могут влиять на биологические свойства. Средние молекулярные веса полимеров, особенно полезных для снижения скорости клиренса при фармакологических применениях, лежат в интервале от 2,000 до 35,000 дальтон. Кроме того, для оптимизации или придания нужной биологической активности длина полимера может варьировать. К активирующим группам, которые можно использовать для "привязывания" водорастворимого полимера к двум или более белкам, относятся: сульфон, малеимид, сульфгидрил, тиол,трифлат, трезилат, азидирин, оксиран и 5 пиридил. В конкретном варианте осуществления изобретения бифункциональный или мультифункциональный активированный линкер,имеющий по меньшей мере один реакционноспособный акцептор Михаэля, может быть получен в соответствии с заявкой на патент США 08/473,809 и очищен в соответствии с заявкой на патент США 08/611,918. Активные начала могут быть присоединены с использованием обычных методов связывания (см. опубликованные международные заявки WO 92/16221 и WO 95/34326, упоминаемые в настоящем описании в качестве ссылок). Кроме того, в заявке WO 92/16221 описано получение различных димеризованных молекул ингибитора sTNFR-I, т.е. димеризованных с 105sNTFR-I. Примером могут служить поливалентные белки, связывающие фактор некроза опухолей и имеющие формулу (sTNFR-I 2.6D/C106)2(20kDa PEG), которые описаны в примере I. Альтернативно, бивалентная молекула может состоять из двух тандемных повторов усеченных продуктов sTNFR, разделенных полипептидным линкером. Конструкция полипептидных линкеров аналогична конструкции вставки последовательностей короткой петли между доменами конструируемых de novo белков (Mutter (1988),TIBS, 13:260-265 и Regan and DeGrado(1988),Science, 241:976-978, работы упоминаются в настоящем описании в качестве ссылок). Показано, что линкер, приемлемый для одноцепо 003900 30 чечных антител, эффективен для получения димерных форм рекомбинантного sTNFR-II человека (Neve et al., (1996), Cytokine, 8(5):365-370,работа упоминается в настоящем описании в качестве ссылки). Было получено несколько различных линкерных конструктов, полезных для применения с антителами; наиболее функционально активные линкеры варьируют по размеру от 12 до 25 аминокислот (аминокислоты с нереакционноспособными боковыми группами, например аланин, серин и глицин), которые вместе составляют гидрофильную последовательность и имеют мало противоположно заряженных остатков, что повышает растворимость молекулы и делает ее гибкой (WhitlowMethods in Enzymology, 2:97-105 и Brigido et al.,(1993), J.Immunol., 150:469-479, работы упоминаются в настоящем описании в качестве ссылок). В конкретном варианте осуществления изобретения усеченные sTNFRs могут быть химически присоединены к биотину, а затем конъюгаты "биотин/усеченные sTNFRs" связывают с авидином, что приводит к образованию тетравалентных молекул"авидин/биотин/ усеченные sTNFRs". Усеченные sTNFRs также могут быть ковалентно связаны с динитрофенолом (DNP) или тринитрофенолом (TNP), а полученные конъюгаты осаждены анти-DNP или анти-TNP-IgM с образованием декамерных конъюгатов с валентностью 10 в отношенииTNF-связывающих сайтов. Согласно другому варианту осуществления изобретения, можно получить рекомбинантные слитые белки, содержащие усеченныйsTNFR, при том что в каждой химерной молекуле последовательность sTNFR, как описано выше, заменена вариабельными доменами тяжелых или легких цепей и содержит полные пли частичные константные домены (но по меньшей мере один константный домен) тяжелых или легких цепей иммуноглобулинов человека. Например, каждый такой химерный слитый белок (усеченный sTNFR/IgG1) может быть получен из двух химерных генов: "усеченныйsTNFR/Cg-1). После транскрипции и трансляции двух химерных генов, как описано ниже, продукты генов могут быть собраны в единую химерную молекулу, в которой усеченные sTNFRs представлены бивалентно. Дополнительные детали конструирования таких химерных молекул описаны в патенте США 5,116,964, опубликованной международной заявке WO 89/09622,опубликованной международной заявке WO 91/16437 и ЕР 315062, упоминаемых в настоящем описании в качестве ссылок. Согласно одному из вариантов осуществления изобретения могут быть получены реком 31 бинантные слитые белки со специфичностью усеченных sTNFRs при том, что каждая рекомбинантная химерная молекула содержит последовательность sTNFR, как описано выше, а также по меньшей мере часть области 186-401 остеопротегрина (OPG), как описано в заявке на Европейский патент 96309363.8. Полинуклеотиды. Настоящее изобретение относится также к полинуклеотидам, кодирующим усеченныеsTNFRs. Основываясь на настоящем описании и используя универсальную таблицу кодонов,любой квалифицированный специалист может легко определить все нуклеотидные последовательности, кодирующие аминокислотные последовательности усеченных sTNFRs. К предпочтительным нуклеотидным последовательностям относятся такие полинуклеотиды, которые кодируютsTNFR-I 2.6D/C105,sTNFR-I 2.6D/C106, sTNFR-I 2.6D/N105, sTNFR-I 2.3D/d8, sTNFR-I 2.3D/d18 и sTNFR-I 2.3D/d15. Примеры различных полинуклеотидов приведены на фиг. 2, 3, 4, 5, 6 и 7. Методы рекомбинантной экспрессии, осуществленные в соответствии с приведенным ниже описанием, могут быть применены для получения таких полинуклеотидов и экспрессии кодируемых ими белков. Например, путем введения нуклеотидной последовательности, кодирующей усеченный sTNFR в соответствующий вектор, квалифицированный специалист может легко получить большие количества нужной нуклеотидной последовательности. Затем последовательности могут быть использованы для получения проб для гибридизации или праймеров для амплификации. Альтернативно, полинуклеотид, кодирующий усеченный sTNFR,может быть введен в вектор экспрессии. При введении вектора экспрессии в соответствующие хозяйские клетки можно получить большие количества нужного усеченного sTNFR. Как видно из дальнейшего описания, существуют многочисленные системы хозяин/вектор, пригодные для получения нужных нуклеотидных последовательностей и/или продукции нужных белков. К ним относятся, но не ограничиваются перечисленными, плазмидные,вирусные и инсерционные векторы и прокариотические и эукариотические клетки-хозяева. Квалифицированный специалист может адаптировать систему хозяин/вектор для наращивания и экспрессии гетерологичной ДНК с целью получения или экспрессии заявленных в настоящем изобретении последовательностей. Кроме того, как следует из настоящего описания и что очевидно квалифицированному специалисту, нуклеотидные последовательности включают вырожденные нуклеотидные последовательности, кодирующие усеченные sTNFRs и имеющие структуру, приведенную на чертежах, а также нуклеотидные последовательности,которые гибридизуются (предпочтительно в 32 жестких условиях гибридизации) с данными нуклеотидными последовательностями [ManiatisManual), Cold Spring Harbor Laboratory, pp. 387389]. Примером гибридизации в "жестких" условиях служит гибридизация в 4 х SSC при 6267 с последующей отмывкой в 0.1 х SSC при 62-67 в течение часа. Альтернативно "жесткую" гибридизацию можно провести в 45-55%ном формамиде, 4 х SSC при 40-45. В объем настоящего изобретения также включены последовательности ДНК, которые гибридизуются с нуклеотидными последовательностями, приведенными на фиг. 1 и 9, в "мягких" условиях гибридизации и которые кодируют усеченныеsTNFRs. Примерами таких "мягких" условий гибридизации могут служить гибридизация в 4 хSSC при 45-55 С или гибридизация в 30-40%ном формамиде при 40-45. Согласно настоящему изобретению также заявлены рекомбинантные ДНК-конструкты,включая векторную ДНК вместе с последовательностями ДНК, кодирующими усеченныеsTNFRs. В каждом из таких ДНК-конструктов нуклеотидные последовательности, кодирующие усеченные sTNFRs (с сигнальными пептидами или без них), функционально связаны с приемлемыми регуляторными последовательностями, способными направлять репликацию и или экспрессию усеченных sTNFRs в определенном хозяине. Рекомбинантная экспрессия. Получение полинуклеотидов. Нуклеотидные последовательности, кодирующие усеченные sTNFRs, могут быть получены различными способами, включая (но не ограничиваясь перечисленными) химический синтез, скрининг геномных и кДНКовых библиотек, скрининг экспрессионных библиотек и/или ПЦР-амплификацию кДНК. Данные методы, а также и другие, пригодные для выделения нуклеотидных последовательностей, известны из уровня техники и описаны в следующих руководствах: Sambrook et al., MolecularMolecular Biology, Current Protocols Press,(1994); и Berger and Kimmel, Methods in Enzymology: Guide to Molecular Cloning Techniques,Vol.152, Academic Press, Inc., San Diego, CA,(1987), упоминаемых в настоящем описании в качестве ссылок. Химический синтез нуклеотидных последовательностей,кодирующих усеченныеsTNFRs, проводят в соответствии с методами,хорошо известными из уровня техники, описанными, например, в работах Engels et al., (1989),Angew. Chem. Intl. Ed., 28:716-734 и Wells et al.,(1985), Gene, 34:315, упоминаемых в настоящем описании в качестве ссылок. Указанные методы 33 включают среди прочих фосфотриэфирный,фосфорамидатный и Н-фосфонатный методы синтеза нуклеотидных последовательностей. Большие нуклеотидные последовательности,например, длиннее 100 нуклеотидов, могут быть синтезированы в виде нескольких фрагментов. Затем фрагменты дотируют друг с другом и получают нуклеотидную последовательность, кодирующую усеченные sTNFRs. Предпочтительным способом является синтез на полимерной подложке с использованием стандартной химии фосфорамидатов. Альтернативно искомые нуклеотидные последовательности можно получить при скрининге соответствующих кДНКовых библиотек(например, библиотеки, полученной из одной или нескольких тканей, в которых экспрессируется данный белок) или геномных библиотек(библиотеки, полученной из тотальной геномной ДНК). Источником для получения кДНКовой библиотеки обычно служит ткань любого типа, в которой нужный белок экспрессируется в приемлемых количествах. Обычно источником получения геномной библиотеки служит любая ткань или ткани млекопитающего или животного другого вида, в которой имеется ген,кодирующий усеченный sTNFR. Библиотека может быть проскринирована на наличие ДНК, кодирующей усеченныйsTNFR, с применением одного или более нуклеотидных зондов (олигонуклеотиды, кДНК или фрагменты геномной ДНК, обладающие достаточным уровнем гомологии с кДНК или клонируемым геном), которые будут избирательно гибридизоваться с кДНК или геном (генами),присутствующим(и) в библиотеке. Используемые для такого скрининга пробы обычно представляют собой небольшой фрагмент последовательности ДНК того же или сходного биологического вида, что и вид животного, из тканей которого получена библиотека. Альтернативно зонды могут быть вырожденными, что обсуждается далее. Обычно скрининг библиотеки проводят путем "отжига" олигонуклеотидного зонда или кДНК с клонами библиотеки в условиях такой жесткости, которая предотвращает неспецифическое связывание, но делает возможным связывание с зондом или праймером тех клонов,которые обладают значительным уровнем гомологии с зондом или праймером. Обычно параметры жесткости гибридизации и последующих отмывок зависят от размера (т.е. числа нуклеотидов) кДНК или олигонуклеотидного зонда, а также от того, является ли зонд вырожденным. При составлении гибридизационной смеси учитывается также вероятность идентификации клона (т.е. скринируется кДНКовая или геномная библиотека). Когда в качестве зонда используют фрагмент ДНК (такой как кДНК), то условия гибридизации выбирают, как описано Ausubel et al., 003900eds. supra. После гибридизации содержащий библиотеку блот отмывают в условиях подходящей жесткости, которая зависит от таких факторов, как размер зонда, ожидаемая гомология зонда и клона, характер скринируемой библиотеки, число скринируемых клонов и т.д. Далее приведены примеры "жестких" отмывочных растворов, которые обычно имеют низкую ионную силу и применяются при сравнительно высоких температурах: 1) 0,015 М NaCl, 0,005 МEDTA, 40 мМ NaHPO4, pH 7,2, и 1% SDS при 40-50 С; 3) 0,2 x SSC, 1% SDS при 50-65 С. Известны различные примерные протоколы отмывания в жестких условиях, когда для скрининга кДНКовых или геномных библиотек используют олигонуклеотидные зонды. Например, в одном из протоколов используется 6 хSSC с 0.05% пирофосфата натрия при температуре от 35 С до 63 С, в зависимости от длины зонда. Например, зонд, состоящий из 14 оснований, отмывают при 35-40 С, из 17 - при 4550 С, из 20 - при 52-57 С и из 23 - при 57-63 С. При усиленном неспецифическом (фоновом) связывании температура может быть повышена на 2-3 С. В другом протоколе для отмывания используется хлорид тетраметиламмония(ТМАС). В состав одного из "жестких" отмывочных растворов входят 3 М ТМАС, 50 мМTris-HCl, pH 8,0, и 0,2% SDS. Другим удобным методом получения нужной нуклеотидной последовательности является полимеразная цепная реакция (ПЦР). В этом случае кДНК получают на матрице поли(А)+РНК или тотальной РНК с помощью фермента обратной транскриптазы. К кДНК добавляют два праймера (олигонуклеотиды),обычно комплементарные двум различным областям кДНК, кодирующей усеченный sTNFR, а также полимеразу, например Taq полимеразу. При этом полимераза амплифицирует область кДНК между праймерами. Олигонуклеотидные последовательности,отобранные в качестве зондов или праймеров,должны иметь адекватную длину и быть достаточно "недвусмысленными", чтобы минимизировать неспецифическое связывание, которое может иметь место при скрининге библиотек или ПЦР-амплификации. Действительная последовательность зондов или праймеров обычно основывается на консервативных или высоко гомологичных последовательностях или участках. Дополнительно, зонды или праймеры могут быть полностью или частично вырожденными,т.е. представлять собой смесь зондов/ праймеров, в совокупности кодирующих одну и ту же аминокислотную последовательность, но использующих для этого различные кодоны. Альтернатива получению вырожденных зондов состоит во введении инозина в некоторые или во все кодоны, положение которых варьирует в зависимости от биологического вида. Олиго 35 нуклеотидные зонды или праймеры могут быть получены методами химического синтеза ДНК,как описано выше. Как указывалось выше, вариантные последовательности представляют собой такие природные (например, аллельные вариации) или синтетические последовательности, которые содержат одну или более замен, делеций или инсерций нуклеотидов в сравнении с последовательностью, представленной на фиг. 2, 3, 4, 5, 6 и 7, что приводит к экспрессии вариантов аминокислотных последовательностей по сравнению с аминокислотной последовательностью дикого типа. Получение синтетических мутантных последовательностей хорошо известно из уровня техники и описано, например, в работахSambrook et al., (1989), supra и Wells et al.,(1985), Gene, 34:315, упоминаемых в настоящем описании в качестве ссылок. Векторы. ДНК, кодирующую усеченные sTNFRs,встраивают в векторы для дальнейшего клонирования (амплификации ДНК) или экспрессии. Могут быть использованы коммерчески доступные векторы или же вектор конструируют специально. Выбор и конструкция соответствующего вектора будут зависеть от следующих факторов: 1) будет ли вектор использован для амплификации ДНК или для экспрессии ДНК; 2) от размера ДНК, предназначенной для встраивания в вектор, и 3) от того, какие клеткихозяева будут трансформированы вектором. В любом векторе нуклеотидная последовательность, кодирующая нужный белок, функционально связана с одной или более регуляторной последовательностью, которые способны направлять, контролировать и вообще каклибо влиять на экспрессию данного белка в конкретных клетках-хозяевах. Каждый вектор содержит различные компоненты в зависимости от его назначения (амплификация ДНК или экспрессия ДНК) и совместимости с определенными хозяйскими клетками. В состав вектора обычно входят следующие компоненты (без ограничения перечисленными): сигнальная последовательность, начало репликации, один или более селективный(е) или маркерный(е) ген(ы),промотор, энхансер, последовательность терминации транскрипции и подобные указанным. Данные компоненты могут быть получены из природных источников или же синтезированы известными методами. К подходящим прокариотическим векторам клонирования относятся бактериофаги, в частности производные фага лямбда, плазмидыE.coli (например, pBR322, col E1, pUC, F-фактор и производные плазмиды Bluescript (Stratagene,LaJolla, CA. Могут использоваться другие векторы экспрессии, многочисленные типы которых известны из уровня техники и которые совместимы с описанными ниже клеткамихозяевами. 36 Сигнальная последовательность. Нуклеиновая кислота, кодирующая сигнальную последовательность, может быть встроена в 5'-концевой участок последовательности, кодирующей усеченный sTNFR, т.е. она может быть компонентом вектора, или же она может являться частью нуклеиновой кислоты,кодирующей усеченный sTNFR, встроенной в вектор. Нуклеиновые кислоты, кодирующие нативные сигнальные последовательностиsTNFR-I и sTNFR-II, известны из уровня техники (ЕР 393438 и ЕР 422339). Начало репликации. Векторы клонирования и экспрессии обычно включают в свой состав нуклеотидные последовательности, обеспечивающие вектору возможность репликации в одном или нескольких типах клеток-хозяев. В случае вектора клонирования такая последовательность позволяет вектору реплицироваться независимо от хозяйской хромосомной ДНК и включает начало репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны. Начало репликации плазмидыpBR322 приемлемо для большинства грамотрицательных бактерий, а различные другие начала репликации (например, вируса SV40, вирусов полиомы, аденовируса, VSV или BPV) пригодны для векторов, предназначенных для клонирования в клетках млекопитающих. Обычно начало репликации не является необходимым для векторов, предназначенных для экспрессии в клетках млекопитающих (например, начало репликации SV40 часто используют только потому, что оно содержит ранний промотор). Селективный ген. Векторы клонирования и экспрессии обычно содержат селективный ген. Данный ген кодирует "маркерный" белок, необходимый для выживания или роста трансформированной клетки-хозяина при выращивании на селективной культуральной среде. Нетрансформированные вектором клетки не будут содержать селективного гена и потому не выживут в данной культуральной среде. Типичные селективные гены кодируют белки, которые а) придают устойчивость к антибиотикам или другим токсинам, например, ампициллину, неомицину, метотрексату или тетрациклину; б) комплементируют ауксотрофные недостаточности или в) предоставляют критически важные питательные вещества, недоступные из культуральной среды. Другие селективные гены используют для амплификации экспрессируемых генов. Амплификация представляет собой процесс, при котором гены, кодирующие нужный белок, и гены,необходимые для роста клеток, тандемно повторяются снова и снова в хромосомах последовательных поколений рекомбинантных клеток. Примерами селективных маркеров, подходящих для клеток млекопитающих, служат дигидрофолатредуктаза (DHFR) и тимидинкиназа. Транс 37 формированные клетки млекопитающих выращивают под селективным давлением, при котором, благодаря перенесенному вектором маркеру, выживают только истинные трансформанты. Селективное давление обеспечивается культивированием трансформированных клеток в условиях последовательно повышающейся концентрации селективного агента в среде, что приводит к амплификации селективного гена и ДНК, кодирующей усеченные sTNFRs. В результате этого на амплифицированной ДНК синтезируются повышенные количества усеченных sTNFRs. Например, клетки, трансформированные селективным геном DHFR, были впервые выделены путем культивирования всей совокупности трансформантов в культуральной среде с метотрексатом, конкурентным антагонистом DHFR. Подходящими клетками-хозяевами для DHFR дикого типа являются клетки яичника китайского хомячка, дефицитные по активности DHFR(см. например, работу Urlaub and Chasin (1980),Proc. Natl. Acad. Sci. U.S.A., 77(7):4216-4220,упоминаемую в настоящем описании в качестве ссылки). Трансформированные клетки затем культивируют при повышающихся концентрациях метотрексата. Это приводит к синтезу множественных копий гена DHFR и, сопутствующим образом, многочисленных копий другой ДНК, присутствующей в векторе экспрессии, например ДНК, кодирующей усеченныйsTNFR. Промотор. Как экспрессионные векторы, так и векторы клонирования обычно содержат промотор,который распознается хозяйским организмом и функционально связан с нуклеотидной последовательностью, кодирующей усеченный sTNFR. Промотор представляет собой нетранслируемую последовательность, расположенную "выше"(обычно в пределах 100-1000 пар оснований),которая контролирует транскрипцию и трансляцию конкретной последовательности нуклеиновой кислоты, в частности, кодирующей усеченный sTNFR. Промоторы обычно подразделяют на два класса: индуцибельные промоторы и конститутивные промоторы. Индуцибельные промоторы индуцируют усиление транскрипции ДНК, находящейся под их контролем, в ответ на какие-либо изменения в условиях культивирования, например температурный сдвиг или наличие или отсутствие какого-либо питательного вещества. Известно большое число промоторов,распознаваемых разнообразными клеткамихозяевами. Промотор может быть функционально связан с ДНК, кодирующей усеченныйsTNFR, путем рестрикционного удаления существующего промотора из ДНК и вставкой в вектор нужной промоторной последовательности. Нативная промоторная последовательностьsTNFR-II могут быть использованы для контроля амплификации и/или экспрессии ДНК, кодирующей усеченный sTNFR. Гетерологичный промотор, однако, является более предпочтительным, поскольку он допускает более высокий уровень транскрипции и обеспечивает более высокий уровень выхода экспрессируемого белка в сравнении с нативным промотором при том, что он совместим с выбранной клеточной системой экспрессии. Например, любая из нативных промоторных последовательностей других членов семейства NGF/TNF может быть использована для контроля амплификации и/или экспрессии ДНК, кодирующей усеченныйsTNFR. К промоторам, удобным для использования в прокариотических хозяевах, относятся бета-лактамазный и лактозный промотор; промотор щелочной фосфатазы и триптофановая(tpr) промоторная система, система гена бактериальной люминесценции (luxR) и такие гибридные промоторы, как tac промотор. Приемлемы также и другие известные бактериальные промоторы. Их нуклеотидные последовательности опубликованы, что позволяет квалифицированному специалисту лигировать их с нужными последовательностями ДНК с применением линкеров или адаптеров, необходимых для создания желаемых сайтов рестрикции. Из уровня техники известны также удобные промоторные последовательности для использования в клетках дрожжей. Известны промоторы для использования в клетках-хозяевах млекопитающих, включая промоторы, выделенные из геномов вирусов, таких как вирус полиомы, вирус птичьей оспы, аденовирус (например, аденовирус типа 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирусы, вирус гепатита В и наиболее предпочтительно обезьяний вирус 40 (SV40). К другим удобным промоторам млекопитающих относятся гетерологичные промоторы млекопитающих, например, промоторы теплового шока и промотор актина. Энхансерный элемент. В вектор может быть введена энхансерная последовательность для усиления транскрипции в клетках высших эукариот последовательностей ДНК, кодирующих усеченный sTNFR. Энхансеры представляют собой цис-действующие элементы ДНК, обычно длиной 10-300 пар оснований, которые влияют на промотор, усиливая транскрипцию. Энхансеры относительно не зависимы от ориентации и положения. Они могут быть расположены как с 5'-конца, так и с 3'конца транскрипционной единицы. Дрожжевые энхансеры предпочтительно использовать вместе с дрожжевыми промоторами. Известны энхансерные последовательности ряда генов млекопитающих (например, глобина, эластазы, альбумина, альфа-фетопротеина и инсулина). Обычно, однако, используют вирусные энхансе 39 ры. Примерами энхансерных элементов, активирующих эукариотические промоторы, служат энхансер SV40, энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы и энхансер аденовируса. При том, что энхансер может быть встроен в вектор как в 5'положении, так и 3'-положении по отношению к фрагменту ДНК, кодирующему усеченныйsTNFR, обычно он занимает 5'-положение относительно промотора. Терминация транскрипции. Экспрессионные векторы, применяемые в эукариотических клетках-хозяевах, обычно содержат последовательности, необходимые для терминации транскрипции и стабилизации мРНК. Подобные последовательности обычно находятся в 5'- (и иногда в 3'-) нетранслируемых областях эукариотических ДНК или кДНК. Данные области содержат нуклеотидные сегменты, транскрибируемые как полиаденилированные фрагменты в нетранслируемой части мРНК, кодирующей усеченный sTNFR. Конструирование вектора. Конструирование приемлемых векторов,содержащих один или более из перечисленных выше компонентов (вместе со смысловыми областями, кодирующими усеченный sTNFR) может быть проведено стандартными методами лигирования. Выделенные плазмиды или фрагменты ДНК разрезают, "кроят" и заново лигируют в нужном порядке для получения необходимого вектора. Чтобы убедиться, что сконструирована правильная последовательность, лигирующей смесью трансформируют E.coli и трансформантов отбирают известными способами, как описано выше. Затем из трансформантов выделяют вектор, подвергают рестрикционному анализу и/или секвенированию для подтверждения наличия нужного конструкта. Может быть использован также и вектор,обеспечивающий транзиторную экспрессию ДНК, кодирующей усеченный sTNFR, в клетках млекопитающих. Вообще говоря, транзиторная экспрессия предусматривает использование вектора экспрессии, который способен эффективно реплицироваться в клетках-хозяевах, так что в клетках аккумулируется множество копий экспрессионного вектора и затем синтезируются большие количества нужного белка, кодируемого вектором экспрессии. Каждая система транзиторной экспрессии, состоящая из соответствующего вектора экспрессии и клеток-хозяев,обеспечивает удобную идентификацию белков,кодируемых клонированными ДНК, а также возможность быстрого скрининга данных белков в отношении нужных биологических или физиологических свойств, например, позволяет проводить идентификацию биологическиактивного варианта усеченного sTNFR. Клетки-хозяева. В объем настоящего изобретения включены также любые рекомбинантные клетки 003900 40 хозяева, содержащие нуклеотидную последовательность, необходимую для экспрессии нужного белка. Примерами прокариотических и эукариотических клеток-хозяев служат клетки бактерий, млекопитающих, грибов, насекомых,дрожжей или растений. К прокариотическим клеткам-хозяевам относятся (но не ограничиваются перечисленными) эубактерии, такие как грамотрицательные или грамположительные организмы (например,E.coli (HB101, DH5a, DH10 и МС 1061); Bacilli,такие как B.subtilis; Pseudomonas, такие как Р.aeruginosa; Streptomyces spp.; Salmonella typhymurium или Serratia marcescans. Примером конкретного осуществления изобретения может служить экспрессия нужного белка в E.coli. В дополнение к прокариотическим клеткам-хозяевам приемлемыми хозяевами для экспрессии нужного белка могут служить такие эукариотические микроорганизмы, как нитчатые грибы и дрожжи. Saccharomyces cerevisiae,или обычные пекарские дрожжи, являются наиболее широко используемыми низшими эукариотами-хозяевами, однако, хорошо известны и широко доступны представители и других родов, видов и штаммов. Усеченный sTNFR можно экспрессировать в гликозилированной форме в каких-либо клетках-хозяевах, полученных из многоклеточного организма. Такие клетки-хозяева обеспечивают сложный процессинг и гликозилирование белка. В принципе, можно использовать культуру любых эукариотических клеток позвоночных и беспозвоночных, включая клетки растений и насекомых. Примером конкретного осуществления изобретения может служить экспрессия нужного белка при помощи бакуловирусной системы в клетках насекомых. Наращивание клеток позвоночных в культуре (культура тканей) является хорошо известным подходом и поэтому в качестве клетокхозяев могут быть использованы клетки позвоночных. Примерами полезных клеточных линий млекопитающих могут служить (но не ограничиваются перечисленными) клетки почки обезьяны линии CV1, трансформированные SV40(COS-7), линия клеток почки эмбриона человека(клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре), клетки почки хомячка и клетки яичника китайского хомячка. К другим приемлемым линиям клеток млекопитающих относятся (но не ограничиваются перечисленными) клетки HeLa, мышиные клетки L-929, линии клеток 3 Т 3, полученные из мышей Swiss, Balb-c или NIH, а также линии клеток хомячка ВНК или НаК. Примером конкретного осуществления изобретения может служить экспрессия нужного белка в клеткахCOS. Клетки-хозяева могут быть трансфицированы и предпочтительно трансформированы нужной нуклеиновой кислотой в соответствую 41 щих условиях, обеспечивающих экспрессию нуклеотидной последовательности. Методы отбора нужных клеток-хозяев, а также методы трансформации, культивирования, амплификации, скрининга так же, как и методы получения и очистки продукта, хорошо известны из уровня техники (Gething and Sambrook (1981), Nature,292:620-625, или, альтернативно, Kaufman et al.,(1985), Mol. Cell. Biol. 5(7):1750-1759, или патент США 4,419,446; указанные источники информации приведены здесь в качестве ссылок). Например, для клеток млекопитающих, не имеющих клеточной стенки, может быть использован метод кальций-фосфатной преципитации. Могут быть использованы электропорация, микроинъекция и другие известные методы. Кроме того, имеется возможность получения нужного белка гомологичной рекомбинацией или методами рекомбинантных нуклеиновых кислот с использованием контролирующих элементов, введенных в клетки уже содержащие ДНК, кодирующую усеченный sTNFR. Гомологичная рекомбинация представляет собой метод,первоначально разработанный для таргетинга("нацеливания") генов для индукции или коррекции мутаций в транскрипционно-активных генах (Kucherlapati (1989), Prog. In Nucl. AcidRes. And Mol. Biol., 36:301; работа упоминается в настоящем описании в качестве ссылки). Первоначальный подход был разработан как метод введения специфических мутаций в конкретные области генома млекопитающих (Thomas et al.,(1986), Cell, 44:419-428; Thomas and Capecchi(1987), Cell, 51:503-512 и Doetschman et al.,(1988), Proc. Natl. Acad. Sci.U.S.A., 85:85838587; все работы упоминаются в настоящем описании в качестве ссылок) или для коррекции специфических мутаций в дефектных генах(Doetschman et al., (1987), Nature, 330: 576-578; работа также упоминается в настоящем описании в качестве ссылки). Примерами могут служить способы, описанные в патенте США 5,272,071; заявках WO 92/01069; WO 93/03183;WO 94/12650 и WO 94/31560, упоминаемых в настоящем описании в качестве ссылок. Посредством гомологичной рекомбинации,последовательность ДНК, которая должна оказаться встроенной в геном, может быть направлена в специфическую область представляющего интерес гена. Достигается это прикреплением ее к "нацеливающей" ДНК. Нацеливающая ДНК- это ДНК, комплементарная (гомологичная) некоторой области геномной ДНК. Небольшие фрагменты нацеливающей ДНК, комплементарные конкретной области генома, входят в контакт с родительской нитью ДНК во время процесса репликации ДНК. Общим свойством перенесенной в клетку ДНК является способность гибридизоваться и потому рекомбинировать с другими фрагментами эндогенной ДНК через области общей гомологии. Если такая компле 003900 42 ментарная нить прикреплена к олигонуклеотиду, содержащему мутацию или другую последовательность ДНК, она также встраивается во вновь синтезируемую нить в результате рекомбинации. В результате осуществления функции проверки считывания появляется вероятность того, что новая последовательность ДНК будет служить матрицей. Таким образом, перенесенная ДНК оказывается встроенной в геном. Если известна последовательность конкретного гена, в частности нуклеотидная последовательность, кодирующая нужный белок,можно синтезировать (или получить другим способом, например, соответствующей рестрикцией нативной ДНК в специфических сайтах, ограничивающих нужную область) последовательность, контролирующую экспрессию(фрагмент ДНК, комплементарный выбранной области гена). Такой фрагмент служит "нацеливающей" последовательностью при введении в клетку и будет гибридизоваться с гомологичной ему областью генома. Если подобная гибридизация происходит при репликации ДНК, то такой фрагмент ДНК и любые прикрепленные к нему дополнительные последовательности будут работать как фрагменты Оказаки и будут встроены во вновь синтезируемую дочернюю нить ДНК. Прикрепленными к фрагментам нацеливающей ДНК оказываются такие участки ДНК,которые могут влиять на экспрессию представляющего интерес белка. Например, промотор/энхансер, супрессор или экзогенный элемент, модулирующий транскрипцию, встраиваются в геном клетки-хозяина в такой ориентации и близости, которые достаточны для влияния на транскрипцию ДНК, кодирующей нужный усеченный sTNFR. Контролирующие элементы не кодируют усеченный sTNFR, но контролируют определенную часть ДНК генома клетки-хозяина. Таким образом, экспрессия усеченного sTNFR может быть достигнута не трансфекцией кодирующей его ДНК, а использованием нацеливающей ДНК (содержащей области гомологии с эндогенным представляющим интерес геном) в сочетании с регуляторными элементами ДНК, обеспечивающими последовательность эндогенного гена узнаваемыми сигналами транскрипции усеченного sTNFR. Культивирование клеток-хозяев. Способы культивирования рекомбинантных клеток-хозяев для продукции нужного белка будут варьировать в зависимости от многих факторов и условий; оптимальная процедура в каждой конкретной ситуации становится понятной квалифицированному специалисту после непродолжительных экспериментов. Рекомбинантные клетки-хозяева культивируют в подходящей среде и экспрессируемый усеченныйsTNFR собирают, выделяют и очищают из культуральной среды (или из клеток, если он экс 43 прессируется внутриклеточно) с использованием известных из уровня техники методов. Конкретно, любые рекомбинантные клетки, используемые для получения усеченногоsTNFR. При необходимости в состав среды могут вводиться гормоны и/или другие ростовые факторы (такие как инсулин, трансферрин или эпидермальный ростовой фактор), соли (такие как хлорид натрия, соли кальция, магния и фосфаты), буферы (такие как HEPES), нуклеозиды(такие как гентамицин), микроэлементы (неорганические соединения, конечная концентрация которых не превышает микромолей), а также глюкоза или другой источник энергии. Могут также вводиться и другие добавки в соответствующих концентрациях, что очевидно для квалифицированного специалиста. Приемлемые для конкретных клеток-хозяев культуральные условия, такие как температура, рН и т.д., также хорошо известны квалифицированному специалисту. Полученный продукт экспрессии может быть вычищен почти до гомогенности с использованием известных из уровня техники методов. Примеры методов очистки описаны в заявках ЕР 393438 и ЕР 422339, упоминаемых в настоящем описании в качестве ссылок. Фармацевтические композиции. Фармацевтические композиции обычно включают терапевтически эффективные количества усеченных sTNFR и химически модифицированных усеченных sTNFR (объединенных понятием "продукт(ы) усеченных sTNFR") в смеси с носителем. Носитель обычно включает один или несколько фармацевтически и физиологически приемлемых материалов в смеси с усеченным продуктом(продуктами) sTNFR и материалом для контролируемого высвобождения. Первичный растворитель в носителе может быть по своей природе как водным, так и неводным. Кроме того, носитель может содержать другие фармацевтически приемлемые материалы для модификации или поддержания рН предпочтительно в пределах 5-6,5 и более предпочтительно в пределах 5,5-6,0 (например, такие буферы, как нитратный, фосфатный, и такие аминокислоты, как глицин); наполнители для лиофилизированных форм (например, маннитол или глицин); вещества для поддержания осмолярности (например, маннитол или хлорид натрия); сурфактанты (например, полисорбат 20,полисорбат 80, тритон и Pluronics); вещества для поддержания вязкости, прозрачности, цвета,стерильности, стабильности (например, сахароза или сорбитол); антиоксиданты (например,сульфит натрия и гидроксисульфит натрия); 44 консерванты (например, бензоиловую кислоту и салициловую кислоту); вещества для сохранения запаха фармацевтической формы; ароматизаторы и растворители; вещества определяющие скорость растворения (например, такие солюбилизаторы или солюбилизирующие агенты, как спирты, полиэтиленгликоли и хлорид натрия); вещества определяющие скорость высвобождения; эмульгирующие агенты; суспендирующие агенты; растворители; наполнители; векторы доставки; разбавители и/или фармацевтические адъюванты. Рассматриваются также такие эффективные формы введения, как парентеральные составы медленного высвобождения, ингаляционные аэрозоли, составы, активные при оральном применении, или суппозитории. Композиции могут также включать конкретные препараты полимерных соединений, таких как разрушающиеся в массе полимеры (например, сополимеры поли(лактокогликоловой кислоты)(виниловый спирт), поли(винилпирролидон),сополимеры малеинового ангидрида и алкилвинилового эфира, целлюлоза, производные гиалуроновой кислоты, альгинат, коллаген, желатин, альбкмин, крахмалы и декстраны) и их композиционные системы или препараты липосом или микросфер. Такие композиции могут оказывать влияние на физическое состояние,стабильность, скорость высвобождения in vivo и скорость клиренса in vivo данных белков и их производных. Оптимальная фармацевтическая композиция конкретного белка определяется квалифицированным специалистом в зависимости от способа введения и нужной дозировки. Примеры фармацевтических композиций описаны в Remington's Pharmaceutical Sciences, 18th(1995), Bioconjugate Chem., 6:332-351; LeoneBay, et al., (1995), Journal of Medicinal Chemistry,38:4263-4269; Haas, et al., (1995), Clinical Immunology and Immunopathology, 76(1):93; WO 94/06457; WO 94/21275; FR 2706772 и WO 94/21235, упоминаемых в настоящем описании в качестве ссылок. Конкретные композиции для поддерживаемого высвобождения доступны от следующих поставщиков: Depotech (Depofoam, мультивезикулярные липосомы);(ProLease PLGA микросферы). Как следует из контекста настоящего описания, под гиалуронаном понимаются гиалуронан, гиалуроновая кислота, ее соли (такие как гиалуронат натрия),эфиры, энзиматические производные и поперечно-сшитые гели гиалуроновой кислоты (такие как гилан). Примеры форм гиалуронанаPettit (1995), Biocojugate Chem., 6:332-351; в патентах США Nos. 4,582,865, 4,605,691,4,636,524, 4,713,448, 4,716,154, 4,716,224,4,772,419, 4.851,521, 4,957,774, 4,863,907,5,128,326, 5,202,431, 5,336,767, 5,356,883; в заявках на европейский патент Nos. 0507604 А 2,0718312 А 2 и WO 96/05845, упоминаемых в настоящем описании в качестве ссылок. Конкретные композиции гиалуронана доступны от следующих поставщиков: BioMatrix, Inc. Ridgefield,NJ (Synvisc, смесь 90:10 жидкого гилана и геля гилана); FIdia S.p.A. Abano Terme, ItalyHyalgan, натриевая соль гиалуроновой кислоты из петушиного гребня (MB от 500,000 до 700,000); Kaken Pharmaceutical Co., Ltd., Tokyo,Japan Artz, 1% раствор гиалуроновой кислоты из петушиного гребня, (MB -700,000); PharmaciaAB, Stockholm, Sweden Healon, гиалуроновая кислота из петушиного гребня, (MB 4 х 104);Pronova Biopolymer, Inc., Portsmouth, NH высокомолекулярная (MB - 1,5-2,2x106) гиалуроновая кислота FCH, полученная из культур Streptococcus zooepidemicus; гиалуронат натрия MVIntergen Company, Purchase, NY гиалуроновая кислота из петушиного гребня, (MB 1 х 106);Diosynth Inc., Chicago, IL; Amerchol Corp., edison, NJ и Kyowa Hakko Kogyo Co., Ltd., Tokyo,Japan. После приготовления фармацевтические композиции могут храниться в стерильных флаконах в виде раствора, суспензии, геля, эмульсии, твердого или дегидратированного или лиофилизированного порошка. Такие композиции могут храниться в виде готовых к применению 46 форм или форм, требующих растворения перед введением (например, лиофилизированных). Один из конкретных вариантов осуществления изобретения относится к наборам, необходимым для получения единичной дозы введения препарата. В каждый набор может входить первый контейнер с высушенным белком и второй контейнер, содержащий водную композицию. В объем настоящего изобретения включены такие наборы, в состав которых входят одноили многокамерные предзаполненные шприцы; такие предзаполненные шприцы (например,шприцы для жидкостей и лиошприцы, такие какLyo-Ject, двухкамерный предзаполненный лиошприц) доступны от Vetter GmbH, Ravensburg,Germany. Применение. Продукты усеченных sTNFR могут быть полезны, как исследовательские реагенты, а также как терапевтические и диагностические агенты. Указанные усеченные sTNFRs можно использовать в диагностических тестах in vitro и/или in vivo для определения количества нативного sTNFR-I или sTNFR-II в образцах тканей и органов или для определения и/или выделения клеток, которые экспрессируют TNF(Scallion et al., (1995), supra). При тестировании тканей и органов радиоактивность от связанных с TNF 125I-усеченных sTNFRs будет меньше при сопоставлении со стандартизованной кривой связывания 125I-усеченных sTNFR в силу связывания немеченного нативного sTNFR-I илиsTNFR можно использовать для обнаружения присутствия TNF в клетках различных типов. Настоящим изобретением также предусмотрено использование продуктов усеченныхsTNFR для получения антител и применение данных антител (в частности, тех, которые связывают нативный sTNFR-I или sTNFR-II). Можно получить антитела, которые связывают усеченные sTNFRs, например, антитела к эпитопам аминокислотной последовательности R1[Cys19-Cys103]-R2 или к эпитопам аминокислотной последовательности R4-[Cys32-Cys115]-R5. Квалифицированный специалист может применить хорошо известные опубликованные методы для получения моноклональных и поликлональных антител или рекомбинантных антител,которые специфически распознают и связывают различные белки, кодируемые аминокислотными последовательностями, заявленными в настоящем изобретении. Подобные антитела можно использовать для очистки и характеристики полноразмерного, зрелого 30 кД ингибитораTNF и полноразмерного, зрелого 40 кД ингибитора TNF. Настоящее изобретение относится также к способам лечения конкретных заболеваний и клинических состояний (многие из которых могут быть охарактеризованы как воспалительные заболевания), которые опосредованы TNF. За 47 болевание или клиническое состояние считается"TNF-обусловленным заболеванием",если спонтанное или экспериментальное заболевание ассоциировано с повышенным содержаниемTNF в жидкостях тела или в тканях, прилегающих к фокусу заболевания. TNF-обусловленные заболевания можно также распознать по следующим двум условиям: (1) патологические проявления, ассоциированные с заболеванием,могут быть воспроизведены экспериментально на животных введением TNF и (2) патология,индуцируемая на животных моделях заболевания может быть подавлена или отменена лечением агентами, которые ингибируют действиеTNF. Многие из TNF-обусловленных заболеваний удовлетворяют двум из трех приведенных условий, а другие удовлетворяют всем трем условиям. В неполный список TNF-обусловленных заболеваний, а также связанных с ними проявлений и симптомов, которые можно лечить согласно способам, заявленным в настоящем изобретении, входят синдром респираторного дистресса у взрослых; кахексия/анорексия; рак (например, лейкозы); синдром хронической усталости; реакция трансплантат против хозяина; гиперальгезия; воспалительное заболевание кишечника; нейровоспалительные заболевания; ишемические/реперфузионные повреждения,включая церебральную ишемию (повреждение мозга в результате травмы, эпилепсии, геморрагии или инсульта, причем каждый из этих факторов может приводить к нейродегенерации); диабет (например, ювенильный сахарный диабет типа 1); рассеянный склероз; заболевания глаз; боль; панкреатит; фиброз легких; ревматические заболевания (например, ревматоидный артрит, остеоартрит, ювенильный (ревматоидный) артрит, серонегативный полиартрит, анкилозирующий спондилит, синдром Рейтера и реактивный артрит, псориатический артрит, энтеропатический артрит, полимиозит, дерматомиозит, склеродерма, системный склероз, васкулит,церебральный васкулит, синдром Шегрена, ревматическая лихорадка, полихондрит и ревматическая полимиалгия и полиартериит гигантских клеток); септический шок; побочные эффекты радиотерапии; системная красная волчанка; временное заболевание мандибулярного сустава; тироидит и пересадка тканей. Каждый продукт усеченных sTNFR может вводиться больным в терапевтически эффективных количествах для леченияTNFобусловленных заболеваний, как определено выше, включая такие острые и хронические воспаления, как ревматические заболевания 48 Продукт усеченного sTNFR можно применять путем местного, энтерального или парентерального введения, включая, без ограничений,внутривенное, внутримышечное, внутриартериальное, внутриоболочечное, внутрикапсулярное,внутриорбитальное, внутрисердечное, внутрикожное, интраперитонеальное, транстрахеальное, подкожное, подоболочечное, внутрисуставное, субкапсулярное, субарахноидальное,внутриспинальное,внутрижелудочковое и внутригрудинное введение или вливание. Продукт усеченного sTNFR можно также вводить орально или через слизистую оболочку, например, внутриназально, подъязычно, защечно или ректально для системной доставки. Предпочтительно вводить продукты усеченного sTNFR внутрисуставной, подкожной,внутримышечной или внутривенной инъекцией. Кроме того, продукт усеченного sTNFR можно вводить способом постоянного вливания (например, при помощи имплантированных или наружных устройств, обеспечивающих постоянную или прерывистую подачу препарата) с тем, чтобы постоянно обеспечивать нужный уровень продукта усеченного sTNFR в крови во время введения. Это достижимо, например, при использовании различных мини-насосов, таких как осмотический мини-насос. При таком способе введения можно быть уверенным, что количество препарата поддерживается на нужном уровне, можно брать пробы крови и контролировать количество препарата в кровотоке. Различные насосы коммерчески доступны от таких поставщиков, как MiniMed Inc., Sylmar, СА (например, МТ 507) и Alza Corp., Palo Alto, CA (например, осмотический насос Alzet, модель 2MLI). Считается также, что могут быть применены и другие способы постоянной или почти постоянной доставки. Например, химическая дериватизация может приводить к созданию форм поддерживаемого высвобождения белка, что сказывается на постоянном присутствии препарата в кровотоке в предсказуемых количествах,причем такое предсказание основывается на схеме дозировки. Способы применения продуктов усеченного sTNFR для лечения TNF-обусловленных заболеваний, включая воспалительные заболевания суставов (например, остеоартрит, псориатический артрит и ревматоидный артрит), описаны в заявке на европейский патент 567566, упоминаемой в настоящем описании в качестве ссылки. Согласно одному из конкретных вариантов осуществления изобретения, продукты усеченного sTNFR можно вводить внутрисуставно для лечения ревматоидного артрита и остеоартрита. Согласно другому конкретному примеру осуществления изобретения продукты усеченного sTNFR можно вводить подкожно или внутримышечно для лечения ревматоидного артрита, воспалительного заболевания ки 49 шечника, кахексии/анорексии или рассеянного склероза. Согласно еще одному конкретному примеру осуществления изобретения продукты усеченного sTNFR можно вводить внутривенно для лечения повреждений мозга в результате травмы, эпилепсии, геморрагии или инсульта или вводить внутрижелудочково для лечения повреждений мозга в результате травмы. Предпочтительный способ лечения артрита включает: (1) единичную внутрисуставную инъекцию продукта усеченного sTNFR, осуществляемую периодически для предотвращения или лечения приступа артрита, и (2) периодические подкожные инъекции продукта усеченного sTNFR. Лечение септического шока должно начинаться как можно скорее после септицемии или диагностирования возможности септицемии. Например, лечение может начинаться немедленно после хирургической операции или несчастного случая, или же в случае любого события, сопряженного с риском септического шока. Предпочтительные способы лечения синдрома респираторного дистресса у взрослых предусматривают: (1) единичное или многократное интратрахеальное введение продукта усеченногоsTNFR и (2) болюсные или постоянные внутривенные вливания продукта усеченного sTNFR. Еще один аспект изобретения относится к клеточной терапии, т.е. имплантации клеток,продуцирующих усеченный sTNFR. Данный вариант осуществления изобретения предусматривает имплантацию больным клеток, способных синтезировать и секретировать биологически активную форму усеченного sTNFR. Такими клетками могут быть клетки, которые в норме не продуцируют усеченный sTNFR, но были модифицированы для продукции усеченногоsTNFR, или же клетки, чья способность продуцировать усеченный sTNFR была улучшена путем трансформации полинуклеотидом, пригодным для экспрессии и секреции усеченногоsTNFR. Для минимизации возможной иммунологической реакции больного на введение усеченного sTNFR другого вида предпочтительно,чтобы исходные клетки имели человеческое происхождение, или чтобы клетки были инкапсулированы в материал, обеспечивающий защиту от иммунного распознавания, или же чтобы клетки были помещены в иммунологически привилегированные участки, такие как тестикулы, глаз или центральная нервная система. Больному могут быть имплантированы клетки человека или животных в биосовместимых полупроницаемых полимерных капсулах или мембранах, допускающих высвобождение усеченного sTNFR, но предотвращающих разрушение клеток иммунной системой больного или действие других неблагоприятных факторов со стороны окружающих тканей. Альтернативно, собственные клетки больного могут быть трансформированы ex vivo для продукции усе 003900 50 ченных sTNFRs и затем имплантированы больному без инкапсуляции. Способы мембранной инкапсуляции живых клеток известны квалифицированным специалистам и потому получение инкапсулированных клеток и их имплантация больным вполне могут быть проведены. В качестве одного из вариантов осуществления изобретения рассматривается генотерапияsTNFR нуклеотидная последовательность может быть введена в клетки-мишени путем локальной инъекции нуклеотидного конструкта с соответствующим вектором доставки или без него. Например, кодирующая усеченный sTNFR нуклеотидная последовательность может быть встроена в вектор на основе адено-ассоциированного вируса. К альтернативным вирусным векторам относятся (без ограничения перечисленными) векторы на основе ретровирусов, аденовирусов,вируса простого герпеса и вируса папилломы. Физический перенос как in vivo, так и ех vivo также приемлем и может быть осуществлен липосомным переносом, прямой инъекцией ("голой" ДНК), рецептор-опосредованным переносом (комплекс лиганд-ДНК) или бомбардировкой микрочастицами ("генное ружье"). Примеры способов клеточной и генной терапии описаны в патенте США 4,892,538,патенте США 5,011,472; патенте США 5,106,627; DE 4219626, WO 94/20517 и 96/22793,упоминаемых в настоящем описании в качестве ссылок. Независимо от способа введения, для лечения TNF-обусловленных заболеваний требуются дозы или схемы дозировок усеченногоsTNFR, эффективные для уменьшения или устранения симптомов заболевания. К другим факторам, от которых зависит соответствующая дозировка, относятся вид заболевания или клинического состояния, которое нужно вылечить или предотвратить, острота заболевания, способ введения, возраст, пол и клиническое состояние больного. Последующие вычисления, необходимые для уточнения соответствующей дозировки, могут быть легко выполнены квалифицированным специалистом, особенно с учетом специальной информации, приведенной в настоящем описании. Дозировку можно также определить с применением известных дозировочных тестов, используемых в сочетании с соответствующими данными "доза-ответ". Частота введений зависит от фармакокинетических параметров усеченных sTNFR в используемых фармакологических формах. Усеченные sTNFR можно вводить однократно или в случае острых и продолжительных расстройств вводить ежедневно меньшими дозами, или вводить в виде исходной болюсной дозы, за которой следуют постоянная доза или поддерживаемое высвобождение. При парентеральном вве 51 дении единичная парентеральная доза, например, может достигать 10 мг, обычно до 15 мг и более предпочтительно до 20 мг. При введении в полость сустава фармацевтическую композицию предпочтительно назначают в виде единичной инъекции, например, объемом от 3 до 10 мл или от 5 до 10 мг/мл усеченного sTNFR, растворенного в изотоническом фосфатном буферном растворе. Препарат можно вводить в полость сустава с частотой, например, один раз в 7-10 дней. При такой схеме введение производят постоянно, например, 4-5 раз, при необходимости изменяя дозу. В некоторых случаях введение продуктов усеченного sTNFR может являться частью сочетанной терапии совместно с другими фармацевтическими композициями, показанными для лечения данного заболевания. Продукт усеченного sTNFR и одно или несколько традиционных или новых противовоспалительных лекарств можно назначать раздельно или в комбинации. Продукты усеченного sTNFR (например,белки R1-[Cys19-Cys103]-R2) и любое одно или несколько дополнительных противовоспалительных лекарств можно назначать раздельно или в комбинации. Информацию о данных соединениях можно найти в руководстве "TheEdition, Merck, SharpDohme Research Laboratories, MerckCo., Rahway, NJ (1992) и в Pharmaprojects, PJB Publications Ltd. Существующее лечение TNF-обусловленных заболеваний, как определено выше, включая острые и хронические ревматические заболевания (например, болезнь Лайма, ювенильный(ревматоидный) артрит, остеоартрит, псориатический артрит, ревматоидный артрит и стафилококк-индуцированный ("септический") артрит),предусматривает прежде всего применение ряда препаратов для контроля боли и воспаления,классифицируемых как нестероидные противовоспалительные препараты (NSAIDs). Второй"эшелон" препаратов включает кортикостероиды, медленно действующие притиворевматические препараты (SAARDs) или препараты, модифицирующие заболевание (MD). В соответствии с конкретным вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2) в сочетании(предобработка, постобработка или конкурентная обработка) с одним или несколькимиNSAIDs для лечения TNF-обусловленных заболеваний, как определено выше, включая острые и хронические ревматические заболевания (например, болезнь Лайма, ювенильный (ревматоидный) артрит, остеоартрит, псориатический артрит, ревматоидный артрит и стафилококкиндуцированный ("септический") артрит) и заболевание "трансплантат против хозяина". 52 действие, по меньшей мере отчасти, подавляя синтез простагландинов (Goodman and Gilman inMcMillan, 7th Edition (1985. NSAIDs могут быть подразделены на девять групп: (1) производные салициловой кислоты; (2) производные пропионовой кислоты; (3) производные уксусной кислоты; (4) производные фенаминовой кислоты; (5) производные карбоновой кислоты;(6) производные масляной кислоты; (7) оксикамы; (8) пиразолы и (9) пиразолоны. Согласно конкретному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например,белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими производными салициловой кислоты, эфирами предлекарств или их фармацевтически приемлемыми солями. К производным салициловой кислоты, эфирам предлекарств и их фармацевтически приемлемым солям относятся: ацетаминосалол, алоксиприн, аспирин, бенорилат, бромосалигенин,ацетилсалицилат кальция, холин магний трисалицилат, дифлузинал, этерсалат, фендосал, гентизиновая кислота, гликолсалицилат, идмидазолсалицилат, лизин ацетилсалицилат, мезаламин, морфолин салицилат, 1-нафтил салицилат,олсалазин, парсалмид, фенил ацетилсалицилат,фенилсалицилат, салацетамид, салициламид Oуксусной кислоты, салсалат и сульфасалазин. Структурно родственные производные салициловой кислоты, имеющие сходные анальгезирующие и противовоспалительные свойства,также включены в эту группу. Согласно конкретному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например,белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими производными пропионовой кислоты, эфирами предлекарств или их фармацевтически приемлемыми солями. К производным пропионовой кислоты, эфирам предлекарств и их фармацевтически приемлемым солям относятся: алминопрофен, беноксапрофен, буклоксиковая кислота, карпрофен,дексиндопрофен, фенопрофен, флуноксапрофен,флурбипрофен, фурклопрофен, ибупрофен,ибупроксам, индопрофен, изопрофен, кетопрофен, локсопрофен, миропрофен, напроксен, оксапрозин, пикетопрофен, пимепрофен, пирпрофен, пранопрофен, протизиновая кислота, пиридоксипрофен, супрофен, тиапрофеновая кислота и тиоксапрофен. Структурно родственные производные пропионовой кислоты, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. Согласно конкретному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, 53 белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими производными уксусной кислоты, эфирами предлекарств или их фармацевтически приемлемыми солями. К производным уксусной кислоты, эфирам предлекарств и их фармацевтически приемлемым солям относятся: ацетамицин, алклофенак, амфенак, буфексамак, цинметацин, клопирак,дельметацин, диклофенак натрия, этодолак,фелбинак, фенклофенак, фенклорак, фенклозиновая кислота, фентиазак, фурофенак, глюкаметацин, ибуфенак, индометацин, изофезолак,изоксипак, лоназолак, метиазиновая кислота,оксаметацин, окспинак, пиметацин, проглюметацин, сулиндак, талметацин, тиарамид, тиопинак, толметин, зидометацин и зомепирак. Структурно родственные производные уксусной кислоты, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. Согласно конкретному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например,белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими производными фенаминовой кислоты, эфирами предлекарств или их фармацевтически приемлемыми солями. К производным фенаминовой кислоты, эфирам предлекарств и их фармацевтически приемлемым солям относятся энфенаминовая кислота,этофенамат, флуфенаминовая кислота, изониксин, меклофенаминовая кислота, меклофенамат натрия, медофенаминовая кислота, мефанаминовая кислота, нифлуминовая кислота, талнифлумат, терофенамат, толфенаминовая кислота и уфенамат. Структурно родственные производные фенаминовой кислоты, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. Согласно другому варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белкаR1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими производными карбоновой кислоты, эфирами предлекарств или их фармацевтически приемлемыми солями. К производным карбоновой кислоты, эфирам предлекарств и их фармацевтически приемлемым солям относятся: клиданак, дифлунизал, флуфенизал, иноридин, кеторолак и тиноридин. Структурно родственные производные карбоновой кислоты, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. Согласно еще одному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например,белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обра 003900 54 ботка) с одним или несколькими производными масляной кислоты, эфирами предлекарств или их фармацевтически приемлемыми солями. К производным масляной кислоты, эфирам предлекарств и их фармацевтически приемлемым солям относятся бумадизон, бутибуфен, фенбуфен и ксенбуцин. Структурно родственные производные масляной кислоты, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. Согласно другому варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белкаR1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими оксикамами, эфирами предлекарств или их фармацевтически приемлемыми солями. К оксикамам, эфирам предлекарств и их фармацевтически приемлемым солям относятся дроксикам, эноликам, изоксикам,пироксикам, судоксикам, теноксикам и 4 гидроксил-1,2-бензотиазин 1,1-диоксид 4-(Nфенил)-карбоксамид. Структурно родственные оксикамы, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. В соответствии с другим вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2 в сочетании(предобработка, постобработка или конкурентная обработка) с одним или несколькими пиразолами, эфирами предлекарств или их фармацевтически приемлемыми солями. К пиразолам,эфирам предлекарств и их фармацевтически приемлемым солям относятся: дифенамизол и эпиризол. Структурно родственные пиразолы,имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. В соответствии с другим вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2) в сочетании(предобработка, постобработка или конкурентная обработка) с одним или несколькими пиразолонами, эфирами предлекарств или их фармацевтически приемлемыми солями. К пиразолонам, эфирам предлекарств и их фармацевтически приемлемым солям относятся апазон, азапропазон, бензпиперилон, фепразон, мофебутазон, торазон, оксифенбутазон, фенилбутазон,пипебузон, пропилфеназон, рамифеназон, суксибузон и тиазолинобутазон. Структурно родственные пиразолоны, имеющие сходные анальгезирующие и противовоспалительные свойства,также включены в эту группу. В соответствии с другим вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2) в сочетании(предобработка, постобработка или конкурент 55 ная обработка) с одним или несколькими следующими NSAIDs: -ацетамидокапроиловая кислота, S-аденозинметионин, 3-амино-4 гидроксибутириловая кислота, амиксетрин, анитразафен, антрафенин, бендазак, бендазак лизинат,бензидамин, бепрозин, броперамол, буколом,буфезолак, ципроквазон, клоксимат, дазидамин,дебоксамет, детомидин, дифенпайрамид, дифенпирамид, дифисаламин, дитазол, эморфазон,фанетилизол месилат, фенфлумизол, флоктафенин, флумизол, флуниксин, флупроквазон, фопиртолин, фосфозал, кваймезал, квайзолен, изониксирн, лефетамин НСl, лефлуномид, лофемизол, лотифазол, лизин клониксинат, мезеклазон,набуметон, никтиндол, нимесулид, орготеин,опраноксин, оксацепролм, оксападол, паранилин, перизоксаль, перизоксаль цитрат, пифоксим, пипроксен, пиразолак, пирфенидон, проквазон, проксазол, тиелавин В, тифламизол, тимегадин, толектин, толпадол, триптамид и такие препараты, имеющие кодовые обозначения компаний, как 480156S, АА 861, AD1590,AFP802, AFP860, AI77B, АР 504, AU8001, ВРРС,BW540C, CHINOIN 127, CN100, ЕВ 382, EL508,F1044, FK-506, GV3658, ITF182, KCNTEI6090,КМЕ 4, LA2851, MR714, MR897, MY309,ONO3144, PR823, PV102, PV108, R830, RS2131,SCR152, SH440, SIR133, SPAS510, SQ27239,ST281, SY6001, ТА 60, TAI-901, 4-бензоил-1 инданкарбоксиловая кислота,TVX2707,U60257, UR2301 и Y41770. Структурно родственные NSAIDs, имеющие сходные анальгезирующие и противовоспалительные свойства,также включены в эту группу. В соответствии с одним вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например,белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими кортикостероидами, эфирами предлекарств или их фармацевтически приемлемыми солями для леченияTNF-обусловленных заболеваний, как определено выше, включая острые и хронические ревматические заболевания (например, болезнь Лайма, ювенильный (ревматоидный) артрит,остеоартрит, псориатический артрит, ревматоидный артрит и стафилококк-индуцированный("септический") артрит) и рассеянный склероз. К кортикостероидам, эфирам предлекарств и их фармацевтически приемлемым солям относятся гидрокортизон и такие соединения, полученные из гидрокортизона, как 21-ацетопрегненолон,алкломеразон, альгестон, амцинонид, беклометазон, бетаметазон, бетаметазон валерат, буденизонид, хлорпреднизолон, клобетазол, клобетазол пропионат, клобетазон, клобетазон бутират, клокортоколон, клопреднол, кортикостерон,кортизон, кортивазол, дефлазакон, дезонид, дезоксимеразон, дексаметазон, дифлоразон, дифлукортолон, дифлупреднат, эноксолон, флуазакорт, флуклоронид, флуметазон, флуметазон 56 пивалат, флунизолид, флуцинолон ацетонид,флуоцинонид, флуороцинолон ацетонид, флуорокортин бутил, флуорокортолон, флуорокортолон гексаноат, дифлукортолон валерат, флуорометолон, флуперолон ацетат, флупредниден ацетат, флупреднизолон, флуранденолид, формокортал, гальцинонид, галометазон, галопредон ацетат, гидрокортамат, гидрокортизон, гидрокортизон ацетат, гидрокортизон бутират, гидрокортизон фосфат, гидрокортизон 21-натрий сукцинат, гидрокортизон тебутат, мазипредон,медризон, мепреднизон, метилпредниколон,мометазон фуроат, параметазон, предникарбат,преднизолон, преднизолон 21-диэдриаминоацетат, преднизолон натрий фосфат, преднизолон натрий сукцинат, преднизолон натрий 21-mcyльфобензоат,преднизолон натрий 21 стеарогликолат, преднизолон тебутат, преднизолон 21-триметилацетат, преднизон, преднивал,преднилиден,преднилиден 21 диэтиламиноацетат, тиксокортол, триамцинолон, триамцинолон ацетонид, триамцинолон бенетонид и триамцинолон гексацетонид. Структурно родственные кортикостероиды,имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. Согласно другому конкретному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2) в сочетании(предобработка, постобработка или конкурентная обработка) с одним или несколькими медленно действующими противоревматическими препаратами (SAARDs) или противоревматическими препаратами, модифицирующими заболевание (DMARDs), эфирами предлекарств или их фармацевтически приемлемыми солями для лечения TNF-обусловленных заболеваний, как определено выше, включая острые и хронические ревматические заболевания (например,болезнь Лайма, ювенильный (ревматоидный) артрит, остеоартрит, псориатический артрит,ревматоидный артрит и стафилококкиндуцированный ("септический") артрит) и рассеянный склероз. К SAARDs или DMARDs,эфирам предлекарств и их фармацевтически приемлемым солям относятся: аллокупреид натрия, ауранофин, ауротиоглюкоза, ауротиоглюканид, азатиоприн, бреквинар натрия, буцилламин, кальций 3-ауротио-2-пропанол-1-сульфонат, хлорамбуцил, хлороквин, клобузарит, купроксолин, циклофосфамид, циклоспорин, дапзон, 15-дезоксиспергуалин, диацереин, глюкозамин, соли золота (например, золотая соль циклоквина, золотая соль тиомалата, золотая соль тиосульфата), гидроксихлороквин, гидроксимочевина, кебузон, левамизол, лобензарит,меллитин, 6-меркаптопурин, метотрексат, мизорибин, микофенолат мофетил, майорал, горчичный азот, D-пенницилламин, такие имидазолы пиридинола, как SKNF86002 и SB203580, рапа 57 мицин, тиолы, тимопоэтин и винкрестин. Структурно родственныеDMARDs, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. В соответствии с другим конкретным вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR(например, белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими ингибиторами СОХ 2, эфирами предлекарств или их фармацевтически приемлемыми солями для лечения TNF-обусловленных заболеваний,как определено выше, включая острое и хроническое воспаление. Примером ингибиторов СОХ 2, эфиров предлекарств или их фармацевтически приемлемых солей служит, например,целекоксиб. Структурно родственные ингибиторы СОХ 2, имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. В соответствии с другим конкретным вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR(например, белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими антимикробными препаратами, эфирами предлекарств или их фармацевтически приемлемыми солями для лечения TNF-обусловленных заболеваний, как опеределено выше, включая острое и хроническое воспаление. К антимикробным препаратам относятся, например, ампициллин,амоксициллин, ауреомицин, бацитрацин, цефтазидим, цефтриаксон, цефотаксим, цефахлор,цефалексин, цефрадин, ципрофлоксацин, клавулановая кислота, клоксациллин, диклоксациллан, эритромицин, флуклоксациллан, гентамицин, грамицидин, темилциллан, неомицин, оксациллан, пенициллин и ванкомицин. Структурно родственные антимикробные препараты,имеющие сходные анальгезирующие и противовоспалительные свойства, также включены в эту группу. В соответствии с другим конкретным вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR(например, белка R1-[Cys19-Cys103]-R2) в сочетании (предобработка, постобработка или конкурентная обработка) с одним или несколькими следующими препаратами для лечения TNFобусловленных заболеваний, как определено выше, включая острое и хроническое воспаление: талидомид; BN 50730; тенидап; Е 5531; тиапафант РСА 4248; нимесулид; панавир; ролипрам; PR 73401; пептид Т; MDL 201; 449 А; 58 Согласно другому конкретному варианту осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2) в сочетании(предобработка, постобработка или конкурентная обработка) с одним или несколькими дополнительными ингибиторами TNF для леченияTNF-обусловленных заболеваний, как опеределено выше, включая острое и хроническое воспаление. Ингибиторами TNF считаются соединения и белки, которые блокируют синтез TNFal., (1994), Lancet, 344:1105-1110; работы упоминаются в настоящем описании в качестве ссылок). В соответствии с определенным вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2 в сочетании(предобработка, постобработка или конкурентная обработка) с растворимым рекомбинантнымFas антигеном человека или его рекомбинантными вариантами (WO 96/20206 и Mountz et al.,J.Immunology, 155:4829-4837; EP 510 681; публикации упоминаются в настоящем описании в качестве ссылок). В заявке WO 96/20206 описан секретируемый Fas антиген человека (природный и рекомбинантный, включая Ig-слитый белок), способы выделения генов, ответственных за кодирование растворимого рекомбинантногоFas антигена человека, методы клонирования гена в приемлемых векторах и типах клеток, а также способы экспрессии гена для получения ингибиторов. В заявке EP 510691 описаны ДНК,кодирующие Fas антиген человека, включая растворимый Fas антиген, векторы для экспрессии указанных ДНК, и клетки-трансформанты,трансфицированные вектором. При парентеральном введении дозы слитого белка Fas антигена колеблются в пределах от 1 до 100 мкг/кг. В соответствии с определенным вариантом осуществления изобретения предложен способ применения продукта усеченного sTNFR (например, белка R1-[Cys19-Cys103]-R2) в сочетании(предобработка, постобработка или конкурентная обработка) с одним или несколькими ингибиторами интерлейкина-1 для лечения TNF 59 обусловленных заболеваний, как определено выше, включая острые и хронические ревматические заболевания (например, болезнь Лайма,ювенильный (ревматоидный) артрит, остеоартрит, псориатический артрит, ревматоидный артрит и стафилококк-индуцированный ("септический") артрит); повреждений мозга в результате травмы, эпилепсии, геморрагии или инсульта, а также рассеянного склероза. К ингибиторам интерлейкина-1 относятся антагонисты рецептора интерлейкина-1 (любые соединение, способные специфически предотвращать активацию клеточных рецепторов IL-1), такие как IL1ra, как описано ниже; анти-IL-1-рецептор антитела (например, EP 623674, упоминаемая в настоящем описании в качестве ссылки); IL-1 связывающие белки, такие как растворимые IL1-рецепторы (например, патент США 5,492,88,патент США 5,488,032, патент США 5,464,937,патент США 5,319,071 и патент США 5,180,812,упоминаемые в настоящем описании в качестве ссылок); анти-IL-1 моноклональные антитела(упоминаемая в настоящем описании в качестве ссылки) и другие соединения и белки, которые блокируют синтез in vivo или внеклеточное высвобождение IL-1. Антагонист рецептора интерлейкина-1 (IL1rа) - это белок человека, который действует как природный ингибитор IL-1. Предпочтительные антагонисты рецептора, а также способы их получения и способы их применения описаны в патенте США 5,075,222 (обозначаемом, как"патент 222"); WO 91/08285; WO 91/17184; AU 9173636; WO 92/16221; WO 93/21946; опубликованной международной заявкеUS 97/02131, в которой также описана фармацевтическая композиция, содержащая (а) эффективное количество полимера для контролируемого высвобождения (например, гиалуроновой кислоты) и (б) эффективное количество IL-1rа;WO 94/06457; WO 94/21275; FR 2706772; WO 94/21235; DE 4219626, WO 94/20517 и WO 96/22793, упоминаемых в настоящем описании в качестве ссылок. К данным белкам относятся как гликозилированные, так и негликозилированные антагонисты рецептора IL-1. Конкретно, три предпочтительные формыIL-1ra (IL-1ra IL-1ra и IL-1rax), полученные на основе одной кодирующей последовательности ДНК, заявлены и описаны в патенте США 5,075,222, Hannum et al., озаглавленном "Ингибиторы интерлейкина-1". Данный патент США, обозначаемый как "патент 222", специально включен в настоящее описание в качестве ссылки. Все три указанных ингибитора интерлейкина-1 обладают сходными функциональными и иммунологическими активностями. 60 Способы получения ингибиторов интерлейкина 1, в частности IL-1rax, также описаны в "патенте 222". Одним из способов предусмотрено выделение ингибиторов из моноцитов человека (где они в норме продуцируются). Второй из описанных способов предусматривает выделение гена, ответственного за кодирование IL-1ras,клонирование гена в удобных векторах и типах клеток, экспрессию гена для получения IL-1ras и выделение IL-1ras. Последний способ, который является частным случаем применения методов рекомбинантных ДНК в целом, наиболее предпочтителен для осуществления настоящего изобретения. Согласно конкретному варианту осуществления изобретения IL-1ra содержит Nконцевую метионильную группу в результате экспрессии в E.coli. В объем настоящего изобретения также входят модифицированные IL1ras. К модифицированным IL-1ras относятся,например, мутеины таких ингибиторов, в которых остатки цистеина заменены другой аминокислотой в одном или нескольких сайтах в аминокислотной последовательности природного ингибитора. Можно обеспечить сайтспецифическую реакцию таких мутеинов с функционализированными единицами полиэтиленгликоля (PEG) или с другими сульфгидрилсодержащими полиэфирами для получения форм IL-1ra-PEG. В опубликованной заявке WO 92/16221 описан ряд модифицированных формIL-1ra и способы получения таких PEGмодифицированных ингибиторов. К дополнительному классу ингибиторов интерлейкина-1 относятся соединения, способные специфически предотвращать активацию клеточных рецепторов IL-1. К таким соединениям относятся IL-1-связывающие белки, такие как растворимые рецепторы и моноклональные антитела. К указанным соединениям также относятся моноклональные антитела к рецепторам. К другому классу ингибиторов интерлейкина-1 относятся соединения и белки, которые блокируют in vivo синтез и/или внеклеточное высвобождение IL-1. К таким соединениям относятся агенты, которые влияют на транскрипцию генов IL-1 или процессинг IL-1 препротеинов. Выше приведены примеры, не исключающие других вариантов лечения, которые могут быть применены конкурентно с данными противовоспалительными соединениями, известными квалифицированному специалисту, или могут быть разработаны квалифицированным специалистом с учетом рекомендаций, приведенных в настоящем описании. Особенно предпочтительно получать композиции дополнительных противовоспалительных соединений в форме единичной дозировки для облегчения введения и постоянства дозировки. Под термином "форма единичной дозировки" понимаются физически дискретные еди
МПК / Метки
МПК: C07K 14/715, C12N 15/12, A61P 43/00, A61K 38/17
Метки: факторов, основе, опухолей, композиции, способы, фактора, некроза, рецепторы, композиций, применения, усеченные, указанных, фармацевтические
Код ссылки
<a href="https://eas.patents.su/30-3900-usechennye-receptory-faktora-nekroza-opuholejj-farmacevticheskie-kompozicii-na-ih-osnove-i-sposoby-primeneniya-ukazannyh-faktorov-i-kompozicijj.html" rel="bookmark" title="База патентов Евразийского Союза">Усеченные рецепторы фактора некроза опухолей, фармацевтические композиции на их основе и способы применения указанных факторов и композиций</a>
Предыдущий патент: Способ получения углеводородов и синтез-газа из углеводородсодержащей формации
Следующий патент: Способ обнаружения активности гепараназы млекопитающих и набор для осуществления способа
Случайный патент: Лечение отеков головного и спинного мозга ишемического, травматического, токсического и инфекционного генеза с помощью гипертонического раствора солей лития












