Диароматические соединения пропинила или диенила, промежуточные соединения, фармацевтические и косметические композиции на основе указанных соединений и применение косметических композиций.
Формула / Реферат
1. Диароматические соединения пропинила или диенила общей формулы (I)

где R1 является
(I) радикалом -СН3,
(II) радикалом -СН2-O-R6,
(III) радикалом -О-R6,
(IV) радикалом -CO-R7,
где R6 и R7 имеют значения, приведенные ниже,
Аr является радикалом, отвечающим следующей формуле (а):
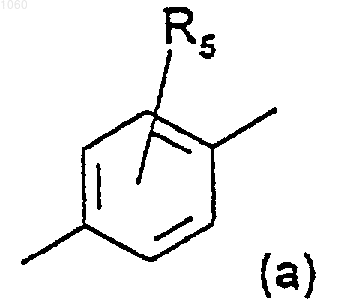
где R5 имеет значения, приведенные ниже,
Х является радикалом формулы
 или
или 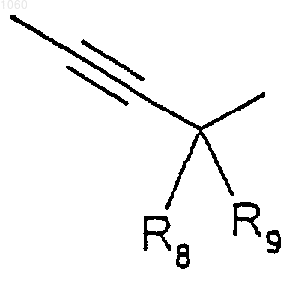 или
или 
где R8 и R9 имеют значения, приведенные ниже,
R2 и R3, одинаковые или различные, являются
(I) атомом водорода,
(II) линейным или разветвленным алкилом, имеющим 1-20 атомов углерода,
(III) радикалом -OR6,
(IV) радикалом -SR6,
где R6 имеет значение, приведенное ниже,
при этом R2 и R3 вместе могут образовывать с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,
при этом R2 и R3 не могут одновременно иметь значения (I), (III) и (IV), указанные выше,
R4 и R5, одинаковые или различные, являются атомом водорода, атомом галогена, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, радикалом -OR6,
при этом если R4 является гидроксилом, то R2 и R3 образуют с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,
R6 является атомом водорода, алкилом с 1-12 атомами углерода или радикалом -COR10,
где R10 имеет значения, определенные ниже,
R7 является
(а) атомом водорода,
(б) алкилом с 1-12 атомами углерода,
(в) радикалом формулы

где R' и R" имеют значения, определенные ниже,
(г) радикалом - OR11,
(д) радикалом -NHOR6,
где R11 имеет значения, определенные ниже,
R8 и R9, взятые отдельно, либо одновременно являются водородом или радикалом
-OR10, либо один является атомом водорода, а другой алкилом с 1-12 атомами углерода или, взятые вместе, образуют цикл -Y-(CH2)n-Y-, где Y является кислородом или серой, а n равен 2 или 3,
R10 является алкилом с 1-12 атомами углерода,
R11 является атомом водорода, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом, моно- или полигидроксиалкилом с 3-6 атомами углерода и 2-5 гидроксильными группами, арилом или аралкилом, таким как бензил или фенетил, которые могут быть замещены, или остатком сахара, или аминокислотным или пептидным остатком,
R' и R", одинаковые или различные, являются атомом водорода, алкилом с 1-12 атомами углерода, моно- или полигидроксиалкилом с 3-6 атомами углерода и 2-5 гидроксильными группами, арилом, который может быть замещен, или остатком аминокислоты или сахара, или вместе образуют гетероцикл,
а также их соли и их оптические и геометрические изомеры.
2. Соединения общей формулы (II)
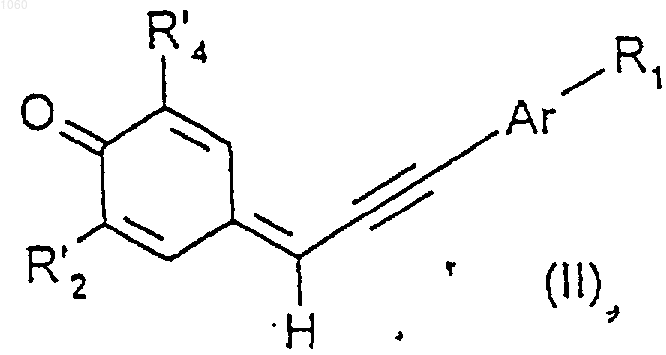
где R1 и Аr имеют те же значения, которые указаны для общей формулы (I) пo п.1, a R'2 и R'4, идентичные или различные, являются линейным или разветвленным алкилом, имеющим 1-20 атомов углерода.
3. Соединения по п.1 или 2, отличающиеся тем, что они представляют собой соли щелочного или щелочно-земельного металла, или цинка, или органического амина.
4. Соединения по п.1, отличающиеся тем, что взятые отдельно или в смеси они представляют собой группу следующих соединений:
-4-[3-(3,5-ди-трет-бутил-4-гидроксифенил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(3,5-ди-трет-бутил-4-гидроксифенил)-1-пропинил]бензойная кислота,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат,
-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(3-гидрокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензолметанол,
-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]диэтаноламинбензоат,
-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензоат лития,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(4,4-диметилтиохроман-6-ил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(8,8-диметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(5,5-диметил-3,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойная кислота,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]этилбензоат,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид,
N-этил-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид,
морфолид 4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойной кислоты,
N-(4-гидроксифенил)-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензальдегид,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]фенол,
-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензолметанол,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]толуол,
-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]гексилбензоат,
N-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид,
N-гидрокси-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид,
-2-метил-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота,
-3-метил-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота,
-6-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]никотиновая кислота,
-4-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]бензойная кислота,
-2-гидрокси-4-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]бензойная кислота,
-2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-бутинил]бензойная кислота,
-5-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]-2-пиридинкарбоновая кислота,
-4-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойная кислота,
-2-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]-4-тиофенкарбоновая кислота,
-2-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]-4-тиофенкарбоновая кислота,
-2-гидрокси-4-[3-(3-трет-бутил-4-метоксифенил)-1-пропинил]бензойная кислота,
-2-гидрокси-4-[3-(3-трет-бутил-4-гидроксифенил)-1-пропинил]бензойная кислота.
5. Соединения по п.2, отличающиеся тем, что отдельно или в смесях входят в группу, состоящую из
-4-[3-(3,5-ди-трет-бутил-4-оксю-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойной кислоты,
-2-гидрокси-4-[3-(3,5-ди-трет-бутил-4-оксо-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойной кислоты.
6. Соединения по п.1 или 2, отличающиеся тем, что для них выполняются, по крайней мере, одно и предпочтительно все следующие условия:
R1 является радикалом -CO-R7,
Ar является радикалом формулы (а).
7. Соединения по одному из пп.1, 3 или 6, отличающиеся тем, что они соответствуют формуле (I), описанной в п.1, где R8 и R9, взятые отдельно, либо являются атомами водорода, либо один является водородом, а другой алкилом с 1-12 атомами углерода.
8. Применение соединений формулы (I) или (II) по одному из предшествующих пунктов для использования в качестве лекарственного средства.
9. Применение по п.8, отличающееся тем, что лекарственное средство предназначено для лечения дерматологических заболеваний, связанных с нарушением кератинизации, обусловленной дифференциацией и пролиферацией, в частности, для лечения акне обыкновенного, юношеского, полиморфного, розового, кистозного, шаровидного, старческого, а также вторичных акне, например, вызванных солнечным медикаментозным воздействием или имеющих профессиональный характер; для лечения других типов нарушений кератинизации, в частности ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонно-подошвенные кератодермии, лейкоплакии и лейкоплакиеподобные состояния, кожный лишай или лишай слизистой (полости рта); для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительной и/или иммуноаллергической компонентой и, в частности, любых форм псориаза кожи, слизистой или ногтей и даже псориатического артрита, или кожной атопии, такой как экзема, или респиратурной атопии, а также гипертрофии десен; соединения могут быть также использованы для лечения некоторых воспалительных процессов, не связанных с нарушением кератинизации; для лечения дермических или эпидермических пролифераций как доброкачественных, так и злокачественных, вирусного или невирусного происхождения, например обыкновенные бородавки, плоские бородавки и бородавчатые эпидермодисплазии, оральный или багровый папиломатоз, и пролиферации, которые могут быть вызваны ультрафиолетовыми лучами, в частности базоцеллюлярные и спиноцеллюлярные эпителиомы; для лечения других дерматологических нарушений, таких как пузырчатый дерматоз или коллагеноз; для лечения некоторых офтальмологических заболеваний, в частности корнеопатий; для восстановления или борьбы со старением кожи как в результате воздействия света, так и возрастных факторов, а также для уменьшения пигментации и белковых кератозов, или любых патологий, связанных с возрастным или белковым старением; для профилактики или лечения признаков эпидермической и/или дермической атрофии, вызванной наружными или системными кортикостероидами, или других форм кожной атрофии; для профилактики или лечения нарушений процесса рубцевания или для заживления рубцов, для лечения нарушений функции сальных желез, например гиперсеборея акне или простая себорея; при лечении и профилактики раковых или предраковых состояний; при лечении некоторых воспалительных процессов, таких как артрит; при лечении любых вирусных общих или кожных заболеваний, например синдром Копоши; для профилактики или лечения облысения; при лечении дерматологических или общих заболеваний с иммунологической компонентой; при лечении заболеваний сердечно-сосудистой системы, таких как артериосклероз или гипертония, а также инсулинонезависимого диабета, при лечении кожных заболеваний, вызванных ультрафиолетовым облучением.
10. Фармакологическая композиция, отличающаяся тем, что содержит в фармацевтически приемлемом носителе, по крайней мере, одно соединение по одному из пп.1-7.
11. Композиция по п.10, отличающаяся тем, что концентрация соединения(ий) по одному из пп.1-7 составляет от 0,001 до 5 мас.% от общей массы композиции.
12. Косметическая композиция, отличающаяся тем, что она содержит в косметически приемлемом носителе, по крайней мере, одно из соединений по одному из пп.1-7.
13. Композиция по п.12, отличающаяся тем, что концентрация соединения(ий) по одному из пп.1-7 составляет от 0,001 до 3 мас.% от общей массы композиции.
14. Применение косметической композиции по одному из пп.12 или 13 для гигиены тела и волос.
Текст
1 Изобретение касается диароматических пропинильных или диенильных соединений. Оно касается также использования этих соединений в фармацевтических композициях, предназначенных для использования в медицине и ветеринарии, или же в косметических композициях. Соединения согласно изобретению имеют выраженную активность в отношении дифференциации и пролиферации клеток и могут найти применение, в частности, для наружного или системного лечения дерматологических заболеваний, связанных с нарушением кератинизации,дерматологических (или других) заболеваний с воспалительной или иммунноаллергической компонентой, и дермических или эпидермических пролифераций как доброкачественных, так и злокачественных. Кроме того, эти соединения могут быть использованы для лечения заболеваний, связанных с дегенерацией соединительных тканей, для борьбы со старением кожи как в результате воздействия света, так и возрастных факторов, а также для лечения нарушений процесса рубцевания. Кроме того, они могут найти применение в офтальмологии, в частности, для лечения корнеопатий. Можно также использовать соединения согласно изобретению в косметических композициях как гигиеническое средство для ухода за кожей и волосами. Соединения согласно изобретению соответствуют следующей общей формуле (I): или или где R8 и R9 имеют значения, приведенные ниже,R2 и R3, одинаковые или различные, являются(I) атомом водорода,(II) линейным алкилом или разветвленным алкилом, имеющим 1-20 атомов углерода,(III) радикалом -OR6, 001060(IV) радикалом -SR6,где R6 имеет значение, приведенное ниже,при этом R2 и R3 вместе могут образовывать с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или возможно прерван атомом кислорода или серы,при этом R2 и R3 не могут одновременно иметь вышеуказанные значения (I), (III) и (IV),R4 и R5, одинаковые или различные, являются атомом водорода, галогеном, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, радикалом -OR6,при этом, если R4 является гидроксилом,то R2 и R3 образуют с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или возможно прерван атомом кислорода или серы,R6 является атомом водорода, низшим алкилом или радикалом -COR10,где R10 имеет значения, определенные ниже,R7 является где R' и R имеют значения, определенные ниже,(г) радикалом -OR11,(д) радикалом -NHOR6; где R11 имеет значения, определенные ниже,R8 и R9, взятые отдельно, либо одновременно являются атомом водорода или радикалом -OR10, либо один является атомом водорода,а другой низшим алкилом, или, взятые вместе,образуют цикл -Y-(СН 2)n-Y-, где Y является кислородом или серой, а n равен 2 или 3,R10 является низшим алкилом,R11 является атомом водорода, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом, моно- или полигидроксиалкилом, арилом или аралкилом, возможно замещенным(ими), или остатком сахара,или остатком аминокислоты или пептида,R' и R" одинаковые или различные, являются атомом водорода, низшим алкилом, моноили полигидроксиалкилом, арилом, который может быть замещен, или остатком аминокислоты или сахара, или вместе образует гетероцикл. Изобретение касается также соединений,которые являются промежуточными продуктами синтеза соединений общей формулы (I), т.е. соединений общей формулы (II) где R1 и Аr имеют те же значения, что в общей формуле (I), a R'2 и R'4, идентичные или различные, являются линейным или разветвленным алкилом, имеющим 1-20 атомов углерода. Изобретение касается также солей соединений формул (I) и (II), когда R1 является функцией карбоновой кислоты, и геометрических или оптических изомеров вышеуказанных соединений формул (I) и (II). Если соединения согласно изобретению находятся в виде солей, то это предпочтительно,соли щелочного или щелочно-земельного металла, или цинка, или органического амина. Согласно изобретению под низшим алкилом подразумевается радикал, имеющий 1-12,предпочтительно 1-9 атомов углерода, предпочтительно метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, гексил, гептил, нонил,децил и додецил. Под линейным алкилом, имеющим 1-20 атомов углерода, подразумевается, в частности,метил, этил, пропил, пентил, гексил, октил, децил, додецил, гексадецил и октадецил. Под разветвленным алкилом, имеющим 1-20 атомов углерода, подразумевается, в частности, 2 этилгексил, 2-метилбутил, 2-метилпентил, 1 метилгексил, 3-метилгептил. Из моногидроксиалкилов предпочтителен радикал, имеющий 2 или 3 атома углерода, в частности, 2-гидроксиэтил, 2-гидроксипропил или 3-гидроксипропил. Из полигидроксиалкилов предпочтителен радикал, имеющий 3-6 атомов углерода и 2-5 гидроксигрупп, такой как 2,3-дигидроксипропил,2,3,4-тригидроксибутил,2,3,4,5 тетрагидроксипентил или остаток пентаэритритола. Из арилов предпочтителен фенил, который может быть замещен, по крайней мере, одним атомом галогена, одним гидроксилом или одной нитрогруппой. Из аралкилов предпочтителен бензил или фенэтил, который может быть замещен, по крайней мере, одним галогеном, одним гидроксилом или одной нитрогруппой. Из алкенилов предпочтителен радикал, содержащий 2-5 атомов углерода и имеющий одну или несколько этиленненасыщенных связей,таких как, в частности, аллил. Под остатком сахара подразумевается остаток, в частности, глюкозы, галактозы или маннозы, а также глюкуроновой кислоты. Под аминокислотным остатком подразумевается, в частности, остаток лизина, глицина или аспарагиновой кислоты, а под пептидным остатком подразумевается, в частности, дипеп 001060 4 тидный или трипептидный остаток, представляющий собой комбинацию аминокислот. Под гетероциклом подразумевается, предпочтительно, пиперидино-, морфолино-, пирролидино- или пиперазино-радикал, возможно,замещенный в положении 4 алкилом С 1-C6, или моно- или полигидроксиалкилом, таким как описано выше. Если R4 и R5 являются галогеном, то последний предпочтительно является фтором,бромом или хлором. Среди соединений формулы (I) в рамках настоящего изобретения можно указать, в частности, следующие:-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензальдегид,-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]фенол,-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил 2-нафтил)-1-пропинил]бензол метанол,-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]толуол,-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]гексилбензоат,-N-гидрокси-4-[3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензамид,N-гидрокси-2-гидрокси-4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензамид,-2-метил-4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензойная кислота,-3-метил-4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензойная кислота,-6-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]никотиновая кислота,-4-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]бензойная кислота,-2-гидрокси-4-[3-(5,5,8,8-тетраметил 5,6,7,8-тетрагидро-2-нафтил)пропа-1,2 диенил]бензойная кислота,-2-гидрокси-4-[3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-бутинил] бензойная кислота,-5-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]2-пиридинкарбоновая кислота,-4-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойная кислота,-2-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]-4-тиофенкарбоновая кислота,-2-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]-4-тиофенкарбоновая кислота,-2-гидрокси-4-[3-(3-трет-бутил-4-метоксифенил)-1-пропинил]-бензойная кислота,-2-гидрокси-4-[3-(3-трет-бутил-4-гидроксифенил)-1-пропинил]-бензойная кислота. Среди соединений формулы (II) в рамках настоящего изобретения можно привести, в частности, следующие соединения:-4-[3-(3,5-ди-трет-бутил-4-оксо-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойная кислота,-2-гидрокси-4-[3-(3,5-ди-трет-бутил-4 оксо-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойная кислота. Согласно настоящему изобретению наиболее предпочтительными соединениями формулR1 является радикалом -CO-R7,Аr является радикалом формулы (а). В частности, предпочтительными соединениями формулы (I) являются те, где R8 и R9,взятые отдельно, либо являются атомами водорода, либо один является водородом, а другой низшим алкилом. Наиболее предпочтительно R8 и R9 являются атомами водорода. Объектом настоящего изобретения являются способы получения соединений формул (I) и (II) согласно реакционным схемам, приведенным на фиг. 1, 2 и 3. Так, производные формулы (Iа) могут быть получены (фиг. 1) последовательным проведением реакций, включающим взаимодействие бензоилхлорида формулы (I) с ацетиленовым производным формулы (2) в присутствии кислоты Льюиса (например, AlCl3) в хлорсодержащем растворителе, таком как дихлорметан. Полученный таким образом кетон (3) восстанавливают до спирта (4), воздействуя гидридом щелочного металла, таким как боргидрид натрия, в спиртовом растворителе (например, метаноле). Восстановление спиртовой функции в карбид может осуществляться в присутствии иодида триметилсилана в растворителе, таком как гексан,или путем переноса гидрида от силана, такого как триэтилсилан, в присутствии BF3Et2O в хлорсодержащем растворителе, таком как метиленхлорид. Производные формулы (1 а) могут быть также получены (фиг. 1) последовательным проведением реакций, включающим взаимодействие бензоилхлорида формулы (1) с триметилацетиленидом лития в присутствии кислоты Льюиса (например, АlСl3) в хлорсодержащем растворителе, таком как дихлорметан. Полученный кетон (5) сначала восстанавливают до спирта (6), воздействуя гидридом щелочного металла, таким как боргидрид натрия, в спиртовом растворителе (например, метаноле), затем в карбид (7), например, путем переноса гидрида от силана, такого как триэтилсилан, в присутствии ВF3 Еt2 О в хлорсодержащем растворителе,таком как метиленхлорид. Затем осуществляют реакцию сочетания соединения (7) с галогенсодержащим производным (8), предпочтительно иодсодержащим или бромсодержащим в присутствии палладиевого катализатора [например,хлорид бис-(трифенилфосфин)-палладия (II)] в растворителе, таком как триэтиламин. Содинения формулы (1b) могут быть получены (фиг. 1) из кетонового производного (3) путем реакции с гликолем (этиленгликоль, пропиленгликоль) или дитиолом (этандитиол, пропандитиол) в присутствии паратолуолсульфонатпиридиния в ароматическом растворителе,таком как толуол, с азеотропным отделением образовавшейся воды. 7 Соединения формулы (1 а) могут быть также получены (фиг. 2) последовательностью реакций, включающей взаимодействие триметилсилилацетиленида лития с альдегидными соединениями (9) и снятие защиты с помощью фторида тетрабутиламмония в ТГФ и получение пропаргилового спирта (6). Затем осуществляют сочетание галогенсодержащего производного(8), предпочтительно иодсодержащего или бромсодержащего в присутствии палладиевого катализатора[например,хлорид бис(трифенилфосфин)-палладия (П)] в растворителе, таком как триэтиламин, и восстанавливают спиртовую функцию до карбида, как описано выше. Соединения формулы (1 с) могут быть получены (фиг. 2), исходя из производных пропаргилового спирта (15) путем восстановления спиртовой функции до карбида, как описано выше. Производные пропаргилового спирта (15) получают либо взаимодействием ацетиленида бора(12) (полученного ин ситу из фенилацетиленида лития (11) и трифторида бора при-78 С в ТГФ) с третичным бензамидом формулы (13) в органическом растворителе, таком как ТГФ,либо взаимодействием фенилацетиленида лития (11) с альдегидным производным (14). Соединения формулы (1 с) могут быть получены (фиг. 3) из соединений формулы (II) путем их обработки гидридом щелочного металла, таким как боргидрид натрия, в спиртовом растворителе (например, метаноле). Соединения же формулы (II) получают последовательным проведением реакций, исходя из гидроксибензальдегидных соединений (16), включающим защиту фенольной функции путем обработки 2(триметилсилил)этоксиметан-хлоридом(SEMCI) (17), затем взаимодействие с триметилсилил-ацетиленидом лития с получением соединения (18) и селективное снятие защитной триметилсилильной группы, имеющейся на ацетиленовой функции с помощью фторида тетрабутиламмония в ТГФ и получение пропаргилового спирта (19). Затем осуществляют реакцию сочетания с галогенсодержащим производным(8), предпочтительно иодсодержащим или бромсодержащим, в присутствии палладиевого катализатора(20). Удаление защитной группы (SEM) осуществляют с помощью трифторуксусной кислоты в хлорсодержащем растворителе, таком как метиленхлорид. Объектом настоящего изобретения являются также соединения вышеописанных формул(I) и (II) в качестве медикаментов. Эти соединения показывают активность в тесте на дифференциацию клеток (F9) эмбриональной тератокарциномы мыши (Cancer Re 001060search 43, р. 5268, 1983) и/или в тесте ингибирования орнитиндекарбоксилазы в результате наведения с помощью ТРА у мыши (Cancer Research 38, р. 793-801, 1978). Эти тесты демонстрируют активность соединений в области дифференциации и пролиферации клеток. Эти соединения имеют также преимущества с точки зрения кинетических параметров при фармацевтическом применении по сравнению с другими синтезированными соединениями типа ретиноидов (период полураспада и среднее время присутствия этих соединений в организме незначительны). Соединения формулы (I) или (II) согласно изобретению особенно подходят для использования в следующих областях медицины: 1) для лечения дерматологических заболеваний, связанных с нарушением кератинизации,обусловленной дифференциацией и пролиферацией, в частности, для лечения акне обыкновенного, юношеского, полиморфного, розового,кистозного, шаровидного, старческого, а также вторичных акне, таких, которые вызваны солнечным, медикаментозным воздействием или имеющих профессиональный характер,2) для лечения других типов нарушений кератинизации, в частности, ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонноподошвенные кератодермии, лейкоплакии и лейкоплакиеподобные состояния, кожный лишай или лишай слизистой (полости рта),3) для лечения других дерматологических заболеваний, связанных с нарушением кератинизации, имеющих воспалительную и/или иммуноаллергическую компоненту и, в частности,любых форм псориаза кожи, слизистой или ногтей, и даже псориатического артрита, или кожной атопии, такой как экзема, или респиратурной атопии, а также гипертрофию десен; соединения могут быть также использованы для лечения некоторых воспалительных заболеваний,не связанных с нарушением кератинизации,4) для лечения дермических или эпидермических пролифераций как доброкачественных, так и злокачественных, вирусного или невирусного происхождения, например обыкновенные бородавки, плоские бородавки и бородавчатые эпидермодисплазии, оральный или багровый папиломатоз, и пролиферации, которые могут быть вызваны ультрафиолетовыми лучами, в частности, базоцеллюлярные и спиноцеллюлярные эпителиомы,5) для лечения других дерматологических нарушений, таких как пузырчатый дерматоз и коллагеноз,6) для лечения некоторых офтальмологических заболеваний, в частности, корнеопатий,7) для восстановления или борьбы со старением кожи как старческим, так и в результате воздействия света, а также для уменьшения пигментации и белковых кератозов или любых 9 патологий, связанных с возрастным или белковым старением,8) для профилактики или лечения признаков эпидермической и/или дермической атрофии, вызванной местными или системными кортикостероидами, иди других форм кожной атрофии,9) для профилактики или лечения нарушений процесса рубцевания или заживления рубцов. 10) для лечения нарушений функции сальных желез, например, гиперсеборея акне или простая себорея,11) при лечении и профилактики раковых или предраковых состояний,12) при лечении некоторых воспалительных процессов, таких как артрит,13) при лечении любых вирусных общих или кожных заболеваний, например, синдром Копоши,14) для профилактики или лечения облысения,15) при лечении дерматологических или общих заболеваний с иммунологической компонентой,16) при лечении заболеваний сердечнососудистой системы, таких как артериосклероз или гипертония,а также инсулинонезависимого диабета,17) при лечении кожных заболеваний, вызванных ультрафиолетовым облучением. В вышеупомянутых областях терапии соединения согласно изобретению могут с успехом применяться в сочетании с другими соединениями, имеющими ретиноидную активность,с витаминами группы D и их производными, с кортикостероидами, с агентами, подавляющими свободные радикалы, с -гидрокси и -кетокислотами и их производными, или же с блокаторами ионных каналов. Под витаминами группы D и их производными подразумеваются, например, производные витамина D2 или D3 и, в частности 1,25-дигидрокси-витамин D3. Под агентами, подавляющими свободные радикалы,подразумеваются, например, -токоферол, Супер Оксид Дисмутат, Убихинол или некоторые агенты образования халатного элементорганического соединения металлов. Под -гидроксиили -кетокислотами или их производными подразумеваются, например, молочная, яблочная, лимонная, гликолевая, миндальная, винная,глицериновая или аскорбиновая кислоты или их соли, амиды или сложные эфиры. Наконец, под блокаторами ионных каналов подразумеваются,например,миноксидил(2,4-диамино-6 пиперидино-пиримидин-3-оксид) и его производные. Объектом настоящего изобретения являются также фармацевтические композиции, содержащие, по крайней мере, одно соединение формулы (I) или (II), или один из его оптиче 001060 10 ских или геометрических изомеров, или одну из его солей, в количестве, достаточном для терапевтического эффекта. Таким образом, объектом настоящего изобретения является фармацевтическая композиция, предназначенная, в частности, для лечения вышеописанных заболеваний, которая отличается тем, что содержит в фармацевтически приемлемом и совместимом со способом введения этой композиции носителе, по крайней мере,одно соединение формулы (I) или (II), или один из его оптических или геометрических изомеров, или одну из его солей. Композиции по изобретению предназначены для энтерального, парентерального, наружного и глазного введения. Композиции для энтерального введения могут находиться в виде таблеток, желатиновых капсул, драже, сиропов, суспензий, растворов,порошков, гранул, эмульсий, микросфер или наносфер, или липидных или полимерных везикул, обеспечивающих контролируемое высвобождение активного вещества. Композиции для парентерального введения могут находиться в виде растворов или суспензий для перфузии или для инъекций. Соединения согласно изобретению, как правило, вводятся в дневных дозах приблизительно от 0,01 до 100 мг/кг веса тела, 1-3 раза в день. Фармацевтические композиции на основе соединений согласно изобретению для наружного применения предназначены, в частности,для лечения кожи и слизистых поверхностей и могут находиться в виде мазей, кремов, молочка, порошка, пропитанных тампонов, растворов,гелей, спреев, лосьонов или суспензий. Они могут выпускаться также в виде микросфер или наносфер или липидных или полимерных везикул или полимерных пластырей и гидрогелей,обеспечивающих контролируемое высвобождение соединений. Эти композиции для наружного применения могут находиться либо в безводной, либо в водной форме, в зависимости от клинического назначения. Для офтальмологического применения композиции, как правило, находятся в виде примочек. Композиции для наружного или офтальмологического применения содержат, по крайней мере, одно соединение формулы (I) или (II),или один из его оптических или геометрических изомеров, или одну из его солей в концентрации предпочтительно от 0,001 до 5 маc.% от общей массы композиции. Соединения формулы (I) или (II) могут найти также применение в косметике, в частности, для гигиены тела и волос и, в частности,для обработки кожи с тенденцией к акне, для роста волос, против выпадения волос, для борьбы с жирной кожей и жирным видом волос, для защиты от негативных воздействий солнечных 11 лучей или для обработки физиологически сухой кожи, для профилактики и/или борьбы с возрастным старением кожи или в результате воздействия солнечного света. В области косметики соединения согласно изобретению целесообразно применять в сочетании с другими соединениями, например с соединениями, обладающими ретиноидной активностью, с витаминами группы D и их производными, с кортикостероидами, с агентами, подавляющими свободные радикалы, с -гидрокси и-кетокислотами и их производными, или же с блокаторами ионных каналов, описанных выше. Настоящее изобретение касается также косметической композиции, которая отличается тем, что содержит в косметически приемлемом и подходящем для наружного применения носителе, по крайней мере, одно соединение формулы (I) или (II), или один из его оптических или геометрических изомеров, или одну из его солей, причем эта косметическая композиция может быть, в частности, представлена в виде крема, молочка, лосьона, геля, микро- или наносфер, или липидных или полимерных везикул,мыла или шампуня. Концентрация соединения формулы (I) или(II) в косметических композициях по изобретению предпочтительно составляет от 0,001 до 3 мас.% от общей массы композиции. Фармацевтические или косметические композиции по изобретению могут, кроме того,содержать инертные, фармакодинамически или косметически активные добавки или комбинации этих добавок и, в частности, смачиватели,депигментирующие агенты, такие как гидрохинон, азелаиновая, кафеиновая или койевая кислоты; мягчители, гидратанты, такие как глицерол, PEG 400, тиаморфолинон и их производные или же мочевина; противосеборейные или антиугревые агенты, такие как s-карбоксиметилцистеин, S-бензил-цистеамин, или соли или их производные, или бензолилпероксид; антибиотики, такие как эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины; противогрибковые агенты, такие как кетоконазол или 4,5-полиметилен 3-изотиазолидоны; агенты, способствующие росту волос, такие как миноксидил (2,4 диамино-6-пиперидино-пиримидин-3-оксид) и его производные, диазоксид (7-хлор-3-метил 1,2,4-бензотиадиазин-1,1-диоксид) и фенитоин(5,4-дифенил-имидазолидин-2,4-дион); противовоспалительные нестероидные агенты; каротеноиды и, в частности, -каротин; противопсориазные агенты, такие как антаралин и его производные; и наконец,эйкоза-5,8,11,14 тетраинойная и эйкоза-5,8,11-триинойная кислоты, их сложные эфиры и амиды. Композиции согласно изобретению могут также содержать вкусовые добавки, консерванты, такие как сложные эфиры парагидроксибен 001060 12 зойной кислоты, стабилизаторы, регуляторы влажности, регуляторы рН, модификаторы осмотического давления, эмульгаторы, УФ-А и УФ-В фильтры, антиоксиданты, такие как токоферол, бутилгидроксианизол или бутилгидрокситолуол. В качестве иллюстрации даны неограничивающие примеры получения активных соединений формулы (I) или (II), а также конкретные рецептуры на основе этих соединений. В приведенных примерах концентрации даны в мас.%,если не оговорено иного. Пример 1. 4-[3-(3,5-ди-трет-бутил-4-оксо 2,5-циклогексадиен-1-илиден)-1-пропинил]бензойная кислота.(а) 3,5-ди-трет-бутил-4-(2-триметилсилилэтоксиметокси)бензальдегид. В колбу вводят 12,3 г (52 ммолей) 3,5-дитрет-бутил-4-гидробензальдегида и 100 мл ТГФ. Добавляют последовательно 10 мл (58 ммолей) диизопропилэтиламина и 10,3 мл (58 ммолей) 2 триметилсилилэтоксиметанхлорида и кипятят с обратным холодильником в течение 3 ч. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя смесью этилацетата и гексана (3/97 об.%). После выпаривания растворителей, получают 15,6 г-триметилсилилэтинил-3,5-ди-третбутил-4-(2-триметилсилилэтоксиметокси)бензолметанол В трехгорлую колбу вводят 6,6 мл (46,5 ммолей) триметилсилилацетилена и 50 мл ТГФ. При температуре -78 С и в потоке азота прикапывают раствор 18,6 мл (46,5 ммолей) нбутиллития (2,5 М раствор в гексане) и оставляют для поднятия температуры до комнатной. Этот раствор прикапывают в раствор 15,4 г(42,3 ммолей) 3,5-ди-трет-бутил-4-(2-триметилсилилэтоксиметокси)бензальдегида в 50 мл ТГФ при температуре -78 С. Реакционную среду оставляют для поднятия температуры до комнатной, выливают в водный раствор хлорида аммония, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Получают 18,5 г (95%) целевого спирта в виде желтого масла.(в) -этинил-3,5-ди-трет-бутил-4-(2-триметилсилил-этоксиметокси)бензолметанол В колбу вводят 18,5 г (40 ммолей) триметилсилил-этинил-3,5-ди-трет-бутил-4-(2 триметилсилилэтоксиметокси)бензолметанола и 50 мл ТГФ и прикапывают 40 мл (44 ммолей) раствора фторида тетрабутиламмония (1,1 М раствор в ТГФ). Перемешивают при комнатной температуре в течение часа, выливают реакционную среду в воду, экстрагируют этиловым 13 эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя смесью этилацетата и гексана (5-95 об.%). После выпаривания растворителей, получают 13,5 г (86%)(г) 4-3-гидрокси-3-[3,5-ди-трет-бутил-4(2-триметилсилилэтоксиметокси)фенил]-1 пропинилметилбензоат В трехгорлую колбу вводят 6 г (15,4 ммолей) -этинил-3,5-ди-трет-бутил-4-(2-триметилсилилэтоксиметокси)бензолметанола, 4,1 г (15,4 ммолей) 4-иодметилбензоата и 50 мл триэтиламина. Реакционную среду дегазируют азотом в течение 30 мин, затем последовательно добавляют 820 мг (1,2 ммоля) бис(трифенилфосфин) палладий (II) хлорида и 360 мг (1,9 ммоля) иодида меди. Перемешивают при комнатной температуре в течение 4 ч, реакционную среду выпаривают досуха, полученный остаток поглощают водой и этиловым эфиром. Органическую фазу декантируют, сушат на сульфате магния,затем выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя смесью дихлорметана и гептана (80/20 об.%) и получают 6,7 г (84%) 4-3 гидрокси-3-[3,5-ди-трет-бутил-4-(2-триметилсилилэтоксиметокси)фенил]-1-пропинилметилбензоата с температурой плавления 91-92 С.(д) 4-3-гидрокси-3-[3,5-ди-трет-бутил-4(2-триметилсилилэтоксиметокси)фенил]-1 пропинилбензойная кислота В колбу вводят 2,4 г (4,6 ммоля) вышеполученного сложного эфира, 8,4 г (200 ммолей) гидроксида лития и 100 мл ТГФ. Нагревают с обратным холодильником в течение 18 ч и реакционную среду выпаривают досуха. Остаток поглощают водой, подкисляют до рН 1, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния и выпаривают. Остаток растирают в порошок в гептане, фильтруют и получают 2,2 г (94%) целевой кислоты с температурой плавления 155156 С.(е) 4-[3-(3,5-ди-трет-бутил-4-оксо-2,5 циклогексадиен-1 илиден)-1-пропинил]бензойная кислота В трехгорлую колбу вводят 2,2 г (4,7 ммоля) 4-3-гидрокси-3-[3,5-ди-трет-бутил-4-(2 триметилсилилэтоксиметокси)фенил]-1-пропинилбензойной кислоты и 75 мл дихлорметана. Добавляют при температуре -78 С 365 мкл (4,7 ммоля) трифторуксусной кислоты и оставляют для поднятия температуры до комнатной. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния и выпаривают. Полученный остаток порошкуют в гептане, 001060(90%) 4-[3-(3,5-ди-трет-бутил-4-оксо-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойной кислоты с температурой плавления 216-218 С. Пример 2. 4-[3-(3,5-ди-трет-бутил-4-гидроксифенил-1-пропинил]бензойная кислота. В трехгорлую колбу вводят 756 мг (2 ммоля) 4-[3-(3,5-ди-трет-бутил-4-оксо-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойной кислоты и 50 мл смеси (50-50) ТГФ и метанола. При 0 С добавляют 152 мг (4 ммоля) боргидрида натрия и оставляют для поднятия температуры до комнатной. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния и выпаривают. Полученный остаток порошкуют в гептане с обратным холодильником,фильтруют и высушивают. Получают 510 мг(а) 2-гидрокси-4-3-гидрокси-3-[3,5-дитрет-бутил-4-(2-триметилсилилэтоксиметокси) фенил]-1-пропинилметилбензоат Аналогично примеру 1 (г), путем реакции 6,7 г (17,3 ммолей) -этинил-3,5-ди-трет-бутил 4-(2-триметилсилилэтоксиметокси)бензолметанола с 4,8 г (17,3 ммолей) 2-гидрокси-4 иодметилбензоата, получают 8,5 г (91%) целевого сложного эфира в виде желтого масла.(б) 2-гидрокси-4-3-гидрокси-3-[3,5-дитрет-бутил-4-(2-триметилсилилэтоксиметокси) фенил]-1-пропинилбензойная кислота Аналогично примеру 1 (д), но исходя из 8,4 г (15,5 ммолей) 2-гидрокси-4-3-гидрокси-3[3,5-ди-трет-бутил-4-(2-триметилсилилэтоксиметокси)фенил]-1-пропинилметилбензоата получают 7,4 г (91%) целевой кислоты с температурой плавления 146-147 С.(в) 2-гидрокси-4-[3-(3,5-ди-трет-бутил-4 оксо-2,5-циклогексадиен-1-илиден)-1-пропинил] бензойная кислота Аналогично примеру 1 (е), но исходя из 2,6 г (5 ммолей) 2-гидрокси-4-3-гидрокси-3-[3,5 ди-трет-бутил-4-(2-триметилсилилэтоксиметокси)фенил]-1-пропинилбензойной кислоты получают 1,7 г (89%) 2-гидpoкcи-4-[3-(3,5-дитрет-бутил-4-оксо-2,5-циклогексадиен-1-илиден)-1-пропинил]бензойной кислоты, плавящейся при 203 С с разложением. Пример 4. 2-гидрокси-4-[3-(3,5-ди-третбутил-4-гидроксифенил)-1-пропинил]бензойная кислота. Аналогично примеру 2, но исходя из 1 г(а) 4-триметилсилилэтинилметилбензоат В трехгорлую колбу в потоке азота вводят 21,5 г (0,1 моля) 4-бромметилбензоата, 300 мл триэтиламина и смесь из 200 мг ацетата палладия и 400 мг трифенилфосфина. Затем добавляют 20 г (0,20 моля) триметилсилилацетилена,постепенно нагревают до 90 С в течение 1 ч и выдерживают при этой температуре в течение 5 ч. Реакционную среду охлаждают, отфильтровывают соль и выпаривают. Остаток обрабатывают 200 мл хлористо-водородной кислоты (5%) и 400 мл эфилового эфира. Органическую фазу декантируют, промывают водой, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя дихлорметаном. После выпаривания растворителей получают 23 г (100%) целевого продукта в виде бесцветного масла.(б) 4-[3-оксо-3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]метилбензоат В колбу вводят 8,4 г (36 ммолей) 5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтоилхлорида, 6,9 г (29,7 ммолей) 4-триметилсилилэтинилметилбензоата и 100 мл дихлорметана. При 0 С небольшими порциями добавляют 16,8 г (125 ммолей) АlСl3 и перемешивают при комнатной температуре в течение 8 ч. Реакционную смесь выливают на лед, экстрагируют дихлорметаном, органическую фазу декантируют, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя смесью дихлорметана и гексана (50/50 об.%). Получают 6,8 г (61%) целевого продукта с температурой плавления 113-114 С.(в) 4-[3-гидрокси-3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат В колбу вводят 4,7 г (125 ммолей) ранее полученного продукта и 100 мл метанола. Охладив содержимое до 0 С, добавляют последовательно 5,7 г (150 ммолей) СеСl2, 7 Н 2 О и 530 мг(125 ммолей) боргидрида натрия и перемешивают при комнатной температуре в течение 4 ч. Реакционную среду выливают в смесь воды и этилового эфира, органическую фазу декантируют, промывают водой, сушат на сульфате магния и выпаривают. Полученный остаток порошкуют в 100 мл гексана, отфильтровывают и высушивают. Получают 4 г (85%) целевого продукта с температурой плавления 142-143 С.(г) 4-[3-гидpoкcи-3-(5,6,7,8-тeтpaгидpo5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота Аналогично примеру 1 (д), но исходя из 1,7 г (4,5 ммоля) ранее полученного метилового(д) 4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота В трехгорлую колбу в потоке азота вводят 2,1 г (8,1 моля) ВF3 Еt2 О (48%) и 50 мл дихлорметана. При температуре -20 С добавляют 2,6 мл (16,2 ммоля) триэтилсилана, затем раствор 1 г(2,7 ммоля) 4-[3-гидрокси-3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойной кислоты в 30 мл дихлорметана, перемешивают при комнатной температуре в течение 30 мин. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя дихлорметаном. После выпаривания растворителей получают 780 мг(a) -Триметилсилилэтинил-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанол В трехгорлую колбу вводят 17,13 мл (0,121 моля) триметилсилилацетилена и 100 мл ТГФ. При температуре -78 С в потоке азота прикапывают раствор 48,5 мл (0,121 моля) п-бутиллития(2,5 М в гексане) и оставляют для поднятия температуры до комнатной. Этот раствор прикапывают в раствор 23,8 г(0,11 моля) 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин-карбоксальдегида в 100 мл ТГФ при -78 С. Реакционную среду оставляют для поднятия температуры до комнатной, выливают в водный раствор хлорида аммония, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя смесью дихлорметана и гексана (50/50 об.%). После выпаривания растворителей получают 29,9 г (86%) целевого спирта в виде желтого масла.-этинил-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафталин)метанол В колбу вводят 29,9 г (95,2 ммолей) триметилсилилэтинил-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафталин)метанола и 100 мл ТГФ и прикапывают 103,8 мл (114,2 ммолей) раствора фторида тетрабутиламмония (1,1 М в ТГФ). Перемешивают при комнатной температуре в течение часа, выливают реакционную среду в воду, экстрагируют этиловым эфиром,декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный 17 остаток очищают хроматографией на кремниевой колонке, элюируя смесью этилацетата и гексана (1/4 объема). После испарения растворителей, получают 18,1 г (79%) -этинил(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с температурой плавления 5657 С.(в) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]метилбензоат Аналогично примеру 1 (г), но исходя из 10,3 г (42,5 ммоля) -этинил-5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафталин)метанола с 11,8 г(42,5 ммоля) 2-гидрокси-4-иодметилбензоата получают 13,6 г (82%) целевого метилового сложного эфира с температурой плавления 9293 С.(г) 2-гидрокси-4[3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-пропинил] метилбензоат Аналогично примеру 5 (д), но исходя из 1 г(2,6 ммоля) полученного выше метилового сложного эфира получают 210 мг (22%) 2 гидрокси-4[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоата с температурой плавления 75-77 С. Пример 7. 2-гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота.(а) 2-гидрокси-4-[3-гидрокси-3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензойная кислота Аналогично примеру 1 (д), но исходя из 8,5 г (21,6 ммоля) 2-гидрокси-4[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]метилбензоата получают 7,8 г (95%) целевой кислоты, плавящейся при 203C с разложением.(б) 2-гидрокси-4-[3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота Аналогично примеру 5 (д), но исходя из 1 г(а) 3-метоксиэтоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-бромнафталин В трехгорлую колбу в потоке азота вводят 720 мг (24 ммоля) гидрида натрия (80%-ая эмульсия в масле) и 50 мл ДМФ. Прикапывают раствор 5,7 г (20 ммолей) 3-бром-5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтола, растворенного в 75 мл ДМФ и перемешивают до прекращения выделения газа. При 0 С добавля 001060 18 ют 6,8 мл (59,3 ммолей) метоксиэтоксиметанхлорида и перемешивают в течение 4 ч. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Получают 16,6 г (91%) целевого продукта в виде масла.(б) 3-метоксиэтоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтилкарбоксальдегид В трехгорлую колбу в потоке азота вводят 16,3 г (44 ммоля) 3-метоксиэтоксиметокси 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-бромнафталина и 50 мл ТГФ. При -78 С прикапывают 19,3 мл п-бутиллития (2,5 М раствор в гексане) и перемешивают в течение 30 мин, затем добавляют 3,7 мл (48,4 ммолей) ДМФ и оставляют для поднятия температуры до комнатной. Реакционную среду выливают в водный раствор хлорида аммония, экстрагируют этиловым эфиром, осветляют органическую фазу, сушат на сульфате магния и выпаривают. Получают 13,9 г (100%) целевого альдегида в виде масла.-этинил-(3-метоксиэтоксиметокси 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанол Аналогично примеру 1 (в), но исходя из 17 г (40,6 ммолей) -триметилсилилэтинил-(3 метоксиэтоксиметокси-5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафталин)метанола получают 12,4 г (88%) -этинил-(3-метоксиэтоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола в виде масла.(д) 2-гидрокси-4-[3-гидрокси-3-(3-метоксиэтоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]метилбензоат Аналогично примеру 1 (г) путем реакции 7,1 г (20,5 ммолей) -этинил-(3-метоксиэтоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталин)метанола с 5,7 г (20,5 ммолей) 2-гидрокси-4-иодметилбензоата получают 9,6 г (94%) метилового сложного эфира в виде масла.(е) 2-гидрокси-4-[3-гидрокси-3-(3-метоксиэтоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота Аналогично примеру 1 (д), но исходя из 9 г(21,6 ммолей) вышеполученного метилового сложного эфира получают 7,8 г (89%) целевой кислоты с точкой плавления 106-108 С.(ж) 2-гидрокси-4-[3-(3-гидрокси-5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензойная кислота Аналогично примеру 5 (д), но исходя из 1,7 г (3,5 ммолей) 2-гидрокси-4-[3-гидрокси-3(3-метоксиэтоксиметокси-5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-пропинил] бензойной кислоты получают 670 мг (50%) целевой кислоты с точкой плавления 216-217 С. Пример 9. 2-гидрокси-4[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензолметанол. В трехгорлую колбу в потоке азота вводят 760 мг (2,2 ммоля) 2-гидрокси-4-[3-(5,6,7,8 тетрагидротетраметил-2-нафтил)-1-пропинил] метилбензоата и 20 мл толуола. При -78 С добавляют 4,4 мл гидрида диизобутилалюминия(1 М раствор в толуоле) и поднимают температуру до комнатной. Последовательно вводят 9 мл метанола, затем 9 мл хлористо-водородной кислоты (1N). Реакционную среду выливают в смесь этилацетата и воды, декантируют органическую фазу, сушат на сульфате магния, затем выпаривают. Полученный осадок очищают хроматографией на колонке из двуокиси кремния,элюируя смесью этилацетата и гептана (50/50 об.%). После испарения растворителей получают 200 мг (30%) целевого спирта с температурой плавления 94-95 С. Пример 10. 2-гидрокси-4[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]диэтаноламинбензоат. В колбу вводят 100 мл (2,76 ммоля) 2 гидрокси-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойной кислоты, 5 мл метанола и добавляют 29 мл (2,76 ммолей) диэтаноламина. Перемешивают в течение часа, реакционную среду выпаривают досуха,полученный остаток порошкуют в смеси гептана и этилового эфира (50-50). Отфильтровывают твердый продукт и высушивают. Получают 100 мг (78%) соли диэтаноламина с температурой плавления 100-105 С. Пример 11. 2-гидрокси-4[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензоат лития. Аналогично примеру 10 путем реакции 200 мг(5,5 молей) 2-гидрокси-4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензойной кислоты и 23 мг (5,5 ммолей) гидратированного гидроксида лития получают 150 мг (74%) целевого продукта с температурой плавления 225-229 С. Пример 12. 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-пропинил]бензойная кислота. Аналогично примеру 5 (д), но исходя из 1,66 г (4,6 ммолей) 4-[1-гидрокси-3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2 пропинил]бензойной кислоты (полученной по примеру 10 (б) патента ЕР 0 661 258) получают 310 мг (19,5%) 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 001060 20 тетраметил-2-нафтил)-2-пропинил]бензойной кислоты с температурой плавления 159-160 С. Пример 13. 2-гидрокси-4-[3-(4,4-диметилтиохроман-6-ил)-1-пропинил]-бензойная кислота. Аналогично примеру 5 (д), но исходя из 750 мг (2 ммоля) 2-гидрокси-4-[3-гидрокси-3(4,4-диметилтиохроман-6-ил)-1-пропинил]бензойной кислоты (полученной по примеру 19 патента ЕР 0 661 258), получают после хроматографии на колонке из диоксида кремния, элюируя смесью дихлорметана и метанола (80-20),340 мг (28%) 2-гидрокси-4-[3-(4,4-диметилтиохроман-6-ил)-1-пропинил]бензойной кислоты с точкой плавления 195-196 С. Пример 14. 2-гидрокси-4-[3-(8,8-диметил 5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойная кислота.(а) 2-гидрокси-4-[3-оксо-(8,8-диметил 5,6,7,8-тетрагидро-2-нафтил)-1-пропинил] метилбензоат В колбу вводят 12 г (54 ммолей) 8,8 диметил-5,6,7,8-тетрагидро-2-нафтоилхлорида,14,7 г (59 молей) 2-гидрокси-4-триметилсилилэтинилметилбензоата (полученного по примеру 5 (а) патента ЕР 0 661 258) и 200 мл дихлорметана. При 0 С небольшими порциями добавляют 21,6 г (162 ммолей) АlСl3 и перемешивают при комнатной температуре в течение 8 ч. Реакционную смесь выливают на лед, экстрагируют дихлорметаном, органическую фазу декантируют, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния,элюируя смесью дихлорметана и гексана(б) 2-гидрокси-4-[3-гидрокси-(8,8-диметил 5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]метилбензоат В колбу вводят 7,95 г (22 ммоля) 2 гидрокси-4-[3-оксо-(8,8-диметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]метилбензоата,150 мл ТГФ и 20 мл метанола. Небольшими порциями добавляют 660 мг (17,4 ммолей) боргидрида натрия и перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь выливают на лед, нейтрализуют хлористоводородной кислотой, экстрагируют этилацетатом, органическую фазу декантируют, промывают водой, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния,элюируя смесью гептана и этилацетата (80-20). После выпаривания растворителей получают 3,8 г (47,5%) целевого продукта в виде масла.(в) 2-гидрокси-4-[3-(8,8-диметил-5,6,7,8 тетрагидро-2-нафтил)-1-пропинил]метилбензоат Аналогично примеру 5 (д), но исходя из 4 г(11 ммолей) полученного выше метилового сложного эфира получают 1,13 г (29,5%) 2 гидрокси-4-[3-(8,8-диметил-5,6,7,8-тетрагидро 21 2-нафтил)-1-пропинил]метилбензоата в виде оранжевого масла.(г) 2-гидрокси-4-[3-(8,8-диметил-5,6,7,8 тетрагидро-2-нафтил)-1-пропинил]бензойная кислота Аналогично примеру 1 (д), но исходя из 1 г(2,9 ммоля) полученного выше метилового эфира получают 370 мг (39%) 2-гидрокси-4-[3-(8,8 диметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойной кислоты с температурой плавления 185-187 С. Пример 15. 2-гидрокси-4[3-(5,5-диметил 5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]бензойная кислота.(а) 2-гидрокси-4-[3-оксо-3-(5,5-диметил 5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]метилбензоат Аналогично примеру 14 (а) путем реакции 4,7 г (21 ммоль) 5,5-диметил-5,6,7,8-тетрагидро 2-нафтоилхлорида с 5,7 г (22,8 ммоля) 2 гидрокси-4-триметилсилилэтинилметилбензоата (полученного по примеру 5 (а) патента ЕР 0 661 258), получают 5,14 г (68,5%) целевого метилового сложного эфира с температурой плавления 89-90 С.(б) 2-гидрокси-4-[3-гидрокси-3-(5,5-диметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил] метилбензоат Аналогично примеру 14 (б), но исходя из 2,4 г (6,6 ммоля) 2-гидрокси-4-[3-оксо-3-(5,5 диметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]метилбензоата получают 1,6 г (67%) 2 гидрокси-4-[3-гидрокси-3-(5,5-диметил-5,6,7,8 тетрагидро-2-нафтил)-1-пропинил]метилбензоата в виде оранжевого масла.(в) 2-гидрокси-4-[3-гидрокси-3-(5,5-диметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил] бензойная кислота Аналогично примеру 1 (д), но исходя из 1,61 г (4,4 ммоля) полученного выше метилового сложного эфира получают 1,2 г (77,4%) целевой кислоты с температурой плавления 141142 С.(г) 2-гидрокси-4-[3-(5,5-диметил-5,6,7,8 тетрагидро-2-нафтил)-1-пропинил]бензойная кислота Аналогично примеру 5 (д), но исходя из 580 мг (1,65 ммоля) 2-гидрокси-4-[3-гидрокси-3(5,5-диметил-5,6,7,8-тетрагидро-2-нафтил)-1 пропинил]бензойной кислоты получают 470 мг(а) метоксиаллен В трехгорлую колбу и в атмосфере аргона вводят 210 мл (2,5 моля) пропаргилметилэфира и 12 г (0,11 моля) трет-бутилата калия. Реакционную смесь нагревают с обратным холодильником в течение 3 ч и дистиллируют при атмосферном давлении и собирают фракцию, отго 001060(б) 3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил В 4-х литровый реактор в потоке азота вводят 20 г (0,82 моля) магния, активированного 0,1 мл дибромэтана. Прикапывают раствор 200 г(0,75 моля) 2-бром-5,6,7,8-тетрагидро-5,5,8,8 тетраметилнафталина при поддержании рефлюкса ТГФ, перемешивают при 50 С в течение 2 ч. Затем реакционную среду охлаждают до-5 С и добавляют 1,2 г (8,2 ммоля) CuBr и прикапывают раствор 58 г (0,82 ммоля) метоксиаллена в 100 мл ТГФ. Перемешивают в течение часа при -5 С, затем температуру поднимают до комнатной и перемешивают в течение 2 ч. Реакционную среду выливают в насыщенный раствор хлорида аммония, экстрагируют этилацетатом, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученное масло перегоняют при 0,02 мм Нg и собирают фракцию, отгоняемую при 95-100 С. Получают 79 г (47%) целевого продукта в виде бесцветного масла.(в) 4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]этилбензоат В трехгорлую колбу в потоке азота вводят 7,4 г (32,7 ммолей) 3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропина, 8,2 г (29,7 ммолей) 4-иодэтилбензоата и 50 мл триэтиламина. Реакционную среду дегазируют барботированием азота, вводят 360 мг (0,5 ммоля) бис(трифенилфосфин)палладий(II)хлорида, 130 мг иодида меди и перемешивают при комнатной температуре в течение 8 ч. Реакционную среду выпаривают досуха, снова вводят в этилацетат и хлористо-водородную кислоту (1N), органическую фазу декантируют, сушат на сульфате магния и выпаривают. Полученный остаток очищают хроматографией на колонке из диоксида кремния, элюируя смесью гептана и этилацетата (70/30). После выпаривания растворителей получают твердое вещество, которое порошкуют в гептане, отфильтровывают, высушивают. Получают 9,3 г (84%) целевого этилового сложного эфира с температурой плавления 5960 С. Пример 17. 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензамид.(а) 4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойная кислота Аналогично примеру 16 (в) путем реакции 8 г (35,3 ммолей) 3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропина и 8 г (32,1 ммолей) 4-иодбензойной кислоты получают 10,4 г (94%) целевой кислоты с температурой плавления 167-168 С. 23 100 мл дихлорметана, прикапывают 2,4 мл (12,1 ммолей) дихлоргексиламина. Перемешивают при комнатной температуре в течение часа,прикапывают 1,2 мл (11,7 ммолей) тионилхлорида и перемешивают в течение часа. Реакционную смесь высушивают досуха, поглощают этиловым эфиром, отфильтровывают соль дициклогексиламина, выпаривают. Получают 3 г(100%) сырого хлорангидрида кислоты, который используется при последующем синтезе.(в) 4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид В колбу вводят 3 г (8,3 ммолей) полученного выше хлорида кислоты, растворенного в 100 мл в ТГФ, добавляют 1 мл (9,1 ммолей) гидроксида аммония (32%) и перемешивают при комнатной температуре в течение часа. Реакционную среду выливают в воду, экстрагируют дихлорметаном, органическую фазу декантируют, промывают водой, сушат на сульфате магния, выпаривают. Полученное твердое вещество порошкуют в гептане, отфильтровывают, высушивают. Получают 2,5 г (87%) 4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензамида с температурой плавления 207-208 С. Пример 18. N-этил-4-[3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид. Аналогично примеру 17 (б) путем реакции 3 г (8,3 ммолей) 4[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензоилхлорида и 650 мкл (10 ммолей) этиламина (70%) получают 1,84 г (59,4%) целевого этилового амида с температурой плавления 128-129 С. Пример 19. Морфолид 4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензойной кислоты. Аналогично примеру 17 (б) путем реакции 1,25 г (3,4 ммолей) 4-[3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензоилхлорида и 320 мкл (3,8 ммолей) морфолина,получают 430 мг (31%) морфолида 4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензойной кислоты с температурой плавления 98-99 С. Пример 20. N-(4-гидроксифенил)-4-[3(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамид. Аналогично примеру 17 (б) путем реакции 3 г (8,3 ммолей) 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензоилхлорида с 1 г (9,2 ммолей) 4-аминофенола получают 1,94 г (54%) N-(4-гидроксифенил)-4-[3(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензамида с температурой плавления 159-160 С. Пример 21. 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензолметанол. Аналогично примеру 16 (в) путем реакции 3,67 г (16,2 ммолей) 3-(5,6,7,8-тетрагидро 001060(14,8 ммолей) 4-иодбензолметанола, получают 4,9 г (100%) 4[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензолметанола в виде вязкого оранжевого масла. ЯМР 1 Н (CDCl3, 250 Мгц), 1,27 (6H, s),1,29 (6H, s), 1,68 (4H, s), 3,77 (2H, s), 4,67 (2 Н,d), 7,17 (1H, Ar, dd), 7,27 (2H, Ar, d), 7,30 (2 Н Ar,d) 7,42 (2 Н Аr, с). Пример 22. 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]бензальдегид. В колбу вводят 1,3 г (4 ммоля) 4-[3(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]бензолметанола и 20 мл дихлорметана и добавляют 3,4 г (39,2 ммоля) оксида марганца. Перемешивают при комнатной температуре в течение 8 ч. В реакционную смесь добавляют сульфат магния, отфильтровывают и выпаривают фильтрат. Полученный осадок очищают хроматографией на колонке из диоксида кремния, элюируя смесью этилацетата и гептана (10-90). После выпаривания растворителей получают 930 г (29,5%) 4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 пропинил]бензальдегида в виде желтого масла. ЯМР 1 Н (CDCl3, 250 Мгц), 1,28 (6 Н, s), 1,30 (6 Н,s), 1,69 (4H, s), 3,81 (2 Н, s), 7,20 (1 Н Ar, dd), 7,31(1H, s). Пример 23. 4-[3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропинил]фенол. Аналогично примеру 16 (в) путем реакции 1,13 г (5 ммолей) 3-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-1-пропина с 1 г (4,5 ммолей) 4-иодфенола получают 1,28 г (88%) 4-[3(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1-пропинил]фенола в виде вязкого краснооранжевого масла. ЯМР 1H (CDCl3, 250 Мгц), 1,27 (6H, s),1,29 (6H, s), 1,68 (4H, s), 3,75 (2H, s), 5,05 (1H, s),6,76 (2 Н, d), 7,20 (1H Ar, dd), 7,25 (1H, d), 7,31(20,8 ммолей) 1-иодгексана и премешивают при комнатной температуре в течение 24 ч. Реакционную среду выливают в воду, экстрагируют этилацетатом, органическую фазу декантируют,промывают водой, сушат на сульфате магния,выпаривают. Получают 2 г (80%) целевого гексилового сложного эфира в виде масла красноватого оттенка. ЯМР 1 Н (CDCl3, 250 Мгц), 0,9 (3H, t), 1,29(а) N -гидрокси-2-гидрокси-4-иодбензамид В трехгорлую колбу в потоке азота вводят 23,3 г(84 ммолей) 2-гидрокси-4 иодметилбензоата и 360 мл раствора гидроксида натрия (1N). Добавляют 8 г (113 ммолей) хлоргидрата гидроксиамина и перемешивают при комнатной температуре в течение 2 ч. рН реакционной среды доводят до 7-8 концентрированной хлористо-водородной кислотой, выливают в воду, отфильтровывают твердый осадок. Твердое вещество растворяют этилацетатом, промывают водой, органическую фазу декантируют,сушат на сульфате магния, выпаривают. Получают 17,6 г (71,5%) целевого продукта с температурой плавления 195-196 С.(б) 6-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]-3-никотиновая кислота В колбу вводят 370 мл (1 ммоля) полученного выше метилового сложного эфира, 10 мл ТГФ и 5 мл метанольного раствора едкого натра(2N). Нагревают при 40 С в течение часа, выпаривают досуха, поглощают водой, доводят до рН 5 с помощью хлористо-водородной кислоты,экстрагируют этилацетатом, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Остаток порошкуют в гептане, отфильтровывают, высушивают. Получают 240 мг(66%) целевой кислоты с температурой плавления 224-225 С. Пример 30. 4-[3-(5,5,8,8-тетраметил 5,6,7,8-тетрагидро-2-нафтил)-пропа-1,2-диенил] бензойная кислота. В колбу вводят 6,02 г (16 ммолей) 4-[3(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)-1-пропинил]этилбензоата, 5 мл метанола, 5 мл ТГФ и 50 мл гептана. Добавляют 850 мг гидроксида натрия и нагревают с обратным холодильником в течение часа. Реакционную среду выливают в воду, доводят до рН 1 хлористоводородной кислотой, экстрагируют этилцетатом, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток порошкуют в этиловом спирте, отфильтровывают, высушивают. Получают 1,37 г(24,5%) 4-[3-(5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафтил)пропа-1,2-диенил]бензойной кислоты с температурой плавления 227-228 С. Пример 31. 2-гидрокси-4-[3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 бутинил]бензойная кислота. Аналогично примеру 5 (д), но исходя из 1 г тетрагидро-5,5,8,8-тетраметил-2-нафтил)-1 бутинил]бензойной кислоты с температурой плавления 191-192 С. Пример 32. В этом примере проиллюстрированы различные конкретные композиции на основе соединений согласно изобретению. А - Для перорального введения(б) Суспензия для питья в ампулах объемом 5 мл Соединение примера 6 0,001 г Глицерин 0,500 г 70%-ый Сорбитол 0,500 г Сахаринат натрия 0,010 г Парагидроксиметилбензоат 0,040 г Ароматическое вещество в достаточном количестве Очищенная вода до 5 мл(в) Таблетка 0,8 г Соединение примера 5 0,500 г Крахмал предварительно желатинированный 0,100 г Микрокристаллическая целлюлоза 0,115 г Лактоза 0,075 г Стеарат магния 0,010 г(г) Суспензия для питья в ампулах объемом 10 мл Соединение примера 2 0,05 г Глицерин 1,000 г 70%-ый Сорбитол 1,000 г Сахаринат натрия 0,010 г Парагидроксиметилбензоат 0,080 г Ароматическое вещество в достаточном количестве Очищенная вода до 10 мл Б - Для наружного применения(а) Мазь Соединение примера 9 Изопропилмиристат Жидкое вазелиновое масло Двуокись кремния ("Aerosil 200," выпускаемый фирмой(б) Мазь Соединение примера 7 Вазелин белый codex(в) Неионный крем масло-в-воде Соединение примера 25 Смесь эмульсионных ланолиновых спиртов, восков и масел 28 Парагидроксипропилбензоат Стерильная деминерализованная вода(г) Лосьон Соединение примера 8 Полиэтиленгликоль (PEG 400) 95% Этанол(д) Гидрофобная мазь Соединение примера 20 Изопропилмиристат Силиконовое масло ("Rhadorsil 47V300, выпускаемый фирмойRHONE-POULENC) Пчелиный воск Силиконовое масло ("Abil 300.000cst", выпускаемый фирмой GOLDSCHNIDT)(е) Неионный крем масло-в-воде Соединение примера 30 Цетиловый спирт Моностеарат глицерина Стеарат PEG50 Масло сального дерева Пропиленгликоль Парагидроксиметилбензоат Парагидроксипропилбензоат Стерильная деминерализованная Вода ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Диароматические соединения пропинила или диенила общей формулы (I)(I) радикалом -СН 3,(II) радикалом -СН 2-O-R6,(III) радикалом -О-R6,(IV) радикалом -CO-R7,где R6 и R7 имеют значения, приведенные ниже,Аr является радикалом, отвечающим следующей формуле (а): или или где R8 и R9 имеют значения, приведенные ниже,R2 и R3, одинаковые или различные, являются(II) линейным или разветвленным алкилом,имеющим 1-20 атомов углерода,(III) радикалом -OR6,(IV) радикалом -SR6,где R6 имеет значение, приведенное ниже,при этом R2 и R3 вместе могут образовывать с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,при этом R2 и R3 не могут одновременно иметь значения (I), (III) и (IV), указанные выше,R4 и R5, одинаковые или различные, являются атомом водорода, атомом галогена, линейным или разветвленным алкилом, имеющим 120 атомов углерода, радикалом -OR6,при этом если R4 является гидроксилом, тоR2 и R3 образуют с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,R6 является атомом водорода, алкилом с 112 атомами углерода или радикалом -COR10,где R10 имеет значения, определенные ниже,R7 является где R' и R" имеют значения, определенные ниже,(г) радикалом - OR11,(д) радикалом -NHOR6,где R11 имеет значения, определенные ниже,R8 и R9, взятые отдельно, либо одновременно являются водородом или радикалом-OR10, либо один является атомом водорода, а другой алкилом с 1-12 атомами углерода или,взятые вместе, образуют цикл -Y-(CH2)n-Y-, гдеY является кислородом или серой, а n равен 2 или 3,R10 является алкилом с 1-12 атомами углерода,R11 является атомом водорода, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом, моно- или полигидроксиалкилом с 3-6 атомами углерода и 2-5 гидроксильными группами, арилом или аралкилом, таким как бензил или фенетил, которые могут быть замещены, или остатком сахара, или аминокислотным или пептидным остатком,R' и R", одинаковые или различные, являются атомом водорода, алкилом с 1-12 атомами углерода, моно- или полигидроксиалкилом с 3-6 атомами углерода и 2-5 гидроксильными группами, арилом, который может быть замещен,или остатком аминокислоты или сахара, или вместе образуют гетероцикл, 001060 30 а также их соли и их оптические и геометрические изомеры. 2. Соединения общей формулы (II) где R1 и Аr имеют те же значения, которые указаны для общей формулы (I) пo п.1, a R'2 и R'4,идентичные или различные, являются линейным или разветвленным алкилом, имеющим 1-20 атомов углерода. 3. Соединения по п.1 или 2, отличающиеся тем, что они представляют собой соли щелочного или щелочно-земельного металла, или цинка,или органического амина. 4. Соединения по п.1, отличающиеся тем,что взятые отдельно или в смеси они представляют собой группу следующих соединений:-2-гидрокси-4-[3-(3,5-ди-трет-бутил-4 оксо-2,5-циклогексадиен-1-илиден)-1-пропинил] бензойной кислоты. 6. Соединения по п.1 или 2, отличающиеся тем, что для них выполняются, по крайней мере,одно и предпочтительно все следующие условия:R1 является радикалом -CO-R7,Ar является радикалом формулы (а). 7. Соединения по одному из пп. 1, 3 или 6,отличающиеся тем, что они соответствуют формуле (I), описанной в п.1, где R8 и R9, взятые отдельно, либо являются атомами водорода,либо один является водородом, а другой алкилом с 1-12 атомами углерода. 8. Применение соединений формулы (I) или (II) по одному из предшествующих пунктов для использования в качестве лекарственного средства. 9. Применение по п.8, отличающееся тем,что лекарственное средство предназначено для лечения дерматологических заболеваний, связанных с нарушением кератинизации, обусловленной дифференциацией и пролиферацией, в частности, для лечения акне обыкновенного,юношеского, полиморфного, розового, кистозного, шаровидного, старческого, а также вторичных акне, например, вызванных солнечным медикаментозным воздействием или имеющих профессиональный характер; для лечения других типов нарушений кератинизации,в частности, ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонно-подошвенные кератодермии, лейкоплакии и лейкоплакиеподобные состояния, кожный лишай или лишай слизистой (полости рта); для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительной и/или иммуноаллергической компонентой и, в частности, любых форм псориаза кожи, слизистой или ногтей и даже псориатического артрита, или кожной атопии, такой как экзема, или респиратурной атопии, а также гипертрофии десен; соединения могут быть также использованы для лечения некоторых воспалительных процессов, не связанных с нарушением кератинизации; для лечения дермических или эпидермических пролифераций как доброкачественных, так и злокачественных, вирусного или невирусного происхождения, например обыкновенные бородавки, плоские бородавки и бородавчатые эпидермодисплазии, оральный или багровый папиломатоз, и пролиферации, которые могут быть вызваны ультрафиолетовыми лучами, в частности, базоцеллюлярные и спиноцеллюлярные эпителиомы; для лечения других дерматологических нарушений, таких как пузырчатый дерматоз или коллагеноз; для лечения некоторых офтальмологических заболеваний, в частности, корнеопатий; для восстановления или борьбы со старением кожи как в результате воздействия света, так и возрастных 34 диабета, при лечении кожных заболеваний, вызванных ультрафиолетовым облучением. 10. Фармакологическая композиция, отличающаяся тем, что содержит в фармацевтически приемлемом носителе, по крайней мере, одно соединение по одному из пп.1-7. 11. Композиция по п.10, отличающаяся тем, что концентрация соединения(ий) по одному из пп.1-7 составляет от 0,001 до 5 мас.% от общей массы композиции. 12. Косметическая композиция, отличающаяся тем, что она содержит в косметически приемлемом носителе, по крайней мере, одно из соединений по одному из пп.1-7. 13. Композиция по п.12, отличающаяся тем, что концентрация соединения(ий) по одному из пп.1-7 составляет от 0,001% до 3 мас.% от общей массы композиции. 14. Применение косметической композиции по одному из пп.12 или 13 для гигиены тела и волос. факторов, а также для уменьшения пигментации и белковых кератозов, или любых патологий,связанных с возрастным или белковым старением; для профилактики или лечения признаков эпидермической и/или дермической атрофии,вызванной наружными или системными кортикостероидами, или других форм кожной атрофии; для профилактики или лечения нарушений процесса рубцевания или для заживления рубцов, для лечения нарушений функции сальных желез, например гиперсеборея акне или простая себорея; при лечении и профилактики раковых или предраковых состояний; при лечении некоторых воспалительных процессов, таких как артрит; при лечении любых вирусных общих или кожных заболеваний, например синдром Копоши; для профилактики или лечения облысения; при лечении дерматологических или общих заболеваний с иммунологической компонентой; при лечении заболеваний сердечнососудистой системы, таких как артериосклероз или гипертония, а также инсулинонезависимого
МПК / Метки
МПК: C07D 335/06, A61P 17/00, C07C 63/66, A61K 31/192
Метки: применение, композиции, косметических, основе, соединений, композиций, фармацевтические, промежуточные, соединения, диароматические, диенила, пропинила, косметические, указанных
Код ссылки
<a href="https://eas.patents.su/19-1060-diaromaticheskie-soedineniya-propinila-ili-dienila-promezhutochnye-soedineniya-farmacevticheskie-i-kosmeticheskie-kompozicii-na-osnove-ukazannyh-soedinenijj-i-primenenie-kosmetiche.html" rel="bookmark" title="База патентов Евразийского Союза">Диароматические соединения пропинила или диенила, промежуточные соединения, фармацевтические и косметические композиции на основе указанных соединений и применение косметических композиций.</a>
Предыдущий патент: Устройство для намотки горячего проката, например, полосы или листа и способ намотки
Следующий патент: Способ и установка для расснаряжения боеприпасов с алюминизированными гексогеносодержащими зарядами
Случайный патент: Боковая стена кузова вагона и способ замены боковой стены кузова вагона












