Ингибиторы металлопротеиназы, фармацевтические композиции, их содержащие, и их фармацевтические применения
Номер патента: 3294
Опубликовано: 24.04.2003
Авторы: Дизон Майкл Е., Жук Скотт Е., Дагнино Раймонд Джр., Бендер Стивен Л., Мелник Майкл Дж.
Формула / Реферат
1. Соединение с формулой 1
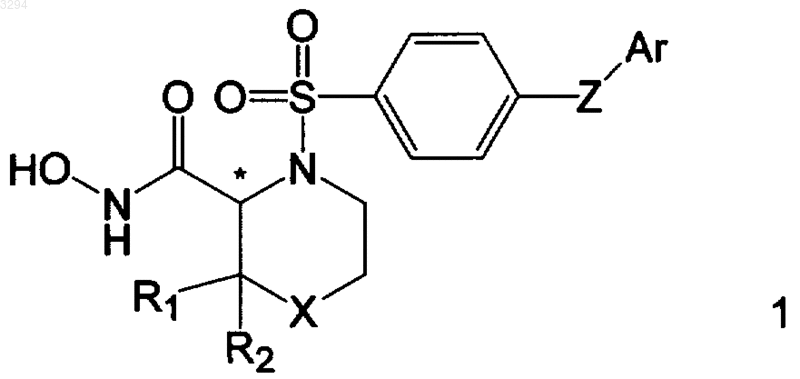
где Z является O или S;
Ar является моноциклической арильной или гетероарильной группой, выбранной из фенильной группы, или пяти- или шестичленной азот- или кислородсодержащей гетероарильной группы, незамещенной или замещенной одним или более заместителями, выбранными из галогрупп и цианогруппы;
X выбран из S, S=O, O, N-R3 и N+(O-)-R4, где R3 является атомом водорода или C1-C6-алкильной группой, где указанная алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности цепью из атомов углерода и водорода, C(O)-R17-группой, C(O)O-R17 группой, C(O)NHR17 группой, SO2-R19 группой, где R17 является C1-C4-алкильной группой, причем указанная алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности цепью из атомов углерода и водорода и где R19 является CH3; и
R4 является C1-C7 алкильной группой, где алкильная группа является моновалентным радикалом с прямой или разветвленной не имеющей ненасыщенности цепью из атомов углерода и водорода и
R1 и R2 независимо выбраны из водорода, C1-C7-алкильных групп, -C(O)O-R17 группы, и -C(O)NR17R18 группы,
где R17 является водородом или C1-C4-алкильной фуппой, a R18 является водородом,
и где любая из указанных алкильных групп является моновалентным радикалом с прямой или разветвленной не имеющей ненасыщенности цепью из атомов углерода и водорода;
фармацевтически приемлемое провещество указанного соединения, его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1,отличающееся тем, что X является N-R3; при этом R3 является атомом водорода или C1-C6-алкильной группой, где указанная алкильная группа является моновалентным радикалом с прямой или разветвленной не имеющей ненасыщенности цепью из атомов углерода и водорода, C(O)-R17-группой, C(O)O-R17 группой, C(O)NHR17 группой, SO2-R19 группой, где R17 является C1-C4-алкильной группой, причем указанная алкильная группа является моновалентным радикалом с прямой или разветвленной не имеющей ненасыщенности цепью из атомов углерода и водорода, и где R19 является CH3.
3. Соединение по п.1, отличающееся тем, что Ar является фенильной группой, которая не замещена или замещена в пара-положении заместителем, выбранным из фтора или хлора.
4. Соединение по п.1, отличающееся тем, что атом углерода, обозначенный *, находится в R-конфигурации, если X является O, N-R3 или N+(O-)-R4, и в S-конфигурации, если X является S или S=O.
5. Соединение по п.1, отличающееся тем, что оно является 3(S)-N-гидрокси-4-(4-((пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2H-1,4-тиазин-3-карбоксамидом, или его фармацевтически приемлемой солью, или фармацевтически приемлемым провеществом.
6. Соединение по п.1, отличающееся тем, что оно выбрано из группы, состоящей из
3(S)-N-гидрокси-4-(4-(4-имидазол-1-ил)фенокси)бензолсульфонил-2,2-диметилтетрагидро-2H-тиазин-3-карбоксамида,
3(S)-N-гидрокси-4-(4-(4-фторфенокси)бензолсульфонил)-2,2-диметилтетрагидро-2H-тиазин-3-карбоксамида,
3(S)-N-гидрокси-4-(4-(4-имидазол-2-ил)фенокси)бензолсульфонил-2,2-диметилтетрагидро-2H-тиазин-3-карбоксамида,
3(S)-N-гидрокси-4-(4-(4-хлорфенокси)бензолсульфонил)-2,2-диметилтетрагидро-2H-тиазин-3-карбоксамида,
2(R)-3,3-диметил-N-гидрокси-1-(4-(4-хлорфеноксил)бензолсульфонил)пиперазин-2-карбоксамида,
2(R)-3,3-диметил-N-гидрокси-1-(4-(4-фторфеноксил)бензолсульфонил)пиперазин-2-карбоксамида,
2(R)-3,3-диметил-N-гидрокси-1-(4-(4-бромфенокси)бензолсульфонил)пиперазин-2-карбоксамида,
2(R)-1-(4-(4-(хлорфенокси)бензолсульфонил)-N-гидрокси-3,3,4-триметилпиперазин-2-карбоксамида,
2(R)-1-(4-(4-фторфенокси)бензолсульфонил)-N-гидрокси-3,3,4-триметилпиперазин-2-карбоксамида,
3(S)-N-гидрокси-4-(4-(4-хлорфенилсульфанил)бензолсульфонил)-2,2-диметилтетрагидро-2H-тиазин-3-карбоксамида,
3(S)-N-гидрокси-4-(4-(4-фторфенилсульфанил)бензолсульфонил)-2,2-диметилтетрагидро-2H-тиазин-3-карбоксамида,
2(R)-3,3-диметил-N-гидрокси-1-(4-(4-фторфенилсульфанил)бензолсульфонил)пиперазин-2-карбоксамида,
2(R)-3,3-диметил-N-гидрокси-1-(4-(4-хлорфенилсульфанил)бензолсульфонил)пиперазин-2-карбоксамида,
2(R)-1-(4-(4-фторфенилсульфанил)бензолсульфонил)-N-гидрокси-3,3,4-триметилпиперазин-2-карбоксамида,
2(R)-1-(4-(4-хлорфенилсульфанил)бензолсульфонил)-N-гидрокси-3,3,4-триметилпиперазин-2-карбоксамида,
2(R),3(S)-N-гидрокси-(4-(4-(пирид-4-ил)окси)бензолсульфонил)-2-метилтетрагидро-2H-тиазин-3-карбоксамида и
2(R),3(S)-N-гидрокси-(4-(4-(пирид-4-ил)сульфанил)бензолсульфонил)-2-метилтетрагидро-2H-тиазин-3-карбоксамида;
2(R)-N-гидрокси-1-(4-(4-хлорфенокси)бензолсульфонил)-4-(метансульфонил)пиперазин-2-карбоксамида;
2(R)-N-гидрокси-1-(4-(4-фторфенокси)бензолсульфонил)-4-(метансульфонил)пиперазин-2-карбоксамида;
3(S)-N-гидрокси-4-(4-((пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2H-1,4-тиазин-3-карбоксамида;
соединения, имеющего формулу
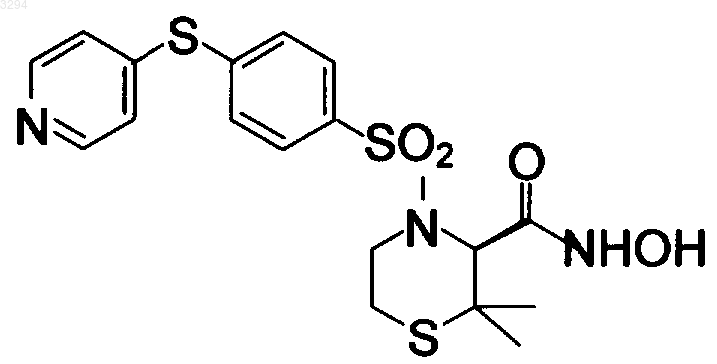
а также фармацевтически приемлемых провеществ, солей и сольватов указанных соединений.
7. Фармацевтическая композиция, содержащая:
(a) терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемого провещества, соли или сольвата и
(b) фармацевтически приемлемый носитель, разбавитель, связующее вещество или инертный наполнитель.
8. Фармацевтическая композиция, содержащая:
(a) терапевтически эффективное количество соединения по п.5 или его фармацевтически приемлемого провещества, соли или сольвата и
(b) фармацевтически приемлемый носитель, разбавитель, связующее вещество или инертный наполнитель.
9. Способ лечения болезненного состояния млекопитающих, индуцируемого металлопротеиназной активностью, предусматривающий введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемого провещества, соли или сольвата.
10. Способ по п.9, отличающийся тем, что указанное болезненное состояние выбрано из группы, включающей опухолевый рост, внедрение метастазов и артрит.
11. Способ лечения болезненного состояния млекопитающих, индуцируемого металлопротеиназной активностью, предусматривающий введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества соединения по п.5 или его фармацевтически приемлемого провещества, соли или сольвата.
12. Способ по п.11, отличающийся тем, что указанное болезненное состояние выбрано из группы, включающей опухолевый рост, внедрение метастазов и артрит.
Текст
1 Данное изобретение относится к соединениям, которые ингибируют металлопротеиназы,в частности, матриксные металлопротеиназы и конвертазу фактора- некроза опухолей, и их фармацевтически приемлемым солям и фармацевтически приемлемым провеществам. Изобретение далее относится к применениям этих соединений, солей и провеществ для терапевтического лечения людей или животных. Матриксные металлопротеиназы ("ММП") являются семейством ферментов, включающим,но не ограниченным ими, коллагеназы, желатиназы, матрилизин и стромолизины, которые участвуют в расщеплении и реконструкции соединительных тканей. Эти ферменты обнаружены во многих типах клеток, которые обнаружены в, или связаны с соединительной тканью,таких, как фибробласты, моноциты, макрофаги,эндотелиальные клетки и метастатические опухолевые клетки. Они также имеют много общих свойств, включая зависимость от цинка и кальция, секрецию в качестве зимогенов, и 40-50% гомологию аминокислотной последовательности. Матриксные металлопротеиназы расщепляют белковые компоненты внеклеточного матрикса, то есть белковые компоненты, обнаруженные в выстилке суставов, интерстициальной соединительной ткани, основных мембранах,хрящах и тому подобном. Эти белки включают коллаген, протеогликан, фибронектин и ламанин. Коллаген является основным структурным белком тканей млекопитающих, составляющим одну треть общего белка в организмах млекопитающих, и является неотъемлемым компонентом многих матриксных тканей, включая хрящ,кость, сухожилия и кожу. Интерстициальные коллагеназы катализируют начальное (ограничивающее скорость) расщепление нативного коллагена типов I, II, III и X. Эти ферменты расщепляют коллаген на два фрагмента, которые спонтанно денатурируют при физиологической температуре. Денатурация коллагена включает конверсию жесткой спирали в случайную спираль, называемую желатином. Эти желатиновые (денатурированный коллаген) фрагменты затем подвергаются дальнейшему расщеплению и деградации с помощью менее специфических ферментов. Чистым результатом коллагеназного расщепления поэтому является потеря структурной целостности матриксной ткани (коллагеновый коллапс), т.е. необратимый по своей сути процесс. Желатиназы включают два различных, но тесно связанных фермента: фермент массой 72 килоДальтона (кДа) и фермент массой 92 кДа. Первый выделяют фибробласты, тогда как второй выделяют мононуклеарные фагоциты, нейтрофилы, клетки эпителия роговицы, опухолевые клетки, цитотрофобласты и кератиноциты. Оба фермента разрушают желатины (денатури 003294 2 рованные коллагены), коллаген типов IV (основная мембрана) и V, фибронектины (высокомолекулярные мультифункциональные гликопротеины, обнаруживаемые в мягкой соединительной ткани и основных мембранах) и нерастворимый эластин (гидрофобные протеины с большим количеством поперечных связей, обнаруженные в выдерживающих нагрузку волокнах соединительной ткани млекопитающих). Стромелизины (1 и 2) расщепляют широкий диапазон субстратов матрикса, включая ламанин, фибронектины, протеогликаны и коллаген типов IV и IX (неспиральный). Матрилизин (вероятная металлопротеиназа или ВМП) также разрушает большое многообразие субстратов матрикса, включая протеогликаны, желатины, фибронектины, эластины и ламанин. Матрилизин был обнаружен в мононуклеарных фагоцитах, эксплантатах матки крысы и опухолевых клетках. В нормальных тканях активность матриксных металлопротеиназ жестко регулируется. В результате разрушение соединительной ткани,опосредуемое этими ферментами, обычно находится в динамическом равновесии с синтезом новой матриксной ткани. При многих патологических болезненных состояниях, однако, нарушение регуляции активности матриксной металлопротеиназы приводит к неконтролируемому разрушению экстраклеточного матрикса. Эти болезненные состояния включают артрит (например, ревматоидный артрит и остеоартрит), заболевания периодонта, аберрантный ангиогенез, метастазирование и инвазию опухолей, изъязвление тканей (например, изъязвление роговицы, изъязвление желудка или изъязвление эпидермиса),заболевания костей, ВИЧ-инфекция и осложнения диабета. Было обнаружено, что ввведение ингибиторов матриксной металлопротеиназы снижает скорость деградации соединительной ткани,приводя тем самым к благоприятному терапевтическому эффекту. Например, в Cancer Res.,vol. 53, p. 2087 (1993) было показано, что синтетический ингибитор матриксной металлопротеиназы имеет in vivo эффективность при моделировании на крысах рака яичников при явном способе действия, заключающемся в ингибировании перестройки матрикса. Структура и применения ингибиторов ММП сообщались, например, в J. Enzyme Inhibition, 2, 1-22 (1987);(1995); и Drug Discovery Today, 1, 16-26(1996). Ингибиторы матриксной металлопротеиназы также являются предметом многочисленных патентов и патентных заявок, включая: патент США 5,189,178; патент США 5,183,900; патент США 5,506,242; патент США 5,552,419; патент США 5,455,258; 3 европейская патентная заявка 0 438 223; европейская патентная заявка 0 276 436; международная публикацияWO 92/21360; международная публикацияWO 92/06966; международная публикацияWO 92/09563; международная публикацияWO 96/00214; международная публикацияWO 95/35276; и международная публикацияWO 96/27583, информация каждой из которых включены сюда в качестве ссылки. Фактор- некроза опухолей (ФНО-) является цитокином, который продуцируется в виде 28-кДа предшественника и выделяется в активной 17-кДа форме. Активная форма может опосредовать большое число вредных эффектовin vivo включая воспаление, лихорадку, кардиоваскулярные эффекты, кровотечение, свертывание и ответы острой фазы, сходные с наблюдаемыми во время острых инфекций и шоковых состояний. Хроническое введение ФНО- может вызывать кахексию и анорексию; аккумуляция избытка ФНО- может быть фатальной. ФНО- конвертаза - это металлопротеиназа, участвующая в биосинтезе ФНО-. Ингибирование ФНОконвертазы ингибирует образование ФНО-. Так как избыточная продукция ФНО- отмечалась при некоторых болезненных состояниях, характеризующихся опосредованной ММП деградацией тканей, включая рассеянный склероз, артрит и рак, то соединения, которые ингибируют как ММП, так и ФНОконвертазу,особенно благоприятны для лечения или профилактики болезненных состояний, в которых участвуют оба механизма. Хотя соединения,которые ингибируют и активность ММП, и продукцию ФНО-, были раскрыты в международных публикацияхWO 94/24140 и WO 94/02466, сведения из которых включены сюда в качестве ссылки, все еще существует потребность в эффективных агентах, ингибирующих ММП и/или ФНОконвертазу. Из-за их положительных терапевтических эффектов существует потребность в эффективных ингибиторах активности металлопротеиназы. Данное изобретение поэтому направлено на определенные соединения, которые ингибируют металлопротеиназы, такие, как ММП и ФНО-конвертазу, их фармацевтические приемлемые провещества, соли и сольваты, фармацевтические композиции, содержащие их, и методы их использования, а также на метод и промежуточные вещества, пригодные для их приготовления. Дополнительные черты и преимущества изобретения будут представлены в описании, которое следует далее, и частично будут ясны из описания или могут быть выяснены при использовании изобретения. Чтобы достичь этих и других преимуществ, в данном изобретении предложено соединение с формулой 1Z является О или S; Аr является моноциклической арильной или гетероарильной группой, выбранной из фенильной группы, или пяти- или шестичленной азот- или кислородсодержащей гетероарильной группы, незамещенной или замещенной одним или более заместителей, выбранных из галогрупп и цианогруппы;X выбран из S, S=O, О, N-R3 и N+(O-)-R4,где R3 является атомом водорода или С 1-С 6 алкильной группой, где указанная алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности, цепью из атомов углерода и водорода, С(О)-R17 группой, C(O)O-R17 группой,C(O)NHR17 группой, SO2-R19 группой, где R17 является С 1-С 4-алкильной группой, причем указанная алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности, цепью из атомов углерода и водорода, и где R19 является СН 3, иR4 является C1-C7 алкильной группой, где алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности, цепью из атомов углерода и водорода; иR1 и R2 независимо выбраны из водорода,С 1-С 7-алкильных групп, -C(O)O-R17 группы, и-C(O)NR17R18 группы,где R17 является водородом или С 1-С 4 алкильной группой, a R18 является водородом, и где любая из указанных алкильных групп является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности,цепью из атомов углерода и водорода; фармацевтически приемлемое провещество указанного соединения, его фармацевтически приемлемые соли или сольваты. Изобретение также направлено на создание способа ингибирования активности металлопротеиназы, такой как ММП или ФНО-конвертазы, путем введения соединения с формулой 1, или фармацевтически приемлемого провещества, соли или сольвата этого соединения. Изобретение далее направлено на фармацевтическую композицию, содержащую эффективное количество соединения с формулой 1,или фармацевтически приемлемого провещества, соли или сольвата этого вещества. Способ приготовления соединений с формулой 1 включает одну или более из нижеследующих реакций, где варианты в нижеследующих формулах определены далее: или его соли или сольвата, в соединение с формулой 3 или в его соль или сольват, при условиях,достаточных для образования соединения с формулой 3;(2) конверсия соединения с формулой 3,приведенной выше, или его соли или сольвата, в соединение с формулой 4 или в его соль или сольват, при условиях,достаточных для образования соединения с формулой 4, или его соли или сольвата;(3) конверсия соединения с формулой 2,приведенной выше, или его соли или сольвата, в соединение с формулой 4, приведенной выше,или в его соль или сольват, при условиях, достаточных для образования соединения с формулой 4, или его соли или сольвата; или его соли или сольвата, в соединение с формулой 6 или его соль или сольват, при условиях,достаточных для образования соединения с формулой 6, или его соли или сольвата;(5) конверсия соединения с формулой 6,приведенной выше, или его соли или сольвата, в соединение с формулой 7 или его соль или сольват, при условиях,достаточных для образования соединения с формулой 7, или его соли или сольвата; 6 или его соли или сольвата, в соединение с формулой 7, приведенной выше, или его соль или сольват, при условиях, достаточных для образования вышеупомянутого соединения с формулой 7, или его соли или сольвата;(7) конверсия соединения с формулой 5,приведенной выше, или его соли или сольвата, в соединение с формулой 11, приведенной выше,или его соль или сольват, при условиях, достаточных для образования вышеупомянутого соединения с формулой 11, или его соли или сольвата; (8) реакция соединения с формулой 7, приведенной выше, или его соли или сольвата, или соединения с формулой 11, приведенной выше,или его соли или сольвата, с соединением с формулой 4, приведенной выше, или его солью или сольватом, при условиях, достаточных для образования соединения с формулой 8: или его соли или сольвата;(9) конверсия соединения с формулой 8,приведенной выше, или его соли или сольвата, в соединение с формулой 9 или его соль или сольват, при условиях,достаточных для образования соединения с формулой 9, или его соли или сольвата;(10) конверсия соединения с формулой 4,приведенной выше, или его соли или сольвата, в соединение с формулой 9, приведенной выше,или его соль или сольват, при условиях, достаточных для образования соединения с формулой 9, или его соли или сольвата;(11) конверсия соединения с формулой 7,приведенной выше, или его соли или сольвата, в соединение с формулой 9, приведенной выше,или его соль или сольват, при условиях, достаточных для образования соединения с формулой 9, или его соли или сольвата;(12) конверсия соединения с формулой 9,приведенной выше, или его соли или сольвата, в соединение с формулой 10 или его соль или сольват, при условиях,достаточных для образования соединения с формулой 10, или его соли или сольвата; и(13) конверсия соединения с формулой 7,приведенной выше, или его соли или сольвата, в соединение с формулой 10, приведенной выше, 7 или его соль или сольват, при условиях, достаточных для образования соединения с формулой 10, или его соли или сольвата. В вышеописанных конверсиях и реакциях использованы следующие определения:Q является циклоалкильной группой,арильной группой, гетероарильной группой,гетероциклоалкильной группой или группой с формулой где А является С или Si, и R8, R9 и R10 независимо выбраны из Н и любой подходящей органической части, или ее соли или сольвата, с условием, что для конверсии (1), описанной выше, еслиD является C-R16, R16 является гетероарильной группой, и для конверсии (4), описанной выше, соединение, соль или сольват с формулой 6 не является эфиром двухосновной кислоты, a Q не является метилом, этилом, изопропилом, nбутилом, -СН 2-фенилом, Для соединений, солей и сольватов с формулой 3, приведенной выше, если D является CR16, R16 является гетероарильной группой. Далее, соединение, соль или сольват с формулой 6 не является эфиром двухосновной кислоты. Кроме того, для соединений, солей и сольватов с формулой 6, Q не является метилом, этилом,изопропилом, n-бутилом, -СН 2-фенилом, Предпочтительные формы реализации указанных выше соединений, композиций и способов более детально обсуждаются ниже после определений. В данной заявке используются следующие определения, если не указано иное:"Алкильная группа" означает моновалентный радикал с прямой или разветвленной цепью из насыщенных и/или ненасыщенных атомов углерода и атомов водорода, такой как метил, 003294 8 этил, пропил, изопропил, бутил, изобутил, тбутил, винил, пентенил, бутенил, пропенил,этинил, бутинил, пропинил, пентинил, гексинил и тому подобные, которые могут быть незамещенными (то есть содержащими только углерод и водород) или замещенными одним или большим числом подходящих заместителей, определенных ниже."О-алкильная группа" или "алкоксигруппа" означает кислород, связанный с алкильной группой, где алкильная группа определена выше."Циклоалкильная группа" означает неароматический, одновалентный моноциклический,бициклический или трициклический радикал,содержащий 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода в кольце, каждый из которых может быть насыщенным или ненасыщенным, и который может быть незамещенным или замещенным одним или большим количеством подходящих заместителей, определенных ниже,и к которым могут быть присоединены одна или больше гетероциклоалкильных групп, арильных групп или гетероарильных групп, которые сами по себе могут быть незамещенными или замещенными одним или большим количеством подходящих заместителей. Иллюстративные примеры циклоалкильных групп включают, но не исчерпываются, циклопропил, циклобутил,циклопентил, циклопентенил, циклогексил,циклогексенил, циклогептил, циклооктил, бицикло[2.2.1.]гептил, бицикло[2.2.1.]гепт-2-ен-5 ил, бицикло[2.2.2]октил, бицикло[3.2.1.]нонил,бицикло[4.3.0]нонил, бицикло[4.4.0]децил, индан-1-ил, индан-2-ил, тетралин-1-ил, тетралин 2-ил, адамантил и тому подобные."Гетероциклоалкильная группа" означает неароматический, моновалентный моноциклический, бициклический или трициклический радикал, который является насыщенным или ненасыщенным, содержащим 3, 4, 5, 6, 7, 8, 9,10, 11, 12, 13, 14, 15, 16, 17 или 18 атомов в кольце, и который включает 1, 2, 3, 4 или 5 гетероатомов, выбранных из азота, кислорода и серы, где радикал является незамещенным или замещенным одним или большим количеством подходящих заместителей, определенных ниже,и к которым могут быть присоединены одна или более циклоалкильных групп, арильных групп или гетероарильных групп, которые, в свою очередь, могут быть незамещенными или замещенными одним или большим количеством подходящих заместителей. Иллюстративные примеры гетероциклоалкильных групп включают, но не исчерпываются ими, азетинидил, пирролидил, пиперидил, пиперазинил, морфолинил,тетрагидро-2 Н-1,4-тиазинил, тетрагидрофурил,дигидрофурил, тетрагидропиранил, дигидропиранил, 1,3-диоксоланил, 1,3-диоксанил, 1,4 диоксанил, 1,3-оксатиоланил, 1,3-оксатианил,1,3-дитианил, азабицикло[3.2.1.]октил, азабицикло[3.3.1]нонил, азабицикло[4.3.0]нонил, ок 9 сабицикло[2.2.1]гептил, 1,5,9-триазациклододецил и тому подобные."Арильная группа" означает ароматический, моновалентный моноциклический, бициклический или трициклический радикал, содержащий 6, 10, 14 или 18 атомов углерода в кольце, которые могут быть незамещенными или замещенными одним или большим количеством подходящих заместителей, определенных ниже,и к которым могут быть присоединены одна или более циклоалкильных групп, гетероалкильных групп или гетероарильных групп, которые, в свою очередь, могут быть незамещенными или замещенными одним или большим количеством подходящих заместителей. Иллюстративные примеры арильных групп включают, но не исчерпываются, фенил, нафтил, флуорен-2-ил,индан-5-ил и тому подобные."Гетероарильная группа" означает ароматический, моновалентный моноциклический,бициклический или трициклический радикал,содержащий 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16,17 или 18 атомов в кольце, включая 1, 2, 3, 4 или 5 гетероатомов, выбранных из азота, кислорода и серы, которые могут быть незамещенными или замещенными одним или большим количеством подходящих заместителей, определенных ниже, и к которым могут быть присоединены одна или более циклоалкильных групп, гетероциклоалкильных групп или арильных групп,которые, в свою очередь, могут быть незамещенными или замещенными одним или большим количеством подходящих заместителей. Иллюстративные примеры гетероарильных групп включают, но не исчерпываются ими,пирролил, имидазолил, пиразолил, фурил, тиенил, тиазолил, оксазолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил,пиразинил, пиридил, пиримидил, пиридазаинил,индолил, изоиндолил, бензимидазолил, бензофурил, изобензофурил, бензотиенил, хинолил,изохинолил, фталазинил, карбазолил, пуринил,птеридинил, акридинил, фенантролинил, феноксазинил, фенотиазинил, и тому подобные."Ацильная группа" означает -С(О)-Rрадикал, где R является любым подходящим заместителем, определенным ниже.-S(О)(О)-R-радикал, где R является любым подходящим заместителем, определенным ниже. Термин "подходящий заместитель" означает любой из заместителей, который признан специалистами в данной области как не оказывающий неблагоприятного влияния на ингибиторную активность изобретенных соединений. Иллюстративные примеры подходящих заместителей включают, но не ограничиваются ими,оксогруппы, алкильные группы, гидроксильные группы, галогруппы, цианогруппы, нитрогруппы, циклоалкильные группы, гетероциклоалкильные группы, арильные группы, гетероа 003294 где Rm и Rn независимо являются алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой,гетероарильной группой, гидроксильной группой, алкоксигруппой, аминогруппой, алкиламиногруппой, или диалкиламиногруппой. Термин "подходящая органическая часть" означает любую органическую часть, которая признана специалистами в данной области как не оказывающая неблагоприятного влияния на ингибиторную активность изобретенных соединений. Иллюстративные примеры подходящих органических частей включают, но не ограничиваются ими, оксогруппы, алкильные группы,гидроксильные группы, галогруппы, цианогруппы, нитрогруппы, циклоалкильные группы,гетероциклоалкильные группы, арильные группы, гетероарильные группы, трансалкильные группы, и группы с формулами (А), (В), (С), (D),(E), (F), (G), (H), (J) и (К), определенные выше."Оксогруппа" означает двухвалентный радикал =О."Галогруппа" означает любой из радикалов"Трансалкилсилильная группа" означает радикал -SiRpRqRs, где Rp, Rq и Rs -каждый независимо являются алкильной группой.-NRURV, где Ru и RV, которые являются одинаковыми или разными, каждый является алкильной группой, определенной выше."Фармацевтически приемлемое вещество" означает соединение, которое превращается при физиологических условиях или путем сольволиза в соединение с формулой 1."Фармацевтически приемлемый сольват" означает сольват, который сохраняет биологическую эффективность и свойства биологически активных компонентов соединений с формулой 1. Примеры фармацевтически приемлемых сольватов включают, но не ограничиваются ими, соединения с формулой 1 в комбинации с водой, изопропанолом, этанолом, метанолом,ДМСО, этилацетатом, уксусной кислотой или этаноламином. В случае твердых рецептур, понятно, что изобретенные соединения могут существовать в различных формах, таких как стабильные и метастабильные кристаллические формы и изотропные и аморфные формы, при этом подразумевается, что все они находятся в сфере действия данного изобретения."Фармацевтически приемлемая соль" означает такие соли, которые сохраняют биологическую эффективность и свойства свободных кислот и оснований, и которые не являются нежелательными с биологической или других точек зрения. Примеры фармацевтически приемлемых солей включают, но не органичиваются ими,сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, вторичные кислые фосфаты, кислые фосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты,пропионаты, деканоаты, каприлаты, акрилаты,соли муравьиной кислоты, изобутираты, соли капроновой кислоты, соли гептановой кислоты, 13 пропиолаты, оксалаты, малонаты, сукцинаты,соли пробковой кислоты, соли себациновой кислоты, фумараты, малеаты, бутин-1,4-диоаты,гексин-1,6-диоаты, бензоаты, хлорбензоаты,метилбензоаты, динитробензоаты, гидроксибензоаты, метоксиэнзоаты, фталаты, сульфонаты,ксиленсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, угидроксибутираты, гликолаты, тартраты, метансульфонаты, пропансульфонаты, нафтален-1 сульфонаты, нафтален-2-сульфонаты и соли миндальной кислоты. Если соединение согласно изобретению является основанием, желаемая соль может быть приготовлена любым подходящим методом, известным в данной области науки, включая обработку свободного основания неорганической кислотой, такой как соляная кислота,бромистоводородная кислота, серная кислота,азотная кислота, фосфорная кислота и тому подобные, или органической кислотой, такой, как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловые кислоты,такие как глюкуроновая кислота и галактуроновая кислота, альфа-гидроксикислоты, такие как лимонная кислота и винная кислота, аминокислоты, такие как аспарагиновая кислота и глютаминовая кислота, ароматические кислоты, такие как бензойная кислота и коричная кислота,сульфоновые кислоты, такие как паратолуенсульфоновая кислота или этансульфоновая кислота, или подобные. Если соединение согласно изобретению является кислотой, желаемая соль может быть приставлена любым подходящим методом, известной в данной области техники, включая обработку свободной кислоты неорганическим или органическим основанием, таким как амин(первичный, вторичный или третичный), гидроокисью щелочного или щелочно-земельного металла или подобными. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных,вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Предпочтительно в формуле 1 Аr является фенильной группой, которая не замещена или замещена в пара-положении заместителем, выбранным из фтора или хлора. Иллюстративные примеры соединений,соответствующих предпочтительным формам реализации данного изобретения, включают, но не ограничиваются ими, 3(S)-N-гидрокси-2,2 диметил-4-(4-(4-(имидазол-2-ил)фенокси)бензолсульфонил)-тетрагидро-2 Н-1,4-тиазин-3 003294 14 карбоксамид и 3(S)-N-гидрокси-2,2-диметил-4(4-пирид-4-ил)окси)бензолсульфонил)тетрагидро-2 Н-1,4-тиазин-3-карбоксамид. Также, в соответствии с предпочтительными формами воплощения данного изобретения, где X является N-R3, R3 является атомом водорода или C1-C6-алкильной группой, где указанная алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности, цепью из атомов углерода и водорода, С(О)-Р 17-группой, C(O)OR17 группой, C(O)NHR17 группой, SO2-R19 группой, где R17 является С 1-С 4-алкильной группой,причем указанная алкильная группа является моновалентным радикалом с прямой или разветвленной, не имеющей ненасыщенности, цепью из атомов углерода и водорода, и где R19 является СН 3. Иллюстративные примеры соединений,соответствующих этим предпочтительным формам данного изобретения, включают, но не ограничиваются ими: Изобретенные соединения могут существовать как отдельные стереоизомеры, рацематы и/или смеси энантиомеров и/или диастереомеров. Все такие отдельные стереоизомеры, рацематы и их смеси подразумеваются находящимися в сфере данного изобретения. Предпочтительно, углерод, несущий гидроксамат, то есть атом углерода, обозначенныйS=O. Для специалистов в этой области понятно,что это различие в обозначении конфигурации является следствием правил последовательности системы Кана-Инголда-Прелога. Если X является S=O, атом серы также предпочтительно находится в "R" конфигурации относительно предпочтительной "S" конфигурации атома углерода, несущего гидроксамат. Таким образом,предпочтительное соединение - это соединение с формулой где W является СН 2, X, Z, и Аr являются такими, как определено для формулы 1, a Y являетсяCR1R2, где R1 и R2 являются такими, как определено для формулы 1. Как в общих чертах понятно специалистам в данной области, оптически чистым соединением, имеющим один хиральный центр (то есть один асимметричный атом углерода), является такое, которое фактически состоит из одного из двух возможных энантиомеров (то есть является 16 энантиометрически чистым), а оптически чистым соединением, имеющим более одного хирального центра, является такое, которое одновременно является диастереометрически чистым и энантиометрически чистым. Предпочтительно, соединения, являющиеся предметом данного изобретения, используются в форме,которая является, по меньшей мере, на 90% оптически чистой, то есть в форме, которая содержит, по меньшей мере, 90% отдельного изомера (80% избыток энантиомера ("е.е") или избыток диастереомера ("d.e."), более предпочтительно - минимум 95% (90% е.е. или d.e.), еще более предпочтительно - минимум 97,5% (95% е.е. или d.e.) и наиболее предпочтительно - минимум 99% (98% е.е. или d.e В вышеописанных методах и промежуточных соединениях для конверсии 1, 2 и 8-12 и для соединений 3, 4, 8, 9 и 10 предпочтительно,чтобы D являлось N. Для конверсии 2, 8 и 10 и для соединения 4 предпочтительно, чтобы J было Cl. Особенно предпочтительными промежуточными соединениями с формулой 4, пригодными для использования в конверсиях 2, 8 и 10,являются соли с формулами 4 а и 4b: Для конверсии 5 и 6 и 8-13 и для соединений 7, 8 и 9, если Q является группой с формулой а А является С, предпочтительно R8 является Н,алкильной группой, О-алкильной группой, Sалкильной группой, циклоалкильной группой,гетероциклоалкильной группой, арильной группой, гетероарильной группой, CN или C(O)R11,где R11 является алкильной группой, арильной группой, циклоалкильной группой, гетероарильной группой или гетероциклоалкильной группой, a R9 и R10 независимо выбраны из Н,алкильной группы и арильной группы. Для тех же конверсий и соединений, если А является Si,предпочтительно R8, R9 и R10 являются независимо выбранными из алкильной группы, циклоалкильной группы и арильной группы. Более предпочтительно для этих конверсий и соединений Q является СН 3, СН 2 СН 3, СН(СН 3)2,С(СН 3)3, СН 2-СН=СН 2, СН 2CN или группой с формулой где R12 является СН 3 или СН(СН 3)2. Для конверсии 4 и для соединения 6, предпочтительными формами реализации изобретенных способов и соединений являются те,когда Q является A(R8)(R9)(R10)группой, как показано выше, а А является С, предпочтительно R8 является Н, алкильной группой, О 17 алкильной группой, S-алкильной группой, циклоалкильной группой, гетероциклоалкильной группой, арильной группой, гетероарильной группой, CN или C(O)R11, где R11 является алкильной группой, арильной группой, циклоалкильной группой, гетероарильной группой или гетероциклоалкильной группой, a R9 и R10 независимо выбраны из Н, алкильной группы и арильной группы. Для этой же конверсии соединения, если А является Si, предпочтительноR8, R9 и R10 независимо выбраны из алкильной группы, циклоалкильной группы и арильной группы. Более предпочтительно, для этой конверсии и соединения Q является СН 3, СН 2 СН 3,СН(СН 3)2, С(СН 3)3, СН 2-СН=СН 2, CH2CN или группой с формулой где R12 является СН 3 или СН(СН 3)2. Для конверсий 3-13 и для промежуточных соединений 6, 7, 8 и 9 предпочтительно R1 и R2 являются каждый метильной группой. Особенно предпочтительными соединениями с формулой 8, пригодными для конверсий 8 и 9, являются соединения с формулой 8 а,где D является N, R1 и R2 каждый являются метильной группой, a Z является О, и с формулой 8b, где D является N, R1 и R2 каждый являются метильной группой, a Z является S. Для соединений 9 и 10 предпочтительно D является N, aR1 и R2 каждый являются метильной группой. Данное изобретение далее направлено на создание способов ингибирования активности металлопротеиназы, например, в тканях млекопитающих, путем введения соединения с формулой 1, или его фармацевтически приемлего провещества, соли или сольвата. Активность изобретенных соединений как ингибиторов активности металлопротеиназ, такой как активность ММП (включая стромелизины, коллагеназы, желатиназы и/или матрилизин) и/или ФНО-конвертазы, может быть измерена любым из методов, доступных специалистам в данной области, включая пробы in vivo и/или in vitro. Примеры подходящих для измерений активности анализов включают анализы, описанные вAnal. Biochem., vol. 147, р.437 (1985), Anal. Biochem., vol. 180, p. 110 (1989), FEВS, vol. 96, p. 263 (1992) и европейской патентной заявке 0 606 046. Введение соединений с формулой 1 или их фармацевтически приемлемых провеществ, солей и сольватов, может быть выполнено в соответствии с любым из принятых способов введения, доступных специалистам в данной области. Иллюстративные примеры подходящих способов введения включают оральное, назальное,парентеральное, местное, трансдермальное и ректальное. Предпочтительно, способ введения является оральным. 18 Изобретенные соединения с формулой 1 или их фармацевтически приемлемые провещества, соли и сольваты, могут быть введены в виде фармацевтических композиций в любой подходящей фармацевтической форме, известной специалистам в данной области. Подходящие фармацевтические формы включают, но не ограничиваются ими, твердые, полутвердые,жидкие или лиофилизированные рецептуры,такие как таблетки, порошки, капсулы, суппозитории, суспензии и аэрозоли. Предпочтительно,фармацевтической формой является таблетка или капсула для орального введения. Фармацевтическая композиция также может включать подходящие наполнители, разбавители, связующие вещества и носители, а также другие фармацевтически активные агенты, в зависимости от предполагаемого использования. Приемлемые методы приготовления подходящих фармацевтических форм фармацевтических композиций известны специалистам в данной области. Например, фармацевтические препараты могут быть приготовлены с помощью традиционных методик фармацевтической химии, включающих такие стадии, как смешивание, гранулирование и сжатие, если необходимы таблетированные формы, или смешивание, наполнение и растворение ингредиентов соответствующим образом, чтобы получить желаемые продукты для орального, парентерального, местного, интравагинального, интраназального, интрабронхиального, интраокулярного, интрааурального и/или ректального введения. Иллюстративные примеры таких методов включают методы, описанные в Remington'sPharmaceutical Sciences, 18-e издание (1990). Твердые или жидкие фармацевтически приемлемые носители, разбавители, связующие вещества или наполнители могут использоваться в фармацевтических композициях. Иллюстративные твердые носители включают крахмал,лактозу, дигидрат сульфата кальция, белую глину, сахарозу, тальк, желатин, агар, пектин, аравийскую камедь, стеарат магния и стеариновую кислоту. Иллюстративные жидкие носители включают патоку, арахисовое масло, оливковое масло, солевой раствор и воду. Носитель или разбавитель может включать подходящий материал для пролонгированного выделения, такой как глицерина моностеарат или глицерина дистеарат, один или вместе с воском. Если используется жидкий носитель, препарат может быть в форме сиропа, эликсира, эмульсии, мягких желатиновых капсул, стерильной жидкости для инъекций (например, раствора) или неводной или водной жидкой суспензии. Доза фармацевтической композиции содержит, по меньшей мере, терапевтически эффективное количество активного соединения(например, соединения с формулой 1, или его фармацевтически приемлемых провеществ, солей или сольватов) и предпочтительно изготов 19 лена из одной или большего количества фармацевтических дозировочных единиц. Примерная дозировочная единица для млекопитающегореципиента содержит количество от 0,1 до 500 мг активного соединения на килограмм веса тела реципиента, предпочтительно от 0,1 до 200 мг, более предпочтительно - 50 мг или менее, и еще более предпочтительно - около 10 мг или менее на килограмм веса реципиента. Выбранная доза может быть введена млекопитающему,например, пациенту-человеку, нуждающемуся в лечении, опосредованном ингибированием металлопротеиназной активности, любым известным методом введения дозы, включающим: местно, например, в виде мази или крема; орально; ректально, например, в виде суппозитория; парентерально путем инъекции; или непрерывно путем интравагинальной, интраназальной, интрабронхиальной, интраауральной или интраокулярной инфузии. Количество изобретенных соединений, солей, сольватов и/или провеществ, которое необходимо ввести, будет варьировать в зависимости от многих факторов, включающих специфическую металлопротеиназу, которую необходимо ингибировать, желаемый уровень ингибирования, характеристики ткани млекопитающего,в которой желательно игибирование, метаболическую стабильность и активность отдельного используемого соединения, являющегося предметом изобретения, и способа введения. Специалист в данной области может легко определить подходящую дозировку, в соответствии с методами, известными в данной области. Предпочтительно вводимое количество соединения,являющегося предметом изобретения, с формулой 1 или его фармацевтически приемлемых провеществ, солей или сольватов лежит между 0,1 мг/кг веса тела и 100 мг/кг веса тела в день. Соединения, являющиеся предметом изобретения, и их соли, сольваты и провещества могут быть приготовлены путем использования методов, имеющихся в данной области, с использованием исходных материалов, которые легко доступны. Примеры способов приготовления соединений, являющихся предметом изобретения, описаны ниже. В следующих схемах,если не указано иначе, W, X, Y, Z, Ar, R1 и R2 являются такими, как здесь определено ранее. Изобретенные соединения с формулой 1 предпочтительно могут быть приготовлены путем реакции соединения с формулой 12-а (где М является гидроксильной группой) с гидроксиламином в присутствии подходящего пептидобразующего агента. Иллюстративные примеры подходящих соединяющих агентов включают 1,1'-карбонилдиимидазол,N-(диметиламинопропил)-N'-этил карбодиимид ("ЭДК"), бензотризол-1-илокси-трис(диметиламино)фосфониум гексафторфосфат или пропанфосфоновый ангидрид в инертном полярном растворителе, таком как диметилформамид ("ДМФ"). Альтернативно, соединение с формулой 12-b (где М является галогеном, таким как хлор) может реагировать с гидроксиламином в подходящей смеси растворителей, такой как третичный бутанол-тетрагидрофуран("ТГФ")дихлорметан, предпочтительно при 0-25 С, с образованием гидроксаматов с формулой 1. Соединения с формулой 12-b предпочтительно приготавливают в форме, которую можно непосредственно использовать для дальнейшей реакции без выделения. Например, такие соединения могут быть приготовлены путем создания возможности для соединений с формулой 12-а реагировать с подходящим галогенирующим агентом, таким как тионилхлорид или оксалилхлорид, предпочтительно в присутствии каталитического количества диметилформамида и предпочтительно в подходящем растворителе, таком как дихлорметан при температуре от 0 С до комнатной. Альтернативно реакции сочетания, описанные выше, могут быть выполнены с соединениями с формулой 12-а или 12-b и защищенными по кислороду соединениями гидроксиламина (то есть, где Pg является подходящей защитной группой, известной специалистам в данной области, такой, как бензил, т-бутил, тбутилдиметилсилил или Т-бутилдифенилсилил,и/или описанными у T.W.Greene and P. G. M.(1991), которые включены здесь в качестве ссылки) для получения соединений с формулой 13. Депротекция соединений с формулой 13 дает соединения с формулой 1. Подходящие методы снятия защиты с соединений с формулой 13 известны в данной области науки, например,описанные у T.W.Greene and P.G.M.Wuts, Protective Groups in Organic Synthesis (1991). Соединения с формулой 12-а могут быть приготовлены путем щелочного гидролиза соответствующего сложного эфира 12-с (где М =OQ, a Q является подходящей защитной группой, такой как метил, этил, аллил, бензил или тбутил) с использованием подходящего водного основания, такого как гидроокись лития, гидроокись натрия или гидроокись калия, предпочтительно, в однородной водно-органической смеси растворителей при температуре от 0 до 25 С. Альтернативно, эти соединения могут также быть приготовлены путем кислотного гидролиза соответствующего сложного эфира с использованием подходящей водной кислоты, такой как 21 соляная кислота в водном диоксане при подходящей температуре, предпочтительно от 50 до 100 С. Также могут быть использованы другие методы, которые могут быть известны специалистам в данной области, как подходящие для превращения сложных эфиров в кислоты, такие как гидрогенолиз бензиновых эфиров с использованием водорода и палладия на углероде,промотированное кислотой сцепление тбутиловых эфиров при безводных условиях, и катализируемое палладием сцепление аллиловых эфиров. Соединения с формулой 1-c (то есть 1, гдеX является N-R3), в которых R3 является алкильной группой, могут быть приготовлены непосредственно из соединений с формулой 1-b, например, путем обработки подходящим алкилирующим агентом, таким как галоидный алкил или родановый эфир, в подходящем растворителе при соответствующей температуре, таком какTNF при температуре от 0 до 50 С. Соединения с формулой 1-c, где R3 является алкилсульфонильной группой или арилсульфонильной группой, также могут быть приготовлены непосредственно из соединений с формулой 1-b. Например, обработка соединений с формулой 1-b 2 эквивалентами триметихлорсилана в присутствии избытка третичного основания, такого как 4-метилморфолин, в апротонном растворителе, таком как дихлорметан, при 25 С с последующей обработкой алкилсульфохлоридом при температуре от 0 до 25 С приводит после общепринятой обработки водой к соединениям с формулой 1-c, где R3 является алкилсульфонилом или арилсульфонилом. Сходным образом можно провести реакцию соединений с формулой 1-b с соответствующими электрофильными карбонильными реагентами для образования соединений с формулой 1-c, где R3 является CO-R3 является любой подходящей органической частью. Соединения с формулой 16 (то есть, 12-а,где W и Y являются СН 2 и X является N-R3) могут быть приготовлены в соответствии со следующей схемой. Предпочтительно использовать имеющуюся в продаже рацемическую смесь пиперазин-2 карбоновая кислота для реакции с подходящим электрофильным реагентом R3-Lg, где Lg является любой подходящей остаточной группой,при таких условиях, чтобы реакция происходила главным образом в положении N-4, чтобы дать соединения с формулой 14. Более предпоч 003294 22 тительно, чтобы реакция происходила в водноорганическом растворителе, таком как ацетонитрил-вода, при температуре от -20 С до 25 С и в присутствии избытка основания, такого как триэтиламин. Для приготовления энантиометрически чистых соединений с формулой 16 рацемическая смесь пиперазин-2-карбоновая кислота может быть вначале растворена в соответствии с известными методами, такими как описанные вChim. Acta, vol. 72, p. 1043 (1989), данные которых включены здесь в качестве ссылки. Примеры подходящих электрофильных реагентов R3-Lg с подходящей зонной селективностью включают BOC-ON, ди-т-бутилбикарбонат, N-(бензилоксикарбокси)сукцинимид и уксусный ангидрид. Промежуточное вещество с формулой 14 затем предпочтительно должно реагировать дальше, без выделения, при тех же условиях с сульфонилхлоридом с формулой 15,чтобы дать соединения с формулой 16. Альтернативно, промежуточное соединение с формулой 14 может быть выделено, и затем включено в реакцию с триметилсилил хлоридом и подходящим основным третичным амином, таким как триэтиламин или 4-метилморфолин. Без выделения результирующий материал затем может вступать в реакцию с сульфонилхлоридом 15 в подходящем растворителе,таком как дихлорметан при 25C, чтобы дать после обычной обработки кислотой соединение с формулой 16. Промежуточное соединение с формулой 14 также может быть приготовлено путем обработки комплекса меди (II) с пиперазин-2-карбоксилатом, приготовленного в соответствии с методом, описанным в патенте США 4, 032,639, данные которого включены здесь в качестве ссылки, R3-Lg с последующим разрушением комплекса путем подкисления и ионобменной хроматографией с использованием смолыDOWEX 50. При помощи этой процедуры может быть получен широкий диапазон электрофильных реагентов R3-Lg. Соединения с формулой 15 предпочтительно могут быть получены путем обработки соответствующего арил/гетероарилфенилового эфира или арил/гетероарилфенилового тиоэфира, которые имеются в продаже или могут быть приготовлены методами, известными специалистам в данной области, с избытком хлорсульфоновой кислоты в растворе дихлорметана при температуре от 0 до 25C. Альтернативно, арилфениловый эфир может быть обработан 0,9-1,2 молярными эквивалентами хлорсульфоновой кислоты при -20 до 25 С. Образующаяся в результате сульфоновая кислота, с выделением или без, впоследствии может быть конвертирована в сульфонилхлорид 15 при избытке хлорирующего реагента, такого как оксалилхлорид или тионилхлорид, в присут 23 ствии каталитического количества диметилформамида ("ДМФ") в подходящем растворителе, таком как дихлорметан, 1,2-дихлорэтан или ацетонитрил, при 25-80 С. Альтернативно, соединения с формулой 16-а, где Pg является подходящей защитной группой, описанной выше, вначале конвертируют в соответствующие метиловые эфиры 17 традиционными методами, такими как обработка триметилсилилдиазометаном в подходящем растворителе, таком как метанолдихлорметан,при комнатной температуре, как показано на следующей схеме. Подходящие защитные группы, Pg, для этого типа реакции могут быть узнаны специалистами в данной области и включают, но не ограничиваются ими, т-бутильные группы и бензильные группы. Удаление защитной группы известными методами дает соединения с формулой 18-а, где R3 является водородом, который может далее реагировать с реагентами, имеющими формулу R3-Lg, где Lg является любой подходящей остаточной группой, с образованием соединений с формулой 18-b, где R3 не является водородом. Иллюстративные примеры подходящих R3-Lg реагентов включают метансульфонилхлорид, метилиодид, метилизоцианат, этилбромацетат, диметилкарбомоилхлорид и метоксиуксусный ангидрид. Соединения с формулой 18 (то есть 12-с,где W является СН 2, Y является CR1R2, a X является NR3) могут быть приготовлены, как проиллюстрировано на схеме ниже.-Аминогидроксиэфирам с формулой 19 и азиридинам с формулой 20 дают возможность реагировать в инертном растворителе,таком как дихлорэтан или, предпочтительно,диоксан, при повышенной температуре от 60 до 100 С для получения аддуктов 21. На использование аминной функции 21 для получения соединения с формулой 22 можно повлиять традиционными методами, известными специалистами в данной области. Циклизация соединений с формулой 22 при условиях типа Мицунобу (см. J. Org. Chem. 1991, 56, 3900-3905, данные которых включены здесь со ссылкой) дает пиперазины 18. 24 Соединения с формулой 19, где R1 является Н, и R2 является алкилом, могут быть приготовлены в соответствии со способами, известными специалистам в данной области из литературы. Если R1 и R2 оба являются метилами,аминоспирты 19 можно получить путем алкилирования нитронатов, как описано в Bull. Chem.Soc. Jpn. 1976, 49, 3181-3184, данные которых включены здесь со ссылкой. Азиридины 20 могут быть приготовлены путем обработки сульфонилхлоридов с формулой 15 избытком этаноламина в ТГФ при температуре от -20 до 25 С с последующей циклизацией образующихся в результате -гидроксиэтилсульфонамидов при помощи DEAD и трифенилфосфина в ТГФ. Соединения с формулой 15 могут быть приготовлены так, как описано выше. Соединения с формулой 28 (то есть 12-с,где X является NH, W является С=О, a Y является CR1R2) могут быть приготовлены в соответствии со следующей схемой.Chem. Int. Ed. Engl. 1994, 33, 998-999, данные из которой включены здесь со ссылкой) сульфонилхлоридами с формулой 15, как описано выше, дает соединения с формулой 24. Алкилирование соединений с формулой 24 этилбромацетатом происходит в присутствии подходящего основания, такого как карбонат калия, в подходящем растворителе, таком как ДМФ, при 2580 С в течение периода от 1 до 48 ч для получения соединений с формулой 25. Окисление алкенов 25 до соединений с формулой 26 происходит при подходящих условиях оксиления,таких как избыток перйодата натрия в присутствии каталитического количества трихлорида рутения в растворителе ацетонитрил : тетрахлористый углерод : вода (2:2:3) при 25 С в течение 1-18 ч. Обработка соединений с формулой 26 дифенилфосфорилазидом ("ДФФА") в присутствии подходящего основания, такого как триэтиламин, в инертном растворителе, таком как бензол, при 70-100 С в течение 1-12 ч дает промежуточный изоцианат, который при добавлении подходящего спирта, такого как бензиловый спирт, дает соединения с формулой 27, гдеPg является соответствующей защитной группой, такой как бензилоксикарбонильная группа. Удаление защитной группы из соединений с формулой 27 при обычных условиях приводит к 25 спонтанной лактамизации, дающей соединения с формулой 28. Альтернативная последовательность приготовления с использованием промежуточных соединений с формулой 24 показана ниже. Окисление соединений с формулой 24 при условиях, описанных в предшествующем параграфе для окисления соединений с формулой 25,дает соединения с формулой 29. Перегруппировка Курциуса кислот 29, описанная выше для конверсии 26-27, за исключением отсутствия добавления спирта, приводит к образованию соединений с формулой 30. Гидролиз слабыми основаниями соединений с формулой 30, например, 1 молярным эквивалентом гидроокиси лития в ТНФ-воде при 0 С в течение 0,5-18 ч,приводит к соединениям с формулой 31. Реакция аминов с формулой 31 с избытком окиси этилена в спиртовом растворителе при 25 - 75 С в течение 1-18 ч дает соединения с формулой 32, которые при обработке DEAD и трифенилфосфином в ТНФ при 25 С дают соединения с формулой 18-с. Специалисты в данной области поймут, что использование энантиометрическиобогащенных соединений с формулой 24, которые можно получить с использованием способов, описанных в литературе и известных специалистам в данной области, даст энантиометрически-обогащенные соединения с формулами 28 и 18-с. Альтернативно промежуточные соединения с формулой 29 могут быть приготовлены в энантиометрически-обогащенной форме в соответствии со следующей схемой. Обработка соединений с формулой 33, которые легко получить из D-аспарагиновой кислоты способами, известными специалистам в данной области, триметилсилилхлоридом и триэтиламином в дихлорметане при 25 С в течение примерно 1 ч дает триметилсилильные эфиры,которые, без выделения, далее реагируют с арилсульфонилхлоридами с формулой 15 в присутствии дополнительного основания для получения, после обычной обработки, соответствующих сульфонамидов с формулой 34. Обработка сульфонамида 34 примерно 3 молярными эквивалентами сильного основания, такого как диизопропиламид лития ("ЛДА"), при темпера 003294 26 туре между - 78 и 0 С в инертном растворителе,таком как ТНФ, с последующей обработкой 1 эквивалентом соответствующего низшего галоидного алкила с формулой R1-X, предпочтительно при температуре между 0 и -78 С, дает моноалкилированный продукт с формулой 35,где R2 является Н. Без выделения реакционная смесь обрабатывается дополнительным эквивалентом основания, а затем проводится реакция со вторым галоидным алкилом с формулой R2X, где R1 и R2 предпочтительно являются одинаковыми, но могут быть различными, для получения после обработки кислотой сульфонамида с формулой 35. После этерификации функциональной группы карбоновой кислоты соединения 35 защитную группу Pg удаляют для получения кислоты 29. Альтернативно, соединения с формулой 18-с могут быть получены в соответствии со следующей схемой. Арилсульфохлориды с формулой 15 могут быть ковертированы в сульфамиды с формулой 36 путем реакции с монозащищенными производными этилендиамина. Конденсация сульфамида 36 с -кетоэфиром с формулой 37 в присутствии кислотного катализатора, такого как паратолуолсульфокислота, дает соединение с формулой 38. Конверсия соединения с формулой 38 в соответствующее соединение с формулой 18-с выполняется путем циклизации в присутствии каталитического основания, такого как карбонат калия, в подходящем растворителе,таком как ДМФ, с последующим удалением защитной группы Pg. Дополнительно, соединения с формулой 42(то есть, 12-а, где X является N-R3, W является СН 2, a Y является CR1R2) могут быть получены в соответствии со следующей схемой. Обработка диэтиламиномалоната, который выпускается в продажу, хлорацетонитрилом или бромацетонитрилом в присутствии диизопропилэтиламина в этиловом спирте дает диэтил(цианометил)аминомалонат, который далее реагирует с арилсульфохлоридом с формулой 15 для получения соединения с формулой 39. Нит 27 рилы с формулой 39 восстанавливают до соответствующих солей аминов с формулой 40 путем гидрогенизации на подводящем металлическом катализаторе, таком как палладий или платина, в присутствии кислоты в спиртовом растворе. Реакция соли амина с формулой 40 с избытком кетона R1-CO-R2 дает производное пиперазина с формулой 41. После защиты аминной группы традиционными методами, известными специалистам в данной области, основной гидролиз этиловых эфиров с последующим декарбоксилированием в кислых условиях дает соединения с формулой 42. Соединения с формулой 44 (то есть 12-а,где W является N-H, X является С=О, a Y является СН) могут быть приготовлены в соответствии со следующей схемой.D-аспарагина, который имеется в продаже, обрабатывается формалином, чтобы дать после охлаждения до 0 С 6(R)-карбокситетрагидропиримидин-4-он (43). Обработка 6(R)-карбокситетрагидропиримидин-4-она триметилсилилхлоридом в подходящем основании, таком какN-метилморфолин или диизопропилэтиламин, в полярном апротонном растворителе, таком как ДМФ, дает соответствующий триметилсилиловый эфир. Этот эфир может быть обработан, без выделения, сульфохлоридом 15 в присутствии дополнительного основания в течение нескольких часов при 25 С, чтобы дать после водной обработки соединение с формулой 44. Альтернативно соединение с формулой 44 может быть приготовлено непосредственно путем обработки раствора 6(R)-карбокситетрагидропиримидина 4-она и основания, такого как N-метилморфолин, в подходящем водно-органическом смешанном растворителе, таком как вода:диоксан, сульфохлоридом с формулой 15 при 25 С в течение нескольких часов с последующей обработкой водным раствором кислоты. Соединения с формулой 48 (то есть соединения с формулой 12-с, где W и X являются СН 2, a Y является N-R3) могут быть приготовлены в соответствии со следующей схемой. Медленное добавление соединений с формулой 15, в виде раствора в инертном растворителе, таком как дихлорметан, к четырем молярным эквивалентам 1,3-диаминопропана в том же 28 растворителе при 20 - 0 С дает соединения с формулой 45, которые легко выделить путем кислотно-основной последовательности экстракции для удаления малых количеств побочного продукта бис-сульфамида. Обработка аминов 45 эфирами глиоксалата с формулой 46,которые имеются в продаже или хорошо известны из литературы, дает промежуточные соединения с формулой 47, которые могут существовать частично или в значительной степени в качестве соответствующих таутомеров иминов открытой формы. Реакция соединений 47 с соответствующим электрофильным реагентом R3-Lg затем дает соединения с формулой 48. Метод приготовления соединений с формулой 54, где X является О или S, показан на схеме ниже. Исходные -гидроксиаминоэфиры 49 либо имеются в продаже, например серии треонин и эфиры аллотреонина, либо могут быть приготовлены методами, описанными в литературе (смотри, например, J. Org. Chem., 1996, 61,2582-2583, результаты которой включены сюда в качестве ссылки). Соединения с формулой 49 обрабатывают сульфохлоридом,имеющим формулу 15, в присутствии подходящего основного третичного амина, такого как N-метилморфолин, в апротонном растворителе, таком как ДМФ-дихлорметан, при 0 - 25 С для получения эфиров -гидроксисульфамина, имеющих формулу 50. Обработка соединений с формулой 50 подходящими дегидратирующими реагентами, например, трифенилфосфином и DEAD в растворе ТНФ при 25 С, дает сульфазиридины с формулой 51. Обработка азиридинов с формулой 51 тиолом (X = S) или спиртом (X = О) с формулой 52, где Lg является любой подходящей остаточной группой (или предшественником, таким как гидроксил, такой остаточной группы) в присутствии кислоты Левиса, такой как эфир трехфтористого бора, при 0 - 25 С, либо без дополнительного растворителя, либо в подходящем инертном растворителе, таком как дихлорметан,дает соединения с формулой 53. Последующая обработка соединений, имеющих формулу 53,основанием, таким как карбонат калия в апротонном растворителе, таком как ДМФ, дает затем соединения с формулой 54. В случае, когдаLg является гидроксилом, циклизация 53 для получения 54 производится трифенилфосфином и DEAD в растворе ТНФ при 25 С. 29 Альтернативно, соединения с формулой 54-а могут быть приготовлены из аминоэфиров 49 при помощи последовательности реакций,показанной ниже. Гидроксиэтилирование аминоэфиров 49 может осуществляться окисью этилена в спиртовом растворителе при 25-70 С для получения соединений с формулой 55, которые могут быть конвертированы в соединения с формулой 56 путем обработки сульфохлоридами 15. Диол 56 может быть циклизован по протоколу опыта Мицунобу (смотри Holladay, M.W.; Nadzan,A.M. J. Org, Chem. 1991, 56, 3900-3905) или в традиционном стиле Вильямсона через тозилат 57 и основание для получения соединения с формулой 54-а. Альтернативно соединения с формулой 54 с (то есть 54-b, где Q является третичным бутилом, X является S, a R1 и R2 оба являются водородом) могут быть приготовлены в соответствии со следующей схемой:(1973), данные из которой включены сюда со ссылкой) обрабатывается 2-меркаптоэтиламином и триэтиламином в подходящем растворителе, таком как смесь хлороформа и бензола,для получения т-бутил-тетрагидро-1,4-тиазин-3 карбоксилат, который в результате реакции с соединением с формулой 16 при подходящих условиях, таких как в присутствии триэтиламина в растворе дихлорметана при 25 С, дает соединения с формулой 54-с. Как показано на схеме ниже, оксиление тетрагидротиазинов с формулой 54-b до соответствующих сульфоксидов с формулой 54-d может быть выполнено при подходящих условиях окисления, таких как m-хлорпербензойная кислота в дихлорметане при температуре от -78 до 0 С или перборат натрия в уксусной кислоте при температуре от 25 до 50 С. Следует понять,что такие окисления также могут быть выполнены на других промежуточных стадиях синтеза соединений с формулой 1, где X является S=O,и также для прямого превращения соединений с 30 формулой 1, где X является S, в соединения с формулой 1, где X является S=O. Соединения с формулой 54-b могут быть приготовлены в соответствии со следующей схемой: Во-первых, -меркаптоаминокислоты с формулой 58, такие как D-пеницилламин или Dцистеин, которые обе имеются в продаже, обрабатывают 2-бромэтанолом в присутствии основания, такого как гидроокись натрия, для получения сульфидов 2-гидроксиэтила с формулой 59. Промежуточные соединения с формулой 59 затем непосредственно реагируют с соединениями с формулой 15 в присутствии подходящего основания, такого как карбонат натрия, в соответствующей системе растворителей, такой как ДМФ/вода, для получения N-сульфонильных производных 60. Кислотную функциональную группу соединений с формулой 60 затем защищают в качестве подходящей эфирной группы Q, например, т-бутиловый эфир, который приготавливают путем реакции 60 с тбутилбромидом в присутствии подходящего основания, такого как карбонат калия, и подходящего катализатора, такого как хлорид бензилтриэтиламмония ("БТЭАХ") в диметилацетамиде при температуре между 50 и 60 С. Циклизация соединения с формулой 61 может быть выполнена с использованием трифенилфосфина иDEAD в подходящем растворителе, таком как ТНФ, чтобы получить соединение с формулой 54-b. Более предпочтительно, соединения с формулой 1-d (то есть 1, где X является S) могут быть приготовлены в соответствии со следующей схемой: Обработка соединений с формулой 58 хлоридом триалкилсилила, таким как хлорид три 31 метилсилила, в присутствии основного третичного амина, такого как диизопропилэтиламин, в апротонном растворителе, таком как ДМФ, дает соответствующий триалкилсилильный эфир,который после реакции с 1,2-дихлорэтаном или 1,2-дибромэтаном в присутствии DBU при 25 С дает промежуточный тетрагидротиазин с формулой 7-b. Без выделения, это промежуточное соединение далее реагирует с 9-флуоренилметил хлорформатом ("FMOC-Cl") в присутствии дополнительного основания, такого как Nметилморфолин, чтобы дать, после обработки водным раствором кислоты, свободную карбоновую кислоту с формулой 62. Эта кислота затем может сопряжена с О-защищенным гидроксиламином, например, где Pg является тбутилдифенилсилилом, при помощи обычных реагентов пептидного сопряжения, такими какEDC, для получения защищенного гидроксамата с формулой 63. За удалением защищающейFMOC группы традиционными методами, такими как пиперидин в ДМФ, следует реакция с сульфохлоридом с формулой 15 в присутствии основания, такого как N-метилморфолин, в подходящем растворителе, таком как дихлорметан,дает соединения с формулой 13-b. Удаление защитной группы Pg дает соединения с формулой 13-b. Удаление защитной группы Рg дает соединения с формулой 1-d. Особенно предпочтительными соединениями, являющимися предметами данного изобретения, являются соединения с формулой 10. Приготовление соединений с формулой 64-b,описанных выше, может быть использовано для синтеза соединений с формулой 10. Более предпочтительно, однако, соединения с формулой 10 получают в соответствии с процессом, описанным ниже. Краткое изложение процесса Одним аспектом данного изобретения является процесс для синтеза определенных ингибиторов матриксной металлопротеиназы, представленных формулой 10. Схема реакции может быть обобщена как включающая следующие стадии: Процесс включает соединение соответствующим образом активированной двухуглеродной цепи с аминокислотой 5 с образованием производного тетрагидро-2 Н-1,4-тиазина 11 или с подходящим эфиром 6 с образованием производного тетрагидро-2 Н-1,4-тиазина 7. Соединение с формулой 7 обрабатывают активированным производным сульфокислоты 4 для получения соответствующего сульфамида 8. С эфирной функциональной группы Q в соединении 8 снимается защита для получения соединения 9, 33 которое затем активируют путем образования хлорида кислоты или другой подходящей активированной группы. Активированную группу замещают гидроксиламином или подходящей солью или производный гидроксиламина для получения гидроксамовой кислоты 10. Активированное производное диарилового эфира сульфокислоты 4 может быть получено из диарилового эфира 2 путем хлорсульфонации непосредственно до хлористого сульфонила или путем ступенчатого процесса сульфонации до сульфоновой кислоты 3 с последующей конверсией до сульфонилхлорида или другого соответствующим образом активированного производного сульфокислоты. Подробное описание процесса Многие диариловые эфиры 2 имеются в продаже. В случаях, когда диарилового эфира нет в продаже, первая стадия процесса включает приготовление диарилового эфира 2. В случае,когда d является азотом, соединения 2 могут быть получены путем соединения либо 4-хлорпиридина гидрохлорида, либо 1-(4-пиридил) пиридиния хлорид гидрохлорида с фенолом или тиофенолом при температуре, равной или выше 100 С, либо чистых, либо в воде, толуоле, ксилоле или другом подходящем растворителе. На стадии 2 процесса диариловый эфир обрабатывают хлорсульфоновой кислотой, серной кислотой, трехокисью серы или другим подходящим сульфирующим агентом для получения сульфоновой кислоты 3, которая используется непосредственно или выделенной путем охлаждения водой с последующим удалением или экстракцией в подходящий не смешивающийся с водой органический растворитель. В некоторых случаях четвертичная соль аммония,такая как тетрабутиламмония бромид, может быть использована для повышения растворимости сульфоновой кислоты 3 в органических растворителях. Стадия 3 процесса включает добавление тионилхлорида, оксалилхлорида, хлорсульфоновой кислоты, пятихлористого фосфора или другого подходящего хлорирующего реагента к сульфоновой кислоте 3 в ацетонитриле, дихлорметане, 1,2-дихлорэтане или другом подходящем органическом растворителе. Результирующий хлористый сульфонил 4 может быть выделен удалением растворителя или охлаждением водой с последующей фильтрацией или экстракцией. Альтернативно сульфоновая кислота 3 может быть конвертирована во фтористый сульфонил фторсульфоновой кислотой или бромистым сульфонилом с бромистым тионилом. Если желательно, хлористый сульфонил,фтористый сульфонил и бромистый сульфонил могут быть конвертированы в более стабильные производные триазолида или бензотриазолида путем обработки 1,2,4-триазолом или бензотриазолом, соответственно. 34 На стадии 4 соединение 5 конвертируется в подходящий силиловый или угольный эфир. В случаях, когда используется силиловый эфир,хлористый триметилсилил, хлористый третичный бутилдиметилсилил, хлористый диметилтексилсилил, хлористый триизопропилсилил или другой подходящий силилирующий агент добавляется к смеси соединения 5 и 1,8-диазобицикло[5.4.0]ундец-7-ена, триэтиламина, диизопропилэтиламина, 4-метилморфолина, пиридина или других подходящих оснований типа третичных аминов в N,N-диметилформамиде,ацетонитриле, дихлорэтане или другом подходящем апротонном растворителе. Результирующая смесь силилового эфира 6 может быть использована непосредственно на стадии 5, или силиловый эфир может быть выделен путем обработки водой, экстракции и удалении растворителя. В случаях, когда используется эфир угольной кислоты, смесь соединения 5 и серной кислоты, хлористого водорода, паратолуолсульфоновой кислоты или другой подходящей органической или минеральной кислоты в метаноле,этаноле, изопропаноле, 1-бутаноле, третичном бутаноле, аллиловом спирте или другом подходящем спиртовом растворителе нагревается с обратным холодильником в течение 4-60 ч. Результирующий эфир выделяют в качестве либо свободного основания или соли амина путем удаления растворителя и/или обработки водой с последующей экстракцией соответствующим растворителем и удалением растворителя или образования соли путем добавления соответствующей кислоты. Альтернативно, третичный бутиловый эфир может быть приготовлен путем выдерживания смеси соединения 5 в жидком изобутилене, подходящего органического растворителя, такого как 1,4-диоксан, и подходящей минеральной кислоты или органической кислоты, такой как серная кислота, хлористый водород или р-толуолсульфоновая кислота, с обратным холодильником в течение 4-60 ч. На стадии 4 а соединение 5 смешивается с 1,8-диазобицикло[5.4.0]ундец-7-еном,гидроокисью натрия, гидроокисью калия или другим подходящим органическим или неорганическим основанием и 1,2-дихлорэтаном, 1,2-дибромэтаном или другой соответствующим образом активированной двухуглеродной частью в 1,2 дихлорэтане, N,N-диметилформамиде, метаноле, этилацетате, тетрагидрофуране, ацетонитриле, воде или другом подходящем растворителе. Результирующее производное тетрагидро-2 Н 1,4-тиазина 11 выделяют путем преципитации с последующей фильтрацией или удалением растворителя. Альтернативно, функциональная группировка карбоновой кислоты соединения 5 может быть защищена in situ путем добавления хлористого триметилсилила и 1,8-диазобицикло[5.4.0]ундец-7-ена. Образующийся в результате силиловый эфир обрабатывают 1,2-дихлор 35 этаном, 1,2-дибромэтаном или другой подходящим образом активированной двухуглеродной частью и 1,8-диазобицикло[5.4.0]ундец-7-еном или другим подходящим основанием типа третичного амина в 1,2-дихлорэтане, N,N-диметилформамиде или другом подходящем апротонном растворителе. С силилового эфира снимают защиту in situ путем добавления метанола, 2 пропанола или другого спиртового растворителя, а образующееся производное тетра-2 Н-1,4 тиазина 11 выделяют путем преципитации и фильтрации. На стадии 5, эфир 6 обрабатывают 1,8 диазобицикло[5.4.0]ундец-7-еном, гидроокисью натрия, гидроокисью калия или другим подходящим органическим или неорганическим основанием, и 1,2-дихлорэтаном, 1,2-дибромэтаном или другой подходящим образом активированной двухуглеродной частью в 1,2-дихлорэтане,N,N-диметилформамиде, метаноле, этилацетате,тетрагидрофуране, ацетонитриле или другом подходящем растворителе. Образующееся в результате производное тетрагидро-2 Н-1,4 тиазина 7 выделяют путем преципитации или водной обработки с последующей экстракцией органическим растворителем и удалением растворителя. На стадии 5 А соединение 11 конвертируется до подходящего силилового или угольного эфира. В случаях, когда используется силиловый эфир, хлористый триметилсилил, хлористый третичный бутилметилсилил, хлористый диметилтексилсилил, хлористый триизопропилсилил или другой подходящий силилирующий реагент добавляют к смеси соединения 11 и 1,8 диазобицикло[5.4.0]ундец-7-ена, триэтиламина,диизопропилэтиламина,4-метилморфолина,пиридина или любого подходящего основания типа третичного амина в N,N-диметилформамиде, ацетонитриле, дихлорэтане или другом подходящем апротонном растворителе. Образующаяся в результате смесь силилового эфира 7 может быть использована непосредственно в стадии 6, или силиловый эфир может быть выделен путем водной обработки, экстракции и удаления растворителя. В случаях, когда используется угольный эфир, смесь соединения 11 и серной кислоты,хлористого водорода, р-толуолсульфоновой кислоты или другой подходящей органической или минеральной кислоты в метаноле, этаноле,изопропаноле, 1-бутаноле, третичном бутаноле,аллиловом спирте или другом подходящем спиртовом растворителе нагревают с обратным холодильником. Образующийся в результате эфир выделяют в виде либо свободного основания, либо соли амина путем удаления растворителя и/или обработки водой с последующей экстракций при помощи подходящего растворителя и удалением растворителя или образованием соли путем добавления соответствующей кислоты в конце. Альтернативно, эфир третичного 36 бутила может быть приготовлен путем выдерживания смеси соединения 11 в 1,4-диоксане или другом подходящем растворителе, жидкого изобутилена и серной кислоты, хлористого водорода, р-толуолсульфоновой кислоты или другой подходящей минеральной кислоты или органической кислоты с обратным холодильником. Альтернативно, производное тетрагидро 2 Н-1,4-тиазина 11 может быть лишено защиты слева и использовано непосредственно в стадии 6. В этом случае стадия 5 А просто пропускается. На стадии 6 производное тетрагидро-2 Н 1,4-тиазина 7 или 11 и производное активированного диарилового эфира сульфоновой кислоты 4 соединяют в дихлорметане, 1,2 дихлорэтане, ацетонитриле, N,N-диметилформамиде, этилацетате, толуоле, метиловом эфире третичного бутила или другом подходящем растворителе в присутствии 4-метилморфолина,пиридина, триэтиламина, диизопропилэтиламина, карбоната калия или другого подходящего органического основания типа третичного амина или неорганического основания. Образующееся в результате производное сульфамида 8 выделяют путем обработки водой, экстракции в соответствующий органический растворитель и удаления растворителя. Стадия 7 включает снятие защиты защищающей эфир группы соединения 8 для получения карбоновой кислоты 9. В случаях, когда используется силиловый эфир, снятие защиты выполняется путем выдерживания смеси эфира и метанола, этанола, изопропанолола или другого спиртового растворителя при 20C с обратным холодильником и выделения продукта путем фильтрации или удаления растворителя. Альтернативно, с силиловых эфиров может быть снята защита путем обработки минеральной кислоты или уксусной кислоты в либо органическом, либо водном растворе или путем обработки фторидным ионом в органическом растворителе. В случаях, когда используется эфир карбоновой кислоты, эфир может быть удален путем нагревания смеси соединения 8 и хлористого водорода, серной кислоты или других минеральных кислот в воде, диоксане или другом подходящем органическом растворителе при обратном холодильнике. Альтернативно, эфир может быть удален обработкой гидроокисью натрия, гидроокисью лития, гидроокисью калия или другим подходящим неорганическим основанием в воде или комбинации воды и метанола,тетрагидрофурана или другого подходящего органического растворителя. В случае, когда Q является аллилом, эфир может быть удален путем обработки N-метиланилином, морфолином или другим подходящим вторичным амином и тетракис(трифенилфосфин)палладием(0) или другим подходящим палладиевым(0) катализа 37 тором в этилацетате, ацетонитриле или другом подходящем органическом растворителе. В случае, если Q является бензилом, эфир может быть удален каталитическим гидрированием. Финальной стадией процесса является двухстадийная процедура, включающая активацию in situ карбоксильной функциональной группы соединения 9 и последующее замещение гидроксиламином или подходящей солью или производным гидроксиламина. Активация выполняется путем реакции соединения 9 с оксалилхлоридом или тионилхлоридом с или безN,N-диметилформамида, присутствующего в качестве катализатора, в дихлорметане, ацетонитриле или другом подходящем растворителе для получения хлорида соответствующей кислоты. Альтернативно, карбоксил может быть активирован добавлением хлористого метансульфонила, изобутилового эфира хлоругольной кислоты или различных других хлоругольных реагентов. Активированное соединение добавляют к гидроксиламину или подходящей соли или производному гидроксиламина и соответствующему органическому или неорганическому основанию, если это необходимо, в воде, тетрагидрофуране, диоксане, диметилоксиэтане, третичному бутиловому спирту, дихлорметане или другом подходящем растворителе или комбинациях растворителей. Образующаяся в результате гидроксамовая кислота 10 может быть выделена путем удаления растворителя или путем растворения в водном растворе гидроокиси, при регулировании рН в диапазоне от 5 до 10, и сборе преципитата путем фильтрации. Предпочтительным соединением является 3(S)-N-гидрокси-4-(4-пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4 тиазин-3-карбоксамид, иллюстрируемое следующей формулой Предпочтительной группой, защищающей карбоновую кислоту, Q является диметилтексилсилил, где А является силиконом, R8 и R9 оба являются СН 3, a R10 является (СН 3)2 СНС(СН 3)2,что иллюстрируется следующей структурной формулой Другие соединения с формулой 1 могут быть приготовлены способами, известными специалистам данной области, образом, аналогичным основным процедурам, описанным выше. Специфические примеры способов, используемых для соединений, являющихся предметом изобретения, описаны ниже вместе с иллюстративными предпочтительными вариантами вы 003294 38 полнения являющихся предметом изобретения соединений с формулой 1, или их фармацевтически приемлемых провеществ, солей или сольватов. Следующие специфические примеры предназначены для того, чтобы проиллюстрировать изобретение, и не должны истолковываться как ограничивающие сферу применения изобретения, определенную прилагаемыми формулами изобретения. Эти примеры включают предпочтительные варианты выполнения соединений,являющихся предметом изобретения. Пример 1. Процесс для приготовления 3(S)-N-гидрокси-4-(4-(пирид-4-илокси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4 тиазин-3-карбоксамида. 1(а) Через промежуточное соединение 3(S)-диметилтексилсилил 2,2-диметил тетрагидро-2 Н-1,4-тиазин-3-карбоксилат. Стадия 1. Приготовление 4-феноксипиридина. Фенол (2,82 кг, 30,0 моль) нагревали до 50 С и добавляли гидрохлорид 4-хлорпиридина(1,5 кг, 10,0 моль). Образующийся в результате раствор нагревали до 150 С в течение 15 ч. Темно-оранжевый раствор охлаждали до 25 С,затем наливали в 3 М водный раствор гидроокиси натрия (16 л). Водную фазу экстрагировали дихлорметаном (3x4 л). Объединенную органическую фазу промывали 1 М раствором гидроокиси натрия (2 х 4 л), воды (4 л) и рассола (4 л),затем высушивали над сульфатом натрия и фильтровали. Растворитель удаляли под вакуумом, и образующееся в итоге масло растворяли в гексане (6 л). Смесь охлаждали до -60C при перемешивании, и образующееся твердое вещество собирали путем фильтрации и высушивали с получением 1.1 кг 4-феноксипиридина (выход 64%). Точка плавления 46-49 С. 1 Н ЯМР (300 МГц, CDCl3)8.45 (dd, J= 1.5, 8 Гц, 2 Н), 7.41 (dd, J=12, 12 Гц, 2 Н), 7.28(dd, J=12, 1 Н), 7.06 (d, J = 12 Гц, 2 Н), 6.84 (dd,J=1.5, 8 Гц, 2 Н). Стадия 2. Приготовление 4-[(пирид-4-ил) окси]бензолсульфоновой кислоты 3 а. К интенсивно перемешиваемому раствору 4-феноксипиридина (1 кг) в сухом 1,2-дихлорэтане (3 л) при -10 С под потоком аргона медленно добавляли хлорсульфоновую кислоту(974 мл). Скорость добавления хлорсульфоновой кислоты регулировали так, чтобы поддерживать температуру реакции ниже 0 С. После того, как была добавлена половина хлорсульфоновой кислоты, выделение тепла прекращалось. Охлаждающую ванну удаляли, и добавление хлорсульфоновой кислоты продолжалось в течение 3 ч, пока реакционный раствор согревался до комнатной температуры. Во время непрерывной продувки инертным газом интенсивно перемешиваемую реакционную смесь нагревали до 45 С. По данным анализа с помощью тон 39 кослойной хроматографии, через 20 ч исходного материала больше не оставалось. Реакционную смесь охлаждали до комнатной температуры и медленно наливали в ледяную воду (5 л) при перемешивании. Трехосновный фосфат калия (212 г) добавляли к смеси в виде твердого вещества, и смесь перемешивали в течение 10 мин, после чего добавляли гидроокись натрия (2 М) до рН 2. После перемешивания в течение 1 ч, рН изменяли до 7 путем добавления гидроокиси натрия (2 М). Взбалтывание продолжали в течение 5 мин, затем органический слой сливали и выбрасывали. Смесь экстрагировали второй раз при помощи дихлорметана (2 л), смесь взбалтывали в течение 5 мин, и органический слой сливали и выбрасывали. Оставшуюся водную смесь экстрагировали добавлением дихлорметана (6 л), бормистого тетрабутиламмония (940 г) и гидроокиси натрия (2 М) до рН 7. Смесь взбалтывали в течение 5 мин,и органический слой (нижний) сливали в бутыль. Процедуру экстракции повторяли дважды. Объединенную органическую фазу высушивали над сульфатом магния, фильтровали, и раствор концентрировали под вакуумом до масла. Остаточное масло разводили 20% этиловым спиртом в этилацетате (8 л, сухой), и газообразный хлористый водород добавляли до рН 1. Твердое вещество отфильтровывали, и отжатый осадок на фильтре промывали 20% этиловым спиртом в этилацетате (2 л). Твердое вещество высушивали под вакуумом при 45 С в течение 15 ч для выхода 4-[(пирид-4-ил)окси]бензолсульфоновой кислоты 3 а (1.3 кг) в виде белого порошкообразного твердого вещества. Точка плавления дес. 275C Аналит. расчет для С 11 Н 9NО 4S: С 52.58; Н 3.61; N 5.57; S 12.76. Обнаружено: С 52.50; Н 3.69; N 5.51; S 12.67. 1 Н ЯМР (300 МГц, ДМСО-d6):8.86 (dd,J= 1.5, 7.4 Гц, 2 Н), 7.84 (dd, J=1.5, 7 Гц, 2 Н), 7.54(8 л) добавляли N,N-диметилформамид (12,35 мл), и вязкую реакционную смесь нагревали до 75 С. Хлористый тионил (756 мл) добавляли к реакционной смеси в течение 30 мин. Реакционная смесь медленно становилась менее вязкой и становилась гомогенной через 45 мин, что показывало завершение реакции. Часть растворителя(4 л) испаряли под вакуумом и добавляли метиловый эфир третичного бутила (4 л). Образующийся в результате шлам фильтровали в инертной атмосфере. Отжатый осадок на фильтре промывали метиловым эфиром третичного бутила (2 л), и твердое вещество высушивали под вакуумом для выхода 4-[(пирид-4-ил)окси]бен 003294 40 золсульфонил хлорида гидрохлорида 4 а (1.35 кг) в виде мелкокристаллического грязно-белого твердого вещества в виде хлопьев с перламутровым блеском: точка плавления 182 С; 1 Н ЯМР (300 МГц, CDCl3)8.87 (d, J= 7 Гц, 2 Н), 8.24 (d, J=8.5 Гц, 2 Н), 7.50 (d, J=8.5 Гц,2 Н), 7.43 (d, J = 7 Гц, 2 Н). Стадии 4 и 5. Приготовление 3(S)-диметилтексилсилил 2,2-диметилтетрагидро-2 Н-1,4 тиазин-3-карбоксилата. Под атмосферой аргона D-пеницилламин(375 г, 2.51 моль) суспендировали в сухом N,Nдиметилформамиде (3,8 л) и добавляли 1,8 диазобицикло[5.4.0]ундец-7-ен (413 мл, 2,76 моль), образующий прозрачный раствор. Поддерживая температуру между 20-30 С, по каплям лобавляли хлористый диметилтексилсилил[5.4.0]ундец-7-ен (788 мл, 5,27 моль) добавляли в течение 1 ч, поддерживая температуру между 25-30 С. Образующуюся в результате смесь перемешивали при 20C в течение 3 ч, затем быстро охлаждали, заливая имеющей температуру 0 С смесью воды (8 л), метилового эфира третичного бутила (2 л) и гексана (2 л). После перемешивания в течение 5 мин, фазы разделяли,и водную фазу экстрагировали дополнительным количеством смеси метилового эфира третичного бутила (2 л) и гексана (2 л). Объединенные органические слои высушивали над сернокислым магнием, фильтровали, а растворитель удаляли под вакуумом для получения 878 г (110% выхода) сырого 3(S)-диметилтексилсилила 2.2 диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата в виде густого, желтого масла. 1 Н ЯМР (300 МГц, CDC3)3.65 (s, 1H),3.42-3.37 (m, 1H), 2.98-2.83 (m, 2 Н), 2.30-2.22(878 г, 2,51 моль) и 4-метилморфолин (547 мл,4,98 моль) растворяли в сухом дихлорметане (14 л), и раствор охлаждали до -20 С. Добавляли гидрохлорид 4-[(пирид-4-ил)окси]бензолсульфонил хлорида 4 а (690 г, 2,26 моль) и смесь медленно нагревали до 20 С и поддерживали при 20 С в течение 12 ч. Образующуюся в результате красную суспензию наливали в воду (8 л). Фазы разделяли, и органический слой высушивали над сульфатом натрия, фильтровали, и растворитель удаляли под вакуумом, получая 1.4 кг (117% выхода) 3(S)диметилтексилсилил 4-(4-пирид-4-ил)окси)бензолсульфонил)-2,2 диметил-тетрагидро-2 Н-1,4-тиазин-3-карбокси 41 лата в виде красного масла, которое использовали без очистки или характеризации. Остаточное красное масло растворяли в метаноле (14 л), и раствор нагревали с обратным холодильником в течение 1 ч, с образованием преципитата. Смесь охлаждали до 4 С, и преципитат собирали путем фильтрации, промывали метанолом и высушивали с получением 575 г(62% выхода) 3(S)-4-(4-пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4 тиазин-3-карбоновой кислоты в виде светлорозового твердого вещества: точка плавления с разложением 235 С; 1 Н ЯМР (300 МГц, CDCl3)8.60 (dd, J=1.5,5 Гц, 2 Н), 7.86 (d, J=8.5, 2H), 7.39 (d, J=9 Гц,2 Н), 7.11 (dd, J=1.5, 5 Гц, 2 Н), 4.3 (s, 1H), 4.03 (d,J=12.5 Гц, 1 Н), 3.75 (ddd, J=2.2, 13, 13 Гц, 1H),3.02 (ddd, J=3, 12.5, 13 Гц, 1H), 2.62 (d, J=14 Гц,1H), 1.52 (s, 3 Н), 1.35(s, 3H). Стадия 8. Приготовление 3(S)-N-гидрокси 4-(4-пирид-4-ил)окси)бензолсульфонил)-2,2 диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксамида. Суспензию 3(S)-4-(4-пирид-4-ил)окси) бензолсульфонил)-2,2-диметилтетрагидро-2 Н 1,4-тиазин-3-карбоновой кислоты (700 г, 1,71 моль) в дихлорметане (7 л) охлаждали до -65 С. Быстро добавляли оксалилхлорид (179 мл, 2,05 моль). Удаляли охлаждающую ванну, и смесь перемешивали при 20 С в течение 15 ч. Образующийся в результате раствор добавляли в течение 1,25 ч к раствору гидроксиламина (1,05 л 50% водного раствора, 17,15 моль) в тетрагидрофуране (3,5 л) и третичном бутиловом спирте(1,8 л), поддерживая температуру между 5 и 20 С. Образующуюся в результате смесь перемешивали при 20 С в течение 15 ч, затем приливали к 1 М водному раствору гидроокиси натрия (10 л) при 5 С. Фазы разделяли и водную фазу экстрагировали метиловым эфиром третичного бутила (4 л). Водный слой фильтровали через Целайт и рН доводили до 8,5 добавлением насыщенного водного раствора хлорида аммония и концентрированной соляной кислоты. Результирующую суспензию перемешивали в течение 3 ч. Твердое вещество собирали путем фильтрации, промывали водой и высушивали с получением 665 г (выход 92%) сырого продукта. Сырой материал перекристаллизовывали из смеси этанола, воды и дихлорметана для получения 466 г (70% возврат) 3(S)-N-гидрокси-4-(4 пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксамида в виде белого, кристаллического твердого вещества: точка плавления 184-186 С с выделением газа; 1 Н ЯМР (300 МГц, ДМСО-d6):10.69 (d,J=1.5 Гц, 1 Н), 8.93 (d, J=1.5 Гц, 1 Н), 8.57 (dd,J=1.5, 4.5 Гц, 2 Н), 7.83 (dd, J=2,7 Гц, 2 Н), 7.37 42 3.91 (ddd, J=3, 2.2, 12 Гц, 1 Н), 2.98 (ddd, J=3.7,13, 13.5 Гц, 1 Н), 2.7-2.55 (m, 1H), 1.49 (s, 3 Н),1.22(s, 3 Н). Пример 1(b). Через т-бутил 3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилат. Стадия 4 А. 3(S)-2,2-Диметилтетрагидро 2 Н-1,4-тиазин-3-карбоновая кислота 11. К перемешиваемой суспензии D-пеницилламина (14.92 г) в дихлорэтане (300 мл) и N,Nдиметилформамиде (2 мл) при 0 С добавляли 1,8-диазобицикло[5.4.0]ундец-7-ена (22.4 мл), а затем - триметилсилилхлорид (19.0 мл). Реакционную смесь перемешивали в течение 3 ч, медленно нагревая до комнатной температуры. К гомогенному раствору добавляли 1,8-диазобицикло[5.4.0]ундец-7-ена (29.9 мл) в течение 10 мин и реакционная смесь нагревалась до 47 С. Реакционную смесь охлаждали до комнатной температуры и перемешивали дополнительно 17,5 ч. К реакционной смеси добавляли метанол(10 мл), и после перемешивания в течение 10 мин образовывался преципитат. Реакционную смесь фильтровали, и преципитированный материал промывали минимальным количеством метанола. Твердое вещество высушивали под вакуумом при 50 С в течение 6 ч для получения 3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3 карбоновой кислоты (16,18 г) в виде белого порошкообразного твердого вещества: точка плавления с разрушением 212 С; 1 Н ЯМР (300 МГц, D2O):3.71 (s, 1 Н),3.68-3.60 (m, 1 Н), 3.27-3.01 (т, 2 Н), 2.78-2.64 (m,1 Н), 1.45 (s, 3 Н), 1.42 (s, 3 Н). Стадию 4 а также выполняли следующим образом. К перемешиваемой суспензии D-пеницилламина (14.92 г) в 1,2-дихлорэтане (150 мл) и диметилформамиде (15 мл) при комнатной температуре в течение 30 мин добавляли хлористый триметилсилил (19.0 мл) и реакционную смесь нагревали до 43C. К образующейся в результате вязкой суспензии добавляли с постоянной скоростью 1,8-диазобицикло[5.4.0]ундец-7-ена(22,4 мл) в течение 4 ч, и во время добавления реакционная смесь нагревалась до 48 С. Реакционную смесь медленно охлаждали до комнатной температуры и перемешивали дополнительно 2 ч. К реакционной смеси добавляли изопропанол (75 мл) и эту смесь перемешивали в течение 3 ч, пока образовывался преципитат. Реакционную смесь фильтровали, и преципитированный материал промывали изопропанолом(100 мл). Твердое вещество сушили под вакуумом при 50 С в течение 6 ч для получения 3(S)2,2-диметилтиоморфолин-3-карбоновой кислоты (15,47 г) в виде белого порошкообразного твердого вещества. Стадия 5 А. Приготовление т-бутил-3(S)2,2-диметил-тетрагидро-2 Н-1,4-тиазин-3-карбоксилата. В 2,0 л склянку с одной шейкой загружали диоксан (320 мл) и 3(S)-2,2-диметилтетрагидро 43 2 Н-1,4-тиазин-3-карбоновую кислоту (28,0 г,0,16 моль). Суспензию охлаждали до 0 С перед добавлением концентрированной серной кислоты (32 мл, 0,6 моль) через воронку в течение 10 мин. Охлаждение удаляли и к суспензии добавляли жидкий изобутилен (200 мл, 2,2 моль).(Изобутилен конденсировали в отдельном градуированном цилиндре при - 20 С из сосуда на 400 г). Газ при комнатной температуре заставляли стекать обратно при помощи конденсора с двойным кожухом, используя этанол при - 50 С из криованны с рециркуляцией. Перемешивание продолжали 19 ч до обработки. Реакционную смесь наливали в холодную, двухфазную смесь,содержащую этилацетат (400 мл) и 2 М раствор бикарбоната натрия (1 л). Органические вещества выделяли, а водную фазу экстрагировали этилацетатом (200 мл). Объединенные органические вещества промывали рассолом и высушивали над сульфатом натрия. После фильтрации растворитель концентрировали под вакуумом для получения т-бутил-3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата в виде масла, которое отвердевает при стоянии. (32.7 г,89% выхода): 1 Н ЯМР (300 МГц, CDCl3) 3.42 (s, 1H), 3.23.35 (m, 1H), 2.7-2.85 (m, 2 Н), 2.05-2.2 (m, 1 Н),1.37 (s, 6 Н), 1.3 (s, 3 Н), 1.2 (s, 3 Н). Стадия 6. т-Бутил-3(S)-4-(4-пирид-4-ил) окси)бензолсульфонил)-2.2-диметилтетрагидро 2 Н-1,4-тиазин-3-карбоксилат. 3(S)-т-Бутил-2,2-диметилтетрагидро-2 Н 1,4-тиазин-3-кабоксилат (2,31 г, 0,01 моль) соединяли с хлористым метиленом (25 мл) и 4 метилморфолином (2,42 мл, 0,022 моль) для образования раствора. К этому раствору добавляли 4-[(пирид-4-ил)окси]бензолсульфонил хлорида гидрохлорида (3.22 г, 0.0105 моль). Реакционная смесь превращалась в оранжевую суспензию, что сопровождалось слабым выделением тепла. Реакционную смесь выливали в этилацетат (300 мл) после перемешивания в течение 4 ч при комнатной температуре. Органические вещества промывали 2N гидроокисью натрия(50 мл) и раствором рассола (50 мл) перед высушиванием над сульфатом натрия, раствор фильтровали, затем концентрировали под вакуумом для получения т-бутил-3(S)-4-(4 пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата в виде желтого твердого вещества (4,4 г, 94 % выхода). 1 Н ЯМР (300 МГц, CDCl3) 8.55 (d, 2 Н), 7.80(dd, 2H), 7.17 (dd, 2H), 6.92 (dd, 2H), 4.37 (s, 1H),4.07 (dd, 1H), 3.89 (dt, 1H), 3.15 (dt, 1 Н), 2.45 (d,1 Н), 1.63 (s, 3 Н), 1.36 (s, 3 Н), 1.33 (s, 9H). Стадия 7. Приготовление гидрохлорида 3(S)-4-(4-пирид-4-ил)окси)бензолсульфонил)2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоновой кислоты. В колбу на 100 мл загружали диоксан (20 мл) и 3(S)-т-бутил-4-(4-пирид-4-ил)окси)бен 003294 44 золсульфонил)-2,2-диметилтетрагидро-2 Н-1,4 тиазин-3-карбоксилат (4.37 г, 0.0094 моль). К этому добавляли 4 М хлористый водород в диоксане (20 мл, 0.08 моль), и смесь нагревали с обратным холодильником. Через 4 ч нагревания с обратным холодильником, реакционную смесь охлаждали и фильтровали для получения гидрохлорида 3(S)-4-(4-пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4 тиазин-3-карбоновой кислоты (3.6 г, 81%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3) 8.82 (d, 2H), 8.15(d, 2H), 7.5-7.6 (m, 4H), 4.4 (s, 1H), 4.15 (dd, 1H),3.85 (dt, 1H), 3.16 (dt, 1H), 2.55 (d, 1H), 1.64 (s,3 Н), 1.39 (s, 3 Н). Пример 1(с). Через метил-3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилат. Стадия 5. Приготовление метил 3(S)-2,2 диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата. К перемешиваемому раствору 1,2-дибромэтана (1,03 мл) в 10 мл сухого N,Nдиметилформамида при 25C в течение 1 ч добавляли через канюлю раствор гидрохлорида метилового эфира D-пеницилламина (2,0 г) и 1,8-диазобицикло[5.4.0]ундец-7-ена (4,5 мл) в 20 мл сухого N,N-диметилформамида. Реакционную смесь перемешивали в течение 2 ч, затем переливали в раствор бикарбоната натрия и экстрагировали этилацетатом (3 х 100 мл), органические фракции объединяли, высушивали над сульфатом натрия, фильтровали, добавляли изооктан и удаляли растворитель. Остаток помещали под вакуум на 24 ч для получения метил 3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3 карбоксилата (1.41 г) в виде слегка желтого масла: 1 Н ЯМР (300 МГц, CDCl3)3.68 (s, 1H),3.67 (s, 3H), 3.39-3.30 (m, 1H), 2.95-2.80 (m, 2H),2.31-2.18 (m, 1H), 1.38 (s, 3 Н), 1.27 (s, 3 Н). Стадия 6. Приготовление метил-3(S)-4-(4 пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата. К раствору метил-3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата (0,756 г) в дихлорметане (20 мл) при комнатной температуре добавляли 4-метилморфолин (0,44), а затем- гидрохлорид 4-[(пирид-4-ил)окси]бензолсульфонил хлорида 4 а (1,28 г). Реакционную смесь перемешивали в течение 24 ч, затем переливали в буфер с рН 7 (100 мл) и экстрагировали этилацетатом (3 х 100 мл). Объединенные органические экстракты высушивали над сульфатом натрия, фильтровали и растворитель удаляли под вакуумом. Остаток хроматографировали на двуокиси кремния, элюируя 40% этилацетатом в дихлорметане. Продуктсодержащие фракции объединяли и растворитель удаляли. Добавляли минимум дихлорметана, а затем - гексан. Растворитель медленно удаляли, что приводило к кристаллизации метил-3(S)-4-(4-пирид-4-ил) окси)бензолсульфонил)-2,2-диметилтетрагидро 45 2 Н-1,4-тиазин-3-карбоксилата (1,06 г) в виде кристаллического белого твердого вещества: точка плавления 151C; 1 Н ЯМР (300 МГц, CDCl3):8.55 (dd,J=1.5, 5 Гц, 2 Н), 7.76 (dd, J=2, 6.5 Гц, 2 Н), 7.17(dd, J=2, 6.5 Гц, 2 Н), 6.89 (dd, J=1.5, 5 Гц, 2 Н),4.47 (s, 1H), 4.10 (ddd, J=1.5, 1.7, 12.5 Гц, 1 Н),3.79 (ddd, J=3, 12.5, 12.5 Гц, 1 Н), 3.46 (s, 3H),3.18 (ddd, J=4, 13, 13.5 Гц, 1 Н), 2.48 (ddd, J=2.5,3, 14 Гц, 1 Н), 1.65 (s, 3 Н), 1.29 (s, 3 Н). Стадия 7. Приготовление 3(S)-4-(4 пирид-4-ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоновой кислоты. Раствор метил-3(S)-4-(4-(пирид-4-илокси)бензолсульфонил)-2,2-диметилтетрагидро 2 Н-1,4-тиазин-3-карбоксилата (15 г, 35,5 ммоль) в 6 М водного раствора соляной кислоты (74 мл) нагревали с обратным холодильником в течение 15 ч. Смесь медленно охлаждали и рН доводили до 6 добавлением 3 М водного раствора гидроокиси натрия и 50% водного раствора гидроокиси натрия. Образующуюся в результате суспензию охлаждали до 20C и преципитат собирали путем фильтрации, промывали водой (200 мл) и высушивали с получением 3(S)-4-(4-пирид-4 ил)окси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоновой кислоты (9) в виде белого твердого вещества, весящего 13.3 г (выход 92%). Пример 1(d). Через аллил-3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилат. Стадия 5 а. Приготовление аллил-3(S)-2,2 диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата 7. Колбу на 50 мл оборудовали нагревательным кожухом, ловушкой Дина-Старка и обратным холодильником и загружали 3(S)-2,2 диметилтетрагидро-2 Н-1,4-тиазин-3-карбоновой кислотой 11 (0,87 г, 0,005 моль). К этому добавляли бензол (20 мл), моногидрат паратолуолсульфоновой кислоты (0,856 г, 0,0045 моль) и серную кислоту (0,14 мл, 0,0025 моль). Реакцию нагревали с обратным холодильником в течение 16 ч для получения оранжевого раствора, тогда как 0,2 мл воды было азеотропным. Нагреватель удаляли и реакционную смесь выливали в воду(25 мл). Водный слой отделяли и соединяли с хлористым метиленом (25 мл). рН доводили от 1 до 9 1N раствором гидроокиси натрия, органическую фазу высушивали и растворитель удаляли под вакуумом для получения аллил-3-2,2 диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата в виде бесцветного масла (0.47 г, выход 44%). 1 Н ЯМР (300 МГц, CDCl3) 1.24 (s, 3H), 1.42 46 Гидрохлорид 4-[(4-пиридил)окси]бензолсульфонилхлорида 4 а (610 мг, 2.0 ммоль) суспендировали в сухом ацетонитриле (10 мл) и добавляли карбонат калия (550 мг, 4.0 ммоль). После перемешивания в течение 30 мин по каплям добавляли раствор аллил 3(S)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксилата (430 мг, 2,0 ммоль) в ацетонитриле (5 мл) в течение 15 мин. Смесь перемешивали при 20C в течение 24 ч. Реакцию гасили буфером с рН 7 и рН доводили до 7 2 М соляной кислотой. Смесь экстрагировали хлористым метиленом (2 х 25 мл). Объединенные органические слои промывали рассолом, высушивали над сульфатом натрия и фильтровали. Растворитель удаляли под вакуумом, получая аллил 3(S)-4-(4-пирид-4-ил)окси) бензолсульфонил)-2,2-диметилтетрагидро-2 Н 1,4-тиазин-3-карбоксилата в виде желтого твердого вещества весом 700 мг (выход 78%). 1 Н ЯМР (300 МГц, CDCl3) 8.53 (d, J = 5 Гц,2 Н), 7.78 (d, J=8 Гц, 2 Н), 7.15 (d, J=8 Гц, 2 Н),6.90 (d, J=8 Гц, 2 Н), 5.84-5.71 (m, 1H), 5.30-5.22(ddd, J=1.5, 1.5, 12 Гц, 1H), 1.65 (s, 3 Н), 1.31 (s,3 Н). Стадия 7. Приготовление 3(S)-4-(4-(пирид 4-илокси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоновой кислоты. К раствору аллил-3(S)-4-(4-пирид-4-илокси)бензолсульфонил)-2,2-диметилтетрагидро 2 Н-1,4-тиазин-3-карбоксилата (0.150 г) в этилацетате (3 мл) при 0 С добавляли N-метилаланин (0,071 мл), а затем - тетракис (трифенилфосфин)палладий(0) (0.0076 г). Реакционную смесь перемешивали в течение 2 ч при 0 С,добавляли гексан (4 мл) и твердое вещество отфильтровывали и высушивали в вакууме для получения 3(S)-4-(4-(пирид-4-илокси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоновой кислоты (0.085 г) в виде белого твердого вещества. Пример 2. Приготовление промежуточных соединений с формулой 15.(а) Хлористый 4-феноксибензолсульфонил. К перемешиваемому раствору 42,5 г (0,25 моль) фенилового эфира в 200 мл дихлорметана при -20C под аргоном медленно добавляли 23,3 г (0,20 моль) хлорсульфоновой кислоты. После того, как добавление было закончено, реакционной смеси давали медленно нагреться до комнатной температуры. Через 16 ч добавляли 150 мл изооктана, и раствор концентрировали до маслянистого остатка. Повторное растворение в 200 мл 1:3 дихлорметане/изооктане и повторное концентрирование с охлаждением примерно до 100 мл, дало твердое вещество. Супернатант декантировали, и твердое вещество растирали в порошок с дополнительным количеством изооктана, а затем высушивали в вакууме для получения 55.2 г сырой 4-феноксибензолсуль 47 фоновой кислоты. Сырую кислоту растворяли в 200 мл дихлорметана, и добавляли 22 мл (32 г,0.25 моль) оксалилхлорида, а затем - 2,5 мл N,Nдиметилформамида. Через 2 дня реакционный раствор приливали к 200 мл ледяной воды и экстрагировали 400 мл гексана. Органический слой промывали 100 мл воды и 100 мл рассола,высушивали над сульфатом магния и концентрировали. Перекристаллизация остатка из дихлорметана/изооктана дала 38,5 г хлористого 4 феноксибензолсульфонила в виде белого твердого вещества: точка плавления 41,5C; 1 Н ЯМР (CDCl3)7.10 (видимо t, 4 Н, J=7 Гц), 7.28 (t, 1 Н, J=7 Гц), 7.46 (t, 2 Н, J=8 Гц), 7.98(b) Хлористый 4-(4-метилфенокси)бензолсульфонил. К раствору 1.84 г (10,0 ммоль) 4 метилдифенилового эфира (см. J. Chem. Soc.,Perkin Trans. 1, 1992, 407-408) с 2 мл дихлорметана в ледяной ванне по каплям добавляли раствор хлорсульфоновой кислоты (0,73 мл, 11,0 ммоль) в 2 мл дихлорметана. Образующуюся в результате смесь перемешивали при 0 С до комнатной температуры в течение 2 ч, а затем по каплям добавляли оксалилхлорид (11,14 мл,13,0 ммоль), после чего 0,15 мл ДМФ. Образующуюся в результате смесь нагревали до 40C в течение 1 ч, а затем позволяли остыть до комнатной температуры в течение 2-х часового периода. Реакционную смесь наливали в ледяной фосфатный буфер с рН 7 (50 мл), затем экстрагировали EtОAc:гексаном (4:3) (3x150 мл). Объединенные органические слои промывали рассолом (75 мл). Водный слой экстрагировалиEtОAc:гексаном (4:3) (150 мл). Органический слой высушивали над Na2SO4, затем испаряли при помощи вакуума для получения сырого продукта в виде белого твердого вещества. Это твердое вещество растирали в порошок с гексаном и собирали путем фильтрации, затем высушивали под высоким вакуумом для получения 1.555 г (57%) хлористого 4-(4-метилфенокси) бензолсульфонила в виде белого твердого вещества: точка плавления 295-300C; 1 Н ЯМР (ДMCO-d6)2.34 (s, 3 Н), 6.916.99 (dd, J=7.7, 8.4 Гц, 4 Н), 7.24-7.27 (d, J=8.4 Гц, 2 Н), 7.61-7.63 (d, J= 8.1 Гц, 2 Н). Аналит. расчет для С 13 Н 11 О 3SCl: С 55.22; Н 3.92; S 11.34; Cl 12.71. Обнаружено: С 55.06; Н 3.95; S 11.28; Cl 12.71. Следующие вещества были приготовлены сходным образом:(g) Хлористый 4-(4-метоксифенокси)бензолсульфонил. Приготовлен из 4-метоксибифенилового эфира (который приготавливали из 4-гидроксибифенилового эфира путем метилирования метилиодидом и карбонатом калия в рефлюксирущем ацетоне).(а) 3(S)-N-Гидрокси-4-(4-(4-(имидазол-1 ил)фенокси)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксамид. Это соединение приготавливали образом,сходным с процедурой, описанной в примере 1(d), за исключением того, что 4-(имидазол-1 ил)бифениловый эфир (приготовленный при помощи процедуры, описанной в патенте США 4,006,243, открытие из которого включено здесь со ссылкой) использовали вместо 4-феноксипиридина: точка плавления 148-150C.(b) 3(S)-N-гидрокси-4-(4-(4-хлорфенокси) бензолсульфонил)-2,2-диметилтетрагидро-2 Н 1,4-тиазин-3-карбоксамид. Это соединение приготавливали образом,сходным с процедурой, описанной в примере 1(d), за исключением того, что хлористый 4-(4 хлорфенокси)бензолсульфонил (пример 2(d применяли вместо хлористого 4-[(4-пиридил) окси]бензолсульфонила на стадии 6: точка плавления 178-180C. Аналитически рассчитано для C19H21N2(с) 3(S)-N-Гидрокси-4-(4-(пирид-4-илсульфанил)бензолсульфонил)-2,2-диметилтетрагидро-2 Н-1,4-тиазин-3-карбоксамид. Это соединение приготавливали образом,сходным с процедурой, описанной в примере 1(d), за исключением того, что тиофенол использовали вместо фенола (в примере 1(а), стадия 1): точка плавления 129-131C с выделением газа; 1 Н ЯМР (300 МГц, ДМСО-d6)10.70 (s,1 Н), 8.92 (s, 1 Н), 8.48 (dd, J=1.5, 6 Гц, 2 Н), 7.83 49 Пример 4. 2(R/S)-N-гидрокси-1-(4-(4-бромфенокси)бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2-карбоксамид. Стадия 1. Раствор дигидрохлорида 2(R/S)пиперазин-2-карбоновой кислоты (1.06 г, 5,23 ммоль) в 8 мл 1:1 диоксана:воды доводили до рН 11 10% водным раствором гидроокиси натрия, а затем охлаждали до 0 С. К этому раствору добавляли раствор ди-т-бутилдикарбоната(1.37 г, 6,28 ммоль) в 3 мл диоксана, и реакционной смеси давали медленно нагреться до комнатной температуры в течение ночи. Реакционную смесь затем повторно охлаждали до 0 С, и добавляли триэтиламин (4,0 мл) и хлористый 4(4-бромфенокси)бензолсульфонил (2,00 г, 5,75 ммоль, в виде раствора в 3 мл диоксана). Реакционную смесь перемешивали в течение 5 ч при 0C до комнатной температуры, а затем подкисляли до рН 2,5 2N соляной кислотой. Смесь экстрагировали этилацетатом (3 х 100 мл), и объединенные органические слои промывали 1N водным раствором кислого сульфата натрия и рассолом, высушивали над сульфатом натрия и концентрировали. Остаток очищали при помощи хроматографии на 200 г двуокиси кремния,элюируя смесью 1:10:1 этилацетата : гексана : уксусной кислоты для получения 1,07 г (38%) 2(R/S)-1-(4-(4-бромфенокси)бензолсульфонил)4-(t-бутоксикарбонил)пиперазин-2-карбоновой кислоты: точка плавления 112,8 С. Стадия 2. К раствору 2(R/S)-1-(4-(4 бромфенокси)бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2-карбоновой кислоты(2.42 г, 4,47 ммоль) в 15 мл безводного дихлорметана при 0 С добавляли О-(т-бутилдиметилсилил)гидроксиламин (998 мг, 6,71 ммоль), а затем раствор EDC метиодида (1,99 г, 6,71 ммоль) в 20 мл дихлорметана. Образующуюся в результате смесь перемешивали в течение 16 ч при 0 С до комнатной температуры, а затем концентрировали in vacua. Остаток распределяли между этилацетатом и водой, и органический слой промывали водой, насыщенным водным раствором бикарбоната натрия и рассолом. После высушивания над сульфатом натрия органический слой концентрировали, и остаток очищали путем быстрой фильтрации через набивку из силикагеля, элюируя 1:1 этилацетатом : гексаном. После концентрирования фильтрата остаток растирали в порошок с гексаном, фильтровали и высушивали под вакуумом для получения, в виде двух выходов, 1,78 г (61%) 2(R/S)N-(т-бутилдиметилсилилокси)-1-(4-(4-бромфенокси)бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2-карбоксамида в виде белого твердого вещества: точка плавления 163,6 С. Стадия 3. К раствору 2(R/S)-N-(т-бутилдиметилсилилоксил)-1-(4-(4-бромфенокси)бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2-карбоксамида (1.599 г, 2,38 ммоль) в 8 мл безводного ТГФ добавляли 1 М раствор фторида тетрабутиламмония в ТГФ (3,6 мл). Через 0,5 50 ч реакционную смесь концентрировали, а остаток распределяли между этилацетатом и водой. Органический слой промывали насыщенным водным раствором бикарбоната натрия и рассолом, высушивали над сульфатом натрия и концентрировали. Растирание остатка в порошок с т-бутилметиловым эфиром:тексаном дало преципитат, который фильтровали и высушивали под вакуумом для получения 1,320 г (99%) 2(R/S)-N-гидрокси-1-(4-(бромфенокси)бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2 карбоксамид: точка плавления 112,4 С. Аналит. расчет для С 22 Н 26 ВrN3 О 7S: С 47,49; Н 4.71; N 7.55; Обнаружено: С 47.56; Н 5.01; N 7.42. Пример 5. (а) 2(R/S)-N-гидрокси-1-(4-(4 бромфенокси)бензолсульфонил)пиперазин-2 карбоксамида гидрохлорид. 2(R/S)-N-гидрокси-1-(4-(4-бромфенокси) бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2-карбоксамид (999,1 мг, 1,80 ммоль) растворяли в 40 мл смеси 4:3:1 этилацетата/ дихлорметана/ метанола при слабом нагревании. Образующемуся в результате прозрачному раствору давали остыть до комнатной температуры и добавляли 5 мл 4 М хлористого водорода в диоксане. Через 5 ч реакционную смесь частично концентрировали при пониженном давлении,а затем разводили этилацетатом:этиловым эфиром. Преципитат собирали путем фильтрации,промывали этилацетатом и этиловым эфиром и высушивали под вакуумом для получения 548,8 мг (62%) 2(R/S)-N-гидрокси-1(4-(4-бромфенокси)бензолсульфонил)пиперазин-2-карбоксамида гидрохлорида в виде белого твердого вещества: точка плавления 186.6 С. Аналитически рассчитано для C17H19ClBrN3O5S: С 41.43; Н 3.89; N 8.53. Обнаружено: С 41.47; Н 3.96; N 8.38. Следующее соединение было приготовлено сходным образом: (b) 2(R/S)-N-гидрокси-1(4-феноксибензолсульфонил)-пиперазин-2 карбоксамид: точка плавления 160.4 С; Аналитически рассчитано дляR. Potoski, патент США,4,032,639 (1977),открытие из которой включено сюда со ссылкой) в дихлорметане (2,5 мл) при 0 С добавляли 0,63 мл хлористого триметиосилила. Через 10 мин добавляли триэтиламин (1,55 мл), а затем 1,37 г хлористого 4-(4-хлорфенокси)бензолсульфонила. Через 3 ч смесь распределяли между дихлорметаном и цитратным буфером с рН 4. Органический слой промывали водой, высушивали над сульфатом натрия и концентрировали. Остаток очищали путем хроматографии, элюи 51 руя 0,5% уксусной кислотой в смеси 95:5 дихлорметана/этанола, для получения 2,05 г (85%) 2(R/S)-1-(4-(4-хлорфенокси)бензолсульфонил)4-(N-бензилоксикарбонил)пиперазин-2 карбоновой кислоты: точка плавления 104,2 С. Аналитически рассчитано для С 25 Н 23ClN2O7S: С 56.55; Н 4.37; N 5.28; S 6.04; Обнаружено: С 56.65; Н 4.41; N 5.22; S 6.10. Стадия 2. Раствор 2(R/S)-1-(4-(4-хлорфенокси)бензолсульфонил)-4-(N-бензилоксикарбонил)пиперазин-2-карбоновой кислоты (2.21 г) в смеси 18:1:1 этанола:этилацетата: воды гидрогенировали при 1 атмосфере над 10% Pd/C (0,22 г) в течение 1 дня. Катализатор удаляли путем фильтрации, и раствор концентрировали для получения 2(R/S)-1-(4-(4-хлорфенокси)бензолсульфонил)пиперазин-2-карбоновой кислоты примерно 95% чистоты, которую использовали без дальнейшей очистки. Стадия 3. К раствору 2(R/S)-1-(4-(4 хлорфенокси)бензолсульфонил)пиперазин-2 карбоновой кислоты (0,987 г) и триэтиламина(0,41 мл) в 20 мл безводного ДМФ добавляли метилизоцианат (0,16 мл). Через 6 ч реакцию распределяли между дихлорметаном и 1N бисульфатом натрия. Водный слой экстрагировали дважды дихлорметаном и объединенные органические слои высушивали (сульфат натрия) и концентрировали. Остаток очищали путем хроматографии, элюируя смесью 85:15 дихлорметана:этанола, содержащей 0,5% уксусную кислоту, для получения 0,918 г (81 %) 2(R/S)-1-(4(4-хлорфенокси)бензолсульфонил)-4-(N-метилкарбомоил)пиперазин-2-карбоновой кислоты: точка плавления 212,7C. Аналитически рассчитано для С 19 Н 20 СlN3 О 6S: С 50.27; Н 4.44; N 9.26;S 7.06; Обнаружено: С 50.56; Н 4.40; N 9.38; S 6.93. Стадия 4. К раствору О-(т-бутилдиметилсилил)гидроксиламина (0.282 г) в 12 мл смеси 5:1 дихлорметана:ДМФ при 0 С добавляли 0.580 г 1-(4-(4-хлорфенокси)бензолсульфонил)4-(N-метилкарбамоил)-2R/S-пиперазинкарбоновой кислоты, затем - EDC гидрохлорид (0,294 г),и реакционную смесь перемешивали в течение 15 мин при 0 С, а затем ей давали нагреться до комнатной температуры. Через 1,5 ч реакцию распределяли между этилацетатом и водным раствором бикарбоната натрия. Органический слой промывали водой и рассолом, высушивали над сульфатом натрия и концентрировали. Остаток кристаллизовали путем медленного испарения из дихлорметана/т-бутилметилового эфира/изооктана для получения 0.643 г (86%) 2(R/S)-N-(т-бутилдиметилсилилокси)-1-(4-(4 хлорфенокси)бензолсульфонил)-4-(N-метилкарбамоил)пиперазин-2-карбоксамида в виде белого твердого вещества: точка плавления 171,0C. Аналитически рассчитано для С 25 Н 35Cl 52 Стадия 5. К раствору 2(R/S)-N-(т-бутилдиметилсилилокси)-1-(4-(4-хлорфенокси)бензолсульфонил)-4-(N-метилкарбамоил)пиперазин-2 карбоксамида в 20 мл метанола при 25C добавляли 0,5 мл трифторуксусной кислоты. Через 30 мин добавляли 20 мл толуола, и раствор концентрировали. Остаток перекристаллизовывали из дихлорметана/т-бутилметилового эфира/изооктана для получения 781 мг (99 %) 2(R/S)-Nгидрокси-1-(4-(4-хлорфенокси)бензолсульфонил)-4-(N-метилкарбамоил)пиперазин-2-карбоксамида в виде белого твердого вещества: точка плавления 133,2 С. Аналитически рассчитано дляC19H21ClN4O6S: С 48.66; Н 4.51; N 11.95; S 6.84; Обнаружено: С 48.74; Н 4.53; N 11.90; S 6.91. Следующие соединения могут быть приготовлены сходным образом:(а) 2(R/S)-N-Гидрокси-1-(4-феноксибензолсульфонил)-4-ацетилпиперазин-2-карбоксамид. Стадия 1. К перемешиваемому раствору 42,5 г (0.25 моль) фенилового эфира в 200 мл дихлорметана при -20C под аргоном медленно добавляли 23,3 г (0,20 моль) хлорсульфоновой кислоты. После того, как добавление было завершено, реакционной смеси давали медленно нагреться до комнатной температуры. Через 16 ч добавляли 150 мл изооктана, и раствор концентрировали до маслянистого остатка. Повторное растворение в 200 мл смеси 1:3 дихлорметана/изооктана и повторная концентрация при охлаждении до примерно 100 мл давали твердое вещество. Супернатант декантировали, а твердое вещество растирали в порошок с дополнительным количеством изооктана, а затем высушивали в ваккуме для получения 55,2 г сырой 4 феноксибензолсульфоновой кислоты. Сырую кислоту растворяли в 200 мл дихлорметана, и добавляли 34 г (0,25 моль) оксалилхлорида, а затем 2,5 мл ДМФ. Через 2 дня реакционный раствор приливали к 200 мл ледяной воды и экстрагировали 400 мл гексана. Органический слой промывали 100 мл воды и 100 мл рассола,высушивали над сульфатом магния и концентрировали. Перекристаллизация остатка из дихлорметана/изооктана дала 38,5 г хлористого 4-феноксибензолсульфонила в виде белого твердого вещества: точка плавления 41,5C. Стадия 2. К перемешиваемому раствору 2(R/S)-пиперазин-2-карбоновой кислоты (1,30 г, 53 10,0 ммоль) и триэтиламина (3,6 мл) в 25 мл смеси 2:2:1 диоксана/воды/ацетонитрила при-20C по каплям добавляли 1,13 мл (1.22 г, 12.0 ммоль) уксусного ангидрида. Через 2 ч при- 20C добавляли дополнительно 1,5 мл триэтиламина, затем 2,69 г (10 ммоль) хлористого 4 феноксибензолсульфонила. Реакционной смеси давали медленно нагреться до комнатной температуры. Через 18 ч реакционную смесь распределяли между 100 мл 0,5N первичного кислого фосфорнокислого калия и 100 мл этилацетата. Водный слой подкисляли 10 мл 2 М серной кислоты и экстрагировали дополнительными 100 мл этилацетата. Объединенные органические слои высушивали над сульфатом натрия и концентрировали. Остаток растворяли в 100 мл смеси 1:1 толуола/метанола и по каплям добавляли триметилсилилдиазометан (2 М раствор в гексане) до тех пор, пока желтый цвет больше не рассеивался (около 15 мл). После добавления 2 капель уксусной кислоты для использования избытка триметилсилилдиазометана раствор концентрировали, а остаток очищали путем хроматографии на 150 г силикагеля, элюируя 80% этилацетатом/гексаном в градиенте этилацетата. Концентрация продуктсодержащих фракций дала масло, которое отвердевало после титрования т-бутилметиловым эфиром/гексаном с выходом 1,86 г (44%) метил-2(R/S)-1-(4 феноксибензолсульфонил)-4-ацетилпиперазин 2-карбоксилата: точка плавления 118 С. Аналитически рассчитано для С 20 Н 22N2O6S: С 57,41; Н 5,30; N 6,69; S 7,66; Обнаружено: С 57,38; Н 5,29; N 6,75; S 7,72. Стадия 3. К раствору метил-2(R/S)-1-(4 феноксибензолсульфонил)-4-ацетилпиперазин 2-карбоксилата (1.672 г) в 12 мл ТНФ и 6 мл метанола по каплям добавляли 4 мл 2N водного раствора гидроокиси лития. Через 1 ч реакционный раствор распределяли между 100 мл этилацетата и 25 мл 1N водного раствора бисульфата натрия. Органический слой промывали рассолом, высушивали над сульфатом натрия и концентрировали. Остаток растирали в порошок с т-бутилметиловым эфиром и фильтровали для получения 1.544 г (96%) 2(R/S)-1-(4-феноксибензолсульфонил)-4-ацетилпиперазин-2-карбоновой кислоты в виде белого твердого вещества: точка плавления 213 С. Аналитически рассчитано для С 19 Н 20N2O6S: С 56.43; Н 4.98; N 6.93; S 7.93; Обнаружено: С 56.50; Н 4.96; N 6.90; S 8.01. Стадия 4. К раствору 0-(тбутилдиметилсилил)гидроксиламина (0,575 г) в 13 мл дихлорметана при 0 С добавляли 1,212 г 2(R/S)-1-(4-феноксибензолсульфонил)-4-ацетилпиперазин-2-карбоновой кислоты. К этой смеси добавляли 2,0 мл ДМФ, что давало прозрачный раствор. Через приблизительно 3 мин добавлялиEDC гидрохлорид (0.634 г) в один прием, и реакционную смесь перемешивали 15 мин при 0 С, а затем давали ей нагреться до комнатной 54 температуры. Через 2 ч реакционную смесь распределяли между 100 мл смеси 3:1 этилацетата:гексана и 50 мл воды. Органический слой промывали насыщенным водным раствором бикарбоната натрия, 1N водным раствором бисульфата натрия и фосфатным буфером/рассолом с рН 7, высушивали и концентрировали. Растирание остатка с т-бутилметиловым эфиром/гексаном и фильтрация давали 1,351 г(84%) 2(R/S)-N-(т-бутилдиметилсилилокси)-1(4-феноксибензолсульфонил)-4-ацетилпиперазин-2-карбоксамид в виде белого твердого вещества: точка плавления 146 С. Аналитически рассчитано для C24H21N3O6S0,25C5H12O (t-BuOMe)0,25 H2O: С 54.63; Н 5.55; N 9.44; S 7.20; Обнаружено: С 54.62; Н 5.45; N 9.38; S 7.20. Следующие соединения могут быть приготовлены сходным образом из энантиометрически чистого 2(R)-пиперазин-2-карбоксилата:(а) 3(R)-N-Гидрокси-4-(4-(4-хлорфенокси) бензолсульфонил)морфолин-3-карбоксамид. Стадия 1. К смеси гидрохлорида метилового эфира D-серина (11.20 г) и N-метилморфолина (16.5 мл) в 385 мл смеси 10:1 дихлорметана/ДМФ при -10C добавляли, порциями в течение 2-часового периода, 18,18 г 4-(4 хлорфенокси)бензолсульфонилхлорида. Смесь перемешивали дополнительно 2,5 ч при -10 С, а затем распределяли между 1 М водным раствором бисульфата натрия (200 мл) и смеси 4:1 этилацетата/гексана (400 мл). Водный слой экстрагировали дополнительным количеством этилацетата:гексана (200 мл), и объединенные органические слои промывали водой, 1 М водным раствором бисульфата натрия, насыщенным водным раствором бикарбоната натрия и рассолом. После высушивания над сульфатом натрия раствор концентрировали почти до сухости, и остаток кристаллизовали из тбутилметилового эфира:дихлорметана:изооктана, получая два выхода 18.09 г и 3.20 г. Общий 55 выход метилового эфира N-(4-(4-хлорфенокси) бензолсульфонил)-D-серина был 21.29 г: точка плавления 103,9 С. Стадия 2. К насыщенному раствору метилового эфира N-(4-(4-хлорфенокси)бензолсульфонил)-D-серина (8.3 г) и трифенилфосфина(6.79 г) в 150 мл ТГФ добавляли диэтилазодикарбоксилат (4.07 мл) в 2,5 мл ТГФ. Через 18 ч реакционную смесь разделяли между смесью 1:1 этилацетата:гексана и воды, и органический слой промывали рассолом, высушивали над сульфатом натрия и концентрировали. Хроматография остатка (20% этилацетата:гексана) дала 7.05 г (89%) метил-2(R)-1-(4-(4-хлорфенокси) бензолсульфонил)азиридин-2-карбоксилата в виде густого сиропа. Стадия 3. К перемешиваемому раствору метил-2(R)-1-(4-(4-хлорфенокси)бензолсульфонил)азиридин-2-карбоксилата (6.81 г) в 13 мл 2-бромэтанола при 0 С по каплям добавляли 1.85 мл эфирата трехфтористого бора. Реакционную смесь перемешивали 30 мин при 0 С и в течение 6 ч при комнатной температуре, а затем распределяли между 200 мл 0,1N фосфатного буфера с рН 7 и 250 мл смеси 2:1 этилацетата: гексана. Органический слой промывали водой и рассолом, высушивали над сульфатом натрия и концентрировали. Перекристаллизация остатка из т-бутилметилового эфира/изооктана дала 3,69 г слабо загрязненного твердого вещества, которое вновь перекристаллизовывали из тбутилметилового эфира/изооктана для получения 2,35 г тонких белых игл. Объединенные фильтраты концентрировали, и остаток хроматографировали на 150 г силикагеля с 40-50% тбутилметилового эфира в гексане. Продуктсодержащие фракции частично концентрировали до объема примерно 50 мл, и кристаллическое твердое вещество выделяли путем фильтрации с получением дополнительно 1.11 г продукта. Общий выход метилового эфира N-(4-(4 хлорфенокси)бензолсульфонил)-О-(2-бромэтил)-D-серина был 4,36 г (51%): точка плавления 98 С. Стадия 4. К раствору метилового эфира N(4-(4-хлорфенокси)бензолсульфонил)-О-(2 бромэтил)-D-серина (3,94 г) в 40 мл безводного ДМФ при 0 С добавляли 4,0 порошкообразного карбоната калия. После добавления ледяную ванну удаляли и смесь интенсивно перемешивали пока реакционной смеси давали нагреться до комнатной температуры. Через 1 ч смесь распределяли между 200 мл воды и 200 мл смеси 1:1 этилацетата:гексана. Органический слой промывали 200 мл 0,1N фосфатного буфера с рН 7, 50 мл воды и 50 мл рассола, высушивали над сульфатом натрия и концентрировали. Образующийся в результате густой сироп (3,86 г) растворяли в 60 мл смеси 4:1:1 диоксана:метанола:воды при 0 С и добавляли 10 мл 2N водного раствора гидроокиси лития. Смесь перемешивали 30 мин при 0 С, а затем ей давали 56 нагреться до комнатной температуры. Через еще один час реакционную смесь распределяли между 250 мл смеси 2:1 этилацетата:гексана и 100 мл 0,5N водного раствора бисульфата натрия. Водный слой экстрагировали дополнительными 50 мл этилацетата:гексана, а объединенные органические слои промывали рассолом, высушивали над сульфатом натрия и концентрировали. Остаток хроматографировали на 150 г двуокиси кремния с 70% смеси этилацета:гатексана, содержащей 0,5% уксусной кислоты. Продуктсодержащие фракции концентрировали для получения 2,98 г (94%) 3(R)-4-(4-(4-хлорфенокси) бензолсульфонил)морфолин-3-карбоновой кислоты в виде сиропа, который отвердевал при стоянии: точка плавления 161,8 С. Стадия 5. К раствору 3(R)-4-(4-(4-хлорфенокси)бензолсульфонил)морфолин-3-карбоновой кислоты (3,06 г) в 35 мл смеси 6:1 дихлорметана:ДМФ при 0 С добавляли О-(тбутилдиметилсилил)-гидроксиламин (1.47 г), а затем EDC гидрохлорид (1,77 г). Раствор перемешивали в течение 30 мин при 0 С, а затем давали ему остыть до комнатной температуры. Через 2 ч реакционную смесь распределяли между 150 мл смеси 1:1 этилацетата:гексана и 100 мл воды. Органический слой промывали холодным 0,1N раствором бисульфата натрия (25 мл),0,1N водным раствором бикарбоната натрия (25 мл) и рассолом, высушивали над сульфатом натрия и концентрировали до масла, которое отвердевало при стоянии. Растирание в порошок с гексаном и фильтрация дали 3.46 г (85%) 3(R)N-(т-бутилдиметилсилилокси)-4-(4-(4-хлорфенокси)бензолсульфонил)морфолин-3-карбоксамида в виде белого твердого вещества: точка плавления 129,6 С. Стадия 6. К суспензии 3(R)-N-(т-бутилдиметилсилилокси)-4-(4-(4-хлорфенокси)бензолсульфонил)морфолин-3-карбоксамида (3,35 г) в 25 мл метанола при 25 С добавляли 0,3 мл трифторуксусной кислоты. Через 1 ч добавляли 20 мл толуола и раствор концентрировали до объема примерно 10 мл. После добавления дополнительных 10 мл толуола, преципитировало твердое вещество. Через несколько минут добавляли 20 мл гексана, и твердое вещество собирали путем фильтрации и высушивали в вакууме, получая 2.65 г (95%) 3(R)-N-гидрокси 4-(4-(4-хлорфенокси)бензолсульфонил)морфолин-3-карбоксамида 0.33 толуола в виде белого твердого вещества: точка плавления 104 С. Аналитически рассчитано для С 17 Н 17 СlN2 О 6S0,33 С 7 Н 8: С 52.32; Н 4.47; N 6.32; Cl 8.00; S 7.23; Обнаружено: С 52.31; Н 4.47; N 6.26; S 7.38. Следующие соединения могут быть получены сходным образом:-15C добавляли BOC-ON (2.70 г) в один прием. Смеси давали медленно нагреться до 25C в течение ночи, а затем концентрировали до объема примерно 10 мл. Образующуюся в результате смесь распределяли между 25 мл воды и 50 мл смеси 4:1 этилацетата:гексана. Водный слой далее промывали дихлорметаном (3x10 мл), а затем концентрировали. Полутвердый остаток растирали с этанолом и фильтровали для получения 1.18 г 2(R)-4-(t-бутоксикарбонил)пиперазин-2-карбоксилата. Концентрация фильтрата дала второй выход в 0,58 г: общий выход 2(R)4-(t-бутоксикарбонил)пиперазин-2-карбоновой кислоты был 1.76 г (76%). Стадия 2. К перемешиваемой суспензии 2(R)-4-(t-бутоксикарбонил)пиперазин-2-карбоновой кислоты (4,62 г) и N-метилморфолина(5.5 мл) в 90 мл смеси 2:1 дихлорметана:ДМФ добавляли по каплям хлористый триметилсилил(2.79 мл) с охлаждением в водяной бане с температурой 15C. Через 1 ч добавляли диизопропилэтиламин (3.5 мл) и смесь перемешивали в течение еще одного часа, после которого оставалось мало твердого вещества. Добавляли дополнительно хлористый триметилсилил (0,20 мл) и через 30 мин реакционная смесь была гомогенным раствором и хлористый 4-(4 хлорфенокси)бензолсульфонил (6,67 г) добавляли в один прием. Реакционную смесь перемешивали в течение 2 ч, а затем гасили примерно 10 мл воды. Через 30 мин смесь распределяли между 300 мл 2:1 этилацетата:гексана и 100 мл 0,5N водного раствора бисульфата натрия. Органический слой промывали объемами по 100 мл 0,2 N и 0,05 N бисульфата натрия и 50 мл рассола, высушивали (сульфат натрия) и концентрировали. Остаток очищали путем хроматографии на 200 г двуокиси алюминия, элюируя градиентом 30-40-50% смеси этилацетата:гексана, содержащей 0,5% уксусной кислоты,получая 9,33 г 2(R)-4-(t-бутоксикарбонил)-1-(4(4-хлорфенокси)бензолсульфонил)пиперазин-2 карбоновой кислоты в виде прочной пены, содержащей следы растворителя.(995 мг) в 12 мл дихлорметана при 0 С добавляли О-(т-бутилдиметилсилил)гидроксиламин(430 мг), а затем - EDC гидрохлорид (460 мг). Через 20 мин реакционной смеси давали нагреться до 25C. Через 2 ч реакционную смесь распределяли между водой и смесью 1:1 этилацетата:гексана. Органический слой промывали водой и холодным 0.1N водным раствором бисульфата натрия, а в конце - фосфатным буфером/рассолом с рН 7. Органический слой высушивали над сульфатом натрия и концентрировали до твердого вещества. Растворение в дихлорметане, разведение изооктаном и частичное концентрирование дали тяжелый преципитат,который после фильтрации и высушивания дал 1.107 г (88%) 2(R)-N-(т-бутилдиметилсилилокси)-4-(t-бутоксикарбонил)-1-(4-(4-хлорфенокси)бензолсульфонил)пиперазин-2-карбоксамид: точка плавления 181,6C. Аналитически рассчитано для С 28 Н 40 Сl(20 мл) и раствор концентрировали до твердого остатка, который перекристаллизовывали из метанола, получая 48 мг 2(R)-N-гидрокси-1-(4(4-хлорфенокси)бензолсульфонил)-4-(t-бутоксикарбонил)пиперазин-2-карбоксамида в виде тонких белых игл: точка плавления 94,6C. Следующие соединения были получены сходным образом:(d) 2(R/S)-N-гидрокси-1-(4-(пирид-2-ил) оксибензолсульфонил)-4-(t-бутоксикарбонил) пиперазин-2-карбоксамид: точка плавления 133,5C; Аналитически рассчитано для С 21 Н 26N4 О 7S: С 52.71; Н 5.48; N 11.71; S 6.70; Обнаружено: С 52.54; Н 5.48; N 11.61; S 6.75. Пример 10. (а) Хлористый 2(R)-Nгидрокси-1-(4-(4-хлорфенокси)бензолсульфонил)пиперазин-2-карбоксамид. К раствору 2(R)-N-(т-бутилдиметилсилилокси)-4-(t-бутоксикарбонил)-1-(4-(4-хлорфенокси)бензолсульфонил)пиперазин-2-карбоксамида (313 мг) в 7 мл смеси 6:1 дихлорметана:метанола добавляли 2.0 мл 4 М HCl в диоксане. Через 1 ч раствор частично концентрировали до объема примерно 2 мл, разводили 5 мл этил 59 ацетата и повторно концентрировали почти до сухости. Остаток растирали с этилацетатом,фильтровали и высушивали в вакууме, чтобы поучить 198 мг (88%) хлористого 2(R)-Nгидрокси-1-(4-(4-хлорфенокси)бензолсульфонил)пиперазин-2-карбоксамида в виде белого твердого вещества: точка плавления 169C. Аналитически рассчитано дляC17H19Cl2N3O5S: С 45.54; Н 4.27; N 9.37; Cl 15.82; S 7.15; Обнаружено: С 45.59; Н 4.25; N 9.20; Cl 15.66; S 7.02. Следующее соединение было приготовлено сходным образом:(b) хлористый 2(R)-N-гидрокси-1 -(4-(4 фторфенокси)бензолсульфонил)-пиперазин-2 карбоксамид: точка плавления 150,8C. Следующие соединения могут быть приготовлены сходным образом:(а) Хлористый 2(R)-N-гидрокси-1-(4-(4 хлорфенокси)бензолсульфонил)-4-метилпиперазин-2-карбоксамид. К раствору 313 мг 2(R)-N-(т-бутилдиметилсилилокси)-4-(t-бутоксикарбонил)-1-(4-(4 хлорфенокси)бензолсульфонил)пиперазин-2 карбоксамида в 2 мл дихлорметана добавляли 1 мл трифторуксусной кислоты. Через 2 ч добавляли 2 мл метанола и раствор перемешивали в течение 15 мин, а затем разводили 5 мл толуола. Концентрирование дало маслянистый остаток, который распределяли между рассолом/ насыщенным раствором бикарбоната натрия и этилацетатом. Водный слой экстрагировали двумя дополнительными порциями этилацетата,а объединенные органические слои высушивали над сульфатом натрия и концентрировали, чтобы получить 231 мг слабо загрязненного 2(R)-Nгидрокси-1-(4-(4-хлорфенокси)бензолсульфонил)пиперазин-2-карбоксамида. К раствору 186 мг этого твердого вещества и диизопропиламина (0,15 мл) в 3,5 мл смеси 6:1 ацетонитрила:ДМФ добавляли иодометан (0.031 мл). После 1,5 ч при 25C реакционную смесь разводили примерно 5 мл этилацетата и концентрировали. Остаток распределяли между 0,5 М водного раствора бикарбоната натрия и этилацетата. Водную фазу экстрагировали второй порцией этилацетата, а объединенные органические слои промывали рассолом, высушивали над сульфатом натрия и концентрировали. Остаток хроматографировали на 10 г силикагеля, элюируя градиентом 6-8-10% метанола в дихлорметане. Продуктсодержащие фракции концентрировали, 003294 60 а остаток растворяли в 5 мл этилацетата: дихлорметана (4:1). К этому раствору добавляли 0,4 мл 1 М HCl в этаноле, и смесь концентрировали до белого остатка, который растирали с этилацетатом и фильтровали для получения 115 мг хлористого 2(R)-N-гидрокси-1-(4-(4-хлорфенокси)бензолсульфонил)-4-метилпиперазин 2-карбоксамида в виде белого твердого вещества: точка плавления 152C (с разрушением). Аналитически рассчитано дляC18H21Cl2N3O5S: С 46.76; Н 4.58; N 9.09; Cl 15.34; S 6.93; Обнаружено: С 46.65; Н 4.65; N 8.98; Cl 15.18; S 6.84. Следующие соединения были приготовлены сходным образом.(b) 2(R)-N-Гидрокси-1-(4-феноксибензолсульфонил)-4-метилпиперазин-2-карбоксамид: точка плавления 127,7C; Аналитически рассчитано для С 18 Н 21 Сl2N3 О 5S: С 56.71; Н 5.98; N 10.18; Обнаружено: С 56.70; Н 5.99; N 10.05;(с) Хлористый 2(R)-N-гидрокси-1-(4-(4 хлорфенокси)бензолсульфонил)-4-(этоксикарбонилметил)пиперазин-2-карбоксамид: точка плавления 163,7C; Аналитически рассчитано для С 21 Н 25 Сl2(е) 2(R)-N-Гидрокси-1-(4-(4-фторфенокси) бензолсульфонил)-4-метилпиперазин-2-карбоксамид; Аналитически рассчитано для С 18 Н 20FN3O5S: С 52.80; Н 4.92; N 10.26; S 7.83; Обнаружено: С 52.66; Н 4.95; N 10.01; S 7.56. Следующее соединение может быть приготовлено сходным образом.(а) 2(R)-N-Гидрокси-1-(4-(4-хлорфенокси) бензолсульфонил)-4-(метансульфонил)пиперазин-2-карбоксамид. Стадия 1. К суспензии 1,00 г 2(R)-N-(тбутилдиметилсилилокси)-4-(1-бутоксикарбонил)-1-(4-(4-хлорфенокси)бензолсульфонил) пиперазин-2-карбоксамида в 4 мл дихлорметана добавляли 3 мл трифторуксусной кислоты, что давало прозрачный раствор. Через 2 ч при 25C раствор концентрировали почти до сухости и остаток растворяли в 10 мл метанола. Через 10 мин раствор повторно концентрировали, остаточный сироп растворяли в 50 мл метанола и добавляли примерно 15 мл IRA-68 слабо основной смолы. Смесь острожно перемешивали в течение 2 ч, а затем смолу удаляли путем
МПК / Метки
МПК: C07D 413/12, A61K 31/535, C07D 241/04, C07D 265/30, A61P 35/00, C07D 403/12, A61P 35/04, C07D 279/12, A61K 31/54, A61K 31/495, C07D 417/12
Метки: ингибиторы, композиции, содержащие, фармацевтические, применения, металлопротеиназы
Код ссылки
<a href="https://eas.patents.su/30-3294-ingibitory-metalloproteinazy-farmacevticheskie-kompozicii-ih-soderzhashhie-i-ih-farmacevticheskie-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы металлопротеиназы, фармацевтические композиции, их содержащие, и их фармацевтические применения</a>
Предыдущий патент: Полипептиды, кодируемые геном, подобным гену липазы человека, содержащие их композиции и способы использования композиций
Следующий патент: Целлюлаза из грибов рода chrysosporium и способы ее применения
Случайный патент: Мутанты fgf21 и их применение












