Ингибиторы синтазы оксида азота
Номер патента: 3026
Опубликовано: 26.12.2002
Авторы: Янг Роберт Джон, Клинтхаус Сэввас, Бесуик Пол Джон
Формула / Реферат
1. Соединение формулы (I)
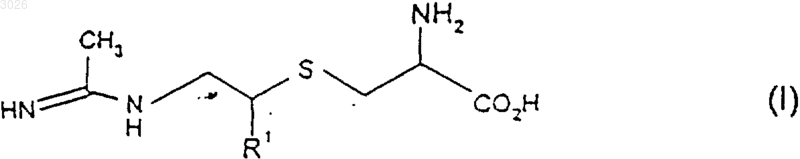
или его соль, сольват или физиологически функциональное производное, где R1 выбран из С1-4алкила, С3-4циклоалкила, С1-4гидроксиалкила и С1-4галогеноалкила.
2. Соединение формулы (I), выбранное из
S-[(R)-2-(1-иминоэтиламино)пропил]-L-цистеина,
S-[(S)-2-(1-иминоэтиламино)пропил]-L-цистеина,
S-[(R/S)-2-(1-иминоэтиламино)пропил]-L-цистеина,
S-[(R)-2-(1-иминоэтиламино)пропил]-D-цистеина,
S-[(S)-2-(1-иминоэтиламино)пропил]-D-цистеина,
S-[(R/S)-2-(1-иминоэтиламино)пропил]-D-цистеина,
S-[(R/S)-2-(1-иминоэтиламино)бутил]-L-цистеина,
S-[(R/S)-2-(1-иминоэтиламино,2-циклопропил)этил]-L-цистеина и
S-[(R/S)-2-(1-иминоэтиламино,3-гидрокси)пропил]-L-цистеина
или их соли, сольвата и физиологически функционального производного.
3. Соединение формулы (I), представляющее собой S-[(R)-2-(1-иминоэтиламино)пропил]-L-цистеин или его соль, сольват или физиологически функциональное производное.
4. Способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, при котором вводят терапевтически эффективное количество соединения формулы (I) по любому из пп.1-3 или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного.
5. Способ по п.4, где клиническое состояние выбрано из артрита, астмы, непроходимости кишечника и мигрени.
6. Применение соединения формулы (I), как оно определено в любом из пп.1-3, или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного в терапевтическом лечении.
7. Фармацевтический препарат, содержащий соединение формулы (I) по любому из пп.1-3 или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один терапевтический ингредиент.
8. Применение соединения формулы (I) по любому из пп.1-3 или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного в производстве лекарства для профилактики или лечения клинического состояния, для которого показан ингибитор синтазы оксида азота.
9. Применение по п.8, где клиническое состояние выбрано из артрита, астмы, непроходимости кишечника и мигрени.
10. Способ получения соединения формулы (I) или его соли, сольвата или физиологически функционального производного, при котором
1) соединение формулы (II)
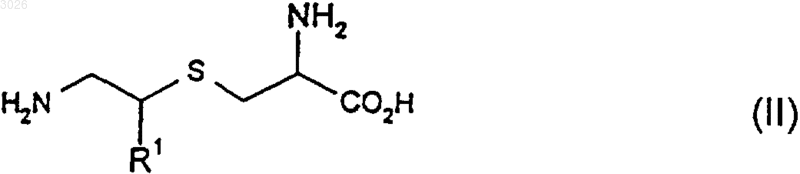
или его оптический изомер, соль или защищенное производное, где R1 является таким, как определено выше, подвергают взаимодействию с соединением формулы (III)

или его солью, где L представляет собой уходящую группу, после чего в любом порядке осуществляют следующие стадии, на которых
2) возможно удаляют любые защитные группы,
3) возможно выделяют оптический изомер из смеси оптических изомеров,
4) возможно превращают продукт в его соответствующие соль, сольват или физиологически функциональное производное.
11. Соединение формулы (II)
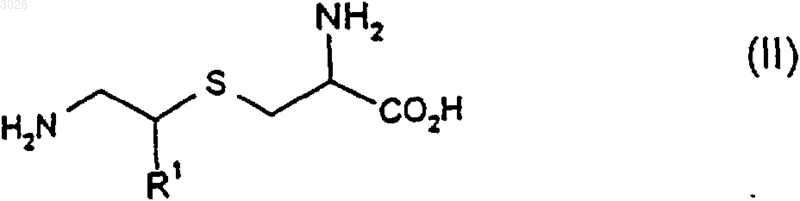
или его оптический изомер, соль или защищенное производное, где R1 является таким, как определено выше.
12. Защищенное производное соединения формулы (I), как оно определено в п.1, выбранное из
(R,R)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата,
(R,S)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата,
(S,S)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата,
(S,R)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата,
(R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-этил-4-тиогексаноата,
(R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-бутоксиметил-4-тиогексаноата и
(R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-циклопропил-4-тиогексаноата
и их солей и сольватов.
Текст
1 Настоящее изобретение относится к новым амидиносоединениям, способу их получения,содержащим их фармацевтическим композициям и их применению в терапии, в частности, их применению в качестве селективных ингибиторов индуцибельной синтазы оксида азота. Оксид азота является эндогенным стимулятором растворимого фермента гуанилатциклазы и вовлечен в ряд биологических механизмов. Избыточное продуцирование оксида азота,как полагают, также вовлечено в ряд состояний,включая септический шок и многие воспалительные заболевания. Биохимический синтез оксида азота из L-аргинина катализируется ферментом синтазой NO. Многие ингибиторы синтазы NO были описаны и предложены для терапевтического применения. Совсем недавно целью исследования в этой области было получение ингибиторов синтазы NO, проявляющих селективность в отношении индуцибельной синтазы NO (iNOS) по сравнению с эндотелиальной синтазой NO(eNOS) и/или нейронной синтазой NO (nNOS). Таким образом, в WO 93/13055 описаны селективные ингибиторы синтазы NO формулы и их соли и фармацевтически приемлемые сложные эфиры и амиды, в которойR1 является С 1-6 алкильной группой с прямой или разветвленной цепью, С 2-6 алкенильной группой, С 2-6 алкинильной группой, С 3-6 циклоалкильной группой или С 3-6 циклоалкилС 1-6 алкильной группой,Q является алкиленовой, алкениленовой или алкиниленовой группой, которая содержит от 3 до 6 углеродных атомов и которая может быть возможно замещена одной или более чем одной С 1-3 алкильной группой,группой формулы -(CH2)pX(CH2)q- , где р равен 2 или 3, q равен 1 или 2, и Х являетсяS(O)x, где х равен 0, 1 или 2, О или NR2, где R2 является Н или С 1-6 алкилом, или группой формулы -(СН 2)rA(СH2)s-, где r равен 0, 1 или 2, s равен 0, 1 или 2, и А является 3-6-членным карбоциклическим или гетероциклическим кольцом, которое может быть возможно замещено одним или более чем одним подходящим заместителем, таким как С 1-6 алкил,С 1-6 алкокси, гидрокси, галогено, нитро, циано,трифторС 1-6 алкил, амино, С 1-6 алкиламино или диС 1-6 алкиламино. Также в совместно рассматриваемой международной заявке WO 98/30537 описаны некоторые амидиносоединения, которые являются селективными ингибиторами индуцибельной синтазы оксида азота. К настоящему времени авторы изобретения обнаружили новый класс соединений, которые являются селективными ингибиторамиiNOS, а также проявляют преимущества, включая то, что они имеют относительно большой период полувыведения, являются перорально биодоступными при введении in vivo и могут быть получены из относительно дешевых исходных материалов. Следовательно, согласно настоящему изобретению предложено соединение фoрмулы (I) или его соль, сольват или физиологически функциональное производное,где R1 выбран из С 1-4 алкила, С 3-4 циклоалкила,С 1-4 гидроксиалкила и С 1-4 галогеноалкила. В формуле (I) R1 предпочтительно является С 1-4 алкилом, наиболее предпочтительно метилом. Соединения формулы (I) имеют два хиральных центра, т.е. углерод, который несет заместитель R1 и асимметрический центр в аминокислотной группе. Предполагается, что формула (I) включает все оптические изомеры или,по существу, в чистой форме, или в смешанной форме в любых соотношениях. В предпочтительном аспекте аминокислотная группа находится в природной L-конфигурации. В другом предпочтительном аспекте углерод, несущий группу R1, находится в R-конфигурации. В наиболее предпочтительном аспекте аминокислота находится в природной L-конфигурации, а углерод, несущий группу R1, находится в Rконфигурации. Во всем описании, где даны стереохимические конфигурации двух хиральных центров в пределах одной молекулы, первая конфигурация относится к -углероду аминокислоты, а вторая относится к углероду, несущему заместитель R1, например, стереохимическая конфигурация, обозначенная как (R,S), означает (R)-стереохимическую конфигурацию в-углероде аминокислоты и (S)-стереохимическую конфигурацию в углероде, несущем заместитель R1. Таким образом, в другом аспекте согласно настоящему изобретению предложено соединение, выбранное изS-[(R/S)-2-(1-иминоэтиламино,3-гидрокси) пропил]-L-цистеина и их солей, сольватов и физиологически функциональных производных. В предпочтительном аспекте согласно настоящему изобретению предложен S-[(R)-2-(1 иминоэтиламино)пропил]-L-цистеин или его соль, сольват или физиологически функциональное производное. В особенно предпочтительном аспекте согласно настоящему изобретению предложен S-[(R)-2-(1-иминоэтиламино) пропил]-L-цистеин или его соль. Понятно, что настоящее изобретение включает все комбинации особенных и предпочтительных групп, описанных здесь. Соли и сольваты соединений формулы (I),которые являются подходящими для применения в медицине, представляют собой те, в которых противоион или ассоциированный растворитель являются фармацевтически приемлемыми. Однако соли и сольваты, имеющие фармацевтически неприемлемые противоионы или ассоциированные растворители, также входят в объем данного изобретения, например, для применения в качестве промежуточных соединений при получении других соединений формулы (I),их фармацевтически приемлемых солей, сольватов и физиологически функциональных производных. Термин "физиологически функциональное производное" означает химическое производное соединения формулы (I), имеющее такую же физиологическую функцию, как и свободное соединение формулы (I), например, способное превратиться в него в организме. Согласно настоящему изобретению примеры физиологически функциональных производных включают в себя сложные эфиры, амиды и карбаматы, предпочтительно сложные эфиры и амиды. Подходящие соли согласно данному изобретению включают в себя образованные как органическими, так и неорганическими кислотами или основаниями. Фармацевтически приемлемые соли присоединения кислот включают в себя образованные из соляной, бромоводородной, серной, лимонной, винной, фосфорной,молочной, пировиноградной, уксусной, трифторуксусной, янтарной, щавелевой, фумаровой,малеиновой, щавелевоуксусной, метансульфоновой, этансульфоновой, паратолуолсульфоновой, бензолсульфоновой и изэтионовой кислот. Фармацевтически приемлемые соли присоединения основания включают в себя соли аммония, соли щелочных металлов, таких как соли натрия и калия, соли щелочно-земельных металлов, таких как соли кальция и магния, и соли с органическими основаниями, такими как дициклогексиламин и N-метил-D глюкамин. Фармацевтически приемлемые сложные эфиры и амиды соединений формулы (I) могут 4 иметь кислотную группу, превращенную в С 1-6 алкил, арил, арилС 1-6 алкил или сложный эфир или амид аминокислоты. Фармацевтически приемлемые амиды и карбаматы соединений формулы (I) могут иметь аминогруппу, превращенную в С 1-6 алкил, арил, арилС 1-6 алкил или амид или карбамат аминокислоты. Как упомянуто выше, соединения формулы (I) являются ингибиторами синтазы NO, как показано в тестах ингибирования синтазы оксида азота (NOS, nitric oxide synthase) ниже. Следовательно, соединения формулы (I) и их фармацевтически приемлемые соли, сольваты и физиологически функциональные производные используются для профилактики и лечения клинических состояний, для которых показан ингибитор синтазы NO, в частности, ингибитор iNOS. Такие состояния включают в себя воспалительные состояния, состояния шока,иммунные нарушения и нарушения желудочнокишечной перистальтики. Соединения формулы(I) и их фармацевтически приемлемые соли,сольваты и физиологически функциональные производные могут также быть использованы для профилактики и лечения заболеваний центральной нервной системы, включая мигрень. Под состояниями шока подразумеваются состояния, вызванные избыточным продуцированием NO, такие как септический шок, геморрагический шок, травматический шок или шок,вызванный внезапной печеночной недостаточностью или терапией цитокинами, такими как ФНО (фактор некроза опухоли), интерлейкин-1 и интерлейкин-2, или терапией цитокининдуцирующими агентами, например, 5,6 диметилксантенонуксусной кислотой. Примеры воспалительных состояний и иммунных нарушений включают в себя нарушения суставов, особенно артрит (например,ревматоидный артрит, остеоартрит, неисправность суставного протеза), или желудочнокишечного тракта (например, неспецифический язвенный колит, болезнь Крона и другие воспалительные заболевания кишечника, гастрит и инфекционные воспаление слизистой желудка,энтеропатия, спровоцированная нестероидными противовоспалительными лекарствами), легких(например, респираторный дистресс синдром у взрослых, астма, муковисцидоз или хроническое обструктивное заболевание легких), сердца (например, миокардит), нервной ткани (например,рассеянный склероз), поджелудочной железы(например, сахарный диабет и его осложнения),почек (например, гломерулонефрит), кожи (например, дерматит, псориаз, экзема, крапивница),глаз (например, глаукома), а также трансплантированных органов (например, отторжение) и заболевания, обусловленные нарушениями нескольких органов (например, системная красная волчанка), и воспалительные осложнения вирусных и бактериальных инфекций. Также очевидно, что ингибиторы iNOS могут быть полез 5 ны в профилактике или лечении бактериальных инфекций (например, пневмонии), в частности,за счет снижения бактериальной нагрузки у зараженного млекопитающего. Более того, существует доказательство избыточного продуцирования NO iNOS при атеросклерозе и последующих гипоксических или ишемических инсультах (с повторной перфузией или без нее), например при ишемическом заболевании головного мозга или сердца. Нарушения желудочно-кишечной перистальтики включают в себя непроходимость кишечника, например, послеоперационную непроходимость кишечника или в результате сепсиса. Под заболеваниями центральной нервной системы подразумеваются те, в которые вовлечено избыточное продуцирование NO, например мигрень, психоз, тревога, шизофрения, нарушения сна, церебральная ишемия, травма ЦНС(центральной нервной системы), эпилепсия,рассеянный склероз, деменция, связанная со СПИДом, хроническое нейродегенеративное заболевание (например, деменция Леви Боди(Lewy Body), болезнь Хантингтона, болезнь Паркинсона или болезнь Альцгеймера) и острая и хроническая боль, и состояния, при которых может быть вовлечен неадренергический нехолинергический синапс, такие как приапизм,ожирение и гиперфагия. Примеры острой боли включают в себя скелетно-мышечную боль, послеоперационную боль и хирургическую боль. Примеры хронической боли включают в себя хроническую воспалительную боль (например, ревматоидный артрит и остеоартрит), невропатическую боль (например, невралгия после опоясывающего лишая, диабетические невропатии, связанные с диабетами, невралгия тройничного нерва, боль,связанная с функциональными нарушениями кишечника, например слизистым колитом, несердечная боль в груди и симпатически поддерживаемая боль) и боль, связанную с раком и фибромиалгией. Более того, ингибирование синтазы NO может способствовать предотвращению потери лимфоцитов, связанной с ВИЧ-инфекцией, повышению радиочувствительности опухолей при радиотерапии и снижению роста опухоли, развития опухоли, развития кровеносных сосудов и метастаза. Соответственно, согласно настоящему изобретению предложен способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, например ингибитор iNOS, при котором вводят терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного. В частности,согласно настоящему изобретению предложен 6 способ профилактики или лечения воспалительного и/или иммунного нарушения, такого как артрит или астма. В предпочтительном аспекте согласно настоящему изобретению предложен способ профилактики или лечения клинического состояния, выбранного из артрита, астмы,непроходимости кишечника и мигрени. В другом аспекте согласно настоящему изобретению предложен способ профилактики или лечения бактериальной инфекции. В качестве альтернативы, также предложено соединение формулы (I) или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное для применения в терапевтическом лечении, в частности для применения в профилактике или лечении клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, например ингибитор iNOS. В частности, предложено соединение формулы (I) или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное для профилактики или лечения воспалительного и/или иммунного нарушения, такого как артрит или астма. В предпочтительном аспекте предложено соединение формулы (I) или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное для профилактики или лечения артрита, астмы, непроходимости кишечника и мигрени. В другом аспекте предложено соединение формулы (I) или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное для профилактики или лечения бактериальной инфекции. Количество соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного, которое необходимо для достижения терапевтического эффекта, будет, несомненно,изменяться в зависимости от конкретного соединения, пути введения, субъекта, подвергающегося лечению, и конкретного нарушения или заболевания, которое лечат. Соединения по данному изобретению могут быть введены перорально или посредством инъекций в дозе от 0,1 до 1500 мг/кг в сутки, предпочтительно от 0,1 до 500 мг/кг в сутки. Для взрослых людей доза обычно находится в пределах от 5 мг до 35 г/сутки и предпочтительно от 5 мг до 2 г/сутки. Таблетки или другие формы выпуска, представленные в отдельных единицах, могут для удобства содержать некоторое количество соединения по данному изобретению, которое является эффективным в данной дозировке, или в составной форме, например единицах, содержащих от 5 до 500 мг, обычно примерно от 10 до 200 мг. Если возможно введение только соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного, предпочти 7 тельно представить его в виде фармацевтического препарата. Соответственно согласно настоящему изобретению далее предложен фармацевтический препарат, содержащий соединение формулы (I) или его фармацевтически приемлемые соль,сольват или физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один терапевтический ингредиент. Согласно настоящему изобретению также предложено применение соединения формулы(I) или его фармацевтически приемлемых соли,сольвата или физиологически функционального производного в производстве лекарства для профилактики или лечения клинического состояния, для которого показан ингибитор синтазы оксида азота, например ингибитор iNOS, например, воспалительного и/или иммунного нарушения, такого как артрит или астма. В предпочтительном аспекте предложено соединение формулы (I) или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное в производстве лекарства для профилактики или лечения клинического состояния, выбранного из артрита, астмы,непроходимости кишечника и мигрени. В другом аспекте предложено соединение формулы(I) или его фармацевтически приемлемые соль,сольват или физиологически функциональное производное в производстве лекарства для профилактики или лечения бактериальной инфекции. В дальнейшем термин "активный ингредиент" означает соединение формулы (I) или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное. Препараты включают в себя те препараты,которые являются подходящими для перорального, парентерального (включая подкожное,внутрикожное, внутримышечное, внутривенное и внутрисуставное), ингаляционного (включая тонкодисперсные порошки или пары, которые могут быть получены при помощи различных типов дозирующих аэрозолей под давлением,распылителей или инсуффляторов), ректального и местного (включая кожное, трансбуккальное,подъязычное и внутриглазное) введения, хотя наиболее подходящий путь введения может зависеть, например, от состояния и нарушения реципиента. Препараты могут представлены для удобства в стандартной лекарственной форме и могут быть получены любыми известными в фармации способами. Все способы включают в себя стадию объединения активного ингредиента с носителем, который составляет один или более чем один дополнительный ингредиент. В основном, препараты получают равномерным и близким объединением активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или обоими, а затем, при 8 необходимости, формованием продукта в желаемый препарат. Препараты по настоящему изобретению,которые являются подходящими для перорального введения, могут быть представлены в виде отдельных единиц, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее определенное количество активного ингредиента, в виде порошка или гранул, в виде раствора или суспензии в водной жидкости или неводной жидкости, или в виде жидкой прямой эмульсии или жидкой обратной эмульсии. Активный ингредиент также может быть представлен в виде болюса, электуария или пасты. Таблетка может быть изготовлена прессованием или формованием, возможно с одним или более чем одним дополнительным ингредиентом. Прессованные таблетки могут быть получены прессованием активного ингредиента в свободнотекущей форме, такой как порошок или гранулы, возможно смешанного со связывающим веществом, смазывающим веществом,инертным разбавителем, смазывающим, поверхностно-активным или диспергирующим агентом, в подходящей машине. Формованные таблетки могут быть получены формованием смеси порошкообразного соединения, увлажненного инертным жидким разбавителем, в подходящей машине. Таблетки возможно могут быть покрыты оболочкой или на них могут быть нанесены риски и могут быть изготовлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента из них. Препараты для парентерального введения включают в себя водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические факторы и растворенные вещества,делающие препарат изотоничным с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загустители. Препараты могут быть представлены в упаковках на один прием или упаковках для многократного приема, например герметизированных ампулах и флаконах, и могут храниться в лиофилизированном состоянии, требующем лишь добавления стерильного жидкого носителя, например физиологического раствора или воды для инъекций, непосредственно перед использованием. Растворы и суспензии, приготовленные для немедленного введения, могут быть приготовлены из стерильных порошков, гранул и таблеток вышеописанных типов. Препараты для ректального введения могут быть представлены в виде суппозиториев с обычными носителями, такими как масло какао или полиэтиленгликоль. Препараты для местного введения через рот, например трансбуккально или подъязычно, 9 включают в себя лепешки, содержащие активный ингредиент в корригентной основе, такой как сахароза и аравийская камедь или трагакант,и пастилки, содержащие активный ингредиент в основе, такой как желатин и глицерин или сахароза и аравийская камедь. Предпочтительными стандартными лекарственными препаратами являются те, которые содержат эффективную дозу активного ингредиента, как указано выше, или ее подходящую часть. Понятно, что кроме упомянутых выше ингредиентов препараты по данному изобретению могут содержать другие агенты, которые являются традиционными и которые имеют отношение к типу рассматриваемого препарата, например препараты, подходящие для перорального введения могут включать в себя корригенты. Согласно другому аспекту изобретения,предложен способ получения соединения формулы (I) или его соли, сольвата или физиологически функционального производного, при котором 1) соединение формулы (II) или его оптический изомер, соль или защищенное производное, где R1 является таким, как определено выше, подвергают взаимодействию с соединением формулы (III) или его солью, где L представляет собой уходящую группу, наиболее подходяще С 1-6 алкоксигруппу, например этокси или алкилтио, аралкилтио или арилтиогруппу, например бензилтио или 1- или 2-нафтилметилтиогруппу, после чего в любом порядке осуществляют следующие стадии, на которых 2) возможно удаляют любые защитные группы,3) возможно выделяют оптический изомер из смеси оптических изомеров,4) возможно превращают продукт в его соответствующие соль, сольват или физиологически функциональное производное. Когда L является С 1-6 алкокси, реакция на стадии (1) выше может быть проведена в растворе при щелочном рН, например рН от 8 до 11, подходяще при рН 10,5, и при низкой температуре, например от -5 до 20 С, подходяще от 0 до 5 С. Когда L является алкилтио, аралкилтио или арилтиогруппой, реакция может быть проведена в органическом растворителе, например тетрагидрофуране или С 1-4 спирте, таком как этанол, при умеренной температуре, например от 10 до 40 С, подходяще при температуре окружающей среды. 10 Соединения формулы (III) и их соли имеются в продаже или могут быть получены способами из органической химии, известными специалисту в данной области, например как описано Shearer et al. в Tetrahedron Letters, 1997,38, 179-182. Соединения формулы (II) и их соли и защищенные производные могут быть получены из соединения формулы (IV) или его защищенного производного путем сочетания с соединением формулы (V) или его защищенным производным, где R1 является таким, как определено выше, и L1 представляет собой уходящую группу, например галогено, такой как бромо, или алкил-, арилили аралкилсульфонатэфир, такой как толуолсульфонил. Защищенные производные соединения формулы (IV), например трет-бутиловый эфирN-трет-бутоксикарбонилцистеина, могут взаимодействовать с соединениями формулы (V) при условиях в подходящем органическом растворителе (например, толуоле) в реакции, опосредованной основанием, таким как 1,8 диазабицикло[5.4.0]ундец-7-ен или похожий агент, которое может быть идентифицировано специалистом в данной области. В качестве альтернативы соединения формулы (II) и их соли и защищенные производные могут быть получены восстановлением (например, с использованием комплекса гидридов металлов) соединения формулы (VI) или его защищенного производного, где R1 является таким, как определено выше. Соединения формулы (VI) могут быть получены способами, аналогичными описаннымYanagisawa et al. в J. Med. Chem 30 (11), 198491, (1987) и Hassner and Dehaen в J. Org. Chem.,55, 5505-5510, (1990). Таким образом, взаимодействие соединения формулы (IV) или его защищенного производного (например, где аминогруппа защищена ацильной группой, такой как трет-бутоксикарбонил, и карбоксильная группа защищена эфирной группой, такой как тpeт-бутиловый эфир) с нитрометаном и подходящим альдегидом R1CHO, где R1 является таким, как определено выше, в присутствии пиперидина приводит к образованию нитросоединения формулы (VI) или его защищенного производного. Соединения формулы (II) или их защищенное производное могут быть также получе 11 ны путем взаимодействия соединения формулы(VII) или его защищенного производного, где R1 является таким, как определено выше, с азиридином формулы (VIII) или его защищенным производным, например где амин защищен ацильной группой, такой как трет-бутоксикарбонил, и кислота защищена эфирной группой, такой как С 1-4 алкиловый эфир. Взаимодействие соединений формул (VII) и (VIII) может быть проведено в инертном растворителе, таком как хлороформ, в присутствии кислоты Льюиса, такой как ВF3(ОЕt)2. Соединения формул (IV), (V), (VII) и (VIII) и их защищенные производные имеются в продаже или могут быть получены способами из органической химии, известными специалисту в данной области. Защитные группы, используемые при получении соединений формулы (I), могут быть использованы удобным способом, например, с использованием способов, описанных в "Protective Groups in Organic Synthesis" by Theodora WGreen, 2nd edition (John Wiley and Sons, 1991), где также описаны способы удаления таких групп. В вышеупомянутых реакциях первичные амины подходящим образом защищают, используя ацильные группы, такие как третбутоксикарбонильную или бензилоксикарбонильную группы, которые могут быть удалены в кислых условиях, например обработкой соляной кислотой или бромоводородной кислотой или гидрогенолизом. Специалисту в данной области понятно,что использование таких защитных групп может включать в себя ортогональную защиту аминогрупп в соединениях формулы (II) для облегчения селективного удаления одной группы в присутствии другой, таким образом давая возможность селективной функционализации одной аминофункции. Например, бензилоксикарбонильная группа может быть селективно удалена гидрогенолизом. Специалист в данной области также поймет другие методы ортогональной защиты, доступные посредством традиционных способов, описанных у Theodora W Green (см. выше). Энантиомерные соединения по данному изобретению могут быть получены (а) разделением компонентов соответствующей рацемической смеси, например при помощи хиральной колоночной хроматографии, методами энзиматического расщепления или получением и разделением подходящих диастереоизомеров, или(б) синтезом непосредственно из подходящих 12 хиральных промежуточных соединений способами, описанными выше. Возможное превращение соединения формулы (I) в соответствующую соль может для удобства осуществляться путем взаимодействия с подходящей кислотой или основанием. Возможное превращение соединения формулы (I) в сответствующий сольват или физиологически функциональное производное может осуществляться методами, известными специалисту в данной области. Согласно другому аспекту настоящего изобретения предложены новые промежуточные соединения для получения соединений формулы(I), например соединения формулы (II), как определено выше, или их оптический изомер, соль или защищенное производное, в частности соединение, выбранное из(R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-6N-бензилоксикарбонил-2,6-диамино-5 бутоксиметил-4-тиогексаноата. В особом аспекте настоящего изобретения соединение формулы (II) выбрано из (R,R)-третбутил-2N-трет-бутоксикарбонил-2,6-диамино-5 метил-4-тиогексаноата и (R,R)-трет-бутил-2Nтрет-бутоксикарбонил-6N-бензилоксикарбонил 2,6-диамино-5-метил-4-тиогексаноата. Некоторые защищенные производные соединений формулы (VI) также являются полезными в качестве промежуточных соединений для получения соединений формулы (II), в част 13 ности, (R,R/S)-тpeт-бутил-2N-трет-бутоксикарбонил-2-амино-5-циклопропил-6-нитро-4-тиогексаноат. Некоторые защищенные производные соединений формулы (I) также являются полезными в качестве промежуточных соединений для получения соединений формулы (I), в частности соединение, выбранное из(R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-циклопропил-4-тиогексаноата и их солей и сольватов. В особом аспекте настоящего изобретения,защищенным производным формулы (I) является (R,R)-трет-бутил-2N-трет-бутоксикарбонил 6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноат или его соль или сольват. Для лучшего понимания настоящего изобретения следующие примеры даны в качестве иллюстрации. Примеры синтеза Пример 1. Синтез дигидрохлорида (R,R)6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата или дигидрохлорида S-[(R)-2-(1 иминоэтиламино)пропил]-L-цистеина.[5.4.0]ундец-7-ен (3,90 мл, 26,2 ммоль) и смесь энергично перемешивали в течение ночи при температуре 60 С в атмосфере азота. Смесь распределяли между этилацетатом и 1 н. воднойHCl, количество каждого из которых составляло 250 мл. Дополнительный органический экстракт объединяли и эти экстракты промывали водным бикарбонатом натрия, водой и рассолом, затем сушили и выпарили. После очистки колоночной хроматографией получали указанное в заголов 003026 14 ке соединение в виде бесцветного масла, которое кристаллизовалось при длительном стоянии с получением белого твердого вещества. ЖХ (жидкостная хроматография)/массспектрометрия с электрораспылительной ионизацией, RT (время удерживания) 4,93 мин, М+Н 469 (100%), M+NH4+ 486 (70%) 1H ЯМР (СDСl3) н, 1.27 (3 Н, d, Me), 1.44 и 1.47 (еа 9 Н, s, CMe3), 2.92 (3 Н, m, 3-Н, 5-Н), 3.23 и 3.38 (еа 1 Н, m, 6-Н), 4.39 (1 Н, шир.m, 2-Н),5.11 (2 Н, s, CH2Ph) 5.31 и 5.42 (еа 1 Н, шир., NH),7.34 (5 Н, т, Аr-Н). Спектр кругового дихроизма (MeCN) 210(+0,42) и 233(-0,11) нм(б) (R,R)-трет-бутил-2N-трет-бутоксикарбонил-2,6-диамино-5-метил-4-тиогексаноат. К раствору (R,R)-трет-бутил-2N-третбутоксикарбонил-6N-бензилоксикарбонил-2,6 диамино-5-метил-4-тиогексаноата (5 г) в 120 мл этанола, дегазированного и под слоем азота,добавили 2,5 мг гидроксида палладия на угле(20%, тип Degussa E101 NE/W, 1:1 с водой), а затем формиат аммония (10 г). Затем раствор нагревали в колбе с обратным холодильником в течение 1 ч, после чего охладили и фильтровали через гифло (hyflo), хорошо промыли водным этанолом. Фильтрат выпарили и остаток пропустили через небольшую колонку с диоксидом кремния, элюировали смесью 90:10:0,5 хлороформ:метанол:880 аммиак с выходом масла при выпаривании, которое непосредственно использовали на следующей стадии. ЖХ/масс-спектрометрия с электрораспылительной ионизацией, RT 2,40 мин, М+Н 335(в) Гидрохлорид (R,R)-трет-бутил-2N-третбутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата. Одну часть гидрохлорида S-(1-нафтилметил)тиоацетимидата (3,10 г, 12,3 ммоль) добавили к раствору 2,75 г (R,R)-тpeт-бутил-2Nтpeт-бутоксикарбонил-6N-2,6-диамино-5-метил 4-тиогексаноата в 50 мл этанола в атмосфере азота и раствор перемешивали в течение 14 ч при комнатной температуре. Растворитель выпарили и остаток распределили в диэтиловом эфире и воде, количество каждого из которых составило 50 мл, затем дважды промыли диэтиловым эфиром, обратные водные экстракты объединили и упарили с образованием сырой белой аморфной пасты, которую непосредственно использовали на следующей стадии. Масс-спектр с термораспылительной ионизацией М+Н 376 (100%), 276 (12%). 1(R,R)-трет-бутил-2N-тpeтбyтоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-метил-4-гексаноата растворили путем добавления 20 мл 4 н. хлористого водорода в диоксане и быстро образовавшуюся суспензию энергично перемешивали в течение ночи в атмосфере азота. Добавили 50 мл диэтилового эфира и декантировали жидкость с образованием липкой смолы. Растиранием в порошок с диэтиловым эфиром наконец получили указанное в заголовке соединение в виде аморфного гигроскопичного белого твердого вещества. Масс-спектр с электрораспылительной ионизацией М+Н 220 (100%),1(3 Н, s, СН 3) 3.23 (3 Н, m, 3-Н, 5-Н), 3.47 (2 Н, m,6-Н), 4.24 (1 Н, t, 2-H) (заметьте, что имеет место некоторое удвоение сигналов из-за ротамерных форм). 13 С ЯМР (DMSO-d6) c, 18.90 (q, Me), 19.30(q, Me), 30.13 (t, 3-С), 38.83 (d, 5-С), 47.43 (t, 6C) 52.20 (d, 2-С), 165.0 (s, N=C-N), 170.0 (s,СО 2 Н). Спектр кругового дихроизма (Н 2 О) 199 (+1,38) и 223 (-0,77) нм. Пример 2. Синтез дигидрохлорида (R,S)6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата или дигидрохлорида S-[(S)-2-(1 иминоэтиламино)пропил]-L-цистеина. Процедуры и способы были идентичны использованным в примере 1, за исключением того, что на стадии алкилирования защищенный(ЗН, s, СН 3) 3.30 (3 Н, m, 3-Н, 5-Н), 3.45 (2 Н, m,6-Н), 4.25 (1 Н, t, 2-H) (обратите внимание, что имеет место некоторое удвоение сигналов из-за ротамерных форм). Пример 3. Синтез дигидрохлорида (S,S)6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата или дигидрохлорида S-[(S)-2-(1 иминоэтиламино)пропил]-D-цистеина. Процедуры и способы были идентичны использованным в примере 1, за исключением того, что на стадии алкилирования энантиомерный защищенный D-цистеин подвергали взаимодействию с тозилатом (R)-N-бензилоксикарбонил 1-аминопропан-2-ола. Спектры продукта идентичны спектрам соединения в примере 1, за исключением Спектра кругового дихроизма (Н 2 О) 199 (-1,05) и 224 (+0,66) нм. Пример 4. Синтез дигидрохлорида (S,R)6N-(1-иминоэтил)-2,6-диамино-5-метил-4-тиогексаноата или дигидрохлорида S-[(R)-2-(1 иминоэтиламино)пропил]-D-цистеина. 16 Процедуры и способы были идентичны использованным в примере 1, за исключением того, что на стадии алкилирования энантиомерный защищенный D-цистеин подвергали взаимодействию с тозилатом (S)-N-бензилоксикарбонил 1-аминопропан-2-ола. Масс-спектр с электрораспылительной ионизацией М+Н 220 (100%),1(3 Н, s, СН 3) 3.30 (3 Н, m, 3-Н, 5-Н), 3.45 (2 Н, m,6-Н), 4.25 (1 Н, t, 2-H). Пример 5. Синтез дигидрохлорида (R,R/S)6N-(1-иминоэтил)-2,6-диамино-5-этил-4-тиогексаноата или дигидрохлорида S-[(R/S)-2-(1 иминоэтиламино)бутил]-L-цистеина. Процедуры и способы были идентичны использованным в примере 1, за исключением того, что на стадии алкилирования защищенныйL-цистеин подвергали взаимодействию с тозилатом (R/S)-N-бензилоксикарбонил 1-аминобутан-2-ола вместо производного 1-аминопропан 2-ола того примера, для получения продукта,который, по существу, являлся эпимерной смесью указанного в заголовке соединения. Масс-спектр с электрораспылительной ионизацией М+Н 234 (100%). Пример 6. Синтез дигидрохлорида (R,R/S)6N-(1-иминоэтил)-2,6-диамино-5-гидроксиметил-4-тиогексаноата или дигидрохлорида S[(R/S)-2-(1-иминоэтиламино,3-гидрокси)пропил]-L-цистеина. Процедуры и способы были идентичны использованным в примере 1, за исключением того, что на стадии алкилирования защищенный(R/S)-N-бензилоксикарбонил-3-третбутокси-1-аминопропан-2-ола вместо производного 1-аминопропан-2-ола того примера. Это обеспечило получение продукта, который, по существу, являлся эпимерной смесью указанного в заголовке соединения, с сопутствующей потерей трет-бутилового эфира на стадии удаления защиты. Масс-спектр с электрораспылительной ионизацией М+Н 236 (100%). Пример 7. Синтез дигидрохлорида S[(R/S)-2-(1-иминоэтиламино,2-циклопропил) этил]-L-цистеина или дигидрохлорида S-[(R/S)2-(1-иминоэтиламино,2-циклопропил)этил]-Lцистеина. а) (R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-2-амино-5-циклопропил-6-нитро-4-тиогексаноат. Защищенный L-цистеин подвергали взаимодействию с нитрометаном, пиперидином и циклопропанкарбоксальдегидом в условиях,описанных Hassner and Dehaen в J. Org. Chem.,55, 5505-5510, (1990), что позволило получить указанное в заголовке соединение в виде бесцветного масла.(R,R/S)-трет-бутил-2N-трет-бутоксикарбонил-2,6-диамино-5-циклопропил-4-тиогексаноат. Нитрогруппы промежуточного соединения со стадии а) восстанавливали, используя смесь хлорид никеля/борогидрид натрия в метаноле согласно способу, описанному Nagarajan andGanem, J. Org. Chem., 51, 4856-4861, (1990). После твердофазной экстракции на силикагеле выделили масло, которое непосредственно использовали на следующей стадии. в) Синтез (R,R/S)-трет-бутил-2N-третбутоксикарбонил-6N-(1-иминоэтил)-2,6-диамино-5-циклопропил-4-тиогексаноата. Продукт вышеуказанной стадии восстановления б) (47 мг, 0,13 ммоль) подвергали взаимодействию с гидрохлоридомS-(1 нафтилметил)тиоацетимидата (72 мг), как описано на стадии в) примера 1, с выходом сырой белой пены. 1(1 Н, m, 5-Н), 2.70 (2 Н, m, 3-Н), 3.25, (2 Н, m, 6 Н) 3.89 (1 Н, m, 2-Н). Масс-спектр с электрораспылительной ионизацией М+Н 402 (50%). г) Синтез дигидрохлорида S-[(R,S)-2-(1 иминоэтиламино,2-циклопропил)этил]-L-цистеина или дигидрохлорида S-[(R/S)-2-(1 иминоэтиламино,2-циклопропил)этил]-L-цистеина. Удаление защиты с (R,R/S)-трет-бутил-2Nтрет-бyтоксикарбонил-6N-(1-иминоэтил)-2,6 диамино-5-циклопропил-4-тиогексаноата проводили с использованием 4 н. HCl в диоксане. Продукт, смесь эпимеров по С-5, выделили в виде гигроскопичного стекловидного твердого вещества после твердофазной экстракции на С 18 с элюированием водой. 1H ЯМР (D2O) н, 0.29 и 0.58 (еа 2 Н, m,циклопропил-Н), 0.82 (1 Н, m, циклопропил-Н),2.14 (3 Н, s, Me), 2.34 (1 Н, m, 5-Н), 3.12 (2 Н, m,3-Н), 3.48,(2 Н, m, 6-Н), 3.98 (1 Н, m, 2-Н). Масс-спектр с электрораспылительной ионизацией М+Н 246 (100%). Биологическая активность 1. Ингибирование выделенной человеческой iNOS. Ингибирование очищенной человеческойiNOS можно определить, используя метод получения человеческой iNOS, как описано в главе"Expression if Human Nitric Oxide Synthase Isozymes" by Charles et al. в Methods in Enzymology,1996 Volume 268, 449-460. Активность можно контролировать, используя изменения количе 003026IС 50 (мкМ) Пример 1 2,0 Пример 2 39,0 Пример 3 6,6 Пример 4 48,0 Пример 7 6,2 2. Ингибирование eNOS и iNOS в аортальных кольцах крыс. Ингибирование eNOS и iNOS in situ в аортальных кольцах крыс оценивали путем измерения повышения кольцевого напряжения, вызванного ингибированием синтазы NO. Для исследований базального тонуса (отражающегоeNOS), кольца грудной аорты вместе с интактным эндотелием приготовили, как описано ранее (Rees et al. (1989) Br. J. Pharmol. 96, 418-424) и получили кривые кумулятивной концентрации для ингибиторов при пороговой концентрации фенилэфрина (phenylephrine) (ЕD1010 нМ). Для исследований индуцированного тонуса гладких мышц (отражающего iNOS) кольца, лишенные эндотелия, подвергали воздействию LPS (липополисахаридов) (0,1 мкг/мл из S.typhosa) в присутствии фенилэфрина приблизительно в ED90 в течение 6 ч, как описано ранее (Rees et al. (1990)Biochem. Biophys. Res. Commun. 173, 541-547). В течение этого времени произошло постепенное снижение тонуса из-за индуцированияiNOS. Затем были получены кривые кумулятивной концентрации для ингибиторов. Результаты представлены в следующей таблице. 3. Ингибирование nNOS в кортикальных срезах. Эффекты соединений на nNOS в срезах головного мозга крыс были определены, как описано у Furfine et al (1994) J. Biol. Chem. 269,26677-26683 и Lizasoain et al. (1995) J. Neurochem. 64, 636-642.KCl-стимулированный (54 мМ) синтез NO измеряли путем определения конверсии 14Cаргинина в 14C-цитруллин в течение 2 ч при температуре 37 С в нарезанных по Mcllwain (0,2 мм 0,2 мм) срезах коры головного мозга крыс с последующим периодом предварительной инкубации в отсутствии соединения или высокой концентрации KCl. Определили, что соединение из примера 1 имеет IC50 более 80 мкМ, предполагающую 19 приблизительно более 300-кратную селективность iNOS против nNOS. 4. Способ определения пероральной биодоступности соединений ингибиторов iNOS. Работа с животными. Крысам (3 животным одновременно) ввели внутривенно определенными дозами (10 мг/кг) и перорально (50 мг/кг) исследуемое соединение в водном растворе. Через определенные интервалы времени после введения взяли образцы крови и путем центрифугирования получили плазму. Образцы хранили при температуре-20 С до проведения анализа. Анализ соединений в плазме. Плазму (50 мкл) депротеинизировали и соединение дериватизировали четвертичноаммониевым реагентом. Затем образцы ввели в систему ВЭЖХ и концентрацию соединения определили с использованием массспектрометрии. Фармакокинетический анализ. Значения концентраций плазмы, полученные вышеописанным способом, ввели в фармакокинетический комплект программного обеспечения (PKCAL v 1.2s) и данные обработали с использованием не разделенного на части метода. Пероральную биодоступность соединений определяли путем сравнения значений площади под кривой (ППК), рассчитанных с помощью программного обеспечения, для пероральных показателей со значениями ППК для внутривенных показателей. Периоды полувыведения были получены обработкой данных времени терминальной фазы внутривенных показателей. Как обнаружили, соединение из примера 1 имеет пероральную биодоступность более 90% и период полувыведения 2-4 ч. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его соль, сольват или физиологически функциональное производное, где R1 выбран из С 1-4 алкила, С 3-4 циклоалкила, С 1-4 гидроксиалкила и С 1-4 галогеноалкила. 2. Соединение формулы (I), выбранное изS-[(R/S)-2-(1-иминоэтиламино,3-гидрокси) пропил]-L-цистеина или их соли, сольвата и физиологически функционального производного. 3. Соединение формулы (I), представляющее собой S-[(R)-2-(1-иминоэтиламино)пропил]-L-цистеин или его соль, сольват или физиологически функциональное производное. 4. Способ профилактики или лечения клинического состояния у млекопитающего, такого как человек, для которого показан ингибитор синтазы оксида азота, при котором вводят терапевтически эффективное количество соединения формулы (I) по любому из пп.1-3 или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного. 5. Способ по п.4, где клиническое состояние выбрано из артрита, астмы, непроходимости кишечника и мигрени. 6. Применение соединения формулы (I),как оно определено в любом из пп.1-3, или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного в терапевтическом лечении. 7. Фармацевтический препарат, содержащий соединение формулы (I) по любому из пп.1-3 или его фармацевтически приемлемые соль, сольват или физиологически функциональное производное и фармацевтически приемлемый носитель или эксципиент и возможно один или более чем один терапевтический ингредиент. 8. Применение соединения формулы (I) по любому из пп.1-3 или его фармацевтически приемлемых соли, сольвата или физиологически функционального производного в производстве лекарства для профилактики или лечения клинического состояния, для которого показан ингибитор синтазы оксида азота. 9. Применение по п.8, где клиническое состояние выбрано из артрита, астмы, непроходимости кишечника и мигрени. 10. Способ получения соединения формулы (I) или его соли, сольвата или физиологически функционального производного, при котором 1) соединение формулы (II) или его оптический изомер, соль или защищенное производное, где R1 является таким, как определено выше, подвергают взаимодействию с соединением формулы (III) или его солью, где L представляет собой уходящую группу, после чего в любом порядке осуществляют следующие стадии, на которых 2) возможно удаляют любые защитные группы,3) возможно выделяют оптический изомер из смеси оптических изомеров,4) возможно превращают продукт в его соответствующие соль, сольват или физиологически функциональное производное. 11. Соединение формулы (II) или его оптический изомер, соль или защищенное производное, где R1 является таким, как определено выше. 12. Защищенное производное соединения формулы (I), как оно определено в п.1, выбранное из
МПК / Метки
МПК: A61P 1/04, C07C 323/58, A61K 31/198
Метки: оксида, азота, синтазы, ингибиторы
Код ссылки
<a href="https://eas.patents.su/12-3026-ingibitory-sintazy-oksida-azota.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы синтазы оксида азота</a>
Предыдущий патент: Лечение диабета тиазолидиндионом и сульфонилмочевиной
Следующий патент: Система для кредитных карточек и способ
Случайный патент: Гербицидные смеси на основе 3-фенилурацилов












