Замещенные 4-аминотиазолы в качестве ингибиторов циклинзависимых киназ
Номер патента: 3527
Опубликовано: 26.06.2003
Авторы: Ли Лин, Чонг Уэсли К.М., Янг Йи, Ксиао Вей, Чу Шао Сонг, Дувади Рохит К.
Формула / Реферат
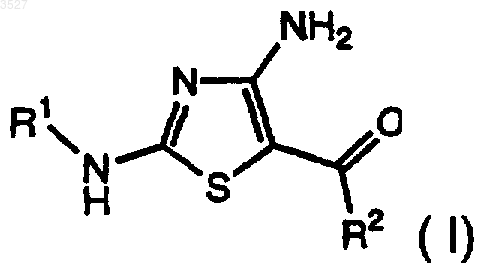
1. Соединение формулы I
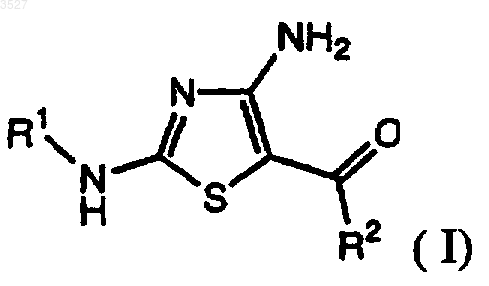
где R1 - замещенная или незамещенная группа, выбранная из C1-6-алкила; фенила; 5-9-членного гетероцикла, содержащего в качестве гетероатомов N, O, S; циклоалкила; (C1-6-алкил)карбонила; (C1-6-алкил)арила; и, в случае если R1 замещен, каждый заместитель независимо представляет собой галоген; галогеналкил; C1-6-алкил; C1-6-алкоксил; амино; нитро; простой тиоэфир; циано; амидо; карбоксил; сульфонамидную группу; кето-группу; сложноэфирную группу; кислород; фенил; 5-9-членный гетероцикл, содержащий в качестве гетероатомов N, O, S; фенил, замещенный 5-7-членным гетероциклом, содержащим в качестве гетероатома N, O, или (C1-6-алкил)амином, которые необязательно имеют заместители такие, как указано для R1; и
R2 - фенильное или 5-9-членное гетероциклическое кольцо, содержащее в качестве гетероатомов S или N, имеющее заместитель в смежном положении по отношению к точке присоединения, чье кольцо необязательно дополнительно замещено; где каждый заместитель R2 независимо представляет собой галоген, галогеналкил, C1-6-алкил; гидроксил; C1-6-алкоксил; амино; нитро; циано; C1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, арил;
или фармацевтически приемлемая соль соединения формулы 1, или пролекарство соединения формулы 1, или его фармацевтически приемлемая соль.
2. Соединение по п.1, где, в случае если R1 замещен и каждый заместитель независимо представляет собой галоген, галогеналкил, C1-6-алкил, кислород, C1-6-алкоксил, амино, нитро, простой тиоэфир, циано, амидо, карбоксил, сульфонамид, кето-группу или сложноэфирную группу, и каждый заместитель R2 независимо представляет собой галоген, галогеналкил, C1-6-алкил, гидроксил, C1-6-алкоксил, амино, нитро, циано, C1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, или его фармацевтически приемлемая соль, или пролекарство.
3. Соединение по п.1, где R1 представляет собой замещенную фенильную группу, или его фармацевтически приемлемая соль, или пролекарство.
4. Соединение по п.1, где R1 представляет собой фенил, замещенный алкиламином или пиридиновой группой, или его фармацевтически приемлемая соль, или пролекарство.
5. Соединение по п.1, где R1 выбран из группы, состоящей из
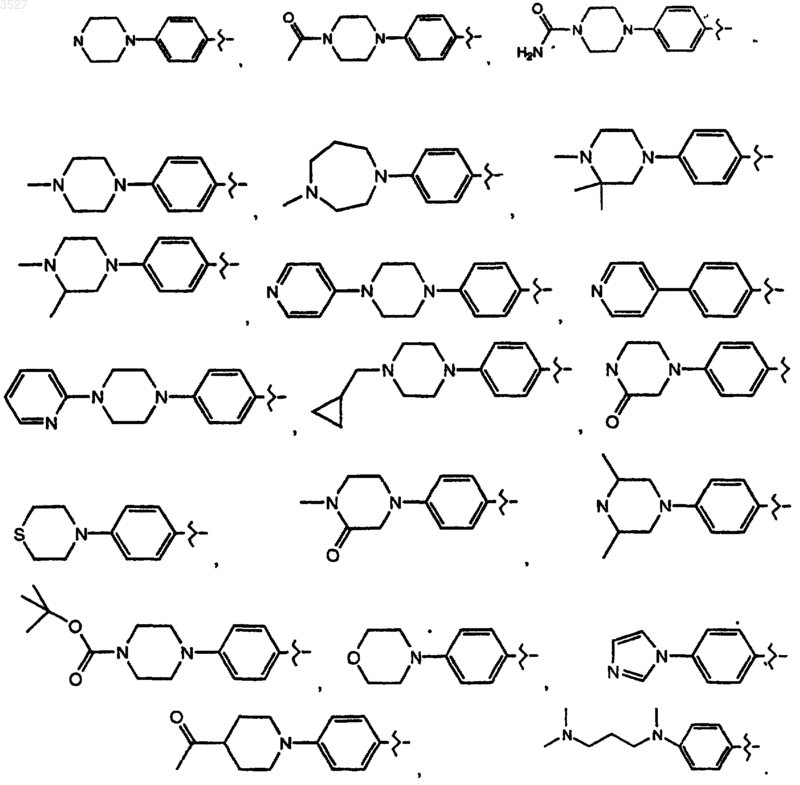
или его фармацевтически приемлемая соль, или пролекарство.
6. Соединение по п.1, где R1 представляет собой фенил, замещенный необязательно замещенной сульфонамидной группой, или его фармацевтически приемлемая соль, или пролекарство.
7. Соединение по п.1, где R1 выбран из группы, состоящей из
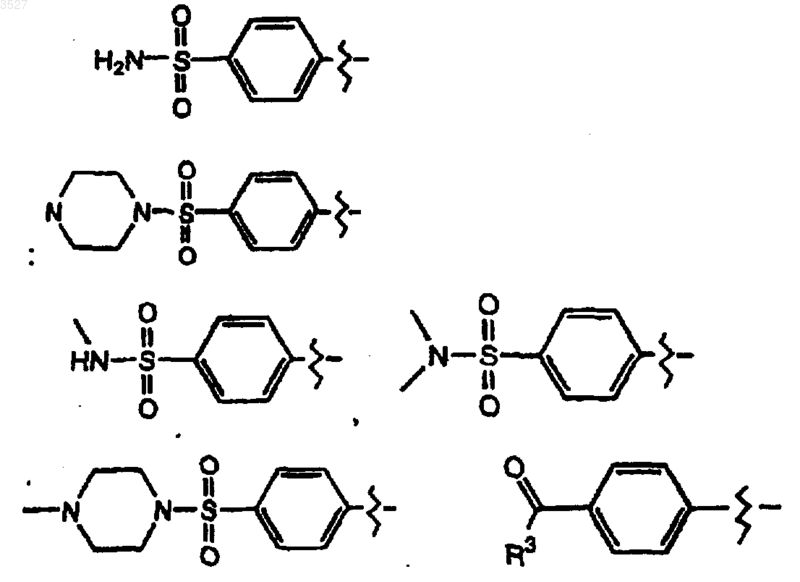
где R3 выбран из группы, состоящей из C1-6-алкила C1-6-алкокси, арила, арилокси и амина, или его фармацевтически приемлемая соль, или пролекарство.
8. Соединение по п.1, где R2 представляет собой ортозамещенный фенил или тиенил, или его фармацевтически приемлемая соль, или пролекарство.
9. Соединение по п.8, где R2 представляет собой о-галогенфенил или орто-дигалогенфенил, или его фармацевтически приемлемая соль, или пролекарство.
10. Соединение по п.9, где R2 представляет собой о-дифторфенил, или его фармацевтически приемлемая соль, или пролекарство.
11. Соединение по п.1, выбранное из группы, состоящей из
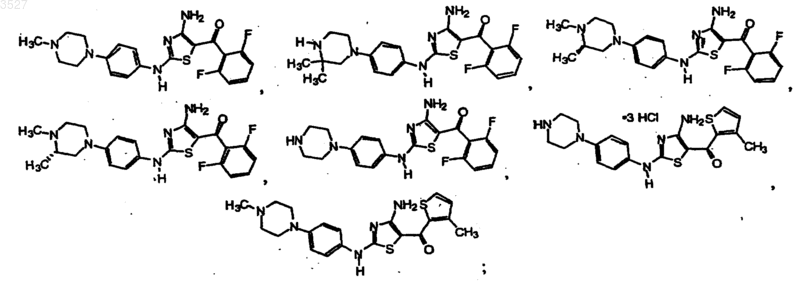
или его фармацевтически приемлемая соль, или пролекарство.
12. Соединение по п.1, выбранное из группы, состоящей из
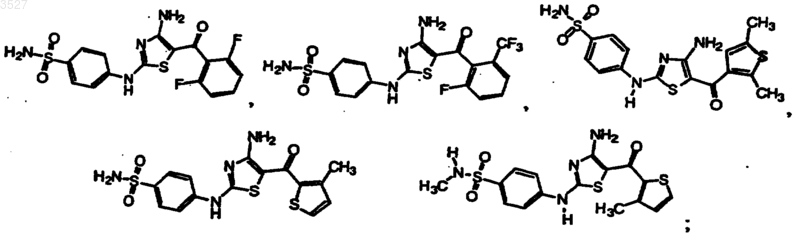
или его фармацевтически приемлемая соль, или пролекарство.
13. Соединение, выбранное из группы, состоящей из
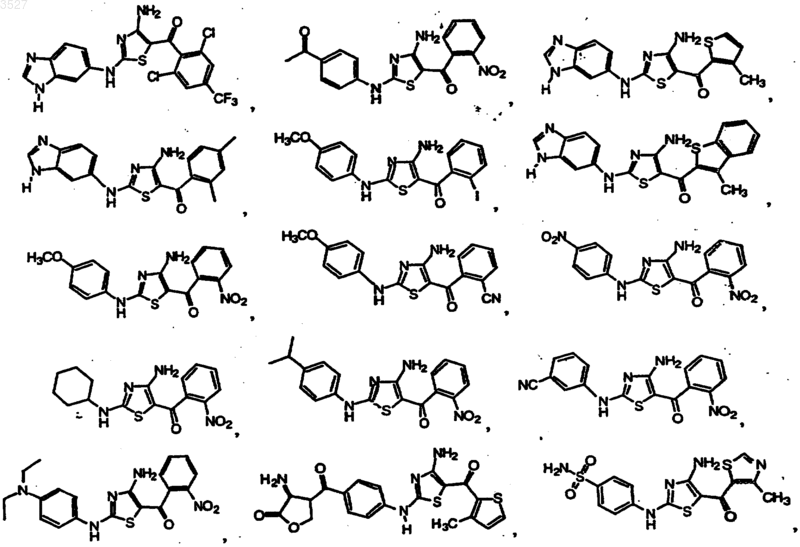
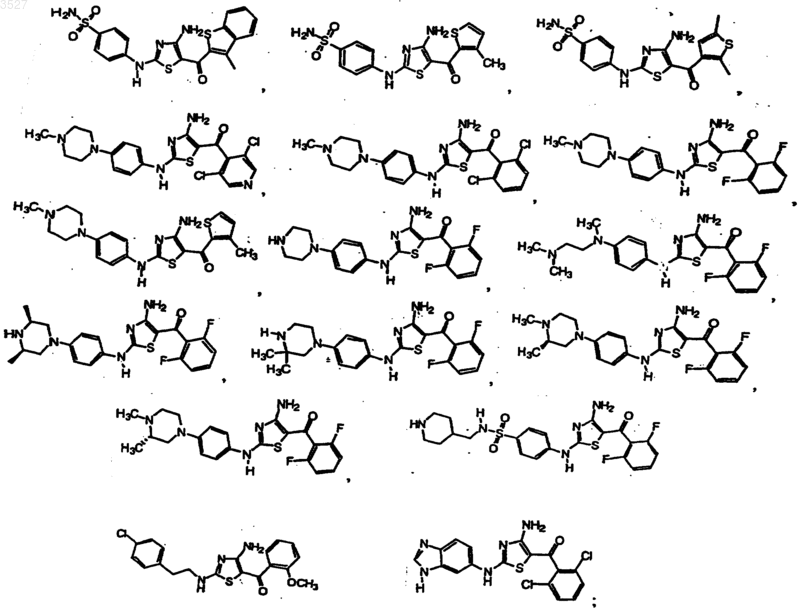
или фармацевтически приемлемая соль, или пролекарство указанного соединения.
14. Фармацевтическая композиция, состоящая из
a) агента, контролирующего клеточный цикл, взятого в количестве, эффективном для ингибирования CDK4 или CDK4/циклин комплекса, выбранного из группы, включающей:
(i) соединение формулы I
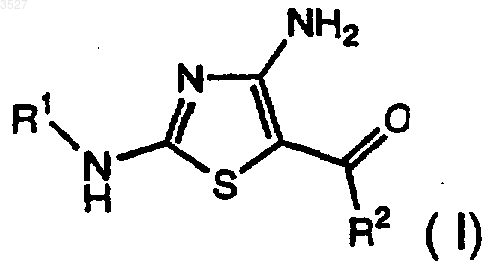
где R1 - замещенная или незамещенная группа, выбранная из C1-6-алкила; фенила; 5-9-членного гетероцикла, содержащего в качестве гетероатомов N, O, S; циклоалкила; (C1-6-алкил)карбонила; (C1-6-алкил)арила; и, в случае если R1 замещен, каждый заместитель независимо представляет собой галоген; галогеналкил; C1-6-алкил; C1-6-алкоксил; амино; нитро; простой тиоэфир; циано; амидо; карбоксил; сульфонамидную группу; кето-группу; сложноэфирную группу; кислород; фенил; 5-9-членный гетероцикл, содержащий в качестве гетероатомов N, O, S; фенил, замещенный 5-7-членным гетероциклом, содержащим в качестве гетероатома N, O, или (C1-6-алкил)амином, которые необязательно имеют заместители такие, как указано для R1; и
R2 - фенильное или 5-9-членное гетероциклическое кольцо, содержащее в качестве гетероатомов S или N, имеющее заместитель в смежном положении по отношению к точке присоединения, чье кольцо необязательно дополнительно замещено; где каждый заместитель R2 независимо представляет собой галоген, галогеналкил, C1-6-алкил; гидроксил; C1-6-алкоксил; амино; нитро; циано; C1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, арил;
(ii) фармацевтически приемлемую соль соединения формулы 1 и
(iii) пролекарство соединения формулы 1 или его фармацевтически приемлемую соль; и
(b) фармацевтически приемлемого носителя.
15. Способ лечения заболеваний или нарушений, которые связаны с ингибированием CDK4 или CDK4/циклин комплекса, включающий введение нуждающемуся в таком лечении пациенту агента, контролирующего клеточный цикл, выбранного из группы, состоящей из соединения формулы I
где R1 - замещенная или незамещенная группа, выбранная из C1-6-алкила; фенила; 5-9-членного гетероцикла, содержащего в качестве гетероатомов N, O, S; циклоалкила; (C1-6-алкил)карбонила; (C1-6-алкил)арила; и, в случае если R1 замещен, каждый заместитель независимо представляет собой галоген; галогеналкил; C1-6-алкил; C1-6-алкоксил; амино; нитро; простой тиоэфир; циано; амидо; карбоксил; сульфонамидную группу; кето-группу; сложноэфирную группу; кислород; фенил; 5-9-членный гетероцикл, содержащий в качестве гетероатомов N, O, S; фенил, замещенный 5-7-членным гетероциклом, содержащим в качестве гетероатома N, O, или (C1-6-алкил)амином, которые необязательно имеют заместители такие, как указано для R1; и
R2 - фенильное или 5-9-членное гетероциклическое кольцо, содержащее в качестве гетероатомов S или N, имеющее заместитель в смежном положении по отношению к точке присоединения, чье кольцо необязательно дополнительно замещено; где каждый заместитель R2 независимо представляет собой галоген, галогеналкил, C1-6-алкил; гидроксил; C1-6-алкоксил; амино; нитро; циано; C1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, арил;
фармацевтически приемлемой соли соединения формулы 1 и пролекарства соединений формулы 1 или его фармацевтически приемлемой соли.
Текст
Перекрестные ссылки, относящиеся к поданной заявке Эта поданная заявка имеет приоритет в соответствии с подачей первичных заявок, поданных в США за N 60/063,634 от 27 октября, 1997,и N 60/063,666, от 28 октября, 1997. Область изобретения Изобретение направлено на создание фармацевтических композиций, содержащих соединения аминотиазола, пригодных для ингибирования циклинзависимых киназ (CDKs), таких какCDK1, CDK2, CDK4 и CDK6. Изобретение также направлено на терапевтическое или профилактическое использование фармацевтических композиций, содержащих указанные соединения, а также оно относится к способам лечения злокачественных опухолей и других заболеваний, путем введения эффективного количества указанных соединений. Уровень техники Безудержно быстрое разрастание клеток знак отличия рака. Разрастание клеток в ответ на различные раздражители проявляется в исчезновении регулирования цикла клеточного деления,т.е. того процесса, в соответствии с которым клетки размножаются и делятся. Опухолевые клетки обычно имеют повреждения в генах, которые непосредственно или косвенно регулируют развитие во время цикла клеточного деления.CDKs составляют класс ферментов, которые играют решающую роль в регулировании переходов между различными фазами клеточного цикла, таких как развитие от статической стадии в G1 (интервал между митозом и началом репликации ДНК для нового круга клеточного деления) до S (период активного синтеза ДНК),или развитие от G2 до М фазы, в которой происходят активный митоз и клеточное деление. См.,например статьи, опубликованные в Science, т. 274 (1996), стр. 1643-1677 и Ann. Rev. Cell Dev.Biol., т. 13 (1997), стр. 261-291. CDK комплексы формируются во время ассоциации регуляторной циклиновой субъединицы (например, циклин A,B1, B2, D1, D2, D3 и Е) и каталитической субъединицы киназы (например, cdc2 (CDK1), CDK2,CDK4, CDK5 и CDK6). Как показывает название,CDKs проявляют абсолютную зависимость от циклиновой субъединицы в отношении фосфорилирования своих целевых субстратов, а также различную киназ/циклиновую парную в отношении регулирования развития во время определенных периодов клеточного цикла.D циклины чувствительны к внеклеточным сигналам роста и активизируются в ответ на митогены во время G1 фазы клеточного цикла.CDK4/циклин D играет важную роль в развитии клеточного цикла, путем фосфорилирования, и таким образом инактивирования, белка ретинобластомы (Rb). Гипофосфорилированный Rb связывается с семейством регуляторов транскрипции, но благодаря гиперфосфорилированию под действием Rb CDK4/циклина D, эти факторы транскрипции высвобождаются для активации генов, продукты которых отвечают за развитие S фазы. Фосфорилирование и инактивация Rb под действием CDK4/циклин D позволяют клетке перейти точку ограничения G1 фазы, после чего чувствительность к внеклеточным сигналам роста или ингибирующим сигналам теряется и клетка подвергается делению. Во время поздней G1,Rb также фосфорилируется и инактивируется под действием CDK2/циклин E, и недавнее свидетельство указывает, что CDK2/циклин Е может также регулировать развитие до S фазы через параллельный путь, который является независимым от фосфорилирования Rb (см. Lukas et al.pRb/E2F Pathway, Genes and Dev. т. 11 (1997),стр. 1479-1492). Развитие от G1 до S фазы, происходящее под действием CDK4/циклин D и CDK2/циклин Е, подчиняется различным механизмам регуляции роста, как негативным, так и позитивным. Стимуляторы роста, такие как митогены, вызывают увеличение синтеза циклина D1 и соответственно увеличение количества функциональнойCDK4. В противоположность этому, рост клеток может быть "обуздан" в ответ на повреждение ДНК или действие негативных стимуляторов роста, путем индукции эндогенных белков ингибиторов. Эти встречающиеся в природе белковые ингибиторы включают семейства p21WAFI/CIPI,р 27KIPI, и p16INKA, последнее из которых ингибирует исключительно CDK4 (см. Harper, "Cyclin(1997), pp. 91-107). Отклонения от нормы в этой системе контроля, в особенности те, которые затрагивают функции CDK4 и CDK2, вовлечены в переход клеток в состояние сильного разрастания, характерное для клеток злокачественных опухолей, типа семейных меланом, карцином пищевода, у панкреатитных раковых образований (см., например, Hall and Peters, "Genetic Alterations of Cyclins, Cyclin-Dependent Kinases, andCell Cycle Regulator Potentially Involved in Genesis of Many Tumor Types", Science, т. 264 (1994),стр. 436-440). Сверхэкспрессия циклина D1 связана с опухолями пищевода, молочной железы и сквамозными клеточными карциномами (см.,например., DelSal et al., "Cell Cycle and Cancer:Rev. Oncogenesis, т. 71 (1996), стр. 127-142). Гены, кодирующие CDK4-специфичные ингибиторы семейства р 16, часто имеют делеции и мутации в случае семейной меланомы, глиом, лейкемий, сарком и панкреатитной, немаленькой клетке легкого карциномы, и карцином головы и шеи численных различных твердых опухолях, и повышенные уровни циклина Е коррелировали с благоприятным прогнозом. Кроме того, клеточные уровни ингибитора CDK p27, который действует и как субстрат, и как ингибиторCDK2/циклин Е являются аномально низкими в опухолях молочной железы, толстой кишки и простаты, и уровни экспрессии р 27 обратно пропорционально зависят от стадии болезни (см.Degradation of the Cyclin-Dependent Kinase Inhibitor p27 in Agressive Colorectal Carcinomas",Nature Medicine, т. 3 (1997), стр. 231-234). Считается, что Р 21 белки также передают сигнал подавления опухоли р 53 к CDKs; таким образом,мутация р 53 в приблизительно 50% всех человеческих раковых образований может косвенно привести к нарушению регулирования активности CDK. Появляющиеся данные обеспечивают твердую основу для использования соединений, ингибирующих CDKs, и CDK4 и CDK2, в частности, в качестве антипролиферативных терапевтических агентов. Для этих целей были предложены некоторые биомолекулы. Например, в US 5,621,082 Xiong и другие раскрыта нуклеиновая кислота, кодирующая ингибитор CDK6, и в ЕР N 0 666 270 А 2 описываются пептиды и пептидные аналоги, которые действуют как ингибиторыCDK1 и CDK2. Несколько небольших молекул были идентифицированы как ингибиторы CDKOpin. Invest. Drugs, vol. 7 (1998), pp. 865-887). Флавон флавопиридол проявляет умеренную селективность в отношении ингибированияCDKs по сравнению с другими киназами, но ингибирует CDK4, CDK2, и CDK1 в равной степени, с IC50S в диапазоне от 0,1-0,3 Флавопиридол в настоящее время проходит Фазу II в качестве онкологического химотерапевтического средстваWO 98/17662. Результаты испытаний производных пуринового основания описаны в Schow и другие, Bioorg. Med. Chem. Lett., т. 7 (1997), стр. 2697-2702; Grant и другие, Proc. Amer. Assoc.Cancer Res., т. 39 (1998), Abst. 1207; Legravend и другие, Bioorg. Med. Chem. Lett., т. 8 (1998), стр. 793-798; Gray et al, Sience т. 281 (1998), стр. 533538; и Furet и другие, 216-ой ACS Nad. Mtg. (2327 августа, 1998, Бостон), Abst MEDI-218. Кроме того, в следующих публикациях описаны некоторые пиримидины, которые ингибируют циклинзависимые киназы, действие которых регулируется факторами роста: Международная Публикация WO 98/33798; Ruetz и другие, Proc.Amer. Assoc. Cancer Res т. 39 (1998), Abst. 3796; и Meyer и другие, Proc. Amer. Assoc. Cancer Res.,vol. 39 (1998), Abst. 3794. Однако все еще имеется потребность в соединениях с небольшой молекулой, которые могут быть быстро синтезированы и являются потенциальными ингибиторами одной или болееCDK4 может служить общим активатором деления в большинстве клеток и поскольку комплексы CDK4/циклин D и CDK2/циклин Е управляют ранней фазой G1 клеточного цикла, имеется потребность в эффективных и специфичных ингибиторах CDK4 и/или CDK2 для лечения одного или более типов опухолей. Сущность изобретения Соответственно задачей изобретения является создание соединений и лекарственных средств, которые ингибируют активность одного или большего количества CDKs, таких как CDK2CDK4 и/или CDK6 или их циклиновых комплексов. Другой задачей является обеспечение эффективного способа лечения проявлений рака путем CDK ингибирования, предпочтительно путем ингибирования CDK4 или циклинового комплекса типа CDK4/D и/или циклиновых комплексов типа CDK2 или CDK2/E. Еще одной задачей является создание фармацевтических композиций, содержащих соединения, способные эффективно блокировать переход опухолевых клеток в фазу разрастания. Эти и другие задачи и преимущества изобретения, которые станут очевидными в свете детального описания, приведенного ниже, достигаются за счет контролирующих клеточный цикл агентов в соответствии с изобретением, как описано ниже. В одном из аспектов изобретение относится к соединениям формулы I где R1 - замещенная или незамещенная группа,выбранная из С 1-6-алкила; фенила; 5-9-членного гетероцикла, содержащего в качестве гетероатомов N, O, S; циклоалкила; (С 1-6-алкил)карбонила; (С 1-6-алкил)арила; и, в случае если R1 замещен, каждый заместитель независимо представляет собой галоген; галогеналкил; С 1-6-алкил; С 1-6-алкоксил; амино; нитро; простой тиоэфир; циано; амидо; карбоксил; сульфонамидную группу; кето-группу; сложноэфирную группу; кислород; фенил; 5-9-членный гетероцикл, содержащий в качестве гетероатомов N, O, S; фенил, замещенный 5-7-членным гетероциклом,содержащим в качестве гетероатома N, O, или(С 1-6-алкил)амином,которые необязательно имеют заместители такие, как указано для R1; и ном положении по отношению к точке присоединения, чье кольцо необязательно дополнительно замещено; где каждый заместитель R2 независимо представляет собой галоген, галогеналкил, С 1-6-алкил; гидроксил; С 1-6-алкоксил; амино; нитро; циано; С 1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, арил; или фармацевтически приемлемым солям соединения формулы I, или пролекарству соединения формулы I, или его фармацевтически приемлемым солям. В другом аспекте изобретение относится к фармацевтическим композициям, состоящим из: а) агента, контролирующего клеточный цикл, взятого в количестве, эффективном для ингибирования CDK4 или СDК 4/циклин комплекса, выбранного из группы, включающей: где R1 - замещенная или незамещенная группа,выбранная из С 1-6-алкила; фенила; 5-9-членного гетероцикла, содержащего в качестве гетероатомов N, O, S; циклоалкила; (С 1-6-алкил)карбонила; (С 1-6-алкил)арила; и, в случае если R1 замещен, каждый заместитель независимо представляет собой галоген; галогеналкил; С 1-6-алкил; С 1-6-алкоксил; амино; нитро; простой тиоэфир; циано; амидо; карбоксил; сульфонамидную группу; кето-группу; сложноэфирную группу; кислород; фенил; 5-9-членный гетероцикл, содержащий в качестве гетероатомов N, O, S; фенил, замещенный 5-7-членным гетероциклом,содержащим в качестве гетероатома N, O, или(С 1-6-алкил)амином,которые необязательно имеют заместители такие, как указано для R1; иR2 - фенильное или 5-9-членное гетероциклическое кольцо, содержащее в качестве гетероатомов S или N, имеющее заместитель в смежном положении по отношению к точке присоединения, чье кольцо необязательно дополнительно замещено; где каждый заместитель R2 независимо представляет собой галоген, галогеналкил, С 1-6-алкил; гидроксил; С 1-6-алкоксил; амино; нитро; циано; С 1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, арил;(ii) фармацевтически приемлемую соль соединения формулы I и(iii) пролекарство соединения формулы I или его фармацевтически приемлемую соль,и(b) фармацевтически приемлемого носителя. Еще в одном аспекте изобретение относится к способу лечения заболеваний или нарушений, которые связаны с ингибированием CDK4 или СDК 4/циклин комплекса, включающему введение нуждающемуся в таком лечении пациенту агента, контролирующего клеточный цикл, 6 выбранного из группы, состоящей из соединения формулы I где R1 - замещенная или незамещенная группа,выбранная из С 1-6-алкила; фенила; 5-9-членного гетероцикла, содержащего в качестве гетероатомов N, O, S; циклоалкила; (С 1-6-алкил)карбонила; (С 1-6-алкил)арила; и, в случае если R1 замещен, каждый заместитель независимо представляет собой галоген; галогеналкил; С 1-6-алкил; С 1-6-алкоксил; амино; нитро; простой тиоэфир; циано; амидо; карбоксил; сульфонамидную группу; кето-группу; сложноэфирную группу; кислород; фенил; 5-9-членный гетероцикл, содержащий в качестве гетероатомов N, O, S; фенил, замещенный 5-7-членным гетероциклом,содержащим в качестве гетероатома N, O, или(С 1-6-алкил)амином,которые необязательно имеют заместители такие, как указано для R1; иR2 - фенильное или 5-9-членное гетероциклическое кольцо, содержащее в качестве гетероатомов S или N, имеющее заместитель в смежном положении по отношению к точке присоединения, чье кольцо необязательно дополнительно замещено; где каждый заместитель R2 независимо представляет собой галоген, галогеналкил, С 1-6-алкил; гидроксил; С 1-6-алкоксил; амино; нитро; циано; С 1-6-алкилкарбамоил, бензоилокси, бензилоксикарбонил, арил; фармацевтически приемлемой соли соединения формулы I и пролекарства соединений формулы I или его фармацевтически приемлемой соли. Композиции согласно изобретению полезны в качестве ингибиторов CDK/циклин комплексов млекопитающих, инсектицидных CDK,или грибковых CDK комплексов. Такие композиции также полезны для осуществления контроля роста, дифференцирования и/или апоптоза. Таким образом, в общем аспекте изобретение направлено на фармацевтические композиции,содержащие фармацевтически эффективные количества агентов, контролирующих клеточный цикл. В предпочтительном воплощении изобретение направлено на сильнодействующие агенты, контролирующие клеточный цикл, в которыхR2 в формуле I представляет собой ортозамещенную арильную кольцевую структуру(например, о-замещенный фенил). Особенно предпочтительны среди таких агентов те, в которых R2 является (о-дизамещенным фенилом). Изобретение, кроме того, относится к способам использования агентов, контролирующих клеточный цикл для лечения заболеваний или недомоганий, вызванных ингибированием CDK,особенно вызванных ингибированием CDK4 и/или CDK2 . В особенности, изобретение на 7 правлено на способы лечения злокачественных опухолей или раковых заболеваний путем применения фармацевтической композиции, содержащей агент, контролирующий клеточный цикл. Дополнительно изобретение относится к использованию агента, контролирующего клеточный цикл, для профилактики или лечения микотических инфекций. Примеры значений R1 включают замещенный или незамещенный арил и алкил, такой как фенил, пиридил, бензимидазол, бензил и С 1-6 алкил. В предпочтительном воплощении изобретения эти группы имеют один или более заместителей, выбранных из галогена; кислорода; галогеналкила; С 1-6-алкила; циклоалкила; гетероциклоалкила; арила; С 1-6 алкоксила; амино; нитро, тиоэфира; циано; амидо; карбоксила; сульфонамидо; кетона; альдегида и сложного эфира. Другими предпочтительными значениями для R1 являются фенильные группы, замещенные алкиламином или пиридиновая группа, необязательно имеющая заместители, выбранные из группы, перечисленные выше для R1. Заместитель алкиламин может быть 5-7-членным гетероциклоалкилом, необязательно содержащим, в дополнение к атому азота кольца, один или более гетероатомов, выбранных из N, O и S. Примеры таких предпочтительных групп R1 включают фенил, замещенный в пара-положении гетероциклоалкилом, например пиперидинилом,пиперазинилом, тиазинилом или морфолинилом или пиридильной группой. Далее следуют следующее примеры предпочтительных значений R1 группы Другие особенно предпочтительные R1 группы включают фенильные группы, замещенные карбонильным или сульфонамидным заместителями, где атом углерода карбонильной группы и атом азота сульфонамидной группы необязательно дополнительно замещены. Далее следуют следующие предпочтительные примеры R1 где R3 выбран из С 1-6 алкила, С 1-6 алкоксила, арила, арилокси и амина. Другие предпочтительные примеры значений R1 включают замещенный или незамещенный фенил, алкилбензил, алкил, бензилкарбоксил сложный эфир, бензилоксифенил, диметиламинофенил, пиридинил, фенетил, алкилкарбоксил, алкилпиперидинил, фениламино, циклогексил, бензилкарбоксилалкил, бензилнитро, фенилалкоксил, этиловый эфир бензойной кислоты,бензилкарбоксил, алкилбензоимидазол, бензоимидазол, бензилдиметиламино, пиридинилсульфанил, цианобензил и фенилсульфамил. В предпочтительных воплощениях изобретения R2 в формуле I представляет собой объемную группу типа замещенного или незамещенного карбоциклического или гетероциклического моноцикла, или замещенного или незамещенного конденсированного или неконденсированного карбоциклического или гетероциклического полицикла. Более предпочтительно, R2 - замещенный (карбо или поли) - (моноцикл или полицикл); еще более предпочтительно, R2 - циклическая кольцевая структура, имеющая заместитель в смежном или в вицинальном положении по отношению к точке присоединения (к основной структуре). Например, предпочтительные группы дляR2 включают ортозамещенную ароматическую кольцевую структуру, такую как о-замещенный фенил или тиенил. Особенно предпочтительные примеры для остатка R2 включают замещенный или незамещенный: о-галогенфенил (например,о-фторфенил, о-хлорфенил, о-иодфенил или обромфенил), о-нитрофенил, о-аминофенил, о-С 1-6 алкилфенил, o-С 1-6-алкоксифенил (например, ометоксифенил или о-этоксифенил), о-С 1-6 алкоксибензотиофенил, о-метилтиофенил, бензнитрил и карбоксибензил. Особенно предпочтительные примеры для остатка R2 также включают ортодизамещенные арилы, например 2,6 дигалоидфенил (например, 2,6-дифторфенил) и 2-галоген-6-трифторметилфенил (например, 2 фтор-6-трифторметилфенил). Соединения формулы I, где R2 - 1,2-замещенная циклическая кольцевая структура, необязательно имеющая один или более дополнительных заместителей,таких как ортозамещенный арил, имеющий другой заместитель в пара-положении, как было неожиданно найдено, являются сильными ингибиторами CDK. Особенно предпочтительные примеры соединений формулы I включают Другие особенно предпочтительные примеры соединений формулы I включают Фармацевтические композиции согласно изобретению могут, альтернативно или в дополнение к соединению формулы I, включать как активный ингрендиент фармацевтически приемлемую соль соединения формулы I, или предшественник лекарственного средства или его соль. Такие соединения, соли, пролекарства, иногда обозначаются в данном описании все вместе как"агенты, контролирующие клеточный цикл". Композиции в соответствии с изобретением ингибируют активность киназы CDK/циклин комплексов, тех, которые активны в стадии G0 или G1 клеточного цикла, например CDK2, CDK4 и/илиCDK6 комплексов. Предпочтительные композиции по изобретению содержат агенты, контролирующие клеточный цикл, имеющие константу ингибирования относительно CDK4 или CDK4/D циклин комплекса около 1 мкМ или меньше, более предпочтительно приблизительно 500 нМ или меньше, еще более предпочтительно приблизительно 200 нМ или меньше, и наиболее предпочтительно приблизительно 100 нМ или меньше. Особенно предпочтительные соединения в соответствии с изобретением включают те соединения, которые имеют CDK4/циклин D3 константу ингибирования (K,CDK4/D3) приблизительно 100 нМ или меньше. Другие предпочтительные композиции по изобретению содержат агенты, контролирующие клеточный цикл, имеющие константу ингибирования относительно CDK2 или CDK2/E циклин комплекса приблизительно 1 мкМ или меньше, более предпочтительно приблизительно 500 нМ или меньше, еще более предпочтительно приблизительно 200 нМ или меньше и наиболее предпочтительно приблизительно 100 нМ или меньше. Некоторые соединения формулы I могут существовать в различных стереоизомерных или таутомерных формах. Настоящее изобретение охватывает все такие ингибирующие CDK со 10 единения, включая активные соединения в форме, по существу, чистых энантиомеров, рацемических смесей и таутомеров. Термин "фармацевтически приемлемый" означает фармакологически приемлемый и существенно нетоксичный для пациента, которому вводят агент, контролирующий клеточный цикл. Фармацевтически приемлемые соли включают обычные кислотно- или основно-аддитивные соли, образованные из подходящих нетоксичных органических или минеральных кислот или неорганических оснований. Примеры солей,образованных при добавлении кислоты, включают те, которые получают из минеральных кислот типа соляной кислоты, бромистоводородной кислоты, йодисто-водородной кислоты, серной кислоты, сульфаминовой кислоты,фосфорной кислоты и азотной кислоты, и те,которые получают из органических кислот типа п-толуолсульфокислоты, метансульфокислоты,этандисульфоновой кислоты, изэтионовой кислоты, щавелевой кислоты, п-бромфенилсульфоновой кислоты, угольной кислоты, янтарной кислоты, лимонной кислоты, бензойной кислоты, 2-ацетоксибензойной кислоты, уксусной кислоты, фенилуксусной кислоты, пропионовой кислоты, гликолевой кислоты, стеариновой кислоты, молочной кислоты, оксиянтарной кислоты, винной кислоты, аскорбиновой кислоты, малеиновой кислоты, гидроксималеиновой кислоты, глутаминовой кислоты, салициловой кислоты, сульфаминовой кислоты и фумаровой кислоты. Примеры основно-аддитивных солей включают получение из гидроксидов аммония (например, четверичного гидроксида аммония типа тетраметиламмоний гидроксида) те, которые получены из неорганических оснований, таких как гидроксиды щелочных или щелочноземельных металлов (например натрия, калия,лития, кальция или магния), и те, которые получены из органических оснований, таких как карбонаты, бикарбонаты, аминов, бензиламины,пиперидины и пирролидины. Термин "пролекарство" относится к метаболическому предшественнику соединения формулы I (или его соли), который является фармацевтически приемлемым. Пролекарство может быть неактивно, когда его вводят пациенту, но превращается in vivo в активное соединение формулы I. Пролекарства соединений формулы I могут быть определены путем использования методов,известных из уровня техники. Агенты, контролирующие клеточный цикл,в соответствии с изобретением полезны в качестве фармацевтических препаратов для лечения пролиферативных заболеваний молочной железы, особенно человека, для которых характерно нежелательное быстрое увеличение эндогенной ткани. Соединения формулы I могут использоваться для лечения пациентов, имеющих заболевания, связанные с чрезмерным быстрым ростом клеток, например карцином, псориаза, заболеваний иммунной системы, включающие нежелательное быстрое увеличение лейкоцитов, и рестеноз, а также другие заболевания гладкой мускулатуры. Кроме того, такие соединения могут быть использованы для предотвращения дедифференцирования постмиотической ткани и/или клеток. Фармацевтические композиции или составы в соответствии с изобретением включают фармацевтически приемлемый носитель и эффективное количество, по крайней мере, одного агента, контролирующего клеточный цикл. Термин "эффективное количество" означает количество, которое в значительной степени ингибирует быстрое разрастание клеток, и/или предотвращает дедифференцирование эукариотической клетки, например клетки млекопитающего,насекомого, растения или гриба, и эффективно для указанного применения, например для определенного терапевтического лечения. Лечебная дозировка агента, контролирующего клеточный цикл, применяемого при лечении для того,чтобы получить терапевтический или ингибирующий эффекты, конечно, может быть определена способом,известным из уровня техники, в соответствии с определенным обстоятельством, возникающим в каждом случае, включая, например, характеристику агента,контролирующего клеточный цикл, способ применения, условие лечения и заболевание или пациента,которого лечат. Примерная общая дневная доза агента, контролирующего клеточный цикл, которая может вводиться одноразово или многократно, находится на уровне от около 0,01 мг/кг веса тела до приблизительно 50 мг/кг веса тела. Агенты, контролирующие клеточный цикл в соответствии с настоящим изобретением, могут быть введены любым из разнообразных пригодных способов, таких как оральный, ректальный,трансдермальный, подкожный, внутривенный,внутримышечный или интраназальный. Агенты,контролирующие клеточный цикл в соответствии с настоящим изобретением, предпочтительно формируют в композиции, подходящие для желаемого способа их введения. Фармацевтическая композиция или состав в соответствии с изобретением включает эффективное количество агента, контролирующего клеточный цикл и фармацевтически приемлемый носитель, такой как разбавитель или наполнитель для агента. Когда носитель служит как разбавитель, он может быть твердым, полутвердым или жидким материалом, действующим как связующее, инертный наполнитель или среда для активного компонента(ов). Композиции согласно изобретению могут быть получены путем смешения активного компонента(ов) с носителем,или путем его разбавления носителем, или путем его включения или капсулирования в носитель,который может быть в форме капсулы, пакетика,бумажного контейнера или тому подобное. Примерные ингредиенты, которые могут быть введе 12 ны в дополнение к одному или большему количеству агентов, контролирующих клеточный цикл, включают любые другие активные ингредиенты, включают Avicel (микрокристаллическую целлюлозу), крахмал, лактозу, дигидрат сульфата кальция, белую трубочную глину, сахарозу, тальк, желатин, агар-агар, пектин, гуммиарабик, стеарат магния, стеариновую кислоту,масло арахиса, оливковое масло, моностеарат глицерина, Твин 80 (полисорбат 80), 1,3 бутандиола, масло какао, пчелиный воск, полиэтиленгликоль, пропиленгликоль, сорбит моностеарат, полисорбат 60, 2-октилдодеканол, бензиловый спирт, аминоуксусную кислоту, сорбиновую кислоту, сорбат калия, вторичный кислый фосфорнокислый натрий, хлористый натрий и воду. Композиции могут быть приготовлены в любой из разнообразных форм, подходящих для желаемого способа введения. Например, фармацевтические составы могут быть приготовлены в форме таблеток, пилюль, порошков, подушечек, лепешек,сахарных облаток, крахмальных облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердых, так и жидких), мазей (например, содержащих до 10% по весу агентов, контролирующих клеточный цикл), в виде мягких и твердых капсул с гелем, свечей, стерильных, пригодных для инъекции растворов, стерильных упакованных порошков и т.п. Фармацевтический состав согласно изобретению включает агент, контролирующий клеточный цикл, и, необязательно, один или большее количество других активных ингредиентов, таких как известный антипролиферативный агент,совместимый с агентом, контролирующим клеточный цикл, и подходящим для симптома, который лечат. В предпочтительном воплощении изобретения фармацевтический состав по изобретению включает эффективное количество агента, контролирующего клеточный цикл формулы I, в качестве активного ингредиента. Сведения, подтверждающие возможность осуществления изобретения. Соединения в соответствии с изобретением могут быть получены способами, аналогично описанным ниже, с буквенным определением примеров (т.е. А, В, С, D, Е, F, G, H, J, K, L, М иN), обозначающим общие схемы синтеза. ПРИМЕРЫ Пример А(1). (4-Амино-2-фениламинотиазол-5-ил)-(3-нитрофенил)метанонChem., том. 35 (1967), стр. 97-104, натрий (188 мг, 8,20 ммоль) осторожно растворяют в метаноле (9 мл) при 0 С и оставляют нагреваться до комнатной температуры. Полученный раствор порциями добавляют к смеси цианамида (345 мг, 13 8,20 ммоль) и фенилизотиоцианата (0,98 мл, 8,2 ммоль), при этом выделяется тепло. Затем добавляют 2-бром-3'-нитроацетофенон (2,00 г, 8,2 ммоль) и полученную смесь перемешивают в течение ночи при комнатной температуре. Смесь разбавляют водой (150 мл), желто-коричневый осадок отфильтровывают, промывают водой и небольшим количеством эфира, сушат под вакуумом и перекристаллизовывают из этанола с получением 2,17 г (52% выход) названного соединения в виде темно-коричневых кристаллов,температура плавления (т. пл.) 186-187 С. 1 Н ЯМР (DMSO-d6):10.95 (1H, s), 8.44 Названное соединение получают аналогично описанному в примере А(1). Фенилизотиоцианат и 2-бром-4'-нитроацетофенон образуют после перекристаллизации из этанола, 3,06 г Названное соединение получают аналогично описанному в примере А(1). Пиридин-3 илизотиоцианат и фенацилхлорид обеспечивают получение, после перекристаллизации из этанола, 4,1 г (75% выход) желтых кристаллов, т.пл. 227-229 С. 1 Н ЯМР (DMSO-d6):10.95 (1H, s), 8.82 Названное соединение получают аналогично описанному в примере А(1). Фенил изотиоцианат и 2-(2-бромацетил) пиридин (см. Menasseet al., Helv. Chim. Acta, том. 38 (1955), стр. 12891291; Imuta et al., J. Org. Chem., том. 45 (1980),стр. 3352-3355) образуют после перекристаллизации из 95% этанола 510 мг (71% выход) коричневых игл, т. пл. 181,5-183,0 С. 1 Н ЯМР (DMSO-d6):10.75 (1 Н, s), 8.92 Названное соединение получают аналогично методике примера А (1). 4-Карбоэтоксифенилизоцианат и 2-бром-2'-нитроацетофенон образуют после перекристаллизации из этанола 1.2 г (59% выход) желтого кристаллического порошка, т. пл. 262-265 С. 1 Н ЯМР (DMSO-d6):11.08 (1 Н, s), 8.12 Названное соединение получают аналогично описанному в примере А(1). 6-Изотиоцианат 2-метил-1H-бензимидазол (см. Galley et al., DE 2259220 (1973); C.A. No. 478781 (1973 и 2 15 бром-2'-нитроацетофенон образуют после перекристаллизации из этанола 1,2 г (62% выход) коричневых кристаллов, т. пл. 190,0-192,5 С. 1 Н ЯМР (DMSO-d6):12.20 (1 Н, bs), 10.76 Названное соединение получают аналогично примеру А(1). 4-Иодфенилизотиоцианат и 2 бром-2'-нитроацетофенон обеспечивают получение 7,9 г (88% выход) оранжево-красного порошка, т. пл. 182-184 С. 1 Н ЯМР (DMSO-d6):10.89 (1H, s), 8.20 Названное соединение получают аналогично методике, описанной в примере А(1). 4 Нитрофенилизотиоцианат и фенацилхлорид образуют 2,5 г (60% выход) твердого вещества, т. пл. 280,0-281,5 С. 1 Н ЯМР (DMSO-d6):11.38 (1 Н, s), 8.308.18 (2H, bs), 8.23 (2H, d, J = 9.3 Гц), 7.87 (2H, d, J Названное соединение получают аналогично методике, описанной в примере А(1). 6 Изотиоцианат-1 Н-бензимидазол (см. Boev et al.,Pharm. Chem. J. (Engl. Transl.), том. 24 (1990),стр. 818-822) и 2-бром-2'-нитроацетофенон обра 16 зуют после перекристаллизации из этанола/метанола, 1,5 г (83% выход) красно-коричневого аморфного порошка, т. пл. 249-255 С. 1 Н ЯМР (DMSO-d6):12.50 (1 Н, bs), 10.84 Названное соединение получают аналогично методике примера А(1). 4-Метоксифенилизотиоцианат и 2-бром-2'-нитроацетофенон обеспечивают получение после перекристаллизации из водного этанола 562 мг (43% выход) коричневого-красных кристаллов, т. пл. 185188 С. 1 Н ЯМР (DMSO-d6):10.65 (1H, s), 8.25 Названное соединение получают, по существу, аналогично методике, описанной в примере А(1). Пиридин-3-илизотиоцианат и 2-бром-2'нитроацетофенон позволяют получить после колоночной хроматографии с 5% МеОН/СН 2 Сl2 750 мг (42% выход) желтого твердого вещества, т. пл. 143,5-146,0 С. 1 Н ЯМР (DMSO-d6):10.95 (1 Н, bs), 8.62 С, 67.63; Н, 5.68; N, 12.45; S, 9.50. Найдено: С, 67.70; Н, 5.73;N ,12.47; S, 9.62. Пример В. [4-Амино-2-(п-Толиламино)тиазол-5-карбонил]фенилбензоат Названное соединение получают, в основном, как описано в примере А(1). 6 Изотиоцианат-1 Н-бензимидазол (см. Boev et al.,Pharm. Chem. J. (Engl. Transl). том. 24 (1990), стр. 818-822) и метилбромацетат образуют с выходом 63% твердое вещество желтого цвета, т. пл. 266267 С. 1 Н ЯМР (DMSO-d6):12.37 (1 Н, bs), 10.52 Названное соединение получают аналогично методике, описанной в примере А(1). пТолилизотиоцианат и 2-бром-2',4'-диметоксиацетофенон образуют после перекристаллизации из МеОН/СНСl3 78 мг (24% выход) желтого твердого вещества, т. пл. 215-216 С. 1 Н ЯМР (DMSO-d6):10.51 (1H, s), 7.88 Названное соединение получают аналогично методике, описанной в примере А(1). пТолилизотиоцианат и 2-бром-2',4'-диметилацетофенон образуют после перекристаллизации из МеОН/СНСl3 65 мг (33% выход) желтых кристаллов, т. пл. 220-221 С. 1 Н ЯМР (DMSO-d6):10.58 (1 Н, s), 7.99 Промежуточное соединение,S-(4 бензоилоксифенилацетил)-N'-циано-N"-п-толилизотиомочевину, вначале получают следуя процессу, описанному Gewald et al., J. Prakt. Chem,том. 35 (1967), стр. 97-104. Натрий (6,7 мг, 0,29 ммоль) осторожно растворяют в метаноле (0,5 мл) и оставляют охлаждаться до комнатной температуры. К полученному раствору добавляют птолилизотиоцианат (43 мг, 0,29 ммоль) и цианамид (12 мг, 0,29 ммоль). Через час добавляют 4 бромацетилфенилбензоат (92 мг, 0,29 ммоль) и полученную смесь перемешивают в течение ночи при комнатной температуре. Смесь затем разбавляют водой (10 мл). Полученное желтоватокоричневое твердое вещество отфильтровывают,промывают водой и небольшим количеством простого эфира, сушат под вакуумом и перекристаллизовывают из этанола/СНСl3 с образованием первого остатка S-(4-бензоилоксифенилацетил)-N'-циано-N"-п-толилизотиомочевины Н ЯМР (DMSO-d6):8.10-8.04 (2 Н, m),7.72 (1H, ddd, J =7.5, 1.8, 1.8 Гц), 7.67-7.54 (4 Н,m), 7.20 (2 Н, d, J = 8.7 Гц), 7.03 (4H, dd, J = 11.2,8.7 Гц), 4.10 (1H, d, J=12.1 Гц), 3.77 (1H, d, J = U 2.1 Гц), 2.19 (3H, s). Из промежуточного соединения названное соединение получают следующим образом. Сырую S-(4-бензоилоксифенилацетил)-N'-циано-N"п-толилизотиомочевину (0,29 ммоль) и триэтиламин (101 мкл, 0,73 ммоль) в этилацетате (1 мл) нагревают с обратным холодильником 2 ч, затем оставляют охлаждаться до комнатной температуры и концентрируют в вакууме с образованием сырого продукта, который кристаллизуют из СН 3 ОН/СНСl3 с получением чистого вещества 67 мг (54% выход) в виде желтых игл, т. пл. 245247 С. 1 Н ЯМР (DMSO-d6):10.71 (1 Н, s), 8.348.11 (4 Н, m), 7.80-7.72 (3H, m), 7.66-7.57 (2H, m),7.46 (2H, d, J = 8.1 Гц), 7.38 (2H, d, J = 8.4, Гц),7.16 (2H, d, J = 8.4 Гц), 2.26 (3H, s). ИК (KBr): 3451, 3332, 3026, 1732, 1597,1522, 1444, 1264, 1206, 1164, 1062, 708 см-1. К смеси 4-метоксикарбонилфенилизотиоцианата (82 мг, 0,5 ммоль) и цианамида (23 мг, 0,55 ммоль) в ацетонитриле (5 мл), добавляют раствор трет.-бутилата калия (61 мг, 0,55 ммоль) в трет.бутаноле (5 мл). Через 30 мин при комнатной температуре добавляют 2-бром-4'-метоксиацетофенон(115 мг, 0,5 ммоль). Через 2 ч при комнатной температуре реакционную смесь разбавляют водой(50 мл). Продукт собирают на фильтре, промывают водой и этиловым эфиром и сушат под вакуумом с образованием желтого твердого вещества, 172 мг (90% выход). 1 Н ЯМР (DMSO-d6):8.00 (2 Н, d, J = 8.2 Гц), 7.84 (2 Н, d, J = 8.2 Гц), 7.72 (2H, d, J = 8.2 Гц), 7.10 (2H, d, J = 8.2 Гц), 3.90 (6H, s). Названное соединение получают аналогично методике, описанной в примере С(1). 4 Бензилоксифенилизотиоцианат и 2- бром-4'метоксиацетофенон обеспечивают получение желто-коричневого твердого вещества с выходом 85% , т. пл. 222-224 С. 1 Н ЯМР (DMSO-d6):7.70 (2 Н, d, J = 8.2 Гц), 7.58-7.34 (7 Н, m), 7.06 (4 Н, dd, J = 7.5, 1.2 Гц), 5.18 (2 Н,s), 3.94 (3 Н,s). Названное соединение получают аналогично методике, описанной в примере С(1) из 4 диметиламинофенилизотиоцианата и 2-бром-4'метоксиацетофенона, при этом образуется про 20 дукт в виде твердого вещества желтого цвета с выходом 85% , т. пл. 178-180 С. 1 Н ЯМР (DMSO-d6):7.70 (2 Н, d, J = 8.2 Гц), 7.34 (2 Н, d, J = 8.2 Гц), 7.00 (2 Н, d, J = 8.6 Гц), 6.80 (2 Н, d, J = 8.6), 3.94 (3H, s), 2.94 (6H, s). Анализ. Вычислено для C19H20N4O2S: С, 61.94; Н, 5.47; N, 15.21; S, 8.70. Найдено: С, 62.22; Н, 5.48; N, 15.03; S, 8.58. Пример С(4). [4-Амино-2-(4-диметиламинофениламино)тиазол-5-ил]-(2-нитрофенил)метанон Названное соединение получают аналогично методике примера С(1). 4-Диметиламинофенилизотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению желтого твердого вещества с 90% выходом, т. пл. 195 С (разложение). 1 Н ЯМР (DMSO-d6):8.06 (2 Н, bs), 7.76 Названное соединение получают, по существу, аналогично описанному в примере С(1). Фенилэтилизотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению аморфного твердого желтого вещества с 90% выходом, т. пл. 75,0-81,5 С (разложение). 1 Н ЯМР (DMSO-d6):8.67 (1 Н, bs), 8.00 Названное соединение получают аналогично описанному в примере С(1). Метил 2(S)изотиоцианатбутират и 2-бром-4'-нитроацетофенон приводят к получению аморфного Названное соединение получают, по существу, аналогично примеру С(1). 4-Диметиламинофенилизотиоцианат и 2-(2-бромацетил)-3 метилбензо[b]тиофен образуют, после перекристаллизации из этанола, 210 мг (92% выход) желтого порошка, т. пл. 123-126 С. 1 Н ЯМР (DMSO-d6):10.50 (1H, s), 8.20 Названное соединение получают аналогично описанному в примере С(1). 6-Изотиоцианат 1 Н-бензимидазол (см. Boev et al., Pharm. Chem. J. Названное соединение получают, по существу, аналогично методике примера С (1). 4-Диметиламинофенилизотиоцианат и 2-(2-бромацетил)-5-хлор-3-метилбензо[b]тиофен обеспечивают 54% выход желтого порошка, т. пл. 265268 С. 1 Названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Boev, et al., Pharm. Chem. J. Названное соединение получают аналогично примеру С(1). 3,4-Метилендиоксифенилизотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению желтого твердого вещества с 73% выходом, т. пл. 200-202,5 С. 1 вначале получают следующим образом. Согласно процессу King et al., J. Org. Chem, том. 29(1964), стр. 3459-3461, к раствору 2'-иодацетофенона (3.54 г, 14.4 ммоль) в этилацетате добавляют бромид меди (II) (6,34 г, 28,8 ммоль),и полученную смесь нагревают с обратным холодильником в течение 90 мин. Смеси позволяют охладиться и твердое вещество отфильтровывают и промывают этилацетатом. Фильтрат концентрируют, обеспечивая получение 4.60 г (98% выход) 2-бром-2'-иодацетофенона в виде желтого масла, который соответствует ранее описанному продукту (Lutz et al., J. Org. Chem., том. 12(1947), p. 617). Названное соединение затем получают аналогично методике примера С(1). 4 Метоксифенилизотиоцианат и 2-бром-2'иодацетофенон обеспечивают получение желтого твердого вещества с 71% выходом, т. пл.187190 С. 1 Н ЯМР (DMSO-d6):10.56 (1H, s), 8.03 Названное соединение получают аналогично методике примера С(1). 4-Нитрофенилизотиоцианат и 2-бром-2'-нитроацетофенон обеспечивают получение желтого твердого вещества с 45% выходом, т. пл. 266.0-268.2 С. 1 Н ЯМР (DMSO-d6):10.80 (1 Н, s), 8.23 Названное соединение получают аналогично примеру С(1). Циклогексилизотиоцианат и 2-бром-2'нитроацетофенон обеспечивают получение желтого твердого вещества с 45% выходом, т. пл. 116-118 С. 1 Н ЯМР (DMSO-d6):8.62 (1 Н, bs), 8.00 Названное соединение получают, по существу, аналогично описанному в примере С(1). Изопропилизотиоцианат и 2-бром-2'-нитроацетофенон обеспечивают получение желтого твердого вещества с 58% выходом, т. пл. 202,5205,0 С. 1 Н ЯМР (DMSO-d6):10.74 (1H, s), 8.05 Названное соединение получают аналогично методике примера С(1). 4-Хлорфенэтилизотиоцианат и 2-бром-2'-нитроацетофенон обеспечивают получение желтого твердого вещества с 61% выходом, т. пл. 117-120 С. Названное соединение получают аналогично методике примера С(1). 4-Диэтиламинофенилизотиоцианат и 2-бром-2'-нитроацетофенон обеспечивают получение желтого твердого вещества с 63% выходом, т. пл. 202,5-205,0 С. 1 Н ЯМР (DMSO-d6):10.45 (1H, s), 8.01 Названное соединение получают аналогично методике примера С(1). 4-Диэтиламинофенилизотиоцианат и 2-бром-4'-нитроацетофенон обеспечивают получение желтого твердого вещества с 63% выходом, т. пл. 220221 С. 1 Н ЯМР (DMSO-d6):10.51 (1 Н, s), 8.42 Названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Boev et al., Pharm. Chem. J.(Engl. Transl), том. 24 (1990), стр. 818-822) и 2-(2 бромацетил)-3-метилтиофен (US 5,189,049; ацетил, бромированный бромидом меди (II) согласно процессу King, et al., J. Org. Chem., Том. 29 Названное соединение получают аналогично описанному в примере С(1). 6-Изотиоцианат 1 Н-бензимидазол (см. Boev et al., Pharm. Chem. J. Названное соединение получают аналогично методике примера С(1). 3-Пиридилизотиоцианат и 2-бром-2',4'-диметилацетофенон обеспечивают получение с 63% выходом желтого порошка, т. пл. 200-202 С. Названное соединение получают, по существу, как описано в примере С(1). 3-Цианофенилизотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению оранжевого твердого вещества с 94% выходом, т. пл. 235236 С. 1 Н ЯМР (DMSO-d):8.26 (1 Н, bs), 8.06 Названное соединение получают аналогично примеру С(1). 3-Метоксипропилизотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению желтого твердого вещества с 90% выходом, т. пл. 170-172 С. 1 Н ЯМР (DMSO-ds):8.02-7.92 (2 Н, m), 7.4 Названное соединение получают аналогично примеру С(1). 4-Ацетилфенилизотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению желтого твердого вещества с 87% выходом,т. пл. 264-265 С. 1 Н ЯМР (DMSO-d6):8.06 (1 Н, d, J = 8.0 Гц), 7.92 (2 Н, d, J = 9.0 Гц), 7.84-7.78 (1H, m),7.73-7.64 (4H, m), 2.42 (3H, s). Названное соединение получают аналогично описанному в примере С(1). 2-[4-(2-Хлор-5 трифторметил-пиридин-2-илсульфанил)фенил] изотиоцианат и 2-бром-2'-нитроацетофенон приводят к получению оранжевого твердого вещества с 52% выходом, т. пл. 150-152 С. 1 Н ЯМР (DMSO-d6):8.65 (1 Н, bs), 8.38 Названное соединение получают, по существу, как описано в примере С(1). 3 Метоксикарбонилфенилизотиоцианат и 2-бром 2'-метоксиацетофенон образуют твердое вещество цвета слоновой кости с 59% выходом, т. пл. 214-215 С. 1 Н ЯМР (DMSO-d6):10.81 (1 Н, s), 8.127.90 (4 Н, m), 7.62 (1 Н, ddd, J = 7.8, 1.2, 1.2 Гц),7.49 (1H, t, J = 7.9 Гц), 7.39 (1H, ddd, J = 8.7, 8.7,1.7 Гц), 7.25 (1H, dd, J = 7.5, 1.9 Гц), 7.09 (1H, d, J Названное соединение получают аналогично описанному в примере С(1). Продукт из 4 хлорфенилэтилизотиоцианата и 2-бром-2-ме 29 токсиацетофенона экстрагируют с помощью 10% изопропанол/СНСl3. Полученное вещество промывают Et2O с получением твердого вещества цвета слоновой кости с 49% выходом, т. пл. 150-151 С. 1 Н ЯМР (DMSO-d6):8.53 (2 Н, bs), 7.87 Названное соединение получают аналогично описанному в примере С(1). 3-Пиридилизотиоцианат и 2,2',4'-трихлорацетофенон образуют желтое твердое вещество с 39% выходом, т. пл. 209-210 С. 1 Н ЯМР (DMSO-d6):10.95 (1H, s), 8.77 Названное соединение получают аналогично примеру С(1). 3-Пиридилизотиоцианат и 2 бром-2'-метоксиацетофенон образуют грязнобелый/цвет слоновой кости твердое вещество с 67% выходом, т. пл. 245-246 С. 1 Н ЯМР (DMSO-d6):10.80 (1 Н, s), 8.77 Названное соединение получают, по существу, как описано в примере С(1). 3-Пиридилизотиоцианат и 2-бром-2'-ацетонафтон образуют после перекристаллизации из этилового спирта желтое твердое вещество с 12% выходом, т. пл. 242-243 С (разложение). 1 Н ЯМР (DMSO-d6):10.97 (1H, s), 8.82 Названное соединение получают аналогично описанному в примере С(1). 2-Метоксибензилизотиоцианат и 2-бромацетил-5-хлорбензофуран обеспечивают получение с 62% выходом желтого порошка, т. пл. 241-242 С. 1 Н ЯМР (DMSO-d6):9.17 (1H, bs), 8.78 Названное соединение получают аналогично описанному в примере С(1). 6-Изотиоцианат 1 Н-бензимидазол (см. Boev et al., Pharm. Chem. J. чение с 72% выходом аморфного желтого порошка, т. пл. 180-185 С (разложение). 1 Н ЯМР (DMSO-d6):12.40 (1 Н, bs), 10.61 Названное соединение получают, по существу, как описано в примере С(1). 2-[4-(2-Хлор-5 трифторметилпиридин-2-илсульфанил)фенил] изотиоцианат и 2-бром-2',6'-дихлор-4'-трифторметилацетофенон приводят к получению оранжевого твердого вещества с 52% выходом, т. пл. 130-132 С. 1 Н ЯМР (DMSO-d6):8.65 (1 Н, bs), 8.38 Названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Boev et al., Pharm. Chem. J.(Engl. Transl.), том. 24 (1990), стр. 818-822) и 2 бром-2',6'-дихлор-4'-трифторметилацетофенон образуют желтое твердое вещество с 56% выходом, которое разлагается при температуре выше 180 С. 1EtOH/H2O и сушки с помощью азеотропа с бензолом, желтого твердого вещества с 46% выходом, т. пл. 294-296 С. 1 Н ЯМР (DMSO-de):8.10 (1 Н, s), 8.05 (2 Н,s), 7.77 (4 Н, dd, J = 9.0, 14.0 Гц). Названное соединение получают аналогично методике примера С(1). 4-Изотиоцианатбензолсульфонамид и 4-(бромацетил)фенилбензоат обеспечивают получение желтого твердого вещества с 77% выходом, т. пл. 300 С. 1 Н ЯМР (DMSO-d6):11.13 (1 Н, s), 8.26 5-Бромацетил-4-метил-1 Н-имидазол, который имеет структурную формулу вначале получают следующим образом. Бром(0,40 мл, 7,77 ммоль) добавляют по каплям к раствору 5-ацетил-4-метил-1H-имидазола (964 мг,7,77 ммоль; LaMattina et al, J. Org. Chem., том. 48(1983), стр. 897-898) в НОАс (20 мл). Через два дня НОАс удаляют в вакууме и остаток расслаивают с помощью СН 2 Сl2 и насыщенного водного раствора NaHCO3. Органический слой промывают рассолом, сушат над Na2SO4 и упаривают с получением светло-коричневого твердого вещества, 625 мг (40% выход), которое используют без дополнительной очистки. 1 Н ЯМР (DMSO-d6):12.65 (1 Н, bs), 7.67(1 Н, s), 4.62 (2H, s), 2.44 (3H, s). Названное соединение получают аналогично примеру С(1). 4-Метоксифенилизотиоцианат и 5-бромацетил-4-метил-1H-имидазол обеспечивают получение желтого порошка с 57% выходом, т. пл. 248-50 С. 1 Н ЯМР (DMSO-d6):12.28 (1 Н, bs), 10.21 1-(4-Изотиоцианатфенил)-1H-имидазол, который имеет структурную формулу вначале получают следующим образом. К раствору 1-(4-аминофенил)-1H-имидазола (1,00 г,6,30 ммоль; Venuti et al, J. Med. Chem., том. 31(1988), стр. 2136-2145) в ацетоне (10 мл) при 0 С одновременно добавляют раствор тиофосгена(580 мкл, 7 ммоль) в ацетоне (15 мл) и раствор 25% водного Na2CO3 (15 мл). Смесь перемешивают при 0 С в течение 0,5 ч и оставляют нагреваться до комнатной температуры в течение более 1,5 ч. Ацетон удаляют при пониженном давлении и остаток разбавляют водой. Осадок кремового цвета отфильтровывают, промывают водой и сушат в высоком вакууме с получением 1,20 г (95% выход сырого продукта) светлого спрессованного твердого вещества, которое используют в дальнейшем без очистки. Н ЯМР (DMSO-d6):8.33 (1 Н, s), 7.81 (1 Н,s), 7.76 (2 Н, d, J = 8.8 Гц), 7.61 (2 Н, d, J = 8.8 Гц),7.12 (1 Н, s). Названное соединение получают аналогично описанному в примере С(1). 1-(4-Изотиоцианатфенил)-1 Н-имидазол и 2-бром-2',4'-диметилацетофенон обеспечивают получение желтого твердого вещества с 14% выходом, т. пл. 180,0180,5 С. 1 Названное соединение получают аналогично методике примера С(1). 1-(4-Изотиоцианатфенил)-1 Н-имидазол (из примера С(41 и 2-бромацетил-3-метилтиофен (из примера С(19 обеспечивают получение желтого твердого вещества с 83% выходом т. пл.300 С. 1 Н ЯМР (DMSO-d6):10.98 (1 Н, s), 8.25 Названное соединение получают аналогично примеру С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Boev et al., Pharm. Chem. J.(Engl. Transl.), том. 24 (1990), стр. 818-822) и 2 хлорацетил-N-метилпиррол (Croce et al., Synthesis (1990), стр. 212-213) обеспечивают получение желтого твердого вещества с 42% выходом, т. пл. 284-285 С. 1 Н ЯМР (DMSO-d6):12.43 (1H, bs), 10.65 Названное соединение получают, по существу, как описано в примере С(1). 4-Ацетилфенилизотиоцианат и 2-бромацетил-3 метилтиофен (из примера С(19 образуют желтое твердое вещество с 89% выходом, т. пл. 1712 С. 1 Н ЯМР (DMSO-d6):11.14 (1 Н, s), 8.22 Названное соединение получают, по существу, как описано в примере С(1). Продукт из 4 изотиоцианатбензоил-DL-гомосерин лактона и 2 бромацетил-3-метилтиофена (из примера С(19 экстрагируют в 10% изопропанол/СНСl3. После колоночной (Flash) ФЛЭШ хроматографии со ступенчатым градиентом 2-3-4-5-6% МеОН/СН 2 Сl2 получают желтое твердое вещество с 43% выходом, т. пл. 162-3 С. 1 Н ЯМР (DMSO-d6):11.05 (1H, s), 8.88 Названное соединение получают, по существу, как описано в примере С(1). Продукт из этил dl-3-изотиоцианатбутирата и 2-бромацетил-3-метилтиофена (из примера С(19 экстрагируют с 10% изопропанол/СНСl3. После колоночной ФЛЭШ хроматографии с 3% метанол/СН 2 Сl2 получают желтое твердое вещество с 45% выходом, т. пл. 129-30 С. 1 Н ЯМР (DMSO-d6):8.61 (1 Н, d, J = 7.8 Гц), 8.08 (2 Н, bs), 7.53 (1 Н, d, J = 5.0 Гц), 6.94 5-Бромацетил-4-метилтиазол, который имеет структурную формулу получают как описано в Sych et al., J. Gen. Chem.USSR, том. 32 (1962), стр. 970-975. Бром (0,75 мл, 7,77 ммоль), добавляют по каплям в раствор 1-(4-метилтиазол-5-ил)этанона (2,05 мг, 14,5 ммоль; Ganapathi et al., Proc.-Indian Acad. Sci.Sect. А, том. 22 (1945), стр. 362-378) в HOAc (3 мл). Смесь перемешивают при 85 С в течение 1,5 ч, и она превращается в желтую лепешку. Добавляют НОАс (3 мл) и после 1,5 ч оставляют охлаждаться. НОАс удаляют в вакууме и остаток распределяют между СН 2 Сl2 и насыщенным водным раствором NaHCO3. Органический слой промывают рассолом, сушат над Na2SO4 и упаривают с образованием черного твердого вещества, 1,3 г (41% выход), который используют в дальнейшем без очистки. 1 Н ЯМР (DMSO-d6):8.85 (1 Н, s), 4.28 (2 Н,s), 2.81 (3H, s). Названное соединение получают аналогично описанному в примере С(1). 4-Изотиоциа 38 натбензолсульфонамид и 5-бромацетил-4 метилтиазол обеспечивают получение коричневого твердого вещества с 31% выходом, т. пл. 265-266 С. 1 Н ЯМР (DMSO-d6):11.18 (1 Н, s), 9.08 Названное соединение получают аналогично примеру С(1). 4-Изотиоцианатбензолсульфонамид и 2-бромацетил-3-метилтиофен(из примера С(19 обеспечивают получение желтого твердого вещества с 69% выходом, т. пл. 284,5-286,0 С. 1 Н ЯМР (DMSO-d6):11.11 (1H, s), 8.20 Названное соединение получают аналогично примеру С(1). 4-Изотиоцианатбензолсульфонамид и 2-(2-бромацетил)-3-метилбензо[b]тиофен обеспечивают получение желтого порошка с 73% выходом, т. пл. 274,0-275,5 С. 1 Н ЯМР (DMSO-d6):11.17 (1 Н, bs), 8.33 3-Бромацетил-2,5-диметилтиофен, который имеет следующую формулу: получают аналогично 2-бром-2'-иодацетофенону в примере С(12). 3-Ацетил-2,5-диметилтиофен (6,83 г, 44,3 ммоль) обеспечивает получение 10,1 г (98% выход) желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.22 (1 Н, s), 4.64 (2 Н, s),2.58 (3H, s), 2.36 (3H, s). Названное соединение получают аналогично примеру С(1). 4-Изотиоцианатбензолсульфонамид и 3-бромацетил-2,5-диметилтиофен обеспечивают получение желтого порошка с 69% выходом, т. пл. 263-5 С. 1 Названное соединение получают, по существу, как описано в примере С(1). 4-Изотиоцианатбензолсульфонамид и 6-(бромацетил)-2 оксо-1,2,3,4-тетрагидрохинолин образуют серожелтое твердое вещество с 48% выходом, т. пл. 300-305 С (разл). 1 Н ЯМР (DMSO-d6):11.08 (1H, s), 10.32 получают следующим образом. К 2,6-дихлорацетофенону (1,0 г, 5,30 ммоль) в НОАс (5 мл) добавляют по каплям бром (272 мкл, 5,30 ммоль). Смесь нагревают при 90 С 1 ч, затем разбавляют ледяной водой и расслаивают между простым эфиром и насыщенным водным раствором NaHCO3. Органический слой промывают рассолом, сушат над MgSO4, концентрируют и перегоняют в виде азеотропа с гептаном дважды с образованием 1,41 г (100% выход) светложелтого масла, которое характеризуют с помощью 1 Н ЯМР и ИК ранее описанному (см. Miotkowska et al., Pol. J. Chem., том. 55 (1981), стр. 631-642) и используемому без дополнительной очистки. 1 Н ЯМР (CDC13):7.39-7.33 (3H, m), 4.23(2 Н, s). Названное соединение получают аналогично примеру С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Boev et al., Pharm. Chem. J.(Engl. Tranl.), том. 24 (1990), стр. 818-822) и 2 бром-2',6'-дихлорацетофенон (из примера С(52 обеспечивают получение желтого твердого вещества с 47% выходом, т. пл. 203-208 С. 1 Н ЯМР (DMSO-d6):12.47 (1 Н, d, J = 17.7 Гц), 10.83 (1 Н, d, J = 16.5 Гц), 8.22-7.80 (3H, m),8.18 (1H, s), 7.76-7.36 (5H, m), 7.19 (1H, d, J = 8.4 Гц). Анализ. Вычислено для C17H12N5OSCl2: С, 50.51; Н, 2.74; N, 17.32; S, 7.93; Cl, 17.54. Найдено: С, 50.32; Н, 2.78; N, 17.11; S, 7.91; Сl, 17.75. Пример С(53). 4-Амино-2-[4-(1 Н-имидазол-2-ил)фениламино]тиазол-5-ил-(2,6-дихлор 4-трифторметилфенил)метанон вначале получают следующим образом. К раствору 2-фенилимидазола (5,00 г, 34,7 ммоль) в конц. H2SO4 (20 мл) при 0 С добавляют раствор конц. HNO3 (2,2 мл, 35 ммоль) в конц. Н 2SO4 (5 мл). Полученную смесь коричневого цвета перемешивают при 0 С в течение 2 ч и захолаживают с помощью колотого льда. Образовавшееся бледно-желтое твердое вещество отфильтровывают. Фильтрат доводят до рН 9 с помощью 2NNaOH. Образовавшееся желтое вещество отфильтровывают, промывают Н 2O и перекристаллизовывают из кипящего метанола с образованием 3,0 г (46% выход) желтого твердого вещества. Твердый продукт используют в дальнейшем без очистки. 1H ЯМР (MeOH-d4):8.34 (2 Н, d. J = 9.0 Гц), 8.08 (2 Н, d, J = 9.0 Гц), 7.26 (2H, s). 4-(1H-Имидазол-2-ил) анилин, который имеет структурную формулу получают следующим образом. К суспензии 2-(4 нитрофенил)-1 Н-имидазола (1,5 г, 7,93 ммоль) в абсолютном этаноле (30 мл) добавляют 10% PdC (250 мг). Полученную смесь перемешивают в атмосфере Н 2 в течение 5 ч. Смесь фильтруют через подушку из Целита . Фильтрат концентрируют при пониженном давлении с получением 1,20 г (95% выход в сыром виде) красной смолы,которую используют без дополнительной очистки. 2-(4-Изотиоцианатфенил)-1 Н-имидазол, который имеет структурную формулу получают аналогично 1-(4-изотиоцианатфенил)1 Н-имидазолу, описанному в примере С(41). 4(1 Н-Имидазол-2-ил)анилин образует бледнокоричневое твердое вещество, который перекристаллизовывают из СНСl3 с 85% выходом, который в дальнейшем используют без очистки. 1 Н ЯМР (MeOH-d4): S 7.88 (4 Н, bd, J = 7.8 Гц), 7.58 (2 Н, s). Названное соединение получают аналогично описанному в примере С(1). 2-(4-Изотиоцианатфенил)-1 Н-имидазол и 2-бром-2',6'дихлор-4'-трифторметилацетофенон образуют после очистки с помощью препаративной тонкослойной хроматографии с МеОН:СНСl3 (8:92) в качестве элюента желтое твердое вещество с 21% выходом, т. пл. 195-197 С. 1 Н ЯМР (DMSO-d6):11.0 (1 Н, s), 8.18 (1 Н,s), 8.02 (2 Н, s), 7.88 (2 Н, d, J = 8.7 Гц), 7.62 (2H, d,J=8.1 Гц), 7.12 (2 Н, bs). ИК (KВr): 3400, 2929, 1610, 1527, 1426,1310 см-1. 4-(4-Изотиоцианатфенил)морфолин, который имеет следующую структурную формулу получают следующим образом. К 4-морфолинанилину (2,0 г, 11,2 ммоль) и триэтиламину (5,01 мл, 35,9 ммоль) в ТГФ (200 мл) при 0 С добавляют по каплям тиофосген (1,03 мл, 13,5 ммоль). Смесь перемешивают при комнатной температуре в течение ночи и затем разделяют между простым эфиром и водой. Эфирный слой промывают водой и рассолом, сушат над MgSO4 и концентрируют с образованием 2,46 г (99%) темно-коричневого твердого вещества. 1 Н ЯМР (CDCl3):7.15 (2 Н, d, J = 9.3 Гц),6.87 (2 Н, d, J = 9.3 Гц), 3.80 (4 Н, t, J = 5.0 Гц),3.19 (4H, t, J=5.0 Гц). Названное соединение получают аналогично примеру С(1). 4-(4-Изотиоцианатфенил)морфолин и 2-бром-2',4-диметилацетофенон обеспечивают получение желтого твердого вещества с 28% выходом, т. пл. 253-254,5 С. 1 Н ЯМР (DMSO-d6):10.44 (1 Н, s), 7.98 Названное соединение получают аналогично примеру С(1). 4-(4-Изотиоцианатфенил)морфолин (из примера С(54 и 2-бром-2',6'дихлорацетофенон (из примера С(52 обеспечивают получение желтого твердого вещества с 9% выходом, т. пл. 245-247 С. 1 Н ЯМР (DMSO-d6):10.58 (1H, s), 8.02 Названное соединение получают аналогично примеру С(1). 4-Этоксикарбонилфенилизотиоцианат и 2-бром-2',6'-дихлорацетофенон(из примера С(52 обеспечивают получение аморфного желтого твердого вещества с 48% выходом. 1 Н ЯМР (DMSO-d6):11.13 (1 Н, s), 8.15 2-Бром-2',4',6'-триметилацетофенон, который имеет следующую структурную формулу: получают аналогично 2-бром-2'-иодацетофенону, см. пример С(12). 2,4,6-Триметилацетофенон (1,50 г, 9,25 ммоль) обеспечивает получение 2,26 г (100%) бесцветного масла, которое используют в дальнейшем без очистки. 1 Н ЯМР (CDCl3):6.87 (2 Н, s), 4.27 (2 Н, s),2.22 (9 Н, s ). Названное соединение получают аналогично примеру С(1). 6-Изотиоцианат-1 Н-бензимидазол (см. Воеу et al., Pharm. Chem. J. (Engl.Transl.), том. 24 (1990), стр. 818-822) и 2-бром 2',4',6'-триметилацетофенон обеспечивают получение желтого порошка с 26% выходом, который разлагается при температуре выше 185 С. 1 Н ЯМР (DMSO-d6):12.42 (1 Н, bs), 10.66 кото получают аналогично методике получения 2 бром-2'-иодацетофенона по примеру С(12). 2',3',6'-Триметилацетофенон (1,50 г, 9,25 ммоль) обеспечивает получение 2,10 г (93% выход) прозрачного масла, которое используют без дополнительной очистки. Названное соединение получают аналогично примеру С(1). 6-Изотиоцианат-1 Н-бензимидазол (см. Boev et al., Pharm. Chem. J. (Engl.Transl.), том. 24 (1990), стр. 818-822) и 2-бром 2',3',6'-триметилацетофенон обеспечивают получение желтого порошка с 70% выходом, который разлагается при температуре выше 196 С. 1 Н ЯМР (DMSO-d6):12.41 (1 Н, bs), 10.65 4-(Бромацетил)-3,5-диметилпиридин бромгидрат, который имеет следующую структурную формулу:al., Can. J. Chem., том. 41 (1963), стр. 695-702) растворяют в 30% НВr в уксусной кислоте (1 мл), нагревают до 70 С и обрабатывают смесью брома (0,17 мл, 3,36 ммоль) в 30% НВr в уксусной кислоте (0,5 мл). Через 2 ч смеси позволяют охладиться до комнатной температуры и добавляют простой эфир (8 мл). Полученный осадок отфильтровывают,промывают простым эфиром (2 х) и сушат, что позволяет получить 1,03 г (100%) твердого вещества, т. пл. 222-225 С, которое используют в дальнейшем без очистки. Названное соединение получают, по существу, как описано в примере С(1). 4-Изотиоцианатбензолсульфонамид и 4-(бромацетил)-3,5 диметилпиридин бромгидрат обеспечивают получение рыжевато-коричневого твердого вещества, которое очищают с помощью колоночной хроматографии с 10% МеОН/СНСl3 и кристаллизуют из метанола с получением 35 мг (51%) аморфного твердого вещества желтого цвета. 1 Н ЯМР (DMSO-d6):11.09 (1H, s), 8.32 2',6'-Диметилацетофенон, который имеет структурную формулу получают согласно методике получения онитроацетофенона (Reynolds et al, Orr. Syn. Coil.,том. TV (1963), стр. 708-710). 2,6-Диметилбензойная кислота (3,00 г, 20,0 ммоль) позволяет получить 2,56 г (86% выход) желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.16 (1H, t, J = 7.2 Гц),7.02 (2 Н. d, J = 7.2 Гц), 2.48 (3H, s), 2.25 (6 Н, s). 2-Бром-2',6'-диметилацетофенон, который имеет следующую формулу: получают аналогично получению 2-бром-2-иодацетофенона, см. пример С(12). 2',6'-Диметилацетофенон (1,50 г, 10,1 ммоль) обеспечивает получение 2,04 г (89% выход) прозрачного масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.21 (1H, t, J = 7.2 Гц),7.05 (2 Н, t, J = 7.2 Гц), 4.29 (2 Н, s), 2.26 (6 Н, s) Названное соединение получают аналогично методике, использованной в примере С(1). 6 46 Изотиоцианат-1 Н-бензимидазол (см. Boev et at.,Pharm. Chem. J. (Engl. Transl.), том. 24 (1990),стр. 818-822) и 2-бром-2',6'-диметилацетофенон обеспечивают получение твердого вещества желтого цвета с выходом 71%, разлагается при температуре выше 185 С. 1 Н ЯМР(DMSO-d6):12.41 (1H, bs), 10.67 2'-Метил-6'-нитроацетофенон,который имеет следующую структурную формулу: получают аналогично процессу получения онитроацетофенона (см. Reynolds et al., Org. Syn.Coll., том. IV, (1963), стр. 708-710). 2-Метил-6 нитробензойная кислота (15,0 г, 82,8 ммоль) обеспечивает получение 14,7 г (99% выход) желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):8.04 (1 Н, d, J = 8.4 Гц),7.55 (1H, d, J = 7.5 Гц), 7.44 (1H, dd, J = 8.4, 7.5 Гц), 2.56 (3H, s), 2.35 (3H, s). 2-Бром-2'-метил-6'-нитроацетофенон, который имеет следующую структурную формулу: получают аналогично получению 5-бромацетил 4-метил-1 Н-имидазола в примере С(40). Сырой 2'-метил-6'-нитроацетофенон (1,56 г, 8,72 мл) приводит к получению вещества белого цвета,2,17 г (97% выход), которое использовали без дополнительной очистки. 1 Н ЯМР (CDCl3:8.11 (1 Н, d. J = 7.8 Гц), 7.62(2 Н, s), 2.40 (3H, s). Названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Boev et al., Pharm. Chem. J. получение твердого вещества коричневого цвета с 32% выходом, т. пл. 198-201 С. 1 Н ЯМР (DMSO-d6):12.40 (1H, bs), 10.78 Названное соединение получают аналогично методике примера С(1). 4-(4-Изотиоцианатфенил)морфолин (из примера С(54 и 2 бром-2',6'-диметилацетофенон(из примера С(60 обеспечивают получение коричневого твердого вещества с 23% выходом, т. пл. 221223 С. 1 Н ЯМР (DMSO-d6):10.42 (1 Н, s), 7.95 4-Бромацетил-3,5-дихлорпиридин, который имеет следующую структурную формулу: вначале получают следующим образом. Смесь 3,5-дихлорпиридин-4-карбоновой кислоты (4,00 г, 20,9 ммоль; Cale et al., J. Med. Chem., том. 32(0,4 мл) и тионилхлорида (3,80 мл, 52,0 ммоль) нагревают с обратным холодильником в течение 60 мин, оставляют охаждаться до комнатной температуры, концентрируют в вакууме, суспендируют в простом эфире (20 мл) и осторожно обрабатывают раствором триметилсилилдиазометана (25 мл 2.0 М в гексане). Через 72 ч осто 48 рожно по каплям добавляют 48% НВr (18 мл) в течение более 20 мин, первоначально с энергичным выделением газа. Через 30 мин смесь осторожно подщелачивают с помощью NaHCO3 и экстрагируют простым эфиром. Эфирные вытяжки сушат над Na2SO4 и упаривают с образованием масла оранжевого цвета, которое очищают с помощью колоночной хроматографии с элюатом 50% СН 2 Сl2/гексан для отделения 2,50 г(51 %) 3,5-дихлорпиридин-4-карбонилхлорида в виде желтого масла, приводящего к получению желаемого продукта, 2,00 г (36%) в виде бледножелтых кристаллов, которые темнеют при комнатной температуре, и которые используют без дополнительной очистки. 1 Н ЯМР (CDCl3):8.58 (2 Н, s), 4.37 (2 Н, s). Анализ. Вычислено C7H4BrCl2NO0.02 С 6 Н 14: С, 31.60; Н, 1.59; N, 5.18. Найдено: С, 31.92; Н,1.59; N, 5.24. Названное соединение получают, по существу, аналогично описанному в примере С(1). 6 Изотиоцианат-1 Н-бензимидазол (см. Boev et al.,Pharm. Chem. J. (Engl. Transl.), том. 24(1990), стр. 818-822) и 4-(бромацетил)-3,5-дихлорпиридин образуют продукт, который после экстракции в 10% МеОН/СНСl3 и колоночной хроматографии с тем же элюентом дают желтое аморфное вещество, 198 мг (55%). Аналитический образец осаждают из этанола, т. пл. 235-240 (разложение). 1 Н ЯМР (CD3OD):8.60 (2 Н, s), 8.18 (1H,s), 7.98 (1H, bs), 7.58 (1H, d, J = 9.0 Гц), 7.30 (1H,dd, J= 1.2, 8.7 Гц). ИК (KВr): 3183, 1608, 1544, 1461, 1427,1355 см-1. 2S-Бромацетил-N-карбобензилоксипирролидин, который имеет следующую структурную формулу: вначале получают следующим образом. Хлорангидрид N-карбобензилокси-L-пролина (1,20 г,4,80 ммоль) был получен по методике Aoyama et личества ДМФА. К раствору сырого хлорангидрида кислоты в ТГФ (5 мл) и CH3CN (5 мл) при 0 С осторожно по каплям добавляют раствор триметилсилилдиазометана (5,0 мл 2,0 М в гексане), что вначале сопровождается бурным выделением газа. Полученную суспензию красного цвета оставляют нагреваться при перемешивании при комнатной температуре в течение ночи. Коричневую смесь охлаждают до 0 С, и осторожно обрабатывают смесью 47% НВr (4,1 мл) и простого эфира (10 мл), при этом вначале наблюдается энергичное выделение газа. Смесь оставляют нагреваться до комнатной температуры в течение более часа, после чего подщелачивают насыщенным водным раствором NaHCO3 (20 мл) и экстрагируют этилацетатом (2 х 20 мл). Объединенные органические слои сушат над Na2SO4 и упаривают с образованием коричневого масла,1,57 г (100%), которое используют без дальнейшей очистки. ЯМР (CDCl3)7.44-7.24 (5 Н, m), 4.34 (1H,d, J = 15.6 Гц), 4.27 (1H, d, J = 15.6 Гц). Названное соединение получают, по существу, так, как описано в примере С(1). 6-Изотиоцианат-1 Н-бензимидазол (см. Boev et al., Pharm.Chem. J. (Engl. Transl.), том. 24 (1990), стр. 818822) и 2S-бромацетил-N-карбобензилоксипирролидин обеспечивают получение твердого вещества, которое дважды высаживают из изопропанола/гексана с получением желтого аморфного вещества, 154 мг (54%), т.пл. 150-165 Названное соединение получают, по существу, аналогично тому, как описано в примере С(1). 4-Изотиоцианатбензолсульфонамид и 2Sбромацетил-N-карбобензилоксипирролидин (см. пример С(64 обеспечивают получение твердого вещества, которое очищают с помощью колоночной хроматографии с элюентом 5% СН 3 ОН/СНСl3 с получением аморфного вещест 50 2'-Бром-6'-метилацетофенон, который имеет следующую структурную формулу: получают аналогично методике получения онитроацетофенона (см Reynolds et al., Org. Syn. Соll, том. IV (1963), стр. 708-710). Из 2-метил-6 бромбензойной кислоты (3,10 г, 14,4 ммоль) получают 2,45 г (80%) желтого масла, которое соответствует ранее охарактеризованному с помощью 1 Н ЯМР продукту (Swenton et al., J. Org.Chem., том. 58 (1993), стр. 3308-3316) и который используют без дополнительной очистки. 2,2'-Дибром-6'-метилацетофенон, который имеет следующую cтруктурную формулу: получают аналогично методике получения 2 бром-2'-иодацетофенона, см. пример С(12). Сырой 2'-бром-6'-метилацетофенон (1,00 г, 4,69 ммоль) обеспечивает получение 1,48 г желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.44-7.37 (1 Н, m), 7.217.17 (2 Н, m), 4.42 (2 Н, s), 2.31 (3H, s). Названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Нбензимидазол (см. Воеv et al., Pharm. Chem. J.(Engl Transl.), том. 24 (1990), стр. 818-822) и 2,2'дибром-6'-метилацетофенон обеспечивают получение коричневого твердого вещества с выходом 32%, т. пл. 208-210 С. 1 Н ЯМР (DMSO-d6):12.43 (1 Н, bs), 10.74 1-(3-Метилбифенил-2-ил)-этанон, который имеет следующую структурную формулу: получают следующим образом. К 2'-бром-6'метилацетофенону (из примера С(66); 760 мг,3,58 ммоль) и Pd(OAc)2 (114 мг) в ДМФА (38 мл) при 0 С в атмосфере аргона добавляют последовательно фенилборную кислоту (495 мг) и 2 М водного Nа 2 СО 3 (1,6 мл). Смесь нагревают 3 ч при 90 С, затем разбавляют водой (50 мл) и экстрагируют простым эфиром (2 х 100 мл). Эфирные экстракты концентрируют с образованием сырого остатка, который очищают с помощью колоночной хроматографии с 2-5% ступенчатым градиентом простой эфир/гексан с получением 670 мг (89% выход) желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.44-7.31 (5 Н, m), 7.257.19 (2 Н, m), 7.16-7.09 (1 Н, m), 2.33 (3H, s), 1.93(3H, s). 2-Бромацетил-3-метилбифенил,который имеет следующую структурную формулу: получают аналогично методике получения 2 бром-2'-иодацетофенона, см. пример С(12). Сырой 1-(3-метилбифенил-2-ил)этанон (295 мг, 1,40 ммоль) обеспечивает получение 413 мг желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.48-7.18 (8 Н, m), 4.42(2 Н, s), 2.38 (3H, s). Названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Нбензимидазол (cM. Boev et al., Pharm. Chem. J.(Engl. Transl.), том. 24 (1990), стр. 818-822) и 2 бромацетил-3-метилбифенил обеспечивают получение твердого вещества желтого цвета с выходом 49%, т. пл. 184-190 С. 1 Н ЯМР (DMSO-d6):8.13 (1 Н, s), 7.87 (1 Н,s), 7.53 (1 Н, d, J = 8.7 Гц), 7.46-7.39 (2H, m), 7.387.15 (7H, m ), 2.35 (3H, s). Названное соединение получают аналогично описанному в примере С(1). 3-Бром-ацетил 2,5-диметилтиофен (из примера С(52 и 1-(2 изотиоцианатэтил)-4-метоксибензол обеспечивают получение твердого вещества белого цвета с выходом 72%, т. пл. 175 С. 1 Н ЯМР (DMSO-d6):6.88 (2 Н, d, J = 8.7 Гц), 6.74 (2H, d, J = 8.7 Гц), 6.41 (1H, s), 6.24 (1H,s), 4.88 (2H, s), 3.78 (3H, s), 2.40 (3H, s), 1.98 (3H,s). ИК (КВr): 3311, 2920, 1663, 1552, 1514,1244 см-1. Названное соединение получают аналогично методике примера С(1). 4-(4-Изотиоцианатфенил)морфолин(из примера С(54 и 4-бромацетил-3,5-дихлорпиридин (из примера С(63 обеспечивают получение желтого твердого вещества с выходом 58%, т. пл. 291,5-292,5 С. 1 Н ЯМР (DMSO-d6):10.75 (1 Н, s), 8.71 1-Метил-4-(4-нитрофенил)пиперазин, который имеет следующую структурную формулу: вначале получают следующим образом. Смесь 1 метилпиперазина (4,00 г, 39,9 ммоль) и 1-хлор-4 нитробензола (3,14 г, 20,0 ммоль) нагревают при 80 С в течение 24 ч, оставляют охлаждаться и разбавляют Н 2 О. Водный слой экстрагируют с помощью СН 3 ОН:СН 2 Сl2 (20:80; 4 х 50 мл). Объединенные органические слои сушат над MgSO4,фильтруют, концентрируют при пониженном давлении и перекристаллизовывают из этанола с образованием 3,2 г (75% выход) желтого твердого вещества, которое соответствует ранее охарактеризованному с помощью 1 Н ЯМР продукту(de Silva et al., J. Chem. Soc. Perkin Trans. 2, том. 9 (1993), стр. 1611-1616) и которое используют без дополнительной очистки. 4-(4-Метилпиперазин-1-ил)анилин,который имеет следующую структурную формулу: получают следующим образом. К суспензии 1 метил-4-(4-нитрофенил) пиперазина (2 г, 9,02 ммоль) в абсолютном этаноле (30 мл) добавляют 10% Pd-C (250 мг). Полученную смесь перемешивают в атмосфере Н 2 5 ч, затем фильтруют через подушку из Целита. Фильтрат концентрируют при пониженном давлении с получением 1,7 г (99% выход) твердого вещества коричневого цвета, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):6.81 (2 Н, d, J = 8.8 Гц),6.62 (2 Н, d, J = 8.8 Гц), 3.42 (2 Н, bs), 3.15 (4 Н, t, J= 5.0 Гц), 2.68 (4H, t, J = 5.0 Гц), 2.40 (3H, s). 1-(4-Изотиоцианатфенил)-4-метилпиперазин, который имеет следующую структурную формулу: получают аналогично методике получения 1-(4 изотиоцианат-фенил)-1 Н-имидазола в примере С(41). 4-(4-Метилпиперазин-1-ил)анилин обеспечивает получение 1,7 г (83% выход) окрашенного в кремовый цвет твердого вещества, т. пл. 118-120 С (лит. 120-122 С, Galstuckova et al., J.Org. Chem. USSR (Engl. Transl.), том. 5 (1969),стр. 1121-1124), которое используют без дальнейшей очистки. ИК спектр показал by Martvon С, 61.77; Н, 6.48; N, 18.01; S, 13.69. Найдено: С, 61.51; Н, 6.56;N, 17.86; S, 13.69. Названное соединение получают аналогично описанному в примере С(1). 1-(4-Изотиоцианатфенил)-4-метилпиперазин и 4-бромацетил-3,5-дихлорпиридин (из примера С(63 образуют сырой твердый остаток, после перекристаллизации которого из этанола/воды получают 40 мг (23% выход) твердого вещества бледнокоричневого цвета, т. пл. 150-151 С. 1 Н ЯМР (DMSO-d6):10.78 (1H, s), 8.70 Названное соединение получают аналогично описанному в примере С(1). 1-(4-Изотиоцианатфенил)-4-метилпиперазин (из примера С(70 и 2-бром-2',6'-дихлорацетофенон (из примера С(52 образуют после перекристаллизации из H2O/EtOH/CH2Cl2, 2,2 г (64% выход) твердого вещества желтого цвета, т. пл. 160-162 С. 1 Н ЯМР (DMSO-d6):10.60 (1 Н, s), 8.00 2-Ацетил-3,5-дибромтиофен, который имеет следующую структурную формулу: вначале получают следующим образом. К раствору 2,4-дибромтиофена (2,0 г, 8,27 ммоль) и ацетилхлорида (0,82 мл, 11,6 ммоль) в простом эфире (3 мл) добавляют порциями АlСl3 (1,5 г,11,2 ммоль). Через 4 ч добавляют другую порцию ацетилхлорида и АlСl3 смесь нагревают с обратным холодильником в течение 1 ч и оставляют охлаждаться. Реакционную массу осторожно захолаживают с помощью льда и экстрагируют простым эфиром. Эфирные слои обесцвечивают с помощью активированного угля и сушат над MgSO4, пропускают через подушку из селикагеля и концентрируют с образованием 1.8 гChem., том. 18 (1981), стр. 1345-1347, и которое используют без дополнительной идентификации. 2-Бромацетил-3,5-дибромтиофен, который имеет следующую структурную формулу: Названное соединение получают аналогично методике, использованной в примере С(1). 4 Изотиоцианатбензолсульфонамид и 2-бромацетил-3,5-дибромтиофен (из примера С(72 обеспечивают получение желтого порошка с 41 % выходом, т.пл. 254-255 С. 1 Н ЯМР (DMSO-d6):11.24 (1 Н, s), 8.31 1,5-Диметил-1 Н-имидазол-4-карбоновую кислоту, которая имеет структурную формулу получают аналогично методике получения 2 бром-2'-иодацетофенона, см. пример С(12). 2 Ацетил-3,5-дибромтиофен (220 мг, 0,77 ммоль) обеспечивает получение 295 мг темнокоричневого твердого вещества, которое использовали без дополнительной очистки. 1 Н ЯМР (CDCl3):7.13 (1 Н, s), 4.54 (2 Н, s). Наконец, названное соединение получают аналогично методике примера С(1). 6-Изотиоцианат-1 Н-бензимидазол (см. Boev et al., Pharm. впервые получают следующим образом. Свежий раствор NaOH (3.86 г, 96,5 ммоль) в воде (20 мл) добавляют к раствору этил 1,5-диметил-1 Нимидазол-4-карбоксилата (5,39 г, 32,0 ммоль;Ohno et al, Chem. Pharm. Bull., том. 42 (1994), стр. 1463-1473) в этаноле (20 мл). Через 5 ч смесь охлаждают до 0 С и подкисляют с помощью 38%HCl до рН 3-4. Полученное белое твердое вещество отфильтровывают, промывают небольшим количеством холодного этанола-Н 2 О (1:1) и сушат при глубоком вакууме с образованием 3,51 г(78%) белого твердого вещества, которое используют без дополнительной очистки. 1 Н ЯМР (D2O):8.49 (1 Н, s), 3.73 (3H, s),2.46 (3H, s). Анализ. Вычислено для C6H8N2O2: С, 51.42; H, 5.75; N, 19.99. Найдено: С, 51.52; Н, 5.78; N, 19.98. 1,5-Диметил-1 Н-имидазол-4-карбоновая кислота N-метокси-N-метиламид, который имеет структурную формулу ммоль) и диизопропилэтиламин (7,5 мл, 43 ммоль). Через 5 мин к полученному прозрачному раствору добавляют N,0-диметилгидроксиламин хлор гидрата (1,54 г, 15,79 ммоль). Через 1 ч полученный желтый раствор распределяют между СНСl3 и водой. Отделенный органический слой промывают водой и рассолом, сушат над K2 СО 3,концентрируют и сушат при высоком вакууме с получением 1,88 г (72% выход) светлокоричневого твердого вещества, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.36 (1H, s), 3.81 (3H, s),3.56 (3H, s), 3.47 (3H, s), 2.45 (3H, s). 1-(1,5-Диметил-1 Н-имидазол-4-ил)этанон,который имеет структурную формулу получают следующим образом. К раствору сырого 1,5-диметил-1H-имидазол-4-карбоновой кислоты N-метокси-N-метиламида (1,69 г, 9,21 ммоль) в ТГФ (55 мл) при -78 С добавляют по каплям 1,4 М CH3MgBr в эфире (8,55 мл, 12,0 ммоль). Смесь оставляют нагреваться до комнатной температуры более часа, затем захолаживают в HCl, подщелачивают до рН 9 в NaOH,концентрируют при пониженном давлении, чтобы удалить ТГФ, и экстрагируют этилацетатом(200 мл). Органический слой отделяют, сушат над K2 СO3 с получением 1,2 г (94% выход) желтого твердого вещества, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3)7.35 (1 Н, s), 3.57 (3H, s),2.55 (3H, s), 2.53 (3H, s). 2-Бром-1-(1,5-диметил-1 Н-имидазол-4-ил) этанон, который имеет структурную формулу затем получают следующим образом. К 1-(1,5 диметил-1 Н-имидазол-4-ил)этанону (464 мг, 3,36 ммоль) в уксусной кислоте (8,5 мл) при 0 С добавляют по каплям бром (173 мкл, 3,36 ммоль). Через 36 ч при комнатной температуре, сырую соль 2-бром-1-(1,5-диметил-1 Н-имидазол-4-ил) этанон бромгидрата отфильтровывают в виде коричневого твердого вещества, который последовательно промывают минимальным количеством воды и эфира, растворяют в СНСl3; охлаждают до 0 С, обрабатывают NaHCO3 и концентрируют при пониженном давлении при температуре ниже 40 С с получением 719 мг (99% выход) желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (DMSO-d6):8.40 (1 Н, s), 4.68 (2 Н,s), 3.66 (3H, s), 2.67 (3H,s). Названное соединение наконец получают аналогично методике, использованной в примере С(1). 6-Изотиоцианат-1 Н-бензоимидазол (см. впервые получают следующим образом. К раствору 2',6'-дихлор-3'-нитроацетофенона (1,3 г, 5,6 ммоль; Breslin, et al., J. Med. Chem., том. 38(5 мл) при комнатной температуре добавляют бром (352 мкл, 6,83 ммоль). Полученную смесь нагревают до 80 С в течение 1 ч, оставляют охлаждаться, разбавляют эфиром. Органический слой промывают холодной Н 2 О со льдом (25 мл),насыщенным водным раствором NaHCO3 (3 х 25 мл), рассолом (25 мл), сушат над MgSO4 и концентрируют при пониженном давлении с получением 1,7 г (97% выход сырого продукта) желтого масла, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.98 (1H, d, J = 8.7 Гц),7.38 (1 Н, d, J = 8.7 Гц), 4.40 (2H, s). Названное соединение получают аналогично описанному в примере С(1). 2-Бром-2',6'дихлор-3'-нитроацетофенон и 4-(4-изотиоцианатфенил)морфолин (из примера С(54 образуют сырое твердое вещество, которое после очистки с помощью флэш колоночной хроматографии с гексаном/этилацетатом (70:30) в качестве элюента, обеспечивают получение темнокоричневой пены с 52% выходом, т.пл. 170172 С. 1 Н ЯМР (DMSO-d6):10.70 (1H, s), 8.30 Названное соединение получают аналогично методике, использованной в примере С(1). 4 Изотиоцианатбензолсульфонамид и 5-бромацетил-1,5-диметил-1 Н-имидазол (из примера С(74 обеспечивают получение желтого твердого вещества с 8% выходом, т.пл. 293-294 С. 1 Н ЯМР (DMSO-d6):10.80 (1 Н, s), 7.81 Названное соединение получают аналогично методике, использованной в примере С(1). 4(4-Изотиоцианатфенил)морфолин (из примера С(54 и 5-бромацетил-1,5-диметил-1 Н-имидазол(из примера С(74 обеспечивают получение желтого твердого вещества с 12% выходом, т.пл. 300 С. 1 Н ЯМР (DMSO-d6):10.21 (1H, s), 7.57 2-Ацетил-3-метил-5-нитротиофен, который имеет структурную формулу впервые получают следующим образом. 2-Бром 3-метил-5-нитротиофен (5,17 г, 23,3 ммоль;(IV) (8,65 мл, 25,6 ммоль) и дихлорбис(трифенилфосфин) палладий (II) (163 мг, 0,23 ммоль) в толуоле (10,5 мл) нагревают в атмосфере Ar при 100 С в течение 2,5 ч. Добавляют 5% водной HCl (78 мл), смесь перемешивают при 60 С в течение 15 мин, затем распределяют между эфиром и водой. Органический слой отделяют, сушат над MgSO4 и концентрируют до образования остатка, который растворяют в эфире(DBU; 2,2 эквивалента) и 0,1 М раствор иода в эфире добавляют по каплям, пока окрашивание будет устойчивым в течение нескольких секунд. Полученный раствор пропускают через короткую колонку с силикагелем и концентрируют в вакууме с образованием 3,74 г (87% выход) желтого твердого вещества, которое используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.72 (1 Н, s), 2.58 (3H, s),2.57 (3H, s). 2-Бромацетил-3-метил-5-нитротиофен, который имеет структурную формулу получают аналогично методике 2-бром-2'-иодацетофенона, см. пример С(12). 2-Ацетил-3 метил-5-нитротиофен (230 мг, 1,24 ммоль) обеспечивает получение 330 мг мутного масла, которое содержит, как показал спектр ЯМР, следовое количество дибромированного побочного продукта, и который используют без дополнительной очистки. 1 Н ЯМР (CDCl3):7.75 (1H, s), 4.28 (2 Н, s),2.60 (2 Н, s). Названное соединение получают аналогично методике, использованной в примере С(1). 6-Изотиоцианат-1 Н-бензоимидазол(1990), стр. 818-822) и 2-бромацетил-3-метил-5 нитротиофен обеспечивают получение желтого твердого вещества с 23% выходом, т.пл. 300 С. 1 Н ЯМР (DMSO-d6):12.50 (1H, d, J= 14.3 Гц), 11.01 (1H,bs), 8.40 (2H,bs), 8.21 (1H, s), 8.02
МПК / Метки
МПК: C07D 277/42, A61P 35/00, A61K 31/427
Метки: качестве, киназ, замещенные, циклинзависимых, 4-аминотиазолы, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-3527-zameshhennye-4-aminotiazoly-v-kachestve-ingibitorov-ciklinzavisimyh-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 4-аминотиазолы в качестве ингибиторов циклинзависимых киназ</a>
Предыдущий патент: Способ получения изображения подземной формации
Следующий патент: Производные никотинамида, их применение, фармацевтическая композиция, способ лечения и способ ингибирования изоферментов фдэ4 d
Случайный патент: Способ лечения и предупреждения артрита


































