Альфа-замещенные арилсульфонамидогидроксамовые кислоты в качестве ингибиторов tnf-альфа и матричных металлопротеиназ
Формула / Реферат
1. Соединение формулы I
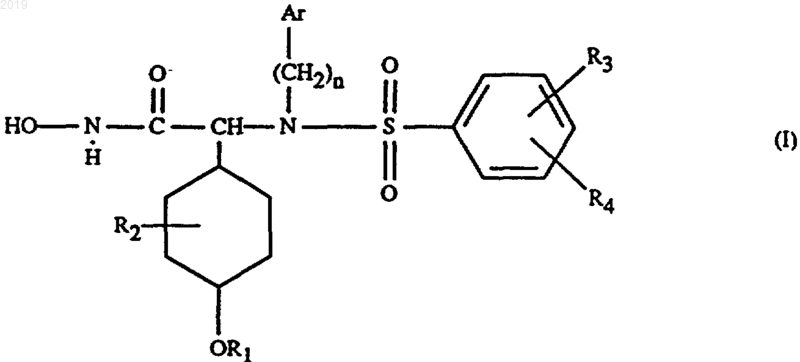
где Аr обозначает пиридил,
R1 обозначает С1-С7алкил, циклоалкил, С1-С7алкокси-С1-С7алкил, фенил, или нафтил, или галоген-С1-С7алкил;
R2 обозначает водород или С1-С7алкил;
R3 и R4 независимо друг от друга обозначают водород, С1-С7алкил, С1-С7алкокси, галоген, гидрокси, ацилокси, С1-С7алкокси-С1-С7алкокси, трифторметил или циано, или R3 и R4 вместе с соседними атомами углерода обозначают С2-С7алкилендиокси, и
n обозначает целое число от 1 до 5,
его фармацевтически приемлемое производное, являющееся пролекарством, или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы III
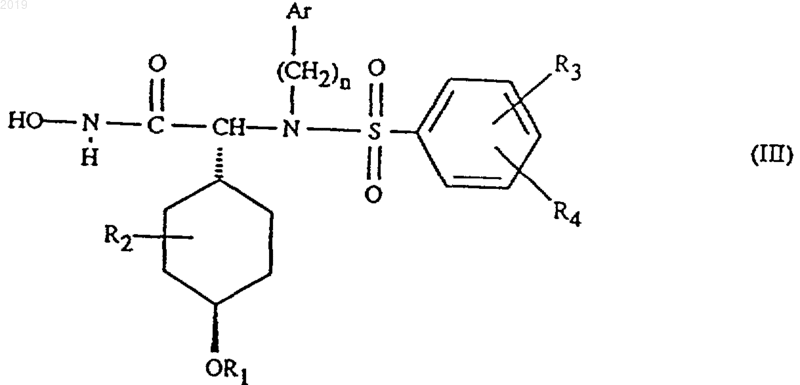
где Аr обозначает пиридил;
R1 обозначает С1-С7алкил, циклоалкил, С1-С7алкокси-С1-С7алкил, фенил или нафтил;
R2 обозначает водород или С1-С7алкил;
R3 обозначает водород или С1-С7алкокси;
R4 обозначает водород или С1-С7алкокси; и
n равно 1 или 2;
его фармацевтически приемлемое производное, являющееся пролекарством, или его фармацевтически приемлемая соль.
3. Соединение по п.2 формулы III, где Аr обозначает пиридил, не обязательно моно- или дизамещенный C1-С6алкилом;
R1 обозначает С1-С6алкил;
R2 обозначает водород;
R3 обозначает пара-С1-С6алкокси;
R4 обозначает водород;
n равно 1 или 2,
или его фармацевтически приемлемая соль.
4. Соединение по п.2 формулы III, в которой Аr обозначает 3- или 4-пиридил;
R1 обозначает С2-С5алкил с прямой цепью;
R2 и R4 обозначают водород;
R3 обозначает пара-С1-С6алкоксил, а
n равно 1,
или его фармацевтически приемлемая соль.
5. Соединение по п.2, которое представляет собой N-гидрокси-2(R)-[(4-этоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-пропоксициклогексил)ацетамид, или его фармацевтически приемлемая соль.
Текст
1 Настоящее изобретение относится к этерифицированным циклогексил- и арилсульфонамидозамещенным гидроксамовым кислотам формулы IR2 обозначает водород или С 1-С 7 алкил;R3 и R4 независимо друг от друга обозначают водород, С 1-С 7 алкил, С 1-С 7 алкокси, галоген, гидрокси, ацилокси, С 1-С 7 алкокси-С 1 С 7 алкокси, трифторметил или циано; или R3 иR4 вместе с соседними атомами углерода обозначают С 2-С 7 алкилендиокси;n обозначает целое число от 1 до 5; к их фармацевтически приемлемым производным, которые являются пролекарством, и к их фармацевтически приемлемым солям. В изобретении также приведен способ получения этих соединений, фармацевтические композиции, содержащие эти соединения, и применение этих соединений для терапевтического лечения человека или животного или для изготовления фармацевтической композиции. Соединения по изобретению в зависимости от природы заместителей имеют один или более асимметричных атомов углерода. Кроме того,циклогексановые заместители имеют либо цис-,либо транс-ориентацию относительно друг друга. Полученные диастереоизомеры, энантиомеры и геометрические изомеры подпадают под объем настоящего изобретения. Предпочтительными являются соединения по изобретению, в которых конфигурация асимметричного атома углерода фрагмента аминогидроксамовой кислоты, к которому присоединено циклогексановое кольцо, соответствует конфигурации предшественника Dаминокислоты и которую обозначают (R)конфигурацией. Из предшествующего уровня техники известны арилсульфамидозамещенные гидроксамовые кислоты, описанные в заявке ЕР 0 606 046 и, соответственно, в патенте США 5 552 419, обладающие свойством ингибировать ферменты металлопротеиназы, разрушающие матрикс. Представленное изобретение, касающееся конкретных синтезированных представителей производных арилсульфонамидозамещенных гидроксамовой кислоты, обладают значительными преимуществами по сравнению с соеди 002019 2 нениями, раскрытыми в приведенном источнике. Фармацевтически приемлемые производные, являющиеся пролекарствами, представляют собой таковые, которые могут превращаться путем сольволиза или в условиях физиологической среды в свободные гидроксамовые кислоты по изобретению и представляют собой такие гидроксамовые кислоты, в которых группаCONHOH превращена в форму O-ацильного или необязательно замещенного O-бензильного производного. Предпочтительными являются необязательно замещенные O-бензильные производные. Предпочтительные ацильные производные, являющиеся пролекарствами, представляют собой производные органической угольной кислоты, органической карбоновой кислоты или карбаминовой кислоты. Ацильным производным, образованным из органической карбоновой кислоты, является,например, (низш.)алканоил (далее и везде под термином "низший" подразумевается остаток с числом атомов углерода от 1 до 7), фенил(низш.)алканоил или незамещенный или замещенный ароил, такой как бензоил. Ацильным производным, образованным из органической угольной кислоты, является, например, алкоксикарбонил, предпочтительно(низш.)алкоксикарбонил, который может быть незамещен или замещен карбоциклическим или гетероциклическим арилом, или циклоалкоксикарбонил, предпочтительно С 3-С 7 циклоалкилоксикарбонил, который может быть незамещен или замещен (низш.)алкилом. Ацильным производным, образованным из карбаминовой кислоты, является, например,аминокарбонил, замещенный (низш.)алкилом,карбоциклическим или гетероциклическим арил-(низш.)алкилом, карбоциклическим или гетероциклическим арилом, (низш.)алкиленом или (низш.)алкиленом, имеющим атомы О илиS. Предпочтительные необязательно замещенные О-бензильные производные, являющиеся пролекарствами, представляют собой бензил или бензил, моно-, ди- или тризамещенный, например, (низш.)алкилом, (низш.)алкокси-, амино-, нитрогруппой, галогеном и/или трифторметилом. Фармацевтически приемлемыми солями кислотных соединений по изобретению являются соли, образованные с основаниями, а именно,катионные соли, такие как соли щелочных и щелочно-земельных металлов, таких как натрий,литий, калий, кальций, магний, а также аммонийные соли, такие как соли аммония, триметиламмония, диэтиламмония и трис(гидроксиметил)метиламмония. Изобретение также включает кислотноаддитивные соли, например, минеральных кислот, органических карбоновых и органических 3 сульфоновых кислот, таких как соляная кислота,метансульфоновая кислота, малеиновая кислота,которые также могут иметь основную группу,такую как пиридил, представляющую собой составную часть структуры. Если не указано иное, общие понятия, которые используются в настоящем описании, в соответствии с объемом изобретения имеют следующие значения. Понятие"(низш.)" выше и далее в настоящем описании в отношении органических радикалов или соединений соответственно означает таковые, разветвленные или неразветвленные и содержащие включительно до 7, предпочтительно включительно до 4 и преимущественно один или два атома углерода.(Низш.)алкильная группа является разветвленной или неразветвленной и содержит 1-7 атомов углерода, предпочтительно 1-4 атома углерода, и представляет собой, например, метил, этил, пропил, бутил, изопропил или изобутил.(Низш.)алкоксигруппа (или алкилоксигруппа) предпочтительно содержит 1-4 атома углерода и представляет собой, например, метокси, этокси, пропокси, изопропокси, бутокси или изобутокси. Галоген предпочтительно означает хлор или фтор, но также может обозначать бром или йод. Арил означает карбоциклический или гетероциклический арил. Карбоциклический арил представляет собой моноциклический или бициклический арил,например, фенил или фенил, моно-, ди- или тризамещенный одним, двумя или тремя радикалами, выбранными из группы, включающей(низш.)алкил, (низш.)алкокси, гидрокси, галоген, циано, трифторметил, (низш.)алкилендиокси и оксиС 2-С 3 алкилен; или 1- либо 2 нафтил. (Низш.)алкилендиокси является двухвалентным заместителем, присоединенным к двум соседним атомам углерода фенила, например, метилендиокси или этилендиокси. ОксиС 2 С 3 алкилен также является двухвалентным заместителем, присоединенным к двум соседним атомам углерода фенила, например, оксиэтилен или оксипропилен. Примером оксиС 2-С 3 алкиленфенила является 2,3-дигидробензофуран-5 ил. В качестве карбоциклического арила предпочтительным является фенил или фенил, монозамещенный(низш.)алкокси,галогеном,(низш.)алкилом или трифторметилом, предпочтительно фенил или фенил, монозамещенный(низш.)алкокси, галогеном или трифторметилом, и особенно фенил. Гетероциклический арил обозначает моноциклический или бициклический гетероарил,например, пиридил, хинолинил, изохинолинил,бензотиенил, бензофуранил, бензопиранил, бен 002019 4 зотиопиранил, фуранил, пирролил, тиазолил,оксазолил, изооксазолил, триазолил, тетразолил,пиразолил, имидазолил, тиенил или замещенный любой из указанных радикалов, прежде всего моно- или дизамещенный, например,(низш.)алкилом или галогеном. Пиридил обозначает 2-, 3- или 4-пиридил, предпочтительно 3- или 4-пиридил. Тиенил обозначает 2- или 3 тиенил, предпочтительно 2-тиенил. Хинолинил обозначает предпочтительно 2-, 3- или 4 хинолинил, особенно 2-хинолинил. Изохинолинил обозначает предпочтительно 1-, 3- или 4 изохинолинил. Бензопиранил, бензотиопиранил обозначает предпочтительно 3-бензопиранил или 3-бензотиопиранил соответственно. Тиазолил обозначает предпочтительно 2- или 4 тиазолил, особенно 4-тиазолил. Триазолил обозначает предпочтительно 1-, 2- или 5-(1,2,4 триазолил). Тетразолил предпочтительно обозначает 5-тетразолил. Имидазолил предпочтительно обозначает 4-имидазолил. Предпочтительно гетероциклический арил обозначает пиридил, хинолинил, пирролил, тиазолил, изоксазолил, триазолил, тетразолил, пиразолил, имидазолил, тиенил или замещенный любой из указанных радикалов, прежде всего моноили дизамещенный,например,(низш.)алкилом или галогеном, предпочтительно пиридил. Биарил предпочтительно обозначает карбоциклический биарил, например, бифенил, а именно, 2-, 3- или 4-бифенил, предпочтительно 4-бифенил, каждый из которых необязательно замещен, например, (низш.)алкилом, (низш.)алкокси, галогеном, трифторметилом или цианогруппой. Циклоалкил обозначает насыщенный циклический углеводород, необязательно замещенный (низш.)алкилом, который содержит 3-10 кольцевых атомов углерода, и предпочтительно обозначает циклопентил, циклогексил, циклогептил или циклооктил, необязательно замещенный (низш.)алкилом. Карбоциклический арил-(низш.)алкил обозначает предпочтительно арилС 1-С 4 алкил с прямой или с разветвленной цепью, в котором карбоциклический арил имеет значения, указанные выше, например, бензил- или фенил-(этил,пропил или бутил), каждый из которых может быть незамещен или замещен на фенильном кольце, как указано выше для карбоциклического арила, предпочтительно необязательно замещенный бензил. Гетероциклический арил-(низш.)алкил обозначает предпочтительно гетероциклический арилС 1-C4 алкил с прямой или разветвленной цепью, в котором гетероциклический арил имеет значения, указанные выше, например, 2-, 3 или 4-пиридилметил или (2-, 3- или 4-пиридил)(этил, пропил или бутил); или 2- или 3 тиенилметил или (2- или 3-тиенил)-(этил, пропил или бутил); 2-, 3- или 4-хинолинилметил 5 или (2-, 3- или 4-хинолинил)-(этил, пропил или бутил); или 2- или 4-тиазолилметил, или (2- или 4-тиазолил)-(этил, пропил или бутил). Циклоалкил-(низш.)алкил обозначает, например, (циклопентил- или циклогексил-)-(метил или этил). Ацил является производным органической карбоновой кислоты, угольной кислоты или карбаминовой кислоты. Ацил обозначает, например, (низш.)алканоил, карбоциклический арил-(низш.)алканоил, (низш.)алкоксикарбонил, ароил, ди(низш.)алкиламинокарбонил или ди-(низш.)алкиламино-(низш.)алканолил. Предпочтительно ацил обозначает (низш.)алканоил.(Низш.)алканоил обозначает, например,С 1-С 7 алканоил, включая формил, и предпочтительно обозначает С 2-С 4 алканоил, такой как ацетил или пропионил. Ароил обозначает, например, бензоил или бензоил, моно- или дизамещенный одним или двумя радикалами, выбранными из группы,включающей (низш.)алкил, (низш.)алкокси, галоген, цианогруппу и трифторметил; или обозначает 1- или 2-нафтоил; а также, например,пиридилкарбонил.(Низш.)алкилен обозначает алкилен с прямой или с разветвленной цепью, имеющий 1-7 атомов углерода, и предпочтительно обозначает алкилен с прямой цепью, имеющий 1-4 атома углерода, например, метиленовую, этиленовую,пропиленовую или бутиленовую цепь, или указанную метиленовую, этиленовую, пропиленовую или бутиленовую цепь, монозамещенную С 1-С 3 алкилом (предпочтительно метилом) или дизамещенную у одного или у различных атомов углерода С 1-С 3 алкилом (предпочтительно метилом), причем общее число атомов углерода достигает 7 включительно.(Низш.)алкилендиокси предпочтительно обозначает этилендиокси или метилендиокси. Этерифицированный карбоксил обозначает, например, (низш.)алкоксикарбонил или бензилоксикарбонил. Амидированный карбоксил обозначает,например, аминокарбонил, моно- или ди(низш.)алкиламинокарбонил. Один из примеров осуществления изобретения относится к соединениям формулы I, в которых асимметричный атом углерода фрагмента -аминогидроксамовой кислоты находится в (R)-конфигурации, а именно, к соединениям формулы II где Аr, R1, R2, R3 и R4 имеют указанные выше значения, к фармацевтически приемлемым производным, являющимся пролекарствами, и к их фармацевтически приемлемым солям. Еще один вариант осуществления относится к вышеуказанным соединениям, имеющим транс-конфигурацию относительно 1,4 заместителей на циклогексановом кольце, в частности, к соединениям формулы III где Аr обозначает карбоциклический или гетероциклический арил;R2 обозначает водород или (низш.)алкил;R4 обозначает водород или (низш.)алкокси; или R3 и R4 вместе с соседними атомами углерода обозначают метилендиокси;n равно 1-4; к их фармацевтически приемлемым производным, являющимся пролекарствами, и к их фармацевтически приемлемым солям. Также предпочтительными являются указанные соединения формулы III, где Аr обозначает гетероциклический арил, как определено выше, R1 обозначает (низш.)алкил, циклоалкил,как определено выше, или (низш.)алкокси(низш.)алкил, R2 обозначает водород или(низш.)алкокси и n равно 1-4, их фармацевтически приемлемые производные, являющиеся пролекарствами, и их фармацевтически приемлемые соли. Предпочтительными являются указанные соединения, в которых R3 находится в параположении и R4 находится в мета-положении. Кроме того, предпочтительными являются указанные соединения формулы III, где Аr обозначает гетероциклический арил, как определено выше, R1 обозначает (низш.)алкил, R2 обозначает водород,R3 обозначает пара(низш.)алкокси, R4 обозначает водород и n рав 7 но 1 или 2, и их фармацевтически приемлемые соли. Особенно предпочтительными являются соединения формулы III, где Аr обозначает пиридил, особенно 3- или 4-пиридил, R1 обозначает (низш.)алкил, прежде всего С 2-C5 алкил с прямой цепью, R2 и R4 обозначают водород, R3 обозначает пара-(низш.)алкокси и n равно 1, и их фармацевтически приемлемые соли. Кроме того, предпочтительными являются соединения, где Аr обозначает 4-пиридил, R1 обозначает С 2-С 4 алкил, R2 и R4 обозначают водород, R3 обозначает пара-этокси и n равно 1, и их фармацевтически приемлемые соли. Специально следует отметить следующую подгруппу группы соединений по изобретению: соединения (формулы I, II или III соответственно), где R1 обозначает С 2-С 7 алкил. Изобретение относится предпочтительно к конкретным соединениям, описанным в примерах, к их фармацевтически приемлемым производным, являющимся пролекарствами, и к их фармацевтически приемлемым солям, в частности, к конкретным соединениям, описанным в примерах, а также к их фармацевтически приемлемым солям. Соединения по изобретению обладают ценными фармакологическими свойствами в отношении млекопитающих, включая человека. Во-первых, они являются ингибиторами фермента, превращающего TNF-альфа (TNFальфа-конвертазы), и вследствие этого ингибируют активность TNF-альфа, например, подавляют образование и/или высвобождение TNFальфа, важного медиатора воспаления и роста ткани. Такие свойства прежде всего обусловливают пригодность соединений по изобретению для лечения опухолей (злокачественных и доброкачественных новообразований), а также воспалительных состояний у млекопитающих, например, для лечения артрита (такого как ревматоидный артрит), септического шока, воспаления пищеварительного тракта, болезни Крона и т.п. Кроме того, соединения по изобретению также ингибируют ферменты металлопротеиназы, которые разрушают матрикс, такие как желатиназа, стромелизин, коллагеназа и металлоэластаза макрофага. Таким образом, соединения по изобретению ингибируют разложение матрикса, и вследствие этого они пригодны для лечения патологических состояний у млекопитающих, связанных с желатиназой, стромелизином, коллагеназой и металлоэластазой макрофага. Такие состояния включают опухоли (путем ингибирования роста опухоли, метастазов опухоли, прогрессивного развития опухоли или инвазии и/или ангиогенеза опухоли), такие опухоли включают, например, рак молочной железы, легкого, мочевого пузыря, толстой кишки,яичника и кожи. Другие состояния, подлежащие лечению с помощью соединений по изобрете 002019 8 нию, включают остеоартрит, заболевания бронхов (такие как астма, путем ингибирования разложения эластина), атеросклеротические состояния (путем, например, ингибирования перфорации атеросклеротических бляшек), а также острый коронарный синдром, сердечные приступы (сердечная ишемия), удары (церебральные ишемии) и рестиноз после пластической операции на сосудах. Кроме того, состояния, подлежащие лечению с помощью соединений по изобретению,включают связанные с демиелинизацией нервной системы воспалительные расстройства, которые включают разрушение или потерю миелина (такие как рассеянный склероз), ретробульбарный неврит, нейромиелит зрительного нерва (болезнь Девика), диффузный и переходный склероз (болезнь Шилдера) и острый рассеянный энцефаломиелит, а также периферические невропатии, связанные с демиелинизацией,такие как синдром Ландри-Гийена-БарреШтроля, связанный с дефектами моторной системы, а также изъязвление ткани (например,образование язв в эпидермисе и желудке), аномальное заживление ран, болезнь периодонта,болезнь кости (например, болезнь Пагета и остеопороз). Соединения по изобретению при лечении глазных болезней применяются для лечения воспаления глаза, изъязвления роговицы, птеригия, кератита, кератоконуса, открытоугольной глаукомы, ретинопатии, а также их применение в связи с глазной хирургией (лазерной или связанной с рассечением) с целью минимизации побочных эффектов. Соединения особенно пригодны для лечения воспалительных состояний, таких как ревматоидный артрит, и опухолей. Эффективность воздействия оценивают в фармакологических опытах, которые обычно хорошо известны в данной области и которые проиллюстрированы в настоящем описании. Вышеуказанные свойства могут быть продемонстрированы в опытах in vitro и in vivo преимущественно при использовании млекопитающих, например, крыс, морских свинок, собак, кроликов или выделенных органов и тканей, а также препаратов ферментов млекопитающих. Указанные соединения могут применяться in vitro в форме растворов, например,предпочтительно водных растворов, и in vivo либо энтерально, либо парентерально, предпочтительно орально, например, в виде суспензии или водного раствора. Дозы, применяемые invitro, могут находиться в диапазоне от 10-5 молей до 10-10 молей. Дозы, применяемые in vivo, в зависимости от пути введения могут находиться в диапазоне от 0,1 до 100 мг/кг. Ингибирование образования и секреции 9 Воздействие на образование растворимогоTNF-альфа клетками линии ТНР-1, стимулированными липополисахаридами (LPS) может быть определено следующим образом. Используемая среда для культуры ткани представляет собой среду RPM 1640 (фирмаGibco, каталожный номер 11875-036), содержащую 10%-ную фетальную телячью сыворотку,1% пенициллина и стрептомицина. Клетки линии ТНР-1 (АТСС 202-TIB) из расчета 1105 клеток/лунку добавляют к 100 мкл среды или тестируемого соединения. Клетки предварительно инкубируют с соединением в течение 30 мин при 37 С в камере влажности с 5% СО 2 и затем стимулируют с помощью 100 нг/мл LPS(липополисахарид, фирма Sigma, каталожный номер L-4391) в течение 4 ч. Планшеты затем центрифугируют и для анализа TNF собирают 100 мкл кондиционированной среды. Количество TNF-альфа в контроле и в опытных культурах определяют с помощью метода ELISA, применяя для построения стандартной кривой рекомбинантный TNF-альфа и используя для анализа TNF ELISA-планшеты, предназначенные для TNF (фирма Genzyme). Определение абсорбции и расчет данных проводят с помощью планшет-ридера типа Molecular Devices. Результаты выражают в виде значения IC50 тестируемого соединения. Воздействие на концентрацию TNF-альфа в плазме мышей после внутривенной инъекции эндотоксина может быть определено следующим образом. Самок мышей линии Balb-CbyJ обрабатывают путем введения через желудочной зонд тестируемого соединения в 0,1 мл кукурузного крахмала в качестве носителя/10 г веса тела. Через 1-4 ч после введения тестируемого соединения внутривенно вводят 0,1 мг/кг липополисахарида (LPS) из штамма Е. coli 0127:B8 (фирма Difco, каталожный номер 3880-25-0) в физиологическом растворе. Через 1 ч после внутривенной инъекции LPS берут кровь для определения TNF-альфа в плазме с помощью набораELISA для мышиного TNF-альфа (фирма Genzyme). В каждой группе, которую подвергают обработке, используют по восемь мышей. Результаты выражают в виде % ингибирования относительно средней концентрации TNF-альфа в плазме контрольных мышей. Воздействие на концентрацию TNF-альфа в синовиальной жидкости в воспаленном коленном суставе крысы может быть определено следующим образом. Самок крыс линии Lewis обрабатывают путем введения через желудочной зонд тестируемого соединения в 0,1 мл кукурузного крахмала в качестве носителя. Через 1-4 ч после введения тестируемого соединения в оба коленных сустава вводят 0,1 мг липополисахарида (LPS) из штамма Е. coli 0127:B8 (фирма Difco, каталожный номер 3880-25-0). Через 2 ч после внут 002019 10 рисуставной инъекции LPS проводят лаваж коленных суставов с помощью 0,1 мл физиологического раствора и объединяют два лаважа, полученных от одной и той же крысы. КоличествоTNF-альфа измеряют, используя набор ELISA для мышиного TNF-альфа (фирма Genzyme),который дает перекрестную реакцию с крысиным TNF-альфа. Результаты выражают в виде % ингибирования относительно средней концентрации TNF-альфа в синовиальной жидкости,полученной из коленных суставов, обработанных физиологическим раствором. Противовоспалительная активность может быть определена с использованием стандартных моделей воспаления и артрита у животных, хорошо известных в данной области, например, на модели вызванного адъювантом артрита у крыс и на модели вызванного коллагеном II артрита у мышей [Mediators of Inflam. 1, 273-279 (1992)]. Один из опытов, позволяющих определить ингибирование активности стромелизина, основан на его применении для гидролиза субстанции Р с использованием модифицированного способа Harrison с сотрудниками (Harrison R.A.,Teahan J. и Stein R. A semicontinuous high performance chromatography based assay forstromelysin, Anal. Biochem. 180, 110-113 (1989. В этом опыте субстанцию Р гидролизуют рекомбинантным человеческим стромелизином,получая фрагмент, субстанцию Р 7-11, который может быть количественно определен с помощью ЖХВР. В типичном опыте 10 мМ маточный раствор соединения, подлежащего тестированию, разбавляют в буфере для анализа до 50 мкМ, смешивая в соотношении 1:1 с 8 мкг рекомбинантного человеческого стромелизина(молекулярная масса 45-47 кДа, 2 единицы, где 1 единица продуцирует за 30 мин 20 ммолей субстанции Р 7-11), и инкубируют вместе с 0,5 мМ субстанции Р в конечном объеме 0,125 мл в течение 30 мин при 37 С. Реакцию прекращают,добавляя 10 мМ ЭДТК, и субстанцию Р 7-11 количественно определяют на колонке RP-8 для ЖХВР. Значение IC50 в качестве показателя ингибирующей активности в отношении стромелизина и значение Кi оценивают относительно контрольной реакции без ингибитора. Активность стромелизина также может быть определена при использовании в качестве субстрата человеческого аггрекана. Этот опыт позволяет подтвердить in vitro, что соединение может ингибировать действие стромелизина на его природном субстрате, обладающем высоким отрицательным зарядом, аггрекане (протеогликане с большой агрегирующей способностью). Внутри хряща протеогликан находится в агрегированном состоянии с гиалуронатом. Человеческий протеогликан, агрегированный с гиалуронатом, используют в качестве субстрата для фермента. Опыт проводят в 96-луночных микротитрационных планшетах, что позволяет бы 11 стро оценить эффективность соединений. Этот опыт состоит из трех основных стадий: 1) Планшеты покрывают гиалуронатом(человеческий артикулярный хрящ, разрушенный D1-хондроитиназой АВС, 2 мг/мл) связывают с гиалуронатом. Планшеты промывают между каждой стадией. 2) В лунки добавляют буферы + ингибитор(1:5000 нМ) + рекомбинантный человеческий сторомелизин (1-3 ед./лунку). Планшеты запечатывают самоклеющей лентой и инкубируют в течение ночи при 37 С. Затем планшеты промывают. 3) Для обнаружения оставшихся фрагментов используют первичное (ЗВЗ) антитело (мышиный IgM, 1:10000). Вторичное антитело,сшитое с пероксидазой анти-IgM, связывают с первичным антителом. Затем в качестве субстрата для пероксидазы добавляют OPD и реакцию прекращают, добавляя серную кислоту. Значение IC50 в качестве показателя ингибирующей активности в отношении стромелизина определяют графическим путем и вычисляют значение Кi. Активность коллагеназы определяют следующим образом: 96-луночные плоскодонные микротитрационные планшеты сначала покрывают бычьим коллагеном типа I (35 мкг/лунку) и выдерживают в течение 2 дней при 30 С сначала во влажной, а затем в сухой атмосфере,планшеты промывают, сушат в течение 3-4 ч на воздухе, запечатывают оберткой из Сарана и помещают на хранение в холодильник. В лунки добавляют человеческую рекомбинантную коллагеназу фибробласта и тестируемое соединение (или буфер) (общий объем 0,1 мл) и планшеты инкубируют в течение 2 ч при 35 С во влажной атмосфере, используют такое количество коллагеназы на лунку, которое вызывает приблизительно 80% от максимального разложения коллагена. Из лунок удаляют инкубационную среду, после этого их промывают буфером, а затем водой. В лунки на 25 мин добавляют краситель кумасии голубой, затем его удаляют и лунки снова промывают водой. Для солюбилизации оставшегося окрашенного коллагена добавляют додецилсульфат натрия (20%ный в 50%-ном диметилформамиде в воде) и оптическую плотность измеряют при длине волны 570 нм). Уменьшение оптической плотности, обусловленное коллагеназой (по сравнению с образцом коллагена без фермента), сравнивают с уменьшением оптической плотности,обусловленным ферментом в присутствии тестируемого соединения, и рассчитывают процент ингибирования ферментативной активности. Значение IC50 определяют с использованием различных концентраций ингибиторов (4-5 концентраций, каждую из которых тестируют в 3 повторностях) и вычисляют значение Кi. 12 Эффективность соединений по изобретению в опытах in vivo может быть определена на кроликах. Обычно четырем кроликам вводят орально соединение за 4 ч до внутрисуставной инъекции в оба коленных сустава (N=8) 40 ед. рекомбинантного человеческого стромелизина,растворенного в 20 мМ трисе, 10 мМ СаСl2 и 0,15 мМ NaCl при рН 7,5. Через 2 ч кроликов умерщвляют, собирают синовиальную жидкость и количественно оценивают фрагменты кератансульфата (KS) и сульфированного глюкозамингликана (S-GAG), которые высвобождаются в сустав. Содержание кератансульфата измеряют по ингибированию с использованием ELISA в соответствии с методом Тонара (Thonar E.J.M.A., Lenz M.E., Klinsworth G.K., Caterson В.,Pachman L.M., Glickman P., Katz R., Huff J.,Keuttner K.E., Quantitation of keratan sulfate inRheum. 28, 1367-1376 (1985. Содержание сульфированных глюкозамингликанов сначала оценивают по разложению синовиального лаважа гиалуронидазой Streptomices, а затем измеряют связывание с красителем DMB по методу Гольдберга (Goldberg R.L. и Kolibas L., An improved method for determining proteoglycan synthesized by chondrocytes in culture. Connect. Tiss.Res., 24, 265-275 (1990. Для внутривенного введения соединения растворяют в 1 мл ПЭГ 400, а при применении перорально соединение вводят в 5-ти мл обогащенного кукурузного крахмала на килограмм веса тела. Эффективность соединений в отношении защиты хряща от разрушения при артритах может быть определена, например, на модели вызванного хирургическим путем остеоартрита,описанной в Arthritis and Rheumatism, том. 26,875-886 (1983). Эффективность в отношении изъязвлений,например, изъязвлений глаза, может быть определена на кроликах путем измерения уменьшения степени изъязвления роговицы, вызванного щелочным ожогом роговицы. Ингибирующая активность в отношении металлоэластазы макрофага (ММЭ) может быть определена путем измерения ингибирования разложения [3 Н] эластина с помощью рекомбинантной процессированной мышиной металлоэластазы макрофага следующим образом. Приблизительно 2 нг рекомбинантной процессированной мышиной металлоэластазы макрофага (FASEB Journal, т. 8, А 151, 1994),очищенной с помощью хроматографии на Qсефарозной колонке, инкубируют при 37 С в течение ночи с тестируемыми соединениями в требуемой концентрации в присутствии 5 нМ СаСl2, 400 нМ NaCl, [3H] эластина (60000 импульсов в мин/пробирку) и 20 мМ триса, рН 8,0. Образцы вращают на микроцентрифуге при 12000 об/мин в течение 15 мин. Для количественной оценки разрушения [3 Н] эластина в сцинтилляционном счетчике измеряют радиоак 13 тивность в аликвотных количествах супернатанта. Значение IC50 определяют с использованием различных концентраций тестируемых соединений и вычисляют процент ингибирования активности фермента. Эффективность соединений по изобретению в отношении лечения эмфиземы может быть определена на животных-моделях, описанных в American Review of Respiratory Disease, 117. 1109 (1978). Противоопухолевая эффективность соединений по изобретению может быть определена,например, при измерении роста опухолей человека, имплантированных подкожно лишенным волосяного покрова мышам линии Balb/c, обработанным в соответствии с хорошо известным в данной области методом, в сравнении с обработанными плацебо мышами. Примерами опухолей являются, например, зависящая от эстрогена карцинома молочной железы человека ВТ 20 иMCF7, карцинома мочевого пузыря человека Т 24, карцинома толстой кишки человека Colo 205, аденокарцинома легкого человека А 549 и карцинома яичника человека NIH-OVCAR3. Воздействие на ангиогенез опухоли может быть определено, например, на крысах, которым для стимуляции ангиогенеза из сосудов конечностей имплантировали в виде гранул карциному Walker 256, как описано у Galardy и др., Cancer Res. 54, 4715 (1994). Эффективность соединений по изобретению в отношении атеросклеротических состояний может быть определена с использованием атеросклеротических бляшек, полученных у кроликов, находящихся на диете с высоким содержанием холестерина, которые содержат активированные матричные металлопротеиназы,как описано у Sukhova и др. Circulation 90. I 404(1994). Ингибирующее воздействие в отношении ферментативной активности матричной металлопротеиназы на атеросклеротических бляшках кролика может быть определено с помощью зимографии in situ, как описано у Galis и др., J. Clin. Invest. 94, 2493 (1994), а его показателем является стабилизация бляшки. Воздействие на рестеноз и на сосудистую реконструкцию может быть оценено на модели сонной артерии крысы с введенным баллонным катетером. Эффективность в отношении расстройств,обусловленных демиелинизацией нервной системы, таких как рассеянный склероз, может быть оценена при измерении реверсии вызванного экспериментальным путем аутоиммунного энцефаломиелита у мышей, например, как описано у Gijbels и др., J. Clin. Invest. 94, 2177(1994). В качестве ингибиторов TNF-альфаконвертазы и матричных металлопротеиназ соединения по изобретению особенно пригодны как противовоспалительные агенты для лечения у млекопитающих, например, остеоартрита, 002019 14 ревматоидного артрита, и как противоопухолевые агенты для лечения или предупреждения роста опухолей, метастазов опухолей, инвазии или прогрессивного развития опухолей. Соединения формулы I могут быть получены, например, путем конденсации карбоновой кислоты формулы IV или ее функционального реакционноспособного производного, в котором Ar, n и R1-R4 имеют указанные выше значения, с гидроксиламином формулы V(V) необязательно в защищенной форме, или с его солью и при необходимости временной защиты любой(ых) участвующей(их) во взаимодействии реакционноспособной(ых) группы(групп) с последующим высвобождением образовавшегося соединения по изобретению, а также, если это необходимо или желательно, превращением образовавшегося соединения по изобретению в другое соединение по изобретению, и/или при необходимости превращением образовавшего свободного соединения в соль или образовавшейся соли в свободное соединение или в другую соль, и/или разделением полученной смеси изомеров или рацематов на отдельные изомеры или рацематы, и/или при необходимости разделением рацематов на оптические антиподы. В исходных соединениях и промежуточных продуктах, из которых приведенным в настоящем описании способом получают соединения по изобретению, присутствуют функциональные группы, такие как амино-, карбокси- и гидроксигруппа, которые необязательно защищены общепринятыми защитными группами, которые обычно применяют в препаративной органической химии. Защищенными амино-, карбокси- и гидроксигруппами являются таковые, которые могут быть превращены в мягких условиях в свободные амино- и гидроксигруппы без нарушения молекулярного каркаса или без прохождения других нежелательных побочных реакций. Целью введения защитных групп является защита функциональных групп от нежелательных взаимодействий с реакционноспособными компонентами в условиях, применяемых для проведения требуемого химического превращения. Потребность и выбор защитных групп для конкретной реакции известен специалистам в данной области и зависит от природы функциональной группы, подлежащей защите (гидроксигруппа, аминогруппа и т.д.), строения и ста 15 бильности молекулы, частью которой является заместитель, и условий реакции. Хорошо известные защитные группы,удовлетворяющие этим условиям, их введение и удаление описаны, например, у J.F.W. McOmie,"Protective Groups in Organic Chemistry", PlenumPress, London, New York, 1973 и у T.W. Greene,"Protective Groups in Organic Synthesis", Wiley,New York, 1991. В приведенных в настоящем описании способах функциональные реакционноспособные производные карбоновых кислот представляют собой, например, ангидриды, предпочтительно смешанные ангидриды, галогенангидриды,азиды кислот,сложные эфиры(низш.)алкила и их активированные сложные эфиры. Смешанные ангидриды предпочтительно представляют собой таковые пивалиновой кислоты или (низш.)алкиловые (этиловый, изобутиловый) полуэфиры угольной кислоты, галогенангидриды представляют собой, например,хлорангидриды или бромангидриды, активированные сложные эфиры представляют собой,например, сукцинимидный, фталимидный и 4 нитрофениловый эфиры, сложные (низш.)алкиловые эфиры представляют собой, например,метиловый или этиловый эфиры. Кроме того, реакционноспособное этерифицированное производное спирта в любой из представленных в настоящем описании реакций представляет собой указанный спирт, этерифицированный сильной кислотой, предпочтительно сильной неорганической кислотой, такой как галоидводородная кислота, предпочтительно соляная, бромисто-водородная или йодистоводородная кислота, или серная кислота, или сильной органической кислотой, предпочтительно сильной органической сульфоновой кислотой, такой как алифатическая или ароматическая сульфоновоя кислота, например, метансульфоновая кислота, 4-метилбензолсульфоновая кислота или 4-бромбензолсульфоновая кислота. Указанное реакционноспособное этерифицированное производное предпочтительно представляет собой производное галогена, например, хлора, брома или йода, или алифатическое или ароматическое производное, замещенное сульфонилоксигруппой, например, метансульфонилокси-, 4-метилбензолсульфонилокси(тозилокси-) или трифторметансульфонилоксигруппой. Вышеуказанный способ синтеза соединений по изобретению может быть проведен в соответствии с методами, хорошо известными в области получения гидроксамовых кислот и их производных. В соответствии с вышеуказанным способом синтез (включая конденсацию свободной карбоновой кислоты формулы IV с необязательно гидроксизащищенным производным гидроксиламина формулы (V), может быть проведен в присутствии конденсирующего агента, 002019 16 например, 1,1'-карбонилдиимидазола, или N(диметиламинопропил)-N'-этилкарбодиимида или дициклогексилкарбодиимида, с добавлением 1-гидроксибензотриазола или без него, в инертном полярном растворителе, таком как диметилформамид или дихлорметан, предпочтительно при комнатной температуре. Синтез, включающий конденсацию функционального реакционноспособного производного кислоты формулы IV, как определено выше, например, хлорангидрида или смешанного ангидрида, с необязательно гидроксизащищененным производным гидроксиламина и его солью, в присутствии основания, такого как триэтиламин, может быть проведен в диапазоне температур от -78 до +75 С в инертном органическом растворителе, таком как дихлорметан или толуол. Защищенные формы гидроксиламина(формулы V) в вышеуказанном способе представляют собой таковые, в которых гидроксигруппа является защищенной, например, находится в виде трет-бутилового эфира, бензилового эфира, трифенилметилового эфира, терагидропиранилового эфира или триметилсилильного производного. Удаление указанных защитных групп проводят методами, хорошо известными в данной области, например, гидрогенолизом или гидролизом. Гидроксиламин предпочтительно получают in situ из гидроксиламиновой соли,такой как гидрохлорид гидроксиламина. Исходные карбоновые кислоты формулыIV могут быть получены следующим образом. Аминокислоту формулы VI где R2 обозначает водород или (низш.)алкил,необязательно этерифицированный, например, с помощью (низш.)алканола (такого как метанол) или бензилового спирта, обрабатывают реакционноспособным функциональным производным соответствующей сульфоновой кислоты формулы VII где R3 и R4 имеют указанные выше значения,например, соответствующим сульфонилхлоридом, в присутствии пригодного основания, такого как триэтиламин или дициклогексиламин,используя полярный растворитель, такой как тетрагидрофуран, диоксан или ацетонитрил,получая соединение формулы VIII где R2-R4 имеют указанные выше значения и R5 обозначает водород или карбоксизащитную группу, например, (низш.)алкил или бензил. Исходные продукты формул VI, VII и XII либо являются известными в данной области,либо могут быть получены методами, хорошо известными в данной области, или как представлено в настоящем описании. Оптические активные D-аминокислоты формулы VI (R-энантиомеры) могут быть получены в соответствии с методами, хорошо известными в данной области техники, например,в соответствии с методами, описанными в Coll.Chem. Int. Ed. (Engl.) 27, 1194 (1988). Промежуточные продукты формулы VIII могут быть превращены в промежуточные продукты формулы IX где R1-R5 имеют указанные выше значения, обработкой реакционноспособным этерифицированным производным спирта формулыI, в условиях, хорошо известных в данной области для образования простых эфиров. Альтернативно этому эфирные промежуточные продукты формулы IX могут быть получены восстановлением кетонов, соединений формулы XI где R2-R5 имеют значения, указанные для формулы VIII, в присутствии спирта формулы Х(R1-OH). Восстановительное O-алкилирование может быть проведено в основном, как описано в J. Am. Chem. Soc. 94, 3659 (1972) с использованием моно-, ди- или триалкилсиланов или моно-, ди- или триарилсиланов в кислой среде,например, в присутствии трифторуксусной кислоты. Образовавшиеся цис- и транс-изомеры могут быть разделены известными методами,такими как хроматография на силикагеле. В альтернативном варианте кетонные промежуточные соединения формулы XI, где R2 обозначает водород, могут быть превращены в 18 промежуточные продукты формулы VIII в виде третичного спирта, где R2 обозначает(низш.)алкил (и R2 и OR1' расположены у одного и того же атома углерода), в соответствии с общепринятыми методами, которые затем этерифицируют с помощью реакционноспособного этерифицированного производного R1-OH, такого как трифторметансульфонильного производного. Кетоны формулы XI в свою очередь могут быть получены окислением спиртов формулыVIII путем обработки, например, гипохлоритом натрия, в присутствии свободного радикала,например, TEMPO (свободный радикал 2,2,6,6 тетраметил-1- пиперидинилокси). Обработка промежуточного продукта формулы IX реакционноспособным этерифицированным производным (таким как галогенид,например, производное хлорида, бромида или йодида) спирта формулы XII Аr-(СН 2)nОН(XII) где Аr и n имеют значения, указанные в настоящем описании, в присутствии соответствующего основания, такого как карбонат калия или дициклогексиламин, в полярном растворителе,таком как диметилформамид, приводит к получению сложного эфира формулы IV. Сложный эфир затем может быть превращен в кислоту формулы IV с использованием либо гидрогенолиза, либо стандартными методами гидролиза сложного эфира в мягких условиях, предпочтительно в кислотных условиях, метод зависит от природы этерифицирующей группы. Вышеуказанные реакции проводят в соответствии со стандартными методами без растворителя или в его присутствии, предпочтительно такого, который является инертным по отношению к реагентам, но растворяет их, в присутствии катализатора, агентов конденсации или других указанных агентов соответственно и/или в атмосфере инертного газа при низких температурах, комнатной температуре или повышенных температурах (предпочтительно при температуре кипения примененных растворителей или при близкой к этой температуре) и при атмосферном давлении или при давлении, превышающем атмосферное. Предпочтительные растворители, катализаторы и реакционные условия указаны в приведенных далее иллюстративных примерах. Кроме того, изобретение включает любой вариант настоящих способов, в котором промежуточный продукт, получаемый на любой его стадии, применяют в качестве исходного продукта и проводят остальные стадии, или способ прерывают на любой его стадии, или при котором исходные продукты получают in situ в реакционных условиях, или при котором компоненты реакционной смеси применяют в форме их солей или оптически чистых антиподов. Соединения по изобретению и промежуточные продукты также могут быть превращены 19 друг в друга в соответствии с обычными хорошо известными методами. Изобретение также относится к любым новым исходным продуктам и способам их получения. В зависимости от выбранных исходных продуктов и методов новые соединения могут находиться в форме одного из возможных изомеров или их смесей, например, в виде практически чистых геометрических (цис- или транс-) изомеров, оптических изомеров (антиподов),рацематов или их смесей. Вышеперечисленные возможные изомеры или их смеси подпадают под объем данного изобретения. Любые образовавшиеся смеси изомеров могут быть разделены на основе физикохимических различий составляющих на геометрические или оптические изомеры, диастереоизомеры, рацематы, например, с помощью хроматографии и/или фракционированной кристаллизации. Любые образовавшиеся рацематы конечных или промежуточных продуктов могут быть разделены на оптические антиподы известными методами, например, путем разделения их диастереоизомерных солей, полученных с оптически активной кислотой или основанием, и высвобождением оптически активного кислотного или основного соединения. Таким образом,промежуточные продукты гидроксамовых кислот или карбоновой кислоты могут быть разделены на их оптические антиподы, например,фракционированной кристаллизацией d- или lсолей (альфа-метиленбензиламина, цинхонидина, синхонина, хинина, хинидина, эфедрина,дегидроабиэтиламина, бруцина или стрихнина). И, наконец, кислотные соединения по изобретению могут быть получены либо в свободной форме, либо в форме соли. Кислотные соединения по изобретению могут быть превращены в соли с помощью фармацевтически приемлемых оснований, например, водного гидроксида щелочного металла,предпочтительно в присутствии эфирного или спиртового растворителя,такого как(низш.)алканол. Из растворов последнего соли могут быть осаждены с помощью простых эфиров, например, диэтилового эфира. Образовавшиеся соли могут быть превращены в свободные соединения путем обработки кислотами. Эти или другие соли также могут применяться для очистки полученных соединений. Соединения по изобретению, имеющие основные группы, могут быть превращены в кислотно-аддитивные соли, предпочтительно фармацевтически приемлемые соли. Их получают, например, с неорганическими кислотами,такими как минеральные кислоты, например,серная кислота, фосфорная кислота или галоидводородная кислота, или с органическими карбоновыми кислотами, такими как (С 1-С 4) 20 алканкарбоновые кислоты, которые, например,могут быть незамещены или замещены галогеном, например, уксусная кислота, такими как насыщенные или ненасыщенные дикарбоновые кислоты, например, щавелевая, янтарная, малеиновая или фумаровая кислота, такими как гидроксикарбоновые кислоты, например, гликолевая, молочная, яблочная, винная или лимонная кислота, такими как аминокислоты, например, аспарагиновая или глутаминовая кислота,или с органическими сульфоновыми кислотами,такими как (С 1-С 4)алкан- или арилсульфоновые кислоты, которые могут быть незамещены или замещены, например, галогеном, например, метансульфоновая кислота. Предпочтительными являются соли, образованные с соляной кислотой, метансульфоновой кислотой и малеиновой кислотой. В связи с близким родством свободных соединений и соединений в форме их солей всякий раз, когда в данном описании делается ссылка на соединение, также подразумевается соответствующая соль, при условии, что это возможно или соответствует данным условиям. Соединения, включая их соли, также могут быть получены в форме их гидратов или могут включать другие растворители, применяемые для их кристаллизации. Фармацевтические композиции по изобретению являются таковыми, которые пригодны для энтерального, такого как оральное или ректальное, трансдермального или парентерального введения млекопитающим, включая человека, с целью ингибирования фермента, превращающего TNF-альфа, и разрушающих матрикс металлопротеиназ и для лечения связанных с ними нарушений, композиции содержат эффективное количество фармакологически активного соединения по изобретению, одного или в комбинации с одним или с несколькими фармацевтически приемлемыми носителями. Фармакологически активные соединения по изобретению пригодны для изготовления фармацевтических композиций, содержащих их эффективное количество в сочетании или в смеси с эксципиентами или носителями, пригодными либо для энтерального, либо для парентарального введения. Предпочтительными являются таблетки и желатиновые капсулы, которые содержат действующее вещество вместе с а) разбавителями, например, с лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином, б) смазывающими веществами, например, с двуокисью кремния, тальком,стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем, для таблеток также с в) связующими веществами,например, с алюмосиликатом магния, пастой из крахмала, желатином, траганатом, метилцеллюлозой, натрийкарбоксиметилцеллюлозой и/или поливинилпирролидоном, при необходимости с г) разрыхлителями, например, с крахмалами, 21 агаром, альгиновой кислотой или ее натриевой солью, или с их шипучими смесями и/или с д) абсорбентами, пигментами, корригентами и подсластителями. Инъецируемые композиции предпочтительно представляют собой водные изотонические растворы или суспензии и суппозитории, которые преимущественно получают из жирных эмульсий или суспензий. Указанные композиции могут быть стерильными и/или содержать адъюванты, такие как консерванты,стабилизирующие, смачивающие или эмульгирующие агенты, вещества, способствующие растворению, соли для регуляции осмотического давления и/или буферы. Кроме того, они также могут содержать другие ценные с терапевтической точки зрения вещества. Эти композици получают в соответствии с общепринятыми методами смешения, гранулирования или покрытия соответственно, и они содержат примерно от 0,1 до 75%, предпочтительно примерно от 1 до 50% действующего вещества. Пригодные для трансдермального нанесения препараты включают эффективное количество соединения по изобретению вместе с носителем. Предпочтительные носители включают фармакологически приемлемые растворители,обладающие способностью абсорбироваться,которые способствуют прохождению через кожу пациента. Обычно устройства для трансдермального нанесения имеют форму бандажа, содержащего в качестве компонента каркас, резервуар, содержащий соединение, необязательно с носителем, необязательно барьер, контролирующий скорость доставки соединения к коже пациента с контролируемой и заранее установленной скоростью в течение продолжительного периода времени, и приспособления для прикрепления устройства к коже. Препараты, пригодные для местного нанесения, например, на кожу или глаза, предпочтительно представляют собой хорошо известные в данной области водные растворы, мази, кремы или гели. Фармацевтические препараты содержат эффективное в отношении ингибирования TNFальфа-конвертазы и/или в отношении ингибирования разрушающих матрикс металлопротеиназ количество соединения по изобретению, как определено выше, либо одного, либо в комбинации с другим терапевтическим агентом, например, с противовоспалительным агентом, обладающим ингибирующей активностью в отношении циклооксигеназы, или с другими антиревматическими агентами, такими как метотрексат, каждый из которых присутствует в терапевтически эффективной дозе, известной в данной области. Такие терапевтические агенты хорошо известны в данной области. Примерами противовоспалительных агентов, обладающих ингибирующей активностью в отношении циклооксигеназы, являются диклофенак, напроксен, ибупрофен и т.п. 22 При использовании в сочетании с другими действующими веществами соединение по изобретению может применяться либо одновременно, до или после другого действующего вещества, либо отдельно при помощи такого же или другого пути введения, либо совместно в одном и том же фармацевтическом препарате. Применяемая доза действующего вещества зависит от видов теплокровных животных (млекопитающих), веса тела, возраста и индивидуального состояния и от формы введения. Стандартная доза для орального введения млекопитающему весом примерно 50-70 кг может находиться в диапазоне от приблизительно 10 до приблизительно 1000 мг, предпочтительно от приблизительно 25 до приблизительно 250 мг действующего вещества. Настоящее изобретение также относится к способам применения соединений по изобретению и их фармацевтически приемлемых солей или фармацевтических композиций на их основе для ингибирования активности TNF-альфа и ингибирования разрушающих матрикс металлопротеиназ, например, стромелизина, желатиназы, коллагеназы и металлоэластазы макрофага,для ингибирования разрушения ткани матрикса у млекопитающих и для лечения связанных сTNF-альфа и с разрушающими матрикс металлопротеиназами состояний, как представлено в настоящем описании, например, воспалений,ревматоидного артрита, остеоартрита и опухолей (роста, метастазов, прогрессивного развития или инвазии опухоли), легочных заболеваний и т.п., как описано в настоящем изобретении. Опухоли (карциномы) включают такие опухоли млекопитающих, как рак молочной железы, легкого, мочевого пузыря, толстой кишки, предстательной железы и яичника и рак кожи, включая меланому и саркому Капоши. Приведенные ниже примеры служат для иллюстрации изобретения и не направлены на его ограничение. Температуры даны в градусах Цельсия. Если не указано иное, все выпаривания проводят при пониженном давлении, предпочтительно при давлении приблизительно 15100 мм рт. столба (что соответствует 20-133 мбар). Строение конечного продукта, промежуточных и исходных продуктов подтверждают стандартными аналитическими методами, например, получают характеристики с помощью микроанализа или спектроскопии (например,МС, ИК, ЯМР). Примененные сокращения являются общепринятыми в данной области. Концентрации при определении []D выражают в мг/мл. Пример 1. N-(трет-бутилокси)-2(R)-[(4 метоксибензолсульфонил)(4-пиколил)амино]-2(транс-4-пропоксициклогексил)ацетамид (0,84 г,1,5 ммоля) растворяют в дихлорметане (50 мл),содержащем этанол (0,1 мл, 1,5 ммоля) в круглодонной колбе и реакционную смесь охлаждают до -10 С. Барботируют в течение 10 мин ды 23 мящей соляной кислотой (из соответствующей колбы). Реакционную смесь запечатывают, дают медленно нагреться до комнатной температуры и перемешивают в течение 4 дней. Объем растворителя уменьшают до 1/3 путем упаривания и растирают с простым эфиром. Смесь фильтруют, осадок на фильтре удаляют и сушат в вакууме, получая гидрохлорид N-гидрокси-2(R)[(4-метоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-пропоксициклогексил)ацетамида в виде твердого вещества белого цвета, tпл 135140 С, формулы Исходный продукт получают следующим образом.D-4-гидроксифенилглицин (10 г) растворяют в 3 н. гидроксиде натрия (20 мл). Добавляют воду (180 мл), а затем никель Ренея (27 г). Реакционную смесь гидрируют в течение ночи при давлении приблизительно 3 атмосферы при 50-80 С. Реакционную смесь фильтруют через целит, уменьшают объем приблизительно до 85 мл и добавляют диоксан (85 мл). Раствор 4 гидроксициклогексилглицина (см. Coll. Czech.Comm. 49, 712-742 (1984 охлаждают до 0 С и обрабатывают триэтиламином (11,37 мл) и 4 метоксибензолсульфонилхлоридом (10,95 г). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение выходных дней. Диоксан удаляют в вакууме и оставшийся водный раствор разбавляют 1 н. соляной кислотой. Образовавшийся осадок собирают, промывают водой и простым эфиром, получая(3,7 г, 20,4 ммоля) и бензилбромид (3,5 г, 20,4 ммоля), перемешивают при комнатной температуре в течение 24 ч. Смесь разбавляют водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают соляным раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая бензиловый эфир(R)-N-(4-метоксибензолсульфонил)-4-гидроксициклогексилглицина в виде смеси диастереомеров. К раствору неочищенного бензилового эфира 24 по каплям раствор бромида натрия (2,06 г, 20 ммолей) в воде (10 мл), а затем добавляют свободный радикал 2,2,6,6-тетраметил-1-пиперидинилокси (TEMPO, 27 г). К этой смеси по каплям добавляют водный раствор 5%-ного гипохлорита натрия (34,2 мл, 34,3 ммоля, марки Clorox) и воду (34,2 мл), значение рН которой доведено до 8,6 с помощью предварительного добавления бикарбоната натрия. Время добавления полученного водного раствора гипохлорита натрия с установленным значением рН составляет 30 мин, после чего перемешивание продолжают в течение еще 20 мин, поддерживая температуру на уровне 0 С. Дихлорметановый слой отделяют и последовательно промывают 10%-ным водным раствором бисульфата калия(40 мл), небольшим количеством 10%-ного водного йодида калия (330 мл), 10%-ным водным раствором тиосульфата натрия (60 мл) и соляным раствором (40 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме, получая твердое вещество, которое затем может быть очищено перекристаллизацией из этилацетата с получением бензилового эфира(R)-N-(4-метоксибензолсульфонил)-4 оксоциклогексилглицина. К смеси бензилового эфира (R)-N-(4 метоксибензолсульфонил)-4-оксоциклогексилглицина (15 г, 34,6 ммоля) в н-пропаноле (7 мл,93,2 ммоля), содержащем фенилсилан (5,2 мл,43,3 ммоля), добавляют по каплям трифторуксусную кислоту и смесь перемешивают при комнатной температуре в течение ночи. Смесь разбавляют этилацетатом и промывают насыщенным водным раствором бикарбоната натрия. Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией на силикагеле (от 1 до 5% этилацетата/метиленхлорид), получая бензиловый эфир (R)-N-(4-метоксибензолсульфонил)-цис-4-пропоксициклогексилглицина и бензиловый эфир (R)-N-(4 метоксибензолсульфонил)-транс-4-пропоксициклогексилглицина. К раствору, содержащему бензиловый эфир (R)-N-(4-метоксибензолсульфонил)-транс 4-пропоксициклогексилглицина (4,0 г, 8,42 ммоля) в диметилформамиде (55 мл), добавляют гидрохлорид 4-пиколилхлорида (1,5 г, 8,95 ммоля), а затем карбонат калия (11,6 г, 84,2 ммоля). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь разбавляют водой и экстрагируют этилацетатом. Объединенные органические экстракты промывают соляным раствором, сушат 25 этаноле (50 мл), содержащем 3 н. соляную кислоту (5 мл, 15 ммолей), гидрируют при давлении 50 фунтов/кв.дюйм в присутствии 5%-ного палладия на древесном угле (200 мг) при комнатной температуре в течение 4 ч. Реакционную смесь фильтруют через целит, промывая этанолом, и концентрируют в вакууме, получая гидрохлорид 2(R)-[(4-метоксибензолсульфонил)(4 пиколил)амино]-2-(транс-4-пропоксициклогексил)уксусной кислоты в виде неочищенного продукта. Гидрохлорид 2(R)-[(4-метоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-пропоксициклогексил)уксусной кислоты (2,65 г, 4,82 ммоля), 1-гидроксибензотриазол (0,65 г, 4,81 ммоля), 4-метилморфолин (2,93 мл, 26,5 ммоля) и гидрохлорид O-трет-бутилгидроксиламина(1,1 г, 5,8 ммоля) и реакционную смесь перемешивают в течение ночи. Затем реакционную смесь разбавляют водой и экстрагируют метиленхлоридом. Объединенные органические экстракты промывают соляным раствором, сушат(Na2SO4) и растворитель выпаривают. Неочищенный продукт очищают хроматографией на силикагеле (5% метанол/метиленхлорид), получая N-(трет-бутилокси)-2(R)-[(4-метоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-пропоксициклогексил)ацетамид. Пример 2. Аналогично примеру 1, получают следующие соединения:(а) К раствору N-(трифенилметокси)-2(R)[(4-метоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-метокси-4-метилциклогексил) ацетамида (348 мг, 0,48 ммоля) в метиленхлориде, содержащем триэтилсилан (260 мкл, 1,63 ммоля) при 0 С добавляют по каплям трифторуксусную кислоту (260 мкл, 3,4 ммоля). Через 20 мин реакционную смесь непосредственно концентрируют в вакууме и разбавляют метиленхлоридом (4 мл). Образовавшийся раствор охлаждают до 0 С и подкисляют газообразным хлористым водородом. Растворитель вновь удаляют в вакууме и остаток повторно растворяют в метиленхлориде. Раствор растирают, добавляя для осаждения продукта пентан. Супернатант удаляют и процесс повторяют до полного удаления трифенилметана. Оставшийся твердый осадок представляет собой гидрохлорид N-гидрокси 2(R)-[(4-метоксибензолсульфонил)(4-пиколил) амино]-2-(транс-4-метокси-4-метилциклогексил)ацетамида, tпл 133 С. Исходный продукт получают следующим образом. Раствор бензилового эфира (R)-N-(4 метоксибензолсульфонил)-4-оксоциклогексилглицина (см. пример 1,5,0 г, 11,6 ммоля) в метиленхлориде (35 мл) добавляют при комнатной температуре к раствору тетрахлорида титана(1,0 М в метиленхлориде) (21,2 мл, 21,2 ммоля) и диметилцинка (1,0 М в гептане) (23,0 мл, 23,0 ммоля) при -78 С в дихлорметане (20 мл). Реакционную смесь перемешивают при -78 С в течение 30 мин, затем медленно нагревают до комнатной температуры в течение 2,5 ч. Реакционную смесь сливают на воду (700 мл) и экстрагируют хлороформом. Объединенные органические экстракты промывают водой, сушат(MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией на силикагеле (40% этилацетат/гексан),получая бензиловый эфир (R)-N-(4-метоксибензолсульфонил)-транс-4-гидрокси-4-метилциклогексилглицина и бензиловый эфир (R)-N(4-метоксибензолсульфонил)-цис-4-метил-4 гидроксициклогексилглицина. К раствору бензилового эфира (R)-N-(4 метоксибензолсульфонил)-транс-4-гидрокси-4 метилциклогексилглицина (600,0 мг, 1,34 ммоля) в метиленхлориде (15 мл), содержащем 2,6 ди-трет-бутилпиридин (755 мкл, 3,36 ммоля),добавляют по каплям при комнатной температуре метилтрифторметансульфонат (305 мкл,2,68 ммоля). Реакционную смесь перемешивают 28 при комнатной температуре в течение ночи и реакцию прекращают, добавляя небольшое количество метанола. Смесь разбавляют хлороформом, затем промывают насыщенным водным раствором хлорида аммония и водой. Органический слой сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией на силикагеле (35% этилацетат/гексан),получая бензиловый эфир (R)-N-(4-метоксибензолсульфонил)-транс-4-метокси-4-метилциклогексилглицина. После гидрогенолиза бензилового эфира до кислоты и обработки O-тритилгидроксиламином (вместо O-трет-бутилгидроксиламина), как в примере 1, получают N(трифенилметокси)-2(R)-[(4-метоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-метокси-4 метилциклогексил)ацетамид.(б) аналогично получают гидрохлорид Nгидрокси-2(R)-[(4-метоксибензолсульфонил)(4 пиколил)амино]-2-(цис-4-метокси-4-метилциклогексил)ацетамида, tпл 128 С. Пример 4. Получение 3000 капсул, каждая из которых содержит по 25 мг действующего вещества,например,N-гидрокси-2(R)-[(4 метоксибензолсульфонил)(4-пиколил)амино]-2(транс-4-пропоксициклогексил)ацетамида: Действующее вещество ЛактозаPolyplasdone XL (поливинилпирролидон) Очищенная вода Стеарат магния Действующее вещество просеивают через ручное сито 30. Действующее вещество, лактозу, Avicel PH 102 и Polyplasdone XL смешивают в течение 15 мин в смесителе. Смесь гранулируют с достаточным количеством воды(примерно 500 мл), сушат в термостате при 35 С в течение ночи и просеивают через сито 20. Стеарат магния просеивают через сито 20, добавляют к гранулированной смеси и смесь смешивают в течение 5 мин в смесителе. Смесь капсулируют в желатиновые капсулы с твердым покрытием 0, каждая из которых содержит количество смеси, эквивалентное 25 мг действующего вещества. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR2 обозначает водород или С 1-С 7 алкил;R3 и R4 независимо друг от друга обозначают водород, С 1-С 7 алкил, С 1-С 7 алкокси, галоген, гидрокси, ацилокси, С 1-С 7 алкокси-С 1 С 7 алкокси, трифторметил или циано, или R3 иR4 вместе с соседними атомами углерода обозначают С 2-С 7 алкилендиокси, иn обозначает целое число от 1 до 5,его фармацевтически приемлемое производное,являющееся пролекарством, или его фармацевтически приемлемая соль. 2. Соединение по п.1 формулы IIIR2 обозначает водород или С 1-С 7 алкил;R3 обозначает водород или С 1-С 7 алкокси;R4 обозначает водород или С 1-С 7 алкокси; иn равно 1 или 2; его фармацевтически приемлемое производное,являющееся пролекарством, или его фармацевтически приемлемая соль. 3. Соединение по п.2 формулы III, где Аr обозначает пиридил, не обязательно моно- или дизамещенный C1-С 6 алкилом;n равно 1 или 2,или его фармацевтически приемлемая соль. 4. Соединение по п.2 формулы III, в которой Аr обозначает 3- или 4-пиридил;n равно 1,или его фармацевтически приемлемая соль. 5. Соединение по п.2, которое представляет собой N-гидрокси-2(R)-[(4-этоксибензолсульфонил)(4-пиколил)амино]-2-(транс-4-пропоксициклогексил)ацетамид, или его фармацевтически приемлемая соль.
МПК / Метки
МПК: C07C 311/29, A61K 31/44, C07D 213/42
Метки: кислоты, ингибиторов, металлопротеиназ, tnf-альфа, матричных, альфа-замещенные, качестве, арилсульфонамидогидроксамовые
Код ссылки
<a href="https://eas.patents.su/16-2019-alfa-zameshhennye-arilsulfonamidogidroksamovye-kisloty-v-kachestve-ingibitorov-tnf-alfa-i-matrichnyh-metalloproteinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Альфа-замещенные арилсульфонамидогидроксамовые кислоты в качестве ингибиторов tnf-альфа и матричных металлопротеиназ</a>
Предыдущий патент: Портативный проигрыватель компакт-дисков
Следующий патент: Способ генерации противовирусного иммунного ответа у человека или животного
Случайный патент: Ветроэлектростанция












