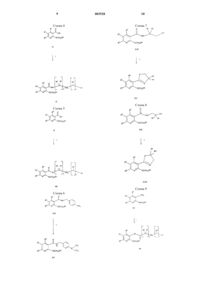
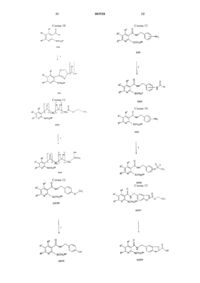
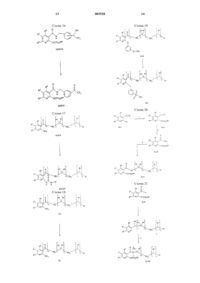
Производные никотинамида, их применение, фармацевтическая композиция, способ лечения и способ ингибирования изоферментов фдэ4 d
Номер патента: 3528
Опубликовано: 26.06.2003
Авторы: Ченг Джон Бин, Чеймберс Роберт Джеймс, Уотсон Джон Уэсли, Марфэт Энтони, Клайнмен Эдуард Фокс, Даплэнтьер Аллен Джейкоб
Формула / Реферат
1. Производные никотинамида формулы (I)
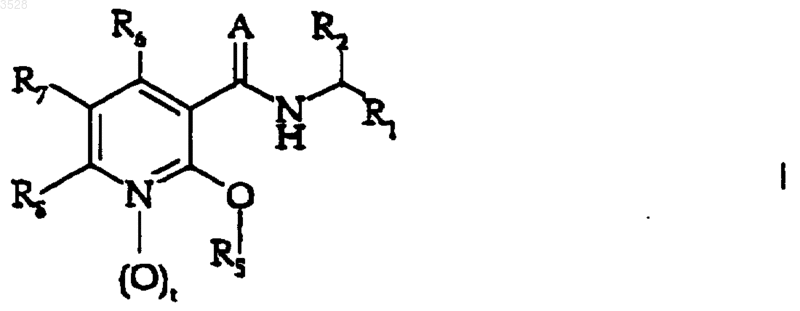
или их фармацевтически приемлемые соли,
где t равно 0 или 1;
A представляет собой кислород или NH;
R1 представляет собой (C3-C7)циклоалкил, (C6-C10)арил или насыщенную или ненасыщенную циклическую или бициклическую (C3-C7)гетероциклическую группу, содержащую в качестве гетероатома от одного до четырех гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы, азота и NR9, где R9 является водородом или (C1-C6)алкилом;
где указанные циклоалкильные, арильные, бициклоалкильные и гетероциклические группы возможно замещены заместителями в количестве от одного до трех, независимо выбранными из заместителей, состоящих из галогено, (C1-C6)алкила, (C1-C6)алкокси, гидрокси(C1-C6)алкила, амино, (C1-C6)алкиламино, ((C1-C6)алкил)2амино или гидрокси(C1-C6)алкиламино;
R2 представляет собой водород или (C1-C6) алкил;
R5 представляет собой группу формулы
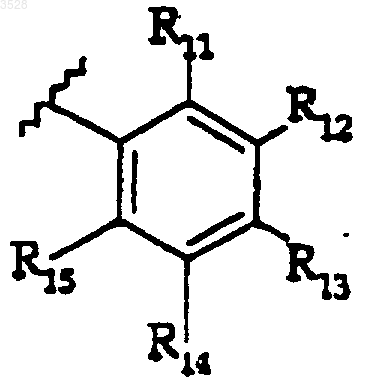
где R11, R12, R13, R14 и R15 каждый является заместителем, независимо выбранным из группы, состоящей из водорода, галогено, циано, амино, нитро, гидрокси, (C1-C6)алкила, (C1-C6)алкокси, (C3-C7)циклоалкила, гидрокси(C1-C6)алкила, дифторметила, трифторметила, дифторметокси, трифторметокси, (C1-C6)алкиламино, ((C1-C6)алкил)2амино;
где алкильные, алкоксильные или циклоалкильные группы указанных групп R11, R12, R13, R14 и R15 возможно замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из галогено, циано, нитро, трифторметила и трифторметокси;
или R12 и R13 вместе с атомами углерода, к которым они присоединены, могут образовывать группу формулы
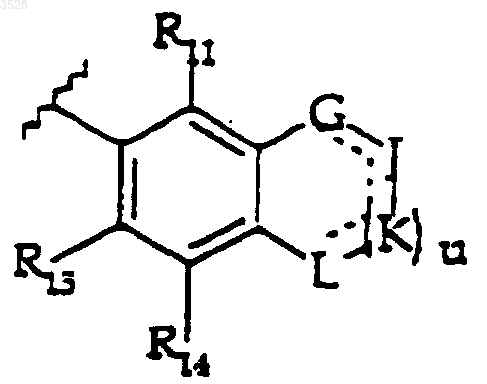
где u равно 0 или 1; и
G, J, K и L, каждый независимо, представляет собой кислород, серу, NR9, где R9 является таким, как определено выше, карбонил или CHR16, где R16 представляет собой водород, карбокси или (C1-C6)алкил; где пунктирные линии представляют собой двойные связи, и где понятно, что когда между G и J, J и K или K и L существует двойная связь, тогда R9 отсутствует, >CHR16 представляет собой >CR16 и G, J, K и L не могут быть карбонилом;
R6, R7 и R8, каждый независимо, выбран из группы, состоящей из водорода, галогено, нитро, трифторметил и трифторметокси;
при условии, что когда A представляет собой кислород, R2 представляет собой водород; R1 представляет собой фенил, замещенный метилом, метокси, хлоро или фторо; и R5 представляет собой фенил, возможно замещенный одной или двумя группами фторо или хлоро; тогда R1 должен быть дополнительно замещен, по меньшей мере, одним заместителем из перечисленных выше, иным чем метил, метокси или галогено;
при условии, что когда t равно 1, тогда соединение формулы I является цвиттерионным N-оксидом;
при условии, что оба соседние положения, обозначенные как G, J, K и L, не могут быть определены как кислород; и
при условии, что когда A представляет собой кислород, R2, R6, R7, R8 представляют собой водород и R1 представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из (C1-4)алкила, (C1-C4)алкокси и галогено, тогда R5 не представляет собой группу формулы
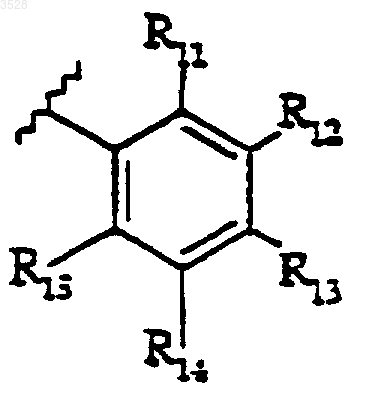
где R11, R12, R13, R14 и R15 представляют собой водород и R14 выбран из галогено и трифторметила.
2. Соединение по п.1, где R2 представляет собой водород; R1 представляет собой (C6-C10)арил, возможно замещенный галогено, (C1-C6)алкилом, (C1-C6)алкокси, гидрокси(C1-C6)алкилом, амино, (C1-C6)алкиламино, ((C1-C6)алкил)2амино или гидрокси(C1-C6)алкиламино.
3. Соединение по п.2, где R1 представляет собой (C6-C10)арил, возможно замещенный гидрокси(C1-C6)алкилом.
4. Соединение по п.1, где A представляет собой кислород; R2 представляет собой водород; R1 представляет собой (C6-C10)арил, возможно замещенный гидрокси(C1-C6)алкилом.
5. Применение соединения формулы (I)
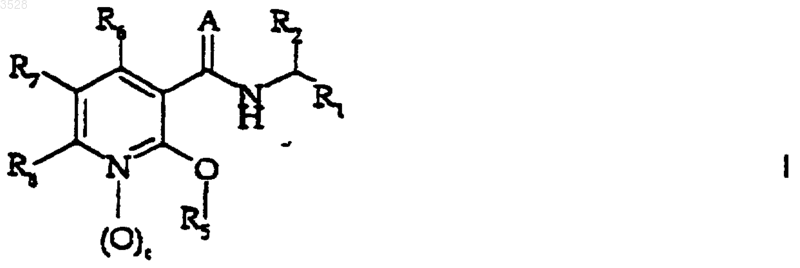
или его фармацевтически приемлемой соли,
где t равно 0 или 1;
А представляет собой кислород или NH;
R1 представляет собой (C3-C7)циклоалкил, (C6-C10)арил или насыщенную или ненасыщенную циклическую или бициклическую (C3-C7)гетероциклическую группу, содержащую в качестве гетероатома от одного до четырех гетероатомов, независимо выбранных из группы, состоящей из кислорода, серы, азота и NR9, где R9 является водородом или (C1-C6)алкилом;
где указанные циклоалкильные, арильные, бициклоалкильные и гетероциклические группы возможно замещены заместителями в количестве от одного до трех, независимо выбранными из заместителей, состоящих из галогено, (C1-C6)алкила, (C1-C6)алкокси, гидрокси(C1-C6)алкила, амино, (C1-C6)алкиламино, ((C1-C6)алкил)2амино или гидрокси(C1-C6)алкиламино;
R2 представляет собой водород или (C1-C6) алкил;
R5 представляет собой группу формулы
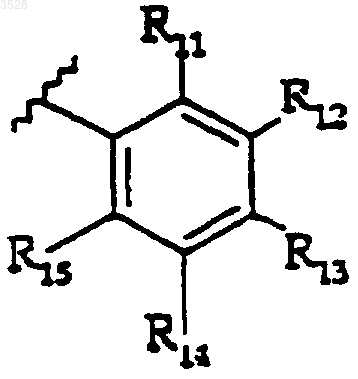
где R11, R12, R13, R14 и R15 каждый является заместителем, независимо выбранным из группы, состоящей из водорода, галогено, циано, амино, нитро, гидрокси, (C1-C6)алкила, (C1-C6)алкокси, (C3-C7)циклоалкила, гидрокси(C1-C6)алкила, дифторметила, трифторметила, дифторметокси, трифторметокси, (C1-C6)алкиламино, ((C1-C6)алкил)2амино;
где алкильные, алкоксильные или циклоалкильные группы указанных групп R11, R12, R13, R14 и R15 возможно замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из галогено, циано, нитро, трифторметила и трифторметокси;
или R12 и R13 вместе с атомами углерода, к которым они присоединены, могут образовывать группу формулы
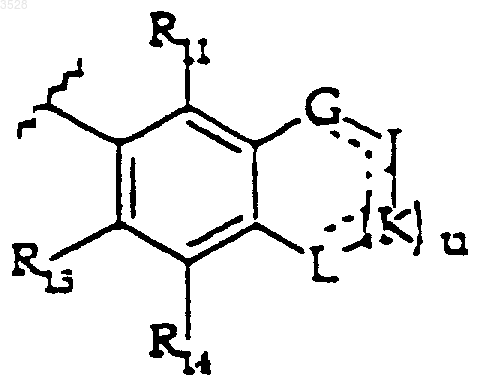
где u равно 0 или 1 и
G, J, K и L, каждый независимо, представляет собой кислород, серу, NR9, где R9 является таким, как определено выше, карбонил или CHR16, где R16 представляет собой водород, карбокси шыш (C1-C6)алкил; где пунктирные линии представляют собой двойные связи, и где понятно, что когда между G и J, J и K или K и L существует двойная связь, тогда R9 отсутствует, >CHR16 представляет собой >CR16 и G, J, K и L не могут быть карбонилом;
R6, R7 и R8, каждый независимо, выбран из группы, состоящей из водорода, галогено, нитро, трифторметил и трифторметокси;
при условии, что когда A представляет собой кислород, R2 представляет собой водород, R1 представляет собой фенил, замещенный метилом, метокси, хлоро или фторо, и R5 представляет собой фенил, возможно замещенный одной или двумя группами фторо или хлоро, тогда R1 должен быть дополнительно замещен, по меньшей мере, одним заместителем из перечисленных выше, иным чем метил, метокси или галогено;
при условии, что когда t равно 1, тогда соединение формулы I является цвиттерионным N-оксидом;
при условии, что оба соседние положения, обозначенные как G, J, K и L, не могут быть определены как кислород;
в качестве лекарственного средства для лечения респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств.
6. Фармацевтическая композиция для лечения респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит, кахексия, болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, содержащая количество соединения формулы (I)
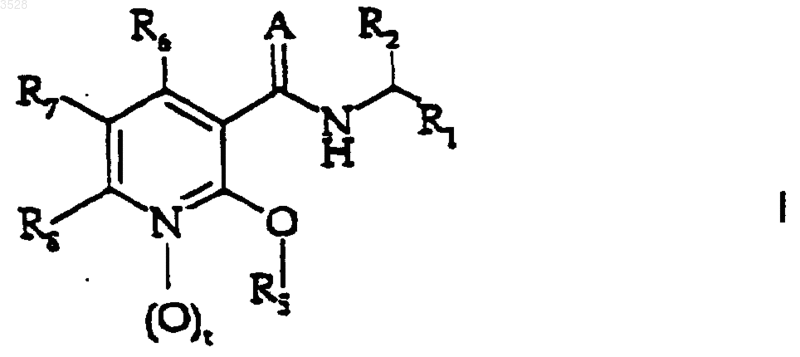
где значения радикалов такие, как определено в п.5, или его фармацевтически приемлемой соли, эффективное при таком предупреждении или лечении, и фармацевтически приемлемый носитель.
7. Способ лечения респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит, кахексия, болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, при котором указанному млекопитающему вводят количество соединения формулы (I)
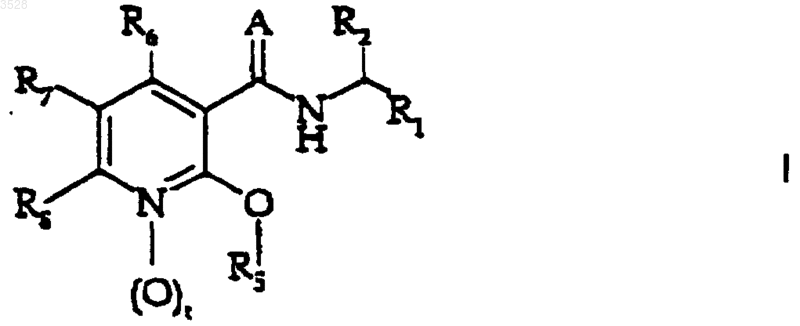
где значения радикалов такие, как определено в п.5, или его фармацевтически приемлемой соли, эффективное при таком лечении.
8. Фармацевтическая композиция для селективного ингибирования изоферментов ФДЭ4 D, которые регулируют активацию и дегрануляцию эозинофилов человека, пригодная при лечении респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит, кахексия, болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, содержащая эффективное в отношении ингибирования изофермента ФДЭ4 D количество соединения формулы (I)
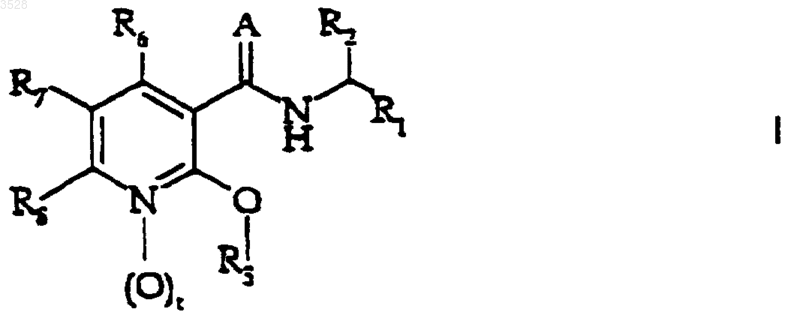
где значения радикалов такие, как определено в п.5, или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
9. Способ селективного ингибирования изоферментов ФДЭ4 D, которые регулируют активацию и дегрануляцию эозинофилов человека, применяемый при лечении респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит, кахексия, болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, при котором указанному млекопитающему вводят эффективное в отношении ингибирования изофермента ФДЭ4 D количество соединения формулы (I)
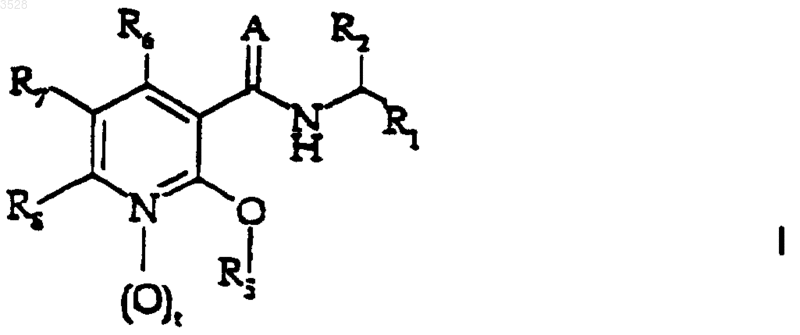
где значения радикалов такие, как определено в п.5, или его фармацевтически приемлемой соли.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к производным никотинамида, которые являются селективными ингибиторами фосфодиэстеразы типа 4 (ФДЭ 4) и продуцирования фактора некроза опухоли (ФНО) и, как таковые, могут применяться при лечении респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительного расстройств, таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит, кахексия,болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания. Настоящее изобретение относится также к способу применения таких соединений при лечении упомянутых выше заболеваний у млекопитающих, особенно у людей, и к фармацевтическим композициям, содержащим такие соединения. С тех пор, как было официально признано,что циклический аденозинмонофосфат (цАМФ) является вторичным внутриклеточным мессенджером, ингибирование фосфодиэстераз стало целью модулирования и, соответственно,терапевтического вмешательства в ряде болезненных процессов. Недавно распознали отдельные классы ФДЭ, и их селективное ингибирование привело к усовершенствованию лекарственной терапии. В частности, стало известно,что ингибирование ФДЭ 4 может приводить к ингибированию высвобождения воспалительного медиатора и релаксации гладких мышц дыхательных путей. Таким образом, соединения,которые ингибируют ФДЭ 4, но которые обладают низкой активностью по отношению к другим типам ФДЭ, будут ингибировать высвобождение воспалительных медиаторов и релаксировать гладкие мышцы дыхательных путей без сердечнососудистых или антитромбоцитарных эффектов. Недавнее молекулярное клонирование выявило сложность и многообразие ферментов ФДЭ 4. В настоящее время известно, что существует четыре различных изофермента ФДЭ 4(А, В, С и D), каждый из которых кодируется отдельным геном. Кинетические исследования рекомбинантных материалов человека позволяют предположить, что эти четыре изофермента можно различать по их значениям Km и Vmax в отношении гидролиза цАМФ. Анализ распределения ФДЭ 4 мРНК в тканях позволяет предположить, что каждый изофермент может характеризоваться клеточно-специфичной локализацией. Например, лейкоциты периферической крови человека, в отличие от скелетной мышцы человека, не экспрессируют фосфодиэстеразу ФДЭ 4 С, а эозинофилы морской свинки в основ 003528 2 ном экспрессируют фосфодиэстеразу ФДЭ 4D. Структурное разнообразие и многообразие распределения изоферментов ФДЭ 4 дает благоприятную возможность обнаружить изоферментселективный ингибитор, который блокирует функцию только воспалительных клеток. Используя ингибиторы, селективные в отношении изофермента ФДЭ 4D, мы продемонстрировали,что изофермент ФДЭ 4D играет ключевую роль в регуляции активации и дегрануляции эозинофилов человека. В модели астмы у приматов соединения, селективные в отношении изофермента ФДЭ 4D, ингибируют легочную эозинофилию, индуцированную антигеном. Следовательно, селективно блокируя изофермент D,ингибиторы ФДЭ 4D проявляют пониженные побочные эффекты и сохраняют противоастматическую (противовоспалительную) эффективность. Сущность изобретения Настоящее изобретение относится к производным никотина формулы или их фармацевтически приемлемым солям,гдеt равно 0 или 1; А представляет собой кислород или NН;R1 представляет собой (С 3-С 7)циклоалкил,(С 6-С 10)арил или насыщенную или ненасыщенную циклическую или бициклическую (С 3 С 7)гетероциклическую группу, содержащую в качестве гетероатома от одного до четырех гетероатомов, независимо выбранных из группы,состоящей из кислорода, серы, азота и NR9, гдеR9 является водородом или (С 1-С 6)алкилом; где указанные циклоалкильные, арильные,бициклоалкильные и гетероциклические группы возможно замещены заместителями в количестве от одного до трех, независимо выбранными из заместителей, состоящих из галогено, (С 1-С 6) алкила, (С 1-С 6)алкокси, гидрокси(С 1-С 6)алкила,амино, (С 1-С 6)алкиламино, С 1-С 6)алкил)2 амино или гидрокси(С 1-С 6)алкиламино;R2 представляет собой водород или (С 1-С 6) алкил;R5 представляет собой группу формулы где R11, R12, R13, R14 и R15 каждый является заместителем, независимо выбранным из группы,состоящей из водорода, галогено, циано, амино,нитро, гидрокси, (С 1-С 6)алкила, (С 1-С 6)алкокси,(С 3-С 7)циклоалкила,гидрокси(С 1-С 6)алкила,дифторметила, трифторметила, дифторметокси,трифторметокси, (С 1-С 6)алкиламино, С 1-С 6) алкил)2 амино, где алкильные, алкоксильные или циклоалкильные группы указанных групп R11, 3R12, R13, R14 и R15 возможно замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из галогено, циано, нитро, трифторметила и трифторметокси; или R12 и R13 вместе с атомами углерода, к которым они присоединены, могут образовывать группу формулыCHR16, где R16 представляет собой водород, карбокси или (С 1-С 6)алкил; где пунктирные линии представляют собой двойные связи, и где понятно, что когда между G и J, J и K или K и L существует двойная связь, тогда R9 отсутствует,CHR16 представляет собой CR16, и G, J, K и L не могут быть карбонилом;R1 представляет собой фенил, замещенный метилом, метокси, хлоро или фторо; и R5 представляет собой фенил, возможно замещенный одной или двумя фторо или хлоро; тогда R1 должен быть дополнительно замещен, по меньшей мере, одним заместителем из перечисленных выше, иным чем метил, метокси или галогено; при условии, что когда t равно 1, тогда соединение формулы I является цвиттер-ионнымN-оксидом; при условии, что соседние положения,обозначенные как G, J, K и L, не могут быть одновременно определены как кислород; и при условии, что когда А представляет собой кислород; R2, R6, R7, R8 представляют собой водород и R1 представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из (С 1-4)алкила, (С 1-С 4) алкокси и галогено, тогда R5 не представляет собой группу формулы где R11, R12, R13, R14 и R15 представляют собой водород, и R14 выбран из галогено и трифторметила. Предпочтительные соединения формулы I включают в себя соединения, где R2 представляет собой водород; R1 представляет собой (С 6 С 10)арил, возможно замещенный галогено, (С 1 С 6)алкилом, (С 1-С 6)алкокси, гидрокси(С 1-С 6) 4 алкилом, амино, (С 1-С 6)алкиламино, С 1-С 6) алкил)2 амино или гидрокси(С 1-С 6)алкиламино. Более предпочтительными соединениями формулы I являются соединения, где R1 представляет собой (С 6-С 10)арил, возможно замещенный гидрокси(С 1-С 6)алкилом. Другие предпочтительные соединения формулы 1 включают в себя соединения, где А представляет собой кислород; R2 представляет собой водород; R1 представляет собой (С 6-С 10) арил, возможно замещенный гидрокси(С 1-С 6) алкилом. Настоящее изобретение относится также к применению соединения формулы (I) или его фармацевтически приемлемой соли в качестве лекарственного средства для лечения респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств. Настоящее изобретение также относится к фармацевтической композиции для лечения респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма,хроническое обструктивное заболевание легких,синдром респираторных заболеваний взрослых,фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит,кахексия, болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, содержащей количество соединения формулы (I) или его фармацевтически приемлемой соли, эффективное для такого предупреждения или лечения, и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения респираторных, аллергических,ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств,таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса,ревматоидный артрит, кахексия, болезнь Крона,неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, при котором указанному млекопитающему вводят количество соединения формулы(I) или его фармацевтически приемлемой соли,эффективное при таком лечении. Настоящее изобретение также относится к фармацевтической композиции для селективного ингибирования изоферментов ФДЭ 4D, которые регулируют активацию и дегрануляцию эозинофилов человека, пригодной при лечении респираторных, аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма, 5 хроническое обструктивное заболевание легких,синдром респираторных заболеваний взрослых,фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит,кахексия, болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, содержащей эффективное в отношении ингибирования изофермента ФДЭ 4D количество соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу селективного ингибирования изоферментов ФДЭ 4 D, которые регулируют активацию и дегрануляцию эозинофилов человека,применяемому при лечении респираторных,аллергических, ревматоидных расстройств, расстройств регуляции веса тела и воспалительных расстройств, таких как астма, хроническое обструктивное заболевание легких, синдром респираторных заболеваний взрослых, фиброз, легочная гиперчувствительность, аллергический ринит, атопический дерматит, псориаз, регулирование веса, ревматоидный артрит, кахексия,болезнь Крона, неспецифический язвенный колит, артритические состояния и другие воспалительные заболевания, у млекопитающего, в том числе у человека, при котором указанному млекопитающему вводят эффективное в отношении ингибирования изофермента ФДЭ 4 D количество соединения формулы (I) или его фармацевтически приемлемой соли. Причем для соединения формулы (I), которое применяют по указанному выше назначению и используют в вышеописанных композициях и способах, радикалы имеют следующие значения:t равно 0 или 1; А представляет собой кислород или NH;R1 представляет собой (С 3-С 7)циклоалкил,(С 6-С 10)арил или насыщенную или ненасыщенную циклическую или бициклическую (С 3-С 7) гетероциклическую группу, содержащую в качестве гетероатома от одного до четырех гетероатомов, независимо выбранных из группы,состоящей из кислорода, серы, азота, и NR9, гдеR9 является водородом или (С 1-С 6)алкилом; где указанные циклоалкильные, арильные,бициклоалкильные и гетероциклические группы возможно замещены заместителями в количестве от одного до трех, независимо выбранными из заместителей, состоящих из галогено, (С 1-С 6) алкила, (С 1-С 6)алкокси, гидрокси(С 1-С 6)алкила,амино, (С 1-С 6)алкиламино, С 1-С 6)алкил)2 амино или гидрокси(С 1-С 6)алкиламино;R2 представляет собой водород или (С 1-С 6) алкил;R5 представляет собой группу формулы где R11, R12, R13, R14 и R15 каждый является заместителем, независимо выбранным из группы,состоящей из водорода, галогено, циано, амино,нитро, гидрокси, (С 1-С 6)алкила, (С 1-С 6)алкокси,(С 3-С 7)циклоалкила,гидрокси(С 1-С 6)алкила,дифторметила, трифторметила, дифторметокси,трифторметокси, (С 1-С 6)алкиламино, С 1-С 6) алкил)2 амино; где алкильные, алкоксильные или циклоалкильные группы указанных групп R11, R12,R13, R14 и R15 возможно замещены заместителями в количестве от одного до трех, независимо выбранными из группы, состоящей из галогено,циано, нитро, трифторметила и трифторметокси; или R12 и R13 вместе с атомами углерода, к которым они присоединены, могут образовывать группу формулыCHR16, где R16 представляет собой водород, карбокси или (С 1-С 6)алкил; где пунктирные линии представляют собой двойные связи, и где понятно, что когда между G и J, J и K или K и L существует двойная связь, тогда R9 отсутствует,CHR16 представляет собой CR16, и G, J, K и L не могут быть карбонилом;R2 представляет собой водород; R1 представляет собой фенил, замещенный метилом, метокси,хлоро или фторо; и R5 представляет собой фенил, возможно замещенный одной или двумя группами фторо или хлоро; тогда R1 должен быть дополнительно замещен, по меньшей мере,одним заместителем из перечисленных выше,иным чем метил, метокси или галогено; при условии, что когда t равно 1, тогда соединение формулы I является цвиттер-ионнымN-оксидом; при условии, что оба соседние положения,обозначенные как G, J, K и L, не могут быть определены как кислород. Термин "алкил", используемый в этом документе, если не указано иначе, включает в себя насыщенные одновалентные углеводородные 7 радикалы, имеющие нормальные, разветвленные или циклические группировки или их комбинации. Термин "алкокси", используемый этом документе, включает в себя О-алкильные группы,где "алкил" определен выше. Термин "арил", используемый в этом документе, если не указано иначе, включает в себя органический радикал, полученный из ароматического углеводорода удалением одного водорода, такой как фенил или нафтил, возможно замещенный заместителями в количестве от 1 до 3, выбранными из группы, состоящей из фторо, хлоро, трифторметила, (С 1-С 6)алкокси, (С 6 С 10)арилокси, трифторметокси, дифторметокси и (С 1-С 6)алкила. Термин "насыщенная или ненасыщенная циклическая или бициклическая (С 3-С 7)гетероциклическая группа, содержащая от одного до четырех гетероатомов из группы, состоящей из кислорода, серы, азота и NR9, где R9 является таким, как определено выше", используемый в этом документе, если не указано, иначе, включает в себя, но не ограничен ими, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидропиранил, пиранил, тиопиранил, азиридинил, оксиранил, метилендиоксил, хроменил,изоксазолидинил, 1,3-оксазолидин-3-ил, изотиазолидинил, 1,3-тиазолидин-3-ил, 1,2-пиразолидин-2-ил, 1,3-пиразолидин-1-ил, пиперидинил,тиоморфолинил, 1,2-тетрагидротиазин-2-ил, 1,3 тетрагидротиазин-3-ил, тетрагидротиадиазинил,морфолинил, 1,2-тетрагидродиазин-2-ил, 1,3 тетрагидродиазин-1-ил,тетрагидроазепинил,пиперазинил, хроманил, фурил, тиенил, тиазолил, пиразолил, изотиазолил, оксазолил, изоксазолил, пирролил, триазолил, тетразолил, имидазолил, 1,3,5-оксадиазолил, 1,2,4-оксадиазолил,1,2,3-оксадиазолил, 1,3,5-тиадиазолил, 1,2,3 тиадиазолил, 1,2,4-тиадиазолил, пиридил, пиримидил,пиразинил,пиридазинил,1,2,4 триазинил, 1,2,3-триазинил, 1,3,5-триазинил,пиразоло[3,4-b]пиридинил, циннолинил, птеридинил, пуринил, 6,7-дигидро-5 Н-[1]пуриндинил,бензо[b]тиофенил, 5,6,7,8-тетрагидро-хинолин 3-ил, бензоксазолил, бензотиазолил, бензотиадиазол, бензизотиазолил, бензизоксазолил, бензимидазолил, тианафтенил, изотианафтенил,бензофуранил, изобензофуранил, изоиндолил,индолил, индолизинил, индазолил, изохинолил,хинолил, фталазинил, хиноксалинил, хиназолинил и бензоксазинил. Предпочтительно, гетероциклическая группа относится к фурилу, тиенилу, тиазолилу, оксазолилу, изоксазолилу, 1,2,3 тиадиазолилу, пиридилу, бензоксазолилу или индолилу. Соединение формулы I может иметь хиральные центры и, следовательно, существовать в различных энантиомерных формах. Данное изобретение относится ко всем оптическим изомерам и стереоизомерам соединений формулы I и их смесям. 8 Подробное описание изобретения Следующие реакционные схемы иллюстрируют получение соединений по настоящему изобретению. Схема 1 По реакции 1 схемы 1, соединение 2 хлорпиридина формулы IV превращают в соответствующее соединение формулы III взаимодействием IV с соединением формулы R5(CH2)rOH в присутствии гидрида натрия и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 3 ч и и приблизительно 20 ч,предпочтительно приблизительно 4 ч. По реакции 1 схемы 2, соединение 3 карбоновой кислоты формулы IV превращают в соответствующее соединение этилового эфира пиридина формулы VI взаимодействием IV с этанолом в присутствии тиенилхлорида. Реакционную смесь нагревают до образования флегмы в течение периода времени между приблизительно 1 ч и приблизительно 3 ч, предпочтительно приблизительно 1,5 ч. По реакции 2 схемы 2, соединение 2 хлорпиридина формулы VI превращают в соответствующее соединение формулы V взаимодействием VI с соединением формулы R5(CH2)rOH в присутствии карбоната цезия и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при температуре между приблизительно 65 С и приблизительно 90 С, предпочтительно приблизительно 65 С, в течение периода времени между приблизительно 10 ч и приблизительно 18 ч, предпочтительно приблизительно 10 ч. По реакции 3 схемы 2, соединение этилового эфира пиридина формулы V превращают в соответствующее соединение 3-карбоновой кислоты формулы III взаимодействием V с этанолом в присутствии гидроксида натрия. Реакционную смесь нагревают до образования флегмы 18 в течение периода времени между приблизительно 3 ч и приблизительно 5 ч, предпочтительно приблизительно 4 ч. По реакции 1 схемы 3, соединение 3 карбоновой кислоты формулы IV превращают в соответствующее соединение бензилового эфира пиридина формулы Х взаимодействием IV с бензилбромидом в присутствии карбоната калия и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 10 ч. По реакции 2 схемы 3, соединение 2 хлорпиридина формулы Х превращают в соответствующее соединение формулы IX взаимодействием Х с 3-йодфенолом в присутствии карбоната цезия и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при температуре между приблизительно 70 С и приблизительно 80 С, предпочтительно приблизительно 75 С, в течение периода времени между приблизительно 1 ч и приблизительно 6 ч, предпочтительно приблизительно 2 ч. По реакции 3 схемы 3, соединение (3-йодфенокси)пиридина формулы IX превращают в соответствующее соединение формулы VIII взаимодействием IX с оксидом углерода и метанолом в присутствии ацетата палладия, 1,1 бис(дифенилфосфино)ферроцена, триэтиламина и полярного апротонного растворителя, такого как диметилформамид. Реакционную смесь нагревают до температуры между приблизительно 50 С и приблизительно 70 С, предпочтительно приблизительно 60 С, в течение периода времени между приблизительно 2 ч и приблизительно 4 ч, предпочтительно приблизительно 4 ч. По реакции 4 схемы 3, соединение бензилового эфира пиридина формулы VIII превращают в соответствующее соединение формулыVII гидрированием VIII в присутствии палладия на угле, метанола и этилацетата. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 2 ч, предпочтительно приблизительно 2 ч. По реакции 1 схемы 4, соединение пиридинкарбоновой кислоты формулы III превращают в соответствующее соединение формулы одним из четырех различных способов синтеза. По первому способу соединение формулы 19 полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 10 ч. По второму способу, III подвергают взаимодействию с хлорформиатом, таким как изобутилхлорформиат, в присутствии N-метилморфолина и полярного апротонного растворителя, такого как метиленхлорид, при температуре между приблизительно 0 С и приблизительно -20 С, предпочтительно приблизительно-10 С, в течение периода времени между приблизительно 15 мин и приблизительно 1 ч,предпочтительно приблизительно 30 мин. Реакционную смесь нагревают до комнатной температуры и добавляют соединение формулы XII. Полученную реакционную смесь перемешивают в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 10 ч. По третьему способу, соединение формулы III нагревают до образования флегмы в присутствии тионилхлорида в течение периода времени между приблизительно 1 часом и приблизительно 24 ч, предпочтительно приблизительно 1 ч. Затем полученный хлорангидрид подвергают взаимодействию с соединением формулы XII в присутствии пиридина и полярного апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре между приблизительно 0 С и приблизительно комнатной температурой, предпочтительно приблизительно 0 С. По четвертому способу, соединение формулы III подвергают взаимодействию с XII в присутствии бензилоктилфталата (БОФ), диизопропилэтиламина и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 3 ч и приблизительно 4 ч, предпочтительно приблизительно 4 ч. По реакции 1 схемы 5, соединение 3 карбоновой кислоты пиридина формулы III превращают в соответствующее соединение формулы XIII взаимодействием III с соединением формулы(ДМАП), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, пиридина и диэтилового эфира. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 3 ч, предпочтительно приблизительно 1 ч. По реакции 1 схемы 6, соединение формулы XVI превращают в соответствующее соеди 003528 20 нение формулы XV взаимодействием XVI с ацетонитрилом в присутствии формальдегида и цианоборогидрида натрия. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 14 ч и приблизительно 16 ч, предпочтительно приблизительно 16 ч. По реакции 1 схемы 7, соединение формулы XVII превращают в соответствующее соединение формулы XVI сначала взаимодействиемXVII с хлорангидридом фосфорной кислоты в апротонном растворителе, таком толуол, затем обработкой соединения, полученного таким образом, гидроксидом натрия в полярном протонном растворителе, таком как метанол. Реакцию проводят при температуре между приблизительно 0 С и комнатной температурой, предпочтительно приблизительно 22 С, в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 12 ч. По реакции 1 схемы 8, соединение формулы XIX превращают в соответствующее соединение формулы XVIII способом, который описан в реакции 1 схемы 7. По реакции 1 схемы 9, соединение 3 аминопиридина формулы XXI превращают в соответствующее соединение формулы XX взаимодействием XXI с соединением формулы в присутствии гидрата 1-гидроксибензотриазола и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 16 ч. По реакции 1 схемы 10, соединение формулы XXIII превращают в соответствующее соединение формулы XXII взаимодействием в присутствии п-толуолсульфоновой кислоты и апротонного растворителя, такого как толуол. Реакционную смесь нагревают до образования флегмы в течение периода времени между приблизительно 1 ч и приблизительно 48 ч, предпочтительно приблизительно 24 ч. По реакции 1 схемы 11, соединение формулы XXVI превращают в соответствующее соединение формулы XXV взаимодействиемXXVI с метиллитием в апротонном растворителе, таком как тетрагидрофуран. Реакцию проводят при температуре между приблизительно-75 С и приблизительно -85 С, предпочтительно приблизительно -78 С, в течение периода вре 21 мени между приблизительно 1 ч и приблизительно 6 ч и, предпочтительно приблизительно 2 ч. По реакции 1 схемы 12, соединение формулы XXVIII превращают в соответствующее соединение формулы XXVII взаимодействиемXXVIII с трибромидом бора в полярном апротонном растворителе, таком как метиленхлорид. Реакцию проводят при температуре между приблизительно -78 С и комнатной температурой,предпочтительно приблизительно 0 С, в течение периода времени между приблизительно 1 часом и приблизительно 24 ч, предпочтительно приблизительно 16 ч. По реакции 1 схемы 13, соединение формулы XXX превращают в соответствующее соединение формулы XXIX взаимодействием в присутствии триэтиламина и полярного апротонного растворителя, такого как метиленхлорид. Реакцию проводят при температуре между приблизительно 0 С и комнатной температурой,предпочтительно приблизительно 0 С, в течение периода времени между приблизительно 30 минутами и приблизительно 2 ч, предпочтительно приблизительно 1 ч. По реакции 1 схемы 14, соединение формулы XXX превращают в соответствующее соединение формулы XXXII взаимодействиемXXX с ангидридом метансульфоновой кислоты в присутствии триэтиламина. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 30 мин и приблизительно 24 ч, предпочтительно приблизительно 12 ч. По реакции 1 схемы 15, соединение формулы XXXV превращают в соответствующее соединение формулы XXXIV взаимодействиемXXXV с гидроксидом натрия в полярном апротонном растворителе, таком как этанол. Реакционную смесь нагревают до образования флегмы в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 9 ч. По реакции 1 схемы 16, соединение формулы XXXVII превращают в соответствующее соединение формулы XXXVI окислениемN-оксидом 4-метилморфолина в полярном апротонном растворителе, таком как метиленхлорид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 2 ч и приблизительно 6 ч, предпочтительно приблизительно 4 ч. По реакции 1 схемы 17, соединение 2 аминопиридина формулы XXXIX превращают в соответствующее соединение формулы 22 нагревают до образования флегмы в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 16 ч. По реакции 1 схемы 18, соединение 2 нитропиридина формулы XLI превращают в соответствующее соединение 2-аминопиридина формулы XL восстановлением XLI с использованием 10% оксида платины на угле, метанола и тетрагидрофурана. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 3 ч, предпочтительно приблизительно 2 ч. По реакции 1 схемы 19, соединение формулы XLIII превращают в соответствующее соединение формулы XLII взаимодействиемXLIII с МСРВА в полярном апротонном растворителе, таком как метиленхлорид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 4 ч, предпочтительно приблизительно 1 ч. По реакции 1 схемы 20, соединение 2 хлорпиридина формулы XLV превращают в соответствующее соединение формулы XLVI взаимодействием XLV с соединением формулыR5(CH2)rOH в присутствии карбоната цезия и полярного апротонного растворителя, такого как диметилформамид. Реакцию проводят при температуре между приблизительно 65 С и приблизительно 90 С, предпочтительно приблизительно 80 С, в течение периода времени между приблизительно 10 ч и приблизительно 18 ч,предпочтительно приблизительно 16 ч. По реакции 2 схемы 20, соединение 3 цианопиридина формулы XLVI превращают в соответствующее соединение формулы XLVII взаимодействием XLVI с пероксидом водорода в присутствии гидроксида калия и полярного протонного растворителя, такого как этанол. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 24 ч, предпочтительно приблизительно 12 ч. По реакции 3 схемы 20, соединение формулы XLVII превращают в соответствующее соединение формулы XLIV взаимодействием где Х представляет собой хлоро, бромо или йодо, в присутствии гидроксида калия и полярного апротонного растворителя, такого как диметилсульфоксид. Реакцию проводят при комнатной температуре в течение периода времени между приблизительно 1 ч и приблизительно 24 ч,предпочтительно приблизительно 1 ч. По реакции 1 схемы 21, соединение формулы XLIX превращают в соответствующее в полярном апротонном растворителе, таком как тетрагидрофуран. Реакцию проводят при температуре между приблизительно -85 С и приблизительно -75 С, предпочтительно приблизительно -78 С, в течение периода времени между приблизительно 0,5 ч и приблизительно 16 ч,предпочтительно приблизительно 2 ч. По реакции 2 схемы 21, соединение формулы L превращают в соответствующее соединение формулы XLVIII взаимодействием L с хромовой кислотой, серной кислотой и водой в полярном апротонном растворителе, таком как ацетон. Реакцию проводят при температуре между приблизительно 0 С и приблизительно 25 С, предпочтительно приблизительно 0 С, в течение периода времени между приблизительно 0,5 ч и приблизительно 16 ч, предпочтительно приблизительно 2 ч. По реакции 1 схемы 22, соединение формулы LIII превращают в соответствующее соединение формулы LIV взаимодействием LIII с соединением формулы в присутствии гидрида натрия и полярного апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре между приблизительно 0 С и приблизительно 60 С, предпочтительно приблизительно 0 С, в течение периода времени между приблизительно 1 ч и приблизительно 16 ч, предпочтительно приблизительно 4 ч. По реакции 2 схемы 22, соединение формулы LIV превращают в соответствующее соединение формулы LII взаимодействием LIV с чистой трифторуксусной кислотой в течение периода времени между приблизительно 1 ч и приблизительно 16 ч, предпочтительно приблизительно 4 ч. По реакции 1 схемы 23, соединение формулы LVI превращают в соответствующее соединение формулы LV взаимодействием LVI с соединением формулы R1CHO в присутствии диизопропиламида лития и полярного апротонного растворителя, такого как тетрагидрофуран. Реакцию проводят при температуре между приблизительно -75 С и приблизительно -85 С,предпочтительно приблизительно -78 С, в течение периода времени между приблизительно 1 ч и приблизительно 6 ч, предпочтительно приблизительно 1 ч. По реакции 1 схемы 24, соединение формулы LVIII превращают в соответствующее соединение формулы LVII взаимодействиемLVIII с борогидридом натрия в присутствии полярного протонного растворителя, такого как метанол. Реакцию проводят при температуре между приблизительно -10 С и приблизительно 10 С, предпочтительно приблизительно 0 С, в течение периода времени между приблизительно 0,5 ч и приблизительно 16 ч, предпочтительно приблизительно 1 ч. По реакции 1 схемы 25, соединение формулы LX превращают в соответствующее соединение формулы LIX взаимодействием LX с соединением формулы где Х представляет собой хлоро, бромо или йодо, в присутствии гидрида натрия и полярного апротонного растворителя, такого как диметилформамид. По реакции 1 схемы 26, соединение 2 фторпиридина формулы LXII превращают в соответствующее соединение формулы LXIII взаимодействием LXII с соединением формулы в присутствии диизопропиламида лития и полярного апротонного растворителя, такого как тетрагидрофуран. По реакции 2 схемы 26, соединение формулы LXIII превращают в соответствующее соединение формулы XLVIII взаимодействиемLXIII с соединением формулы HE-(CH2)r-R5 в присутствии гидрида натрия и полярного апротонного растворителя, такого как диметилформамид. По реакции 1 схемы 27, соединение формулы LXV превращают в соответствующее соединение формулы LXVI взаимодействием LXV с реагентом Бургеса, СН 3 ООСNSO2NСН 2 СН 3, в присутствии бензола. По реакции 2 схемы 27, соединение формулы LXVI превращают в соответствующее соединение формулы LXIV взаимодействиемLXVI с оксидом осмия (IX) в присутствии третбутанола, NMO и актона. По реакции 1 схемы 28, соединение формулы LXVI превращают в соответствующее соединение формулы LXVII гидрированиемLXVI в присутствии палладия на угле и этанола. Соединения формулы I, которые имеют основный характер, способны образовывать широкий ряд различных солей со многими неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения человеку или животным, часто на практике желательно на первой стадии выделить соединение формулы I из 25 реакционной смеси в виде фармацевтически неприемлемой соли, а затем легко превратить последнюю обратно в соединение в виде свободного основания обработкой щелочным реагентом, а потом превратить это последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений по данному изобретению легко получают обработкой основного соединения по существу эквивалентным количеством выбранной неорганической или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. Требуемую твердую соль легко получают при выпаривании растворителя. Требуемую соль присоединения кислоты также можно осаждать из раствора свободного основания в органическом растворителе, добавляя раствор соответствующей неорганической или органической кислоты. Фармацевтически приемлемые соли аминогрупп включают в себя гидрохлорид(предпочтительно), гидробромид, сульфат, кислый сульфат, фосфат, кислый фосфат, бикислый фосфат, ацетат, сукцинат, цитрат, тартрат, лактат, манделат, метансульфонат (мезилат) и птолуолсульфонат (тозилат). Катионные соли соединений формулы I получают аналогично,но только через посредство реакции карбоксигруппы, такой как, где R6 представляет собой кабоксигруппу, с соответствующим реагентом катионной солью, такой как соль натрия, калия,кальция, магния, аммония, N,N'-дибензилэтилендиамином, N-метилглюкамином (меглумином), этаноламином, трометамином или диэтаноламином. Для введения человеку при лечении или профилактике воспалительных заболеваний пероральные дозировки соединения формулы I или его фармацевтически приемлемой соли (активных соединений) обычно находятся в пределах то 0,1 до 1000 мг ежедневно в однократных или многократных дозах для среднего взрослого пациента (70 кг). Активные соединения можно вводить в однократных или многократных дозах. Индивидуальные таблетки или капсулы обычно должны содержать от 0,1 до 100 мг активного соединения в подходящем фармацевтически приемлемом наполнителе или носителе. Дозировки для внутривенного введения обычно находятся в пределах от 0,1 до 10 мг на однократную дозу, в зависимости от того, как требуется. Для ингаляционного введения или через нос дозу обычно готовят в виде от 0,1 до 1%ного (мас./об.) раствора. На практике лечащий врач будет определять фактическую дозировку,которая будет наиболее подходящей для индивидуального пациента и будет меняться в зависимости от возраста, веса и реакции конкретного пациента. Упомянутые выше дозировки являются типичными для среднего пациента, но могут, конечно, существовать отдельные слу 003528 26 чаи, когда заслуживают внимания более высокие или более низкие пределы дозировки, и все такие дозировки находятся в объеме этого изобретения. Человеку активные соединения по настоящему изобретению можно вводить одни, но обычно их будут вводить в смеси с фармацевтическим разбавителем или носителем, выбранным относительно назначенного пути введения и традиционной фармацевтической практики. Например, их можно вводить перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах либо одни, либо в смеси с эксципиентами, или в форме эликсиров или суспензий, содержащих корригенты или красители. Их можно инъецировать парентерально; например, внутривенно,внутримышечно или подкожно. Для парентерального введения лучше всего их применять в форме стерильного водного раствора, который может содержать другое вещество; например достаточно соли или глюкозы, чтобы сделать раствор изотоническим. Кроме того, активные соединения можно вводить местно при лечении воспалительных состояний кожи, и это можно выполнять с помощью кремов, желе, гелей, паст или мазей, в соответствии с традиционной фармацевтической практикой. Терапевтические соединения также можно вводить млекопитающим, отличным от человека. Доза для введения млекопитающему будет зависеть от вида животного и заболевания или расстройства, которое лечат. Терапевтические соединения можно вводить животным в форме капсулы, болюса, таблетки или жидкой большой дозы лекарства. Терапевтические соединения также можно вводить животным инъекцией или в виде имплантата. Такие препараты получают традиционным способом в соответствии со стандартной ветеринарной практикой. В качестве альтернативного варианта терапевтические соединения можно вводить в корм животным и с этой целью концентрированная кормовая добавка или премикс могут быть приготовлены смешиванием с обычным кормом животных. Способность соединений формулы I или их фармацевтически приемлемых солей ингибировать ФДЭ 4 может быть определена следующим испытанием. Ингибирование дегрануляции и активации эозинофилов цельной крови человека Измерение дегрануляции и активации эозинофилов крови человека Взятие крови и инкубирование От здоровых доноров берут 100 мл крови вUSP(Фармакопея США) гепарина натрия/мл крови). Гепаринизированную кровь собирают в 50 мл конические центрифужные пробирки при 22 С. В три силиконированные стеклянные пробирки 12 х 75, содержащие по 1 мкл ДМСО (ди 27 метилсульфоксид) или 1 мкл испытуемого соединения, вносят по 1 мл крови. После перемешивания пробирки помещают в вибрирующую водяную баню при 37 С на 15 мин. Во все пробирки добавляют 1 мкл PGE1 в ДМСО до конечной концентрации 1 мкМ. После перемешивания во все пробирки добавляют 100 мкл PBS(конечная концентрация 8,25-16,5 мг/мл). После перемешивания все пробирки инкубируют в вибрирующей водяной бане при 37 С в течение 1-2 ч. Приготовление образцов плазмы В конце инкубирования в каждую пробирку для анализа добавляют 20 мкл 15%-ного раствора ЭДТА в PBS. После перемешивания образцы центрифугируют при 2000 об/мин (центрифуга Sorvall 6000B) при 22 С в течение 5 мин. Определение уровней НЭЛ (или ЕРХ) и ЛТЕ 4 и эффект соединений Все образцы плазмы тестируют на уровни НЭЛ (нейротоксин, образованный эозинофилом) и ЛТЕ 4 (лейкотриен Е 4). Обширные исследования позволяют предположить, что гранулы Sephadex запускают высвобождение эозинофил-опосредованного НЭЛ и ЛТЕ 4 в цельной крови человека. Уровни НЭЛ и ЛТЕ 4 определяют радиоиммунным анализом (Kabi Pharmacia(Cayman Chemical), соответственно. Уровни НЭЛ и ЛТЕ 4 рассчитывают путем сравнения со стандартной кривой, используя Microsoft Excel или другое соответствующее программное обеспечение. Процент контрольного высвобождения НЭЛ или ЛТЕ 4 рассчитывают следующим образом:% контрольного ЛТЕ 4 = [ЛТЕ 4 (соединение) - ЛТЕ 4 ("холостой" опыт)]/[ЛТЕ 4 (сумм.) ЛТЕ 4 ("холостой" опыт)],где уровень в "холостом" опыте является уровнем НЭЛ или ЛТЕ 4 в отсутствие гранулSephadex, а суммарный уровень является уровнем НЭЛ или ЛТЕ 4 в присутствии гранулSephadex. Величину ИК 30 или ИК 50 определяют как концентрацию соединения, которая ингибирует специфическое высвобождение НЭЛ и ЛТЕ 4 на 30 или 50%, соответственно. Ингибирование изофермента ФДЭ 4 и активации эозинофилов (+) и (-) энантиомерами Для того, чтобы фармакологически определить, какой изофермент(ы) ФДЭ 4 отвечает за активацию эозинофильных лейкоцитов, мы получили энантиомеры ингибиторов ФДЭ 4 и сравнили ингибиторный эффект этих энантиомеров на активность ФДЭ 4 и активацию эозинофилов. Активность ФДЭ 4 оценивают измеряя гидролиз 1 мкМ цАМФ отдельными рекомби 003528 28 нантными изоферментами ФДЭ 4 человека(ФДЭ 4 А, 4 В, 4 С или 4D). Активацию эозинофилов оценивают измеряя высвобождение нейротоксина, образованного эозинофилом (НЭЛ) и лейкотриена Е 4 цельной крови человека, индуцированное гранулами Sephadex. Табл. 1 иллюстрируют сравнение одного примера (-) и (+) энантиомеров на активность отдельных изоферментов ФДЭ 4 и на высвобождение НЭЛ и ЛТЕ 4.(-)энантиомер R)-(-)-2-(4-фторфенокси)-N-[1(4-метоксифенил)этил]никотинамида); однако они приблизительно одинаково активны в ингибировании других 3 изоферментов, т.е. ФДЭ 4 А,4 В и 4 С. Является важным тот факт, что(+)энантиомер в 20-37 раз более эффективен по отношению к ответу НЭЛ и ЛТЕ. Эти результаты показывают, что дифференцированное влияние (+) и (-) энантиомеров на ингибирование изофермента ФДЭ 4 является идентичным их влиянию на высвобождение НЭЛ/ЛТЕ 4, демонстрируя, что изофермент ФДЭ 4 играет ключевую роль в регуляции эозинофилов. Таблица 1(+) vs. (-) энантиомеры - реакция изоферментов ФДЭ 4 и эозинофилов Эозинофил цельной крови человека Изофермент - ИК 50, мкМ Всего получено 8 пар (+) и (-) энантиомеров, включая вышеупомянутый энантиомер. Как показано в табл. 2, энантиоселективный эффект этих соединений на ингибирование фермента ФДЭ 4D существенно коррелирует с эффектами на ответ НЭЛ и ЛТЕ 4. Таблица 2 Корреляция энантиоселективных эффектов 8 соединений, каждое из которых имеет (+) и (-) энантиомеры, на активность ФДЭ и реакцию НЭЛ/ЛТЕ 4 Корреляция дифференцированных эффектов (+) и (-) энантиомеров:Vs. Реакция ЛТЕ 4 ФДЭ 4 А Не коррелирует Не коррелирует ФДЭ 4 В Не коррелирует Не коррелирует ФДЭ 4 С Не коррелирует Не коррелирует ФДЭ 4D Положительная корре- Положительная корреляция (р 0,02) ляция (р 0,005) Ингибирование легочной эозинофилии Для того чтобы оценить данные соединения относительно легочной эффективности, мы использовали общеизвестную модель астмы обезьяны (Turner et al., Am. J. Respir. Crit. CareMed. 149, 1153-1159, 1994). Подвергание атопических обезьян Масаса Fascicularis действию антигена вызывает значительный приток воспалительных клеток, наблюдаемый в бронхоальвеолярной (BAL) жидкости этих обезьян за 4-24 ч после введения антигена. В этой модели изофермент ФДЭ 4D-селективные соединения, введенные подкожно, значительно ингибируют инфильтрацию легочных эозинофильных лейкоцитов (на 59-76%) за 24 ч после введения антигена. Эти соединения, однако, не оказывают влияния на инфильтрацию нейтрофилов или лимфоцитов, демонстрируя селективное ингибирование эозинофильной реакции. Ингибирование выработки ФНО в выделенных моноцитах человека Способность соединений I или их фармацевтически приемлемых солей ингибировать выработку ФНО и, следовательно, демонстрировать их эффективность относительно лечения заболеваний, включающих в себя продуцирование ФНО, показано следующим испытанием invitro: Периферическую донорскую кровь человека (100 мл) собирают в этилендиаминтетрауксусную кислоту (ЭДТА). Одноядерные клетки выделяют FICOLL/Hypaque и промывают три раза в неполном HBSS (среда Хенка). Клетки повторно суспендируют до конечной концентрации 1 х 106 клеток в 1 мл в предварительно нагретом RPMI (содержащего 5% FCS (фетальной сыворотки теленка), глутамин, pen/step и нистатин). Моноциты засевают в количестве 1 х 106 клеток в 1,0 мл в 24-луночных планшетах. Клетки инкубируют при 37 С (5% диоксида углерода) и оставляют для адгезии с планшетами в течение 2 ч, после чего неадгезированные клетки удаляют осторожной промывкой. Затем к клеткам добавляют испытуемые соединения(10 мл), каждое в 3-4 концентрациях, и инкубируют в течение 1 часа. К соответствующим лункам добавляют LPS (липополисахариды - 10 мл). Планшеты инкубируют в течение ночи (18 часов) при 37 С. По окончании инкубирования ФНО анализируют, используя "сэндвич"-ЕLISА(RD Quantikine Kit). ИК 50 определяют для каждого соединения на основе линейного регрессионного анализа. Масс спектры определяли ГХ-МС (газовая хроматография - масс-спектрометрия), методы АМРI, АД/ХИ (атмосферное давление/химическая ионизация) или термораспылительной ионизации). Все 1H ЯМР спектры снимали на приборе 400 МГц. Подготовительная стадия 1. 2-(4-Фторфенокси)никотиновая кислота. К перемешиваемому раствору 4 фторфенола (5,0 г, 44,6 ммоль) в диметилформамиде (40 мл) при комнатной температуре порциями добавляют 60%-ный гидрид натрия(3,6 г, 89,0 ммоль) и перемешивают в течение 30 мин. Порциями добавляют 2-хлорникотиновую кислоту (7,1 г, 45,0 ммоль) и смесь нагревают с обратным холодильником в течение 3 ч. Раствор вливают в 300 мл воды и промывают диэтиловым эфиром. Водный слой вливают в 400 мл смеси льда с водой и подкисляют уксусной кислотой до рН 3. Полученный осадок отделяют фильтрованием с получением не совсем белого твердого вещества (5,2 г). Т.пл. 180-182 С; ММ 233,21; МС (m/е) 234 (М 1). (MM молекулярная масса). Соединения подготовительных стадий 2-5 получают в соответствии с методикой подготовительной стадии 1, заменяя 4-фторфенол соответствующим спиртом. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 2. 2-(3-Фторфенокси)никотиновая кислота. ММ 233,21; МС (m/е) 233 (М+). Подготовительная стадия 3. 2-(2,4-Дифторфенокси)никотиновая кислота. ММ 251,19; МС (m/е) 252 (M1). Подготовительная стадия 4. 2-(3-Хлорфенокси)никотиновая кислота. ММ 249,65; МС (m/е) 250 (М 1). Подготовительная стадия 5. 2-(3-Метоксифенокси)никотиновая кислота. ММ 245,23; МС (m/е) 261 (М 18). Подготовительная стадия 6. 2-(Пиридин-3 илокси)никотиновая кислота. Раствор этилового эфира 2-(пиридин-3 илокси)никотиновой кислоты (0,419 г, 1,71 ммоль) в этаноле (10 мл) и 1 н. гидроксид натрия(4 мл) нагревают с обратным холодильником в течение 4 ч. Смесь вливают в 100 мл воды, подкисляют 1 н. соляной кислотой до рН 4 и концентрируют до сухого состояния с получением твердого вещества (0,643 г). ММ 216,21; МС(m/е) 217 (M1). Соединения подготовительных стадий 7-22 получают в соответствии с методикой подготовительной стадии 6, заменяя этиловый эфир 2(пиридин-3-илокси)никотиновой кислоты соответствующим эфиром. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 7. 2-(5-Хлорпиридин-3-илокси)никотиновая кислота. ММ 250,65; МС (m/е) 251 (М 1). Подготовительная стадия 8. 2-(3-Нитрофенокси)никотиновая кислота. Т.пл. 172-174 С; ММ 260; МС (m/е) 261H ЯМР (ДМСО-d6)2.88 (3 Н, s), 2.93 (3 Н,s), 7.08 (4 Н, m), 7.42 (1 Н, m), 8.22 (2 Н, m). Подготовительная стадия 23. Этиловый эфир 2-(пиридин-3-илокси)никотиновой кислоты. Раствор этилового эфира 2-хлорникотиновой кислоты (0,53 г, 2,85 ммоль), карбоната цезия (2,326 г, 6,73 ммоль) и пиридин-3-ола(0,271 г, 2,85 ммоль) в диметилформамиде (20 мл) нагревают до 65 С в течение 10 ч. Смесь разбавляют 300 мл воды и экстрагируют этилацетатом. Объединенные экстракты промывают водой и рассолом, сушат над Na2SO4, фильтруют и концентрируют до масла (0,55 г). ММ 244,25; МС (m/e) 244 (М+). Соединения подготовительных стадий 2443 получают в соответствии с методикой подго 003528 32 товительной стадии 23, заменяя пиридин-3-ол соответствующим спиртом. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 24. Этиловый эфир 2-(5-хлорпиридин-3-илокси)никотиновой кислоты. Раствор этилового эфира 2-хлорникотиновой кислоты (2,07 г, 11,2 ммоль), карбоната цезия (7,27 г, 22,3 ммоль) и 5-хлор-3 пиридинола (1,45 г, 11,2 ммоль) в сухом диметилформамиде (40 мл) перемешивают при 90 С в течение ночи. Суспензию охлаждают до комнатной температуры, вливают в воду и экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают водой и рассолом, сушат над МgSO4 и концентрируют до желтовато-коричневого твердого вещества. Перекристаллизация из гексана приводит к получению желтого твердого вещества (1,0 г). Т.пл. 65-69 С; Анализ: вычислено для С 13 Н 11 СlN2O3: С 56.03; Н 3.98; N 10.05. Найдено: С 56.14; Н 4.04; N 10.16.(12,5 г) в этаноле (250 мл) по каплям добавляют тионилхлорид (5,77 мл) и нагревают с обратным холодильником в течение 1,5 ч. Смесь концентрируют (для того чтобы удалить этанол) и разбавляют 300 мл воды. Для установления рН раствора 8,0 добавляют твердый бикарбонат натрия. Раствор экстрагируют этилацетатом, промывают водой, насыщенным раствором бикарбоната натрия, водой и рассолом, сушат надNa2SO4, фильтруют и концентрируют до желтой жидкости (10,0 г). ММ 185,61; МС (m/e) 185(М+). Подготовительная стадия 45. 2-(4-Цианофенокси)никотиновая кислота. Раствор метилового эфира 2-(4-цианофенокси)никотиновой кислоты (0,200 г, 0,787 ммоль) в тетрагидрофуране (3 мл) и 1 МLiOHH2O (1,97 мл) перемешивают в течение ночи. Смесь разбавляют 25 мл воды, подкисляют 2 н. соляной кислотой до рН 1 и фильтруют с получением белого твердого вещества (0,144 г). ММ 240; 1H ЯМР (ДМСО-d6)7.2 (3 Н, т), 7.90(2 Н, т), 8.35 (2 Н,т), 13.5(1H, bs). Соединение подготовительной стадии 46 получают в соответствии с методикой подготовительной стадии 45, заменяя метиловый эфир 2-(4-циано-фенокси)-никотиновой кислоты соответствующим эфиром. Продолжительность реакции находится в интервале между 1 и 24 часами. Подготовительная стадия 46. 2-(3-Циано-4 фторфенокси)никотиновая кислота. ММ 258,22; МС (m/e) 258, 257 (М+). Подготовительная стадия 47. 2-(4 Аминометилфенил)пропан-2-ол. К перемешиваемому раствору 4-(1 гидрокси-1-метилэтил)бензонитрила (20,9 г,0,13 ммоль) в сухом тетрагидрофуране (300 мл) при 0 С медленно по каплям добавляют 1,0 М раствор алюмогидрида лития в тетрагидрофуране (388 мл, 0,39 ммоль). Смесь нагревают с обратным холодильником в течение 30 мин, затем охлаждают до 0 С и смешивают с метанолом(50 мл), который медленно добавляют по каплям. Смесь концентрируют в вакууме до половины объема и разбавляют хлороформом (1200 мл), затем промывают водой (300 мл). Полученную смесь фильтруют через целит, и слои фильтрата разделяют. Органический экстракт сушат (MgSO4) и концентрируют с получением 16,2 г светло-желтого твердого вещества (т.пл. 64-66 С). ЯМР (CDCl3): 7.45 (d, 2H), 7.26 (d,2H), 3.83 (s, 2H), 1.57 (s, 6H). ГХ-МС (m/e, %): 164 (M+, 15), 150 (80), 132 (75), 106(100). Подготовительная стадия 48. Метиловый эфир 2-(4-цианофенокси)никотиновой кислоты. Раствор этилового эфира 2-(4-цианофенокси)никотиновой кислоты (0,90 г, 2,44 ммоль) в метаноле (10 мл) и карбонат калия (1,01 г, 7,33 ммоль) нагревают с обратным холодильником в течение 20 мин. Смесь разбавляют 100 мл воды,подкисляют до рН 1 и фильтруют с получением твердого вещества (0,200 г). ММ 254; МС (m/e) 254 (М+). Подготовительная стадия 49. 2-(3-Хлорфенокси)никотинамид. Раствор нитрила 2-(3-хлорфенокси)никотиновой кислоты (7,81 г, 33,9 ммоль), 3%-ного пероксида водорода (190 мл, 169 ммоль) и 50%ного гидроксида калия (380 мл, 3,39 ммоль) в этаноле (100 мл) перемешивают при 70 С в течение ночи. Смесь концентрируют до 250 мл и охлаждают до 0 С. Твердое вещество выделяют фильтрованием, растворяют в этилацетате, сушат над сульфатом магния и концентрируют до белого твердого вещества (6,51 г). Т.пл. 225228 С; ММ 248,67; МС (m/e) 250 (М 1). 35 Подготовительная стадия 50. Нитрил 2-(3 хлорфенокси)никотиновой кислоты. Раствор нитрила 2-хлорникотиновой кислоты (5,00 г, 36,1 ммоль), карбоната цезия (23,5 г, 72,2 ммоль) и 3-хлорфенола (4,65 г, 36,1 ммоль) в диметилформамиде (100 мл) нагревают до 80 С в течение ночи. Смесь охлаждают и вливают в 500 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над MgSО 4,фильтруют и концентрируют до белого твердого вещества (8,21 г). Т.пл. 88-90 С; Анализ: вычислено для C12H7N2OCl: С 62.49; Н 3.06; N 12.15. Найдено: С 62.43; Н 3.00; N 12.13. Подготовительная стадия 51. 2-(4-Фторфенокси)пиридин-3-иламин. К раствору 2-(4-фторфенокси)-3 нитропиридина (3,00 г, 12,81 ммоль) в этилацетате (100 мл) добавляют 10%-ный палладий на угле (0,600 г). Смесь встряхивают при 344,738 кПа (50 фунт/кв.дюйм) водорода в течение 1 ч. Катализатор удаляют фильтрованием, а раствор концентрируют с получением белого твердого вещества (2,49 г). Т.пл. 92-94 С; ММ 204,20; МС (m/e) 204 (М+). Соединение подготовительной стадии 10 а получают в соответствии с методикой подготовительной стадии 10, заменяя 2-(4-фторфенокси)-3-нитропиридин соответствующим нитросоединением. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 52. 2-(Пиридин 3-илокси)пиридин-3-иламин.MM 187; МС (m/e) 188 (М 1). Подготовительная стадия 53. 2-(4-Фторфенокси)-3-нитропиридин. Раствор 2-хлор-3-нитропиридина (5,00 г,31,54 ммоль), карбоната цезия (25,7 г, 78,85 ммоль) и 4-фторфенола (3,6 г, 34,69 ммоль) в диметилформамиде (85 мл) перемешивают в течение 2 ч при комнатной температуре. Смесь разбавляют 250 мл воды и экстрагируют этилацетатом. Объединенные экстракты промывают 1 н. NaOH, водой и рассолом, сушат над Na2SO4,фильтруют и концентрируют до желтого твердого вещества (7,16 г). Т.пл. 87-89 С; ММ 234,1; МС (m/e) 234 (М+). Соединение подготовительной стадии 54 получают в соответствии с методикой подготовительной стадии 53, заменяя 4-фторфенол соответствующим спиртом. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 54. 2-(Пиридин 3-илокси)-3-нитропиридин. ММ 217,186; МС (m/e) 218 (M1). Подготовительная стадия 55. 2-(3-Хлорфенокси)пиридин-3-карбальдегид. К раствору метилсульфоксида (0,23 мл, 3,3 ммоль) и метиленхлорида (10 мл) при -70 С по каплям за 5 мин добавляют хлорангидрид щавелевой кислоты (0,20 мл, 2,3 ммоль) и перемешивают в течение 1 ч. К перемешиваемой смеси по 36 каплям добавляют раствор [2-(3-хлорфенокси)пиридин-3-ил]метанола (0,39 г, 1,7 ммоль) в метиленхлориде (10 мл) и перемешивают при -70 С в течение 1 ч. Смесь нагревают до -35 С в течение 15 мин и охлаждают до-70 С; в это время добавляют триэтиламин (1,15 мл, 8,3 ммоль), и смесь нагревают до 0 С. Смесь разбавляют 20 мл метиленхлорида и промывают насыщенным раствором гидрокарбоната натрия и рассолом, сушат над Na2SO4 фильтруют и концентрируют до оранжевого масла, которое очищают хроматографией на диоксиде кремния,элюируя смесью 1/3 этилацетат/гексан, с получением желтого масла (0,180 г). ММ 233,65; МС(m/e) 234 (М 1). Соединение подготовительной стадии 56 получают в соответствии с методикой подготовительной стадии 55, заменяя [2-(3-хлорфенокси)пиридин-3-ил]метанол соответствующим спиртом. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 56. 2-(Пиридин 3-илокси)пиридин-3-карбальдегид. ММ 200,20; МС (m/e) 201 (М 1). Подготовительная стадия 57. [2-(3 Хлорфенокси)пиридин-3-ил]метанол. К раствору этилового эфира 2-(3-хлорфенокси)никотиновой кислоты (0,5 г) и тетрагидрофурана (10 мл) при 0 С добавляют две порции алюмогидрида лития (0,4 г) и перемешивают в течение 30 мин. Раствор оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Смесь гасят 1 н. гидроксидом натрия (0,5 мл) и разбавляют водой. Смесь фильтруют через целит, который промывают этилацетатом для экстракции продукта. Объединенные экстракты промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до масла (0,39 г). ММ 235,67; МС(m/e) 236 (M1). Соединение подготовительной стадии 58 получают в соответствии с методикой подготовительной стадии 57, заменяя этиловый эфир 2(3-хлорфенокси)никотиновой кислоты соответствующим сложным эфиром. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 58. [2-(Пиридин 3-илокси)пиридин-3-ил]метанол. ММ 202,21; МС (m/e) 203 (М 1). Подготовительная стадия 59. 3-Тетразол-1 илфенол. К раствору 1-(3-бензилоксифенил)-1 Нтетразола (0,640 г, 2,54 ммоль) в этаноле (15 мл) добавляют 10%-ный палладий на угле (0,100 г). Раствор перемешивают в атмосфере водорода в течение ночи. Катализатор удаляют фильтрованием, а раствор концентрируют с получением белого твердого вещества (0,364 г). Т.пл. 171172 С; ММ 162,12; МС (m/e) 163 (M1). Подготовительная стадия 60. 1-(3-Бензилоксифенил)-1 Н-тетразол. 37 К раствору 3-бензилоксифениламина (1,50 г, 7,53 ммоль) и уксусной кислоты (15 мл) при 70 С добавляют раствор этилового эфира ортомуравьиной кислоты (1,116 г, 7,53 ммоль) в уксусной кислоте (4 мл) и перемешивают в течение 4 ч. К раствору добавляют две порции азида натрия (1,468 г, 22,6 ммоль) и перемешивают в течение 20 ч при 70 С. Смесь экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным раствором гидрокарбоната натрия и рассолом, сушат над Na2SO4, фильтруют и концентрируют. Продукт очищают флэш-хроматографией на диоксиде кремния,используя смесь гексан/этилацетат 3/1 в качестве элюента, с получением белых кристаллов(0,650 г). Т.пл. 85-86 С; ММ 252,25; МС (m/e) 252,8 (М+). Подготовительная стадия 61. 3-Метилсульфанилфенол. Через раствор уксусной кислоты (200 мл),охлажденный до -50 С, барботируют газообразный НВr (20 г). Добавляют м-метоксифенилметилсульфид (20 г, 130 ммоль) и 48%-ный водный раствор НВr (10 мл) и смесь нагревают с обратным холодильником в течение 3 ч. Уксусную кислоту удаляют, а масло вливают в 150 мл ледяной воды. Смесь экстрагируют диэтиловым эфиром. Объединенные экстракты промывают 15%-ным раствором КОН, подкисляют водный слой концентрированной соляной кислотой и экстрагируют диэтиловым эфиром. Объединенные экстракты сушат над Na2SO4, фильтруют и концентрируют до масла (11,5 г). ММ 140,205; МС (m/e) 141 (M1). Подготовительная стадия 62. 1-Метокси-3 метилсульфанилбензол. К суспензии магния (7,2 г, 296 ммоль) и йода (100 мл) в диэтиловом эфире (250 мл) медленно добавляют м-броманизол (47,0 г, 250 ммоль) со спонтанным образованием флегмы. Добавляют диметилдисульфид (16,0 г, 160 ммоль) и перемешивают в течение 1 ч. Во время охлаждения смеси добавляют раствор концентрированной соляной кислоты (30 мл) и воды(100 мл). Слои разделяют и водный слой экстрагируют диэтиловым эфиром. Объединенные экстракты сушат над МgSO4, фильтруют и концентрируют до масла, которое очищают перегонкой (20 мм Нg) при 130-135 С. (23,5 г). Подготовительная стадия 63. Этиловый эфир 2-(пиридин-3-илметокси)никотиновой кислоты. К раствору пиридин-3-илметанола (0,59 г,5,4 ммоль) в диметилформамиде (20 мл) добавляют гидрид натрия (0,259 г, 6,5 ммоль) и перемешивают в течение 30 минут. Шприцом добавляют этиловый эфир 2-хлорникотиновой кислоты (1,0 г, 5,4 ммоль) и перемешивают при комнатной температуре в течение ночи. Смесь разбавляют водой (150 мл) и экстрагируют диэтиловым эфиром и этилацетатом. Объединенные экстракты промывают 1 н. NaOH, водой и рассо 003528 38 лом, сушат над Na2SO4, фильтруют и концентрируют до масла (1,3 г). ММ 258,28; МС (m/e) 259 (М 1). Подготовительная стадия 64. 2-(3-Метоксикарбонилфенокси)никотиновая кислота. К раствору бензилового эфира 2-(3 метоксикарбонилфенокси)никотиновой кислоты(1,1 г) в метаноле (15 мл) и этилацетате (15 мл) добавляют 10%-ный палладий на угле (0,2 г). Смесь встряхивают при 206,8428 кПа (30 фунт/кв.дюйм) водорода в течение 2 ч. Катализатор удаляют фильтрованием, а раствор концентрируют с получением твердого вещества,которое перетирают в смеси метиленхлорид/гексан с получением белого твердого вещества (0,630 г). ММ 273,26; МС (m/e) 274 (М 1). Подготовительная стадия 65. Бензиновый эфир 2-(3-метоксикарбонилфенокси)никотиновой кислоты. Через раствор бензилового эфира 2-(3-йодфенокси)никотиновой кислоты (1,7 г, 3,94 ммоль), dppf (0,131 г, 0,24 ммоль), Pd(OAc)2(0,027 г, 0,12 ммоль) и триэтиламина (0,797 г,7,9 ммоль) в метаноле (10 мл) барботируют газообразный оксид углерода в течение 5 мин. Смесь нагревают до 60 С в течение 4 ч, вливают в 200 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния,используя смесь 25% этилацетата/гексан в качестве элюента, (1,2 г). ММ 363,39; МС (m/e) 364(M1). Подготовительная стадия 66. Бензиловый эфир 2-(3-йодфенокси)никотиновой кислоты. Раствор бензилового эфира 2-хлорникотиновой кислоты (1,7 г, 6,86 ммоль), карбоната цезия (4,5 г, 13,7 ммоль) и 3-йодфенола (1,7 г,7,54 ммоль) в диметилформамиде (20 мл) перемешивают в течение 2 ч при 70-80 С. Смесь вливают в 150 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над MgSO4,фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 30% этилацетата/гексан в качестве элюента, (2,32 г). ММ 431,24; МС (m/e) 432 (M1). Подготовительная стадия 67. Бензиловый эфир 2-хлорникотиновой кислоты. Раствор 2-хлорникотиновой кислоты (3,0 г,19,0 ммоль), карбоната калия (6,5 г, 48,0 ммоль) и бензилбромида (2,8 мл, 24,0 ммоль) в диметилформамиде (20 мл) перемешивают при комнатной температуре в течение ночи. Смесь вливают в 200 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над MgSO4, фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния,используя смесь 10% этилацетата/гексан в каче 39 стве элюента, (2,8 г). ММ 247,69; МС (m/e) 247(М+). Подготовительная стадия 68. С-(5-Хлорфуран-2-ил)метиламин. К раствору оксима 5-хлорфуран-2 карбальдегида (1,38 г, 9,5 ммоль) в тетрагидрофуране (30 мл) по каплям добавляют 1,0 М алюмогидрид лития (21 мл, 21 ммоль) и нагревают с обратным холодильником в течение 30 мин. Смесь охлаждают до 0 С и смешивают с 5 мл метанола и 5 мл насыщенного раствора NH4Cl. Смесь вливают в 150 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над(0,403 г). ММ 131,57; МС (m/e) 130/131 (М+). Соединения подготовительных стадий 6971 получают в соответствии с методикой подготовительной стадии 68, заменяя оксим 5-хлорфуран-2-карбальдегида соответствующим оксимом. Продолжительность реакции находится в интервале между 30 мин и 24 ч. Подготовительная стадия 69. С-(5-Метилфуран-2-ил)метиламин.(1,3 г, 9,96 ммоль) и NaOAc (1,8 г, 21,9 ммоль) в метиленхлориде (30 мл) и воде (30 мл) добавляют NH2OHHCl (0,761 г, 10,96 ммоль) и перемешивают при комнатной температуре в течение ночи. Смесь вливают в 150 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до твердого вещества (1,38 г). ММ 145,55;MC (m/e) 145/147 (М+). Соединения подготовительных стадий 7375 получают в соответствии с методикой подготовительной стадии 72, заменяя 5-хлорфуран-2 карбальдегид соответствующим альдегидом. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 73. Оксим 5 метилфуран-2-карбальдегида. Смесь E/Z изомеров; ММ 125,11. 1H ЯМР(60 мл) подвергают перегонке с водяным паром до тех пор, пока не соберется 150 мл жидкости. Смесь вливают в 150 мл воды и экстрагируют этилацетатом. Объединенные экстракты промывают насыщенным раствором NаНСО 3, водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до масла, которое очищают флэшхроматографией на диоксиде кремния, используя смесь 20% этилацетата/гексан в качестве элюента, с получением белого твердого вещества (1,3 г). ММ 130,53; МС (m/e) 129/131 (М 1). Подготовительная стадия 77. 2,4,6-Трифторбензиламин. Раствор 2-бромметил-1,3,5-трифторбензола (2,0 г, 8,9 ммоль) и гексаметилентетрамина(НМТА) (3,1 г, 22,2 ммоль) в хлороформе (35 мл) нагревают с обратным холодильником в течение 18 ч. Полученный осадок отделяют фильтрованием и переносят в метанол (10 мл),воду (5 мл) и концентрированную соляную кислоту (5 мл) и нагревают с обратным холодильником в течение 4 ч. Смесь вливают в 200 мл воды и промывают диэтиловым эфиром. Водную смесь подщелачивают 5 н. гидроксидом натрия и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над MgSO4, фильтруют и концентрируют до масла, которое затвердевает при стоянии (1,32 г). ММ 161,14; МС (m/e) 145 (M+NH2). Соединения подготовительных стадий 7879 получают в соответствии с методикой подготовительной стадии 77, заменяя 2-бромметил 1,3,5-трифторбензол соответствующим галогенидом. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 78. С-(5-Хлортиофен-2-ил)метиламин. ММ 147,64; МС (m/e) 147 (М+). Подготовительная стадия 79. С-(3,5 Дихлортиофен-2-ил)метиламин.MM 182,08; МС (m/e) 181-186 (М+). Подготовительная стадия 80. С-(3,4 Дихлортиофен-2-ил)метиламин. К раствору амида 3,4-дихлортиофен-2 карбоновой кислоты (0,640 г, 3,3 ммоль) в тетрагидрофуране (20 мл) по каплям добавляют 1,0 М алюмогидрид лития (7 мл, 7 ммоль) и перемешивают при комнатной температуре в течение 30 мин. Смесь охлаждают до 0 С и смешивают с 3 мл метанола и 5 мл насыщенного раствора NH4Cl, добавляемого по каплям. Смесь вливают в 100 мл воды и экстрагируют диэтиловым эфиром. Затем смесь фильтруют через целит. Объединенные экстракты промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до масла, которое очищают(1 Н, s). Соединения подготовительных стадий 8188 получают в соответствии с методикой подготовительной стадии 80, заменяя амид 3,4 дихлортиофен-2-карбоновой кислоты соответствующим амидом. Продолжительность реакции находится в интервале между 30 мин и 24 ч. Подготовительная стадия 81. С-(3-Хлортиофен-2-ил)метиламин. ММ 147,64; 1H ЯМР (CDCl3)3.99 (2 Н, s),6.86 (1 Н, d), 7.16 (1 Н, d). Подготовительная стадия 82. С-Бензо[b] тиофен-2-илметиламин.(1,9 мл, 25,3 ммоль) и нагревают с обратным холодильником в течение 3 ч. Смесь концентрируют с получением масла. Масло переносят в метиленхлорид (15 мл), охлаждают до 0 С,барботируют газообразный NН 3 в течение 5 мин и перемешивают в течение 20 мин. Смесь разбавляют метиленхлоридом (150 мл), промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до твердого вещества, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 2,5% метанола/метиленхлорид в качестве элюента, с получением твердого вещества, которое перетирают в метиленхлориде с получением белого твердого ве 003528(М+). Соединения подготовительных стадий 9092 получают в соответствии с методикой подготовительной стадии 89, заменяя 3,4-дихлортиофен-2-карбоновую кислоту соответствующей кислотой. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 90. Амид 3-хлортиофен-2-карбоновой кислоты. ММ 161; МС (m/e) 161/163 (М+). Подготовительная стадия 91. Амид 5 трифторметилтиофен-2-карбоновой кислоты. ММ 195,18; MC (m/e) 196 (М 1). Подготовительная стадия 92. Амид 5-(1 гидрокси-1-метилэтил)фуран-2-карбоновой кислоты. ММ 169,18; 1H ЯМР (ДМСО-d6)1.40 (6 Н,s), 5.20 (1 Н, d), 6.26 (1 Н, d), 6.93 (1 Н, d), 7.24(10 мл) добавляют 1,0 М алюмогидрид лития (6,2 мл, 6,2 ммоль) и нагревают с обратным холодильником в течение 40 мин. Смесь охлаждают до 0 С и смешивают с 5 мл метанола, добавляемого по каплям, и разбавляют насыщенным раствором NH4Cl (50 мл). Смесь экстрагируют диэтиловым эфиром. Объединенные экстракты промывают рассолом, сушат над Na2SO4,фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 5% метанола/метиленхлорид в качестве элюента, с получением масла (0,230 г). ММ 205,18; МС (m/e) 206(M1). Соединения подготовительных стадий 94106 получают в соответствии с методикой подготовительной стадии 93, заменяя 4-(2,2,2 трифторэтокси)бензонитрил соответствующим нитрилом. Продолжительность реакции находится в интервале между 30 мин и 24 ч. Подготовительная стадия 94. 4-Дифторметоксибензиламин. ММ 173,18; 1H ЯМР (CDCl3)3.85 (2 Н, s),6.48 (1 Н, t), 7.09 (2 Н, m), 7.30 (2 Н, m). Подготовительная стадия 95. С-(1 НИндол-5-ил)метиламин. ММ 146,21; МС (m/e) 146 (М+). Подготовительная стадия 96. 5-Фтортиофен-2-(2-метиламин). 1H ЯМР (CDCl3)1.54 (6 Н, s), 3.89 (2 Н, s),7.30 (2 Н, m), 7.48 (1 Н, s). Подготовительная стадия 107. 4-(1-Гидрокси-1-метилэтил)бензонитрил. К перемешиваемому раствору 4-цианоацетофенона (49,5 г, 0,34 моль) в сухом тетрагидрофуране (400 мл) при -78 С по каплям добавляют 3,0 М метилмагнийхлорид (150 мл, 0,45 моль). Смесь оставляют медленно нагреваться до 0 С за 3,5 ч, затем смешивают с метанолом(80 мл), добавляемым по каплям. Смесь вливают в воду (1000 мл) и подкисляют щавелевой кислотой до рН 3, затем экстрагируют этилацетатом (2 х 500 мл). Органические экстракты объединяют и промывают водой (2 х 100 мл),рассолом (100 мл), сушат (МgSO4), затем концентрируют с получением белого остатка. Флэш-хроматография на силикагеле с элюированием смесью 20% этилацетата/гексан приводит к получению прозрачного масла (13,5 г),которое затвердевает при стоянии. Т.пл. 4547 С. Подготовительная стадия 108. 4-(2,2,2 Трифторэтокси)бензонитрил. К раствору 4-цианофенола (5,0 г, 42,0 ммоль) в триамиде гексаметилфосфорной кислоты (НМРТ) (40 мл) добавляют гидрид натрия(1,68 г, 42,0 ммоль) и перемешивают в течение 15 мин при комнатной температуре. Шприцом добавляют 2,2,2-трифторэтилметансульфонат(8,98 г, 50,4 ммоль) и смесь перемешивают при 140 С в течение ночи. Смесь охлаждают до комнатной температуры, разбавляют 300 мл ледяной воды и 50 мл 2 н. соляной кислоты и 44 экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой, 1 н. гидроксидом натрия и рассолом, сушат над Na2SO4,фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 25% диэтилового эфира/гексан в качестве элюента с получением масла (2,68 г). (Synthesis 727 (1980. Подготовительная стадия 109. 1-(5-Хлортиофен-2-ил)этиламин. Раствор 1-(5-хлортиофен-2-ил)этанона (5,0 г, 31,0 ммоль) в формамиде (6 мл, 150,0 ммоль) перемешивают при 160 С в течение 18 ч. Смесь вливают в 200 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над MgSO4,фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 20% этилацетат/гексан в качестве элюента, с получением масла. Масло переносят в 26 мл 6 н. NaOH, 20 мл метанола и 5 мл тетрагидрофурана и нагревают с обратным холодильником в течение 3 ч. Смесь вливают в 200 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты концентрируют с получением темного масла (2,3 г). ММ 161,67; МС (m/e) 161 (М+). Соединения подготовительных стадий 110111 получают в соответствии с методикой подготовительной стадии 109, заменяя 1-(5-хлортиофен-2-ил)-этанон соответствующим альдегидом или кетоном. Продолжительность реакции находится в интервале между 30 мин и 24 ч. Подготовительная стадия 110. С-(5-Метилтиофен-2-ил)метиламин. ММ 127,23; МС (m/e) 127 (М+). Подготовительная стадия 111. С-(3-Метилтиофен-2-ил)метиламин. ММ 127,23; МС (m/e) 127 (М+). Подготовительная стадия 112. 5-Аминометил-1,3-дигидроиндол-2-он. К раствору 2-оксо-2,3-дигидро-1 Н-индол 5-карбонитрила (1,3 г) в метаноле (30 мл) добавляют 10% РtO2 (0,200 г). Смесь встряхивают при 303,36944 кПа (44 фунт/кв.дюйм) водорода в течение ночи. Катализатор удаляют фильтрованием, и смесь сушат над Na2SO4. Раствор концентрируют с получением желтого твердого вещества (1,1 г). ММ 162; МС (m/e) 162 (М+). Подготовительная стадия 113. 2-Оксо-2,3 дигидро-1 Н-индол-5-карбонитрил. Раствор 3,3-дибром-2-оксо-2,3-дигидро 1 Н-индол-5-карбонитрила (10,5 г, 33,3 ммоль) и цинковой пыли (22,0 г, 338,5 ммоль) в уксусной кислоте (250 мл) перемешивают при комнатной температуре в течение 45 мин. Смесь фильтруют через целит и концентрируют до сухого состояния. Полученное масло разбавляют 300 мл воды и экстрагируют этилацетатом. Объединенные экстракты промывают 1 н. гидроксидом натрия и рассолом, сушат над MgSO4, фильтруют 45 и концентрируют с получением белого твердого вещества (1,9 г). ММ 158. Подготовительная стадия 114. 3,3-Дибром 2-оксо-2,3-дигидро-1 Н-индол-5-карбонитрил. К раствору 1 Н-индол-5-карбонитрила (5,0 г, 35,2 ммоль) в трет-бутаноле (300 мл) за 10 мин добавляют пербромид бромида пиридиния(37,5 г, 105,6 ммоль) и перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют до оранжевого масла. Полученное масло разбавляют 500 мл воды и экстрагируют этилацетатом. Объединенные экстракты промывают водой и рассолом, сушат над Na2SO4,фильтруют и концентрируют с получением желтого твердого вещества (10,37 г). ММ 315,95; МС (m/e) 316 (М 1). Подготовительная стадия 115. 6-Амино 3 Н-бензооксазол-2-он. Раствор 6-нитро-3 Н-бензооксазол-2-она(8,4 г, 46,0 ммоль) и олова (16,0 г) в концентрированной соляной кислоте (100 мл) перемешивают при 60 С в течение 2 ч. Смесь разбавляют водой, подщелачивают до рН 12 и экстрагируют этилацетатом. Объединенные экстракты сушат над Na2SO4, фильтруют и концентрируют с получением оранжевого твердого вещества (2,45 г). ММ 150; МС (m/e) 151 (М 1). Подготовительная стадия 116. 6-Нитро-3 Нбензооксазол-2-он. Раствор 3 Н-бензооксазол-2-она (10,0 г) в концентрированной НNО 3 (100 мл) перемешивают при 40 С. При этом выпадает осадок, и температура реакции увеличивается. Смесь охлаждают в ледяной бане до температуры ниже 50 С. Смесь разбавляют ледяной водой и осадок отделяют фильтрованием. Продукт промывают водой с получением белого твердого вещества(8,4 г). Т.пл. 239-241 С. Подготовительная стадия 117. Этиловый эфир 5-аминометил-1 Н-индол-2-карбоновой кислоты. Раствор этилового эфира 5-циано-1 Ниндол-2-карбоновой кислоты (1,8 г, 8,4 ммоль) иBu4N+BH3- в метиленхлориде (80 мл) нагревают с обратным холодильником в течение 4 ч. Смесь концентрируют до коричневого масла, которое растворяют в 10%-ной соляной кислоте (50 мл) и нагревают с обратным холодильником в течение 1 ч. Смесь экстрагируют этилацетатом (из отходов) и нейтрализуют. Водный слой экстрагируют этилацетатом. Объединенные экстракты сушат над Na2SO4, фильтруют и концентрируют с получением твердого вещества (0,920 г). ММ 218,258; МС (m/e) 218 (М+). Подготовительная стадия 118. 3,5-Ди-третбутил-4-гидроксибензонитрил. Раствор оксима 3,5-ди-трет-бутил-4-гидроксибензальдегида (3,0 г, 8,4 ммоль) в уксусном ангидриде (6 мл) нагревают с обратным холодильником в течение 2 ч. Смесь охлаждают до 0 С и добавляют насыщенный раствор гидрокарбоната натрия. Смесь экстрагируют мети 003528 46 ленхлоридом. Объединенные экстракты промывают насыщенным раствором NaHCO3, сушат над Na2SO4, фильтруют и концентрируют с получением твердого вещества. Твердое вещество растворяют в диэтиловом эфире и экстрагируют 1 н. гидроксидом натрия, затем подкисляют до рН 1 и экстрагируют этилацетатом. Экстракт сушат и концентрируют до желтого твердого вещества, которое перекристаллизовывают из смеси этилацетат/гексан с получением белых кристаллов (1,05 г). ММ 231; МС (m/e) 249(14,83 г, 213,3 ммоль) и 40%-ного КОН (80 мл) в метаноле (100 мл) перемешивают при комнатной температуре в течение выходных дней. Для того, чтобы удалить метанол, смесь концентрируют. Водную фазу подкисляют и экстрагируют этилацетатом. Объединенные экстракты промывают водой и рассолом, сушат над Na2SO4,фильтруют и концентрируют с получением желтого твердого вещества (8,9 г). Т.пл. 122-124 С; ММ 249; МС (m/е) 249 (М+). Соединение подготовительной стадии 120 получают в соответствии с методикой подготовительной стадии 119, заменяя 3,5-ди-третбутил-4-гидрокси-бензальдегид соответствующим альдегидом. Продолжительность реакции находится в интервале между 1 и 48 ч. Подготовительная стадия 120. Оксим 4 гидрокси-3,5-диметилбензальдегида. ММ 165; МС (m/e) 166 (М 1). Подготовительная стадия 121. 4-Аминометил-2,6-диметилфенол. Раствор оксима 4-гидрокси-3,5-диметилбензальдегида (1,0 г, 6,06 ммоль) в уксусной кислоте (30 мл) и цинковую пыль (4,0 г, 61,2 ммоль) перемешивают при 60 С в течение 2 ч. Смесь фильтруют через целит, подщелачивают водным раствором гидроксида аммония и экстрагируют хлороформом. Объединенные экстракты сушат над МgSO4, фильтруют и концентрируют с получением пены (0,90 г). ММ 151; МС (m/e) 151 (М+). Подготовительная стадия 122. 1-(2-Хлорфенил)этан-1,2-диол. К энергично перемешиваемой смеси ADmix (1,4 г) в воде (5 мл) и трет-бутанола (5 мл) при 0 С добавляют 1-хлор-2-винилбензол (0,140 г, 1,0 ммоль) и перемешивают при 0 С в течение 2 ч. К смеси добавляют сульфит натрия (1,5 г) и оставляют нагреваться до комнатной температуры в течение 1 ч. Смесь экстрагируют метиленхлоридом. Объединенные экстракты промывают рассолом, сушат над Na2SO4, фильтруют и концентрируют с получением бесцветного масла (0,190 г). ММ 172,61; МС (m/e) 190 (М 18). 47 Подготовительная стадия 123. Амид 4 хлор-5-(1-гидрокси-1-метилэтил)тиофен-2-карбоновой кислоты. Раствор метилового эфира 4-хлор-5-(1 гидрокси-1-метилэтил)тиофен-2-карбоновой кислоты (2,4 г) в сжиженном NН 3 (20 мл) и метаноле (10 мл) перемешивают при комнатной температуре в запаянной трубке в течение 3 дней. Растворитель выпаривают с получением твердого вещества, которое очищают флэшхроматографией на диоксиде кремния, используя смесь 5% метанола/метиленхлорид в качестве элюента, с получением желтоватокоричневого твердого вещества, которое перетирают в диэтиловом эфире с получением белого твердого вещества (1,6 г). ММ 219,71; МС(m/e) 237 (M18), 220 (M1). Соединения подготовительных стадий 124125 получают в соответствии с методикой подготовительной стадии 123, заменяя метиловый эфир 4-хлор-5-(1-гидрокси-1-метилэтил)тиофен 2-карбоновой кислоты соответствующим сложным эфиром. Продолжительность реакции находится в интервале между 1 и 72 ч. Подготовительная стадия 124. Амид 5-(1 этил-1-гидроксипропил)тиофен-2-карбоновой кислоты. ММ 213,33; МС (m/e) 213 (М+). Подготовительная стадия 125. Амид 3 хлор-5-(1-гидрокси-1-метилэтил)тиофен-2 карбоновой кислоты. ММ 186,63; 1 Н ЯМР (CDCl3)1.63 (6 Н, s),6.85 (1 Н, s). Подготовительная стадия 126. Метиловый эфир 4-хлор-5-(1-гидрокси-1-метилэтил)тиофен 2-карбоновой кислоты. К раствору диизопропиламина (6 мл, 38,9 ммоль) в тетрагидрофуране (15 мл) при 0 С по каплям добавляют 2,5 М н-BuLi (16 мл) и перемешивают при 0 С в течение 10 мин. Смесь охлаждают до -78 С и по каплям добавляют 4 хлортиофен-2-карбоновую кислоту (3,0 г, 18,5 ммоль) в тетрагидрофуране (15 мл) и перемешивают в течение 20 мин, а затем добавляют ацетон (1,6 мл, 22,2 ммоль), и смесь оставляют нагреваться до комнатной температуры за 1 ч. Смесь вливают в 200 мл воды и экстрагируют диэтиловым эфиром. Водный слой подкисляют щавелевой кислотой до рН 4 и экстрагируют метиленхлоридом. Объединенные экстракты промывают водой, сушат над MgSO4, фильтруют и концентрируют до твердого вещества, которое переносят в диэтиловый эфир (100 мл) и обрабатывают CH2N2 при 0 С. Реакционную смесь гасят уксусной кислотой, разбавляют диэтиловым эфиром (300 мл) и промывают насыщенным раствором NаНСО 3, водой и рассолом,сушат над MgSO4, фильтруют и концентрируют с получением масла, которое очищают флэшхроматографией на диоксиде кремния, используя смесь 20% этилацетата/гексан в качестве 48 элюента, с получением твердого вещества (2,42 г). ММ 234,72; МС (m/e) 234/236 (М 1). Соединения подготовительных стадий 127129 получают в соответствии с методикой подготовительной стадии 126, заменяя 4-хлортиофен-2-карбоновую кислоту соответствующей кислотой. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 127. Амид 5-(1 гидрокси-1-метилэтил)фуран-2-карбоновой кислоты. ММ 184,21; МС (m/e) 184 (М+). Подготовительная стадия 128. Метиловый эфир 5-(1-этил-1-гидроксипропил)тиофен-2-карбоновой кислоты. ММ 228,34; МС (m/e) 228 (М+). Подготовительная стадия 129. Метиловый эфир 3-хлор-5-(1-гидрокси-1 метилэтил)тиофен-2-карбоновой кислоты. ММ 234,70; 1H ЯМР (CDCl3)1.62 (6 Н, s),3.85 (3 Н, s), 6.84 (1 Н, s). Подготовительная стадия 130. Этиловый эфир 5-аминопентановой кислоты. Раствор 5-аминопентановой кислоты (1,06 г, 9,0 ммоль) и тионилхлорида (20,0 мл) перемешивают при комнатной температуре в течение 2 ч. Растворитель выпаривают, добавляют этанол (26,5 мл) и осторожно нагревают. Через два часа раствор концентрируют с получением желтого твердого вещества (0,580 г). ММ 145,22; МС (m/e) 146 (M1). Соединение подготовительной стадии 131 получают в соответствии с методикой подготовительной стадии 130, заменяя 5-аминопентановую кислоту соответствующей кислотой. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 131. Этиловый эфир транс-4-аминометилциклогексанкарбоновой кислоты. ММ 185,28; МС (m/e) 186 (M1). Подготовительная стадия 132. Метиловый эфир 5-(1-гидрокси-1-метилэтил)фуран-2-карбоновой кислоты. К раствору диизопропиламина (7,6 мл, 54,0 ммоль) в тетрагидрофуране (20 мл) при 0 С добавляют 2,5 М раствор н-бутиллития (22 мл, 54,0 ммоль). Смесь охлаждают до -78 С и по каплям добавляют раствор фуран-2-карбоновой кислоты (3,0 г, 27,0 ммоль) в тетрагидрофуране (20 мл), перемешивают в течение 20 мин и добавляют ацетон (2,4 мл, 32,0 ммоль). Смесь перемешивают при -78 С в течение 10 мин и оставляют нагреваться до комнатной температуры за 1 ч. Смесь вливают в 200 мл воды, подкисляют щавелевой кислотой до рН 2 и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат надMgSО 4, фильтруют и концентрируют с получением твердого вещества (0,580 г). ММ 145,22; МС (m/e) 146 (M1). 49 Подготовительная стадия 133. 3-Хлор-4-(1 гидрокси-1-метилэтил)бензонитрил. К раствору метилового эфира 3-хлор-4 цианобензойной кислоты (2,0 г, 10,0 ммоль) в тетрагидрофуране (30 мл) при -40 С по каплям добавляют 3,0 М СН 3 МgСl (8 мл, 22,0 ммоль). Смесь оставляют нагреваться до комнатной температуры за 1 ч. Реакционную смесь гасят 10 мл метанола, добавляемого по каплям, вливают в 200 мл воды, подкисляют щавелевой кислотой и экстрагируют этилацетатом. Объединенные экстракты промывают водой и рассолом, сушат над MgSO4, фильтруют и концентрируют с получением масла (2,1 г). ММ 195,60; МС (m/e) 195/197 (М+). Соединение подготовительной стадии 134 получают в соответствии с методикой подготовительной стадии 133, заменяя метиловый эфир 3-хлор-4-цианобензойной кислоты соответствующим сложным эфиром. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 134. 2-Хлор-4-(1 гидрокси-1-метилэтил)бензонитрил. ММ 195,60; МС (m/e) 195/197 (М+). Подготовительная стадия 135. Метиловый эфир 2-хлор-4-цианобензойной кислоты. Раствор метилового эфира 4-бром-2-хлорбензойной кислоты (3,1 г, 12,0 ммоль), Zn(CN)2(0,875 г, 7,0 ммоль) и Рd(РРh3)4 (0,555 г, 48,0 ммоль) в диметилформамиде (30 мл) нагревают до 90 С в течение ночи. Реакционную смесь вливают в 200 мл насыщенного раствора гидрокарбоната натрия и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют с получением масла, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 20% этилацетата/гексан в качестве элюента, с получением белого твердого вещества (2,1 г). ММ 195,61; МС(m/e) 195/197 (М+). Соединение подготовительной стадии 136 получают в соответствии с методикой подготовительной стадии 135, заменяя метиловый эфир 4-бром-2-хлорбензойной кислоты метиловым эфиром 3-хлор-4-трифторметансульфонилоксибензойной кислоты. Продолжительность реакции находится в интервале между 1 и 24 ч. Подготовительная стадия 136. 4-Трифторацетилбензонитрил. ММ 199,13; МС (m/e) 199 (М+). Подготовительная стадия 137. (S)-(+)транс-1-(4-Аминометилциклогексил)этанол. Получают способом, аналогичным способу в подготовительной стадии 253 из бензилового эфира (S)-(+)-(транс-4-(1-гидроксиэтил)циклогексилметил)карбаминовой кислоты, который получают из бензилового эфира (транс-4 ацетилциклогексилметил)карбаминовой кислоты, с использованием моногидрата (R)-2-метилСВS-оксазаборолидина аналогично подготовительной стадии 254.(0,840 г, 4,49 ммоль) в тетрагидрофуране (20 мл) по каплям добавляют 1,0 М алюмогидрид лития(15 мл, 14,8 ммоль), перемешивают при 0 С в течение 10 мин и нагревают с обратным холодильником в течение 30 мин. Смесь охлаждают до 0 С, смешивают с 10 мл метанола, добавляемого по каплям, и разбавляют хлороформомMgSО 4, фильтруют и концентрируют до масла,которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 5% метанола/метиленхлорид в качестве элюента, с получением твердого вещества (0,350 г). ММ 205,20; МС (m/e) 205 (М+). Соединение подготовительной стадии 139 получают в соответствии с методикой подготовительной стадии 138, заменяя 4-фторацетилбензонитрил соответствующим нитрилом. Продолжительность реакции находится в интервале между 30 мин и 24 ч. Подготовительная стадия 139. 7-Аминометилхроман-4-ол. ММ 179,24; МС (m/e) 179 (М+). Подготовительная стадия 140. 4-Оксохроман-7-карбонитрил. Раствор 4-оксохроман-7-илового эфира трифторметансульфоновой кислоты (2,0 г, 6,80 ммоль), Zn(CN)2 (0,476 г, 4,1 ммоль) и Pd(PPh3)4(0,314 г, 0,27 ммоль) в диметилформамиде (20 мл) нагревают до 80 С в течение ночи. Реакционную смесь вливают в 200 мл смеси 1/1 насыщенный раствор NаНСО 3/вода и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат надMgSO4, фильтруют и концентрируют с получением масла,которое очищают флэшхроматографией на диоксиде кремния, используя смесь 30% этилацетата/гексан в качестве элюента, с получением твердого вещества (1,02 г). ММ 173,20; МС (m/e) 173 (М+). Соединение подготовительной стадии 141 получают в соответствии с методикой подготовительной стадии 140, заменяя 4-оксохроман-7 иловый эфир трифторметансульфоновой кислоты соответствующим трифлатом. Продолжительность реакции находится в интервале между 30 мин и 24 ч. Подготовительная стадия 141. Метиловый эфир 3-хлор-4-цианобензойной кислоты. ММ 195,61; МС (m/e, %) 195 (М+, 25), 164-100 С по каплям добавляют 2,5 М н-BuLi (4,8 мл) и перемешивают при -100 С в течение 15 мин. По каплям добавляют циклобутанон (0,965 г, 13,19 ммоль) и перемешивают в течение 10 51 мин и оставляют нагреваться до комнатной температуры за 1 ч. Смесь вливают в 200 мл воды и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом,сушат над МgSO4, фильтруют и концентрируют до масла, которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 40% этилацетата/гексан в качестве элюента, с получением прозрачного масла (1,5 г). ММ 173,23; МС (m/e) 173 (М+). Подготовительная стадия 143. 4-(1-Гидроксипроп-2-инил)бензонитрил. К раствору 4-формилбензонитрила (1,5 г,10,0 ммоль) в тетрагидрофуране (20 мл) при-78 С по каплям добавляют 0,5 М этинилмагнийбромид (26 мл, 13,0 ммоль). Смесь перемешивают при -78 С в течение 30 мин и оставляют нагреваться до комнатной температуры за 1 ч. Реакционную смесь охлаждают до 0 С, смешивают с 10 мл метанола, вливают в 200 мл воды,подкисляют щавелевой кислотой и экстрагируют диэтиловым эфиром. Объединенные экстракты промывают водой и рассолом, сушат над МgSO4, фильтруют и концентрируют до масла,которое очищают флэш-хроматографией на диоксиде кремния, используя смесь 30% этилацетата/гексан в качестве элюента, с получением твердого вещества (1,6 г). ММ 157,18; МС (m/e) 157 (М+). Подготовительная стадия 144. Метиловый эфир 3-хлор-4-трифторметансульфонилоксибензойной кислоты. К раствору метилового эфира 3-хлор-4 гидроксибензойной кислоты (15,0 г, 80,0 ммоль), триэтиламина (20,2 г, 200 ммоль) и диметиламинофенола (ДМАП) (1,0 г, 8,0 ммоль) в метиленхлориде (200 мл) при 0 С по каплям добавляют ангидрид трифторметансульфоновой кислоты (17 мл, 100,0 ммоль). Смесь оставляют нагреваться до комнатной температуры и перемешивают в течение четырех часов. Смесь разбавляют метиленхлоридом (600 мл), промывают водой, сушат над МgSO4, фильтруют и концентрируют до масла, которое очищают флэшхроматографией на диоксиде кремния, используя смесь 20% этилацетата/гексан в качестве элюента, с получением масла (20,9 г). ММ 322,05; МС (m/e) 322 (M+). Подготовительная стадия 145. 4-(1-Азетидинил)бензонитрил. Смесь 6,34 г (52,5 ммоль) 4-фторбензонитрила, 3,00 г (52,5 ммоль) азетидина,7,26 г (52,5 ммоль) K2 СО 3 и 50 мл метилсульфоксида нагревают до 60 С в течение 16 ч. Охлажденную смесь разбавляют 200 мл воды и экстрагируют EtOAc (2 х 150 мл). Объединенные органические экстракты промывают водой(Na2SO4) и упаривают до 5,65 г белого твердого вещества. Перетирание в гексане приводит к получению 3,85 г (выход 56%) указанного в заглавии соединения в виде белого твердого ве 003528 52 щества, т.пл. 98-99 С. 1H ЯМР (CDCl3)2.392.45 (2 Н, m), 3.96 (4 Н, t, J=7 Гц), 6.32 (2 Н, d, J=9 Гц), 7.41 (2 Н, d, J=9 Гц); AMPI MC (m/e) 159(M1). Соединения подготовительных стадий 146151 получают в соответствии с методикой подготовительной стадии 145, заменяя азетидин соответствующим амином. Температура находится в интервале 90-115 С. Получение аминов,использованных в подготовительных стадиях 54 а и 54 е, известно (Rosenberg, S.H. et al. J. Med.H ЯМР (CDCl3)1.27 (6 Н, s), 1.56 (1 Н, s),3.09 (3 Н, s), 3.39 (2 Н, s), 6.79 (2 Н, d, J=9 Гц),7.44 (2 Н, d, J=9 Гц); MC (m/e) 205 (M1). Подготовительная стадия 152. 1-[4-(Аминометил)фенил]азетидин. К раствору 2,00 г (12,6 ммоль) соединения подготовительной стадии 145 в 50 мл тетрагидрофурана порциями добавляют 479 мг (12,6 ммоль) алюмогидрида лития. После того, как добавление заканчивают, смесь перемешивают в течение 4 ч при комнатной температуре. Смесь охлаждают последовательным добавлением 2 мл воды, 2 мл 15%-ного водного гидроксида натрия и 6 мл воды. Осадок удаляют фильтрованием, промывая ТГФ. Фильтрат сушат(Nа 2SO4) и упаривают до желтого твердого ве 53 щества, которое очищают флэш-хроматографией, используя EtOAc, а затем 76:20:4 СНСl3:МеОН:конц.NН 3 (водн.) в качестве элюентов, с получением 1,22 г полутвердого вещества. Перетирание в гексане приводит к получению 815 мг (выход 40%) указанного в заглавии соединения, т.пл. 58-60 С. 1H ЯМР (CDCl3)1.60 (2 Н, s), 2.29-2.37 (2 Н, m), 3.73 (2 Н, s), 3.83(4 Н, t, J=7 Гц), 6.42 (2 Н, d, J=8 Гц), 7.13 (2H, d,J=8 Гц). Соединения подготовительных стадий 153158 получают в соответствии с методикой подготовительной стадии 55, заменяя соединение подготовительной стадии 145 соответствующим субстратом. Масс-спектры определяют AMPI методом. Подготовительная стадия 153. 1-(4-Аминометилфенил)азетидин-3-ол. 1s), 2.97 (3 Н, s), 3.25 (2 Н, s), 3.78 (2 Н, s), 6.80 (2 Н,d, J=9 Гц), 7.20 (2 Н, d, J=9 Гц). Подготовительная стадия 159. Метиловый эфир 2-(4-фторфенокси)-3-пиридинкарбоновой кислоты. Смесь 20,0 г (89,6 ммоль) 2-(4-фторфенокси)-3-пиридинкарбоновой кислоты (получение: Villani, F.J. et. al. J. Med. Chem., 1975, 18,3), 300 мл метанола и 5,5 мл концентрированной серной кислоты нагревают до образования флегмы в течение 2 ч. Охлажденную смесь вливают в 500 мл ледяного насыщенного раствора 54 гидрокарбоната натрия, и полученный осадок фильтруют, промывают водой и сушат под вакуумом с получением 12,9 г (выход 64%) указанного в заглавии соединения в виде белого твердого вещества, т.пл. 97-99 С. Анализ: вычислено для С 13 Н 10NO3F: С 63.16; Н 4.08; N 5.67. Найдено: С 62.80; Н 4.08; N 5.50. Подготовительная стадия 160. 2-(4 Фторфенокси)-3-пиридинметанол. Раствор 10,00 г (40,45 ммоль) соединения подготовительной стадии 56 в 200 мл безводного толуола охлаждают до -78 С и по каплям обрабатывают 84,59 мл (84,98 ммоль) 1 М раствора гидрида диизобутилалюминия в CH2Cl2. После этого добавляют 200 мл воды, а затем 200 млEtOAc, и смесь оставляют нагреваться до комнатной температуры. 1 н. Водным раствором соляной кислоты устанавливают рН водного слоя 4, органический слой отделяют и объединяют с 200 мл (после обратной промывки водного слоя). Органические экстракты промывают насыщенным водным раствором гидрокарбоната натрия, рассолом, сушат (Na2SO4) и упаривают с получением 9,00 г (выход 90%) указанного в заглавии соединения в виде не совсем белого твердого вещества, т.пл. 70-72 С. 1H ЯМР(CDCl3)1.59 (1 Н, s), 4.84 (2 Н, d, J=6 Гц), 6.997.13 (5 Н, m), 7.76-7.80 (1 Н, m), 8.07 (1 Н, dd, J=2,5 Гц). Подготовительная стадия 161. 2-(4-Фторфенокси)-3-пиридинкарбоксальдегид. Смесь 932 мг (4,25 ммоль) соединения подготовительной стадии 57, 2,00 г (23,0 ммоль) диоксида марганца и 30 мл бензола нагревают до образования флегмы в течение 3 ч с выделением воды. Охлажденную смесь фильтруют,упаривают до белого твердого вещества и очищают флэш-хроматографией, используя смесь 15% ЕtOАс-гексан в качестве элюента и получая 735 мг (выход 80%) указанного в заглавии соединения в виде белого твердого вещества, т.пл. 61-62 С. 1H ЯМР (CDCl3)7.08-7.21 (5 Н, m),8.19-8.32 (2H, m), 10.55 (1H, s). Подготовительная стадия 162. третБутиловый эфир 3-[2-(4-фторфенокси)-3-пиридинил]-3-гидроксиакриловой кислоты. При -78 С, 115,3 мл (115,3 ммоль) раствора 1 М бис(триметилсилил)амида лития в тетрагидрофуране обрабатывают каплями 15,43 мл(13,39 г, 115,3 ммоль) трет-бутилацетата. После окончания добавления смесь перемешивают в течение 15 мин, а затем обрабатывают раствором 9,500 г (38,43 ммоль) соединения подготовительной стадии 56 в 50 мл ТГФ. После окончания добавления смесь перемешивают в течение 15 мин, а затем гасят 230 мл 1 н. водного раствора соляной кислоты. После нагревания до комнатной температуры органический слой экстрагируют эфиром (2 х 500 мл), и объединенные органические слои промывают насыщенным водным раствором гидрокарбоната натрия (1 х 55 100 мл), рассолом (1 х 200 мл), сушат (Na2SO4) и упаривают до 13,8 г бледно-желтого масла. Очистка флэш-хроматографией с использованием смеси с градиентом от 15 до 85% эфирагексан в качестве элюента дает 11,7 г полутвердого вещества, которое перетирают в гексане с получением 6,124 г (выход 48%) указанного в заглавии соединения в виде белого твердого вещества, т.пл. 87-89 С. 1H ЯМР (CDCl3)1.54(9 Н, s), 6.12 (1 Н, s), 7.01-7.16 (5 Н, m), 8.14 (1 Н,dd, J=2,5 Гц), 8.30 (1 Н, dd, J=2,8 Гц), 12.99 (1 Н,s). ЯМР спектры также показали наличие 10% кето таутомера. После стояния в течение 12 дней концентрированный маточный раствор кристаллизуется; перетирание в гексане приводит к получению дополнительных 2,21 г (выход 17%) указанного в заглавии соединения. Подготовительная стадия 163. Третбутиловый эфир -[(2-хлорфенил)метил]-2-(4 фторфенокси)оксо-3-пиридинпропионовой кислоты. Гидрид натрия, полученный после промывки 28,9 г (0,604 ммоль) 50%-ной дисперсии гидрида натрия в минеральном масле пентаном(3 х 5 мл) суспендируют в 5 мл ТГФ, охлаждают до 0 С и обрабатывают по каплям раствором 200 мг (0,604 ммоль) соединения подготовительной стадии 59 в 5 мл ТГФ. После перемешивания в течение 15 мин добавляют 0,078 мл(124 мг, 0,604 ммоль) 2-хлорбензилбромида, и смесь оставляют нагреваться до комнатной температуры, перемешивают в течение 4 ч, а затем нагревают до образования флегмы в течение 16 ч. Охлажденную смесь распределяют между 100 мл насыщенного водного раствора NH4Cl и 200 мл ЕtOАс. Отделенный органический слой промывают насыщенным водным раствором гидрокарбоната натрия (100 мл), рассолом (100 мл),сушат (Na2SO4) и упаривают до масла. Очистка флэш-хроматографией с использованием смеси 60% СН 2 Сl2-гексан в качестве элюента дает 226 мг (выход 82%) указанного в заглавии соединения в виде масла. 1H ЯМР (CDCl3)1.54 (9 Н, s),3.32-3.52 (2 Н, m), 5.09 (1 Н, dd, J=7, 8 Гц), 7.027.30 (9 Н, m), 8.05 (1 Н, dd, J=2, 8 Гц), 8.22 (1 Н,dd, J=2,5 Гц). ЯМР спектры также показали наличие 10% енольного таутомера. Соединения подготовительных стадий 164168 получают в соответствии с методикой подготовительной стадии 163, заменяя 2 хлорбензилбромид указанным бензилгалогенидом. В случаях подготовительных стадий 165168 после добавления бензилгалогенида немедленно добавляют 1 эквивалент KI. Все соединения являются маслами. Масс-спектры определяют методом термораспыления. Подготовительная стадия 164. Трет-бутиловый эфир 2-(4-фторбензил)-3-[2-(4-фторфенокси)пиридин-3-ил]-3-оксопропионовой кислоты. 56 МС (m/e) 440 (M1); 1H ЯМР (CDCl3)1.27 (9 Н, s), 3.17-3.44 (2 Н, m), 4.80 (1 Н, dd, J=7,8 Гц), 6.85-7.30 (9 Н, m), 8.08 (1 Н, dd, J=2,8 Гц),8.23-8.25 (1 Н, m). Подготовительная стадия 165. Третбутиловый эфир 3-[2-(4-фторфенокси)пиридин 3-ил]-3-оксо-2-(4-трифторметилбензил)пропионовой кислоты. МС (m/e) 490 (М 1); 1H ЯМР (CDCl3)1.24 (9 Н, s), 3.36 (2 Н, АВХ образец, JAB=14 Гц,JAX=7 Гц, JBX=8 Гц), 4.83 (1 Н, dd, J=7,8 Гц), 6.997.50 (9 Н, т), 8.02-8.22 (2 Н, m). Подготовительная стадия 166. Третбутиловый эфир 3-[2-(4-фторфенокси)пиридин 3-ил]-3-оксо-2-(4-трифторметоксибензил)пропионовой кислоты. МС (m/e) 506 (М 1); 1H ЯМР (CDCl3)1.25 (9 Н, s), 3.32-3.46 (2 Н, т), 4.82 (1 Н, t, J=7 Гц), 7.03-7.28 (9 Н, т), 8.09 (1 Н, dd, J=2,8 Гц),8.24 (1 Н, dd, J=2,5 Гц). Подготовительная стадия 167. Третбутиловый эфир 2-(3,5-дифторбензил)-3-[2-(4 фторфенокси)пиридин-3-ил]-3-оксопропионовой кислоты МС (m/e) 458 (M1); 1H ЯМР (CDCl3)1.25 (9 Н, s), 3.28 (2 Н, АВХ образец, JAB=14 Гц,JAX=7 Гц, JBX=8 Гц), 4.79 (1 Н, dd, J=7,8 Гц), 6.557.18 (8 Н, m), 8.09 (1 Н, dd, J=2,8 Гц), 8.23 (1 Н,dd, J=2,4 Гц). Подготовительная стадия 168. Третбутиловый эфир 3-[2-(4-фторфенокси)пиридин 3-ил]-3-оксо-2-(2,4,6-трифторбензил)пропионовой кислоты. МС (m/e) 476 (М 1); 1H ЯМР (CDCl3)1.22 (9 Н, s), 3.22-3.35 (2 Н, m), 4.82 (1 Н, J=8 Гц),6.56 (2 Н, t, J=8 Гц), 7.02-7.12 (5 Н, m), 8.11 (1 Н,dd, J=2,8 Гц), 8.22 (1H, dd,J=2,5 Гц). Подготовительная стадия 169. 4-(1-Гидрокси-1-метилэтил)бензолпропионовая кислота. Смесь 12,61 г (224,7 ммоль) KОН, 73 мл воды и 425 мл этанола объединяют с 15,00 гFr., 1971, 2227). Полученную смесь перемешивают при комнатной температуре в течение 2 ч. Смесь концентрируют, и остаток растворяют в 100 мл воды, охлаждают до 0 С и подкисляют концентрированным водным раствором соляной кислоты. Осадок отфильтровывают и перекристаллизовывают из смеси метанол-вода с получением 10,11 г (выход 77%) 3-[4-(1-оксоэтил) фенил]пропионовой кислоты в виде белого твердого вещества, т.пл. 118-119 С. Анализ: вычислено для С 11 Н 12 О 3: С 68.52; Н 6.06. Найдено: С 68.74; Н 6.29. Раствор 5,000 г (26,01 ммоль) вышеупомянутой кислоты в 500 мл тетрагидрофурана охлаждают до -17 С и обрабатывают по каплям 21,67 мл (65,03 ммоль) 3 М раствора метилмагниййодида в эфире. Тремя порциями, 5, 5 и 10 57 мл, соответственно, в течение нескольких часов добавляют дополнительное количество реактива Гриньяра, при этом протекание реакции наблюдают при помощи ЯМР. Смесь охлаждают до-30 С, добавляют 200 мл насыщенного водного раствора NH4Cl и оставляют нагреваться до комнатной температуры. 1 н. Водным раствором соляной кислоты устанавливают рН водного слоя 1 и экстрагируют органический слойEtOAc (2 х 200 мл). Объединенные органические слои промывают рассолом (3 х 500 мл),сушат (Na2SO4) и упаривают до 5,62 г желтого твердого вещества. Перекристаллизация из смеси гексан-ЕtOАс приводит к получению 2,20 г(2 Н, t, J=7 Гц), 2.74 (2 Н, t, J=7 Гц), 4.90 (1 Н, s),7.21 (4 Н, АВ квартет, J= 7 Гц), 12.09 (1 Н, s). Подготовительная стадия 170. N-МетоксиN-метил-4-фторбензолпропанамид. Суспензию 10,00 г (59,46 ммоль) 3-(4 фторфенил)пропионовой кислоты, 12,54 г (65,41 ммоль) гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида, 6,381 г (65,41 ммоль) гидрохлорида N,O-диметилгидроксиламина в 300 мл СН 2 Сl2 охлаждают до 0 С и обрабатывают 18,23 мл (13,23 г, 130,8 ммоль) триэтиламина. Смесь перемешивают в течение 16 ч при медленном нагревании до комнатной температуры. Смесь концентрируют, и остаток распределяют между 300 мл EtOAc и 200 мл 1 н. водного раствора соляной кислоты. Отделенный органический слой промывают 1 н. водным раствором соляной кислоты (1 х 100 мл), насыщенным водным раствором гидрокарбоната натрия(m/e) 212 (M1). Соединения подготовительных стадий 171180 получают в соответствии с методикой подготовительной стадии 170, заменяя 3-(4 фторфенил)пропионовую кислоту соответствующей карбоновой кислотой. Карбоновая кислота, применяемая в подготовительной стадии 174, является соединением подготовительной стадии 163, тогда как все другие карбоновые кислоты коммерчески доступны. Масс-спектры определяют АД/ХИ методом. Подготовительная стадия 171. N-МетоксиN-метил-3-фенилпропионамид. Анализ: вычислено для C11H15NO2: С 68.37; Н 7.82; N 7.25. Найдено: С 68.65; Н 8.11;H ЯМР (CDCl3)3.21 (3 Н, s), 3.74 (3 Н, s),4.88 (2 Н, s), 6.89-6.93 (2 Н, m), 7.15-7.19 (1 Н, m),7.34-7.36 (1 Н, m). Подготовительная стадия 181. 1-[2-Фтор-3 пиридинил]-3-(4-фторфенил)-1-пропанон. Раствор 5,90 мл (4,56 г, 45,0 ммоль) диизопропиламина в 20 мл тетрагидрофурана охлаждают до -78 С и обрабатывают по каплям 18,0 мл (45,0 ммоль) 2,5 М раствора н-бутиллития в гексане. После окончания добавления смесь перемешивают в течение 0,5 ч при -78 С и обрабатывают по каплям 3,88 мл (4,37 г, 45,0 ммоль) 2-фторпиридина, перегнанного непосредственно перед применением. После окончания добавления полученную желтую суспензию 59 перемешивают в течение 0,5 ч при -78 С. К суспензии по каплям добавляют раствор 9,51 г(45,0 ммоль) соединения Подготовительной Стадии 62 в 200 мл тетрагидрофурана. Смесь перемешивают в течение 16 ч при медленном нагревании до комнатной температуры по мере того, как баня из сухой лед/ацетон плавится. Смесь гасят 50 мл 1 н. водного раствора соляной кислоты и частичным выпариванием удаляют ТГФ. Остаток распределяют между ЕtOАс (300 мл) и 1 н. водным раствором соляной кислоты(100 мл). Отделенный органический слой промывают 1 н. водным раствором соляной кислоты(100 мл), насыщенным водным раствором гидрокарбоната натрия (100 мл), рассолом (100 мл),сушат (Na2SO4) и упаривают до 12,6 г желтого масла. Очистка флэш-хроматографией с использованием смеси 25% EtOAc-гексан в качестве элюента дает 7,11 г желтого вещества, которое затвердевает при стоянии. Перетирание в гексане приводит к получению 6,87 г (выход 62%) указанного в заглавии соединения в виде светло-желтого твердого вещества, т.пл. 73-74 С. 1H ЯМР (CDCl3)3.02 (2 Н, t, J=7 Гц), 3.29-3.36(2 Н, m), 6.91-6.99 (2 Н, m), 7.17-7.33 (3 Н, m),8.29-8.38 (2 Н, m). АД/ХИ МС (m/e) 248 (М 1). Соединения подготовительных стадий 182190 получают в соответствии с методикой подготовительной стадии 191, заменяя соединение подготовительной стадии 170 соответствующимN-метокси-N-метиламидом или сложным эфиром. В случаях подготовительных стадий 185 и 191 используют дополнительный эквивалент полученного in situ 2-фтор-3-литийпиридина. Продукты очищают прямым перетиранием и/или флэш-хроматографией. Масс-спектры определяют АД/ХИ методом. Подготовительная стадия 182 1-(2 Фторпиридин-3-ил)-3-фенилпропан-1-он. 1
МПК / Метки
МПК: A61K 31/455, A61P 1/04, C07D 213/82
Метки: изоферментов, композиция, никотинамида, способ, фармацевтическая, применение, фдэ4, лечения, производные, ингибирования
Код ссылки
<a href="https://eas.patents.su/30-3528-proizvodnye-nikotinamida-ih-primenenie-farmacevticheskaya-kompoziciya-sposob-lecheniya-i-sposob-ingibirovaniya-izofermentov-fde4-d.html" rel="bookmark" title="База патентов Евразийского Союза">Производные никотинамида, их применение, фармацевтическая композиция, способ лечения и способ ингибирования изоферментов фдэ4 d</a>
Предыдущий патент: Замещенные 4-аминотиазолы в качестве ингибиторов циклинзависимых киназ
Следующий патент: Предупреждение потери и восстановление костной массы некоторыми агонистами простагландина
Случайный патент: Устройство для очистки дымовых газов, имеющее окислительное устройство в сборнике орошающей жидкости