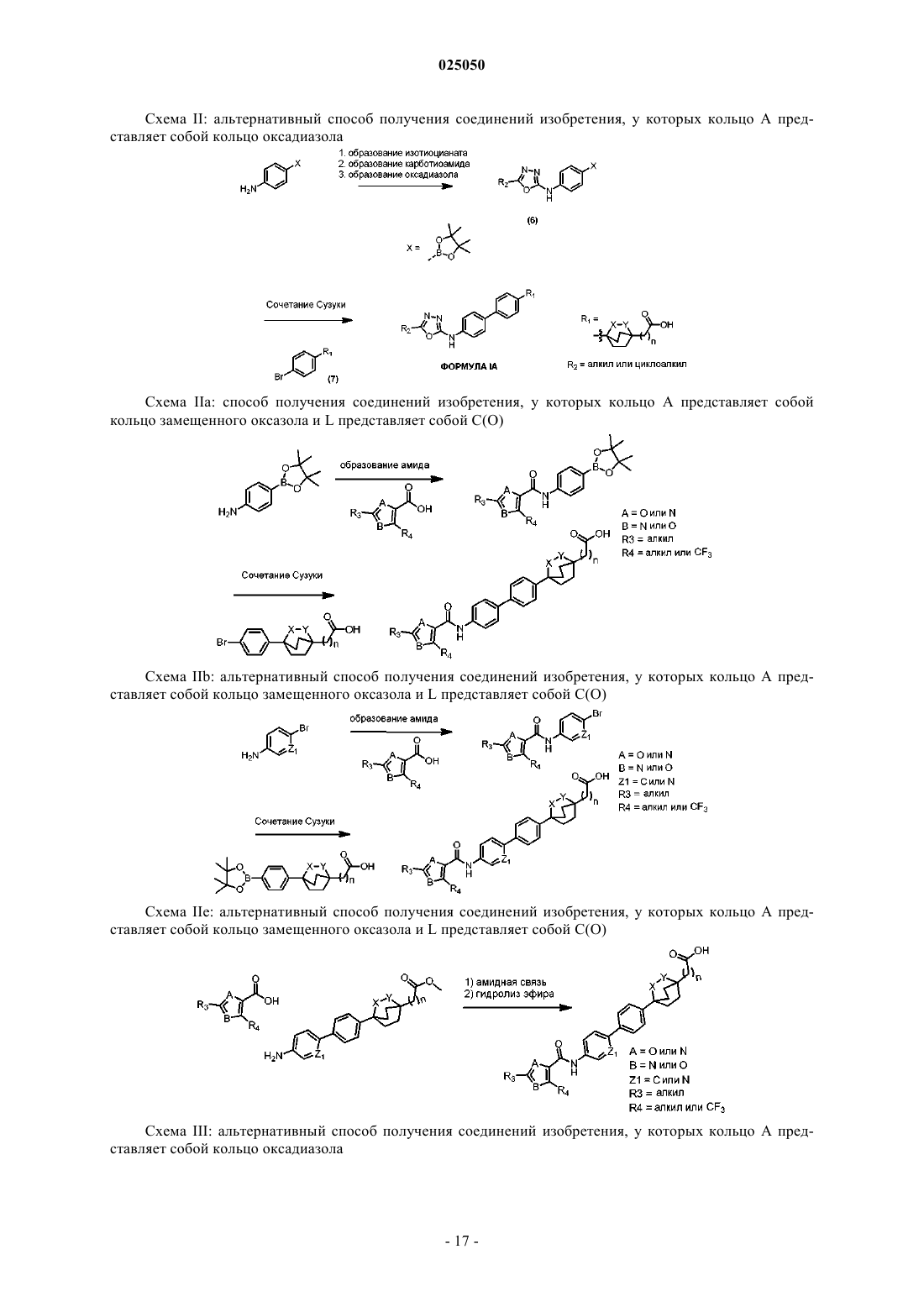
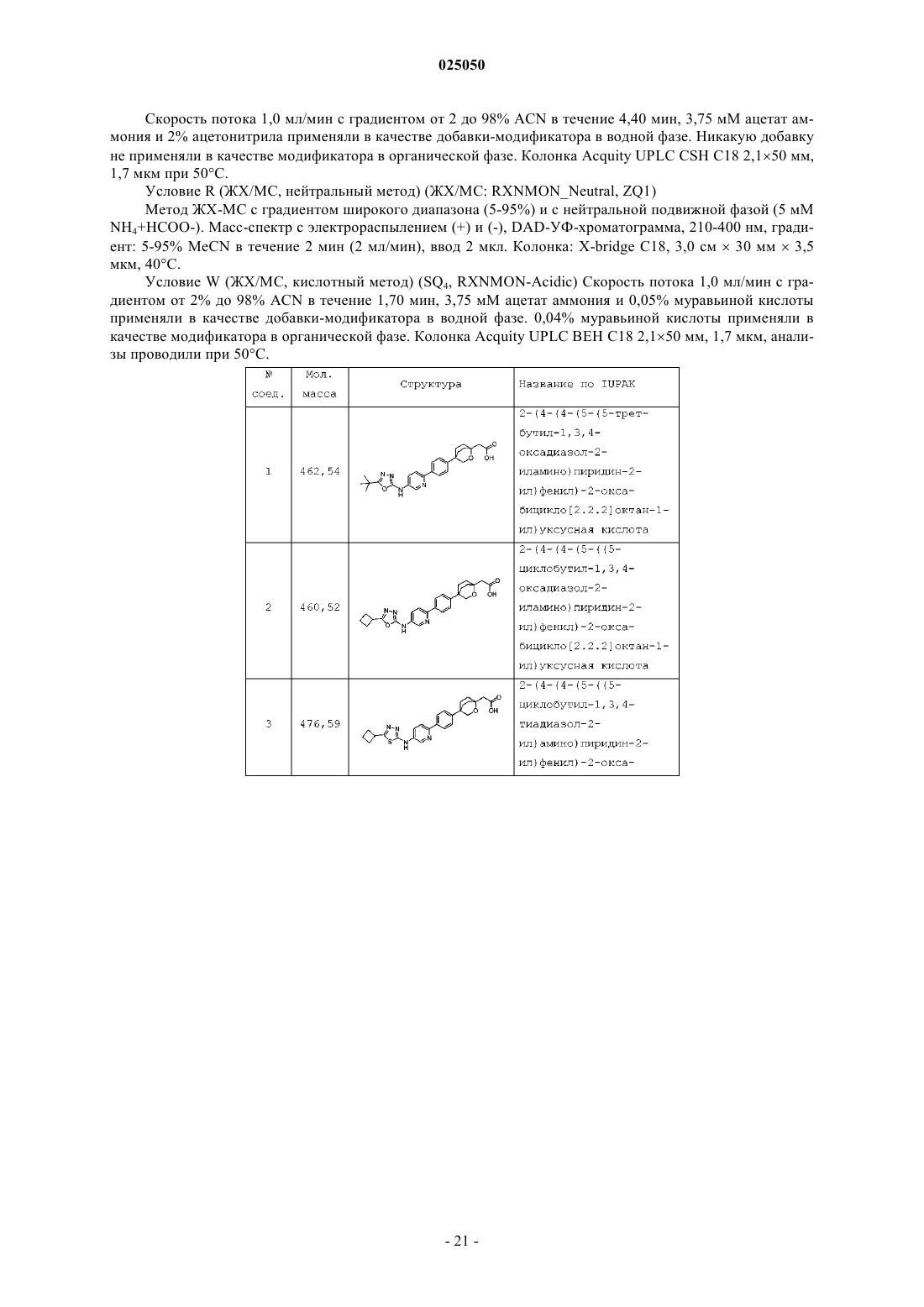
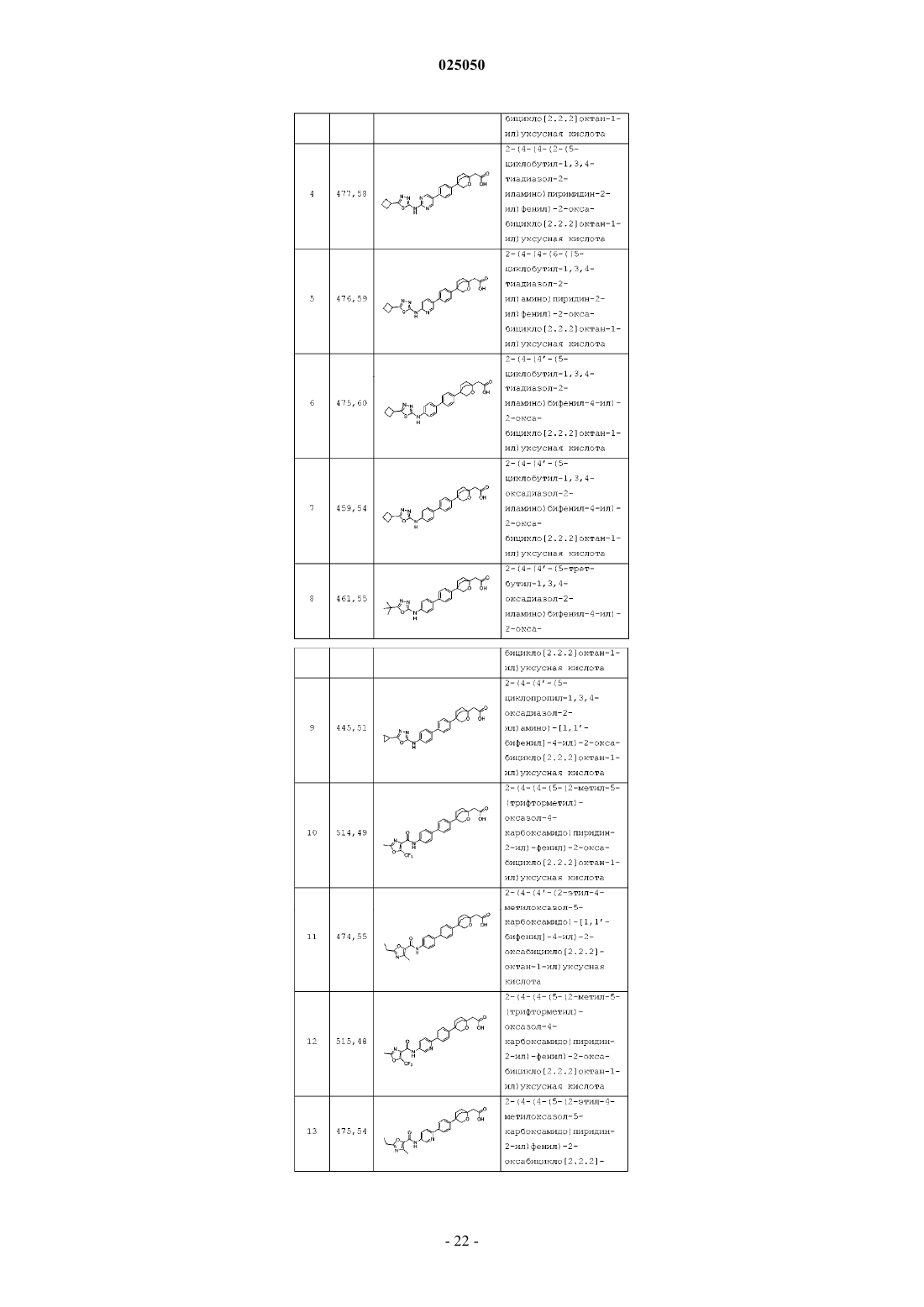
Циклические мостиковые простые эфиры в качестве ингибиторов dgat1
Номер патента: 25050
Опубликовано: 30.11.2016
Авторы: Дьювэйди Роухит, Чжэн Сюйчунь, Е Цзюн, Лю Цянь, Гай Юй, Зекри Фредерик, Динг Ипин, Ларроу Джэй, Чэнь Синь, Чжоу Ицзун, Пэйтел Сиджэл, Чжэн Жуй, Мао Джастин Йик Чинг, Гаррисон Тайлер
Формула / Реферат
1. Соединение согласно формуле (I) или его фармацевтически приемлемая соль
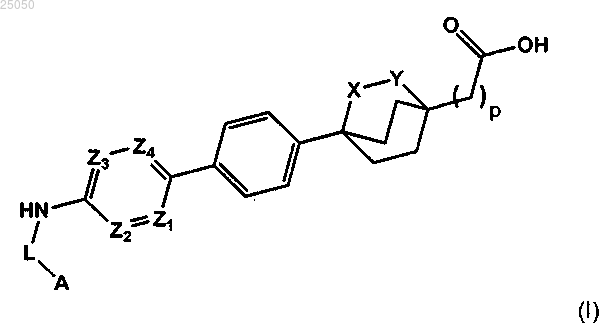
в которой
р равно 1, 2 или 3;
X представляет собой О или СН2;
Y представляет собой О, СН2 или отсутствует, причем только один из X и Y представляет собой О;
Z1, Z2, Z3 и Z4 представляют собой, каждый независимо, N или СН;
L представляет собой С(О) или отсутствует и
А представляет собой замещенный оксазол, тиазол, оксадиазол или тиадиазол, где каждый замещен по меньшей мере одним С1-6алкилом, С3-7циклоалкилом или С1-6галогеналкилом.
2. Соединение по п.1, которое является соединением формулы (II) или его фармацевтически приемлемой солью
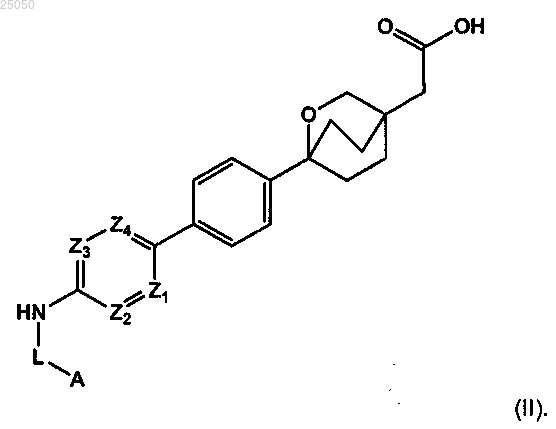
3. Соединение по п.1, которое является соединением формулы (III) или его фармацевтически приемлемой солью
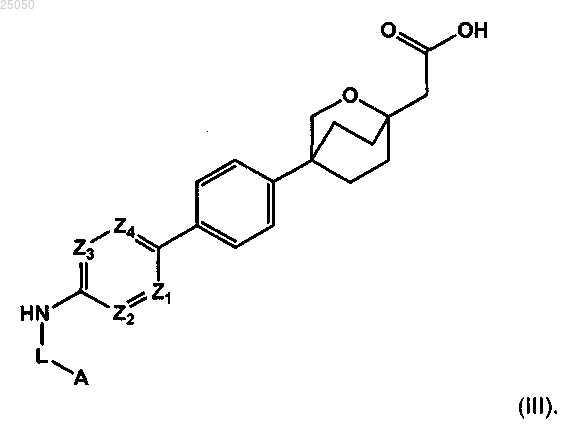
4. Соединение по п.1, которое является соединением формулы (IV) или его фармацевтически приемлемой солью

5. Соединение по п.1, у которого р равно 1.
6. Соединение по п.1, у которого р равно 2.
7. Соединение по пп.1-6 или его фармацевтически приемлемая соль, у которого все из Z1, Z2, Z3 и Z4 представляют собой СН.
8. Соединение по пп.1-6 или его фармацевтически приемлемая соль, у которого Z1 представляет собой N и каждый из Z2, Z3 и Z4 представляет собой СН.
9. Соединение по пп.1-6 или его фармацевтически приемлемая соль, у которого Z2 представляет собой N и каждый из Z1, Z3 и Z4 представляет собой СН.
10. Соединение по пп.1-6 или его фармацевтически приемлемая соль, у которого оба из Z1 и Z2 представляют собой N и оба из Z3 и Z4 представляют собой СН.
11. Соединение по любому из пп.1-10 или его фармацевтически приемлемая соль, у которого L представляет собой С(О).
12. Соединение по любому из пп.1-10 или его фармацевтически приемлемая соль, у которого L отсутствует.
13. Соединение по любому из пп.1-12 или его фармацевтически приемлемая соль, у которого А выбирают из
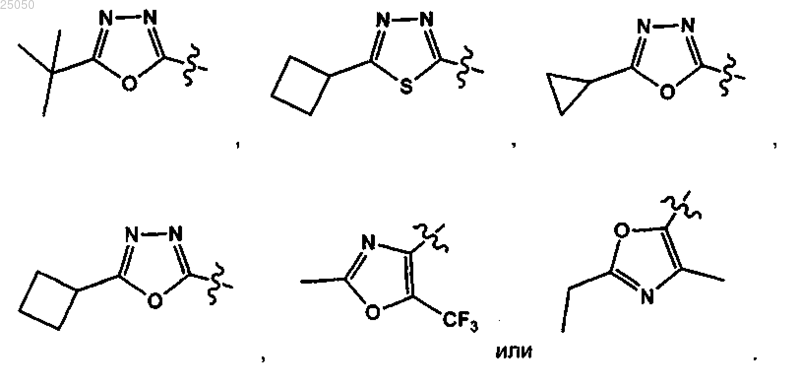
14. Соединение по любому из пп.1-10 и 12-13 или его фармацевтически приемлемая соль, у которого А выбирают из
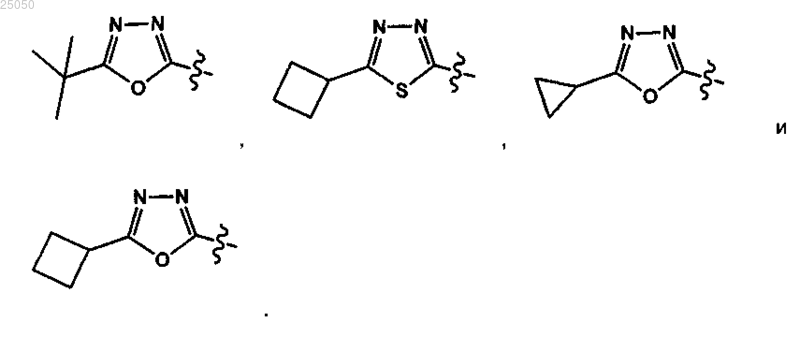
15. Соединение по любому из пп.1-11 и 13 или его фармацевтически приемлемая соль, у которого А выбирают из
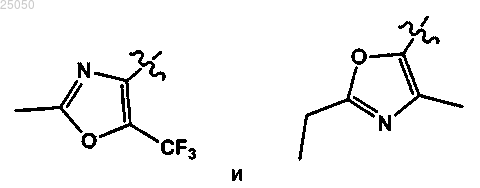
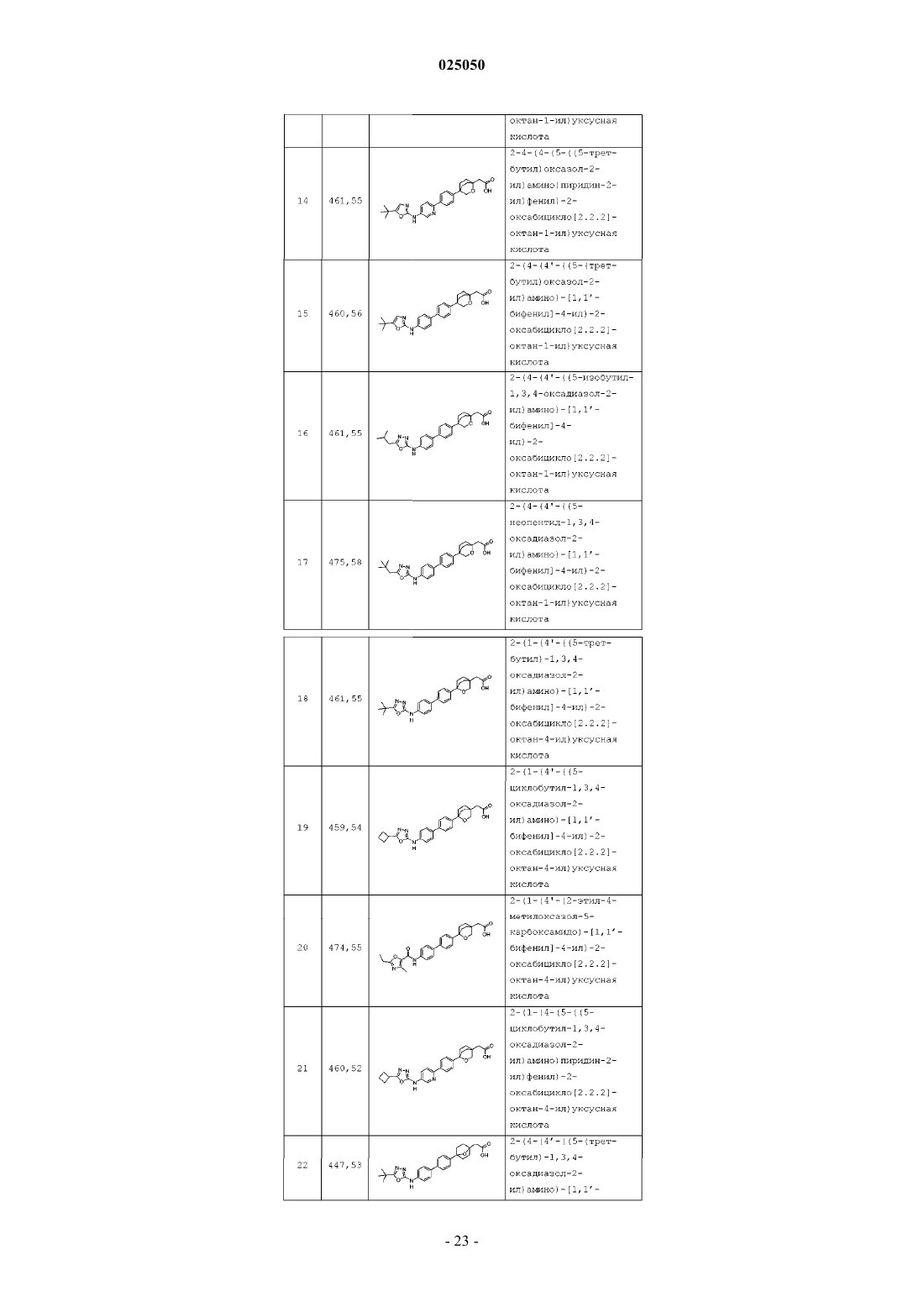
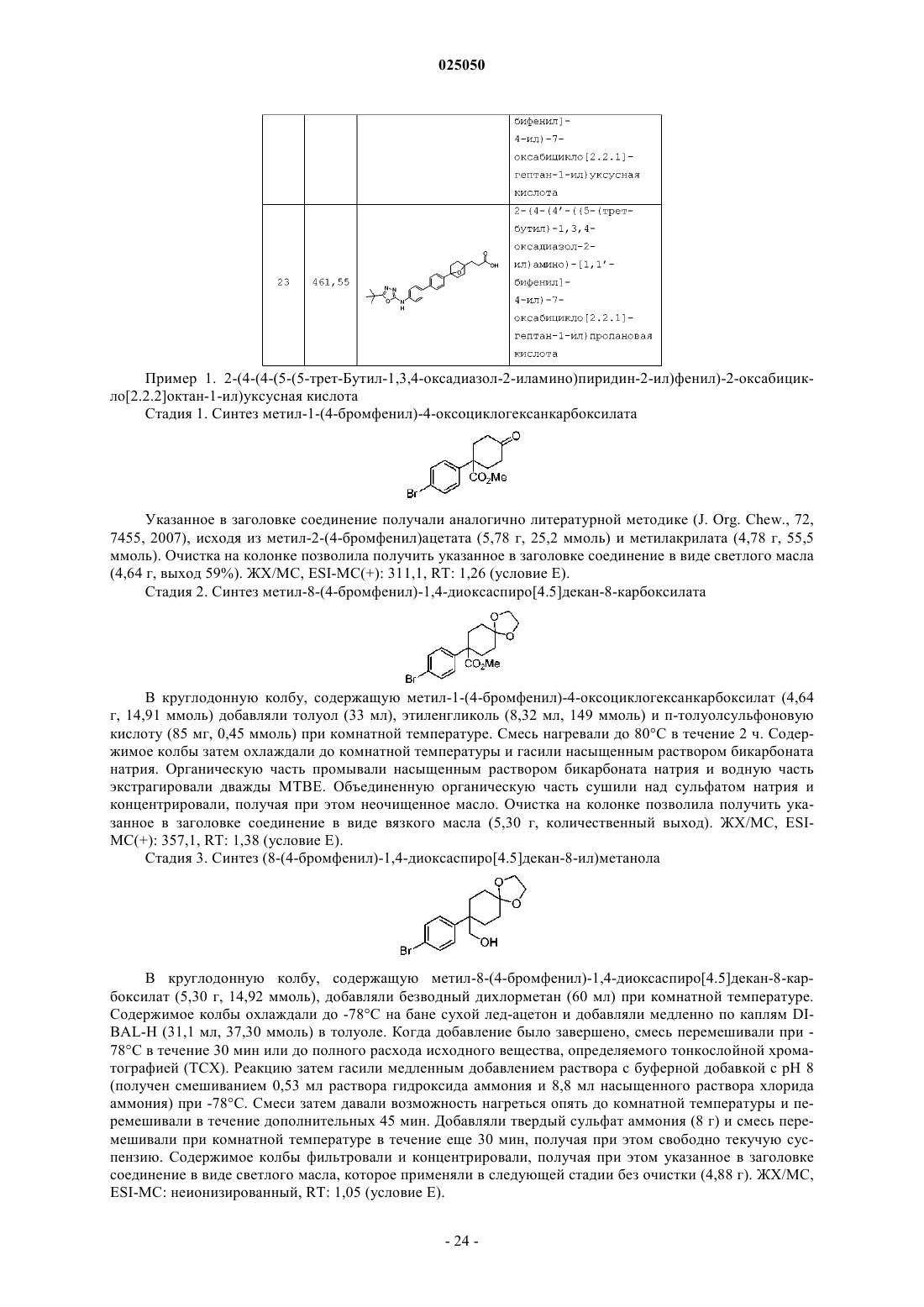
16. Соединение по п.1 или его фармацевтически приемлемая соль, где соединение выбирают из
2-(4-(4-(5-(5-трет-бутил-1,3,4-оксадиазол-2-иламино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(5-((5-циклобутил-1,3,4-оксадиазол-2-ил)амино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(5-((5-циклобутил-1,3,4-тиадиазол-2-ил)амино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(2-(5-циклобутил-1,3,4-тиадиазол-2-иламино)пиримидин-5-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(6-((5-циклобутил-1,3,4-тиадиазол-2-ил)амино)пиридин-3-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-(5-циклобутил-1,3,4-тиадиазол-2-иламино)бифенил-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-(5-циклобутил-1,3,4-оксадиазол-2-иламино)бифенил-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-(5-трет-бутил-1,3,4-оксадиазол-2-иламино)бифенил-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-((5-циклопропил-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-(2-этил-N,4-диметилоксазол-5-карбоксамидо)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-(2-этил-4-метилоксазол-5-карбоксамидо)бифенил-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(5-(2-метил-5-(трифторметил)оксазол-4-карбоксамидо)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(5-(2-этил-4-метилоксазол-5-карбоксамидо)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4-(5-((5-(трет-бутил)оксазол-2-ил)амино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-((5-(трет-бутил)оксазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-((5-изобутил-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(4-(4'-((5-неопентил-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты;
2-(1-(4'-((5-(трет-бутил)-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-4-ил)уксусной кислоты;
2-(1-(4'-((5-циклобутил-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-4-ил)уксусной кислоты;
2-(1-(4'-(2-этил-5-метилоксазол-4-карбоксамидо)-[1,1'-бифенил]-4-ил)-2-оксабицикло[2.2.2]октан-4-ил)уксусной кислоты;
2-(1-(4-(5-((5-циклобутил-1,3,4-оксадиазол-2-ил)амино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-4-ил)уксусной кислоты;
2-(4-(4'-((5-(трет-бутил)-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-7-оксабицикло[2.2.1]гептан-1-ил)уксусной кислоты;
3-(4-(4'-((5-(трет-бутил)-1,3,4-оксадиазол-2-ил)амино)-[1,1'-бифенил]-4-ил)-7-оксабицикло[2.2.1]гептан-1-ил)пропановой кислоты или его соли или сольвата.
17. Фармацевтическая композиция, содержащая один или несколько фармацевтически приемлемых носителей и терапевтически эффективное количество соединения по любому из пп.1-16.
18. Способ лечения заболевания или состояния, опосредуемого активностью ацил-соА-диацилглицеринацилтрансферазы 1 (DGAT1), у пациента, включающий введение субъекту терапевтически эффективного количества соединения по любому из пп.1-16.
19. Способ по п.18, в котором заболевание или состояние выбирают их группы, состоящей из HCV, нарушенной толерантности к глюкозе, диабета II типа и ожирения.
20. Способ лечения HCV, нарушенной толерантности к глюкозе, диабета II типа и ожирения, содержащий введение субъекту эффективного количества композиции, содержащей соединение по любому из пп.1-16.
21. Применение соединения по любому из пп.1-16 в качестве лекарственного средства для лечения заболевания или состояния, опосредуемого активностью DGAT1.
22. Применение соединения по любому из пп.1-16 для получения лекарственного средства для лечения заболевания или состояния, опосредуемого активностью DGAT1.
23. Применение соединения по любому из пп.1-16 для лечения HCV, нарушенной толерантности к глюкозе, диабета II типа и ожирения.
24. Способ предотвращения, задержки развития или лечения заболевания, обостряемого неадекватным продуцированием фосфатидилхолина, содержащий введение теплокровному животному терапевтически эффективного количества соединения по любому из пп.1-16.
25. Способ по п.24, в котором теплокровным животным является человек.
26. Применение соединения по любому из пп.1-16 для получения фармацевтической композиция для лечения нарушения или заболевания, обостряемого неадекватным продуцированием фосфатидилхолина, у субъекта, опосредуемого ингибированием DGAT1.
27. Применение соединения по любому из пп.1-16 для предотвращения, задержки развития или лечения заболевания или состояния, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V.
28. Применение соединения по любому из пп.1-16 для снижения уровней триглицеридов после приема пищи у пациентов, страдающих заболеванием или состоянием, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V.
29. Применение соединения по любому из пп.1-16 для предотвращения, задержки развития или лечения панкреатита у пациентов, страдающих заболеванием или состоянием, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V.
30. Применение соединения по любому из пп.1-16 для предотвращения, задержки развития или лечения симптома, выбранного из повторяющихся приступов панкреатита, отложения триглицеридов в коже в форме высыпающих ксантом, гепатоспленомегалии, молочного белого триглицерида в кровеносных сосудах в задней части глаза (отложение липидов в сетчатке глаза) и средней нейрокогнитивной недостаточности.
31. Соединение формулы (V)
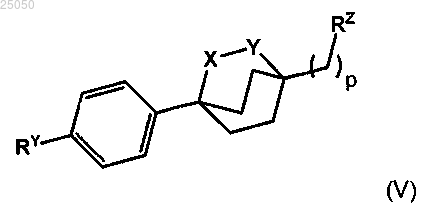
в которой
р равно 1, 2 или 3;
X представляет собой О или СН2;
Y представляет собой О, СН2 или отсутствует, причем обязательно один из X и Y представляет собой О;
RY представляет собой галоген, трифлат, группу бороновой кислоты или эфира бороновой кислоты;
RZ выбран из СО2Н, СО2-С1-7алкила, СО2-М+, CO2NR'R" и циано;
М+ представляет собой катион металла, выбранный из Li+, Na+, K+, Mg2+, Ca2+ и Al3+;
R' и R" представляют собой, каждый независимо, Н или С1-7алкил;
или его фармацевтически приемлемая соль.
Текст
ЦИКЛИЧЕСКИЕ МОСТИКОВЫЕ ПРОСТЫЕ ЭФИРЫ В КАЧЕСТВЕ ИНГИБИТОРОВ Изобретение относится к соединениям формулы (I), применимым для лечения нарушений,опосредуемых ацил-СоА-диацилглицеринацилтрансферазой 1 (DGAT1), например нарушений обмена веществ. Изобретение относится также к способам лечения таких нарушений и соединениям и композициям и т.д. для таких способов лечения. Чэнь Синь (US), Динг Ипин (CN),Дьювэйди Роухит (US), Гай Юй (CN),Гаррисон Тайлер, Лю Цянь, Ларроу Джэй, Мао Джастин Йик Чинг, Пэйтел Сиджэл (US), Е Цзюн (CN), Зекри Фредерик (US), Чжэн Сюйчунь (CN),Чжэн Жуй (US), Чжоу Ицзун (CN) Медведев В.Н. (RU) Родственные заявки Данная заявка испрашивает приоритет предварительной заявки США 61/639341, зарегистрированной 27 апреля 2012, предварительной заявки США 61/787695, зарегистрированной 15 марта 2013, и международной заявкиPCT/CN 2013/072735, зарегистрированной 15 марта 2013, содержание которых включено в контекст в качестве ссылок во всей их полноте. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, применимым для лечения нарушений, опосредуемых ацил-соА-диацилглицеринацилтрансферазой 1 (DGAT1), например нарушений обмена веществ. Изобретение относится также к способам лечения таких нарушений, а также соединениям и композициям и т.д. для их лечения. Уровень техники Хотя триглицериды (известные также как "триацилглицериды") имеют важное значение для нормальной физиологии, избыточное накопление триглицеридов приводит к ожирению и, особенно, когда это имеет место в нежировых тканях, связано с резистентностью к инсулину. Ожирение увеличивает риск многих распространенных и серьезных заболеваний, в том числе ишемической болезни сердца, гипертензии, дислипидемии, атеросклероза, диабета типа II, инсульта, остеоартрита, обструктивной болезни легких, приступа апноэ во сне, некоторых типов рака и воспалительных заболеваний. Стандартным лечением ожирения является ограничение калорийности пищи и увеличение физической нагрузки. Однако, такие подходы редко бывают удачными и для устранения таких нарушений обмена веществ требуется медикаментозное лечение. Поэтому потенциальная терапия для этих состояний включает в себя ингибирование синтеза триглицеридов. Диацилглицеринацилтрансфераза (DGAT) является ферментом, который катализирует последнюю стадию биосинтеза триацилглицерина. DGAT катализирует связывание 1,2-диацилглицерина с (ацил жирной кислоты)-СоА, в результате которого образуются кофермент А и триацилглицерин. Идентифицированы два фермента, которые проявляют активность DGAT: DGAT1 (ацил-соА-диацилглицеринацилтрансфераза 1) [Cases et al., Proc. Natl. Acad. Sci. 1998, 95: 13018-13023] и DGAT2 (ацил-соА-диацилглицеринацилтрансфераза 2) [Cases et al., J. Biol. Chem. 2001, 276: 38870-38876].DGAT1 и DGAT2 не имеют значительную общую гомологию последовательности белков. Важно,однако, что мыши с дефицитом DGAT1 защищены от увеличения веса, вызванного кормом с высоким содержанием жира, и резистентности к инсулину [Smith et al., Nature Genetics 2000, 25:87-90]. Фенотип мышей с дефицитом DGAT1 позволяет предположить, что ингибиторы DGAT1 могут быть применимы для лечения ожирения и связанных с ожирением осложнений [Smith et al., Nature Genetics 2000, 25:8790]. Следовательно, существует потребность в соединениях, которые ингибируют активность DGAT1. Описание изобретения Авторами изобретения получены соединения формулы (I), которые являются применимыми для ингибирования активности DGAT1. Соответственно этому в первом варианте осуществления изобретения предлагается соединение формулы (I), или его соль, или сольват в которой р равно 1, 2 или 3; X представляет собой О или СН 2; Y представляет собой О, СН 2 или отсутствует, причем только один из X и Y представляет собой О; Z1, Z2, Z3 и Z4 представляют собой, каждый независимо, N или СН; L представляет собой С(О) или отсутствует; и А представляет собой замещенный оксазол, тиазол, оксадиазол или тиадиазол, замещенный по меньшей мере одним C1-6 алкилом,С 3-7 циклоалкилом или C1-6 галогеналкилом. Во втором варианте осуществления согласно первому варианту осуществления изобретение относится к соединению формулы (I), в которой р равно 1. В третьем варианте осуществления согласно первому варианту осуществления изобретение относится к соединению формулы (I), в которой р равно 2. В четвертом варианте осуществления изобретение относится к соединению формулы (II), или его соли, или сольвату В пятом варианте осуществления изобретение относится к соединению формулы (III), или его соли,или сольвату В шестом варианте осуществления изобретением относится к соединению формулы (IV), или его соли, или сольвату В седьмом варианте осуществления согласно любому из вариантов осуществления от первого до шестого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), в которых все символы Z1, Z2, Z3 и Z4 представляют собой СН. В восьмом варианте осуществления согласно любому из вариантов осуществления от первого до шестого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), в которых символZ1 представляет собой N и каждый из символов Z2, Z3 и Z4 представляет собой СН. В девятом варианте осуществления согласно любому из вариантов осуществления от первого до шестого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), в которых символZ2 представляет собой N и каждый из символов Z1, Z3 и Z4 представляет собой СН. В десятом варианте осуществления согласно любому из вариантов осуществления от первого до шестого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), в которых символыZ1 и Z2 представляют собой N и оба из символов Z3 и Z4 представляет собой СН. В одиннадцатом варианте осуществления согласно любому из вариантов осуществления от первого до десятого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), в которых символ L представляет собой С(О). В двенадцатом варианте осуществления согласно любому из вариантов осуществления от первого до десятого изобретение относится к соединению согласно формулам (I), (II), (Ш) и (IV), в которых символ L отсутствует. В тринадцатом варианте осуществления согласно любому из вариантов осуществления от первого до двенадцатого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), в которых символ А выбран из В четырнадцатом варианте осуществления согласно любому из вариантов осуществления от первого до десятого и двенадцатого изобретение относится к соединению согласно формулам (I), (II), (III) и В пятнадцатом варианте осуществления согласно любому из вариантов осуществления от первого до одиннадцатого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), или его соли, или сольвату, в которых L представляет собой С(О) и А выбирают из В шестнадцатом варианте осуществления согласно любому из вариантов осуществления от первого до пятнадцатого изобретение относится к соединению согласно формулам (I), (II), (III) и (IV), где соединение выбрано по меньшей мере из одного из следующих соединений: В семнадцатом варианте осуществления изобретение относится к фармацевтической композиции,содержащей один или несколько фармацевтически приемлемых носителей и терапевтически эффективное количество соединения согласно вариантам осуществления от первого до шестнадцатого. В (восемнадцатом) варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к комбинации, в частности фармацевтической комбинации, содержащей терапевтически эффективное количество соединения согласно формуле (I), (II), (III) и(IV) и второго терапевтически активного агента. В девятнадцатом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к способу лечения заболевания или состояния, опосредуемого активностью DGAT1, у пациента, где способ содержит введение субъекту терапевтически эффективного количества согласно формуле (I), (II), (III) и (IV). В двадцатом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого и девятнадцатого заболевание или состояние выбирают из группы, состоящей из HCV,нарушенной толерантности к глюкозе, диабета типа II и ожирения. В двадцать первом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к способу лечения HCV, нарушенной толерантности к глюкозе, диабета типа II или ожирения, содержащего введение субъекту, нуждающемуся в этом, эффективного количества композиции, содержащей соединение формулы (I), (II), (III) и (IV). В двадцать втором варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к соединению согласно формуле (I), (II), (III) и (IV) для применения в качестве лекарственного средства. В двадцать третьем варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к применению соединения согласно формуле (I), (II), (III) и (IV) при изготовлении лекарственного средства для лечения заболевания или состояния, опосредуемого активностью DGAT1. В двадцать четвертом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к применению соединения согласно формуле (I), (II),(III) и (IV) для лечения HCV, нарушенной толерантности к глюкозе, диабета типа II или ожирения. В двадцать пятом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к способу предотвращения, задержки развития или лечения заболевания, обостряемого неадекватным продуцированием фосфатидилхолина, содержащему введение теплокровному животному, нуждающемуся в этом, терапевтически эффективного количества ингибитора DGAT1 формулы (I), (II), (III) или (IV). В примерном варианте осуществления теплокровным животным является человек. В двадцать шестом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к применению ингибитора DGAT1 формулы (I), (II), (III) или (IV) для получения фармацевтической композиции для лечения нарушения или заболевания, обостряемого неадекватным продуцированием фосфатидилхолина у субъекта, опосредуемого ингибированиемDGAT1. В двадцать седьмом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к ингибитору DGAT1 формулы (I), (II), (III) или (IV) или его фармацевтически приемлемой соли или сложному эфиру для применения при предотвращении, задержке развития или лечении заболевания или состояния, которое выбирают из синдрома хиломикронемии 5, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V. В двадцать восьмом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к ингибитору DGAT1 формулы (I), (II), (III) или (IV) или его фармацевтически приемлемой соли или сложному эфиру для применения при снижении уровней триглицеридов после приема пищи у пациентов, страдающих заболеванием или состоянием, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V. В двадцать девятом варианте осуществления согласно любому из вариантов осуществления от первого до шестнадцатого изобретение относится к ингибитору DGAT1 формулы (I), (II), (III) или (IV) или его фармацевтически приемлемой соли или сложному эфиру для применения при предотвращении, задержке развития или лечении панкреатита у пациентов, страдающих заболеванием или состоянием, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V. В тридцатом варианте осуществления согласно любому из вариантов осуществления от первого до пятнадцатого изобретение относится к ингибитору DGAT1 формулы (I), (II), (III) или (IV) или его фармацевтически приемлемой соли или сложному эфиру для применения при предотвращении, задержке развития или лечении симптома, выбранного из повторяющихся приступов панкреатита, отложения триглицеридов в коже в форме высыпающих ксантом, гепатоспленомегалии, молочного белого триглицерида в кровеносных сосудах в задней части глаза (отложение липидов в сетчатке глаза) и средней нейрокогнитивной недостаточности. В тридцать первом варианте осуществления изобретение относится к соединению формулы (V) в которой р равно 1, 2 или 3; X представляет собой О или СН 2; Y представляет собой О, СН 2 или отсутствует, причем обязательно один из X и Y представляет собой О; RY представляет собой галоген,трифлат, группу бороновой кислоты или эфира бороновой кислоты; RZ выбран из СО 2 Н, СО 2-С 1-7 алкила,СО 2-М+, CO2NR'R" и циано; М+ представляет собой катион металла, выбранный из Li+, Na+, K+, Mg2+,Ca2+ и Al3+; R' и R" представляют собой, каждый независимо, Н или С 1-7 алкил; или его соли, или сольвату. В тридцать втором варианте осуществления согласно тридцать первому варианту осуществления изобретение относится к соединению формулы (VA) или его соли, или сольвату. В тридцать третьем варианте осуществления согласно тридцать первому варианту осуществления изобретение относится к соединению формулы (VB) или его соли, или сольвату. В тридцать четвертом варианте осуществления согласно тридцать первому варианту осуществления изобретение относится к соединению формулы В тридцать пятом варианте осуществления согласно тридцать первому и тридцать третьему вариантам осуществления изобретение относится к соединению формулы Соединения формул (I)-(IV) и т.д. и их производные Применяемые в контексте термины "соединения изобретения" и "соединения формулы (I)" и т.д. включают в себя их фармацевтически приемлемые производные и полиморфы, изомеры и меченые изотопами варианты. Кроме того, термин "соединения изобретения" и "соединения формулы (I)" и т.д. включают в себя соединения формулы (II), (III) и (IV) и описанные в контексте их варианты осуществления. Фармацевтически приемлемые производные Термин "фармацевтически приемлемое производное" включает в себя любую фармацевтически приемлемую соль, сольват, гидрат или пролекарство соединения формулы (I). В одном варианте осуществления фармацевтически приемлемыми производными являются фармацевтически приемлемые соли,сольваты или гидраты соединения формулы (I). Фармацевтически приемлемые соли Применяемые в контексте термины "соль" или "соли" относятся к кислотно-аддитивной или основно-аддитивной соли соединения изобретения. "Соли" включают в себя в частности "фармацевтически приемлемые соли". Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства соединений данного изобретения и которые обычно не являются биологически или иным образом нежелательными. Во многих случаях соединения настоящего изобретения способны образовывать соли с кислотами и/или основаниями вследствие присутствия аминогрупп и/или карбоксильных групп или групп, подобных им. Фармацевтически приемлемые кислотно-аддитивные соли можно получить с неорганическими кислотами и органическими кислотами, например, ацетатные, аспартатные, бензоатные, безилатные, бромидные/гидробромидные, бикарбонатные/карбонатные, бисульфатные/сульфатные, камфорасульфонатные, хлоридные/гидрохлоридные, хлортеофиллонатные, цитратные, этандисульфонатные, фумаратные,глюцептатные, глюконатные, глюкуронатные, гиппуратные, гидроиодидные/иодидные, изетионатные,лактатные, лактобионатные, лаурилсульфатные, малатные, малеатные, малонатные, манделатные, мезилатные, метилсульфатные, нафтоатные, напсилатные, никотинатные, нитратные, октадеканоатные, олеатные, оксалатные, пальмитатные, памоатные, фосфатные/гидрофосфатные/дигидрофосфатные, полигалактуронатные, пропионатные, стеаратные, сукцинатные, сульфосукцинатные, тартратные, тозилатные и трифторацетатные соли. Неорганические кислоты, из которых можно получить соли, включают в себя, например, хлористоводородную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и тому подобное. Органические кислоты, из которых можно получить соли, включают в себя, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту и тому подобное. Фармацевтически приемлемые основно-аддитивные соли можно получить с неорганическими и органическими основаниями. Неорганические основания, из которых можно получить соли, включают в себя, например, аммониевые основания и основания металлов колонок I-XII периодической таблицы элементов. В некоторых вариантах осуществления соли получают из натрия, калия, аммония, кальция, магния, железа, серебра,цинка и меди, особенно подходящие соли включают в себя соли аммония, калия, натрия, кальция и магния. Органические основания, из которых можно получить соли, включают в себя, например, первичные, вторичные и третичные амины, замещенные амины, включающие в себя встречающиеся в природе замещенные амины, циклические амины, основные ионообменные смолы и тому подобное. Некоторые органические амины включают в себя изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин,лизин, меглумин, пиперазин, трометамин, аргинин, пролин и трис. Фармацевтически приемлемые соли настоящего изобретения можно синтезировать из основной или кислотной группы общепринятыми химическими способами. Обычно такие соли получают реакцией форм свободных кислот этих соединений со стехиометрическим количеством подходящего основания(такого как гидроксид, карбонат, бикарбонат или другое основное соединение Na, Ca, Mg или К) или реакцией форм свободных оснований этих соединений со стехиометрическим количеством подходящей кислоты. Такие реакции обычно проводят в воде или органическом растворителе, или смеси таких двух растворителей. Обычно желательно применение неводной среды, подобной простому эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу, в тех случаях, когда это осуществимо. Перечень дополнительных подходящих солей можно найти, например, в "Remington's Pharmaceutical Sciences", 20th ed.,Mack Publishing Company, Easton, Pa., (1985); и в "Handbook of Pharmaceutical Salts: Properties, Selection,and Use" by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Сольваты и гидраты Соединения изобретения могут существовать как в несольватированной, так и в сольватированной формах. Термин "сольват" включает в себя молекулярные комплексы, содержащие соединение изобретения и одну или несколько молекул фармацевтически приемлемого растворителя, такого как вода или C16 спирты, например, этанол. Термин "гидрат" означает "сольват", в котором растворителем является вода. Пролекарства Кроме того, соединения настоящего изобретения, включающие в себя их соли, можно также получить в форме их гидратов или сольватов с другими растворителями, применяемыми для их кристаллизации. Соединения настоящего изобретения могут по своей природе или по разработанному способу образовывать сольваты с фармацевтически приемлемыми растворителями (включая воду); поэтому предполагается, что изобретение включает в себя как сольватированные, так и несольватированные формы. Термин "сольват" относится к молекулярному комплексу соединения настоящего изобретения (в том числе его фармацевтически приемлемых солей) с одной или несколькими молекулами растворителя. Такими молекулами растворителя являются молекулы растворителей, обычно применяемых в фармацевтической области, которые, как известно, являются безвредными для реципиента, например, воды, этанола и тому подобного. Термин "гидрат" относится к комплексу, в котором молекулой растворителя является молекула воды. Соединения настоящего изобретения, включая их соли, гидраты и сольваты, могут по своей природе или по разработанному способу образовывать полиморфы. Описание изомерных форм и способов разделения Любой асимметричный атом (например, атом углерода или подобный атом) соединения(ий) настоящего изобретения может присутствовать в рацемической или энантиомерно обогащенной, например,(R)-, (S)- или (R,S)-конфигурации. В некоторых вариантах осуществления каждый асимметричный атом имеет по меньшей мере 50% энантиомерный избыток, по меньшей мере 60% энантиомерный избыток, по меньшей мере 70% энантиомерный избыток, по меньшей мере 80% энантиомерный избыток, по меньшей мере 90% энантиомерный избыток, по меньшей мере 95% энантиомерный избыток или по меньшей мере 99% энантиомерный избыток (R)- или (S)-конфигурации. Заместители у атомов с ненасыщенными двойными связями могут, если это возможно, присутствовать в цис-(Z)- или транс-(Е)-форме. Соответственно этому, применяемое в контексте соединение изобретения может быть в форме одного из возможных изомеров, ротамеров, атропизомеров, таутомеров или их смесей, например, в виде по существу чистых геометрических (цис или транс)-изомеров, диастереомеров, оптических изомеров (антиподов), рацематов или их смесей. Любые получаемые смеси изомеров можно разделить на основе физико-химических различий компонентов на чистые или по существу чистые геометрические или оптические изомеры, диастереомеры,рацематы, например, хроматографией и/или фракционной кристаллизацией. Любые полученные рацематы конечных продуктов или промежуточных продуктов можно разделить на оптические антиподы известными способами, например, разделением их диастереомерных солей,полученных с оптически-активной кислотой или основанием, и выделением оптически-активного кислотного или основного соединения. В частности, основный остаток можно таким образом применять для разделения соединений настоящего изобретения на их оптические изомеры, например, фракционной кристаллизацией соли, образованной с оптически-активной кислотой, например, винной кислотой, ди-7 025050 бензоилвинной кислотой, диацетилвинной кислотой, ди-О,О'-п-толуоилвинной кислотой, миндальной кислотой, яблочной кислотой или камфора-10-сульфоновой кислотой. Рацемические продукты можно также разделить хиральной хроматографией, например, высокоэффективной жидкостной хроматографией (ВЭЖХ) с применением хирального адсорбента. Аморфные и кристаллические формы Соединения изобретения могут существовать в твердых состояниях от аморфных до кристаллических форм. Все такие твердые формы включены в настоящее изобретение. Изомерные формы Применяемый в контексте термин "оптический изомер" или "стереоизомер" относится к любой из различных стереоизомерных конфигураций, которые могут существовать для данного соединения настоящего изобретения и включают в себя геометрические изомеры. Понятно, что заместитель может быть присоединен к хиральному центру атома углерода. Термин "хиральный" относится к молекулам,которые обладают свойством "суперненакладываемости" на их партнера с зеркальным изображением,тогда как термин "ахиральный" относится к молекулам, которые являются "супернакладываемыми" на их партнера с зеркальным изображением. Следовательно, изобретение включает в себя энантиомеры, диастереомеры или рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые являются несупернакладываемыми друг на друга зеркальными изображениями. Смесь 1:1 пары энантиомеров является "рацемической" смесью. Такой термин применяют для обозначения рацемической смеси в тех случаях, когда это уместно."Диастереоизомеры" являются стереоизомерами, которые имеют по меньшей мере два асимметричных атома, но которые не являются зеркальными изображениями друг друга. Абсолютную стереохимию устанавливают согласно R-S системе Кана-Ингольда-Прелога. Когда соединение является чистым энантиомером, стереохимию у каждого хирального атома углерода можно указать посредством обозначения либо R либо S. Разделенные соединения, абсолютная конфигурация которых неизвестна, можно обозначать (+) или (-) в зависимости от направления (право- или левовращающий), в которое они вращают плоскость поляризации света при длине волны линии D натрия. Некоторые описанные в контексте соединения содержат один или несколько асимметричных центров или осей и могут поэтому обуславливать существование энантиомеров, диастереомеров и других стереоизомерных форм, которые можно обозначать в терминах абсолютной стереохимии как (R)- или (S)-. В зависимости от выбора исходных веществ и процедур, соединения могут присутствовать в форме одного из возможных изомеров или в виде их смесей, например, в виде чистых оптических изомеров или в виде смесей изомеров, таких как рацематы и смеси диастереомеров, в зависимости от числа асимметричных атомов углерода. Имеется в виду, что настоящее изобретение включает в себя все такие возможные изомеры, в том числе рацемические смеси, диастереомерные смеси и оптически чистые формы. Оптически активные (R)- и (S)-изомеры можно получить при помощи хиральных синтонов или хиральных реагентов или разделением смесей с применением общепринятых способов. Если соединение содержит двойную связь, заместитель может иметь Е- или Z-конфигурацию. Если соединение содержит дизамещенный циклоалкил, заместитель циклоалкила может иметь цис- или транс-конфигурацию. Имеется в виду также, что включены все таутомерные формы. Мечение изотопами Имеется также в виду, что любая формула, приведенная в контексте, представляет собой немеченые изотопами формы, а также меченые изотопами формы соединений. Меченые изотопами соединения имеют структуры, изображенные формулами, указанными в контексте, за исключением того, что один или несколько атомов заменены атомом, имеющим выбранную атомную массу или массовое число. Примеры изотопов, которые можно включить в соединения изобретения, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 18F, 31P, 32P,35S, 36Cl, 125I соответственно. Изобретение включает в себя различные меченые изотопами соединения,указываемые в контексте, например, соединения, в которых присутствуют радиоактивные изотопы, такие как 3 Н и 14 С, или соединения, в которых присутствуют нерадиоактивные изотопы, такие как 2 Н и 13 С. Такие меченые изотопами соединения являются применимыми в метаболических исследованиях (с 14 С),кинетических исследованиях реакций (например, с 2 Н или 3 Н), способах детектирования или получения изображения, таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), включающих в себя анализы распределения лекарственного средства или субстрата в ткани, или при радиоактивном лечении пациентов. В частности, меченое 18F соединение может быть, в частности, желательным для исследований PET или SPECT. Меченые изотопами соединения формулы (I) обычно получают общепринятыми способами, известными специалистам в данной области, или способами, аналогичными способам, описанным в указанных примерах и получениях, с применением подходящих меченых изотопами реагентов вместо ранее применяемого немеченого реагента. Далее, замещение более тяжелыми изотопами, особенно дейтерием (т.е. 2 Н или D) может принести некоторые терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например, увеличенного периода полураспада in vivo или требований уменьшенных доз, или улучшения терапевтического индекса. Понятно, что дейтерий в данном контексте рассматривается как заместитель в соединении формулы (I). Концентрацию такого более тяжелого изотопа, особенно дейтерия, можно определять фактором изотопного обогащения. Термин "фактор изотопного обогащения",применяемый в контексте, означает отношение между относительным содержанием указанного изотопа в данном соединении и природным относительным содержанием такого изотопа. Если заместителем в соединении данного изобретения является дейтерий, такое соединение имеет фактор изотопного обогащения для каждого указанного атома дейтерия по меньшей мере 3500 (52,5% включения дейтерия для каждого указанного атома дейтерия), по меньшей мере 4000 (60% включения дейтерия), по меньшей мере 4500 (67,5% включения дейтерия), по меньшей мере 5000 (75% включения дейтерия), по меньшей мере 5500 (82,5% включения дейтерия), по меньшей мере 6000 (90% включения дейтерия), по меньшей мере 6333,3 (95% включения дейтерия), по меньшей мере 6466,7 (97% включения дейтерия), по меньшей мере 6600 (99% включения дейтерия) или по меньшей мере 6633,3 (99,5% включения дейтерия). Фармацевтически приемлемые сольваты согласно изобретению включают в себя сольваты, при получении которых растворитель для кристаллизации может быть замещен изотопами, например, D2O, d6 ацетон, d6-ДМСО. Сокристаллы Соединения изобретения, т.е. соединения формулы (I), которые содержат группы, способные действовать как доноры и/или акцепторы водородных связей, могут быть способны образовывать сокристаллы с подходящими агентами образования сокристаллов. Эти сокристаллы можно получить из соединений формулы (I) известными методами образования сокристаллов. Такие методы включают в себя измельчение, нагревание, совместное сублимирование, совместное плавление или контактирование в растворе соединений формулы (I) с агентом образования сокристаллов в условиях кристаллизации и выделение таким образом образованных сокристаллов. Подходящие агенты образования сокристаллов включают в себя такие агенты, описанные в WO 2004/078163. Следовательно, изобретение дополнительно относится к сокристаллам, содержащим соединение формулы (I). Лечение заболеваний и болезненных состояний Обнаружено, что соединения формулы (I) являются ингибиторами DGAT1. Изобретение относится к соединения формулы (I) для применения в терапии. Изобретение далее относится к фармацевтической композиции, содержащей соединение формулы (I) в комбинации с фармацевтически приемлемым эксципиентом. Изобретение далее относится к способу лечения заболевания или состояния, опосредуемогоDGAT1, содержащий стадию введения терапевтически эффективного количества соединения формулы(I) пациенту. Изобретение относится также к применению соединения формулы (I) при изготовлении лекарственного средства для лечения заболевания или состояния, опосредуемого DGAT1. Изобретение относится также к соединению формулы (I) для применения при лечении заболевания или состояния,опосредуемого DGAT1. Изобретение относится также к кристаллам DGAT1 и соединения формулы (I). Такие кристаллы можно применять для исследований дифракцией рентгеновского излучения ингибирования DGAT1, например, для получения атомной структурной информации для обеспечения рациональной разработки получения дополнительных ингибиторов DGAT1. Активность ингибирования DGAT1 соединений изобретения можно демонстрировать анализомDGAT1, описанным в контексте (см. "анализ ингибирования DGAT1"). Предпочтительные соединения изобретения имеют IC50 в анализе ингибирования DGAT1 100 мкМ, в одном варианте осуществления 10 мкМ, в другом варианте осуществления 1 мкМ, в другом варианте осуществления 100 нМ и в другом варианте осуществления 10 нМ. Заболевания и состояния, опосредуемые DGAT1 Изобретение является применимым для лечения заболевания или состояния, опосредуемогоDGAT1. Заболевания и состояния, опосредуемые DGAT1, включают в себя нарушения обмена веществ,такие как ожирение, диабет (например, диабет II типа), нервная анорексия, булимия, кахексия, синдромX, инсулинорезистентность, толерантность к глюкозе, гипогликемия, гипергликемия, гиперурикемия,гиперинсулинемия, гиперхолестеринемия, гиперлипидемия, дислипидемия, смешанная дислипидемия,гипертриглицеридемия, панкреатит и неалкогольное жировое перерождение печени; сердечнососудистые заболевания, такие как атеросклероз, артериосклероз, острая сердечная недостаточность,застойная сердечная недостаточность, коронарное артериальное заболевание, кардиомиопатия, инфаркт миокарда, стенокардия, гипертензия, гипотензия, инсульт, ишемия, миокардиальная ишемия, ишемическое повреждение при инфузии, аневризма, рестеноз и стеноз сосудов; опухолевые болезни, такие как солидные опухоли, рак кожи, меланома, лимфома и эндотелиальные раковые болезни, например, рак молочной железы, рак легких, колоректальный рак, рак желудка, другие раковые болезни желудочнокишечного тракта (например, рак пищевода и рак поджелудочной железы), рак простаты, рак почек, рак печени, рак мочевого пузыря, рак шеи, рак матки, рак яичка и рак яичника; дерматологические болезненные состояния, такие как обыкновенные угри; вирусный гепатит С (HCV), заболевания, при которых мишенью патогенов являются липидные капельки (например денге и хламидия), и болезни, при которых инфекционным агентам в их жизненном цикле требуются липидные капельки и/или триглицериды. В одном варианте осуществления заболеванием или состоянием, опосредуемым DGAT1, является ослабленная толерантность к глюкозе (IGT), диабет II типа или ожирение. Указываемый в контексте пациент страдает "ожирением", если пациент имеет по меньшей мере одну из следующих характеристик: индекс массы тела (BMI), т.е. масса пациента (в кг), деленный на квадрат роста пациента (в м), составляет 30 или более; абсолютная длина окружности талии 102 см у мужчины или 8 8 у женщины; отношение длины окружности талии к длине окружности бедер 0,9 у мужчины или 0,85 у женщины; процент жира в теле 25% у мужчины и 30% у женщины. Указываемые в контексте пациенты страдают "диабетом II типа", если они соответствуют критерию для диагноза диабета Всемирной организации здравоохранения (выявление и диагностика сахарного диабета и промежуточной гипергликемии,ВОЗ, 2006), т.е. пациент имеет по меньшей мере одну из следующих характеристик: содержание глюкозы в плазме натощак 7,0 ммоль/л (126 мг/дл) или содержание глюкозы в плазме венозной крови 11,1 ммоль/л (200 мг/дл) спустя 2 ч после перорального приема 75 г глюкозы. Указываемые в контексте пациенты страдают "IGT", если они соответствуют критерию для диагноза IGT (выявление и диагностика сахарного диабета и промежуточной гипергликемии, ВОЗ, 2006), т.е. пациент имеет обе из следующих характеристик: содержание глюкозы в плазме натощак 7,0 ммоль/л (126 мг/дл) и содержание глюкозы в плазме венозной крови 7,8 и 11,1 ммоль/л (200 мг/дл) спустя 2 ч после перорального приема 75 г глюкозы. Еще в одном аспекте изобретение является применимым в качестве лекарственного средства, снижающего аппетит. В одном варианте осуществления заболеванием или состоянием, опосредуемым DGAT1, является(11): 1295-8.Cbaries Harris, Eva Herker, Robert V. Farese Jr., Melanie Ott, The Journal of Biological Chemistry, 286, 42615-42625). В другом варианте осуществления заболеванием или состоянием, опосредуемым DGAT1, является ишемия сердечной мышцы [Stanley, W.C., Expert opinion in Investig. Drugs; 11(5): 615-629, 2002; andDyck, J.R. and Lopaschuk, G.D., J. Mol. Cell. Cardiol. 34(9): 1099-1109, 2002]. В одном варианте осуществления увеличение содержания клеточного фосфатидилхолина достигается ингибированием DGAT1 и такое увеличение применяют в качестве подхода для терапевтического повышения содержания фосфатидилхолина в липопротеинах плазмы и в кишечном эпителии (Kent С.,Biochim. Biophys. Acta, 1733: 53-66, 2005; Coleman R.A., Prog. Lipid Res., 34: 134-176, 2004; Goni F.M., etNatl. Acad. Sci. 95:13018-13023, 1998; Cases et al., J. Biol. Chem. 276:38870-38876, 2001; and Smith et al.,Nature Genetics 25:87-90, 2000). В другом варианте осуществления настоящее изобретение относится к применению соединенияингибитора DGAT1 или его фармацевтически приемлемой соли или эфира для лечения, предотвращения,задержки развития или лечения заболевания или состояния, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V. Настоящее изобретение далее относится к применению фармацевтической композиции, содержащей соединение-ингибиторDGAT1 или его фармацевтически приемлемую соль или эфир, для предотвращения, задержки развития или лечения заболевания или состояния, которое выбирают из синдрома хиломикронемии, синдрома семейной хиломикронемии и гиперлипопротеинемии типа V. Гиперлипидемия или присутствие повышенных уровней липидов в кровотоке может принимать форму гиперхолестеринемии (повышенное содержание холестерина), гипертриглицеридемии (повышенный уровень триглицеридов) или комбинацию обеих форм. Гиперхолестеринемия, которую можно далее подразделить, обычно связана с повышенным риском атеросклероза, сердечно-сосудистого заболевания. Гипертриглицеридемия имеет место, когда продуцирование или потребление триглицеридов превышает способность организма метаболизировать триглицериды или удалять триглицериды из кровотока. Наиболее тяжелой формой гипертриглицеридемии является хиломикронемия (называемая также гиперхиломикронемией) и связана с повышенным риском панкреатита. Хиломикроны являются частицами липопротеинов, которые переносят абсорбированный пищевой жир из кишечника в другие ткани тела посредством кровотока, и обычно присутствуют только во время приема пищи. Хиломикронемию определяют как присутствие хиломикронов в кровотоке во время голодания и обычно связывают с общими уровнями триглицеридов в плазме выше 1000 мг/дл. Синдром хиломикронемии относится к установлению клинических осложнений, связанных с высокими уровнями хиломикронов. Пациенты с синдромом хиломикронемии обычно имеют заметно повышенные уровни триглицеридов при голодании (1000-2000 мг/дл) с большими отклонениями от таких уровней (вплоть до 5000 мг/дл и выше) после потребления ими жира. Значительно повышенные уровни триглицеридов в плазме связаны с рядом клинических показателей и осложнений, включающих в себя повторяющиеся приступы панкреатита, отложения триглицеридов в коже в форме высыпающих ксантом,гепатоспленомегалии, появление молочных образований в кровеносных сосудах в задней части глаза(отложение липидов в сетчатке глаза) и среднюю нейрокогнитивную недостаточность. Синдром хиломикронемии можно далее подразделить на две группы на основе ультрацентрифугирования видов липопротеинов (см. "A system for phenotyping hyperlipoproteinemia", Fredrickson D.S., LeesR.S. Circulation, 1965 Mar; 31, pp. 321-327). При заболевании типа I по классификации Фредриксона, известном также как синдром семейной хиломикронемии (FCS), пациенты имеют аккумуляцию только хиломикронов в кровотоке, тогда как при заболевании типа V по классификации Фредриксона, известном также как гиперлипопротеинемия типаV, пациенты имеют аккумуляцию как хиломикронов, так и имеющих очень низкую плотность липопротеинов (VLDL) в кровотоке. Синдром семейной хиломикронемии (FCS или гиперлипопротеинемии типа I) вызывается недостатком гомозиготных или гетерозиготных организмов при очищении хиломикронов из кровотока. Наиболее обычной причиной FCS является недостаток липопротеинлипазы (LPL), белка, который гидролизует триглицериды, переносимые на хиломикронах. Другие причины FCS включают в себя недостаток аполипопротеина CII (apoCII, соактиватора LPL) или прикрепленного к гликозилфосфатидилинозиту белка 1, связывающего липопротеин высокой плотности (GPIHBP1, прикрепляющий белок LPL). Пациентов с гиперлипопротеинемией типа I обычно идентифицируют по появлению ранней гипертриглицеридемии и панкреатита. Поэтому пациенты с GCS обычно имеют в детском возрасте резко повышенные уровни триглицеридов (2000 мл/дл) и повторяющиеся приступы боли в брюшной полости вследствие панкреатита. В детском возрасте уровни триглицеридов остаются повышенными и пациенты обычно испытывают многократные приступы боли в брюшной полости и панкреатита, которые могут привести к госпитализации и смерти. Пациенты испытывают также другие проявления, включающие в себя высыпающие ксантомы, кремовый вид кровеносных сосудов сетчатки, гепатоспленомегалию и среднюю нейрокогнитивную недостаточность. Основной терапевтической задачей при лечении FCS является предотвращение или лечение панкреатита посредством уменьшения уровня триглицеридов. К сожалению, стандартные терапии снижения уровней липидов, такие как фибраты, омега-3 жирные кислоты, статины и производные никотиновой кислоты (ниацин), являются неэффективными при снижении уровней триглицеридов у пациентов с FCS. Поэтому образцом осторожной терапии для пациентов с FCS является диета с очень низким содержанием жира (10% по калориям), которую до некоторой степени очень трудно поддерживать на всем протяжении жизни [The Familial ChylomicronemiaSyndrome. Santamarina-Fojo S. Lipid Disorders 1998. 27 (3): 551-567]. Другим подходом к лечению FCS, который находится в процессе изучения, является генная терапия с применением имеющего недостаточную репликацию аденоассоциированного вирусного вектора для внутримышечной доставки присутствующего в природе "благотворного" варианта LPL (Glybera). Однако, такое лечение является только кратковременно эффективным и требует иммуносупрессии микофенолятом, циклоспорином и стероидами [Alipogene tiparvovec, and adeno-associated virus encoding theSer(447)X variant of human lipoprotein lipase gene for the treatment of patients with lipoprotein lipase deficiency. Burnett J.R., Hooper A.J. Curr Opin Mol Ther 2009. 6:681-691]. Таким образом, в настоящее время не имеется эффективной фармакотерапии для лечения FCS, и поэтому существует потребность в новых способах лечения синдрома семейной хиломикронемии (FCS),известной также как гиперлипопротеинемия типа I. Пациенты с гиперлипопротеинемией типа V представляют собой вторую группу с риском синдрома хиломикронемии, у них обычно диагностируют тяжелую гипертриглицеридемию во взрослом состоянии. Эта группа является разнородной группой у предельного края спектра многофакторной гипертриглицеридемии. Пациенты с гиперлипопротеинемией типа V обычно имеют как лежащую в основе генетическую причину, так и одну или несколько приобретенных причин гипертриглицеридемии. Лежащие в основе генетические причины включают в себя хорошо характеризованную дислипидемию, такую как семейная комбинированная гиперлипидемия (тип НА), дисбеталипопротеинемия (тип III) и семейная гипертриглицеридемия (тип VI), и группу менее полно характеризованных дислипидемий (например недостаточность гетерозиготной LPL, дефекты в генах ароА и ароС, дефекты в связывании жирных кислот и транспортных белках). Выявленные причины гипертриглицеридемии включают в себя коморбидные заболевания (например, диабет II типа, ожирение, инсулинорезистентность, липодистрофия, гипотиродизм), медикаментозные лечения (например, бетаблокаторами, тиазидными диуретиками, эстрогеном, глюкокортикоидами,- 11025050 лечения с трансплантацией) и другие факторы (например беременность, потребление алкоголя). Главной целью терапии пациентов с гиперлипопротеинемией типа V является снижение уровней триглицеридов и, следовательно, уменьшения риска панкреатита. Большинство пациентов можно успешно лечить обращением к лежащей в основе заболевания обнаруженной причины(ин) - повышенных уровней триглицеридов, например, уменьшением количества потребляемого пищевого жира, лечением неконтролируемых коморбидных заболеваний, таких как T2DM (сахарный диабет II типа), прерыванием вызывающих нарушение в организме медикаментозных лечений и проведением медикаментозных лечений, снижающих уровень липидов, таких как лечения фибраторами, омега-3-жирными кислотами или производными никотиновой кислоты (ниацин) [Chylomicronemia Syndrome. Chait A., Brunzell J. Adv Intern Med 5 1992. 37:249-73]. Несмотря на оптимальную терапию, некоторые пациенты с гиперлипопротеинемией типа V имеют повышенные уровни триглицеридов. Поэтому существует потребность в новых способах лечения гиперлипопротеинемии типа V. Терапевтические термины Применяемый в контексте термин "лечение" включает в себя радикальное и профилактическое лечение. Применяемый в контексте термин "пациент" означает животное, предпочтительно млекопитающее, предпочтительно человек, нуждающийся в лечении. Количество вводимого соединения изобретения должно быть терапевтически эффективным количеством, когда соединение или производное применяют для лечения заболевания или состояния, и профилактически эффективным, когда соединение или производное применяют для профилактики заболевания или состояния. Термин "терапевтически эффективное количество", применяемый в контексте, относится к количеству соединения, необходимого для лечения или уменьшения интенсивности симптома рассматриваемого заболевания или состояния. Термин "профилактически эффективное количество", применяемый в контексте, относится к количеству соединения, необходимого для предотвращения рассматриваемого заболевания или состояния. Точная дозировка обычно зависит от состояния пациента во время введения. Факторы, которые можно принять во внимание при определении дозировки, включают в себя тяжесть патологического состояния пациента, общее состояние здоровья пациента, возраст, массу, пол, диету,время, частоту и путь введения, комбинации лекарственных средств, реакционная чувствительность и толерантность или восприимчивость пациента к терапии. Точное количество можно определить экспериментальным путем, но точное количество может в конечном счете определяться решением клинициста. Эффективная доза обычно будет составлять от 0,01 мг/кг/день (масса лекарственного средства по сравнению с массой пациента) до 1000 мг/кг/день, например от 1 мг/кг/день до 100 мг/кг/день. Композицию можно вводить отдельно пациенту или можно вводить в комбинации с другими агентами, лекарственными средствами или гормонами. Введение и препарат Общие термины Для фармацевтического применения соединения изобретения можно вводить в виде лекарственного средства энтеральными или парентеральными путями, включающими в себя внутривенное, внутримышечное, подкожное, чрескожное, воздуховодное (аэрозоль), пероральное, интраназальное, ректальное,вагинальное и местное (в том числе трансбуккальное и сублингвальное) введение. Соединения формулы(I) должны быть оценены по их биофармацевтическим свойствам, таким как растворимость и стабильность растворов (в диапазоне значений рН), проницаемость и т.д., чтобы выбрать наиболее подходящую лекарственную форму и путь введения для лечения предполагаемого заболевания. Соединения изобретения можно вводить в виде кристаллических или аморфных продуктов. Соединения изобретения можно вводить отдельно или в комбинации с одним или несколькими другими соединениями изобретения или в комбинации с одним или несколькими другими лекарственными средствами(или в виде любой их комбинации). Обычно их вводят в виде препарата в сочетании с одним или несколькими эксципиентами. Термин "эксципиент" включает в себя любой ингредиент, другой, чем соединение(я) изобретения, который может придавать либо функциональные (например, агент для регулирования скорости высвобождения лекарственного средства) и/или нефункциональные (например, вспомогательное средство для обработки или разбавитель) характеристики препаратам. Выбор эксципиента в большой степени будет зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Типичные фармацевтически приемлемые эксципиенты включают в себя разбавители, например, лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза и/или глицин; смазывающие вещества, например, диоксид кремния, тальк, стеариновая кислота, ее магниевая или кальциевая соль и/или полиэтиленгликоль; связывающие вещества, например, силикат магния и алюминия, паста крахмала, желатин, трагакант, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон; дезинтегрирующие средства, например, крахмалы, агар, альгиновая кислота или ее натриевая соль или смеси, вызывающие выделение пузырьков газа, и/или абсорбенты, окрашивающие добавки, корригенты и/или подслащивающие средства. Полное обсуждение фармацевтически приемлемых эксципиентов имеется в публикации Gennaro,Remington: The Science and Practice of Pharmacy 2000, 20th edition (ISBN: 0683306472). Соответственно этому, в одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и фармацевтически приемлемый эксципиент. Общие галеновые аспекты В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение настоящего изобретения или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Фармацевтическую композицию можно изготовить для конкретных путей введения, например, для перорального введения, парентерального введения и ректального введения и т.д. Кроме того, фармацевтические композиции настоящего изобретения можно изготовить в твердой форме(включающей в себя, но не ограничивающейся указанным, капсулы, таблетки, пилюли, гранулы, порошки или суппозитории) или жидкой форме (включающей в себя, но не ограничивающейся указанным, растворы, суспензии или эмульсии). Фармацевтические композиции можно подвергать общепринятым фармацевтическим операциям, таким как стерилизация, и/или могут содержать общепринятые инертные разбавители, смазывающие агенты или буферные агенты, а также адъюванты, такие как консерванты,стабилизаторы, смачивающие агенты, эмульгаторы и буферы и т.д. Фармацевтические композиции обычно являются таблетками или желатиновыми капсулами, содержащими активный ингредиент вместе сb) смазывающими веществами, например, диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; в случае таблеток такжеc) связывающими веществами, например, силикатом магния и алюминия, пастой крахмала, желатином, трагакантом, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы и/или поливинилпирролидоном; если необходимо, сd) дезинтегрирующими средствами, например, крахмалами, агаром, альгиновой кислотой или ее натриевой солью или смесями, вызывающими выделение пузырьков газа; и/или е) абсорбентами, окрашивающими добавками, корригентами и подслащивающими средствами. Таблетки могут быть либо покрыты пленкой, либо покрыты энтеросолюбильной оболочкой согласно способам, известным в данной области. Подходящие композиции для перорального введения включают в себя эффективное количество соединения изобретения и имеют форму таблеток, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсии, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, получают согласно любому способу, известному в области изготовления фармацевтических композиций, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из подслащивающих агентов, корригентов, окрашивающих агентов и консервантов, для получения фармацевтически изящных и приятных на вкус препаратов. Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые являются подходящими для изготовления таблеток. Этими эксципиентами являются, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия, гранулирующие и дезинтегрирующие агенты, например, кукурузный крахмал или альгиновая кислота; связывающие агенты,например, крахмал, желатин или аравийская камедь; и смазывающие агенты, например, стеарат магния,стеариновая кислота или тальк. Таблетки не покрывают или покрывают оболочкой известными способами для задержки дезинтеграции и абсорбции в желудочно-кишечном тракте, тем самым обеспечивая стойко поддерживаемое действие на протяжении более длительного периода времени. Например, для задержки дезинтеграции можно применять такое вещество, как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального применения можно предоставлять в виде твердых желатиновых капсул, в которых активный ингредиент смешивают с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или мягких желатиновых капсул, в которых активный ингредиент смешивают с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Некоторые инъецируемые композиции являются водными изотоническими растворами или суспензиями, и суппозитории преимущественно получают из масляных эмульсий или суспензий. Такие композиции можно стерилизовать и/или они могут содержать адъюванты, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, промоторы растворения, соли для регуляции осмотического давления и/или буферы. Кроме этого, они могут содержать также другие терапевтически ценные вещества. Такие композиции получают согласно общепринятым способам смешивания, грануляции или нанесения оболочки, соответственно, и содержат приблизительно 0,1-75% или содержат приблизительно 1-50% активного ингредиента. Композиции, подходящие для чрескожного применения, включают в себя эффективное количество соединения изобретения вместе с подходящим носителем. Носители, подходящие для чрескожной доставки, включают в себя абсорбируемые фармакологически приемлемые растворители для содействия прохождению препарата через кожу хозяина. Чрескожные устройства, например, имеют форму бандажа,содержащего мембрану на обратной стороне, резервуар, содержащий соединение, необязательно с носителями, необязательно барьер для регулирования скорости, и предназначенного для доставки соединения в кожу хозяина при регулируемой и предварительно определенной скорости на протяжении пролонгированного периода времени, и имеют средства для закрепления устройства на коже. Подходящие композиции для местного применения, например для нанесения на кожу и в глаза,включают в себя водные растворы, суспензии, мази, кремы, гели или разбрызгиваемые препараты, например для доставки аэрозолем или т.п. Такие системы для местной доставки могут быть в частности подходящими для кожного применения, например, для лечения рака кожи, например для профилактического применения в солнцезащитных кремах, лосьонах, спреях и т.д. Поэтому они являются особенно подходящими для применения в местных, в том числе косметических, препаратах, хорошо известных в данной области. Они могут содержать солюбилизаторы, стабилизаторы, агенты, повышающие тоничность, буферы и консерванты. Применяемое в контексте выражение местное применение может также относиться к ингаляции или интраназальному применению. Их можно преимущественно доставлять в форме сухого порошка(либо отдельно, либо в виде смеси, например, сухой смеси с лактозой, или смеси частиц компонентов,например с фосфолипидами) из ингалятора сухого порошка или аэрозольного спрея из находящегося под давлением контейнера, насоса, спрея, пульверизатора или распылителя с применением или без применения подходящего пропеллента (газа-вытеснителя). Лекарственные формы Фармацевтическая композиция или комбинация настоящего изобретения может содержать унифицированную дозу приблизительно 1-1000 мг активного ингредиента(ов) для субъекта массой приблизительно 50-70 кг или приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150,или приблизительно 0,5-100 мг, или приблизительно 1-50 мг активных ингредиентов. Терапевтически эффективная доза соединения, фармацевтической композиции или их комбинаций зависит от вида субъекта, массы тела, возраста и индивидуального состояния субъекта, подвергаемого лечению нарушения или заболевания или его тяжести. Врач, клиницист или ветеринар среднего уровня может легко определить эффективное количество каждого из активных ингредиентов, необходимое для предотвращения,лечения или задержки развития нарушения или заболевания. Вышеуказанные дозированные количества доказываются испытаниями in vitro и in vivo с применением преимущественно млекопитающих, например, мышей, кроликов, собак, обезьян, или выделенных органов, тканей и их препаратов. Соединения настоящего изобретения можно применять in vitro в форме растворов, например, водных растворов, и in vivo либо энтерально, парентерально, преимущественно внутривенно, например, в виде суспензии, либо в водном растворе. Доза in vitro может изменяться в пределах между приблизительно 10-3 молярной и 10-8 молярной концентрациями. Терапевтически эффективное количество in vivo может изменяться в зависимости от пути введения между приблизительно 0,1500 мкг или между приблизительно 1-100 мг/кг. Активность соединения согласно настоящему изобретению можно определить способами, проводимыми in vitro и in vivo. Комплексная терапия Соединение формулы (I) можно вводить отдельно или можно вводить в сочетании с другим терапевтическим агентом (т.е. агентом, отличным от соединения формулы (I. Соединение изобретения и другой терапевтический агент вводят предпочтительно в терапевтически эффективном количестве. Соединение настоящего изобретения можно вводить либо одновременно с другим терапевтическим агентом либо до или после другого терапевтического агента. Соединение настоящего изобретения можно вводить отдельно таким же или другим путем введения или вместе с другим терапевтическим агентом в одной и той же фармацевтической композиции. В одном варианте осуществления изобретение относится к продукту, содержащему соединение формулы (I) и другой терапевтический агент, как комбинированному препарату для одновременного,раздельного или последовательного применения в терапии. В одном варианте осуществления терапия представляет собой лечение заболевания или состояния, опосредуемого DGAT1. Продукты, представленные как комбинированный препарат, включают в себя композицию, содержащую соединение формулы (I) и другой терапевтический агент вместе в одной и той же фармацевтической композиции, или соединение формулы (I) и другой терапевтический агент в отдельных композициях, например в форме набора. В одном варианте осуществления изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и другой терапевтический агент. Фармацевтическая композиция необязательно может содержать фармацевтический приемлемый эксципиент, как описано выше в разделе "Введение и препарат". В одном варианте осуществления изобретение относится к набору, содержащему два или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы (I). В одном варианте осуществления изобретения набор содержит средства для сохранения указанных композиций, такие как контейнер, разделенный сосуд или разделенный пакет из фольги. Примером такого набора является блистерная упаковка, которую обычно применяли для упаковки таблеток,капсул и т.д. Набор изобретения можно применять для введения различных лекарственных форм, например, пероральных и парентеральных, для введения отдельных композиций при различных интервалах введения доз или для титрования отдельных композиций против друг друга. Для помощи введению композиций набор изобретения обычно содержит указания для введения. В комбинированных терапиях изобретения соединение изобретения и другой терапевтический агент могут быть изготовлены и/или представлены в виде препаратов одним и тем же или разными изготовителями. Кроме того, соединение изобретения и другой терапевтический агент могут быть взяты вместе для комбинированной терапии (i) до отпуска комбинированного продукта врачу (например, в случае набора, содержащего соединение изобретения и другой терапевтический агент), (ii) самим врачом (или под руководством врача) незадолго до введения; (III) самим пациентом, например, во время последовательного введения соединения изобретения и другого терапевтического агента. Соответственно этому, изобретение относится к применению соединения формулы (I) при изготовлении лекарственного средства для лечения заболевания или состояния, опосредуемого DGAT1, когда лекарственное средство получают для введения с другим терапевтическим агентом. Изобретение относится также к применению другого терапевтического агента при изготовлении лекарственного средства для лечения заболевания или состояния, опосредуемого DGAT1, когда лекарственное средство получают для введения с соединением формулы (I). Изобретение относится также к соединению формулы (I) для применения в способе лечения заболевания или состояния, опосредуемого DGAT1, когда соединение формулы (I) получают для введения с другим терапевтическим агентом. Изобретение относится также к другого терапевтическому агенту для применения в способе лечения заболевания или состояния, опосредуемого DGAT1, когда другой терапевтический агент получают для введения с соединением формулы (I). Изобретение относится также к соединению формулы (I) для применения в способе лечения заболевания или состояния, опосредуемогоDGAT1, когда соединение формулы (I) вводят с другим терапевтическим агентом. Изобретение относится также к другому терапевтическому агенту для применения в способе лечения заболевания или состояния, опосредуемого DGAT1, когда терапевтический агент вводят с соединением формулы (I). Изобретение относится также к применению соединения формулы (I) при изготовлении лекарственных средства для лечения заболевания или состояния, опосредуемого DGAT1, когда пациента предварительно (например в пределах 24 ч) лечили другим терапевтическим агентом. Изобретение относится также к применению другого терапевтического агента при изготовлении лекарственного средства для лечения заболевания или состояния, опосредуемого DGAT1, когда пациента предварительно (например в пределах 24 ч) лечили соединением формулы (I). В другом варианте осуществления другой терапевтический агент выбирают из антидиабетических агентов, таких как инсулин, производные и миметики инсулина; средства, усиливающие секрецию инсулина, такие как глипизид, глибурид и амарил; лиганды инсулинотропных сульфонилмочевин, такие как меглитиниды, например, натеглинид и репагинид; ингибиторы протеинтирозинфосфатазы-1 В (РТР-1 В), такие как РТР-112; ингибиторы транспортного белка холестерилового сложного эфира (СЕТР), такие как торцетрапиб, ингибиторы GSK3 (гликогенсинтазакиназы 3), такие какAGN-194204; ингибиторы натрийзависимых сопереносчиков глюкозы, такие как Т-1095; ингибиторы гликогенфосфорилазы А, такие как BAY R3401; бигуаниды, такие как метформин; ингибиторы альфаглюкозидазы, такие как арабоза; GLP-1 (глюкагоноподобный пептид-1), аналоги GLP-1, такие как эксендин-4 и миметики GLP-1 и ингибиторы DPPIV (дипептидилпептидазы IN), такие как видаглиптин; гиполипидемических агентов, таких как ингибиторы 3-гидрокси-3-метилглутарилкофермент А(НМГ-СоА)-редуктазы, например, левастатин, питавастатин, симвастатин, правастатин, церивастатин,мевастатин, велостатин, флувастатин, далвастатин, алорвастатин, розувастатин и ривастатин; ингибиторы скваленсинтазы; лиганды FXR (рецептора фарнезола X) и LXR (рецептора X печени); холестерамин; фибраты, никотиновая кислота и аспирин; агентов против ожирения, таких как орлистат и римонабант; гипотензивных агентов, например средств, угнетающих реабсорбцию антрия и хлоридов не только в проксимальных и дистальных канальцах, но и в петле Генле, таких как этакриновая кислота, фуросемид и торсемид; ингибиторов ангиотензинпревращающего фермента (АСЕ), таких как беназеприл, каптоприл, эналаприл, фозиноприл, лизиноприл, моэксиприл, перинодоприл, квинаприл, рамиприл и трандолаприл; ингибиторов Na-K-АТФазы мембранного насоса, например, дигоксина; ингибиторов невтралендопептидазы (NEP); ингибиторов ACE/NEP, таких как омапатрилат, сампатриат и фазидотрил; антагонистов ангиотензина II, таких как кандесартан, апросартан, ирбесартан, лосартан, телмисартан и вал- 15025050 сартан, в частности валсартан; ингибиторов ренина, таких как дитекирен, терлакирен, алискирен, RO661132 и RO-66-1168; блокаторов -адренергических рецепторов, таких как ацебутолол, атенолол, бетаксолол, бисопролол, метопролол, надолол, пропранолол, соталолол и тимолол; инотропных агентов, таких как дигоксин, добутамин и милринон; блокаторов кальциевых каналов, таких как амлодипин, бепридил,дилтиазам, фелодипин, никардипин, нимодипин, нифедипин, низолдипин и верапамил; антагонистов рецептора альдостерона и ингибиторов альдостеронсинтазы; агонистов рецепторов пролифераторов-активаторов пероксисомы, таких как фенофибрат, пиоглитазон, розиглитазон, тезаглитазар, ВМС-298585, L-796449, соединения, конкретно описанных в заявке на патент WO 2004/103995, т.е. соединения примеров 1-35 или соединения, конкретно перечисленные в п.21, или соединения, конкретно описанные в заявке на патент WO 03/043985, т.е. соединения примеров 1-7 или соединения, перечисленные в п.19. и особенно (R)-1-4-[5-метил-2-(4-трифторметилфенил)оксазол-4-илметокси]бензолсульфонил-2,3-дигидро-1 Н-индол-2-карбоновая кислота или ее соль, и конкретных антидиабетических соединений, описанных в Expert Opin Investig Drugs 2003, 12(4): 623-633, фиг. 1-7. Основные способы получения Конкретные способы получения соединений изобретения описываются подробно ниже в примерах. В общем, соединения формулы (I) можно получать схемами реакций, описанных ниже. Соединение изобретения, у которого кольцо А представляет собой кольцо оксадиазола, можно получить реакцией анилина (2) с 1,1'-тиокарбонилдипиридин-2(1 Н)-оном (1). Изотиоцианат (3) затем подвергают реакции с карбогидразидами (4), получая при этом гидразинкарботиоамид (5). Циклизация его с 3-(этилиминометиленамино)-N,N-диметилпропан-1-амином (EDC) дает соединение изобретения, представленное формулой I. Соединения, представленные формулой IA, в которой кольцо А представляет собой кольцо оксадиазола и кольцо В представляет собой фенил, можно получить реакциями схемы I, а также альтернативным способом, показанным на схемах II и III. Соединения, представленные формулой IA, в которой кольцо А представляет собой кольцо оксадиазола и В представляет собой фенил, можно получить сочетание Сузуки пинаколборонатного эфира(6) и соответствующего бифенилбромида (7), как показано на схеме II. Альтернативно, соединения,представленные формулой IA, в которой кольцо А представляет собой кольцо оксадиазола и В представляет собой пиридин, можно получить реакцией оксадиазола (8) с соответствующим пинаколборонатным эфиром (9), как указано на схеме III. Соединения, представленные формулой IIA, в которой кольцо А представляет собой кольцо тиадиазола, можно получить реакциями на схеме I. Циклизация гидразинкарботиоамида обработкой серной кислотой в присутствии этанола дает соединение изобретения, представленное формулой IIA. Схема I: способ получения соединений изобретения, у которых кольцо А представляет собой кольцо оксадиазола или тиадиазола Схема II: альтернативный способ получения соединений изобретения, у которых кольцо А представляет собой кольцо оксадиазола Схема IIa: способ получения соединений изобретения, у которых кольцо А представляет собой кольцо замещенного оксазола и L представляет собой С(О) Схема IIb: альтернативный способ получения соединений изобретения, у которых кольцо А представляет собой кольцо замещенного оксазола и L представляет собой С(О) Схема IIe: альтернативный способ получения соединений изобретения, у которых кольцо А представляет собой кольцо замещенного оксазола и L представляет собой С(О) Схема III: альтернативный способ получения соединений изобретения, у которых кольцо А представляет собой кольцо оксадиазола В общем, соединения формул (IVA) и (VA) можно получить схемами реакций, приведенных ниже. Схема IV: способ получения соединений, содержащих остаток 4-фенил-2-оксабицикло[2.2.2]октана 4-Фенил-2-оксабицикло[2.2.2]октан можно получить реакцией кетона (12) с метилакрилатом (13). Последующее замыкание кольца с последующим декарбоксилированием давало производное циклогексанона (14), которое защищают образованием ацеталя (15). Восстановление с последующим удалением защиты у образованного ацеталя дает первичный спирт (17). Реакция с триметилфосфоноацетатом с последующей промотированной основанием внутримолекулярной циклизацией позволяли получить соединение изобретения, представленное формулой IVA. 1-Фенил-2-оксацикло[2.2.2]октан можно получить реакцией кетона (20) с реагентом Комина в присутствии основания с образованием промежуточного продукта (21). Сочетанием Сузуки этого промежуточного продукта с бороновой кислотой (22) с последующим восстановлением и циклизацией получали первичный спирт (24). Окисление его и последующая гомологизация позволяла получить простой эфир енола (25). Окисление и последующее восстановление приводили к образованию соединения изобретения, представленного формулой VA. Схема V: способ получения производных 1-фенил-2-оксабицикло[2.2.2]октана В общем, соединения формулы (XIA) можно получать схемой реакций, приведенной ниже. 7-Оксабицикло[2.2.1]гептан-1-ил соединения можно получить реакцией кетона (47) с образованнымin situ реактивом Гриньяра (48) с образованием третичного спирта (49). Удалением защитной группы у спирта с последующей реакцией Виттига продукта получали эфир (50). Наконец, промотированная основанием внутримолекулярная циклизация позволяла получить соединение изобретения, представленное формулой XIA. Схема XI: способ получения соединений, у которых D представляет собой 7-оксабицикло[2.2.1]гептан-1-ил В общем, соединения формулы (XIIA) можно получать схемой реакций, показанной ниже. Производные 7-оксабицикло[2.2.1]гептан-1-ил пропановой кислоты можно получить взаимодействием кетона (47) с фосфоний-илидом посредством реакции Виттига с последующим удалением защиты с образованием алкена (51). Реакция с образованным in situ реактивом Гриньяра (48) давала третичный спирт (52). Промотированной иодом циклизацией получали бициклическое промежуточное соединение(53), которое можно превратить в бис-метиловый эфир (55) посредством алкилирования диметилмалонатом (54). Конечная стадия декарбоксилирования позволяла получить соединение изобретения, представленное формулой XIIA. Стадия XII: способ получения производных 7-оксабицикло[2.2.1]гептан-7-ил пропановой кислоты Химические группы Применяемый в контексте термин "галоген" или "(гало)" относится к фтору, брому, хлору или иоду,в частности к фтору, хлору. Галогензамещенные группы и остатки, такие как алкил, замещенный галогеном (галогеналкил), могут быть моно-, поли- или пергалогенированными. Применяемый в контексте термин "алкил" относится к полностью насыщенному разветвленному или неразветвленному углеводородному остатку, имеющему вплоть до 20 атомов углерода. Если не указано иначе, алкил относится к углеводородным остаткам, имеющим 1-16 атомов углерода, 1-10 атомов углерода, 1-7 атомов углерода или 1-4 атома углерода. Репрезентативные примеры алкила включают в себя, но не ограничиваются указанным, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3 диметилпентил, н-гептил, н-октил, н-нонил, н-децил и тому подобное. Замещенным алкилом является алкильная группа, содержащая один или несколько, например, один, два или три заместителя, выбранные из галогена, гидрокси- или алкоксигрупп. Применяемый в контексте термин "галогеналкил" относится к алкилу, определяемому в контексте,который замещен одним или несколькими атомами галогена, указываемыми в контексте. Галогеналкил может быть моногалогеналкилом, дигалогеналкилом или полигалогеналкилом, включающим в себя пер- 19025050 галогеналкил. Моногалогеналкил может иметь один атом иода, брома, хлора или фтора в алкильной группе. Дигалогеналкильные и полигалогеналкильные группы могут иметь два или более одинаковых атомов галогена или комбинацию разных атомов галогенов в алкиле. Обычно полигалогеналкил содержит до 12 или 10, или 8, или 6, или 4, или 3, или 2 атома галогена. Неограничивающие примеры галогеналкила включают в себя фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил, дифторпропил,дихлорэтил и дихлорпропил. Пергалогеналкил относится к алкилу, у которого все атомы водорода заменены на атомы галогена. Применяемый в контексте термин "циклоалкил" относится к насыщенным или ненасыщенным моноциклическим, бициклическим, трициклическим или спироциклическим углеводородным группам с 312 атомами углерода. Если не оговорено иначе, циклоалкил относится к циклическим углеводородным группам, имеющим от 3 до 9 атомов углерода в кольце или от 3 до 7 атомов углерода в кольце. Замещенный циклоалкил является циклоалкильной группой, замещенной одним или двумя, или тремя, или более заместителями, независимо выбранными из группы, состоящей из гидроксила, тиола,циано, нитро, оксо, алкилимино, С 1-С 4 алкила, С 1-С 4 алкенила, С 1-С 4 алкинила, С 1-С 4 алкокси, С 1-С 4 тиоалкила, С 1-С 4 алкенилокси, С 1-С 4 алкинилокси, галогена, С 1-С 4 алкилкарбонила, карбокси, С 1-С 4 алкоксикарбонила, амино, С 1-С 4 алкиламино, ди-C1-С 4 алкиламино, С 1-С 4 алкиламинокарбонила, ди-С 1-С 4 алкиламинокарбонила, С 1-С 4 алкилкарбониламино, С 1-С 4 алкилкарбонил(С 1-С 4 алкил)амино, сульфонила, сульфамоила, алкилсульфамоила, C1-C4-алкиламиносульфонила, где каждая из вышеуказанных углеводородных групп (например, алкил, алкенил, алкинил, алкоксигруппа) может быть дополнительно замещена одним или несколькими остатками, независимо выбранными в каждом случае из галогена, гидроксила или С 1-С 4-алкоксигрупп. Примерные моноциклические углеводородные группы включают в себя, но не ограничиваются указанным, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил и тому подобное. Примерные бициклические углеводородные группы включают в себя борнил, инданил, гексагидроинданил, тетрагидронафтил, декагидронафтил, бицикло[2.1.1]гексил, бицикло[2.2.1]гептил, бицикло[2.2.1]гептенил, 6,6-диметилбицикло[3.1.1]гептил, 2,6,6-триметилбицикло[3.1.1]гептил, бицикло[2.2.2]октил и тому подобное. Примерные трициклические углеводородные группы включают в себя адамантил и тому подобное. Общие термины Термин "содержащий" включает в себя термин "включающий", а также "состоящий из", например,композиция, "содержащая" X, может состоять только из X или может включать в себя кое-что дополнительно, например, X + Y. Слово "по существу" не исключает слово "полностью", например, композиция, которая "по существу" не содержит Y, может быть композицией, полностью не содержащей Y. Если необходимо, слово "по существу" можно исключить из определения изобретения. Термин "приблизительно" в отношении численной величины х означает, например, х 10%. Способы осуществления изобретения Следующие примеры предназначены для иллюстрации изобретения и не должны истолковываться,как ограничивающие его. Если не указано иначе, все выпаривания проводили при пониженном давлении,между приблизительно 50 мм рт.ст. и 100 мм рт.ст. Структуру конечных продуктов, промежуточных продуктов и исходных веществ подтверждали стандартными аналитическими способами, например,микроанализом, точкой плавления (т. пл.) и спектроскопическими характеристиками, например, МС, ИК и ЯМР. Применяемыми аббревиатурами являются аббревиатуры, общепринятые в данной области. Условия для определения масс и времен удерживания (RT) были следующими: Условие Е (ЖХ/МС: нейтральный метод) (ЖХМС: RXNMONNutral) Метод ЖХ-МС с градиентом в широком диапазоне (5-95%) и нейтральной подвижной фазой (5 мМNH4 + HCOO-). Масс-спектр с электрораспылением (+) и (-), DAD-УФ-хроматограмма, 210-400 нм, градиент 5-95% MeCN в течение 2 мин (2 мл/мин), ввод 2 мкл. Колонка: инертсил С 8-3, 3,0433 мм 3,0 мкм, 40 С. Условие Z (масс-спектроскопия высокого разрешения)(МС/ВР, pre OAA) Скорость потока 1,0 мл/мин, градиент 5%-95% ацетонитрила (с 0,05% муравьиной кислоты) в течение 9,50 мин. Водная фаза, модифицированная 0,1% муравьиной кислоты. Колонка: инертсил ODS-4 С 18, 3 мкм, 3,0100 мм. Данные ЖХУФ/ESI-MC регистрировали на Agilent 6220 с разрешением 11000 (FWHM). Условие L (МС/ВР с оценкой чистоты) (QT2, ОАА МС/ВР) Скорость потока 1,0 мл/мин с градиентом от 2 до 98% ACN в течение 4,40 мин, 3,75 мМ ацетат аммония и 0,0005% муравьиной кислоты, применяемой в качестве добавки-модификатора в водной фазе,0,04% муравьиной кислоты, применяемой в качестве модификатора в органической фазе. Колонка Acquity UPLC CSH C18 2,150 мм, 1,7 мкм при 50 С, данные ЖХУФ/ESI-MC регистрировали на Acquity G2 Скорость потока 1,0 мл/мин с градиентом от 2 до 98% ACN в течение 4,40 мин, 3,75 мМ ацетат аммония и 2% ацетонитрила применяли в качестве добавки-модификатора в водной фазе. Никакую добавку не применяли в качестве модификатора в органической фазе. Колонка Acquity UPLC CSH C18 2,150 мм,1,7 мкм при 50 С. Условие R (ЖХ/МС, нейтральный метод) (ЖХ/МС: RXNMONNeutral, ZQ1) Метод ЖХ-МС с градиентом широкого диапазона (5-95%) и с нейтральной подвижной фазой (5 мМNH4+HCOO-). Масс-спектр с электрораспылением (+) и (-), DAD-УФ-хроматограмма, 210-400 нм, градиент: 5-95% MeCN в течение 2 мин (2 мл/мин), ввод 2 мкл. Колонка: X-bridge C18, 3,0 см 30 мм 3,5 мкм, 40 С. Условие W (ЖХ/МС, кислотный метод) (SQ4, RXNMON-Acidic) Скорость потока 1,0 мл/мин с градиентом от 2% до 98% ACN в течение 1,70 мин, 3,75 мМ ацетат аммония и 0,05% муравьиной кислоты применяли в качестве добавки-модификатора в водной фазе. 0,04% муравьиной кислоты применяли в качестве модификатора в органической фазе. Колонка Acquity UPLC ВЕН С 18 2,150 мм, 1,7 мкм, анализы проводили при 50 С. Указанное в заголовке соединение получали аналогично литературной методике (J. Org. Chew., 72,7455, 2007), исходя из метил-2-(4-бромфенил)ацетата (5,78 г, 25,2 ммоль) и метилакрилата (4,78 г, 55,5 ммоль). Очистка на колонке позволила получить указанное в заголовке соединение в виде светлого масла В круглодонную колбу, содержащую метил-1-(4-бромфенил)-4-оксоциклогексанкарбоксилат (4,64 г, 14,91 ммоль) добавляли толуол (33 мл), этиленгликоль (8,32 мл, 149 ммоль) и п-толуолсульфоновую кислоту (85 мг, 0,45 ммоль) при комнатной температуре. Смесь нагревали до 80 С в течение 2 ч. Содержимое колбы затем охлаждали до комнатной температуры и гасили насыщенным раствором бикарбоната натрия. Органическую часть промывали насыщенным раствором бикарбоната натрия и водную часть экстрагировали дважды МТВЕ. Объединенную органическую часть сушили над сульфатом натрия и концентрировали, получая при этом неочищенное масло. Очистка на колонке позволила получить указанное в заголовке соединение в виде вязкого масла (5,30 г, количественный выход). ЖХ/МС, ESIМС(+): 357,1, RT: 1,38 (условие Е). Стадия 3. Синтез (8-(4-бромфенил)-1,4-диоксаспиро[4.5]декан-8-ил)метанола В круглодонную колбу, содержащую метил-8-(4-бромфенил)-1,4-диоксаспиро[4.5]декан-8-карбоксилат (5,30 г, 14,92 ммоль), добавляли безводный дихлорметан (60 мл) при комнатной температуре. Содержимое колбы охлаждали до -78 С на бане сухой лед-ацетон и добавляли медленно по каплям DIBAL-H (31,1 мл, 37,30 ммоль) в толуоле. Когда добавление было завершено, смесь перемешивали при 78 С в течение 30 мин или до полного расхода исходного вещества, определяемого тонкослойной хроматографией (ТСХ). Реакцию затем гасили медленным добавлением раствора с буферной добавкой с рН 8(получен смешиванием 0,53 мл раствора гидроксида аммония и 8,8 мл насыщенного раствора хлорида аммония) при -78 С. Смеси затем давали возможность нагреться опять до комнатной температуры и перемешивали в течение дополнительных 45 мин. Добавляли твердый сульфат аммония (8 г) и смесь перемешивали при комнатной температуре в течение еще 30 мин, получая при этом свободно текучую суспензию. Содержимое колбы фильтровали и концентрировали, получая при этом указанное в заголовке соединение в виде светлого масла, которое применяли в следующей стадии без очистки (4,88 г). ЖХ/МС,ESI-MC: неионизированный, RT: 1,05 (условие Е).(4,88 г, 14,91 ммоль) добавляли ацетон (34 мл) и воду (17 мл) при комнатной температуре, затем добавляли п-толуолсульфоновую кислоту (57 мг, 0,30 ммоль) и смесь нагревали до 75 С в течение 1 ч. Содержимое колбы охлаждали до комнатной температуры и концентрировали при пониженном давлении для удаления избытка ацетона. Полученную водную смесь экстрагировали дважды EtOAc. Объединенную органическую часть сушили над сульфатом натрия и концентрировали, получая при этом указанное в заголовке соединение в виде белого твердого вещества (4,22 г). ЖХ/МС, ESI-MC: неионизированный,RT: 1,05 (условие Е). Стадия 5. Синтез метил-2-(4-(4-бромфенил)-4-(гидроксиметил)циклогексилиден)ацетата В круглодонную колбу, содержащую метанол (60 мл) добавляли порциями гидрид натрия (0,78 г,19,37 ммоль) при комнатной температуре при перемешивании. По каплям добавляли триметилфосфоноацетат (2,58 мл, 17,88 ммоль) и образовавшуюся смесь перемешивали при комнатной температуре в течение 30 мин. К этой смеси затем добавляли в виде нескольких порций 4-(4-бромфенил)-4-(гидроксиметил)циклогексанон (4,22 г, 14,90 ммоль) и смесь перемешивали при комнатной температуре на протяжении ночи. Реакционную смесь затем гасили насыщенным раствором хлорида аммония и затем концентрировали для удаления избытка метанола. Остаток переносили в насыщенный раствор хлорида аммония и экстрагировали дважды EtOAc. Объединенную органическую часть сушили над сульфатом натрия и концентрировали, получая при этом сырой продукт. Очистка на колонке позволяла получать указанное в заголовке соединение в виде вязкого масла (4,36 г, выход 86%). ЖХ/МС, ESI-MC: неионизированный,RT: 1,32 (условие Е). Стадия 6. Синтез метил-2-(4-(4-бромфенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетата В круглодонную колбу, содержащую метил-2-(4-(4-бромфенил)-4-(гидроксиметил)циклогексилиден)ацетат (4,36 г, 12,85 ммоль) добавляли 1,4-диоксан (161 мл). Светлый раствор охлаждали на ледяной бане и затем порциями добавляли гидрид натрия (0,67 г, 16,75 ммоль). После добавления смесь нагревали до комнатной температуры и перемешивали в течение 10 мин. После 10 мин перемешивания содержимое колбы нагревали до 100 С на масляной бане (с обратным холодильником) в течение 30 мин. Реакционную смесь охлаждали до комнатной температуры и гасили насыщенным раствором хлорида аммония и затем концентрировали для удаления избытка диоксана. Остаток переносили в насыщенный раствор хлорида аммония и экстрагировали дважды EtOAc. Объединенную органическую часть сушили над сульфатом натрия и концентрировали, получая при этом сырой продукт. Очистка на колонке позволяла получить указанное в заголовке соединение в виде белого твердого вещества (3,4 г, выход 78%). ЖХ/МС,ESI-МС: 341,2 (М+Н+)+, RT: 1,40 (условие Е). Стадия 7. Синтез метил-2-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетата(2,98 г, 30,3 ммоль) и безводный 1,4-диоксан (48 мл). Смесь перемешивали и дегазировали азотом при комнатной температуре в течение 15 мин. Затем добавляли PdCl2(dppf) (0,41 г, 0,51 ммоль) и смесь нагревали до 80 С на протяжении ночи. Темную смесь затем охлаждали до комнатной температуры и фильтровали через подушку целита. Полученный фильтрат концентрировали и очищали на колонке, получая при этом указанное в заголовке соединение в виде не совсем белого твердого вещества (3,87 г, вы- 25025050 В микроволновую ампулу, содержащую метил-2-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (100 мг, 0,26 ммоль), 6-бромпиридин-3-амин (49 мг,0,28 ммоль) и Pd2(PPh3)4 (60 мг, 0,05 ммоль), добавляли 1,4-диоксан (1,3 мл) при комнатной температуре. Добавляли 2 н раствор карбоната натрия (0,39 мл, 0,78 ммоль) и смесь подвергали микроволновому излучению при 120 С в течение 50 мин. Образовавшуюся смесь концентрировали досуха и переносили вEtOAc, суспензию сушили над сульфатом натрия и фильтровали через подушку целита. Фильтрат концентрировали и очищали колоночной хроматографией, получая при этом указанное в заголовке соединение (120 мг, выход 65%). ЖХ/МС, ESI-MC(+): 353,4, RT: 1,12 (условие Е). Стадия 9. Синтез метил-2-(4-(4-(5-(5-трет-бутил-1,3,4-оксадиазол-2-иламино)пиридин-2-ил)фенил)2-оксабицикло[2.2.2]октан-1-ил)ацетата В реакционный сосуд, содержащий метил-2-(4-(4-(5-аминопиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (120 мг, 0,23 ммоль), добавляли дихлорметан (2 мл) при комнатной температуре. Добавляли 1,1'-тиокарбонилдипиридин-2(1 Н)-он (59 мг, 0,26 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч, получая при этом ярко-оранжевую смесь. Затем в виде одной порции добавляли пивалогидразин (40 мг, 0,35 ммоль) и смесь перемешивали при комнатной температуре в течение еще часа. Добавляли 1-этил-3-(3- диметиламинопропил)карбодиимид (80 мг, 0,42 ммоль) и смесь перемешивали при комнатной температуре на протяжении ночи. Содержимое затем концентрировали досуха и полученный остаток переносили в воду с образованием тонкой суспензии. Суспензию фильтровали и промывали водой, сушили, получая при этом указанное в заголовке соединение в виде не совсем белого твердого вещества (55 мг, выход 50%). ЖХ/МС, ESI-MC(+): 477,4, RT: 1,31 (условие Е). Стадия 10. Синтез 2-(4-(4-(5-(5-трет-бутил-1,3,4-оксадиазол-2-иламино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты В реакционный сосуд, содержащий метил-2-(4-(4-(5-(5-трет-бутил-1,3,4-оксадиазол-2-иламино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (55 мг, 0,12 ммоль), добавляли ТГФ (1,5 мл) и 1 н раствор NaOH (0,35 мл, 0,35 ммоль). Смесь энергично перемешивали при комнатной температуре на протяжении ночи. Образовавшуюся смесь концентрировали досуха и остаток переносили в воду. Смесь подкисляли 1 н HCl до рН между 3 и 4, получая при этом густой остаток. Остаток концентрировали досуха и переносили в МеОН, получая при этом тонкую суспензию. Суспензию фильтровали и промывали небольшим количеством МеОН и воды, получая при этом указанное в заголовке соединение в виде белого твердого вещества после сушки (36 мг, выход 67%). МС/ВР (М+Н)+: найдено 463,2354. RT: 5,76 (условие Z). 1H ЯМР (400 МГц, ДМСО-d6)м.д. 12,09 (шир.с, 1 Н), 10,78 (шир.с, 1 Н), 8,76 (д, J=2,78 Гц, 1 Н),8,04-8,13 (м, 1 Н), 7,90-8,01 (м, 3 Н), 7,41 (д, J=8,59 Гц, 2 Н), 3,90 (с, 2 Н), 2,29 (с, 2 Н), 1,82-2,08 (м, 8 Н), 1,36 Указанное в заголовке соединение получали аналогично примеру 1, стадии 9, исходя из метил-2-(4(4-(5-аминопиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетата (35 мг, 0,10 ммоль) и циклобутилкарбогидразида (17 мг, 0,15 ммоль). Очистка на колонке позволяла получить указанное в заголовке соединение в виде белого твердого вещества после сушки (38 мг, выход 81%). ЖХ/МС, ESI-MC(+): 475,25, RT: 1,14 (условие Е). Стадия 2. Синтез 2-(4-(4-(5-5-циклобутил-1,3,4-оксадиазол-2-ил)амино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты К смеси метил-2-(4-(4-(5-(5-циклобутил-1,3,4-оксадиазол-2-иламино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил) ацетата (38 мг, 0,08 ммоль) и ТГФ (1 мл) добавляли NaOH (0,24 мл, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение 7 ч. Полученное содержимое сосуда концентрировали и очищали препаративной ВЭЖХ, получая при этом после сушки указанное в заголовке соединение в виде белого твердого вещества (15 мг, выход 41%). МС/ВР (М+Н)+: найдено 461,2188. К раствору метил-2-(4-(4-(5-аминопиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетата (57 мг, 0,16 ммоль) в DCM (0,5 мл) добавляли 1,1'-тиокарбонилдипиридин-2(1 Н)-он (39 мг, 0,17 ммоль) и смесь перемешивали при комнатной температуре. После 30 мин перемешивания добавляли циклобутилкарбогидразид (28 мг, 0,24 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь затем концентрировали и добавляли раствор концентрированной H2SO4(0,05 мл, 0,94 ммоль) и EtOH (0,5 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Смесь переносили в EtOAc и промывали NaHCO3, затем насыщенным раствором соли. Органическую часть сушили над MgSO4, фильтровали и концентрировали, получая при этом сырой продукт. Очистка на колонке позволяла получить указанное в заголовке соединение, содержащее приблизительно 25% этилового эфира (общий выход 33 мг). Смесь применяли в следующей стадии без водной дополнительной очистки. ЖХ/МС, ESI-MC(+): метиловый эфир, 491,7, RT: 1,20 (условие Е). Этиловый эфир, 505,6, RT: 1,26 (условие Е). Стадия 2. Синтез 2-(4-(4-(5-5-циклобутил-1,3,4-тиадиазол-2-ил)амино)пиридин-2-ил)фенил)-2 оксабицикло[2.2.2]октан-1-ил)уксусной кислоты Указанное в заголовке соединение получали аналогично примеру 2, стадия 2, исходя из этил/метил 2-(4-(4-(5-(5-циклобутил-1,3,4-тиадиазол-2-иламино)пиридин-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1 ил)ацетата (33 мг, 0,07 ммоль) и 1 н раствора NaOH (0,20 мл, 0,20 ммоль). Очистка препаративной ВЭЖХ позволяла получить указанное в заголовке соединение в виде белого твердого вещества после сушки (18 мг, выход 56%). МС/ВР (М+Н)+, найдено 477,1961. RT: 5,93 (условие Z). 1H ЯМР (400 МГц,ДМСО-d6)м.д. 1,85-2,08 (м, 10 Н), 2,30 (с, 4 Н), 2,35-2,44 (м, 2 Н), 3,84 (квинт.д, J=8,49, 8,49, 8,49, 8,49,0,88 Гц, 1 Н), 3,90 (с, 2 Н), 7,41 (д, J=8,59 Гц, 2 Н), 7,93 (д, J=8,59 Гц, 1 Н), 7,97 (д, J=8,59 Гц, 2 Н), 8,25 (дд,J=8,72, 2,65 Гц, 1 Н), 8,77 (д, J=2,78 Гц, 1 Н). Пример 4. 2-(4-(4-(2-(5-Циклобутил-1,3,4-тиадиазол-2-иламино)пиримидин-5-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусная кислота Стадия 1. Синтез метил-2-(4-(4-(2-аминопиримидин-5-ил)фенил)-2-оксабицикло[2.2.2]октан-1 ил)ацетата В реакционный сосуд, содержащий метил-2-(4-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (200 мг, 0,52 ммоль), 5-бромпиримидин-2-амин (108 мг, 0,62 ммоль) и K3PO4 (132 мг, 0,62 ммоль), добавляли диметоксиэтан (4,8 мл). Смесь перемешивали при комнатной температуре и дегазировали после добавления EtOH (1,6 мл) и воды (0,64 мл). Добавляли аддуктPdCl2(dppf)DCM (21 мг, 0,03 ммоль) и смесь нагревали до 80 С на масляной бане в течение 3 ч. Затем реакционную смесь концентрировали досуха и переносили в DCM. Суспензию сушили над сульфатом натрия и фильтровали через подушку целита. Фильтрат концентрировали и очищали колоночной хроматографией, получая при этом указанное в заголовке соединение (193 мг, выход 84%). ЖХ/МС, ESIMC(+): 354,3, RT: 1,06 (условие Е). Стадия 2. Синтез метил-2-(4-(4-(2-(2-циклобутанкарбонил)гидразинкарботиоамидо)пиримидин-5 ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетата В реакционный сосуд, содержащий метил-2-(4-(4-(2-аминопиримидин-5-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (40 мг, 0,11 ммоль) добавляли дихлорметан (1 мл) при комнатной температуре. Добавляли 1,1'-тиокарбонилдипиридин-2(1 Н)-он (29 мг, 0,12 ммоль) и образовавшуюся смесь нагревали до 50 С на протяжении ночи. Смесь охлаждали до комнатной температуры и затем добавляли циклобутанкарбогидразид (19 мг, 0,17 ммоль) и перемешивали при комнатной температуре в течение еще часа. Содержимое затем концентрировали досуха и полученный остаток переносили в МеОН с образованием суспензии. Суспензию фильтровали и промывали небольшим количеством МеОН, получая при этом указанное в заголовке соединение в виде не совсем белого твердого вещества после сушки (48 мг,выход 83%). ЖХ/МС, ESI-МС(+): 510,4, RT: 1,26 (условие Е). Стадия 3. Синтез этил/метил-2-(4-(4-(2-(5-циклобутил-1,3,4-тиадиазол-2-иламино)пиримидин-5 ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетатаEtOH (0,6 мл) при комнатной температуре. Добавляли раствор концентрированной H2SO4 (0,03 мл, 0,56 ммоль) и смесь нагревали до 80 С в течение 1 ч. Полученную смесь охлаждали до комнатной температуры и гасили добавляемым по каплям насыщенным раствором NaHCO3. Содержимое концентрировали досуха и затем переносили в DCM и сушили над сульфатом натрия. Смесь фильтровали и концентрировали, получая при этом сырой остаток. Очистка на колонке позволяла получить указанное в заголовке соединение, содержащее приблизительно 18% метилового эфира (общий выход 41 мг). Смесь применяли в следующей стадии без дополнительной очистки. ЖХ/МС, ESI-MC(+): метиловый эфир, 492,2, RT: 1,42 В реакционный сосуд, содержащий смесь этил/метил 2-(4-(4-(2-(5-циклобутил-1,3,4-тиадиазол-2 иламино)пиримидин-5-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (41 мг, 0,08 ммоль) добавляли ТГФ (1 мл) и МеОН (1 мл) при комнатной температуре. Добавляли NaOH (0,24 мл, 0,24 ммоль) и смесь перемешивали при комнатной температуре на протяжении ночи. Реакционную смесь затем концентрировали досуха и переносили в воду. Смесь подкисляли 1 н HCl до рН между 3 и 4, получая при этом густую суспензию. Суспензию фильтровали и промывали небольшим количеством воды, получая при этом указанное в заголовке соединение в виде белого твердого вещества после сушки (37 мг, выход 97%). МС/ВР Указанное в заголовке соединение получали аналогично примеру 4, стадия 1, исходя из метил-2-(4(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетата (200 мг,0,52 ммоль) и 5-иодпиридин-2-амина (137 мг, 0,62 ммоль). Реакцию проводили при 80 С на протяжении ночи. После обработки и очистки на колонке получали указанное в заголовке соединение в виде не совсем белого твердого вещества после сушки (133 мг, выход 58%). ЖХ/МС, ESI-MC(+): 353,3, RT: 1,12 В реакционный сосуд, содержащий метил-2-(4-(4-(6-аминопиридин-3-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)ацетат (40 мг, 0,11 ммоль) и DCM (1 мл) добавляли 1,1'-тиокарбонилдипиридин 2(1 Н)-он (29 мг, 0,12 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Затем добавляли циклобутанкарбогидразин (19 мг, 0,17 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение еще часа. Смесь затем концентрировали досуха, добавляли EtOH (1 мл) с последующим добавлением раствора концентрированной H2SO4 (0,04 мл, 0, 66 ммоль). Смесь нагревали до 80 С в течение 1 ч. Полученную смесь охлаждали до комнатной температуры и гасили добавлением по каплям насыщенного раствора NaHCO3. Содержимое концентрировали досуха и затем переносили вDCM и сушили над сульфатом натрия. Смесь фильтровали и концентрировали, получая при этом сырой остаток. Очистка на колонке позволяла получить указанное в заголовке соединение, содержащее приблизительно 47% метилового эфира (общий выход 48 мг). Смесь применяли в следующей стадии безводный дополнительной очистки. ЖХ/МС, ESI-MC(+): метиловый эфир, 491,2, RT: 2,88 (условие М). Этиловый эфир, 505,2, RT: 3,06 (условие М). Стадия 3. Синтез 2-(4-(4-(6-5-циклобутил-1,3,4-тиадиазол-2-ил)амино)пиридин-3-ил)фенил)-2-оксабицикло[2.2.2]октан-1-ил)уксусной кислоты
МПК / Метки
МПК: C07D 417/12, A61K 31/4245, C07D 413/12, A61P 3/10, A61P 3/04, A61P 3/00, A61K 31/422
Метки: качестве, циклические, мостиковые, эфиры, dgat1, ингибиторов, простые
Код ссылки
<a href="https://eas.patents.su/30-25050-ciklicheskie-mostikovye-prostye-efiry-v-kachestve-ingibitorov-dgat1.html" rel="bookmark" title="База патентов Евразийского Союза">Циклические мостиковые простые эфиры в качестве ингибиторов dgat1</a>