Способ получения соединения алкоксида алкилолова и способ получения эфира карбоновой кислоты с использованием указанного соединения
Формула / Реферат
1. Способ получения продукта, содержащего соединение, представленное формулой XOR2, и
соединение диалкоксида диалкилолова следующей формулы (3):

включающий взаимодействие в отсутствие катализатора соединения диалкилолова следующей формулы (1):

и
эфира карбоновой кислоты, представленного формулой R2OCOOR2, и/или
спирта, представленного формулой R2OH;
где каждый R1 независимо представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода;
каждый R2 независимо представляет собой заместитель, имеющий 1-10 атомов углерода и выбранный из группы, состоящей из линейной или разветвленной алкильной группы, циклоалкила, углеводородной группы, содержащей насыщенный или ненасыщенный циклический углеводородный заместитель, и -Y-CH2- группы;
каждый Y независимо представляет собой заместитель, выбранный из группы, состоящей из арилзамещенной углеводородной группы, полиоксиалкильной группы и полиоксиалкиленовой группы;
ОХ представляет собой ацилоксигруппу, содержащую 1-12 атомов углерода, и НОХ, которая представляет собой конъюгированную кислоту ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8.
2. Способ получения продукта, содержащего соединение, представленное формулой XOR2, и
соединение тетраалкилдиалкоксидистанноксана следующей формулы (4):
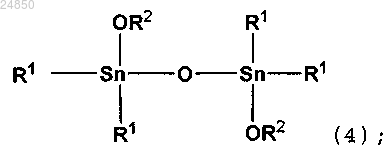
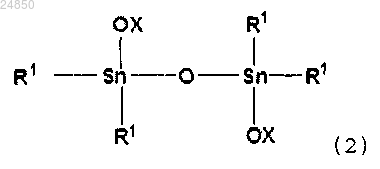
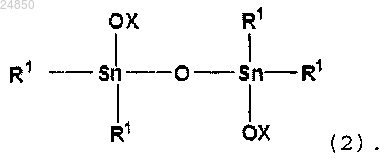
включающий взаимодействие в отсутствие катализатора соединения тетраалкилдистанноксана следующей формулы (2):
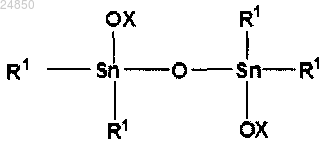
(2);
и
эфира карбоновой кислоты, представленного формулой R2OCOOR2, и/или
спирта, представленного формулой R2OH;
где каждый R1 независимо представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода;
каждый R2 независимо представляет собой заместитель, имеющий 1-10 атомов углерода и выбранный из группы, состоящей из линейной или разветвленной алкильной группы, циклоалкила, углеводородной группы, содержащей насыщенный или ненасыщенный циклический углеводородный заместитель, и -Y-CH2- группы;
каждый Y независимо представляет собой заместитель, выбранный из группы, состоящей из арилзамещенной углеводородной группы, полиоксиалкильной группы и полиоксиалкиленовой группы;
ОХ представляет собой ацилоксигруппу, содержащую 1-12 атомов углерода, и НОХ, которая представляет собой конъюгированную кислоту ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8.
3. Способ по п.1 или 2, в котором в эфире карбоновой кислоты R2OCOOR2 и/или в спирте R2OH R2 представляет собой заместитель, имеющий 1-10 атомов углерода и выбранный из группы, состоящей из линейной или разветвленной алкильной группы, циклоалкила, углеводородной группы, содержащей насыщенный или ненасыщенный циклический углеводородный заместитель.
4. Способ по п.3, в котором в диалкиловом эфире карбоновой кислоты R2OCOOR2 и/или в спирте R2OH R2 представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 8 атомов углерода.
5. Способ по п.1 или 2, в котором взаимодействие соединения диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты и/или спиртом проводят при температуре от 20 до 250°С.
6. Способ по п.1 или 2, в котором соединение диалкилолова следующей формулы (1):
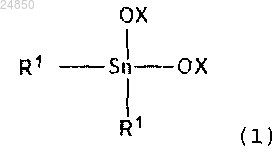
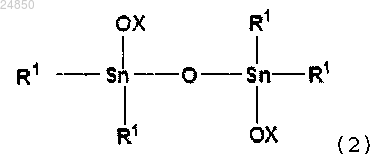
и/или соединение тетраалкилдистанноксана следующей формулы (2):
представляют собой соединения, полученные согласно способу, который включает
стадию (1) взаимодействия композиции алкилолова, содержащей соединение алкоксида моноалкилолова и соединение алкоксида триалкилолова, которые получают реакцией диспропорционирования по меньшей мере одного соединения алкоксида алкилолова, выбранного из группы, включающей в себя соединение диалкоксида диалкилолова следующей формулы (3):

и/или соединение тетраалкилдиалкоксидистанноксана следующей формулы (4):

с кислотой, представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8), и/или ангидридом кислоты, представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8), для получения смеси оловоорганических соединений, содержащих группу (ОХ группу), которую получают из кислоты и/или ангидрида кислоты; и
стадию (2) осуществления реакции перераспределения алкильных групп в результате термической обработки смеси оловоорганических соединений, полученных на стадии (1), для получения из соединения алкоксида моноалкилолова и соединения алкоксида триалкилолова в композиции алкилолова по меньшей мере одного соединения алкилолова, выбранного из группы, включающей в себя:
i) соединение диалкилолова следующей формулы (1):

и
ii) соединение тетраалкилдистанноксана следующей формулы (2):
каждый R1 независимо представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода;
каждый R2 независимо представляет собой заместитель, имеющий 1-10 атомов углерода и выбранный из группы, состоящей из линейной или разветвленной алкильной группы, циклоалкила, углеводородной группы, содержащей насыщенный или ненасыщенный циклический углеводородный заместитель, и -Y-CH2- группы;
каждый Y независимо представляет собой заместитель, выбранный из группы, состоящей из арилзамещенной углеводородной группы, полиоксиалкильной группы и полиоксиалкиленовой группы;
ОХ представляет собой ацилоксигруппу, содержащую 1-12 атомов углерода, и НОХ, которая представляет собой конъюгированную кислоту ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8;
при условии, что R1, который непосредственно связан с атомом олова в соединении диалкилолова, соединении тетраалкилдистанноксана, соединении диалкоксида диалкилолова, соединении тетраалкилдиалкоксидистанноксана, соединении алкоксида моноалкилолова и алкоксида триалкилолова, является одной и той же алкильной группой.
7. Способ по п.6, в котором композиция алкилолова представляет собой композицию алкилолова, полученную в процессе производства эфира карбоновой кислоты, полученного при последовательном осуществлении
стадии (а) получения реакционной жидкости, содержащей эфир карбоновой кислоты и тетраалкилдиалкоксидистанноксан, представленный следующей общей формулой (6), и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода, при взаимодействии диалкоксида диалкилолова, представленного следующей общей формулой (5), с двуокисью углерода
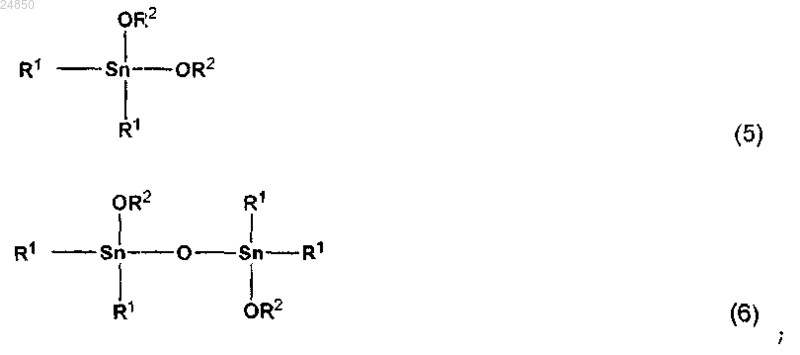
стадии (b) получения остаточной жидкости, содержащей тетраалкилдиалкоксидистанноксан и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода, при отделении эфира карбоновой кислоты от реакционной смеси методом перегонки, и
стадии (с) взаимодействия остаточной жидкости со спиртом, представленным следующей общей формулой (7), для того, чтобы удалить воду, полученную в качестве побочного продукта, для регенерации диалкоксида диалкилолова, и использование диалкоксида диалкилолова в качестве диалкоксида диалкилолова на стадии (а)
WHO (7)
в которой
каждый R1 независимо представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода;
каждый R2 и W независимо представляет собой заместитель, имеющий 1-10 атомов углерода и выбранный из группы, состоящей из линейной или разветвленной алкильной группы, циклоалкила, углеводородной группы, содержащей насыщенный или ненасыщенный циклический углеводородный заместитель, и -Y-CH2- группы;
каждый Y независимо представляет собой заместитель, выбранный из группы, состоящей из арилзамещенной углеводородной группы, полиоксиалкильной группы и полиоксиалкиленовой группы.
8. Способ по п.7, в котором стадию регенерации диалкоксида диалкилолова и/или тетраалкилдиалкоксидистанноксана из композиции алкилолова, полученной в процессе получения эфира карбоновой кислоты, проводят после стадии (b) и/или стадии (с), и использование регенерированного диалкоксида диалкилолова и /или тетраалкилдиалкоксидистанноксана в качестве диалкоксида диалкилолова на стадии (а) и в качестве исходного вещества на стадии (с) при смешивании с остаточной жидкостью со стадии (b).
9. Способ получения эфира карбоновой кислоты по п.1 или 2, дополнительно включающий следующие стадии от (А) до (В):
стадия (А): получение реакционной жидкости, содержащей эфир карбоновой кислоты и соединение тетраалкилдиалкоксидистанноксана и/или конъюгат соединения тетраалкилдиалкоксидистанноксана с двуокисью углерода, за счет взаимодействия соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана с двуокисью углерода; и
стадия (В): получение остаточной жидкости, содержащей тетраалкилдиалкоксидистанноксан и/или конъютат соединения тетраалкилдиалкоксидистанноксана с двуокисью углерода, за счет отделения эфира карбоновой кислоты от реакционной жидкости методом перегонки.
10. Способ получения эфира карбоновой кислоты по п.9, дополнительно включающий следующую стадию (С):
стадия (С): получение по меньшей мере одного соединения алкилолова, выбранного из группы, включающей в себя следующее i) и ii), при взаимодействии остаточной жидкости со стадии (В) с кислотой, представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8), и/или ангидридом кислоты, представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8);
i) соединение диалкилолова следующей формулы (1):
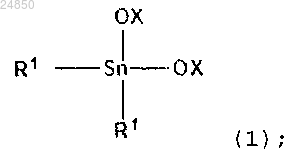
и
ii) соединение тетраалкилдистанноксана следующей формулы (2):
11. Способ по п.1 или 2, в котором соединение диалкилолова и/или соединение тетраалкилдистанноксана представляют собой соединения, полученные согласно способу, включающему в себя
стадию (I) взаимодействия диалкоксида диалкилолова, представленного следующей общей формулой (8), с двуокисью углерода, с получением реакционной жидкости, содержащей эфир карбоновой кислоты и тетраалкилдиалкоксидистанноксан, представленный следующей общей формулой (9), и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода;
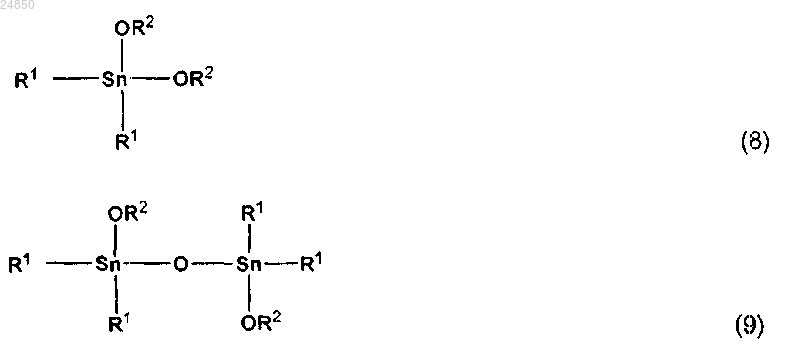
стадию (II) отделения эфира карбоновой кислоты от реакционной жидкости путем перегонки с получением остаточной жидкости, содержащей тетраалкилдиалкоксидистанноксан и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода; и
стадию (III) взаимодействия остаточной жидкости стадии (II) с кислотой, представленной общей формулой НОХ, с получением соединения, содержащего группу (ОХ группу), полученную из кислоты и/или ангидрида кислоты, и которое представляет собой соединение диалкоксиолова, представленное следующей общей формулой (10), и/или соединение тетраалкилдистанноксана, представленное следующей общей формулой (11):
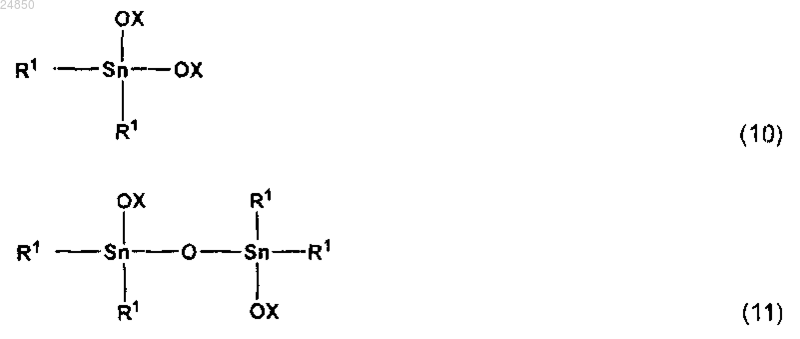
в которых
каждый R1 независимо представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода,
каждый R2 независимо представляет собой заместитель, имеющий 1-10 атомов углерода и выбранный из группы, состоящей из линейной или разветвленной алкильной группы, циклоалкила, углеводородной группы, содержащей насыщенный или ненасыщенный циклический углеводородный заместитель, и -Y-CH2- группы;
каждый Y независимо представляет собой заместитель, выбранный из группы, состоящей из арилзамещенной углеводородной группы, полиоксиалкильной группы и полиоксиалкиленовой группы.
12. Способ по любому из пп.1-11, в котором алкильная группа R1 представляет собой линейную алкильную группу, содержащую от 1 до 8 атомов углерода.
13. Способ по п.12, в котором алкильная группа R1 представляет собой н-бутильную группу или н-октильную группу.
14. Способ по любому из пп.6, 10 и 11, в котором кислота НОХ представляет собой карбоновую кислоту.
15. Способ по п.14, в котором карбоновую кислоту выбирают из группы, включающей в себя уксусную кислоту, пропионовую кислоту и малеиновую кислоту.
16. Способ по любому из пп.6, 10 и 11, в котором ангидрид кислоты ХОХ представляет собой ангидрид кислоты, выбранный из группы, включающей в себя уксусный ангидрид, пропионовый ангидрид и малеиновый ангидрид.
Текст
СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ АЛКОКСИДА АЛКИЛОЛОВА И СПОСОБ ПОЛУЧЕНИЯ ЭФИРА КАРБОНОВОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО СОЕДИНЕНИЯ В настоящем изобретении предоставлен способ получения соединения, представленного формулойXOR2; соединения диалкоксида диалкилолова, содержащего один атом олова, две связи Sn-R1 и две связи Sn-OR2; и/или соединения тетраалкилдиалкоксидистанноксана, содержащего одну связьSn-O-Sn, где каждый атом олова соединения тетраалкилдиалкоксидистанноксана образует две связи Sn-R1 и одну связь Sn-OR2, при этом данный способ включает в себя взаимодействие, в отсутствие катализатора, по меньшей мере одного соединения алкилолова, выбранного из группы,включающей в себя приведенные далее i) и ii): i) соединение диалкилолова, содержащее один атом олова, две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX(где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ,представляет собой кислоту Бренстеда с рКа от 0 до 6,8); и ii) соединение тетраалкилдистанноксана,содержащее одну связь Sn-O-Sn, где каждый атом олова соединения тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ представляет собой группу, в которой НОХ,являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8); с эфиром карбоновой кислоты, представленным формулой R2OCOOR2 (где R2 представляет собой линейную или разветвленную, насыщенную или ненасыщенную углеводородную группу,углеводородную группу, имеющую насыщенный или ненасыщенный циклический углеводородный заместитель, или группу Y-CH2- (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира и/или спиртом, представленным формулой R2OH (где R2 аналогичен определенному выше).(71)(73) Заявитель и патентовладелец: АСАХИ КАСЕИ КАБУСИКИ КАЙСЯ Область техники, к которой относится изобретение Настоящее изобретение относится к получению соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана в качестве катализатора, используемого для получения сложных эфиров и эфиров карбоновых кислот, и к получению сложного эфира и эфира карбоновой кислоты с использованием соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана. Уровень техники Соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана чрезвычайно широко используются в качестве катализаторов, таких как катализаторы синтеза сложных эфиров, катализаторы синтеза эфиров карбоновых кислот, катализаторы реакции переэтерификации и катализаторы сушки силиконового полимера или уретана. В частности, помимо того, что эфиры карбоновых кислот используются в качестве присадок, таких как присадки к бензину для повышения октанового числа и присадки к дизельному топливу для снижения концентрации частиц в выхлопных газах, эти полезные соединения применимы также в качестве алкилирующих агентов, карбонилирующих агентов или растворителей и так далее для синтеза поликарбонатов, уретанов, фармацевтических препаратов, сельскохозяйственных химических веществ и других органических соединений, или в качестве электролитов для литиевых аккумуляторных батарей, смазочных масел, или сырья для обескислороживающих агентов для предотвращения окисления труб для паровых котлов. Соединения диалкоксида диалкилолова и соединения тетраалкилдиалкоксидистанноксана привлекают особенное внимание в качестве синтетических катализаторов. Например, в патентном документе 1 (международная публикацияWO 2003/055840) описан способ получения эфира карбоновой кислоты, включающий в себя введение во взаимодействие металлоорганического соединения, содержащего диалкоксид диалкилолова, с двуокисью углерода с последующим термическим разложением полученного продукта присоединения. Известны различные способы получения соединений диалкоксидов диалкилолова и соединений тетраалкилдиалкоксидистанноксанов. Например, в патентном документе 2 (патент США 5545600) описан способ, включающий в себя проведение реакции дегидратации с участием оксида диалкилолова и спирта и удаление полученного низкокипящего компонента, содержащего воду, из реакционной жидкости. Предполагается, что данная реакция является последовательной равновесной реакцией, сопровождающей дегидратацию, как показано в приведенных ниже формулах (1) и (2), и для того, чтобы получить диалкоксид диалкилолова с высоким выходом, диалкоксид диалкилолова образуется при одновременном выведении воды, образующейся в результате каждой реакции дегидратации, за пределы данной системы. Кроме того, поскольку данная реакция энергетически невыгодна, необходимо осуществлять реакцию в течение длительного времени при высокой температуре (например, 180 С) и есть случаи, когда вследствие такого нагревания в течение длительного времени при высокой температуре в продуктах, имеющих форму соединений диалкоксида диалкилолова и соединений тетраалкилдиалкоксидистанноксана, происходят реакции термической денатурации. Так как соединение диалкилолова является твердым веществом, есть случаи, когда при производстве путем непрерывного процесса возникают сложности в обращении.(где каждый R и R' независимо представляет собой алкильную группу).(где каждый R и R' независимо представляет собой алкильную группу). Кроме того, в непатентном документе 1 (Journal of Chemical Society, p. 740, 1964) описан способ получения дибутилоксида диэтилолова реакцией дихлордиэтилолова с бутилатом натрия. В данной реакции, поскольку побочный продукт, представляющий собой хлорид натрия, образуется в виде твердого вещества, жидкость после реакции находится в форме суспензии, что приводит, таким образом, к возможным сложностям в обращении при очистке соединения олова и так далее. С другой стороны, в патентном документе 3 (международная патентная публикацияWO 2008/044575) описан способ, в котором дезактивированную композицию оловянного катализатора, полученную в процессе способа получения эфира карбоновой кислоты, регенерируют и снова используют в качестве катализатора для получения эфира карбоновой кислоты. В этом способе регенерации соединение диалкилолова образуется в результате термической обработки соединения, полученного при взаимодействии композиции, содержащей дезактивированную форму соединения алкоксида диалкилолова, образующегося в способе получения эфира карбоновй кислоты, с кислотой и/или ангидридом кислоты, и соединение диалкилолова далее регенерируют, получая соединение алкоксида диалкилолова. Ссылки на предшествующую область Патентные документы. Патентный документ 1: международная публикацияWO 2003/055840. Патентный документ 2: патент США 5545600. Патентный документ 3: международная патентная публикацияWO 2008/044575. Непатентные документы. Непатентный документ 1: Journal of Chemical Society, p. 740, 1964. Описание изобретения Задачи, которые предстоит решить при помощи изобретения На стадии регенерации соединения диалкилолова в соединение диалкоксида диалкилолова образуется композиция, содержащая оксид диалкилолова, при взаимодействии соединения диалкилолова с водным раствором щелочи, при этом данная композиция реагирует со спиртом, а компонент, содержащий образующуюся воду, удаляют из реакционной смеси, и поскольку это сопровождается реакцией дегидратации, представленной приведенными выше формулами (1) и (2), имеются случаи, когда данная стадия может сопровождаться реакцией термической денатурации соединения диалкоксида диалкилолова и соединения тетраалкилдиалкоксидистанноксана, как описано ранее. Более того, поскольку на данной стадии оксид диалкилолова является твердым, присутствуют стадии, включающие в себя обращение с жидкостью, и стадии, включающие в себя обращение с твердым веществом, что приводит, таким образом, к сложности применительно к промышленному осуществлению. Как описано выше, проблема разработки технологии простого производства соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана без необходимости обращения с веществом, находящимся в твердом состоянии, в настоящее время остается нерешенной. Поэтому целью настоящего изобретения является предоставление способа производства соединений алкоксида диалкилолова, не включающего в себя обращение с твердыми соединениями олова. Следующей целью настоящего изобретения является предоставление способа использования полученных соединений алкоксида диалкилолова при получении эфиров карбоновых кислот. Способы решения данных проблем В результате проведения тщательного исследования упомянутых выше проблем, авторами настоящего изобретения было найдено, что вышеуказанные проблемы можно решить, получая соединение диалкоксида диалкилолова и/или соединение тетраалкилдиалкоксидистанноксана реакцией конкретного соединения диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты и/или спиртом, что приводит, таким образом, к завершению настоящего изобретения. А именно, в настоящем изобретении предоставлен:[1] способ получения соединения, представленного формулой XOR2; соединения диалкоксида диалкилолова, содержащего один атом олова, две связи Sn-R1 и две связиSn-OR2; и/или соединения тетраалкилдиалкоксидистанноксана, содержащего одну связь Sn-O-Sn, в которой каждый атом олова соединения тетраалкилдиалкоксидистанноксана образует две связи Sn-R1 и одну связьSn-OR2; включающий в себя взаимодействие, в отсутствие катализатора, по меньшей мере одного соединения алкилолова, выбранного из группы, включающей в себя приведенные далее i) и ii):i) соединение диалкилолова, содержащее один атом олова, две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8); иii) соединение тетраалкилдистанноксана, содержащее одну связь Sn-O-Sn, в которой каждый атом олова соединения тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8); с эфиром карбоновой кислоты, представленным формулой R2OCOOR2 (где R2 представляет собой линейную, или разветвленную, насыщенную, или ненасыщенную углеводородную группу, углеводородную группу, имеющую насыщенный или ненасыщенный циклический углеводородный заместитель, или группу Y-CH2- (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу,или циклическую насыщенную, или ненасыщенную алкиленовую группу простого эфира, и/или спиртом, представленным формулой R2OH (где R2 аналогичен определенному выше);[2] способ по п.[1], в котором в эфире карбоновой кислоты R2OCOOR2 и/или в спирте R2OH R2 представляет собой линейную, или разветвленную, насыщенную, или ненасыщенную углеводородную группу, или углеводородную группу, имеющую насыщенный или ненасыщенный циклический углеводородный заместитель;[3] способ по п.[1] или [2], в котором в диалкиловом эфире карбоновой кислоты R2OCOOR2 и/или в спирте R2OH R2 представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 8 атомов углерода;[4] способ по любому из пп.[1]-[3], в котором соединение диалкилолова является соединением,представленным следующей формулой (3):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода,О является атомом кислорода,ОХ 1 и ОХ 2 представляют собой ОХ 1 и ОХ 2, в которых НОХ 1 и НОХ 2, которые являются сопряженными кислотами для ОХ 1 и ОХ 2, представляют собой кислоты Бренстеда с рКа от 0 до 6,8, а а и b являются целыми числами от 0 до 2, соответственно, и а + b = 2);[5] способ по любому из пп.[1]-[4], в котором соединение тетраалкилдистанноксана является соединением, представленным следующей формулой (4):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода,О является атомом кислорода, а ОХ 3 и ОХ 4 представляют собой ОХ 3 и ОХ 4, в которых НОХ 3 и НОХ 4, которые являются сопряженными кислотами для ОХ 3 и ОХ 4, представляют собой кислоты Бренстеда с рКа от 0 до 6,8);[6] способ по любому из пп.[1]-[5], в котором группа ОХ представляет собой ацилоксигруппу;[7] способ по любому из пп.[1]-[6], в котором взаимодействие соединения диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты и/или спиртом проводят при температуре от 20 до 250 С;[8] способ по п.[1], в котором соединение диалкоксида диалкилолова представляет собой соединение, представленное следующей формулой (5):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, которую получают из соединения диалкилолова и/или соединения тетраалкилдистанноксана, а каждый R2 независимо представляет собой линейную, или разветвленную, ненасыщенную, или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира), которую получают из эфира карбоновой кислоты и/или спирта),[9] способ по любому из пп.[1]-[8], в котором соединение тетраалкилдиалкоксидистанноксана представляет собой соединение, представленное следующей формулой (6):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, которую получают из соединения диалкилолова и/или соединения тетраалкилдистанноксана, а каждый R2 независимо представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира), которую получают из эфира карбоновой кислоты и/или спирта),[10] способ по любому из пп.[1]-[9], в котором соединение диалкилолова и/или соединение тетраалкилдистанноксана представляют собой соединения, полученные согласно способу, который включает в себя стадию (1) взаимодействия композиции алкилолова, содержащей соединение алкоксида моноалкилолова и соединение алкоксида триалкилолова, которые получают реакцией диспропорционирования по меньшей мере одного соединения алкоксида алкилолова, выбранного из группы, включающей в себя соединение диалкоксида диалкилолова, содержащее один атом олова, две связи Sn-R1 и две связи Sn-OR2 и/или соединение тетраалкилдиалкоксидистанноксана, содержащее одну связь Sn-O-Sn, где каждый атом олова в соединении тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OR2 (где две группы R1, связанные с атомом олова, диспропорционируют между двумя молекулами в случае соединения алкоксида диалкилолова или диспропорционируют внутримолекулярно и/или межмолекулярно в случае соединения тетраалкилдиалкоксидистанноксана, превращаясь в соединение алкоксида моноалкилолова, содержащее одну связь Sn-R1, и соединение алкоксида триалкилолова, содержащее три связи SnR1), с кислотой, представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8) и/или ангидридом кислоты, представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, является кислотой Бренстеда с рКа от 0 до 6,8), для получения смеси оловоорганических соединений, содержащих группу (ОХ группу), которую получают из кислоты и/или ангидрида кислоты; и стадию (2) осуществления реакции перераспределения алкильных групп в результате термической обработки смеси оловоорганических соединений, полученных на стадии (1), для получения из соединения алкоксида моноалкилолова и соединения алкоксида триалкилолова в композиции алкилолова по меньшей мере одного соединения алкилолова, выбранного из группы, включающей в себя:i) соединение диалкилолова, содержащее один атом олова, при этом единственный атом олова образует две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, является кислотой Бренстеда с рКа от 0 до 6,8) иii) соединение тетраалкилдистанноксана, содержащее одну связь Sn-O-Sn, в котором каждый атом олова в соединении тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, является кислотой Бренстеда с рКа от 0 до 6,8), при условии, что R1, который непосредственно связан с атомом олова в соединении диалкилолова, соединении тетраалкилдистанноксана, соединении диалкоксида диалкилолова, соединении тетраалкилдиалкоксидистанноксана, соединении алкоксида моноалкилолова и алкоксиде триалкилолова, является одной и той же алкильной группой;[11] способ по п.[10], в котором композиция алкилолова представляет собой композицию алкилолова, полученную в процессе производства эфира карбоновой кислоты, полученного при последовательном осуществлении стадии (а) получения реакционной жидкости, содержащей эфир карбоновой кислоты и тетраалкилдиалкоксидистанноксан, представленный следующей общей формулой (8), и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода, при взаимодействии диалкоксида диалкилолова, представленного следующей общей формулой (7), с двуокисью углерода(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, а каждый R2 независимо представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира;(в которой R1 представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода, аR2 представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира; стадии (b) получения остаточной жидкости, содержащей тетраалкилдиалкоксидистанноксан и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода, при выделении эфира карбоновой кислоты из реакционной смеси методом перегонки, и стадии (с) взаимодействия остаточной жидкости со спиртом, представленным следующей общей формулой (9), с тем, чтобы удалить воду, полученную в качестве побочного продукта, для регенерации диалкоксида диалкилолова, и использования диалкоксида диалкилолова в качестве диалкоксида диалкилолова на стадии (а)(в которой W представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира;[12] способ по п.[11], в котором стадию осуществления способа по п.[10] для регенерации диалкоксида диалкилолова и/или тетраалкилдиалкоксидистанноксана из композиции диалкоксида диалкилолова,полученной в процессе получения эфира карбоновой кислоты, проводят после стадии (b) и/или стадии (с) по п.[11], и использование регенерированного диалкоксида диалкилолова и/или тетраалкилдиалкоксидистанноксана в качестве диалкоксида диалкилолова на стадии (а) и в качестве исходного вещества на стадии (с) при смешивании с остаточной жидкостью со стадии (b);[13] способ получения эфира карбоновой кислоты, дополнительно включающий в себя следующие стадии от (А) до (В) в способе по п.[1]: стадия (А): получение реакционной жидкости, содержащей эфир карбоновой кислоты и соединение тетраалкилдиалкоксидистанноксана и/или конъюгат соединения тетраалкилдиалкоксидистанноксана с двуокисью углерода, за счет взаимодействия соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана по п.[1] с двуокисью углерода; и стадия (В): получение остаточной жидкости, содержащей тетраалкилдиалкоксидистанноксан и/или конъюгат соединения тетраалкилдиалкоксидистанноксана с двуокисью углерода, за счет отделения эфира карбоновой кислоты от реакционной жидкости методом перегонки;[14] способ получения эфира карбоновой кислоты, включающий в себя, кроме того, следующую стадию (С) в способе по п.[13] и использование соединения алкилолова, полученного на стадии (С), в качестве соединения алкилолова по п.[1]: стадия (С): получение по меньшей мере одного соединения алкилолова, выбранного из группы,включающей в себя следующее i) и ii), при взаимодействии остаточной жидкости стадии (В) с кислотой,представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8) и/или ангидридом кислоты,представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8);i) соединение диалкилолова, содержащее один атом олова, две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, является кислотой Бренстеда с рКа от 0 до 6,8); иii) соединение тетраалкилдистанноксана, содержащее одну связь Sn-O-Sn, в которой каждый атом олова соединения тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, является кислотой Бренстеда с рКа от 0 до 6,8);[15] способ по п.[1], в котором соединение диалкилолова и/или соединение тетраалкилдистанноксана представляют собой соединения, полученные согласно способу, включающему в себя стадию (I) взаимодействия диалкоксида диалкилолова, представленного следующей общей формулой (10), с двуокисью углерода, с получением реакционной жидкости, содержащей эфир карбоновой кислоты и тетраалкилдиалкоксидистанноксан, представленный следующей общей формулой (11), и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, а-5 024850 каждый R2 независимо представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира;(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, а каждый R2 независимо представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира; стадию (II) отделения эфира карбоновой кислоты от реакционной жидкости путем перегонки с получением остаточной жидкости, содержащей тетраалкилдиалкоксидистанноксан и/или конъюгат тетраалкилдиалкоксидистанноксана с двуокисью углерода; и стадию (III) взаимодействия остаточной жидкости стадии (II) с кислотой, представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8), и/или ангидридом кислоты, представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, является кислотой Бренстеда с рКа от 0 до 6,8), с получением соединения, содержащего группу(ОХ группу), полученную из кислоты и/или ангидрида кислоты, и которое представляет собой соединение диалкоксиолова, представленное следующей общей формулой (12), и/или соединение тетраалкилдистанноксана, представленное следующей общей формулой (13):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода,О представляет собой атом кислорода, а ОХ представляет собой группу ОХ, в которой НОХ, являющаяся сопряженной кислотой для ОХ,является кислотой Бренстеда с рКа от 0 до 6,8);(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода,О представляет собой атом кислорода, а ОХ представляет собой группу ОХ, в которой НОХ, являющаяся сопряженной кислотой для ОХ,является кислотой Бренстеда с рКа от 0 до 6,8);[16] способ по любому из пп.[1]-[15], в котором алкильная группа R1 представляет собой линейную алкильную группу, содержащую от 1 до 8 атомов углерода;[17] способ по п.[16], в котором алкильная группа R1 представляет собой н-бутильную группу или н-октильную группу;[18] способ по любому из пп.[10], [14] и [15], в котором кислота НОХ представляет собой карбоновую кислоту;[19] способ по п.[18], в котором карбоновую кислоту выбирают из группы, включающей в себя уксусную кислоту, пропионовую кислоту и малеиновую кислоту;[20] способ по любому из пп.[10], [14] и [15], в котором ангидрид кислоты НОХ представляет собой ангидрид кислоты, выбранный из группы, включающей в себя уксусный ангидрид, пропионовый ангидрид и малеиновый ангидрид. Преимущественные эффекты изобретения В соответствии с настоящим изобретением соединение диалкилолова и/или соединение тетраалкилдистанноксана легко можно превратить в соединение алкоксида диалкилолова и/или соединение тетра-6 024850 алкилдиалкоксидистанноксана, исключая обращение с твердыми соединениями олова. Соединение алкоксида диалкилолова и/или соединение тетраалкилдиалкоксидистанноксана можно использовать в качестве катализатора для получения эфиров карбоновых кислот. Кроме того, поскольку применимые компоненты в виде соединений диалкоксида диалкилолова и/или соединений тетраалкилдиалкоксидистанноксана можно получить из соединений алкоксида моноалкилолова и соединений алкоксида тетраалкилолова, полученных реакцией диспропорционирования алкильных групп в соединении диалкоксида диалкилолова и/или соединении тетраалкилдиалкоксидистанноксана, используемых для получения эфира карбоновой кислоты, и данные применимые соединения можно использовать повторно для получения эфиров карбоновой кислоты, настоящее изобретение весьма полезно в промышленных областях. Краткое описание фигур На фиг. 1 представлена блок-схема, поясняющая способ регенерации соединения алкоксида моноалкилолова и соединения алкоксида триалкилолова, полученных реакцией диспропорционирования алкильных групп в соединении диалкоксида диалкилолова и/или соединении тетраалкилдиалкоксидистанноксана, таких как соединение диалкоксида диалкилолова и/или соединении тетраалкилдиалкоксидистанноксана в настоящем варианте осуществления; на фиг. 2 - блок-схема улучшенного способа получения эфира карбоновой кислоты, который объединяет в себе способ получения эфира карбоновой кислоты и способ получения соединения диалкилолова согласно настоящему варианту осуществления; на фиг. 3 - блок-схема, поясняющая способ получения эфира карбоновой кислоты, объединяющего в себе стадии от (А) до (С) со стадией (Z) настоящего варианта осуществления; на фиг. 4 - блок-схема, поясняющая способ получения эфира карбоновой кислоты, объединяющего в себе стадии с (I) по (III) со стадией (Z) настоящего варианта осуществления; на фиг. 5 - схематическое изображение реакционного аппарата для получения эфира карбоновой кислоты в виде примера; на фиг. 6 - схематическое изображение реакционного аппарата для получения диалкоксида диалкилолова и/или тетраалкилдиалкоксидистанноксана в виде примера; на фиг. 7 - схематическое изображение реакционного аппарата для получения эфира карбоновой кислоты и диалкоксида диалкилолова и/или тетраалкилдиалкоксидистанноксана в виде примера; и на фиг. 8 - схематическое изображение реакционного аппарата для получения эфира карбоновой кислоты и диалкоксида диалкилолова и/или тетраалкилдиалкоксидистанноксана в виде примера. Подробное описание изобретения Далее предоставлено подробное объяснение предпочтительных вариантов осуществления настоящего изобретения (называемых настоящими вариантами осуществления). Кроме того, настоящее изобретение не ограничено следующими вариантами осуществления, но предпочтительно может быть осуществлено, не выходя из его сущности и рамок. В способе настоящего изобретения предоставлен способ получения соединения, представленного формулой XOR2; соединения диалкоксида диалкилолова, содержащего один атом олова, две связи Sn-R1 и две связиSn-OR2; и/или соединения тетраалкилдиалкоксидистанноксана, содержащего одну связь Sn-O-Sn, в которой каждый атом олова в соединении тетраалкилдиалкоксидистанноксана образует две связи Sn-R1 и одну связьSn-OR2; включающий в себя взаимодействие, в отсутствие катализатора, по меньшей мере одного соединения алкилолова, выбранного из группы, включающей в себя приведенные ниже i) и ii):i) соединение диалкилолова, содержащее один атом олова, две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8), иii) соединение тетраалкилдистанноксана, содержащее одну связь Sn-O-Sn, в которой каждый атом олова в соединении тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8), и эфира карбоновой кислоты, представленного формулой R2OCOOR2 (где R2 представляет собой линейную или разветвленную, ненасыщенную или насыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель или-Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира; и/или спирта, представленного формулой R2OH (где R2 аналогичен определенному выше). Соединение диалкилолова. Сначала предоставлено объяснение в отношении соединения диалкилолова, относящегося к i). Соединение диалкилолова представляет собой соединение, представленное следующей формулой (14)(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода,О представляет собой атом кислорода,ОХ 1 и ОХ 2 представляет собой ОХ 1 и ОХ 2, в которых сопряженные кислоты ОХ 1 и ОХ 2 в форме 1 НОХ и НОХ 2 являются кислотами Бренстеда с рКа от 0 до 6,8, а а и b являются целыми числами от 0 до 2, соответственно, и а + b = 2). Примеры R1 в формуле (14) могут включать в себя алкильные группы в виде алифатических углеводородных групп, в которых количество атомов углерода, составляющих данную группу, представляет собой число, выбранное из целого числа от 1 до 12, такие как метильная, этильная, пропильная (включая изомеры), бутильная (включая изомеры), пентильная (включая изомеры), гексильная (включая изомеры),гептильная (включая изомеры), октильная (включая изомеры), нонильная (включая изомеры), децильная(включая изомеры) или додецильная (включая изомеры) группа. Их предпочтительные примеры могут включать в себя линейные или разветвленные алкильные группы, в которых количество атомов углерода,составляющих данную группу, представляет собой число, выбранное из целого числа от 1 до 8. Несмотря на то, что можно использовать соединение диалкилолова, в котором данные группы представляют алкильные группы, в которых количество атомов углерода, составляющих данную группу, выходит за пределы указанного интервала, может ухудшиться текучесть и может снизиться производительность. Принимая во внимание простоту получения при промышленном производстве, алкильные группы более предпочтительно представляют собой н-бутильные группы или н-октильные группы. Хотя не существует особенных ограничений в отношении ОХ 1 и ОХ 2 в формуле (14), при условии,что их сопряженные кислоты в форме НОХ 1 и НОХ 2 являются кислотами Бренстеда с рКа от 0 до 6,8, они предпочтительно представляют собой по меньшей мере один тип заместителя, выбранного из группы,включающей в себя ацилоксигруппы и арилоксигруппы, а рКа их сопряженных кислот составляет от 0 до 6,8. Более предпочтительно ОХ 1 и ОХ 2 являются группами, в которых количество атомов углерода, составляющих данную группу, представляет собой число, выбранное из целых чисел от 1 до 12. Конкретные примеры подобных групп могут включать в себя ацилоксигруппы, состоящие из линейной или разветвленной, насыщенной алкильной группы, карбонильной группы и атома кислорода, такие как ацетоксигруппа, пропионилоксигруппа, бутирилоксигруппа, валерилоксигруппа или лауроилоксигруппа, и арилоксигруппы, такие как феноксигруппа, метилфеноксигруппа (включая изомеры), этилфеноксигруппа(включая изомеры), метилбутилфеноксигруппа (включая изомеры), метилпентилфеноксигруппа (включая изомеры), диэтилфеноксигруппа (включая изомеры), этилпропилфеноксигруппа (включая изомеры),этилбутилфеноксигруппа (включая изомеры), дипропилфеноксигруппа (включая изомеры), триметилфеноксигруппа (включая изомеры), диметилэтилфеноксигруппа (включая изомеры), диметилпропилфеноксигруппа (включая изомеры), диметилбутилфеноксигруппа (включая изомеры), метилэтилпропилфеноксигруппа (включая изомеры), метилдиметилфеноксигруппа (включая изомеры) или триэтилфеноксигруппа (включая изомеры). Конкретные примеры соединений диалкилолова, представленных формулой (14), могут включать в себя соединения диалкилдиацилоксиолова, такие как диметилдиацетоксиолово, диметилдипропионилоксиолово (включая изомеры), диметилдибутирилоксиолово (включая изомеры), диметилвалерилоксиолово (включая изомеры), диметилдилауроилоксиолово (включая изомеры), дибутилацетоксиолово (включая изомеры), дибутилдипропионилоксиолово (включая изомеры), дибутилдибутирилоксиолово (включая изомеры), дибутилдивалерилоксиолово (включая изомеры), дибутилдилауроилоксиолово (включая изомеры), диоктилдиацетоксиолово (включая изомеры), диоктилдипропионилоксиолово (включая изомеры), диоктилбутирилоксиолово (включая изомеры), диоктилдивалерилоксиолово (включая изомеры) или диоктилдилауроилоксиолово (включая изомеры); и соединения алкилдиарилоксиолова, такие как диметилдифеноксиолово, диметилди(метилфенокси)олово (включая изомеры), диметилди(этилфенокси)олово (включая изомеры), диметилди(пропилфенокси)олово (включая изомеры), диметилди(бутилфенокси)олово (включая изомеры), диметилди(пентилфенокси)олово (включая изомеры), диметилди(гексилфенокси)олово (включая изомеры), диметил-бис(диметилфенокси)олово (включая изомеры), диметилди(метилэтилфенокси)олово (включая изомеры), диметилди(метилпропилфенокси)олово(включая изомеры),диоктилди(этилбутилфенокси)олово (включая изомеры), диоктилди(пропилфенокси)олово (включая изомеры), диоктилди(триметилфенокси)олово (включая изомеры), диоктил-бис(диметилэтилфенокси)олово (включая изомеры), диоктил-бис(диметилпропилфенокси)олово (включая изомеры), диоктил-бис(диметилбутилфенокси)олово (включая изомеры), диоктилди(метилэтилпропилфенокси)олово (включая изомеры), диоктилди(этилдиметилфенокси)олово (включая изомеры) или диоктилди(триэтилфенокси)олово (включая изомеры). Соединение тетраалкилдистанноксана. Затем предоставлено объяснение в отношении соединения тетраалкилдистанноксана, принадлежащего ii). Соединение тетраалкилдистанноксана представляет собой соединение, представленное следующей формулой (15):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода,О представляет собой атом кислорода, а ОХ 3 и ОХ 4 представляют собой ОХ 3 и ОХ 4, в которых сопряженные кислоты для ОХ 3 и ОХ 4 в форме НОХ 3 и НОХ 4 являются кислотами Бренстеда с рКа от 0 до 6,8). Примеры R1 в формуле (15) могут включать в себя алкильные группы в виде алифатических углеводородных групп, в которых количество атомов углерода, составляющих данные группы, представляет собой число, выбранное из целого числа от 1 до 12, такие как метильная, этильная, пропильная (включая изомеры), бутильная (включая изомеры), пентильная (включая изомеры), гексильная (включая изомеры),гептильная (включая изомеры), октильная (включая изомеры), нонильная (включая изомеры), децильная(включая изомеры) или додецильная (включая изомеры) группа. Их предпочтительные примеры могут включать в себя линейные или разветвленные алкильные группы, в которых количество атомов углерода,составляющих данные группы, представляет собой число, выбранное из целого числа от 1 до 8. Несмотря на то, что можно использовать соединение тетраалкилдистанноксана, в котором данные группы представляют собой алкильные группы, в которых количество атомов углерода, составляющих группы, находится за пределами указанного интервала, может ухудшиться текучесть и может снизиться производительность. Принимая во внимание простоту получения при промышленном производстве, данные алкильные группы более предпочтительно представляют собой н-бутильные группы, или н-октильные группы. Хотя в отношении ОХ 3 и ОХ 4 в формуле (15) нет особенных ограничений, при условии, что их со-9 024850 пряженные кислоты в форме НОХ 3 и НОХ 4 являются кислотами Бренстеда, и рКа данных сопряженных кислот составляет от 0 до 6,8, они предпочтительно представляют собой по меньшей мере один из типов заместителя, выбранного из группы, включающей в себя ацилоксигруппы и арилоксигруппы, а рКа их сопряженных кислот составляет от 0 до 6,8. Более предпочтительно ОХ и ОХ представляют собой группы, в которых количество атомов углерода, составляющих данные группы, представляет собой число,выбранное из целых чисел от 1 до 12. Конкретные примеры таких групп могут включать в себя ацилоксигруппы, состоящие из линейной или разветвленной, насыщенной алкильной группы, карбонильной группы и атома кислорода, такие как ацетоксигруппа, пропионилоксигруппа, бутирилоксигруппа, валерилоксигруппа или лауроилоксигруппа; и арилоксигруппы, такие как феноксигруппа, метилфеноксигруппа (включая изомеры), этилфеноксигруппа (включая изомеры), пропилфеноксигруппа (включая изомеры), бутилфеноксигруппа (включая изомеры), пентилфеноксигруппа (включая изомеры), гексилфеноксигруппа (включая изомеры), диметилфеноксигруппа (включая изомеры), метилэтилфеноксигруппа(включая изомеры), метилпропилфеноксигруппа (включая изомеры), метилбутилфеноксигруппа (включая изомеры), метилпентилфеноксигруппа (включая изомеры), диэтилфеноксигруппа (включая изомеры),этилпропилфеноксигруппа (включая изомеры), этилбутилфеноксигруппа (включая изомеры), дипропилфеноксигруппа (включая изомеры), триметилфеноксигруппа (включая изомеры), диметилэтилфеноксигруппа (включая изомеры), диметилпропилфеноксигруппа (включая изомеры), диметилбутилфеноксигруппа (включая изомеры), метилэтилпропилфеноксигруппа, метилдиметилфеноксигруппа или триэтилфеноксигруппа (включая изомеры). Конкретные примеры соединений, представленных формулой (15), могут включать в себя 1,1,3,3 тетраалкил-1,3-диацилоксидистанноксаны, такие как 1,1,3,3-тетраметил-1,3-диацетоксидистанноксан,1,1,3,3-тетраметил-1,3-дипропионилоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3 дибутирилоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3-дивалерилоксидистанноксан(включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(метилпропилфенокси)дистанноксан (включая изомеры),1,1,3,3-тетраоктил-1,3-ди(метилбутилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3 ди(метилпентилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-бис(диэтилфенокси) дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(этилпропилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(этилбутилфенокси)дистанноксан (включая изомеры), 1,1,3,3 тетраоктил-1,3-ди(дипропилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(триметилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-бис(диметилэтилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-бис(диметилпропилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-бис(диметилбутилфенокси)дистанноксан (включая изомеры), 1,1,3,3 тетраоктил-1,3-ди(метилэтилпропилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3 ди(этилдиметилфенокси)дистанноксан (включая изомеры) или 1,1,3,3-тетраоктил-1,3-ди(триэтилфенокси)дистанноксан (включая изомеры). Обычно оловоорганические соединения легко принимают ассоциированную структуру. Например,известно, что диалкоксиды диалкилолова образуют димерную структуру, тогда как о тетраалкилдиалкоксидистанноксанах известно, что они существуют за счет образования ступенчатых структур, в которых ассоциированы две или три молекулы. Даже в тех случаях, когда такие ассоциированные состояния изменяются, среди специалистов принято представлять данные соединения в виде их мономерной структуры. Эфир карбоновой кислоты. В отношении эфира карбоновой кислоты, используемого в настоящем варианте осуществления, нет особых ограничений, и предпочтительно используют эфиры карбоновой кислоты, представленные следующей формулой (16):(в которой каждый R2 независимо представляет собой линейную или разветвленную, насыщенную или ненасыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-СН 2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира. Несмотря на то, что в эфирах карбоновой кислоты, представленных формулой (16), R2 может представлять собой алифатическую углеводородную группу или ароматическую углеводородную группу,вследствие того, что более низкая кислотность гидроксильного соединения, имеющего структуру R2OH,в которой ОН группа связана с группой R2, составляющей эфир карбоновой кислоты, облегчает элиминирование в виде R2OX, в ряду упомянутых выше R2 предпочтительными являются такие R2, в которых атом углерода, связанный с кислородом, имеет метильную или метиленовую структуру. Примеры такихR2 могут включать в себя алкильные группы, такие как метильная группа, этильная группа, пропильная группа (включая изомеры), бутильная группа (включая изомеры), пентильная группа (включая изомеры),гексильная группа (включая изомеры), гептильная группа (включая изомеры), октильная группа (включая изомеры), нонильная группа (включая изомеры), децильная группа (включая изомеры), додецильная группа (включая изомеры), гексадецильная группа (включая изомеры) или октадецильная группа (включая изомеры); циклоалкильные группы, такие как циклопентильная группа, циклогексильная группа,циклогептильная группа, циклооктильная группа (включая изомеры), метилциклопентильная группа,метилциклогексильная группа, метилциклогептильная группа, метилциклооктильная группа, этилциклопентильная группа, этилциклогексильная группа, этилциклогептильная группа, этилциклооктильная группа (включая изомеры), пропилциклопентильная группа, пропилциклогексильная группа, пропилциклогептильная группа, пропилциклооктильная группа (включая изомеры), циклопентилметильная группа,циклогексилметильная группа, циклогептилметильная группа, циклооктилметильная группа (включая изомеры), циклопентилэтильная группа, циклогексилэтильная группа, циклогептилэтильная группа, циклооктилэтильная группа (включая изомеры), циклопентилпропильная группа, циклогексилпропильная группа, циклогептилпропильная группа, или циклооктилпропильная группа (включая изомеры); углеводородные группы, содержащие циклический углеводородный заместитель, такие как циклопентилме- 11024850 тильная группа, циклопентилэтильная группа, циклогексилметильная группа или циклогексилэтильная группа; арилзамещенные углеводородные группы, такие как фенилметильная группа, фенилэтильная группа, толилметильная группа, толилэтильная группа (включая изомеры), ксилилметильная группа(включая изомеры) или ксилилэтильная группа (включая изомеры), и полиоксиалкиленовые группы, такие как метоксиметильная группа, метоксиэтильная группа, метоксипропильная группа (включая изомеры), метоксибутильная группа (включая изомеры), метоксипентильная группа (включая изомеры), метоксигексильная группа (включая изомеры), этоксиметильная группа, этоксиэтильная группа, этоксипропильная группа (включая изомеры), этоксибутильная группа (включая изомеры), этоксипентильная группа (включая изомеры), этоксигексильная группа (включая изомеры) или полиоксиэтиленовая группа. Из их числа, принимая во внимание текучесть и разделение после взаимодействия, эфир карбоновой кислоты более предпочтительно представляет собой эфир карбоновой кислоты, в котором R2 в формуле(16) содержит от 1 до 8 атомов углерода. В ряду данных углеводородов наиболее предпочтительные эфиры карбоновой кислоты, в которых R2 представляет собой группу, выбранную из алкильных групп и циклоалкильных групп. Конкретные прммеры эфиров карбоновых кислот, представленных формулой(16), могут включать в себя диметилкарбонат, диэтилкарбонат, дипропилкарбонат (включая изомеры),дибутилкарбонат (включая изомеры), дипентилкарбонат (включая изомеры), дигексилкарбонат (включая изомеры), дигептилкарбонат (включая изомеры) и диоктилкарбонат (включая изомеры). Спирт. В отношении спирта, используемого в настоящем варианте осуществления, нет особенных ограничений, и он представляет собой спирт, представленный следующей формулой (17):(в котором R2 аналогичен определенному ранее для R2 в формуле (16. Несмотря на то, что в спирте,представленном формулой (17), R2 может быть алифатической углеводородной группой или ароматической углеводородной группой, предпочтительными являются спирты, в которых R2 представляет собой группу, выбранную из алкильных групп и циклоалкильных групп. Примеры таких R2 могут включать в себя алкильные группы, такие как метильная группа, этильная группа, пропильная группа (включая изомеры), бутильная группа (включая изомеры), пентильная группа (включая изомеры), гексильная группа(включая изомеры), гептильная группа (включая изомеры), октильная группа (включая изомеры), нонильная группа (включая изомеры), децильная группа (включая изомеры), додецильная группа (включая изомеры), гексадецильная группа (включая изомеры) или октадецильная группа (включая изомеры); циклоалкильные группы, такие как циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа (включая изомеры), метилциклопентильная группа, метилциклогексильная группа, метилциклогептильная группа, метилциклооктильная группа (включая изомеры), этилциклопентильная группа, этилциклогексильная группа, этилциклогептильная группа, этилциклооктильная группа (включая изомеры), пропилциклопентильная группа, пропилциклогексильная группа, пропилциклогептильная группа, пропилциклооктильная группа (включая изомеры), циклопентилметильная группа,циклогексилметильная группа, циклогептилметильная группа, циклооктилметильная группа (включая изомеры), циклопентилэтильная группа, циклогексилэтильная группа, циклогептилэтильная группа, циклооктилэтильная группа (включая изомеры), циклопентилпропильная группа, циклогексилпропильная группа, циклогептилпропильная группа или циклооктилпропильная группа (включая изомеры). Из их числа более предпочтительными являются спирты, в которых R2 в формуле (17) представляет собой алкильную группу, содержащую от 1 до 8 атомов углерода. Конкретные примеры таких спиртов могут включать в себя метанол, этанол, пропиловый спирт (включая изомеры), бутиловый спирт (включая изомеры), пентиловый спирт (включая изомеры), гексиловый спирт (включая изомеры), гептиловый спирт(включая изомеры) и октиловый спирт (включая изомеры). Кроме того, спирты, представленные следующей формулой (18), используются в другом аспекте настоящего варианта осуществления:(в которой W представляет собой линейную или разветвленную, насыщенную или ненасыщенную углеводородную группу, углеводородную группу, содержащую насыщенный или ненасыщенный циклический углеводородный заместитель, или -Y-CH2- группу (в которой Y представляет собой алкилполиалкиленовую группу, ароматическую группу или циклическую насыщенную или ненасыщенную алкиленовую группу простого эфира. В отношении спирта, представленного формулой (18), нет ограничений, и можно использовать спирты, представленные упомянутой выше формулой (17). В качестве предпочтительных примеров спиртов, представленных формулой (17), можно также предпочтительно использовать спирты, перечисленные как предпочтительные примеры в формуле (18). Несмотря на то, что они описаны далее, спирты,температура кипения которых при нормальном давлении выше, чем температура кипения воды, более предпочтительны для облегчения отделения воды, и примеры таких спиртов могут включать в себя нбутанол, 3-метилпропанол, пентиловый спирт (включая изомеры), гексиловый спирт (включая изомеры),- 12024850 гептиловый спирт (включая изомеры) и октиловый спирт (включая изомеры). Взаимодействие между соединением диалкилолова и/или соединением тетраалкилдистанноксана и эфиром карбоновой кислоты. Далее приведено объяснение в отношении взаимодействия между соединением диалкилолова и/или соединением тетраалкилдистан ноксана и эфиром карбоновой кислоты в настоящем варианте осуществления. В реакции соединения диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты композиционное соотношение данных соединений таково, что стехиометрическое соотношение соединения диалкилолова и/или соединения тетраалкилдистанноксана и эфира карбоновой кислоты предпочтительно составляет от 1:0,1 до 1:100. Хотя для того чтобы повысить скорость реакции и быстро завершить реакцию, предпочтительно использовать избыток эфира карбоновой кислоты, данную реакцию проводят при композиционном соотношении, которое предпочтительно находится в интервале от 1:0,3 до 1:50, а более предпочтительно, от 1:1 до 1:30, вследствие того, что при использовании чрезмерно большого количества эфира карбоновой кислоты реактор становится слишком большим. Несмотря на изменения в соответствии с типом и композиционным соотношением используемых реагентов, температура реакции предпочтительно находится в интервале от 20 до 250 С. Несмотря на то,что для быстрого завершения реакции реакцию предпочтительно проводят при высокой температуре,может иметь место реакция термической денатурации и так далее в ряду исходных веществ, имеющих вид соединения диалкилолова и/или соединения тетраалкилдистанноксана, и/или продуктов реакции в виде соединения диалкоксидиалкилолова и/или соединения тетраалкилдиалкоксидистанноксана, и поскольку это может привести к снижению выхода требуемого соединения в данной реакции, более предпочтительно температура реакции находится в интервале от 30 до 230 С и еще более предпочтительно в интервале от 50 до 200 С. Кроме того, в данной реакции не требуется использование катализатора. Несмотря на то, что в данной реакции не требуется использование растворителя, растворитель можно использовать для улучшения текучести или упрощения процедуры реакции. Можно использовать любой растворитель, при условии, что он не взаимодействует с исходными веществами реакции, имеющими вид соединения диалкилолова и/или соединения тетраалкилдистанноксана, и эфиром карбоновой кислоты или с продуктами реакции в виде соединения диалкоксидиалкилолова и/или соединения тетраалкилдиалкоксидистанноксана. Примеры таких растворителей включают в себя линейные, разветвленные или циклические углеводороды, содержащие от 5 до 16 атомов углерода, простые эфиры, состоящие из линейных, разветвленных, или циклических углеводородов, содержащих от 4 до 16 атомов углерода, и линейные, разветвленные, или циклические галогензамещенные углеводороды, содержащие от 1 до 16 атомов углерода. Более конкретно можно использовать линейные или циклические углеводороды, выбранные из пентана (включая изомеры), гексана (включая изомеры), гептана (включая изомеры), октана(включая изомеры), нонана (включая изомеры), декана (включая изомеры), гексадекана (включая изомеры), циклогексана, циклогептана, циклооктана, бензола, толуола, ксилола (включая изомеры) или этилбензола; простые эфиры, выбранные из диэтилового эфира, дипропилового эфира (включая изомеры),дибутилового эфира (включая изомеры), дигексилового эфира (включая изомеры), диоктилового эфира(включая изомеры) и дифенилового эфира (включая изомеры), или галогензамещенные углеводороды,выбранные из хлористого метилена, хлороформа, четыреххлористого углерода, хлорбензола, тетрахлорэтана и дихлорбензола (включая изомеры). Кроме того, в случае использования в данной реакции избытка эфира карбоновой кислоты в качестве растворителя можно также использовать избыток эфира карбоновой кислоты. Данные растворители можно использовать по отдельности или можно использовать смесь двух или более типов. Несмотря на то, что к растворителю не требуется прибавлять другие добавки, в целях регулирования текучести или регулирования скорости реакции можно прибавлять добавки. Эти добавки можно прибавлять без ограничения при условии, что они не оказывают неблагоприятного влияния на реакцию. Примеры подобных добавок включают в себя соединения, представляющие собой кислоты Льюиса, и соединения, представляющие собой основания Льюиса. Примеры подобных соединений могут включать в себя SnF2 и SnBr2. В отношении давления, при котором проводится реакция, нет особых ограничений, хотя реакцию можно проводить в условиях пониженного давления, атмосферного давления или повышенного давления, в случае проведения реакции при одновременном удалении из реакционной системы всех или части продуктов реакции в виде соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана и/или соединения, представленного XOR2, которое будет описано далее, данную реакцию предпочтительно проводят при пониженном давлении. В случае проведения реакции при пониженном давлении реакцию проводят при давлении, которое предпочтительно находится в интервале от 10 Па до 1 МПа, а более предпочтительно в интервале от 1 кПа до 0,5 МПа. Кроме того, реакцию предпочтительно проводят в атмосфере инертного газа, такого как аргон, неон или азот, и данные газы предпочтительно используют после высушивания при помощи дегидратирующей колонки и так далее. Несмотря на то, что период времени, в течение которого проводят реакцию (время удержания в случае непрерывного процесса) изменяется в зависимости от соединений и реактора, используемого в реакции, температуры и давления, и что в его отношении нет особенных ограничений, реакцию предпочтительно можно проводить в течение от 0,01 до 30 ч, а более предпочтительно в течение от 0,1 до 20 ч. Кроме того, реакцию можно завершать после подтверждения образования требуемого количества соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана. Протекание реакции можно подтверждать, отбирая пробы реакционной жидкости из реактора и подтверждая количество образовавшегося соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана при помощи анализа с использованием такого метода, как ЯМР 119Sn или газовая хроматография. Например, реакцию можно завершать, как только образовалось 10% или более соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана из расчета на количество моль соединения диалкилолова и/или соединения тетраалкилдистанноксана, или реакцию можно завершать после ее продолжения до тех пор, пока данное значение не достигнет 90% или более. Кроме того, хотя в реакции соединения диалкоксида диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты R2OCOOR2 образуется также соединение XOR2, которое будет описано далее, реакцию можно также завершать после подтверждения получения требуемых количеств данных соединений, проводя количественную оценку их количеств при помощи известного метода, такого, как газовая хроматография, или жидкостная хроматография. В отношении реактора, используемого для каждой реакции в настоящем варианте осуществления,нет особенных ограничений, и можно использовать известный реактор. Например, для использования можно подходящим образом объединить стандартные реакторы, примеры которых могут включать в себя реакционный аппарат с мешалкой, герметизованный реакционный аппарат с мешалкой, разгерметизованный реакционный аппарат с мешалкой, колоночный реактор, ректификационную колонну, насадочную ректификационную колонну и дистиллятор для перегонки в тонких пленках. В отношении материала реактора также нет особых ограничений, и можно использовать известный материал. Например, можно использовать реактор, изготовленный из стекла, нержавеющей стали, углеродистой стали или сплава Хастеллой, или реактор, изготовленный из материала основы со стеклянной футеровкой, или реактор с покрытием из Teflon. Поскольку есть случаи, когда в зависимости от стадии и условий, может оказаться значительной коррозия, вызванная кислотой, можно подходящим образом выбрать реактор, изготовленный из стекла, реактор со стеклянной футеровкой, реактор с покрытием из Teflon или реактор, изготовленный из сплава Хастеллой. Взаимодействие между соединением диалкилолова и/или соединением тетраалкилдистанноксана и спиртом. Далее приведено объяснение в отношении взаимодействия соединения диалкилолова и/или соединения тетраалкилдистанноксана со спиртом. В реакции соединения диалкилолова и/или соединения тетраалкилдистанноксана со спиртом композиционное соотношение данных соединений таково, что стехиометрическое соотношение соединения диалкилолова и/или соединения тетраалкилдистанноксана и спирта предпочтительно составляет от 1:0,1 до 1:100. Хотя для увеличения скорости реакции и быстрого завершения реакции предпочтительно использовать избыток спирта, реакцию проводят при композиционном соотношении, которое предпочтительно находится в интервале от 1:0,3 до 1:50, а более предпочтительно от 1:1 до 1:30, вследствие того,что при использовании чрезмерно большого избытка спирта реактор становиться слишком большой. Несмотря на изменение в зависимости от типов и композиционного соотношения используемых реагентов, температура реакции предпочтительно находится в интервале от 20 до 250 С. Хотя для быстрого завершения реакции данную реакцию предпочтительно проводят при высокой температуре, в случае чрезмерно высокой температуры может произойти реакция термической денатурации и так далее, в ряду исходных веществ реакции, имеющих вид соединения диалкилолова и/или соединения тетраалкилдистанноксана, и продуктов реакции в виде соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана, и поскольку это может привести к снижению выхода требуемого соединения в данной реакции, температура реакции более предпочтительно находится в интервале от 30 до 230 С, а еще более предпочтительно в интервале от 50 до 200 С. Кроме того, в данной реакции не требуется использование катализатора. Несмотря на то, что в данной реакции не требуется использовать растворитель, растворитель можно использовать в целях улучшения текучести или облегчения процедуры реакции. Можно использовать любой растворитель при условии, что он не взаимодействует с исходными соединениями реакции, имеющими вид соединения диалкилолова и/или соединения тетраалкилдистанноксана, и эфиром карбоновой кислоты, или с продуктами реакции в виде соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана. Примеры таких растворителей могут включать в себя линейные, разветвленные или циклические углеводороды, содержащие от 5 до 16 атомов углерода, простые эфиры,состоящие из линейных, разветвленных или циклических углеводородов, содержащих от 4 до 16 атомов углерода, и линейные, разветвленные или циклические галогензамещенные углеводороды, содержащие от 1 до 16 атомов углерода. Более конкретно, можно использовать линейные или циклические углеводороды, выбранные из пентана (включая изомеры), гексана (включая изомеры), гептана (включая изомеры),октана (включая изомеры), нонана (включая изомеры), декана (включая изомеры), гексадекана (включая изомеры), циклогексана, циклогептана, циклооктана, бензола, толуола, ксилола (включая изомеры) или этилбензола; простые эфиры, выбранные из диэтилового эфира, дипропилового эфира (включая изомеры), дибутилового эфира (включая изомеры), дигексилового эфира (включая изомеры), диоктилового эфира (включая изомеры) и дифенилового эфира (включая изомеры); или галогензамещенные углеводороды, выбранные из хлористого метилена, хлороформа, четыреххлористого углерода, хлорбензола, тетрахлорэтана и дихлобензола (включая изомеры). Кроме того, в случае использования в данной реакции избытка спирта в качестве растворителя можно также использовать избыток спирта. Данные растворители можно использовать по отдельности или в виде смеси двух или более типов. Хотя к растворителю не требуется прибавлять другие добавки, в целях регулирования текучести или регулирования скорости реакции можно прибавлять добавки. Эти добавки можно прибавлять без ограничения при условии, что они не оказывают неблагоприятного влияния на реакцию. Примеры подобных добавок включают в себя соединения, представляющие собой кислоты Льюиса и соединения,представляющие собой основания Льюиса. Примеры подобных соединений могут включать в себя SnF2 иSnBr2. В отношении давления, при котором проводится реакция, нет особых ограничений, и хотя реакцию можно проводить в условиях пониженного давления, атмосферного давления или повышенного давления, в случае проведения реакции при удалении из реакционной системы всех или части продуктов реакции в виде соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана и/или соединения, представленного XOR2, которое будет описано далее, данную реакцию предпочтительно проводят при пониженном давлении. В случае проведения реакции при пониженном давлении реакцию проводят при давлении, которое предпочтительно находится в интервале от 10 Па до 1 МПа, а более предпочтительно в интервале от 1 кПа до 0,5 МПа. Кроме того, реакцию предпочтительно проводят в атмосфере инертного газа, такого как аргон, неон или азот, и данные газы предпочтительно используют после высушивания при помощи дегидратирующей колонки и так далее. Несмотря на то, что период времени, в течение которого проводят реакцию (время удержания в случае непрерывного процесса) изменяется в зависимости от соединений и реактора, используемого в реакции, температуры и давления, и в его отношении нет особенных ограничений, реакцию можно предпочтительно проводить в течение от 0,01 до 30 ч, а более предпочтительно в течение от 0,1 до 20 ч. Кроме того, реакцию можно завершать после подтверждения образования требуемого количества соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана. Глубину протекания реакции можно подтверждать, отбирая пробы реакционной жидкости из реактора и подтверждая количество образовавшегося соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана анализом при помощи такого метода, как ЯМР 119Sn, или газовой хроматографией. Например, реакцию можно завершать, как только образовалось 10% или более соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана из расчета на количество молей соединения диалкилолова и/или соединения тетраалкилдистанноксана, или реакцию можно завершать после продолжения до тех пор, пока данное значение не достигнет 90% или более. Кроме того, хотя в реакции между соединением диалкилолова и/или соединением тетраалкилдистанноксана и спиртом R2OH также образуется соединение, представленное формулой XOR2, которое будет описано далее, реакцию можно также завершать после подтверждения получения требуемых количеств данных соединений, проводя количественную оценку их количеств при помощи известного метода, такого как газовая хроматография или жидкостная хроматография. Альтернативным образом, поскольку в данной реакции в качестве побочного продукта, помимо соединения, представленного формулой XOR2, образуется также вода, реакцию, кроме того, можно завершить, подтверждая, что образовалось количество воды, пропорциональное количеству образовавшегося требуемого соединения, проводя количественную оценку количества воды с использованием влагомера Карла Фишера и так далее. В отношении реактора, используемого для каждой реакции в настоящем варианте осуществления,нет особенных ограничений, и можно использовать известный реактор. Например, для использования можно подходящим образом объединить стандартные реакторы, примеры которых могут включать в себя реакционный аппарат с мешалкой, герметизованный реакционный аппарат с мешалкой, разгерметизованный реакционный аппарат с мешалкой, колоночный реактор, ректификационную колонну, насадочную ректификационную колонну и дистиллятор для перегонки в тонких пленках. В отношении материала реактора также нет особых ограничений, и можно использовать известный материал. Например, можно использовать реактор, изготовленный из стекла, нержавеющей стали, углеродистой стали или сплава Хастеллой, или реактор, изготовленный из основного материла со стеклянной футеровкой, или реактор с покрытием из Teflon. Поскольку есть случаи, когда в зависимости от стадии и условий может оказаться значительной коррозия, вызванная кислотой, можно подходящим образом выбрать реактор, изготовленный из стекла, реактор со стеклянной футеровкой, реактор с покрытием из Teflon или реактор, изготовленный из сплава Хастеллой. При получении указанного выше соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана можно осуществлять либо реакцию соединения диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты, либо реакцию соединения диалкилолова и/или соединения тетраалкилдистанноксана со спиртом, либо можно одновременно осуществлять обе реакции. Соединение диалкоксида диалкилолова. Следующее объяснение представляет собой объяснение в отношении соединения диалкоксида диалкилолова, полученного в результате описанного ранее способа получения. Соединение диалкоксида диалкилолова представляет собой соединение, содержащее один атом олова, две связи Sn-R1 и две связи Sn-OR2, и представлено следующей формулой (19):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, которая образуется из соединения диалкилолова и/или соединения тетраалкилдистанноксана, а каждый R2 независимо представляет собой углеводородную группу, которая образуется из эфира карбоновой кислоты и/или спирта). Конкретные примеры соединений, представленных формулой (19), могут включать в себя диметилдиметоксиолово, диметилдиэтоксиолово, диметилдипропоксиолово (включая изомеры), диметилдибутоксиолово (включая изомеры), диметилдипентилоксиолово (включая изомеры), диметилдигексилоксиолово (включая изомеры), диметилдигептилоксиолово (включая изомеры), диметилдиоктилоксиолово(включая изомеры), дибутилдибутоксиолово (включая изомеры), дибутилдипентилоксиолово (включая изомеры), дибутилдигексилоксиолово (включая изомеры), дибутилдигептилоксиолово (включая изомеры), дибутилдиоктилоксиолово (включая изомеры), дибутилдифеноксиолово (включая изомеры), дибутилди(метилфенокси)олово (включая изомеры), дибутилди(этилфенокси)олово (включая изомеры), дибутил-бис(диметилфенокси)олово (включая изомеры), дибутилди(фенилметокси)олово, дибутилди(фенилэтокси)олово (включая изомеры), дибутилди(метилфенилметокси)олово (включая изомеры),диоктилдиметоксиолово, диоктилдиэтоксиолово, диоктилдипропоксиолово (включая изомеры), диоктилдибутоксиолово (включая изомеры), диоктилдипентилоксиолово (включая изомеры), диоктилдигексилоксиолово (включая изомеры), диоктилдигептилоксиолово (включая изомеры), диоктилдиоктилоксиолово (включая изомеры), диоктилдифеноксиолово (включая изомеры), диоктилди(метилфенокси)олово (включая изомеры), диоктилди(этилфенокси)олово (включая изомеры), диоктилбис(диметилфенокси)олово (включая изомеры), диоктилди(фенилметокси)олово (включая изомеры), диоктилди(фенилэтокси)олово (включая изомеры) и диоктилди(метилфенилметокси)олово (включая изомеры). Соединение тетраалкилдиалкоксидистанноксана. Далее приведено объяснение в отношении соединения тетраалкилдиалкоксидистанноксана, полученного в результате описанного ранее способа получения. Соединение тетраалкилдиалкоксидистанноксана представляет собой соединение тетраалкилдиалкоксидистанноксана, содержащее одну связь Sn-O-Sn, где каждый атом олова соединения тетраалкилдиалкоксидистанноксана образует две связи Sn-R1 и одну связь Sn-OR2, а более конкретно представлено следующей формулой (20):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, которая образуется из соединения тетраалкилдистанноксана и/или соединения диалкилолова, а каждый R2 независимо представляет собой алкильную группу, которая образуется из эфира карбоновой кислоты и/или спирта). Конкретные примеры соединений, представленных формулой (20), могут включать в себя 1,1,3,3 тетраметил-1,3-диэтоксидистанноксан, 1,1,3,3-тетраметил-1,3-дипропоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3-дибутилоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3-дипентилоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3-дигексилоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3-дигептилоксидистанноксан (включая изомеры), 1,1,3,3-тетраметил-1,3- 16024850(включая изомеры), 1,1,3,3-тетраоктил-1,3-дигептилоксидистанноксан (включая изомеры), 1,1,3,3 тетраоктил-1,3-диоктилоксидистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(фенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(метилфенокси)дистанноксан (включая изомеры),1,1,3,3-тетраоктил-1,3-бис(диметилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3 ди(этилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(фенилметокси)дистанноксан (включая изомеры), 1,1,3,3-тетрабоктил-1,3-ди(фенилэтокси)дистанноксан (включая изомеры) и 1,1,3,3-тетраоктил-1,3-ди(метилфенилметокси)дистанноксан (включая изомеры). Несмотря на то, что они были описаны ранее, оловоорганические соединения обычно легко принимают ассоциированную структуру. Например, известно, что соединения диалкоксида диалкилолова образуют димерную структуру, тогда как о соединениях тетраалкилдиалкоксидистанноксана известно, что они существуют, образуя ступенчатые структуры, в которых связаны две или три молекулы. Даже в тех случаях, когда подобные ассоциированные состояния изменяются, у специалистов в данной области принято представлять данные соединения в виде их мономерной структуры. Соединение XOR2. Кроме того, в упомянутом выше способе получения, помимо соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана, образуется соединение, представленное следующей формулой (21):(в которой X представляет собой группу, полученную из соединения диалкилолова и/или соединения тетраалкилдистанноксана,R2 представляет собой алкильную группу, полученную из эфира карбоновой кислоты и/или спирта,а О является атомом кислорода). В приведенной выше формуле (21) ОХ группа является группой, полученной из соединения диалкилолова и/или соединения тетраалкилдистанноксана, используемого в данной реакции, а в случае использования соединения диалкилолова, представленного описанной ранее формулой (14), ОХ группа является группой, полученной из группы ОХ 1, или группы ОХ 2, тогда как в случае использования соединения тетраалкилдистанноксана, представленного описанной ранее формулой (15), ОХ группа является группой, полученной из группы ОХ 3 или группы ОХ 4. Кроме того, в приведенной выше формуле (21) группа R2 является группой, полученной из эфира карбоновой кислоты и/или спирта, используемого в данной реакции, а в случае использования карбонового эфира, представленного формулой R2OCOOR2, группа R2 является группой, полученной из группыR2, которая является составляющей эфира карбоновой кислоты, тогда как в случае использования спирта,представленного формулой R2OH, группа R2 является группой, полученной из группы R2, которая является составляющей спирта. Более конкретно, в том случае, когда ОХ группа является ацилоксигруппой, соединение, представленное формулой (21), представляет собой соединение сложного эфира и эквивалентно таким соединениям, как этилацетат, пропилацетат (включая изомеры), бутилацетат (включая изомеры), пентилацетат(включая изомеры), гептилвалерат (включая изомеры), октилвалерат (включая изомеры), этиллаурат,пропиллаурат (включая изомеры), бутиллаурат (включая изомеры), пентиллаурат (включая изомеры),гексиллаурат (включая изомеры), гептиллаурат (включая изомеры), или октиллаурат (включая изомеры). Соединение диалкоксида диалкилолова и/или соединение тетраалкилдиалкоксидистанноксана можно получить из соединения диалкилолова и/или соединения тетраалкилдистанноксана указанным выше способом. В это же время, требуемое соединение диалкоксида диалкилолова и/или соединение тетраалкилдиалкоксидистанноксана можно получить непосредственно реакцией соединения диалкилолова и/или соединения тетраалкилдистанноксана с эфиром карбоновой кислоты и/или спиртом, или первое соединение диалкоксида диалкилолова и/или первое соединение тетраалкилдиалкосидистанноксана можно получить, вводя во взаимодействие соединение диалкилолова и/или соединение тетраалкилдистанноксана с первым эфиром карбоновой кислоты и/или первым спиртом с последующим получением требуемого второго соединения диалкоксида диалкилолова и/или второго соединения тетраалкилдиалкоксидистанноксана при взаимодействии первого соединения диалкоксида диалкилолова и/или первого соединения тетраалкилдиалкоксидистанноксана со вторым эфиром карбоновой кислоты и/или вторым спиртом. В приведенном выше разъяснении объяснен способ настоящего варианта осуществления получения соединения, представленного формулой XOR2, и соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана при взаимодействии соединения алкилолова с эфиром карбоновой кислоты и/или спиртом. Кроме того, стадию осуществления данного способа получения определяют как стадию (Z). Этот способ получения можно предпочтительно использовать в способе получения эфира карбоновой кислоты с использованием соединения диалкоксида диалкилолова. Далее приведено объяснение способа получения эфира карбоновой кислоты, который объединяет в себе данный способ получения. Способ получения соединения диалкилолова/соединения тетраалкилдистанноксана. В способе получения соединения диалкилолова и соединения тетраалкилдистанноксана настоящего варианта осуществления предпочтительно используют соединение диалкилолова и соединение тетраалкилдистанноксана, полученное согласно способу, который включает в себя стадию (1) и стадию (2),разъясненные ниже: стадия (1): взаимодействие композиции алкилолова, содержащей соединение алкоксида моноалкилолова и соединение алкоксида триалкилолова, образованные с алкильной группой, которые получены реакцией диспропорционирования по меньшей мере одного соединения алкоксида алкилолова, выбранного из группы, включающей в себя соединение диалкоксида диалкилолова, содержащее один атом олова, две связи Sn-R1 и две связи Sn-OR2, и/или соединение тетраалкилдиалкоксидистанноксана, содержащее одну связь Sn-O-Sn, где каждый атом олова в соединении тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OR2 (где две группы R1, связанные с атомом олова, диспропорционированы между двумя молекулами в случае соединения алкоксида диалкилолова, или диспропорционированы внутримолекулярно и/или межмолекулярно в случае соединения тетраалкилдиалкоксидистанноксана, с тем, чтобы превратиться в соединение алкоксида моноалкилолова, содержащее одну связь Sn-R1, и соединение алкоксида триалкилолова, содержащее три связи Sn-R1), с кислотой, представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8) и/или ангидридом кислоты, представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8), для получения смеси оловоорганических соединений, содержащих группу (ОХ группу), полученную из данной кислоты и/или ангидрида кислоты; и стадия (2): проведения реакции перераспределения алкильных групп при термической обработке смеси оловоорганических соединений, полученных на стадии (1), для получения из соединения алкоксида моноалкилолова и соединения алкоксида триалкилолова в композиции алкилолова по меньшей мере одного соединения алкилолова, выбранного из группы, включающей в себяi) соединение диалкилолова, содержащее один атом олова, при этом данный атом олова образует две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8), иii) соединение тетраалкилдистанноксана, содержащее одну связь Sn-O-Sn, где каждый атом олова в соединении тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ представляет собой группу, в которой НОХ, являющаяся сопряженной кислотой для ОХ, представляет собой кислоту Бренстеда с рКа от 0 до 6,8). Реакция диспропорционирования алкильных групп. Сначала приведено объяснение в отношении реакции диспропорционирования алкильных групп в соединении алкоксида алкилолова, приведенной выше стадии (1). Используемое здесь соединение алкоксида алкилолова относится к разъясненному ранее соедине- 18024850 нию диалкоксида диалкилолова и/или соединению тетраалкилдиалкоксидистанноксана, а более конкретно, относится к соединению диалкилолова, представленному следующей формулой (22), и/или соединению тетраалкилдиалкоксидистанноксана, представленному следующей формулой (23):(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, которая образуется из соединения диалкилолова и/или соединения тетраалкилдистанноксана, а каждый R2 независимо представляет собой углеводородную группу, которая образуется из эфира карбоновой кислоты и/или спирта).(в которой каждый R1 независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода, которая образуется из соединения тетраалкилдистанноксана и/или соединения диалкилолова, а каждый R2 независимо представляет собой углеводородную группу, которая образуется из эфира карбоновой кислоты и/или спирта). Конкретные примеры соединений, представленных формулой (22), могут включать в себя диметилдиметоксиолово, диметилдиэтоксиолово, диметилдипропоксиолово (включая изомеры), диметилдибутоксиолово (включая изомеры), диметилдипентилоксиолово (включая изомеры), диметилдигексилоксиолово (включая изомеры), диметилдигептилоксиолово (включая изомеры), диметилдиоктилоксиолово(включая изомеры), 1,1,3,3-тетраоктил-1,3-дигептилоксидистанноксан (включая изомеры), 1,1,3,3 тетраоктил-1,3-диоктилоксидистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(фенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(метилфенокси)дистанноксан (включая изомеры),1,1,3,3-тетраоктил-1,3-бис(диметилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3 ди(этилфенокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(фенилметокси)дистанноксан (включая изомеры), 1,1,3,3-тетраоктил-1,3-ди(фенилэтокси)дистанноксан (включая изомеры) и 1,1,3,3-тетраоктил-1,3-ди(метилфенилметокси)дистанноксан (включая изомеры). Несмотря на то, что они были описаны ранее, оловоорганические соединения обычно легко принимают ассоциированную структуру. Например, известно, что соединения диалкоксида диалкилолова образуют димерную структуру, тогда как о соединениях тетраалкилдиалкоксидистанноксана известно, что они существуют, образуя ступенчатые структуры, в которых связаны две или три молекулы. Даже в тех случаях, когда подобные ассоциированные состояния изменяются, у специалистов в данной области принято представлять данные соединения в виде их мономерной структуры. Реакция диспропорционирования алкильных групп в соединении алкоксида алкилолова упомянутой выше стадии (1) относится к реакции, в которой две группы R1 (где R1 представляет собой алкильную группу), связанные с атомом олова, диспропорционируют между двумя молекулами в случае соединения алкоксида диалкилолова или диспропорционируют внутримолекулярно и/или межмолекулярно в случае соединения тетраалкилдиалкоксидистанноксана с тем, чтобы превратиться в соединение алкоксида моноалкилолова, содержащего одну связь Sn-R1, и соединение алкоксида триалкилолова, содержащего три связи Sn-R1. Например, в случае соединения тетраалкилдиалкоксидистанноксана предполагается, что происходит реакция диспропорционирования алкильных групп, представленная следующей формулой (24), тогда как в случае соединения диалкоксида диалкилолова предполагается, что происходит реакция диспропорционирования алкильных групп, представленная следующей формулой (25):(где каждый R и R' независимо представляет собой линейную или разветвленную алкильную группу,содержащую от 1 до 12 атомов углерода). Несмотря на то, что сложно идентифицировать структуры всех продуктов реакции диспропорционирования алкильных групп, по меньшей мере один из продуктов представляет собой соединение алкоксида триалкилолова, представленное ниже. Например, во многих случаях соединение алкоксида триалкилолова, представленное следующей формулой (26), образуется примерно в половинном количестве в выражении через его стехиометрическое соотношение относительно уменьшения количества соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана в данной реакции диспропорционирования алкильных групп. В соединении алкоксида триалкилолова, на которое ссылаются в настоящем варианте осуществления, имеется три связи Sn-R1, а алкильная группа R1 представляет собой алкильную группу, полученную из соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана.(в которой каждый R1 независимо представляет собой алкильную группу, которая образуется из соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана, а каждый R2 представляет собой алкильную группу, которая образуется из соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана). Примеры соединений алкоксида триалкилолова, представленных формулой (26), могут включать в себя соединения триалкилалкоксиолова, такие как триметилметоксиолово, триметилэтоксиолово, триметилпропоксиолово (включая изомеры), триметилбутоксиолово (включая изомеры), триметилпентилоксиолово (включая изомеры), триметилгексилоксиолово (включая изомеры), триметилгептилоксиолово бутилбутоксиолово (включая изомеры), октилдибутилпентилоксиолово (включая изомеры), октилдибутилгексилоксиолово (включая изомеры), октилдибутилгептилоксиолово (включая изомеры), октилдибутилоктилоксиолово (включая изомеры), диоктилбутилметоксиолово (включая изомеры), диоктилбутилэтоксиолово (включая изомеры), диоктилбутилпропоксиолово (включая изомеры), диоктилбутилбутоксиолово (включая изомеры), диоктилбутилпентилоксиолово (включая изомеры), диоктилбутилгексилоксиолово (включая изомеры), диоктилбутилгептилоксиолово (включая изомеры), диоктилбутилоктилоксиолово (включая изомеры), триоктилметоксиолово (включая изомеры), триоктилэтоксиолово (включая изомеры), триоктилпропоксиолово (включая изомеры), триоктилбутоксиолово (включая изомеры), триоктилпентилоксиолово (включая изомеры), триоктилгексилоксиолово (включая изомеры), триоктилгептилоксиолово (включая изомеры) или триоктилоктилоксиолово (включая изомеры). Как было описано ранее, поскольку соединение алкоксида триалкилолова образуется в результате реакции диспропорционирования алкильных групп, предполагается, что соединение алкоксида моноалкилолова, содержащее одну связь Sn-R1, образуется одновременно с соединением алкоксида триалкилолова, показанным в приведенной выше формуле (22) и/или формуле (23), принимая во внимание баланс алкильных групп. Примеры подобных соединений алкоксида моноалкилолова могут включать в себя оксиды моноалкилалкоксиолова, такие как оксид метилметоксиолова, оксид метилэтоксиолова, оксид метилпропоксиолова (включая изомеры), оксид метилбутилоксиолова (включая изомеры), оксид метилпентилоксиолова (включая изомеры), оксид метилгексилоксиолова (включая изомеры), оксид метилгептилоксиолова (включая изомеры), оксид метилоктилоксиолова (включая изомеры), оксид бутилметоксиолова (включая изомеры), оксид бутилэтоксиолова, оксид бутилпропоксиолова (включая изомеры),оксид бутилбутилоксиолова (включая изомеры), оксид бутилпентилоксиолова (включая изомеры), оксид бутилгексилоксиолова (включая изомеры), оксид бутилгептилоксиолова (включая изомеры), оксид бутилоктилоксиолова (включая изомеры), оксид октилметоксиолова (включая изомеры), оксид октилэтоксиолова, оксид октилпропоксиолова (включая изомеры), оксид октилбутилоксиолова (включая изомеры),оксид октилпентилоксиолова (включая изомеры), оксид октилгексилоксиолова (включая изомеры), оксид октилгептилоксиолова (включая изомеры) или оксид октилоктилоксиолова (включая изомеры); и моноалкилтриалкоксиолово, такое как метилтриметоксиолово, метилтриэтоксиолово, метилтрипропоксиолово(включая изомеры), октилтрибутоксиолово (включая изомеры), октилтрипентилоксиолово (включая изомеры), октилтригексилоксиолово (включая изомеры), октилтригептилоксиолово (включая изомеры) или октилтриоктилоксиолово (включая изомеры). Несмотря на то, что структуру соединения алкоксида моноалкилолова сложно охарактеризовать помимо того, что в нем содержится "одна связь Sn-R1", как описано ранее, его можно охарактеризовать величиной его химического сдвига, определенного методом ЯМР 119Sn. А именно, по меньшей мере один тип соединения, полученного в результате реакции диспропорционирования алкильных групп соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана, представляет собой соединение алкоксида моноалкилолова, а данное соединение алкоксида моноалкилолова характеризуется за счет детектирования атома олова, химический сдвиг которого проявляется в области от -220 до-610 м.д. относительно тетраметилолова при анализе методом ЯМР 119Sn в растворе дейтерированного хлороформа. А именно, в продуктах реакции диспропорционирования алкильных групп содержится соединение алкоксида триалкилолова, содержащее три связи Sn-R1, и соединение алкоксида моноалкилолова, содержащее одну связь Sn-R1, и химический сдвиг соединения алкоксида моноалкилолова проявляется в области от -220 до -610 м.д. относительно тетраметилолова при анализе методом ЯМР 119Sn в растворе дейтерированного хлороформа. В настоящем варианте осуществления композицию, содержащую соединение алкоксида триалкилолова и соединение алкоксида моноалкилолова, называют "композицией алкилолова". Во многих случаях соединение диалкоксида диалкилолова, представленное формулой (22), и соединение тетраалкилдиалкоксидистанноксана, представленное формулой (23), содержат атом олова, химический сдвиг которого проявляется в области от 200 до -200 м.д. относительно тетраметилолова при анализе методом ЯМР 119Sn в растворе дейтерированного хлороформа, а в результате реакции диспропорционирования алкильных групп в соединении диалкоксида диалкилолова и соединении тетраалкилдиалкоксидистанноксана детектируют атом олова, химический сдвиг которого проявляется в описанном выше интервале от -220 до -610 м.д. Практически во всех случаях помимо оксида моноалкилалкоксиолова и моноалкилтриалкоксиолова, представленных формулой (24) и/или формулой (25), предполагается,что продукт реакции диспропорционирования алкильных групп во многих случаях содержит также другие структуры, поскольку продукт реакции диспропорционирования алкильных групп проявляется в ви- 22024850 де большого количества сигналов в интервале от -220 до -610 м.д. Хотя некий продукт реакции диспропорционирования алкильных групп состоит из соединений, структура которых неизвестна при таком способе, данные соединения с неизвестной структурой могут содержаться в композиции алкилолова,используемой на стадии (1), не вызывая проблем. Кроме того, также нет сложностей, связанных с соединением диалкоксида диалкилолова и/или соединением тетраалкилдиалкоксидистанноксана, которые содержатся в композиции алкилолова. Предполагается, что продукт, образующийся в результате реакции диспропорционирования алкильных групп в соединении диалкоксида диалкилолова и/или соединении тетраалкилдиалкоксидистанноксана, легко принимает структуру, отличающуюся от указанных выше примеров. Более того, в результате образования станноксанового каркаса может получиться соединение, содержащее звено, в котором с атомом олова связаны две алкильные группы, и звено, в котором с атомом олова связано целое число алкильных групп, отличающееся от двух. Предполагаемые структуры продуктов, образующихся в результате реакции диспропорционирования алкильных групп, приведены ниже вместе с примерами, описанными ранее(в которых каждый R1 независимо представляет собой алкильную группу, которая образуется из соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана, и каждый R2 независимо представляет собой алкильную группу, которая образуется из соединения диалкоксида диалкилолова и/или соединения тетраалкилдиалкоксидистанноксана). Как описано ранее, хотя композиция алкилолова, используемая в настоящем варианте осуществления, относится к композиции, содержащей соединение алкоксида триалкилолова и соединение алкоксида моноалкилолова, она может представлять собой композицию, состоящую, по существу, из соединения алкоксида триалкилолова и соединения алкоксида моноалкилолова, или она может представлять собой композицию, содержащую также соединение тетраалкилдиалкоксидистанноксана и соединение диалкоксида диалкилолова. Кроме того, в ней также может содержаться продукт, образующийся в результате описанной ранее реакции диспропорционирования алкильных групп. Композиция алкилолова, предпочтительно используемая в настоящем варианте осуществления,представляет собой композицию алкилолова, содержащую в выражении через мол.%, 10 мол.% или более, предпочтительно 30 мол.% или более, а более предпочтительно 50 мол.% или более соединения в композиции алкилолова, в котором количество алкильных групп, связанных с атомом олова, представляет собой число, отличающееся от 2, из расчета на общее количество моль атомов олова, содержащихся в композиции алкилолова. В зависимости от случая, хотя в композиции алкилолова может содержаться соединение диалкоксида диалкилолова, соединение тетраалкилдиалкоксидистанноксана, тетраалкилолово, гексаалкилдистанноксан или оксид олова (S) и так далее, данные соединения могут содержаться без проблем при условии, что они содержатся в количестве, которое не будет препятствовать цели настоящего изобретения. Кроме того, можно также использовать композицию, в которой композиция, содержащая соединение алкоксида триалкилолова, и композиция, содержащая соединение алкоксида моноалкилолова, отделены от композиции алкилолова. В качестве метода разделения можно использовать различные известные методы. Например, можно использовать по меньшей мере один из методов, выбранных из группы,включающей в себя разделение перегонкой, разделение экстракцией и мембранное разделение, а особенно предпочтительно использовать разделение перегонкой. Стадия (1) представляет собой стадию взаимодействия описанной выше композиции алкилолова с кислотой, представленной общей формулой НОХ (кислота Бренстеда с рКа от 0 до 6,8) и/или ангидридом кислоты, представленным общей формулой ХОХ (где ОХ представляет собой группу, в которой сопряженная кислота для ОХ в виде НОХ является кислотой Бренстеда с рКа от 0 до 6,8), с образованием смеси оловоорганических соединений, содержащих группу (ОХ группу), которая получена из кислоты и/или ангидрида кислоты. На стадии (1) в качестве кислоты, представленной общей формулой НОХ, предпочтительно используют органическую кислоту. Несмотря на то, что примеры органических кислот могут включать в себя карбоновую кислоту, сульфоновую кислоту и фенольную кислоту, предпочтительно используют карбоновую кислоту. Примеры карбоновых кислот могут включать в себя соединения насыщенных или ненасыщенных алифатических монокарбоновых кислот, таких как муравьиная кислота, уксусная кислота,пропионовая кислота, н-масляная кислота, изомасляная кислота, валериановая кислота, изовалериановая кислота, 2-метилбутановая кислота, пивалевая кислота, гексановая кислота, изокапроевая кислота, 2 этилбутановая кислота, 2,2-диметилбутановая кислота, гептановая кислота (включая изомеры), октановая кислота (включая изомеры), нонановая кислота (включая изомеры), декановая кислота (включая изомеры), ундекановая кислота (включая изомеры), додекановая кислота (включая изомеры), тетрадекановая кислота (включая изомеры), гексадекановая кислота (включая изомеры), акриловая кислота, кротоновая кислота, изокротоновая кислота, винилуксусная кислота, метакриловая кислота, ангеликовая кислота, тиглиновая кислота, аллилуксусная кислота или ундеценовая кислота (включая изомеры); насыщенную или ненасыщенную алифатическую дикарбоновую кислоту, такую как щавелевая кислота, малоновая кислота, янтарная кислота, глутаровая кислота, адипиновая кислота, гептандикарбоновая кислота (включая изомеры), октандикарбоновая кислота (включая изомеры), нонандикарбоновая кислота(включая изомеры), декандикарбоновая кислота (включая изомеры), малеиновая кислота, фумаровая кислота, метилмалеиновая кислота, метилфумаровая кислота, пентендикарбоновая кислота (включая изомеры), итаконовая кислота, или аллилмалоновая кислота; соединения насыщенных или ненасыщенных трикарбоновых кислот, такие как 1,2,3-пропантрикарбоновая кислота, 1,2,3-пропентрикарбоновая кислота или 2,3-диметилбутан-1,2,3-трикарбоновая кислота; соединения ароматических карбоновых кислот,такие как бензойная кислота, метилбензойная кислота (включая изомеры), этилбензойная кислота (включая изомеры), пропилбензойная кислота (включая изомеры), диметилбензойная кислота (включая изомеры) или триметилбензойная кислота (включая изомеры); соединения ароматических дикарбоновых кислот, такие как фталевая кислота, изофталевая кислота, терефталевая кислота, или метилизофталевая кислота (включая изомеры); и соединения ароматических трикарбоновых кислот, такие как гемимеллитовая кислота, тримеллитовая кислота или тримезиновая кислота. В ряду данных карбоновых кислот предпочтительно используют насыщенные монокарбоновые кислоты, при этом более предпочтительно используют насыщенные монокарбоновые кислоты со стандартной температурой кипения, составляющей 300 С или менее, а еще более предпочтительно используют насыщенные монокарбоновые кислоты со стандартной температурой кипения, составляющей 250 С или менее. Стандартная температура кипения относится к температуре кипения при 1 атм, как описано в Encyclopedia Chimica (Kyoritsu PublishingCo., Ltd.). Более конкретно, предпочтительно используют уксусную кислоту, пропионовую кислоту, нмасляную кислоту, изомасляную кислоту, валериановую кислоту, изовалериановую кислоту, 2 метилбутанкарбоновую кислоту, пивалевую кислоту или гексанкарбоновую кислоту. Кроме того, на стадии (1) примеры ангидридов кислот, представленные общей формулой ХОХ, могут включать в себя алифатические ангидриды, такие как уксусный ангидрид, пропионовый ангидрид,масляный ангидрид, изомасляный ангидрид, валериановый ангидрид, изовалериановый ангидрид, янтарный ангидрид, малеиновый ангидрид, пропионовый ангидрид или глутаровый ангидрид; и ароматические ангидриды, такие как бензойный ангидрид, фталевый ангидрид или пиромеллитовый ангидрид. Из их числа предпочтительно используют ангидриды кислот со стандартной температурой кипения, составляющей 300 С или менее, а для облегчения удаления избытка ангидрида кислоты после реакции более предпочтительно используют ангидриды кислот со стандартной температурой кипения, составляющей 200 С или менее. Кроме того, с точки зрения облегчения удаления побочных продуктов, таких как эфиры карбоновых кислот, и простоты промышленного получения, предпочтительными являются малеиновый ангидрид и уксусный ангидрид. Несмотря на то, что данные кислоты и ангидриды кислот можно использовать по отдельности или смешивая большое количество типов, в случае использования кислоты во многих случаях при взаимодействии кислоты с композицией алкилолова происходит образование воды. Для удаления воды можно осуществить разделение перегонкой или мембранное разделение или можно использовать дегидратирующий агент. Кроме того, предпочтительным является объединенное использование ангидрида кислоты в качестве дегидратирующего агента. Более того, поскольку во многих случаях в результате реакции композиции алкилолова с ангидридом кислоты не происходит образование воды, в случае использования лишь ангидрида кислоты, предпочтительным является метод, в котором используется только ангидрид кислоты. Далее приведено объяснение реакции на стадии (1). Количество используемой кислоты и/или ангидрида кислоты предпочтительно находится в интервале от 0,1 до 50-кратного избытка в выражении через стехиометрическое соотношение из расчета на количество атомов олова, содержащихся в композиции алкилолова, принимая во внимание скорость реакции и конечный выход смеси оловоорганических соединений (далее будет объяснено подробно) на стадии (1), а более предпочтительно находится в интервале от 0,5- до 20-кратного избытка, принимая во внимание размер реактора и скорость реакции. Если используемое количество меньше 0,1, в выражении через стехиометрическое соотношение, есть случаи, когда протекание реакции затруднено, тогда как напротив, даже использование в количестве, превышающем 50-кратный избыток, в выражении через стехиометрическое соотношение, во многих случаях не влияет на скорость реакции или конечный выход смеси оловоорганических соединений в данной реакции. Реакцию стадии (1) предпочтительно проводят при температуре реакции от -20 до 300 С, а более предпочтительно при температуре реакции от -10 до 250 С, и хотя высокая температура реакции предпочтительная для увеличения скорости реакции, реакцию еще более предпочтительно проводят при температуре реакции, составляющей от 0 до 230 С, поскольку есть также случаи, когда при высоких температурах происходят нежелательные реакции, такие как разложение (например, реакция, в которой алкильные группы, связанные с атомом олова, диссоциируют с образованием алканов и кетонов), снижая,таким образом, выход. Кроме того, реакцию стадии (1) предпочтительно проводят в атмосфере инертного газа, такого как аргон, неон или азот. Несмотря на то, что на стадии (1) не требуется использование растворителя, растворитель можно использовать в целях улучшения текучести, облегчения методики реакции или эффективности удаления воды за пределы системы в случае, когда в результате реакции образуется вода. Примеры таких растворителей могут включать в себя линейные, разветвленные или циклические углеводороды, содержащие от 5 до 16 атомов углерода, простые эфиры, состоящие из линейных, разветвленных или циклических углеводородов, содержащих от 4 до 16 атомов углерода, и линейные, разветвленные или циклические галогензамещенные углеводороды, содержащие от 1 до 16 атомов углерода. Более конкретно, примеры растворителей, которые можно использовать, включают в себя линейные или циклические углеводороды,выбранные из группы, включающей в себя пентан (включая изомеры), гексан (включая изомеры), гептан(включая изомеры), октан (включая изомеры), нонан (включая изомеры), декан (включая изомеры), гексадекан (включая изомеры), циклогексан, циклогептан, циклооктан, бензол, толуол, ксилол (включая изомеры) и этилбензол; простые эфиры, выбранные из диэтилового эфира, дипропилового эфира (включая изомеры), дибутилового эфира (включая изомеры), дигексилового эфира (включая изомеры), диоктилового эфира (включая изомеры) и дифенилового эфира (включая изомеры); и галогензамещенные углеводороды, выбранные из группы, включающей в себя хлористый метилен, хлороформ, четыреххлористый углерод, хлорбензол, тетрахлорэтан и дихлобензол (включая изомеры). Данные растворители можно использовать по отдельности или в виде смеси двух или более типов. Несмотря на то, что она будет описана далее, реакция перераспределения алкильных групп стадии(2) представляет собой равновесную реакцию и, исходя из типичных свойств равновесных реакций, реакцию перераспределения алкильных групп стадии (2) предпочтительно проводят, осуществляя реакцию стадии (1) с использованием композиции алкилолова, в которой соединение алкоксида моноалкилолова и соединение алкоксида триалкилолова накоплены и/или сконцентрированы при высокой концентрации(например, содержание соединения алкоксида моноалкилолова и соединения алкоксида триалкилолова в композиции алкилолова из расчета на общее количество моль атомов олова в композиции алкилолова,выраженное в виде мол.%, составляет 10 мол.% или более, предпочтительно 30 мол.% или более, а более предпочтительно 50 мол.% или более). Случай отделения соединения алкоксида триалкилолова от композиции алкилолова. Композицию, содержащую соединение алкоксида триалкилолова, и композицию, содержащую соединение алкоксида моноалкилолова, можно отделить от композиции алкилолова перед осуществлением стадии (1). Кроме того, в случае отделения композиции, содержащей соединение алкоксида триалкилолова, и композиции, содержащей соединение алкоксида моноалкилолова, от композиции алкилолова,каждую композицию можно ввести во взаимодействие с кислотой и/или ангидридом кислоты в условиях разной температуры. Хотя для данного разделения можно использовать различные известные методы, такие как разделение перегонкой, кристаллизация, мембранное разделение, фильтрование или экстракция растворителем,разделение предпочтительно осуществляют разделением перегонкой. Удаление непрореагировавших соединений и побочных продуктов. Смесь оловоорганических соединений, полученную на стадии (1), можно непосредственно использовать в качестве сырья на стадии (2) или ее можно использовать в качестве сырья на стадии (2) после удаления непрореагировавшей кислоты и/или ангидрида кислоты и/или органических соединений, не содержащих атомов олова, полученных в данной реакции. Предпочтительно ее используют в качестве исходных веществ на стадии (2) после удаления непрореагировавшей кислоты и/или ангидрида кислоты. Причиной этого является то, что если стадию (2) проводят без удаления непрореагировавшей кислоты и/или ангидрида кислоты, во многих случаях происходит реакция деалкилирования, которая будет описана далее, и из-за данной реакции деалкилирования выход образующегося соединения диалкилолова и/или соединения тетраалкилдистанноксана снижается. Для удаления непрореагировавшей кислоты и/или ангидрида кислоты и/или органических соединений, не содержащих атомов олова, полученных в данной реакции, можно использовать известный метод, такой как фильтрование, разделение перегонкой,мембранное разделение, кристаллизация или экстракция растворителем. Кроме того, хотя реакция деалкилирования, которая будет описана далее, может происходить одновременно со стадией (1), или во время процедуры удаления непрореагировавшей кислоты и/или ангидрида кислоты, это не представляет проблемы при условии, что она находится в рамках сущности на- 25024850 стоящего варианта осуществления. Кроме того, на стадии (1) может также образоваться твердое соединение, содержащее атомы олова. Согласно исследованиям, проведенным авторами настоящего изобретения, в случае взаимодействия композиции алкилолова с уксусной кислотой, например, есть случаи, когда в зависимости от соединений, содержащихся в композиции алкиолова, условий реакции и так далее, происходит образование возгоняющегося белого твердого вещества. Хотя на основании результатов анализа методом ЯМР и так далее предполагалось, что данное белое твердое вещество является двухвалентным диацетоксиоловом, стадию (2) можно проводить после удаления этого соединения из смеси, полученной на стадии (1), или стадию (2) можно проводить без удаления этого соединения. Кроме того, помимо смеси оловоорганических соединений, может образоваться спирт, полученный из алкоксигруппы, имеющейся в композиции алкилолова, содержащий группу (ОХ группу), образующуюся из кислоты и/или ангидрида кислоты на стадии (1), в зависимости от условий реакции на стадии(1), и данный спирт предпочтительно отделяют и регенерируют. Регенерированный спирт можно использовать в качестве спирта на других стадиях настоящего варианта осуществления (например, в качестве спирта формулы (17), формулы (18), или формулы (36. Несмотря на то, что для отделения и регенерации спирта можно использовать известный метод, такой как отделение перегонкой или мембранное разделение, предпочтительным является отделение перегонкой. После взаимодействия кислоты и/или ангидрида кислоты с композицией алкилолова температура во время разделения и регенерации побочного продукта спирта при помощи отделения перегонкой предпочтительно находится в интервале от 0 до 100 С, а более предпочтительно в интервале от 0 до 80 С. Использование высокой температуры может привести к разложению или реакции дегидратацииконденсации между кислотой и спиртом, и выход регенерированного спирта может снизиться, тогда как при низкой температуре оловоорганическое соединение может затвердеть, приводя к плохой текучести. Таким образом, отделение и регенерацию спирта более предпочтительно осуществлять в интервале температуры от 20 до 60 С. Несмотря на изменения в зависимости от типов используемых соединений, температуры реакции и так далее, давление предпочтительно находится в интервале от 1 Па до 1 МПа, а более предпочтительно в интервале от 10 Па до 10 кПа. При чрезмерно высоком давлении для отделения спирта перегонкой требуется значительное время, или же между кислотой и спиртом может произойти реакция дегидратации-конденсации, а поскольку это может привести к снижению выхода регенерированного спирта, давление еще более предпочтительно находится в интервале от 10 Па до 1 кПа. Методику регенерации спирта перегонкой можно осуществить после завершения процедуры взаимодействия кислоты и/или ангидрида кислоты с композицией алкилолова или можно осуществлять одновременно с взаимодействием кислоты и/или ангидрида кислоты и композиции алкилолова. В отношении реактора, используемого для реакции кислоты и/или ангидрида кислоты с композицией алкилолова, и реактора, используемого для отделения спирта перегонкой, нет особенных ограничений, и можно использовать известный реактор. Например, для использования можно подходящим образом объединить стандартные реакторы, примеры которых могут включать в себя реакционный аппарат с мешалкой, герметизованный реакционный аппарат с мешалкой, разгерметизованный реакционный аппарат с мешалкой, колоночный реактор, ректификационную колонну, насадочную ректификационную колонну и дистиллятор для перегонки в тонких пленках. В отношении материала реактора также нет особых ограничений, и можно использовать известный материал. Например, можно использовать реактор,изготовленный из стекла, нержавеющей стали, углеродистой стали или сплава Хастеллой, или реактор,изготовленный из материала основы со стеклянной футеровкой, или реактор с покрытием из Teflon. Поскольку есть случаи, когда в зависимости от стадии и условий может оказаться значительной коррозия, вызванная кислотой, можно подходящим образом выбрать реактор, изготовленный из стекла, реактор со стеклянной футеровкой, реактор с покрытием из Teflon или реактор, изготовленный из сплава Хастеллой. Оловоорганические соединения. Далее приведено объяснение в отношении смеси оловоорганических соединений, образующейся в результате реакции стадии (1). Используемый в настоящем варианте осуществления термин "оловоорганические соединения" относится к оловоорганическим соединениям, содержащим группу (ОХ группу), полученную из кислоты и/или ангидрида кислоты, образующимся в результате реакции стадии (1). Как описано ранее, несмотря на то, что исходное вещество на стадии (1) в виде соединения алкилолова содержит соединение алкоксида триалкилолова, представленное формулой (25), в результате реакции стадии (1) из соединения алкоксида триалкилолова образуется соединение, содержащее три связи Sn-R1 (где R1 представляет собой алкильную группу) и одну связь Sn-OX (где ОХ представляет собой группу, образующуюся из кислоты и/или ангидрида кислоты). Более конкретно, оно является соединением, представленным следующей формулой (28):(в которой каждый R1 независимо представляет собой алкильную группу;X представляет собой группу, полученную из кислоты и/или ангидрида кислоты; а О является атомом кислорода). С другой стороны, соединения, содержащие одну связь Sn-R1 и от одной до трех групп Sn-OX, образуются из вышеупомянутого соединения алкоксида моноалкилолова по реакции стадии (1). Ранее было описано, что при анализе данных соединений алкоксида моноалкилолова методом ЯМР 119Sn в растворе дейтерированного хлороформа было найдено, что эти соединения содержат атом олова, химический сдвиг которого проявляется в интервале от 200 до -200 м.д. относительно тетраметилолова, затрудняя за счет этого идентификацию структур всех данных соединений. Таким образом, сложно также идентифицировать структуры всех соединений, полученных из данных соединений алкоксидов моноалкилолова. Однако поскольку во многих случаях реакция соединения алкоксида моноалкилолова с кислотой и/или ангидридом кислоты представляет собой, главным образом, реакцию, которая объединяет 1) реакцию, в которой группа R2O связи Sn-OR2 соединения алкоксида моноалкилолова замещается группой ХО, и 2) реакцию, в которой связи дистанноксана, представленные Sn-O-Sn, расщепляются, приводя к образованию связей Sn-OX, во многих случаях образуется соединение, представленное следующей формулой(в которой каждый R1 независимо представляет собой алкильную группу;X представляет собой группу, полученную из кислоты и/или ангидрида кислоты; а О является атомом кислорода). Кроме того, как указывалось выше, предполагается, что продукты, образующиеся в результате реакции диспропорционирования алкильных групп в соединении диалкоксида диалкилолова и/или соединении тетраалкилдиалкоксидистанноксана, принимают различные структуры, и предполагается, что соединения, имеющие структуру, представленную упомянутой выше формулой (27), являются продуктами реакции диспропорционирования алкильных групп. Кроме того, ожидается, что данные соединения,представленные формулой (27), будут реагировать с кислотой и/или ангидридом кислоты на стадии (1), и предполагается, что данная реакция будет протекать, как представлено следующей формулой (30):(в которых R1 и R2 аналогичны определенным в формуле (27), а О является атомом кислорода). Стадия 2. Далее приведено объяснение стадии (2). Стадия 2 представляет собой стадию получения по меньшей мере одного соединения алкилолова,выбранного из группы, включающей в себяi) соединение диалкилолова, содержащее один атом олова, в котором этот один атом олова образует две связи Sn-R1 (где R1 представляет собой алкильную группу) и две связи Sn-OX (где ОХ является группой, в которой сопряженная кислота для ОХ в форме НОХ представляет собой кислоту Бренстеда с рКа от 0 до 6,8), иii) соединение тетраалкилдистанноксана, содержащее одну связь Sn-O-Sn, в котором каждый атом олова соединения тетраалкилдистанноксана образует две связи Sn-R1 и одну связь Sn-OX (где ОХ является группой, в которой сопряженная кислота для ОХ в форме НОХ представляет собой кислоту Бренстеда с рКа от 0 до 6,8),из соединения алкоксида моноалкилолова и соединения алкоксида триалкилолова в композиции алкилолова в результате термической обработки смеси оловоорганических соединений, полученной на стадии (1), и осуществления реакции перераспределения алкильных групп. Используемая здесь реакция перераспределения алкильных групп относится к реакции, в которой количество алкильных групп, связанных с одним атомом олова, уравновешивается за счет взаимодействия двух или более типов оловоорганических соединений, содержащих два или более различных количеств алкильных групп, связанных с одним атомом олова, и реакция перераспределения алкильных групп является равновесной реакцией. Несмотря на то, что точный механизм данной реакции неясен, предполагается, что он включает в себя образование оловоорганических соединений, содержащих две алкильные группы, связанные с одним атомом олова, при реакции оловоорганического соединения, содержащего три алкильных группы, связанных с одним атомом олова, с оловоорганическим соединением, содержащим одну алкильную группу, связанную с одним атомом олова, как показано на следующей формуле(в которой каждый R1 независимо представляет собой алкильную группу,X представляет собой группу, полученную из кислоты и/или ангидрида кислоты, а О является атомом кислорода). Реакция перераспределения алкильных групп протекает в результате термической обработки смеси двух или более типов оловоорганических соединений, содержащих два или более различных количеств алкильных групп, связанных с одним атомом олова. Данную термическую обработку предпочтительно проводят в интервале температуры от 20 до 300 С, а в случае желания ускорить реакцию или в случае желания получить более высокую концентрацию диалкильной формы (соединение олова, содержащее две связи Sn-R1), более предпочтительно температура составляет от 50 до 280 С, поскольку высокая температура реакции благоприятная для сдвига равновесия вправо. Несмотря на то, что для увеличения скорости реакции высокая температура предпочтительна для температуры термической обработки, реакцию еще более предпочтительно проводят в интервале температуры от 80 до 260 С, так как при высоких температурах могут происходить нежелательные реакции, такие как разложение, приводя, таким образом, к снижению выхода. Если температура ниже 20 С, реакция может стать чрезмерно продолжительной, тогда как в том случае, когда температура превышает 300 С, выход соединения диалкилолова может снизиться в результате денатурации оловоорганических производных вследствие разложения, и так далее. Несмотря на изменения в зависимости от используемых соединений и температуры термической обработки, продолжительность реакции составляет от 0,01 до 50 ч, предпочтительно от 0,01 до 10 ч, а рассматривая промышленное производство, температуру реакции и так далее, устанавливают так, чтобы продолжительность реакции составляла от 0,1 до 2 ч. Реакцию можно остановить при получении требуемого соединения диалкилолова, что определяется при помощи ЯМР 119Sn и так далее. Ниже будет описано, что поскольку предполагается, что реакция перераспределения алкильных групп настоящего варианта осуществления является равновесной реакцией, то для того, чтобы получить соединение олова, содержащее две алкильные группы, связанные с одним атомом олова, в более высокой концентрации, чем реагенты, реакцию проводит в таком интервале температуры, чтобы концентрация продуктов превышала концентрацию реагентов при измерении равновесных концентраций используемых соединений относительно температуры, или при повышении концентрации соединений дилакилолова в продуктах за счет превращения заместителей при помощи метода,который будет описан далее. Кроме того, в случае проведения термической обработки при высокой температуре (например, при 150 С или выше), выход соединения диалкилолова может снизиться, если для охлаждения после проведения реакции потребуется время. Причиной этого является то, что реакционная система стремится достигнуть равновесной концентрации при низкой температуре в процессе охлаждения, что делает, таким образом, предпочтительным проведение термической обработки при высокой температуре с последующим быстрым охлаждением. Для охлаждения реакционной жидкости можно предпочтительно использовать известный метод и предпочтительно можно использовать такой метод,как использование раствора соли или вливание в реактор при более низком давлении, чем в резервуаре для термической обработки. Реакцию перераспределения алкильных групп можно проводить в присутствии или в отсутствие катализатора на основе галогенида металла. Примеры катализаторов на основе галогенида металла могут включать в себя хлорид олова(II), хлорид ртути(II), хлорид свинца(II), фторид ртути(II), фторид свинца(II), фторид олова(II), йодид олова(II), йодид свинца(II), йодид ртути(II), бромид олова(II), бромид ртути(II) и бромид свинца(II), и данные галогениды металлов можно использовать по отдельности или можно использовать смесь двух или более типов. Данные галогениды металлов предпочтительно можно использовать в интервале от 0,1 до 10 мас.% из расчета на раствор, используемый для термической обработки. Несмотря на то, что в реакции перераспределения алкильных групп не требуется использование растворителя, в целях улучшения текучести или облегчения процедуры реакции можно использовать растворитель. Примеры таких растворителей могут включать в себя линейные, разветвленные или циклические углеводороды, содержащие от 5 до 16 атомов углерода, простые эфиры, состоящие из линейных, разветвленных или циклических углеводородов, содержащих от 4 до 16 атомов углерода, и линейные, разветвленные или циклические галогензамещенные углеводороды, содержащие от 1 до 16 атомов углерода. Конкретные примеры могут включать в себя линейные и циклические углеводороды, выбранные из пентана (включая изомеры), гексана (включая изомеры), гептана (включая изомеры), октана(включая изомеры), нонана (включая изомеры), декана (включая изомеры), гексадекана (включая изомеры), циклогексана, циклогептана, циклооктана, бензола, толуола, ксилола (включая изомеры) и этилбензола; простые эфиры, выбранные из диэтилового эфира, дипропилового эфира (включая изомеры), дибутилового эфира (включая изомеры), дигексилового эфира (включая изомеры), диоктилового эфира(включая изомеры) и дифенилового эфира (включая изомеры); и галогензамещенные углеводороды, выбранные из хлористого метилена, хлороформа, четыреххлористого углерода, хлорбензола, тетрахлорэтана и дихлобензола (включая изомеры). Данные растворители можно использовать по отдельности или в виде смеси двух или более типов. Растворители можно использовать в целях улучшения текучести, облегчения процедуры реакции или эффективности удаления воды за пределы системы в случае, когда в результате реакции образуется вода. Примеры таких растворителей могут включать в себя линейные,разветвленные или циклические углеводороды, содержащие от 5 до 16 атомов углерода, простые эфиры,состоящие из линейных, разветвленных, или циклических углеводородов, содержащих от 4 до 16 атомов углерода, и линейные, разветвленные, или циклические галогензамещенные углеводороды, содержащие от 1 до 16 атомов углерода. Их конкретные примеры могут включать в себя линейные и циклические углеводороды, выбранные из пентана (включая изомеры), гексана (включая изомеры), гептана (включая изомеры), октана (включая изомеры), нонана (включая изомеры), декана (включая изомеры), гексадекана(включая изомеры), циклогексана, циклогептана, циклооктана, бензола, толуола, ксилола (включая изомеры) и этилбензола; простые эфиры, выбранные из диэтилового эфира, дипропилового эфира (включая изомеры), дибутилового эфира (включая изомеры), дигексилового эфира (включая изомеры), диоктилового эфира (включая изомеры) и дифенилового эфира (включая изомеры); и галогензамещенные углеводороды, выбранные из хлористого метилена, хлороформа, четыреххлористого углерода, хлорбензола,тетрахлорэтана и дихлобензола (включая изомеры). Данные растворители можно использовать по отдельности или в виде смеси двух или более типов. Кроме того, реакция деалкилирования, которая будет описана ниже, может также протекать одновременно на стадии (2). Как было описано ранее, предполагается, что реакция перераспределения алкильных групп является равновесной реакцией. В результате тщательных исследований, проведенных авторами настоящего изобретения, было найдено, что данная реакция перераспределения алкильных групп зависит от заместителей, связанных с атомом олова, и/или от температуры, при которой проводят реакцию перераспределения алкильных групп. Что касается заместителей, связанных с атомом олова, в случае группы (например,группы, эквивалентной группе ОХ в описанной ранее формуле (31, связанной с атомом олова, которая отличается от алкильной группы (например, группа, эквивалентная R1 в формуле (31, во многих случаях равновесие смещено в сторону продуктов в случае, когда рКа сопряженной кислоты для данной группы составляет от 0 до 6,8, тогда как, напротив, во многих случаях равновесие сдвигается в сторону реагентов, когда рКа сопряженной кислоты для данной группы составляет от 6,8 до 25. Кроме того, также было найдено, что равновесие смещается в сторону продуктов при более высокой температуре в случае,когда рКа сопряженной кислоты составляет от 0 до 6,8. А именно, в целом, реакция перераспределения алкильных групп на стадии (2) может происходить в результате того, что рКа группы OR2 в упомянутых выше формулах (24) и (25) превышает 6,8 и в результате превращения группы OR2 в группу ОХ на стадии (1). Несмотря на то, что ранее был использован термин "реакция деалкилирования", данная реакция деалкилирования относится к реакции, в которой оловоорганическое соединение, содержащее связи Sn- 29
МПК / Метки
МПК: C07C 69/96, C07C 68/04, C07F 7/22
Метки: кислоты, карбоновой, указанного, эфира, алкоксида, алкилолова, способ, использованием, соединения, получения
Код ссылки
<a href="https://eas.patents.su/30-24850-sposob-polucheniya-soedineniya-alkoksida-alkilolova-i-sposob-polucheniya-efira-karbonovojj-kisloty-s-ispolzovaniem-ukazannogo-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения соединения алкоксида алкилолова и способ получения эфира карбоновой кислоты с использованием указанного соединения</a>
Предыдущий патент: Конструкция, содержащая нуклеиновую кислоту и химическое соединение, и способ ее получения
Следующий патент: Пищевой продукт, содержащий сыр
Случайный патент: Способ включения трехфазной линии электропередачи


































