Соединения четвертичного аммония как антагонисты тахикинина
Номер патента: 2424
Опубликовано: 25.04.2002
Авторы: Бернс Кристофер Джон, Монаган Сандра Марина, Алкер Дэвид
Формула / Реферат
1. Соединение формулы
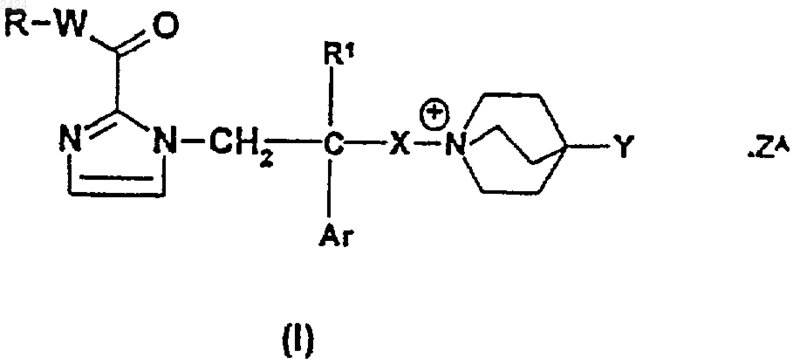
где R представляет собой фенил, С3-С7 циклоалкил или гетероарил, каждый из которых является необязательно сопряженным с бензольным циклом или с С3-С7 циклоалкилом и необязательно замещенным, включая фрагмент, сопряженный с бензольным циклом или с С3-С7 циклоалкилом, 1-3 заместителями, каждый из которых независимо выбран из C1-C4 алкила, фтор(C1-C4) алкила, C1-C4 алкоксигруппы, фтор (C1-C4)алкоксигруппы, феноксигруппы, C2-C4 алканоила, галогена, C1-C4 алкоксикарбонила, С3-С7 циклоалкила, -S(O)m(C1-C4 алкила), цианогруппы, -NR2R3, -S(O)mNR2R3, -NR4(C1-C4 алканоила) и -CONR2R3, или R представляет собой 2,3-дигидробензо[b]фуранил или хроманил;
R1 представляет собой Н или C1-C6 алкил;
R2 и R3, каждый независимо, выбран из Н и C1-C6 алкила или, взятые вместе, представляют собой C4-C6 алкилен;
R4 представляет собой Н или C1-C6 алкил;
W представляет собой прямую связь, метилен или этилен;
Х представляет собой неразветвленный C2-C4 алкилен;
Y представляет собой фенил, нафтил, бензил, пиридил, тиенил или C3-C7 циклоалкил, каждый из которых является необязательно замещенным 1-3 заместителями, каждый из которых независимо выбран из C1-C4 алкила, фтор(C1-C4) алкила, C1-C4 алкоксигруппы, фтор(C1-C4) алкоксигруппы, галогена и цианогруппы;
Аr представляет собой фенил, нафтил, бензил, тиенил, бензо[b]тиенил или индолил, каждый из которых является необязательно замещенным 1-3 заместителями, каждый из которых независимо выбран из C1-C4 алкила, фтор(C1-C4) алкила, C1-C4 алкоксигруппы, фтор(C1-C4) алкоксигруппы, галогена и цианогруппы, или Аr представляет собой 1,3-бензодиоксолан-4 или 5-ил или 1,4-бензодиоксан-5 или 6-ил;
m равно 0, 1 или 2;
ZA является фармацевтически приемлемым анионом; и
гетероарил, использующийся в определении R, обозначает тиенил или 5- или 6-членную циклическую гетероарильную группу, содержащую либо от 1 до 4 гетероатомов азота, либо 1 или 2 гетероатома азота и 1 гетероатом кислорода или серы,
при условии, что, если W представляет собой прямую связь, а R является необязательно сопряженным и необязательно замещенным гетероарилом, то упомянутый гетероарил связан с карбонильной группой через углеродный атом цикла.
2. Соединение по п.1, где R представляет собой фенил, который является необязательно сопряженным с бензольным циклом или с С3-С7 циклоалкилом и необязательно замещенным, включая фрагмент, сопряженный с бензольным циклом или с С3-С7 циклоалкилом, 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-C4 алкила, фтор(C1-C4) алкила, C1-C4 алкоксигруппы, фтор(C1-C4) алкоксигруппы, феноксигруппы и галогена, или R представляет собой 2,3-дигидробензо[b]фуранил.
3. Соединение по п.1 или 2, где R представляет собой фенил, который является необязательно сопряженным с бензольным циклом или с С3-С7 циклоалкилом и необязательно замещенным, включая фрагмент, сопряженный с бензольным циклом или с С3-С7 циклоалкилом, 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, этила, трифторметила, метоксигруппы, изопропоксигруппы, трифторметоксигруппы, феноксигруппы, фтора и хлора, или R представляет собой 2,3-дигидробензо[b]фуранил.
4. Соединение по пп.1, 2 или 3, R представляет собой фенил, нафтил или тетрагидронафтил, каждый из которых является необязательно замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, этила, трифторметила, метоксигруппы, изопропоксигруппы, трифторметоксигруппы, феноксигруппы, фтора и хлора, или R представляет собой 2,3-дигидробензо[b]фуранил.
5. Соединение по любому из пп.1-4, где R представляет собой фенил, 3,5-диметилфенил, 2,3-диметилфенил, 2-трифторметоксифенил, 2-метокси-3-метилфенил, 2, 3-дигидробензо[b]фуран-7-ил, нафт-2-ил, 4-фтор-3-трифторметилфенил, 1,2,3,4-тетрагидронафт-5-ил, 1,2,3,4-тетрагидронафт-6-ил, 5-хлор-2-метоксифенил, 2-метоксифенил, 2-трифторметилфенил, 2-изопропоксифенил, 2-этилфенил, 2-феноксифенил или 3,5-бис(трифторметил)фенил.
6. Соединение по любому из пп.1-5, где R представляет собой 2,3-диметилфенил, нафт-2-ил, 1,2,3,4-тетрагидронафт-5-ил или 2-метоксифенил.
7. Соединение по любому из пп.1-6, где R1 представляет собой Н.
8. Соединение по любому из пп.1-7, где W представляет собой прямую связь или метилен.
9. Соединение по любому из пп.1-8, где W представляет собой прямую связь.
10. Соединение по любому из пп.1-9, где Х представляет собой 1,2-этилен.
11. Соединение по любому из пп.1-10, где Y представляет собой фенил, нафтил или циклогексил, каждый из которых является необязательно замещенным 1, 2 или 3 C1-C4 алкильными заместителями.
12. Соединение по любому из пп.1-11, где Y представляет собой фенил, 3,5-диметилфенил, циклогексил или нафт-2-ил.
13. Соединение по любому из пп.1-12, где Y представляет собой фенил.
14. Соединение по любому из пп.1-13, где Аr представляет собой фенил, необязательно замещенный 1, 2 или 3 галогеновыми заместителями.
15. Соединение по любому из пп.1-14, где Аr представляет собой фенил, замещенный 1 или 2 заместителями, которые являются хлором.
16. Соединение по любому из пп.1-15, где Аr представляет собой 3,4-дихлорфенил.
17. Соединение по любому из пп.1-16, где ZA представляет собой хлорид, бромид, нитрат, метансульфонат, паратолуолсульфонат, бензолсульфонат, гидросульфат или сульфат.
18. Соединение по любому из пп.1-17, где ZA представляет собой хлорид или метансульфонат.
19. Соединение по любому из пп.1-18, где ZA представляет собой метансульфонат.
20. Соединение по п.1, где R1 представляет собой Н, Х представляет собой -CH2CH2-, а Аr представляет собой 3,4-дихлорфенил и где
R-W представляет собой 3,5-диметилфенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2,3-диметилфенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-трифторметоксифенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-метокси-3-метилфенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2,3-дигидробензо[b]фуран-7-ил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой нафт-2-ил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 4-фтор-3-трифторметилфенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 1,2,3,4-тетрагидронафт-5-ил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 1,2,3,4-тетрагидронафт-6-ил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 5-хлор-2-метоксифенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-метоксифенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-трифторметилфенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-изопропоксифенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-этилфенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-феноксифенил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой бензил, Y представляет собой фенил и ZA представляет собой СН3SО3-;
R-W представляет собой 3,5-бис (трифторметил)фенил, Y представляет собой фенил и ZA представляет собой Сl-;
R-W представляет собой 2-метоксифенил, Y представляет собой циклогексил и ZA представляет собой СН3SО3-;
R-W представляет собой 4-фтор-3-трифторметилфенил, Y представляет собой циклогексил и ZA представляет собой СН3SО3-;
R-W представляет собой 2-метоксифенил, Y представляет собой 3,5-диметилфенил и ZA представляет собой СН3SО3- или
R-W представляет собой 2-метоксифенил, Y представляет собой нафт-2-ил и ZA представляет собой СН3SО3-;
или где ZA представляет собой альтернативный фармацевтически приемлемый анион, что касается любого из них.
21. Соединение по п.1, которое представляет собой 4-фенил-1-(3(S)-[3,4-дихлорфенил]-4-[2-(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1-ил]бутил)хинуклидиний метансульфонат или 4-фенил-1-(3(R)-[3,4-дихлорфенил]-4-[2-(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1-ил]бутил) хинуклидиний метансульфонат.
22. Способ получения соединения формулы (I) по п.1, где R, R1, W, X, Y, Аr и ZA такие, как определены в п.1, включающий взаимодействие соединения формулы
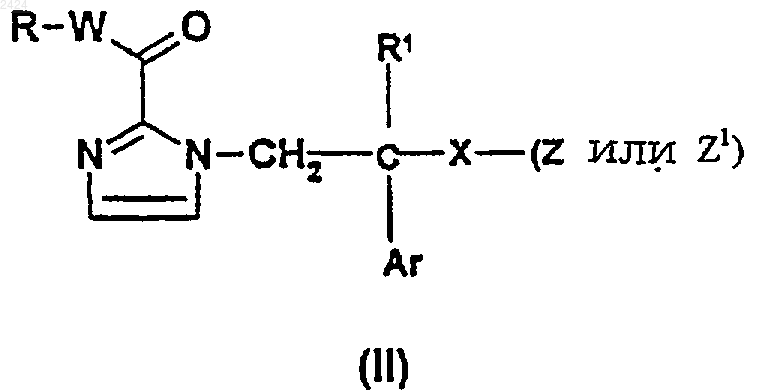
R, R1, Аr, W и Х такие, как определены ранее для соединения формулы (I), где Z является подходящей уходящей группой, способной к образованию фармацевтически приемлемого аниона (ZA), и Z1 является уходящей группой с соединением формулы
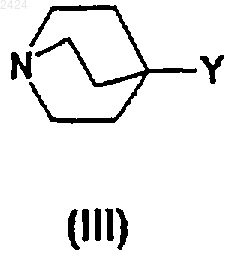
где Y такой, как определен ранее для соединения формулы (I), упомянутый способ сопровождается также либо (а), где Z1 является уходящей группой, заменяемой на фармацевтически приемлемый анион (ZA), или (b), необязательно, где ZA является фармацевтически приемлемым анионом, заменяемым на другой фармацевтически приемлемый анион.
23. Способ по п.22, где Z представляет собой C1-C4 алкансульфонилоксигруппу, бензолсульфонилоксигруппу, паратолуолсульфонилоксигруппу, хлор, бром или иод и Z1 является трифторметансульфонилоксигруппой.
24. Способ по п.22, где Z представляет собой метансульфонилоксигруппу, а ZA является метансульфонатом.
25. Фармацевтическая композиция, включающая соединение формулы (I) по любому из пп.1-21 вместе с фармацевтически приемлемым разбавителем или носителем.
26. Применение соединения формулы (I) по п.1 в качестве активного агента для лечения заболеваний, при которых показано антагонистическое действие на тахикининовые рецепторы.
27. Применение соединения формулы (I) по любому из пп.1-21 в производстве лекарственного средства для лечения заболевания путем продуцирования антагонистического эффекта на тахикининовый рецептор или на комбинацию тахикининовых рецепторов.
28. Применение по п.27, где антагонистический эффект оказывается на NK1 и NK2 тахикининовые рецепторы человека.
29. Применение по п.27 или 28, где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как беспокойство, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство, такое как функциональное кишечное заболевание, болезненно чувствительный кишечный синдром, желудочно-эсофагеальный обратный ток, недержание дефекации, колит или болезнь Крона, заболевание, вызываемое Helicobacter pylori или другой уреазаположительной грамотрицательной бактерией, заболевание урогенитального тракта, такое как недержание, гиперрефлексия или цистит, легочное заболевание, такое как хроническая обструктивная болезнь дыхательных путей, аллергическое заболевание, такое как экзема, контактный дерматит, атопический дерматит или ринит, гиперчувствительность, например, к сумаху укореняющемуся, периферическую невропатию, такую как диабетическая невропатия, невралгия, каузалгия, болевая невропатия, ожог, герпетическая невралгия или постгерпетическая невралгия, рвота, кашель, мигрень или острая или хроническая боль.
30. Способ лечения заболевания человека путем продуцирования антагонистического эффекта на тахикининовый рецептор или на комбинацию тахикининовых рецепторов, который включает лечение человека эффективным количеством соединения формулы (I) или его фармацевтически приемлемой композицией по пп.1-21 и 25, соответственно.
31. Способ по п.30, где антагонистический эффект оказывается на NK1 и NK2 тахикининовые рецепторы человека.
32. Способ по п.30 или 31, где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как беспокойство, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство, такое как функциональное кишечное заболевание, болезненно чувствительный кишечный синдром, желудочно-эсофагеальный обратный ток, недержание дефекации, колит или болезнь Крона, заболевание, вызываемое Helicobacter pylori или другой уреазаположительной грамотрицательной бактерией, заболевание урогенитального тракта, такое как недержание, гиперрефлексия или цистит, легочное заболевание, такое как хроническая обструктивная болезнь дыхательных путей, аллергическое заболевание, такое как экзема, контактный дерматит, атопический дерматит или ринит, гиперчувствительность, например, к сумаху укореняющемуся, периферическую невропатию, такую как диабетическая невропатия, невралгия, каузалгия, болевая невропатия, ожог, герпетическая невралгия или постгерпетическая невралгия, рвота, кашель, мигрень или острая или хроническая боль.
33. Соединение формулы
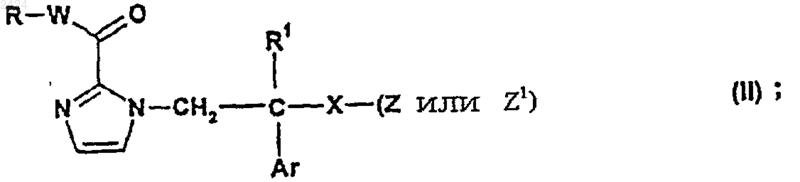
где R, R1, W, X и Ar такие, как определены в п.1, Z является уходящей группой, способной к образованию фармацевтически приемлемого аниона (ZA), Z1 является уходящей группой.
34. Соединение формулы
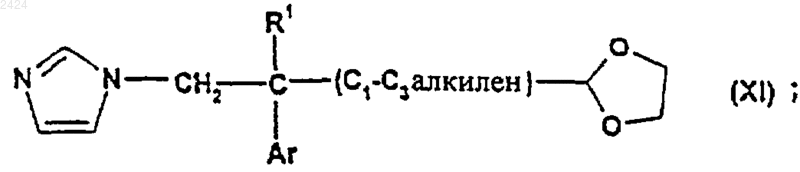
где R1 и Ar такие, как определены в п.1.
35. Соединение формулы
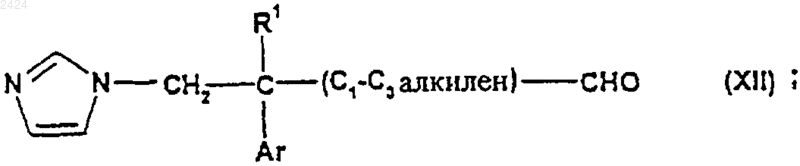
где R1 и Ar такие, как определены в п.1.
36. Соединение формулы
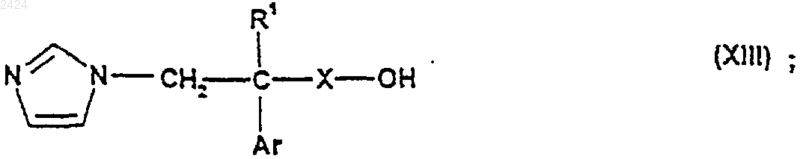
где R1, Х и Ar такие, как определены в п.1.
37. Соединение формулы
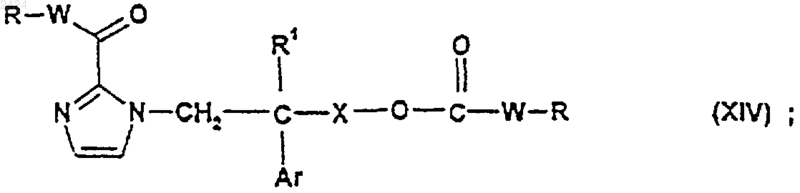
где R, R1, W, X и Ar такие, как определены в п.1.
38. Соединение формулы

где R, R1, W, X и Аr такие, как определены в п.1.
39. Соединение формулы
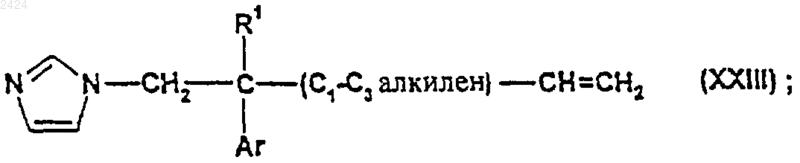
где R1 и Аr такие, как определены в п.1, при условии, что, когда R1 является Н, а C1-С3 алкилен является СН2, тогда Аr не является 2-хлорфенилом или 2,4-дихлорфенилом.
40. Соединение формулы
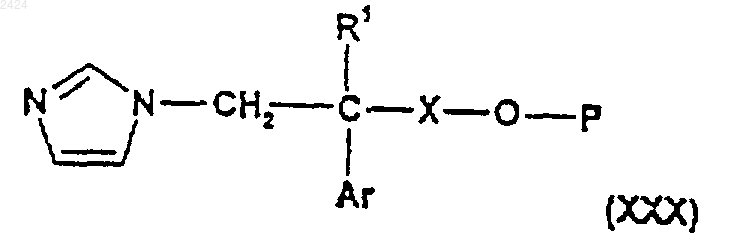
где R1, Х и Аr такие, как определены в п.1, Р является защитной группой.
41. Соединение формулы
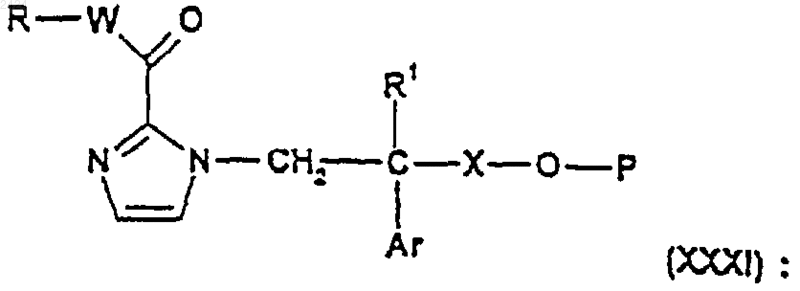
где R1, Х и Аr такие, как определены в п.1, Р является защитной группой.
Текст
1 Данное изобретение относится к соединениям четвертичного аммония. Более конкретно,данное изобретение относится к солям 1-(2 ацилимидазол-1-илалкил)хинуклидиния, к способам их получения, к промежуточным соединениям, использующимся в их получении, к композициям, содержащим такие соли, и к применению таких солей. Настоящие соединения являются антагонистами тахикининов, включающих NKA (нейрокинин A), NKB (нейрокинин В) и вещество Р,действующими на человеческие рецепторы нейрокинина-1 (NK1), нейрокинина-2 (NK2) и нейрокинина-3 (НК 3). Указанные соединения особенно полезны как двойные антагонисты рецепторов NK1 иNK2, и, следовательно, могут использоваться для лечения воспалительных заболеваний, таких как артрит, псориаз, астма или воспалительные заболевания кишечника, расстройства центральной нервной системы (ЦНС), такие как беспокойство, депрессия, деменция или психоз,желудочно-кишечные (ЖК) расстройства, такие как функциональное кишечное заболевание,болезненно чувствительный кишечный синдром, желудочно-эсофагеальный обратный ток,недержание дефекации, колит или болезнь Крона, заболевания, вызываемые Helicobacter pylori или другой уреаза-положительной грамотрицательной бактерией, заболевания урогенитального тракта, такие как недержание, импотенция,гиперрефлексия или цистит, легочные заболевания, такие как хроническая обструктивная болезнь дыхательных путей, аллергические заболевания, такие как экзема, контактный дерматит, атопический дерматит, крапивница, экзематоидный дерматит или ринит, гиперчувствительность, например, к сумаху укореняющемуся, пролиферативные заболевания, такие как рак или заболевание, включающее пролиферацию фибробластов, вазоспастические заболевания,такие как ангиогенез, стенокардия или заболевание Рейнауда, фиброзные или коллагеновые заболевания, такие как атеросклероз, склеродермия или эозинофильный фасциолез, обратные симпатические дистрофии, такие как синдром плечи/руки, аддикции, такие как алкоголизм, обусловленные стрессом соматические заболевания, периферические невропатии, такие как диабетическая невропатия, невралгия, каузалгия, болевая невропатия, ожог, герпетическая невралгия или постгерпетическая невралгия,невропатологические заболевания, такие как болезнь Альцгеймера или рассеянный склероз,заболевания, относящиеся к активизации или подавлению иммунитета, такие как системная красная волчанка, ревматические заболевания,такие как фиброзит, рвота, кашель, острая или хроническая боль, мигрень, офтальмические заболевания, такие как пролиферативная ретинопатия, грипп или простуда. 2 ЕР-А-680962 и ЕР-А-0739891 раскрывают гетероциклические соединения, которые являются непептидными антагонистами NKA, и то,что они являются полезными при лечении заболеваний, таких как астма. ЕР-А-0591040 раскрывает четвертичные соединения, обладающие антагонистической активностью по отношению к тахикинину. Настоящее изобретение касается соединения формулыR представляет собой фенил, С 3-С 7 циклоалкил или гетероарил, каждый из которых является необязательно сопряженным с бензольным циклом или с С 3-С 7 циклоалкилом и необязательно замещенным, включая фрагмент, сопряженный с бензольным циклом или с С 3-С 7 циклоалкилом, 1-3 заместителями, каждый из которых независимо выбран из С 1-С 4 алкила, фторR2 и R3 каждый независимо выбран из Н и С 1-С 6 алкила, или, взятые вместе, представляют собой С 4-С 6 алкилен;W представляет собой прямую связь, метилен или этилен; Х представляет собой неразветвленный С 2 С 4 алкилен;Y представляет собой фенил, нафтил, бензил, пиридил, тиенил или С 3-С 7 циклоалкил,каждый из которых является необязательно замещенным 1-3 заместителями, каждый из которых независимо выбран из С 1-С 4 алкила, фтор(С 1-С 4)алкила, С 1-С 4 алкоксигруппы, фтор(С 1 С 4)алкоксигруппы, галогена и цианогруппы; Аr представляет собой фенил, нафтил, бензил, тиенил, бензо[b]тиенил или индолил, каждый из которых является необязательно замещенным 1-3 заместителями, каждый из которых независимо выбран из С 1-С 4 алкила, фтор(С 1 С 4)алкила, С 1-С 4 алкоксигруппы, фтор(С 1 С 4)алкокси группы, галогена и цианогруппы,или Аr представляет собой 1,3-бензодиоксолан 4 или 5-ил, или 1,4-бензодиоксан-5 или 6-ил;ZA является фармацевтически приемлемым анионом; и "гетероарил", использующийся в определении R, обозначает тиенил или 5-, или 6 3 членную циклическую гетероарильную группу,содержащую либо от 1 до 4 гетероатомов азота,либо 1 или 2 гетероатома азота и 1 гетероатом кислорода, или серы,при условии, что, если W представляет собой прямую связь, а R является необязательно сопряженным и необязательно замещенным гетероарилом, то упомянутый гетероарил связан с карбонильной группой через углеродный атом цикла. В вышеприведенных определениях "галоген" обозначает фтор, хлор, бром или иод, и алкильные и алкоксигруппы, имеющие три или более атомов углерода, алканоильные группы,имеющие четыре атома углерода, и алкиленовые группы, имеющие два или более атомов углерода (за исключением специально оговоренных случаев), могут быть разветвленными и неразветвленными.ZA является фармацевтически приемлемым анионом, таким как хлорид, бромид, нитрат,метансульфонат, паратолуолсульфонат, бензолсульфонат, гидросульфат или сульфат. Предпочтительно ZA является хлоридом или метансульфонатом. Наиболее предпочтительно ZA является метансульфонатом. Соединение формулы (I) содержит один или несколько асимметрических атомов углерода и, следовательно, существует в двух или более стереоизомерных формах. Настоящее изобретение включает индивидуальные стереоизомеры соединений формулы (I) и их смеси. Разделение диастереоизомеров может быть достигнуто с помощью подходящих способов,например, путем фракционной кристаллизации,хроматографии или ВЭЖХ стереоизомерической смеси соединений формулы (I) или подходящих солей/или их производных. Индивидуальный энантиомер соединения формулы (I) может быть также получен из соответствующего оптически чистого промежуточного соединения или путем разделения соответствующего рацемата, например, с помощью ВЭЖХ с подходящим хиральным носителем, или путем фракционной кристаллизации диастереоизомерных солей, полученных в результате реакции соответствующего рацемата с подходящей оптически активной кислотой. Предпочтительно R представляет собой фенил, который является необязательно сопряженным с бензольным циклом или с С 3-С 7 циклоалкилом, и необязательно замещенным,включая фрагмент, сопряженный с бензольным циклом или с С 3-С 7 циклоалкилом, 1, 2 или 3 заместителями, каждый из которых независимо выбран из С 1-С 4 алкила, фтор(С 1-С 4)алкила, С 1 С 4 алкоксигруппы, фтор(С 1-С 4)алкоксигруппы,феноксигруппы и галогена, или R представляет собой 2,3-дигидробензо[b]фуранил. Более предпочтительно, R представляет собой фенил, который является необязательно 4 сопряженным с бензольным циклом или с С 3-С 7 циклоалкилом, и необязательно замещенным,включая фрагмент, сопряженный с бензольным циклом или с С 3-С 7 циклоалкилом, 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, этила, трифторметила, метоксигруппы, изопропоксигруппы, трифторметоксигруппы, феноксигруппы, фтора и хлора, или R представляет собой 2,3-дигидробензо[b] фуранил. Еще более предпочтительно, R представляет собой фенил, нафтил или тетрагидронафтил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбран из метила, этила, трифторметила, метоксигруппы, изопропоксигруппы,трифторметоксигруппы, феноксигруппы, фтора и хлора, или R представляет собой 2,3 дигидробензо[b]фуранил. Еще предпочтительнее, R представляет собой фенил, 3,5-диметилфенил, 2,3-диметилфенил, 2-трифторметоксифенил, 2-метокси-3 метилфенил,2,3-дигидробензо[b]фуран-7-ил,нафт-2-ил,4-фтор-3-трифторметилфенил,1,2,3,4-тетрагидронафт-5-ил, 1,2,3,4-тетрагидронафт-6-ил, 5-хлор-2-метоксифенил, 2-метоксифенил, 2-трифторметилфенил, 2-изопропоксифенил, 2-этилфенил, 2-феноксифенил или 3,5 бис(трифторметил)фенил. Наиболее предпочтительно R представляет собой 2,3-диметилфенил, нафт-2-ил, 1,2,3,4 тетрагидронафт-5-ил или 2-метоксифенил. Предпочтительно R1 представляет собой Н. Предпочтительно W представляет собой прямую связь или метилен. Наиболее предпочтительно W представляет собой прямую связь. Предпочтительно Х представляет собой 1,2-этилен. Предпочтительно Y представляет собой фенил, нафтил или циклогексил, каждый из которых является необязательно замещенным 1,2 или 3 С 1-С 4 алкильными заместителями. Более предпочтительно Y представляет собой фенил, 3,5-диметилфенил, циклогексил или нафт-2-ил. Наиболее предпочтительно Y представляет собой фенил. Предпочтительно Аr представляет собой фенил, необязательно замещенный 1, 2 или 3 атомами галогена. Более предпочтительно Аr представляет собой фенил, замещенный 1 или 2 атомами хлора. Наиболее предпочтительно Аr представляет собой 3,4-дихлорфенил. Предпочтительные примеры соединений формулы (I) представляют собой соединения формулыR-W представляет собой 3,5 диметилфенил, Y представляет собой фенил иZA представляет собой СН 3SО 3-; 2)R-W представляет собой 2,3 диметилфенил, Y представляет собой фенил иZA представляет собой СН 3SО 3-; 3)R-W представляет собой 2 трифторметоксифенил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 4) R-W представляет собой 2-метокси-3 метилфенил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 5) R-W представляет собой 2, 3 дигидробензо[b]фуран-7-ил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 6) R-W представляет собой нафт-2-ил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 7) R-W представляет собой 4-фтор-3 трифторметилфенил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 8) R-W представляет собой 1,2,3,4 тетрагидронафт-5-ил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 9) R-W представляет собой 1,2,3,4 тетрагидронафт-6-ил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 10) R-W представляет собой 5-хлор-2 метоксифенил, Y представляет собой фенил иZA представляет собой СН 3SО 3-; 11)ZA представляет собой СН 3SО 3-; 12)R-W представляет собой 2 трифторметилфенил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 13)R-W представляет собой 2 изопропоксифенил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 14) R-W представляет собой 2-этилфенил,Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 15)R-W представляет собой 2 феноксифенил, Y представляет собой фенил иZA представляет собой СН 3SО 3-; 16) R-W представляет собой бензил, Y представляет собой фенил и ZA представляет собой СН 3SО 3-; 17) R-W - представляет собой 3,5 бис(трифторметил)фенил, Y представляет собой фенил, и ZA представляет собой Сl-; 18)R-W представляет собой 2 метоксифенил, Y представляет собой циклогексил и ZA представляет собой СН 3SО 3-; 6 19) R-W представляет собой 4-фтор-3 трифторметилфенил, Y представляет собой циклогексил и ZA представляет собой СН 3SО 3-; 20) R-W представляет собой 2-метоксифенил, Y представляет собой 3,5-диметилфенил и ZA представляет собой СН 3SО 3-; или 21)R-W представляет собой 2 метоксифенил, Y представляет собой нафт-2-ил и ZA представляет собой СН 3SО 3-; или альтернативную фармацевтически приемлемую соль любого из них (re ZA). Особенно предпочтительными примерами соединений формулы (I) являются 4-фенил-1(3(S)-[3,4-дихлорфенил]-4-[2-(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1-ил]бутил)хинуклидиний метансульфонат и 4-фенил-1-(3(R)-[3,4 дихлорфенил]-4-[2-(1,2,3,4-тетрагидро-5 нафтоил)имидазол-1-ил]бутил)хинуклидиний метансульфонат. Все соединения формулы (I) могут быть получены путем взаимодействия соединения формулы где R, R1, Аr, W и Х такие, как определены ранее для соединения формулы (I), Z является подходящей уходящей группой, способной к образованию фармацевтически приемлемого аниона (ZA), и Z1 является удобной уходящей группой, с соединением формулы где Y такой, как определен ранее для соединения формулы (I), упомянутый способ сопровождается также либо (а), где Z1 является уходящей группой, заменяемой на фармацевтически приемлемый анион (ZA), или (b), необязательно, гдеZA является фармацевтически приемлемым анионом, заменяемым на другой фармацевтически приемлемый анион. Предпочтительными примерами Z являются C1-C4 алкансульфонилоксигруппа, бензолсульфонилоксигруппа,паратолуолсульфонилоксигруппа, хлор, бром и иод. Примером Z1 является трифторметансульфонилоксигруппа. Предпочтительно уходящая группа в соединении формулы (II) образует фармацевтически приемлемый анион (Z/ZA), например метансульфонилокси/метансульфонат, и, следовательно, замена аниона в конце процесса не является необходимой. Возможен обмен фармацевтически приемлемых анионов (re ZA) в рабочей методике, например метансульфонат может быть заменен на хлорид путем обработки выделенного соедине 7 ния или неочищенной смеси водным раствором соляной кислоты. Реакцию соединений (II) и (III) обычно проводят в подходящем растворителе, например ацетонитриле, при повышенных температурах,предпочтительно при температуре его кипения с обратным холодильником. Исходные соединения формулы (II) могут быть получены по схеме 1. Схема 1 где R, R1, Ar, W, X, Z и Z1 такие, как определены ранее для соединения формулы (II), a L и L1 представляют собой удобные уходящие группы,например хлор, бром, иод, метансульфонилокситрифторметансульфонилокси, бензолсульфонилокси и паратолуолсульфонилокси группу. Подходящие условия реакций, реагенты и растворители для любой из стадий, показанных на схеме 1 будут ясны специалистам в данной области из способов получения, приведенных в данном документе. Что касается последней стадии в последовательности реакций, соединение формулы(XV) может быть преобразовано в соединение формулы (II) с использованием традиционных условий. Например, спирт формулы (XV) может быть преобразован в соединение формулы (II), в котором Z является метансульфонилоксигруппой, путем обработки метансульфонилхлоридом, триэтиламином и дихлорметаном, а соединение формулы (II), в котором Z1 является трифторметансульфонилокси группой, может быть получено путем обработки спирта формулы (XV) трифторметансульфоновым ангидридом, необязательно в присутствии подходящего акцептора кислоты, и в подходящем растворителе, например, в дихлорметане. Соединения формулы (XII) могут быть также получены по схеме 2: где R1 и Аr такие, как определены ранее для соединения формулы (XII), a L2 и L3 представляют собой подходящие уходящие группы, например, как ранее определено для L и L1. Подходящие условия реакций, реагенты и растворители для выполнения любой из стадий,показанных на схеме 2 будут ясны специалистам в данной области из способов получения,приведенных в данном документе. Соединения формулы (XV) могут быть также получены по схеме 3. где R, R1, Ar, W и X такие, как определены ранее для соединения формулы (XV), L4 и L5 представляют собой подходящие уходящие группы, например, как ранее определено для L иL1, a P является подходящей защитной группой. Примеры подходящих защитных групп (Р) вместе со способами их удаления можно найти в публикации "Protective Groups in Organic Synthesis", T.W. Greene и P.G.M. Wuts, Second Edition, Wiley-Interscience. Предпочтительным примером Р является тетрагидропиран-2-ил,который может быть удален с помощью ионообменной смолы Amberlyst 15 (товарный знак),или с помощью метанола, насыщенного газообразным хлористым водородом. Подходящие условия реакций, реагенты и растворители для выполнения любой из стадий, 11 показанных на схеме 3 будут ясны специалистам в данной области из способов получения,приведенных в данном документе. Соединения формулы (XXXI) могут быть также получены путем взаимодействия соединения формулы (XXIX) с соединением формулы 12 родия-на-окиси алюминия и в подходящем растворителе, например, в уксусной кислоте. Соединения формулы (IIIA) могут быть получены с помощью способов, подобных описанным в Chem. Ber., 108, 3475 (1975) и J. Org.Chem., 22, 1484 (1957). Соединения формулы (III) могут быть также получены по схеме 5. Схема 5 где R и W такие, как определены ранее для соединения формулы (XXXI), необязательно в присутствии дополнительного акцептора кислоты, например, карбоната калия. Соединения формулы (XXXII) могут быть получены по схеме 4. Схема 4 где R и W такие, как определены ранее для соединения формулы (XXXII). Соединения формулы (III) могут быть получены по способу, подобно описанному вChem., Ber., 108, 3475 (1975). Альтернативно соединения формулы (III),где Y является необязательно замещенным циклогексилом, как ранее определено в определении Y для соединения формулы (I), могут быть получены путем каталитического гидрирования соединения формулы где Y является необязательно замещенным фенилом, как ранее определено в вышеупомянутом определении Y. Восстановление может быть проведено в атмосфере водорода с использованием подходящего катализатора, например, где Y такой, как определен ранее для соединения формулы (III). 13 Подходящие условия реакций, реагенты и растворители для любой из стадий, показанных на схеме 5, будут ясны специалистам в данной области из способов получения, приведенных в данном документе. Все вышеперечисленные реакции и способы получения новых исходных веществ, используемых в предшествующих способах являются общепринятыми, и соответствующие реагенты и условия реакций для их проведения или получения, также как и способы выделения целевых продуктов будут ясны специалистам в данной области из литературных источников,примеров и способов получений, приведенных в данном документе. Сродство соединений формулы (I) к рецептору NK1 человека может быть определено invitro путем определения их способности ингибировать связывание [3H]-вещества Р с мембранами, полученными из клеточной линии человека IM9, экспрессирующей рецептор NK1 человека, с помощью модификации способа, описанного в McLean, S.et al, J. Pharm. Exp. Ther., 267,472-9 (1993), в котором используют целые клетки. Сродство соединений формулы (I) к рецептору NK2 человека может быть определено invitro путем определения их способности конкурировать с [3H]-NKA (нейрокинином А) за связывание с мембранами, полученными из клеток яичника китайского хомяка, экспрессирующих клонированный рецептор NK2 человека. В этом способе промытые мембраны клеток яичника китайского хомяка получают так, как описано в предыдущем способе, где вместо этих клеток используются клетки IM9. Мембраны инкубируют (90 мин, 25 С) с [3H]-NKA и с тестируемым соединением в разных концентрациях. Неспецифическое связывание определяют в присутствии 10 мкМ NKA. Антагонистическая активность соединений формулы (I) по отношению к рецептору NK1 человека может быть определена in vitro путем тестирования их способности проявлять антагонистическую активность по отношению к сократительным эффектам вещества Р в деэпитализированных полосках трахеи морских свинок. Ткани могут быть получены из морских свинок(350-600 г), которых умерщвляют путем оглушения и обескровливания. Ампутированную трахею очищают от соединительной ткани и продольно вскрывают по стороне, противоположной полосе трахейной мышцы. Затем удаляют эпителиальный слой, протирая внутреннюю поверхность трахеи ватным тампоном. Разрезают на полоски шириной приблизительно в 4 хрящевых кольца и устанавливают под натяжением в 1 г в бане для органов, содержащей раствор Кребса (состав: NaCl 118 мМ, КСl 4,6 мМ, NaНСО 3 25 мМ, КН 2 РO4 1,4 мМ, MgSO4 1,2 мМ, CaCl2 2,5 мМ, глюкоза 11 мМ) при 37 С в атмосфере 95% O2/5% CO2. Потенциальное дей 002424 14 ствие вещества Р на популяцию рецептора NK2,обнаруженную в этой ткани, может быть предотвращено путем включения селективного антагониста рецептора NK2SR-48 968 (1 мкМ) в буферный раствор Кребса. Кроме того, для устранения влияния эндогенных простаноидов добавляют индометацин (3 мкМ). Изменение растяжения ткани в ответ на кумулятивное добавление агониста вещества Р записывали изометрически. Эффективность соединений формулы(I) может быть оценена по величине полученного сдвига в кривой дозе вещества Р-ответ, с помощью стандартного анализа Шильда, спустя 30 мин после инкубации соединения с тканью. Деэпитализированный препарат из полосок трахеи морских свинок может быть также использован для оценки in vitro антагонистической активности соединений формулы (I) по отношению к рецептору NK2 путем использования селективного агониста [-Ala8]NKA(4-10) рецептора NK2 в качестве контрактильного агента. Для таких исследований полоски готовят и устанавливают в бане для органов так, как описано выше, используя раствор Кребса следующего состава: NaCl 118 мМ, КСl 4,6 мМ, NaHCO3 25 мМ, KH2PO4 1,4 мМ, MgSO4 1,2 мМ, CaCl2 2,5 мМ, глюкоза 11 мМ, индометацин 3 мкМ. Эффективность этих соединений может быть оценена по величине полученного сдвига в кривой дозе [-Ala8]NKA(4-10) ответ, с помощью стандартного анализа Шильда, спустя 30 мин после инкубации соединения с тканью. Соединения формулы (I) могут быть тестированы in vitro на антагонистическую активность по отношению к рецептору NК 3 путем тестирования их способности проявлять антагонистическую активность по отношению к сократительным эффектам селективного агониста рецептора NК 3 сенктида в подвздошной кишке морских свинок с помощью способа Maggi et al.,Br. J. Pharmacol., 101, 996-1000 (1990). При применении человеком соединения формулы (I) могут быть введены индивидуально, но обычно их вводят в смеси с фармацевтическим носителем, выбранным в соответствии с предполагаемым способом введения и стандартной фармацевтической практикой. Например, они могут быть введены перорально или подъязычно в виде таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах, или в шариках, либо индивидуально, либо в смеси с эксципиентами,или в виде эликсиров, растворов или суспензий,содержащих ароматизаторы или красители. Они могут быть введены парентерально путем инъекции, например, внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше использовать в виде стерильного водного раствора, который может содержать другие вещества, например, количество солей или глюкозы, достаточное для того, чтобы 15 сделать раствор изотоническим по отношению к крови. При пероральном и парентеральном введении людям, уровень ежедневной дозы соединений формулы (I) составляет от 0,01 до 20 мг/кг(в единичных или разделенных дозах). Таким образом таблетки или капсулы соединений содержат от 1 мг до 1,0 г активного соединения для однократного, двукратного и многократного введения за прием, как назначено. Врач в любом случае определяет актуальную дозировку, которая наиболее подходит для индивидуального пациента и варьирует в зависимости от возраста, веса и восприимчивости конкретного пациента. Вышеприведенные дозировки представляют собой образец среднего случая. Конечно, могут существовать индивидуальные случаи, когда применяются, более высокие или более низкие дозы, и они находятся в сфере настоящего изобретения. Соединения формулы (I) могут также быть введены через нос или путем ингаляции, и их удобно наносить в виде сухого порошкаингалятора или в виде аэрозольного спрея из контейнера под давлением или распылителя, с использованием подходящего пропелланта, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана,такого как 1,1,1,2-тетрафторэтан (HFA 134A[товарный знак]) или 1,1,1,2,3,3,3-гептафторпропана (HFA 227EA [товарный знак]), диоксида углерода или другого подходящего газа. В случае аэрозоля, находящегося под давлением,дозировочная единица может быть определена с помощью клапана для нанесения отмеренного количества. Контейнер под давлением или распылитель может содержать раствор или суспензию активного соединения, например, с использованием смеси этанола и пропелланта в качестве растворителя, которая может дополнительно содержать смазывающий агент, например, триолеат сорбитана. Капсулы и картриджи (сделанные, например, из желатина), применяемые в ингаляторе или инжекторе, могут содержать порошковую смесь соединения формулы (I) и подходящую порошковую основу, такую как лактозу или крахмал. Аэрозольные составы предпочтительно готовят так, что каждая отмеренная доза или порция аэрозоля содержит от 20 до 1000 мкг соединения формулы (I) для передачи пациенту. Полная дневная доза, при применении аэрозоля,находится в интервале от 20 мкг до 20 мг, она может быть введена как однократная доза, или,чаще, ее разделяют на несколько доз, принимаемых в течение дня. Альтернативно, соединения формулы (I) могут быть введены в виде суппозиториев или пессариев, или они могут применяться наружно в виде лосьонов, растворов, кремов, мазей или присыпок. Например, они могут быть включены в крем, состоящий из водной эмульсии полиэти 002424 16 ленгликолей, или из жидкого парафина, или они могут быть включены в концентрации от 1 до 10 мас.% в мазь, состоящую из белого воска или белого мягкого парафинового основания, и из требуемых стабилизаторов и консервантов. Соединения формулы (I) могут быть также введены через кожу с помощью кожного пластыря. Необходимо отметить, что лечение включает исцеляющее лечение, паллиативное и профилактику. Таким образом, данное изобретение далее представляет:(I) фармацевтическую композицию, включающую соединение формулы (I) вместе с фармацевтически приемлемым разбавителем или носителем;(II) соединение формулы (I) или его фармацевтически приемлемую композицию для применения в качестве лекарственного средства;(III) применение соединения формулы (I),или его фармацевтически приемлемой композиции в производстве лекарственного средства для лечения заболевания путем продуцирования антагонистического эффекта на тахикининовый рецептор, или на комбинацию тахикининовых рецепторов;(IV) применение по пункту (III), где антагонистический эффект оказывается на NK1 и(V) применение по пункту (III) или (IV),где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз,астма или воспалительное заболевание кишечника, расстройство центральной нервной системы (ЦНС), такое как беспокойство, депрессия,деменция или психоз, желудочно-кишечное(ЖК) расстройство, такое как функциональное кишечное заболевание, болезненно чувствительный кишечный синдром, желудочноэсофагеальный обратный ток, недержание дефекации, колит или болезнь Крона, заболевание,вызываемое Helicobacter pylori или другой уреаза-положительной грамотрицательной бактерией, заболевание урогенитального тракта, такое как недержание, гиперрефлексия или цистит,легочное заболевание, такое как хроническая обструктивная болезнь дыхательных путей, аллергические заболевания, такие как экзема, контактный дерматит, атопический дерматит или ринит, гиперчувствительность, например, к сумаху укореняющемуся, периферическую невропатию, такую как диабетическая невропатия,невралгия, каузалгия, болевая невропатия, ожог,герпетическая невралгия или постгерпетическая невралгия, рвота, кашель, мигрень, или острая,или хроническая боль;(VI) способ лечения заболевания человека путем продуцирования антагонистического эффекта на тахикининовый рецептор или на комбинацию тахикининовых рецепторов, который включает лечение упомянутого человека эффек 17 тивным количеством соединения формулы (I) или его фармацевтически приемлемой композицией;(VII) способ по пункту (VI), где антагонистический эффект оказывается на NK1 и NK2 тахикининовые рецепторы человека;(VIII) способ по пункту (VI) или (VII), где заболевание представляет собой воспалительное заболевание, такое как артрит, псориаз, астма или воспалительное заболевание кишечника,расстройство центральной нервной системы(ЦНС), такое как беспокойство, депрессия, деменция или психоз, желудочно-кишечное (ЖК) расстройство, такое как функциональное кишечное заболевание, болезненно чувствительный кишечный синдром, желудочно-эсофагеальный обратный ток, недержание дефекации,колит или болезнь Крона, заболевание, вызываемое Helicobacter pylori или другой уреазаположительной грамотрицательной бактерией,заболевание урогенитального тракта, такое как недержание, гиперрефлексия или цистит, легочное заболевание, такое как хроническая обструктивная болезнь дыхательных путей, аллергическое заболевание, такое как экзема, контактный дерматит, атопический дерматит или ринит, гиперчувствительность, например, к сумаху укореняющемуся, периферическую невропатию, такую как диабетическая невропатия,невралгия, каузалгия, болевая невропатия, ожог,герпетическая невралгия или постгерпетическая невралгия, рвота, кашель, мигрень, или острая,или хроническая боль; и(IX) соединение формулы (II), (XI), (XII),(XIII), (XIV), (XV), (XXIII), (XXX) или (XXXI): при условии, что для соединения формулы(XXIII), когда R1 является Н, а "С 1-С 3 алкилен" является СН 2, тогда Аr не является 2-хлорфенилом или 2,4-дихлорфенилом. Следующие примеры иллюстрируют получение соединений формулы (I). 4-Фенил-1-(3-[3,4-дихлорфенил]-4-[2-(3,5-диметилбензоил)имидазол-1-ил]бутил)хинуклидиний метансульфонат 1-Метансульфонилокси-3-(3,4-дихлорфенил)-4-[2-(3,5-диметилбензоил)имидазол-1-ил] бутан (0,71 г) (см. получение 74) и 4 фенилхинуклидин (0,32 г) (cм. J. Org. Chem., 22,1484, (1957 растворяют в ацетонитриле (10 мл) и смесь нагревают с обратным холодильником в течение 4 ч. Растворитель удаляют при пониженном давлении и полученный остаток растворяют в дихлорметане, после чего растворитель удаляют при пониженном давлении. Остаток подвергают хроматографии на силикагеле,элюируя градиентом смеси растворителей ди 002424 18 хлорметан:метанол от 95:5 до 85:15 (об./об.), с получением продукта в виде белой пены. Затем его растирают с диэтиловым эфиром, фильтруют и высушивают при комнатной температуре при пониженном давлении, получая 4-фенил-1(3-[3,4-дихлорфенил]-4-[2-(3,5-диметилбензоил) имидазол-1-ил]бутил)хинуклидиний метансульфонат (0,71 г) в виде твердого вещества белого цвета. 1 получают по способу, подобно способу примера 1, используя соответствующий мезилат (см. получения 75-84 и 86-90) и 4-фенилхинуклидин в качестве исходных веществ. 1-Метансульфонилокси-3-(3,4-дихлорфенил)-4-2-[3,5-бис-(трифторметил)бензоил] имидазол-1-илбутан (0,7 г) (см. получение 85) и 4-фенилхинуклидин (0,32 г) (см. J. Org. Chem.,22, 1484, (1957 растворяют в ацетонитриле (10 мл) и смесь нагревают с обратным холодильником в течение 18 ч. Растворитель удаляют при пониженном давлении, полученный остаток растворяют в дихлорметане и дважды промывают 2N водным раствором хлористоводородной кислоты. Затем органическую фазу сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении,получая остаток, который подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан : метанол от 95:5 до 90:10 (об./об.), с получением 4-фенил-1-(3[3,4-дихлорфенил]-4-2-[3,5-бис(трифторметил) бензоил]имидазол-1-илбутил)хинуклидиний хлорида (0,37 г) в виде белой пены. 1 Н-ЯМР (CDCl3):8,69 (2 Н, с), 8,04 (1 Н,с), 7,54 (1H, с), 7,14-7,41 (9 Н, м), 4,76-4,96 (2 Н,м), 3,70-3,98 (7 Н, м), 3,80-3,93 (1H, м), 3,10-3,21 1-Метансульфонилокси-3(S)-[3,4-дихлорфенил]-4-[2-(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1-ил]бутан (0,82 г) (см. получение 105) и 4-фенилхинуклидин (0,35 г) (см. J. Org. Chem.,22, 1484, (1957 растворяют в ацетонитриле (10 мл), смесь нагревают с обратным холодильником в течение 4 ч и затем оставляют стоять при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан:метанол от 9:1 до 8:2 (об./об.), с получением продукта в виде белой пены. Его растворяют в дихлорметане, фильтруют, из фильтрата удаляют растворитель, получая 4 фенил-1-(3(S)-[3,4-дихлорфенил]-4-[2-(1,2,3,4 тетрагидро-5-нафтоил)имидазол-1-ил]бутил)хинуклидиний метансульфонат (0,7 г) в виде белого порошка. 1 Н-ЯМР (CDCl3):7,05-7,44 (13 Н, м), 4,804,94 (2 Н, м), 3,61-3,89 (7 Н, м), 3,38-3,71 (1 Н, м),3,01-3,12 (1 Н, м), 2,76-2,91 (5 Н, м), 2,22-2,69 1-Метансульфонилокси-3-(3,4-дихлорфенил)-4-[2-(2-метоксибензоил)имидазол-1-ил] бутан (0,59 г) (см. получение 84) и 4-циклогексилхинуклидин (0,27 г) (см. получение 1) растворяют в ацетонитриле (8 мл) и нагревают с обратным холодильником в течение 3,5 ч. Растворитель удаляют при пониженном давлении и полученный остаток растворяют в дихлорметане, после чего растворитель удаляют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан : метанол от 95:5 до 85:15 (об./об.), с получением 4-циклогексил-1-(3-[3,4-дихлорфенил]-4-[2-(2-метоксибензоил)имидазол-1-ил]бутил)хинуклидиний метансульфоната (0,69 г) в виде белой пены. 1 Н-ЯМР (СDCl3):7,21-7,49 (6 Н, м), 6,947,08 (3 Н, м), 4,87 (1 Н, дд), 4,71 (1 Н, дд), 3,77 Указанное соединение получают по способу, подобно способу примера 18, используя 1 метансульфонилокси-3(R)-(3,4-дихлорфенил)-4[2-(1,2,3,4-тeтpaгидpo-5-нaфтoил)имидaзoл-1 ил]бyтан (см. получение 106) и 4-фенилхинуклидин (0,36 г) (cм. J. Org. Chem., 22, 1484,(1957 в качестве исходных веществ. 1 Н-ЯМР (CDCl3):7,05-7,44 (13 Н, м), 4,804,94 (2 Н, м), 3,61-3,89 (7 Н, м), 3,38-3,71 (1 Н, м),3,01-3,12 (1 Н, м), 2,76-2,91 (5 Н, м), 2,22-2,69 1-Метансульфонилокси-3-(3,4-дихлорфенил)-4-[2-(3-трифторметил-4-фторбензоил)имидазол-1-ил]бутан (0,77 г) (см. получение 80) и 4 циклогексилхинуклидин (0,31 г) (см. получение 1) растворяют в ацетонитриле (10 мл) и нагревают с обратным холодильником в течение 5 ч. Растворитель удаляют при пониженном давлении и полученный остаток растворяют в дихлорметане, после чего растворитель удаляют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан : метанол от 95:5 до 80:20 (об./об.) с получением 4 циклогексил-1-(3-[3,4-дихлорфенил]-4-[2-(3 23 трифторметил-4-фторбензоил)имидазол-1-ил] бутил)хинуклидиний метансульфоната (0,69 г) в виде белой пены. 1 1-Метансульфонилокси-3-(3,4-дихлорфенил)-4-[2-(2-метоксибензоил)имидазол-1-ил] бутан (0,55 г) (см. получение 84) и 4-(3,5 диметилфенил)хинуклидин (0,28 г) (см. получение 12) растворяют в ацетонитриле (10 мл) и нагревают с обратным холодильником в течение 2,5 ч. Растворитель удаляют при пониженном давлении, полученный остаток растворяют в дихлорметане и растворитель удаляют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан : метанол от 95:5 до 90:10 (об./об.), с получением 4-(3,5 диметилфенил)-1-(3-[3,4-дихлорфенил]-4-[2-(2 метоксибензоил)имидазол-1-ил]бутил) хинуклидиний метансульфоната (0,69 г) в виде белой пены. 1 1-Метансульфонилокси-3-(3,4-дихлорфенил)-4-[2-(2-метоксибензоил)имидазол-1-ил] бутан (0,55 г) (см. получение 84) и 4-(2-нафтил) хинуклидин (0,31 г) (см. получение 7) растворяют в ацетонитриле (10 мл) и нагревают с обратным холодильником в течение 2,5 ч. Растворитель удаляют при пониженном давлении, полученный остаток растворяют в дихлорметане и 24 растворитель удаляют при пониженном давлении. Остаток подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан : метанол от 95:5 до 85:15(10 Н, м), 3,34-3,66 (1H, м), 3,03-3,16 (1H, м),2,84 (3 Н, с), 2,30-2,55 (8 Н, м) м.д. Следующие способы получения описывают получение некоторых исходных веществ,используемых в синтезе соединений предшествующих примеров. Получение 1. Циклогексилхинуклидин.Chem., 22, 1484, (1957 растворяют в ледяной уксусной кислоте (25 мл), добавляют 5% (мас.) родий на окиси алюминия (2 г) и смесь гидрируют в течение 5 дней при 345 кПа (50 фунтов/кв.дюйм). Смесь фильтруют через короткую колонку с фильтром Arbacel (товарный знак) и подложку промывают метанолом. Фильтрат собирают и растворитель удаляют при пониженном давлении, получая остаток, который растворяют в воде. рН доводят до 10 путем добавления 0,88 водного раствора аммиака. Водную смесь экстрагируют этилацетатом (х 3),органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 4 циклогексилхинуклидин (4,7 г) в виде твердого вещества бледно-розового цвета. 1 Н-ЯМР (CDCl3):2,75-2,96 (6 Н, м), 1,601,85 (5 Н, м), 1,06-1,45 (9 Н, м), 1,80-1,98 (3 Н, м) м.д. Получение 2. Этил 2-(1-бензилпиперидин 4-илиден)-2-цианоацетат.N-Бензилпиперидин-4-он (25 г), этилцианоацетат (16,4 г), ледяную уксусную кислоту (6 мл) и ацетат аммония (2,54 г) нагревают вместе в толуоле (200 мл) , удаляя воду с помощью прибора Дина и Старка, в течение 90 мин. Смесь охлаждают, добавляют дополнительное количество толуола (100 мл) и раствор последовательно промывают водой (100 мл) и насыщенным раствором соли (100 мл), при этом выпадает в осадок красный маслянистый продукт. Фазы разделяют и маслянистый продукт растворяют в дихлорметане. Толуольный и дихлорметановый 25 растворы объединяют и растворители удаляют при пониженном давлении, получая остаток. Остаток растворяют в дихлорметане и промывают последовательно водой и насыщенным водным раствором гидрокарбоната натрия, затем удаляют растворитель при пониженном давлении. Неочищенный продукт подвергают хроматографии на силикагеле, элюируя смесью дихлорметан:метанол 98:2 (об./об.), с получением указанного в заголовке соединения (30,8 г) в виде масла. 1 2-Бромнафталин (26 г) растворяют в безводном диэтиловом эфире (100 мл) и 1/5 часть этого раствора добавляют при энергичном перемешивании к смеси магниевой стружки (3,3 г) и 2-3 кристалликов иода в атмосфере азота. Для инициации образования реагента Гриньяра применяют слабое нагревание, так как оказалось трудным поддерживать самопроизвольное кипение с обратным холодильником. Остаток раствора 2-бромнафталина добавляют в 4 приема,позволяя утихнуть кипению после добавления каждой порции, и затем смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч, после чего образуются две темные органические фазы. Смесь охлаждают на бане со льдом и добавляют безводный тетрагидрофуран (50 мл), затем по каплям добавляют раствор этил 2-(1-бензилпиперидин-4-илиден)2-цианоацетата (12 г) (см. получение 2) в тетрагидрофуране (100 мл). Однофазную смесь перемешивают при 0 С в течение 30 мин, затем оставляют стоять при комнатной температуре в течение ночи. Затем смесь выливают в насыщенный водный раствор хлорида аммония (450 мл) и экстрагируют дважды диэтиловым эфиром. Органические экстракты объединяют и растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:диэтиловый эфир градиентом от 4:0 до 4:1 (об./об.), с получением указанного в заголовке соединения (5,9 г) в виде масла. 1 Раствор гидроксида калия (10 г) в воде (30 мл) добавляют к раствору этил 2-циано-2-(1 бензил-4-(2-нафтил)пиперидин-4-ил)-2-этаноата(5,9 г) (см. получение 3) в этаноле (40 мл), что приводит к образованию суспензии, которую перемешивают при комнатной температуре в течение ночи и затем нагревают на паровой бане до образования прозрачного раствора. Этот раствор распределяют между двумя сосудами для микроволнового нагрева и подвергают микроволновому нагреву при давлении 690 кПа (100 фунтов/кв.дюйм)/100% энергоотдачи в течение 5 ч. Затем растворы объединяют, растворитель удаляют при пониженном давлении и остаток подвергают 4-кратной азеотропной перегонке с толуолом для удаления остатков воды. Остаток растворяют в этаноле (250 мл) , охлаждают на бане со льдом и раствор насыщают газообразным хлористым водородом, на этой стадии образуется осадок. Смесь оставляют стоять при комнатной температуре в течение 3 дней,фильтруют и из фильтрата удаляют растворитель при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле, элюируя градиентом смеси растворителей дихлорметан:метанол от 98:2 до 96:4(об./об.), с получением гидрохлорида, указанного в заголовке соединения. Затем соль хлористо-водородной кислоты распределяют между дихлорметаном и насыщенным водным раствором карбоната натрия, органическую фазу отделяют, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение Этил 2-(1-бензил-4-(2-нафтил)пиперидин 4-ил)-2-этаноат (5,8 г) (см. получение 4) растворяют в безводном диэтиловом эфире (100 мл),охлаждают на бане со льдом и порциями добавляют алюмогидрид лития (0,57 г). Смесь перемешивают при комнатной температуре в течение 30 минут, затем осторожно добавляют воду(0,8 мл), 2N водный раствор гидроксида натрия(0,8 мл) и еще воду (1,6 мл). Смесь перемешивают в течение 20 минут и полученный гранулярный осадок удаляют путем фильтрования. 27 Растворитель удаляют из фильтрата при пониженном давлении, получая твердое вещество,которое растворяют в дихлорметане, сушат над безводным сульфатом натрия и растворитель снова удаляют при пониженном давлении, получая 4-(2-нафтил)-4-(2-гидроксиэтил)-N-бензилпиперидин (2,2 г) в виде твердого вещества белого цвета. Гранулярный осадок растирают с дихлорметаном и фильтруют. Фильтрат промывают водой, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая вторую порцию 4-(2 нафтил)-4-(2-гидроксиэтил)-N-бензилпиперидина (2,7 г) в виде твердого вещества белого цвета. 1 4-(2-Нафтил)-4-(2-гидроксиэтил)-N-бензилпиперидин (4,9 г) (см. получение 5) растворяют в пиридине (30 мл), охлаждают на бане со льдом и добавляют 4-метилфенилсульфонилхлорид (3,0 г). Перед удалением растворителя при пониженном давлении смесь оставляют при 0 С в течение 16 ч. Остаток суспендируют в 10% (мас.) водном растворе карбоната калия(120 мл) и экстрагируют толуолом (2 х 130 мл). Объединенные органические фазы промывают 10% (мас.) водным раствором карбоната калия,сушат над безводным карбонатом калия в течение 10 мин и фильтруют. Фильтрат собирают и при пониженном давлении уменьшают объем до 60 мл, получая суспензию. Затем ее нагревают при 90 С в течение 6 ч, оставляют стоять при комнатной температуре в течение ночи и полученный осадок отфильтровывают. Осадок последовательно промывают толуолом и диэтиловым эфиром и высушивают, получая 4-(2 нафтил)-N-бензилхинуклидиний 4-метилфенилсульфонат (3,5 г) в виде твердого вещества белого цвета. 1(мас.) палладий на угле (0,5 г) и смесь гидрируют в течение 40 ч при 345 кПа (50 фунтов/кв. дюйм). Смесь фильтруют через короткую колонку с фильтром Arbacel (товарный знак) и растворитель удаляют из фильтрата при пониженном давлении, получая остаток. Его распределяют между диэтиловым эфиром и 1N водным раствором гидроксида натрия. Две фазы разделяют и водную фазу экстрагируют дважды диэтиловым эфиром. Органические фазы объединяют и растворитель удаляют при пониженном давлении. Полученный остаток растворяют в этилацетате и раствор последовательно промывают 0,88 водным раствором аммиака и насыщенным раствором соли, после чего сушат над безводным сульфатом натрия. Затем растворитель снова удаляют при пониженном давлении, получая 4-(2-нафтил)хинуклидин (1,56 г) в виде твердого вещества. 1 1,3-Диметил-5-бромбензол (15,6 г) растворяют в безводном диэтиловом эфире (60 мл) и добавляют при энергичном перемешивании к смеси магниевой стружки (2,2 г) и 2-3 кристалликов иода в атмосфере азота. Для инициации образования реагента Гриньяра применяют слабое нагревание, и когда самопроизвольное кипение утихает, смесь нагревают при температуре кипения с обратным холодильником в течение дополнительно 30 мин. Смесь охлаждают на бане со льдом и добавляют раствор этил 2-(1 бензилпиперидин-4-илиден)-2-цианоацетата (8,0 г) (см. получение 2) в безводном тетрагидрофуране (80 мл) в течение 20 мин. Смесь перемешивают при 0 С в течение 15 мин, затем оставляют стоять при комнатной температуре в течение 3 дней. Затем смесь выливают в насыщенный водный раствор хлорида аммония (300 мл) и экстрагируют дважды диэтиловым эфиром. Органические экстракты объединяют и растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:диэтиловый эфир градиентом от 3:0 до 3:1 (об./об.), с получением указанного в заголовке соединения (4,7 г) в виде масла. 1 Раствор гидроксида калия (3,4 г) в воде (20 мл) добавляют к раствору этил 2-циано-2-(1 бензил-4-(3,5-диметилфенил)пиперидин-4-ил) этаноата (4,7 г) (см. получение 8) в этаноле (24 мл) и смесь подвергают микроволновому нагреву при давлении 345 кПа(100 фунтов/кв.дюйм)/100% энергоотдачи в течение 2,5 ч. Растворитель удаляют при пониженном давлении и остаток подвергают азеотропной перегонке с толуолом для удаления остатков воды. Остаток растворяют в этаноле (100 мл),охлаждают на бане со льдом и раствор насыщают газообразным хлористым водородом. Смесь оставляют стоять при комнатной температуре в течение ночи, затем проводят повторное насыщение раствора газообразным хлористым водородом и оставляют стоять в течение еще 24 ч. Раствор фильтруют и из фильтрата удаляют растворитель при пониженном давлении, получая остаток, который растворяют в насыщенном водном растворе карбоната натрия и экстрагируют дважды дихлорметаном. Органические фазы объединяют, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле,элюируя смесью растворителей дихлорметан:метанол градиентом от 97:3 до 90:10(50 мл), охлаждают на бане со льдом и порциями добавляют алюмогидрид лития (0,21 г). Смесь перемешивают при комнатной температуре в течение 45 мин, затем осторожно добавляют воду (0,3 мл), 2N водный раствор гидроксида натрия (0,3 мл) и еще воду (0,6 мл). Смесь перемешивают в течение 20 мин, полученный гранулярный осадок удаляют путем фильтрования и промывают диэтиловым эфиром. Растворитель удаляют из фильтрата при пониженном 30 давлении, получая твердое вещество, которое растворяют в дихлорметане, сушат над безводным сульфатом натрия, и растворитель снова удаляют при пониженном давлении, получая 4(3,5-диметилфенил)-4-(2-гидроксиэтил)-Nбензилпиперидин (1,67 г) в виде масла. 1 Н-ЯМР (CDCl3):7,20-7,35 (5 Н, м), 6,90 4-(3,5-Диметилфенил)-4-(2-гидроксиэтил)N-бензилпиперидин (1,6 г) (см. получение 10) растворяют в пиридине (10 мл), охлаждают на бане со льдом и добавляют 4-метилфенилсульфонилхлорид (1,0 г) 4-мя порциями в течение 10 мин. Перед удалением растворителя при пониженном давлении смесь оставляют при 0 С в течение 16 ч. Остаток суспендируют в 10%(мас.) водном растворе карбоната калия (30 мл) и экстрагируют толуолом (50 мл). Органическую фазу промывают 10% (мас.) водным раствором карбоната калия, сушат над безводным карбонатом калия и фильтруют. Фильтрат собирают и при пониженном давлении уменьшают объем до 12 мл, получая суспензию, которую затем нагревают при 90 С в течение 3 ч, оставляют охлаждаться до комнатной температуры и уменьшают объем до 5 мл, при этом продукт начинает осаждаться из раствора. Добавляют диэтиловый эфир (30 мл), осадок отфильтровывают, промывают диэтиловым эфиром и высушивают,получая 4-(3,5-диметилфенил)-Nбензилхинуклиний 4-метилфенилсульфонат(1,59 г) в виде твердого вещества белого цвета. 1 Н-ЯМР (CDCl3):7,96 (2 Н, д), 7,58 (2 Н,д), 7,30-7,40 (3 Н, м), 7,16 (2 Н, д), 6,96 (1 Н, с),6,75 (2 Н, с), 4,86 (2 Н, д), 3,72-3,82 (6 Н, м), 2,34 4-(3,5-Диметилфенил)-N-бензилхинуклиний 4-метилфенилсульфонат (1,4 г) (см. получение 11) растворяют в метаноле (14 мл), добавляют 10% (мас.) палладий-на-угле (0,2 г) и смесь гидрируют в течение 40 ч при 345 кПа (50 фунтов/кв.дюйм). Смесь фильтруют через короткую колонку с фильтром Arbacel (товарный знак) и растворитель удаляют при пониженном давлении, получая остаток. Его распределяют между диэтиловым эфиром и 1N водным рас 31 твором гидроксида натрия. Две фазы разделяют и водную фазу экстрагируют дважды диэтиловым эфиром. Органические фазы объединяют и растворитель удаляют при пониженном давлении. Полученный остаток растворяют в этилацетате и раствор промывают насыщенным раствором соли, после чего сушат над безводным сульфатом натрия. Затем растворитель снова удаляют при пониженном давлении, получая 4(3,5-диметилфенил)хинуклидин (0,59 г) в виде твердого вещества белого цвета. 1 Н-ЯМР (CDCl3):6,89 (2 Н, с), 6,83 (1 Н,с), 2,95-3,05 (6 Н, м), 2,33 (6 Н, с), 1,70-1,81 (6 Н,м) м.д. Получение 13. 2-(3,4-Дихлорфенил)-3-(1,3 диоксолан-2-ил)пропаннитрил. Гидрид натрия (60% (мас.) дисперсия в минеральном масле) (4,73 г) суспендируют в тетрагидрофуране (70 мл) в атмосфере азота и смесь охлаждают на бане со льдом. Раствор 3,4 дихлорфенилацетонитрила (20 г) в тетрагидрофуране (80 мл) добавляют по каплям в течение 35 мин, смеси дают нагреться до комнатной температуры и оставляют перемешиваться в течение 16 ч. Добавляют 2-бромметил-1,3 диоксолан (19,71 г) и тетра-н-бутиламмоний иодид (2 г) и полученную смесь нагревают при температуре кипения с обратным холодильником в течение 4 ч. Смесь охлаждают и распределяют между этилацетатом и водой. Органический слой отделяют и промывают насыщенным раствором соли. Органические растворители удаляют при пониженном давлении, получая коричневое масло, которое подвергают хроматографии на силикагеле, используя в качестве элюента смесь этилацетат : гексан 80:20(об./об.), с получением продукта в виде оранжевого подвижного масла. Это масло затем растворяют в метаноле, охлаждают на льду и, образовавшийся осадок отфильтровывают, промывают метанолом и сушат при пониженном давлении, получая 2-(3,4-дихлорфенил)-3-(1,3 диоксолан-2-ил)пропаннитрил (15,8 г) в виде твердого вещества белого цвета. 1 Н-ЯМР (CDCl3):7,40-7,50 (2 Н, м), 7,207,25 (1 Н, дд), 4,95 (1H, дд), 3,82-4,05 (5 Н, м),2,30-2,40 (1H, м), 2,05-2,15 (1 Н, м) м.д. Получение 14. 2-(3,4-Дихлорфенил)-3-(1,3 диоксолан-2-ил)пропан-1-аль. 32 лаждают до -70 С в атмосфере азота. Затем в течение 50 мин добавляют диизобутилалюминий гидрид (200 мл 1,5 М раствор в толуоле), по истечении этого времени раствор становится прозрачным. Смесь перемешивают при -70 С в течение дополнительных 30 мин и затем оставляют медленно нагреваться до -20 С. Затем осторожно (экзотермическая реакция) добавляют воду (24 мл), после чего выливают смесь в 15%(мас.) водный раствор лимонной кислоты (1800 мл). Добавляют толуол (100 мл) и смесь энергично перемешивают в течение 1 ч. Полученную эмульсию фильтруют через короткую колонку с фильтром Arbacel (товарный знак), получая две прозрачные фазы, которые разделяют. Органическую фазу промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 2-(3,4-дихлорфенил)-3-(1,3-диоксолан-2-ил)пропан-1-аль в виде желтого масла (53,5 г). 1 Н-ЯМР (CDCl3):9,90 (1H, с), 7,10-7,50 К охлажденному на льду раствору 2-(3,4 дихлорфенил)-3-(1,3-диоксолан-2-ил)пропан-1 аля (53,5 г) (см. получение 14) в этаноле (300 мл) добавляют двумя порциями боргидрид натрия (5 г) в течение 40 мин. Смесь перемешивают в течение еще 30 мин, затем удаляют растворитель при пониженном давлении, получая остаток. Его суспендируют в воде (200 мл), охлаждают до 0 С и смесь подкисляют (рН 6) ледяной уксусной кислотой. Добавляют дихлорметан и водную фазу подщелачивают (рН 8) путем добавления твердого карбоната натрия. Добавляют дополнительное количество дихлорметана (200 мл) и разделяют органическую и водную фазы. Водную фазу дополнительно экстрагируют дихлорметаном (200 мл). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 2-(3,4-дихлорфенил)3-(1,3-диоксолан-2-ил)пропан-1-ол (54,6 г) в виде желтого масла. 1 Н-ЯМР (СDСl3):7,30-7,45 (2 Н, м), 7,09 К охлажденному на льду раствору 2-(3,4 дихлорфенил)-3-(1,3-диоксолан-2-ил)пропан-1 ола (12 г) (см. получение 15) и триэтиламина(5,7) в дихлорметане (100 мл) добавляют метансульфонилхлорид (5,5 г) в течение 10 мин. Смесь перемешивают в течение 30 мин, после чего дополнительно добавляют дихлорметан (50 мл). Затем раствор последовательно промывают водой (3 х 50 мл) и насыщенным раствором соли(50 мл), после чего сушат над безводным сульфатом натрия. Удаляют растворитель при пониженном давлении, получая 1-метансульфонилокси-2-(3,4-дихлорфенил)-3-(1,3-диоксолан-2 ил)пропан в виде желтого масла (15,6 г), которое отвердевает при стоянии. 1 1-Метансульфонилокси-2-(3,4-дихлорфенил)-3-(1,3-диоксолан-2-ил)пропан (15,5 г) (см. получение 16) и имидазол (9 г) растворяют в безводном ацетонитриле (100 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 90 ч. Растворитель удаляют при пониженном давлении, остаток растворяют в дихлорметане (100 мл) и растворитель снова удаляют при пониженном давлении. Остаток растворяют в дихлорметане (300 мл) и промывают достаточным количеством водного раствора карбоната натрия так, чтобы рН водной фазы гарантированно достигал 14. Две фазы разделяют и водную фазу экстрагируют дихлорметаном (100 мл). Затем органические фазы объединяют и растворитель удаляют при пониженном давлении, получая остаток,который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан : метанол градиентом от 99:1 до 95:5 5N водный раствор хлористо-водородной кислоты (100 мл) добавляют к охлажденному на льду раствору 1-(имидазол-1-ил)-2-(3,4-дихлорфенил)-3-(1,3-диоксолан-2-ил)пропана (11 г)(см. получение 17) в тетрагидрофуране (100 мл). Смеси дают медленно нагреться до комнатной температуры и затем оставляют стоять на 24 ч. Тетрагидрофуран удаляют при пониженном давлении и кислую фазу экстрагируют дихлорметаном (2 х 100 мл). Органические фазы объединяют, промывают насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, получая неочищенный продукт, который подвергают хроматографии на силикагеле,элюируя смесью растворителей дихлорметан : метанол градиентом от 97,5:2,5 до 95:5 (об./об.),с получением 3-(3,4-дихлорфенил)-4-(имидазол 1-ил)бутан-1-аля (4,4 г) в виде вязкого масла. 1 К охлажденному на льду раствору 3-(3,4 дихлорфенил)-4-(имидазол-1-ил)бутан-1-аля(3,3 г) (см. получение 18) в этаноле (25 мл) добавляют тремя порциями боргидрид натрия(0,52 г) в течение 5 мин. Смесь перемешивают в течение еще часа, затем удаляют растворитель при пониженном давлении, получая остаток. Остаток затем суспендируют в воде (50 мл),охлаждают до 0 С и смесь подкисляют до pH1 2N водным раствором хлористо-водородной кислоты и затем подщелачивают до рН 14 путем добавления твердого карбоната натрия, после чего экстрагируют этилацетатом (3 х 200 мл). Органические фазы объединяют, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 3-(3,4 дихлорфенил-4-(имидазол-1-ил)бутан-1-ол (2,84 г) в виде кремового твердого вещества. 1 Н-ЯМР (СDСl3):7,35 (1 Н, д), 7,15-7,30 3,4-Дихлорфенилацетонитрил (80 г) растворяют в безводном тетрагидрофуране (800 мл) в атмосфере азота, охлаждают до -70 С и добавляют литий диизопропиламид (320 мл 1,5 М раствора в циклогексане). Смесь перемешивают при -70 С в течение 30 мин, в течение 15 мин добавляют аллилбромид (63 г) и смесь перемешивают в течение еще 30 мин. Затем добавляют 2N водный раствор хлористо-водородной кислоты (600 мл) и смесь экстрагируют дважды диэтиловым эфиром. Органические экстракты объединяют и растворитель удаляют при пониженном давлении. Полученный остаток растворяют в дихлорметане, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая красное подвижное масло. Его подвергают хроматографии на силикагеле, элюируя смесью растворителей гексан:дихлорметан 4:1 (об./об.), с получением 4-циано-4-(3,4-дихлорфенил)бут-1-ена (94,8 г) в виде масла. 1 4-Циано-4-(3,4-дихлорфенил)бут-1-ен (13 г) (см. получение 20) растворяют в безводном толуоле (100 мл) и охлаждают до -70 С в атмосфере азота. К раствору в течение 30 мин добавляют диизобутилалюминий гидрид (50 мл 1, 5 М раствора в толуоле), смесь перемешивают при 70 С в течение еще 30 мин и затем оставляют медленно нагреваться до -10 С. Осторожно добавляют воду (6 мл) (экзотермическая реакция),затем выливают смесь в 15% (мас.) водный раствор лимонной кислоты (500 мл), затем дополнительно добавляют толуол (300 мл) и смесь энергично перемешивают в течение 30 мин. Две фазы разделяют, органическую фазу промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 4-(3,4 дихлорфенил)-4-формилбут-1-ен в виде масла К охлажденному на льду раствору 4-(3,4 дихлорфенил)-4-формилбут-1-ена (13 г) (см. получение 21) в этаноле (100 мл) добавляют четырьмя порциями боргидрид натрия (2,2 г) в течение 10 мин. Смесь перемешивают в течение еще 30 мин, затем удаляют растворитель при пониженном давлении, получая остаток. Остаток суспендируют в воде (50 мл), охлаждают до 0 С и смесь подкисляют (рН 6) 2N водным раствором хлористо-водородной кислоты. Смесь экстрагируют три раза дихлорметаном, органические фазы объединяют и удаляют растворитель при пониженном давлении. Добавляют дихлорметан (200 мл), смесь перемешивают,фильтруют и растворитель удаляют из фильтрата при пониженном давлении, получая масло. Его подвергают хроматографии на силикагеле,элюируя дихлорметаном, с получением 4-(3,4 дихлорфенил)-5-гидроксипент-1-ена (7 г) в виде оранжевого масла. 1 К охлажденному на льду раствору 4-(3,4 дихлорфенил)-5-гидроксипент-1-ена (4,3 г) (см. получение 22) и триэтиламина (2,5 г) в дихлорметане (50 мл) добавляют раствор метансульфонилхлорида (2,3 г) в дихлорметане в течение 10 мин. Смесь перемешивают в течение еще 30 мин, затем последовательно промывают водой(3 х 25 мл) и насыщенным раствором соли (25 мл), после чего сушат над безводным сульфатом натрия. Удаляют растворитель при пониженном давлении,получая 4-(3,4-дихлорфенил)-5(метансульфонилокси)пент-1-ен (5,4 г), в виде масла. 1 4-(3,4-Дихлорфенил)-5-(метансульфонилокси)пент-1-ен (5,4 г) (см. получение 23) и имидазол (3,6 г) растворяют в безводном ацетонит 37 риле (40 мл) и смесь нагревают при температуре кипения с обратным холодильником в течение 100 ч. Растворитель удаляют при пониженном давлении, остаток растворяют в дихлорметане и растворитель удаляют при пониженном давлении. Остаток растворяют в дихлорметане (100 мл) и промывают количеством водного раствора карбоната натрия, достаточным для того, чтобы значение рН водной фазы гарантированно достигало 14. Две фазы разделяют и водную фазу экстрагируют дихлорметаном (100 мл). Органические фазы объединяют и растворитель удаляют при пониженном давлении, получая остаток,который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:метанол градиентом от 100:0 до 98:2(2 Н, м), 6,99 (1H, с), 6,84 (1H, д) , 6,69 (1H, с),5,55-5,70 (1 Н, м), 5,07 (2 Н, д), 3,95-4,22 (2 Н, м),2,95-3,10 (1H, м), 2,32-2,45 (2 Н, м) м.д. Соль хлористо-водородной кислоты получают путем растворения свободного основания в дихлорметане, обработки раствора газообразным хлористым водородом и удаления растворителя при пониженном давлении с получением гидрохлорида 4-(3,4-дихлорфенил)-5-(имидазол 1-ил)пент-1-ена в виде пены. Получение 25 (способ, альтернативный получению 18). 3-(3,4-Дихлорфенил)-4(имидазол-1-ил)бутан-1 аль. Гидрохлорид 4-(3,4-дихлорфенил)-5(имидазол-1-ил)пент-1-ена (3,6 г) (см. получение 24) растворяют в смеси ацетонитрила (50 мл) и воды (20 мл) и добавляют тетраоксид осмия (4 мл 0,05 М раствора в толуоле). Смесь перемешивают в течение 30 мин, добавляют периодат натрия (5,3 г) и продолжают перемешивание в течение 2 ч. Добавляют дополнительную порцию ацетонитрила (20 мл) и продолжают перемешивание в течение 16 ч, затем удаляют органический растворитель при пониженном давлении, получая водную суспензию. Ее подщелачивают до рН 7 путем добавления твердого карбоната натрия. Затем смесь экстрагируют дихлорметаном, органическую фазу сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая темное масло, которое подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан : метанол градиентом от 98:2 до 92,5:7,5 (об./об.), с получением 3-(3,4 дихлорфенил)-4-(имидазол-1-ил)бутан-1-аля(2,28 г) в виде бесцветного вязкого масла. К смеси гидрида натрия (60% (мас.) дисперсия в минеральном масле) (19,24 г) и безводного тетрагидрофурана (450 мл) при 0 С в атмосфере азота добавляют по каплям раствор 3,4 дихлорфенилацетонитрила (89,5 г) в безводном тетрагидрофуране (450 мл) в течение 40 мин. Еще через 30 мин добавляют раствор 2-(2 бромэтокси)тетрагидрофурана (100 г) в безводном тетрагидрофуране (100 мл). Смесь оставляют нагреваться до комнатной температуры и затем перемешивают в течение 14 ч. Добавляют 30% (мас.) водный раствор хлорида аммония(500 мл) и смесь экстрагируют диэтиловым эфиром (2 х 400 мл). Органические экстракты объединяют, промывают водой (2 х 400 мл), сушат над безводным сульфатом магния и растворитель удаляют при пониженном давлении. Остаток подвергают хроматографии на силикагеле,элюируя смесью растворителей диэтиловый эфир:гексан градиентом от 1:9 до 1:1 (об./об.), с получением 2-(3,4-дихлорфенил)-4(тетрагидрофуран-2-илокси)бутаннитрила (51 г) в виде масла, как смесь диастереомеров. 1 2-(3,4-Дихлорфенил)-4-(тетрагидрофуран 2-илокси)бутаннитрил (20,2 г) (см. получение 26) растворяют в безводном толуоле (300 мл) и охлаждают до -78 С в атмосфере азота. Затем по каплям добавляют диизобутилалюминий гидрид(85,6 мл 1,0 М раствора в толуоле). Смесь перемешивают при -78 С в течение 1,5 ч, после чего смеси дают медленно нагреться до -40 С. Осторожно (экзотермическая реакция) добавляют воду (100 мл) и насыщенный водный раствор хлорида аммония (50 мл), смесь оставляют нагреваться до 10 С, после чего добавляют еще воду (100 мл) и насыщенный водный раствор хлорида аммония (50 мл). Добавляют 10% (мас.) водный раствор соли Rochelle (тетрагидрат тартрата калия, натрия) (400 мл) и смесь экстрагируют диэтиловым эфиром. Органическую фазу 39 сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении,получая неочищенный продукт. Его подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:метанол 98:2 Боргидрид натрия (2,03 г) добавляют порциями к раствору 2-(3,4-дихлорфенил)-4(тетрагидрофуран-2-илокси)бутан-1-аля (17,02 г) (см. получение 27) в 2-пропаноле (250 мл). Смесь перемешивают при комнатной температуре в течение ночи и осторожно добавляют ледяную уксусную кислоту (4 мл), затем добавляют воду (2 мл). Растворитель удаляют при пониженном давлении, получая остаток, который растворяют в дихлорметане и последовательно промывают водой, разбавленным водным раствором гидрокарбоната натрия и насыщенным раствором соли. Раствор сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Неочищенный продукт подвергают хроматографии на силикагеле, элюируя смесью растворителей этилацетат:гексан 1:1 (об./об.), с получением 2-(3,4 дихлорфенил)-4-(тетрагидрофуран-2-илокси) бутан-1-ола (14,7 г) в виде бесцветного масла,как смесь диастереомеров. 1 Н-ЯМР (CDCl3) (смесь двух диастереомеров):7,30-7,40 (2 Н, м), 7,09 (1 Н, д), 4,55 (0,5 Н,т), 4,46 (0,5 Н, т), 3,24-3,82 (6 Н, м), 2,90-3,0 (1 Н,м), 1,45-2,10 (9 Н, м) м.д. Получение 29. 1-Метансульфонилокси-2(3,4-дихлорфенил)-4-(тетрагидрофуран-2 илокси)бутан. Метансульфонилхлорид (2,4 мл) добавляют по каплям к охлажденному на льду раствору 2-(3,4-дихлорфенил)-4-(тетрагидрофуран-2 илокси)бутан-1-ола (8,13 г) (см. получение 28) и триэтиламина (5,32 мл) в дихлорметане (100 мл) в атмосфере азота. Смесь перемешивают в течение 10 мин при 0 С и затем 90 мин при комнатной температуре, после чего дважды промывают водой. Органическую фазу отделяют, сушат 40 над безводным сульфатом натрия и удаляют растворитель при пониженном давлении, получая неочищенный продукт. Его подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:диэтиловый эфир 95:5 (об./об.), с получением 1-метансульфонилокси-2-(3,4-дихлорфенил)-4-(тетрагидропиран-2 илокси)бутана (8,85 г) в виде желтого масла, как смесь диастереомеров. 1(см. получение 29), имидазол (2,07 г) и карбонат калия (7,65 г) растворяют в безводном ацетонитриле (50 мл) и нагревают с обратным холодильником в атмосфере азота в течение 3 дней. Затем органический растворитель удаляют при пониженном давлении и полученную водную суспензию распределяют между дихлорметаном и водой. Органическую фазу отделяют, промывают последовательно водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Неочищенный продукт подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:метанол 95:5 (об./об.), с получением 1-(имидазол-1-ил)2-(3,4-дихлорфенил)-4-(тетрагидропиран-2 илокси)бутана (3 г) в виде масла, как смесь диастереомеров. 1 3,5-Диметилбензоилхлорид (1,33 г) добавляют по каплям к суспензии 3-(3,4-дихлорфенил)-4-(имидазол-1-ил)бутан-1-ола (0,75 г) (см. получение 19) и триэтиламина (1,1 г) в безводном ацетонитриле (15 мл) и раствор перемешивают при комнатной температуре в течение 120 ч. Затем смесь смешивают с водой (30 мл) и дихлорметаном (50 мл), органическую фазу отде 41 ляют и промывают последовательно водой и насыщенным раствором соли. Растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:метанол градиентом от 100:0 до 99:1(38 мл) растворяют в гексане (300 мл), охлаждают на бане со льдом и добавляют н-бутиллитий(100 мл 2,5 М раствора в гексане). Смесь перемешивают при 0 С в течение 15 мин, затем по каплям добавляют 2,3-дигидробензо[b]фуран(30 г) в течение 30 мин. Смесь оставляют нагреваться до комнатной температуры в течение 30 мин, перемешивают при комнатной температуре в течение еще 4 ч, выливают в избыточное количество твердого диоксида углерода и оставляют стоять в течение 3 дней, за это время растворитель испаряется. Остаток распределяют между этилацетатом (1 л) и 4N водным раствором хлористо-водородной кислоты (240 мл),слои разделяют и водный слой экстрагируют этилацетатом (500 мл). Органические экстракты объединяют, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток затем растирают с диэтиловым эфиром,получая 2,3 дигидробензо[b]фуран-7-оевую кислоту в виде твердого вещества белого цвета (21 г). 1 10% (мас.) палладий-на-угле (10 г) добавляют к раствору 1-нафтоевой кислоты (33,4 г) в ледяной уксусной кислоте (150 мл) и смесь гидрируют при 345 кПа (50 фунтов/кв. дюйм) и 85 С в течение 4 дней. Теплую смесь фильтруют через короткую колонку с фильтром Arbacel(товарный знак) и подложку промывают ледяной уксусной кислотой (150 мл). К фильтрату добавляют воду (1,5 л) и полученный осадок отфильтровывают и промывают водой. Осадок растворяют в дихлорметане, раствор сушат над 42 безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая масло, которое кристаллизуют из этилацетата,получая 1,2,3,4-тетрагидро-5-нафтоевую кислоту (2,94 г) в виде твердого вещества белого цвета (т.пл. 148-150 С). 1 1,2,3,4-Тетрагидро-6-нафтальдегид (2,0 г) суспендируют в 0,5 М водном растворе гидроксида натрия (125 мл), интенсивно перемешивают и добавляют 70% (мас.) раствор гидропероксида третичного бутила в воде (10,3 мл). Смесь нагревают приблизительно при 70 С в течение 4 ч и затем оставляют стоять при комнатной температуре на 3 дня. Добавляют дополнительное количество 70% (мас.) раствора гидропероксида третичного бутила в воде (10 мл) и смесь нагревают приблизительно при 70 С в течение еще 24 ч. Смесь охлаждают, добавляют диэтиловый эфир (100 мл) и фазы разделяют. Водную фазу подкисляют до рН 1 с 2N водным раствором хлористо-водородной кислоты и экстрагируют диэтиловым эфиром (2 х 100 мл). Органические фазы объединяют, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле, элюируя смесью растворителей диэтиловый эфир:пентан градиентом от 1:1 до 1:0(об./об.), с получением 1,2,3,4-тетрагидро-6 нафтоевой кислоты (0,62 г) в виде твердого вещества белого цвета. 1 2,3-Дигидробензо[b]фуран-7-оевую кислоту (3 г) (см. получение 32) суспендируют в безводном дихлорметане (30 мл) и добавляют оксалил хлорид (3,5 г), затем добавляют диметилформамид (3 капли). Смесь перемешивают при комнатной температуре в течение 2,5 ч, растворитель удаляют при пониженном давлении, полученный остаток растворяют в дихлорметане и растворитель удаляют при пониженном давлении. Остаток снова растворяют в дихлорметане и растворитель удаляют при пониженном давлении, получая 2,3-дигидробензо[b] фуран-7 оил хлорид в виде твердого вещества розового цвета (3,3 г). 1,2,3,4-Тетрагидро-5 Указанное соединение получают по способу, подобно получению 35, используя в качестве исходного вещества 1,2,3,4-тетрагидро-5-нафтоевую кислоту (см. получение 33). Получение 37. 1,2,3,4-Тетрагидро-6-нафтоил хлорид Указанное соединение получают по способу, подобно получению 35, используя в качестве исходного вещества 1,2,3,4-тетрагидро-6-нафтоевую кислоту (см. получение 34). Получение 38-46. Соединения получений,перечисленных в следующей таблице (таблица 2), имеющие общую формулу получают по способу, подобно получению 31,используя 3-(3,4-дихлорфенил)-4-(имидазол-1 ил)бутан-1-ол (см. получение 19) и соответствующий хлорангидрид кислоты в качестве исходного вещества. Таблица 2(a) хроматографируют на силикагеле,элюируя смесью растворителей этилацетат : пентан градиентом от 1:2 до 1:0 (об./об.);(c) хроматографируют на силикагеле,элюируя смесью растворителей этилацетат : пентан градиентом от 1:2 до 2:1 (об./об.); 3-(3,4-Дихлорфенил)-4-[2-(3,5-диметилбензоил)имидазол-1-ил]бутил 3,5-диметилбензоат (0,93 г) (см.получение 31) растворяют в метаноле (10 мл) и добавляют 2N водный раствор гидроксида натрия (2 мл). Образуется густая смола, добавляют дополнительно метанол(50 мл) и полученную суспензию перемешивают при комнатной температуре в течение ночи. Затем метанол удаляют при пониженном давлении и остаток распределяют между дихлорметаном (50 мл) и водой (10 мл). Органическую фазу отделяют, промывают насыщенным раствором соли и растворитель удаляют при пониженном давлении, получая неочищенный продукт, который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан : метанол градиентом от 99:1 до 95:5 3-(3,4-Дихлорфенил)-4-[2-(2-нафтоил) имидазол-1-ил]бутил-2-нафтоат (1,25 г) (см. получение 42) растворяют в 1,4-диоксане (15 мл), добавляют 1N водный раствор гидроксида натрия (4 мл) и смесь перемешивают при комнатной температуре в течение ночи. Затем диоксан удаляют при пониженном давлении и остаток распределяют между этилацетатом и водой. Органическую фазу отделяют, промывают последовательно 1N водным раствором гидроксида натрия, водой и насыщенным раствором соли, растворитель удаляют при пониженном давлении, получая неочищенный продукт, который подвергают хроматографии на силикагеле,элюируя смесью растворителей дихлорметан : метанол градиентом от 99:1 до 95:5 (об./об.), с получением 3-(3,4-дихлорфенил)-4-[2-(2-нафтоил)имидазол-1-ил]бутан-1-ол (0,8 г) в виде смолы. 1(а) хроматографируют на силикагеле,элюируя смесью растворителей диэтиловый эфир:этилацетат градиентом от 1:0 до 0:1 Получение 63. 1-Этоксиметилимидазол. 1-(Имидазол-1-ил)-2-(3,4-дихлорфенил)-4(тетрагидропиран-2-илокси)бутан (0,86 г) (см. получение 30) и триэтиламин (1,3 мл) растворяют в ацетонитриле (15 мл) в атмосфере азота,раствор охлаждают на бане со льдом и добавляют по каплям 2-метоксибензоилхлорид (1,4 мл). Смеси дают медленно нагреться до комнатной температуры и затем перемешивают в течение 2 дней. Ацетонитрил удаляют при пониженном давлении, остаток растворяют в дихлорметане (20 мл) и промывают последовательно водой и насыщенным раствором соли. Затем органическую фазу сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле,элюируя смесью растворителей дихлорметан : метанол 97:3, с получением 1-[2-(2-метоксибензоил)имидазол-1-ил]-2-(3,4-дихлорфенил)-4 Имидазол (20 г) растворяют в тетрагидрофуране (700 мл) в атмосфере азота, охлаждают до -70 С и по каплям добавляют н-бутиллитий(117,5 мл 2,5 М раствора в гексане) в течение 15 мин. Смесь оставляют нагреваться до -20 С и перемешивают при -20 С в течение 30 мин, после чего по каплям добавляют хлорметилэтиловый эфир (30,5 г). Смесь оставляют нагреваться до комнатной температуры и перемешивают еще час. Растворитель удаляют при пониженном давлении, получая остаток, который растирают с дихлорметаном и фильтруют через короткую прикладку фильтра Arbacel (товарный знак). Растворитель удаляют из фильтрата при пониженном давлении, получая подвижное масло,которое перегоняют при пониженном давлении(400 мл) в атмосфере азота, охлаждают до -70 С и по каплям добавляют н-бутиллитий (40 мл 2,5 М раствора в гексане) в течение 5 мин. Смесь перемешивают при -70 С 1 ч и по каплям добавляют хлортриметилсилан (10,83 г). Смесь перемешивают при -70 С 1 ч, после чего смеси дают нагреться до комнатной температуры и перемешивают еще 3 ч. Добавляют фенацетилхлорид (14,68 г) и продолжают перемешивание в течение 18 ч, после чего удаляют растворитель при пониженном давлении. Полученный остаток растворяют в дихлорметане и последовательно промывают водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, затем сушат над безводным сульфатом натрия. Растворитель удаляют из органической фазы при пониженном давлении. Неочищенный продукт подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:метанол 95:5 1-Этоксиметил-2-фенацетилимидазол (8,23 г) (см. получение 64) растворяют в этаноле (200 мл), добавляют 2N водный раствор хлористоводородной кислоты (200 мл) и полученную суспензию нагревают при температуре кипения с обратным холодильником в течение 30 мин. Для растворения оставшегося суспендированного вещества добавляют дополнительное количество этанола (50 мл) и смесь нагревают с обратным холодильником еще 6 ч, после чего ее оставляют стоять при комнатной температуре в течение ночи. Органический растворитель удаляют при пониженном давлении и полученную водную суспензию подщелачивают до рН 9 путем добавления насыщенного водного раствора гидрокарбоната натрия. Затем смесь экстрагируют (три раза) дихлорметаном. Органические экстракты объединяют, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 2-фенацетил 002424 50 имидазол (6,29 г) в виде твердого вещества желтого цвета. 1 Н-ЯМР (СDСl3):7,19-7,39 (7 Н, м), 4,40(0,41 г) и смесь нагревают при температуре кипения с обратным холодильником в атмосфере азота в течение 18 ч. Смесь охлаждают, растворитель удаляют при пониженном давлении и остаток распределяют между дихлорметаном и водой. Органическую фазу отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Затем полученный остаток подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан : метанол 99:1 (об./об.), с получением 1-[2-фенацетилимидазол-1-ил]-2-(3,4-дихлорфенил)-4-(тетрагидропиран-2-илокси)бутана в виде масла, как смесь диастереомеров (0,23 г). 1 1-[2-(2-Метоксибензоил)имидазол-1-ил]-2(3,4-дихлорфенил)-4-(тетрагидрофуран-2-илокси)бутан (1,1 г) (см. получение 57) растворяют в метаноле (20 мл), добавляют ионнообменную смолу Amberlyst 15 (товарный знак) (0,11 г) и смесь перемешивают при комнатной температуре в течение 5 дней. Смолу удаляют фильтрацией через короткую колонку с фильтром Arbacel(товарный знак) и растворитель удаляют из фильтрата при пониженном давлении, получая остаток. Его подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан:метанол 97:3 (об./об.), с получением 1-[2-[2-Трифторметилбензоил]имидазол-1 ил]-2-(3,4-дихлорфенил)-4-(тетрагидропиран-2 илокси)бутан (0,68 г) (см. получение 59) растворяют в метаноле (15 мл), который был предварительно насыщен газообразным хлористым водородом, и оставляют стоять на 4 ч. Растворитель удаляют при пониженном давлении, получая остаток, который распределяют между дихлорметаном и насыщенным водным раствором гидрокарбоната натрия (рН водного слоя поддерживают при 8-9). Органическую фазу отделяют и водную фазу экстрагируют (дважды) дихлорметаном. Органические фазы объединяют, высушивают над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 3-(3,4-дихлорфенил)-4-[2-(2 трифторметилбензоил)имидазол-1-ил]бутан-1 ол (0,41 г) в виде белой пены. 1(а) Продукт очищают путем хроматографии на силикагеле, элюируя смесью дихлорметан:метанол 98:2 (об./об.). Получение 74. 1-Метансульфонилокси-3(3,4-дихлорфенил)-4-[2-(3,5-диметилбензоил) имидазол-1-ил]бутан. 3-(3,4-Дихлорфенил)-4-[2-(3,5-диметилбензоил)имидазол-1-ил]бутан-1-ол (0,63 г) (см. получение 47) и триэтиламин (0,20 г) растворяют в дихлорметане (12 мл), охлаждают на бане со льдом и добавляют метансульфонилхлорид(0,19 г). Смесь перемешивают в течение 30 мин,добавляют дихлорметан (35 мл) и раствор последовательно промывают водой (2 х 30 мл) и насыщенным раствором соли (30 мл). Органическую фазу сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Остаток растворяют в ацетонитриле и растворитель удаляют при пониженном получают по способу, подобно получению 74,используя соответствующие спирты в качестве исходных веществ (см. получения 48-56 и 67-73). Таблица 7Bioorganic и Medicinal Chemistry Letters, 3, 319,(1993 растворяют в безводном тетрагидрофуране (400 мл), охлаждают на бане со льдом и осторожно добавляют литий алюминий гидрид(5,7 г) двумя порциями (экзотермическая реакция). Смесь перемешивают при 0 С в течение 20 мин и затем перемешивают 1 ч при комнатной температуре, после чего охлаждают до 0 С. Осторожно добавляют воду (6 мл), затем 2N водный раствор гидроксида натрия (6 мл) и еще 55 воду (12 мл). Смесь интенсивно перемешивают в течение 40 мин, полученный остаток удаляют путем фильтрации и промывают диэтиловым эфиром. Фильтрат собирают и разделяют органическую и водную фазы. Из органической фазы затем удаляют растворитель при пониженном давлении, получая желтое масло, которое подвергают хроматографии на силикагеле,элюируя смесью растворителей дихлорметан : гексан градиентом от 4:1 до 4:0 (об./об.), с получением 4(S)-(3,4-дихлорфенил)-5-гидроксипент-1-ена (11,74 г) в виде масла. 1 Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 91, используя соответствующее исходное вещество, (cм. Bioorganic и Метансульфонилхлорид (3,55 г) добавляют по каплям к охлажденному на льду раствору 4(S)-(3,4-дихлорфенил)-5-гидроксипент-1-ена(6,0 г) (см. получение 91) и триэтиламина (3,48 г) в дихлорметане (100 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Затем растворитель удаляют при пониженном давлении и остаток распределяют между диэтиловым эфиром и водой. Две фазы разделяют и водный слой дополнительно экстрагируют диэтиловым эфиром. Затем органические фазы объединяют и последовательно промывают водой, разбавленным водным раствором лимонной кислоты, насыщенным раствором соли, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, после чего сушат над безводным сульфатом натрия. Удаляют растворитель при пониженном давлении,получая 4(S)-(3,4-дихлорфенил)-5-(метансульфонилокси)пент-1-ен (8,25 г) в виде масла. 1 Н-ЯМР (CDCl3):7,42 (1H, д), 7,30 (1 Н,с), 7,04 (1H, дд), 5,56-5,72 (1H, м), 5,01-5,10 (2 Н,м), 4,22-4,39 (2 Н, м), 3,05-3,15 (1H, м), 2,88 (3 Н,с), 2,33-2,60 (2 Н, м) м.д. Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 93, используя 4(R)-(3,4 дихлорфенил)-5-гидроксипент-1-ен (см. получение 92) в качестве исходного вещества. 1 4(S)-(3,4-Дихлорфенил)-5-(метансульфонилокси)пент-1-ен (8,25 г) (см. получение 93) и имидазол (5,3 г) растворяют в ацетонитриле (80 мл) и смесь нагревают с обратным холодильником в течение 6 дней. Растворитель удаляют при пониженном давлении, получая остаток, который распределяют между диэтиловым эфиром и насыщенным водным раствором гидрокарбоната натрия (рН водной фазы поддерживают 7). Две фазы разделяют и водную фазу экстрагируют диэтиловым эфиром. Затем объединенные органические экстракты промывают водой, сушат над безводным сульфатом натрия и удаляют растворитель при пониженном давлении,получая остаток, который подвергают хроматографии на силикагеле, элюируя смесью растворителей дихлорметан : метанол градиентом от 98:2 до 95:5 (об./об.), с получением 4(S)-(3,4 дихлорфенил)-5-(имидазол-1-ил)пент-1-ена Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 95, используя 4(R)-(3,4 дихлорфенил)-5-(метансульфонилокси)пент-1 ен (см. получение 94) в качестве исходного вещества. 1 4(S)-(3,4-Дихлорфенил)-5-(имидазол-1 ил)пент-1-ен (4,75 г) (см. получение 95) растворяют в смеси ацетонитрила (75 мл), воды (13 мл) и 1N водного раствора хлористоводородной кислоты (17 мл). Добавляют тетраоксид осмия (3,4 мл 0,05 М раствора в толуоле) и смесь перемешивают в течение 20 мин. Затем добавляют периодат натрия (5,3 г) вместе с дополнительным количеством ацетонитрила (30 мл) и продолжают перемешивание в течение ночи. Добавляют воду (приблизительно 100 мл) и ацетонитрил удаляют при пониженном давлении, получая водную суспензию, которую подщелачивают до рН 7 путем добавления твердого карбоната натрия. Затем смесь экстрагируют(три раза) этилацетатом и объединенные органические экстракты промывают последовательно водой и насыщенным раствором соли, после чего сушат над безводным сульфатом натрия. Удаляют растворитель при пониженном давлении, получая 3(S)-(3,4-дихлорфенил)-4-(имидазол-1-ил)бутан-1-аль (4,3 г) в виде масла. 1 Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 97, используя 4(R)-(3,4 дихлорфенил)-5-(имидазол-1-ил)пент-1-ен Боргидрид натрия (0,68 г) осторожно добавляют к охлажденному на льду раствору 3(S)(3,4-дихлорфенил)-4-(имидазол-1-ил)бутан-1 аля (4,3 г) (см. получение 97) в этаноле (40 мл) и смесь перемешивают при комнатной температуре в течение одного часа, после чего удаляют растворитель при пониженном давлении, получая остаток. Остаток суспендируют в воде (30 58 мл), охлаждают на бане со льдом и смесь подкисляют до pH1 2N водным раствором хлористо-водородной кислоты, и затем подщелачивают до рН 14 путем добавления 2N водного раствора гидроксида натрия. Полученную суспензию фильтруют и остаток промывают водой,сушат и затем кристаллизуют из ацетонитрила,получая 3(S)-(3,4-дихлорфенил)-4-(имидазол-1 ил)бутан-1-ол (1,37 г) в виде кремового твердого вещества. 1 Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 99, используя 3(R)-(3,4 дихлорфенил)-4-(имидазол-1-ил)бутан-1-аль 1,2,3,4-Тетрагидро-5-нафтоил хлорид (1,70 г) (см. получение 36) добавляют по каплям к суспензии 3(S)-(3,4-дихлорфенил)-4-(имидазол 1-ил)бутан-1-ола (0,90 г) (см. получение, 99) и триэтиламина (1,45 г) в безводном ацетонитриле(15 мл) и раствор перемешивают при комнатной температуре в течение 4 дней. Затем удаляют растворитель при пониженном давлении, получая остаток, который распределяют между этилацетатом и насыщенным водным раствором гидрокарбоната натрия. Фазы разделяют и водную фазу дополнительно экстрагируют этилацетатом. Органические фазы объединяют, промывают последовательно водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая остаток, который подвергают хроматографии на силикагеле,элюируя смесью растворителей пентан : этилацетат градиентом от 2:1 до 0:1 (об./об.), с получением 3(S)-(3,4-дихлорфенил)-4-[2-(1,2,3,4 59 тетрагидро-5-нафтоил)имидазол-1-ил]бутил 1,2,3,4-тетрагидро-5-нафтоата (1,38 г) в виде смолы. 1 Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 101, используя 3(R)-(3,4 дихлорфенил)-4-(имидазол-1-ил)бутан-1-ол (см. получение 100) в качестве исходного вещества. 1 3(S)-(3,4-Дихлорфенил)-4-[2-(1,2,3,4-тeтpaгидpo-5-нaфтoил)-имидазол-1-ил]бутил 1,2,3,4 тeтpaгидpo-5-нaфтoaт (1,38 г) (см. получение 101) растворяют в метаноле (40 мл), добавляют 1N водный раствор гидроксида натрия (5 мл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Затем метанол удаляют при пониженном давлении и остаток распределяют между этилацетатом и водой. Органическую фазу отделяют, промывают последовательно насыщенным водным раствором и гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении, получая 3(S)-(3,4-дихлорфенил)-4-[2(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1 ил]бутан-1-ол (0,82 г) в виде смолы. 1 Указанное соединение получают по способу, подобно использующемуся при получении соединения получения 103, используя 3(R)-(3,4 дихлорфенил)-4-[2-(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1-ил]бутил 1,2,3,4-тeтpaгидpo-5 нaфтoaт (см. получение 102) в качестве исходного вещества. 1(0,22 г) растворяют в дихлорметане (15 мл), раствор охлаждают на бане со льдом и добавляют метансульфонилхлорид (0,22 г). Смесь перемешивают в течение 4 ч, после чего растворитель удаляют при пониженном давлении, получая остаток, который распределяют между этилацетатом и водой. Органическую фазу отделяют и промывают насыщенным водным раствором гидрокарбоната натрия, затем сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, получая 1 метансульфонилокси-3(S)-(3,4-дихлорфенил)-4[2-(1,2,3,4-тетрагидро-5-нафтоил)имидазол-1 ил]бутан (0,82 г) в виде масла. 1 Указанное соединение получают по способу, подобно использующемуся при получении
МПК / Метки
МПК: A61P 1/06, C07D 453/02, A61K 31/439
Метки: тахикинина, четвертичного, аммония, антагонисты, соединения
Код ссылки
<a href="https://eas.patents.su/30-2424-soedineniya-chetvertichnogo-ammoniya-kak-antagonisty-tahikinina.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения четвертичного аммония как антагонисты тахикинина</a>
Предыдущий патент: Противомикробная профилактика и лечение заболеваний, вызванных вирусом иммунодефицита человека и другими инфекциями
Следующий патент: Фунгицидная смесь
Случайный патент: Баня


































