Производные индолизина, способ их получения и их терапевтическое применение
Номер патента: 24160
Опубликовано: 31.08.2016
Авторы: Лассалль Жильбер, Алькуфф Шанталь, Эрбер Корантен
Формула / Реферат
1. Соединение формулы (I)
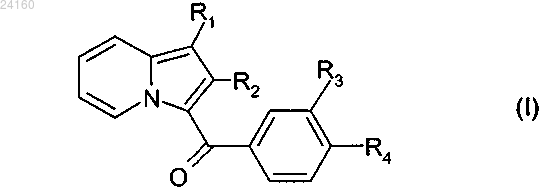
где R1 представляет собой атом водорода, -OR5, -O-Alk-OR5 или -O-Alk-NR7R8 группу, или С5-С10-арильную группу, или пиридильную группу, где указанная арильная группа необязательно замещена одной или несколькими -COOR5 группами;
R2 представляет собой C1-С6-алкильную группу или фенильную группу;
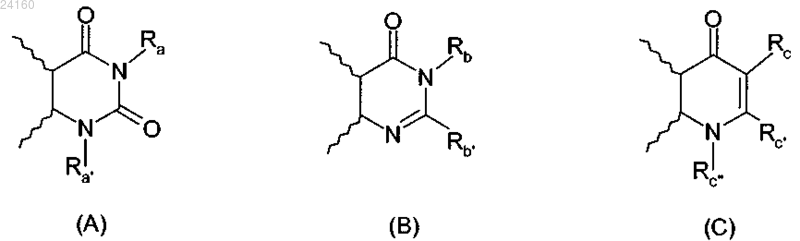
R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, 6-членный азотистый гетероцикл, соответствующий одной из формул (А), (В) и (С), приведенных ниже:
в которых волнистыми линиями обозначено фенильное ядро, к которому присоединены R3 и R4,
Ra представляет собой атом водорода или С1-С6-алкильную, -Alk-CF3, -Alk-COOR5, -Alk'-COOR5, -Alk'-CO-NR5R6, -Alk-CONR7R8, -Alk-CONR5-OR6, -Alk-NR7R8, -Alk-O-R5, -Alk-CN, -O-Alk-COOR5, -NR5R6, -NR5-COOR6, -Alk-С5-С10-арильную, -Alk-гетероарильную или гетероарильную группу, где С5-С10-арильная или гетероарильная группы необязательно замещены одним или несколькими атомами галогена и/или C1-C6-алкильными группами, причем указанный гетероарил выбран из 5-членного гетероарила, содержащего 3 или 4 гетероатома, таких как атомы кислорода и/или азота,
Ra' представляет собой атом водорода или линейную или разветвленную С1-С6-алкильную группу или -Alk-OR5 группу,
Rb представляет собой атом водорода или -Alk-COOR5 группу,
Rb' представляет собой атом водорода или C1-С6-алкильную, галоген-С1-С6-алкильную или -Alk-COOR5 группу,
Rc представляет собой атом водорода или -CN, -COOR5, -CONR7R8, -CONR5-Alk-OR5 или гетероарильную группу, выбранную из 5-членного гетероарила, содержащего 3 или 4 гетероатома, таких как атомы кислорода и/или азота,
Rc' представляет собой атом водорода или C1-С6-алкильную группу,
Rc" представляет собой атом водорода или C1-С6-алкильную, С2-С6-алкенильную или -Alk-OR5 группу;
R5 и R6, которые могут быть одинаковыми или различными, представляют собой атомы водорода или C1-С6-алкильные группы;
R7 и R8, которые могут быть одинаковыми или различными, представляют собой атомы водорода или C1-С6-алкильные группы или
R7 и R8 вместе образуют 3-8-членное насыщенное кольцо, которое может необязательно содержать гетероатом, который представляет собой кислород;
Alk представляет собой линейную или разветвленную C1-C6-алкиленовую цепь;
Alk' представляет собой линейную, разветвленную, циклическую или частично циклическую C1-С6-алкиленовую цепь,
необязательно в форме его фармацевтически приемлемой соли.
2. Соединения формулы (I) по п.1, где R2 представляет собой С1-С4-алкильную или фенильную группу.
3. Соединения формулы (I) по любому из пп.1, 2, где R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, 6-членный азотистый гетероцикл, соответствующий одной из формул (А), (В) или (С), определенных в п.1, и где
Ra представляет собой атом водорода или С1-С4-алкильную, -Alk'-COOR5; -Alk'-CO-NR5R6, -NR5R6, -Alk-NR7R8, -Alk-CN, -NR5-COOR6, -Alk-CO-NR5-OR6 или -O-Alk-COOR5 группу, или гетероарильную, -Alk-гетероарильную, или -Alk-С5-С10-арильную группу, где С5-С10-арильная или гетероарильная группа необязательно замещена С1-С4-алкильной группой или атомом галогена, причем указанный гетероарил выбран из 5-членного гетероарила, содержащего 3 или 4 гетероатома, таких как атомы кислорода и/или азота;
Ra' представляет собой атом водорода или С1-С4-алкильную или -Alk-OR5 группу;
Rb представляет собой атом водорода или -Alk-COOR5 группу;
Rb' представляет собой атом водорода или C1-C4-алкильную, галоген-С1-С4-алкильную или -Alk-COOR5 группу;
Rc представляет собой атом водорода, -COOR5, CN, -CO-NR7R8 группу или гетероарил, выбранный из 5-членного гетероарила, содержащего 3 или 4 гетероатома, таких как атомы кислорода и/или азота;
Rc' представляет собой атом водорода или С1-С4-алкильную группу;
Rc" представляет собой атом водорода или С1-С4-алкильную или С2-С4-алкенильную группу;
R5 и R6 представляют собой атомы водорода или C1-C4-алкильные группы;
R7 и R8 представляют собой атомы водорода или C1-C4-алкильные группы или вместе образуют 5- или 6-членное насыщенное кольцо;
Alk представляет собой линейную или разветвленную C1-C4-алкиленовую цепь;
Alk' представляет собой линейную, разветвленную, циклическую или частично циклическую C1-C4-алкиленовую цепь
4. Соединения формулы (I) по п.3, где R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, 6-членный азотистый гетероцикл, соответствующий любой из формул (А) и (С).
5. Соединение формулы (I) по п.3, где R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, 6-членный азотистый гетероцикл, соответствующий формуле (С).
6. Соединения формулы (I) по любому из пп.1-5, выбранные из следующих соединений:
2-{6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2H)-ил}-N,N'-диметилацетамид,
2-{6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-1-метил-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}-N,N'-диметилацетамид,
6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-3-[(3-метил-1,2,4-оксадиазол-5-ил)метил]хиназолин-2,4(1H,3H)-дион,
{3-{3-(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил}-2-метилиндолизин-1-ил}бензойная кислота,
{6-[(1-метокси-2-фенилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}уксусная кислота,
этил ({6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2Н)-ил}окси)ацетат,
3-амино-6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]хиназолин-2,4(1Н,3H)-дион,
6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метилхиназолин-4(3H)-он,
3-{2-метил-3-[(2-метил-4-оксо-3,4-дигидрохиназолин-6-ил)карбонил]индолизин-1-ил}бензойная кислота,
6-{[1-(2-метоксиэтокси)-2-метилиндолизин-3-ил]карбонил}-3-пропилхиназолин-2,4(1Н,3H)-дион,
6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота,
6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота,
6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-N-метил-4-оксо-1,4-дигидрохинолин-3-карбоксамид,
N-1-диметил-6-[(2-метилиндолизин-3-ил)карбонил]-4-оксо-1,4-дигидрохинолин-3-карбоксамид,
N-1-диметил-6-{[2-метил-1-(пиридин-4-ил)индолизин-3-ил]карбонил}-4-оксо-1,4-дигидрохинолин-3-карбоксамид гидрохлорид.
7. Способ получения соединения формулы (I) по любому из пп.1-6, где R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, 6-членный азотистый гетероцикл, соответствующий формуле (А), где R1 представляет собой -OR5, -O-Alk-OR5 или -O-Alk-NR7R8 группу и R2, R5, R7 и R8 являются такими, как определено в п.1, отличающийся тем, что
соединение формулы (II)
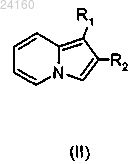
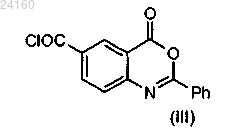
конденсируют с соединением формулы (III)
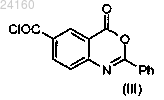
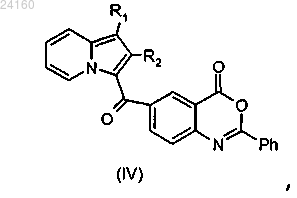
для получения соединения формулы (IV)
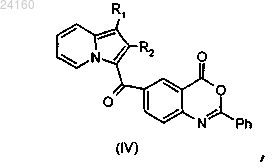
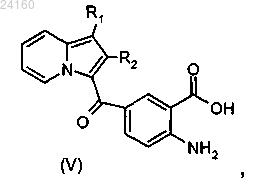
соединение формулы (IV) подвергают реакции основного гидролиза с получением соединения формулы (V)
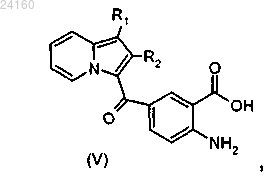
осуществляют этерификацию соединения формулы (V) и получают соединение формулы (VI)
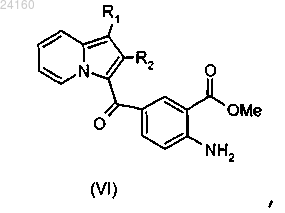
соединение формулы (VI) подвергают действию трифосгена для образования изоцианата, соответствующего соединению формулы (VI), и затем этот изоцианат конденсируют с амином формулы RaNH2, где Ra является таким, как определено в п.1, с получением мочевины формулы (VII)
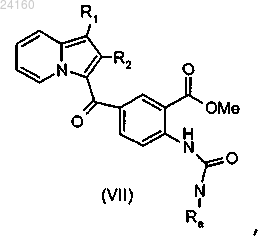
соединение формулы (VII) подвергают реакции циклизации в щелочной среде с получением соединения формулы (VIII)
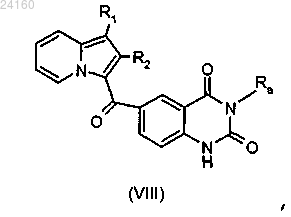
соединение формулы (VIII) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X, где Ra' является таким, как определено в п.1, и X представляет собой галоген.
8. Способ получения соединения формулы (I) по любому из пп.1-6, где R3 и R4 вместе образуют азотистый гетероцикл формулы (А) и R1 определен в п.1 при условии, что R1 не представляет собой одну из следующих групп: -OR5, -O-Alk-OR5 и -O-Alk-NR7R8, где R2, R5, R7 и R8 являются такими, как определено в п.1, отличающийся тем, что
соединение формулы (IX)

конденсируют с соединением формулы (III)
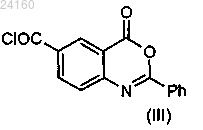
с получением соединения формулы (X)
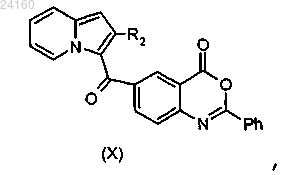
соединение формулы (X) подвергают реакции основного гидролиза с получением соединения формулы (XI)
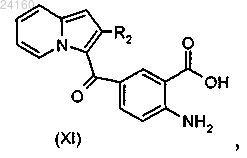
осуществляют этерификацию соединения формулы (XI) и получают соединение формулы (XII)
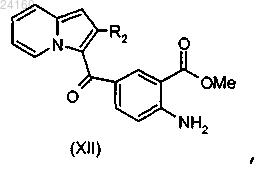
соединение формулы (XII) подвергают взаимодействию с N-бромсукцинимидом и получают соединение формулы (XIII)
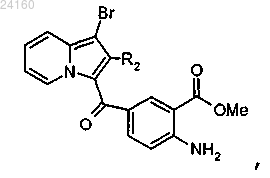
соединение формулы (XIII) подвергают действию трифосгена и получают изоцианат, соответствующий соединению формулы (XIII), который конденсируют с амином формулы RaNH2, где Ra является таким, как определено в п.1, с получением мочевины формулы (XIV)
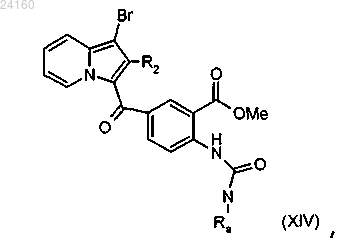
соединение формулы (XIV) подвергают реакции циклизации в щелочной среде с получением соединения формулы (XV)
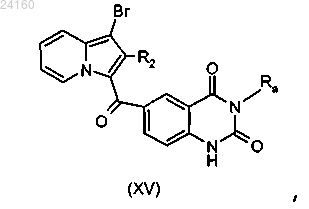
соединение формулы (XV) подвергают в присутствии катализатора на основе палладия, лиганда и основания взаимодействию с производными фенилборонового или гетероарилборонового эфира или фенилборонатного или гетероарилборонатного эфира в соответствии с реакцией сочетания Сузуки или
реакции цианирования с цианидом цинка с последующим кислотным гидролизом с получением соединения формулы (XVI)

соединение (XVI) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X, где Ra' является таким, как определено в п.1, и X представляет собой галоген.
9. Способ получения соединения формулы (I) по любому из пп.1-6, где R3 и R4 вместе образуют азотистый гетероцикл формулы (С), где R1 представляет собой -OR5, -O-Alk-OR5 - или -O-Alk-NR7R8 группу и R2, R5, R7 и R8 такие, как определено в п.1, отличающийся тем, что
соединение формулы (II)
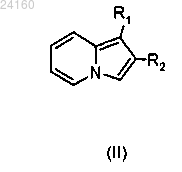
конденсируют с соединением формулы (III)
с получением соединения формулы (IV)
соединение формулы (IV) подвергают реакции основного гидролиза с получением соединения формулы (V)
соединение (V) подвергают реакции конденсации с получением соединения (XXI)

соединение (XXI) подвергают реакции алкилирования в присутствии основания и галогенированного производного Rc"X, где Rc" является таким, как определено в п.1, и X представляет собой галоген, или в присутствии защитной группы Р и получают соединение формулы (XXII)

соединение (XXII) подвергают реакции конденсации с малоновым производным с получением соединения формулы (XXIII)
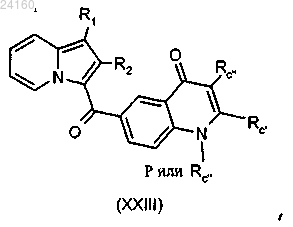
где Rc' и Rc определены в п.1;
соединение формулы (XXIII) подвергают реакции снятия защитных групп.
10. Способ получения соединения формулы (I) по любому из пп.1-6, где R3 и R4 вместе образуют азотистый гетероцикл формулы (С), R1 представляет собой С5-С10-арильную или гетероарильную группу, необязательно замещенную одной или несколькими -COOR5 группами, Rc' предпочтительно представляет собой C1-С6-алкил, Rc, Rc", R5, R6 и R2 определены в п.1, отличающийся тем, что
соединение формулы (IX)
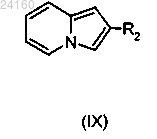
конденсируют с соединением формулы (III)
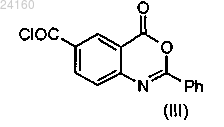
с получением соединения формулы (X)
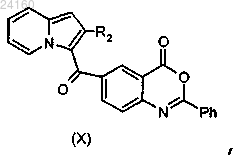
соединение формулы (X) подвергают реакции основного гидролиза с получением соединения формулы (XI)

осуществляют этерификацию соединения формулы (XI) и получают соединение формулы (XII)
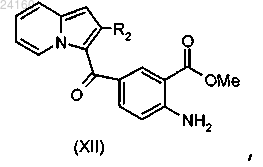
соединение формулы (XII) подвергают взаимодействию с N-бромсукцинимидом и получают соединение формулы (XIII)
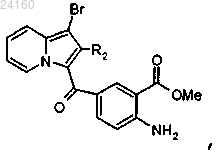
соединение формулы (XIII) подвергают реакции омыления в щелочной среде с получением соединения (XVIII)
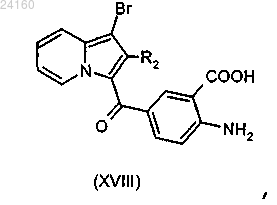
соединение (XVIII) подвергают реакции конденсации с получением соединения (XXIV)
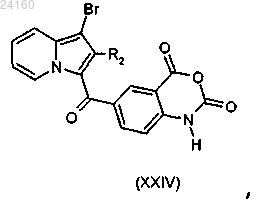
соединение формулы (XXIV) подвергают реакции алкилирования в присутствии основания и галогенированного производного Rc"X, где Rc" является таким, как определено в п.1, и X представляет собой галоген, или в присутствии защитной группы Р с получением соединения формулы (XXV)
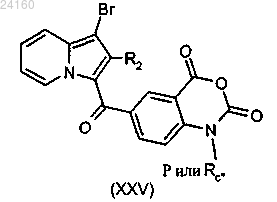
соединение формулы (XXV) подвергают реакции конденсации с малоновым производным с получением соединения формулы (XXVI)

где Rc' и Rc определены в п.1;
соединение формулы (XXVI) подвергают в присутствии катализатора на основе палладия, лиганда и основания взаимодействию с производными фенилборонового или гетероарилборонового эфира или фенилборонатного или гетероарилборонатного эфира в соответствии с реакцией сочетания Сузуки с получением соединения формулы (XXVII)
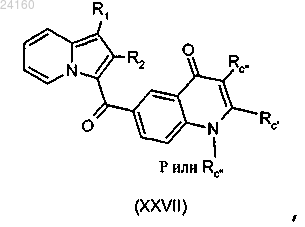
соединение формулы (XXVII) подвергают реакции снятия защитных групп.
11. Способ получения соединения формулы (I) по любому из пп.1-6, где R3 и R4 вместе образуют азотистый гетероцикл формулы (С), где Rc' представляет собой водород, Rc и Rc" являются такими, как определено в п.1, и R1 представляет собой водород или -OR5, -O-Alk-OR5 или -O-Alk-NR7R8 группу и R2, R5, R7 и R8 являются такими, как определено в п.1, отличающийся тем, что
соединение формулы (II)
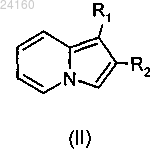
конденсируют с хлоридом 4-нитробензойной кислоты и получают соединение формулы (XXVIII)
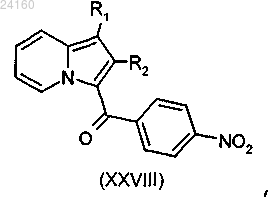
соединение формулы (XXVIII) подвергают реакции в присутствии железа и уксусной кислоты и получают соединение формулы (XXIX)

соединение формулы (XXIX) подвергают реакции конденсации и получают соединение формулы (XXX)
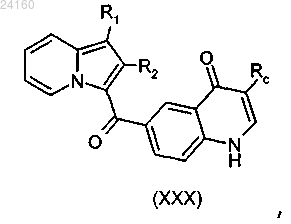
соединение формулы (XXX) подвергают реакции алкилирования в присутствии галогенида Rc"X, где Rc" является таким, как определено в п.1, и X представляет собой галоген, и в присутствии основания.
12. Фармацевтическая композиция для применения в лечении и профилактике заболеваний, требующих модуляции b-FGF, содержащая в качестве активного ингредиента соединение формулы (I) по любому из пп.1-6, необязательно в комбинации с одним или несколькими подходящими инертными эксципиентами.
13. Применение соединения по любому из пп.1-6 в лечении и профилактике заболеваний, требующих модуляции b-FGF.
14. Применение соединения по любому из пп.1-6 в лечении и профилактике рака, который имеет высокую степень васкуляризации, такого как рак легких, молочной железы, простаты, поджелудочной железы, толстой кишки, почек и пищевода, рака, который вызывает метастазы, такого как рак толстой кишки, рак печени и рак желудка, меланома, глиома, лимфома, лейкемия.
15. Применение соединения по любому из пп.1-6 в лечении и профилактике сердечно-сосудистых заболеваний, таких как атеросклероз или рестеноз после ангиопластики, заболеваний, связанных с осложнениями, которые возникают после имплантации эндоваскулярных стентов и/или аортокоронарных шунтов или сосудистых трансплантатов, гипертрофии сердца, сосудистых осложнений после сахарного диабета, таких как диабетическая ретинопатия, фиброзов печени, почек и легких, невропатической боли, хронических воспалительных заболеваний, таких как ревматоидный артрит или IBD (воспалительное заболевание кишечника), гиперплазии предстательной железы, псориаза, светлоклеточной акантомы, остеоартрита, хондродистрофии (АСН), гипохондроплазии (НСН), TD (танатофорной дисплазии), ожирения и дегенерации желтого пятна, такой как возрастная макулярная дегенерация (ARMD).
Текст
ПРОИЗВОДНЫЕ ИНДОЛИЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ где R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены,6-членный азотистый гетероцикл, соответствующий одной из формул (А), (В) и (С): где волнистыми линиями обозначено фенильное ядро, к которому присоединены R3 и R4, способу их получения и терапевтическому применению. Настоящее изобретение относится к производным индолизина, которые являются ингибиторамиFGF (факторы роста фибробластов), способу их получения и их терапевтическому применению.FGF представляют собой семейство полипептидов, синтезируемых большим количеством клеток в процессе эмбрионального развития и клетками зрелых тканей при различных патологических состояниях. Производные индолизина, которые являются антагонистами связывания FGF с их рецепторами,описаны в международных патентных заявках WO 03/084956 и WO 2005/028476, тогда как производные имидазо[1,5-а]пиридина, которые являются антагонистами FGF, описаны в международной патентной заявке WO 2006/097625. В настоящее время были идентифицированы новые производные индолизина,которые являются антагонистами связывания FGF с их рецепторами. Таким образом, предметом настоящего изобретения являются соединения, производные индолизина, соответствующие формуле (I) где R1 представляет собой атом водорода или галогена,алкильную группу, необязательно замещенную -COOR5,алкенильную группу, необязательно замещенную -COOR5,-COOR5 или -CONR5R6 группу,-NR5COR6 или -NR5-SO2R6 группу,-OR5, -O-Alk-OR5, -O-Alk-COOR5, -O-Alk-OR5, -O-Alk-NR5R6, -O-Alk-NR7R8 группу или арильную группу, в частности фенил, или гетероарильную группу, где указанная арильная или гетероарильная группа необязательно замещена одной или несколькими группами, выбранными из атомов галогена, алкильных групп, циклоалкильных групп, -COOR5, -CF3, -OCF3, -CN, -C(NH2)NOH, -OR5,-O-Alk-COOR5, -O-Alk-NR5R6, -O-Alk-NR7R8, -Alk-OR5, -Alk-COOR5, -CONR5R6, -CO-NR5-OR6,-CO-NR5-SO2R7, -CONR5-Alk-NR5R6, -CONR5-Alk-NR7R8, -Alk-NR5R6, -NR5R6, -NC(O)N(CH3)2, -CO-Alk,-CO(OAlk)nOH, COO-Alk-NR5R6, COO-Alk-NR7R8 и 5-членных гетероарильных групп, где указанные гетероарильные группы необязательно замещены одной или несколькими группами, выбранными из атомов галогена и алкильной, -CF3, -CN, -COOR5, -Alk-OR5, -Alk-COOR5, -CONR5R6, -CONR7R8,-CO-NR5-OR6, -CO-NR5-SO2R6, -NR5R6 и -Alk-NR5R6 групп, или гидроксильной группой, или атомом кислорода;n является целым числом от 1 до 3;R2 представляет собой атом водорода,алкильную группу,фенильную группу, необязательно замещенную одной или несколькими алкильными группами;R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены,6-членный азотистый гетероцикл, соответствующий одной из формул (А), (В) и (С), приведенных ниже: где волнистыми линиями обозначено фенильное ядро, к которому присоединены R3 и R4,Ra представляет собой атом водорода или алкильную, галогеналкильную, -Alk-CF3, -Alk-COOR5,-Alk'-COOR5, -Alk- CONR5R6, -Alk'-CONR5R6, -Alk-CONR7R8, -Alk-NR5R6, -AlkCONR5-OR6, -Alk-NR7R8,-Alk-циклоалкильную, -Alk-O-R5, -Alk-S-R5, -Alk-CN, -OR5, -OAlkCOOR5, -NR5R6, -NR5-COOR6,-Alk-арильную, -Alk-O-арильную, -Alk-O-гетероарильную, -Alk-гетероарильную или гетероарильную группу, где арильная или гетероарильная группа необязательно замещена одним или несколькими атомами галогена и/или алкильной, циклоалкильной, -CF3, -OCF3, -O-R5 или -S-R5 группами,Ra' представляет собой атом водорода или линейную, разветвленную, циклическую или частично циклическую алкильную группу или -Alk-OR5, -Alk-NR5R6 или -Alk-NR7R8 группу, Ra' необязательно замещен одним или несколькими атомами галогена,Rb представляет собой атом водорода или алкильную или -Alk-COOR5 группу,Rb' представляет собой атом водорода или алкильную, галогеналкильную, циклоалкильную, фенильную или -Alk-COOR5 группу,-1 024160Rc представляет собой атом водорода или алкильную, -CN, -COOR5, -CO-NR5R6, -CONR7R8,-CO-NR5-Alk-NR5R6, -CONR5-Alk-OR5, -CONR5SO2R5, -Alk-арильную или -Alk-гетероарильную группу,где арильная или гетероарильная группа необязательно замещена одним или несколькими атомами галогена и/или алкильной, циклоалкильной, -CF3, -OCF3, -О-алкильной или -S-алкильной группами,Rc' представляет собой атом водорода или алкильную группу,Rc" представляет собой атом водорода или алкильную, алкенильную, галогеналкильную, циклоалкильную, -Alk-NR5R6, -Alk-NR7R8, -Alk-OR5 или -Alk-SR5 группу;R5 и R6, которые могут быть одинаковыми или различными, представляют собой атомы водорода,галогеналкильные группы или алкильные группы, циклоалкильные группы или Ms (мезил) группу;R7 и R8, которые могут быть одинаковыми или различными, представляют собой атомы водорода или алкильные или фенильные группы; илиR7 и R8 вместе образуют 3-8-членное насыщенное кольцо, которое может необязательно содержать гетероатом;Alk представляет собой линейную или разветвленную алкиленовую цепь;Alk' представляет собой линейную разветвленную циклическую или частично циклическую алкиленовую цепь,эти соединения находятся необязательно в форме фармацевтически приемлемой соли. Соединения формулы (I) могут содержать один или несколько асимметричных атомов углерода. Соответственно они могут существовать в виде энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси, являются частью изобретения. Соединения формулы (I) могут существовать в форме оснований или кислот, или могут образовывать соли с кислотами или основаниями, в частности, фармацевтически приемлемыми кислотами или основаниями. Такие аддитивные соли являются частью изобретения. Эти соли преимущественно получают с фармацевтически приемлемыми кислотами или основаниями, но соли других кислот или оснований, пригодных, например, для очистки или выделения соединений формулы (I), также являются частью изобретения. Соединения формулы (I) могут существовать в форме гидратов или сольватов, а именно в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или растворителей. Такие гидраты или сольваты также являются частью изобретения. В контексте изобретения и если в тексте не указано иное, термин:"алкил" обозначает линейную или разветвленную, насыщенную алифатическую группу на основе углеводорода, содержащую от 1 до 6 атомов углерода;"циклоалкил" обозначает циклическую алкильную группу, содержащую от 3 до 8 членов в кольце,содержащую от 3 до 6 атомов углерода и необязательно содержащую один или несколько гетероатомов,например 1 или 2 гетероатома, таких как азот и/или кислород, где указанная циклоалкилая группа необязательно замещена одним или несколькими атомами галогена и/или алкильными группами. В качестве примера можно привести циклопропильную, циклопентильную, пиперазинильную, пирролидинильную и пиперидинильную группы;"частично циклическая алкильная группа" обозначает алкильную группу, в которой только часть образует кольцо;"алкилен" обозначает линейную или разветвленную двухвалентную алкильную группу, содержащую от 1 до 6 атомов углерода;"галоген" обозначает хлор, фтор, бром или йод, предпочтительно атом хлора или фтора;"галогеналкил" обозначает алкильную цепь, в которой все или некоторые из атомов водорода заменены на атомы галогена, такие как атомы фтора;"алкенил" обозначает алкильную группу, содержащую этиленовую ненасыщенную связь; и"арил" означает циклическую ароматическую группу, содержащую от 5 до 10 атомов углерода, например, фенильную группу;"гетероарил" обозначает циклическую ароматическую группу, содержащую от 3 до 10 атомов,включая один или несколько гетероатомов, например от 1 до 4 гетероатомов, таких как азот, кислород или сера, и эта группа содержит одно или несколько, предпочтительно одно или два, кольца. Гетероциклы могут содержать несколько конденсированных колец. Гетероарилы необязательно замещены одной или несколькими алкильными группами или атомом кислорода. В качестве примера можно привести тиенильную, пиридинильную, пиразолильную, имидазолильную, тиазолильную и триазолильную группы;"5-членный гетероарил" обозначает гетероарильную группу, состоящую из 5-членного кольца, содержащего от 1 до 4 гетероатомов (например, атомы кислорода и/или азота), необязательно замещенную одной или несколькими алкильными группами или гидроксильной группой или атомом кислорода. В качестве примера можно привести, например, оксадиазолильную и тетразолильную группы. В числе соединений формулы (I) в соответствии с изобретением можно указать подгруппы соединений, в которых R1 представляет собой -OR5, -O-Alk-OR5, -COOR5 или -O-Alk-COOR5 группу или фенил, необязательно замещенный одной или несколькими алкильной или -COOR5 группами, в которых R5 представляет собой атом водорода или алкильную группу, содержащую от 1 до 4 атомов углерода, и Alk представляет собой алкиленовую цепь, содержащую 1 или 2 атома углерода, или гетероарильную группу, предпочтительно пиридинильную группу. Другая подгруппа соединений формулы (I) в соответствии с изобретением является такой, чтоR1 представляет собой -OR5, -O-Alk-OR5 или -O-Alk-COOR5 группу или фенильную группу, необязательно замещенную одной или несколькими алкильной или -COOR5 группами, в которых R5 представляет собой атом водорода или метильную группу и Alk представляет собой алкиленовую цепь, содержащую 1 или 2 атома углерода, или гетероарильную группу, предпочтительно пиридинильную группу. Предпочтительно R1 представляет собой -OR5, -О-Alk-OR5 или -O-Alk-COOR5 группу или фенильную группу, необязательно замещенную -COOR5 группой, где R5 представляет собой атом водорода или метильную группу и Alk представляет собой алкиленовую цепь, содержащую 2 атома углерода. В числе соединений формулы (I) в соответствии с изобретением можно указать другую подгруппу соединений, где R2 представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода, или фенильную группу. Предпочтительно R2 представляет собой метильную или фенильную группу. В числе соединений формулы (I) в соответствии с изобретением можно указать другую подгруппу соединений, в которой R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, 6-членный азотистый гетероцикл, соответствующий одной из приведенных выше формулRa представляет собой атом водорода или алкильную или галогеналкильную, -OR5, -Alk-OR5,-Alk'-COOR5, -NR5R6, -Alk-NR7R8, -Alk-CN, -NR5-COOR6, -Alk'-CO-NR5R6, -Alk-CO-NR5-OR6 или-O-Alk-COOR5 группу или гетероарильную, -Alk-гетероарильную или -Alk-арильную группу, где арильная или гетероарильная группа,необязательно замещена алкильной группой или атомом галогена,Ra' представляет собой атом водорода или алкильную или -Alk-OR5 группу,Rb представляет собой атом водорода или алкильную или -Alk-COOR5 группу,Rb' представляет собой атом водорода или алкильную, галогеналкильную или -Alk-COOR5 группу,Rc представляет собой атом водорода или алкильную, COOR5, CN, -CO-NR5R6, -CO-NR7R8,Alk-гетероарильную или гетероарильную группу,Rc' представляет собой атом водорода или алкильную группу,Rc" представляет собой атом водорода или алкильную или алкенильную группу,указанные алкильные или алкенильные группы, описанные выше, содержат от 1 до 4 атомов углерода,R5 и R6 представляют собой атомы водорода или алкильные или галогеналкильные группы, где указанные алкильные и галогеналкильные группы содержат от 1 до 4 атомов углерода,R7 и R8 представляют собой атомы водорода или алкильные группы, содержащие от 1 до 4 атомов углерода, или вместе образуют 5- или 6-членное насыщенное кольцо,Alk представляет собой линейную или разветвленную алкиленовую цепь, содержащую от 1 до 4 атомов углерода, иAlk' представляет собой линейную, разветвленную, циклическую или частично циклическую алкиленовую цепь, содержащую от 1 до 4 атомов углерода. В числе соединений формулы (I), можно также указать соединения подгруппы, определенной выше,где R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены,6-членный азотистый гетероцикл, соответствующий любой из формул (А) и (С). Другая подгруппа соответствует соединениям формулы (I), в которой R3 и R4 образуют вместе с атомами углерода фенильного ядра, к которому они присоединены, азотистый гетероцикл формулы (С),гдеRc представляет собой атом водорода или алкильную, -COOR5, CN, -CO-NR5R6, -CO-NR7R8,Alk-гетероарильную или гетероарильную группу,Rc' представляет собой атом водорода или алкильную группу,Rc" представляет собой атом водорода или алкильную или алкенильную группу, указанные алкильная или алкенильная группы, описанные выше, содержат от 1 до 4 атомов углерода,R5 и R6 представляют собой атомы водорода или алкильные или галогеналкильные группы, где указанные алкильные и галогеналкильные группы содержат от 1 до 4 атомов углерода,R7 и R8 представляют собой атомы водорода или алкильные группы, содержащие от 1 до 4 атомов углерода, или вместе образуют 5- или 6-членное насыщенное кольцо,Alk представляет собой линейную или разветвленную алкиленовую цепь, содержащую от 1 до 4 атомов углерода, иAlk' представляет собой линейную, разветвленную, циклическую или частично циклическую алкиленовую цепь, содержащую от 1 до 4 атомов углерода. В числе соединений, которые являются предметом изобретения, можно указать следующие соединения: Ниже по тексту под термином "защитная группа" понимают группу, которая позволяет, с одной стороны, защищать реакционноспособную функциональную группу, такую как гидроксил или амин, во время синтеза, и, с другой стороны, регенерировать интактную реакционноспособную функциональную группу по окончании синтеза. Примеры защитных групп, а также способы защиты и снятия защиты указаны в "Protective Groups in Organic Synthesis", Green et al., 3rd Edition (John WileySons, Inc., New York). В оставшейся части текста термин "удаляемая группа" обозначает группу, которая может быть легко отщеплена от молекулы путем разрыва гетеролитической связи с удалением электронной пары. Следовательно, эта группа может быть легко заменена другой группой, например, во время реакции замещения. Такими удаляемыми группами являются, например, галогены или активированная гидроксильная группа, такая как мезил, тозил, трифлат, ацетил-, паранитрофенил и т.д. Примеры удаляемых групп, а также способы их получения, описаны в "Advances in Organic Chemistry", J. March, 3rd Edition, WileyInterscience, p. 310-316. В соответствии с изобретением соединения общей формулы (I) могут быть получены описанными ниже способами. На схеме 1 представлен способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (А), как определено выше, R1 представляет собой -OR5, -O-Alk-OR5,-COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 или -O-Alk-NR7R8 группу и R2 представляет собой группу, как определено выше.WO 03/084956), где R1 и R2 являются такими, как определено для соединения формулы (I), конденсируют с соединением формулы (III) с получением соединения формулы (IV). Соединение формулы (IV) подвергают реакции основного гидролиза с получением соединения формулы (V). Этерификация соединения формулы (V) дает соединение формулы (VI). При взаимодействии трифосгена образуется изоцианат, соответствующий соединению формулы (VI), который конденсируют с амином формулы RaNH2 с получением мочевины формулы (VII). Соединение формулы (VII) подвергают реакции циклизации в щелочной среде с получением соединения формулы (VIII). Соединение формулы (VIII) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X с получением соединения формулы (I), где R2 является таким, как определено выше. Схема 2 представляет собой способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (А), как определено выше, R1 является таким, как определено выше,за исключением -OR5, -O-Alk-OR5, -COOR5, -О-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 или -O-Alk-NR7R8 группы и R2 представляет собой группу, как определено выше. Схема 2 (способ 2)WO 03/084956), где R2 является таким, как определено для соединения формулы (I), конденсируют с соединением формулы (III) для получения соединения формулы (X). Соединение формулы (X) подвергают реакции основного гидролиза с получением соединения формулы (XI). Этерификация соединения формулы (XI) дает соединение формулы (XII). При взаимодействии N-бромсукцинимида образуется соединение формулы (XIII). При взаимодействии трифосгена, образуется изоцианат, соответствующий соединению формулы (XIII), который конденсируют с амином формулы RaNH2 с получением мочевины формулы (XIV). Соединение формулы (XIV) подвергают реакции циклизации в щелочной среде, с получением соединения формулы (XV). Соединение формулы (XV) подвергают в присутствии катализатора на основе палладия, лиганда и основания взаимодействию с производными фенилборонового или гетероарилборонового эфира или фенилборонатного или гетероарилборонатного эфира в соответствии с реакцией сочетания Сузуки или реакции цианирования с цианидом цинка с последующим кислотным гидролизом с получением соединения формулы (XVI). Соединение (XVI) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X с получением соединения формулы (I), где R2 является таким, как определено выше, и R1 является таким, как определено выше, за исключением -OR5, -O-Alk-OR5, -COOR5, -O-AlkCOOR5,-O-Alk-OR5, O-Alk-NR5R6 или -O-Alk-NR7R8 группы. Схема 3 представляет собой способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (В), как определено выше, и R1 является таким, как определено выше,за исключением арильной или гетероарильной группы, необязательно замещенной одной или несколькими алкильной, -OR5, -NR5R6 или -COOR5 группами, и R2 является таким, как определено выше. Схема 3 (метод 3) Соединение формулы (V), где R1 является таким, как определено выше, за исключением фенильной группы, необязательно замещенной одной или несколькими алкильной или -COOR5 группами, подвергают реакции конденсации с ангидридом кислоты с получением соединения формулы (XVII), где R1 и R2 являются такими, как определено выше. Соединение (XVII) подвергают реакции замещения с получением соединения формулы (I), где R1 и R2 являются такими, как определено выше. Схема 4 представляет собой способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (В), как определено выше, и R1 представляет собой арильную или гетероарильную группу, необязательно замещенную одной или несколькими алкильной, -OR5, -NR5R6 или -COOR5 группами, и R2 представляет собой группу, как определено выше. Схема 4 (метод 4) Соединение формулы (XIII) подвергают реакции омыления в щелочной среде с получением соединения (XVIII). Соединение (XVIII) подвергают реакции конденсации с ангидридом кислоты с получением соединения формулы (XIX). Соединение (XIX) подвергают реакции замещения с получением соединения формулы (XX). Соединение формулы (XX) подвергают, в присутствии катализатора на основе палладия, лиганда и основания, взаимодействию с производными фенилборонового или гетероарилборонового эфира или фенилборонатного или гетероарилборонатного эфира в соответствии с реакцией сочетания Сузуки с получением соединения формулы (I), где R1 и R2 являются такими, как определено выше. Схема 5 представляет собой способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (С), как определено выше, и R1 представляет собой -OR5, -O-Alk-OR5,-COOR5, -O-Alk-COOR5, -O-Alk-OR5, O-Alk-NR5R6 или -O-Alk-NR7R8 группу, и R2 является таким, как определено выше. Соединение (V) подвергают реакции конденсации с получением соединения XXI. Соединение XXI подвергают реакции алкилирования в присутствии основания и галогенированного производного Rc"X или защитной группы с получением соединения (XXII). Соединение (XXII) подвергают реакции конденсации с производной малоновой кислоты с получением соединения формулы (XXIII), где Rc' и Rc являются такими, как определено выше. Соединение формулы (XXIII) подвергают реакции снятия защитных групп с получением соединений формулы (I), где R1 и R2 являются такими, как определено выше. Схема 6 представляет собой способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (C), как указано выше, и R1 представляет собой арильную или гетероарильную группу, где арильная или гетероарильная группа необязательно замещена одной или несколькими алкильной, -OR5, -NR5R6 или -COOR5 группами, и Rc' преимущественно представляет собой алкил, и Rc" и R2 являются такими, как определено выше. Схема 6 (способ 6) Соединение (XVIII) подвергают реакции конденсации с получениемсоединения (XXIV). Соединение (XXIV) подвергают реакции алкилирования в присутствии основания и галогенированного производного Rc"X или защитной группы с получением соединения (XXV). Соединение (XXV) подвергают реакции конденсации с производным малоновой кислоты для получения соединения формулы (XXVI),где Rc' и Rc являются такими, как определено выше. Соединения (XXVI) подвергают в присутствии катализатора на основе палладия, лиганда и основания взаимодействию с производными фенилборонового или гетероарилборонового эфира или фенилборонатного или гетероарилборонатного эфира в соответствии с реакцией сочетания Сузуки с получением соединения формулы (XXVII). Соединение формулы(XXVII) подвергают реакции снятия защитных групп с получением соединений формулы (I), где R1 и R2 являются такими, как определено выше. Схема 7 представляет собой способ получения соединений формулы (I), где R3 и R4 вместе образуют азотистый гетероцикл формулы (С) с Rc', представляющего водород, и Rc и Rc" являются такими, как указано выше, и R1 представляет собой водород или -OR5, -O-Alk-OR5, -COOR5, -O-Alk-COOR5,-O-Alk-OR5, O-Alk-NR5R6 или -O-Alk-NR7R8 группу и R2 является таким, как определено выше. Соединение формулы (II), где R1 и R2 являются такими, как определено выше, конденсируют с хлоридом 4-нитробензойной кислоты с получением соединения (XXVIII). Соединение (XXVIII) подвергают восстановлению в присутствии железа и уксусной кислоты с получением соединения (XXIX). Соединение (XXIX) подвергают реакции конденсации с получением соединения (XXX). Соединение (XXX) подвергают реакции алкилирования в присутствии галоида Rc"X и основания для получения соединения формулы (I), где R1 и R2 являются такими, как определено выше. На указанных выше схемах исходные соединения и реагенты, в случае, когда способ их получения не описан, являются коммерчески доступными или описаны в литературе, либо могут быть получены в соответствии со способами, которые описаны в настоящем документе или которые известны специалистам в данной области. Предметом изобретения, в соответствии с другим его аспектом, также являются определенные выше соединения формул (I)-(XXX). Эти соединения используют в качестве промежуточных продуктов для синтеза соединений формулы (I). Следующие примеры описывают получение некоторых соединений в соответствии с изобретением. Эти примеры не являются ограничивающими и только иллюстрируют настоящее изобретение. Номера соединений из примеров соответствуют номерам, приведенным в нижеследующих таблицах, иллюстрирующих химические структуры и физические свойства некоторых соединений по изобретению. Реагенты и промежуточные соединения, в случае, когда способ их получения не объясняется, описаны в литературе или являются коммерчески доступными. Некоторые промежуточные соединения, которые используют для получения соединений формулы (I), могут также служить в качестве конечных продуктов формулы (I), что станет ясно из примеров, приведенных ниже. Кроме того, некоторые соединения формулы (I) в соответствии с изобретением могут служить в качестве промежуточных соединений,которые используют для получения других соединений формулы (I) в соответствии с изобретением. Так, например, соединения формулы (I) выбраны из следующих соединений: Сокращения: ДМФ: N,N-диметилформамид,ТГФ: тетрагидрофуран,DBU: 1,8-диазабицикло[5,4,0]ундец-7-ен,HBTU: O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония гексафторфосфат,DIEA: диизопропилэтиламин,DME: диметиловый эфир этиленгликоля,TOTU: О-[(этоксикарбонил)цианометиленамино]-N,N,N',N'-тетраметилурония фторборат. ЯМР анализ выполняли с помощью прибора Bruker Avance с частотой 250, 300 и 400 МГц. Температуры плавления измеряли с помощью прибора Buchi В-450. Масс-спектрометрические анализы выполняли с помощью прибора Waters Alliance 2695(23,1 ммоль) натриевой соли 2-амино-5-[(1-метокси-2-метилиндолизин-3 ил)карбонил]бензойной кислоты (описана в WO 03/084956) в 130 мл ДМФ добавляли 1,51 мл(24,26 ммоль) метилйодида, в инертной атмосфере при температуре окружающей среды. После перемешивания в течение 1 ч добавляли воду. Образовавшийся осадок отфильтровывали, промывали водой, а затем сушили при пониженном давлении при 50C в течение ночи. Получали 7,17 г твердого вещества желтого цвета. МН+: 339. Метил 2-([2-(диметиламино)-2-оксоэтил]карбамоиламино)-5-[(1-метокси-2-метилиндолизин-3 ил)карбонил]бензоат. К 1,3 г (3,84 ммоль) метил 2-амино-5-[(1-метокси-2-метилиндолизин-3-ил)карбонил]бензоата в 50 мл диоксана добавляли 0,798 г (2,69 ммоль) трифосгена, разведенного в 10 мл диоксана, в инертной атмосфере при температуре окружающей среды. После перемешивания в течение 1 ч, добавляли 1,25 г(7,68 ммоль) ацетата N,N-диметилглицинамида и 2,68 мл (19,21 ммоль) триэтиламина. Реакционную среду перемешивали в течение ночи при температуре окружающей среды, а затем гидролизовали водой. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Получали 1,8 г твердого вещества желтого цвета. Температура плавления: 228C. МН+: 467. 2-6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2 Н)-илN,N'-диметилацетамид. К 1,8 г (3,86 ммоль) метил 2-([2-(диметиламино)-2-оксоэтил]карбамоиламино)-5-[(1-метокси-2 метилиндолизин-3-ил)карбонил]бензоата в 25 мл ТГФ добавляли 0,69 мл (4,63 ммоль) DBU при температуре окружающей среды в инертной атмосфере. Реакционную среду перемешивали в течение ночи при температуре окружающей среды. ТГФ концентрировали при пониженном давлении. Остаток растворяли в воде. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество желтого цвета очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Полученное вещество в виде пены оранжевого цвета обрабатывали минимальным количеством метанола. После добавления воды осадок отфильтровывали, промывали водой, а затем сушили при пониженном давлении при 50C в течение ночи. Получали 1,14 г порошка желтого цвета. Температура плавления: 290C. МН+: 435. 1H-ЯМР (D6-ДМСО, 400 МГц)м.д.: 1,82 (с, 3H), 2,85 (с, 3H), 3,08 (с, 3H), 3,83 (с, 3H), 4,75 (с, 2 Н),6,95 (т, J=6,85 Гц, 1 Н), 7,19-7,24 (м, 1 Н), 7,32 (д, J=8,43 Гц, 1 Н), 7,66 (д, J=8,87 Гц, 1 Н), 7,91 (д, J=8,47 Гц,1 Н), 8,09 (д, J=2,02 Гц, 1 Н), 9,53 (д, J=7,26 Гц, 1 Н), 11,83 (с, 1 Н). Пример 2. Соединение 68. 2-6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-1-метил-2,4-диоксо-1,4-дигидрохиназолин 3(2 Н)-ил-N,N'-диметилацетамид. К 0,150 г (0,35 ммоль) 2-6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4 дигидрохиназолин-3(2 Н)-ил-N,N'-диметилацетамида в 5 мл ДМФ добавляли 0,04 мл (0,69 ммоль) метилйодида и 0,225 г (0,69 ммоль) карбоната цезия в инертной атмосфере при температуре окружающей среды. Реакционную среду перемешивали в течение 2,5 ч при температуре окружающей среды, а затем гидролизовали водой. Водную фазу экстрагировали этилацетатом. Полученную органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Полученное твердое вещество обрабатывали минимальным количеством метанола. После добавления воды, осадок отфильтровывали, промывали водой, а затем сушили при пониженном давлении при 50C в течение ночи. Получали 0,135 г твердого вещества желтого цвета. Температура плавления: 276C. МН+: 449. 1 Н-ЯМР (D6-ДМСО, 400 МГц)м.д.: 1,82 (с, 3H), 2,85 (с, 3H), 3,09 (с, 3H), 3,60 (с, 3H), 3,83 (с, 3H),4,81 (с, 2 Н), 6,97 (т, J=7,05 Гц, 1 Н), 7,21-7,26 (м, 1 Н), 7,62 (д, J=8,75 Гц, 1 Н), 7,67 (д, J=8,75 Гц, 1 Н), 8,02 Пример 3. Соединение 36. 6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-3-[(3-метил-1,2,4-оксадиазол-5 ил)метил]хиназолин-2,4(1 Н,3H)дион. Метил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2 Н)илацетат. К 2 г (5,91 ммоль) метил 2-амино-5-[(1-метоксииндолизин-3-ил)карбонил] бензоата в 65 мл диоксана добавляли 1,22 г (4,14 ммоль) трифосгена, разбавленного в 15 мл диоксана, в инертной атмосфере при температуре окружающей среды. Реакционную среду перемешивали в течение 1 ч при температуре окружающей среды, а затем добавляли 1,48 г (11,82 ммоль) метилглицината и 4,12 мл (29,55 ммоль) триэтиламина. Реакционную среду перемешивали в течение 18 ч, а потом добавляли 1,08 г (5,91 ммоль)DBU. После перемешивания в течение 24 ч, среду гидролизовали водой. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу промывали водой, сушили над сульфатом натрия,фильтровали и затем концентрировали при пониженном давлении. Твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Полученное твердое вещество перекристаллизовывали при нагревании из метанола. Получали 1,5 г твердого вещества желтого цвета. Температура плавления: 253C. МН+: 422. 6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-3-[(3-метил-1,2,4-оксадиазол-5 ил)метил]хиназолин-2,4(1 Н,3H)дион. К 0,1 г (0,25 ммоль) метил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4 дигидрохиназолин-3(2 Н)-илацетата в 5 мл ДМФ добавляли 0,14 г (0,37 ммоль) HBTU, 0,21 мл(1,23 ммоль) DIEA, а затем 0,18 г (1,23 ммоль) (1E)-N'-гидроксиэтанимидамида в инертной атмосфере при температуре окружающей среды. Реакционную среду нагревали при 90C в течение 24 ч. После гидролиза с помощью воды, реакционную смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия и затем водой, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество желтого цвета очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 0,046 г твердого вещества желтого цвета. Температура плавления: 176C. МН+: 446. 1H-ЯМР (D6-DMCO, 500 МГц)м.д.: 1,82 (с, 3H), 2,30 (с, 3H), 3,82 (с, 3H), 5,36 (с, 2 Н), 6,96 (т,J=7,04 Гц, 1 Н), 7,20-7,24 (м, 1 Н), 7,35 (д, J=8,48 Гц, 1 Н), 7,66 (д, J=8,81 Гц, 1 Н), 7,94 (д, J=8,32 Гц, 1 Н),8,11 (д, J=1,92 Гц, 1 Н), 9,54 (д, J=7,43 Гц, 1 Н), 12,01 (с, 1 Н). Пример 4. Соединение 14. Натриевая соль 3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил-2 метилиндолизин-1-ил]бензойной кислоты. Метил 2-амино-5-[(1-бром-2-метилиндолизин-3-ил)карбонил]бензоат. К 0,812 г (2,6 ммоль) метил 2-амино-5-[(2-метилиндолизин-3-ил)карбонил]бензоата в 17 мл дихлорметана добавляли 0,492 г (2,73 ммоль) N-бромсукцинимида в инертной атмосфере при температуре окружающей среды. Реакционную среду перемешивали в течение 2 ч, а затем гидролизовали водой. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия и потом насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя дихлорметаном. Получали 0,9 г твердого вещества желтого цвета. МН+: 387, 389. Метил 2-амино-5-(1-[3-(метоксикарбонил)фенил]-2-метилиндолизин-3-илкарбонил)бензоат. К 0,410 г (1,06 ммоль) метил 2-амино-5-[(1-бром-2-метилиндолизин-3-ил)карбонил]бензоата в 8 мл смеси DME/H2O (5/1) добавляли 0,229 г (1,27 ммоль) [3-(метоксикарбонил)фенил]бороновой кислоты,0,492 г (2,12 ммоль) дигидрофосфата калия и 0,024 г (0,02 ммоль) тетракис-(трифенилфосфин)палладия в атмосфере аргона при температуре окружающей среды. Реакционную среду нагревали при 90C в течение 18 ч. Реакционную среду экстрагировали дихлорметаном, промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя дихлорметаном. Получали 309 мг твердого вещества желтого цвета. Температура плавления: 232C. МН+: 443. Метил 5-(1-[3-(метоксикарбонил)фенил]-2-метилиндолизин-3-илкарбонил)-2[(пропилкарбамоил)амино]бензоат. В инертной атмосфере при температуре окружающей среды, к 308 мг (0,68 ммоль) метил 2-амино 5-(1-[3-(метоксикарбонил)фенил]-2-метилиндолизин-3-илкарбонил)бензоата в 5,6 мл диоксане добав- 11024160 ляли 0,143 мг (0,47 ммоль) трифосгена, разбавленного в 2 мл диоксана. Реакционную среду перемешивали в течение 2 ч при температуре окружающей среды и затем добавляли 0,28 мл (2,03 ммоль) триэтиламина и 0,11 мл (1,35 ммоль) н-пропиламина, разбавленного в 4 мл диоксана. После перемешивания в течение 2 ч реакционную среду гидролизовали водой. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу промывали 1 н. водным раствором соляной кислоты, а затем насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 215 мг твердого вещества желтого цвета. Температура плавления: 143C. МН+: 496. Натриевая соль 3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]-2 метилиндолизин-1-илбензойной кислоты. К 0,203 мг (0,39 ммоль) метил 5-(1-[3-(метоксикарбонил)фенил]-2-метилиндолизин-3 илкарбонил)-2-[(пропилкарбамоил)амино]бензоата в 4 мл метанола добавляли 0,96 мл (0,96 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 7 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Полученный осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 50C в течение ночи. К 0,158 г (0,33 ммоль) полученного твердого вещества добавляли 0,31 мл (0,31 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду перемешивали в течение 1 ч, а затем добавляли диизопропиловый эфир. Полученный осадок отфильтровывали, промывали диизопропиловым эфиром, а затем сушили при пониженном давлении при 50C в течение ночи. Получали 155 мг твердого вещества желтого цвета. Температура плавления: 361C. МН+: 504. 1WO 06/097625) в 100 мл дихлорэтана добавляли 2,25 мл (16,12 ммоль) триэтиламина и 3 г (13,44 ммоль) 1-метокси-2-фенилиндолизина (в соответствии с методом, описанным в WO 03/084956), разбавленного в 20 мл дихлорэтана, в инертной атмосфере при температуре окружающей среды. После перемешивания в течение ночи при температуре окружающей среды реакционную смесь фильтровали и промывали дихлорэтаном. Фильтрат промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток фильтровали через силиконовый фильтр, элюируя дихлорметаном. Получали 4,4 г твердого вещества желтого цвета. МН+: 473. 2-Амино-5-[(1-метоксииндолизин-3-ил)карбонил]бензойная кислота. К 4,4 г (9,31 ммоль) 6-[(1-метокси-2-фенилиндолизин-3-ил)карбонил]-2-фенил-4 Н-3,1-бензоксазин 4-она в 50 мл N-метилпирролидона добавляли, при температуре окружающей среды, 1,56 г (27,94 ммоль) гидроксида калия, растворенного в 4 мл воды. Реакционную среду нагревали при 80C в течение 24 ч. Реакционную среду выливали в 1 н. водный раствор соляной кислоты. Образовавшийся осадок отфильтровывали и промывали водой. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 3,05 г зеленого твердого вещества. Температура плавления: 106C. МН+: 387. Метил 2-амино-5-[(1-метокси-2-фенилиндолизин-3-ил)карбонил]бензоат. К 3,03 г (7,84 ммоль) 2-амино-5-[(1-метоксииндолизин-3-ил)карбонил] бензойной кислоты в 50 мл ДМФ добавляли 0,54 мл (8,63 ммоль) метилйодида и 2,8 г (8,63 ммоль) карбоната цезия в инертной атмосфере при температуре окружающей среды. После перемешивания в течение 3 ч при температуре окружающей среды добавляли воду. Образовавшийся осадок отфильтровывали, промывали водой, а затем сушили при пониженном давлении при 50C в течение ночи. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя дихлорметаном. Получали 1,98 г твердого вещества желтого цвета. МН+: 401. Этил 6-[(1-метокси-2-фенилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохинаЗолин-3(2 Н)илацетат. К 0,4 г (1 ммоль) метил 2-амино-5-[(1-метоксииндолизин-3-ил)карбонил] бензоата в 50 мл диоксана добавляли 0,208 г (0,7 ммоль) трифосгена, разбавленного в 15 мл диоксана, в инертной атмосфере при температуре окружающей среды. После перемешивания в течение 1 ч добавляли 0,279 г (2 ммоль) этилглицината и 0,70 мл (5 ммоль) триэтиламина. После перемешивания при температуре окружающей среды в течение 2 ч реакционную среду гидролизовали водой. После того как смесь выдерживали в течение ночи при температуре окружающей среды, водную фазу экстрагировали дихлорметаном. Полученную органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 0,362 г твердого вещества желтого цвета. Температура плавления: 221C. МН+: 498. Натриевая соль 6-[(1-метокси-2-фенилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4 дигидрохиназолин-3(2 Н)-илуксусной кислоты. К 0,312 мг (0,63 ммоль) этил 6-[(1-метокси-2-фенилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4 дигидрохиназолин-3(2 Н)-илацетата в 10 мл метанола добавляли при температуре окружающей среды 0,75 мл (0,75 ммоль) 1 н. водного раствора гидроксида натрия. Реакционную среду нагревали с обратным холодильником в течение 7 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Полученный осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 50C в течение ночи. К 0,250 г (0,53 ммоль) полученного твердого вещества добавляли при температуре окружающей среды 0,52 мл (0,52 ммоль) 1 н. водного раствора гидроксида натрия. Реакционную среду перемешивали в течение 1 ч и затем добавляли диизопропиловый эфир. Полученный осадок отфильтровывали, промывали диизопропиловым эфиром, а потом сушили при пониженном давлении при 50C в течение ночи. Получали 0,237 г твердого вещества желтого цвета. Температура плавления: 337C. МН+: 470. 1H-ЯМР (D6-ДМСО, 400 МГц)м.д.: 3,64 (с, 3H), 4,07 (с, 2 Н), 6,70 (д, J=8,55 Гц, 1 Н), 7,00-7,1 (м,6 Н), 7,21-7,27 (м, 1 Н), 7,49 (д, J=8,37 Гц, 1 Н), 7,76 (д, J=9,07 Гц, 1H), 7,88 (д, J=1,92 Гц, 1 Н), 9,55 (д,J=7,15 Гц, 1 Н), 1,27 (с, 1 Н). Пример 6. Соединение 34. Этил (6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2 Н)илокси)ацетат. Метил 5-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-[(проп-2-ен-1-илокси)карбамоил]аминобензоат. К 0,4 г (1,18 ммоль) метил 2-амино-5-[(1-метокси-2-метилиндолизин-3-ил)карбонил]бензоата в 10 мл диоксана добавляли в инертной атмосфере при температуре окружающей среды 0,251 г(0,83 ммоль) трифосгена, разбавленного в 3 мл диоксана. После перемешивания в течение 2,5 ч добавляли 0,267 г (2,36 ммоль) O-проп-2-ен-1-илгидроксиламина и 0,82 мл (5,91 ммоль) триэтиламина. Реакционную среду перемешивали в течение 1 ч, а затем гидролизовали водой. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу промывали 1 н. водным раствором соляной кислоты и насыщенным водным раствором хлорида натрия, а затем сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали 0,581 г твердого вещества желтого цвета. МН+: 438. 6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-3-(проп-2-ен-1-илокси)хиназолин-2,4(1 Н,3H)дион. К 0,370 мг (0,85 ммоль) метил 5-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-[(проп-2-ен-1 илокси)карбамоил]аминобензоата в 5 мл метанола добавляли 1,27 мл (1,27 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 1 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Водную фазу экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия,сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя дихлорметаном. Получали 0,293 г твердого вещества желтого цвета. Температура плавления: 258C. МН+: 406. 3-Гидрокси-6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]хиназолин-2,4(1 Н,3H)-дион. К 0,276 г (0,65 ммоль) 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-3-(проп-2-ен-1 илокси)хиназолин-2,4(1 Н,3H)-диона в 7 мл дихлорметана добавляли в атмосфере инертного газа при 0C 0,15 мл (1,18 ммоль) фенилсилана и 0,030 г (0,03 ммоль) тетракис-(трифенилфосфин)палладия. Реакционную среду перемешивали в течение 4 ч при температуре окружающей среды и затем фильтровали. Осадок промывали дихлорметаном. Твердое вещество растворяли в 1 н. водном растворе гидроксида натрия. После добавления 1 н. водного раствора соляной кислоты, полученный осадок отфильтровывали,промывали водой и сушили при пониженном давлении в течение ночи при 50C. Получали 0,208 мг твердого вещества желтого цвета. Температура плавления: 300C. МН+: 366. Этил (6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2,4-диоксо-1,4-дигидрохиназолин-3(2 Н)илокси)ацетата. К 0,36 г (0,99 ммоль) 3-окси-6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]хиназолин-2,4(1 Н,3H)диона в 12,5 мл этанола добавляли 0,11 мл (0,99 ммоль) этилбромацетата, а затем 0,14 мл (0,99 ммоль) триэтиламина, при температуре окружающей среды в инертной атмосфере. Реакционную среду перемешивали в течение 18 ч и затем добавляли 0,14 мл (0,99 ммоль) триэтиламина и 0,11 мл (0,99 ммоль) этилбромацетата. После перемешивания в течение 18 ч при температуре окружающей среды реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол. Получали 217 мг желтого порошка. МН+: 452. Температура плавления: 230C. 1(с, 1 Н), 9,52-9,54 (г, 1 Н), 11,9 (с, 1 Н). Пример 7. Соединение 51. 3-Амино-6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]хиназолин-2,4(1 Н,3H)-дион. К 0,2 г (0,6 ммоль) метил 2-амино-5-[(1-метокси-2-метилиндолизин-3-ил)карбонил]бензоата в 10 мл диоксана добавляли 0,123 г (0,41 ммоль) трифосгена в инертной атмосфере при температуре окружающей среды. После перемешивания в течение 10 мин добавляли 58 мкл (1,2 ммоль) гидрата гидразина и 0,4 мл (3 ммоль) триэтиламина. Реакционную среду перемешивали в течение 3 ч, а затем гидролизовали водой. Водную фазу экстрагировали этилацетатом. Полученную органическую фазу сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 16 мг твердого вещества желтого цвета. Температура плавления: 220C. МН+: 365. 1(пример 150, описанный в WO 03/084956) в 1 мл уксусного ангидрида нагревали с обратным холодильником в течение 3 ч. Реакционную среду концентрировали при пониженном давлении. Получали 0,107 г твердого вещества желтого цвета. Температура плавления: 218C. 6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-2-метилхиназолин-4(3H)-он. 0,100 г (0,29 ммоль) 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4 Н-3,1-бензоксазин 4-она в 2 мл 20%-ного водного раствора аммиака нагревали в течение 2 ч при 50C и затем гидролизовали 3 мл 10%-ного раствора гидроксида натрия и доводили до 50C в течение 2 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты до значения рН 9. Полученный осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 40C в течение ночи. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 67 мг твердого вещества желтого цвета. Температура плавления: 290C. МН+: 348. 1 Пример 9. Соединение 43. Натриевая соль 3-2-метил-3-[(2-метил-4-оксо-3,4-дигидрохиназолин-6-ил)карбонил]индолизин-1 илбензойной кислоты. 2-Амино-5-[(1-бром-2-метилиндолизин-3-ил)карбонил]бензойная кислота. К 1,91 г (4,69 ммоль) метил 2-амино-5-[(1-бром-2-метилиндолизин-3-ил)карбонил]бензоата в 30 мл метанола добавляли при температуре окружающей среды 4,92 мл (4,92 ммоль) 1 н. водного раствора гидроксида натрия. Реакционную среду нагревали с обратным холодильником в течение 10 ч и затем гидролизовали 1 н. водным раствором соляной кислоты. Водную фазу экстрагировали этилацетатом. Полученную органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество промывали диизопропиловым эфиром и дихлорметаном, и сушили при пониженном давлении в течение ночи при 50C. Получали 1,55 г твердого вещества желтого цвета. МН+: 374. Температура плавления: 230C. 6-[(1-Бром-2-метилиндолизин-3-ил)карбонил]-2-метилхиназолин-4(3H)-он. 0,450 г (1,15 ммоль) 2-амино-5-[(1-бром-2-метилиндолизин-3-ил)карбонил]бензойной кислоты в 3,79 мл уксусного ангидрида нагревали с обратным холодильником в течение 1,5 ч в инертной атмосфере. Реакционную среду концентрировали при пониженном давлении. 0,457 г (1,15 ммоль) твердого вещества, полученного в 8 мл 0,5 н. водного раствора аммиака в диоксане, нагревали при 50C в течение 1 ч. После добавления диизопропилового эфира образовавшийся осадок отфильтровывали, промывали водой, а затем сушили при пониженном давлении при 50C в течение ночи. Получали 182 мг твердого вещества желтого цвета. МН+: 348. Метил 3-2-метил-3-[(2-метил-4-оксо-3,4-дигидрохиназолин-6-ил)карбонил]индолизин-1 илбензоат. К 0,256 г (0,65 ммоль) 6-[(1-бром-2-метилиндолизин-3-ил)карбонил]-2-метилхиназолин-4(3H)-она в 9 мл ДМФ добавляли 0,139 г (0,78 ммоль) [3-(метоксикарбонил)фенил]бороновой кислоты, 0,321 г(1,29 ммоль) дигидрата фосфата калия, растворенного в 0,81 мл воды, и 0,0149 г (0,01 ммоль) тетракис(трифенилфосфин)палладия в атмосфере аргона при температуре окружающей среды. Реакционную среду нагревали в микроволновой печи при 150C в течение 15 мин. После разбавления этилацетатом, органическую фазу промывали 1 н. водным раствором соляной кислоты, а затем насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/2). Получали 172 мг твердого вещества желтого цвета. Температура плавления: 232C. МН+: 452. Натриевая соль 3-2-метил-3-[(2-метил-4-оксо-3,4-дигидрохиназолин-6-ил)карбонил]индолизин-1 илбензойной кислоты. К 0,171 г (0,38 ммоль) метил 3-2-метил-3-[(2-метил-4-оксо-3,4-дигидрохиназолин-6 ил)карбонил]индолизин-1-илбензоата в 4 мл метанола добавляли 0,45 мл (0,45 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 10 ч и затем гидролизовали 1 н. водным раствором соляной кислоты. Водную фазу экстрагировали этилацетатом. Полученную органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество промывали водой и затем сушили при пониженном давлении в течение ночи при 50C. К 0,056 г полученного твердого вещества добавляли 0,12 мл (0,12 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды, в 4 мл метанола. Реакционную среду перемешивали в течение 1 ч, а затем добавляли диизопропиловый эфир. Полученный осадок отфильтровывали, промывали диизопропиловым эфиром, а затем сушили при пониженном давлении при 50C в течение ночи. Получали 58 мг твердого вещества желтого цвета. Температура плавления: 344C. МН+: 438. 1 Н-ЯМР (D6-ДМСО, 400 МГц)м.д.: 1,83 (с, 3H), 2,40 (с, 3H), 7,04 (т, J=6,70 Гц, 1 Н), 7,25-7,44 (м,3H), 7,55 (д, J=8,04 Гц, 1 Н), 7,70 (д, J=8,71 Гц, 1 Н), 7,8 (д, J=6,70 Гц, 1 Н), 7,92 (с, 1 Н), 8,04 (д, J=8,04 Гц,1 Н), 8,31 (с, 1 Н), 9,59 (д, J=6,70 Гц, 1 Н), 12,53 (с, 1 Н). Пример 10. Соединение 48. 6-[1-(2-Метоксиэтокси)-2-метилиндолизин-3-ил]карбонил-3-пропилхиназолин-2,4(1 Н,3H)дион. Метил 2-амино-5-[ (1-гидрокси-2-метилиндолизин-3-ил)карбонил]бензоат. К 0,8 г (1,93 ммоль) метил 2-амино-5-[1-(бензилокси)-2-метилиндолизин-3-ил]карбонилбензоата в 30 мл ДМФ добавляли 0,3 65 мг (5,79 ммоль) формиата аммония и 0,102 г (0,1 ммоль) палладия на угле(10%) при температуре окружающей среды в инертной атмосфере. Реакционную среду перемешивали в течение 3 ч при температуре окружающей среды и затем фильтровали. Палладий промывали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Получали масло зеленого цвета. МН+: 325. Метил 2-амино-5-[1-(2-метоксиэтокси)-2-метилиндолизин-3-ил]карбонилбензоат. К 0,313 г (0,97 ммоль) метил 2-амино-5-[1-гидрокси-2-метилиндолизин-3-ил]карбонилбензоата в 10 мл ДМФ добавляли 0,161 г (1,16 ммоль) 1-бром-2-метоксиэтана и 0,359 мг (1,16 ммоль) карбоната цезия в инертной атмосфере при температуре окружающей среды. Реакционную среду перемешивали в течение 24 ч при температуре окружающей среды, гидролизовали водой, а затем подкисляли 1 н. водным раствором соляной кислоты. Водную фазу экстрагировали этилацетатом. Полученную органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 150 мг желтого масла. МН+: 383 Метил 5-[1-(2-метоксиэтокси)-2-метилиндолизин-3-ил]карбонил-2-[(пропилкарбамоил)амино]бензоат. К 0,2 г(0,52 ммоль) метил 2-амино-5-[1-(2-метоксиэтокси)-2-метилиндолизин-3 ил]карбонилбензоата в 5 мл диоксана добавляли 0,108 г (0,37 ммоль) трифосгена, разбавленного в 1 мл диоксана, в инертной атмосфере при температуре окружающей среды. Реакционную среду перемешивали в течение 1 ч при температуре окружающей среды, а затем добавляли 0,22 мл (1,57 ммоль) триэтиламина и 0,09 мл (1,05 ммоль) н-пропиламина. После перемешивания в течение 18 ч реакционную смесь гидролизовали водой. Водную фазу экстрагировали дихлорметаном. Полученную органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 170 мг твердого вещества желтого цвета. Температура плавления: 125C. МН+: 468. 6-[1(2-Метоксиэтокси)-2-метилиндолизин-3-ил]карбонил-3-пропилхиназолин-2,4(1 Н,3H)-дион. К 0,17 г (0,36 ммоль) метил 5-[1-(2-метоксиэтокси)-2-метилиндолизин-3-ил]карбонил-2[(пропилкарбамоил)амино]бензоата в 5 мл метанола добавляли 0,44 мл (0,44 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 7 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Полученный осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 50C в течение ночи. Получали 79 мг твердого вещества желтого цвета. Температура плавления: 215C. МН+: 436. 1(1-Метокси-2-метилиндолизин-3-ил)(4-нитрофенил)метанон. К 1,7 г (10,77 ммоль) 1-метокси-2-метилиндолизина в 15 мл дихлорэтана добавляли 1,8 мл(12,92 ммоль) триэтиламина, при температуре окружающей среды в инертной атмосфере, и затем, по каплям, по 2,2 г (11,85 ммоль) хлорида 4-нитробензойной кислоты. Реакционную среду перемешивали в течение 30 мин при температуре окружающей среды, гидролизовали насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали дихлорметаном. Органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром. Получали 3 г твердого вещества оранжевого цвета. МН+: 311. Температура плавления: 151C.(4-Аминофенил) (1-метокси-2-метилиндолизин-3-ил)метанон. К 2,91 г (9,57 ммоль) (1-метокси-2-метилиндолизин-3-ил)(4-нитрофенил)метанона в 120 мл 2/1 смеси воды и этанола добавляли 1,93 г (34,46 ммоль) железа и 8,21 мл (143,57 ммоль) ледяной уксусной кислоты. Реакционную среду нагревали при 80C в течение 3 ч. Реакционную среду экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматогра- 16024160 фии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 2,58 г твердого вещества желтого цвета. МН+: 281. Этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-4-оксо-1,4-дигидрохинолин-3-карбоксилат. К 0,4 г (1,43 ммоль) (4-аминофенил)(1-метокси-2-метилиндолизин-3-ил)метанона в 6 мл толуола добавляли 0,36 мл диэтилэтоксиметиленмалоната в инертной атмосфере при температуре окружающей среды. Реакционную среду нагревали при 110C в течение 1 ч 45 и затем концентрировали при пониженном давлении. Полученный остаток растворяли в 8,2 мл дифенилового эфира и затем нагревали при 230C в течение 1 ч 20. После добавления диизопропилового эфира и пентана при температуре окружающей среды, осадок отфильтровывали и промывали пентаном. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 142 мг желтого порошка. Температура плавления: 271C. МН+: 405. Этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4-дигидрохинолин-3 карбоксилат. К 10 г (23,24 ммоль) этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-4-оксо-1,4 дигидрохинолин-3-карбоксилата в 100 мл ДМФ добавляли 3,8 г (27,89 ммоль) карбоната калия и 1,74 мл(27,89 ммоль) метилйодида при температуре окружающей среды в инертной атмосфере. Реакционную среду нагревали при 90C в течение 1 ч 30 мин. Реакционную среду фильтровали через фильтр из талька,разбавляли дихлорметаном, а затем промывали водой. Органическую фазу сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 9,1 г твердого вещества желтого цвета. Температура плавления: 258C. МН+: 419. Натриевая соль 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4 дигидрохинолин-3-карбоновой кислоты. К 0,348 г (0,83 ммоль) этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4 дигидрохинолин-3-карбоксилата в 4 мл смеси трет-бутанола и воды (1/1) добавляли 0,34 мл (0,34 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 2 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Полученный осадок очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95/5). К 0,231 г полученного твердого вещества в 4 мл метанола добавляли 0,56 мл (0,56 ммоль) 1 н. водного раствора гидроксида натрия. Реакционную среду перемешивали в течение 1 ч и затем добавляли диэтиловый эфир. Полученный осадок отфильтровывали, промывали диэтиловым эфиром и затем сушили при пониженном давлении при 50C в течение ночи. Получали 265 мг твердого вещества желтого цвета. Температура плавления: 258C. МН+: 391. 1 Н-ЯМР (D6-ДМСО, 400 МГц)м.д.: 1,75 (с, 3H), 3,8 (с, 3H), 3,96 (с, 3H), 6,96 (т, J=6,43 Гц, 1 Н),7,22 (т, J=6,89, 1 Н), 7,66 (д, J=8,72 Гц, 1 Н), 7,82 (д, J=8,27 Гц, 1 Н), 7,96 (д, J=8,27 Гц, 1 Н), 8,45 (с, 1 Н),8,69 (с, 1 Н), 9,57 (д, J=7,35 Гц, 1 Н). Пример 12. Соединение 73. Натриевая соль 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1,4 дигидрохинолин-3-карбоновой кислоты. 6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-1-проп-2-ен-1-ил-2 Н-3,1-бензоксазин-2,4(1 Н)дион. К 1 г (2,85 ммоль) 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2 Н-3,1-бензоксазин-2,4(1 Н)диона в 15 мл ДМФ добавляли 0,5 мл (5,71 ммоль) аллилбромида и 0,19 г (4,28 ммоль) гидрида натрия при 60% в инертной атмосфере при температуре окружающей среды. Реакционную среду перемешивали в течение 2 ч при температуре окружающей среды и затем концентрировали при пониженном давлении. После добавления льда к остатку, образовавшийся осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 50C в течение ночи. Получали 0,773 г твердого вещества желтого цвета. МН+: 391. Этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1-проп-2-ен-1-ил-1,4 дигидрохинолин-3-карбоксилат. К 0,66 г (1,52 ммоль) 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-1-проп-2-ен-1-ил-2 Н-3,1 бензоксазин-2,4(1 Н)-диона в 30 мл ДМФ добавляли 0,49 мл (3,80 ммоль) этилацетоацетата, разбавленного в 20 мл безводного ДМФ, в инертной атмосфере при температуре окружающей среды. Реакционную смесь перемешивали при температуре окружающей среды в течение ночи и затем экстрагировали этил- 17024160 ацетатом. Полученную органическую фазу промывали насыщенным водным раствором хлорида натрия,сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 0,441 г твердого вещества желтого цвета. Температура плавления: 101C. МН+: 459. Этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1,4-дигидрохинолин-3 карбоксилат. К 0,307 (0,67 моль) этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1-проп-2 ен-1-ил-1,4-дигидрохинолин-3-карбоксилата в 12 мл смеси ДМФ трет-бутанола и воды (1/1) добавляли 6,7 мг (0,02 ммоль) дихлор(2,6,10-додекатриен)-1,12-диила рутения(IV) при температуре окружающей среды в инертной атмосфере. Реакционную среду нагревали в микроволновой печи в течение 30 мин при 120C и затем экстрагировали этилацетатом. Полученную органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный осадок очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95/5). Получали 94 мг твердого вещества желтого цвета. Температура плавления: 257C. МН+: 419. Натриевая соль 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1,4 дигидрохинолин-3-карбоновой кислоты. К 0,066 г (0,16 ммоль) этил 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-2-метил-4-оксо-1, 4 дигидрохинолин-3-карбоксилата в 4 мл этанола добавляли 0,32 мл (0,32 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 2 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Полученный осадок очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметан/метанол (95/5). К 0,019 г полученного твердого вещества в 2 мл метанола добавляли 0,04 мл(0,04 ммоль) 1 н. водного раствора гидроксида натрия. Реакционную среду перемешивали в течение 1 ч и затем добавляли диэтиловый эфир. Полученный осадок отфильтровывали, промывали диэтиловым эфиром и затем сушили при пониженном давлении при 50C в течение ночи. Получали 16 мг твердого вещества желтого цвета. МН+: 391. 1(37,09 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 2 ч. Реакционную среду подкисляли 1 н. водным раствором соляной кислоты. Полученный осадок промывали этилацетатом, метанолом и затем водой и сушили при пониженном давлении в течение ночи при 50C. Получали 1,8 г твердого вещества желто-зеленого цвета. Одновременно органическую фазу промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток промывали эфиром и сушили при пониженном давлении в течение ночи при 50C. Получали 0,85 г твердого вещества желтого цвета. Температура плавления: 289C. МН+: 377. 6-[(1-Метокси-2-метилиндолизин-3-ил)карбонил]-N-метил-4-оксо-1,4-дигидрохинолин-3 карбоксамид. К 1 г (2,66 ммоль) 6-[(1-метокси-2-метилиндолизин-3-ил)карбонил]-4-оксо-l,4-дигидрохинолин-3 карбоновой кислоты в 23 мл безводного ДМФ добавляли 0,36 г (5,31 ммоль) гидрохлорида метиламина,1,3 г (3,99 ммоль) TOTU и 1,37 г (10,63 ммоль) DIEA. Реакционную смесь перемешивали при температуре окружающей среды в атмосфере азота в течение 8 ч. К реакционной среде добавляли 0,36 г(5,33 ммоль) гидрохлорида метиламина. Через 18 ч при температуре окружающей среды реакционную смесь гидролизовали 1 н. раствором HCl и затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 0,06 г твердого вещества желтого цвета.(2-Метилиндолизин-3-ил)(4-нитрофенил)метанон. К 3,56 г (27,14 ммоль) 2-метилиндолизина в 15 мл дихлорэтана добавляли 4,54 мл (32,52 ммоль) триэтиламина, при температуре окружающей среды в инертной атмосфере, а затем по каплям 5,53 г(29,85 ммоль) хлорида 4-нитробензойной кислоты. Реакционную среду перемешивали в течение 18 ч при температуре окружающей среды, гидролизовали насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали дихлорметаном. Органическую фазу промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток промывали диэтиловым эфиром. Получали 5,69 г твердого вещества желтого цвета. МН+: 281. Температура плавления: 149C.(4-Аминофенил)(2-метилиндолизин-3-ил)метанон. К 6,74 г (24,05 ммоль) (2-метилиндолизин-3-ил) (4-нитрофенил)метанона в 120 мл 2/1 смеси воды и этанола добавляли 5,66 г (86,57 ммоль) цинка и 20,63 мл (360,71 ммоль) ледяной уксусной кислоты. Реакционную среду нагревали при 80C в течение 4 ч. Добавляли 0,57 г (8,7 ммоль) цинка и 2,06 мл ледяной уксусной кислоты. Кипячение с обратным холодильником выполняли в течение 1 ч. Реакционную смесь отфильтровывали при температуре окружающей среды. Полученный остаток промывали этилацетатом и метил-ТГФ. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия и затем насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 4,9 г твердого вещества желтого цвета. МН+: 251. Температура плавления: 186C. Этил 6-[(2-метилиндолизин-3-ил)карбонил]-4-оксо-1,4-дипадрохинолин-3-карбоксилат. К 1,83 г (6,8 ммоль) (4-аминофенил)(2-метилиндолизин-3-ил)метанона в 23 мл толуола добавляли 1,69 мл диэтилэтоксиметиленмалоната в инертной атмосфере при температуре окружающей среды. Реакционную среду нагревали при 110C в течение 1 ч 45 и затем концентрировали при пониженном давлении. Полученный остаток растворяли в 45 мл дифенилового эфира и затем нагревали при 230C в течение 30 мин. После добавления диизопропилового эфира при температуре окружающей среды, осадок отфильтровывали, промывали диизопропиловым эфиром, метанолом, а затем дихлорметаном и сушили при пониженном давлении при 50C в течение ночи. Получали 1,2 г порошка желтого цвета. МН+: 375. Температура плавления: 287C. Этил 6-[(2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4-дигтадрохинолин-3-карбоксилат. К 3,73 г (9,27 ммоль) этил 6-[(2-метилиндолизин-3-ил) карбонил]-4-оксо-1,4-дигидрохинолин-3 карбоксилата в 100 мл ДМФ добавляли 1,53 г (11,12 ммоль) карбоната калия и 0,69 мл (11,12 ммоль) метилйодида при температуре окружающей среды в инертной атмосфере. Реакционную среду нагревали при 90C в течение 2 ч. Добавляли 0,384 г (2,78 ммоль) карбоната калия и 0,173 мл (2,78 ммоль) метилйодида, а затем нагревание продолжали в течение 40 мин. Реакционную среду гидролизовали водой и затем экстрагировали этилацетатом и дихлорметаном. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 3,15 г твердого вещества желтого цвета. Температура плавления: 232C. МН+: 389. 6-[(2-Метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота. К 0,5 г (1,29 ммоль) этил 6-[(2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4 дигидрохинолин-3-карбокилата в 9 мл смеси трет-бутанола и воды (1/1) добавляли 0,27 мл (3,22 ммоль) 1 н. водного раствора гидроксида натрия при температуре окружающей среды. Реакционную среду нагревали с обратным холодильником в течение 1 ч, подкисляли 1 н. водным раствором соляной кислоты при температуре окружающей среды, а затем экстрагировали дихлорметаном. Органическую фазу промывали водой, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток промывали эфиром и сушили при пониженном давлении при 50C. Получали 448 мг твердого вещества желтого цвета.N-1-Диметил-6-[(2-метилиндолизин-3-ил)карбонил]-4-оксо-1,4-дигидрохинолин-3-карбоксамид. К 0,44 г (1,22 ммоль) 6-[(2-метилиндолизин-3-ил)карбонил]-1-метил-4-оксо-1,4-дигидрохинолин-3 карбоновой кислоты в 7 мл безводного ДМФ добавляли 0,16 г (2,44 ммоль) гидрохлорида метиламина,0,6 г (1,59 ммоль) HBTU и 0,74 мл (4,27 ммоль) DIEA. Реакционную среду перемешивали при температуре окружающей среды в атмосфере азота в течение 5 ч 30 мин. В реакционную среду добавляли 0,16 г(2,44 ммоль) гидрохлорида метиламина, 602 мг (1,29 ммоль) HBTU и 0,74 мл (4,27 ммоль) DIEA. Через 48 ч при температуре окружающей среды реакционную смесь гидролизовали насыщенным раствором гидрокарбоната натрия и затем экстрагировали дихлорметаном. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле,элюируя смесью дихлорметан/метанол (90/10). Получали 0,273 г твердого вещества желтого цвета. Температура плавления: 328C. МН+: 374. 1N-1-диметил-6-[(2-метилиндолизин-3-ил)карбонил]-4-оксо-l,4 дигидрохинолин-3-карбоксамида в 6 мл дихлорметана добавляли 0,108 мг (0,6 ммоль)N-бромсукцинимида при температуре окружающей среды в атмосфере азота. После перемешивания в течение 3 ч при температуре окружающей среды реакционную среду гидролизовали насыщенным раствором гидрокарбоната натрия и затем экстрагировали дихлорметаном. Органическую фазу промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 0,217 г твердого вещества желтого цвета. МН+: 453.N-1-Диметил-6-[2-метил-1-(пиридин-4-ил)индолизинил-3-ил]карбонил-4-оксо-1,4 дигидрохинолин-3-карбоксамид. К 0,108 г (0,24 ммоль) 6-[(1-бром-2-метилиндолизин-3-ил)карбонил]-N-1-диметил-4-оксо-1,4 дигидрохинолин-3-карбоксамида в 2,5 мл ДМФ добавляли 0,061 г (0,29 ммоль) 4-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)пиридина, 0,178 г (0,72 ммоль) дигидрофосфата калия и 0,0055 г (0,004 ммоль) тетракис-(трифенилфосфин)палладия в атмосфере аргона при температуре окружающей среды. Реакционную среду нагревали в микроволновой печи в течение 15 мин при 150C. Реакционную среду фильтровали через тальк. Полученный остаток промывали дихлорметаном и метанолом. Органическую фазу концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью дихлорметан/метанол (90/10). Получали 53 мг твердого вещества желтого цвета. Это твердое вещество обрабатывали 2 мл метанола. Добавляли 0,16 мл(0,16 ммоль) 1 н. раствора HCl при температуре окружающей среды в атмосфере азота. После перемешивания в течение 5 мин добавляли эфир. Полученный осадок отфильтровывали, промывали эфиром и сушили при пониженном давлении при 50C в течение ночи. Получали 55 мг твердого вещества желтого цвета. Температура плавления: 228C. МН+: 451. 1(дд, J=8,8, 2,0 Гц, 1 Н), 8,65 (д, J=2,0 Гц, 1 Н), 8,83 (д, J=6,5 Гц, 2 Н), 8,94 (с, 1 Н), 9,46 (д, J=7,0 Гц, 1 Н),9,65-9,74 (м, 1 Н). В таблице, которая приведена ниже, представлены химические структуры и физические свойства некоторых соединений в соответствии с изобретением. В этой таблице:Me и Et представляют соответственно метиловую и этиловую группы; волнистая линия обозначает связь, присоединенную к остальной части молекулы; Мр представляет точку плавления соединения, выраженную в градусах Цельсия; М+Н+ представляет собой массу соединения, полученную с помощью LC-MS (жидкостная хроматография - масс-спектроскопия).
МПК / Метки
МПК: A61K 31/437, C07D 471/04, A61P 35/00
Метки: получения, применение, производные, индолизина, терапевтическое, способ
Код ссылки
<a href="https://eas.patents.su/30-24160-proizvodnye-indolizina-sposob-ih-polucheniya-i-ih-terapevticheskoe-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индолизина, способ их получения и их терапевтическое применение</a>
Предыдущий патент: Стеклянная подложка с интерференционной окраской для облицовочной панели
Следующий патент: Фармацевтические композиции, содержащие замещенные ациланилиды
Случайный патент: Ларингеальная маска












