Производные индолизина, способ их получения и терапевтические композиции на их основе
Номер патента: 14158
Опубликовано: 29.10.2010
Авторы: Роккон Ален, Маршионни Давид, Тоннер Бернар, Готье Патрик, Ваньон Жан
Формула / Реферат
1. Производные индолизина общей формулы (I)
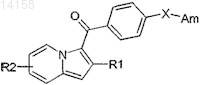
в которой X обозначает радикал -(СН2)n-, где n обозначает целое число от 1 до 6, или группу формулы -CH2-Z-(СН2)2-, в которой Z обозначает группу О(СН2)m-, где m обозначает целое число от 0 до 3, R1 обозначает C1-C8 алкил, линейный, разветвленный или циклический;
Am обозначает группу NR3R4, в которой R3 и R4, одинаковые или разные, обозначают независимо друг от друга атом водорода, C1-C6алкил, линейный, разветвленный или циклический, или C1-C3 алкил, замещенный С3-С6циклоалкилом,
или радикал (СН2)l-O-В, в котором В обозначает атом водорода или алкил (СН2)k, где l и k обозначают целые числа l³2 и 1+k£6,
или R3и R4 образуют вместе с атомом азота, с которым они соединены, 4-6-членный гетероцикл, необязательно содержащий один или несколько гетероатомов, выбираемых из N, О, и необязательно несущий один или несколько заместителей, выбираемых из C1-C6 алкила, линейного, разветвленного или циклического,
R2 обозначает атом водорода, С1-С6алкил, линейный, разветвленный или циклический,
и их фармацевтически приемлемые соли.
2. Производные индолизина по п.1, отличающиеся тем, что X обозначает радикал -(СН2)n-, где n является целым числом от 1 до 6.
3. Производные индолизина по п.1, отличающиеся тем, что X обозначает радикал -(СН2)n-, где n является целым числом от 3 до 4.
4. Производные индолизина по п.1, отличающиеся тем, что X обозначает группу формулы -CH2-Z-(CH2)2-, в которой Z обозначает группу О(СН2)m-, где m обозначает целое число от 0 до 3.
5. Производные индолизина по пп.1, 2, 3 или 4, отличающиеся тем, что R1 обозначает С1-С4алкил.
6. Производные индолизина по любому из пп.1-5, отличающиеся тем, что R3 и R4 обозначают независимо друг от друга линейный C1-C4 алкил.
7. Производные индолизина по любому из пп.1-6, отличающиеся тем, что R3 и R4 образуют вместе пиперидинил или пиперазинил, необязательно несущий один или несколько метильных радикалов.
8. Производные индолизина по любому из пп.1-7, отличающиеся тем, что R2 обозначает атом водорода.
9. Производные индолизина по любому из пп.1-8, отличающиеся тем, что фармацевтически приемлемую соль выбирают из оксалата и гидрохлорида.
10. Производные индолизина формулы (I), которые имеют следующие наименования:
гидрохлорид (2-бутилиндолизин-3-ил){4-[3-(диэтиламино)пропил]фенил}метанона;
оксалат (2-этилиндолизин-3-ил){4-[3-(диэтиламино)пропил]фенил}метанона;
гидрохлорид {4-[3-(диэтиламино)пропил]фенил}(2-пропилиндолизин-3-ил)метанона;
оксалат (2-бутилиндолизин-3-ил){4-[4-(диэтиламино)бутил]фенил}метанона;
оксалат {4-[4-(диэтиламино)бутил]фенил}(2-этилиндолизин-3-ил)метанона;
гидрохлорид {4-[4-(диэтиламино)бутил]фенил}(2-пропилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил){4-[3-(дипропиламино)пропил]фенил}метанона;
гидрохлорид полугидрата (2-бутилиндолизин-3-ил){4-[3-(дипропиламино)пропил]фенил}метанона;
сульфат (2-бутилиндолизин-3-ил){4-[3-(дипропиламино)пропил]фенил}метанона;
фумарат (2-бутилиндолизин-3-ил){4-[3-(дипропиламино)пропил]фенил}метанона;
гидрохлорид {4-[3-(дипропиламино)пропил]фенил}(2-этилиндолизин-3-ил)метанона;
гидрохлорид {4-[3-(дипропиламино)пропил]фенил}(2-пропилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил){4-[4-(дипропиламино)бутил]фенил}метанона;
гидрохлорид {4-[4-(дипропиламино)бутил]фенил}(2-этилиндолизин-3-ил)метанона;
гидрохлорид {4-[3-(дипропиламино)пропил]фенил}(2-изопропилиндолизин-3-ил)метанона;
гидрохлорид {4-[3-(дипропиламино)пропил]фенил}(2-метилиндолизин-3-ил)метанона;
оксалат {4-[4-(дипропиламино)бутил]фенил}(2-изопропилиндолизин-3-ил)метанона;
гидрохлорид {4-[4-(дипропиламино)бутил]фенил}(2-метилиндолизин-3-ил)метанона;
гидрохлорид {4-[4-(дипропиламино)пропил]фенил}(2-пропилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил){4-[3-(дибутиламино)пропил]фенил}метанона;
гидрохлорид {4-[3-(дибутиламино)пропил]фенил}(2-этилиндолизин-3-ил)метанона;
гидрохлорид {4-[3-(дибутиламино)пропил]фенил}(2-пропилиндолизин-3-ил)метанона;
оксалат (2-бутилиндолизин-3-ил){4-[4-(дибутиламино)бутил]фенил}метанона;
оксалат {4-[4-(дибутиламино)бутил]фенил}(2-этилиндолизин-3-ил)метанона;
оксалат {4-[4-(дибутиламино)бутил]фенил}(2-пропилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил)(4-{3-[этил(пропил)амино]пропил}фенил)метанона;
оксалат (2-этилиндолизин-3-ил)(4-{3-[этил(пропил)амино]пропил}фенил)метанона;
гидрохлорид (4-{3-[этил(пропил)амино]пропил}фенил) (2-изопропилиндолизин-3-ил)метанона;
гидрохлорид (4-{3-[этил(пропил)амино]пропил}фенил)(2-метилиндолизин-3-ил)метанона;
оксалат (4-{4-[этил(пропил)амино]бутил}фенил)(2-изопропилиндолизин-3-ил)метанона;
гидрохлорид (4-{4-[этил(пропил)амино]бутил}фенил)(2-метилиндолизин-3-ил)метанона;
гидрохлорид (4-{3-[этил(пропил)амино]пропил}фенил)(2-пропилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил) (4-{4-[этил(пропил)амино]бутил}фенил)метанона;
оксалат (2-этилиндолизин-3-ил)(4-{4-[этил(пропил)амино]бутил}фенил)метанона;
гидрохлорид (4-{4-[этил(пропил)амино]бутил}фенил)(2-пропилиндолизин-3-ил)метанона;
оксалат (2-бутилиндолизин-3-ил)(4-{3-[бутил(пропил)амино]пропил}фенил)метанона;
оксалат (4-{3-[бутил(этил)амино]пропил}фенил)(2-бутилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил)(4-{3-[(циклопропилметил)(пропил)амино]пропил}фенил) метанона;
гидрохлорид {4-[4-(пропиламино)бутил]фенил}(2-пропилиндолизин-3-ил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил){4-[3-(пропиламино)пропил]фенил}метанона;
гидрохлорид (2-бутилиндолизин-3-ил){4-[3-(диметиламино)пропил]фенил}метанона;
гидрохлорид (2-бутилиндолизин-3-ил)(4-{3-[(3R,5S)-3,5-диметилпиперазин-1-ил]пропил}фенил)метанона;
гидрохлорид (2-бутилиндолизин-3-ил)(4-{3-[{3R,5S)-3,4,5-триметилпиперазин-1-ил]пропил}фенил) метанона;
оксалат (4-{3-[бис(2-метоксиэтил)амино]пропил}фенил)(2-бутилиндолизин-3-ил)метанона;
оксалат (2-бутилиндолизин-3-ил)[4-(3-пиперидин-1-илпропил)фенил]метанона;
гидрохлорид (2-бутил-6-метилиндолизин-3-ил){4-[3-(дипропиламино)пропил]фенил}метанона;
гидрохлорид (2-бутил-6-этилиндолизин-3-ил){4-[3-(дипропиламино)пропил]фенил}метанона;
гидрохлорид (2-бутил-6-метилиндолизин-3-ил)(4-{3-[этил(пропил)амино]пропил}фенил)метанона;
гидрохлорид (2-бутил-6-этилиндолизин-3-ил)(4-{3-[этил(пропил)амино]пропил}фенил)метанона.
11. Способ получения производных формулы (I) по любому из пп.1-10, включающий взаимодействие амина H-Am с соединением формулы (II)
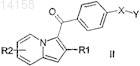
в которой Y обозначает атом галогена, а другие заместители имеют значения, указанные в предыдущих пунктах.
12. Способ, включающий способ получения соединения формулы (II) по п.11 и включающий взаимодействие соединения формулы (III)
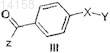
с соединением формулы (IV)

13. Производные индолизина общей формулы (I) по любому из пп.1-10 для применения в качестве лекарственного средства.
14. Лекарственные средства, включающие производные индолизина общей формулы (I), определенной в любом из пп.1-10.
15. Фармацевтическая или ветеринарная композиция, отличающаяся тем, что она содержит в качестве действующего начала по меньшей мере одно производное индолизина формулы (I) по любому из пп.1-10 или фармацевтически приемлемую соль этого производного в сочетании с соответствующим фармацевтическим носителем или эксципиентом.
16. Применение производного индолизина общей формулы (I) по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения патологических синдромов сердечно-сосудистой системы, в частности для лечения стенокардии, гипертензии, вентрикулярной или суправентрикулярной аритмии, лечения сердечной недостаточности, инфаркта миокарда, осложненного или не осложненного сердечной недостаточностью, или для предотвращения постинфарктной смертности.
17. Применение производного индолизина по п.16 для получения лекарственного средства, предназначенного для лечения стенокардии, гипертензии, вентрикулярной или суправентрикулярной аритмии, лечения сердечной недостаточности, инфаркта миокарда, осложненного или не осложненного сердечной недостаточностью, или для предотвращения постинфарктной смертности.
Текст
ПРОИЗВОДНЫЕ ИНДОЛИЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ТЕРАПЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ Настоящее изобретение относится к производным индолизина формулы (I), в которой X обозначает радикал -(СН 2)n-, где n обозначает целое число от 1 до 6, или группу формулы -CH2Z-(СН 2)2-, в которой Z обозначает группу О(СН 2)m-, где m обозначает целое число от 0 до 3, R1 обозначает C1-C6 алкил, линейный, разветвленный или циклический; Am обозначает группуNR3R4, в которой R3 и R4, одинаковые или разные, обозначают независимо друг от друга атом водорода, C1-C6 алкил, линейный, разветвленный или циклический, или C1-C3 алкил,замещенный радикалом циклоалкил C3-C6, или радикал (СН 2)l-О-В, в котором В обозначает атом водорода или алкил (СН 2)k, где l и k обозначают целые числа l2 и l+k6, или R3 и R4 образуют вместе с атомом азота, с которым они соединены, 4-6-членный гетероцикл, необязательно содержащий один или несколько гетероатомов, выбираемых из N, О, и необязательно несущий один или несколько заместителей, выбираемых из C1-C6 алкила, линейного, разветвленного или циклического, R2 обозначает атом водорода, C1-C6 алкил, линейный, разветвленный или циклический, и к их фармацевтически приемлемым солям. 014158 Настоящее изобретение относится к новым производным индолизина, к способу их получения и к фармацевтическим композициям на их основе. В документах FR 2341578 и ЕР 471609 описаны производные индолизина, которые обладают интересными фармакологическими свойствами, в частности антиаритмическими свойствами, поскольку эти производные показали себя способными устранять или предотвращать нарушения желудочкового и предсердного ритма. Большинство описанных соединений имеют электрофизиологические свойства,соответствующие классам 1, 2, 3 и 4 согласно классификации Vaughan-Williams, которые, помимо антиаритмических свойств, сообщают брадикардические свойства, антигипертензивные и неконкурентные или -антиадренергические свойства. Эти свойства делают рассматриваемые соединения очень полезными для лечения некоторых патологических синдромов сердечно-сосудистой системы, в частности для лечения стенокардии, гипертензии, вентрикулярной или суправентрикулярной аритмии. Кроме того, эти соединения полезны для лечения сердечной недостаточности, инфаркта миокарда, осложненного или не осложненного сердечной недостаточностью, или для предотвращения постинфарктной смертности. Тем не менее, у этих соединений имеется недостаток, заключающийся в том, они нерастворимы или очень мало растворимы в воде, в частности при рН 4, особенно при физиологическом рН. Амиодарон, который является активным антиаритмическим средством для лечения предсердной или вентрикулярной аритмии, вводимым пероральным и внутривенным путем, является водонерастворимой молекулой; по этой причине раствор, предназначенный для инъекций, содержит растворители,такие как полисорбат 80 или бензиловый спирт. Эти растворители создают у пациента отрицательный гипотензивный и инотропный негативный эффект. Инъецируемый раствор приводит также к местной венозной интолерантности, которую устраняют путем системной инъекции в специальной благоприятной среде. Дронедарон, являющийся производным бензофурана, не содержащим иода в своей химической структуре в отличие от амиодарона, также проявляет антиаритмическую активность в отношении предсердной и вентрикулярной аритмии при введении пероральным или внутривенным путем. Низкий уровень растворимости этого соединения (растворимость в воде S=0,247 мг/мл при рН=3) значительно ограничивает возможность получения и хранения его в виде инъецируемого продукта. Этот низкий уровень растворимости значительно ограничивает возможность получения и хранения этих соединений в виде инъецируемого продукта. В настоящее время в соответствии с изобретением были открыты новые производные индолизина,которые имеют хорошую растворимость в воде и, одновременно, сохраняют и даже улучшают свои фармакологические свойства, в частности свои антиаритмические свойства. Их хорошая растворимость в воде, в частности при рН 4, позволяет создать фармацевтические, пригодные для инъекций, формы. Соединения согласно изобретению представляют собой молекулы, растворимые в воде, которые можно вводить внутривенным путем в физиологическом растворе (0,9% раствор хлорида натрия) или в растворе глюкозы и, кроме того, обладают электрофизиологическими, гемодинамическими и антиаритмическими свойствами амиодарона. Помимо этого, указанные новые соединения обладают хорошей метаболической стабильностью. Таким образом, настоящее изобретение относится в новым производным индолизина общей формулы (I) в которой X обозначает радикал -(СН 2)n-, где n обозначает целое число от 1 до 6, или группу формулы -CH2-Z-(CH2)2-, в которой Z обозначает группу О(СН 2)m-, где m обозначает целое число от 0 до 3,R1 обозначает C1-C8 алкил, линейный, разветвленный или циклический;Am обозначает группу NR3R4, в которой R3 и R4, одинаковые или разные, обозначают независимо друг от друга атом водорода, C1-C6 алкил, линейный, разветвленный или циклический, или C1-C3 алкил,замещенный C3-C6 циклоалкилом,или радикал (СН 2)I-O-В, в котором В обозначает атом водорода или алкил (СН 2)k, где I и k обозначают целые числа I2 и 1+k6,или R3 и R4 образуют вместе с атомом азота, с которым они соединены, 4-6-членный гетероцикл,необязательно содержащий один или несколько гетероатомов, выбираемых из N, О, и необязательно несущий один или несколько заместителей, выбираемых из C1-C6 алкил, линейного, разветвленного или циклического,R2 обозначает атом водорода, C1-C6 алкил, линейный, разветвленный или циклический,и к их фармацевтически приемлемым солям. В соответствии с первым вариантом изобретение относится к производным индолизина, которые определены выше, в которых X обозначает радикал -(СН 2)n-, где n является целым числом от 1 до 6.-1 014158 В соответствии со вторым вариантом изобретение относится к производным индолизина, которые определены выше, в которых X обозначает группу формулы -CH2-Z-(CH2)2-, в которой Z обозначает группу О(СН 2)m-, где m обозначает целое число от 0 до 3. Более конкретно, изобретение относится к производным индолизина, которые определены выше,отличающимся тем, что X обозначает радикал -(СН 2)n-, где n обозначает целое число от 3 до 4. Более конкретно, производные индолизина согласно изобретению отличаются тем, что R1 обозначает C1-C4 алкил. Более конкретно, производные индолизина согласно изобретению отличаются тем, что R3 и R4 обозначают независимо друг от друга линейный C1-C4 алкил. В частности, производные индолизина согласно изобретению отличаются тем, что R3 и R4 образуют вместе группу пиперидинил или пиперазинил, необязательно несущую один или несколько метильных радикалов. В частности, производные индолизина согласно изобретению отличаются тем, что R2 обозначает атом водорода. Соединения формулы (I) могут существовать в виде оснований или в виде солей, которые можно получить с помощью кислот или оснований, в частности фармацевтически приемлемых кислот или оснований. Такие аддитивные соли составляют часть изобретения. Эти соли получают преимущественно с фармацевтически приемлемыми кислотами, однако соли с другими кислотами, пригодными, например, для очистки или выделения соединений формулы (I), также составляют часть изобретения. Соединения формулы (I) могут существовать также в виде гидратов или сольватов, а именно, в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения. Изобретение относится также к фармацевтически приемлемым солям соединений формулы (I), образованным с органической или неорганической кислотой. В качестве примеров органических солей указанного типа можно назвать малонаты, додеканоаты,оксалаты, малеаты, фумараты, метансульфонаты, бензоаты, аскорбаты, пальмоаты, сукцинаты, гексаматы, бисметиленсалицилаты, этандисульфонаты, ацетаты, пропионаты, тартраты, салицилаты, цитраты,глюконаты, лактаты, малаты, циннаматы, манделаты, цитраконаты, аспартаты, пальмитаты, стеараты,итаконаты, гликолаты, п-аминобензоаты, глютаматы, бензолсульфонаты, п-толуолсульфонаты и теофиллинацетаты, а также соли, образованные с аминокислотами, такие как соль лизина или гистидина. В качестве неорганических солей этого типа можно назвать гидрохлориды, гидробромиды, сульфаты, сульфаматы, фосфаты и нитраты. Более конкретно, изобретение относится к производным индолизина, которые определены выше,отличающимся тем, что фармацевтически приемлемую соль выбирают из оксалата и гидрохлорида. Изобретение относится также к получению соединений формулы (I). Таким образом, настоящее изобретение относится к способу получения производных формулы (I),которые определены выше, включающему взаимодействие амина H-Am с соединением, представленным формулой (II) в которой Y обозначает атом галогена, а другие заместители имеют указанные выше значения. Изобретение относится также к способу, включающему способ получения соединения формулы Таким образом, согласно изобретению соединения формулы (I), в которой X обозначает радикал-(СН 2)n-, описанный выше, получают согласно следующей схеме синтеза: где Y обозначает галоген, например Cl или Br, а n, группы R1, R2 и Am имеют такие же значения,которые указаны выше. Информацию о получении соединений формулы (III) можно получить в US 6949583. Информацию о получении соединений формулы (IV) можно получить в публикации EUR J. MED. СНЕМ-CHEMICAL THERAPEUTICA, NOV.-DEC. 1975-10,6, стр. 579-584 и в патенте LABAZ US 4103012. Также можно сослаться на US4103012 в отношении получения производных индолизина формулы(I), заключающегося в конденсации вторичного амина формулы H-Am с хлорпроизводным формулы (II),и получения соединений формулы (II), заключающегося во взаимодействии соединений формулы (III) с производными формулы (IV). В отношении соединений формулы (I) согласно изобретению, в которых X обозначает группу формулы CH2-Z-(СН 2)2-, в которой Z обозначает группу О(СН 2)m-, которая определена выше, можно сослаться на US6949583 и на Monatsh. Chem.; 129; 3; 1998; 309-318, а также на следующую схему получения: где группы Rl7 R2 и Am имеют такие же значения, которые указаны выше. Изобретение относится также к фармацевтической или ветеринарной композиции, отличающейся тем, что она содержит в качестве действующего начала по меньшей мере одно производное индолизина формулы (I), которое определено выше, или фармацевтически приемлемую соль этого производного в сочетании с подходящим фармацевтическим носителем или эксципиентом. Например, фармацевтические композиции согласно изобретению могут быть составлены для перорального, сублингвального, подкожного, внутримышечного, внутривенного, чрескожного или ректального введения. Предпочтительно, композиции представляют собой форму, пригодную для инъекций,поскольку производные согласно изобретению отличаются хорошей растворимостью. Что касается лекарственной формы, то она может иметь форму, например, таблетки, драже, капсулы, желатиновой капсулы, порошка, суспензии, сиропа или же гранул для перорального введения, или суппозитория для ректального введения или раствора или суспензии для парентерального введения. Фармацевтические композиции согласно изобретению могут содержать на одну лекарственную форму, например, 50-500 мг по массе активного компонента для перорального введения, 50-200 мг активного компонента для ректального введения и 50-150 мг активного компонента для парентерального введения. В зависимости от выбранного пути введения фармацевтические или ветеринарные композиции получают путем комбинации по меньшей мере одного соединения формулы (I) или фармацевтически приемлемой соли этого соединения с соответствующим эксципиентом, причем этот эксципиент может представлять собой по меньшей мере один компонент, выбранный, например, из следующих веществ: лактоза, крахмал, тальк, стеарат магния, поливинилпирролидон, альгиновая кислота, коллоидный диоксид кремния, дистиллированная вода, бензиловый спирт или подсластители.-3 014158 Если лекарственная форма представляет собой таблетки, то они могут быть обработаны таким образом, чтобы достичь пролонгированного или замедленного действия и чтобы постоянно высвобождалось заданное количество активного начала. Изобретение относится также к производным индолизина общей формулы (I), определенным выше,пригодным для их применения в качестве лекарственного средства. Таким образом, настоящее изобретение относится к лекарственным средствам, содержащим производные индолизина общей формулы (I),определенные выше. Производные индолизина общей формулы (I) согласно изобретению, определенные выше, могут быть использованы для получения лекарственного средства, предназначенного для лечения патологических синдромов сердечно-сосудистой системы. Более конкретно, производные индолизина общей формулы (I) согласно изобретению, определенные выше, могут быть использованы для получения лекарственного средства, предназначенного для лечения стенокардии, гипертензии, вентрикулярной аритмии,суправентрикулярной аритмии, в частности фибрилляции предсердий, сердечной недостаточности, инфаркта миокарда, осложненного или не осложненного сердечной недостаточностью, или для предотвращения постинфарктной смертности. Результаты фармакологических тестов, осуществленных для того, чтобы определить влияние соединений согласно изобретению на сердечно-сосудистую систему, описаны ниже.I. Вентрикулярные аритмии Целью этого теста является определение способности соединений согласно изобретению обеспечить защиту от аритмии, вызванной реперфузией в коронарную артерию, которая была предварительно ишемизирована. С этой целью использовалась методика, описанная MANNING A.S. и сотр. в Circ. Res. 1984, 55: 545-546, измененная как указано ниже: Сначала анестезировали крыс, распределенных по группам, с помощью пентабарбитала натрия (60 мг/кг интраперитонально), затем крыс интубировали для поддержания у них вспомогательного дыхания. Затем устанавливали в яремной вене крыс трубку для внутривенного введения, вводили в сонную артерию катетер для измерения артериального давления, а также устанавливали на коже электроды для измерения ECG (ЭКГ). После уравновешивания параметров вводили внутривенную дозу исследуемого соединения и спустя 5 мин после завершения трахеотомии формировали лигатурную петлю вокруг нисходящей задней левой коронарной артерии, у самого ее начала. Затем создавали окклюзию этой артерии в течение 5 мин путем затягивания концов лигатуры. Реперфузию осуществляли путем ослабления натяжения. Затем измеряли величину аритмии, возникшую вследствие реперфузии. Аналогичный тест был осуществлен после перорального введения соединения. В этом случае, исследуемое соединение вводили за 60-120 мин перед лигатурой нисходящей задней левой коронарной артерии. Результаты этих тестов показали, что соединения согласно изобретению, вводимые в дозах от 0,3 до 10 мг/кг внутривенно и от 30 до 100 мг/кг перорально, значительно защищают, иногда полностью, от вентрикулярной аритмии у обработанных животных.II. Антиадренергические свойства Целью этого теста является определение способности соединений согласно изобретению уменьшить увеличение кровяного давления, индуцированного фенилэприном (эффект анти-), и увеличение сердечной частоты, индуцированной изопреналином (эффект анти-) у собак, предварительно анестезированных пентобарбиталом и хлоразолом. Сначала определяют для каждой собаки дозу фенилэприна (5 мкг/кг), которая вызывает увеличение артериального давления на 25-40 мм Hg, и дозу изопреналина (0,5 или 1 мкг/кг), которая должна привести к увеличению сердечной частоты на 40-110 ударов в минуту. Вливают поочередно каждые 10 мин установленные дозы фенилэприна и изопреналина и после получения двух последовательных контрольных ответов вводят дозу исследуемого соединения внутривенным путем. Эффект антиРегистрируют степень снижения в процентах под действием соединения согласно изобретению индуцированной гипертензии по сравнению с контрольной гипертензией, измеренной перед введением этого соединения. Эффект антиРегистрируют степень снижения в процентах под действием исследуемого соединения индуцированного увеличения сердечной частоты. Результаты этих тестов показали, что при дозах 3-10 мг/кг соединения согласно изобретению обладают эффектами анти- и/или анти-, выраженными в снижениях индуцированной гипертензии и/или индуцированного увеличения сердечной частоты, доходящих до 50%.III. Аурикулярные аритмии Целью этого теста является определение эффективности соединений согласно изобретению в отно-4 014158 шении аурикулярной аритмии (восприимчивость левого предсердия), индуцированной экстрастимулированием у свиней, анастезированных по методу, описанному в Naunyn-Schmiedeberg's Arch Pharmacol 2001; 363:166-174. Исследуемые соединения вводили в дозе 3 мг/кг методом медленной внутривенной перфузии в течение 5 мин. Гемодинамические и электрокардиографические параметры, а также рефрактерные периоды левого и правого предсердия определяли до и после введения исследуемого соединения. При дозе 3 мг/кг соединения согласно изобретению устраняли обычно на 100% непостоянные эпизоды фибрилляции или фибрилляцию предсердий, индуцированные предшествующим экстрастимулированием. При этой дозе наблюдалось значительное увеличение рефрактерных периодов предсердий при различных исходных значениях периодов работы сердца.IV. Действие на ионные каналы сердца Целью этого теста является определение воздействия соединений согласно изобретению на ионные каналы сердца. Соединения согласно изобретению (1-5 мкМ) ингибируют проницаемость каналов человеческих генов hERG (lKr) и hKv1,5 (lKur), экспрессируемых в линиях клеток СНО (Chinese hamster ovary). Они ингибируют также нативные потоки натриевых (lNa), кальциевых (ICaL) и калиевых (IK(Ach каналов и АТР-зависимые (IKATP) кардиомиоциты свиньи и калиевые каналы (Ito и Isus) кардиомиоцитов крысы. Следовательно, соединения согласно изобретению являются ингибиторами многих ионных сердечных каналов.V. Токсичность Токсичность соединений согласно изобретению является совместимой с их применением в терапии.VI. Растворимость Тесты на растворимость соединений согласно изобретению осуществляли при рН 4 (на основе фосфатного буфера рН=6; 0,1 М) с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) с использованием градиента H2O/CH3CN/CH3SO3H по отношению к контрольному образцу (разведенный раствор исследуемого продукта, являющегося внутренним эталоном). Результаты растворимости S и уровень рН представлены в следующей таблице и выражены в мг/мл. Обычно соединения формулы (I) согласно изобретению имеют растворимость выше или равную 1 мг/мл при рН 4, некоторые их них могут иметь растворимость выше 8 мг/мл и даже выше 10 мг/мл. ТАБЛИЦА ПРИМЕРОВ Следующие неограничивающие примеры иллюстрируют получение соединений и композиций согласно изобретению: Спектры магнитного резонанса протона (ЯМР 1 Н), приведенные ниже, регистрировали при 200 МГц в ДМСО-d6 с использованием пика ДМСО-d6 в качестве эталона. Химические смещениявыражали в ч/млн. Наблюдаемые сигналы были выражены следующим образом: с - синглет; се - синглет уширенный; д - дублет; дд - развязанный дублет; т - триплет; тд - развязанный триплет; к - квадруплет; кви - квинтуплет; м - массив; мт - мультиплет; скт - секступлет. Пример 1. Гидрохлорид (2-бутил-6-этилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона (соединение 44). а) 1-Бромгексан-2-он. К раствору 58,6 г (0,976 мол) карбамида в 210 мл уксусной кислоты медленно добавляют при комнатной температуре 60 г (0,599 мол) 2-гексанона. Охлаждают среду до 0 С в ледяной бане, затем добавляют по каплям 33 мл брома (0,640 мол) и перемешивают 18 ч при комнатной температуре. Среду выливают в воду (1500 мл), экстрагируют метиленхлоридом, промывают органическую фазу раствором гидрокарбоната натрия, затем сушат над сульфатом натрия и раствор концентрируют. Остаток перегоняют при пониженном давлении. Выделяют 76 г целевого соединения (температура кипения: 80-90 С/18 мм Hg), включающего небольшое количество своего изомера: 3-бромгексанона(6%). б) N-(Гексан-2-он-1-ил)метил-2-этил-5-пиридинийбромид. Медленно прибавляют 21,6 г (0,178 мол) 5-этил-2-метилпиридина к 40 г бром-1-гексанона-2 (0,223 мол) и перемешивают 3 ч при комнатной температуре. Получают вязкую среду, которую используют без очистки на следующей стадии. в) 2-Бутил-6-этилиндолизин. К раствору продукта, описанного выше, в 300 мл этанола добавляют по каплям раствор 65 г триэтиламина в 370 мл этанола, затем кипятят с обратным холодильником 18 ч. Концентрируют в вакууме, обрабатывают этилацетатом, промывают водой, затем сушат органическую фазу над сульфатом натрия и концентрируют досуха. Очищают флэш-хроматографией на диоксиде кремния(элюент:гептан/метиленхлорид 50/50). Таким образом получают 15 г целевого соединения в виде желтого масла. Выход: 34%. г) (2-Бутил-6-этилиндолизин-3-ил) [4-(3-хлорпропил)фенил]метанон. Нагревают при 50 С в течение 18 ч смесь 5 г (27 ммол) соединения, полученного на предыдущей стадии, и 5,9 г (27 ммол) 4-(3-хлорпропил)бензоилхлорида. Обрабатывают водой, экстрагируют дихлорметаном, промывают органическую фазу раствором карбоната натрия, затем сушат над сульфатом натрия и концентрируют досуха. Очищают флэш-хроматографией на оксиде алюминия (элюент:гептан/метиленхлорид 50/50). Таким образом получают 8 г целевого соединения в виде масла. Выход: 76%. д) (2-Бутил-6-этилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанон. В реакторе растворяют 4 г (10,4 ммол) соединения, полученного на предыдущей стадии, в 50 мл ме-6 014158 тилизобутилкетона и прибавляют к полученной реакционной среде 2,7 г (27 ммол) дипропиламина,0,31 г (2 ммол) иодида натрия и нагревают при 110 С в течение 48 ч. Выливают в воду, экстрагируют дихлорметаном, промывают раствором гидрокарбоната натрия, сушат над сульфатом натрия и концентрируют досуха. Очищают флэш-хроматографией на оксиде алюминия (элюент: метиленхлорид/этилацетат 80/20). Так получают 3,9 г целевого соединения. Выход: 84%. е) Гидрохлорид (2-бутил-6-этилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона. К раствору продукта, описанного выше, (3,9 г) в эфире (400 мл) прибавляют 6,5 мл раствора хлористо-водородной кислоты в эфире (2 М в эфире), перемешивают 30 мин и фильтруют выпавшую в осадок соль. Так получают 3,7 г целевого продукта. Выход: 88%. Т.пл. без разложения=140,7 С. Спектр ЯМР 1 Н (200 МГц, ДМСО,в ч/млн): 0,65 (т:3 Н); 0,79-1,10 (м:8 Н); 1,11-1,44 (м:5 Н); 1,66(мт:4 Н); 2,03 (мт:2 Н); 2,17 (т:2 Н); 2,62 (к:2 Н); 2,74 (т:2 Н); 2,87-3,16 (м:6 Н); 6,45 (с:1 Н); 7,15 (д:1 Н); 7,297,65 (м:5 Н); 9,36 (с:1 Н); 10,49 (с ушир.:1 Н). Следуя способу, описанному в примере 1, но используя соответствующие исходные продукты, получают следующие соединения. Гидрохлорид (2-бутил-6-метилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона. Т.пл.без разложения=140 С. Спектр ЯМР 1H (200 МГц, ДМСО,в ч/млн): 0,65 (т:3 Н); 0,79-1,10 (м:8 Н); 1,32 (кви:2 Н); 1,66(мт:2 Н); 2,01 (мт:2 Н); 2,17 (т:2 Н); 2,62 (к:2 Н); 2,75 (т:2 Н); 2,85-3,23 (м:6 Н); 6,45 (с:1 Н); 7,15 (д:1 Н); 7,297,65 (м:5 Н); 9,36 (с:1 Н); 10,53 (с ушир.:1 Н). Пример 2. Оксалат (2-этилиндолизин-3-ил)-4-[3-(диэтиламино)пропил]фенилметанона (соединение 2). а) (2-Этилиндолизин-3-ил)[4-(3-хлорпропил)фенил]метанон. Нагревают при 50 С в течение 18 ч смесь 8 г (55 ммол) 2-этилиндолизина и 13,1 г (60 ммол) 4-(3 хлорпропил)бензоилхлорида. Обрабатывают водой, экстрагируют дихлорметаном, промывают раствором карбоната натрия, сушат органическую фазу над сульфатом натрия и концентрируют досуха. Очищают затем флэш-хроматографией на оксиде алюминия (элюент: циклогексан/метиленхлорид 50/50). Так получают 17 г целевого соединения в виде масла. Выход: 94%. б) (2-Этилиндолизин-3-ил) 4-[3-(диэтиламино)пропил]фенилметанон. В реакторе растворяют 4 г (12 ммол) соединения, полученного на предыдущей стадии, в 50 мл метилизобутилкетона и прибавляют к полученной реакционной среде 2,3 г (31 ммол) диэтиламина, 0,36 г(2,4 ммол) иодида натрия и нагревают при 110 С в течение 48 ч. Выливают в воду, экстрагируют дихлорметаном, промывают раствором гидрокарбоната натрия, сушат над сульфатом натрия и концентрируют досуха. Очищают флэш-хроматографией на оксиде алюминия (элюент: метанол/метиленхлорид 10/90). Так получают 2,9 г целевого соединения. Выход: 65%. в) Оксалат (2-этилиндолизин-3-ил)-4-[3-(диэтиламино)пропил]фенилметанона. Растворяют 2,9 г продукта, описанного выше, в 40 мл этилацетата и прибавляют 0,719 г (1 эквивалент) щавелевой кислоты. Фильтруют соль, которая кристаллизуется. Так получают 2,9 г целевого продукта. Выход: 80%. Т.пл.=160 С. Спектр ЯМР 1 Н (200 МГц, ДМСО,в ч/млн): 0,98 (т:3 Н); 1,15 (т:6 Н); 1,96 (м:2 Н); 2,20 (к:2 Н); 2,74(соединение 7). а) 2-Метил-1-(2-оксогексил)пиридинийбромид. Медленно прибавляют 30,21 г 2-пиколина (0,32 мол) к 83 г бром-1-гексанона-2 (0,46 мол) и перемешивают 4 ч при комнатной температуре. Образуется вязкая среда, которую используют без очистки на следующей стадии. б) 2-Бутилиндолизин. Растворяют N-(гексанон-2-ил)метилпиридинийбромид, полученный выше, в 100 мл этанола и до-7 014158 бавляют 84 г гидрокарбоната натрия, растворенного в 630 мл воды. Нагревают реакционную среду в течение 3 ч при 110 С. Концентрируют в вакууме, обрабатывают водой, экстрагируют дихлорметаном,промывают органическую фазу раствором хлорида натрия, сушат над сульфатом натрия и выпаривают досуха. Очищают полученный продукт на колонке из диоксида кремния под давлением (элюент:метиленхлорид/гептан 20/80). Так получают 33 г бутил-2-индолизина. Выход: 30%. в) (2-Бутилиндолизин-3-ил) [4-(3-хлорпропил)фенил]метанон. Нагревают при 50 С в течение 18 ч смесь 9 г (56 ммол) 2-бутилиндолизина и 12,4 г (57 ммол) 4-(3 хлорпропил)бензоилхлорида. Обрабатывают водой, экстрагируют дихлорметаном, промывают раствором карбоната натрия, сушат органическую фазу над сульфатом натрия и концентрируют досуха. Очищают затем флэш-хроматографией на диоксиде кремния (элюент:метиленхлорид/гептан 80/20). Так получают 14 г целевого соединения в виде масла. Выход: 77%. г) (2-Бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанон. В реакторе растворяют 6 г (17 ммол) соединения, полученного на предыдущей стадии, в 60 мл метилизобутилкетона и добавляют в полученную реакционную среду 4,4 г (44 ммол) дипропиламина, 0,5 г(3,4 ммол) иодида натрия и нагревают при 110 С в течение 48 ч. Выливают в воду, экстрагируют дихлорметаном, промывают раствором гидрокарбоната натрия, сушат над сульфатом натрия и концентрируют досуха. Очищают затем флэш-хроматографией на оксиде алюминия (элюент:метиленхлорид/метанол 98/2). Так получают 6,2 г целевого соединения. Выход: 88%. д) Гидрохлорид (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона. К раствору продукта, описанного выше, (6,2 г) в эфире (100 мл) прибавляют 11 мл раствора хлористоводородной кислоты в эфире (2 М в эфире) и перемешивают 30 мин. Концентрируют в вакууме, обрабатывают этилацетатом (60 мл) и фильтруют продукт, который кристаллизуется. Так получают 6,3 г целевого продукта. Выход: 95%. Т.пл.без разложения=115 С. Спектр ЯМР 1 Н (200 МГц, ДМСО,в ч/млн): 0,64 (т:3 Н); 0,78-1,12 (м:8 Н); 1,33 (кви:2 Н); 1,66(мт:4 Н); 2,02 (мт:2 Н); 2,20 (т:2 Н); 2,74 (т:2 Н); 2,85-3,15 (м:6 Н); 6,50 (с:1 Н); 6,92 (т:1 Н); 7,20 (т:1 Н); 7,307,57 (система АА' -ВВ' : 4 Н); 7,62 (д:1 Н); 9,45 (д:1 Н); 10,60 (сушир.:1 Н). Гидрохлорид полугидрата (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона. К раствору (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона (500 г) в этилацетате (796 мл) прибавляют 11 мл воды. К этому окрашенному раствору, охлажденному до 10 С, добавляют раствор хлористо-водородной кислоты в эфире (2 М в эфире). В среду вводят затравку, затем выдерживают 3 ч в изотермическом режиме. Полученный продукт фильтруют, промывают метилизобутилкетоном и сушат. Таким образом, получают 478,5 г целевого продукта. Выход: 86,3%. Анализ ЯМР подтверждает структуру соединения.DSC ("Differential Scanning Calorimetry"): Эндотермический процесс при 95,2 С, соответствующий потере воды, затем следует эндотермический процесс при 117,1 С, соответствующий плавлению. Сульфат (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона. К раствору (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона (4,19 г) в этилацетате (30 мл), нагретому до 70 С, прибавляют раствор серной кислоты в этилацетате. Среду охлаждают до 20 С, выдерживают при этой температуре, затем полученное соединение фильтруют, промывают и сушат. Так получают 4,4 г целевого соединения. Выход: 85%. Анализ ЯМР подтверждает структуру соединения.DSC: эндотермический процесс при 92 С, соответствующий плавлению. Фумарат (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона. К раствору (2-бутилиндолизин-3-ил)-4-[3-(дипропиламино)пропил]фенилметанона (9,5 г) в этилацетате (39 мл), нагретому затем до 50 С, прибавляют раствор фумаровой кислоты в этилацетате. Среду охлаждают до 30 С, вводят затравку, затем охлаждают до 5 С. После выдерживания при этой температуре полученное соединение фильтруют и сушат. Таким образом получают 9,2 г целевого соединения. Выход: 75,8%. Анализ ЯМР подтверждает структуру соединения.DSC: эндотермический процесс плавления при 83,9 С. Следуя способам, описанным выше в примерах 2 и 3, но используя соответствующие исходные продукты, получают следующие соединения Гидрохлорид (2-бутилиндолизин-3-ил)-4-[3-(диэтиламино)пропил]фенилметанона. Т.пл. без разложения=145 С. Спектр ЯМР 1 Н (200 МГц, ДМСО,в ч/млн): 0,65 (т:3 Н); 0,99 (скт:2 Н); 1,18 (т:6 Н); 1,34 (кви:2 Н); 1,99 (мт:2 Н); 2,20 (т:2 Н); 2,75 (т:2 Н); 2,93-3,22 (М:6 Н); 6,50 (с:1 Н); 6,92 (т:1 Н); 7,20 (т:1 Н); 7,32-7,57 (система АА'-ВВ':4 Н); 7,62 (д:1 Н); 9,45 (д:1 Н); 10,60 (с ушир.:1 Н). Гидрохлорид 4-[3-(диэтиламино)пропил]фенил(2-пропилиндолизин-3-ил)метанона. Т.пл. без разложения=152 С.(соединение 16). а) (2-Пропилиндолизин-3-ил)[4-(4-хлорбутил)фенил]метанон. Нагревают при 50 С в течение 18 ч смесь 11 г (69 ммол) 2-пропилиндолизина и 15,9 г (69 ммол) 4(4-хлорбутил)бензоилхлорида. Обрабатывают водой, экстрагируют дихлорметаном, промывают раствором карбоната натрия, сушат органическую фазу над сульфатом натрия и концентрируют досуха. Очищают флэш-хроматографией на оксиде алюминия (элюент:гептан/метиленхлорид 50/50). Так получают 23 г целевого соединения в виде масла. Выход: 94,2%. б) (2-Пропилиндолизин-3-ил) 4-[4-(дипропиламино)бутил]фенилметанон. В реакторе растворяют 4 г (11,3 ммол) соединения, полученного на предыдущей стадии, в 50 мл метилизобутилкетона и добавляют в полученную реакционную среду 2,9 г (29,3 ммол) дипропиламина, 0,33 г (2,26 ммол) иодида натрия и нагревают при 110 С в течение 72 ч. Выливают в воду, экстрагируют дихлорметаном, промывают раствором гидрокарбоната натрия и концентрируют досуха. Очищают флэшхроматографией на диоксиде кремния (элюент: метиленхлорид/метанол 95/5). Так получают 3,9 г целевого соединения. Выход: 82,9%. в) Гидрохлорид (2-пропилиндолизин-3-ил)4-[4-(дипропиламино)бутил]фенилметанона. К раствору 3,9 г продукта, описанного выше, в эфире (50 мл) прибавляют 7 мл раствора хлористоводородной кислоты в эфире (2 М в эфире), перемешивают 30 мин и фильтруют соль, которая кристаллизуется. Получают таким образом 3,1 г целевого продукта. Выход: 73%. Т.пл. без разложения=93 С. Спектр ЯМР 1 Н (200 МГц, (ДМСО),в ч/млн): 0,60 (т:3 Н); 0,90 (т:6 Н); 1,38 (с кт:2 Н); 1,52-1,85(м:8 Н); 2,17 (т:2 Н); 2,71 (т:2 Н); 2,84-3,18 (М:6 Н); 6,50 (с:1 Н); 6,93 (т:1 Н); 7,20 (т:1 Н); 7,29-7,57 (система АА'-ВВ':4 Н); 7,62 (д:1 Н); 9,45 (д:1 Н)-10,23 (с ушир.,1 Н). Тесты на растворимость осуществляли при рН 4 следующим образом. Готовили фосфатный буфер 0,1 М с рН 6 добавлением 6,15 мл 0,1 М раствора Na2HPO4 и 4 3,85 мл 0,1 М раствора NaH2PO4. Раствор доводили до 100 мл фильтрованной водой с помощью системы Millipore(товарный знак). Контрольный опыт (исследуемый продукт в концентрации, при которой этот продукт растворим и является внутренним эталоном) Точно отвешивают навеску около 0,2 мг (в чашечке) и разбавляют ее 1 мл H2O/CH3CN: (50:50), т.е. получают 0,2 мг/мл, затем обрабатывают образец в течение 5 мин с помощью ультразвука. Образец с исследуемым продуктом: точно отвешивают навеску около 4 мг (в чашечке) и разбавляют ее 400 мкл (т.е. получают 10 мг/мл) фосфатного буфера рН 6 (0,1 М), затем обрабатывают образец в течение 5 мин с помощью ультразвука. Определяют значение рН и, если рН ниже 4, добавляют 1 мкл 1N NaOH до получения рН выше 4,затем снова измеряют рН. Раствор фильтруют (0,45 мкм), затем при необходимости разбавляют фосфатным буфером рН 6. (Если после разбавления продукт выпадает в осадок, то разбавленный образец не учитывается, отбирают маточный раствор и определяют растворимость по длине волны, отличающейся от А мах для того, чтобы избежать искажения сигнала). Затем определяют растворимость соединения с помощью ВЭЖХ при следующих условиях. Условия эксперимента Инструмент: Хроматограф Agilent 1100 Программа: Chemstation Колонка: XTERRA C18 (15 04,6 мм; 3,5 мкм) Элюент A: H2O/CH3CN/CH3SO3H: 1000/25/1 Температура колонки: 30 С. Расход: 0,8 мл/мин. Определение: А=230 нм. Впрыскиваемый объем: 5 мкл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные индолизина общей формулы (I) в которой X обозначает радикал -(СН 2)n-, где n обозначает целое число от 1 до 6, или группу формулы -CH2-Z-(СН 2)2-, в которой Z обозначает группу О(СН 2)m-, где m обозначает целое число от 0 до 3,R1 обозначает C1-C8 алкил, линейный, разветвленный или циклический;Am обозначает группу NR3R4, в которой R3 и R4, одинаковые или разные, обозначают независимо друг от друга атом водорода, C1-C6 алкил, линейный, разветвленный или циклический, или C1-C3 алкил,замещенный С 3-С 6 циклоалкилом,или радикал (СН 2)I-O-В, в котором В обозначает атом водорода или алкил (СН 2)k, где I и k обозначают целые числа I2 и 1+k6,или R3 и R4 образуют вместе с атомом азота, с которым они соединены, 4-6 членный гетероцикл,необязательно содержащий один или несколько гетероатомов, выбираемых из N, О, и необязательно несущий один или несколько заместителей, выбираемых из C1-C6 алкила, линейного, разветвленного или циклического,R2 обозначает атом водорода, С 1-С 6 алкил, линейный, разветвленный или циклический,и их фармацевтически приемлемые соли. 2. Производные индолизина по п.1, отличающиеся тем, что X обозначает радикал -(СН 2)n-, где n является целым числом от 1 до 6. 3. Производные индолизина по п.1, отличающиеся тем, что X обозначает радикал -(СН 2)n-, где n является целым числом от 3 до 4. 4. Производные индолизина по п.1, отличающиеся тем, что X обозначает группу формулы -CH2-Z(CH2)2-, в которой Z обозначает группу О(СН 2)m-, где m обозначает целое число от 0 до 3. 5. Производные индолизина по пп.1, 2, 3 или 4, отличающиеся тем, что R1 обозначает С 1-С 4 алкил. 6. Производные индолизина по любому из пп.1-5, отличающиеся тем, что R3 и R4 обозначают независимо друг от друга линейный C1-C4 алкил. 7. Производные индолизина по любому из пп.1-6, отличающиеся тем, что R3 и R4 образуют вместе пиперидинил или пиперазинил, необязательно несущий один или несколько метильных радикалов. 8. Производные индолизина по любому из пп.1-7, отличающиеся тем, что R2 обозначает атом водорода. 9. Производные индолизина по любому из пп.1-8, отличающиеся тем, что фармацевтически приемлемую соль выбирают из оксалата и гидрохлорида. 10. Производные индолизина формулы (I), которые имеют следующие наименования: гидрохлорид (2-бутилиндолизин-3-ил) 4-[3-(диэтиламино)пропил]фенилметанона; оксалат (2-этилиндолизин-3-ил)4-[3-(диэтиламино)пропил]фенилметанона; гидрохлорид 4-[3-(диэтиламино)пропил]фенил(2-пропилиндолизин-3-ил)метанона; оксалат (2-бутилиндолизин-3-ил)4-[4-(диэтиламино)бутил]фенилметанона; оксалат 4-[4-(диэтиламино)бутил]фенил(2-этилиндолизин-3-ил)метанона; гидрохлорид 4-[4-(диэтиламино)бутил]фенил(2-пропилиндолизин-3-ил)метанона; гидрохлорид (2-бутилиндолизин-3-ил)4-[3-(дипропиламино)пропил]фенилметанона; гидрохлорид полугидрата (2-бутилиндолизин-3-ил)4-[3-(дипропиламино)пропил]фенилметанона; сульфат (2-бутилиндолизин-3-ил)4-[3-(дипропиламино)пропил]фенилметанона;(2-бутилиндолизин-3-ил)(4-3-[(циклопропилметил)(пропил)амино]пропилфенил) метанона; гидрохлорид 4-[4-(пропиламино)бутил]фенил(2-пропилиндолизин-3-ил)метанона; гидрохлорид (2-бутилиндолизин-3-ил)4-[3-(пропиламино)пропил]фенилметанона; гидрохлорид (2-бутилиндолизин-3-ил)4-[3-(диметиламино)пропил]фенилметанона; гидрохлорид (2-бутилиндолизин-3-ил)(4-3-[(3R,5S)-3,5-диметилпиперазин-1-ил]пропилфенил)метанона; гидрохлорид (2-бутилиндолизин-3-ил)(4-3-[3R,5S)-3,4,5-триметилпиперазин-1-ил]пропилфенил) метанона; оксалат (4-3-[бис(2-метоксиэтил)амино]пропилфенил)(2-бутилиндолизин-3-ил)метанона; оксалат (2-бутилиндолизин-3-ил)[4 -(3-пиперидин-1-илпропил)фенил]метанона; гидрохлорид (2-бутил-6-метилиндолизин-3-ил)4-[3-(дипропиламино)пропил]фенилметанона; гидрохлорид (2-бутил-6-этилиндолизин-3-ил)4-[3-(дипропиламино)пропил]фенилметанона; гидрохлорид (2-бутил-6-метилиндолизин-3-ил)(4-3-[этил(пропил)амино]пропилфенил)метанона; Гидрохлорид (2-бутил-6-этилиндолизин-3-ил)(4-3-[этил(пропил)амино]пропилфенил)метанона. 11. Способ получения производных формулы (I) по любому из пп.1-10, включающий взаимодействие амина H-Am с соединением формулы (II) в которой Y обозначает атом галогена, а другие заместители имеют значения, указанные в предыдущих пунктах. 12. Способ, включающий способ получения соединения формулы (II) по п.11 и включающий взаимодействие соединения формулы (III) 13. Производные индолизина общей формулы (I) по любому из пп.1-10 для применения в качестве лекарственного средства. 14. Лекарственные средства, включающие производные индолизина общей формулы (I), определенной в любом из пп.1-10. 15. Фармацевтическая или ветеринарная композиция, отличающаяся тем, что она содержит в качестве действующего начала по меньшей мере одно производное индолизина формулы (I) по любому из пп.1-10 или фармацевтически приемлемую соль этого производного в сочетании с соответствующим фармацевтическим носителем или эксципиентом. 16. Применение производного индолизина общей формулы (I) по любому из пп.1-10 для получения лекарственного средства, предназначенного для лечения патологических синдромов сердечнососудистой системы, в частности для лечения стенокардии, гипертензии, вентрикулярной или суправентрикулярной аритмии, лечения сердечной недостаточности, инфаркта миокарда, осложненного или не осложненного сердечной недостаточностью, или для предотвращения постинфарктной смертности. 17. Применение производного индолизина по п.16 для получения лекарственного средства, предназначенного для лечения стенокардии, гипертензии, вентрикулярной или суправентрикулярной аритмии,лечения сердечной недостаточности, инфаркта миокарда, осложненного или не осложненного сердечной недостаточностью, или для предотвращения постинфарктной смертности.
МПК / Метки
МПК: A61K 31/454, A61P 9/00, C07D 471/04
Метки: получения, способ, терапевтические, индолизина, производные, композиции, основе
Код ссылки
<a href="https://eas.patents.su/16-14158-proizvodnye-indolizina-sposob-ih-polucheniya-i-terapevticheskie-kompozicii-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индолизина, способ их получения и терапевтические композиции на их основе</a>
Предыдущий патент: Рекомбинантные мутанты интерферона α2 (ifnα2)
Следующий патент: Выдувная пленка, способ ее получения, применение и изделие
Случайный патент: Форма для сооружения защитного и крепежного элемента тюфячного типа и относящийся к ней способ












