Лиганды нейронального никотинового ацетилхолинового рецептора α4β2
Номер патента: 23293
Опубликовано: 31.05.2016
Авторы: Мохаммед Абдул Рашид, Кумават Кана Рам, Мудигонда Котешвара, Нироджи Рамакришна, Кандикере Нагарадж Вишвоттам, Джасти Венкатесварлу, Схинде Анил Карбхари, Джаяраджан Прадип, Ахмад Иштияк
Формула / Реферат
1. Соединение общей формулы (I)
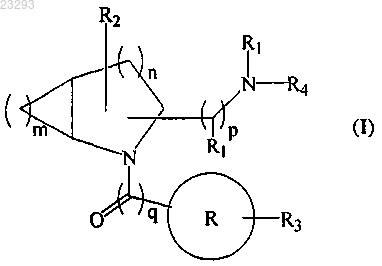
где означает пиридил, фуранил, пиразинил, пиримидинил, хинолинил, бензофуранил или индолил;
означает пиридил, фуранил, пиразинил, пиримидинил, хинолинил, бензофуранил или индолил;
R1 означает водород или метил;
R2 означает водород;
R3 означает водород, гидрокси, бром, хлор, метил, метокси, этокси, изопропокси или трифторметил;
R4 означает водород, метил или этил; необязательно, R1 и R4 вместе с атомом азота могут образовывать пирролидинил, морфолинил или пиперазинил;
"m" равно 1;
"n" равно 1;
"p" равно 0-2;
"q" равно 0-1;
или его соответствующие стереоизомеры и фармацевтически приемлемые соли.
2. Соединение по п.1, которое выбирают из группы, включающей
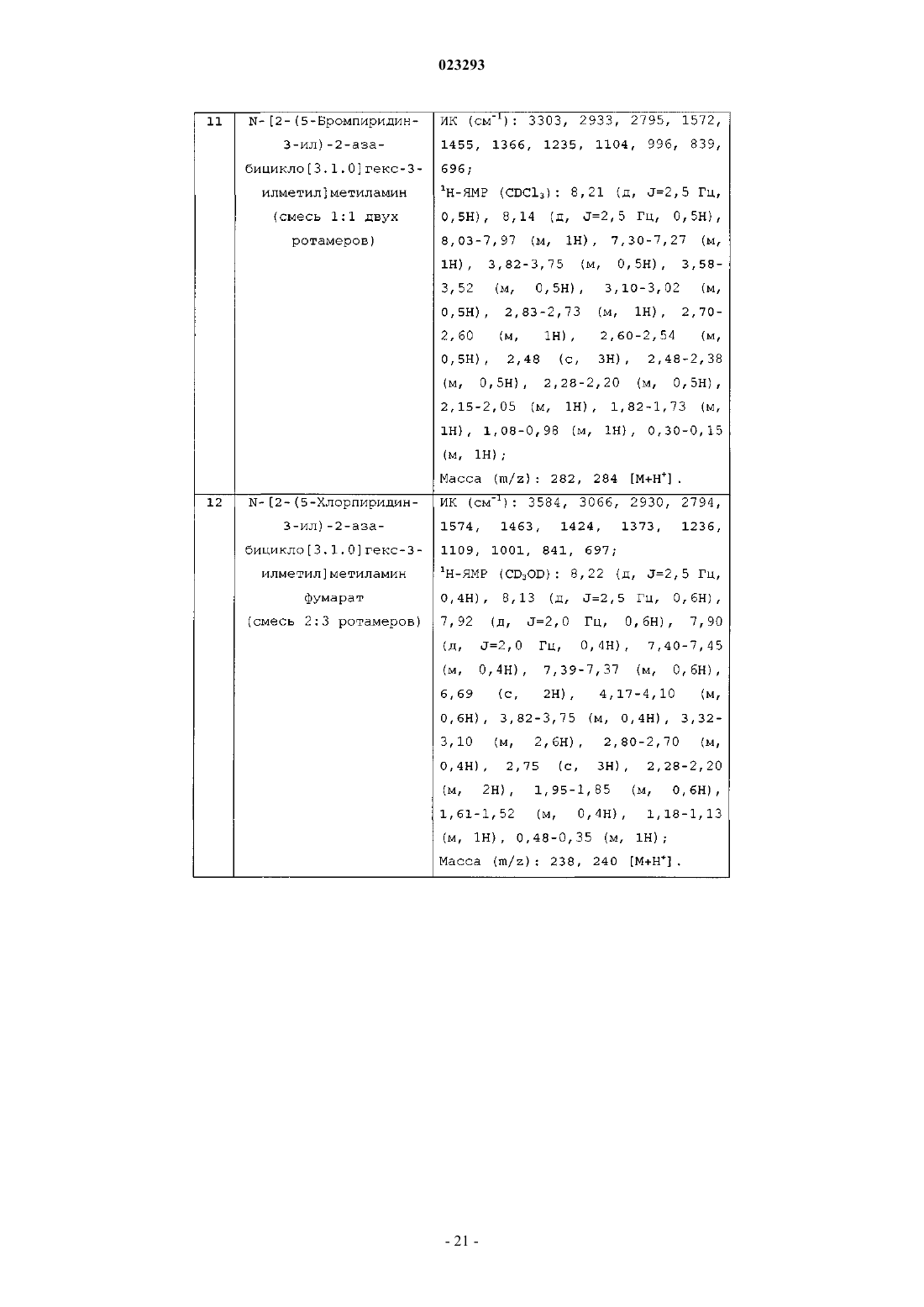
N-[2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]диметиламин гидрохлорид;
[2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-ил]метиламин;
фуран-2-ил-(3-метиламинометил-2-азабицикло[3.1.0]гекс-2-ил)метанон тартрат;
N-[2-(пиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин гидрохлорид;
N-[2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]этиламин тартрат;
2-(5-бромпиридин-3-ил)-3-пирролидин-1-илметил-2-азабицикло[3.1.0]гексан тартрат;
2-(5-бромпиридин-3-ил)-3-(морфолин-4-илметил)-2-азабицикло[3.1.0]гексан тартрат;
2-(5-бромпиридин-3-ил)-3-(пиперазин-1-илметил)-2-азабицикло[3.1.0]гексан;
N-[2-(пиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]диметиламин;
N-[2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин;
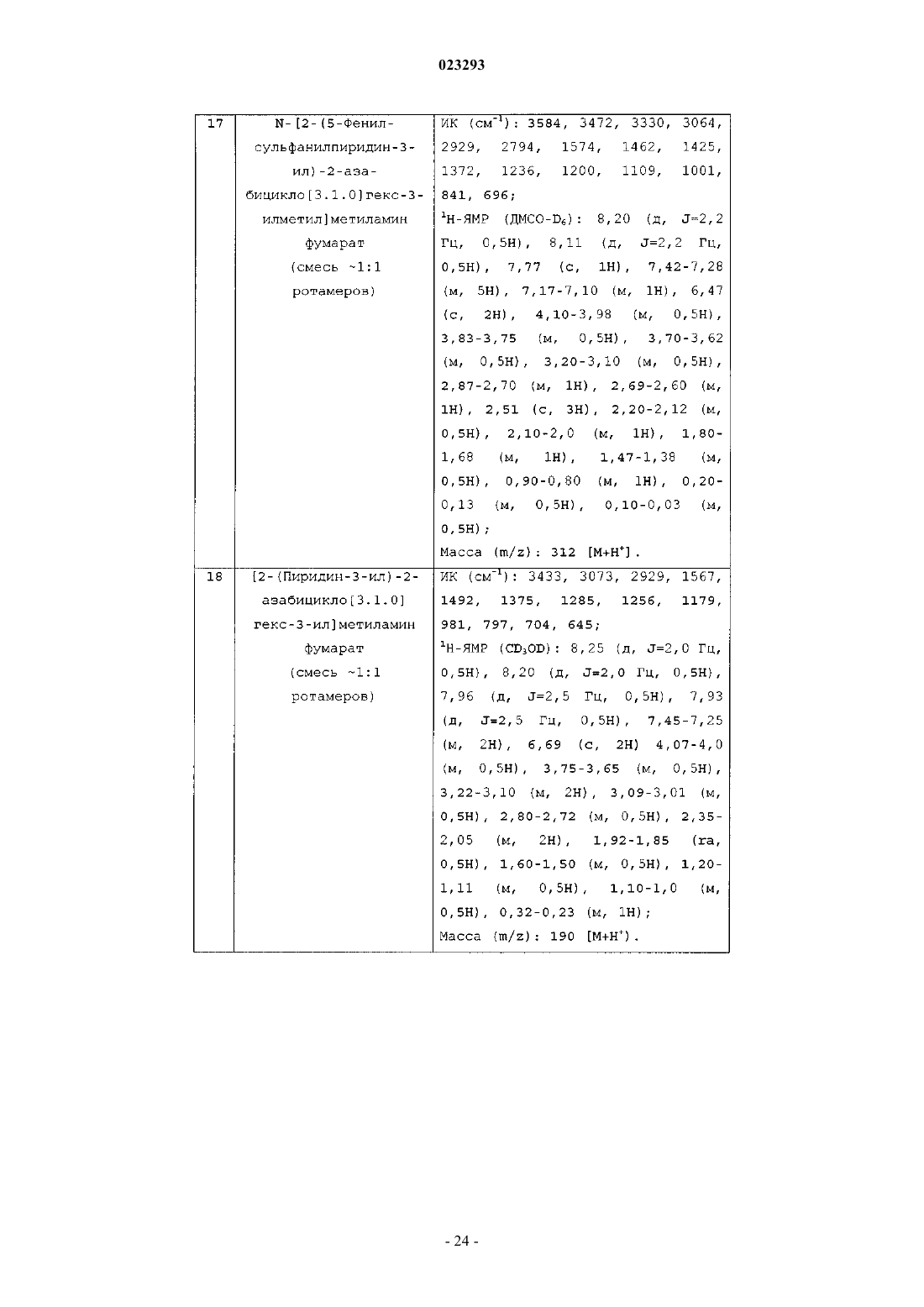
N-[2-(5-хлорпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин фумарат;
[2-(5-хлорпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-ил]метиламин фумарат;
N-[2-(5-метоксипиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин фумарат;
N-[2-(5-изопропоксипиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин;
[2-(пиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-ил]метиламин фумарат;
[2-(3-бром-2-этоксипиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин фумарат;
N-[2-(3-гидроксипиразин-2-ил)-2-азабицикло[3.1.0]гекс-3-илметил]метиламин;
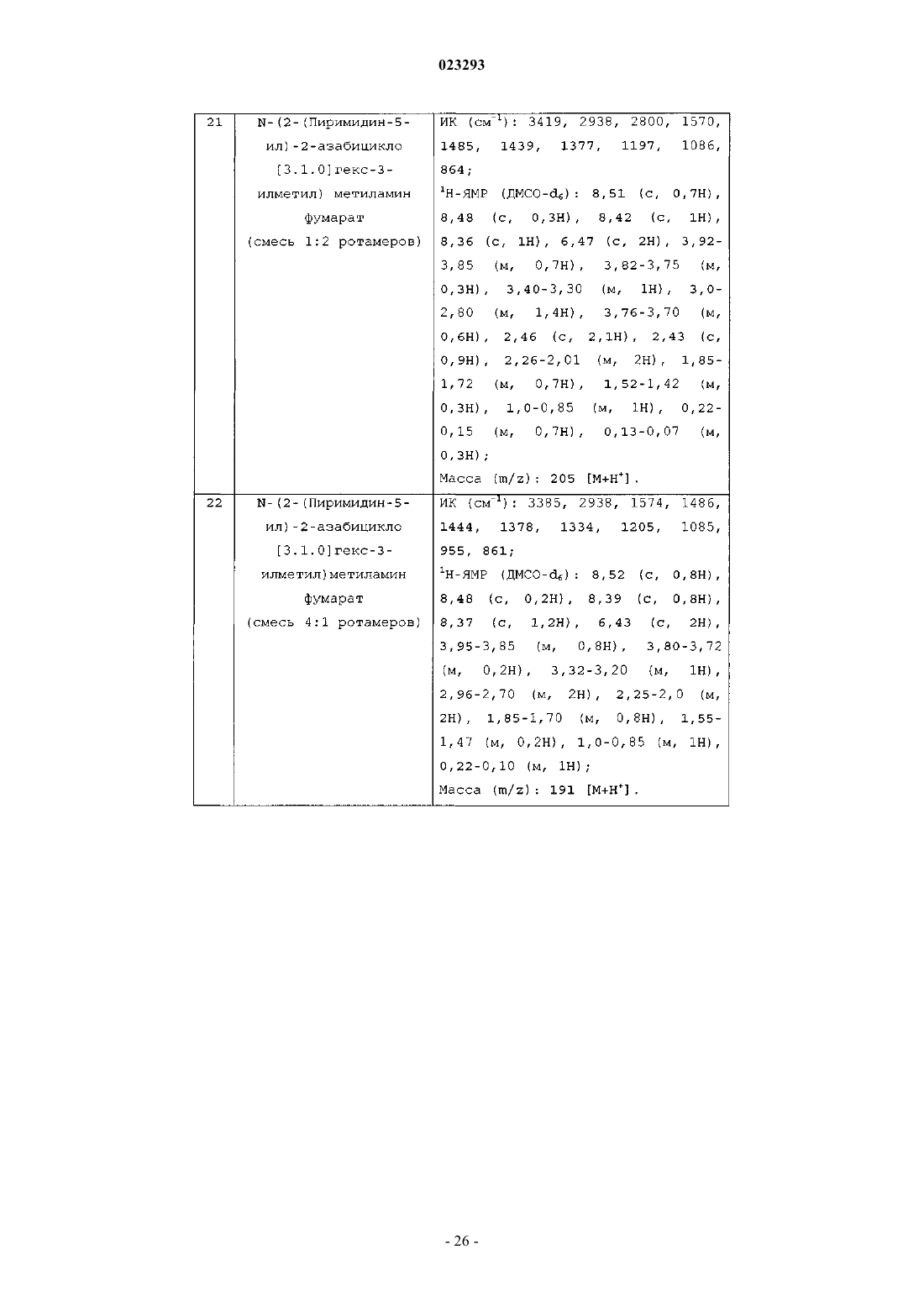
N-(2-(пиримидин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)метиламин фумарат;
N-(2-(2-трифторметилпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)метиламин фумарат;
N-(2-(2-трифторметилпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)амин фумарат;
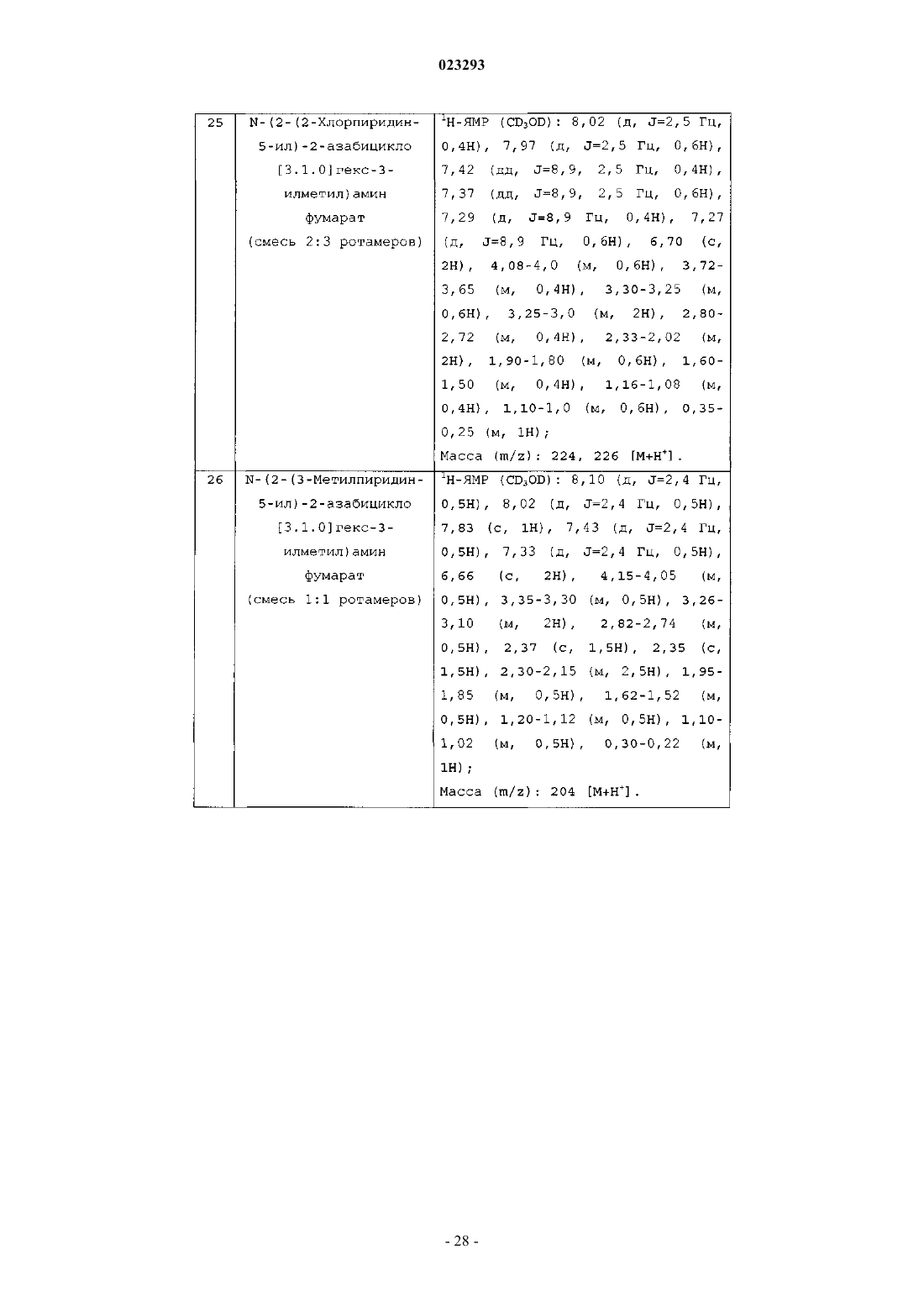
N-(2-(2-хлорпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)амин фумарат;
N-(2-(3-метилпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)амин фумарат;
N-(2-(3-метилпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)метиламин бистартрат;
N-(2-(3-трифторметилпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)амин фумарат;
N-(2-(хинолин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил)амин фумарат;
N-(2-(3-трифторметилпиридин-5-ил)-2-азабицикло[3.1.0]гекс-3-илметил)метиламин фумарат;
N-(2-(хинолин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил)метиламин фумарат;
бензофуран-2-ил-(3-метиламинометил-2-азабицикло[3.1.0]гекс-2-ил)метанон тартрат;
(7-бромбензофуран-2-ил)-(3-метиламинометил-2-азабицикло[3.1.0]гекс-2-ил)метанон тартрат;
(3-аминометил-2-азабицикло[3.1.0]гекс-2-ил)-(1Н-индол-2-ил)метанон;
(3-аминометил-2-азабицикло[3.1.0]гекс-2-ил)фуран-2-илметанон тартрат;
(3-аминометил-2-азабицикло[3.1.0]гекс-2-ил)-(5-бромпиридин-3-ил)метанон тартрат;
(3-аминометил-2-азабицикло[3.1.0]гекс-2-ил)пиридин-2-илметанон тартрат;
(3-аминометил-2-азабицикло[3.1.0]гекс-2-ил)пиридин-3-илметанон тартрат;
(3-аминометил-2-азабицикло[3.1.0]гекс-2-ил)пиридин-4-илметанонтартрат;
или соответствующие стереоизомеры и фармацевтически приемлемые соли.
3. Способ получения соединения формулы (I) по п.1, который включает:
(a) сочетание соединения формулы (12) с соединением формулы (13)
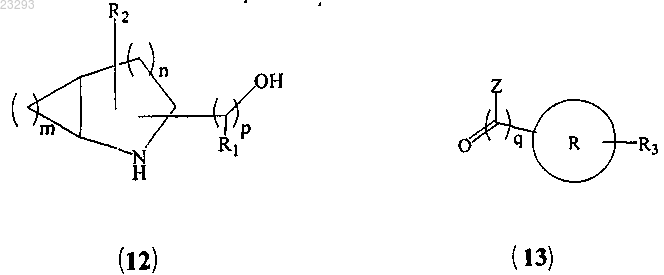
с образованием соединения формулы (14)
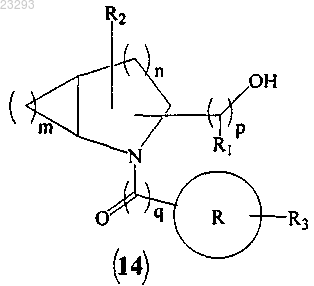
(b) превращение гидроксильной группы соединения формулы (14) в мезилатную группу (Ms) соединения формулы (15)
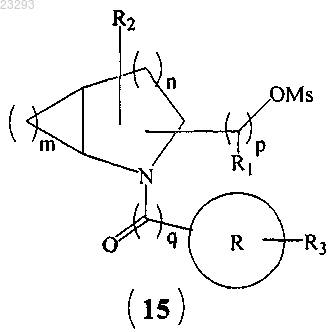
(с) взаимодействие соединения формулы (15) с алкиламинами с образованием соединения формулы (I), где все заместители являются такими, как указано в п.1, и "Z" означает галоген.
4. Способ получения соединения формулы (I) по п.1, который включает:
(a) сочетание соединения формулы (12) с соединением формулы (13)
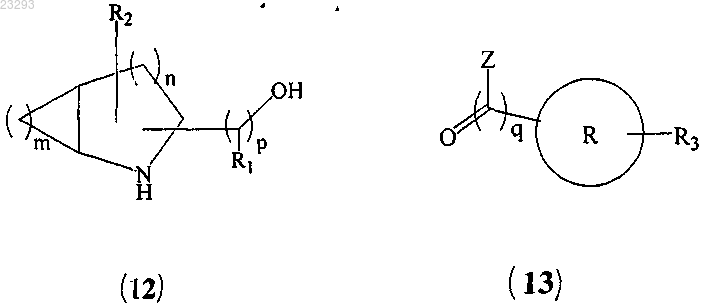
с образованием соединения формулы (14)
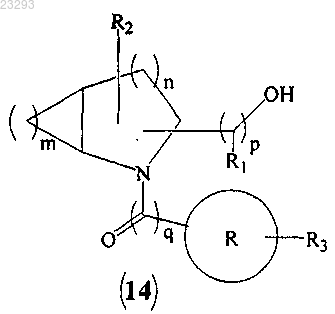
(b) превращение гидроксильной группы соединения формулы (14) в мезилатную группу (Ms) соединения формулы (15)
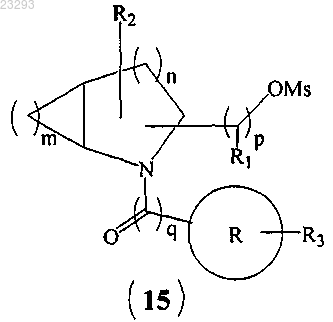
(с) взаимодействие соединения формулы (15) с азидной солью с образованием соединения формулы (16)
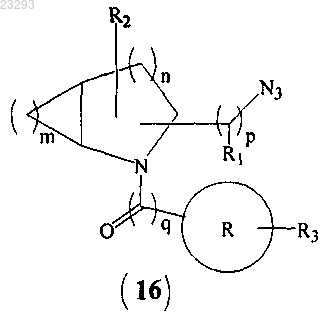
(d) восстановление соединения формулы (16) с образованием соединения формулы (I), где все заместители являются такими, как указано в п.1, и "Z" означает галоген.
5. Способ получения соединения формулы (I) по п.1, который включает:
(a) сочетание соединения формулы (17) с соединением формулы (13)
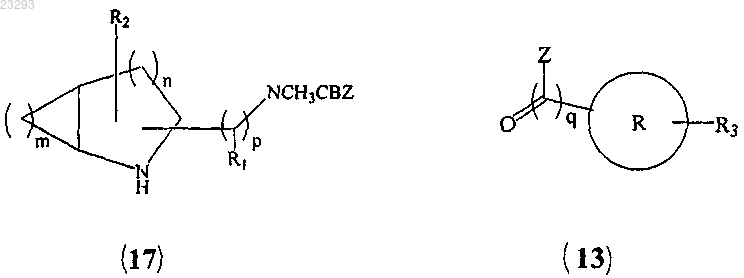
с образованием соединения формулы (19)
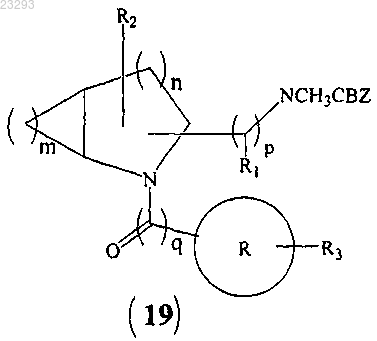
(b) снятие защиты соединения формулы (19) с образованием соединения формулы (I), где все заместители являются такими, как указано в п.1, "Z" означает галоген и CBZ означает бензилоксикарбонильную группу.
6. Способ по любому из пп.3-5, дополнительно включающий превращение соединения формулы (I) в соответствующие стереоизомеры или фармацевтически приемлемые соли.
7. Фармацевтическая композиция для лечения заболеваний, связанных с никотиновым рецептором α4β2, содержащая эффективное количество соединения по пп.1, 2 и фармацевтически приемлемый эксципиент.
8. Фармацевтическая композиция по п.7 для лечения клинических состояний, таких как депрессия, когнитивные нарушения памяти, боль и ожирение.
9. Применение соединения по любому из пп.1, 2 при изготовлении лекарственного средства для лечения заболеваний, связанных с никотиновым рецептором α4β2.
10. Применение соединения по п.9, где лекарственное средство предназначено для лечения клинических состояний, таких как депрессия, когнитивные нарушения памяти, боль и ожирение.
Текст
ЛИГАНДЫ НЕЙРОНАЛЬНОГО НИКОТИНОВОГО АЦЕТИЛХОЛИНОВОГО РЕЦЕПТОРА 42 Котешвара, Джасти Венкатесварлу Изобретение касается новых соединений - лигандов нейронального никотинового ацетилхолинового рецептора 42 формулы (I) и соответствующих стереоизомеров,фармацевтически приемлемых солей и фармацевтических композиций, содержащих указанные соединения. Изобретение касается также способов получения соединений формулы (I) и их применения при изготовлении лекарственного средства для лечения заболеваний, связанных с никотиновым рецептором 42, таких как депрессия, когнитивные нарушения памяти, боль и ожирение.(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) Область техники, к которой относится изобретение Настоящее изобретение касается новых соединений - лигандов нейронального никотинового ацетилхолинового рецептора 42, формулы (I) и соответствующих производных, стереоизомеров, фармацевтически приемлемых солей и композиций, содержащих указанные соединения. Настоящее изобретение также касается способа получения вышеуказанных новых соединений и производных, стереоизомеров и фармацевтически приемлемых солей указанных соединений. Соединения общей формулы (I) полезны в лечении различных нарушений, связанных с никотиновыми рецепторами 42. Предпосылки создания изобретения Никотиновые ацетилхолиновые рецепторы (nAChR) или нейрональные никотиновые рецепторы(NNR) опосредуют очень широкий ряд физиологических эффектов и являются мишенью для терапевтического лечения различных нарушений. nAChR, принадлежащие к суперсемейству лиганд-управляемых ионных каналов (LGIC), широко распространены в центральной нервной системе (ЦНС) и периферической нервной системе (ПНС). Предполагается, что NNR играют важную роль в регуляции функции ЦНС и высвобождении многих нейромедиаторов. Как правило, NNR образуются пятимерной сборкой субъединичных белков. К настоящему времени идентифицировано семнадцать субъединиц nAChR, которые идентифицированы как 2-18, 1-4, ,и . Из перечисленных субъединиц восемь нейрональных(2-9) и три нейрональных(2-4) в значительном количестве присутствуют в мозге млекопитающихal., Immunohistochemical localization of nicotinic acetylcholine receptor subunits in human cerebellum, Neuroscience, 2002; 113:493-507). Также существует множество функционально различных комплексов nAChR; поскольку гомомерный функциональный пентамер или комбинации различных субъединиц могут комплексоваться совместно (смотри, например, Hogg, R.C. et al., Nicotinic acetylcholine receptors: from structure to brain function, Rev. Physiol., Biochem. Pharmacol., 2003, 147: 1-46). Идентификация семейства генов, кодирующих nAChR, и возрастающие знания относительно экспрессии и функции указанных генов в центральной нервной системе приводят к нарастающему вниманию в отношении потенциала указанных генов в качестве лекарственных мишеней (см., например, HoggR.C. et al., Nicotinic Acetylcholine Receptors as Drug Targets, Curr. Drug Targets: CNS Neurol. Disord. 2004,3: 123-130; Suto et al., Neuronal nicotinic acetylcholine receptors as drug targets, Expert Opin. Ther. Targets 2004, 8: 61-64). Существует множество потенциальных терапевтических применений для людей лигандов нейрональных никотиновых рецепторов 42, основанных на прямых воздействиях и на показаниях к применению, устанавливаемых научными исследованиями. Нейрональные никотиновые рецепторы 42 вовлечены в различные способы лечения заболеваний, таких как когнитивные расстройства, включающие болезнь Альцгеймера, болезнь Паркинсона, синдром дефицита внимания/гиперактивности, шизофрения и синдром Туретта (см., например, Newhouse et al., Effects of nicotinic stimulation on cognitive performance,Curr. Opin. Pharmacol. 2004, 4: 36-46; Levin E.D. et al., Nicotinic Treatment for Cognitive Dysfunction, Curr.Drug Targets: CNS Neurol. Disord. 2002, 1: 423-431; Graham A.J. et al., Human Brain Nicotinic Receptors,their Distribution and Participation in Neuropsychiatric Disorders, Curr. Drug Targets: CNS Neurol. Disord. 2002, 1: 387-397; McEvoy J.P. et al., The Importance of Nicotinic Acetylcholine Receptors in Schizophrenia,Bipolar Disorder and Tourette's Syndrome, Curr. Drug Targets: CNS Neurol. Disord. 2002, 1: 433-442). Исследования на ряде моделей боли, на грызунах показывают, что лиганды рецептора 42 обладают потенциалом для высокоэффективного лечения различных болевых состояний и воспаления (см., например, Vincler et al., Neuronal nicotinic receptors as targets for novel analgesics, Expert Opin. Invest. Drugs,2005, 14: 1191-1198; Decker M.W. et al., The therapeutic potential of nicotinic acetylcholine receptor agonistsfor pain control, Expert Opin Investig Drugs. 2001 Oct; 10(10):1819-30; Miao et al., Central terminals of nociceptors are targets for nicotine suppression of inflammation, Neuroscience 2004, 123: 777-84). Существенные усилия прилагаются для понимания гиперхолинергической нейротрансмиссии, связанной с состояниями подавленного настроения, предполагается, что указанная нейротрансмиссия может быть опосредована избыточной активацией нейрональных никотиновых рецепторов и что терапевтические воздействия многих антидепрессантов могут быть, отчасти, опосредованы ингибированием указанных рецепторов. Таким образом, лиганды нейронального никотинового ацетилхолинового рецептора 42 могут представлять собой новый класс терапевтических средств для лечения депрессии и тревожных расстройств (см., например, Shytle et al., Nicotinic acetylcholine receptors as targets for antidepressants,Mol. Psychiatry 2002, 7: 525-35; Shytle et al., Neuronal nicotinic receptor inhibition for treating mood disorders: preliminary controlled evidence with mecamylamine, Depress. Anxiety, 2002, 16: 89-92). Недавние исследования также подтвердили, что nAChR играют определенную роль в нейродегенеративных расстройствах. Никотин и селективные лиганды субтипов nAChR могут обеспечивать нейрозащиту в исследованиях моделей таких нарушений на животных на системах клеточных культур in-vitro и in-vivo (см.,например, O'Neill et al., The role of neuronal nicotinic acetylcholine receptors in acute and chronic neurodegeneration, Curr. Drug Targets: CNS Neurol. Disord., 2002, 1: 399-411). Субтип nAChR 42 обладает наибольшей аффинностью к никотину и является основным вероятным кандидатом на опосредование центральных воздействий никотина. Хроническое воздействие никотина (на людей, животных и системы клеточных культур) ведет к возрастанию числа nAChR 42 (повышающая регуляция), с функциональными осложнениями при отказе. Такие исследования указывают на то, что лиганды нейронального никотинового рецептора 42 играют решающую роль в лечении наркотической зависимости (Dwoskin et al., A novel mechanism of action and potential use for lobeline as atreatment for psychostimulant abuse, Biochem. Pharmacol., 2002, 63: 89-98; Coe et al., 3,5-Bicyclic aryl piperidines: a novel class of 42 nAChR partial agonists for smoking cessation, Bioorg. Med. Chem. Lett., 2005, 15: 4889-97). Предполагается также, что лиганды рецептора 42 будут полезны в лечении ожирения (Li etal., Nicotine, body weight and potential implications in the treatment of obesity, Curr. Top. Med. Chem., 2003,3: 899-919). Вместе взятые, вышеуказанные исследования убедительно свидетельствуют о том, что соединения,являющиеся модуляторами рецептора 42, т.е. лигандами, могут быть полезны при показаниях к применению, включающих лечение болезней, связанных с дефицитом памяти, познавательной способности и обучения, таких как болезнь Альцгеймера и синдром дефицита внимания; лечение личностных нарушений, таких как шизофрения; лечение поведенческих нарушений, например, тревоги, депрессии и обсессивно-компульсивных расстройств; лечение боли и воспаления; лечение двигательных или моторных расстройств, таких как болезнь Паркинсона и эпилепсия; лечение болезней, связанных с нейродегенерацией, таких как внезапный удар или травма головы, или отвыкание от наркотической зависимости,включая зависимость от никотина, алкоголя и других веществ, допускающих злоупотребление, и ожирение. Патентные публикации WO 2008057938 (A1), US 20040192673 (A1) и EP296560 (B1) описывают ряд соединений в качестве лигандов никотиновых ацетилхолиновых рецепторов, указанные соединения заявлены, как полезные в лечении различных расстройств ЦНС. Хотя некоторые соединения - лиганды никотиновых ацетилхолиновых рецепторов, описаны, продолжает оставаться потребность в соединениях, полезных для модуляции никотиновых ацетилхолиновых рецепторов. В настоящем исследовании в области никотиновых ацетилхолиновых рецепторов, заявителями установлено, что бициклические соединения формулы (I) проявляют очень высокую аффинность к никотиновым ацетилхолиновым рецепторам. Таким образом, цель настоящего изобретения состоит в получении соединений, полезных в качестве терапевтических средств при лечении/профилактике ряда расстройств центральной нервной системы или нарушений, зависящих от никотиновых рецепторов 42. Краткое изложение сущности изобретения Настоящее изобретение касается новых соединений - лигандов нейрональных никотиновых ацетилхолиновых рецепторов 42, формулы (I) и соответствующих стереоизомеров, фармацевтически приемлемых солей и композиций, содержащих указанные соединения.R1 означает водород или метил;R4 означает водород, метил или этил; необязательно, R1 и R4 вместе с атомом азота могут образовывать пирролидинил, морфолинил или пиперазинил;"q" равно 0-1. Настоящее изобретение касается применения терапевтически эффективного количества соединения формулы (I) при изготовлении лекарственного средства для лечения заболеваний, связанных с никотиновым рецептором 42. В частности, соединения по данному изобретению полезны для лечения клинических состояний,таких как депрессия, когнитивные нарушения памяти, боль и ожирение. В другом аспекте изобретение касается фармацевтической композиции для лечения заболеваний,связанных с никотиновым рецептором 42, содержащей эффективное количество соединения формулы(I) и фармацевтически приемлемый эксципиент. В еще одном аспекте изобретение также касается способов получения соединения формулы (I) и соответствующих стереоизомеров и фармацевтически приемлемых солей. Один из способов получения соединения формулы (I) настоящего изобретения включает:(a) сочетание соединения формулы (12) с соединением формулы (13) с образованием соединения формулы (14)(b) превращение гидроксильной группы соединения формулы (14) в мезилатную группу (Ms) соединения формулы (15)(c) взаимодействие соединения формулы (15) с алкиламинами, с образованием соединения формулы (I), где все заместители являются такими, как указано в п.1, и "Z" означает галоген;(d) необязательно, превращение соединения формулы (I) в соответствующие стереоизомеры или фармацевтически приемлемые соли. Второй способ получения соединения формулы (I) настоящего изобретения включает:(a) сочетание соединения формулы (12) с соединением формулы (13) с образованием соединения формулы (14)(b) превращение гидроксильной группы соединения формулы (14) в мезилатную группу (Ms) соединения формулы (15)(с) взаимодействие соединения формулы (15) с азидной солью, с образованием соединения формулы (16)(d) восстановление соединения формулы (16) с образованием соединения формулы (I), где все заместители являются такими, как указано в п.1, и "Z" означает галоген,(e) необязательно, превращение соединения формулы (I) в соответствующие стереоизомеры или фармацевтически приемлемые соли. Третий способ получения соединения формулы (I) настоящего изобретения включает:(a) сочетание соединения формулы (17) с соединением формулы (13) с образованием соединения формулы (19)(b) снятие защиты соединения формулы (19) с образованием соединения формулы (I), где все заместители являются такими, как указано в п.1, "Z" означает галоген и CBZ означает бензилоксикарбонильную группу,(c) необязательно, превращение соединения формулы (I) в соответствующие стереоизомеры или фармацевтически приемлемые соли. Характерные соединения настоящего изобретения включают нижеуказанные соединения и соответствующие стереоизомеры и фармацевтически приемлемые соли: Подробное описание изобретения Если не указано иное, следующие термины, используемые в описании и формуле изобретения,имеют приведенные ниже значения: Термин "стереоизомеры" является общим термином для всех изомеров отдельных молекул, отличающихся только ориентацией атомов в пространстве. Указанный термин включает зеркальные изомеры(энантиомеры), геометрические (цис-, транс-) изомеры и изомеры соединений с несколькими хиральными центрами, не являющиеся зеркальным отображением друг друга (диастереомеры). Указанный термин также включает ротамеры, которые являются конформерами, отличающимися вращением вокруг только одной простойсвязи. Термины "лечить" или "лечение" охватывают все смысловые значения, такие как превентивное,профилактическое, паллиативное. Фраза "фармацевтически приемлемые соли" указывает, что, при лечении млекопитающего, вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, входящими в рецептуру. Фраза "терапевтически эффективное количество" определяется как количество соединения по настоящему изобретению, которое (i) излечивает или предотвращает конкретное заболевание, состояние или нарушение, (ii) смягчает, улучшает состояние или устраняет один или несколько симптомов конкретного заболевания, состояния или нарушения, (iii) предотвращает или замедляет появление одного или нескольких симптомов указанного здесь конкретного заболевания, состояния или нарушения. Коммерческие реагенты использованы без дополнительной очистки. Комнатная температура соответствует 25-30C. ИК снимают, используя KBr в твердом состоянии. Если не указано иное, все массспектры снимают, используя ESI-условия. 1H-ЯМР-спектр регистрируют при 400 МГц на прибореBruker. В качестве растворителя используют дейтерированный хлороформ (99,8% D). ТМС используют в качестве внутреннего эталона сравнения. Величины химических сдвигов выражены в миллионных долях. Следующие обозначения мультиплетности использованы для ЯМР-сигналов: с = синглет, уш.с = уширенный синглет, д = дублет, т = триплет, кв = квартет, квин = квинтет, г = гептет, дд = двойной дуб-7 023293 лет), дт = двойной триплет, тт = тройной триплет, м = мультиплет. Хроматография означает колоночную хроматографию, выполняемую с использованием силикагеля 100-200 меш и проводимую в условиях давления азота (флэш-хроматография). В соединение общей формулы (I) можно ввести радиоактивную метку, применяя стандартные методики, известные в органической химии. Альтернативно, радиоактивная метка может быть введена в соединение формулы (I) с помощью радиоизотопа, как заместителя в одном из исходных веществ или в промежуточном соединении, используемом в синтезе соединения формулы (I). Синтез соединения с радиоактивной меткой, в целях удобства, может быть осуществлен поставщиком радиоизотопов, специализирующимся на синтезе, по специальным техническим требованиям заказчика, меченного радиоактивностью соединения-зонда, таким как Amersham Corporation, ArlingtonChemSyn Laboratories, Lexena, KS; American Radiolabeled Chemicals, Inc.St. Louis, MO. Меченные радиоактивным изотопом аналоги соединения формулы (I) могут быть использованы в клинических испытаниях по оценке роли лигандов никотиновых рецепторов 42 для широкого спектра болезней, при которых предполагается задействовать лиганды никотиновых рецепторов 42. Соединения формулы (I) с радиоактивной меткой полезны в качестве визуализирующих средств и биомаркеров для лекарственной терапии и медицинской диагностики. Такие соединения с радиоактивной меткой также полезны в качестве фармакологических инструментов для изучения функций и активности никотиновых рецепторов 42. Например, изотопно меченные соединения в особенности полезны в SPECT (однофотонной эмиссионной компьютерной томографии) и в PET (позитронно-эмиссионной томографии). Фармацевтические композиции. С целью применения соединений формулы (I) в терапии указанные соединения обычно формулируют в фармацевтическую композицию согласно стандартной фармацевтической практике. Фармацевтическую композицию по настоящему изобретению можно формулировать общепринятым способом, используя один или несколько фармацевтически приемлемых носителей. Так, активные соединения по изобретению можно формулировать для перорального, буквального, интраназального,парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения, или в форму, пригодную для введения путем ингаляции или инсуффляции. Для перорального введения фармацевтические композиции могут иметь форму, например, таблеток или капсул, полученных общепринятыми способами с фармацевтически приемлемыми эксципиентами,такими как связующие вещества (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, магния стеарат, тальк или диоксид кремния); дезинтеграторы (например, картофельный крахмал или натрия гликолят крахмала); или увлажняющие средства (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой способами,хорошо известными из уровня техники. Жидкие препараты для перорального введения могут иметь форму, например, растворов, сиропов или суспензий, или могут быть представлены в виде сухого продукта для восстановления водой или другим подходящим растворителем перед использованием. Такие жидкие препараты могут быть получены общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сорбитовый сироп, метилцеллюлоза или гидрогенезированные пищевые жиры); эмульгирующие средства (например, лецитин или гуммиарабик); неводные растворители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может иметь форму таблеток или пастилок, формулированных общепринятым способом. Активные соединения по изобретению могут быть формулированы для парентерального введения путем инъекции, включая применение общепринятых способов катетеризации или инфузии. Примеры для инъекции могут быть представлены в единичной дозированной форме, например, в ампулах или многодозовых контейнерах, с добавкой консерванта. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных растворителях, и могут содержать используемые для формулирования вещества, такие как суспендирующие средства, стабилизирующие и/или диспергирующие средства. Альтернативно, активный ингредиент может быть в форме порошка для восстановления с помощью подходящего растворителя, например, стерильной апирогенной воды, перед использованием. Активные соединения по изобретению могут также быть формулированы в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения или введения путем ингаляции, активные соединения по изобретению обычно доставляют в форме аэрозоля, распыляемого из контейнера под давлением или распылителя,или из капсулы, с использованием ингалятора или инсуффляторов. В случае аэрозоля под давлением,подходящим пропеллентом является, например, дихлордифторметан, трихлорфторметан, дихлортетраф-8 023293 торэтан, диоксид углерода или другой подходящий газ, и единица дозирования может быть отмерена путем обеспечения клапана для отпуска дозированного количества. Лекарственное средство для контейнера под давлением или распылителя может содержать раствор или суспензию активного соединения; тогда как для капсулы такое средство предпочтительно должно быть в форме порошка. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть составлены, как содержащие смесь порошков соединения по изобретению и подходящей порошковой основы, такой как лактоза или крахмал. Аэрозольные препараты для лечения вышеперечисленных состояний (например, мигрени) у среднего взрослого человека предпочтительно устроены так, что каждая отмеренная доза или "пуф" аэрозоля содержал от 20 до 1000 мкг соединения по изобретению. Полная суточная доза аэрозоля составляет в диапазоне от 100 до 10 мг. Вводить можно ежедневно по несколько раз, например, 2, 3, 4 или 8 раз, давая, например, 1, 2 или 3 дозы каждый раз. Эффективное количество соединения общей формулы (I), как определено выше, может быть использовано для получения лекарственного средства, наряду с общепринятыми фармацевтическими вспомогательными веществами, носителями и добавками. Такая терапия включает множественный выбор: например, введение двух совместимых соединений одновременно в единичной дозированной форме или введение каждого соединения по отдельности в отдельной дозировке; или, если требуется, с одним и тем же временным интервалом, или раздельно, чтобы свести к максимуму положительный эффект или предельно уменьшить возможные побочные эффекты лекарственных средств согласно известным принципам фармакологии. Доза активных соединений может изменяться в зависимости от факторов, таких как способ введения, возраст и вес пациента, характер и тяжесть излечиваемого заболевания и тому подобных факторов. Поэтому любая ссылка здесь на фармакологически эффективное количество соединений общей формулы(I) относится к вышеупомянутым факторам. Предполагаемая доза активных соединений по данному изобретению, как для перорального, парентерального, назального, так и для буккального введения, для среднего взрослого человека при лечении вышеуказанных состояний составляет от 0,1 до 200 мг активного ингредиента на единичную дозу, которую можно вводить, например, 1-4 раза в день. Способ получения. Соединения формулы (I) могут быть получены по схеме I, как показано ниже. Схема I В вышеуказанной формуле (13) символ "Z" означает галоген. Соединение формулы (12) подвергают взаимодействию с соединением формулы (13) с образованием соединения формулы (14). Гидроксильную группу соединения формулы (14) превращают в мезилатную группу с образованием соединения формулы (15). Соединение формулы (15) обрабатывают алкиламинами с образованием соединения формулы(I). На первой стадии вышеуказанного способа получения осуществляют сочетание соединения формулы (12) с соединением формулы (13) в присутствии катализаторов на основе 2,2'-бис-(дифенилфосфино)1,1'-бинафтила (BINAP) и палладия, получая соединение формулы (14). Данное взаимодействие преимущественно осуществляют в растворителе, таком как 1,4-диоксан, тетрагидрофуран, толуол, этилацетат,диметилформамид, диметилсульфоксид и тому подобное, или смеси указанных растворителей и предпочтительно с использованием 1,4-диоксана. На взаимодействие может влиять наличие основания, такого как трет-бутилат натрия, трет-бутилат калия, карбонат калия, гидроксид натрия, гидрид натрия, карбонат цезия или смеси указанных оснований, и предпочтительно использование трет-бутилата натрия. Взаимодействие осуществляют, используя фосфиновые лиганды, такие как 2,2'-бис-(дифенилфосфино)1,1'-бинафтил, ксантфос, dppf, cy3p, Tol3P или смесь указанных лигандов, предпочтительно применяя 2,2'бис-(дифенилфосфино)-1,1'-бинафтил. Палладиевые реагенты включают Pd(oAc)2, Pd2(dba)3, Pd(dppf)Cl2,-9 023293Pd(pph3)2Cl2, Pd(pph3)4 и Pd(dba)2 и предпочтительно Pd2(dba)3. Реакционная температура может быть в диапазоне от комнатной температуры до 150C в зависимости от выбора растворителя и предпочтительно при температуре в диапазоне от 90 до 130C. Взаимодействие также можно осуществлять в условиях нагревания токами сверхвысокой частоты. Длительность взаимодействия может быть в диапазоне от 10 до 25 ч, предпочтителен период от 1 до 18 ч. На второй стадии вышеуказанного способа получения соединение формулы (14) в присутствии метансульфонилхлорида превращают в соединение формулы (15) в присутствии основания. Такое взаимодействие предпочтительно осуществляют в растворителе, таком как 1,4-диоксан, тетрагидрофуран, триэтиламин, толуол, пиридин, этилацетат, дихлорметан и тому подобное, или в смеси указанных растворителей и предпочтительно с использованием пиридина и дихлорметана. Взаимодействие осуществляют в присутствии основания, такого как карбонат натрия, карбонат калия, бикарбонат натрия, карбонат цезия,карбонат кальция, триэтиламин или N,N-диизопропилэтиламин и тому подобного, и в смеси указанных соединений и предпочтительно с использованием триэтиламина. Длительность взаимодействия может быть в диапазоне от 1 до 4 ч, предпочтителен период от 1 до 3 ч. На третьей стадии вышеуказанного способа получения соединение формулы (15) обрабатывают алкиламином с образованием соединения общей формулы (I). Данное взаимодействие предпочтительно осуществляют в растворителе, таком как этанол, тетрагидрофуран, толуол, этилацетат, вода, диметилформамид, диметилсульфоксид и тому подобное, или в смеси указанных соединений и предпочтительно с использованием диметилформамида. Длительность взаимодействия может быть в диапазоне от 16 до 30 ч, предпочтителен период от 22 до 26 ч. Исходное соединение формулы (12) синтезируют, как описано в способе получения 1. Исходные соединения формул (12) и (13) могут быть коммерчески доступными или могут быть получены общепринятыми способами или путем модификации с применением известного способа. Соединения формулы (I) могут также быть получены по схеме II, как показано ниже. Схема II В вышеуказанной формуле (13) символ "Z" означает галоген. Соединение формулы (12) подвергают взаимодействию с соединением формулы (13) с образованием соединения формулы (14). Гидроксильную группу соединения формулы (14) превращают в мезилатную группу с образованием соединения формулы (15). Соединение формулы (15) обрабатывают азидной солью с образованием соединения формулы(16). Соединение формулы (16) восстанавливают с образованием соединения формулы (I). На первой стадии вышеуказанного способа получения осуществляют сочетание соединения формулы (12) с соединением формулы (13) в присутствии катализаторов на основе 2,2'-бис-(дифенилфосфино)1,1'-бинафтила (BINAP) и палладия, получая соединение формулы (14). Данное взаимодействие преимущественно осуществляют в растворителе, таком как 1,4-диоксан, тетрагидрофуран, толуол, этилацетат,диметилформамид, диметилсульфоксид и тому подобное, или смеси указанных растворителей и предпочтительно с использованием 1,4-диоксана. На взаимодействие может влиять наличие основания, такого как трет-бутилат натрия, трет-бутилат калия, карбонат калия, гидроксид натрия, гидрид натрия, карбонат цезия или смеси указанных оснований, и предпочтительно использование трет-бутилата натрия. Взаимодействие осуществляют, используя фосфиновые лиганды, такие как 2,2'-бис-(дифенилфосфино)1,1'-бинафтил, ксантфос, dppf, cy3p, Tol3P, или смесь указанных лигандов, предпочтительно применяя 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил. Палладиевые реагенты включают Pd(oAc)2, Pd2(dba)3,Pd(dppf)Cl2, Pd(pph3)2Cl2, Pd(pph3)4 и Pd(dba)2, и предпочтительно Pd2(dba)3. Реакционная температура может быть в диапазоне от комнатной температуры до 150C в зависимости от выбора растворителя и предпочтительно при температуре в диапазоне от 90 до 130C. Взаимодействие также можно осуществлять в условиях нагревания токами сверхвысокой частоты. Длительность взаимодействия может быть в диапазоне от 10 до 25 ч, предпочтителен период от 1 до 18 ч. На второй стадии вышеуказанного способа получения, соединение формулы (14), в присутствии метансульфонилхлорида, превращают в соединение формулы (15), в присутствии основания. Такое взаимодействие предпочтительно осуществляют в растворителе, таком как 1,4-диоксан, тетрагидрофуран,триэтиламин, толуол, пиридин, этилацетат, дихлорметан и тому подобное, или в смеси указанных растворителей и предпочтительно с использованием пиридина и дихлорметана. Взаимодействие осуществляют в присутствии основания, такого как карбонат натрия, карбонат калия, бикарбонат натрия, карбонат цезия, карбонат кальция, триэтиламин или N,N-диизопропилэтиламин и тому подобного, и в смеси указанных соединений и предпочтительно с использованием триэтиламина. Длительность взаимодействия может быть в диапазоне от 1 до 4 ч, предпочтителен период от 1 до 3 ч. На третьей стадии вышеуказанного способа получения, соединение формулы (15) обрабатывают азидной солью с образованием соединения общей формулы (16). Данное взаимодействие преимущественно осуществляют в растворителе, таком как этанол, тетрагидрофуран, толуол, этилацетат, вода, диметилформамид, диметилсульфоксид или и тому подобное, или в смеси указанных растворителей и предпочтительно с использованием диметилформамида. Длительность взаимодействия может быть в диапазоне от 2 до 20 ч, предпочтителен период от 14 до 18 ч. Реакционная температура может быть в диапазоне от комнатной температуры до 150C, в зависимости от выбора растворителя и предпочтительно при температуре в диапазоне от 70 до 110C. На четвертой стадии вышеуказанного способа получения соединение формулы (16) восстанавливают с образованием соединения общей формулы (I). Данное взаимодействие преимущественно осуществляют в растворителе, таком как этанол, тетрагидрофуран, толуол, этилацетат, вода, диметилформамид,диметилсульфоксид и тому подобное, или в смеси указанных растворителей и предпочтительно с использованием смеси ТГФ и вода. На взаимодействие может влиять присутствие фосфиновых реагентов,таких как трициклогексилфосфин, триортотолилфосфин, трифенилфосфин, или смеси указанных реагентов и предпочтительно с использованием трифенилфосфина. Взаимодействие также может быть выполнено в атмосфере водорода с использованием палладиевых катализаторов, никеля Ренея и проч. Взаимодействие также может быть выполнено с использованием гидридных реагентов, таких как NiBH4, LiAlH4, DIBAL-H и проч. Длительность взаимодействия может быть в диапазоне от 12 до 20 ч, предпочтителен период от 14 до 18 ч. Температура взаимодействия может быть в диапазоне от -10 до 40C в зависимости от выбора растворителя и предпочтительна температура в диапазоне от -5 до 35C. Исходное соединение формулы (12) синтезируют, как описано в способе получения 1. Исходные соединения формул (12) и (13) могут быть коммерчески доступными или могут быть получены общепринятыми способами или путем модификации с применением известного способа. Соединения формулы (I) могут также быть получены по схеме III, как показано ниже Схема III В вышеуказанной формуле (13) символ "Z" означает галоген. Соединение формулы (17) подвергают взаимодействию с соединением формулы (13) с образованием соединения формулы (19). Снимают защиту соединения формулы (19), получая соединение формулы (I). На первой стадии вышеуказанного способа получения осуществляют сочетание соединения формулы (17) с соединением формулы (13) в присутствии растворителя, такого как дихлорметан, 1,4-диоксан,тетрагидрофуран, толуол, этилацетат, диметилформамид, диметилсульфоксид и тому подобное, или сме- 11023293 си указанных растворителей и предпочтительно использование дихлорметана. На взаимодействие может влиять наличие основания, такого как трет-бутилат натрия, трет-бутилат калия, карбонат калия, гидроксид натрия, гидрид натрия, карбонат цезия, диизопропилэтиламин, триэтиламин, или смеси указанных оснований и предпочтительно использование диизопропилэтиламина. Реакционная температура может быть в диапазоне от 20 до 40C в зависимости от выбора растворителя и предпочтительна температура в диапазоне от 25 до 35C. Длительность взаимодействия может быть в диапазоне от 0,5 до 2 ч, предпочтителен период от 1 до 1,5 ч. Необязательно, могут быть использованы дополнительные катализаторы типа 4-диметиламинопиридина (DMAP). На второй стадии вышеуказанного способа получения снимают защиту соединения формулы (19),получая соединение формулы (I), в присутствии растворителя, такого как этанол, тетрагидрофуран, толуол, этилацетат, диметилформамид, диметилсульфоксид и тому подобное, или смеси указанных растворителей и предпочтительно используя этанол. Взаимодействие выполняют в атмосфере водорода, используя палладиевые катализаторы. Длительность взаимодействия может быть в диапазоне от 1 до 5 ч,предпочтителен период от 2 до 4 ч. Реакционная температура может быть в диапазоне от 20 до 40C в зависимости от выбора растворителя и предпочтительна температура в диапазоне от 25 до 35C. Исходное соединение формулы (17) синтезируют, как описано в способе получения 2. Исходные соединения формул (17) и (13) могут быть получены общепринятыми способами или путем модификации с применением известного способа. Соединения, полученные вышеуказанным способом получения по настоящему изобретению, могут быть превращены в другое соединение по настоящему изобретению дополнительными химическими модификациями с использованием хорошо известных взаимодействий, таких как окисление, восстановление, введение защиты, снятие защиты, реакция перегруппировки, галогенирование, гидроксилирование,алкилирование, алкилтиолирование, деметилирование, O-алкилирование, O-ацилирование, Nалкилирование, N-алкенилирование, N-ацилирование, N-цианирование, N-сульфонилирование, реакция связывания с использованием переходных металлов и тому подобное. При необходимости, могут быть выполнены одна или несколько следующих стадий:i) превращение соединения формулы (I) в другое соединение формулы (I);ii) удаление любых защитных групп илиiii) получение фармацевтически приемлемой соли, сольвата или пролекарства. Способ (i) может быть осуществлен с использованием общепринятых методов взаимных превращений, таких как эпимеризация, окисление, восстановление, алкилирование и нуклеофильное или электрофильное ароматическое замещение, и сложноэфирный гидролиз или образование амидной связи. В способе (ii) подходящие аминозащитные группы включают сульфонил (например, тозил), ацил(например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), который удаляют гидролизом (например, с применением кислоты, такой как соляная или трифторуксусная кислота) или восстановительно (например, гидрогенолизом бензильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы с применением цинка в уксусной кислоте), в зависимости от ситуации. Другие подходящие аминозащитные группы включают трифторацетил, который может быть удален путем каталитического гидролиза, или бензильную группу, связанную с твердофазной смолой, такую как 2,6-диметоксибензильная группа, связанная со смолой Меррифилда (связующий агент Элмана), которая может быть удалена кислотным каталитическим гидролизом, например, с помощью трифторуксусной кислоты. В способе (iii) фармацевтически приемлемые соли могут быть получены обычно взаимодействием с соответствующей кислотой или кислотным производным, как описано подробно ранее. Некоторые соединения формулы (I) способны существовать в стереоизомерных формах (например,диастереомеры и энантиомеры), и изобретение охватывает каждую из таких стереоизомерных форм и смеси указанных форм, включая рацематы. Различные стереоизомерные формы могут быть отделены друг от друга общепринятыми способами, либо любой заданный изомер может быть получен стереоспецифическим или асимметрическим синтезом. Изобретение также распространяться на таутомерные формы и смеси таутомерных форм. Стереоизомеры, как правило, обычно получают в виде рацематов, которые могут быть разделены на оптически активные изомеры, по существу, известным способом. В случае соединений общей формулы(I), имеющих асимметрический атом углерода, настоящее изобретение касается D-формы, L-формы иD,L-смесей, и в случае соединения общей формулы (I), имеющего несколько асимметрических атомов углерода, диастереомерных форм, и изобретение охватывает каждую из таких стереоизомерных форм и соответствующие смеси, включая рацематы. Те соединения общей формулы (I), которые имеют асимметрический атом углерода и, как правило, могут быть получены в виде рацематов, можно отделять друг от друга общепринятыми способами, либо любой заданный изомер может быть получен стереоспецифическим или асимметрическим синтезом. Однако с самого начала, можно также использовать оптически активное соединение, тогда в качестве конечного соединения получают соответственно оптически активное энантиомерное или диастереомерное соединение. Стереоизомеры соединений общей формулы (I) могут быть получены одним или несколькими спо- 12023293i) один или несколько реагентов могут быть использованы в оптически активной форме;ii) оптически чистый катализатор или хиральные лиганды, наряду с металлическим катализатором,могут быть использованы в процессе восстановления. Металлическим катализатором может быть родий,рутений, индий и тому подобное. Хиральными лигандами предпочтительно могут являться хиральные фосфины;iii) смесь стереоизомеров может быть разделена общепринятыми способами, такими как получение диастереомерных солей с хиральными кислотами или хиральными аминами, или хиральными аминоспиртами, хиральными аминокислотами. Полученная смесь диастереомеров может быть затем разделена методами, такими как фракционированная кристаллизация, хроматография и тому подобное, с последующей дополнительной стадией выделения оптически активного продукта путем гидролиза производного;iv) смесь стереоизомеров может быть разделена общепринятыми способами, такими как микробиологическое разделение, разделение диастереомерных солей, образованных хиральными кислотами или хиральными основаниями. Хиральными кислотами, которые могут быть использованы, являются винная кислота, миндальная кислота, молочная кислота, камфорсульфоновая кислота, аминокислоты и тому подобное. Хиральными основаниями, которые могут быть использованы, являются алкалоиды хинного дерева, бруцин или основная аминокислота, такая как лизин, аргинин и тому подобное. В случае соединений общей формулы(I), имеющих геометрическую изомерию, настоящее изобретение касается всех таких геометрических изомеров. Подходящие фармацевтически приемлемые соли очевидны для специалистов в данной области и включают фармацевтически приемлемые соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с неорганическими кислотами, например соляной, бромистоводородной, серной, азотной или фосфорной кислотой, и органическими кислотами, например, такими как янтарная, малеиновая, уксусная, фумаровая, лимонная, яблочная, винная, бензойная, п-толуоловая, птолуолсульфоновая, метансульфоновая или нафталинсульфоновая кислота. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, составляющие часть данного изобретения, могут быть получены обработкой соединения формулы (I) 1-6 эквивалентами основания, такого как гидрид натрия, метилат натрия, этилат натрия, гидроксид натрия, трет-бутилат калия, гидроксид кальция, ацетат кальция, хлорид кальция, гидроксид магния, хлорид магния и тому подобное. Могут также быть использованы растворители, такие как вода, ацетон, простой эфир, ТТФ, метанол, этанол, трет-бутанол, диоксан, изопропанол,простой изопропиловый эфир или смеси указанных растворителей. Примеры Новые соединения по настоящему изобретению получены по следующим методикам с использованием соответствующих материалов, и способы получения дополнительно иллюстрируются следующими конкретными примерами. Наиболее предпочтительными соединениями по изобретению являются некоторые, либо все соединения, конкретно приведенные в данных примерах. Указанные соединения, однако,не рассматриваются как исключительно составляющие класс объектов, признанных изобретением, и любая комбинация соединений или соответствующих групп, может составлять класс объектов. Следующие примеры дополнительно иллюстрируют детали получения соединений по данному изобретению. Специалисты в данной области легко поймут, что известные изменения условий и технологического процесса следующих препаративных методик могут быть использованы для получения таких соединений. Предварительный синтез 1. Получение [2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3 ил]метанола. Стадия (i). Получение 5-(трет-бутилдифенилсиланилоксиметил)пирролидин-2-она. К охлажденному льдом раствору 5-гидроксиметилпирролидин-2-она (5 г, 43,4 ммоль) в дихлорметане (174 мл) добавляют имидазол (6,5 г, 95,5 ммоль), 4-диметиламинопиридин (530 мг, 4,3 ммоль) с последующим добавлением трет-бутилдифенилсилилхлорида (12,53 г, 45,57 ммоль). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакционную смесь разбавляют дихлорметаном, промывают водой, насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение, 15,37 г, в виде смолистой жидкости, которую используют для последующего взаимодействия без дополнительной очистки. 1H-ЯМР (CDCl3): 7,65-7,63 (м, 4H), 7,45-7,37 (м, 6H), 3,84-3,77 (м, 1H), 3,62 (дд, J=3,9, 10,2 Гц, 1H),3,50 (дд, J=7,7, 10,2 Гц, 1H), 2,40-2,30 (м, 2H), 2,20-2,11 (м, 1H), 1,76-1,67 (м, 1H), 1,05 (с, 9H); масса (m/z): 354 [M+H+]. Стадия (ii). Получение трет-бутилового эфира 2-(трет-бутилдифенилсиланилоксиметил)-5 оксопирролдидин-1-карболовой кислоты. К перемешиваемому раствору полученного выше соединения (15,35 г, 43,42 ммоль) в ацетонитриле ммоль). После перемешивания в течение 16 ч при комнатной температуре реакционную смесь разбавляют этилацетатом, промывают водой, насыщенным раствором соли и сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении и сырой продукт очищают колоночной флэшхроматографией, используя силикагель 230-400 меш, что дает указанное в заголовке соединение, 18,28 г,в виде твердого вещества. Выход: 93% на две стадии. Температурный интервал плавления: 105,9-108,3C. ИК (см-1): 2953, 2930, 1747, 1709, 1471, 1431, 1311, 1111, 742, 705; 1H-ЯМР (CDCl3): 7,64-7,56 (м, 4H), 7,46-7,35 (м, 6H), 4,22-4,19 (м, 1H), 3,89 (дд, J=4,2, 10,5 Гц, 1H),3,70 (дд, J=2,3, 10,5 Гц, 1H), 2,78 (ддд, J=10,4, 10,4, 17,6 Гц, 1H), 2,44 (ддд, J=3,2, 8,8, 17,6 Гц, 1H), 2,222,07 (м, 2H), 1,43 (с, 9H), 1,04 (С, 9H); масса (m/z): 454 [M+H+]. Стадия (iii). Получение трет-бутилового эфира 2-(трет-бутилдифенилсиланилоксиметил)-5 гидроксипирролидин-1-карбоновой кислоты. К перемешиваемому раствору полученного выше соединения (18,27 г, 40,28 ммоль) в тетрагидрофуране (160 мл) при -78C добавляют раствор литийтриэтилборгидрида (1 М в тетрагидрофуране, 44,3 мл). После перемешивания в течение 1 ч реакционную смесь гасят добавлением насыщенного раствора натрийбикарбоната (68 мл). Реакционную смесь нагревают до 0C, добавляют перекись водорода (30% м/о, 1,3 мл) и перемешивают в течение 20 мин. Два слоя разделяют, водный слой экстрагируют дихлорметаном и объединенный органический слой сушат над безводным сульфатом натрия. Растворитель удаляют при пониженном давлении, получая указанное в заголовке соединение, 20,0 г, в виде смолистой жидкости, которое достаточно чистое для применения в последующем взаимодействии. Выход: 95,7%. ИК (см-1): 3444, 2960, 2931, 1681, 1392, 1166, 1112, 702; 1(м, 1H), 3,75-3,52 (м, 2H), 2,25-2,15 (м, 1H), 2,10-1,82 (м, 3H), 1,51 (с, 3H), 1,34 (с, 6H), 1,06 (с, 9H); масса (m/z): 456 [M+H+]. Стадия (iv). Получение трет-бутилового эфира 2-(трет-бутилдифенилсиланилоксиметил)-5 метоксипирролидин-1-карбоновой кислоты. К охлажденному льдом раствору полученного выше соединения (18,34 г, 40,2 ммоль) в метаноле(160 мл) добавляют пиридинийпаратолуолсульфонат (p-PTS, 1,0 г, 4,02 ммоль). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают в течение 2 ч. Добавляют триэтиламин(1,2 мл, 8,04 ммоль), летучие вещества удаляют при пониженном давлении и сырой продукт очищают на колонке для флэш-хроматографии, используя силикагель, 230-400 меш, что дает изомерную смесь указанного в заголовке соединения, 18,1 г, в виде смолистой жидкости. Выход: 95,7%. ИК (см-1): 2958, 2931, 1701, 1390, 1366, 1163, 1112, 1085, 757, 702; 1(с, 9H); масса (m/z): 492 [M+Na+]. Стадия (v). Получение трет-бутилового эфира 2-(трет-бутилдифенилсиланилоксиметил)-2,3 дигидропиррол-1-карбоновой кислоты. Смесь полученного выше соединения (18,1 г, 38,5 ммоль) и хлорида аммония (311 мг, 5,7 ммоль) нагревают при 150C при пониженном давлении (50 мбар) в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и очищают на колонке для флэш-хроматографии, используя силикагель, 230400 меш, что дает указанное в заголовке соединение, 14,6 г, в виде смолистой жидкости. Выход: 86,5%. ИК (см-1): 2959, 2930, 2857, 1701, 1404, 1132, 1112, 762, 741, 701; 1H-ЯМР (CDCl3): 7,66-7,60 (м, 4H), 7,45-7,32 (м, 6H), 6,49 (д, J=43,3 Гц, 1H), 4,95 (д, J=34,1 Гц, 1H),4,25 (д, J=42,0 Гц, 1H), 3,90-3,58 (м, 2H), 2,90-2,65 (м, 2H), 1,46 (с, 3H), 1,32 (с, 6H), 1,04 (с, 9H); масса (m/z): 438 [M+H+]. Стадия (vi). Получение трет-бутилового эфира 3-(трет-бутилдифенилсиланилоксиметил)-2 азабицикло[3.1.0]гексан-2-карбоновой кислоты. К охлажденному льдом раствору полученного выше соединения (2,0 г, 4,56 ммоль) в дихлорметане(18 мл) добавляют раствор диэтилцинка (1 М в гексане, 5,0 мл) с последующим добавлением дииодметана (0,55 мл, 6,84 ммоль) за период 15 мин и перемешивают в течение 30 мин. Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 3 ч. pH реакционной смеси доводят до 8 добавлением насыщенного раствора бикарбоната натрия. Два слоя разделяют и водный слой экстрагируют дихлорметаном. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, растворитель выпаривают при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, используя силикагель 230-400 меш, что дает указанное в заголовке соединение, 1,5 г, в виде смолистой жидкости. Выход: 73%. ИК (см-1): 2960, 2931, 2857, 1698, 1391, 1178, 1130, 1112, 1090, 702; 1 0,38-0,30 (м, 1H); масса (m/z): 452 [M+H+]. Стадия (vii). Получение трет-бутилового эфира 3-гидроксиметил-2-азабицикло[3.1.0]гексан-2 карбоновой кислоты. К охлажденному льдом раствору полученного выше соединения (16,8 г, 37,1 ммоль) в сухом тетрагидрофуране (104 мл) добавляют тетрабутиламмонийфторид (1 М в тетрагидрофуране, 37,1 мл) за период 10 мин. Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 12 ч. Летучие вещества удаляют при пониженном давлении и сырой продукт очищают колоночной флэшхроматографией, получая указанное в заголовке соединение, 7,0 г, в виде смолистой жидкости. Выход: 88,6%. ИК (см-1): 3417, 2976, 2878, 1694, 1669, 1403, 1255, 1175, 1133, 1085, 773; 1H-ЯМР (CDCl3): 4,90 (уш.с, 1H), 3,75-3,65 (м, 1H), 3,63-3,55 (м, 2H), 3,27 (ддд, J=2,3, 6,2, 8,5 Гц,1H), 2,16 (дд, J=8,3, 13,1 Гц, 1H), 1,82-1,70 (м, 1H), 1,52-1,44 (м, 1H), 1,49 (с, 9H), 0,78-0,68 (м, 1H), 0,430,35 (м, 1H); масса (m/z): 214 [M+H+]. Стадия (viii). Получение (2-азабицикло[3.1.0]гекс-3-ил)метанола. К охлажденному льдом раствору трет-бутилового эфира 3-гидроксиметил-2 азабицикло[3.1.0]гексан-2-карбоновой кислоты (полученного согласно предварительному синтезу 1) (6,5 г, 14,41 ммоль) в изопропаноле (7 мл) добавляют раствор сухого гидрохлорида в изопропаноле (3 М, 28 мл), реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 16 ч. Реакционную смесь разбавляют раствором аммиака в метаноле (7 М, 14 мл) и летучие вещества удаляют при пониженном давлении. Сырой продукт очищают колоночной флэш-хроматографией, используя силикагель 230-400, что дает указанное в заголовке соединение, 1,51 г. Выход: 93%. ИК (см-1): 3348, 2934, 2866, 1666, 1398, 1086, 1044, 1021, 816, 758; 1H-ЯМР (CDCl3): 3,57 (дд, J=3,6, 10,9 Гц, 1H), 3,42 (дд, J=4,6, 10,9 Гц, 1H), 3,15-3,07 (м, 1H), 2,822,74 (м, 1H), 1,94-1,80 (м, 2H), 1,46-1,38 (м, 1H), 0,52-0,47 (м, 1H), 0,46-0, 38 (м, 1H); масса (m/z): 114 [M+H+]. Стадия (ix). Получение [2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-ил]метанола. К перемешиваемому раствору (2-азабицикло[3.1.0]гекс-3-ил)метанола (750 мг, 6,63 ммоль) (полученного на стадии (i в сухом 1,4-диоксане (20 мл) в реакционный сосуд под давлением добавляют 3,5 дибромпиридин (1,57 г, 6,63 ммоль), трет-бутилат натрия (700 мг, 7,3 ммоль) и рацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (207 мг, 0,33 ммоль). Реакционную смесь дегазируют в течение 30 мин,затем добавляют трис-(дибензилиденацетон)дипалладий(0) (122 мг, 0,133 ммоль). Устанавливают навинчивающуюся крышку на реакционный сосуд, температуру взаимодействия постепенно повышают до 110C и реакционную смесь перемешивают при указанной температуре 16 ч. Реакционную смесь охлаждают до комнатной температуры, разбавляют насыщенным бикарбонатом натрия и экстрагируют этилацетатом. Объединенный органический слой сушат над безводным сульфатом натрия, растворитель удаляют при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, используя силикагель 230-400, что дает указанное в заголовке соединение, 600 мг, в виде твердого вещества. Выход: 33%. Температурный интервал плавления: 90,4-93,5C. ИК (см-1): 3242, 2934, 2893, 1573, 1538, 1456, 1379, 1193, 1004, 688, 573; 1(м, 1H), 2,10 (дд, J=7,7, 13,0 Гц, 1H), 1,82-1,72 (м, 1H), 1,05-0,96 (м, 1H), 0,28-0,21 (м, 1H); масса (m/z): 269, 271 [M+H+]. Предварительный синтез 2. Получение 3-[N-(бензилоксикарбонил)-N-(метил)аминометил]-2 азабицикло[3.1.0]гексана. Стадия (i). Получение трет-бутилового эфира 3-метансульфонилоксиметил-2-азабицикло[31.0]гексан-2-карбоновой кислоты. К охлажденному льдом раствору трет-бутилового эфира 3-гидроксиметил-2 азабицикло[3.1.0]гексан-2-карбоновой кислоты (2,52 г, 11,83 ммоль) в сухом дихлорметане (10 мл) добавляют триэтиламин (2,5 мл, 17,75 ммоль) с последующим добавлением метансульфонилхлорида (1,0 мл, 13,01 ммоль). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают в течение 1 ч. Реакционную смесь разбавляют дихлорметаном. Органический слой промывают насыщенным раствором бикарбоната натрия, затем насыщенным раствором соли, сушат над безводным сульфатом натрия, растворитель выпаривают при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, используя 230-400 меш силикагель, что дает указанное в заголовке соединение, 3,09 г, в виде смолистой жидкости. Выход: 90%. 1 Стадия (ii). Получение трет-бутилового эфира 3-метиламинометил-2-азабицикло[3.1.0]гексан-2 карбоновой кислоты. К перемешиваемому раствору полученного выше соединения (3,09 г, 10,61 ммоль) в диметилформамиде (23 мл) добавляют 40% (м/о) водный раствор диметиламина (23 мл). После перемешивания в течение 24 ч реакционную смесь разбавляют насыщенным раствором хлорида натрия (150 мл) и 2,5 М раствором гидроксида натрия (23 мл) и экстрагируют этилацетатом. Объединенный органический слой сушат над безводным сульфатом натрия, растворитель удаляют при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, используя силикагель 230-400 меш, что дает требуемое соединение, 1,95 г. Выход: 85%. ИК (см-1): 3396, 3322, 2959, 2928, 1629, 1592, 1485, 1389, 1195, 1044, 955, 861, 770; 1(iii). Получение трет-бутил-3-[N-(бензилоксикарбонил)-N-(метил)аминометил]-2 азабицикло[3.1.0]гексан-2-карбоксилата. К охлажденному льдом раствору полученного выше соединения (2,0 г, 8,85 ммоль) в сухом тетрагидрофуране (35 мл) добавляют безводный карбонат калия (1,84 г, 13,3 ммоль) с последующим добавлением 50% м/о раствора бензилхлороформиата в толуоле (3,4 мл, 9,74 ммоль). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 16 ч при комнатной температуре. Реакционную смесь разбавляют водой и водный слой экстрагируют дихлорметаном. Объединенный органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, растворитель выпаривают при пониженном давлении и сырой продукт очищают колоночной флэшхроматографией, используя силикагель 230-400 меш, что дает указанное в заголовке соединение, 2,0 г, в виде смолистой жидкости. Выход: 63%. ИК (см-1): 2958, 2930, 1697, 1586, 1404, 1252, 1175, 1127, 1085, 755; 1(iv). Получение 3-[N-(бензилоксикарбонил)-N-(метил)аминометил]-2 азабицикло[3.1.0]гексана. К охлажденному льдом раствору полученного выше соединения (1,8 г, 5,0 ммоль) в сухом дихлорметане (5 мл) добавляют трифторуксусную кислоту (5 мл). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 6 ч при комнатной температуре. Выпаривают летучие вещества при пониженном давлении, остаток разбавляют дихлорметаном. Органический слой промывают насыщенным раствором бикарбоната натрия и затем насыщенным раствором соли, сушат над безводным сульфатом натрия, растворитель выпаривают при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, используя силикагель 230-400 меш, что дает указанное в заголовке соединение, 1,09 г. Выход: 85%. ИК (см-1): 3316, 2931, 1699, 1585, 1485, 1402, 1300, 1151, 1079, 767, 742; 1H-ЯМР (CDCl3): 7,42-7,28 (м, 5H), 5,12 (с, 2H), 3,45-3,35 (м, 1H), 3,30-3,05 (м, 2H), 2,98 (с, 3H),2,82-2,72 (м, 1H), 2,05-1,88 (м, 1H) 1,60-1,55 (м, 1H), 1,45-1,35 (м, 1H), 0,60-0,50 (м 1H), 0,38-0,30 (м, 1H); масса (m/z): 261 [M+H+]. Пример 1. Получение N-[2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]диметиламин гидрохлорида. Стадия (i). Получение 2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметилметансульфоната. К охлажденному льдом раствору [2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-ил]метанола(462 мг, 2,43 ммоль) в сухом дихлорметане (10 мл) добавляют триэтиламин (0,51 мл, 3,6 ммоль) с последующим добавлением метансульфонилхлорида (334 мг, 2,92 ммоль). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 1 ч. Летучие вещества удаляют при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, получая указанное в заголовке соединение, 586 мг, в виде смолистой жидкости. Выход: 90%. 1(м, 1H), 1,13-1,05 (м, 1H); масса (m/z): 347, 349 [M+H+]. Стадия (ii). Получение N-[2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гекс-3-илметил]диметиламин гидрохлорида. К перемешиваемому раствору полученного выше соединения (560 мг, 2,09 ммоль) в диметилформамиде (4 мл) добавляют 40% (м/о) водный раствор диметиламина (4 мл). После перемешивания в течение 24 ч реакционную смесь разбавляют насыщенным раствором хлорида натрия (30 мл) и 2,5 М раствором гидроксида натрия (4 мл) и экстрагируют этилацетатом. Объединенный органический слой сушат над безводным сульфатом натрия, растворитель удаляют при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией, используя силикагель 230-400 меш. Полученный таким образом продукт перемешивают с сухим хлористым водородом в изопропаноле (3 М, 4 мл) в течение 10 мин, летучие вещества удаляют при пониженном давлении и остаток порошкуют с диэтиловым эфиром,получая указанное в заголовке соединение, 215 мг, Выход: 40%. ИК (см-1): 3408, 2943, 2820, 2768, 1677, 1573, 1458, 1370, 1099, 997; 1(м, 3H), 2,87 (д, J=4,6 Гц, 3H), 2,83 (д, J=4,6 Гц, 3H), 2,35 (дд, J=7,1, 13,1 Гц, 1H), 2,10 (дд, J=7,9, 13,1 Гц,1H), 1,84-1,77 (м, 1H), 1,0-0,92 (м, 1H), 0,28-0,21 (м, 1H); масса (m/z): 296, 298 [M+H+]. Пример 2. Получение [2-(5-бромпиридин-3-ил)-2-азабицикло-[3.1.0]-гекс-3-ил]метиламина. Стадия (i). Получение 3-азидометил-2-(5-бромпиридин-3-ил)-2-азабицикло[3.1.0]гексана. К перемешиваемому раствору метансульфоната (как получено на стадии (i) примера 1) (215 мг, 0,62 ммоль) в сухом диметилфуране (2 мл) добавляют азид натрия (180 мг, 2,77 ммоль). Реакционную смесь постепенно нагревают до 90C и перемешивают 16 ч. По завершении взаимодействия реакционную смесь разбавляют диэтиловым эфиром, промывают водой, насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель удаляют при пониженном давлении. Сырой продукт очищают колоночной флэш-хроматографией на силикагеле, получая указанное в заголовке соединение в виде смолистой жидкости, 164 мг. Выход: 90%. 1H-ЯМР (CDCl3): 8,14 (д, J=2,5 Гц, 1H), 8,0 (д, J=2,0 Гц, 1H), 7,25 (м, 1H), 3,90-3,80 (м, 1H), 3,44 (дд,J=5,7, 8,3 Гц, 2H), 3,18-3,12 (м, 1H), 2,25-2,15 (м, 2H), 1,90-1,80 (м, 1H), 1,12-1,03 (м, 1H), 0,33-0,28 (м,1H); масса (m/z): 294, 296 [M+H+]. Стадия (ii). Получение [2-(5-бромпиридин-3-ил)-2-азабицикло-[3.1.0]-гекс-3-ил]метиламина. К перемешиваемому раствору полученного выше соединения (175 мг, 0,6 ммоль) в тетрагидрофуране при температуре охлаждения льдом добавляют трифенилфосфин (173 мг, 1,06 ммоль) и воду (32 мкл, 1,8 ммоль). Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 16 ч. Летучие вещества удаляют при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией на силикагеле, получая указанное в заголовке соединение, 98 мг. Выход: 63%. ИК (см-1): 3584, 3365, 2935, 2871, 1572, 1458, 1370, 1237, 1202, 1101, 996, 841; 1(i). Получение фуран-2-ил-[3-[(N-бензилоксикарбонил-N-метил)аминометил]-2 азабицикло[3.1.0]гекс-2-ил]метанона. К перемешиваемому раствору 3-[N-(бензилоксикарбонил)-N-(метил)аминометил]-2 азабицикло[3.1.0]гексана (210 мг, 0,81 ммоль) в дихлорметане (2 мл), охлажденному до 0C, в инертной атмосфере добавляют диизопропилэтиламин (0,42 мл, 2,4 ммоль), 4-диметиламинопиридин (0,1 ммоль) и раствор хлорангидрида кислоты (0,09 мл, 0,89 ммоль) в дихлорметане (2 мл) за период 30 мин. Реакционную смесь постепенно нагревают до комнатной температуры и перемешивают 1 ч. По завершении взаимодействия реакционную смесь разбавляют холодной водой и экстрагируют дихлорметаном. Объединенный органический слой сушат над безводным бисульфатом натрия и растворитель удаляют при пониженном давлении. Сырой продукт очищают колоночной флэш-хроматографией на силикагеле, получая 206 мг смеси двух изомеров. Выход: 73%. ИК (см-1): 2936, 1699, 1626, 1484, 1406, 1300, 1198, 1142, 1066, 700; 1H-ЯМР (CDCl3): 7,55 (с, 1H), 7,40-7,30 (м, 5H), 7,20 (с, 0,5H), 7,17 (с, 0,5H), 6,50 (с, 1H), 5,12 (с,2H), 4,73-4,62 (м, 1H), 3,70-3,50 (м, 3H), 3,01 (с, 3H), 2,22-2,0 (м, 1H), 1,96-1,65 (м, 2H) 1,20-1,02 (м, 1H),0,61-0,52 (м 1H); масса (m/z): 355 [M+H+]. Стадия (ii). Получение фуран-2-ил-(3-метиламинометил-2-азабицикло[3.1.0]гекс-2-ил)метанон тартрата (изомеры). К перемешиваемому раствору фуран-2-ил-[3-[(N-бензилоксикарбонил-N-метил)аминометил]-2 азабицикло[3.1.0]гекс-2-ил]метанона (124 мг, 0,35 ммоль) в этаноле (2 мл), в атмосфере водорода добавляют палладий на угле (13 мг, 10% м/м). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь фильтруют. Растворитель удаляют при пониженном давлении и сырой продукт очищают колоночной флэш-хроматографией на силикагеле, получая два изомера фуран-2-ил-(3 метиламинометил-2-азабицикло[3.1.0]гекс-2-ил)метанонтартрата (20 и 36 мг соответственно). Выход: 73%. Данные характеризации фуран-2-ил-(3-метиламинометил-2-азабицикло[3.1.0]гекс-2 ил)метанонтартрата (изомер-1). ИК (см-1): 3377, 2925, 1627, 1595, 1486, 1379, 1198, 1082, 955, 861;
МПК / Метки
МПК: A61P 25/22, A61P 25/04, C07D 405/06, A61P 25/20, A61P 3/04, A61K 31/403, A61P 25/08, A61P 25/18, A61P 25/16, C07D 403/06, C07D 401/14, C07D 401/06, C07D 403/04, A61P 25/24, A61P 25/28, A61P 25/30, C07D 401/04
Метки: никотинового, нейронального, рецептора, alpha;4β2, лиганды, ацетилхолинового
Код ссылки
<a href="https://eas.patents.su/30-23293-ligandy-nejjronalnogo-nikotinovogo-acetilholinovogo-receptora-alpha4beta2.html" rel="bookmark" title="База патентов Евразийского Союза">Лиганды нейронального никотинового ацетилхолинового рецептора α4β2</a>
Предыдущий патент: Винтовой дюбель для крепления рельса
Следующий патент: Фармацевтическая композиция, содержащая солифенацин
Случайный патент: Способ получения поглощающего покрытия на основе золь-гель технологии для гелиотермических систем