Производные гидроксиалкилиндолкарбазола, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 6201
Опубликовано: 27.10.2005
Авторы: Прюдом Мишель, Моро Паскаль, Пфайфер Брюно, Марминон Кристель, Пьер Ален, Ренар Пьер, Хикман Джон, Бизо-Эспьяр Жан-Ги
Формула / Реферат
1. Соединения формулы (I)

в которой R1 и R2, которые могут быть одинаковыми или разными, каждый, независимо друг от друга, представляет собой группу, выбранную из водорода, линейного или разветвленного (C1-C6)алкила, арил(C1-C6)алкила, в котором алкильная часть может быть линейной или разветвленной, гидрокси, линейного или разветвленного (C1-C6)гидроксиалкила, линейного или разветвленного дигидрокси(C1-C6)алкила, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкокси(C1-C6)алкила, аминогруппы и линейного или разветвленного (C1-C6)аминоалкила, амино-часть в каждой группе необязательно замещена одной или двумя одинаковыми или разными группами, выбранными из линейного или разветвленного (C1-C6)алкила, арила и арил(C1-C6)алкила, в котором алкильная часть может быть линейной или разветвленной,
Ra и Rb, которые могут быть одинаковыми или разными, каждый независимо друг от друга, представляет собой линейную или разветвленную (C1-C6)алкиленовую цепь,
X1, X2 и X3, которые могут быть одинаковыми или разными, каждый, независимо друг от друга, представляет собой группу, выбранную из гидрокси, линейного или разветвленного (C1-C6)алкокси, арилокси, арил(C1-C6)алкокси, в котором алкоксильная часть может быть линейной или разветвленной, линейного или разветвленного (C1-C6)алкила, аминогруппы (необязательно замещенной одной или двумя одинаковыми или разными линейными или разветвленными (C1-C6)алкильными группами), галогена, линейного или разветвленного (C1-C6)алкилкарбонилокси и азидо,
X4 представляет собой метилиденовую группу или группу формулы -Rc-X1, в которой Rc представляет собою простую связь или метиленовую группу и X1 имеет значения, указанные выше,
их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием,
где под "арильной группой" подразумевается фенильная или нафтильная группа и под "изомерами" подразумеваются оптические изомеры.
2. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R1 представляет собой атом водорода, линейную или разветвленную (C1-C6)алкильную группу или линейную или разветвленную (C1-C6)гидроксиалкильную группу, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R2 представляет собой атом водорода.
4. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что Ra и Rb являются одинаковыми и представляют собой линейную (C1-C3)алкиленовую цепь, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что X1, X2 и X3, каждый представляет собой группу, выбранную из гидрокси, линейного или разветвленного (C1-C6)алкокси и линейного или разветвленного (C1-C6)алкилкарбонилокси, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что X4 представляет собой группу, выбранную из -Rc-X1 групп, в которых Rc представляет собой метиленовую группу и X1 представляет собой группу, выбранную из гидрокси, галогена, линейного или разветвленного (C1-C6)алкокси и (C1-C6)алкилкарбонилокси, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что они представляют собой соединения формулы (IA)
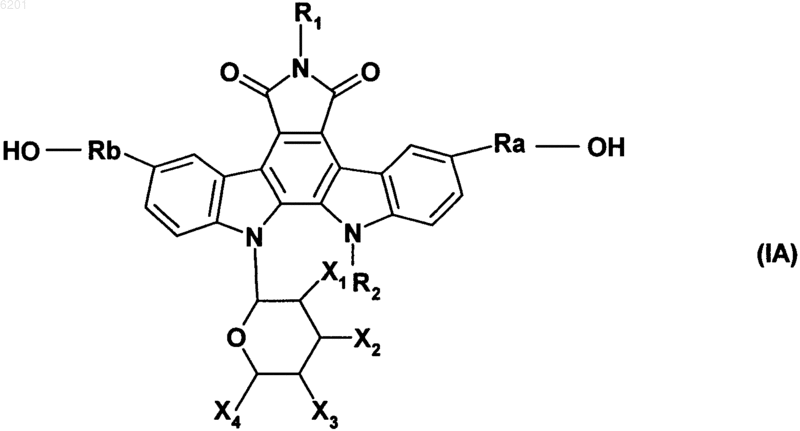
в которой R1, R2, Ra, Rb, X1, X2, X3 и X4 имеют значения, указанные для формулы (I),
их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3,9-бис(гидроксиметил)-12-(4-O-метил-b-D-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]-карбазол-5,7(6H)-дион, его изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Способ получения соединений формулы (I) в соответствии с п.1, характеризующийся тем, что в качестве исходного вещества применяют соединение формулы (II)
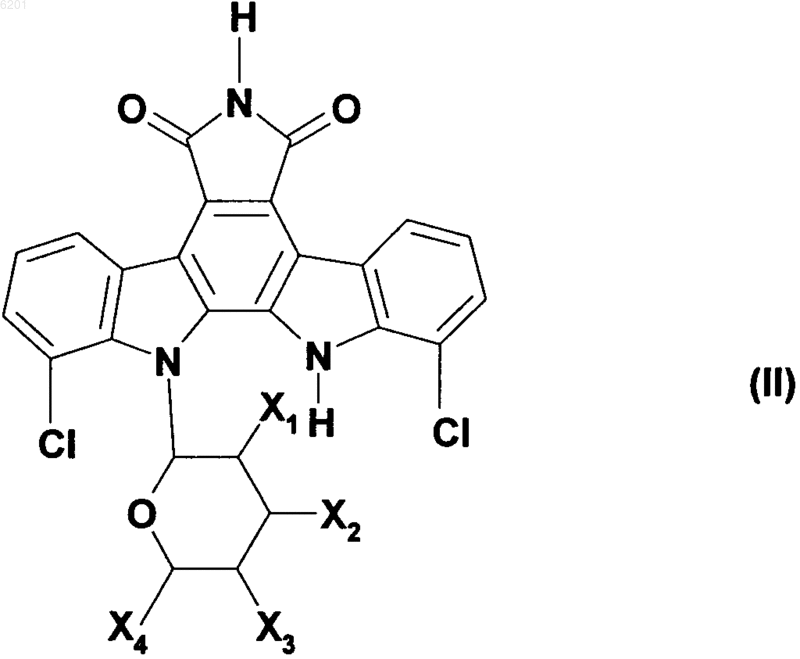
в которой X1, X2, X3 и X4 имеют значения, указанные для формулы (I),
в котором соединение формулы (II) подвергают гидрогенолизу в присутствии никеля Ренея и раствора гидроокиси натрия, получая соединение формулы (III)

в которой X1, X2, X3 и X4 имеют значения, указанные выше,
в которой соединение формулы (III) подвергают реакции с соединением формулы (IV)
R1-NH2 (IV),
в которой R1 имеет значения, указанные для формулы (I),
получая соединение формулы (V)
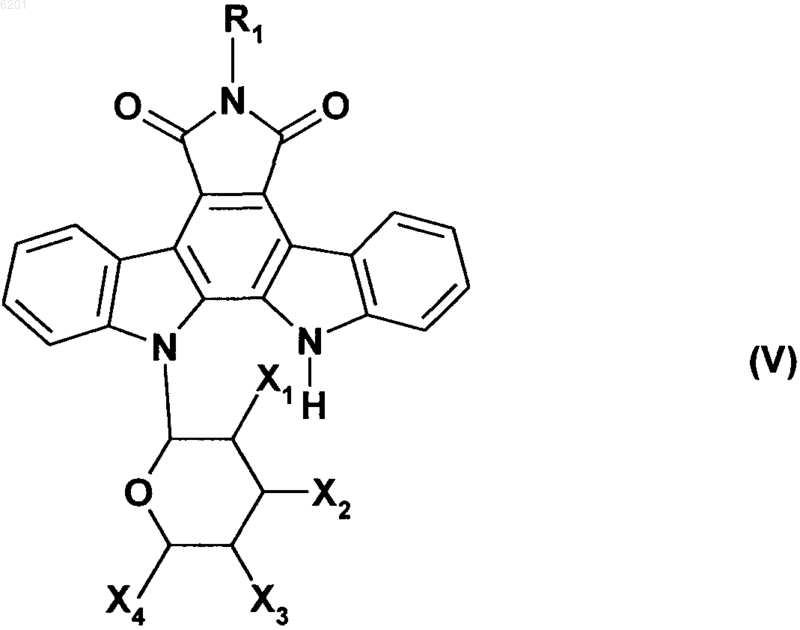
в которой R1, X1, X2, X3 и X4 имеют значения, указанные выше,
в которой соединение формулы (V) подвергают реакции с метиловым эфиром a,a-дихлорметила в присутствии кислоты Льюиса, получая соединение формулы (VI)
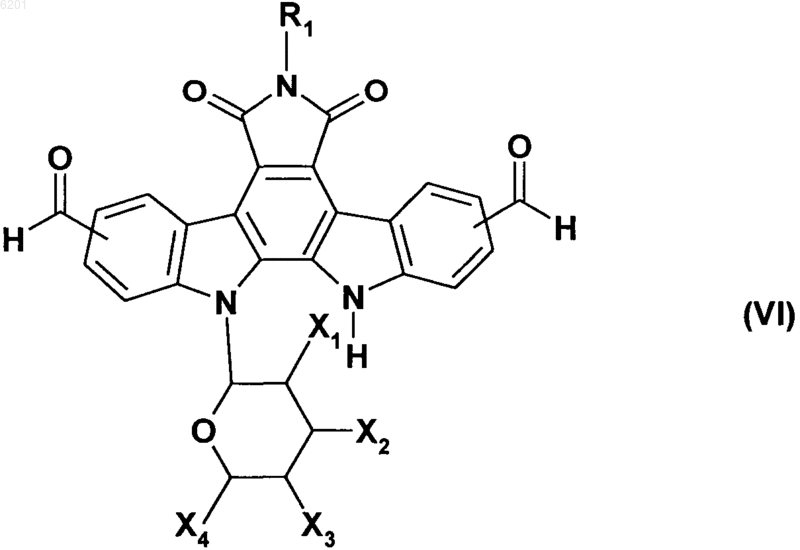
в которой R1, X1, X2, X3 и X4 имеют значения, указанные выше,
альдегидные функциональные группы в соединении формулы (VI) восстанавливают путем взаимодействия с восстановителем, который обычно применяется при органическом синтезе, получая соединение формулы (I/a), частный случай соединений формулы (I)
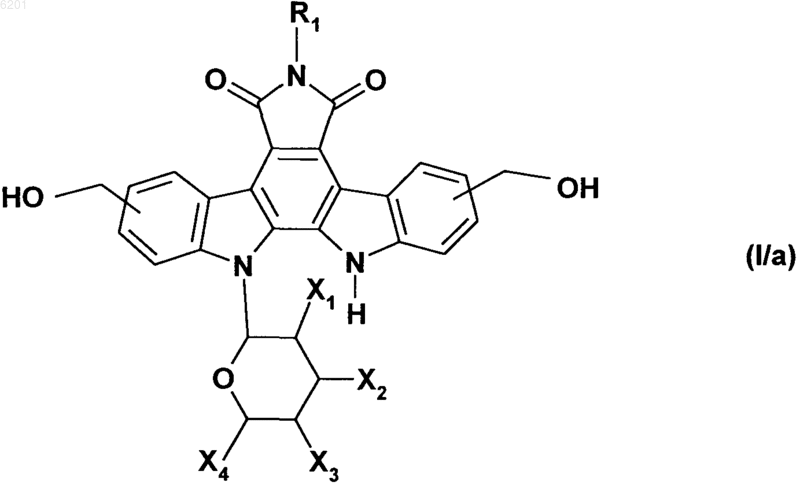
в которой R1, X1, X2, X3 и X4 имеют значения, указанные выше,
затем соединение формулы (I/a) превращают в его соответствующее дигалогенированное соединение в соответствии с обычными условиями органической химии и затем подвергают реакции с цианидом щелочи в присутствии диметилсульфоксида, получая соединение формулы (VII)
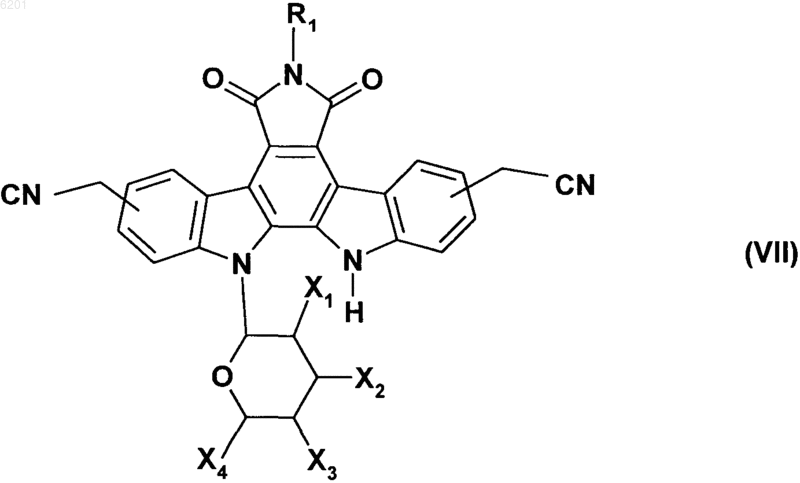
в которой R1, X1, X2, X3 и X4 имеют значения, указанные выше,
в которой соединение формулы (VII) превращают в сложный эфир в соответствии со стандартными условиями и затем подвергают взаимодействию с восстановителем, получая соединение формулы (I/b), частный случай соединений формулы (I)
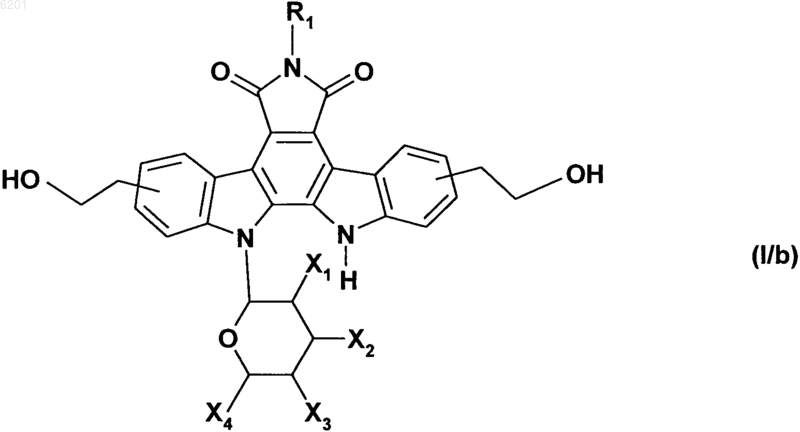
в которой R1, X1, X2, X3 и X4 имеют значения, указанные выше,
соединение формулы (I/b) может снова и повторно подвергаться идентичным реакциям, при которых получают соединения формул (VII) и (I/b), исходя из соединений формулы (I/a), получая соединение формулы (I/c), частный случай соединений формулы (I)

в которой R1, X1, X2, X3 и X4 имеют значения, указанные выше, и
Ra и Rb имеют значения, указанные для формулы (I),
затем соединение формулы (I/с) может подвергаться взаимодействию с соединением формулы (VIII)
R2a-Hal (VIII),
в которой R2a имеет такие же значения, как указано для R2 в формуле (I), за исключением атома водорода,
с получением соединения формулы (I/d), частного случая соединений формулы (I)
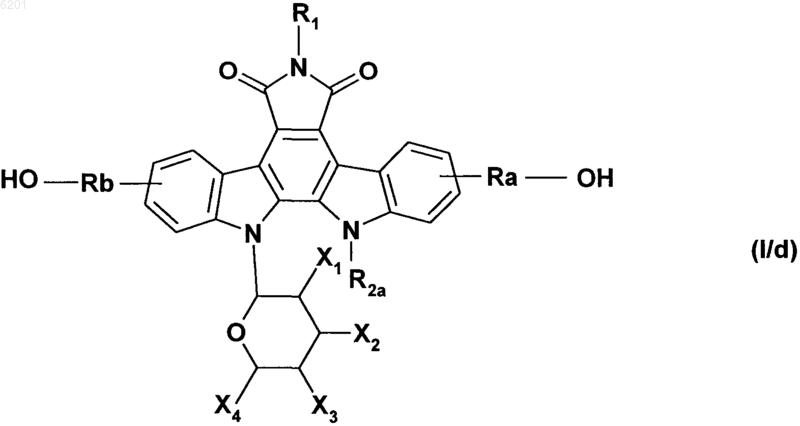
в которой R1, Ra, Rb, X1, X2, X3, X4 и R2a имеют значения, указанные выше,
соединения формул (I/a)-(I/d) составляют множество соединений формулы (I), которые необязательно очищают в соответствии с обычными способами очистки, можно, при необходимости, разделить на их различные изомеры в соответствии с обычными способами разделения, заместители X1, X2, X3 и X4 которых можно модифицировать в соответствии с обычными способами органического синтеза, которые используются в области химии сахаров, и соединения, при необходимости, превращают в их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Фармацевтическая композиция, содержащая в качестве активного компонента по крайней мере одно соединение в соответствии с одним из пп.1-8, в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями.
11. Применение фармацевтической композиции в соответствии с п.10 в качестве ингибитора киназы гликогенсинтазы GSK-3.
12. Применение фармацевтической композиции в соответствии с п.10 в качестве лекарственного средства для лечения диабета II-го типа, ожирения, нарушений центральной нервной системы, болезни Альцгеймера, болезни Паркинсона и для ингибирования апоптоза нормальных клеток, который вызывается противораковым лечением.
Текст
006201 Настоящее изобретение относится к новым соединениям гидроксиалкилиндолокарбазола, к способу их получения и к фармацевтическим композициям, которые их содержат. Соединения согласно настоящему изобретению являются производными ребеккамицина, который обладает ингибирующим действием по отношению к топоизомеразе I, вследствие чего он является особенно полезным для лечения опухолей. Многочисленные химические модификации ребеккамицина для улучшения терапевтических свойств осуществляются как по отношению к функциональным группам,имеющимся в молекуле (WO 98/07433), так и по отношению к их положению в гексациклической структуре (WO 00/64917). Соединения, описанные заявителем, неожиданно обнаруживают избирательное ингибирующее действие по отношению к семейству киназ, и более специфически, по отношению к киназе GSK-3 (киназе гликогенсинтазы). Киназа гликогенсинтазы 3 находится в большинстве тканей человека (мышцах, печени, поджелудочной железе, сердце, кишечнике и т.д.). Этот фермент вовлечен в метаболический путь передачи сигнала при помощи инсулина. Соответственно инсулин, путем передачи сигнала при помощи РI3-киназы,ингибирует GSK-3, что приводит к увеличению синтеза запасов в виде гликогена. GSK-3 также фосфорилирует белковые субстраты инсулина, вызывая десенсибилизацию метаболических путей передачи сигнала при помощи инсулина. Эксперименты, проведенные на крысах Zucker (которые страдают от ожирения и диабета) показали, что ингибирование GSK-3 проводит к увеличению переноса глюкозы. Эти данные также подтверждают то, что активность GSK-3 повышается на некоторых моделях или при некоторых патологических состояниях у животных и у людей (диабет II-го типа). Кроме того, некоторые исследования свидетельствуют о том, что ингибирование активности GSK-3 предотвращает гибель нейронов у пациентов с нейродегенеративными нарушениями, а также предотвращает гибель здоровых клеток у пациентов, страдающих от опухолевых заболеваний, которые поддаются лечению при помощи цитотоксических средств. Таким образом, соединения, способные ингибировать синтез GSK-3, являются особенно пригодными для лечения диабета II-го типа, ожирения, нарушений центральной нервной системы, болезни Альцгеймера и болезни Паркинсона и для предотвращения апоптоза нормальных клеток, который вызывается противораковыми лекарственными средствами. Таким образом, соединения, описанные заявителем, являются новыми, и, кроме того, неожиданно обнаруживают избирательное ингибирующее действие по отношению к киназе гликогенсинтазы 3, что делает их особенно полезными для применения в качестве лекарственного средства для дечения нарушений, указанных выше. Настоящее изобретение относится, главным образом, к соединениям формулы (I): в которой R1 и R2, которые могут быть одинаковыми или разными, каждый, независимо друг от друга,представляет собой группу, выбранную из водорода, линейного или разветвленного (С 1-С 6)алкила,арил(С 1-С 6)алкила, в котором алкильная часть может быть линейной или разветвленной, гидрокси, линейного или разветвленного (С 1-С 6)гидроксиалкила, линейного или разветвленного дигидрокси(С 1 С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (С 1 С 6)алкокси(С 1-С 6)алкила, аминогруппы и линейного или разветвленного (С 1-С 6)аминоалкила, аминочасть в каждой группе необязательно замещена одной или двумя одинаковыми или разными группами,выбранными из линейного или разветвленного (С 1-С 6)алкила, арила и арил(С 1-С 6)алкила, в котором алкильная часть может быть линейной или разветвленной,Ra и Rb, которые могут быть одинаковыми или разными, каждый, независимо друг от друга, представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,X1, Х 2 и Х 3, которые могут быть одинаковыми или разными, каждый, независимо друг от друга,представляет собой группу, выбранную из гидрокси, линейного или разветвленного (С 1-С 6)алкокси, арилокси, арил(С 1-С 6)алкокси, в котором алкоксильная часть может быть линейной или разветвленной, линейного или разветвленного (С 1-С 6)алкила, аминогруппы (необязательно замещенной одной или двумя одинаковыми или разными линейными или разветвленными (С 1-С 6)алкильными группами), галогена,линейного или разветвленного (С 1-С 6)алкилкарбонилокси и азидо,-1 006201 Х 4 представляет собой метилиденовую группу или группу формулы -Rc-X1, в которой Rc представляет собою простую связь или метиленовую группу и X1 имеет значения, указанные выше,к их изомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой илиоснованием,где под арильной группой подразумевается фенильная или нафтильная группа и под изомерами подразумеваются оптические изомеры (рацематы, энантиомеры и диастереоизомеры). Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту,трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфокислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить, но только в качестве примеров,гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными группами R1 соединений согласно изобретению являются атом водорода, линейный или разветвленный (С 1-С 6)алкил и линейный или разветвленный (С 1-С 6)гидроксиалкил. Предпочтительной группой R2 соединений согласно изобретению является атом водорода. В соответствии с предпочтительным вариантом осуществления изобретения предпочтительными соединениями являются соединения формулы (I), в которой Ra и Rb являются одинаковыми и представляют собой линейную (С 1-С 3)алкиленовую цепь. Предпочтительными группами X1, X2 и Х 3 соединений согласно изобретению являются группы, выбранные из гидрокси, линейного или разветвленного (С 1-С 6)алкокси и линейного или разветвленного(С 1-С 6)алкилкарбонилокси. Предпочтительные группы Х 4 соединений согласно изобретению выбирают из -Rc-X1 групп, в которых Rc представляет собой метиленовую группу и X1 представляет собой группу, выбранную из гидрокси, галогена, линейного или разветвленного (С 1-С 6)алкокси и (С 1-С 6)алкилкарбонилокси. В соответствии с предпочтительным вариантом осуществления изобретения предпочтительными соединениями является соединения формулы (IA): в которой R1, R2, Ra, Rb, X1, Х 2, Х 3 и Х 4 имеют значения, указанные для формулы (I). Предпочтительным соединением согласно изобретению является 3,9-бис(гидроксиметил)-12-(4-OметилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-a]пирроло[3,4-с]карбазол-5,7(6H)-дион. Энантиомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием предпочтительных соединений являются существенной частью изобретения. Настоящее изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) в которой X1, Х 2, Х 3 и Х 4 имеют значения, указанные для формулы (I),в котором соединение формулы (II) подвергают гидрогенолизу в присутствии никеля Ренея и раствора гидроокиси натрия, получая соединение формулы (III) в которой X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,в котором соединение формулы (III) подвергают реакции с соединением формулы (IV)(IV),в которой R1 имеет значения, указанные для формулы (I),получая соединение формулы (V) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,в котором соединение формулы (V) подвергают реакции с метиловым эфиром ,-дихлорметила в присутствии кислоты Льюиса, получая соединение формулы (VI) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,альдегидные функциональные группы в соединении формулы (VI) восстанавливают путем взаимодействия с восстановителем, который обычно применяется при органическом синтезе, получая соединение формулы (I/a), частный случай соединений формулы (I) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,в котором соединение формулы (I/a) превращают в его соответствующее дигалогенированное соединение в соответствии с обычными условиями органической химии и затем подвергают реакции с цианидом щелочи в присутствии диметилсульфоксида, получая соединение формулы (VII) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,в котором соединение формулы (VII) превращают в сложный эфир в соответствии со стандартными условиями и затем подвергают взаимодействию с восстановителем, получая соединение формулы (I/b),частный случай соединений формулы (I) в которой R1, X1, X2, Х 3 и Х 4 имеют значения, указанные выше,в котором соединение формулы (I/b) может снова и повторно подвергаться идентичным реакциям,при которых получают соединения формул (VII) и (I/b), исходя из соединений формулы (I/a), получая соединение формулы (I/с), частный случай соединений формулы (I)Ra и Rb имеют значения, указанные для формулы (I),в котором соединение формулы (I/с) может подвергаться взаимодействию с соединением формулы (VIII):(VIII),в которой R2a имеет такие же значения, как указано для R2 в формуле (I), за исключением атома водорода,получая соединение формулы (I/d), частный случай соединений формулы (I)-4 006201 в которой R1, Ra, Rb, X1, Х 2, Х 3, Х 4 и R2 а имеют значения, указанные выше,соединения формул (I/a)-(I/d) составляют множество соединений формулы (I), которые необязательно очищают в соответствии с обычными способами очистки, можно, при необходимости, разделить на их различные изомеры в соответствии с обычными способами разделения, заместители X1, Х 2, Х 3 и Х 4 которых можно модифицировать в соответствии с обычными способами органического синтеза, которые используются в области химии cахаров, и соединения, при необходимости, превращают в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формул (II), (IV) и (VIII) являются коммерчески доступными соединениями или соединениями, которые получают согласно обычным способам органического синтеза, хорошо известным специалисту в данной области техники. Соединения формулы (I) обладают избирательным ингибирующем действием по отношению кGSK-3 (киназе гликогенсинтазы-3), что является совершенно неожиданным. Эти специфические свойства делают их пригодными для лечения диабета II-го типа, ожирения, нарушений центральной нервной системы, болезни Альцгеймера, болезни Паркинсона и для апоптоза. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве активного компонента по крайней мере одно соединение формулы (I), его изомер или его аддитивную соль с фармацевтически приемлемой кислотой или основанием, отдельно или в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного, внутримышечного или подкожного), чрез- или транскожного, внутривлагалищного, ректального, назального, подъязычного, трансбуккального, внутриглазного введения или введения в дыхательные пути. Фармацевтические композиции согласно изобретению для парентерального введения включают, в частности, стерильные водные и неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановленных растворов для инъекций или дисперсий. Фармацевтические композиции согласно изобретению для перорального введения в виде твердых форм включают, в особенности, таблетки или драже, подъязычные таблетки, саше, желатиновые капсулы, гранулы и для перорального, назального, трансбуккального или внутриглазного введения в виде жидких форм включают, в особенности, эмульсии, растворы, суспензии, капли, сиропы и аэрозоли. Фармацевтические композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, и композиции для чрез- или транскожного введения включают, в особенности, порошки, аэрозоли, кремы, мази, гели и пластыри. Фармацевтические композиции, указанные выше, приведены только с целью иллюстрации изобретения и никоим образом его не ограничивают. Среди фармацевтически приемлемых, инертных, нетоксичных наполнителей или носителей можно отметить, но только с целью иллюстрации, и никоим образом не ограничиваясь ими, разбавители, растворители, консерванты, смачивающие вещества, эмульгирующие средства, диспергирующие средства,связывающие вещества, агенты, вызывающие набухание, дезинтеграторы, вещества для замедленного высвобождения, замасливатели, абсорбенты, суспендирующие вещества, красители, ароматизаторы и т.п. Полезная дозировка изменяется в зависимости от возраста и веса пациента, пути введения, применяемой фармацевтической композиции, природы и тяжести расстройства и применения сопутствующих видов лечения. Дозировка изменяется в пределах от 0,5 до 500 мг в сутки на одно или больше введений. Примеры, представленные ниже, приведены только с целью иллюстрации и никоим образом не ограничивают изобретение. Используемые исходные материалы являются известными продуктами или продуктами, которые получают в соответствии с известными способами. Разные стадии получения приводят к синтезу промежуточных продуктов для применения для получения соединений согласно изобретению. Структуры соединений, описанных в примерах и в составах, были определены согласно обычным спектрофотометрическим способам (инфракрасная спектрометрия, ядерный магнитный резонанс, массспектрометрия и т.п). Пример 1. 3,9-бис(Гидроксиметил)-12-(4-O-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион. Стадия А. 12-(2,3,6-три-O-Aцетил-4-O-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3 а]пирроло[3,4-с]карбазол-5,7(6H)-дион. При 0 С 1,37 ммоль уксусного ангидрида и 3 ммоль пиридина добавляли подряд к 0,136 ммоль дехлорированного ребеккамицина. После перемешивания в течение 19 ч при температуре окружающей среды реакционную смесь выливали на лед и экстрагировали этилацетатом. Органическую фазу промывали раствором Na2CO3 и затем насыщенным раствором NaCl, высушивали над сульфатом магния и концентрировали. При хроматографирования остатка на силикагеле (этилацетат) выделяли ожидаемый продукт. Стадия В. 3,9-Диформил-12-(2,3,6-три-O-ацетил-4-O-метилD-глюкопиранозил)-12,13-дигидро 5H-индоло[2,3-a]пирроло[3,4-с]карбазол-5,7(6H)-дион.-5 006201 2,4 ммоль метилового эфира ,-дихлорметила добавляли к раствору 0,12 ммоль соединения, полученного на стадии А, в 2 мл дихлорметана. Смесь охлаждали до 0 С, и добавляли 2,4 ммоль 1 М раствораTiCl4 в дихлорметане, и затем смесь перемешивали при температуре окружающей среды в течениe 24 ч. После гидролиза и экстракции дихлорметаном органическую фазу промывали насыщенным растворомNaCl, высушивали над сульфатом магния и концентрировали, получая ожидаемый продукт. Стадия С: 3,9-Диформил-12-(4-O-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-a]пирроло[3,4-с]карбазол-5,7(6H)-дион. Соединение, полученное на стадии В, растворяли в 13 мл метанола и затем добавляли 6 мл водного 30%-ного раствора NH4OH. После перемешивания в течениe 24 ч при температуре окружающей среды реакционную смесь выпаривали насухо. Остаток растворяли в смеси этилацетата/тетрагидрофурана,подкисляли 1 н. раствором соляной кислоты и затем экстрагировали этилацетатом. Органическую фазу высушивали над сульфатом магния и выпаривали при пониженном давлении. При хроматографировании остатка на силикагеле (циклогексан/ацетон: 20/80) выделяли ожидаемый продукт. Точка плавления: 300 С. Стадия D. 3,9-бис(Гидроксиметил)-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион. 20 мг никеля Ренея (1/1 по весу в воде) добавляли к раствору 0,09 ммоль соединения, полученного на стадии С, в 28 мл метанола. Смесь перемешивали в течение 3 дней при температуре окружающей среды в атмосфере водорода при давлении 1 бар. После фильтрации через целит и последовательного промывания твердого вещества метанолом, тетрагидрофураном и ацетоном растворители выпаривали. При хроматографировании остатка на силикагеле (циклогексан/ацетон : 1/1) выделяли ожидаемый продукт. Точка плавления: 300 С. ИК (KBr): CO=1720, 1740 cm1; NH,OH=3100-3600 cm-1. Пример 2. 3,9-бис(Гидроксиметил)-6-метил-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5Hиндоло(2,3-а]пирроло-[3,4-с]карбазол-5,7-дион. Стадия А. 12-(4-О-метилD-глюкопиранозил)-12,13-дигидрофуро[3,4-с]индоло[2,3-a]карбазол-5,7 дион. Раствор 0,40 ммоль 12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-диона, 420 мг раствора гидроокиси натрия и 70 мл воды кипятили в колбе с обратным холодильником в течениe 3 ч и затем разбавляли, подкисляли водным 1 н. раствором соляной кислоты и экстрагировали этилацетатом. Органическую фазу промывали, высушивали, фильтровали и затем концентрировали при пониженном давлении. При хроматографировании на силикагеле (этилацетат/циклогексан: 80/20) выделяли ожидаемый продукт. Стадия В. 6-Метил-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5 Н-индоло[2,3-д]пирроло[3,4-с]карбазол-5,7-дион. 0,12 ммоль соединения, полученного на стадии А, и 2 М раствор метиламина в 14 мл тетрагидрофурана перемешивали при 70 С в течение 16 ч. После охлаждения реакционную смесь гидролизовали, вызывая образование осадка. Этот осадок очищали при помощи хроматографии на силикагеле (этилацетат/ циклогексан : 80/20), выделяя ожидаемый продукт. Стадия С. 3,9-бис(Гидроксиметил)-6-метил-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5Hиндоло[2,3-a]пирроло[3,4-с]карбазол-5,7-дион. Продукт получали в соответствии с процедурой примера 1, стадии A-D, используя соединение, полученное на вышеуказанной стадии В, в качестве субстрата. Пример 3. 6-(2-Гидроксиэтил)-3,9-бис(гидроксиметил)-12-(4-О-метилD-глюкопиранозил)-12,13 дигидро-5H-индоло[2,3-a]пирроло[3,4-с]карбазол-5,7-дион. Стадия А. 6-(2-Гидроксиэтил)-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а] пирроло[3,4-с]карбазол-5,7-дион. Раствор 0,30 ммоль соединения, полученного на стадии А примера 2, и 1,3 мл этаноламина перемешивали при температуре окружающей среды в течение 1 ч и затем выливали на лед и экстрагировали этилацетатом. Органическую фазу высушивали, фильтровали и затем концентрировали при пониженном давлении. При хроматографировании на силикагеле (этилацетат/циклогексан) выделяли ожидаемый продукт. Стадия В. 6-(2-Гидроксиэтил)-3,9-бис(гидроксиметил)-12-(4-О-метилD-глюкопиранозил)-12,13 дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дион. Продукт получали в соответствии с процедурой примера 1, стадии A-D, используя соединение, полученное на вышеуказанной стадии А, в качестве субстрата. Пример 4. 6-Диэтиламиноэтил-3,9-бис(гидроксиметил)-12-(4-О-метилD-глюкопиранозил)-12,13 дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7-дион. Стадия А. 6-Диэтиламиноэтил-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3a]пирроло[3,4-с]карбазол-5,7-дион. 26 мкл N,N-диэтилэтилендиамина по каплям добавляли к раствору 60 мг соединения, полученного на стадии А примера 2, растворенного в 7 мл сухого тетрагидрофурана. Реакционную смесь нагревали-6 006201 при 65 С в течение 4 дней без света и затем охлаждали и вносили в смесь (водный 1 н. раствор соляной кислоты/этилацетат). После экстрагирования этилацетатом органическую фазу высушивали, фильтровали и затем концентрировали при пониженном давлении. При хроматографировании на силикагеле выделяли ожидаемый продукт. Стадия В. 6-Диэтиламиноэтил-3,9-бис(гидроксиметил)-12-(4-О-метилD-глюкопиранозил)-12,13 дигидро-5H-индоло[2,3-a]пирроло[3,4-с]карбазол-5,7-дион. Продукт получали в соответствии с процедурой примера 1, стадии A-D, используя соединение, полученное на вышеуказанной стадии А, в качестве субстрата. Пример 5. 3,9-бис(Гидроксиметил)-12-(2,3,6-три-О-ацетил-4-О-метилD-глюкопиранозил)-12,13 дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получали в соответствии с процедурой стадии D примера 1, используя соединение, полученное на стадии В примера 1, в качестве субстрата. Пример 6. 3,9-бис(Гидроксиметил)-12-(6-хлор-6-деокси-4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион. Стадия А. 12-(6-Хлор-6-деокси-4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а] пирроло[3,4-с]карбазол-5,7(6H)-дион. 4 эквивалента РРh3 и 2 эквивалента ССl4 добавляли к раствору 0,45 ммоль дехлорированного ребеккамицина в 2 мл пиридина. После перемешивания при температуре окружающей среды в течение 3 ч реакционную смесь гидролизовали водным 1 н. раствором соляной кислоты и затем экстрагировали этилацетатом. Органическую фазу промывали, высушивали, фильтровали и затем концентрировали при пониженном давлении. Стадия В. 3,9-бис(Гидроксиметил)-12-(6-хлор-6-деокси-4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]карбазол-5,7(6H)-дион. Продукт получали в соответствии с процедурой примера 1, стадии A-D, используя соединение, полученное на вышеуказанной стадии А, в качестве субстрата. Фармакологические исследования соединений по изобретению Пример 7. Ингибирующее действие по отношению к GSK-3. Экспериментальный протокол. Киназу гликогенсинтазы 3 очищали из клеток Sf9, трансфектированных, как описано в Eur. J. Biochem.,1992, 305-311. Реакционная смесь содержала, при конечном объеме 30 мкл, 1 мг/мл БСА, 10 мкмольDTT, 6,7 мкмоль GS-1 пептида а качестве субстрата, 15 мкмоль [-32 Р]АТФ (3000 Ки/ммоль, 1 мКи/мл),10 ммоль MgCl2, 1 ммоль EGTA, 25 ммоль трис-HCl рН=7,5; 50 мкг/мл гепарина и ингибитор в заданной концентрации. Через 30 мин при 30 С 25 мкл смеси помещали на Whatman P81 фосфоцелюллозные бумажные фильтры, которые затем промывали 5 раз 10 мл фосфорной кислоты (10 мл/л). Затем подсчитывали радиоактивность фильтров в присутствии 1 мл сцинтилляционной жидкости. Значения IС 50 определяли на основании кривых доза-ответ. В этом исследовании соединение из примера 1 имело значение IС 50 при концентрации 0,03 мкмоль. Таким образом, оно является активным по отношению к GSK-3 и эта активность является избирательной,что подтверждается результатами, приведенными в примерах 8 и 9, описанных ниже. Пример 8. Ингибирующее действие по отношению к CDK-1. Экспериментальный протокол. Фермент очищали из гомогената ооцитов морской звезды (Marthasterias glacialis) в М фазе, как описано в Eur. J. Biochem, 1997, 243, 527-536 и J. Biol. Chem., 1999, 274, 11977-11986. Реакционная смесь содержала, при объеме 30 мкл, 1 мг/мл гистона H1 в качестве субстрата, 15 мкмоль [-32 Р]АТФ (3000 Ки/ммоль,1 мКи/мл), 15 ммоль MgCl2, 60 мкмоль -глицерофосфата, 15 мкмоль n-нитрофенилфосфата, 25 ммольMOPS pH=7,2; 5 ммоль EGTA, 1 ммоль DTT, 1 ммоль ванадата натрия и ингибитор в заданной концентрации. Через 10 мин инкубирования при 30 С 25 мкл реакционной смесь удаляли и обрабатывали, как описано выше в GSK-3 протоколе. Значения IС 50 определяли на основании кривых доза-ответ. В этом исследовании соединение из примера 1 имело значение IС 50 при концентрации свыше 5 мкмоль, что свидетельствует о его незначительной способности ингибировать эту циклинзависимую протеинкиназу. Пример 9. Ингибирующее действие по отношению к CDK5. Экспериментальный протокол.CDK5 экспрессировали в Е. coli в виде GST (глутатион-S-трансфераза) слитого белка и очищали на глутатион-агарозной аффинной колонке. Затем CDK5 активировали при помощи р 25 (смесь 1/1), приготовленной аналогичным образом. Ферментативную активность комплекса CDK5/p25 определяли, как описано выше для CDK1/циклин В. Значения IС 50 определяли на основании кривых доза-ответ. В этом исследовании соединение из примера 1 имело значение IС 50 при концентрации свыше 5 мкмоль,что свидетельствует о его незначительной способности ингибировать эту циклинзависимую протеинкиназу.-7 006201 Пример 10. Фармацевтическая композиция на 1000 таблеток, каждая из которых содержит дозу 10 мг. Соединение из примера 1 10 г Гидроксипропилметилцеллюлоза 10 г Пшеничный крахмал 15 г Лактоза 90 г Стеарат магния 2 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) в которой R1 и R2, которые могут быть одинаковыми или разными, каждый, независимо друг от друга,представляет собой группу, выбранную из водорода, линейного или разветвленного (С 1-С 6)алкила,арил(С 1-С 6)алкила, в котором алкильная часть может быть линейной или разветвленной, гидрокси, линейного или разветвленного (С 1-С 6)гидроксиалкила, линейного или разветвленного дигидрокси(С 1 С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (С 1 С 6)алкокси(С 1-С 6)алкила, аминогруппы и линейного или разветвленного (С 1-С 6)аминоалкила, аминочасть в каждой группе необязательно замещена одной или двумя одинаковыми или разными группами,выбранными из линейного или разветвленного (С 1-С 6)алкила, арила и арил(С 1-С 6)алкила, в котором алкильная часть может быть линейной или разветвленной,Ra и Rb, которые могут быть одинаковыми или разными, каждый независимо друг от друга, представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь,X1, Х 2 и Х 3, которые могут быть одинаковыми или разными, каждый, независимо друг от друга, представляет собой группу, выбранную из гидрокси, линейного или разветвленного (С 1-С 6)алкокси, арилокси,арил(С 1-С 6)алкокси, в котором алкоксильная часть может быть линейной или разветвленной, линейного или разветвленного (С 1-С 6)алкила, аминогруппы (необязательно замещенной одной или двумя одинаковыми или разными линейными или разветвленными (С 1-С 6)алкильными группами), галогена, линейного или разветвленного (С 1-С 6)алкилкарбонилокси и азидо,Х 4 представляет собой метилиденовую группу или группу формулы -Rc-X1, в которой Rc представляет собою простую связь или метиленовую группу и X1 имеет значения, указанные выше,их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием,где под арильной группой подразумевается фенильная или нафтильная группа и под изомерами подразумеваются оптические изомеры. 2. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R1 представляет собой атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу или линейную или разветвленную (С 1-С 6)гидроксиалкильную группу, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R2 представляет собой атом водорода. 4. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что Ra и Rb являются одинаковыми и представляют собой линейную (С 1-С 3)алкиленовую цепь, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что X1, X2 и Х 3, каждый представляет собой группу, выбранную из гидрокси, линейного или разветвленного (С 1-С 6)алкокси и линейного или разветвленного (С 1-С 6)алкилкарбонилокси, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что Х 4 представляет собой группу, выбранную из -Rc-X1 групп, в которых Rc представляет собой метиленовую группу и X1 представляет собой группу, выбранную из гидрокси, галогена, линейного или разветвленного (С 1-С 6)алкокси и (С 1-С 6)алкилкарбонилокси, их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.-8 006201 7. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что они представляют собой соединения формулы (IA) в которой R1, R2, Ra, Rb, X1, Х 2, Х 3 и Х 4 имеют значения, указанные для формулы (I),их изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3,9-бис(гидроксиметил)-12-(4-О-метилD-глюкопиранозил)-12,13-дигидро-5H-индоло[2,3-а]пирроло[3,4-с]-карбазол-5,7(6H)дион, его изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Способ получения соединений формулы (I) в соответствии с п.1, характеризующийся тем, что в качестве исходного вещества применяют соединение формулы (II) в которой X1, Х 2, Х 3 и Х 4 имеют значения, указанные для формулы (I),в котором соединение формулы (II) подвергают гидрогенолизу в присутствии никеля Ренея и раствора гидроокиси натрия, получая соединение формулы (III) в которой X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,в которой соединение формулы (III) подвергают реакции с соединением формулы (IV)(IV),в которой R1 имеет значения, указанные для формулы (I),получая соединение формулы (V) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,-9 006201 в которой соединение формулы (V) подвергают реакции с метиловым эфиром ,-дихлорметила в присутствии кислоты Льюиса, получая соединение формулы (VI) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,альдегидные функциональные группы в соединении формулы (VI) восстанавливают путем взаимодействия с восстановителем, который обычно применяется при органическом синтезе, получая соединение формулы (I/a), частный случай соединений формулы (I) в которой R1, X1, X2, Х 3 и Х 4 имеют значения, указанные выше,затем соединение формулы (I/a) превращают в его соответствующее дигалогенированное соединение в соответствии с обычными условиями органической химии и затем подвергают реакции с цианидом щелочи в присутствии диметилсульфоксида, получая соединение формулы (VII) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,в которой соединение формулы (VII) превращают в сложный эфир в соответствии со стандартными условиями и затем подвергают взаимодействию с восстановителем, получая соединение формулы (I/b),частный случай соединений формулы (I) в которой R1, X1, Х 2, Х 3 и Х 4 имеют значения, указанные выше,- 10006201 соединение формулы (I/b) может снова и повторно подвергаться идентичным реакциям, при которых получают соединения формул (VII) и (I/b), исходя из соединений формулы (I/a), получая соединение формулы (I/с), частный случай соединений формулы (I)Ra и Rb имеют значения, указанные для формулы (I),затем соединение формулы (I/с) может подвергаться взаимодействию с соединением формулы (VIII)(VIII),в которой R2a имеет такие же значения, как указано для R2 в формуле (I), за исключением атома водорода,с получением соединения формулы (I/d), частного случая соединений формулы (I) в которой R1, Ra, Rb, X1, Х 2, Х 3, Х 4 и R2a имеют значения, указанные выше,соединения формул (I/a)-(I/d) составляют множество соединений формулы (I), которые необязательно очищают в соответствии с обычными способами очистки, можно, при необходимости, разделить на их различные изомеры в соответствии с обычными способами разделения, заместители X1, X2, Х 3 и Х 4 которых можно модифицировать в соответствии с обычными способами органического синтеза, которые используются в области химии cахаров, и соединения, при необходимости, превращают в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Фармацевтическая композиция, содержащая в качестве активного компонента по крайней мере одно соединение в соответствии с одним из пп.1-8, в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными наполнителями или носителями. 11. Применение фармацевтической композиции в соответствии с п.10 в качестве ингибитора киназы гликогенсинтазы GSK-3. 12. Применение фармацевтической композиции в соответствии с п.10 в качестве лекарственного средства для лечения диабета II-го типа, ожирения, нарушений центральной нервной системы, болезни Альцгеймера, болезни Паркинсона и для ингибирования апоптоза нормальных клеток, который вызывается противораковым лечением.
МПК / Метки
МПК: C07H 19/23, A61P 25/00, A61K 31/7056
Метки: гидроксиалкилиндолкарбазола, способ, получения, производные, композиции, содержат, которые, фармацевтические
Код ссылки
<a href="https://eas.patents.su/12-6201-proizvodnye-gidroksialkilindolkarbazola-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гидроксиалкилиндолкарбазола, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Осушитель природного газа
Следующий патент: Способ подавления образования спаек у млекопитающего
Случайный патент: Способ и устройство для интенсификации добычи углеводородов из буровых скважин