Соединение бензимидазола
Номер патента: 999
Опубликовано: 28.08.2000
Авторы: Гриффин Роджер Джон, Голдинг Бернард Томас, Ньюэлл Дэвид Ричард, Кертин Никола Джэйн, Калверт Элан Хилари
Формула / Реферат
1. Применение бензимидазольного соединения, имеющего общую структурную формулу I
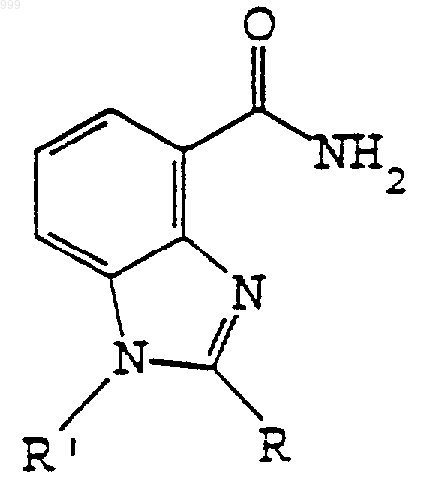 I
I
или его фармацевтически приемлемой соли, и/или пролекарственной формы в качестве активного агента для получения лекарственного препарата или ветеринарного препарата для использования в лечении для ингибирования активности фермента-поли(ADP-рибоза)полимеразы или PARP (также известного как ADP-рибозил трансфераза или ADPRT), причем ингибирование фермента составляет элемент терапевтического лечения,
отличающееся тем, что указанное бензимидазольное соединение обеспечивает активное средство, ингибирующее PARP фермент, и в структурной формуле I
R выбран из водорода, алкильной, гидроксиалкильной (например, СН2СН2ОН), ацильной (например, ацетил или бензоил) или необязательно замещенной арильной (например, фенил) или аралкильной (например, бензил или карбоксибензил) группы, и
R' выбран из водорода, алкила, гидроксиалкильной (например, CH2CH2OH), ацильной (например, ацетил или бензоил) или необязательно замещенной арильной (например, фенил) или аралкильной (например, бензил или карбоксибензил) группы.
2. Применение по п.1 бензимидазольного соединения, определенного в нем, где каждая присутствующая алкильная группа, либо как таковая, либо как часть алкокси или другой группы, содержит 1-6 углеродных атомов.
3. Применение по п.1 бензимидазольного соединения, определенного в п.1 или 2, где R представляет необязательно замещенную фенильную группу, имеющую структурную формулу II
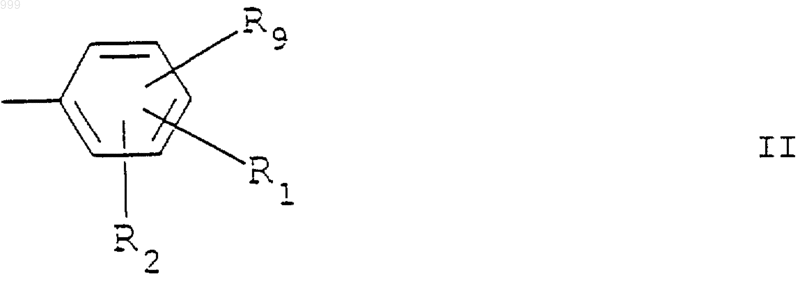
где R1, R2 и R9 каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W (причем W является галогеном) и CN.
4. Применение по п.1 бензимидазольного соединения, определенного в п.3, где R1 представляет группу, отличную от водорода, и находится в 4'-положении и где R2 и R9 каждый представляет водород.
5. Применение по п.1 бензимидазольного соединения, определенного в любом из предшествующих пунктов, где
R' представляет необязательно замещенную фенильную группу, имеющую структурную формулу III
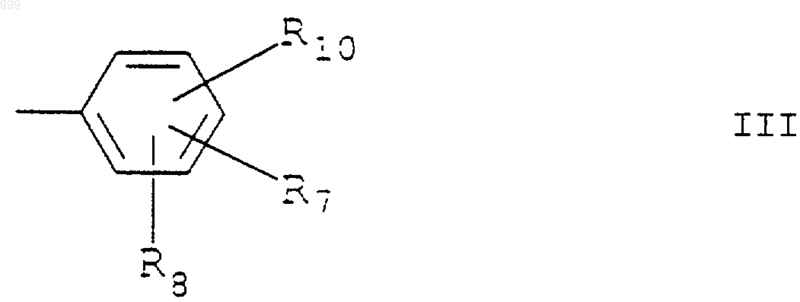
где R7, R8 и R10 каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NНСОR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W (причем W является галогеном) и CN.
6. Применение по п.1 бензимидазольного соединения, определенного в п.5, где R7 представляет группу, отличную от водорода, и находится в 4'-положении и где R8 и R10 каждый представляют водород.
7. Применение по п.1 бензимидазольного соединения, определенного в нем, где R выбран из метила, этила, н-пропила, изо-пропила, н-бутила, трет-бутила и циклогексила.
8. Применение по п.1 бензимидазольного соединения, определенного в нем, где R' представляет водород или алкил и R представляет фенил или бензил, имеющий, по крайней мере, один заместитель в бензольном кольце, который выбран из гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W (причем W является галогеном) и CN.
9. Применение по п.1 бензимидазольного соединения, которое представляет собой одно из следующих:
(a) 2-метилбензимидазол-4-карбоксамид;
(b) бензимидазол-4-карбоксамид;
(c) 2-фенилбензимидазол-4-карбоксамид;
(d) 2-(4'-метоксифенил)бензимидазол-4-карбоксамид;
(e) 2-(4'-трифторметилфенил)бензимидазол-4-карбоксамид;
(f) 2-(4'-гидроксифенил)бензимидазол-4-карбоксамид;
(g) 2-трифторметилбензимидазол-4-карбоксамид;
(h) 2-(4'-метоксифенил)-N-метилбензимидазол-4-карбоксамид;
(i) 2-(4'-нитрофенил)бензимидазол-4-карбоксамид;
(j) 2-(4'-цианофенил)бензимидазол-4-карбоксамид;
(k) 2-(3'-трифторметилфенил)бензимидазол-4-карбоксамид;
(l) 2-(3'-метоксифенил)бензимидазол-4-карбоксамид;
(m) 2-(4'-метоксифенил)-1-N-бензоил-бензимидазол-4-карбоксамид;
(n) 2-(4'-аминофенил)-бензимидазол-4-карбоксамид;
(о) 2-(2'-трифторметилфенил)бензимидазол-4-карбоксамид;
(р) N-карбоксибензил-2- (4'-метоксифенил) бензимидазол-4-карбоксамид.
10. Применение по п.1 бензимидазольного соединения, определенного в любом из предшествующих пунктов, где указанное соединение находится в форме пролекарства, имеющего группу-заместитель, выбранную из фосфата, карбамата и аминокислоты.
11. Применение по п.1 бензимидазольного соединения, которое представляет фосфатное производное соединения, имеющего общую структурную формулу I, и которое представляет собой пролекарственную форму бензамидазольного соединения, определенного в любом из пп.1-9.
12. Применение по п.1 бензимидазольного соединения в форме пролекарства в виде фосфатного производного, которое является водорастворимой фосфатной солью аммония или щелочного металла, полученной из бензимидазольного соединения, которое имеет структуру, определенную в любом из пп.1-9, где, по крайней мере, один заместитель является гидроксильной группой.
13. Применение по п.12, где бензимидазольное соединение, из которого получают пролекарство в виде фосфатного производного, имеет заместитель - гидроксильную группу, которая взаимодействует с дибензилфосфонатом.
14. Бензимидазольное соединение, имеющее общую структурную формулу I
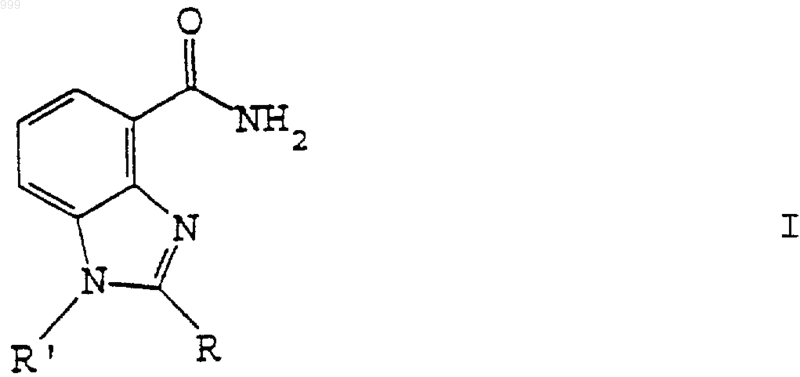
или его фармацевтически приемлемая соль и/или пролекарственная форма, в котором
R выбран из водорода, алкильной, гидроксиалкильной и необязательно замещенной арильной или аралкильной группы, при условии, что R не является 4'-метансульфонилокси-2'-метоксифенилом или 4'-метансульфониламино-2'-метоксифенилом и не представляет фенильную группу, имеющую заместитель, который представляет алкилсульфенильную, алкилсульфинильную, алкансульфонильную или алкилсульфоксимино группу, алкилсульфоксимино группу, замещенную по атому азота алканоильной, алкилсульфонильной или гидроксикарбонилалкиленкарбонильной группой, этокси или н-пропокси группу, каждая из которых замещена в концевом положении алкилсульфенильной, алкилсульфинильной, алкансульфонильной или алкилсульфоксимино группой, алкокси-карбониламино или N-алкиламино-карбониламино группу; и
R' выбран из водорода, алкила, гидроксиалкильной, ацильной или необязательно замещенной арильной группы, при условии, что R' не включает бифенильную или замещенную бифенильную группу в качестве активного фармацевтического агента.
15. Бензимидазольное соединение, имеющее общую структурную формулу I

или его фармацевтически приемлемая соль, где
R выбран из водорода, гидроксиалкильной и замещенной арильной группы;
при условии, что R не являетёя 4'-метансульфонилокси-2'-метоксифенилом или 4'-метансульфониламино-2'-метоксифенилом и не является фенильной группой, имеющей заместитель, который представляет алкилсульфенильную, алкилсульфинильную, алкансульфонильную или алкилсульфоксимино группу, алкилсульфоксимино группу, замещенную по атому азота алканоильной, алкилсульфонильной или гидроксикарбонилалкиленкарбонильной группой, этокси или н-пропокси группу, каждая из которых замещена в концевом положении алкилсульфенильной, алкилсульфинильной, алкансульфонильной или алкилсульфоксимино группой, алкоксикарбониламино или N-алкиламинокарбониламино группу; и
R' выбран из водорода, алкила, гидроксиалкильной, ацильной или необязательно замещенной арильной группы, при условии, что R' не включает бифенильную или замещенную бифенильную группу.
16. Соединение по п.14 или 15, где каждая присутствующая алкильная группа, либо как таковая, либо как часть алкокси или другой группы, содержит 1-6 углеродных атомов.
17. Соединение по любому из пп.14, 15 или 16, где R представляет фенильную группу, имеющую структурную формулу
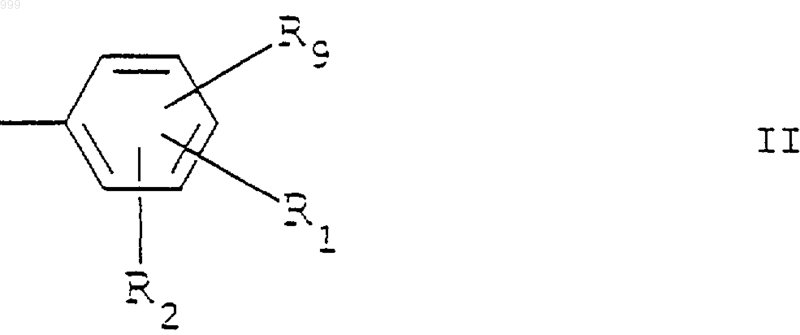
где R1, R2 и R9 каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NНСОR3 (причем R3 является алкилом или арилом), СО2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W (причем W является галогеном) и CN.
18. Соединение по п.17, где R1 представляет группу, отличную от водорода, и находится в 4'-положении и где R2 и R9 каждый представляет водород.
19. Соединение по любому из пп.14-18, где R' представляет необязательно замещенную фенильную группу, имеющую структурную формулу III

где R7, R8 и R10 каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), СO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W (причем W является галогеном) и CN.
20. Соединение по п.19, где R7 представляет группу, отличную от водорода, и находится в 4'-положении и где R8 и R10 каждый представляет водород.
21. Соединение по п.14 или 15, где R выбран из метила, этила, н-пропила, изо-пропила, н-бутила, трет-бутила и циклогексила.
22. Соединение по п.14 или 15, где R' представляет водород и R представляет либо фенильную, либо бензильную группу, имеющую, по крайней мере, один заместитель в бензольном кольце, который выбран из гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W (причем W является галогеном) и CN.
23. Соединение по п.14 или 15, которое представляет собой одно из следующих:
(a) бензимидазол-4-карбоксамид;
(b) 2-(4'-метоксифенил)бензимидазол-4-карбоксамид;
(c) 2-(4'-трифторметилфенил)бензимидазол-4-карбоксамид;
(d) 2-(4'-гидроксифенил)бензимидазол-4-карбоксамид;
(e) 2-(4'-метоксифенил)-N-метилбензимидазол-4-карбоксамид;
(f) 2-(4'-нитрофенил)бензимидазол-4-карбоксамид;
(g) 2-(4'-цианофенил)бензимидазол-4-карбоксамид;
(h) 2-(3'-трифторметилфенил)бензимидазол-4-карбоксамид;
(i) 2-(3'-метоксифенил)бензимидазол-4-карбоксамид;
(j) 2-(4'-метоксифенил)-1-N-бензоилбензимидазол-4-карбоксамид;
(k) 2-(4'-аминофенил)-бензимидазол-4-карбоксамид;
(l) 2-(2'-трифторметилфенил)бензимидазол-4-карбоксамид; или
(m) N-карбоксибензил-2-(4'-метоксифенил)бензимидазол-4-карбоксамид.
24. Соединение по любому из пп.14-23, которое пригодно для перорального или внутривенного терапевтического введения и находится в форме пролекарства, имеющего группу-заместитель, выбранную из фосфата, карбамата и аминокислоты.
25. Соединение по п.24, где пролекарственная форма представляет фосфатное производное соединения, имеющего общую структурную формулу I.
26. Соединение по п.25, причем указанное соединение находится в пролекарственной фосфатной форме, которое представляет собой водорастворимую фосфатную соль аммония или щелочного металла, полученную из соединения структурной формулы I, которое имеет, по крайней мере, один заместитель - гидроксильную группу.
27. Соединение по п.26, где соединение структурной формулы I, из которого получают пролекарство в фосфатной форме, имеет заместитель - гидроксильную группу, которая взаимодействует с дибензилфосфонатом.
28. Способ получения соединения общей формулы I
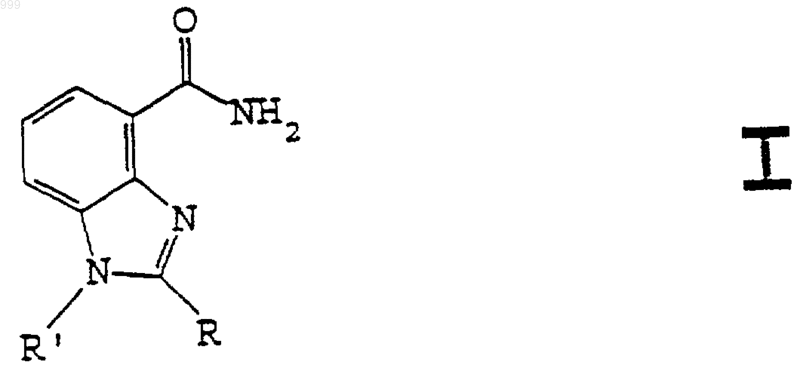
где R такой, как определен в п.17, и R' такой, как определен в пп.14 и 15, включающий стадии взаимодействия алкил 2,3-диаминобензоата с арил хлорангидридом кислоты, обработки продукта уксусной кислотой при повышенной температуре с образованием бензимидазольного кольца и взаимодействия с жидким аммиаком с получением амидного производного.
29. Применение соединения по любому из пп.14-27 в качестве активного PARP-ингибирующего агента.
30. Применение соединения по любому из пп.14-27 в качестве активного агента для получения лекарственного препарата или ветеринарного препарата для использования в терапевтическом лечении млекопитающего.
31. Фармацевтическая композиция, обладающая PARP-ингибирующей активностью, содержащая в качестве активного агента соединение по любому из пп.14-27 в единичной дозированной форме, составленной для введения млекопитающему, которому показано лечение PARP-ингибирующим агентом.
32. Фармацевтическая композиция, обладающая PARP-ингибирующей активностью для медицинского применения, включающая в качестве активного агента эффективное PARP-ингибирующее количество соединения по любому из пп.14-27 вместе с фармацевтически приемлемым носителем.
33. Фармацевтический состав или композиция по п.31 или 32 для применения в сочетании с цитотоксическими средствами или радиотерапией при противоопухолевом лечении.
34. Фармацевтическая композиция, содержащая эффективное PARP-ингибирующее количество соединения по любому из пп.14-27 в смеси с терапевтически полезным и эффективным количеством цитотоксического лекарственного средства для применения при противоопухолевом лечении.
35. Способ терапевтического лечения, проводимого на млекопитающем, для которого полезно ингибирование активности PARP фермента, где указанный способ включает введение указанному млекопитающему эффективного PARP-ингибирующего количества соединения по любому из пп.14-27.
36. Способ терапевтического лечения, проводимого на млекопитающем, по п.35, отличающийся тем, что дополнительно включает введение ДНК-повреждающего цитотоксического лекарственного средства или радиотерапию в ходе противоопухолевого лечения.
Текст
1 Данное изобретение относится к определенным бензимидазольным соединениям, которые представляют интерес, поскольку они являются, по крайней мере, потенциально полезными химиотерапевтическими средствами благодаря способности ингибировать активность фермента-поли ADP-рибозилтрансферазы (ЕС 2.4.2.30), также известного как поли(ADPрибоза)полимераза, обычно обозначаемой какADPRT или PARP. В общем, последняя аббревиатура PARP будет использоваться в данном описании. Предшествующий уровень техники Известно, что, по крайней мере, у высших организмов фермент полиADP-рибозилтрансфераза катализирует перенос части ADPрибозы от окисленной формы, NAD+, никотинамид аденин динуклеотида к ядерным акцепторным белкам так, чтобы образовать гомоADP-рибоза полимеры, и этот процесс имеет место в целом ряду клеточных событий, таких как, например, восстановление ДНК повреждения, развитие клеточной дифференциации,трансформация клеток онкогенами и экспрессия генов. Общим признаком в ряде этих процессов является образование и восстановление разрывов цепей ДНК и стадия, которая включаетPARP фермент, по-видимому, является стадией повторного соединения ДНК цепи, опосредованного лигазой II. В большинстве случаев роль полиADP-рибозилации(ADP-rybosylation),включает использование ингибиторов PARP фермента, что привело к предположениям, что такие ингибиторы, мешая внутриклеточному механизму ДНК восстановления, могут играть полезную химиотерапевтическую роль, поскольку они должны быть способны модифицировать характеристики резистентности к лечению и потенцировать или усиливать эффективность цитотоксических лекарственных средств при химиотерапии или эффективность радиации при радиотерапии, когда первичное действие лечения состоит в вызывании ДНК повреждения в клетках-мишенях, как, например, при многих формах противоопухолевого лечения. В этой связи уже известны некоторые классы PARP ингибиторов, которые включают бензамид и различные аналоги никотинамида и бензамида, особенно 3-замещенные бензамиды с небольшими группами-заместителями, такими как 3-амино, 3-гидрокси и 3-метокси. О PARPингибирующей активности некоторых Nзамещенных бензамидов сообщалось в ЕР-А 0305008, в котором также предложено использование этих соединений в медицине для повышения цитотоксичности радиации или химиотерапевтических лекарственных средств. Что касается использования бензамидных соединений в качестве химиотерапевтических средств, различные исследования таких соединений, которые, как известно, обладают PARPингибирующей активностью, подтвердили, что 2 они могут потенцировать цитотоксичность ряда противоопухолевых средств in vitro, например блеомицина и метилирующих лекарственных средств. Кроме того, более ограниченные данные указывают на то, что такие бензамидные соединения могут также потенцировать активность цитотоксических лекарственных средствin vivo, хотя требования к дозам, как оказалось,являются довольно высокими (например, в диапазоне 0,5 г-1 на дозу для 3-аминобензамида), и это может вызвать проблемы, связанные с получением удовлетворительных фармацевтических препаративных форм, и проблемы, связанные с ограничениями по токсичности. Кроме того, ряд известных бензамидных соединений, как было показано, имеет потенциал как радиосенсибилизаторы, увеличивая, например, гибель клеток опухоли, вызванную ионизирующим облучением как in vitro, так и in vivo, и полагают, что во многих случаях это действие связано с этими соединениями, действующими как PARP ингибиторы и включающимися в ДНК восстановление. Однако несмотря на существующие данные in vitro и in vivo исследований, подтверждающих, что PARP ингибиторы имеют значительный потенциал как полезные химиотерапевтические средства, которые заслуживают дополнительной клинической оценки, например, в связи с лечением злокачественных опухолей, в настоящее время доступные известные PARP ингибиторы, как полагают, пока не являются в полной мере пригодными, чтобы представлять лекарственные средства-кандидаты, и остается потребность в том, чтобы найти и разработать более широкий диапазон соединений, имеющих потенциально полезные PARP ингибирующие свойства. Сущность изобретения Данное изобретение раскрывает новый ряд или ряды соединений, представляющих интерес как PARP ингибиторы, которые могут использоваться в медицине, особенно при введении в сочетании с, по крайней мере, некоторыми цитотоксическими лекарственными средствами или в случае радиотерапии для повышения их цитотоксической эффективности. В общем, соединения, относящиеся к данному изобретению,включают некоторые производные бензимидазола, в частности, соединения бензимидазол-4 карбоксамида, определенные ниже. Благодаря своей структуре, по-видимому, многие такие соединения особенно хорошо адаптированы для того, чтобы конкурировать с природным субстратом NAD+ за PARP фермент. В частности, согласно одному аспекту изобретение относится к использованию определенного здесь соединения для получения лекарственного средства или ветеринарного препарата для использования при лечении для ингибирования активности фермента-поли(АDРрибоза)полимеразы или PARP (также известной 3 как ADP-рибозил трансфераза или ADPRT),ингибирования фермента, включающего элемент терапевтического лечения, где указанное соединение обеспечивает агент, ингибирующий активный PARP фермент, и включает бензимидазол-4-карбоксамид, имеющий общую структурную формулу I или его фармацевтически приемлемую соль и/или его пролекарственную форму,отличающееся тем, что в структурной формуле I R выбран из водорода, алкильной,гидроксиалкильной (например, СН 2 СН 2 ОН),ацильной (например, ацетильной или бензоильной) и необязательно замещенной арильнойR' выбран из водорода, алкильной, гидроксиалкильной (например, СН 2 СН 2OН), ацильной (например, ацетильной или бензоильной) и необязательно замещенной арильной (например,фенильной) или аралкильной (например, бензильной или карбоксибензильной) группы. Данное изобретение обеспечивает также использование в терапии в качестве активных фармацевтических веществ, особенно, но не исключительно как PARP ингибиторы, соединений бензимидазола, имеющих общую структурную формулу I(или их фармацевтически приемлемой соли и/или их пролекарственной формы), с заместителями, определенными выше, за исключением того, что R не является 4'-метансульфонилокси 2'-метоксифенилом или 4'-метансульфониламино-2'-метоксифенилом и не представляет фенильную группу, имеющую заместитель, который представляет алкилсульфенильную, алкилсульфинильную, алкансульфонильную или алкилсульфоксимино группу, алкилсульфоксимино группу, замещенную по атому азота алканоильной, алкилсульфонильной или гидроксикарбонилалкиленкарбонильной группой, этокси или н-пропокси группу, каждая из которых замещена в концевом положении алкилсульфенильной, алкилсульфинильной, алкансульфонильной или алкилсульфоксимино группой, алкоксикарбониламино или N-алкиламинокарбониламино группу и R' является необязательно замещенной аралкильной группой и не включает бифенильную или замещенную бифенильную группу. 4 Кроме того, данное изобретение относится к новым бензимидазольным соединениям,имеющим общую структурную формулу I (или их фармацевтически приемлемые соль и/или их пролекарственную форму), с заместителями,определенными выше, за исключением того, чтоR не представляет незамещенную арильную группу, такую как фенил. Алкильные группы, если присутствуют,как таковые или как часть в других группах,обычно включают 1-8 атомов углерода, предпочтительно 1-6 атомов углерода и чаще 1-4 атома углерода. В частности, когда R и/или R' является алкильной группой, она обычно представляет собой C1-6 алкил, такой как, например,метил, этил, н-пропил, изо-пропил, н-бутил,трет-бутил или циклогексил. Когда R и/или R' представляет или включает фенильную группу,то она может быть замещенной, особенно в 4(пара)-положении, но альтернативно или дополнительно во 2-положении и/или 3-положении,например, различными заместителями, включая гидрокси, алкокси (метокси или этокси, например), циано, карбокси, амид, тетразол, амино или замещенную амино, CW3, (например СF3) или W, где W является галогеном. В случаях, когда R' является водородом или алкилом, предпочтительные соединения структурной формулы I включают соединения,в которых R представляет фенил или бензил,имеющий, по крайней мере, один заместитель в бензольном кольце, который выбран из гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 и R6,каждый, независимо является водородом, алкилом или алкокси), NHCOR3, (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2),тетразола, алкила, гидроксиалкила, СW3 или W(причем W является галогеном) и CN. В частности, когда R представляет замещенную фенильную группу, имеющую структурную формулу IIR1, R2 и R9 могут быть каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6(причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NНСОR3(причем R3 является алкилом или арилом),СО 2R4 (причем R4 является Н или алкилом),амида (например, CONH2), тетразола, алкила,гидроксиалкила, СW3 или W (причем W является галогеном) и CN. Данное изобретение включает также способ получения соединения структурной формулы I, охарактеризованного выше, где R представляет необязательно замещенную фенильную группу, имеющую структурную формулу II,причем указанный способ включает стадии 5 взаимодействия алкил 2,3-диаминобензоата с арилхлорангидридом кислоты, обработки продукта уксусной кислотой при повышенной температуре с образованием бензимидазольного кольца и взаимодействия с жидким аммиаком с образованием амидного производного. Когда R' представляет замещенную фенильную группу, имеющую структурную формулу IIIR7, R8 и R10 может быть каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3,NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси),NHCOR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, СW3 или W (причем W является галогеном) и CN. Соединения структурной формулы I, определенной выше, которые имеют ароматическое кольцо, включающее CN заместитель, могут быть также особенно полезны в качестве промежуточных продуктов для получения других соединений в соответствии с данным изобретением, поскольку циано заместитель обычно может быть превращен, используя стандартные методики, в целый ряд других функциональных групп, включая амин, карбоксил, амид и тетразол. Среди ряда бензимидазольных соединений, раскрытых здесь, предпочтительные представители, которые представляют особый интерес, включают:(р) N-карбоксибензил-2-(4'-метоксифенил) бензимидазол-4-карбоксамид. Полагают, что в вышеупомянутых соединениях данного изобретения, в которых имеется электроннонасыщенное ароматическое кольцо,в, по крайней мере, некоторых случаях карбоксамидная группа может находиться в фиксированной конформации, особенно благоприятной для действия соединения как ингибитора NAD+ связывания с PARP ферментом путем внутримолекулярной водородной связи между атомом азота имидазольного кольца и одним из водородных атомов карбоксамидной группы. Как уже указано, данное изобретение включает способы получения определенных здесь соединений (включая в некоторых случаях промежуточные соединения) и терапевтическое использование таких соединений для лечения млекопитающих. Это включает их использование для получения медицинских или ветеринарных препаратов или фармацевтических препаративных форм, содержащих эффективноеPARP ингибирующее количество активного соединения, для введения пациенту в сочетании с цитотоксическим лекарственным средством или с радиотерапией для того, чтобы увеличить цитотоксическую эффективность последнего. Такие препараты или препаративные средства могут быть получены в соответствии с любым из способов, хорошо известных в области фармации, для введения любым подходящим способом, например перорально, парентерально(включая подкожно, внутримышечно или внутривенно), или местно, причем способ введения,тип препаратов или препаративных форм и доза обычно определяются особенностями химиотерапии,цитотоксическими лекарственными средствами или радиотерапии, действие которых необходимо усилить. При получении таких фармацевтических препаративных форм в виде стерильных жидких препаратов для парентерального использования,например, предварительно определенное терапевтически эффективное нетоксичное количество конкретного рассматриваемого соединения может быть растворено в забуференном фосфатом солевом растворе, и препараты могут присутствовать в единичной дозированной форме и содержаться в герметичных ампулах, готовых для использования. В общем, по крайней мере, в водном растворе, обычно предпочтительны концентрации не более чем 200 мг/мл, но количество и доза, обычно требуемые для оптимальной эффективности, могут, конечно, варьироваться и, в конце концов, находятся в компетенции практикующего врача или ветеринара, лечащего млекопитающее, и определяются для каждого отдельного случая. Если соединение 7 должно использоваться в сочетании с цитотоксическим лекарственным средством, то последнее в некоторых случаях может вводиться одновременно и может быть включено в ту же самую фармацевтическую препаративную форму или композицию. Как указано, соединения данного изобретения имеют, по крайней мере, потенциал, какPARP ингибиторы, и в in vitro испытаниях, описанных ниже, демонстрируют положительную фармакологическую активность, которая, как полагают, отражает активность, которая может быть найдена in vivo в ходе терапевтического клинического использования. Следует иметь в виду, что там, где указано данное соединение формулы I, такое указание следует понимать, где уместно, как распространяющееся также на их фармацевтически приемлемые соли и другие фармацевтически приемлемые биопредшественники (пролекарственные формы). Термин "пролекарство" используют в данном описании для того, чтобы обозначать модифицированные формы или производные фармацевтически активного соединения, которое биодеградирует in vivo и превращается в указанное активное соединение после введения,особенно при пероральном или внутривенном введении, в ходе терапевтического лечения млекопитающего. Такие пролекарства обычно выбирают из-за повышенной растворимости в водных средах, что помогает преодолевать проблемы, связанные с получением препаративных форм и, кроме того, в некоторых случаях это дает относительно медленное или контролируемое выделение активного агента. Удовлетворительное пролекарство должно быть обычно водорастворимым производным,которое нетоксично и достаточно стабильно в растворе при физиологическом рН, но которое будет биодеградировать или превращаться, например, с помощью ферментной деградации или при изменении рН окружающей среды в активное соединение в требуемом месте после введения в ходе лечения. Для бензимидазольных соединений данного изобретения пролекарственные формы можно получить с помощью карбаматных или аминокислотных производных, например глицина или других аминокислотных карбаматных производных, или с помощью фосфатных производных. Фосфатные производные могут быть чувствительны к ферментному дефосфорилированию in vivo, и в настоящее время предпочтительны особенно водорастворимые аммониевые фосфатные соли или фосфатные соли щелочных металлов. Как правило,их можно получить из соединений структурной формулы I, имеющих, по крайней мере, один заместитель - гидроксильную группу, например,в группе ароматического ядра, взаимодействием с дибензилфосфонатом, предпочтительно в присутствии четвертичного основания, такого как 8 В случаях, где R является фенилом (или бензилом) и где необходимо иметь заместитель,отличный от гидроксила, например NO2, СО 2 Н,CN и т.д. в 4'-положении для того, чтобы получить удовлетворительную PARP ингибирующую активность, гидроксильный заместитель,подвергаемый фосфорилированию или другой пролекарственной модификации, может находиться в другом положении ароматического кольца, например, в 3'-положении. Во всех водорастворимых пролекарственных формах данного изобретения предусмотренные фосфатная, карбаматная или другая водорастворимая пролекарственная часть обычно является группой R или R' в структурной формуле I. Следует также иметь ввиду, что любое из соединений настоящего изобретения может существовать в более чем одной энантиомерной форме, все такие формы, их смеси и их получение и использование входит в объем данного изобретения. Описание примеров предпочтительных вариантов изобретения Нижеследующие примеры и описания стадий синтетических способов получения различных предпочтительных представляющих интерес соединений служат для дополнительной иллюстрации данного изобретения, но их нельзя истолковывать никоим образом, как ограничение его объема. В первом примере (пример 1) описано получение различных промежуточных соединений, необходимых для получения бензимидазольных соединений данного изобретения, которые описаны в примерах 2-6. Пример 1. Получение промежуточных соединений.(а) 3-Нитрофталаминовая кислота 3-Нитрофталевый ангидрид (10,0 г, 50 ммоль) добавляют порциями в течение 20 мин к концентрированному раствору водного аммиака(15 мл) и смесь перемешивают при 30 С в течение дополнительных 30 мин. Кристаллическую массу фталамата аммония, выпавшую после охлаждения бледно-желтого раствора, собирают и повторно растворяют в минимальном количестве теплой воды. Добавляют по каплям при перемешивании концентрированную хлористоводородную кислоту (4,5 мл) и полученную пасту промывают водой, сушат в вакууме, получая 3-нитрофталаминовую кислоту в виде тонкого белого порошка (9,01 г, 83%), т. пл. 217 С. Найдено: С, 45,76; Н, 2,79; N, 13,21. Вычислено для С 8 Н 6N2O5: С, 45,71; Н, 2,86;(b) 2-Амино-3-нитробензойная кислота (3 нитроантраниловая кислота) К перемешиваемому раствору гидроксида калия (21,4 г) в воде (110 мл) при 0 С добавляют бром (2,46 мл), затем 3-нитрофталаминовую кислоту (10 г, 47,62 ммоль). Реакционную смесь перемешивают в течение 3 ч при 60 С, охлаждают до комнатной температуры, перемешивают в течение дополнительных 12 ч. Оранжевый осадок собирают, повторно растворяют в минимальном количестве воды и подкисляют, добавляя по каплям концентрированную хлористоводородную кислоту. Перекристаллизация полученного желтого твердого вещества из горячей воды дает 3-нитроантраниловую кислоту в виде желтых микрокристаллов, (6,42 г, 74%), т. пл. 208-209 С. Найдено: С, 45,83; Н, 3,07; N, 15,21. Вычислено для С 7 Н 6N2O4: С, 46,15; Н, 3,07;(c) Метил 2-амино-3-нитробензоат Газообразный хлористый водород пропускают через раствор 2-амино-3-нитробензойной кислоты (0,5 г, 2,75 ммоль) в метаноле (40 мл) в течение 15 мин при 0 С. Реакционную смесь кипятят с обратным холодильником в течение 5 ч и дают охладиться до комнатной температуры в течение 12 ч, в результате чего осаждается метил 2-амино-3-нитробензоат в виде желтого твердого вещества (417 мг, 77%), т. пл. 95-96 С. Найдено: С, 49,09; Н, 3,78; N, 14,03. Вычислено для C8H8N2O4: С, 49,98; Н, 4,08;(d) 2,3-Диаминобензойная кислота Катализатор, палладий на углероде (10%Pd, 200 мг), осторожно добавляют в виде суспензии в метаноле (10 мл) к раствору 3 нитроантраниловой кислоты (2,44 г, 13 ммоль) в метаноле (120 мл) и смесь перемешивают в атмосфере водорода в течение 2 ч до тех пор, пока не прекратится поглощение газа. Катализатор удаляют фильтрованием через целит и фильтрат выпаривают досуха при пониженном давлении,получая неочищенный продукт. Очистка с помощью колоночной хроматографии на силикагеле смесью дихлорметан:метанол (4:1) в каче 000999 10 стве элюента дает 2,3-диаминобензойную кислоту в виде красного твердого вещества (1,34 г,66%).(0,2 г, 1,32 ммоль) в метаноле (40 мл) насыщают хлористым водородом, как описано выше, и смесь далее кипятят с обратным холодильником в течение 2 ч. Твердый остаток, полученный при выпаривании растворителя, растворяют в воде и раствор доводят до рН 7,0 кислым карбонатом натрия. После экстракции этилацетатом (2 х 30 мл), объединенные органические слои сушат(MgSО 4) и растворитель удаляют, получая метил 2,3-диаминобензоат в виде коричневого масла, которое отверждается при растирании с петролейным эфиром (petrol) (40/60) (121,6 мг,56%), т. пл. 62-63 С. Найдено: С, 58,35; Н, 5,80; N, 16,69. Вычислено для C8H10N2O2: С, 57,83; Н,6,02; N, 16,87%; н (d6-ДМСО, 200 МГц) 3,87(3 Н, с, ОСН 3), 4,90 (2 Н, шс, Ar-2-NH2), 6,32 (2 Н,шс, Аг-3-NН 2), 6,46-6,54 (1 Н, т, Аr-5 Н), 6,806,84 (1 Н, дд, Аr-4 Н), 7,18-7,23 (1 Н, дд, Аr-6 Н); м/з (ЭИ) 166 (М+), 134, 106, 79. Метил 2,3-диаминобензоат, кроме того,получают восстановлением метил 2-амино-3 нитробензоата следующим образом: раствор метил 2-амино-3-нитробензоата (284 мг, 1,45 ммоль) в метаноле (40 мл), содержащий катализатор, палладий на углероде (10% Pd, 50 мг),перемешивают в атмосфере водорода в течение 24 ч. Раствор фильтруют через целит для удаления катализатора и выпаривают растворитель в вакууме, получая сложный метиловый эфир в виде коричневого твердого вещества (180 мг,75%), идентичного метил 2,3-диаминобензоату,полученному выше.(f) Метил 2-амино-3-N-бензоиламинобензоат Раствор бензоил хлорида (38,4 мкл, 0,331 ммоль) в тетрагидрофуране (5 мл) добавляют по каплям к раствору метил 2,3-диаминобензоата(5 мл), содержащем триэтиламин (46 мкл) и 4 диметиламинопиридин (1,8 мг, 5 мол.%). После перемешивания смеси в течение 24 ч при 45 С растворители выпаривают и неочищенный продукт очищают колоночной хроматографией на силикагеле смесью петролейный эфир(40/60):этилацетат (3:2) в качестве элюента. Перекристаллизация из смеси этилацетатпетролейный эфир (40/60) дает названное соединение в виде белых кристаллов. (60 мг,74%); н (d6-ДМСО, 200 МГц) 3,95 (3 Н, с, 11 ОСН 3), 6,64 (2 Н, шс, Ar-NH2), 6,69-6,77 (1 Н, т,Ar-5H), 7,46-7,50 (1H, д, Ar-4H), 7,59-7,70 (3 Н,m, Ph-3 и Ph-3' 4H), 7,81-7,85 (1H, д, Ar-6H),8,11-8,14 (2 Н, д, Ph-2H и Ph-2'H), 9,8-9,9 (1H,шс, Аr-NHCO); м/з (ЭИ) 270 (М+), 253, 105.(378 мкл, 2,77 ммоль), триэтиламин (385,5 мкл,2,77 ммоль) и 4-диметиламинопиридин (17 мг, 5 мол.%). Реакционную смесь перемешивают при комнатной температуре в течение ночи, получая нерастворимый осадок, который собирают с помощью фильтрации. Фильтрат выпаривают при пониженном давлении и твердый остаток повторно растворяют в кипящем метаноле и фильтруют горячим, получая нерастворимое вещество. Растворитель удаляют в вакууме и твердый остаток объединяют с ранее собранным осадком. Перекристаллизация из водного метанола дает белые кристаллы названного соединения. (513,2 мг, 62%); т. пл. 179-180 С. Найдено: С, 64,26; Н, 5,31; N, 9,17. Вычислено для C16H16N2O4: С, 64,0; Н,5,33; N, 9,33%;(h) Метил 2-фенилбензимидазол-4 карбоксилат Раствор метил 2-амино-3-N-бензоиламинобензоата (6,3 мг, 0,023 ммоль) в ледяной уксусной кислоте (0,5 мл) перемешивают при кипячении с обратным холодильником в течение 15 мин. После охлаждения растворитель удаляют при пониженном давлении, получая названное соединение; н (d6-ДМСО, 200 МГц) 4,09 (3 Н, с, ОСН 3),7,40-7,48 (1H, т, Ar-5H), 7,64-7,70 (3 Н, т, 2-Рh3 Н и 3'-Рh-4 Н), 7,93-7,97 (1H, д, Аr-4 Н), 8,068,10 (1H, д, Аr-6 Н), 8,39-8,41 (2 Н, д, 2-Ph-2/2'H),12,4-12,5 (1H, шс, Ar-NHCO). Пример 2. Бензимидазол-4-карбоксамид 12 ется при охлаждении, собирают, повторно растворяют в кипящем метаноле и обесцвечивают с помощью активированного угля. Выпаривание растворителя дает бензоксазол-4-карбоновую кислоту в виде белого порошка (407,9 мг, 77%). Найдено: С, 46,11; Н, 3,63; N, 13,27. Вычислено для С 8 Н 6N2O2 НСl0,5 Н 2O: С,46,28; Н, 3,88; N, 13,49%; н (d6-ДМСО, 200 МГц) 7,7-7,8 (1 Н, т, Ar5H), 8,2-8,3 (2 Н, дд, Аг-4/6 Н), 9,55 (1H, с, имидазол-2 Н).(b) 2 стадия: получение бензимидазол-4 карбоксамида (соединение NU1066) Суспензию бензимидазол-4-карбоновой кислоты (3,974 мг, 2,45 ммоль) в тионил хлориде (10 мл) кипятят с обратным холодильником в течение 3,5 ч и тионил хлорид удаляют вакуумной дистилляцией. Твердый остаток суспендируют в сухом тетрагидрофуране (10 мл) и добавляют по каплям концентрированный водный аммиак (50 мл) при перемешивании в течение 30 мин. Избыток растворителя удаляют в вакууме и остаток растворяют в минимальном объеме воды и экстрагируют этилацетатом (2 х 20 мл). Твердое вещество, полученное после выпаривания объединенных органических слоев, растворяют в хлористо-водородной кислоте(0,1 М, 10 мл) и нерастворимый остаток удаляют фильтрованием. Водный фильтрат осторожно доводят до рН 9 с интервалами рН, равными единице, экстрагируя этилацетатом (10 мл) в каждом интервале. Объединенные экстракты сушат (МgSO4) и растворитель выпаривают. Перекристаллизация из этилацетата дает бензимидазол-4-карбоксамид (50 мг, 13%). Найдено: С, 59,95; Н, 3,90; N, 24,59. Вычислено для С 9 Н 7N3 О: С, 59,63; Н, 4,35;(200 мг, 1,32 ммоль) в хлористо-водородной кислоте (4 М, 3,2 мл) добавляют уксусную кислоту (0,23 мл) и смесь кипятят с обратным холодильником в течение 1 ч. Растворители выпаривают и оставшееся твердое вещество повторно растворяют в кипящем метаноле (5 мл) и обесцвечивают активированным углем. Удаление растворителя дает 2-метилбензимидазол-4 карбоновую кислоту в виде аморфного белого твердого вещества (167,5 мг, 72%); н (d6 ДМСО) 2,9 (3 Н, с, имидазол-2-СН 3), 7,6-7,8 (1 Н,т, Ar-5H) 8,1 (2 Н, д, Аг-4/6 Н); м/з (ЭИ) 176 (М+),158, 130.(b) 2 стадия: получение 2-метилбензимидазол-4-карбоксамида (соединение NU1064) Суспензию 2-метилбензимидазол-4 карбоновой кислоты (500 мг, 2,84 ммоль) в тионил хлориде (10 мл) кипятят с обратным холодильником в течение 2 ч и вакуумной дистилляцией удаляют тионил хлорид. Твердый остаток повторно растворяют в сухом тетрагидрофуране и добавляют по каплям концентрированный водный раствор аммиака (50 мл) в течение 30 мин при перемешивании. Растворитель удаляют в вакууме, твердый остаток повторно растворяют в минимальном количестве горячей воды,фильтруют и экстрагируют этилацетатом (2 х 30 мл). Выпариванием растворителя получают коричневое твердое вещество, которое перекристаллизуют из этилацетата, получая названное соединение в виде белого твердого вещества(a) 1 стадия: получение 2-фенилбензимидазол-4-карьоновой кислоты Смесь 2,3-диаминобензойной кислоты (0,1 г, 0,66 ммоль), бензойной кислоты (80,2 мг, 0,66 ммоль) и полифосфорной кислоты (5 мл) нагревают при 150-160 С в течение 30 мин и после охлаждения добавляют колотый лед (10 г). Нерастворимые вещества удаляют из темного раствора фильтрацией и фильтрат экстрагируют этилацетатом (2 х 20 мл), чтобы удалить непрореагировавшую бензойную кислоту. Водный раствор осторожно нейтрализуют гидроксидом натрия (10 М), фильтруют и фильтрат экстрагируют этилацетатом (2 х 30 мл). Объединенные экстракты сушат (МgSO4) и растворитель выпаривают. Хроматографируют на силикагеле смесью дихлорметан:метанол (85:15) в качестве элюента и получают названное соединение (31,2 мг, 20%); н (d6-ДМСО, 200 МГц) 7,4 (1H, т, Ar-5H),7,62 (3 Н, шс, 3-Ph-4H и 3'-Ph-4H), 7,91 (1H, д,Аг-6 Н), 7,97 (1H, д, Ar-4H), 8,39 (2 Н, д, Ph-2H и(b) 2 стадия: получение 2-фенилбензимидазол-4-карбоксамида (соединение NU1070) 2-Фенилбензимидазол-4-карбоновую кислоту (50 мг, 0,21 ммоль) растворяют в сухом тетрагидрофуране (10 мл) и добавляют тионил хлорид (16,8 мкл, 0,231 ммоль) и ДМФ (DMF)(0,05 мл). Смесь перемешивают при комнатной 14 температуре в течение 12 ч, причем образуется белый осадок, и суспензию добавляют по каплям к перемешиваемому водному аммиаку (10 мл) в течение 10 мин. Смесь перемешивают дополнительно 30 мин, разбавляют водой (20 мл) и нейтрализуют хлористо-водородной кислотой(4 М). Белое твердое вещество, которое осаждается при охлаждении, собирают фильтрацией,получая 2-фенилбензимидазол-4-карбоксамид(а) 1 стадия: получение ацетатной соли метил 2-(4'-метоксифенил)бензимидазол-4-карбоксилата Метил 2-амино-3-N-(4'-метоксибензоил) бензоат (480 мг, 1,6 ммоль) растворяют в ледяной уксусной кислоте (15 мл) и нагревают при 120-130 С в течение 30 мин. Растворитель удаляют и твердый остаток перекристаллизуют из смеси этилацетат-петролейный эфир (40/60),получая продукт в виде белого кристаллического твердого вещества, (409 мг, 75%); т. пл. 141142 С; Найдено: С, 63,68; Н, 4,79; N, 7,88. Вычислено для С 16 Н 14N2O3 СО 3 СO2 Н: С,63,16; Н, 5,26; N, 8,19%; 1257,34; н (D6-ДМСО,200 МГц) 2,02 (3 Н, с, СН 3 СО 2 Н), 3,97 (3 Н, с,ОМе), 4,09 (3 Н, с, ОМе), 7,21-7,25 (2 Н, д, J=8,6,Ph-3/3'Н), 7,39-7,46 (1H, t, Ar-5H), 7,90-7,93 (1H,д, Ar-4H), 8,00-8,04 (1H, д, Ar-6H), 8,36-8,40(b) 2 стадия: получение 2-(4'-метоксифенил)бензимидазол-4-карбоксамида (NU1076) Ацетатную соль 2-(4'-метоксифенил) бензимидазол-4-карбоксилата растворяют в избытке жидкого аммиака и нагревают при 100 С в герметизированном сосуде при давлении 40 атмосфер в течение ночи. Аммиаку дают возможность испариться, и твердый остаток собирают и промывают водой, охлажденной льдом(3 х 5 мл). Перекристаллизация из водного метанола дает названное соединение (226,4 мг,80%); т. пл. 261-263 С; Найдено: С, 66,07; Н, 4,23; N, 15,29. Вычислено для С 15 Н 13N3 О 20,2 СН 3 ОН: С,66,70; Н, 5,08; N, 15,35%;(300 мг, 1,807 ммоль) добавляют 4 трифторметилбензоил хлорид (268,4 мкл, 1,807 ммоль), триэтиламин (251,4 мкл, 1,807 ммоль) и 4-диметиламинопиридин (11 мг, 5 мол.%), и смесь перемешивают при комнатной температуре в течение ночи. Из реакционной смеси удаляют растворитель при пониженном давлении, и образующееся твердое вещество промывают этилацетатом. Дважды проводят перекристаллизацию из смеси метанол-вода, получая названное соединение в виде белого твердого вещества(b) 2 стадия: получение ацетатной соли метил 2-(4'-трифторметилфенил) бензимидазол-4 карбоксилата Метил 2-амино-3-N-(4'-трифторметилбензоил)аминобензоат (75,7 мг, 0,224 ммоль) растворяют в ледяной уксусной кислоте (5 мл) и перемешивают при 125 С в течение 0,5 ч. Растворитель выпаривают и остающееся белое твердое вещество промывают петролейным эфиром (40/60), получая названное соединение(c) 3 стадия: получение 2-(4'-трифторметил)бензимидазол-4-карбоксамида (NU1077) Ацетатную соль метил 2-(4'-трифторметилфенил)бензимидазол-4-карбоксилата растворяют в избытке жидкого аммиака и нагревают при 100 С в герметизированном сосуде под давлением 40 атмосфер в течение 12 ч. Дают возможность аммиаку испариться, и твердый остаток промывают водой, охлажденной льдом(3 х 5 мл). Перекристаллизация из смеси метанол-вода дает продукт в виде тонких белых иглNU1085). В атмосфере аргона 1 М трибромид бора в дихлорметане (3,8 мл, 3,79 ммоль) переносят в сосуд,содержащий 2-(4'-метоксифенил)бензимидазол-4-карбоксамид (NU1076 из примера 5) (202,4 мг, 0,758 ммоль). Полученный раствор кипятят с обратным холодильником в течение 24 ч, используя воздушный конденсатор(холодильник). Растворитель удаляют дистилляцией досуха. Твердый остаток обрабатывают 10% NaOH, а затем по каплям добавляют концентрированную хлористо-водородную кислоту для нейтрализации (рН 7). Белый осадок собирают фильтрованием и растворяют в этилацетате (10 мл). Органический раствор промывают водой (2 х 3 мл), сушат над MgSO4, и, удаляя растворитель при пониженном давлении, получают продукт (109,5 мг, 57%); т. пл. 266-267 С; Найдено: С, 63,27; Н, 4,37; N, 15,67. Вычислено для С 14 Н 11N3O20,75 МеОН: С,63,04; Н, 4,69; N, 15,76%;NU1090). 2-(4'-метоксифенил)бензимидазол-4 карбоксамид (NU1076 из примера 5) (105,3 мг,0,394 ммоль) и порошкообразный гидроксид калия (22 мг, 0,394 ммоль) суспендируют в ацетоне (4 мл) и перемешивают до тех пор, пока не растворятся все твердые вещества. Добавляют метил иодид (24,6 мкл, 0,394 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и белый твердый остаток очищают с помощью колоночной хроматографии смесью дихлорметан/метанол 95:5, получая тонкие белые кристаллы названного соединения. (33,2 мг, 30%), т. пл. 289292 С; Найдено: С, 68,62; Н, 5,36; N, 14,67. Вычислено для C16H15N3O2: С, 68,33; Н,5,34; N, 14,95;(NU1076 из примера 5) (75,1 мг, 0,281 ммоль) и порошкообразного гидроксида калия (15,8 мг,0,281 ммоль) и перемешивают до тех пор, пока не растворятся все твердые вещества. Добавляют бензоил хлорид (32,6 мкл, 0,281 ммоль) и раствор перемешивают в течение ночи при комнатной температуре с получением белого осадка. Растворитель удаляют при пониженном давлении и белый твердый остаток очищают с помощью колоночной хроматографии, используя смесь дихлорметан/метанол 95:5. Полученное твердое вещество перекристаллизовывают из смеси петролейный эфир (40/60)/этилацетат,получая чистый продукт в виде блестящих белых призм (15,6 мг, 15%); т. пл. 207-210 С; Найдено С, 70,45; Н, 4,60; N, 10,99. Вычислено для С 22 Н 17N3 О 30,25 СН 3 ОН: С,70,45; Н, 4,47; N, 11,08;(2 Н, д), 7,50-7,65 (4 Н, м), 7,72-7,82 (3 Н, м), 7,887,92 (2 Н, д), 8,08 (1H, C, CONH), 8,10-8,14 (1H,д), 9,1-9,2 (1H, шс, CONH); м/з (ЭИ) 371 (М+),105. Дополнительные примеры. В следующих дополнительных примерах и также некоторых уже описанных примерах используются некоторые обычные стандартные методики. Они включают:(2) Образование бензимидазольного кольца циклизацией, катализируемой кислотой(3) Образование амида реакцией с жидким аммиаком (стандартная методика С). Экспериментальные детали этих стандартных методик описаны ниже: Стандартная методика А. Готовят охлаждаемый на бане со смесью лед/соль раствор метил 2,3-диаминобензоата (1 экв.), сухого тетрагидрофурана (1-1,5 экв.) и диметиламинопиридина(ДМАП,DMAP-5 мол.%) в половине требуемого объема сухого тетрагидрофурана (ТГФ). Требуемый хлорангидрид (1 экв.) растворяют в оставшемся сухом тетрагидрофуране и добавляют к охлажденному раствору при перемешивании в течение более 30 мин. Реакционной смеси дают возможность медленно нагреться до комнатной температуры и перемешивают в течение ночи. Чтобы удалить 18 осадок, растворитель отфильтровывают и осадок суспендируют в этилацетате, промывают дважды водой, а затем насыщенным солевым раствором и сушат над МgSO4. Органический слой добавляют к реакционному фильтрату и растворитель удаляют при пониженном давлении. Твердый остаток повторно растворяют в этилацетате, промывают дважды водой, а затем насыщенным солевым раствором и сушат надMgSO4. Удаление растворителей при пониженном давлении дает твердый остаток, который очищают с помощью колоночной хроматографии и/или перекристаллизуют из подходящих растворителей. Стандартная методика В. Исходное вещество растворяют в ледяной уксусной кислоте и погружают в предварительно нагретую масляную баню при 120 С. Раствор нагревают в течение соответствующего времени и затем дают возможность охладиться до комнатной температуры. Уксусную кислоту удаляют при пониженном давлении, твердый остаток очищают с помощью колоночной хроматографии и/или перекристаллизуют из подходящих растворителей. Стандартная методика С. Исходное вещество растворяют в избытке свежесконденсированного жидкого аммиака. Нагревают до 80 С в герметизированном сосуде, создавая давление 40 атмосфер, в течение 24 ч. Аммиак испаряют и полученный твердый остаток очищают с помощью колоночной хроматографии и/или перекристаллизуют из подходящих растворителей. Пример 10. 2-(4'-Цианофенил)-1-Нбензимидазол-4-карбоксамид (NU1092).(a) 1 стадия: получение метил 2-амино-3N-(4'-цианобензоил)аминобензоата Следуя стандартной методике А, метил 2,3-диаминобензоат (300 мг, 1,81 ммоль), триэтиламин (251 мкл, 1,81 ммоль) и ДМАП (11 мг) растворяют в ТГФ (7,5 мл) и охлаждают. К раствору добавляют 4-цианобензоил хлорид (299 мг, 1,81 ммоль), растворенный в ТГФ (7,5 мл). Продукт очищают с помощью колоночной хроматографии смесью дихлорметан/метанол 99:1 с последующей перекристаллизацией из кипящего метанола (196 мг, 37%); т. пл. 198-202 С;(b) 2 стадия: получение метил 2-(4'цианофенил)-1-Н-бензимидазол-4-карбоксилата Следуя стандартной методике В, метил 2 амино-3-N-(4'-цианобензоил)аминобензоат (301 мг, 1,02 ммоль) с 1 стадии нагревают в ледяной уксусной кислоте (10 мл). Продукт получают двойной перекристаллизацией, используя смесь(с) 3 стадия: получение 2-(4'-цианофенил)1-Н-бензимидазол-4-карбоксамида (NU1092) Следуя стандартной методике С, метил 2(4'-цианофенил)-1-Н-бензимидазол-4-карбоксилат (169,5 мг, 0,612 ммоль) обрабатывают аммиаком под давлением. Неочищенный продукт повторно кристаллизуют из кипящего метанола,получая названное соединение в виде белых кристаллов (116,5 мг, 73%) т. пл. 310 С; Найдено: С, 67,81; Н, 3,89; N, 20,87; Вычислено для C15H10N4O0,2 MeOH: С,67,95; Н, 4,05; N, 20,85;(а) 1 стадия: получение метил 2-амино-3N-(4'-нитробензоил)аминобензоата Следуя стандартной методике А, метил 2,3-диаминобензоат (300 мг, 1,807 ммоль), сухой триэтиламин (276,6 мкл, 1,988 ммоль) и ДМАП (11 мг) растворяют в сухом ТГФ (12 мл). Добавляют 4-нитробензоил хлорид (335,2 мг,1,807 ммоль) в сухом ТГФ (12 мл). Колоночная хроматография смесью дихлорметан/метанол 99:1 с последующей перекристаллизацией из метанола дает чистый продукт; т. пл. 196-197 С. Найдено: С, 57,08; Н, 3,78; N, 13,25; Вычислено для С 15 Н 13N3 О 5: С, 57,14; Н,4,12; N, 13,33;(b) 2 стадия: получение метил 2-(4'нитрофенил)-1-Н-бензимидазол-4-карбоксилата Следуя стандартной методике В, метил 2 амино-3-N-(4'-нитробензоил)аминобензоат(340,2 мг, 1,08 ммоль) нагревают в ледяной уксусной кислоте (10 мл) в течение 15 мин. Продукт получают очисткой перекристаллизацией из метанола. (208 мг, 65%); т. пл. 208-210 С. Найдено: С, 60,69; Н, 3,57; N, 13,96; Вычислено для C15H11N3O4: 60,61; Н, 3,70;(c) 3 стадия: получение 2-(4'-нитрофенил)1-Н-бензимидазол-4-карбоксамида (NU1091) Следуя стандартной методике С, метил 2(4'-нитрофенил)-1-Н-бензимидазол-4-карбоксилат растворяют в жидком аммиаке и нагревают при постоянном объеме в сосуде, рассчитанном на высокое давление. Продукт очищают с помощью колоночной хроматографии из смеси дихлорметан/метанол 99:1 и перекристаллизуют из метанола; т.пл. 310 С. н 7,48-7,56 (1H, т), 7,90-7,94 (1H, д), 8,00(a) 1 стадия: получение метил 2-амино-3N-(3 -трифторметилбензоил)аминобензоата Следуя стандартной методике А, метил 2,3-диаминобензоат (200 мг, 1,205 ммоль), сухой триэтиламин (704 мкл, 5,06 ммоль) и диметиламинопиридин (ДМАП, 7,3 мг) растворяют в сухом ТГФ (7,5 мл). К раствору добавляют 3 трифторметилбензоил хлорид (183 мкл, 1,205 ммоль) в сухом ТГФ (7,5 мл). Колоночной хроматографией смесью дихлорметан/метанол 99:1 удаляют примеси и более полярный продукт элюируют смесью дихлорметан/метанол 97:3. Перекристаллизация из метанола дает продукт в виде белого твердого вещества (160,4 мг, 26%); т. пл. 157-159 С; Найдено: С, 57,14; Н, 3,57; N, 8,10; Вычислено для С 16 Н 13F3 Н 2 О 3: С, 56,80; Н,3,85; N, 8,28;(b) 2 стадия: получение ацетатной соли метил 2-(3'-трифторметилфенил)-1-Н-бензимидазол-4-карбоксилата Следуя стандартной методике В, раствор(6 мл) метил 2-амино-3-N-(3'-трифторметилбензоил)аминобензоата в ледяной уксусной кислоте нагревают в течение 15 мин. Удаление растворителя при пониженном давлении, а затем высушивание в высоком вакууме дает продукт в виде однородного белого твердого вещества (154,2 мг, 96%); т. пл. 105-107 С; Найдено: С, 56,93; Н, 3,78; N, 7,32; Вычислено для C18H13F3N2O2CH3CO2H: С,56,84; Н, 3,95; N, 7,37;(с) 3 стадия: получение 2-(3'трифторметилфенил)-1-Н-бензимидазол-4 карбоксамида (соединение NU1093) Следуя стандартной методике С, ацетатную соль метил 2-(3'-трифторметилфенил)-1-Нбензимидазол-4-карбоксилата (134,8 мг, 0,358 ммоль) обрабатывают избытком жидкого аммиака в герметизированном сосуде. Продукт очищают перекристаллизацией из метанола,получая беловатые иглы (78 мг, 72%), т. пл. 268270 С; Найдено: С, 57,68; Н, 3,82; N, 12,96; Вычислено для C15H10F3N3O0,6 СН 3 ОН: С,57,74; Н, 3,82; N, 12,95;(а) 1 стадия: получение метил 2-амино-3N-(3'-метоксибензоил)аминобензоата Следуя стандартной методике А, получают раствор метил 2,3-диаминобензоата (670,3 мг,4,038 ммоль), сухого триэтиламина (842,6 мкл,6,057 ммоль) и ДМАП (25 мг) в сухом ТГФ (20 мл). К нему добавляют раствор 3 метоксибензоил хлорида (567 мкл, 6,038 ммоль) в сухом ТГФ (20 мл). Образовавшийся твердый остаток очищают с помощью колоночной хроматографии, используя смесь дихлорметан/метанол 99:1, и получают чистый продукт после двух перекристаллизаций из смеси петролейный эфир (40/60)/этилацетат (282,6 мг, 23%),т. пл. 124-125 С; Найдено: С, 63,90; Н, 5,11; N, 9,24; Вычислено для C16H16N2O4: С, 64,0; Н,5,33; N, 9,33;(b) 2 стадия: получение ацетатной соли метил 2-(3'-метоксифенил)-1-Н-бензимидазол-4 карбоксилата Следуя стандартной методике В, метил 2 амино-3-N-(3'-метоксибензоил)аминобензоат(356,9 мг, 1,19 ммоль) нагревают в ледяной уксусной кислоте (12 мл). Удаляя растворитель при пониженном давлении с последующей перекристаллизацией из смеси петролейный эфир(40/60)/этилацетат получают названное соединение чистым (235,6 мг, 58%), т. пл. 93-94 С; Найдено: С, 62,66; Н, 5,13; N, 8,06.(c) 3 стадия: получение 2-(3'метоксифенил)-1-Н-бензимидазол-4-карбоксамида (NU1098) Следуя стандартной методике С, раствор метил 2-(3'-метоксифенил)-1-Н-бензимидазол-4 карбоксилата (203 мг, 0,596 ммоль) в жидком аммиаке нагревают при постоянном объеме. Твердый остаток перекристаллизовывают из метанола, получая очищенный продукт (73,5 мг,46%), т. пл. 223-225 С; Найдено: С, 57,52; Н, 4,91; N, 15,62; Вычислено для С 15 Н 13N3 О 2: С, 67,42; Н,4,87; N, 15,73;(a) 1 стадия: получение метил 2-амино-3 Н-(2'-трифторметилбензоил)аминобензоата Следуя стандартной методике А, перемешивают раствор метил 2,3-диаминобензоата(564 мг, 3,4 ммоль) в ТГФ (20 мл) с триэтиламином (709 мкл, 5,1 ммоль) и диметиламинопиридином (21 мг) и к смеси добавляют раствор 2 трифторметилбензоил хлорида в ТГФ (20 мл). Образовавшийся маслянистый остаток абсорбируют на силикагеле и затем подвергают колоночной хроматографии смесью дихлорметан/метанол 99:1 в качестве элюента. Получают чистый продукт после перекристаллизации из смеси петролейный эфир (40/60)/этилацетат(b) 2 и 3 стадия: получение 2-(2'трифторметил)-1-Н-бензимидазол-4-карбоксамида (NU1104) Подвергая продукт с 1 стадии последовательно стандартным методикам В и С, получают названное соединение. Пример 15. 2-(4'-Аминофенил)-1-Нбензимидазол-4-карбоксамид (NU1103). 23 Метил-2-амино-3-N-(4'-нитробензоил) аминобензоат (с 1 стадии примера 11) суспендируют в метаноле (40 мл) и добавляют суспензию катализатора, 10% палладия на активированном угле (50 мг), в метаноле (10 мл) при перемешивании в атмосфере аргона. Раствор гидрируют при атмосферном давлении в течение 2 ч. После фильтрации через целит (Per.TM) для удаления катализатора получают продукт путем удаления растворителя при пониженном давлении, что дает белое твердое вещество, которое сушат в высоком вакууме (204,1 мг, 92%), т. пл. 197-200 С; Найдено: С, 62,95; Н, 5,30; N, 14,39; Вычислено для С 15 Н 15N3 О 3: С, 63,16; Н,5,26; N, 14,73;(b) 2 стадия; получение ацетатной соли метил 2-(4'-аминофенил)-1-Н-бензимидазол-4 карбоксилата Следуя стандартной методике В, обработка метил 2-амино-3-N-(4'-аминобензоил)аминобензоата (186,5 мг, 0,654 ммоль) горячей ледяной уксусной кислотой (8 мл) в течение 30 мин дает названное соединение с последующей перекристаллизацией из смеси петролейный эфир(c) 3 стадия: получение 2-(4'-аминофенил)1-Н-бензимидазол-4-карбоксамида (NU1103) Следуя стандартной методике С, ацетатную соль метил 2-(4'-аминофенил)-1-Нбензимидазол-4-карбоксилата (113 мг, 0,346 ммоль) обрабатывают жидким аммиаком при давлении в течение 24 ч. Очищенное названное соединение выделяют с помощью колоночной хроматографии неочищенного вещества, используя смесь дихлорметан/метанол 90:10 (21,4 мг, 25%), т. пл. 237-240 С; н 5,90 (2 Н, с, NH2),6,79-6,83 (2 Н, д, J=8,3), 7,31-7,39 (1 Н, т), 7,717,75 (1H, д), 7,84 (1H, с, NH), 7,88-7,92 (1 Н, д),8,00-8,04 (2 Н, д, J=8,3), 9,5-9,6 (1H, шс, NH),13,0 (1H, шс, NH). Анализ на PARP ингибирующую активность Соединения данного изобретения, особенно соединения, детально описанные в предше 000999 24 ствующих примерах, были испытаны in vitro на активность как PARP ингибиторы, используя следующие методы и материалы. В общем, используемый PARP анализ основывается на активировании эндогенной PARP(как описано далее) в клетках, содержащих экзогенный [32P]-NAD+, включенный в них путем суспендирования клеток в растворе [32P]-NAD+,для которого они становятся проницаемыми на начальной стадии предобработки. Поли(ADPрибоза), которую затем синтезируют при помощи фермента, может быть осаждена трихлоруксусной кислотой (ТХК), и количество включенного в нее радиомеченого 32P можно измерить,например, используя сцинтилляционный счетчик, чтобы получить степень активности PARP в конкретных условиях эксперимента. При повторении эксперимента, следуя той же самой методике, и в тех же самых условиях, в присутствии каждого соединения, подлежащего испытанию, уменьшение активности фермента, характеризующее ингибирующее действие испытываемого соединения, можно затем установить по уменьшению, если оно имеет место, количества [32P], определенного в осажденной при помощи ТХК поли(ADP-рибозы). Результаты этого анализа могут быть выражены в виде процента ингибирования или уменьшения активности для одной или более различных концентраций каждого испытываемого соединения или их можно выразить в виде концентрации испытываемого соединения, которая снижает ферментативную активность на 50%, т.е. величиной IC50. Таким образом, для ряда различных соединений можно получить ряд сравнительных значений ингибирующей активности. На практике L1210 мышиные лейкозные клетки были использованы в качестве источникаPARP фермента, после того как их сделали проницаемыми для экзогенного [32P]NAD, помещая в гипотоническом буфере и подвергая шоку холодом. Разработана предпочтительная методика для получения точных и воспроизводимых результатов, в которой определенное количество небольшого синтетического олигонуклеотида, в частности, одноцепочечного олигонуклеотида,имеющего повторяющуюся последовательностьCGGAATTCCG, вводят в суспензию клеток для активации PARP фермента. Эта олигонуклеотидная последовательность скручивается с образованием двуцепочечной молекулы с единственным дефосфорилированным концом и обеспечивает эффективный субстрат для активацииPARP. Ее поведение как мощного активатора фермента подтверждается проведенными испытаниями. Принят экспериментальный протокол, в котором вышеупомянутый синтетический олигонуклеотид вводят в качестве специфического активатора PARP, и он дискриминирует междуPARP и другими моно-ADP-рибосилтрансферазами в клетках. Тем самым, введение таких синтетических олигонуклеотидов вызывает 5-6 кратную стимуляцию во введенной радиоактивной метке и это приписывается исключительноPARP активности. Дополнительные детали анализа представлены ниже. Материалы. Используемые материалы включают:(92 мг/100 мл) Вышеупомянутые ингредиенты растворяют в приблизительно 80 мл дистиллированной воды, рН доводят до 7,8 (NaOH/HCl), затем раствор доводят до 100 мл дистиллированной водой, хранят в холодильнике. DTT добавляют к 5 мМ непосредственно перед использованием (50 мкл/мл). Изотонический буфер: 40 мМ Hepes(15,39 г/200 мл) Вышеупомянутые ингредиенты растворяют в приблизительно 150 мл дистиллированной воды, рН доводят до 7,8 (NaOH/HCl), раствор затем доводят до 200 мл дистиллированной водой и хранят в холодильнике. DTT добавляют к 2,5 мМ непосредственно перед использованиемNAD хранят в виде твердого вещества в виде предварительно взвешенных аликвот при-20 С. Из них приготавливают свежие растворы с концентрацией приблизительно 6 мМ (4-4,5 мг/мл) незадолго перед проведением анализа, и контролируют молярность путем измерения оптической плотности (O.D., О.П.) при 260 нм. Исходный раствор затем разбавляют водой, получая концентрацию 600 мкм, и добавляют небольшое количество 32P меченого NAD (например, 2-5 мкл/мл). Олигонуклеотид. Олигонуклеотид, имеющий повторяющуюся последовательность CGGAATTCCG,синтезированный стандартным способом, сушат в вакууме и хранят в виде твердой лепешки в морозильнике. Перед использованием его готовят с концентрацией до 200 мкг/мл в 10 мМ Трис/HCl, рН 7,8, причем каждую лепешку растворяют полностью в 50 мл буфера. Затем раствор нагревают до 60 С на водяной бане в тече 000999 26 ние 15 мин и дают возможность медленно охладиться, чтобы гарантировать корректное повторное получение лепешки. После добавления 9,5 мл буфера концентрацию контролируют путем измерения оптической плотности разбавленной пробы при 260 нм. Основной раствор затем разбавляют до концентрации 200 мкг/мл и хранят в виде 500 мкл аликвот в морозильнике,готовый для использования. ТХК. Растворы ТХК (трихлоруксусная кислота) готовят в двух концентрациях. 10% ТХК + 10% пирофосфат натрия и 1% ТХК + 1% пирофосфат натрия. Клетки.L1210 клетки, используемые в качестве источника PARP фермента, сохраняют в виде суспензии культуры в RPMI среде + 10% фетальная бычья сыворотка + глутамин и антибиотики(пенициллин и стрептомицин). Также добавляют HEPES и бикарбонат натрия и клетки высевают в 100-200 мл среды так, чтобы концентрация во время проведения анализа составляла приблизительно 8 х 105/мл. Способ. Тестируемые соединения обычно готовят в виде концентрированного раствора в ДМСО(диметилсульфоксид). Растворимость соединения затем контролируют путем добавления некоторого количества ДМСО раствора к некоторому количеству изотонического буфера в требуемых конечных пропорциях, которые необходимы для осуществления анализа, и затем некоторое количество раствора исследуют под микроскопом для определения признаков образования кристаллов. Требуемое количество клеток, установленное путем подсчета с помощью гемоцитометра,затем центрифугируют (1500 об/мин в центрифуге "Europa"' модель 24 М в течение 5 мин),супернатант удаляют и полученные осадки вновь суспендируют в 20 мл забуференного фосфатом солевого раствора, свободного от Са и Мg (Dulbeco's модификация А, с аббревиатурой Dul А) при 4 С до проведения повторного центрифугирования при 1500 об/мин и 4 С. После повторного удаления супернатанта клетки вновь суспендируют при концентрации 3 х 107 клетки/мл в охлажденном льдом гипотоническом буфере и оставляют в течение 30 мин на льду. Затем добавляют девять объемов охлажденного льдом изотонического буфера, и клетки, ставшие теперь проницаемыми для экзогенного NAD+, затем используют в течение следующего часа для проведения анализа. Проницаемость клеток может быть проконтролирована на этой стадии путем добавления двойных аликвот клеток к равному объему трипана голубого, выдерживания в течение 5 мин и затем подсчета на гемоцитометре. Клетки, ставшие проницаемыми, будут поглощать трипан голубой и окрасятся. 27 Затем осуществляют анализ, используя для удобства 15 мм пластиковые пробирки с коническим дном для анализа, установленные в вибрирующую водяную баню при 26 С, температуре, оптимальной для этого фермента. В типичном анализе, используя раствор олигонуклеотида при концентрации 5 мкг/мл и раствор испытываемое соединение/ДМСО при концентрации 2% и осуществляя анализ в четырех повторах, в каждую пробирку для анализа обычно помещают 5 мкл раствора олигонуклеотида, 50 мкл 600 мкМ NAD + [32P]-NAD раствор, 8 мкл раствора испытываемое соединение/ДМСО и 37 мкл воды. До начала эксперимента этот "коктейль" обычно предварительно нагревают в течение 7 мин при 26 С так же, как и клеточную суспензию. Затем реакцию обычно начинают добавлением 300 мкл клеточной суспензии. Реакцию обычно останавливают добавлением 2 мл охлажденного льдом раствора 10% ТХК + 10% пирофосфат натрия. В дополнение к вышеприведенному,обычно шесть пробирок для анализа ставят в качестве контролей, причем они содержат те же самые вышеупомянутые ингредиенты, но перед добавлением клеточной суспензии добавляют ТХК раствор для предотвращения любой реакции, которая может произойти. Это дает возможность ввести поправки на какое-либо неспецифическое связывание меченого вещества с используемым фильтром (см. ниже). После добавления клеточной суспензии в определенные интервалы времени в каждую из пробирок для анализа добавляют 10% ТХК + 10% пирофосфат натрия при 4 С в каждую пробирку для анализа строго через 5 мин после добавления клеточной суспензии в ту же пробирку. Затем после выдерживания пробирок на льду в течение минимум одного часа, содержимое каждой индивидуальной пробирки фильтруют через индивидуальную фильтровальную воронку фильтровального устройства с отсасыванием,используя GF/C фильтровальные элементы (шероховатой стороной вверх), смоченные 10% ТХК. После фильтрования содержимого каждой пробирки и промывания фильтров несколько раз раствором 1% ТХК + 1% пирофосфат натрия, фильтры осторожно удаляют и сушат до помещения в индивидуальные сцинтилляционные пробирки. Четыре дополнительные сцинтилляционные пробирки также устанавливают в качестве стандартов сравнения, содержащих 10 мкл 600 мкМ NAD + [32P]-NAD раствора, причем 10 мл сцинтиллят затем добавляют в каждую пробирку. Счет проводят через 2 мин насчетчике, определяя количество присутствующего 32P и, таким образом, количество поли(ADP-рибозы) и активность PARP фермента. 28 Результаты in vitro изучения PARP ингибирования Помимо проведения PARP ферментного анализа в соответствии со стандартной методикой, описанной выше в общих чертах, для ряда соединений, которые были получены в соответствии с данным изобретением, с целью сравнения его также проводят с некоторыми бензамидными соединениями, в частности бензамидом, 3-гидроксибензамидом и 3-метоксибензамидом которые, как уже известно, демонстрируют некоторую PARP ингибирующую активность. Перечень некоторых иллюстративных соединений, которые были получены и/или изучены, представлен ниже в таблице в конце данного описания вместе с результатами анализаPARP ингибирования, полученными в одном или нескольких различных экспериментах, выраженными либо как процент ингибирования при 10 мкМ концентрации, либо, чаще всего,как IC50 значения, для соединений, испытанных в соответствии с описанным выше анализом. При рассмотрении этого перечня известныеPARP ингибиторы,банзамид,3 аминобензамид и 3-метоксибензамид могут рассматриваться как соединения сравнения. Хотя результаты варьируются в некоторой степени, в общем, соединения данного изобретения, которые подвергались испытанию, демонстрируют относительно высокую степень ингибирующей активности. Особый интерес представляют бензамидазол карбоксамиды, имеющие ссылочные номера NU1064, NU1066, NU1086, и наиболее интересны NU1070, NU1076, NU1077, NU1085,NU1090, NU1091, NU1092, NU1093 и NU1098,среди которых NU1091 и NU1092 демонстрируют исключительно высокую ингибирующую активность. Дополнительные исследования биологической активности Используют культуры мышиной лейкозной L1210 клеточной линии для проведения экспериментов по ингибированию роста для того, чтобы оценить цитотоксическое действие соединений, и проводят анализы по клоногенному выживанию, чтобы оценить цитотоксичность, особенно в отношении использования соединений в сочетании с цитотоксическими средствами, повреждающими ДНК, такими как цитотоксические противоопухолевые лекарственные средства или гамма-облучение. ДНК повреждение и действие PARP ингибиторов на процесс образования разрыва в цепи ДНК и восстановления также оценивают проведением анализов разрыва цепи ДНК и контролирования щелочным элюированием в соответствии с опубликованными методиками. При анализах ингибирования роста обычноL1210 клетки высевают при 1 х 106/мл в трех повторениях в 24-луночные планшеты и спустя 24 ч добавляют соединения и лекарственные средства, подлежащие испытанию, в выбранных 29 комбинациях и концентрациях. В это время одно из повторений обычно обсчитывают, используя Coulter счетчик (N0), и спустя 48 ч подсчитывают оставшиеся образцы (N1). Затем устанавливают процент (%) ингибирования роста образцов, обработанных лекарственным средством. В случае экспериментов с комбинацией лекарственных средств, где предполагают очевидность синтетического действия на рост клеток или клоногенность, используют единственную, фиксированную концентрацию образца цитотоксического лекарственного средства, например, темозоломида (temozolomide, ТМ), которую берут как контрольную величину. Примеры in vitro анализов на цитотоксичность В конкретном примере in vitro анализа на цитотоксичность при использовании соединения NU1064 (2-метилбензимидазол-4-карбоксамид) L1210 мышиные (или крысиные) лейкозные клетки инкубируют с возрастающими концентрациями NU106 в присутствии или отсутствии 100 мкМ метилирующего агента, темозоломида при конечной ДМСО концентрации 1% в течение 24 ч при 36 С. Клетки осаждают центрифугированием, повторно суспендируют в свежей среде, подсчитывают и производят посев для образования колонии в 0,15% агарозу в свободной от лекарственного средства среде. Через 1 неделю колонии жизнеспособных клеток окрашивают МТТ (1 мл 0,5 мг/мл) и подсчитывают. Эффективность культивирования контроляNU1064 обработанных клеток выражают в виде процента от этих значений. Имело место умеренное снижение выживших клеток, вызванное только NU1064 (относительная эффективность культивирования при 100 мкМ и 200 мкМ NU1064 = 72% и 54% соответственно), но очень заметное увеличение в цитотоксичности темозоломида при возрастании концентраций NU1064 (относительная эффективность культивирования при 100 и 200 мкМ NU1064 = 28% и 2% соответственно), что указывает на усиление цитотоксичности темозоломида, связанное с концентрацией NU1064. Иллюстрация этих результатов представлена на фиг. 1 приложенного чертежа. В других анализах на клоногенное выживание обычно L1210 клетки подвергают воздействию изменяющихся концентраций ТМфиксированная концентрация PARP ингибитора в течение фиксированного времени 16 ч, до подсчитывания и посева для образования колонии в 0,12-0,15% агарозу в свободной от лекарственного средства среде. Спустя 7-10 дней колонии обычно подвергают окрашиванию 0,5 мг/мл МТТ и подсчитывают визуально в разделенном сеткой освещенном боксе. Это дает возможность построить кривые выживания и получитьDEF10 значения, причем DEF10 определяют как отношение концентрации ТМ, которая снижает выживание до 10%, деленной на концентрацию ТМ, которая снижает выживание до 10% в присутствии фиксированной концентрации PARP ингибитора. В дополнительных анализах на клоногенное выживание можно использовать облучение гамма-лучами для повреждения клеток. ОбычноL1210 клетки (3 мл, 4 х 103/мл в миниатюрных пластмассовых бутылочках) облучают при 4 С варьирующими дозами гамма-лучей в присутствии или отсутствии соединения, подлежащего испытанию, и конечной концентрации 2% ДМСО. Затем клетки инкубируют при 37 С в течение 2 ч при непрерывном присутствии или отсутствии PARP ингибитора до их посева для образования колоний. Восстановление потенциально летального повреждения (PLD) происходит, когда клетки выдерживают в стационарной фазе после инициирования PLD до того, как происходит допустимое деление клетки. В других типичных экспериментах для тестирования потенциальныхPARP ингибиторов L1210 клеткам дают возможность восстановить гамма-лучевое PLD в присутствии или отсутствии испытываемого соединения следующим образом: L1210 клетки выдерживают в культуре до тех пор, пока они не достигнут стационарной фазы (106 клеток/мл). Их разбавляют до 1,5 х 105/мл в кондиционированной среде из культур стационарной фазы, чтобы предотвратить дальнейшее деление клетки (цитокенез). Повторные 2-мл образцы клеток в пластмассовых миниатюрных бутылочках выдерживают на льду до и немедленно после облучения гамма-лучами дозой 8 Грэй(Gray). 1 мл 3-кратной конечной концентрации испытываемых соединений, полученный в кондиционированной среде из стационарных культур, затем добавляют, получая соответствующие конечные концентрации (например, 106 клеток/мл в 1% ДМСОиспытываемые соединения), и клетки инкубируют при 37 С в течение 0, 2 или 4 ч до повторного суспендирования в свободной от лекарственного средства среде и посева для образования колоний. Необлученные культуры стационарной фазы, инкубированные при 37 С в течение 0, 2 или 4 ч с 1% ДМСОто же самое количество испытываемого соединения, представляют собой соответствующие контроли для определения относительного выживания клеток. В отсутствии PARP ингибитора,выживаемость клетки обычно увеличивается со временем, предоставленным для PLD восстановления, которое происходит. Например, в одной серии экспериментов, когда осуществляют посев немедленно после облучения (нет восстановления), выживает только около 0,2% клеток, но после 4-часового периода восстановления выживание увеличивается до 0,7%. Эффективный PARP ингибитор блокирует это восста 31 новление, таким образом уменьшая степень выживания. Что касается ранее упомянутых анализов по разрыву цепи ДНК, обычно образцы L1210 клеток инкубируют в течение определенного времени, например 1 ч, с фиксированной концентрацией, например 150 мкм, темозоломида и,за исключением контроля, в присутствии возрастающих концентраций испытываемых PARP ингибиторов. Чем более эффективен ингибитор,тем выше скорость щелочного элюирования(измерение меры разрушения цепи) по сравнению с одним темозоломидом. В целом, проведенные исследования полностью подтверждают мнение, что PARP ингибирующие характеристики испытываемых соединений отражают способность этих соединений потенцировать (усиливать) цитотоксичность средств, повреждающих ДНК, таких как некоторые цитотоксические противоопухолевые лекарственные средства, и радиацию, используемую в радиотерапии. Таким образом, можно ожидать, что вследствие своих сильных PARP ингибирующих характеристик соединения данного изобретения будут особенно полезны для введения в сочетании с цитотоксическими лекарственными средствами или радиотерапией,для того, чтобы потенцировать цитотоксическое действие последних в ходе медицинского лечения, как указано выше. Выводы Хотя данное изобретение следует рассматривать в целом, как включающее каждый и все новые признаки или комбинацию признаков,раскрытых здесь, главные аспекты изобретения включают принципиально, но не исключительно, следующее:(i) Новые соединения формулы (I), определенные здесь;(ii) Соединения формулы (I) с определенными выше заместителями (включая пролекарственные формы и их соли) для лечения или использования в медицине и для получения медицинских препаратов, полезных, например, какPARP ингибиторы, которые вводят в сочетании с цитотоксическими лекарственными средствами, или с радиотерапией для потенцирования эффективности последних в лечении рака;(iii) Способы получения определенных здесь новых соединений формулы (I), включая любые новые промежуточные соединения, получаемые при проведении таких способов;(iv) Фармацевтические препаративные формы, включающие определенное здесь соединение формулы (I) вместе с фармацевтически приемлемым носителем; и(v) Способ получения фармацевтической препаративной формы, как определено в (iv) выше, например, с помощью способов, на которые ссылаются.(например, ацетил или бензоил) или необязательно замещенной арильной (например, фенил) или аралкильной (например, бензил или карбоксибензил) группы. 2. Применение по п.1 бензимидазольного соединения, определенного в нем, где каждая присутствующая алкильная группа, либо как таковая, либо как часть алкокси или другой группы, содержит 1-6 углеродных атомов. 3. Применение по п.1 бензимидазольного соединения, определенного в п.1 или 2, гдеR представляет необязательно замещенную фенильную группу, имеющую структурную формулу II ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение бензимидазольного соединения, имеющего общую структурную формулуI или его фармацевтически приемлемой соли,и/или пролекарственной формы в качестве активного агента для получения лекарственного препарата или ветеринарного препарата для использования в лечении для ингибирования активности фермента-поли(ADP-рибоза)полимеразы или PARP (также известного как ADPрибозил трансфераза или ADPRT), причем ингибирование фермента составляет элемент терапевтического лечения,отличающееся тем, что указанное бензимидазольное соединение обеспечивает активное средство, ингибирующее PARP фермент, и в структурной формуле IR выбран из водорода, алкильной, гидроксиалкильной (например, СН 2 СН 2 ОН), ацильной (например, ацетил или бензоил) или необязательно замещенной арильной (например, фенил) или аралкильной (например, бензил или карбоксибензил) группы, и где R1, R2 и R9 каждый независимо выбран из Н,гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 иR6 каждый независимо является водородом, алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например,CONH2), тетразола, алкила, гидроксиалкила,CW3 или W (причем W является галогеном) иCN. 4. Применение по п.1 бензимидазольного соединения, определенного в п.3, где R1 представляет группу, отличную от водорода, и находится в 4'-положении и где R2 и R9 каждый представляет водород. 5. Применение по п.1 бензимидазольного соединения, определенного в любом из предшествующих пунктов, гдеR' представляет необязательно замещенную фенильную группу, имеющую структурную формулу III где R7, R8 и R10 каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6 (причемR5 и R6 каждый независимо является водородом,алкилом или алкокси), NНСОR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например,CONH2), тетразола, алкила, гидроксиалкила,CW3 или W (причем W является галогеном) и 35 из метила, этила, н-пропила, изо-пропила, нбутила, трет-бутила и циклогексила. 8. Применение по п.1 бензимидазольного соединения, определенного в нем, где R' представляет водород или алкил и R представляет фенил или бензил, имеющий, по крайней мере,один заместитель в бензольном кольце, который выбран из гидрокси, алкокси, NO2, N3, NR5R6(причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NHCOR3(причем R3 является алкилом или арилом),CO2R4 (причем R4 является Н или алкилом),амида (например, CONH2), тетразола, алкила,гидроксиалкила, CW3 или W (причем W является галогеном) и CN. 9. Применение по п.1 бензимидазольного соединения, которое представляет собой одно из следующих:(р) N-карбоксибензил-2- (4'-метоксифенил) бензимидазол-4-карбоксамид. 10. Применение по п.1 бензимидазольного соединения, определенного в любом из предшествующих пунктов, где указанное соединение находится в форме пролекарства, имеющего группу-заместитель, выбранную из фосфата,карбамата и аминокислоты. 11. Применение по п.1 бензимидазольного соединения, которое представляет фосфатное производное соединения, имеющего общую структурную формулу I, и которое представляет собой пролекарственную форму бензамидазольного соединения, определенного в любом из пп.1-9. 36 12. Применение по п.1 бензимидазольного соединения в форме пролекарства в виде фосфатного производного, которое является водорастворимой фосфатной солью аммония или щелочного металла, полученной из бензимидазольного соединения, которое имеет структуру,определенную в любом из пп.1-9, где, по крайней мере, один заместитель является гидроксильной группой. 13. Применение по п.12, где бензимидазольное соединение, из которого получают пролекарство в виде фосфатного производного,имеет заместитель - гидроксильную группу,которая взаимодействует с дибензилфосфонатом. 14. Бензимидазольное соединение, имеющее общую структурную формулу I или его фармацевтически приемлемая соль и/или пролекарственная форма, в которомR выбран из водорода, алкильной, гидроксиалкильной и необязательно замещенной арильной или аралкильной группы, при условии, что R не является 4'-метансульфонилокси 2'-метоксифенилом или 4'-метансульфониламино-2'-метоксифенилом и не представляет фенильную группу, имеющую заместитель, который представляет алкилсульфенильную, алкилсульфинильную, алкансульфонильную или алкилсульфоксимино группу, алкилсульфоксимино группу, замещенную по атому азота алканоильной, алкилсульфонильной или гидроксикарбонилалкиленкарбонильной группой, этокси или н-пропокси группу, каждая из которых замещена в концевом положении алкилсульфенильной, алкилсульфинильной, алкансульфонильной или алкилсульфоксимино группой, алкокси-карбониламино илиR' выбран из водорода, алкила, гидроксиалкильной, ацильной или необязательно замещенной арильной группы, при условии, чтоR' не включает бифенильную или замещенную бифенильную группу в качестве активного фармацевтического агента. 15. Бензимидазольное соединение, имеющее общую структурную формулу I или его фармацевтически приемлемая соль, гдеR выбран из водорода, гидроксиалкильной и замещенной арильной группы; при условии, что R не является 4'метансульфонилокси-2'-метоксифенилом или 4' 37 метансульфониламино-2'-метоксифенилом и не является фенильной группой, имеющей заместитель, который представляет алкилсульфенильную, алкилсульфинильную, алкансульфонильную или алкилсульфоксимино группу, алкилсульфоксимино группу, замещенную по атому азота алканоильной, алкилсульфонильной или гидроксикарбонилалкиленкарбонильной группой, этокси или н-пропокси группу,каждая из которых замещена в концевом положении алкилсульфенильной, алкилсульфинильной, алкансульфонильной или алкилсульфоксимино группой, алкоксикарбониламино или Nалкиламинокарбониламино группу; иR' выбран из водорода, алкила, гидроксиалкильной, ацильной или необязательно замещенной арильной группы, при условии, что R' не включает бифенильную или замещенную бифенильную группу. 16. Соединение по п.14 или 15, где каждая присутствующая алкильная группа, либо как таковая, либо как часть алкокси или другой группы, содержит 1-6 углеродных атомов. 17. Соединение по любому из пп.14, 15 или 16, где R представляет фенильную группу,имеющую структурную формулу где R1, R2 и R9 каждый независимо выбран из Н,гидрокси, алкокси, NO2, N3, NR5R6 (причем R5 иR6 каждый независимо является водородом, алкилом или алкокси), NНСОR3 (причем R3 является алкилом или арилом), СО 2R4 (причем R4 является Н или алкилом), амида (например,CONH2), тетразола, алкила, гидроксиалкила,CW3 или W (причем W является галогеном) иCN. 18. Соединение по п.17, где R1 представляет группу, отличную от водорода, и находится в 4'-положении и где R2 и R9 каждый представляет водород. 19. Соединение по любому из пп.14-18, гдеR' представляет необязательно замещенную фенильную группу, имеющую структурную формулу III где R7, R8 и R10 каждый независимо выбран из Н, гидрокси, алкокси, NO2, N3, NR5R6 (причемR5 и R6 каждый независимо является водородом,алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), СO2R4 (причем R4 является Н или алкилом), амида (например,CONH2), тетразола, алкила, гидроксиалкила,CW3 или W (причем W является галогеном) и 38 20. Соединение по п.19, где R7 представляет группу, отличную от водорода, и находится в 4'-положении и где R8 и R10 каждый представляет водород. 21. Соединение по п.14 или 15, где R выбран из метила, этила, н-пропила, изо-пропила,н-бутила, трет-бутила и циклогексила. 22. Соединение по п.14 или 15, где R' представляет водород и R представляет либо фенильную, либо бензильную группу, имеющую, по крайней мере, один заместитель в бензольном кольце, который выбран из гидрокси,алкокси, NO2, N3, NR5R6 (причем R5 и R6 каждый независимо является водородом, алкилом или алкокси), NHCOR3 (причем R3 является алкилом или арилом), CO2R4 (причем R4 является Н или алкилом), амида (например, CONH2), тетразола, алкила, гидроксиалкила, CW3 или W(причем W является галогеном) и CN. 23. Соединение по п.14 или 15, которое представляет собой одно из следующих:(m) N-карбоксибензил-2-(4'-метоксифенил) бензимидазол-4-карбоксамид. 24. Соединение по любому из пп.14-23, которое пригодно для перорального или внутривенного терапевтического введения и находится в форме пролекарства, имеющего группузаместитель, выбранную из фосфата, карбамата и аминокислоты. 25. Соединение по п.24, где пролекарственная форма представляет фосфатное производное соединения, имеющего общую структурную формулу I. 26. Соединение по п.25, причем указанное соединение находится в пролекарственной фосфатной форме, которое представляет собой водорастворимую фосфатную соль аммония или щелочного металла, полученную из соединения структурной формулы I, которое имеет, по крайней мере, один заместитель - гидроксильную группу. 27. Соединение по п.26, где соединение структурной формулы I, из которого получают пролекарство в фосфатной форме, имеет заместитель - гидроксильную группу, которая взаимодействует с дибензилфосфонатом. 28. Способ получения соединения общей формулы I где R такой, как определен в п.17, и R' такой,как определен в пп.14, 15, включающий стадии взаимодействия алкил 2,3-диаминобензоата с арил хлорангидридом кислоты, обработки продукта уксусной кислотой при повышенной температуре с образованием бензимидазольного кольца и взаимодействия с жидким аммиаком с получением амидного производного. 29. Применение соединения по любому из пп.14-27 в качестве активногоPARPингибирующего агента. 30. Применение соединения по любому из пп.14-27 в качестве активного агента для получения лекарственного препарата или ветеринарного препарата для использования в терапевтическом лечении млекопитающего. 31. Фармацевтическая композиция, обладающая PARP-ингибирующей активностью,содержащая в качестве активного агента соединение по любому из пп.14-27 в единичной дози 40 рованной форме, составленной для введения млекопитающему, которому показано лечениеPARP-ингибирующим агентом. 32. Фармацевтическая композиция, обладающая PARP-ингибирующей активностью для медицинского применения, включающая в качестве активного агента эффективное PARPингибирующее количество соединения по любому из пп.14-27 вместе с фармацевтически приемлемым носителем. 33. Фармацевтический состав или композиция по п.31 или 32 для применения в сочетании с цитотоксическими средствами или радиотерапией при противоопухолевом лечении. 34. Фармацевтическая композиция, содержащая эффективное PARP-ингибирующее количество соединения по любому из пп.14-27 в смеси с терапевтически полезным и эффективным количеством цитотоксического лекарственного средства для применения при противоопухолевом лечении. 35. Способ терапевтического лечения, проводимого на млекопитающем, для которого полезно ингибирование активности PARP фермента, где указанный способ включает введение указанному млекопитающему эффективногоPARP-ингибирующего количества соединения по любому из пп.14-27. 36. Способ терапевтического лечения, проводимого на млекопитающем, по п.35, отличающийся тем, что дополнительно включает введение ДНК-повреждающего цитотоксического лекарственного средства или радиотерапию в ходе противоопухолевого лечения.
МПК / Метки
МПК: A61K 31/415, A61P 35/00, C07D 235/06
Метки: бензимидазола, соединение
Код ссылки
<a href="https://eas.patents.su/21-999-soedinenie-benzimidazola.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение бензимидазола</a>
Предыдущий патент: Прерыватель электрической цепи
Следующий патент: Производные пептидов
Случайный патент: Управление разделением фаз в отстойнике в процессе производства уксусной кислоты












