Антитела к cgrp
Номер патента: 22931
Опубликовано: 31.03.2016
Авторы: Дарлинг Райан Джеймс, Аллан Барретт, Беншоп Роберт Ян, Чамберс Марк Джоффри
Формула / Реферат
1. Сконструированное антитело человека, содержащее вариабельную область легкой цепи (LCRV) и вариабельную область тяжелой цепи (HCVR), причем указанная LCVR содержит последовательности аминокислот LCDR1, LCDR2 и LCDR3, a HCVR содержит последовательности аминокислот HCDR1, HCDR2 и HCDR3, причем LCDR1 представляет собой SEQ ID NO: 10, LCDR2 представляет собой SEQ ID NO: 11, LCDR3 представляет собой SEQ ID NO: 5, HCDR1 представляет собой SEQ ID NO: 12, HCDR2 представляет собой SEQ ID NO: 37, a HCDR3 представляет собой SEQ ID NO: 38, при этом указанное сконструированное антитело, связывается с CGRP человека.
2. Сконструированное антитело человека по п.1, причем LCDR1 представляет собой RASQDIDNYLN (SEQ ID NO: 3), LCDR2 представляет собой YTSEYHS (SEQ ID NO: 4), LCDR3 представляет собой QQGDALPPT (SEQ ID NO: 5), HCDR1 представляет собой GYTFGNYWMQ (SEQ ID NO: 12), HCDR2 представляет собой AIYEGTGDTRYIQKFAG (SEQ ID NO: 13) и HCDR3 представляет собой LSDYVSGFSY (SEQ ID NO: 14).
3. Сконструированное антитело человека по п.1, причем LCDR1 представляет собой RASQDIDNYLN (SEQ ID NO: 3), LCDR2 представляет собой YTSEYHS (SEQ ID NO: 4), LCDR3 представляет собой QQGDALPPT (SEQ ID NO: 5), HCDR1 представляет собой GYTFGNYWMQ (SEQ ID NO: 12), HCDR2 представляет собой AIYEGTGKTVYIQKFAG (SEQ ID NO: 15) и HCDR3 представляет собой LSDYVSGFSY (SEQ ID NO: 14).
4. Сконструированное антитело человека по п.1, причем LCDR1 представляет собой RASKDISKYLN (SEQ ID NO: 6), LCDR2 представляет собой YTSGYHS (SEQ ID NO: 7), LCDR3 представляет собой QQGDALPPT (SEQ ID NO: 5), HCDR1 представляет собой GYTFGNYWMQ (SEQ ID NO: 12), HCDR2 представляет собой AIYEGTGKTVYIQKFAD (SEQ ID NO: 16) и HCDR3 представляет собой LSDYVSGFGY (SEQ ID NO: 39).
5. Сконструированное антитело человека по п.1, причем LCDR1 представляет собой RASRPIDKYLN (SEQ ID NO: 8), LCDR2 представляет собой YTSEYHS (SEQ ID NO: 4), LCDR3 представляет собой QQGDALPPT (SEQ ID NO: 5), HCDR1 представляет собой GYTFGNYWMQ (SEQ ID NO: 12), HCDR2 представляет собой AIYEGTGKTVYIQKFAG (SEQ ID NO: 15) и HCDR3 представляет собой LSDYVSGFGY (SEQ ID NO: 39).
6. Сконструированное антитело человека по п.1, причем LCDR1 представляет собой RASQDIDKYLN (SEQ ID NO: 9), LCDR2 представляет собой YTSGYHS (SEQ ID NO: 7), LCDR3 представляет собой QQGDALPPT (SEQ ID NO: 5), HCDR1 представляет собой GYTFGNYWMQ (SEQ ID NO: 12), HCDR2 представляет собой AIYEGTGKTVYIQKFAG (SEQ ID NO: 15) и HCDR3 представляет собой LSDYVSGFGY (SEQ ID NO: 39).
7. Сконструированное антитело человека по п.1, причем последовательность аминокислот LCVR представляет собой SEQ ID NO: 42, а последовательность аминокислот HCVR представляет собой SEQ ID NO: 43.
8. Сконструированное антитело человека по п.2, причем указанная последовательность аминокислот LCVR представляет собой SEQ ID NO: 17, а указанная последовательность аминокислот HCVR представляет собой SEQ ID NO: 22.
9. Сконструированное антитело человека по п.3, причем указанная последовательность аминокислот LCVR представляет собой SEQ ID NO: 18, а указанная последовательность аминокислот HCVR представляет собой SEQ ID NO: 23.
10. Сконструированное антитело человека по п.4, причем указанная последовательность аминокислот LCVR представляет собой SEQ ID NO: 19, а указанная последовательность аминокислот HCVR представляет собой SEQ ID NO: 24.
11. Сконструированное антитело человека по п.5, причем указанная последовательность аминокислот LCVR представляет собой SEQ ID NO: 20, а указанная последовательность аминокислот HCVR представляет собой SEQ ID NO: 25.
12. Сконструированное антитело человека по п.6, причем указанная последовательность аминокислот LCVR представляет собой SEQ ID NO: 21, а указанная последовательность аминокислот HCVR представляет собой SEQ ID NO: 26.
13. Сконструированное антитело человека по п.8, причем указанное антитело содержит легкую цепь и тяжелую цепь, причем последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 27, а последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 32.
14. Сконструированное антитело человека по п.9, причем указанное антитело содержит легкую цепь и тяжелую цепь, причем последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 28, а последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 33.
15. Сконструированное антитело человека по п.10, причем указанное антитело содержит легкую цепь и тяжелую цепь, причем последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 29, а последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 34.
16. Сконструированное антитело человека по п.11, причем указанное антитело содержит легкую цепь и тяжелую цепь, причем последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 30, а последовательность аминокислот указанной цепи представляет собой SEQ ID NO: 35.
17. Сконструированное антитело человека по п.12, причем указанное антитело содержит легкую цепь и тяжелую цепь, причем последовательность аминокислот легкой цепи представляет собой SEQ ID NO: 31, а последовательность аминокислот тяжелой цепи представляет собой SEQ ID NO: 36.
18. Сконструированное антитело человека по п.13, причем указанное антитело содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 27, а последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 32.
19. Сконструированное антитело человека по п.14, причем указанное антитело содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 28, а последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 33.
20. Сконструированное антитело человека по п.15, причем указанное антитело содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 29, а последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 34.
21. Сконструированное антитело человека по п.16, причем указанное антитело содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 30, а последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 35.
22. Сконструированное антитело человека по п.17, причем указанное антитело содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой легкой цепи представляет собой SEQ ID NO: 31, а последовательность аминокислот каждой тяжелой цепи представляет собой SEQ ID NO: 36.
23. Фармацевтическая композиция для лечения боли при остеоартрите или мигрени, содержащая сконструированное антитело человека к CGRP по любому из пп.1-22 и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
24. Способ лечения боли при остеоартрите, включающий введение пациенту-человеку, нуждающемуся в этом, сконструированного антитела человека к CGRP по любому из пп.1-22.
25. Применение сконструированного антитела человека к CGRP по любому из пп.1-22 в терапии состояний или нарушений, ассоциированных с активностью пептида, связанного с геном кальцитонина (CGRP).
26. Применение сконструированного антитела человека к CGRP по любому из пп.1-22 для лечения боли при остеоартрите.
27. Применение сконструированного антитела человека к CGRP по любому из пп.1-22 в производстве лекарственного препарата для лечения боли при остеоартрите.
28. Способ лечения мигрени, включающий введение пациенту-человеку, нуждающемуся в этом, сконструированного антитела человека к CGRP по любому из пп.1-22.
29. Применение сконструированного антитела человека к CGRP по любому из пп.1-22 в лечении мигрени.
30. Применение сконструированного антитела человека к CGRP по любому из пп.1-22 в производстве лекарственного препарата для лечения мигрени.
31. Антигенсвязывающий фрагмент сконструированного антитела человека к CGRP по любому из пп.1-22.
Текст
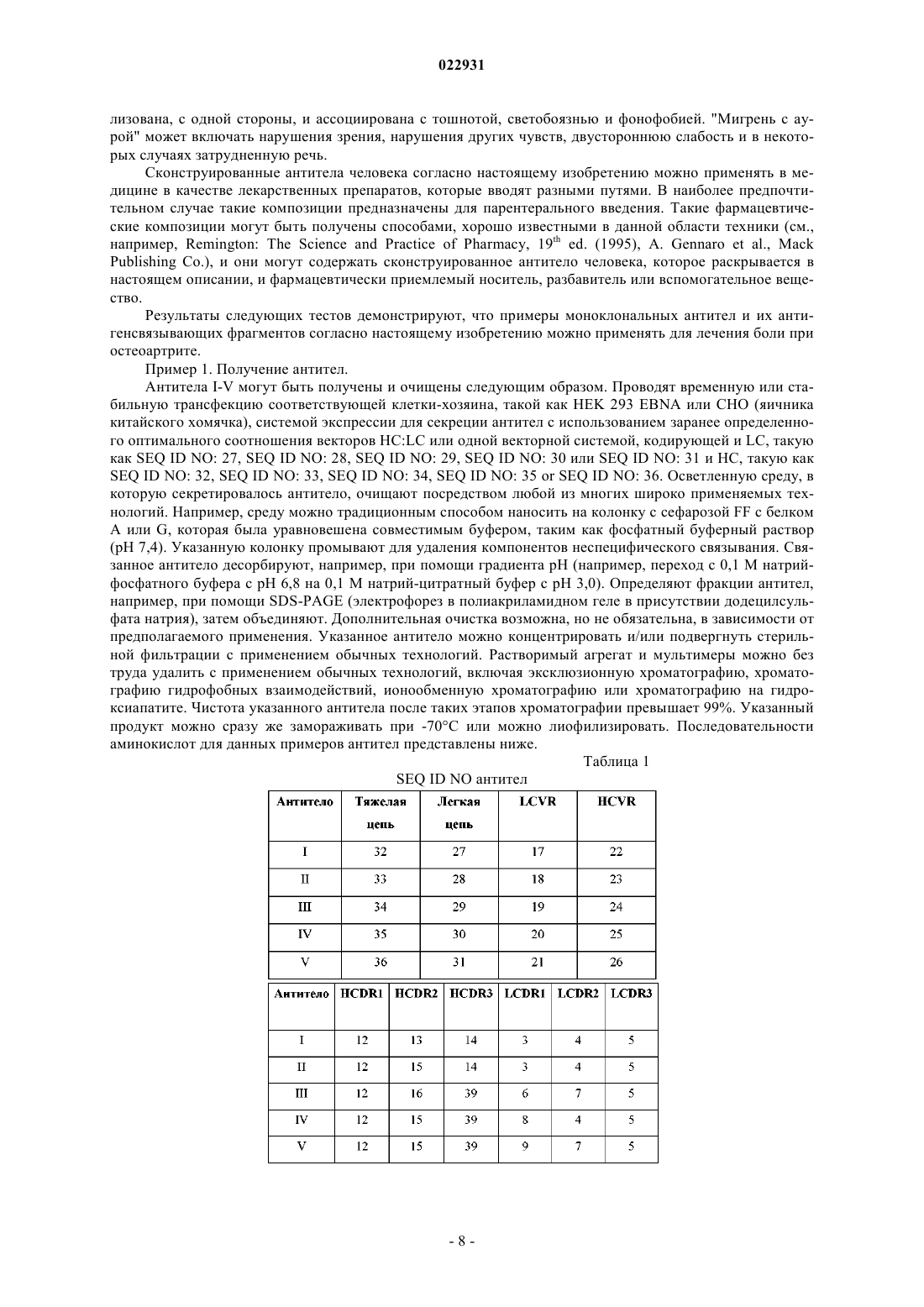
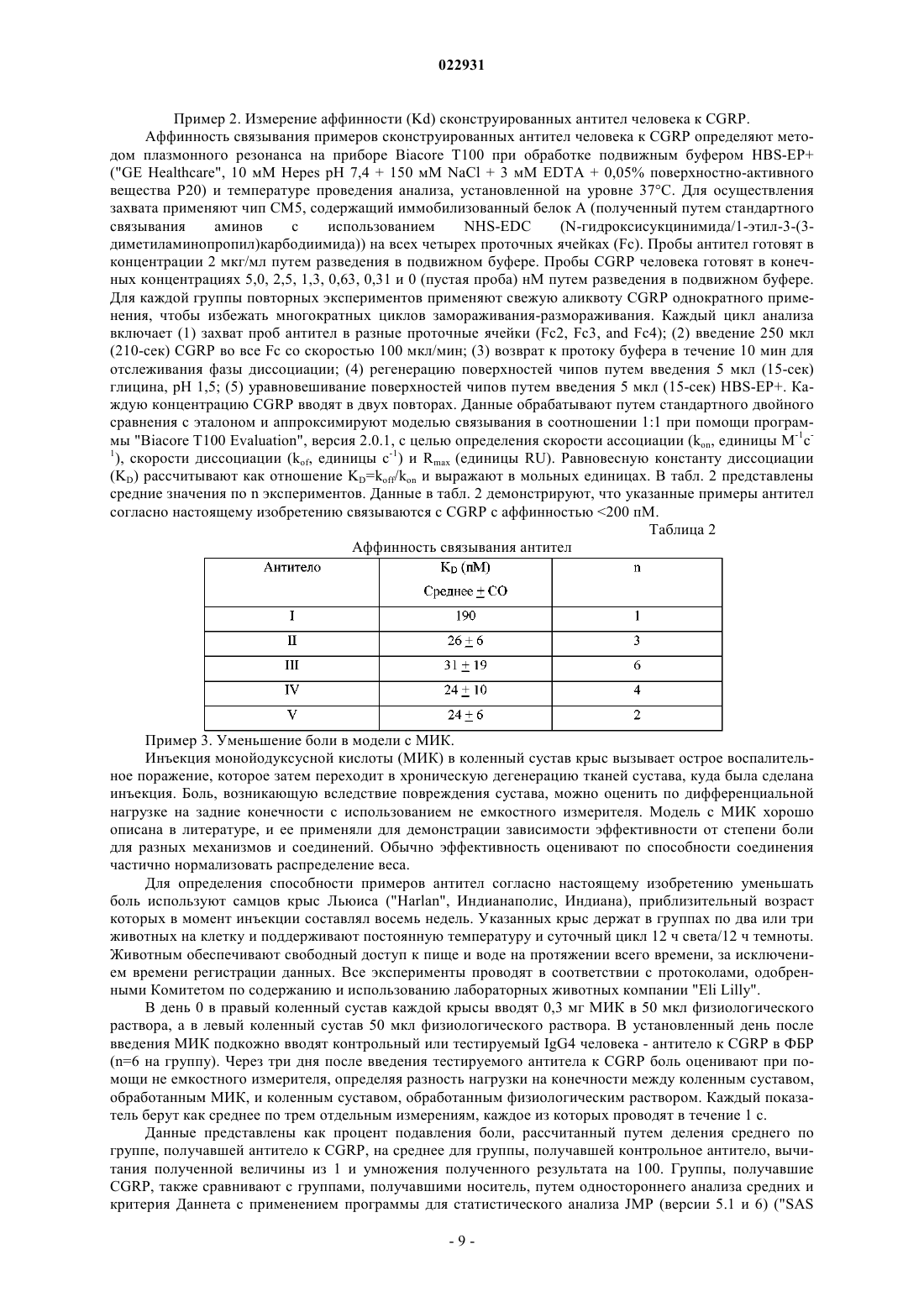
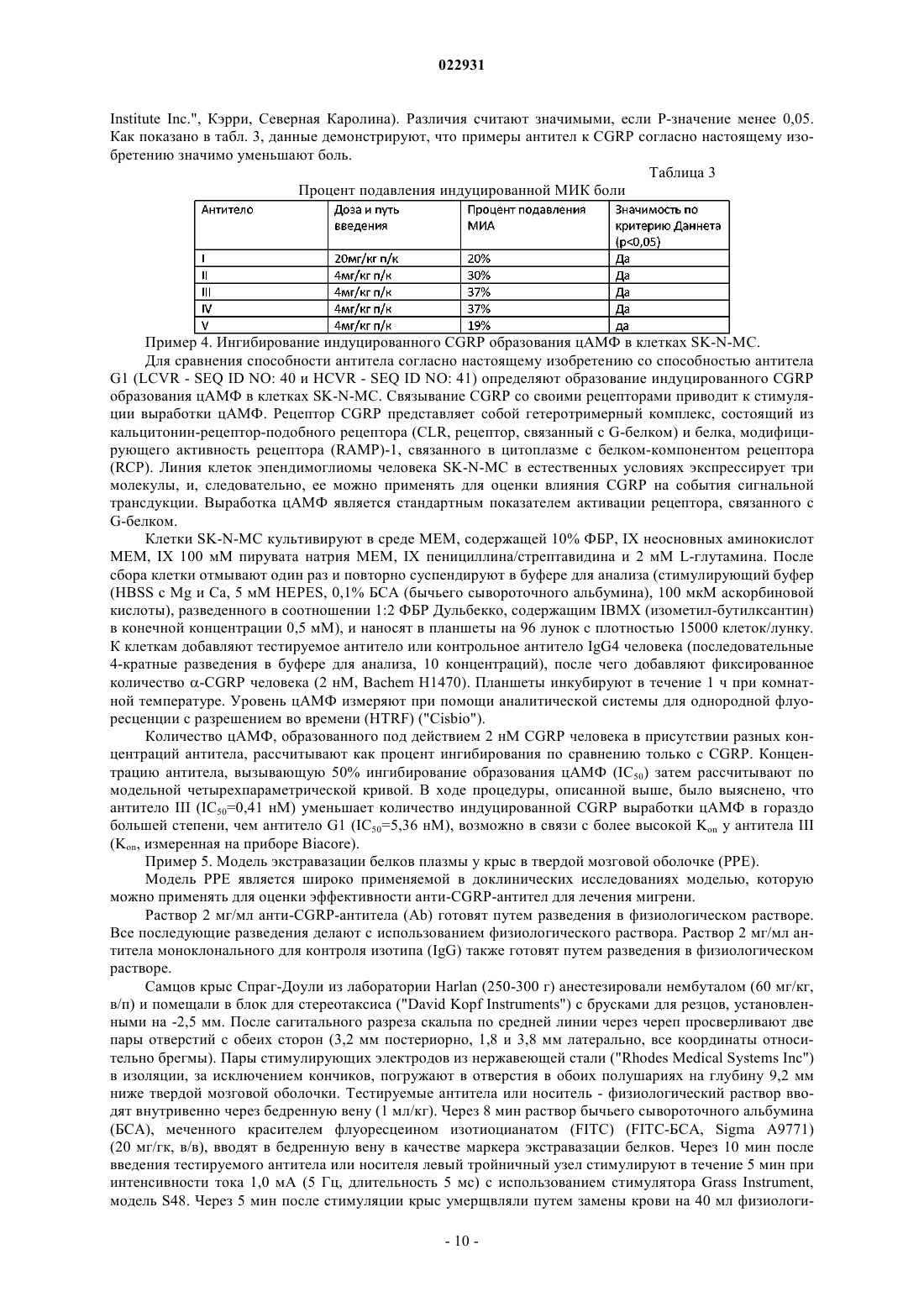
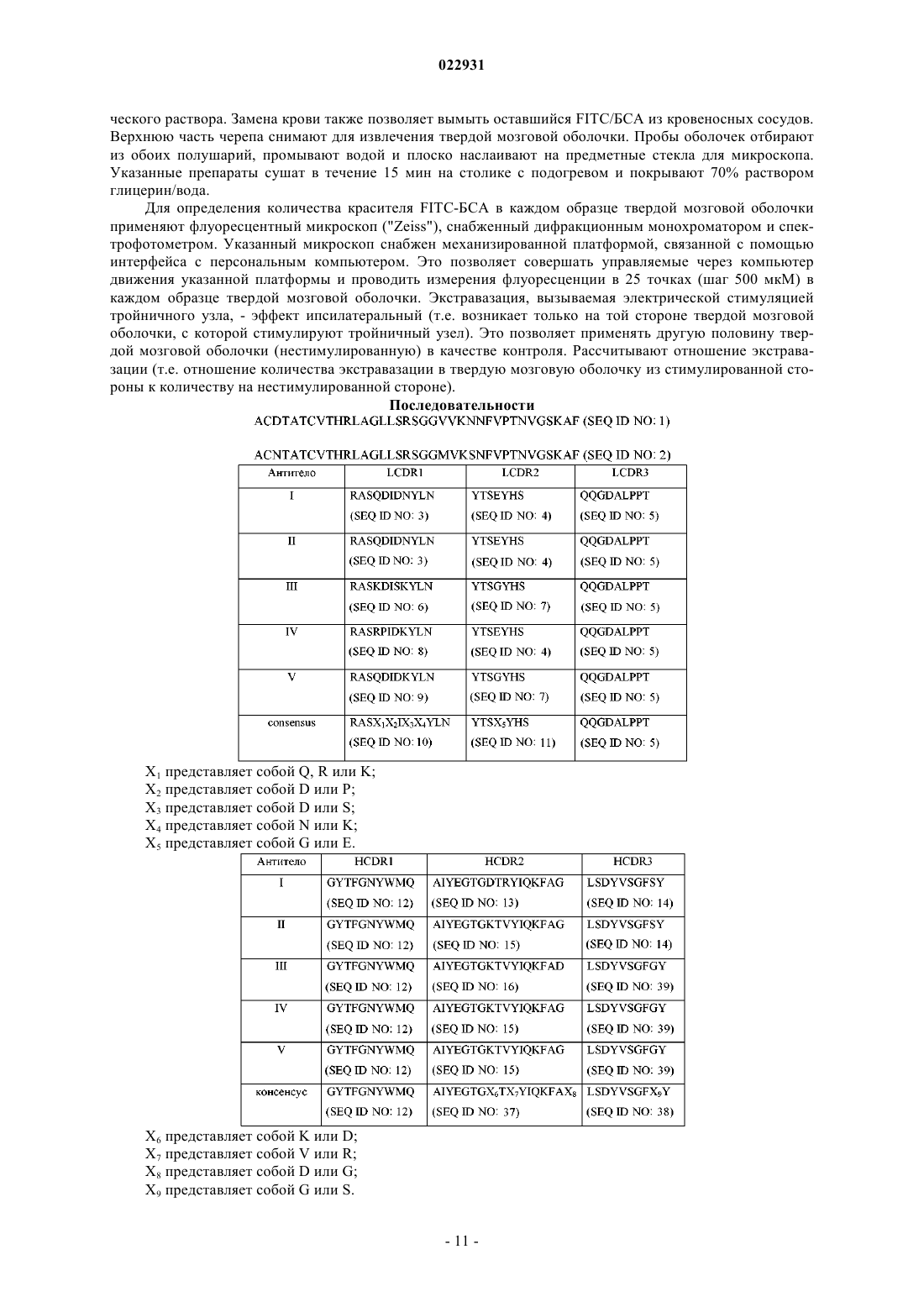
(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Изобретение обеспечивает сконструированные антитела человека к пептиду, связанному с геном кальцитонина, (CGRP) или их антигенсвязывающие фрагменты. Кроме того, изобретение обеспечивает применение сконструированных антител человека к пептиду, связанному с геном кальцитонина, или их антигенсвязывающих фрагментов для лечения боли при остеоартрите. Аллан Барретт, Беншоп Роберт Ян,Чамберс Марк Джоффри, Дарлинг Райан Джеймс (US) Лыу Т.Н. (RU) Настоящее изобретение относится к области медицины, в частности к области антител к пептиду,связанному с геном кальцитонина, (CGRP). Более конкретно, настоящее изобретение относится к антителам к CGRP и применению антител к CGRP в терапии боли при остеоартрите или мигрени. Пептид, связанный с геном кальцитонина (CGRP), представляет собой нейропептид из 37 аминокислот, секретируемый нервами центральной и периферической нервной системы. CGRP широко распространен в чувствительных нервах как в периферической, так и в центральной нервной системе и демонстрирует большое число различных видов биологической активности. Есть сообщения о роли CGRP. Считается, что, когда CGRP выделяется из волокон тройничного и других нервов, он опосредует связанные с ним биологические реакции путем связывания со специфическими рецепторами на поверхности клеток. Сообщалось, что CGRP играет некоторую роль при мигренях, поскольку CGRP выделяется при стимуляции чувствительных нервов и обладает мощным сосудорасширяющим действием. ВыделениеCGRP повышает проницаемость стенок сосудов и последующий выход белков плазмы крови (экстравазация белка плазмы) в ткани, иннервируемые волокнами тройничного нерва при стимуляции указанных волокон. Кроме того, есть данные об исследованиях, в которых инфузия CGRP пациентам, страдающим мигренью, вызывала симптомы, подобные мигрени. Также сообщалось, что CGRP играет некоторую роль при остеоартрите (ОА). ОА представляет собой хроническое заболевание, которое поражает большую долю населения во всем мире. Боль при артрите характеризуется повышением болевой чувствительности (чрезмерная чувствительность стимулам,которые в норме не являются болезненными) и спонтанными болями (боль в покое). Воспаление сустава вызывает повышение центральной и периферической чувствительности. При повышении периферической чувствительности CGRP-содержащие ноцицепторы, в норме обладающие высоким порогом восприятия, начинают реагировать на легкое давление, связанное с нормальной подвижностью сустава. CGRP действует как местный медиатор воспалительного процесса. Этот непрерывный процесс в итоге приводит к повышению центральной чувствительности в спинном мозге, в результате чего нервы становятся восприимчивы к стимуляции, поступающей от воспаленной, а также невоспаленной ткани. В доклинических моделях боли при ОА на крысах наблюдалось увеличение числа CGRP-положительных нервных волокон, которое имело положительную корреляцию с интенсивностью боли. Текущий стандарт лечения боли при ОА включает нестероидные противовоспалительные препараты (НПВП) и селективные ингибиторы ЦОГ-2 (циклооксигеназы-2). Со временем многие пациенты утрачивают чувствительность к этим лекарственным средствам или не могут переносить высокие дозы, которые требуются для эффективного облегчения боли. Последующее лечение включает внутрисуставные инъекции (гиалуронан) или опиаты. Последняя стадия лечения - хирургическая замена всего сустава. Многие из перечисленных средств лечения обладают отрицательными побочными эффектами, от желудочно-кишечных (НПВП) до сердечно-сосудистых (ингибиторы ЦОГ-2), создают неудобства и/или не очень эффективны (внутрисуставные инъекции), создают риск злоупотребления (опиаты) или ограничены только одним суставом (внутрисуставные инъекции, хирургическое вмешательство). Хотя антитела к CGRP для лечения мигрени и для лечения боли воспалительной природы уже описаны (мигрень - WO 2007/076336 и WO 2007/054809; ОА - см. антитела G1 в WO 2009/109908A1), все еще остается потребность в альтернативах. В предпочтительном случае альтернативное средство должно быть безопасным и эффективным. В более предпочтительном случае альтернативное средство лечения ОА должно обеспечивать долгосрочное облегчение боли в нескольких суставах и переносится пациентами без риска зависимости и/или злоупотребления. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее вариабельную область легкой цепи (LCRV) и вариабельную область тяжелой цепи (HCVR), в которых указанная LCVR содержит последовательности аминокислот LCDR1, LCDR2 и LCDR3, a HCVR содержит последовательности аминокислот HCDR1, HCDR2 и HCDR3, которые выбраны из группы, состоящей из:NO: 15) и HCDR3 представляет собой LSDYVSGFGY (SEQ ID NO: 39),причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которыхHCDR3 представляет собой SEQ ID NO: 14,причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которыхHCDR3 представляет собой SEQ ID NO: 14,причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которыхHCDR3 представляет собой SEQ ID NO: 39,причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которыхHCDR3 представляет собой SEQ ID NO: 39,причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которыхHCDR3 представляет собой SEQ ID NO: 39,причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которыхX9 представляет собой G или S,причем указанное сконструированное антитело человека к CGRP связывается с CGPR человека. Согласно другому варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее вариабельную область легкой цепи (LCRV) и вариабельную область тяжелой цепи (HCVR), в которых указанная LCVR содержитX9 = G или S; Х 10 = L или Т (SEQ ID NO: 43),причем указанное антитело связывается с CGRP человека. Согласно другому варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее вариабельную область легкой цепи (LCRV) и вариабельную область тяжелой цепи (HCVR), в которых указанные LCVR и HCVR представляют собой последовательности аминокислот, выбранные из группы, состоящей из:e) LCVR представляет собой SEQ ID NO: 21, a HCVR представляет собой SEQ ID NO: 26. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCVR, имеющую последовательность SEQ ID NO: 17, и HCVR, имеющую последовательностьSEQ ID NO: 22. Согласно предпочтительному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP содержащее LCVR, имеющую последовательность SEQ ID NO: 18, и HCVR, имеющую последовательность SEQ ID NO: 23. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCVR, имеющую последовательность SEQ ID NO: 19, и HCVR, имеющую последовательностьSEQ ID NO: 24. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCVR, имеющую последовательность SEQ ID NO: 20, и HCVR, имеющую последовательностьSEQ ID NO: 25. Согласно настоящему изобретению предложено сконструированное антитело человека к CGRP, содержащее LCVR, имеющую последовательность SEQ ID NO: 21 и HCVR, имеющую последовательность Также согласно настоящему изобретению предложено сконструированное антитело человека кCGRP, содержащее последовательности аминокислот легкой цепи (LC) и тяжелой цепи (НС), которые выбраны из группы, состоящей из:a) LC представляет собой SEQ ID NO: 27, а НС представляет собой SEQ ID NO: 32;b) LC представляет собой SEQ ID NO: 28, а НС представляет собой SEQ ID NO: 33;c) LC представляет собой SEQ ID NO: 29, а НС представляет собой SEQ ID NO: 34;d) LC представляет собой SEQ ID NO: 3, а НС представляет собой SEQ ID NO: 35;e) LC представляет собой SEQ ID NO: 31, а НС представляет собой SEQ ID NO: 36. Согласно одному варианту реализации указанное сконструированное антитело человека к CGRP,содержит LC, имеющую последовательность SEQ ID NO: 27 и НС, имеющую последовательностьSEQ ID NO: 32. Согласно еще одному варианту реализации указанное сконструированное антитело человека кSEQ ID NO: 33. Согласно еще одному варианту реализации указанное сконструированное антитело человека кSEQ ID NO: 34. Согласно еще одному варианту реализации указанное сконструированное антитело человека кSEQ ID NO: 35. Согласно еще одному варианту реализации указанное сконструированное антитело человека кSEQ ID NO: 36. Согласно еще одному варианту реализации указанное сконструированное антитело человека кCGRP содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждойLC представляет собой SEQ ID NO: 27, а последовательность аминокислот каждой НС представляет собой SEQ ID NO: 32. Согласно одному варианту реализации указанное сконструированное антитело человека к CGRP содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой LC представляет собой SEQ ID NO: 28, а последовательность аминокислот каждой НС представляет собойSEQ ID NO: 33. Согласно одному варианту реализации указанное сконструированное антитело человека к CGRP содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой LC представляет собой SEQ ID NO: 29, а последовательность аминокислот каждой НС представляет собойSEQ ID NO: 34. Согласно одному варианту реализации указанное сконструированное антитело человека к CGRP содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой LC представляет собой SEQ ID NO: 30, а последовательность аминокислот каждой НС представляет собойSEQ ID NO: 35. Согласно одному варианту реализации указанное сконструированное антитело человека к CGRP содержит две легкие цепи и две тяжелые цепи, причем последовательность аминокислот каждой LC представляет собой SEQ ID NO: 31, а последовательность аминокислот каждой НС представляет собойSEQ ID NO: 36. Также согласно настоящему изобретению предложен антигенсвязывающий фрагмент антител, описанных выше. Также согласно настоящему изобретению предложено сконструированное антитело человека кCGRP, которое обладает IC501,0 нМ в тесте, по существу, таком, как описанный в примере 4. Согласно одному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которых LCDR1 представляет собойSEQ ID NO: 6, LCDR2 представляет собой SEQ ID NO: 7, LCDR3 представляет собой SEQ ID NO: 5,HCDR1 представляет собой SEQ ID NO: 12, HCDR2 представляет собой SEQ ID NO: 16 и HCDR3 представляет собой SEQ ID NO: 39, причем указанное сконструированное антитело человека к CGRP связывается с CGRP человека, а также обладает IC501,0 нМ в тесте, по существу, таком, как описанный в примере 4. Согласно одному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее LCRV с последовательностью аминокислот SEQ ID NO: 19 иHCVR с последовательностью аминокислот SEQ ID NO: 24, причем указанное сконструированное антитело человека к CGRP обладает IC501,0 нМ в тесте, по существу, таком, как описанный в примере 4. Согласно одному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее LC, имеющую последовательность аминокислот SEQ ID NO: 29, и НС, имеющую последовательность аминокислот SEQ ID NO: 34, причем указанное сконструированное антитело человека к CGRP обладает IC501,0 нМ в тесте, по существу, таком, как описанный в примере 4. Также согласно настоящему изобретению предложено сконструированное антитело человека кCGRP, которое обладает IC500,5 нМ в тесте, по существу, таком, как описанный в примере 4. Согласно одному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее LCRV и HCVR, в которых LCDR1 представляет собой SEQ ID NO: 6, LCDR2 представляет собой SEQ ID NO: 7, LCDR3 представляет собой SEQ ID NO: 5, HCDR1 представляет собойSEQ ID NO: 12, HCDR2 представляет собой SEQ ID NO: 16 и HCDR3 представляет собой SEQ ID NO: 39,причем указанное сконструированное антитело человека к CGRP связывается с CGRP человека, а также обладает IC500,5 нМ в тесте, по существу, таком, как описанный в примере 4. Согласно одному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее LCRV, имеющую последовательность аминокислотSEQ ID NO: 19, и HCVR, имеющую последовательность аминокислот SEQ ID NO: 24, причем указанное сконструированное антитело человека к CGRP обладает IC500,5 нМ в тесте, по существу, таком, как описанный в примере 4. Согласно одному варианту реализации настоящего изобретения предложено сконструированное антитело человека к CGRP, содержащее LC, имеющую последовательность аминокислот SEQ ID NO: 29, и НС, имеющую последовательность аминокислот SEQ ID NO: 34, причем указанное сконструированное антитело человека к CGRP обладает IC500,5 нМ в тесте, по существу, таком, как описанный в примере 4. Также согласно настоящему изобретению предложена фармацевтическая композиция, содержащая сконструированное антитело человека к CGRP или его антигенсвязывающий фрагмент согласно настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Дополнительно, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая сконструированное антитело человека к CGRP согласно настоящему изобретению с фармацевтически приемлемым носителем и, возможно, другими терапевтическими ингредиентами. Согласно другому аспекту настоящего изобретения предложен способ лечения боли при остеоартрите, включающий введение пациенту, нуждающемуся в этом, сконструированного антитела человека кCGRP или его антигенсвязывающего фрагмента согласно настоящему изобретению. Согласно еще одному аспекту настоящего изобретения предложен способ лечения мигрени, включающий введение пациенту, нуждающемуся в этом, сконструированное антитело человека к CGRP или его антигенсвязывающий фрагмент согласно настоящему изобретению. Также согласно настоящему изобретению предложено сконструированное антитело человека кCGRP или его антигенсвязывающий фрагмент согласно настоящему изобретению для применения в терапии. Согласно еще одному аспекту настоящего изобретения предложено сконструированное антитело человека к CGRP или его антигенсвязывающий фрагмент согласно настоящему изобретению для лечения боли при остеоартрите. Согласно дополнительному аспекту настоящего изобретения предложено сконструированное антитело человека к CGRP или его антигенсвязывающий фрагмент согласно настоящему изобретению для лечения мигрени. Также согласно настоящему изобретению предложено применение сконструированного антитела человека к CGRP или его антигенсвязывающего фрагмента согласно настоящему изобретению для применения в лечении боли при остеоартрите. Согласно еще одному аспекту настоящего изобретения также предложено сконструированное антитело человека к CGRP или его антигенсвязывающего фрагмента согласно настоящему изобретению для применения в лечении мигрени. Также согласно настоящему изобретению предложено применение сконструированного антитела человека к CGRP или его антигенсвязывающего фрагмента согласно настоящему изобретению для производства лекарственного препарата для лечения остеоартрита. Также согласно настоящему изобретению предложено применение сконструированного антитела человека к CGRP или его антигенсвязывающего фрагмента согласно настоящему изобретению для производства лекарственного препарата для лечения мигрени. Полноразмерное антитело в том виде, в котором оно существует в природе, представляет собой молекулу иммуноглобулина, содержащую две тяжелые (Н) цепи и две легкие (L) цепи, соединенные друг с другом дисульфидными связями. N-концевая часть каждой цепи включает вариабельную область примерно из 100-110 аминокислот, отвечающую в первую очередь за распознавание антигена за счет гипервариабельных участков (CDR), содержащихся в ней. С-концевая часть каждой цепи определяет константную область, отвечающую в первую очередь за эффекторную функцию.CDR перемежаются участками, которые более консервативны, называемыми каркасными участками (FR). Вариабельная область каждой легкой цепи (LCVR) и вариабельная область каждой тяжелой цепи (HCVR) состоит из трех CDR и четырех FR, расположенных в следующем порядке от N-конца к С-концу: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Три CDR легкой цепи называют "LCDR1, LCDR2 иLCDR3", а три CDR тяжелой цепи называют "HCDR1, HCDR2 и HCDR3". Указанные CDR содержат большинство остатков, которые вступают в специфические взаимодействия с антигеном. Нумерация и определение расположения остатков аминокислот CDR в составе областей LCVR и HCVR проводятся в соответствии с традиционными правилами Kabat. Легкие цепи делят на каппа и лямбда, характеризующиеся конкретными константными областями,как известно в данной области техники. Тяжелые цепи делят на гамма, мю, альфа, дельта и ипсилон, а изотипы антитела определяют как IgG, IgM, IgA, IgD или IgE соответственно. Антитела IgG можно также разделить на подклассы, например IgG1, IgG2, IgG3, IgG4. Каждый тип тяжелых цепей характеризуют по конкретной константной области, имеющей последовательность, хорошо известную в данной области техники. В настоящем описании термин "моноклональное антитело" (Mab) относится к антителу, которое получают из одной копии или клона, включая, например, клон эукариот, прокариот или фага, а не к способу, которым указанное антитело получили. Mab согласно настоящему изобретению преимущественно существует в однородной или по существу однородной популяции. Полные Mab содержат две тяжелые цепи и две легкие цепи. "Антигенсвязывающие фрагменты" таких моноклональных антител включают,например, фрагменты Fab, фрагменты Fab', фрагменты F(ab')2 и одноцепочечные фрагменты Fv. Моноклональные антитела и их антигенсвязывающие фрагменты согласно настоящему изобретению могут быть получены, например, с использованием рекомбинантных технологий, технологий фагового дисплея, технологий синтеза, например прививки CDR, или сочетания таких технологий либо с использованием других технологий, известных в технике. Например, можно вакцинировать мышей CGRP человека или его фрагментами, полученные в результате антитела можно восстановить и очистить и можно оценить, обладают ли они связывающими и функциональными свойствами, близкими или сходными со свойствами соединений-антител, раскрытых в настоящем описании, методами, описываемыми в разделе"Примеры". Антигенсвязывающие фрагменты могут быть также получены традиционными способами. Способы получения и очистки антител и антигенсвязывающих фрагментов хорошо известны в данной области техники, и их описание можно найти, например, в Harlow and Lane (1988), Antibodies, ALaboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, chapters 5-8 and 15,ISBN 0-87969-314-2. Фраза "сконструированное антитело человека к CGRP" относится к моноклональному антителу, созданному и/или подвергнутому манипуляциям таким образом, что в результате оно обладает связывающими и функциональными свойствами согласно настоящему изобретению, связывается с CGRP человека, и которое содержит каркасные области, которые являются по существу человеческими или полностью человеческими, окружающие CDR, полученные из антитела, не являющегося антителом человека."Антигенсвязывающие фрагменты" таких сконструированных антител человека включают, например, фрагменты Fab, фрагменты Fab', фрагменты F(ab')2 и одноцепочечные фрагменты Fv. Термины "каркасные участки" или "каркасные последовательности" относятся к любой из каркасных областей 1-4. Сконструированные антитела человека и их антигенсвязывающие фрагменты, включенные в настоящее изобретение, включают молекулы, в которых один или более каркасных участков 1-4 является по существу или полностью человеческим, т.е. в них присутствует любое из возможных сочетаний отдельных по существу или полностью человеческих каркасных участков 1-4. Например, они включают молекулы, в которых каркасный участок 1 и каркасный участок 2, каркасный участок 1 и каркасный участок 3, каркасные участки 1, 2 и 3, и т.д. являются по существу или полностью человеческими. По существу человеческие каркасные участки - это участки, которые по меньшей мере приблизительно на 80% идентичны известной эмбриональной каркасной последовательности человека. Предпочтительно по существу человеческие каркасные участки по меньшей мере приблизительно на 85%, приблизительно на 90%, приблизительно на 95%, приблизительно на 99% идентичны последовательности известной эмбриональной каркасной последовательности человека. Полностью человеческие каркасные участки - это участки, которые идентичны известной эмбриональной каркасной последовательности человека. Информацию об эмбриональных каркасных последовательностях человека можно получить в ImMunoGeneTics (IMGT) на их интернет-сайтеhttp://imgt.cines.fr или из пособия The Immunoglobulin FactsBook Marie-Paule Lefranc and Gerard Lefranc,Academic Press, 2001, ISBN 012441351. Например, эмбриональные каркасные участки легких цепей могут быть выбраны из группы, состоящей из A11, A17, А 18, А 19, А 20, А 27, А 30, L1, L11, L12, L2, L5, L15, L6,L8, O12, O2 и O8, а эмбриональные каркасные участки тяжелых цепей могут быть выбраны из группы,состоящей из VH2-5, VH2-26, VH2-70, VH3-20, VH3-72, VHI-46, VH3-9, VH3-66, VH3-74, VH4-31,VHI-18, VHI-69, VI-13-7, VH3-11, VH3-15, VH3-21, VH3-23, VH3-30, VH3-48, VH4-39, VH4-59 и VH5-51. Сконструированные антитела, проявляющие близкие функциональные свойства согласно настоящему изобретению, в дополнение к раскрытым в настоящем изобретении, могут быть получены при помощи нескольких других способов. Конкретные соединения-антитела, раскрываемые в настоящем изобретении, можно использовать в качестве матрицы или исходных антител для приготовления дополнительных соединений-антител. Согласно одному подходу CDR исходного соединения-антитела прививают в каркасную область, которая обладает высокой идентичностью с каркасной последовательностью исходного соединения-антитела. Идентичность последовательности новой каркасной области обычно будет составлять по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 99% относительно последовательности соответствующей каркасной области в исходном соединении-антителе. Такая прививка может приводить к снижению аффинности связывания по сравнению с исходным антителом. В этом случае каркасную область можно подвергнуть мутации к первоначальному виду, как в каркасном участке исходного антитела, в определенных положениях, на основании специфических критериев, раскрытых вQueen et al. (1991), Proc. Natl. Acad. Sci. USA, 88:2869. Дополнительные ссылки на источники, где описаны способы, которые можно применять для гуманизации антител мыши, включают патент США 4816397; 5225539 и 5693761; компьютерные программы ABMOD и ENCAD, описанные у Levittet al. (1988), Nature, 332:323-327 и Verhoeyen et al. (1988), Science, 239:1534-1536). Идентификацию остатков - кандидатов на обратное мутирование - можно осуществлять следующим образом. Когда аминокислоты попадают в следующую категорию, аминокислоту каркасной области эмбриональной последовательности человека, которая была использована ("акцепторный каркасный участок"),заменяют на аминокислоту каркасного участка из исходного соединения-антитела ("донорный каркасный участок"):(а) аминокислота в каркасном участке человека акцепторного каркасного участка не типична для каркасных участков человека в данном положении, а соответствующая аминокислота в донорном иммуноглобулине типична для каркасных участков человека в данном положении;(b) положение указанной аминокислоты непосредственно соседствует с одной из CDR или(c) любой из атомов в аминокислоте каркасного участка находится в пределах 5-6 ангстрем (межцентровое расстояние) от любого из атомов аминокислоты CDR в трехмерной модели иммуноглобулина. Если каждая из аминокислот в акцепторном каркасном участке человека и соответствующая аминокислота в донорном каркасном участке в целом не типичны для каркасных участков человека в данном положении, такую аминокислоту можно заменить на аминокислоту, типичную для каркасных областей человека в данном положении. Такой критерий обратного мутирования позволяет восстановить активность исходного соединения-антитела. Еще один подход к получению сконструированных антител человека, проявляющих функциональные свойства, близкие свойствам соединений-антител, раскрываемых в настоящем изобретении, основан на случайном мутировании аминокислот в привитых CDR без изменения каркасных участков и на скрининге полученных молекул на аффинность связывания и другие функциональные свойства, которые являются такими же хорошими или лучше, чем свойства исходных соединений-антител. Также можно вводить одиночные мутации в каждом положении аминокислот в каждой CDR и затем оценивать влияние таких мутаций на аффинность связывания и другие функциональные свойства. Одиночные мутации,приводящие к улучшению свойств, можно сочетать с оценкой их эффектов в комбинации с другой мутацией. Кроме того, можно сочетать оба вышеперечисленных подхода. После прививки CDR можно осуществить обратное мутирование конкретных каркасных участков совместно с введением замен аминокислот в CDR. Такая методика описана у Wu et al. (1999), J. Mol. Biol. 294:151-162. Применяя идеи настоящего изобретения, специалист в данной области техники может применить обычные технологии, например сайт-направленный мутагенез, для замены аминокислот в раскрытых в настоящем описании последовательностях CDR и каркасных участков с получением других последовательностей аминокислот вариабельных областей, полученных из настоящих последовательностей. В конкретные сайты замены можно вводить все альтернативные природные аминокислоты. Способы, раскрываемые в настоящем описании, можно применять для скрининга таких дополнительных последовательностей аминокислот вариабельных областей с целью идентификации последовательностей, обладающих указанными функциями in vivo. Таким образом, можно идентифицировать дополнительные последовательности для получения сконструированных антител человека и их антигенсвязывающих частей согласно настоящему изобретению. В предпочтительном случае замена аминокислоты в каркасных участках ограничена одним, двумя или тремя положениями в любой одной или более из четырех каркасных участков легких и/или тяжелых цепей, раскрываемых в настоящем изобретении. В предпочтительном случае замена аминокислоты в CDR ограничена одним, двумя или тремя положениями в любом одной или более из трех каркасных участков легкой и/или тяжелой цепей. Также можно сочетать разные изменения в указанных каркасных областях и CDR, описанных выше. Термин "лечение" (или "лечить") относится к процессу, включающему замедление, предотвращение, приостановку, контроль, прекращение, сокращение или обращение прогрессирования или тяжести симптома, нарушения, состояния или заболевания, но не обязательно включает общее устранение всех связанных с заболеванием симптомов, состояний или нарушений, ассоциированных с активностьюCGRP. В настоящем описании термин "мигрень" (мигрени) относится к "мигрени без ауры" (ранее - простая мигрень) и к "мигрени с аурой" (ранее - "классическая мигрень") согласно руководству Комиссии по классификации головной боли Международной ассоциации головной боли (International HeadacheSociety, 2004). Например, "мигрень без ауры" обычно может характеризоваться пульсирующим характером, умеренной или высокой интенсивностью и может усугубляться при обычной физической активности, лока-7 022931 лизована, с одной стороны, и ассоциирована с тошнотой, светобоязнью и фонофобией. "Мигрень с аурой" может включать нарушения зрения, нарушения других чувств, двустороннюю слабость и в некоторых случаях затрудненную речь. Сконструированные антитела человека согласно настоящему изобретению можно применять в медицине в качестве лекарственных препаратов, которые вводят разными путями. В наиболее предпочтительном случае такие композиции предназначены для парентерального введения. Такие фармацевтические композиции могут быть получены способами, хорошо известными в данной области техники (см.,например, Remington: The Science and Practice of Pharmacy, 19th ed. (1995), A. Gennaro et al., MackPublishing Co.), и они могут содержать сконструированное антитело человека, которое раскрывается в настоящем описании, и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Результаты следующих тестов демонстрируют, что примеры моноклональных антител и их антигенсвязывающих фрагментов согласно настоящему изобретению можно применять для лечения боли при остеоартрите. Пример 1. Получение антител. Антитела I-V могут быть получены и очищены следующим образом. Проводят временную или стабильную трансфекцию соответствующей клетки-хозяина, такой как HEK 293 EBNA или СНО (яичника китайского хомячка), системой экспрессии для секреции антител с использованием заранее определенного оптимального соотношения векторов HC:LC или одной векторной системой, кодирующей и LC, такую как SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30 или SEQ ID NO: 31 и НС, такую какSEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35 or SEQ ID NO: 36. Осветленную среду, в которую секретировалось антитело, очищают посредством любой из многих широко применяемых технологий. Например, среду можно традиционным способом наносить на колонку с сефарозой FF с белком А или G, которая была уравновешена совместимым буфером, таким как фосфатный буферный раствор(рН 7,4). Указанную колонку промывают для удаления компонентов неспецифического связывания. Связанное антитело десорбируют, например, при помощи градиента рН (например, переход с 0,1 М натрийфосфатного буфера с рН 6,8 на 0,1 М натрий-цитратный буфер с рН 3,0). Определяют фракции антител,например, при помощи SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия), затем объединяют. Дополнительная очистка возможна, но не обязательна, в зависимости от предполагаемого применения. Указанное антитело можно концентрировать и/или подвергнуть стерильной фильтрации с применением обычных технологий. Растворимый агрегат и мультимеры можно без труда удалить с применением обычных технологий, включая эксклюзионную хроматографию, хроматографию гидрофобных взаимодействий, ионообменную хроматографию или хроматографию на гидроксиапатите. Чистота указанного антитела после таких этапов хроматографии превышает 99%. Указанный продукт можно сразу же замораживать при -70 С или можно лиофилизировать. Последовательности аминокислот для данных примеров антител представлены ниже. Таблица 1 Пример 2. Измерение аффинности (Kd) сконструированных антител человека к CGRP. Аффинность связывания примеров сконструированных антител человека к CGRP определяют методом плазмонного резонанса на приборе Biacore T100 при обработке подвижным буфером HBS-EP+("GE Healthcare", 10 мМ Hepes pH 7,4 + 150 мМ NaCl + 3 мМ EDTA + 0,05% поверхностно-активного вещества Р 20) и температуре проведения анализа, установленной на уровне 37 С. Для осуществления захвата применяют чип СМ 5, содержащий иммобилизованный белок А (полученный путем стандартного связывания аминов с использованием(N-гидроксисукцинимида/1-этил-3-(3 диметиламинопропил)карбодиимида на всех четырех проточных ячейках (Fc). Пробы антител готовят в концентрации 2 мкг/мл путем разведения в подвижном буфере. Пробы CGRP человека готовят в конечных концентрациях 5,0, 2,5, 1,3, 0,63, 0,31 и 0 (пустая проба) нМ путем разведения в подвижном буфере. Для каждой группы повторных экспериментов применяют свежую аликвоту CGRP однократного применения, чтобы избежать многократных циклов замораживания-размораживания. Каждый цикл анализа включает (1) захват проб антител в разные проточные ячейки (Fc2, Fc3, and Fc4); (2) введение 250 мкл(210-сек) CGRP во все Fc со скоростью 100 мкл/мин; (3) возврат к протоку буфера в течение 10 мин для отслеживания фазы диссоциации; (4) регенерацию поверхностей чипов путем введения 5 мкл (15-сек) глицина, рН 1,5; (5) уравновешивание поверхностей чипов путем введения 5 мкл (15-сек) HBS-EP+. Каждую концентрацию CGRP вводят в двух повторах. Данные обрабатывают путем стандартного двойного сравнения с эталоном и аппроксимируют моделью связывания в соотношении 1:1 при помощи программы "Biacore T100 Evaluation", версия 2.0.1, с целью определения скорости ассоциации (kon, единицы M-1c1(KD) рассчитывают как отношение KD=koff/kon и выражают в мольных единицах. В табл. 2 представлены средние значения по n экспериментов. Данные в табл. 2 демонстрируют, что указанные примеры антител согласно настоящему изобретению связываются с CGRP с аффинностью 200 пМ. Таблица 2 Аффинность связывания антител Пример 3. Уменьшение боли в модели с МИК. Инъекция монойодуксусной кислоты (МИК) в коленный сустав крыс вызывает острое воспалительное поражение, которое затем переходит в хроническую дегенерацию тканей сустава, куда была сделана инъекция. Боль, возникающую вследствие повреждения сустава, можно оценить по дифференциальной нагрузке на задние конечности с использованием не емкостного измерителя. Модель с МИК хорошо описана в литературе, и ее применяли для демонстрации зависимости эффективности от степени боли для разных механизмов и соединений. Обычно эффективность оценивают по способности соединения частично нормализовать распределение веса. Для определения способности примеров антител согласно настоящему изобретению уменьшать боль используют самцов крыс Льюиса ("Harlan", Индианаполис, Индиана), приблизительный возраст которых в момент инъекции составлял восемь недель. Указанных крыс держат в группах по два или три животных на клетку и поддерживают постоянную температуру и суточный цикл 12 ч света/12 ч темноты. Животным обеспечивают свободный доступ к пище и воде на протяжении всего времени, за исключением времени регистрации данных. Все эксперименты проводят в соответствии с протоколами, одобренными Комитетом по содержанию и использованию лабораторных животных компании "Eli Lilly". В день 0 в правый коленный сустав каждой крысы вводят 0,3 мг МИК в 50 мкл физиологического раствора, а в левый коленный сустав 50 мкл физиологического раствора. В установленный день после введения МИК подкожно вводят контрольный или тестируемый IgG4 человека - антитело к CGRP в ФБР(n=6 на группу). Через три дня после введения тестируемого антитела к CGRP боль оценивают при помощи не емкостного измерителя, определяя разность нагрузки на конечности между коленным суставом,обработанным МИК, и коленным суставом, обработанным физиологическим раствором. Каждый показатель берут как среднее по трем отдельным измерениям, каждое из которых проводят в течение 1 с. Данные представлены как процент подавления боли, рассчитанный путем деления среднего по группе, получавшей антитело к CGRP, на среднее для группы, получавшей контрольное антитело, вычитания полученной величины из 1 и умножения полученного результата на 100. Группы, получавшиеCGRP, также сравнивают с группами, получавшими носитель, путем одностороннего анализа средних и критерия Даннета с применением программы для статистического анализа JMP (версии 5.1 и 6) ("SASInstitute Inc.", Кэрри, Северная Каролина). Различия считают значимыми, если Р-значение менее 0,05. Как показано в табл. 3, данные демонстрируют, что примеры антител к CGRP согласно настоящему изобретению значимо уменьшают боль. Таблица 3 Процент подавления индуцированной МИК боли Пример 4. Ингибирование индуцированного CGRP образования цАМФ в клетках SK-N-MC. Для сравнения способности антитела согласно настоящему изобретению со способностью антителаG1 (LCVR - SEQ ID NO: 40 и HCVR - SEQ ID NO: 41) определяют образование индуцированного CGRP образования цАМФ в клетках SK-N-MC. Связывание CGRP со своими рецепторами приводит к стимуляции выработки цАМФ. Рецептор CGRP представляет собой гетеротримерный комплекс, состоящий из кальцитонин-рецептор-подобного рецептора (CLR, рецептор, связанный с G-белком) и белка, модифицирующего активность рецептора (RAMP)-1, связанного в цитоплазме с белком-компонентом рецептора(RCP). Линия клеток эпендимоглиомы человека SK-N-MC в естественных условиях экспрессирует три молекулы, и, следовательно, ее можно применять для оценки влияния CGRP на события сигнальной трансдукции. Выработка цАМФ является стандартным показателем активации рецептора, связанного сMEM, IX 100 мМ пирувата натрия MEM, IX пенициллина/стрептавидина и 2 мМ L-глутамина. После сбора клетки отмывают один раз и повторно суспендируют в буфере для анализа (стимулирующий буфер(HBSS с Mg и Са, 5 мМ HEPES, 0,1% БСА (бычьего сывороточного альбумина), 100 мкМ аскорбиновой кислоты), разведенного в соотношении 1:2 ФБР Дульбекко, содержащим IBMX (изометил-бутилксантин) в конечной концентрации 0,5 мМ), и наносят в планшеты на 96 лунок с плотностью 15000 клеток/лунку. К клеткам добавляют тестируемое антитело или контрольное антитело IgG4 человека (последовательные 4-кратные разведения в буфере для анализа, 10 концентраций), после чего добавляют фиксированное количество -CGRP человека (2 нМ, Bachem Н 1470). Планшеты инкубируют в течение 1 ч при комнатной температуре. Уровень цАМФ измеряют при помощи аналитической системы для однородной флуоресценции с разрешением во времени (HTRF) ("Cisbio"). Количество цАМФ, образованного под действием 2 нМ CGRP человека в присутствии разных концентраций антитела, рассчитывают как процент ингибирования по сравнению только с CGRP. Концентрацию антитела, вызывающую 50% ингибирование образования цАМФ (IC50) затем рассчитывают по модельной четырехпараметрической кривой. В ходе процедуры, описанной выше, было выяснено, что антитело III (IC50=0,41 нМ) уменьшает количество индуцированной CGRP выработки цАМФ в гораздо большей степени, чем антитело G1 (IC50=5,36 нМ), возможно в связи с более высокой Kon у антитела III(Kon, измеренная на приборе Biacore). Пример 5. Модель экстравазации белков плазмы у крыс в твердой мозговой оболочке (РРЕ). Модель РРЕ является широко применяемой в доклинических исследованиях моделью, которую можно применять для оценки эффективности анти-CGRP-антител для лечения мигрени. Раствор 2 мг/мл анти-CGRP-антитела (Ab) готовят путем разведения в физиологическом растворе. Все последующие разведения делают с использованием физиологического раствора. Раствор 2 мг/мл антитела моноклонального для контроля изотипа (IgG) также готовят путем разведения в физиологическом растворе. Самцов крыс Спраг-Доули из лаборатории Harlan (250-300 г) анестезировали нембуталом (60 мг/кг,в/п) и помещали в блок для стереотаксиса ("David Kopf Instruments") с брусками для резцов, установленными на -2,5 мм. После сагитального разреза скальпа по средней линии через череп просверливают две пары отверстий с обеих сторон (3,2 мм постериорно, 1,8 и 3,8 мм латерально, все координаты относительно брегмы). Пары стимулирующих электродов из нержавеющей стали ("Rhodes Medical Systems Inc") в изоляции, за исключением кончиков, погружают в отверстия в обоих полушариях на глубину 9,2 мм ниже твердой мозговой оболочки. Тестируемые антитела или носитель - физиологический раствор вводят внутривенно через бедренную вену (1 мл/кг). Через 8 мин раствор бычьего сывороточного альбумина(БСА), меченного красителем флуоресцеином изотиоцианатом (FITC) (FITC-БСА, Sigma A9771)(20 мг/гк, в/в), вводят в бедренную вену в качестве маркера экстравазации белков. Через 10 мин после введения тестируемого антитела или носителя левый тройничный узел стимулируют в течение 5 мин при интенсивности тока 1,0 мА (5 Гц, длительность 5 мс) с использованием стимулятора Grass Instrument,модель S48. Через 5 мин после стимуляции крыс умерщвляли путем замены крови на 40 мл физиологи- 10022931 ческого раствора. Замена крови также позволяет вымыть оставшийся FITC/БСА из кровеносных сосудов. Верхнюю часть черепа снимают для извлечения твердой мозговой оболочки. Пробы оболочек отбирают из обоих полушарий, промывают водой и плоско наслаивают на предметные стекла для микроскопа. Указанные препараты сушат в течение 15 мин на столике с подогревом и покрывают 70% раствором глицерин/вода. Для определения количества красителя FITC-БСА в каждом образце твердой мозговой оболочки применяют флуоресцентный микроскоп ("Zeiss"), снабженный дифракционным монохроматором и спектрофотометром. Указанный микроскоп снабжен механизированной платформой, связанной с помощью интерфейса с персональным компьютером. Это позволяет совершать управляемые через компьютер движения указанной платформы и проводить измерения флуоресценции в 25 точках (шаг 500 мкМ) в каждом образце твердой мозговой оболочки. Экстравазация, вызываемая электрической стимуляцией тройничного узла, - эффект ипсилатеральный (т.е. возникает только на той стороне твердой мозговой оболочки, с которой стимулируют тройничный узел). Это позволяет применять другую половину твердой мозговой оболочки (нестимулированную) в качестве контроля. Рассчитывают отношение экстравазации (т.е. отношение количества экстравазации в твердую мозговую оболочку из стимулированной стороны к количеству на нестимулированной стороне). Последовательности
МПК / Метки
МПК: A61K 39/395
Метки: антитела
Код ссылки
<a href="https://eas.patents.su/30-22931-antitela-k-cgrp.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела к cgrp</a>
Предыдущий патент: 5-фтор-2-оксопиримидин-1(2h)-карбоксилатные производные
Следующий патент: Димерные слитые белки vstm3 и связанные с ними композиции и способы
Случайный патент: Извлечение воды из воздуха