Производные 6,7-дигидро-5h-бензо[7]аннулена, способы их получения, фармацевтические препараты, содержащие их, и их применение для получения лекарственных средств
Номер патента: 22547
Опубликовано: 29.01.2016
Авторы: Цорн Лудвиг, Винтермантель Тим, Нуббемейер Райнхард, Коземунд Дирк, Бирер Доналд, Тер Лак Антониус, Вортманн Ларс, Боте Ульрих, Мёллер Карстен, Больманн Рольф
Формула / Реферат
1. Соединение общей формулы (I)
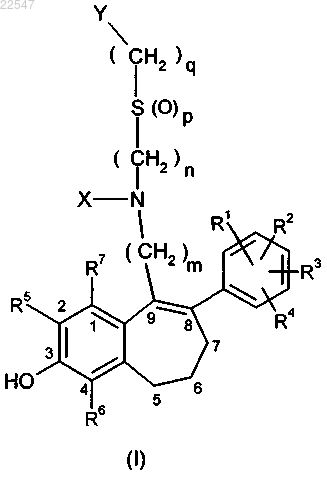
в которой
R1, R2, R3 и R4 независимо друг от друга означают водород или фтор, где по меньшей мере один заместитель, выбранный из R1, R2, R3 и R4, означает фтор,
R5, R6 и R7 независимо друг от друга означают водород, фтор, хлор, бром,
X выбирают из группы, включающей Н, C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкил-S(O)2-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -ОН, галогена, -CN, -C1-C6-алкокси, -С(О)ОН, -C(O)OC1-C6-алкила или -С(О)О-бензила и в которых, необязательно, атомы водорода также могут быть заменены на атомы дейтерия,
Y означает перфторированный или частично фторированный -C1-C4-алкил или перфторированный или частично фторированный C3-C8-циклоалкил,
m означает 4, 5, 6 или 7,
n означает 2, 3, 4, 5 или 6,
р означает 0, 1 или 2,
q означает 0, 1,2, 3, 4, 5 или 6,
и его соли, сольваты или сольваты солей.
2. Соединение по п.1, в котором
R1, R2, R3, R4, R5, R6 или R7 независимо друг от друга означают водород или фтор, где по меньшей мере один заместитель R1, R2, R3 и R4 означает фтор,
X выбирают из группы, включающей водород, C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкил-S(O)2-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -ОН, галогена, дейтерия, -CN, -C1-C6-алкокси, -С(О)ОН, -С(О)ОС1-С6-алкила или -С(О)О-бензила,
Y означает -CF3, -C2F5, -C3F7, -C4F9 или -С3-С7-циклоалкил с 2-4 атомами фтора,
m означает 4, 5 или 6,
n означает 2, 3, 4, 5 или 6,
р означает 0, 1 или 2,
q означает 0, 1, 2, 3, 4, 5 или 6,
и его соли, сольваты или сольваты солей.
3. Соединение по п.2, отличающееся тем, что
R1, R2, R3, R4 независимо друг от друга означают водород или фтор, причем должно содержаться не менее одного и не более двух атомов фтора,
R5 и R6 независимо друг от друга означают водород или фтор,
R7 означает водород,
X выбирают из группы, включающей водород, -C1-С4-алкил, циклопропил-, которые необязательно могут быть один раз замещены посредством -ОН, -CN, метокси, -С(О)ОН, -С(О)ОСН3 или -С(О)-Обензила или один раз или многократно посредством -F или дейтерия, или X выбирают из метил-S(О)2-,
Y означает -CF3, -C2F5, -CF2CF2CF3, -CF(CF3)2 или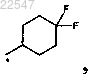
m означает 5 или 6,
n означает 3, 4 или 5,
р означает 0, 1 или 2,
q означает 0, 1, 2, 3, 4 или 5,
и его соли, сольваты или сольваты солей.
4. Соединение по п.3, отличающееся тем, что
R1, R2, R3 и R4 независимо друг от друга означают водород или фтор, причем должно содержаться не менее одного и не более двух атомов фтора,
R5 и R6 независимо друг от друга означают водород или фтор, при условии, что R5 и R6 одновременно не означают фтор,
X означает С1-С4-алкил-, необязательно замещенный дейтерием,
Y означает -CF3, -C2F5, 4,4-дифторциклогексил,
m означает 5 или 6,
n означает 3 или 4,
р означает 1 или 2,
q означает 2, 3, 4 или 5
или в частном случае, в котором Y означает 4,4-дифторциклогексил,
q означает 0 или 1,
и его соли, сольваты или сольваты солей.
5. Соединения по п.4 формулы (II)
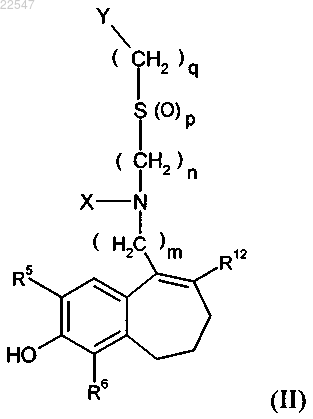
в которой
R12 означает 3,5-дифторфенил-, 3,4-дифторфенил-, 2,4-дифторфенил-, 4-фторфенил-,
R5 и R6 независимо друг от друга означают водород или фтор, где R5 и R6 одновременно не означают фтор,
X означает С1-С4-алкил-, необязательно замещенный дейтерием,
Y означает -CF3, -C2F5, 4,4-дифторциклогексил,
m означает 6,
n означает 3 или 4,
р означает 1 или 2,
q означает 2, 3, 4 или 5,
или в частном случае, в котором Y означает 4,4-дифторциклогексил,
q означает 0 или 1,
и их соли, сольваты или сольваты солей.
6. Соединения по пп.1-5, которые представляют собой
8-(3,5-дифторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфинил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(4,4,4-трифторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(3,3,3-трифторпропил)сульфинил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(4,4,5,5,5-пентафторпентил)сульфинил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(этил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-{6-[(2-метоксиэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-{6-[(3-метоксипропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфинил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(4,4,4-трифторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(3,3,3-трифторпропил)сульфинил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(4,4,5,5,5-пентафторпентил)сульфинил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(этил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-{6-[(2-метоксиэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-{6-[(3-метоксипропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфинил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(4,4,4-трифторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-{6-[(2-метоксиэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-{6-[(3-метоксипропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[5-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)пентил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[5-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)пентил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(3-гидроксипропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(3-гидроксипропил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[(4-фторбензил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-{6-[(3-гидроксипропил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-{6-[(3-гидроксипропил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-[6-(трет-бутил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-4-фтор-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[(2,2-дифторэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-4-фтор-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-9-{6-[(4-фторбензил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-[6-(циклопропил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-8-(3,4-дифторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-({4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{5-[(3,3,3-трифторпропил)сульфонил]пентил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{4-[(3,3,4,4,4-пентафторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,5-дифторфенил)-9-[6-(метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{5-[(3,3,3-трифторпропил)сульфонил]пентил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{4-[(3,3,4,4,4-пентафторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3,4-дифторфенил)-9-[6-(метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[(2-фторэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{4-[(3,3,4,4,4-пентафторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{5-[(3,3,3-трифторпропил)сульфонил]пентил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-({4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфанил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(5,5,6,6,6-пентафторгексил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
бензил-N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}глицинат,
метил-N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}глицинат,
метил-N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}-бета-аланинат,
4-фтор-8-(4-фторфенил)-9-{6-[{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}(2,2,2-трифторэтил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-9-{6-[(2-фторэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфанил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
метил-4-({6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)бутаноат,
N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}ацетамид,
({6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)ацетонитрил,
N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}метансульфонамид,
8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){4-[(4,4,4-трифторбутил)сульфонил]бутил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-([(2S)-2-гидроксипропил]{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}глицин,
N-{6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}-N-{4-[(4,4,4-трифторбутил)сульфонил]бутил}-бета-аланин,
4-({6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)бутановая кислота,
8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(4,4,4-трифторбутил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-([(2R)-2-гидроксипропил]{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){3-[(4,4,4-трифторбутил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил){4-[(4,4,4-трифторбутил)сульфонил]бутил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{5-[(3,3,3-трифторпропил)сульфонил]пентил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(2-гидроксиэтил)(3-{[3,4,4,4-тетрафтор-3-(трифторметил)бутил]сульфонил}пропил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(2-гидроксиэтил)(4-{[3,4,4,4-тетрафтор-3-(трифторметил)бутил]сульфонил}бутил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[метил(3-{[3,4,4,4-тетрафтор-3-(трифторметил)бутил]сульфонил}пропил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[метил(4-{[3,4,4,4-тетрафтор-3-(трифторметил)бутил]сульфонил}бутил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-({3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-({3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(4,4,4-трифторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфинил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(3,3,3-трифторпропил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-{6-[(2-гидрокси-2-метилпропил){3-[(3,3,3-трифторпропил)сульфинил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[{3-[(4,4-дифторциклогексил)сульфонил]пропил}(метил)амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[{4-[(4,4-дифторциклогексил)сульфонил]бутил}(метил)амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[(3-{[(4,4-дифторциклогексил)метил]сульфонил}пропил)(метил)амино]гексил}-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3-фторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(3-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2-фторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[5-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)пентил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{3-[(4,4,5,5,5-пентафторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{3-[(3,3,3-трифторпропил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{4-[(3,3,3-трифторпропил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{5-[(3,3,3-трифторпропил)сульфонил]пентил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{3-[(4,4,4-трифторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{3-[(6,6,6-трифторгексил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-{6-[(2H3)метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,5-дифторфенил)-9-{6-[(2H3)метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил)(4-{[3,4,4,4-тетрафтор-3-(трифторметил)бутил]сульфонил}бутил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол
8-(4-фторфенил)-9-{6-[(2H3)метил{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
2-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(6,6,6-трифторгексил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
({6-[8-(4-фторфенил)-3-гидрокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексил}{3-[(5,5,5-трифторпентил)сульфонил]пропил}амино)ацетонитрил,
2-фтор-8-(4-фторфенил)-9-{6-[(2-гидроксиэтил)(3-{[3,4,4,4-тетрафтор-3-(трифторметил)бутил]сульфонил}пропил)амино]гексил}-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,5-дифторфенил)-9-[6-(метил{4-[(4,4,4-трифторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
9-{6-[{4-[(4,4-дифторциклогексил)сульфонил]бутил}(метил)амино]гексил}-2-фтор-8-(4-фторфенил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{3-[(3,3,4,4,4-пентафторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{4-[(3,3,4,4,4-пентафторбутил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(2,4-дифторфенил)-9-[6-(метил{4-[(4,4,5,5,5-пентафторпентил)сульфонил]бутил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
8-(4-фторфенил)-9-[6-(метил{3-[(6,6,6-трифторгексил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол,
4-фтор-8-(4-фторфенил)-9-[6-(метил{3-[(4,4,4-трифторбутил)сульфонил]пропил}амино)гексил]-6,7-дигидро-5H-бензо[7]аннулен-3-ол.
7. Применение соединения по любому из пп.1-6 для лечения и/или профилактики заболеваний.
8. Применение соединения по любому из пп.1-6 для получения лекарственного средства для лечения и/или профилактики заболеваний.
9. Применение соединения формулы (I) по любому из пп.1-6 в способе индукции овуляции, для ингибирования созревания спермы, для облегчения симптомов андропаузы и менопаузы, то есть для заместительной терапии мужскими и женскими половыми гормонами, для предотвращения или профилактики и для лечения нарушений, сопровождающих дисменорею, дисфункциональных маточных кровотечений, акне, сердечно-сосудистых заболеваний, гиперхолестеринемии и гиперлипидемии, атеросклероза, пролиферации артериальных гладкомышечных клеток, респираторного дистресс-синдрома новорожденных, первичной легочной гипертензии, остеопороза, потери костной массы у женщин в постменопаузе, у женщин после гистероэктомии или у женщин, получавших лечение ЛГРФ агонистами или антагонистами, ревматоидного артрита, болезни Альцгеймера, эндометриоза, миом, гормонозависимых опухолей (также у женщин в пременопаузе), например карциномы молочной железы или эндометрия, бесплодия, болезней предстательной железы, заболеваний молочной железы с доброкачественным течением, например мастопатии, удара, болезни Альцгеймера и других заболеваний центральной нервной системы, которые связаны с клеточной смертью нейронов.
10. Применение соединения по любому из пп.1-6 для получения лекарственного средства для индукции овуляции, для ингибирования созревания спермы, для облегчения симптомов андропаузы и менопаузы, то есть для заместительной терапии мужскими и женскими половыми гормонами, для предотвращения или профилактики и для лечения нарушений, сопровождающих дисменорею, дисфункциональных маточных кровотечений, акне, сердечно-сосудистых заболеваний, гиперхолестеринемии и гиперлипидемии, атеросклероза, пролиферации артериальных гладкомышечных клеток, респираторного дистресс-синдрома новорожденных, первичной легочной гипертензии, остеопороза, потери костной массы у женщин в постменопаузе, у женщин после гистероэктомии или у женщин, получавших лечение ЛГРФ агонистами или антагонистами, ревматоидного артрита, болезни Альцгеймера, эндометриоза, миом, гормонозависимых опухолей (также у женщин в пременопаузе), например карциномы молочной железы или эндометрия, бесплодия, болезней предстательной железы, заболеваний молочной железы с доброкачественным течением, например мастопатии, удара, болезни Альцгеймера и других заболеваний центральной нервной системы, которые связаны с клеточной смертью нейронов.
11. Лекарственное средство, содержащее соединение по любому из пп.1-6 в комбинации с инертным, нетоксичным, фармацевтически пригодным наполнителем.
12. Применение лекарственного средства по п.11 для индукции овуляции, для ингибирования созревания спермы, для облегчения симптомов андропаузы и менопаузы, то есть для заместительной терапии мужскими и женскими половыми гормонами, для предотвращения или профилактики и для лечения нарушений, сопровождающих дисменорею, дисфункциональных маточных кровотечений, акне, сердечно-сосудистых заболеваний, гиперхолестеринемии и гиперлипидемии, атеросклероза, пролиферации артериальных гладкомышечных клеток, респираторного дистресс-синдрома новорожденных, первичной легочной гипертензии, остеопороза, потери костной массы у женщин в постменопаузе, у женщин после гистероэктомии или у женщин, получавших лечение ЛГРФ агонистами или антагонистами, ревматоидного артрита, болезни Альцгеймера, эндометриоза, миом, гормонозависимых опухолей (также у женщин в пременопаузе), например карциномы молочной железы или эндометрия, бесплодия, болезней предстательной железы, заболеваний молочной железы с доброкачественным течением, например мастопатии, удара, болезни Альцгеймера и других заболеваний центральной нервной системы, которые связаны с клеточной смертью нейронов.
Текст
ПРОИЗВОДНЫЕ 6,7-ДИГИДРО-5H-БЕНЗО[7]АННУЛЕНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ИХ, И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ Изобретение относится к селективным модуляторам эстрогеновых рецепторов (SERM) и способам их получения, их применению для лечения и/или профилактики заболеваний и их применению для получения лекарственных средств для лечения и/или профилактики заболеваний, в частности нарушений свертываемости, остеопороза, эндометриоза, миом, гормонозависимых опухолей, для гормонозаместительной терапии и для контрацепции.(71)(73) Заявитель и патентовладелец: БАЙЕР ИНТЕЛЛЕКТЧУАЛ ПРОПЕРТИ ГМБХ (DE) Изобретение относится к селективным модуляторам эстрогеновых рецепторов (SERM) и способам их получения, их применению для лечения и/или профилактики заболеваний и их применению для получения лекарственных средств для лечения и/или профилактики заболеваний, в частности нарушений свертываемости, остеопороза, эндометриоза, миом, гормонозависимых опухолей, для гормонозаместительной терапии и для контрацепции.SERM являются соединениями, которые обладают ткань-селективным, либо антиэстрогенным/эстрогенингибирующим, либо эстрогенным или частично эстрогенным действием, например в случае матки они ингибируют действие эстрогена, а в случае кости они обладают нейтральным или эстрогеноподобным действием. Тамоксифен, ралоксифен и базедоксифен могут быть упомянуты в качестве примеров таких соединений. SERM следует отличать от чистых антиэстрогенов, которые обладают чистым антагонистическим действием, ингибирующим действие эстрогена, во всех тканях и не демонстрируют какого-либо эстрогенного или частично эстрогенного действия в тканях. SERD (селективные негативные регуляторы эстрогеновых рецепторов) принадлежат к антиэстрогенам и приводят на белковом уровне к полному распаду эстрогенового рецептора в клетках-мишенях. Соединение фулвестрант может быть упомянуто в качестве примера чистого антиэстрогена или SERD. Уже были описаны производные 6,7-дигидро-5H-бензо[7]аннулена в качестве SERM, также как и их применение для лечения нарушений свертываемости, остеопороза, эндометриоза, миом, гормонозависимых опухолей, для гормонозаместительной терапии и для контрацепции (ср. WO 00/03979). Дополнительная информация о структурно более отдаленных родственных веществах, SERM или применении отдельных SERM для лечения конкретных заболеваний приведена, например, в EP 0584952,WO 96/21656; J. Endocrinol. 1994, 141, 335; EP 0124369; US 6645951; Bioorg. Med. Chem. Lett. 2006, 14,4803-4819; US 6153768; BioorganicMedicinal Chemistry Letters 14 (2004) 4659-4663; DE 19521646 A1,Archiv der Pharmazie 333, (2000) 305-311; US 6147105, DE 10117441, EP 138504, DE 19622457; DE 19636625, WO 98/07740, WO 99/33855, WO 00/14104, Mol. Pharmacol. 1991, 39: 421-428; J. Med. Chem. 1986, 29, 2053-2059; J. Med. Chem. 1988, 31, 1316-1326; WO 00/55137, US 20030105148, WO 2009047343,Indian Journal of Chemistry, vol. 25B, Aug. 1986, 832-837; WO 04/58682 или Bioorg. and Medicinal Chemistry 16 (2008), 9554-9573. Проблемой, которая решается с помощью настоящего изобретения, является разработка доступных альтернативных веществ, действующих в качестве SERM с улучшенными физико-химическими свойствами. Настоящее изобретение относится к соединениям формулы (I)R1, R2, R3 и R4 независимо друг от друга означают водород или фтор, где по меньшей мере один заместитель, выбранный из R1, R2, R3 и R4, означает фтор,R5, R6 и R7 независимо друг от друга означают водород, фтор, хлор, бром, метил, этил, трифторметил или нитрил,X выбирают из группы, включающей водород, C1-C6-алкил-, C3-C8-циклоалкил-, C2-C6-алкенил-, C2C6-алкинил-, C1-C6-алкил-S(O)2-, C1-C6-алкилкарбонил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -ОН, галогена, -CN, -NR8R9,-C(O)NR10R11, -N(R10)C(O)NR10R11, -C1-C6-галогеналкокси, -C1-C6-алкокси, -С(О)ОН, -C(O)OC1-C6-алкил или -С(О)Обензила и в которых, необязательно, атомы водорода также могут быть заменены на атомы дейтерия,R8 и R9 означают C1-C6-алкил, C3-C7-циклоалкил, фенил или бензил, необязательно замещенный галогеном или дейтерием,-1 022547R10 и R11 означают водород или C1-C6-алкил, C3-C7-циклоалкил, фенил или бензил, необязательно замещенный галогеном или дейтерием,Y означает перфторированный или частично фторированный C1-C4-алкил или перфторированный или частично фторированный C3-C8-циклоалкил,m означает 4, 5, 6 или 7,n означает 2, 3, 4, 5 или 6,p означает 0, 1 или 2,q означает 0, 1, 2, 3, 4, 5 или 6,и их солям, сольватам или сольватам солей, включая все кристаллические модификации. Было найдено, что производные 6,7-дигидро-5H-бензо[7]аннулена (I), которые присоединены в 8-м положении к фторированному ароматическому заместителю и которые присоединены в 9-м положении к необязательно замещенной алифатической цепи, действуют в качестве SERM. Многие из заявленных производных 6,7-дигидро-5H-бензо[7]аннуленов дополнительно демонстрируют, в отличие от известных сегодня SERM, таких как тамоксифен, ралоксифен или подобные соединения, дестабилизирующее действие на содержание ER (остаточное относительное содержание ER менее или равно 30%). По всему структурному диапазону эти соединения демонстрируют высокое антиэстрогенное действие in vitro (значения IC50 ниже 0,6 микромолярных и в основном даже двузначные или однозначные наномолярные IC50 значения для ингибирования эстрадиол-стимулированной люциферазной активности). Соединения в соответствии с изобретением являются соединениями формулы (I) и их солями, сольватами и сольватами солей, соединениями формул, приведенных ниже, которые покрываются формулой(I), и их солями, сольватами и сольватами солей, и соединениями, представленными ниже в качестве примеров, которые покрываются формулой (I), и их солями, сольватами и сольватами солей, при условии, что соединения, установленные ниже, которые покрываются формулой (I), еще не представляют собой соли, сольваты и сольваты солей. Соединения в соответствии с изобретением в зависимости от их строения могут существовать в стереоизомерных формах (энантиомеры, диастереоизомеры). В соединениях формулы (I) стереоцентры могут находиться на атоме серы (для р = 1) и/или в остатке X. Изобретение, следовательно, включает энантиомеры и/или диастереоизомеры и соответствующие их смеси. Стереоизомерно однородные компоненты могут быть выделены известным путем из указанных смесей энантиомеров и/или диастереоизомеров. В рамках настоящего изобретения соединение является энантиомерно чистым при энантиомерном избытке более 90% ( 90% ее). Если соединения в соответствии с изобретением могут встречаться в таутомерных формах, настоящее изобретение включает все таутомерные формы. Физиологически безвредные соли соединений в соответствии с изобретением являются предпочтительными в качестве солей в рамках настоящего изобретения. Однако соли, которые не являются пригодными сами по себе для фармацевтических применений, но могут применяться, например, для выделения или очистки соединений в соответствии с изобретением, также включены в объем изобретения. Физиологически безвредные соли соединений в соответствии с изобретением включают кислотноаддитивные соли минеральных кислот, карбоновых кислот и сульфоновых кислот, например соли соляной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, уксусной кислоты, муравьиной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты. Физиологически безвредные соли соединений в соответствии с изобретением также включают соли обычных оснований, таких как, например, и предпочтительно соли щелочных металлов (например, соли натрия и калия), соли щелочно-земельных металлов (например, соли кальция и магния) и соли аммония,производные аммиака или органических аминов, содержащих 1-16 атомов углерода, таких как, например, и предпочтительно этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин,диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, Nметилморфолин, аргинин, лизин, этилендиамин и N-метилпиперидин. Те формы соединений, которые образуют комплекс в твердом или жидком состоянии путем координации с молекулами растворителя, в рамках изобретения называют сольватами. Гидраты являются особой формой сольватов, в которых координация происходит с водой. Гидраты являются предпочтительными в качестве сольватов в рамках настоящего изобретения. Кроме того, настоящее изобретение также включает пролекарства соединений в соответствии с изобретением. Термин "пролекарства" включает соединения, которые могут сами быть биологически активными или неактивными, однако во время их пребывания в теле они преобразуются в соединения в соответствии с изобретением (например, метаболически или гидролитически). В рамках настоящего изобретения заместители имеют, если не определено иное, следующие значения. Алкил как таковой и "алк", и "алкил" в алкокси, алкилкарбониле, алкиламино, алкиламинокарбони-2 022547 ле, алкоксикарбониле, алкоксикарбониламино и алкилкарбониламино означает линейный или разветвленный алкильный остаток, содержащий, как правило, от 1 до 6, предпочтительно от 1 до 4, особенно предпочтительно от 1 до 3 атомов углерода, например, предпочтительно метил, этил, н-пропил, изопропил, трет-бутил, н-пентил и н-гексил. Алкокси означает, например, и предпочтительно метокси, этокси, н-пропокси, изопропокси, третбутокси, н-пентокси и н-гексокси. Алкилкарбонил означает, например, и предпочтительно формил, ацетил и пропаноил. Алкиламино означает остаток алкиламино с одним или двумя (выбранными независимо друг от друга) алкильными заместителями. (C1-C3)-алкиламино означает, например, остаток моноалкиламино,содержащий от 1 до 3 атомов углерода, или остаток диалкиламино, содержащий в каждом случае от 1 до 3 атомов углерода на алкильный заместитель. Например, предпочтительно можно упомянуть метиламино, этиламино, н-пропиламино, изопропиламино, трет-бутиламино, н-пентиламино, н-гексиламино, N,Nдиметиламино, N,N-диэтиламино, N-этил-N-метиламино, N-метил-N-н-пропиламино, N-изопропил-N,Nн-пропиламино, N,N-т-бутил-N,N-метиламино, N-этил-N,N-н-пентиламино и N-н-гексил-N,N-метиламино. Алкиламинокарбонил означает алкиламинокарбонильный остаток с одним или двумя (выбранными независимо друг от друга) алкильными заместителями. (C1-C3)-алкиламинокарбонил означает, например,моноалкиламинокарбонильный остаток, содержащий от 1 до 3 атомов углерода, или диалкиламинокарбонильный остаток, содержащий в каждом случае от 1 до 3 атомов углерода на алкильный заместитель. Например, предпочтительно можно упомянуть метиламинокарбонил, этиламинокарбонил, нпропиламинокарбонил, изопропиламинокарбонил, трет-бутиламинокарбонил, н-пентиламинокарбонил,н-гексиламинокарбонил, N,N-диметиламинокарбонил, N,N-диэтиламинокарбонил, N-этил-N,N-метиламинокарбонил, N-метил-N-н-пропиламинокарбонил, N-изопропил-N,N-н-пропиламинокарбонил, N,N-тбутил-N-метиламинокарбонил, N,N-этил-N-н-пентиламинокарбонил и N-н-гексил-N-метиламинокарбонил. Алкоксикарбонил означает, например, и предпочтительно метоксикарбонил, этоксикарбонил, нпропоксикарбонил, изопропоксикарбонил, трет-бутоксикарбонил, н-пентоксикарбонил и н-гексоксикарбонил. Алкоксикарбониламино означает, например, и предпочтительно метоксикарбониламино, этоксикарбониламино, н-пропоксикарбониламино, изопропоксикарбониламино, трет-бутоксикарбониламино,н-пентоксикарбониламино, н-гексоксикарбониламино, метоксикарбонил-N-метиламино, этоксикарбонил-N-метиламино, н-пропоксикарбонил-N-метиламино, изопропоксикарбонил-N-метиламино, трет-бутоксикарбонил-N-метиламино, н-пентоксикарбонил-N-метиламино и н-гексоксикарбонил-N-метиламино. Алкилкарбониламино означает, например, и предпочтительно ацетиламино, ацетил-N-метиламино,этилкарбониламино и этилкарбонил-N-метиламино. Циклоалкил означает циклоалкильную группу, содержащую, как правило, от 3 до 8, предпочтительно от 5 до 7 атомов углерода, где кольцо также может быть частично ненасыщенным, например, и предпочтительно циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Арил означает монотрициклический ароматический, карбоциклический остаток, содержащий, как правило, от 6 до 14 атомов углерода; например, и предпочтительно фенил, нафтил и фенантренил. Гетероарил означает ароматический, моно- или бициклический остаток, содержащий, как правило,от 5 до 10, предпочтительно от 5 до 6 кольцевых атомов и до 5, предпочтительно до 4 гетероатомов из ряда S, О и N, например, и предпочтительно тиенил, фурил, пирролил, тиазолил, оксазолил, имидазолил,пиридил, пиримидил, пиридазинил, индолил, индазолил, бензофуранил, бензотиофенил, хинолинил, изохинолинил. Гетероциклил означает моно- или полициклический, предпочтительно моно- или бициклический,неароматический гетероциклический остаток, содержащий, как правило, от 4 до 10, предпочтительно от 5 до 8 кольцевых атомов и до 3, предпочтительно до 2 гетероатомов и/или гетерогрупп из ряда N, О, S,SO, SO2. Гетероциклильные остатки могут быть насыщенными или частично ненасыщенными. Пяти-8 членные моноциклические насыщенные гетероциклильные остатки, содержащие до двух гетероатомов из ряда О, N и S, являются предпочтительными. Например, и предпочтительно можно упомянуть тетрагидрофуранил, пирролидинил, пирролинил, пиперидинил, морфолинил, тиоморфолинил, пергидроазепинил. Галоген означает фтор, хлор, бром и йод. Дейтерий или D используют в отношении веществ, в которых в соответствующем положении доля дейтерия значительно выше по сравнению со встречающимся в природе изотопным отношением, например в отношении соединений с изотопной чистотой 10-100%, в частности с изотопной чистотой 50, 60,70, 80, 90% или более высокой. Перфорированный -C1-C4-алкил означает полностью фторированный линейный или разветвленный алкильный остаток, содержащий, как правило, от 1 до 4, предпочтительно от 1 до 3 атомов углерода, например, и предпочтительно трифторметил, пентафторэтил, гептафторпропил и гептафторизопропил. Частично фторированный -C1-С 4-алкил означает частично фторированный линейный или разветвленный алкильный остаток, содержащий, как правило, от 1 до 4 атомов углерода, выбранный из, но без ограничения перечисленным, 1,2,2,2-тетрафторэтила, 1,1,2,2-тетрафторэтила, 2,2,2-трифтор-1-(трифторметил)этила, 1,1,3,3,3-пентафторпропила, 1,1,2,3,3,3-гексафторпропила, 1,1,2,2,3,3,4,4-октафторбутила,1,2,2,3,3,3-гексафтор-1-метилпропила, 1,1,3,3,3-пентафтор-2-(трифторметил)пропила, 2,2,2-трифтор-1 метил-1-(трифторметил)этила, 2-фтор-1,1-бис-(фторметил)этила. 1,2,2,2-Тетрафторэтил, 1,1,3,3,3-пентафторпропил, 1,1,2,3,3,3-гексафторпропил и 2,2,2-трифтор-1-(трифторметил)этил являются предпочтительными, а 2,2,2-трифтор-1-(трифторметил)этил и 1,1,3,3,3-пентафторпропил являются особенно предпочтительными. Перфорированный -C3-C7-циклоалкил означает полностью фторированную циклоалкильную группу, содержащую, как правило, 3-7, предпочтительно 5-6 атомов углерода, например, и предпочтительно перфторциклопентил и перфторциклогексил. Частично фторированный -C1-C7-циклоалкил означает частично фторированную циклоалкильную группу, содержащую, как правило, от 3 до 7 атомов углерода, выбранную, но без ограничения перечисленным, из 2,2-дифторциклогептила, 2-фторциклогептила, 3,3-дифторциклогептила, 3-фторциклогептила, 4,4-дифторциклогептила, 4-фторциклогептила, 4,4-дифторциклогексила, 4-фторциклогексила, 3,3 дифторциклогексила, 3-фторциклогексила, 2,2-дифторциклогексила, 2-дифторциклогексила, 3,3-дифторциклопентила, 3-фторциклопентила, 2,2-дифторциклопентила, 2-фторциклопентила, 3,3-дифторциклобутила, 3-фторциклобутила, 2,2-дифторциклобутила, 2-фторциклобутила, 2,2-дифторциклопропила, 2-фторциклопропил. 4,4-Дифторциклогексил, 4-фторциклогексил, 3,3-дифторциклогексил, 3,3-дифторциклопентил, 3,3-дифторциклобутил и 2,2-дифторциклопропил являются предпочтительными. 4,4 Дифторциклогексил является особенно предпочтительным. Символна связи означает положение присоединения в молекуле. Когда остатки в соединениях в соответствии с изобретением являются замещенными, если не определено иное, такие остатки могут быть монозамещенными или полизамещенными. В рамках настоящего изобретения для всех остатков, которые встречаются несколько раз, их значение является независимым друг от друга. Замещение одним, двумя или тремя одинаковыми или разными заместителями является предпочтительным. Замещение одним заместителем в некоторой степени является особенно предпочтительным. Предпочтительными являются соединения формулы (I), в которойR1, R2, R3, R4, R5, R6 или R7 независимо друг от друга означают водород или фтор, где по меньшей мере один заместитель R1, R2, R3 и R4 означает фтор,X выбирают из группы, включающей водород, C1-C6-алкил-, C3-C8-циклоалкил, C1-C6-алкил-S(O)2-,С 1-C6-алкилкарбонил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, галогена, дейтерия, -CN, -NR8R9, -C(O)NR10R11,-N(R10)CCONR10R11, алкокси, -С(О)OH, -С(О)ОС 1-C6-алкила или -С(О)Обензила,R8 и R9 означают C1-C6-алкил или бензил,R10 и R11 означают водород, C1-C6-алкил или бензил,Y означает -CF3, -C2F5, -C3F7, -C4F9 или -С 3-С 7-циклоалкил с 2-4 атомами фтора,m означает 4, 5 или 6,n означает 2, 3, 4, 5 или 6,p означает 0, 1 или 2,q означает 0, 1,2, 3, 4, 5 или 6,и их соли, сольваты или сольваты солей, включая все кристаллические модификации. Также предпочтительными являются соединения формулы (I), в которойR1, R2, R3, R4 независимо друг от друга означают водород или фтор, причем должно содержаться не менее одного и не более двух атомов фтора,R5 и R6 независимо друг от друга означают водород или фтор,R7 означает водород,X выбирают из группы, включающей водород, -C1-С 4-алкил, циклопропил, которые необязательно могут быть один раз замещены посредством -ОН, -CN, метокси, -С(О)ОН, -С(О)ОСН 3 или-С(О)Обензила, или один раз или многократно посредством -F или дейтерия, или X выбирают из метилS(O)2- или метилкарбонилаm означает 5 или 6,n означает 3, 4 или 5,р означает 0, 1 или 2,q означает 0, 1, 2, 3, 4 или 5,и их соли, сольваты или сольваты солей, включая все кристаллические модификации. Кроме того, предпочтительными являются соединения формулы (I), в которойR1, R2, R3 и R4 независимо друг от друга означают водород или фтор, причем должно содержаться не менее одного и не более двух атомов фтора,R5 и R6 независимо друг от друга означают водород или фтор, при условии, что R5 и R6 одновременно не означают фтор,X означает C1-C4-алкил, необязательно замещенный дейтерием,Y означает -CF3, -C2F5, 4,4-дифторциклогексил,m означает 5 или 6,n означает 3 или 4,р означает 1 или 2,q означает 2, 3, 4 или 5,или в частном случае, в котором Y означает 4,4-дифторциклогексил, q означает 0 или 1,и его соли, сольваты или сольваты солей, включая все кристаллические модификации. Особенно предпочтительными являются соединения формулы (II) в качестве подгруппы формулыR12 означает 3,5-дифторфенил, 3,4-дифторфенил, 2,4-дифторфенил-, 4-фторфенил,R5 и R6 независимо друг от друга означают водород или фтор, гдеR5 и R6 одновременно не означают фтор,X означает C1-C4-алкил-, необязательно замещенный дейтерием,Y означает -CF3, -C2F5, 4,4-дифторциклогексил,m означает 6,n означает 3 или 4,p означает 1 или 2,q означает 2, 3, 4 или 5,или в частном случае, в котором Y означает 4,4-дифторциклогексил, q означает 0 или 1,и их соли, сольваты или сольваты солей, включая все кристаллические модификации. Изобретение далее относится к соединениям формулы (I), в которой R1, R2, R3 и R4 независимо друг от друга означают водород или фтор, где по меньшей мере один заместитель R1, R2, R3 и R4 означает фтор. Изобретение далее относится к соединениям формулы (I), в которой R5, R6 и R7 независимо друг от друга означают водород, фтор, хлор, бром, метил, этил, трифторметил или нитрил. Изобретение далее относится к соединениям формулы (I), в которой X выбирают из группы, включающей Н, C1-C6-алкил-, C3-C8-циклоалкил-, C2-C6-алкенил-, C2-C6-алкинил-, C1-C6-алкил-S(O)2-, C1-C6 алкилкарбонил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, галогена, -CN, -NR8R9, -C(O)NR10R11, -N(R10)C(O)NR10R11, -C1-C6 галогеналкокси, -C1-C6-алкокси, -С(О)OH, -C(O)OC1-C6-алкила или -С(О)Обензила и в которых, необязательно, атомы водорода также могут быть заменены на атомы дейтерия. Изобретение далее относится к соединениям формулы (I), в которой R8 и R9 означают C1-C6-алкил,C3-C7-циклоалкил, фенил или бензил, необязательно замещенный галогеном и/или дейтерием. Изобретение далее относится к соединениям формулы (I), в которой R10 и R11 означают водород илиC1-C6-алкил, C3-C7-циклоалкил, фенил или бензил, необязательно замещенный галогеном и/или дейтерием. Изобретение далее относится к соединениям формулы (I), в которой Y означает перфторированный или частично фторированный -C1-C4-алкил или перфторированный или частично фторированный C3-C8 циклоалкил. Изобретение далее относится к соединениям формулы (I), в которой m означает 4, 5, 6 или 7. Изобретение далее относится к соединениям формулы (I), в которой n означает 2, 3, 4, 5 или 6. Изобретение далее относится к соединениям формулы (I), в которой p означает 0, 1 или 2. Изобретение далее относится к соединениям формулы (I), в которой q означает 0, 1, 2, 3, 4, 5 или 6. Изобретение далее относится к соединениям формулы (I), в которой R1, R2, R3, R4, R5, R6 или R7 независимо друг от друга означают водород или фтор, где по меньшей мере один заместитель R1, R2, R3 и Изобретение далее относится к соединениям формулы (I), в которой X выбирают из группы, включающей Н, C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкил-S(O)2-, C1-C6-алкилкарбонил-, фенил-C1-C6 алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством-OH, галогена, дейтерия, -CN, -NR8R9, -C(O)NR10R11, -N(R10)C(O)NR10R11, алкокси, -С(О)OH, -C(O)OC1C6-алкила или -С(О)Обензила. Изобретение далее относится к соединениям формулы (I), в которой R8 и R9 означают C1-C6-алкил или бензил. Изобретение далее относится к соединениям формулы (I), в которой R10 и R11 означают водород, C1C6-алкил или бензил. Изобретение далее относится к соединениям формулы (I), в которой Y означает -CF3, -C2F5, -C3F7,-C4F9 или -С 3-С 7-циклоалкил с 2-4 атомами фтора. Изобретение далее относится к соединениям формулы (I), в которой m означает 4, 5 или 6. Изобретение далее относится к соединениям формулы (I), в которой n означает 2, 3, 4, 5 или 6. Изобретение далее относится к соединениям формулы (I), в которой R1, R2, R3, R4 независимо друг от друга означают водород или фтор, причем должно содержаться не менее одного и не более двух атомов фтора. Изобретение далее относится к соединениям формулы (I), в которой R5 и R6 независимо друг от друга означают водород или фтор. Изобретение далее относится к соединениям формулы (I), в которой R7 означает водород. Изобретение далее относится к соединениям формулы (I), в которой X выбирают из группы, включающей водород, -C1-C4-алкил, циклопропил, необязательно замещенные один раз посредством -OH,-CN, метокси, -С(О)OH, -С(О)OCH3 или -С(О)OBn, или один раз или многократно посредством -F или дейтерия, метил-S(O)2- или метилкарбонила. Изобретение далее относится к соединениям формулы (I), в которой Y означает -CF3, -C2F5, -CF2CF2CF3, -CF(CF3)2 или Изобретение далее относится к соединениям формулы (I), в которой m означает 5 или 6. Изобретение далее относится к соединениям формулы (I), в которой n означает 3, 4 или 5. Изобретение далее относится к соединениям формулы (I), в которой q означает 0, 1, 2, 3, 4 или 5. Изобретение далее относится к соединениям формулы (I), в которой R5 и R6 независимо друг от друга означают водород или фтор, при условии, что R5 и R6 одновременно не означают фтор. Изобретение далее относится к соединениям формулы (I), в которой X означает C1-C4-алкил-. Изобретение далее относится к соединениям формулы (I), в которой Y означает -CF3, -C2F5, 4,4 дифторциклогексил. Изобретение далее относится к соединениям формулы (I), в которой m означает 5 или 6. Изобретение далее относится к соединениям формулы (I), в которой n означает 3 или 4. Изобретение далее относится к соединениям формулы (I), в которой p означает 1 или 2. Изобретение далее относится к соединениям формулы (I), в которой q означает 2, 3, 4 или 5. Изобретение далее относится к соединениям формулы (I), в которой, в частном случае, Y означает 4,4-дифторциклогексил, q означает 0 или 1. Изобретение далее относится к соединениям формулы (II), в которой R12 означает 3,5-дифторфенил,3,4-дифторфенил, 2,4-дифторфенил, 4-фторфенил. Изобретение далее относится к соединениям формулы (II), в которой R5 и R6 независимо друг от друга означают водород или фтор, при условии, что R5 и R6 одновременно не означают фтор. Изобретение далее относится к соединениям формулы (II), в которой X означает C1-C4-алкил. Изобретение далее относится к соединениям формулы (II), в которой Y означает -CF3, -C2F5, 4,4 дифторциклогексил. Изобретение далее относится к соединениям формулы (II), в которой m означает 6. Изобретение далее относится к соединениям формулы (II), в которой n означает 3 или 4. Изобретение далее относится к соединениям формулы (II), в которой p означает 1 или 2. Изобретение далее относится к соединениям формулы (II), в которой q означает 2, 3, 4 или 5. Изобретение далее относится к соединениям формулы (II), в которой в частном случае Y означает 4,4-дифторциклогексил, q означает 0 или 1. Определения остатков, установленные индивидуально в отдельных комбинациях или предпочтительных комбинациях остатков, при необходимости также заменяются на определения остатков другой комбинации независимо от отдельно установленных комбинаций остатков. Комбинации двух или нескольких предпочтительных диапазонов, установленных выше, в некоторой степени особенно предпочтительны. Определения остатков, приведенные выше в целом или в предпочтительных диапазонах, применяются и на конечные продукты формулы (I) и соответственно на исходные вещества или промежуточные соединения, необходимые для получения в каждом конкретном случае. Изобретение далее относится к способу получения соединений в соответствии с изобретением. По-6 022547 лучение соединений в соответствии с изобретением (I) или соединений (II) в качестве подгруппы формулы (I) можно пояснить следующей схемой синтеза. Промежуточные соединения 5, которые получали, как раскрыто в описании изобретения к патентуWO 03/033461 А 1, приведены на следующей общей схеме (схема синтеза 1), где R1, R2, R3, R4, R5, R6 и R7 имеют значения, указанные для формулы (I). Схема синтеза 1 Промежуточные соединения 2 синтезируют с помощью реакций конденсации ацетальдегида, известных специалисту в данной области техники, с одним из промежуточных соединений 1 (доступных для приобретения, например, от Aldrich, ABCR) при основном катализе в воде с добавлением или без органического растворителя, который является стабильным в этих условиях (Organic Reactions 1968, 16,1; Justus Liebigs Ann. Chem. 1917, 412, 322; J. Org. Chem. 1951, 16, 1519; Helv. Chim. Acta 1993, 76, 1901). Реакция с гидроксидом калия с добавлением дихлорметана между 1-30C является особенно предпочтительной. Промежуточные соединения 3 затем подвергают реакции при условиях Кневенагеля, известных специалисту в данной области техники, с арилуксусной кислотой (доступной для приобретения от, например, Aldrich, ABCR) (Organic Reactions 1967, 15, 204; Tetrahedron Lett. 1998, 39, 8013). Реакция с уксусным ангидридом и триэтиламином при нагревании до 90C с обратным холодильником является особенно предпочтительной. Промежуточные соединения 4 синтезируют с помощью каталитического гидрирования, как известно специалисту в данной области техники (Houben Weyl "Methoden der organischenVerlag Штутгарт, Нью-Йорк). Промежуточные соединения 5 получают с помощью методов замыкание кольца Фриделя-Крафтса, которые хорошо знакомы специалисту в данной области техники (Chem. Rev. 1970, 70, 553; J. Org. Chem. 1958, 23, 789, J. Org. Chem. 1981, 46, 2974; J. Med. Chem. 1986, 29, 1615). Использование пентаоксида фосфора в метансульфоновой кислоте или трифторметансульфоновой кислоте в температурном диапазоне 0-30C может быть упомянуто как особенно предпочтительное. Альтернативно, промежуточные соединения 5 могут быть получены в соответствии со схемой синтеза 2, где R1, R2, R3, R4, R5, R6 и R7 имеют значения, указанные для формулы (I). Схема синтеза 2 Промежуточные соединения 5 могут быть получены путем арилирования промежуточных соединений K, известного специалисту в данной области техники (J. Am. Chem. Soc. 1997, 119, 11108; J. Am.Chem. 2006, 71, 685; Tetrahedron 2005, 61, 9716; Angew. Chem. 2005, 117, 2497; Angew. Chem. 2005, 117,407; Angew. Chem. 2006, 118, 7789). Для этого соединение палладия (например, Pd(OAc)2, Pd2(dba)3) подвергают реакции с лигандом (таким как, например, BINAP, 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил,-7 022547 ксантфос, трифенилфосфин, DTPF, 1,1'-бис-(ди-о-толилфосфино)ферроцен, 1,3-ди-трет-бутил-2-хлор 1,3,2-диазафосфолидин, 2'-(дициклогексилфосфино)-N,N-диметилбифенил-2-амин) в растворителе (таком как, например, толуол, ксилол, тетрагидрофуран, диоксан, диметоксиэтан, трет-бутилметиловый эфир) с основанием (таким как, например, трет-бутилат натрия, трет-бутилат калия, гидрид натрия, гидрид калия, гексаметилдисилазид калия, трикалий фосфат, карбонат цезия) и ароматическим галогенидом или трифлатом при температуре в диапазоне 40-160C. Используемая температура также зависит от растворителя. Также используемое соединение палладия может быть присоединено к соответствующим лигандам заранее, например, представлять собой (ItBu)Pd(аллил)Cl, (IPr)Pd(acaac)Cl, Pd(dppf)Cl,[PdBrPtBu]2. Особенно предпочтительно для реакций используют ацетат палладия(II) с BINAP или ксантфосом или аллилхлор(1,3-бис-(2,6-диизопропилфенил)имидазол-2-илиден)палладий. Соль щелочного металла со спиртом в качестве основания в ТГФ при температуре 60-80C является особенно предпочтительной. В некоторой степени является особенно предпочтительной реакция с ацетатом палладия(II), ксантфосом, трет-бутилатом натрия в ТГФ при нагревании с обратным холодильником. Избыток арилгалогенида следует поддерживать настолько низким, насколько это возможно, предпочтительно используют точно один эквивалент арилгалогенида и один эквивалент кетона. Промежуточные соединения 10 могут быть синтезированы в соответствии со схемой синтеза 3, гдеR1, R2, R3, R4, R5, R6 и R7 и m имеют значения, указанные для формулы (I). Схема синтеза 3 Промежуточное соединение 6 может быть получено при условиях, известных специалисту в данной области техники (Tetrahedron: Asymmetry 1990, 1, 97; J. Org. Chem. 1996, 61, 8536; Synthesis 2002, 2064). Также могут быть получены аналогичные перфторированные сульфониленольные простые эфиры, где нонафторбутильный остаток заменен, например, на трифторметил. Реакция в присутствии органических аминов в простых эфирах или галогенированных растворителях является особенно предпочтительной для получения промежуточного соединения 6. Реакция с нонафторбутилсульфонилфторидом в смеси тетрагидрофуран/метил-трет-бутиловый эфир с 2,3,4,5,7,8,9,10-октагидропиридо[1,2-4][1,3]диазепином в качестве основания и с охлаждением при 0-15C в некоторой степени является особенно предпочтительной. Промежуточные соединения 7 могут быть получены по Соногашира с палладиевым катализатором(например, Pd(PPh3)4, Pd(Cl)2(PPh3)2 и такими же коммерческими катализаторами) и аминооснованием в апротонном растворителе (Chem. Rev. 2007, 107, 874; Synthesis 1986, 320; Angew. Chetn. 1994, 106, 1568),как известно специалисту в данной области техники. Реакция с тетракистрифенилфосфином палладия и триэтиламином в ДМФА при 60-100C является особенно предпочтительной. Промежуточные соединения 8 могут быть синтезированы с помощью методов, известных специалисту в данной области техники(J. Org. Chem. 1990, 55, 3484; J. Org. Chem. 1964, 29, 3660; Chem. Ber. 1959, 92, 541) с использованием катализатора на основе переходного металла и водорода. Гидрирование над палладием является особенно предпочтительным. Гидрирование в метаноле с добавлением основания, например гидроксида калия,в некоторой степени является особенно предпочтительным. Для получения промежуточного соединения 9 метиловый эфир должен быть расщеплен с помощью методов, которые известны специалисту в данной области техники ("Protective Groups in Organic Synthesis" 3-е издание, с. 250 и последующие с. (1999),John WileySons Нью-Йорк). Расщепление трибромидом бора является особенно предпочтительным, а расщепление метилового эфира трибромидом бора с добавлением производного пиридина (например,лутидин) с охлаждением в инертном растворителе (например, дихлорметане) при 0-10C в некоторой степени является особенно предпочтительным. Для получения примерных соединений синтезируют промежуточное соединение 10, которое в боковой цепи преобразовано в активированную форму, как известно специалисту в данной области техники (J. Am. Chem. Soc. 1964, 86, 964; Tetrahedron Lett. 1973,3937; Angew. Chem. Int. Ed. 1975, 14, 801; J. Org. Chem. 1969, 34, 212; J. Am. Chem. Soc. 1970, 92, 2139; J.Chem. Soc., Perkin Trans. 1, 1980, 2866; J. Org. Chem. 1986, 51, 5291; J. Org. Chem. 1962, 27, 349). Превращение в бромсодержащее соединение с помощью трифенилфосфина и четырехбромистого углерода в инертном растворителе (например, тетрагидрофуране) при 0-10C является особенно предпочтительным. Промежуточные соединения 11 могут быть получены в соответствии со схемой синтеза 4, где галоген означает хлор, бром или йод, n имеет значение, приведенное в формуле (I), и X1 выбирают из группы, включающей Н, C1-C6-алкил-, C3-C8-циклоалкил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, галогена, -CN, алкокси. Схема синтеза 4 Промежуточные соединения 11 могут быть получены при условиях, известных специалисту в данной области техники (J. Chem. Soc. 1950, 579; J. Am. Chem. Soc. 1953, 75, 3700). Промежуточные соединения 16 могут быть получены в соответствии со схемой синтеза 5, где Y, q,n имеют значения, указанные для формулы (I), X2 выбирают из группы, включающей Н, C1-C6-алкил-,C3-C8-циклоалкил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, дейтерия, галогена, -CN, алкокси. Схема синтеза 5 Коммерческие промежуточные соединения 12 (например, Aldrich) превращают с помощью методов,известных специалисту в данной области техники, в промежуточные соединения 13 (J. Chem. Soc. 1939,1248; Synthesis 1996, 594; Helv. Chim. Acta 1946, 29, 671). Промежуточные соединения 14 могут быть синтезированы с помощью методов, известных специалисту в данной области техники (J. Chem. Soc. 1950, 579; J. Am. Chem. Soc. 1953, 75, 3700). Промежуточные соединения 15 получают методами синтеза,известными специалисту в данной области техники (Pharm. Chem. J. 1989, 23, 998). Промежуточные соединения 16 синтезируют с помощью методов, известных специалисту в данной области техники (Org.Soc. 1952, 74, 5105; J. Am. Chem. Soc. 1954, 76, 658). Промежуточные соединения 18 могут быть получены в соответствии со схемой синтеза 6, где Y, q,n имеют значения, указанные для формулы (I), Х 3 выбирают из группы, включающей Н, C1-C6-алкил-,C3-C8-циклоалкил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, дейтерия, галогена, -CN, алкокси. Промежуточные соединения 17 могут быть получены с помощью методов, известных специалисту в данной области техники (Org. Prep. Proced. Int. 1982, 14, 45; J. Org. Chem. 1962, 27, 282). Окисление метаперйодатом является особенно предпочтительным. Окисление метаперйодатом натрия в некоторой степени является особенно предпочтительным. Промежуточные соединения 18 могут быть получены,как описано для промежуточных соединений 16. Промежуточные соединения 20 могут быть получены в соответствии со схемой синтеза 7, где Y, q,n имеют значения, указанные для формулы (I), X4 выбирают из группы, включающей Н, C1-C6-алкил-,C3-C8-циклоалкил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, дейтерия, галогена, -CN, алкокси. Схема синтеза 7 Промежуточные соединения 19 могут быть получены с помощью методов, известных специалисту в данной области техники (J. Org. Chem. 1957, 22, 241; J. Org. Chem. 2004, 69, 3824; J. Am. Chem. Soc. 1941, 63, 2939; Org. Lett. 1999, 1, 189). Окисление перкислотами является особенно предпочтительным. Промежуточные соединения 20 могут быть получены, как описано для промежуточных соединений 16. Промежуточные соединения 14 также могут быть получены в соответствии со схемой синтеза 8, гдеY и q имеют значения, указанные для формулы (I). Схема синтеза 8 Промежуточные соединения 14 также могут быть получены из соответствующих галогенсодержащих соединений с помощью методов, известных специалисту в данной области техники (J. Am. Chem.Soc. 1953, 75, 3700; J. Org. Chem. 1984, 49, 3231). Промежуточные соединения 16, 18 и 20 также альтернативно могут быть получены в соответствии со схемой синтеза 9, где Y, p, q, n имеют значения, указанные для формулы (I), Х 5 выбирают из группы,включающей II, C1-C6-алкил-, C3-C8-циклоалкил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, дейтерия, галогена, -CN, алкокси. Промежуточные соединения 21 синтезируют с помощью реакции тозилатов 13 или соответствующих галогенсодержащих соединений с промежуточным соединением 11 с помощью методов, известных специалисту в данной области техники, как описано для промежуточного соединения 15. Превращение в промежуточные соединения 22 совершается по аналогии с методами получения промежуточных соединений 17 и 19. Превращение в промежуточные соединения 16, 18 и 20, исходя из промежуточных соединений 21 или 22, может совершаться с помощью методов, известных специалисту в данной области техники (например, "Protective Groups in Organic Synthesis", 3-е издание, с. 520 и последующие с. (1999),John WileySons Нью-Йорк). Расщепление кислотами является особенно предпочтительным, а расщепление трифторуксусной кислотой в некоторой степени является особенно предпочтительным. Примерные соединения могут быть синтезированы в соответствии со схемой синтеза 10 по реакции промежуточных соединений 16, 18 или 20 с промежуточным соединением 10, где R1, R2, R3, R4, R5, R6,R7, m, n, p, q, Y имеют значения, указанные для формулы (I), X6 выбирают из группы, включающей Н,C1-C6-алкил-, C3-C8-циклоалкил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, дейтерия, галогена, -CN, алкокси. Схема синтеза 10 Примерные соединения синтезировали в соответствии со схемой синтеза 10 по реакции промежуточных соединений 16, 18 или 20 с промежуточным соединением 10. Реакции могут быть проведены с помощью методов, известных специалисту в данной области техники, как описано для превращения промежуточного соединения 15 в промежуточное соединение 16. Реакция в присутствии йодида щелочного металла и карбоната щелочных металлов в апротонном растворителе, таком как ДМФА или NMP,является особенно предпочтительной. Дальнейшие примерные соединения могут быть получены в соответствии со схемой синтеза 11 по реакции примерных соединений со значением Х 6 = Н до примерных соединений с Х 7, выбранным из группы, включающей C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкил-S(O)2-, C1-C6-алкилкарбонил-, фенил-C1-C6-алкил-, которые необязательно могут быть замещены один раз, два раза или многократно посредством -OH, дейтерия, галогена, -CN, NR7R8, -C(O)NR9R10, -N(R9)C(O)NR9R10, алкокси или -С(О)ОС 1 С 6-алкила. Реакция в соответствии со схемой синтеза 11 может быть проведена с помощью методов, описанных для превращения промежуточного соединения 15 в промежуточное соединение 16. Дальнейшие примерные соединения могут быть получены в соответствии со схемой синтеза 12 по реакции примерных соединений со значением Х 7 = C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкилкарбонил-, фенил-C1-C6-алкил-, которые замещены один раз, два раза или многократно -C(O)OC1-C6-алкилом,в примерные соединения со значением Х 8 = C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкилкарбонил-, фенил-C1-C6-алкил-, которые замещены один раз, два раза или многократно -С(О)OH. Схема синтеза 12 Гидролиз примерных соединений со значением Х 7 = C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкилкарбонил-, фенил-C1-C6-алкил-, которые замещены один раз, два раза или многократно -C(O)OC1-C6 алкилом, до примерных соединений со значением Х 8 = C1-C6-алкил-, C3-C8-циклоалкил-, C1-C6-алкилкарбонил-, фенил-С 1-C6-алкил-, которые замещены один раз, два раза или многократно -С(О)OH, может быть выполнен с помощью методов, которые известны специалисту в данной области техники ("Protective Groups in Organic Synthesis", 3-е издание, с. 250 и последующие с. (1999), John WileySons НьюЙорк; J. Am. Chem. Soc. 1946, 68, 1855; J. Org. Chem. 1959, 24, 1367). Реакции с водным щелочным раствором и спиртом являются особенно предпочтительными. Реакции с гидроксидом щелочного металла(например, NaOH, KOH, LiOH) в некоторой степени являются особенно предпочтительными. Соединения в соответствии с изобретением демонстрируют непредвиденный, ценный фармакологический и фармакокинетический спектр действия. Они, следовательно, являются пригодными для применения в качестве лекарственных средств для лечения и/или профилактики заболеваний у людей и животных. В рамках настоящего изобретения термин "лечение" включает профилактику. Фармацевтическая действенность соединений в соответствии с изобретением может быть объяснена их действием в качестве SERM. Настоящее изобретение далее относится к применению соединений в соответствии с изобретением для лечения и/или профилактики заболеваний, предпочтительно гинекологических заболеваний, для облегчения симптомов андропаузы и менопаузы, то есть для заместительной терапии мужскими и женскими половыми гормонами (НКТ), а именно и для профилактики, и для лечения; для лечения нарушений,сопровождающих дисменорею; лечения дисфункциональных маточных кровотечений; лечения акне; предотвращения и лечения сердечно-сосудистых заболеваний; лечения гиперхолестеринемии и гиперлипидемии; предотвращения и лечения атеросклероза; для ингибирования пролиферации артериальных гладкомышечных клеток; для лечения респираторного дистресс-синдрома новорожденных; лечения первичной легочной гипертензии; для предотвращения и лечения остеопороза (Black, L.J., Sato, M., Rowley,E.R., Magee, D.E., Bekele, A., Williams, D.C., Cullinan, G.J., Bendele, R., Kauffman, R.F., Bensch, W.R.,Frolik, C.A., Termine, J.D. and Bryant, H.U. Raloxifene [LY 139481 HC1] prevents bone loss and reduces serum cholesterol without causing uterine hypertrophy in ovariectomized rats; J. Clin. Invest. 93: 63-69, 1994); для предотвращения потери костной массы у женщин в постменопаузе, у женщин после гистероэктомии или у женщин, получавших лечение ЛГРФ агонистами или антагонистами; ингибирования созревания спермы; лечения ревматоидного артрита; для предотвращения болезни Альцгеймера; лечения эндомет- 12022547 риоза; лечения миомы; лечения миомы и эндометриоза в комбинации с ЛГРФ аналогами; лечения гормонозависимых опухолей (также у женщин в пременопаузе), например рака молочной железы или, например, эндометриальной карциномы, лечения болезней предстательной железы, лечения заболеваний молочной железы с доброкачественным течением, например мастопатии. Кроме того, на основе их фармакологического профиля соединения в соответствии с изобретением являются пригодными и для мужской, и для женской контрацепции. Настоящее изобретение далее относится к применению соединений в соответствии с изобретением для лечения бесплодия и для индукции овуляции. Настоящее изобретение далее относится к применению соединений в соответствии с изобретением для лечения и профилактики удара и болезни Альцгеймера и других заболеваний центральной нервной системы, которые сопровождаются клеточной смертью нейронов. Настоящее изобретение далее относится к применению соединений в соответствии с изобретением для получения лекарственного средства для лечения и/или профилактики заболеваний, в частности вышеупомянутых заболеваний. Настоящее изобретение далее относится к способу лечения и/или профилактики заболеваний, в частности вышеупомянутых заболеваний, с применением эффективного количества соединений в соответствии с изобретением. Настоящее изобретение далее относится к применению соединений в соответствии с изобретением для лечения и/или профилактики заболеваний, в частности вышеупомянутых заболеваний. Настоящее изобретение далее относится к соединениям в соответствии с изобретением для применения в способе лечения и/или профилактики вышеупомянутых заболеваний. Настоящее изобретение далее относится к лекарственным средствам, содержащим по меньшей мере одно соединение в соответствии с изобретением и по меньшей мере одно или несколько других активных веществ, в частности, для лечения и/или профилактики вышеупомянутых заболеваний. Например, и предпочтительно следующие вещества могут быть упомянуты в качестве пригодных активных веществ комбинаций: эстрогены, гестагены и антагонисты прогестероновых рецепторов. Эстрогены являются соединениями (встречающимися в природе или синтетическими, стероидными и нестероидными соединениями), которые демонстрируют эстрогенное действие. Такими соединениями являются, например, этинилэстрадиол, эстрадиол, эстрадиол сульфамат, эстрадиол валерат, эстрадиол бензоат, эстроны, местранол, эстриол, эстриол сукцинат и конъюгированный эстроген, включая конъюгированные лошадиные эстрогены, такие как эстрон сульфат, 17-эстрадиол сульфат, 17-эстрадиол сульфат, эквилин сульфат, 17-дигидроэквилин сульфат, 17-дигидроэквилин сульфат, эквиленин сульфат, 17-дигидроэквиленин сульфат и 17-дигидроэквиленин сульфат. Главным образом интересными эстрогенами являются этинилэстрадиол, эстрадиол, эстрадиол сульфамат, эстрадиол валерат, эстрадиол 15-бензоат, эстрон, местранол и эстрон сульфат. В качестве эстрогенов являются предпочтительными этинилэстрадиол, эстрадиол и местранол, а этинилэстрадиол является особенно предпочтительным. Гестагены в смысле настоящего изобретения подразумевают либо природный прогестерон как таковой, либо синтетические производные (стероидные и нестероидные), которые подобно прогестерону как таковому связываются с прогестероновым рецептором и в дозировках, которые выше подавляющей овуляцию дозы, подавляют овуляцию. Следующие вещества могут быть упомянуты в качестве примеров гестагенов: левоноргестрел, норгестимат, норетистерон, дидрогестерон, дроспиренон, 3-бета-гидроксидезогестрел, 3-кетодезогестрел (= этоногестрел), 17-деацетилноргестимат, 19-норпрогестерон, ацетоксипрегненолон, аллилэстренол, амгестон, хлоромадинон, ципротерон, демегестон, дезогестрел, диеногест, дигидрогестерон, диметистерон, етистерон, этинодиол диацетат, флурогестон ацетат, гастринон,гестоден, гестринон, гидроксиметилпрогестерон, гидроксипрогестерон, линестренол (= линоэстренол),мецирогестрон, медроксипрогестерон, мегестрол, меленгестрол, номегестрол, норэтиндрон (= норетистерон), норэтинодрель, норгестрел (включая d-норгестрел и dl-норгестрел), норгестриенон, норметистерон,прогестерон, квингестанол, (17 альфа)-17-гидрокси-11-метилен-19-норпрегна-4,15-диен-20-ин-3-он, тиболон, тримегестон, алгестон ацетофенид, несторон, промегестон, сложный эфир 17-гидроксипрогестерона, 19-нор-17-гидроксипрогестерон, 17 альфа-этинил-тестостерон, 17 альфа-этинил-19-нортестостерон, d-17 бета-ацетокси-13 бета-этил-17 альфа-этинил-гон-4-ен-3-оноксим или соединения, раскрытые вWO 00/66570, в частности танапрогет. Левоноргестрел, норгестимат, норетистерон, дроспиренон, дидрогестерон и диеногест являются предпочтительными. Дроспиренон и диеногест являются особенно предпочтительными. Антагонистами прогестероновых рецепторов являются соединения, которые ингибируют действие прогестерона на его рецептор. В качестве примеров можно упомянуть RU 486, онапристон, лонаприсан(11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он ср. WO 98/34947) и соединения, заявленные в WO 08/58767. Изобретение также относится к фармацевтическим препаратам, которые содержат по меньшей мере одно соединение общей формулы I (или его физиологически совместимые кислотно-аддитивные соли с органическими и неорганическими кислотами), и к применению этих соединений для получения лекар- 13022547 ственных средств, в частности в случае упомянутых выше показаний. Соединения могут применяться в случае упомянутых выше показаний и путем перорального, и путем парентерального введения. Соединения также могут применяться в комбинации с природным витамином D3 или с аналогами кальцитриола для остеогенеза или в качестве поддерживающей терапии в случае терапий, которые вызывают потерю костной массы (например, терапии глюкокортикоидами, химиотерапии). Соединения общей формулы I также могут применяться в комбинации с антагонистами прогестероновых рецепторов или в комбинации с чистым эстрогеном и, в частности, для применения в гормонозаместительной терапии и для лечения гинекологических расстройств и для контроля женской фертильности. Терапевтическое средство, содержащее эстроген и чистый антиэстроген для одновременного, последовательного или отдельного применения, для селективной эстрогенной терапии перименопаузальных или постменопаузальных состояний уже описано в ЕР-А-0346014. Соединения общей формулы I также могут вводиться в комбинации с гестагенами, веществами с гестагенным действием или КПК (комбинированный пероральный контрацептив), в частности для применения у женщин в пременопаузе для лечения гинекологических заболеваний, таких как эндометриоз,миомы или нарушения менструального цикла, например дисменореи или гиперменореи, или для лечения гормонозависимых опухолей, например рака молочной железы. Соединения общей формулы I могут вводиться и непрерывно (например один раз ежедневно), и в прерывистых режимах. Можно упомянуть, например, (но не исключительно) режимы лечения, такие как один раз в неделю, один раз в месяц, ежедневный в течение нескольких дней, в частности дней женского менструального цикла (например, в течение 14 последовательных дней секреторной фазы или нескольких дней в середине менструального цикла). Соединения общей формулы I также могут вводиться непрерывно в течение более длительного периода лечения (например, 14-168 последовательных дней) с последующей паузой в лечении, которая либо является четко установленной (например, 14-84 дней), либо является гибкой и длится до начала следующего менструального кровотечения. В этих прерывистых режимах лечения соединения общей формулы I могут вводиться сами или в комбинации с вышеупомянутыми препаратами комбинированного лечения, а те, в свою очередь, могут быть введены непрерывно или же прерывисто. Соединения в соответствии с изобретением могут обладать системным и/или местным действием. Для этой цели они могут вводиться пригодным путем, например перорально, парентерально, пульмонально, назально, сублингвально, лингвально, буккально, ректально, дермально, трансдермально, конъюнктивально, отично или в виде имплантата или стента. Этими путями применения соединения в соответствии с изобретением могут вводиться в пригодных лекарственных формах. Лекарственные формы, которые функционируют в соответствии с известным уровнем техники, с быстрым и/или модифицированным высвобождением соединений в соответствии с изобретением, содержащие соединения в соответствии с изобретением в кристаллическом, и/или аморфизованном, и/или растворенном виде, являются пригодными для перорального применения, например, в виде таблеток(непокрытых или покрытых таблеток, например, с энтеросолюбильными покрытиями, или покрытиями с отсроченным растворением, или нерастворимыми покрытиями, которые контролируют высвобождение соединения в соответствии с изобретением), таблеток, которые быстро распадаются в полости рта, или пленок/облаток, пленок/лиофилизатов, капсул (например, твердых желатиновых или мягких желатиновых капсулы), драже, гранул, пеллет, порошков, эмульсий, суспензий, аэрозолей или растворов. Парентеральное применение может выполняться во избежание стадии всасывания (например, внутривенно, внутриартериально, интракардиально, интраспинально или интралюмбарно) или с включением всасывания (например, внутримышечно, подкожно, внутрикожно, чрескожно или внутрибрюшинно). Пригодными лекарственными формами для парентерального применения являются, среди других,инъекция и инфузия препаратов в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков. Пригодными лекарственными формами для других путей введения являются, например, ингаляционные фармацевтические формы (например, ингаляторы для порошков, распылители), капли в нос,растворы и распыляемые растворы; таблетки для лингвального, сублингвального или буккального введения, пленки/облатки или капсулы, суппозитории, препараты для ушей или глаз, вагинальные капсулы,водные суспензии (лосьоны, взбалтываемые смеси), липофильные суспензии, мази, кремы, трансдермальные терапевтические системы (например, пластыри), молочко, пасты, пены, присыпки, имплантаты,внутриматочные системы IUS для высвобождения лекарства (например, внутриматочные спирали), влагалищные кольца или стенты. Соединения в соответствии с изобретением могут быть переведены в установленные лекарственные формы. Это можно выполнить способом, который известен как таковой, путем смешивания с инертными,нетоксичными, фармацевтически пригодными наполнителями. Эти наполнители включают среди прочего носители (например, микрокристаллическую целлюлозу, лактозу, маннит), растворители (например,жидкие полиэтиленгликоли), эмульгаторы и диспергирующие или смачивающие вещества (например,додецилсульфат натрия, полиоксисорбитанолеат), связующие (например, поливинилпирролидон), синте- 14022547 тические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как аскорбиновая кислота), красители (например, неорганические пигменты, такие как оксиды железа) и вещества, корректирующие вкус и/или запах. Настоящее изобретение далее относится к лекарственным средствам, которые содержат по меньшей мере одно соединение в соответствии с изобретением, обычно вместе с одним или несколькими инертными, нетоксичными, фармацевтически пригодными наполнителями, и их применению с целью, установленной выше. В случае перорального введения количество составляет около 0.01-100 мг/кг массы тела в день. Количество соединения общей формулы I, подлежащее введению, варьируется в широком диапазоне и может покрывать каждое эффективное количество. В зависимости от состояния, подвергающегося лечению, и способа введения количество вводимого соединения может составлять 0.01-100 мг/кг массы тела в день. Однако, необязательно, в некоторых случаях может существовать необходимость в отклонении от установленных количеств, а именно в зависимости от массы тела, пути введения, индивидуального ответа на активное вещество, типа препарата и момента времени или интервала, в котором имеет место применение. Таким образом, в некоторых случаях может быть достаточным применять количество, меньшее, чем вышеупомянутое минимальное количество, тогда как в других случаях установленный верхний предел должен быть превышен. В случае введения больших количеств может быть целесообразным разделение последних на несколько отдельных доз, вводимых в течение дня. Процентные содержания, указанные в следующих исследованиях и примерах, являются, если не определено иное, процентными содержаниями по массе; части являются частями по массе. Части растворителей, степени разбавления и информация о концентрации для растворов жидкость/жидкость относятся в каждом случае к объему. Список сокращений, химия Сокращения и акронимыCI химическая ионизация (в МС) ТСХ тонкослойная хроматография ДМФА диметилформамид ДМСО диметилсульфоксид теор. "от теоретического" (относящийся к выходу)ESI ионизация методом электрораспыления (в МС) ГХ-МС газовая хроматография в сочетании с масс-спектроскопией ч час(-ы) ВЭЖХ высокоэффективная (высокого давления) жидкостная хроматография ЖХ-МС жидкостная хроматография в сочетании с масс-спектроскопией Найденная масса, найденная по масс-спектру масса мин минута(-ы) МС масс-спектроскопия ЯМР ядерный магнитный резонансRt время удержания (в ВЭЖХ) КТ комнатная температура ТФУ трифторуксусная кислота ТГФ тетрагидрофуран Очистка соединений в соответствии с изобретением В некоторых случаях соединения в соответствии с изобретением могут быть очищены с помощью препаративной ВЭЖХ, например с использованием автоочистительных аппаратов от компании Waters(детектирование соединений с помощью УФ-детектирования и ионизация методом электрораспыления) в комбинации с доступными для приобретения, предварительно укомплектованными ВЭЖХ колонками(например, колонка XBridge (от Waters), С 18, 5 мкм, 30100 мм). В качестве системы растворителей использовали смесь ацетонитрил/вода + 0.1% ТФУ или 0.1% муравьиной кислоты. Взамен ацетонитрила,например, также можно использовать метанол. Поток во время очистки составляет 50 мл/мин. В некоторых случаях соединения в соответствии с изобретением очищали, придерживаясь следующего метода (ВЭЖХ-метод 1): ВЭЖХ автоочистительная система Waters Pump 2525, устройство управления образцами 2767, CFO, DAD 2996, ELSD 2424, ZQ 4000, колонка: XBridge С 18, 5 мкм, 10030 мм,50 мл/мин, растворитель: вода с 0.1% муравьиной кислоты-ацетонитрил 99:1, 0-1 мин; 99:1 1:99, 1-7.5 мин; 1:99, 7.5-10 мин, детектирование на DAD с диапазоном сканирования 210-400 нм, ELSD, MC ESI(+), ESI (-), с диапазоном сканирования 160-1000 m/z. В некоторых случаях соединения в соответствии с изобретением очищали, придерживаясь следующего метода (ВЭЖХ-метод 2): XBridge С 18, 5 мкм, 10030 мм, 50 мл/мин, растворитель: вода с 0.1% муравьиной кислоты-метанол 70:30, 0-1 мин; 70:30 1:99, 1-7.5 мин; 1:99, 7.5-10 мин, другие условия были подобными методу 1. Сушку вымораживанием или вакуумное центрифугирование использовали для удаления смеси растворителей для ВЭЖХ. Полученные таким образом соединения могли находиться в виде ТФУ соли или соли муравьиной кислоты и могли быть превращены в соответствующие свободные основания с помощью стандартных лабораторных методик, которые известны специалисту в данной области техники. В некоторых случаях соединения в соответствии с изобретением могли быть очищены с помощью хроматографии с силикагелем. Для этого можно было бы, например, использовать предварительно заправленные силикагелем картриджи (например, от компании Separtis, Isolute Flash silica gel) в комбинации с хроматографом Flashmaster II (Argonaut/Biotage) и растворителями или смесями растворителей для хроматографии, такими как, например, гексан, этилацетат и дихлорметан, и метанол, причем также могли быть использованы примеси водного раствора аммиака. Структурный анализ соединений в соответствии с изобретением В некоторых случаях соединения в соответствии с изобретением анализировали с помощью ЖХМС. Один из использованных методов анализа основывался на следующих параметрах. Система Waters Acquity СВЭЖХ-МС: устройство управления бинарным растворителем, устройство управления образцами/органайзер, устройство управления колонкой, PDA, ELSD, SQD 3001, колонка:Acquity ВЕН С 18, 1.7 мкм, 502.1 мм. Воду с 0.1% ТФУ или с 0.1% муравьиной кислоты использовали в качестве растворителя А. Растворитель В состоял из ацетонитрила. Градиент 0-1.6 мин 1-99% В, 1.6-2.0 мин 99% В, поток 0.8 мл/мин, температура 60C, раствор образца 1.0 мг/мл в смеси ацетонитрил/вода 7:3,инжекция 2.0 мкл, детектирование на DAD с диапазоном сканирования 210-400 нм, ELSD, MC ESI (+),ESI (-), с диапазоном сканирования 160-1000 m/z. В некоторых случаях соединения в соответствии с изобретением анализировали с помощью ЖХМС: время удержания Rt из ЖХ-МС анализа: детектирование: УФ = 200-400 нм (ВЭЖХ система Acquity от компании Waters)/MC 100-800 Да; 20 В (Micromass/Waters ZQ 4000) в ESI положит. методике (для получения положительно заряженных молекулярных ионов); ВЭЖХ колонка: X Bridge (Waters), 2.150 мм,ВЕН 1.7 мкм; растворитель: А: вода/0.05% муравьиной кислоты, В: ацетонитрил. Градиент: 10-90% В в 1.7 мин, 90% В в течение 0.2 мин, 98-2% В в 0.6 мин; скорость потока: 1.3 мл/мин. В некоторых случаях для регистрации масс-спектра использовали прибор Waters ZQ4000 или Single Quadrupol API (ионизация при атмосферном давлении) масс-детектор (Waters). Следующие символы используются при указании ЯМР данных соединений в соответствии с изобретением: 50 г Гидроксида калия растворяли в 250 мл воды и добавляли 50 г (0.324 моль) 2-фтор-3 метоксибензальдегида в 200 мл дихлорметана. 57.16 г Ацетальдегида в 250 мл воды добавляли по каплям в течение 3 ч. Перемешивание продолжали в течение ночи и в течение 1 дня при комнатной температуре. По каплям добавляли 15 г ацетальдегида в 60 мл воды. Смесь перемешивали в течение дополнительных 24 ч при комнатной температуре. Смесь взбалтывали три раза с дихлорметаном. Значение pH объединенных органических фаз устанавливали на 5-6 с помощью смеси уксусная кислота-вода 1:4, промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Продукт очищали на силикагеле 60 (растворитель: гексан, гексан-этилацетат 95:5 и 90:10). Получали 38 г (65% от теор.) продукта. 1 142 мл 20% Раствора гидроксида калия добавляли к 50 г (0.324 моль) 4-фтор-3-метоксибензальдегида в 250 мл дихлорметана. 73 мл (1.298 моль) Ацетальдегида в 210 мл воды добавляли по каплям при температуре ниже 30C в течение 2 ч. Перемешивание продолжали в течение ночи при комнатной температуре. В каждый из четырех дней 1 моль-эквивалент ацетальдегида добавляли по каплям 3-мя порциями по 6 мл и перемешивание продолжали в течение ночи или в течение выходных дней. Реакционную смесь взбалтывали три раза с дихлорметаном. Значение pH объединенных органических фаз устанавливали на 5-6 с помощью смеси уксусная кислота-вода 1:3, промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Продукт очищали на силикагеле 60 (растворитель: гексан, гексан-этилацетат 95:5, 90:10, 85:15, 80:20 и 70:30). Получали 17.56 г (30% от теор.) продукта. 1 17.88 г (0.116 моль) (4-Фторфенил)уксусной кислоты и 32.2 мл (0.232 моль) триэтиламина добавляли к 19.00 г (0.105 моль) (2 Е)-3-(2-фтор-3-метоксифенил)акрилальдегида и 21.9 мл (0.232 моль) уксусного ангидрида. Смесь перемешивали в течение 10 ч при 100C и в течение ночи при комнатной температуре. Реакционную смесь выливали в смесь лед/вода с 5 об.% концентрированной соляной кислоты и три раза экстрагировали хлороформом. Объединенные органические фазы два раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. К остатку добавляли смесь диизопропиловый эфир-гексан 1:1, отфильтровывали с отсасыванием и сушили в сушильном шкафу. Выделяли 21.0 г (63% от теор.) продукта. 1(2 Е,4 Е)-5-(4-Фтор-3-метоксифенил)-2-(4-фторфенил)пента-2,4-диеновая кислота 15.3 мл (162.2 ммоль) Уксусного ангидрида и 22.5 мл (162.3 ммоль) триэтиламина добавляли к 15.2 г (84.4 ммоль) (2 Е)-3-(4-фтор-3-метоксифенил)акрилальдегида и 13 г (84.3 ммоль) (4-фторфенил)уксусной кислоты. Смесь перемешивали в течение 8 ч при 100C. Эту реакционную смесь вместе с второй смесью (15.95 г (88.5 ммоль) (Е)-3-(4-фтор-3-метоксифенил)пропеналя) выливали в 800 мл смеси лед/вода с 5 об.% концентрированной соляной кислоты и перемешивали. Смесь два раза экстрагировали 300 мл дихлорметана и два раза 500 мл хлороформа. Объединенные органические фазы нагревали до тех пор, пока все сухое вещество не растворялось; затем три раза промывали 200 мл воды, сушили над сульфатом магния и концентрировали путем упаривания. Остаток перемешивали в смеси н-гексана и диизопропилового эфира 1:1 в течение 1 ч при нагревании с обратным холодильником. Реакционную смесь охлаждали в заключение на ледяной бане, твердое вещество отфильтровывали с отсасыванием, промывали вновь смесью н-гексан-диизопропиловый эфир 1:1 и сушили в вакуумном сушильном шкафу. Выделяли 38.67 г (71% от теор.) продукта. 1H-ЯМР (300 МГц, хлороформ-d1): главный изомер:= 3.87 (s, 3H), 6.68 (dd, 1H), 6.86-7.18 (m, 6H),7.27-7.33 (m, 2H), 7.72 (d, 1H). Примеры промежуточного соединения 4 Общее описание 4 для получения 4: 1 г диенкарбоновой кислоты растворяли в 20 мл тетрагидрофурана и гидрировали с 0.1 г 10 мас.% палладия на активированном угле при нормальном давлении до тех пор, пока водород не абсорбируется полностью. Катализатор отфильтровывали на кизельгуре и промывали тетрагидрофураном. Фильтрат упаривали досуха. Продукт образовывался количественно. Промежуточное соединение 1-4 5-(2-Фтор-3-метоксифенил)-2-(4-фторфенил)пентановая кислота 21.0 г (66.4 ммоль) (2 Е,4 Е)-5-(2-Фтор-3-метоксифенил)-2-(4-фторфенил)пента-2,4-диеновой кислоты подвергали реакции в соответствии с общим описанием 4. 1 38.9 г (123.0 ммоль) (2 Е,4 Е)-5-(4-Фтор-3-метоксифенил)-2-(4-фторфенил)пента-2,4-диеновой кислоты подвергали реакции в соответствии с общим описанием 4. Получали 39.5 г (100% от теор.) продукта. 1H-ЯМР (300 МГц, хлороформ-d1):= 1.45-1.68 (m, 2H), 1.71-1.89 (m, 1H), 2.00-2.14 (m, 1H), 2.482.65 (m, 2H), 3.54 (t, 1H), 3.84 (s, 3H), 6.62 (ddd, 1H), 6.70 (dd, 1H), 6.90-7.05 (m, 3H), 7.22-7.29 (m, 2H). Примеры промежуточного соединения 5 Общее описание 5 для получения 5 при предотвращении попадания влаги воздуха: 1 г карбоновой кислоты растворяли в 5-7.2 мл метансульфоновой кислоты и порциями, при охлаждении добавляли 2.72.8 эквивалента пентаоксида фосфора. Смесь перемешивали в течение 3-16 ч при комнатной температуре. Реакционную смесь выливали в смесь лед/вода и взбалтывали с этилацетатом три раза. Объединенные органические фазы промывали с помощью 2 М раствора гидроксида натрия до тех пор, пока промывная вода не имела pH 7-8, промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали путем упаривания. Общее описание 5-А для получения 5 при предотвращении попадания влаги воздуха: 1 г карбоновой кислоты растворяли в прибл. 5-10 мл трифторметансульфоновой кислоты. 2.8 Эквивалентов пентаоксида фосфора добавляли 3-мя порциями при 5-20C. Перемешивание продолжали в течение ночи. Реакционную смесь выливали в смесь лед/вода и перемешивали в течение дополнительных 30 мин. Водную фазу взбалтывали три раза с этилацетатом. Объединенные органические фазы промывали водой, насыщенным раствором хлорида натрия и раствором карбоната натрия до тех пор, пока промывная вода не имела pH 7-8, сушили над сульфатом магния и концентрировали путем упаривания. Промежуточное соединение 1-5 1-Фтор-6-(4-фторфенил)-2-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-он 21.0 г (65.6 ммоль) 5-(2-Фтор-3-метоксифенил)-2-(4-фторфенил)пентановой кислоты подвергали реакции при 5-10C в соответствии с общим описанием 5-А. После перемешивания в течение дополнительных 30 мин осадок отфильтровывали с отсасыванием и промывали водой четыре раза. Остаток сушили при 40C в сушильном шкафу. Получали 18.6 г (94% от теор.) продукта. 1 37.5 г (117 ммоль) 5-(4-Фтор-3-метоксифенил)-2-(4-фторфенил)пентановой кислоты подвергали реакции в соответствии с общим описанием 5. После перемешивания в течение дополнительных 3 ч при комнатной температуре смесь выливали в смесь лед/вода и перемешивали вновь. Смесь экстрагировали с помощью 1 л дихлорметана. Органическую фазу три раза промывали насыщенным раствором гидрокарбоната натрия и три раза водой и концентрировали путем упаривания. Остаток растворяли в 700 мл хлороформа и сушили над сульфатом магния. После фильтрования добавляли активированный уголь, отфильтровывали на ПТФЭ фильтре и упаривали досуха. Получали 34.15 г (96% от теор.) продукта. 1H-ЯМР (300 МГц, хлороформ-d1):= 1.72-1.88 (m, 1H), 2.03-2.28 (m, 3H), 2.96 (ddd, 1H), 3.13 (mc,1H), 3.95 (s, 3H), 4.04 (dd, 1H), 6.81 (d, 1H), 7.03 (tt, 1H), 7.18-7.25 (m, 2H), 7.48 (d, 1H). Получение промежуточных соединений 5 с использованием палладиевого катализа Общее описание 5-vPd для получения 5 с помощью палладиевого катализа под атмосферой аргона: 1.3 эквивалента трет-бутилата натрия, 0.05 эквивалентов ацетата палладия(II) и 0.024 эквивалентов ксантфоса помещали в тетрагидрофуран (20 мл/1 г кетона) под аргоном. Добавляли по каплям 1 эквивалент 2-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-она (кетона), растворенного в тетрагидрофуране (5 мл/1 г кетона). После перемешивания в течение дополнительных 10 мин по каплям добавляли 1 эквивалент арилбромида в тетрагидрофуране (5 мл/1 г арилбромида). Смесь перемешивали при нагревании с обратным холодильником в течение 10-25 ч. Реакционную смесь охлаждали и выливали в буфер на основе фосфата калия с pH 7. Смесь экстрагировали этилацетатом четыре раза. Объединенные органические фазы сушили над сульфатом магния или сульфатом натрия и концентрировали путем упаривания. Остаток очищали, используя силикагель 60. Промежуточное соединение 3-5 6-(3,4-Дифторфенил)-2-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-он 29.55 г (155.3 ммоль) 2-Метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-она подвергали реакции в соответствии с общим описанием 5-vPd с 29.98 г (155.4 ммоль) 4-бром-1,2-фторбензола. Смесь перемешивали при нагревании с обратным холодильником в течение 24 ч. Остаток очищали, используя силикагель 60 (растворитель: гексан, гексан-ацетон 95:5; вторая колонка, растворитель: гексан, гексанэтилацетат 95:5). Выделяли 12.4 г (26% от теор.) продукта. 1 23 г (120.9 ммоль) 2-Метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-она подвергали реакции в соответствии с общим описанием 5-vPd с 23.33 г (120.9 ммоль) 1-бром-3,5-фторбензола. Смесь перемешивали при нагревании с обратным холодильником в течение 16 ч. Остаток очищали, используя силикагель 60 (растворитель: гексан, гексан-ацетон 95:5). Выделяли 21 г (57% от теор.) продукта. 1 24.63 г (129.5 ммоль) 2-Метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-она подвергали реакции в соответствии с общим описанием 5-vPd с 25 г (129.5 ммоль) 1-бром-2,5-фторбензола. Смесь перемешивали в течение 30 ч при нагревании с обратным холодильником, в течение ночи при комнатной температуре и вновь в течение 3 ч при нагревании с обратным холодильником. Остаток очищали, используя силикагель 60 (растворитель: гексан, гексан-этилацетат 95:5, 94:6, 93:7, 92:8, 90:10 и 80:20). Выделяли 9.53 г (24% от теор.) продукта. Фракции, содержащие промежуточное соединение, очищали вновь, используя силикагель 60 (растворитель: гексан-этилацетат 95:5, 93:7 и 90:10). Получали дополнительные 7.55 гH-ЯМР (300 МГц, хлороформ-d1):= 1.76-1.92 (m, 1H), 1.99-2.27 (m, 3H), 2.94 (dt, 1H), 3.15 (mc,1H), 3.86 (s, 3H), 4.23 (dd, 1H), 6.76 (d, 1H), 6.84 (dd, 1H), 6.87-7.08 (m, 3H), 7.76 (d, 1H). Следующие промежуточные соединения получали подобным образом по реакции 2-метокси-6,7,8,9 тетрагидро-5H-бензо[7]аннулен-5-она с арилгалогенидами. Примеры промежуточного соединения 6 Общее описание 6-1 для получения 6 под атмосферой аргона: 1 г кетона растворяли в 4.5-12.5 мл безводного тетрагидрофурана и при 3C добавляли 1.2 эквивалента 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-а]азепина. При этой температуре по каплям добавляли 1.2 эквивалента 1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилфторида в безводном тетрагидрофуране (1 г в 0.6-4.5 мл). Смесь перемешивали в течение дополнительных 2 ч при 3C и в течение ночи при комнатной температуре. Затем смесь выливали в насыщенный раствор гидрокарбоната натрия (10-20 мл раствор на 1 г кетона) и три раза экстрагировали метил-трет-бутиловым эфиром (прибл. 10-20 мл на 1 г кетона). Объединенные органические фазы два раза промывали насыщенным раствором хлорида натрия (прибл. 5-20 мл на 1 г кетона), сушили над сульфатом магния и упаривали досуха. К остатку добавляли пентан и смесь перемешивали в течение 1 ч при комнатной температуре. Смесь фильтровали с отсасыванием, промывали вновь пентаном и сушили в сушильном шкафу при комнатной температуре. Общее описание 6-2 для получения 6 под атмосферой аргона: 1 г кетона растворяли в 5-7.5 мл смеси безводный тетрагидрофуран/трет-бутилметиловый эфир (1:1-4:3) и добавляли 2.4 эквивалентов 2,3,4,6,7,8,9,10-октагидропиримидо[1.2-а]азепина. При этой температуре добавляли по каплям 2.4 эквивалентов 1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилфторида в безводном тетрагидрофуране (1 г в 1 мл). Смесь перемешивали в течение дополнительных 3 ч при 3C. Смеси позволяли достичь комнатной температуры, добавляли насыщенный раствор карбоната калия, фазы разделяли и водную фазу взбалтывали два раза с трет-бутилметиловым эфиром. Объединенные органические фазы сушили над сульфатом натрия и упаривали досуха. Промежуточное соединение 1-6 8-(3,4-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил-1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонат 19.00 г (62.8 ммоль) 1-Фтор-6-(4-фторфенил)-2-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5 она подвергали реакции в соответствии с общим описанием 6-1. Выделяли 36.00 г (98% от теор.) сырого продукта. 1 15.5 г (51.3 ммоль) 6-(2,5-Дифторфенил)-2-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5-она подвергали реакции в соответствии с общим описанием 6-1, но без обработки пентаном. Выделяли 33.81 г (113% от теор.) сырого продукта. 1 32.1 г (106.2 ммоль) 3-Фтор-6-(4-фторфенил)-2-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-5 она подвергали реакции в соответствии с общим описанием 6-1. Смесь перемешивали в течение дополнительных 3 дней при комнатной температуре. Добавляли дополнительные 0.42 эквивалента 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-а]азепина и 0.40 эквивалента 1,1,2,2,3,3,4,4,4-нонафторбутан-1 сульфонилфторида и смесь перемешивали в течение дополнительных 2 ч при комнатной температуре. Смесь обрабатывали, как описано в описании 6-1, но без обработки пентаном. Выделяли 71.5 г (115% от теор.) сырого продукта. 1 13.5 г (47 ммоль) 6-(4-Фторфенил)-2-метокси-6,7,8,9-тетрагидробензоциклогептен-5-она добавляли в 100 мл ТГФ и по каплям с охлаждением на ледяной бане добавляли 10.6 мл DBU (1,8 диазабицикло[5.4.0]ундец-7-ен) и 12.8 мл фторангидрида перфторбутан-1-сульфоновой кислоты, разбавленной 20 мл ТГФ. Смесь перемешивали в течение 2 ч с охлаждением на ледяной бане и в течение 19 ч при комнатной температуре. Добавляли насыщенный раствор гидрокарбоната натрия, фазы разделяли и водную фазу два раза экстрагировали этилацетатом. Объединенные органические фазы промывали водой и насыщенным раствором хлорида натрия. Смесь сушили над сульфатом натрия, фильтровали, концентрировали путем упаривания и сушили в вакууме. Получали 37 г остатка, который подвергали реакции далее без проведения анализа. Следующие промежуточные соединения получали подобным образом: Промежуточные соединения 7 Общее описание 7 для получения 7 под атмосферой аргона и при предотвращении попадания влаги: 1 г нонафлатенолового эфира растворяли в прибл. 8-13 мл безводного N,N-диметилформамида. Добавляли 2.5-2.6 эквивалента алкинола, 4.1 эквивалента триэтиламина и 0.033 эквивалента тетракис(трифенилфосфин)палладия(0). Смесь перемешивали в течение 0.5-1.5 ч при 80C. Реакционную смесь охлаждали и летучие компоненты удаляли в вакууме масляного насоса на роторном испарителе. Остаток вносили в этилацетат и три раза промывали водой. Смесь сушили над сульфатом магния или сульфатом натрия и упаривали досуха. Остаток очищали, используя силикагель 60. Промежуточное соединение 1-7 6-[8-(3,4-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гекс-5-ин-1-олH-ЯМР (300 МГц, хлороформ-d1):= 1.46-1.63 (m, 4H), 2.16-2.37 (m, 6H), 2.64 (t, 2H), 3.60 (mc,2H), 3.92 (s, 3H), 6.79 (d, 1H), 7.05 (mc, 2H), 7.30 (d, 1H), 7.58 (mc, 2H). Следующие промежуточные соединения получали путем, подобным приведенному в общем описании 7, необязательно с добавлением 0.4 эквивалента йодида меди(I): 11.8 г (30.9 ммоль) 6-[8-(3,4-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гекс-5 ин-1-ола и 1.41 г 5 мас.% палладия на активированном угле в 300 мл 0.2% метанольного раствора гидроксида калия гидрировали при комнатной температуре и нормальном давлении. Смесь фильтровали на целите с отсасыванием, вновь промывали метанолом и концентрировали путем упаривания. Остаток вносили в дихлорметан и три раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Получали 11.3 г продукта (83% от теор.) 1 10.0 г (26.1 ммоль) 6-[8-(3,5-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гекс-5 ин-1-ола и 1.195 г 5 мас.% палладия на активированном угле в 300 мл 0.2% метанольного раствора гидроксида калия гидрировали при комнатной температуре и нормальном давлении. Смесь фильтровали на целите с отсасыванием, вновь промывали метанолом и концентрировали путем упаривания. Остаток вносили в дихлорметан и три раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Получали 10.1 г (100% от теор.) продукта. 1 10.0 г (26.1 ммоль) 6-[4-Фтор-8-(4-фторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9 ил]гекс-5-ин-1-ола и 1.2 г 5 мас.% палладия на активированном угле в 300 мл 0.2% метанольного раствора гидроксида калия гидрировали при комнатной температуре и нормальном давлении. Смесь фильтровали на целите с отсасыванием, вновь промывали метанолом и концентрировали путем упаривания. Остаток вносили в дихлорметан и три раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Получали 10.1 г (99% от теор.) продукта. 1 12.5 г (36.7 ммоль) 6-[8-(2,5-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гекс-5 ин-1-ола и 1.2 г 5 мас.% палладия на активированном угле в 250 мл 0.2% метанольного раствора гидроксида калия гидрировали при комнатной температуре и нормальном давлении. Смесь фильтровали на целите с отсасыванием, вновь промывали метанолом и концентрировали путем упаривания. Остаток вносили в дихлорметан и три раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Получали 10.62 г (84% от теор.) продукта. 1 13.8 г (36.1 ммоль) 6-[2-Фтор-8-(4-фторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9 ил]гекс-5-ин-1-ола и 1.38 г 5 мас.% палладия на активированном угле в 275 мл 0.2% метанольного раствора гидроксида калия гидрировали при комнатной температуре и нормальном давлении. Смесь фильтровали на целите с отсасыванием и дополнительно гидрировали с 0.5 г 5 мас.% палладия на активированном угле. Смесь фильтровали на целите с отсасыванием, вновь промывали метанолом и упаривали досуха. Остаток вносили в дихлорметан, три раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Получали 17.22 г (124% от теор.) продукта. 1 90 мг палладия на карбонате кальция (10%) добавляли к 870 мг 6-[8-(4-фторфенил)-3-метокси-6,7 дигидро-5H-бензо[7]аннулен-9-ил]гекс-5-ип-1-ола в 30 мл ТГФ и перемешивали под атмосферой водорода. Затем смесь фильтровали на целите, концентрировали путем упаривания и ТГФ и добавляли 87 мг палладия на активированном угле (10%). Подавали водород. После фильтрования на целите и удаления растворителя указанное в заголовке соединение выделяли в виде сырого продукта. C24H29FO2 (368.5). МС(m, 2H), 3.18-3.25 (m, 2H), 3.73 (s, 3H), 4.22 (t, 1H), 6.77-6.83 (m, 2H), 7.12-7.28 (m, 5H). Следующие промежуточные соединения получали подобным образом: Промежуточные соединения 9 Общее описание 9 для получения 9 под атмосферой защитного газа и при предотвращении попадания влаги: 3.5 эквивалентов 2,6-диметилпиридина в дихлорметане (прибл. 4.4-5.5 мл/г) добавляли при 35C к 3.5 эквивалентам трибромида бора (1 ммоль трибромид бора в 1.5-4 мл дихлорметана). Добавляли по каплям 1 эквивалент метилового эфира, растворенного в дихлорметане (4.3-6.1 мл/г) при 3-5C, и перемешивали в течение ночи при комнатной температуре. Смесь выливали в ледяную воду, фазы разделяли и водную фазу взбалтывали три раза с дихлорметаном. Объединенные органические фазы промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Промежуточное соединение 1-9 8-(3,4-Дифторфенил)-9-(6-гидроксигексил)-6,7-дигидро-5H-бензо[7]аннулен-3-ол 10.0 г (25.87 ммоль) 6-[8-(3,5-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексан-1-ола подвергали реакции в соответствии с общим описанием 9. К остатку добавляли гексан и продукт отфильтровывали с отсасыванием. Получали 9.3 г (97% от теор.) продукта. 1 10.0 г (25.87 ммоль) 6-[4-Фтор-8-(4-фторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9 ил]гексан-1-ола подвергали реакции в соответствии с общим описанием 9. Осадок отфильтровывали с отсасыванием и промывали водой. Его сушили при 40C в сушильном шкафу. Фильтрат взбалтывали три раза с дихлорметаном. Объединенные органические фазы два раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Диизопропиловый эфир добавляли к остатку и продукт отфильтровывали с отсасыванием. Всего получали 6.1 г (62% от теор.) продукта. 1 10.6 г (27.4 ммоль) 6-[8-(2,5-Дифторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9-ил]гексан-1-ола подвергали реакции в соответствии с общим описанием 9. Смесь перемешивали в течение ночи при комнатной температуре, выливали в смесь лед/вода и перемешивали в течение дополнительного 1 ч. Продукт отфильтровывали с отсасыванием и промывали небольшим количеством дихлорметана и пять раз водой. Его сушили при 40C в сушильном шкафу. Получали 9.55 г (93% от теор.) продукта. 1 12.38 г (32.0 ммоль) 6-[2-Фтор-8-(4-фторфенил)-3-метокси-6,7-дигидро-5H-бензо[7]аннулен-9 ил]гексан-1-ола подвергали реакции с 4.0 эквивалентами реагента в соответствии с общим описанием 9. Смесь перемешивали в течение ночи при комнатной температуре, выливали в смесь лед/вода, перемешивали в течение дополнительных 2 ч, отфильтровывали с отсасыванием и вносили в 1 л дихлорметана. Смесь три раза промывали водой, сушили над сульфатом магния и концентрировали путем упаривания. Получали 12.75 г (107% от теор.) продукта. 1H-ЯМР (300 МГц, хлороформ-d1):= 1.07-1.27 (m, 6H), 1.44 (mc, 2H), 2.02-2.16 (m, 4H), 2.31 (m,2H), 2.58 (m, 2H), 3.55 (t, 2H), 5.38 (s, 1H), 6.84 (d, 1H), 6.98-7.09 (m, 3H), 7.14-7.22 (m, 2H). Следующие промежуточные соединения получали подобным образом: Промежуточные соединения 10 Общее описание 10 для получения 10 под атмосферой защитного газа и при предотвращении попадания влаги: 1 г спирта растворяли в прибл. 13-33 мл дихлорметана, смеси дихлорметана и тетрагидрофурана или чистого тетрагидрофурана. Порциями при 0-5C добавляли 1.5-1.6 эквивалентов трифенилфосфина и 1.5-1.6 эквивалентов четырехбромистого углерода. Смесь перемешивали при 3-5C в течение дополнительных 2-3 ч, если не описано иначе. Реакционную смесь разбавляли дихлорметаном или метил-трет-бутиловым эфиром, промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушили над сульфатом магния или сульфатом натрия и концентрировали путем упаривания. Продукт затем хроматографировали, используя силикагель 60.
МПК / Метки
МПК: A61P 5/30, A61K 31/216, A61K 31/145, A61K 31/277, C07C 323/25, A61K 31/18, C07C 317/28, A61K 31/165
Метки: производные, их, применение, 6,7-дигидро-5h-бензо[7]аннулена, фармацевтические, средств, содержащие, лекарственных, способы, препараты, получения
Код ссылки
<a href="https://eas.patents.su/30-22547-proizvodnye-67-digidro-5h-benzo7annulena-sposoby-ih-polucheniya-farmacevticheskie-preparaty-soderzhashhie-ih-i-ih-primenenie-dlya-polucheniya-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6,7-дигидро-5h-бензо[7]аннулена, способы их получения, фармацевтические препараты, содержащие их, и их применение для получения лекарственных средств</a>
Предыдущий патент: Способ торможения роста карциномы эрлиха у лабораторного животного
Следующий патент: Устройство и способ прессования упаковки












