7альфа-(кси-аминоалкил)эстратриены, способ их получения, фармацевтические препараты, содержащие эти 7альфа-(кси-аминоалкил) эстратриены, и их применение для изготовления лекарственных средств
Номер патента: 1577
Опубликовано: 25.06.2001
Авторы: Зауер Герхард, Больманн Рольф, Хегеле-Хартунг Криста, Хайнрих Николаус, Шнайдер Мартин, Лихтнер Роземари, Кюнцер Германн, Хофмайстер Гельмут, Парчик Карстен, Биттлер Дитер, Нишино Юкишиге, Хайнди Йозеф
Формула / Реферат
1. Замещенные 7a-(x -аминоалкил)эстратриены общей формулы
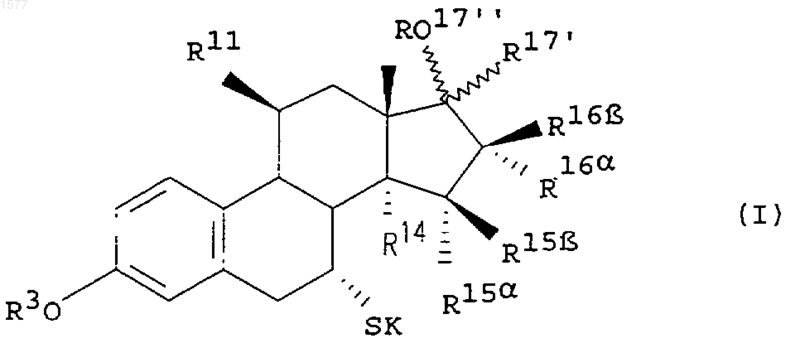
в которой боковая цепь SK представляет собой остаток формулы

где
m обозначает 4, 5 или 6,
n обозначает 0, 1 или 2,
х обозначает 0, 1 или 2,
А представляет собой атом водорода или C1-С5алкильную группу,
В и D каждый представляет собой атом водорода, или
А и В оба вместе представляют собой алкиленовую группу -(СН2)p-, где р обозначает 2, 3, 4 или 5, а D представляет собой атом водорода, или
А и D оба вместе представляют собой алкиленовую группу -(СН2)q-, где q обозначает 2, 3 или 4, а В представляет собой атом водорода, и
Е представляет собой незамещенный либо одно- до пятикратно фторированный этильный остаток, или концевой заместитель -(СН2)3-Е в боковой цепи заменен на необязательно замещенный арильный либо гетероарильный остаток, связанный непосредственно либо через моно-, ди- или триметиленовую группу с атомом серы,
R3 представляет собой атом водорода, углеводородный остаток с числом атомов углерода до 8 или остаток формулы R3'-С(O)-, где R3' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8 либо фенильный остаток,
R11 представляет собой атом водорода, атом галогена или нитрооксигруппу -O-NO2,
R14, R15a, R15b, R16a и R16b каждый обозначает атом водорода, или
R14 и R15a представляют собой дополнительную связь или метиленовый мостик, или
R15b представляет собой метильную группу, a R15a представляет собой атом водорода, или
R15a и R15b каждый обозначает метильную группу, или
R15b и R16b оба вместе представляют собой метиленовый мостик, или
R16a либо R16b обозначает атом галогена, или
R16a и R16b оба вместе представляют собой метилиденовую группу, а oстальные из заместителей R14, R15a, R15b, R16a и R16b каждый обозначает атом водорода,
R17' в a- либо b-положении представляет собой атом водорода, С1-С5алкильную, С2-С5 алкенильную либо С2-С5алкинильную группу или трифторметильную группу, а
R17" представляет собой атом водорода или остаток формулы R17"'-С(O)-, где R17"' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8, или,
если R17' находится в a-положении, то R17' совместно с R14 представляют собой этановый мостик,
при условии, что, если А и В оба вместе не обозначают -(СН2)р- или А и D оба вместе не обозначают -(СН2)q-, по меньшей мере, один из заместителей R11, R14, R15a, R15b, R16a и R16b не является водородом,
а также их физиологически приемлемые кислотно-аддитивные соли органических и неорганических кислот.
2. Эстратриены по п.1, где m обозначает 5.
3. Эстратриены по п.1, где n обозначает 0.
4. Эстратриены по п.1, где n обозначает 1.
5. Эстратриены по п.1, где n обозначает 2.
6. Эстратриены по п.1, где А представляет собой метильную группу.
7. Эстратриены по п.1, где х обозначает 0.
8. Эстратриены по п.1, где х обозначает 1.
9. Эстратриены по п.1, где х обозначает 2.
10. Эстратриены по п.6, где n обозначает 1.
11. Эстратриены по п.1, где А и В совместно представляют собой -(СН2)3-.
12. Эстратриены по п.11, где n обозначает 0.
13. Эстратриены по п.12, где х обозначает 0.
14. Эстратриены по п.1, где Е представляет собой перфторэтильный остаток.
15. Эстратриены по п.1, где R3 представляет собой атом водорода.
16. Эстратриены по п.1, где R3 представляет собой метильную группу.
17. Эстратриены по п.1, где R3 представляет собой ацетильную группу.
18. Эстратриены по п.1, где R11 представляет собой атом водорода.
19. Эстратриены по п.1, где R11 представляет собой атом фтора.
20. Эстратриены по п.1, где R11 представляет собой нитрооксигруппу.
21. Эстратриены по п.1, где R14 представляет собой атом водорода.
22. Эстратриены по п.1, где R14 совместно с R15a образуют дополнительную связь.
23. Эстратриены по п.1, где R15b представляет собой метильную группу.
24. Эстратриены по п.1, где R15b и с R16b образуют вместе метиленовый мостик.
25. Эстратриены по п.1, где R16a представляет собой атом галогена (F, Сl, Вr, I).
26. Эстратриены по п.25, где R16a представляет собой атом фтора.
27. Эстратриены по п.1, где R16a и R16b совместно образуют метилиденовую группу.
28. Эстратриены по п.1, где R17 находится в a-положении.
29. Эстратриены по п.28, где R17 представляет собой трифторметильную группу.
30. Эстратриены по п.28, где R17 представляет собой метильную группу.
31. Эстратриены по п.28, где R17 представляет собой атом водорода.
32. Эстратриены по п.1, где R17 находится в b-положении.
33. Эстратриены по п.32, где R17 представляет собой метильную группу.
34. Эстратриены по п.32, где R17 представляет собой атом водорода.
35. Эстратриены по п.28, где R14 и R17 совместно образуют этановый мостик.
36. Эстратриены по п.1, где SK представляет собой остаток формулы
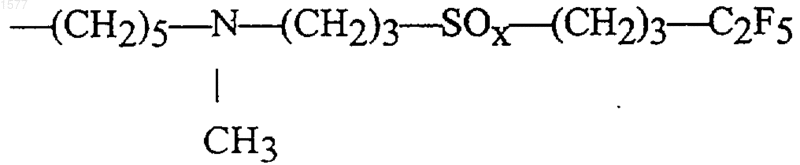
где х обозначает 0, 1 или 2.
37. Эстратриены по п.13, где m равно 5, Е представляет собой перфторэтильный остаток, а 2-ой атом углерода гетероцикла имеет R-конформацию.
38. Эстратриены по п.13, где m равно 5, Е представляет собой перфторэтильный остаток, а 2-ой атом углерода гетероцикла имеет S-конформацию.
39. Эстратриены по п.37, где R17 находится в a-положении и представляет собой атом водорода.
40. Эстратриены по п.1, а именно:
14,17-этано-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
14,17-этано-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
3,17b-диацетокси-14a,17a-этано-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен,
14,17-этано-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
17a-трифторметил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
15b,16b-метано-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
15b,16b-метано-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
15b,16b-метано-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
15b,16b-метано-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
15b-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
15b,17a-диметил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-17b-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17a-диол,
16a-фтор-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
16a-фтop-17a-мeтил-7a-{5-[N-мeтил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17a-диол,
16a-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10),14-тетраен-3,17b-диол,
7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10),14-тетраен-3,17b-диол,
7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил}эстра-1,3,5(10),14-тетраен-3,17b-диол,
7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
7a-{5-[(2R)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
17a-метил-7a-{5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[N-метил-N-2-(4,4,5,5,5-пентафторпентансульфонил)этиламино]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил}-3-гидроксиэстра-1,3,5(10)-триен-17-он,
11b-фтор-7a-{6-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтиo)пропиламино]гексил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{6-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]гексил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-(5-{[N-3-(фуран-2-илметилтио)пропил]-N-метиламино}пентил)эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-(5-{N-метил-[N-3-(тиофен-2-илметилтио)пропил]амино}пентил)эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[(2S)-2-(4-трифторметилфенилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-17a-метил-7a-{5-[(2R)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол,
11b-фтор-7a-{5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил]пентил}эстра-1,3,5(10)-триен-3,17b-диол.
41. Фармацевтические препараты, содержащие, по меньшей мере, одно соединение общей формулы I по п.1, а также один фармацевтически приемлемый носитель.
42. Применение соединений общей формулы I по п.1 для изготовления лекарственных средств.
Текст
1 Настоящее изобретение относится к замещенным 7-(-аминоалкил)эстратриенам общей формулы I в которой боковая цепь SK представляет собой остаток формулыm обозначает 4, 5 или 6,n обозначает 0, 1 или 2,х обозначает 0, 1 или 2,А представляет собой атом водорода или С 1-С 5 алкильную группу,В и D каждый представляет собой атом водорода, или А и В оба вместе представляют собой алкиленовую группу -(СН 2)р-, где р обозначает 2,3, 4 или 5, а D представляет собой атом водорода, или А и D оба вместе представляют собой алкиленовую группу -(СН 2)q-, где q обозначает 2, 3 или 4, а В представляет собой атом водорода, и Е представляет собой незамещенный либо однодо пятикратно фторированный этильный остаток, или концевой заместитель -(CH2)3-E в боковой цепи заменен на необязательно замещенный арильный либо гетероарильный остаток, связанный непосредственно либо через моно-, диили триметиленовую группу с атомом серы,R3 представляет собой атом водорода, углеводородный остаток с числом атомов углерода до 8 или остаток формулы R3'-С(О)-, где R3' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8 либо фенильный остаток,R11 представляет собой атом водорода,атом галогена или нитрооксигруппу-O-NO2,R14, R15, R15, R16 и R16 каждый обозначает атом водорода, илиR14 и R15 представляют собой дополнительную связь или метиленовый мостик, илиR15 представляет собой метильную группу, a R15 представляет собой атом водорода,илиR15 и R15 каждый обозначает метильную группу, илиR15 и R16 оба вместе представляют собой метиленовый мостик, илиR16 и R16 оба вместе представляют собой метилиденовую группу, а остальные из замести 001577 телей R14, R15, R15, R16 и R16 каждый обозначает атом водорода,R17' в - либо -положении представляет собой атом водорода, С 1-С 5 алкильную, С 2-С 5 алкенильную либо С 2-С 5 алкинильную группу или трифторметильную группу, аR17" представляет собой атом водорода или остаток формулы R17"'-С(O)-, гдеR17"' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8, или,если R17' находится в -положении, то R17' совместно с R14 представляют собой этановый мостик, при условии, что если А и В оба вместе не обозначают -(СН 2)p- или А и D оба вместе не обозначают -(СН 2)q-, по меньшей мере, один из заместителей R11, R14, R15, R15, R16 и R16 не является водородом,а также к их физиологически приемлемым кислотно-аддитивным солям органических и неорганических кислот. Настоящее изобретение относится, кроме того, к фармацевтическим препaратам, содержащим эти соединения общей формулы I и их физиологически приемлемые кислотно-аддитивные соли органических и неорганических кислот, а также к применению указанных соединений для получения лекарственных средств. Предпочтительно в соединениях общей формулы I атом азота в боковой цепи отделен пятью метиленовыми группами от атома углерода 7 стероидного скелета. Если А представляет собой алкильную группу с числом атомов углерода до 5, то последняя представляет собой метильную, этильную, пропиловую, изопропиловую, бутиловую,изобутиловую, трет-бутиловую, пентильную,изопентильную либо неопентильную группу; предпочтительна из них для А метильная группа. Индекс n может обозначать 0, 1 или 2,причем, если А представляет собой атом водорода или алкильную группу с числом атомов углерода до 5, то предпочтительным значениемn является 1, вследствие чего атом азота и атом серы отделены тремя метиленовыми группами. Атом азота может быть фрагментом 4-7 членного, соответственно 5-7-членного гетероцикла, который в положении 2, соответственно 3 замещен остатком боковой цепи -(CH2)n-SOx(CH2)3-E. Предпочтительно А и В оба вместе представляют собой триметиленовую группу, т.е. они образуют совместно с атомом азота и смежным с ним атомом углерода замещенное в положении 2 пирролидиновое кольцо. В последнем случае предпочтительным значением n является 0, а предпочтительным значением х также является 0. Атом серы в боковой цепи может быть представлен в виде простого серного мостика(сульфида), в виде сульфона либо сульфоксида. Предпочтительны сульфиды. В качестве остатка Е может рассматриваться незамещенный либо одно- до пятикратно фторированный этильный остаток; предпочтителен для Е перфторостаток. Если концевой заместитель -(CH2)3-E в боковой цепи заменен на необязательно замещенный арильный либо гетероарильный остаток,связанный непосредственно либо через моно-,ди- или триметиленовую группу с атомом серы,то арильный остаток представляет собой предпочтительно фенильный остаток; в случае же гетероарильного остатка последний представляет собой предпочтительно 2-фурильный или 2 тиенильный остаток. В качестве заместителя этого арильного или гетероарильного остатка может быть представлена, например, пентафторэтильная либо трифторметильная группа,предпочтительно последняя из них, в свою очередь, предпочтительно в положении 4 фенильного остатка. 2-фурильный или 2-тиенильный остаток отделен предпочтительно метиленовой группой от атома серы. Под заместителем R3 атома кислорода 3 имеется в виду в первую очередь атом водорода. Гидроксильная группа может быть в то же время этерифицирована прямоцепочечным либо разветвленным, насыщенным либо ненасыщенным углеводородным остатком с числом атомов углерода до 8, таким, например, как метильный,этильный, пропиловый, изопропиловый, бутиловый, изобутиловый, трет-бутиловый, пентильный, изопентильный, неопентильный, гептильный, гексильный или октильный остаток,до простого эфира или же этерифицирована ацильным остатком R3'-С(О)-, где R3' обозначает атом водорода или углеводородный остаток с числом атомов углерода до 8 либо фенильный остаток, до сложного эфира. Касательно заместителя R11 речь может идти об атоме водорода, атоме галогена (F, Сl,Вr, I) или о нитрооксигруппе; предпочтителен атом фтора. Если R11 является атомом водорода или если А и В оба вместе не обозначают -(СН 2)p- или А и D оба вместе не обозначают -(СН 2)q-, то Dкольцо имеет замещение из группы, включающей 14,15-двойную связь, 14,15-метилен,15-метил, 15,15-диметил, 15,16-метилен,16- либо 16-галоген, из них в первую очередь 16-фтор, 16-метилиден или 14,17-этано. Среди предпочтительных следует назвать 15 метильную группу или 16-атом фтора.R17' может находиться в - либо положении. В случае С 1-С 5 алкильной группы последняя представляет собой метильную, этильную,пропиловую, изопропиловую, бутиловую, изобутиловую, трет-бутиловую, пентильную, изопентильную или неопентильную группу. В ка 001577 4 честве С 2-С 5 алкенильной группы можно назвать, например, винильный либо аллильный остаток. Примерами представителей С 2-С 5 алкинильной группы могут служить этинильный и 1 пропинильный остатки. Если R17' находится в -положении, то его предпочтительным значением является атом водорода, метильная либо трифторметильная группа или образуемый вместе с R14 этановый мостик. Для R17' в -положении следует в первую очередь назвать такие значения, как атом водорода и метильная группа. К предпочтительным прежде всего относятся такие соединения общей формулы I, в которой боковая цепь SK представляет собой либо остаток формулы -(CH2)5-N(CH3)-(CH2)3-SOx(CH2)3-C2F5, где х обозначает 0, 1 или 2, либо=-(СH2)3-. В последнем случае соединения имеют предпочтительно 17-атом водорода. Для образования кислотно-аддитивных солей пригодны неорганические и органические соли, известные специалисту в данной области техники, которые он может использовать для получения физиологически приемлемых солей. В качестве кислотно-аддитивных солей следует назвать прежде всего гидрохлориды и метансульфонаты. Ниже представлены соединения, относящиеся согласно изобретению к особенно предпочтительным: 14,17-этано-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол,14,17-этано-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентансульфинил)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол,3,17-диацетокси-14,17-этано-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен,14,17-этано-7-5-[N-мeтил-N-3-(4,4,5,5,5 пeнтaфтopпeнтaнcyльфoнил)пропиламино]пент илэстра-1,3,5(10)-триен-3,17-диол,17-трифторметил-7-5-[N-мeтил-N-3(4,4,5,5,5-пeнтaфтopпeнтилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол,15,16-метано-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диол,15,16-метано-17-метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил) пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диол,15,16-метано-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол,15,16-метано-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол, 5 11-фтор-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил эстра-1,3,5(10)-триен-3,17-диол,11-фтор-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил] пентилэстра-1,3,5(10)-триен-3,17-диол,11-фтор-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил] пентилэстра-1,3,5(10)-триен-3,17-диол. Соединения общей формулы I представляют собой соединения, обладающие исключительно высокой антиэстрогенной эффективностью. Под соединениями общей формулы I по изобретению имеются в виду, с одной стороны,чистые антиэстрогены или, с другой стороны,так называемые частичные антагонисты, иными словами, антиэстрогены с частичным эстрогенным действием, такие, как тамоксифен или ралоксифен. Однако агонистическое, эстрогенное действие у соединений по изобретению в любом случае выражено заметно слабее по сравнению с тамоксифеном. В отличие от тамоксифена частичные антагонисты общей формулы I проявляют свое агонистическое, эстрогенное действие избирательно по отношению к тканям. В первую очередь агонистическое действие проявляется по отношению к костям, в сердечнососудистой системе и в ЦНС (центральной нервной системе). Такое агонистическое действие не наблюдается прежде всего по отношению к матке. Соединения с антиэстрогенными свойствами, т.е. вещества с ингибирующим действием по отношению к эстрогенам, описаны в многочисленных публикациях. В качестве соединений, наиболее близких по своей структуре предлагаемым соединениям общей формулы I, следует рассматривать описанные в европейской заявке ЕР 0138504 стероидные производные, а из них прежде всего 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)-триен-3,17-диол (ЕР-А 0138504, с. 58, предпоследнее соединение). Это соединение проходит в настоящее время клинические испытания при лечении гормонозависимых опухолей (рака груди) и представляет собой на сегодняшний день лучшее из известных стероидных производных,т.е. такое соединение, которое обладает самой высокой антиэстрогенной эффективностью. Фармацевтические композиции, содержащие сексуально-стероидные ингибиторы со стероидным скелетом, имеющим 7-боковую цепь при одновременном присутствии, по меньшей мере, еще одного заместителя в положении 14,15 либо 16, являются объектом изобретения европейской заявки ЕР 0376576 и могут также рассматриваться в качестве ближайшего уровня техники. Целый ряд самых различных соединений, в частности таковых стероидного происхождения, 001577 8 равно как и таковых с 2-фенилиндоловым скелетом, обладающих антиэстрогенным действием и/или подавляющих биосинтез эстрогенов,описаны в международной заявке WO 93/10741. Другие стероидные антиэстрогены, несущие 11-фенильный остаток, описаны в европейских заявках EP-AS 0384842 и 0629635. Касательно соединений по изобретению речь идет об антиэстрогенах с более высокой антиэстрогенной эффективностью по сравнению с уже упоминавшимся выше 7-[9-(4,4,5,5,5 пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)-триен-3,17-диолом. Соединения общей формулы I согласно настоящей заявке в сравнении с уже известными стероидными производными согласно ЕР-А 0138504 и ЕР-А 367576 отличаются наличием боковых цепей нового типа у атома углерода 7 стероидного скелета. Эта структурная модификация приводит к обладающим высокоантиэстрогенным действием соединениям, как это было подтверждено тестированием трансактивации. В отличие от соединений в ЕР-А 0138504 соединения общей формулы I имеют, кроме того, другое замещение у атома углерода 11 и/или в D-кольце (за исключением того случая, когда А и В совместно обозначают -(СН 2)p- или А и D совместно обозначают -(СН 2)q. По сравнению же с соединениями в ЕР-А 0367576 соединения общей формулы I могут нести у атома углерода 11 и/или в D-кольце те же самые либо другие заместители. Благодаря дисклеймеру в расшифровке общей формулы I из числа соединений, подпадающих под эту формулу, исключаются таковые, которые описаны в неопубликованной заявке DE Р 19622457. Антиэстрогенное действие соединений по изобретению исследовали с помощью анализа трансактивации [Demirpence E., Duchesne M.-J.,Badia E., Gagne D. и Pons M.: MVLN Cells: AHela-клетки являются клетками, содержащими вектор, обеспечивающий неустойчивую экспрессию человеческого рецептора эстрогена(HEGO), и ген-репортер Vit-TK-CAT, a MVLNклетки представляют собой клетки, стабильно трансфектированные геном-репортером Vit-TKLUC. Эффективность эстрогенного действия определяли в присутствии 0,1 нМ эстрадиола.IC50-значения для новых соединений находятся в диапазоне их наномолярных концентраций. По отношению к Hela-, а также MVLNклеточной линиям для соединений в примерах 12, 15, 18, 25, 29, 31 и 36, равно как и для 7-[9(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил] эстра-1,3,5(10)-триен-3,17-диола были выявлены следующие IС 50-значения (тестирование проводили согласно указанным выше источникам): Соединение Пример 12 Пример 15 Пример 18 Пример 25 Пример 29 Пример 31 Пример 36 Контроль: 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)-триен-3,17-диол Опыты in vivo также подтверждают превосходство соединений по изобретению по сравнению с 7-[9-(4,4,5,5,5-пентафторпентансульфинил)-н-нонил]эстра-1,3,5(10)-триен 3,17-диодом. Ниже представлены проводившиеся опыты. 1. Исследование разрастания матки у молодых крыс, перорально (опыт на антиэстрогенное действие). 2. Исследование опухоли: противоопухолевое действие на зависящий от гормонов рак молочной железы (рак молочной железы у крыс,индуцированный диметилбензантраценом(ДМБА. 1. Исследование разрастания тела матки у молодых крыс (антиэстрогенное действие). Методика У грызунов матка реагирует на применение эстрогенов увеличением веса (как пролиферация, так и накопление в ткани жидкости). Это разрастание можно подавить за счет одновременного введения в соответствующей дозировке обладающих антиэстрогенным действием соединений. Проведение опыта Подопытные животные: инфантильные женские особи крыс весом 35-45 г в начале опыта, каждую дозу вводили 5-6 животным. Приготовление композиции и введение субстанций: для перорального введения субстанции разводили в одной части этанола (Э) и добавляли 9 частей арахисового масла (AM). Постановка опыта Подопытные инфантильные крысы, отнятые от "груди матери", поступали в целях адаптации за день до начала эксперимента и сразу же получали, в том числе и в клетке, соответствующий корм. Затем животным ежедневно один раз в течение 3 дней вводили тестируемую субстанцию в сочетании с 0,5 мкг эстрадиолбензоа 10 та (ЭБ). ЭБ вводили всегда подкожно, тогда как тестируемую субстанцию - перорально (р.о.). По истечении 24 ч после введения последней дозы животных взвешивали, умерщвляли и матку удаляли. После препарирования маток определяли вес экссудата (без содержимого). Контроль Отрицательный контроль: наполнитель(Э/АМ), 0,2 мл/животное/день; положительный контроль: 0,5 мкг ЭБ/0,1 мл/животное/день. Оценка результатов На основании относительного веса органа(мг/100 г веса тела) определяли для каждой группы средние значения со стандартным отклонением (Х+СО), а также достоверность существенных различий по отношению к контрольной группе (ЭБ) с использованием критерия Даннетта (Dunnett) (p0,05). Показатели эффективности подавления (в %) в сравнении с ЭБ-контролем рассчитывали с использованием соответствующего программного обеспечения. Относительную эффективность испытуемых субстанций определяли с помощью ковариантного и регрессионного анализов. Антиутеротрофическое действие на крысах Соединение из примера 12 15 18 29 31 36 Контроль ZM 182 780 Результаты подтверждают значительно более высокую антиэстрогенную эффективность соединений общей формулы I по сравнению с соединением 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)-триен 3,17-диол, соответственно после орального введения. Соединения по изобретению отличаются более высокой биодоступностью после орального введения. 2. Опыт по исследованию опухоли. Влияние на разрастание опухоли на ДМБА-модели у крыс (опухоль, смоделированная под действием 9,10-диметил-1,2-бензантрацена) Биологическая основа Разрастание ДМБА-индуцированной опухоли молочной железы у крысы в значительной степени зависит от эстрогенов и пролактина. Эффективные антиэстрогены, антигестагены и ингибиторы ароматазы подавляют разрастание опухоли. Субстанции, обладающие антигонадотропными и андрогенными свойствами, также проявляют подавляющее рост опухоли действие. 11 Животный материал Женские особи крыс в возрасте 45-47 дней(Sprague-Dawley, поставщик ZIH или Moellegard), 8-10 животных в каждой группе. Постановка опыта Животным в один прием вводили орально 10 мг ДМБА. Затем раз в неделю животных исследовали методом пальпации на развитие опухоли. По истечении 6-10 недель после введения ДМБА у каждого из животных образовалось примерно от 1 до 10 опухолей. Размер опухоли измеряли еженедельно штангенциркулем. Когда, по меньшей мере, одна опухоль увеличивалась до определенных размеров (площадь опухоли 150 мм 2), проводили овариэктомию, соответственно приступали к лечению животных испытуемой субстанцией. Лечение проводили в большинстве случаев ежедневно в течение приблизительно 28 дней (подробно ход лечения см. описание опыта). В дальнейшем величину опухоли измеряли раз в неделю. Оценка результатов Общий размер опухоли у каждого животного выявляли до начала лечения (предварительные показатели). Затем для каждой группы определяли в процентном выражении средний показатель происходивших изменений величины опухоли по отношению к первоначальным показателям. Кроме того, определяли в процентном выражении показатель по каждой группе животных, у которых опухоль, соответственно (1), спала полностью (полная регрессия), спала частично (2) (частичная регрессия),(3) осталась на прежнем уровне (без изменений) или (4) продолжала расти (увеличение). Выявленные показатели проверяли на достоверность с помощью критерия Даннетта и изображали графически. Результаты опыта При оральной дозе 3 мг/кг/день 11-фтор 7-5-[2-(4,4,5,5,5-пентафторпентилтиометил) пирролидин-1-ил]пентилэстра-1,3,5(10)-триен 3,17-диол (соединение из примера 29) подавляет рост опухоли сильнее по сравнению с оральной дозой 10 мг/кг/день 7-[9-(4,4,5,5,5-пентафторпентансульфинил)-н-нонил]эстра-1,3,5(10)триен-3,17-диола, который при указанной дозе проявляет лишь незначительный эффект в сравнении с интактным контролем. Овариэктомия приводит к полной ремиссии опухолей (фиг. 1). Соединения оказывают ингибирующее действие на зависимые от гормонов опухолевые клетки, прежде всего они подавляют рост зависимых от эстрогенов опухолевых клеток молочной железы человека (MCF-7). Антипролиферативная активность новых соединений в клеточных линиях рака молочной железы выше по сравнению с таковой 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)триен-3,17-диола. 12 В качестве чистых антиэстрогенов в контексте настоящего описания рассматриваются такие соединения общей формулы I, которые в представленном ниже тесте in vitro на эстрогенную эффективность не проявляют никакого либо лишь незначительное агонистическое действие (до порядка 10% от действия эстрадиола). Частичное эстрогенное действие определяли при этом также с помощью анализа трансактивации. Hela-клетки трансфектировали вектором, обеспечивающим экспрессию человеческого рецептора эстрогена (HEGO), и геномрепортером rPR-TK-CAT. Этот ген-репортер содержит "элемент, ответственный за эстроген" гена-рецептора прогестерона у кролика (+698EMBO J. 10, 1875-1883 (1991). Эстрогенную эффективность субстанций определяли в концентрации 1 мкМ. Активация rPR-TK-промотора-15 Отрицательный показатель означает супрессию активности гена-репортера ниже контрольных значений. Соединение из примера Соединения по изобретению, прежде всего когда они представляют собой чистые антиэстрогены, могут применяться для терапии зависимых от эстрогенов заболеваний, как, например,рак молочной железы (терапия "второй линии",в данном случае терапия рака молочной железы,устойчивого к тамоксифену; для адъювантного лечения рака молочной железы вместо тамоксифена), рак эндометрия, гиперплазия простаты,ановуляторное бесплодие и меланома. Чистые антиэстрогены общей формулы I могут использоваться, кроме того, в качестве компонента в описанных в заявке ЕР 346014 В 1 продуктах,содержащих эстроген и чистый антиэстроген, а именно, для одновременного, последовательного либо раздельного применения при избирательной эстрогенной терапии женщин перед наступлением или после наступления климактерического периода. Соединения общей формулы I, прежде всего когда речь идет о чистых антиэстрогенах, могут применяться совместно с антигестагенами (конкурентоспособные антагонисты прогестерона) для лечения зависимых от гормонов опухолей (см. европейскую заявку ЕР 310542 А). Другими показателями к возможному применению соединений общей формулы I яв 13 ляются выпадение волос у мужчин, диффузная алопеция, алопеция, обусловленная химиотерапией, а также гирсутизм (см. Hye-Sun Oh и Robert С., Smart. Proc. Natl. Acad. Sci USA, 93(1996), стр. 12525-12530). Кроме того, соединения общей формулы I могут применяться для изготовления медикаментов, предназначенных для лечения эндометриоза и рака эндометрия. Соединения общей формулы I можно применять далее для приготовления фармацевтических композиций, предназначенных для контроля мужского и женского бесплодия (контроль мужского бесплодия см. заявку Германии DE-A 19510862.0). Те соединения общей формулы I, которые обладают избирательным по отношению к тканям эстрогенным частичым действием, могут найти применние в первую очередь для профилактики и терапии остеопороза и для изготовления препаратов, предназначенных для заместительной терапии перед наступлением, во время и после наступления климактерического периода (HRT) (Black L.J., Sato M., Rowley E.R.,Magee D.E., Bekele A., Williams D.C., Cullinanhypertrophy in ovariectomized rats; J. Clin. Invest. 93: 63-69, 1994). Эстрогенное частичное действие проявляется исключительно по отношению к тому органу, на который направлено это действие. Изобретение относится также к фармацевтическим препаратам, содержащим, по меньшей мере, одно из соединений общей формулы I(или их физиологически приемлемые кислотноаддитивные соли органических и неорганических кислот) и к применению этих соединений для получения лекарственных средств, предназначенных прежде всего для лечения зависимых от эстрогенов заболеваний и опухолей, и лекарственных средств для гормонозаместительной терапии (HRT). Предлагаемые согласно изобретению соединения и кислотно-аддитивные соли пригодны для приготовления фармацевтических составов и композиций. Фармацевтические композиции, соответственно лекарственные средства,содержат в качестве активного вещества одно или несколько соединений по изобретению либо их кислотно-аддитивные соли, необязательно в смеси с другими фармакологически, соответственно фармацевтически эффективными веществами. Получение лекарственных средств осуществляют по известной технологии, используя при этом известные и обычные вспомогательные фармацевтические вещества, а также другие обычные носители и разбавители. Такими носителями и вспомогательными веществами могут служить, например, те из них, которые реко 001577 14 мендуются, соответственно указаны в приведенных ниже публикациях для использования в качестве вспомогательных веществ в фармации,косметике и родственных областях: (UllmansHilfsstoffe fuer Pharmazie, Kosmetik und angrenzende Gebiete Cantor KG, Aulendorf in Wuerttemberg 1971. Соединения по изобретению могут назначаться для орального или парентерального введения, например, внутрибрюшинного, внутримышечного, подкожного либо чрескожногo. Соединения можно также имплантировать в ткань. Вводимые количества соединений варьируются в относительно широком диапазоне, что определяется в конечном счете требуемым эффектом. В зависимости от состояния пациента,степени и вида заболевания, а также типа назначения количество вводимого соединения может составлять от 0,1 до 25 мг/кг веса тела, предпочтительно от 0,5 до 5 мг/кг веса тела в день. Для человека это соответствует суточной дозе от 5 до 1250 мг. Предпочтительная суточная доза для человека составляет от 50 до 200 мг. Это относится прежде всего к случаям опухолевой терапии. Для орального приема могут применяться капсулы, пилюли, таблетки, драже и т.д. Унифицированные дозы наряду с активным веществом могут содержать также фармацевтически приемлемые носители, как, например, крахмал,сахар, сорбит, желатин, смазки, кремниевую кислоту, тальк и т.д. Унифицированные дозы для орального приема могут содержать, например, от 5 до 500 мг активного вещества. Для достижения лучшей биодоступности активного вещества соединения можно получать также в виде клатратов циклодекстрина. С этой целью соединения подвергают взаимодействию с -, - или -циклодекстрином либо с их производными (см. РСТ/ЕР 95/02656). Для парентерального введения активные вещества можно растворять либо суспендировать в физиологически приемлемом разбавителе. В качестве таких разбавителей очень часто используют масла с добавками либо без добавок агента, способствующего растворимости, поверхностно-активного вещества, суспендирующего агента или эмульгатора. Примерами используемых в указанных целях маслами являются оливковое масло, арахисовое масло, хлопковое масло, соевое масло, касторовое масло,кунжутное масло. Соединения можно применять также в виде депоинъекций или имплантируемого препарата, которые можно приготавливать таким об 15 разом, чтобы обеспечить замедленное высвобождение активного вещества. В качестве инертных материалов имплататы могут содержать в своем составе, например,биологически разлагаемые полимеры или синтетические каучуки, как, например, силиконовый каучук. Действующие вещества можно,кроме того, для чрескожного применения заделывать, например, в пластырь. Предлагаемые согласно изобретению соединения могут быть получены так, как это описано ниже. Представленные далее примеры служат для более подробного пояснения изобретения. По аналогичной технологии, используя аналогичные реагенты в соответствии с содержащимися в примерах данными, можно получить все соединения общей формулы I. Омыление эфирных группировок, равно как и этерифицирование свободных гидроксильных групп с получением сложных и простых эфиров осуществляют соответственно по общепринятым способам органической химии. С учетом различной реакционной способности этерифицированной и свободной 3- и 17-гидроксильных групп можно осуществлять избирательное расщепление 3,17 диэфиров в положении 3, а затем 3-гидрокси-17 ацилоксисоединение целенаправленно в положении 3 далее функционализовать; точно такая же возможность существует для избирательного этерифицирования 3,17-дигидроксисоединения только в положении 3 с получением сложных или простых эфиров, после чего можно целенаправленно вводить в положении 17 другой, чем уже находящийся в положении 3 остаток. Кислотно-аддитивные соли соединений общей формулы I также могут быть получены с помощью обычных способов из соединений общей формулы I. Нижеследующие примеры предназначены,как уже указывалось, для более подробного пояснения изобретения. Пример 1. 14,17-Этано-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол. а) 7-(5-трет-Бутилдиметилсилилоксипентил)эстр-4-ен-3,17-дион. В 70 мл абсолютного тетрагидрофурана 15,1 г магниевой стружки подвергают взаимодействию с 175,6 г 1-бром-5-трет-бутилдиметилсилилоксипентана [Tetrahedron Letters 23,1982, 4, 4147-4150], растворенными в 600 мл абсолютного ТГФ, с получением реагента Гриньяра. В этот охлажденный до -20 С раствор в токе азота добавляют 59 г иодида меди (I), а затем в течение одного часа по каплям добавляют 50 г эстра-4,6-диен-3,17-диона [Steroids,том 1, 1963, 233-249], растворенных в 300 мл абсолютного ТГФ. Для последующей переработки добавляют по каплям 37,5 мл уксусной кислоты, реакционную смесь разбавляют уксусным эфиром, промывают насыщенным раство 001577 16 ром хлорида аммония, водой и раствором гидрокарбоната натрия и сушат. Образовавшийся после упаривания остаток хроматографируют на силикагеле. Таким путем получают 35,4 г 7-(5 трет-бутилдиметилсилилоксипентил)эcтр-4-ен 3,17-диона. []D22 = +52,8 (с = 0,535% в хлороформе). б) 7-(5-Гидроксипентил)эстр-4-ен-3,17 дион. Раствор из 125,4 г 7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-диона в 625 мл метанола и 347 мл воды перемешивают с 694 мл ледяной уксусной кислоты в течение 2,5 ч при 50 С. После упаривания при 60 С под вакуумом получают 94,1 г сырого 7-(5 гидроксипентил)эстр-4-ен-3,17-диона в виде масла. в) 7-(5-Ацетоксипентил)эстр-4-ен-3,17 дион. Раствор из 94 г сырого 7-(5 гидроксипентил)эстр-4-ен-3,17-диона в 620 мл пиридина медленно смешивают с 310 мл ацетангидрида и перемешивают в течение 2 ч при 25 С. Затем при охлаждении льдом медленно смешивают со 116 мл воды, разбавляют 3 л диэтилового эфира, органическую фазу после промывки раствором гидрокарбоната натрия сушат и упаривают. Остаток хроматографируют на силикагеле, получая в результате 84,4 г 7(5-ацетоксипентил)эстр-4-ен-3,17-диона в виде масла. г) 7-(5-ацетоксипентил)-3-гидроксиэстра 1,3,5(10)-триен-17-он. К раствору из 82,3 г 7-(5-ацетоксипентил)эстр-4-ен-3,17-диона в 936 мл ацетонитрила при 80 С температуры ванны добавляют 17,8 г бромида лития и 92,83 г бромида меди (II). По истечении 10 мин при температуре ванны 80 С реакционный раствор охлаждают, трижды экстрагируют уксусным эфиром, промывают водой и раствором гидрокарбоната натрия и сушат. Образовавшийся после упаривания остаток хроматографируют на силикагеле и получают в результате 60,4 г 7-(5-ацетоксипентил)-3 гидроксиэстра-1,3,5(10)-триен-17-она в виде масла. д) 3-Ацетокси-7-(5-ацетоксипентил)эстра-1,3,5(10)-триен-17-он. Раствор из 60,4 г 7-(5-ацетоксипентил)-3 гидроксиэстра-1,3,5(10)-триен-17-она в 300 мл пиридина перемешивают в течение 1 ч при комнатной температуре со 150 мл ацетангидрида. Затем осаждают с помощью смеси лед/вода/ поваренная соль/соляная кислота, растворяют с помощью уксусного эфира, промывают раствором гидрокарбоната натрия и раствором поваренной соли до нейтрального состояния, после чего сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 63,9 г 3-ацетокси-7-(5-ацетоксипентил)эстра-1,3,5 е) 3-Ацетокси-7-(5-ацетоксипентил)-17,17-этилендиоксиэстра-1,3,5(10)-триен. Раствор из 63,9 г 3-ацетокси-7-(5 ацетоксипентил)эстра-1,3,5(10)-триен-17-она в 460 мл дихлорметана перемешивают с 460 мл этиленгликоля, 155 мл триметилортоформиата и 1,2 г паратолуолсульфоновой кислоты в течение 3 ч при темпeратуре ванны 50 С. Затем разбавляют дихлорметаном, промывают раствором гидрокарбоната натрия и раствором поваренной соли, после чего сушат над сульфатом натрия,концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. В результате получают 63,2 г 3-ацетокси-7-(5 ацетоксипентил)-17,17-этилендиоксиэстра-1,3,5(10)-триена в 630 мл тетрагидрофурана при 0 С смешивают порциями с 61,7 г пербромида пиридингидробромида и перемешивают в течение 2 ч при 0 С. Затем добавляют раствор из 15 г сульфида натрия в 70 мл воды, разбавляют уксусным эфиром, промывают раствором гидрокарбоната натрия и раствором поваренной соли,после чего сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 74,1 г 3-ацетокси-7-(5-ацетоксипентил)16-бром-17,17-этилендиоксиэстра-1,3,5(10)триена в виде масла. з) 17,17-Этилендиокси-7-(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-3-ол. Раствор из 74,1 г 3-ацетокси-7-(5 ацетоксипентил)-16-бром-17,17-этилендиоксиэстра-1,3,5(10)-триена в 740 мл диметилсульфоксида и 74 мл метанола перемешивают с 74 мг гидроксида калия в течение 7,5 ч при температуре ванны 85 С. Затем осаждают льдом/ водой/поваренной солью, растворяют с помощью уксусного эфира, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют гексаном/уксусным эфиром. В результате получают 36,12 г чистого 17,17-этилендиокси-7-(5 гидроксипентил)эстра-1,3,5(10),15-тетраен-3 ола в виде пенистого вещества. и) 3-Гидрокси-7-(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-17-он. Раствор из 36,12 г 17,17-этилендиокси-7(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-3 ола в 958 мл ацетона и 111 мл воды перемешивают в течение 2 ч при комнатной температуре с 2,76 г паратолуолсульфоновой кислоты. Затем концентрируют под вакуумом до 1/3 объема,растворяют с помощью уксусного эфира, промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 31,7 г 3-гидрокси 7-(5-гидроксипентил)эстра-1,3,5(10),15-тетра 001577 18 ен-17-она в виде кристаллов с температурой плавления 194-196 С. к) 3,17-Диацетокси-7-(5-ацетоксипентил) эстра-1,3,5(10),14,16-пентаен. Раствор из 15,7 г 3-гидрокси-7-(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-17-она в 330 мл ангидрида уксусной кислоты перемешивают с 4,6 г паратолуолсульфоновой кислоты в течение 4 ч при комнатной температуре. Затем осаждают пиридином/водой/поваренной солью,растворяют с помощью уксусного эфира, промывают раствором гидрокарбоната натрия и раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/ уксусным эфиром. В результате получают 11,1 г чистого 3,17-диацетокси-7-(5-ацетоксипентил) эстра-1,3,5(10),14,16-пентаена в виде масла. л) 3,17-диацетокси-7-(5-ацетоксипентил)-14,17-этеноэстра-1,3,5(10)триен. 11,0 г 3,17-диацетокси-7-(5-ацетоксипентил)эстра-1,3,5(10),14,16-пентаена в 120 мл бензола обрабатывают при давлении 300 бар и температуре 175 С в течение 6,5 дней этеном. Затем растворяют с помощью уксусного эфира, промывают раствором гидрокарбоната натрия и раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. В результате получают 8,4 г 3,17-диацетокси-7-(5-ацетоксипентил)14,17-этеноэстра-1,3,5(10)-триена в виде пенистого вещества. м) 3,17-диацетокси-7-(5-ацетоксипентил)-14,17-этаноэстра-1,3,5(10)-триен. Раствор из 8,4 г 3,17-диацетокси-7-(5 ацетоксипентил)-14,17-этеноэстра-1,3,5(10)триена в 200 мл уксусного эфира встряхивают с 1,5 г палладия (10%-ного) на угле в течение 1 ч при комнатной температуре в токе водорода. Затем отфильтровывают с помощью вакуумфильтра через броунмиллерит, после чего промывают уксусным эфиром, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. В результате получают 6,0 г 3,17-диацетокси-7-(5-ацетоксипентил)-14,17-этаноэстра-1,3,5(10)-триена в виде пенистого вещества. н) 14,17-Этано-7-(5-гидроксипентил) эстра-1,3,5(10)-триен-3,17-диол. Раствор из 6,0 г 3,17-диацетокси-7-(5 ацетоксипентил)-14,17-этаноэстра-1,3,5(10)триена в 100 мл 1-молярного раствора гидроксида калия выдерживают в течение 7,5 ч при комнатной температуре. Затем сливают в 1 молярную соляную кислоту, трижды экстрагируют уксусным эфиром, промывают раствором гидрокарбоната натрия и раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и перекристаллизовывают 19 из ацетона/гексана. В результате получают 4,57 г 14,17-этано-7-(5-гидроксипентил)эстра 1,3,5(10)-триен-3,17-диола в виде бесцветных кристаллов с температурой плавления 63-65 С. о) 3-Бензилокси-14,17-этано-7-(5-гидроксипентил)эстра-1,3,5(10)-триен-17-ол. Раствор из 4,5 г 14,17-этано-7-(5 гидроксипентил)эстра-1,3,5(10)-триен-3,17 диола в 90 мл ацетонитрила перемешивают с 1,91 г карбоната калия и 1,53 мл бензилбромида в течение 6,5 ч при температуре ванны 80 С. Затем концентрируют под вакуумом до 1/3 объема, сливают на воду, трижды экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/ацетоном. В результате получают 4,8 г 3-бензилокси-14,17 этано-7-(5-гидроксипентил)эстра-1,3,5(10)триен-17-ола в виде пенистого вещества. п) 3-Бензилокси-14,17-этано-7-(5-тозилоксипентил)эстра-1,3,5(10)-триен-17-ол. Раствор из 4,8 г 3-бензилокси-14,17 этано-7-(5-гидроксипен-тил)эстра-1,3,5(10)триен-17-ола в 50 мл пиридина перемешивают при 0 С с 3,63 г ангидрида толуолсульфоновой кислоты в течение 4 ч. Затем разбавляют уксусным эфиром, экстрагируют 2-молярной соляной кислотой, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. В результате получают 4,75 г 3-бензилокси-14,17 этано-7-(5-тозилоксипентил)эстра-1,3,5(10)триен-17-ола в виде пенистого вещества. р) 3-Бензилокси-14,17-этано-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-17-ол. Раствор из 4,7 г 3-бензилокси-14,17 этано-7-(5-тозилоксипентил)эстра-1,3,5(10)триен-17-ола в 100 мл диметилформамида перемешивают с 2,7 г метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]амина в течение 4 ч при температуре ванны 80 С. Затем сливают на воду, трижды экстрагируют уксусным эфиром,промывают раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихорметаном/метанолом. В результате получают 3,8 г 3-бензилокси-14,17-этано-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-17-ола в виде масла. с) 14,17-Этано-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 3,7 г 3-бензилокси-14,17 этано-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-17-ола в 65 мл дихлорметана пере 001577 20 мешивают при 0 С с 2,1 мл N,N-диметиланилина в течение 5 мин, смешивают с 2,75 г безводного хлорида алюминия и перемешивают в течение 3,5 ч при 0 С. Затем смешивают с насыщенным водным раствором калий-натрийтартрата, сливают на воду, трижды экстрагируют дихлорметаном, промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 6,3 г сырого продукта, который хроматографируют на силикагеле дихлорметаном/метанолом. Таким путем получают 2,85 г чистого 14,17-этано-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диола в виде кристаллов с температурой плавления 63-67 С; []D22 =+19,4 (с = 0,505% в хлороформе). Пример 2. 14,17-Этано-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 1,0 г 14,17-этано-7-[5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола в 37,5 мл метанола и 1,78 мл воды перемешивают с 381 мг периодата натрия в течение 5 ч при комнатной температуре. Затем сливают на воду, трижды экстрагируют дихлорметаном,промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. Таким путем получают 985 мг сырого продукта, который хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 514,3 г чистого 14,17-этано 7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5= 0,5% в хлороформе). Пример 3. 3,17-Диацетокси-14,17 этано-7-[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра 1,3,5(10)-триен. Раствор из 600 мг 14,17-этано-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола в 2 мл пиридина и 1 мл ацетангидрида перемешивают с 5 мг диметиламинопиридина в течение 4,5 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают водой и раствором поваренной соли, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 680 мг 3,17-диацетокси-14,17-этано-7-[5-[N-метил-N-3(4,4,5,5,5-пентафтор-пентилтио)пропиламино] пентилэстра-1,3,5(10)-триена в виде масла. Пример 4. 14,17-Этано-7-5-[N-метил-N3-(4.4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диол. Раствор из 650 мг 3,17-диацетокси 14,17-этано-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триена в 15 мл ледяной уксусной кислоты перемешивают с 1,5 г тетрагидрата пербората натрия в течение 3 ч при комнатной температуре. Затем сливают на воду, трижды экстрагируют дихлорметаном, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом, растворяют в 10 мл 0,2-молярного метанольного раствора гидроксида калия, перемешивают в течение 24 ч при комнатной температуре, сливают на воду, трижды экстрагируют дихлорметаном,промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом, суспендируют в 20 мл уксусного эфира,смешивают с 10 мл раствора хлорида олова (II),перемешивают в течение 4 ч при комнатной температуре, разбавляют уксусным эфиром,промывают раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. В результате получают 300 мг чистого 14,17-этано-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил]эстра-1,3,5(10)-триен-3,17 диола в виде кристаллов с температурой плавления 55-58 С; []D22 = +19,4 (с = 0,51% в хлороформе). Пример 5. 17-Трифторметил-7-[5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3.5(10)-триен-3,17 диол. а) 17-Ацетокси-7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3-он. В 200 мл абсолютного ТГФ 22,9 г магниевой стружки подвергают взаимодействию с 261 г 1-бром-5-трет-бутилдиметилсилилоксипентана[Tetrahedron Letters 23, 1982, 40, 4147-4150],растворенными в 250 мл абсолютного ТГФ, с получением реагента Гриньяра. В этот охлажденный до -20 С раствор в токе азота добавляют 92,9 г иодида меди (I), после чего в течение 1 ч по каплям добавляют 73,5 г 17-ацетоксиэстра 4,6-диен-3-она [Journ. Am. Chem. Soc. 80, 1958,2596-2597], растворенных в 300 мл абсолютного ТГФ. Для последующей переработки добавляют по каплям 61,2 мл уксусной кислоты, реакционную смесь разбавляют уксусным эфиром, промывают насыщенным раствором хлорида аммония, водой и раствором гидрокарбоната натрия и сушат. Образовавшийся после упаривания остаток хроматографируют на силикагеле. В результате получают 48 г 17-ацетокси-7-(5 трет-бутилдиметилсилилоксипентил)эстр-4-ен 3-она. б) 17-Ацетокси-7-(5-гидроксипентил) эстр-4-ен-3-он. Раствор из 48 г 17-ацетокси-7-(5-третбутилдиметилсилилоксипентил)эстр-4-ен-3-она 22 в 350 мл метанола выдерживают вместе с 35 мл 8 об.%-ной серной кислоты в течение 30 мин при комнатной температуре. Затем раствор разбавляют диэтиловым эфиром, промывают водой до нейтрального состояния и сушат. После упаривания получают 37,7 г 17-ацетокси-7-(5 гидроксипентил)эстр-4-ен-3-она в виде масла. в) 17-Ацетокси-7-(5-ацетоксипентил) эстр-4-ен-3-он. Раствор из 37,7 г 17-ацетокси-7-(5 гидроксипентил)эстр-4-ен-3-она в 160 мл пиридина медленно смешивают с 80 мл ацетангидрида и перемешивают в течение 16 ч при 25 С. Затем разбавляют уксусным эфиром, органическую фазу после промывки раствором гидрокарбоната натрия сушат и упаривают. Остаток хроматографируют на силикагеле и в результате получают 26,6 г 17-ацетокси-7-(5 ацетоксипентил)эстр-4-ен-3-она в виде масла;[]D22 = +20,0 (с = 0,51% в хлороформе). г) 17-Ацетокси-7-(5-ацетоксипентил)эстра-1,3,5(10)-триен-3-ол. К нагретому до 80 С раствору из 26,6 г 17-ацетокси-7-(5-ацетоксипентил)эстр-4-ен 3-она в 260 мл ацетонитрила добавляют по каплям и при перемешивании раствор из 5,18 г бромида лития и 26,73 г бромида меди (II) в 260 мл ацетонитрила в течение 30 мин. По завершении процесса добавления реакционный раствор охлаждают, разбавляют диэтиловым эфиром,промывают водой и раствором гидрокарбоната натрия и сушат. Образовавшийся после упаривания остаток хроматографируют на силикагеле и в результате получают 21,3 г 17-ацетокси-7(5-ацетоксипентил)эстра-1,3,5(10)-триен-3-ола в виде масла; []D22 = +28,9 (с = 0,535% в хлороформе). д) 17-Ацетокси-7-(5-ацетоксипентил)-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен. Раствор из 21,3 г 17-ацетокси-7-(5 ацетоксипентил)эстра-1,3,5(10)-триен-3-ола в 213 мл тетрагидрофурана выдерживают вместе с 21,3 мл 3,4-дигидро-2 Н-пирана и 1,065 г птолуолсульфоновой кислоты в течение 8 ч при комнатной температуре. Затем реакционную смесь смешивают с 3 мл пиридина, далее разбавляют диэтиловым эфиром, промывают водой и сушат. Образовавшийся после упаривания остаток хроматографируют на силикагеле и в результате получают 24,3 г 17-ацетокси-7-(5 ацетоксипентил)-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триена в виде масла; []D22 =+31,5 (с = 0,535% в хлороформе). е) 17-Ацетокси-7-(5-гидроксипентил)-3(тетрагидропиран-2-илок-си)эстра-1,3,5(10)триен. Раствор из 10,2 г 17-ацетокси-7-(5 ацетоксипентил)-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триена в 205 мл метанола перемешивают с 33,7 мл едкого натра в течение 45 23 мин при 15 С. Затем разбавляют диэтиловым эфиром, промывают водой, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 5,6 г 17-ацетокси-7-(5 гидроксипентил)-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триена; []D22 = +32,2 (с = 0,505% в хлороформе). ж) 17-Ацетокси-3-(тетрагидропиран-2 илокси)-7-(5-п-толуолсульфонилоксипентил) эстра-1,3,5(10)-триен. Раствор из 5,5 г 17-ацетокси-7-(5 гидроксипентил)-3-(тетра-гидропиран-2-илокси) эстра-1,3,5(10)-триена в 47 мл пиридина выдерживают вместе с 5,5 г ангидрида птолуолсульфоновой кислоты в течение 45 мин при комнатной температуре. Затем реакционный раствор охлаждают в ледяной бане, смешивают с 4 мл воды и перемешивают в течение 45 минут. Далее разбавляют уксусным эфиром,промывают водой, сушат и упаривают. В результате получают 8,2 г 17-ацетокси-3-(тетрагидропиран-2-илокси)триен-7-(5-п-толуолсульфонилоксипентил)эстра-1,3,5(10)-триена в виде масла. з) 17-Ацетокси-7-(5-метиламинопентил)-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен. В раствор из 8,2 г 17-ацетокси-3(тетрагидропиран-2-илокси)триен-7-(5-п-толуолсульфонилоксипентил)эстра-1,3,5(10)-триена в 80 мл тетрагидрофурана, помещенный в трубку для проведения реакции под давлением, при охлаждении льдом вводят 6,3 г метиламина. Затем закрытую трубку нагревают в течение 6 ч до 60 С. После охлаждения досуха упаривают под вакуумом и остаток хроматографируют на силикагеле. В результате получают 5,1 г 17 ацетокси-7-(5-метиламинопентил)-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена в виде масла; []D22 = +29,7 (с = 0,535% в хлороформе). и) 17-Ацетокси-7-[5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентил]-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен. Раствор из 1,64 г 17-ацетокси-7-(5 метиламинопентил)-3-(тетрагидропиран-2 илокси)эстра-1,3,5(10)-триена в 25 мл абсолютного ТГФ перемешивают со 159 мг 80%-ного гидрида натрия в токе азота в течение 2 ч при комнатной температуре. Затем по каплям добавляют 1,43 г 3-хлорпропил-4,4,5,5,5-пентафторпентилсульфида в 7 мл абсолютного ДМФ,после чего перемешивают в течение 22 ч при 80 С. Далее реакционную смесь разбавляют уксусным эфиром, промывают водой, сушат,упаривают и остаток хроматографируют на силикагеле. В результате получают 820 мг 17 ацетокси-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]-3(тетрагидропиран-2-илокси)эстра-1,3,5(10) 001577 триена в виде масла; []D22 = +21,5 (с = 0,51% в хлороформе). к) 7-5-[N-Метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17 ол. Раствор из 790 мг 17-ацетокси-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена в 8 мл метанола и 3 мл ТГФ перемешивают с 430 мг карбоната калия в течение 18 ч при комнатной температуре. Затем реакционную смесь разбавляют диэтиловым эфиром, промывают водой, сушат и упаривают. В результате получают 750 мг сырого 7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17-ола. л) 7-5-[N-Метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 750 мг 7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентил]-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-ола в 28 мл метанола и 2,8 мл воды перемешивают с 350 мг щавелевой кислоты в течение 17 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают раствором гидрокарбоната натрия и водой,сушат и упаривают. Остаток хроматографируют на силикагеле и в результате получают 640 мг 7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)триен-3,17-диола в виде масла; []D22 = +24,0(с = 0,515% в хлороформе). м) 7-5-[N-Метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17 он. Раствор из 900 мг 7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-ола в 30 мл толуола и 9,6 мл циклогексанона смешивают с раствором из 900 мг изопропилата алюминия в 16 мл толуола и нагревают в течение 30 мин при медленной отгонке. Затем реакционную смесь разбавляют уксусным эфиром, промывают 20%-ным раствором калий-натрийтартрата, сушат и упаривают. Остаток хроматографируют на силикагеле гексаном/уксусным эфиром. В результате получают 715 мг 7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентил-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-она в виде масла. н) 17-Трифторметил-3-(тетрагидропиран 2-илокси)-7-[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-17-ол. Раствор из 500 мг 7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтиo)пропиламино] пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-она (см. Ausw.-Pat., пример 2 а) в 5 мл абсолютного тетрагидрофурана смешивают при температуре ванны 0 С с 0,27 мл(трифторметил)триметилсилана. Затем медленно по каплям добавляют 0,2 мл 1,1-молярного раствора фторида тетрабутиламмония и перемешивают в течение 45 мин, повторно добавляют 1 мл 1,1-молярного раствора фторида трибутиламмония и продолжают перемешивание еще в течение 30 мин. Далее разбавляют уксусным эфиром, промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 285 мг 17-трифторметил-3-(тетрагидропиран-2-илокси)-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-17-ола в виде масла. о) 17-Трифторметил-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол. Раствор из 280 мг 17-трифторметил-3(тетрагидропиран-2-илокси)-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-17-ола в 5,6 мл метанола и 0,56 мл воды перемешивают со 140 мг щавелевой кислоты в течение 18 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 215 мг 17-трифторметил-7-[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диола в виде масла. Пример 6. 15,16-Метано-17-метил-7[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. а) 3-Бензилокси-17,17-этилендиокси-7-(5 гидроксипентил)эстра-1,3,5(10),15-тетраен. Раствор из 32,7 г 17,17-этилендиокси-7(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-3 ола (см. пример 1 з) в 327 мл диметилформамида смешивают при комнатной температуре с 5,73 г гидроксида лития и перемешивают с 15,1 мл бензилбромида в течение 2 ч при 60 С. Затем разбавляют уксусным эфиром, промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 32,8 г 3-бензилокси-17,17 этилендиокси-7-(5-гидроксипентил)эстра-1,3,5(10),15-тетраена в 328 мл ацетона и 32,8 мл воды перемешивают при комнатной температуре с 1,033 г паратолуолсульфоновой кислоты в течение 2 ч. Затем разбавляют диэтиловым эфиром,промывают раствором гидрокарбоната натрия и водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметанол/ацетоном. В результате получают 25,4 г 3-бензилокси-7-(5-гидроксипентил)эстра-1,3,5-(10),15-тетраен-17-она. в) 3-Бензилокси-7-(5-гидроксипентил)15,16-метаноэстра-1,3,5(10),15-тетраен-17-он. 2,861 г иодида триметилсульфоксония в 65 мл диметилсульфоксида подвергают взаимодействию в течение 2 ч при комнатной температуре с 345 мг 80%-ного гидрида натрия. В этот раствор добавляют 4,44 г 3-бензилокси-7-(5 гидроксипентил)эстра-1,3,5(10),15-тетраен-17 она и перемешивают в течение 45 минут при комнатной температуре. Выпавший осадок отфильтровывают и промывают водой. Затем этот осадок растворяют с помощью уксусного эфира,промывают водой, сушат над сульфатом натрия,концентрируют под вакуумом и хроматографируют на силикагеле гексаном/ацетоном. В результате получают 2,8 г 3-бензилокси-7-(5 гидроксипентил)-15,16-метаноэстра-1,3,5(10),15-тетраен-17-она в 25 мл пиридина смешивают при комнатной температуре с 2,5 г ангидрида пара-толуолсульфоновой кислоты и оставляют в таком состоянии на 30 мин, после чего при охлаждении льдом смешивают с 1 мл воды и оставляют на последующие 45 мин. Затем разбавляют диэтиловым эфиром, промывают водой, сушат над сульфатом натрия и концентрируют под вакуумом. Таким путем получают 3,4 г сырого 3-бензилокси-15,16-метано 7-(5-тозилоксипентил)эстра-1,3,5(10),15-тетраен-17-она. д) 3-Бензилокси-15,16-метано-7-[5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-тетраен-17-он. К раствору из 3,4 г сырого 3-бензилокси 15,16-метано-7-(5-тозилоксипентил)эстра 1,3,5(10),15-тетраен-17-она в 34 мл диметилформамида добавляют раствор из 2,1 г метил[3(4,4,5,5,5-пентафторпентилтио)пропил]амина в 1 мл диметилформамида и перемешивают в течение 3,5 ч при 100 С. Затем разбавляют уксусным эфиром, промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле ди 27 хлорметаном/метанолом. В результате получают 2,6 г 3-бензилокси-15,16-метано-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10),15-тетраен-17 она в виде масла. е) 15,16-Метано-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентил-3-гидроксиэстра-1,3,5(10),15-тетраен 17-он. Раствор из 2,3 г 3-бензилокси-15,16 метано-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра 1,3,5(10),15-тетраен-17-она в 53 мл дихлорметана перемешивают при температуре ванны 0 С с 1,12 мл N,N-диметиланилина и 1,64 г безводного хлорида алюминия в течение 4,5 ч. Затем разбавляют уксусным эфиром, промывают 30%ным раствором калий-натрийтартрата и водой,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 1,52 г 15,16-метано-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио) пропиламино]пентил-3-гидроксиэстра-1,3,5(10),15-тетраен-17-она в виде масла; []D22 = -2,5 (с= 0,505% в хлороформе). ж) 15,16-метано-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диол. К раствору из 515 мг 15,16-метано-75-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-гидроксиэстра 1,3,5(10),15-тетраен-17-она в 10 мл тетрагидрофурана добавляют по каплям при температуре ванны 0 С 1,8 мл 3-молярного раствора метилмагнийбромида и перемешивают в течение 2 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают насыщенным раствором хлорида аммония и водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 395 мг 15,16-метано-17-метил-7-[5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола в виде масла; []D22 = -5,1 (с = 0,52% в хлороформе). Пример 7. 15,16-Метано-17-метил-75-[N-метил-N-3-(4,4.5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диола (см. пример 6) в 5 мл метанола перемешивают с 80 мг периодата натрия в течение 3 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на(10),15-тетраен-17-она (см. пример 6 е) в 10 мл метанола и 1 мл воды перемешивают в течение 3 часов при комнатной температуре со 100 мг борогидрида натрия. Затем разбавляют уксусным эфиром, промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 340 мг 15,16-метано-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)-пропиламино] пентил]эстра-1,3,5(10)-триен-3,17-диола в виде масла; []D22 = +11,9 (с = 0,52% в хлороформе). Пример 9. 15,6-Метано-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3.5(10)-триен-3,17 диол. Раствор из 100 мг 15,16-метано-7-5[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио) пропиламино]пентил]эстра-1,3,5(10)-триен 3,17-диола (см. пример 8) в 5 мл метанола перемешивают в течение 3 ч при комнатной температуре с 80 мг периодата натрия. Затем разбавляют уксусным эфиром, промывают водой,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 70 мг 15,16-метано-7-[5-[N-метилN-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола в виде масла; []D22 = +12,2 (с = 0,515% в хлороформе). Пример 10. 15-Метил-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол. а) 3-Бензилокси-7-(5-гидроксипентил)15-метилэстра-1,3,5(10)-триен-17-он. К охлажденному льдом раствору из 11,9 мл 3-молярного раствора метилмагнийбромида в 68 мл тетрагидрофурана добавляют в токе азота 5,35 г иодида меди (I). Затем по каплям добавляют раствор из 4,26 г 3-бензилокси-7-(5 гидроксипентил)эстра-1,3,5(10),15-тетраен-17 она (см. пример 66) в 50 мл тетрагидрофурана и в течение 30 мин перемешивают при температуре ванны 0 С. Затем с помощью насыщенного раствора хлорида аммония разлагают избыточный реагент, разбавляют уксусным эфиром,промывают раствором хлорида аммония и во 29 дой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/ацетоном. В результате получают 3,6 г 3-бензилокси-7-(5-гидроксипентил)-15-метилэстра-1,3,5(10)-триен-17-она в виде масла; []D22 = +66,4 (с = 0,515% в хлороформе). б) 3-Бензилокси-15-метил-7-(5-тозилоксипентил)эстра-1,3,5(10)-триен-17-он. Раствор из 3,6 г 3-бензилокси-7-(5 гидроксипентил)-15-метилэстра-1,3,5(10)триен-17-она тозилируют аналогично тому, как описано в примере 6 г. Таким путем получают 4,9 г сырого 3-бензилокси-15-метил-7-(5 тозилоксипентил)эстра-1,3,5(10)-триен-17-она. в) 3-Бензилокси-15-метил-7-(5-N-метиламинопентил)эстра-1,3,5-(10)-триен-17-он. В раствор из 4,9 г 3-бензилокси-15-метил 7-(5-тозилоксипентил)эстра-1,3,5(10)-триен 17-она в 30 мл тетрагидрофурана в реакторе,работающем под давлением, конденсируют при охлаждении 3,8 г метиламина, закрытый реактор нагревают затем в течение 5,5 ч до 80 С,после чего охлаждают и открывают. Далее разбавляют уксусным эфиром, промывают водой,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом/1%триэтиламином. Таким путем получают 3,15 г 3-бензилокси-15-метил-7-(5-N-метиламинопентил) эстра-1,3,5(10)-триен-17-она в виде масла. г) 3-Бензилокси-15-метил-7-[5-N-метилN-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]эстра-1,3,5(10)-триен-17-он. Раствор из 3,15 г 3-бензилокси-15-метил 7-(5-N-метиламинопентил)эстра-1,3,5(10)-триен-17-она в 31,5 мл абсолютного диметилформамида смешивают с 228 мг 80%-ного гидрида натрия и перемешивают в течение 5 ч при комнатной температуре, потом смешивают с 2,6 г 3 хлорпропил-4,4,5,5,5-пентафторпентилсульфида в 2 мл абсолютного диметилформамида и в течение 24 ч перемешивают при 80 С. Затем разбавляют уксусным эфиром, промывают гидрокарбонатом натрия и водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. Таким путем получают 3,1 г 3 бензилокси-15-метил-7-[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10),15-триен-17-она в виде масла. д) 3-Гидрокси-15-метил-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-17-он. Раствор из 3,1 г 3-бензилокси-15-метил 7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]эстра-1,3,5(10)-триен 17-она дебензилируют аналогично тому, как 30 описано в примере 6 е). Таким путем получают 830 мг 3-гидрокси-15-метил-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]эстра-1,3,5(10)-триен-17-она в виде масла. е) 15-Метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диол. Раствор из 460 мг 3-гидрокси-15-метил 7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен 17-она восстанавливают аналогично тому, как описано в примере 8. Таким путем получают 200 мг 15-метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диола в виде масла;[]D22 = +4,5 (с = 0,51 % в хлороформе). Пример 11. 15,17-Диметил-7-[5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диол. В 15 мл тетрагидрофурана в течение 2 часов при комнатной температуре перемешивают 1,44 г сухого хлорида церия (III), затем при охлаждении льдом смешивают с 3,75 мл 3 молярного раствора метилмагнийбромида, перемешивают в течение 15 мин при охлаждении и в течение 30 мин при комнатной температуре,далее добавляют по каплям раствор из 650 мг 3 гидрокси-15-метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил эстра-1,3,5(10)-триен-17-она (см. пример 10 д) в 7 мл тетрагидрофурана, перемешивают в течение 2 ч при комнатной температуре и с помощью насыщенного раствора хлорида аммония разлагают избыточный реагент. Затем разбавляют уксусным эфиром, промывают насыщенным раствором хлорида аммония и водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 145 мг 15,17-диметил-7-[5-[N-метил-N3-(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диола в виде масла; []D22 = -7,3 (с = 0,505 % в хлороформе). Пример 12. 11-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фторэстр-4-ен-3,17-дион. К 5,0 г 11-гидроксиэстр-4-ен-3,17-диона в 100 мл толуола и 7,3 мл 1,8-диазабицикло[5,4,0]ундец-7-ена по каплям добавляют при 0 С 4,6 мл фторангидрида перфторбутан-1-сульфокислоты. По истечении 30 мин раствор разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 3,8 г 11 31 фторэстр-4-ен-3,17-диона с температурой плавления 173-174 С. б) 11-Фтор-3-метоксиэстра-3,5-диен-17 он 7,8 г 11-фторэстр-4-ен-3,17-диона перемешивают в 40 мл 2,2-диметоксипропана с 780 мг пиридинийтолуол-4-сульфоната в течение 5 часов при 80 С. Затем добавляют 1,5 мл триэтиламина, разбавляют уксусным эфиром и промывают насыщенным раствором хлорида натрия. После кристаллизации из метанола получают 5,3 г 11-фтор-3-метоксиэстра-3,5-диен-17-она с температурой плавления 173 С. в) 11-Фторэстра-4,6-диен-3,17-дион. К 5,0 г 11-фтор-3-метоксиэстра-3,5-диен 17-она в 50 мл ДМФ при 0 С добавляют последовательно 5 мл 10%-ного раствора ацетата натрия и порциями 2,5 г 1,3-дибром-5,5 диметилгидантоина. По истечении 30 мин добавляют 2,3 г сульфита натрия, а затем 2,5 г бромида лития и 2,0 г карбоната лития и перемешивают в течение 2 ч при 100 С. Реакционную смесь сливают при перемешивании в ледяную воду. Выпавший в осадок продукт отфильтровывают с помощью вакуум-фильтра,растворяют в уксусном эфире, промывают водой, сушат и концентрируют под вакуумом. После перекристаллизации из уксусного эфира получают 3,6 г 11-фторэстра-4,6-диен-3,17 диона с температурой плавления 198 С. г) 11-Фтор-7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-дион. 7,9 г магния в 40 мл ТГФ подвергают в атмосфере азота взаимодействию с раствором из 95,3 г 1-бром-5-трет-бутилдиметилсилилоксипентана (Tetrahedron Letters 1982, 4147-4150) в 260 мл ТГФ с получением в результате реагента Гриньяра. При температуре -30 С добавляют сначала 32 г иодида меди (I), а затем по каплям 29 г 11-фторэстра-4,6-диен-3,17-диона в 290 мл ТГФ. По завершении реакции смешивают с 20,4 мл ледяной уксусной кислоты и реакционную смесь сливают при перемешивании в ледяную воду. Выпавший в осадок продукт отфильтровывают с помощью вакуум-фильтра, растворяют в уксусном эфире, промывают водой до нейтрального состояния и сушат. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 23,9 г 11 фтор-7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-диона в виде пенистого вещества. д) 11-Фтор-7-(5-гидроксипентил)эстр-4 ен-3,17-дион Раствор из 23,1 г 11-фтор-7-(5 трет-бутилдиметилсилилоксипентил)эстр-4-ен 3,17-диона в 115 мл ТГФ и 64 мл воды перемешивают в течение 2,5 ч при 50 С со 128 мл ледяной уксусной кислоты. Затем реакционную смесь концентрируют под вакуумом, растворяют с помощью уксусного эфира, промывают водой и сушат. Таким путем получают 20,4 г 11-фтор-7-(5-гидроксипентил)эстр-4-ен-3,17 диона в виде пенистого вещества. е) 7-(5-Ацетоксипентил)-11-фторэстр-4 ен-3,17-дион. 20 г 11-фтор-7-(5-гидроксипентил)эстр 4-ен-3,17-диона в 100 мл пиридина выдерживают в течение 2 ч при 25 С для взаимодействия с 50 мл ацетангидрида. Затем при 0 С добавляют 5 мл воды и перемешивают в течение 45 мин. Затем экстрагируют диэтиловым эфиром, промывают 2 н. серной кислотой до полного отсутствия пиридина и раствор нейтрализуют последовательно насыщенным раствором гидрокарбоната натрия и водой. После сушки и концентрирования под вакуумом сырой продукт хроматографируют на силикагеле градиентом гексан-уксусный эфир. Таким путем получают 17 г 7-(5-ацетоксипентил)-11-фторэстр-4-ен-3,17 диона с температурой плавления 78,4 С. ж) 7-(5-Ацетоксипентил)-11-фтор-3 гидроксиэстра-1,3,5(10)-триен-17-он. К 16,5 г 7-(5-ацетоксипентил)-11 фторэстр-4-ен-3,17-диона в 190 мл ацетонитрила при 80 С добавляют 18,6 г бромида меди (II) и 3,6 г бромида лития. По истечении 15 мин реакционную смесь сливают при перемешивании в ледяную воду, содержащую гидрокарбонат натрия. Выпавший в осадок продукт отфильтровывают с помощью вакуум-фильтра,растворяют в уксусном эфире, промывают водой, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 8,5 г 7-(5-ацетоксипентил)-11-фтор-3 гидроксиэстра-1,3,5(10)-триен-17-она в виде пенистого вещества. з) 7-(5-Ацетоксипентил)-11-фтор-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-он. 8,2 г 7-(5-ацетоксипентил)-11-фтор-3 гидроксиэстра-1,3,5(10)-триен-17-она в 86 мл ТГФ перемешивают с 8,6 мл 3,4-дигидро-2 Нпирана и 820 мг гидрата п-толуолсульфокислоты в течение 2,5 ч при комнатной температуре. Затем добавляют 0,5 мл триэтиламина,разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 7,8 г 7-(5 ацетоксипентил)-11-фтор-3-(тетрагидропиран 2-илокси)эстра-1,3,5(10)-триен-17-она в виде пенистого вещества. и) 11-Фтор-7-(5-гидроксипентил)-3(тетрагидропиран-2-илок-си)эстра-1,3,5(10)триен-17-он. 7,4 г 7-(5-ацетоксипентил)-11-фтор-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-она в 370 мл метанола и 37 мл воды перемешивают при комнатной температуре с 1,8 г карбоната калия. По истечении 3 ч реакцион 33 ную смесь сливают в ледяную воду. Выпавший в осадок продукт отфильтровывают с помощью вакуум-фильтра, растворяют в уксусном эфире,промывают водой до нейтрального состояния,сушат и концентрируют под вакуумом. Таким путем получают 7,0 г 11-фтор-7-(5-гидроксипентил)-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-она в виде пенистого вещества. к) 11-Фтор-3-(тетрагидропиран-2-илокси)-7-(5-п-толуолсульфо-нилоксипентил)эстра 1,3,5(10)-триен-17-он. 6,7 г 11-фтор-7-(5-гидроксипентил)-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-она в 70 мл пиридина перемешивают при комнатной температуре с 6,0 г ангидрида птолуолсульфокислоты в течение 3 ч. Затем раствор разбавляют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом гексан-уксусный эфир. Таким путем получают 5,7 г 11-фтор-3-(тетрагидропиран-2-илокси)7-(5-п-толуолсульфонилоксипентил)эстра 1,3,5(10)-триен-17-она в виде пенистого вещества. л) 11-Фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентил-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-он. 2,0 г 11-фтор-3-(тетрагидропиран-2 илокси)-7-(5-п-толуолсульфонилоксипентил) эстра-1,3,5(10)-триен-17-она в 44 мл ДМФ перемешивают при 80 С с 1,2 г метил-[3-(4,4,5,5,5 пентафторпентилтио)пропил]амина. По истечении 6,5 ч реакционную смесь смешивают с водой. Затем экстрагируют уксусным эфиром,промывают насыщенным раствором хлорида натрия и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид-метанол получают 1,3 г 11-фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропила-мино]пентил-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-она в виде масла. м) 11-Фтор-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентил-тио)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-ол. К 2,0 г 11-фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-она в 17 мл ТГФ, 10 мл этанола и 4,2 мл воды при 0 С добавляют порциями 350 мг борогидрида натрия. По истечении 30 мин реакционную смесь сливают при перемешивании в ледяную воду, затем экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия и концентрируют под вакуумом. Таким путем получают 1,7 г сырого 11-фтор-7-[5-[N-метил-N-3-(4,4,5,5,5-пента 001577 34 фторпентилтио)пропиламино]пентил-3(тетрагидропиран-2-илокси)эстра-1,3,5(10)триен-17-ола в виде пенистого вещества. н) 11-Фтор-7-[5-[N-мeтил-N-3-(4,4,5,5,5 пeнтaфтopпeнтил-тио)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диол. Раствор из 1,6 г 11-фтор-7-[5-[N-метилN-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]-3-(тетрагидропиран-2-илокси)-эстра 1,3,5(10)-триен-17-ола в 20 мл метанола и 2 мл воды перемешивают с 1,0 г щавелевой кислоты. По истечении 3 ч реакционную смесь сливают в ледяную воду. Затем экстрагируют метиленхлорид ом, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлоридметанол получают 1,1 г 11-фтор-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола с температурой плавления 95 С. Пример 13. 11-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. 580 мг 11-фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диола в 24 мл метанола и 1,1 мл воды перемешивают при комнатной температуре с 350 мг периодата натрия. По истечении 1,5 ч разбавляют метиленхлоридом, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. Сырой продукт хроматографируют на силикагеле градиентом метиленхлоридметанол. В результате получают 287 мг 11 фтор-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра 1,3,5(10)-триен-3,17-диола с температурой плавления 87 С. Пример 14. 11-Фтор-7-[5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. а) 11-фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентансульфонил)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-17-он. 2,0 г 11-фтор-3-(тетрагидропиран-2-илокси)-7-5-п-толуолсульфонилоксипентил)эстра 1,3,5(10)-триен-17-она в 40 мл ДМФ перемешивают при 80 С с 2,1 г метил-[3-(4,4,5,5,5 пентафторпентансульфонил)пропил]амина. По истечении 7 ч реакционную смесь сливают в ледяную воду, экстрагируют уксусным эфиром,промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид-метанол получают 1,1 г 11-фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфонил)пропил 35 амино]пентил-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17-она в виде масла. б) 11-Фтор-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино] пентил]-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-ол. 1,5 г 11-фтор-7-[5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино] пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-она смешивают при 0 С в смеси из 13 мл ТГФ, 7,5 мл этанола и 3,2 мл воды порциями с 270 мг борогидрида натрия. По истечении 90 мин добавляют воду, экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. Таким путем получают 1,5 г 11-фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил-3-(тетрагидропиран-2-илокси) эстра-1,3,5(10)-триен-17-ола в виде сырого продукта. в) 11-Фтор-7-[5-[N-метил-N-3-(4,4,5,5,5 пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. 1,4 г 11-фтор-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино] пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-11-ола перемешивают в 18 мл метанола и 1,8 мл воды при комнатной температуре с 900 мг щавелевой кислоты. По истечении 4 ч реакционную смесь сливают при перемешивании в ледяную воду. Выпавший в осадок продукт растворяют с помощью метиленхлорида,промывают водой, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид-метанол получают 325 мг 11-фтор-7-5[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)триен-3,17-диола с температурой плавления 70 С. Пример 15. 16-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диол. а) 7-(5-хлорпентил)эстр-4-ен-3,17-дион. В 150 мл безводного тетрагидрофурана суспендируют 11,6 г магниевой стружки и с помощью 58,8 мл 1-бром-5-хлорпентана в 40 мл безводного тетрагидрофурана приготавливают реагент Гриньяра. Затем перемешивают в течение 30 мин при комнатной температуре, разбавляют за счет добавления еще 100 мл безводного тетрагидрофурана и охлаждают до -70 С. Далее добавляют по каплям раствор из 3,04 г комплексного соединения бромид меди (I)диметилсульфид в 72 мл 1,3-диметилтетрагидро-2(1 Н)-пиримидинона (DMPU) и 150 мл тетрагидрофурана при внутренней температуре от -65 до -70 С. После этого в течение 2,5 ч добавляют раствор из 50 г эстра-4,6-диен-3,17 001577 36 диона (Steroids, том 1, 1963, 223) и 75 мл триметилхлорсилана в 700 мл безводного тетрагидрофурана. В охлаждающей ванне при перемешивании смеси дают медленно нагреться до комнатной температуры, на следующее утро при охлаждении льдом подкисляют 48 мл уксусной кислоты и после 15-минутного перемешивания смешивают с уксусным эфиром. Органическую фазу трижды экстрагируют насыщенным раствором хлорида аммония, а водную фазу уксусным эфиром, после чего объединенные органические фазы промывают раствором бикарбоната натрия, сушат сульфатом магния и упаривают под вакуумом. Остаток 53 г хроматографируют на силикагеле гексаном/ дихлорметаном и уксусным эфиром. Выход: 35 г 7-(5 хлорпентил)эстр-4-ен-3,17-диона. Аналогичный продукт получают из 8,05 г 7-(5-гидроксипентил)эстр-4-ен-3,17-диона(пример 1 б) по реакции, осуществляемой в течение 3,5 ч взаимодействием с 8,66 г трифенилфосфина в 85 мл тетрахлорметана и 30 мл ацетонитрила при комнатной температуре. Реакционную смесь разбавляют дихлорметаном, экстрагируют встряхиванием с насыщенным раствором бикарбоната натрия и насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают под вакуумом. Остаток хроматографируют на силикагеле дихлорметаном и уксусным эфиром, получая в результате 4,08 г 7-(5-хлорпентил)эстр-4-ен-3,17-диона;[]D22 = +68 (с = 0,5% в хлороформе). б) 7-(5-Хлорпентил)-3-гидроксиэстра-1,3,5(10)-триен-17-он. 18,96 г 7-(5-Хлорпентил) эстр-4-ен-3,17 диона растворяют в 350 мл безводного ацетонитрила и в атмосфере инертного газа при 80 С смешивают с раствором из 4,36 г бромида лития и 22,5 г бромида меди (II) в 390 мл безводного ацетонитрила. Перемешивание продолжают еще в течение 5 мин, смесь охлаждают в ледяной бане и смешивают с водой и уксусным эфиром. Органическую фазу экстрагируют встряхиванием с насыщенным раствором бикарбоната натрия, водную фазу - с уксусным эфиром, объединенные органические фазы - с насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают под вакуумом. Сырой продукт (выход 19,1 г) хроматографируют на силикагеле в гексане и уксусном эфире, получая в результате 10,0 г маслянистого 7-(5 хлорпентил)-3-гидроксиэстра-1,3,5 (10)-триен 17-она, который можно кристаллизовать из гексана/дихлорметана. Температура плавления 143,5 С; []D22 =+112 (с = 0,5% в хлороформе). в) Бис-3,17-триметилсилилокси-7-(5 хлорпентил)эстра-1,3,5(10),16-тетраен. В 75 мл бензола растворяют 5,65 г 7-(5 хлорпентил)эстра-1,3,5(10)-триен-3-ол-17-она, 9 мл триэтиламина и 9 мл триметилсилилового 37 эфира трифторметансульфокислоты и нагревают в течение 2 ч с обратным холодильником. После охлаждения разбавляют гексаном, верхнюю фазу экстрагируют встряхиванием с насыщенным раствором бикарбоната натрия и с насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают под вакуумом. Таким путем получают бис-3,17-триметилсилилокси-7-(5-хлорпентил)эстра-1,3,5(10),16 тетраен в виде масла. г) 7-(5-хлорпентил)-16-фторэстра-1,3,5(10)-триен-3-ол-17-он. Продукт, полученный в предыдущем опыте, растворяют в 150 мл безводного дихлорметана и смешивают с 14,2 гNфторбензолсульфонимида. После перемешивания в течение 2 ч при комнатной температуре добавляют 50 мл 8%-ной серной кислоты, интенсивно перемешивают в течение последующих 3 ч, после чего фазы разделяют. Водную фазу дважды экстрагируют встряхиванием с дихлорметаном, органическую фазу - последовательно с насыщенным раствором бикарбоната натрия и хлорида натрия, сушат над сульфатом натрия и упаривают под вакуумом. Сырой продукт - 15,3 г - хроматографируют на силикагеле дихлорметаном/диизопропиловым эфиром, получая таким путем 2,92 г 7-(5-хлорпентил)16-фторэстра-1,3,5(10)-триен-3-ол-17-она в виде масла. Это вещество можно кристаллизовать из диизопропилового эфира. Температура плавления 176 С, []D22 = +114 (с = 0,5% в хлороформе). д) 7-(5-Хлорпентил)-16-фтор-17 метилэстра-1,3,5(10)-триен-3,17-диол. 3,0 г 7-(5-хлорпентил)-16-фторэстра 1,3,5(10)-триен-3-ол-17-она растворяют в 300 мл безводного толуола в атмосфере инертного газа и смешивают при комнатной температуре с интервалом в 15 мин с 3 порциями по 20 мл каждая 1,5-молярного раствора метиллития и бромида лития в простом эфире. По истечении последующих 30 мин реакционную смесь сливают при перемешивании и охлаждении льдом в полунасыщенный раствор хлорида аммония, подкисляют 8%-ной серной кислотой и экстрагируют уксусным эфиром. Объединенные органические фазы экстрагируют встряхиванием с раствором хлорида натрия, сушат над сульфатом натрия и упаривают под вакуумом. Сырой продукт - 3,2 г - хроматографируют на силикагеле гексаном и метил-трет-бутиловым эфиром. Полярная фракция, равная 1,21 г, представляет собой 7-(5-хлорпентил)-16-фтор-17-метилэстра-1,3,5(10)-триен-3,17-диол,кристаллизующийся из диизопропилового эфира/гексана; температура плавления 70 С, []D22 = +7 40,8 мг 7-5-Хлорпентил)-16-фтор-17 метилэстра-1,3,5(10)-триен-3,17-диола растворяют в 0,5 мл диметилформамида и добавляют раствор из 58 мг 3-(N-метиламино)пропил 4,4,5,5,5-пентафторпентилсульфида и 13 мг иодида лития и нагревают в течение 17 ч до 100 С в атмосфере инертного газа. После охлаждения смесь смешивают с уксусным эфиром, последовательно экстрагируют встряхиванием с насыщенным раствором гидрокарбоната натрия и поваренной соли, сушат над сульфатом натрия и выпаривают растворитель под вакуумом. Остаток хроматографируют на силикагеле уксусным эфиром/метанолом. Выход: 25 мг 16-фтор 17-метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропилами-но]пентилэстра 1,3,5(10)-триен-3,17-диола в виде масла. Пример 16. 16-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]эстра-1,3,5(10)-триен-3,17 диол. В виде неполярного продукта, образовавшегося после хроматографии в примере 15 д),получают 7-(5-хлорпентил)-16-фтор-17 метилэстра-1,3,5(10)-триен-3,17-диол в количестве 0,48 г. Путем кристаллизации из диизопропилового эфира/гексана получают кристаллы с температурой плавления 65 С и []D22 =+5 (с = 0,5% в хлороформе). 41 мг указанного продукта подвергают превращению аналогично тому, как это описано в примере 15 е), и получают в результате 23 мг 16-фтор-17-метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диола. Пример 17. 16-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. Путем окисления периодатом натрия из 72 мг 16-фтор-17-метил-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диола получают аналогично тому, как это описано в примере 2, 38 мг 16-фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диола. Пример 18. 16-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. Аналогично тому, как описано в примере 15 е), 40,8 мг 7-(5-хлорпентил)-16-фтор-17 метилэстра-1,3,5(10)-триен-3,17-диола в диметилформамиде подвергают взаимодействию с 70 мг 4-(N-метиламино)пропил-4,4,5,5,5-пента 39 фторпентилсульфона. После переработки получают 21 мг 16-фтор-17-метил-7-[5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диола в виде масла. Пример 19. 16-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентил]эстра-1,3,5(10)-триен-3.17-диол. а) 7-(5-Хлорпентил)-16-фторэстра-1,3,5(10)-триен-3,17-диол и 7-(5-хлорпентил)16-фторэстра-1,3,5(10)-триен-3,17-диол. 392 мг 7-(5-хлорпентил)-16-фторэстра 1,3,5(10)-триен-3-ол-17-она, пример 15 г), растворяют в 2 мл безводного тетрагидрофурана и добавляют при охлаждении в ледяной бане 1,1 мл 1-молярного раствора три-третбутоксиалюмогидрида лития в тетрагидрофуране. После 30-минутного перемешивания при 0 С смешивают с водой и 8%-ной серной кислотой,инициируя слабокислую реакцию, и затем трижды экстрагируют уксусным эфиром. Органическую фазу промывают насыщенным раствором хлорида натрия, сушат над сульфатом натрия и упаривают досуха под вакуумом. Сырой продукт хроматографируют на силикагеле гексаном/уксусным эфиром и получают таким путем 118 мг 7-(5-хлорпентил)-16-фторэстра 1,3,5(10)-триен-3,17-диола и 138 мг 7-(5 хлорпентил)-16-фторэстра-1,3,5(10)-триен 3,17-диола, оба соединения в виде твердого пенистого вещества. б) 16-Фтор-7-5-[Н-метил-N-3-(4,4,5,5,5-пентафторпентил-тио)пропиламино]пентил эстра-1,3,5(10)-триен-3,17-диол. Взаимодействием 100 мг 7-(5-хлорпентил)-16-фторэстра-1,3,5(10)-триен-3,17-диола с 3-(N-метиламино)пропил-4,4,5,5,5-пентафторпентилсульфидом аналогично тому, как описано в примере 15 е), получают 83 мг 16-фтор-75-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропила-мино]пентилэстра-1,3,5(10)триен-3,17-диола в виде твердого пенистого вещества. Пример 20. 16-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10)-триен-3,17-диол. Аналогичным путем из 100 мг 7-(5 хлорпентил)-16-фторэстра-1,3,5(10)-триен 3,17-диола по такой же технологии получают 75 мг 16-фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества. Пример 21. 16-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. Путем окисления 85 мг 16-фтор-7-5[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио) пропиламино]пентил]эстра-1,3,5(10)-триен 001577 3,17-диола периодатом натрия аналогично тому, как описано в примере 17, получают 47 г 16-фтор-7-5-[N-метил-N-3-(4,4,5,5,5 пентафторпентилсульфинил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества. Пример 22. 16-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил]эстра-1,3,5(10)-триен-3,17-диол. Аналогично тому, как описано в примере 15 е), 65 мг 7-(5-хлорпентил)-16-фторэстра 1,3,5(10)-триен-3,17-диола подвергают взаимодействию с 90 мг 3-(N-метиламино)пропил 4,4,5,5,5-пентафторпентилсульфона и получают в результате 53 мг 16-фтор-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола в виде масла. Пример 23. 7-5-[N-Метил-N-3-(4,4,5,5,5 пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10),14-тетраен-3,17-диол. а) 7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-дион. В 34 мл абсолютного тетрагидрофурана 8,9 г магниевой стружки подвергают взаимодействию со 103 г 1-бром-5-трет-бутилдиметилсилилоксипентана, растворенных в 110 мл тетрагидрофурана, с получением реагента Гриньяра. К этому раствору при температуре в интервале от -70 до -65 С добавляют 2,5 г комплекса бромида меди (I) и диметилсульфида и смесь из 60 мл 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинона и 70 мл тетрагидрофурана, после чего полученную суспензию продолжают перемешивать еще в течение 30 мин при -70 С в атмосфере аргона. Затем при температуре в интервале от-70 до -65 С по каплям добавляют раствор из 50 г эстра-4,6-диен-3,17-диона [Steroids, том 1,1963, 233-249] в 730 мл абсолютного тетрагидрофурана и 62,7 мл хлортриметилсилана и смесь перемешивают в течение ночи при -70 С. С целью последующей переработки реакционную смесь при -15 С смешивают с 48 мл уксусного эфира и после 15-минутного перемешивания при этой температуре сливают в смесь из насыщенного раствора хлорида аммония и этилацетата. Органическую фазу отделяют и последовательно промывают насыщенным раствором хлорида аммония, насыщенным раствором гидрокарбоната натрия и в завершение насыщенным раствором поваренной соли до нейтрального состояния, затем сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле дихлорметаном/ацетоном. Таким путем получают 47 г 7-(5-трет-бутилдиметилсилилоксипентил)эстр-4-ен-3,17-диона в виде желтого масла; []D22 = +62,2 (с = 0,545% в хлороформе). б) 3-Гидрокси-7-(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-17-он.(10),15-тетраен-17-она. в) 3-Бензилокси-7-(5-гидроксипентил) эстра-1,3,5(10),15-тетраен-17-он. Раствор из 2,85 г 3-гидрокси-7-(5 гидроксипентил)эстра-1,3,5(10),15-тетраен-17 она в 57 мл ацетона смешивают с 3,25 г карбоната цезия и 1,14 мл бензилбромида и смесь нагревают в течение 1 ч с обратным холодильником, остаток смешивают с водой, экстрагируют встряхиванием с этилацетатом, органическую фазу сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 3,12 г 3-бензилокси-7-(5-гидроксипентил)эстра-1,3,5(10),15-тетраен-17-она в виде пенистого вещества. г) 17-ацетокси-7-(5-ацетоксипентил)-3 бензилоксиэстра-1,3,5(10),14,16-пентаен. Раствор из 6,12 г 3-бензилокси-7-(5 гидроксипентил)эстра-1,3,5(10),15-тетраен-17 она в 717 мл ацетангидрида перемешивают с 920 мг п-толуолсульфокислоты в течение 1 ч при комнатной температуре. Затем реакционную смесь по технологии, описанной в примере 1 к), перерабатывают и сырой продукт хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 4,6 г 17 ацетокси-7-(5-ацетоксипентил)-3-бензилоксиэстра-1,3,5(10),14,16-пентаена в виде масла. д) 7-(5-Ацетоксипентил)-3-бензилоксиэстра-1,3,5(10),14-тетраен-17-ол. К раствору из 4,58 г 17-ацетокси-7-(5 ацетоксипентил)-3-бензилоксиэстра-1,3,5(10),14,16-пентаена в 26,8 мл тетрагидрофурана и 161 мл этанола при комнатной температуре добавляют по каплям раствор из 1,25 г борогидрида натрия в 90 мл этанола и 18 мл воды и смесь перемешивают в течение 1 ч. Далее реакционную смесь смешивают с 4 мл уксусного эфира,концентрируют и остаток растворяют с помощью этилацетата. Органическую фазу промывают гидрокарбонатом натрия, сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 2,16 г 7-(5 ацетоксипентил)-3-бензилоксиэстра-1,3,5(10),14-тетраен-17-ола в виде пенистого вещества. е) 3-Бензилокси-7-(5-гидроксипентил) эстра-1,3,5(10),14-тетраен-17-ол. 2,16 г 7-(5-ацетоксипентил)-3-бензилоксиэстра-1,3,5(10),14-тетраен-17-ола омыляют в течение ночи при комнатной температуре 38 мл 1 н. метанольного раствора гидроксида калия. Затем реакционную смесь сливают в охлажденный льдом насыщенный раствор поваренной соли, осадок отфильтровывают с помощью вакуум-фильтра, растворяют с помощью дихлор 001577 42 метана, промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Таким путем получают 1,86 г 3 бензилокси-7-(5-гидроксипентил)эстра-1,3,5(10),14-тетраен-17-ола в виде пенистого вещества. ж) 3-Бензилокси-7-(5-тозилоксипентил) эстра-1,3,5(10),14-тетраен-17-ол. В условиях согласно примеру 1 п) 3,03 г 3 бензилокси-7-(5-гидроксипентил)эстра-1,3,5(10),14-тетраен-17-ола подвергают взаимодействию с 2,31 г ангидрида п-толуолсульфокислоты в 58 мл пиридина, перерабатывают и хроматографируют на силикагеле. Таким путем получают 3 г 3 -бензилокси-7-(5-тозилоксипентил)эстра-1,3,5(10),14-тетраен-17-ола в виде пенистого вещества. з) 3-Бензилокси-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил эстра-1,3,5(10),14-тетраен-17-ол. Раствор из 2 г 3-бензилокси-7-(5-тозилоксипентил)эстра-1,3,5(10),14-тетраен-17-ола в 28 мл этилметилкетона перемешивают с 1,77 гN-метил-3-(4,4,5,5,5-пентафторпентилтио)пропиламина в присутствии 950 мг карбоната калия и 230 мг иодида калия в течение 5 ч при температуре ванны 80 С. Затем реакционную смесь сливают в раствор поваренной соли, экстрагируют этилацетатом, промывают раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 1,93 г 3-бензилокси-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10),14-тетраен 17-ола в виде смолы; []D22 = +47,3 (с = 0,505% в хлороформе). и) 7-5-[N-Метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра 1,3,5(10),14-тетраен-3,17-диол. К раствору из 850 мг 3-бензилокси-7-5[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10),14 тетраен-17-ола в 10,2 мл толуола при комнатной температуре добавляют по каплям 10,2 мл 1,2-молярного раствора диизобутилалюмогидрида в толуоле и смесь нагревают в течение 5 ч при температуре ванны 120 С. Затем реакционную смесь при перемешивании и в атмосфере аргона добавляют по каплям к смеси из насыщенного раствора поваренной соли и 2 н. серной кислоты, трижды экстрагируют этилацетатом,органическую фазу дважды промывают 2 н. серной кислотой и трижды насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле гексаном/этилацетатом/0-30% метанолом. В результате получают 670 мг 7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)про 43 пиламино]пентилэстра-1,3,5(10),14-тетраен 3,17-диола в виде пенистого вещества; []D22 =+43 (с = 0,520% в хлороформе/метаноле). Пример 24. 7-5-[N-Метил-N-3-(4,4,5,5,5 пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10),14-тетраен-3,17-диол. В условиях, описанных в примере 2, 400 мг 7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил]эстра-1,3,5(10),14 тетраен-3,17-диола подвергают взаимодействию с 177 мг периодата натрия, перерабатывают и сырой продукт хроматографируют на силикагеле этилацетатом/метанолом. В результате получают 287 мг указанного в заголовке соединения в виде пенистого вещества; []D22 = +30,7(с = 0,530% в хлороформе/метаноле). Пример 25. 7-5-[N-Метил-N-3-(4,4,5,5,5 пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10),14-тетраен-3,17-диол. а) 3-Бензилокси-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил]эстра-1,3,5(10),14-тетраен-17-ол. В условиях согласно примеру 23 з) 1 г 3 бензилокси-7-(5-тозилоксипентил)эстра-1,3,5(10),14-тетраен-17-ола подвергают взаимодействию с 990 мг N-метил-3-(4,4,5,5,5-пентафторпентансульфонил)пролиламина, перерабатывают и сырой продукт хроматографируют на силикагеле этилацетатом/метанолом. Таким путем получают 960 мг 3-бензилокси-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентансульфонил) пропиламино]пентилэстра-1,3,5(10),14-тетраен 17-ола в виде масла; []D22 = +48,5 (с = 0,535% в хлороформе). б) 7-5-[N-Метил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентил эстра-1,3,5(10),14-тетраен-3,17-диол. Раствор из 100 мг 3-бензилокси-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10),14 тетраен-17-ола в 1 мл дихлорметана смешивают при охлаждении ледяной баней с 0,2 мл диметиланилина и 73 мг хлорида алюминия и перемешивают в течение 1 ч при этой температуре. Затем реакционную смесь сливают в 1 н. соляную кислоту, экстрагируют встряхиванием с этилацетатом, промывают раствором гидрокарбоната натрия и насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Сырой продукт хроматографируют на силикагеле дихлорметаном/0-30% метанола. Таким путем получают 74 мг указанного в заголовке соединения в виде пенистого вещества; []D22 = +36 (с = 0,525% в хлороформе/метаноле). Пример 26. 7-5-[(2S)-2-(4,4,5,5,5 Пентафторпентилтиометил)пирролидин-1-ил] пентилэстра-1,3,5(10)-триен-3,17-диол. а) 7-(5-Ацетоксипентил)-3-бензилоксиэстра-1,3,5(10)-триен-17-он Раствор из 6,5 г 7(5-ацетоксипентил)-3-гидроксиэстра-1,3,5(10)триен-17-она (пример 1 г) в 65 мл диметилформамида смешивают с 3,3 мл бензилхлорида, 8,7 г карбоната цезия и 400 мг иодида натрия и в течение ночи перемешивают при комнатной температуре. Затем реакционную смесь сливают в воду, экстрагируют встряхиванием с этилацетатом, органическую фазу промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 7,26 г 7-(5-ацетоксипентил)-3-бензилоксиэстра-1,3,5(10)-триен-17-она в 80 мл метанола и 3 мл тетрагидрофурана омыляют в течение ночи при комнатной температуре 22,2 мл 2 н. едкого натра. Затем реакционную смесь сливают в 2 н. соляную кислоту, экстрагируют встряхиванием с этилацетатом, органическую фазу промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Таким путем получают 6,7 г 3-бензилокси-7(5-гидроксипентил)эстра-1,3,5(10)-триен-17-она в виде пенистого вещества. в) 3-Бензилокси-7-(5-тозилоксипентил) эстра-1,3,5(10)-триен-17-он В условиях согласно примеру 1 п) 6,5 г 3-бензилокси-7-(5-гидроксипентил)эстра-1,3,5(10)-триен-17-она подвергают взаимодействию с 7,14 г ангидрида птолуолсульфокислоты, перерабатывают и хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 7,45 г 3 бензилокси-7-(5-тозилоксипентил) эстра-1,3,5[]D22 = +80,6 (с = 0,620% в хлороформе). г) 3-Бензилокси-7-5-[(2S)-2-(4,4,5,5,5 пентафторпентилтиометил)пирролидин-1-ил] пентилэстра-1,3,5(10)-триен-17-он. В условиях согласно примеру 23 з) 4,58 г 3 бензилокси-7-(5-тозилоксипентил)эстра-1,3,5(10)-триен-17-она подвергают взаимодействию с 3,17 г (2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидина, перерабатывают и сырой продукт хроматографируют на силикагеле гексаном/этилацетатом. Таким путем получают 3,9 г 3-бензилокси-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил эстра-1,3,5(10)-триен-17-она в виде масла; []D22= +32,5 (с = 0,117% в хлороформе). д) 3-Гидрокси-7-5-[(2S)-2-(4,4,5,5,5 пентафторпентилтиометил)пирролидин-1-ил] пентилэстра-1,3,5(10)-триен-17-он. В условиях согласно примеру 6 е) дебензилируют 2,05 г 3-бензилокси-7-5-[(2S)-2(4,4,5,5,5-пентафторпентилтиометил)пирроли 45 пентафторпентилтиометил)пирролидин-1 ил]пентилэстра-1,3,5(10)-триен-17-она. Таким путем получают 1,25 г 3-гидрокси-7-5-[(2S)2-(4,4,5,5,5-пентафторпентилтиометил) пирролидин-1-ил]пентилэстра-1,3,5(10)-триен-17-она в виде масла; []D22 = +22,7 (с = 0,475% в хлороформе). е) 7-5-[(2S)-2-(4,4,5,5,5-Пентафторпентилтиометил)пирролидин-1-ил]пентилэстра 1,3,5(10)-триен-3,17-диол. В условиях согласно примеру 8 500 мг 3 гидрокси-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра 1,3,5(10)-триен-17-она восстанавливают с помощью 100 мг борогидрида натрия. В результате получают 325 мг указанного в заголовке соединения в виде масла; []D22 = -8,7 (c = 0,510% в метаноле). Пример 27. 7-5-[(2R)-2-(4,4,5,5,5-Пентафторпентилтиометил)пирролидин-1-ил]пентил эстра-1,3,5(10)-триен-3,17-диол. Аналогичным путем, как это описано в примере 26 г), из 2,3 г 3-бензилокси-7-(5 тозилоксипентил)эстра-1,3,5(10)-триен-17-она(10)-триен-3,17-диол. Суспензию из 5,21 г безводного хлорида церия (III) в 53,2 мл тетрагидрофурана перемешивают в течение 2 часов при комнатной температуре, затем при 0 С добавляют ее по каплям к 7 мл раствора метилмагнийбромида (3 М в диэтиловом эфире) и смесь перемешивают в течение 30 мин при 0 С и в течение 15 мин при комнатной температуре. Далее добавляют раствор из 1 г 7-(5-хлорпентил)-3-гидроксиэстра 1,3,5(10)-триен-17-она (пример 15 б) в 24 мл тетрагидрофурана и продолжают перемешивание еще в течение 30 мин при комнатной температуре. Затем реакционную смесь сливают на охлажденный льдом насыщенный раствор хлорида аммония, экстрагируют встряхиванием с этилацетатом, органическую фазу сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле гексаном/ этилацетатом. Таким путем получают 753 мг 7-(5 хлорпентил)-17-метилэстра-1,3,5(10)-триен 3,17-диола в виде пенистого вещества; []D22 = 46 с 5,6 г иодида натрия и в течение 17 ч нагревают при температуре ванны 80 С. Затем реакционную смесь сливают в воду, экстрагируют встряхиванием с этилацетатом. органическую фазу промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Таким путем получают 834 мг 7-(5 иодпентил)-17-метилэстра-1,3,5(10)-триен 3,17-диола в виде пенистого вещества; []D22 =(2S)-2-(4,4,5,5,5-пентафторпентилтиометил) пирролидина в 8 мл N-метил-2-пирролидинона нагревают в течение 4 ч до температуры ванны 80 С. Затем охлажденную реакционную смесь сливают в насыщенный раствор гидрокарбоната натрия, экстрагируют встряхиванием с этилацетатом, органическую фазу промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и концентрируют. Остаток хроматографируют на силикагеле дихлорметаном/этилацетатом. В результате получают 413 мг указанного в заголовке соединения в виде пенистого вещества; []D22 = -25,8 (с = 0,500% в хлороформе). Пример 29. 11-Фтор-7-5-[2-(4,4,5,5,5 пентафторпентилтиометил)пирролидин-1-ил] пентилэстра-1,3,5(10)-триен-3,1-диол. а) 7-(5-Хлорпентил)-11-фторэстр-4-ен 3,17-дион Раствор из 78,7 г 11-фтор-7-(5 гидроксипентил)эстр-4-ен-3,17-диона (пример 12 д) в 1,4 л тетрахлорметана и 475 мл ацетонитрила перемешивают с 71 г трифенилфосфина в течение 8,5 ч при комнатной температуре. Затем экстрагируют водой, водным раствором гидрокарбоната натрия и поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. Таким путем получают 48,0 г 7-(5-хлорпентил)-11-фторэстр-4-ен 3,17-диона в виде кристаллов с температурой плавления 51-53 С; []D22 = +78,5 (с = 0,5% в хлороформе). б) 7-(5-Хлорпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-он. К раствору из 47 г 7-(5-хлорпентил)-11 фторэстр-4-ен-3,17-диона в 470 мл ацетонитрила при температуре ванны 80 С добавляют по каплям раствор из 10,34 г бромида лития и 53,2 г бромида меди (II) в 280 мл ацетонитрила. После добавления 20 мл выдерживают некоторое время до обесцвечивания раствора, после чего остаток раствора добавляют в течение 12 мин и продолжают далее перемешивание еще в течение 5 мин при температуре ванны 80 С. Затем охлаждают до 0 С, смешивают с раствором гидрокарбоната натрия, сливают на воду, четыреж 47 ды экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле гексаном/уксусным эфиром. Таким путем получают 25,3 г 7-(5-хлорпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она; []D22 = +115,4 (с= 0,5% в хлороформе). в) 11-Фтор-3-гидрокси-7-5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1 ил]пентилэстра-1,3,5(10)-триен-17-он. Раствор из 785,9 мг 7-(5-хлорпентил)11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17 она в 7 мл N-метил-2-пирролидинона смешивают с 535,5 мг иодида лития и 520 мг (2S)-2(4,4,5,5,5-пентафторпентилтиометил)пирролидина и перемешивают в течение 2,5 ч при температуре ванны 100 С. Затем сливают на воду,трижды экстрагируют диэтиловым эфиром,промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. Таким путем получают 525 мг чистого 11-фтор-3-гидрокси-7-5[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)-триен-17 она; []D22 = +29,3 (с = 0,5% в хлороформе). г) 11-фтор-7-[5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил]эстра-1,3,5(10)-триен-3,17-диол. 500 мг 11-фтор-3-гидрокси-7-5-[2(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)-триен-17-она растворяют в 5 мл тетрагидрофурана, 2,75 мл этанола и 1,1 мл воды и добавляют при температуре ванны 0 С 100 мг борогидрида натрия и перемешивают в течение 0,5 ч при комнатной температуре. Затем сливают на воду, трижды экстрагируют уксусным эфиром, промывают насыщенным раствором поваренной соли до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 441,3 мг 11-фтор-7-5-[2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)-триен. 6,28 г 7-(9-[4,4,5,5,5-пентафторпентансульфинил]нонил)эстра-1,3,5(10)-триен-3,17 диола растворяют в 30 мл пиридина, смешивают при охлаждении водой с 15 мл ангидрида уксусной кислоты, после чего оставляют на 5 ч 48 для перемешивания при комнатной температуре. В целях последующей переработки реакционный раствор сливают на ледяную воду, диацетат экстрагируют уксусным эфиром, органическую фазу промывают разбавленной серной кислотой, водой, насыщенным раствором поваренной соли и сушат над сульфатом натрия. В качестве сырого продукта получают масло, которое растворяют с помощью 100 мл уксусной кислоты и смешивают с 15 г пербората натрия. После 5-часового перемешивания при комнатной температуре превращение полностью завершается. Далее реакционную смесь сливают на ледяную воду и затем экстрагируют уксусным эфиром. Из органической фазы с помощью водного раствора бикарбоната удаляют остатки кислоты. После сушки над сульфатом натрия фильтруют, концентрируют и хроматографируют на силикагеле (гексан/уксусный эфир, 7:3). Таким путем получают 6,83 г требуемого продукта в виде пенистого вещества. б) 3,17-Диацетилокси-11-нитроокси-7(9-[4,4,5,5,5-пентафторпентансульфонил]нонил) эстра-1,3,5(10)-триен-9-ол. К раствору из 3,0 г 3,17-диацетилокси 7-(9-[4,4,5,5,5-пентафторпентансульфонил] нонил)эстра-1,3,5(10)-триена в 50 мл водной уксусной кислоты (90%-ной) добавляют 18,6 г аммонийнитрат церия и перемешивают в течение 4 ч при комнатной температуре. Для последующей переработки реакционную смесь сливают на ледяную воду, экстрагируют уксусным эфиром и органическую фазу промывают водным раствором бикарбоната до нейтрального состояния. Затем промывают насыщенным раствором поваренной соли и сушат над сульфатом натрия. Сырой продукт хроматографируют на силикагеле (гексан/уксусный эфир, 7:3). Таким путем получают 2,0 г требуемого продукта в виде окрашенного в желтый цвет пенистого вещества. в) 3,17-Диацетилокси-11-нитроокси-7(9-[4,4,5,5,5-пентафторпентансульфонил]нонил) эстра-1,3,5(10)-триен. Для восстановительного удаления 9 гидроксигруппы в 3,17-диацетилокси-11 нитроокси-7-(9-[4,4,5,5,5-пентафторпентансульфонил]нонил)эстра-1,3,5(10)-триен-9-ола растворяют 2,0 г исходного материала в 25 мл дихлорметана, охлаждают до -15 С и последовательно смешивают с 15 мл триэтилсилана и 2,2 мл эфирата трифторида бора. После перемешивания в течение 1 ч при -15 С охлажденную ванну удаляют и дают смеси нагреться до комнатной температуры до ее оттаивания. Для последующей переработки сливают на ледяную воду, экстрагируют дихлорметаном, органическую фазу промывают водным раствором бикарбоната, насыщенным раствором поваренной соли и сушат над сульфатом натрия. Сырой продукт хроматографируют на силикагеле (гек 49 сан/уксусный эфир, 9:1), выход 1,3 г пенистого вещества. г) 11-Нитроокси-7-(9-[4,4,5,5,5-пентафторпентансульфонил]нонил)эстра-1,3,5(10)триен-3,17-диол. Для омыления растворяют 1,0 г 3,17 диацетилокси-11-нитроокси-7-(9-[4,4,5,5,5 пентафторпентансульфонил]нонил)эстра-1,3,5(10)-триена в 50 мл метанола, смешивают с 20 мл 3%-ного едкого калия в метаноле и выдерживают в течение 4 ч при комнатной температуре. Затем реакционную смесь сливают при перемешивании в лимонно-кислую ледяную воду и затем экстрагируют уксусным эфиром. После промывки органической фазы водой и насыщенным раствором поваренной соли сушат над сульфатом натрия. Сырой продукт хроматографируют на силикагеле (гексан/уксусный эфир, градиент до 3:2), выход 0,53 г в виде масла. Пример 31. 11-Фтор-17-метил-7-5[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил) пирролидин-1-ил]пентилэстра-1,3,5(10)-триен 3,17-диол. а) 7-(5-Хлорпентил)-11-фтор-17 метилэстра-1,3,5(10)-триен-3,17-диол. В условиях согласно примеру 28 а) 750 мг 7-(5-хлорпентил)-11-фтор-3-гидроксиэстра 1,3,5(10)-триен-17-она (пример 296) подвергают взаимодействию с 4,9 мл раствора метилмагнийбромида (3 М в диэтиловом эфире), затем перерабатывают и хроматографируют. Таким путем получают 561 мг 7-(5-хлорпентил)-11 фтор-17-метилэстра-1,3,5(10)-триен-3,17 диола в виде пенистого вещества; []D22 =+51,6 (с = 0,515% в хлороформе). б) 11-Фтор-17-метил-7-5-[(2S)-2(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра-1,3,5(10)-триен-3,17 диол. В условиях согласно примеру 15 е) 408 мг 7-(5-хлорпентил)-11-фтор-17-метилэстра 1,3,5(10)-триен-3,17-диола в 5 мл N-мeтил-2 пирролидинона в присутствии 130 мг иодида лития подвергают взаимодействию с 606 мг= -5,8 (с = 0,535% в хлороформе). Пример 32. 11-Фтор-17-метил-7-5[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентил]эстра-1,3,5(10)триен-3,17-диол. В условиях согласно примеру 13 260 мг 11-фтор-17-метил-7-5-[(2S)-2-(4,4,5,5,5 пентафторпентилтиометил)пирролидин-1 ил]пентил]эстра-1,3,5(10)-триен-3,17-диола 50 151 мг периодата натрия, затем перерабатывают и хроматографируют. В результате получают 129 мг указанного в заголовке соединения в виде масла. Пример 33. 3,17-Диацетокси-11-фтор 17-метил-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентансульфонилметил)пирролидин-1-ил]пентилэстра-1,3,5(10)-триен. В условиях согласно примеру 3 65 мг 11 фтор-17-метил-7-5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентил эстра-1,3,5(10)-триен-3,17-диола (пример 31 б) ацетилируют ацетангидридом и сырой продукт аналогично тому, как описано в примере 4,окисляют перборатом натрия, тетрагидратом,затем перерабатывают и хроматографируют. В результате получают 27 мг указанного в заголовке соединения в виде масла. Пример 34. 7-5-[(2S)-2-(4,4,5,5,5 Пентафторпентансульфинилметил)пирролидин 1-ил]пентилэстра-1,3,5(10)-триен-3,17-диол. Путем окисления периодатом натрия аналогично тому, как это описано в примере 2, из 152 мг 7-5-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил)пирролидин-1-ил]пентилэстра 1,3,5(10)-триен-3,17-диола (пример 26 е) получают 66 мг указанного в заголовке соединения в виде масла; []D22 = +11,8 (с = 0,53% в метаноле). Пример 35. 7-5-[(2S)-2-(4,4,5,5,5-Пентафторпентансульфонилметил)пирролидин-1 ил]пентилэстра-1,3,5(10)-триен-3,17-диол. В условиях согласно примеру 3 76 мг 75-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил) пирролидин-1-ил]пентилэстра-1,3,5(10)-триен 3,17-диола (пример 26 е) ацетилируют ацетангидридом и сырой продукт аналогично тому,как это описано в примере 4, окисляют перборатом натрия, тетрагидратом, затем перерабатывают и хроматографируют. В результате получают 31 мг указанного в заголовке соединения в виде масла; []D22 = +30,6 (с = 0,515% в метаноле). Пример 36. 11-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диол. а) 11-Фтор-3-гидрокси-17-метил-7-5[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио) пропиламино]пентилэстра-1,3,5(10)-триен-17 он. Раствор из 2,0 г 11-фтор-7-[5-[N-метилN-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-она в 20 мл метанола и 2 мл воды перемешивают при комнатной температуре с 1,2 г щавелевой кислоты. По истечении 2,5 ч сливают на ледяную воду, экстрагируют дихлорметаном, промывают насыщенным раствором поваренной соли, сушат над сульфатом на 51 трия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/ метанолом. Таким путем получают 1,2 г 11-фтор-3 гидрокси-17-метил-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентил-тио)пропиламино] пентилэстра-1,3,5(10)-триен-17-она в виде пенистого вещества; []D22 = +69 (с = 0,5% в хлороформе). б) 11-Фтор-17-метил-7-[5-[N-метил-N3-(4,4,5,5,5-пентафторпентилтио)пропиламино] пентилэстра-1,3,5(10) -триен-3,17-диол. К 5 г 11-фтор-3-гидрокси-17-метил-75-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен 17-она в 150 мл тетрагидрофурана по каплям добавляют при комнатной температуре 33 мл 1,6-молярного эфирного раствора метилата лития. По истечении 2,5 ч добавляют при охлаждени льдом насыщенный раствор хлорида аммония, экстрагируют уксусным эфиром, промывают насыщенным раствором поваренной соли,сушат над сульфатом натрия и концентрируют под вакуумом. После хроматографии на силикагеле, содержащем 2% триэтиламина, дихлорметаном/метанолом получают 2,0 г 11-фтор-17 метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диола в виде кристаллов с температурой плавления 83 С. Пример 37. 11-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. Раствор из 500 мг 11-фтор-17-метил-75-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диола в 20 мл метанола и 0,9 мл воды перемешивают при комнатной температуре с 355 мг периодата натрия в течение 3 ч. Затем сливают на ледяную воду, экстрагируют дихлорметаном, промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия,концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 216 мг 11-фтор-17 метил-7-5-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]пентилэстра 1,3,5(10)-триен-3,17-диола в виде кристаллов с температурой плавления 83,4 С. Пример 38. 11-Фтор-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен 3,17-диол. а) 11-Фтор-3-гидрокси-17-метил-7-5[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфо 001577 52 нил)пропиламино]пентилэстра-1,3,5(10)-триен 17-он. Раствор из 3 г 7-(5-хлорпентил)-11 фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она в 50 мл диметилформамида перемешивают в течение 22 ч при 100 С с 1,6 г иодида лития и с 6,2 г метил [3-(4,4,5,5,5-пентафторпентансульфонил)пропил]амина. Затем экстрагируют уксусным эфиром, промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/ метанолом. Таким путем получают 4,5 г 11 фтор-3-гидрокси-17-метил-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-17-она в виде пенистого вещества. б) 11-Фтор-17-метил-7-5-[N-метил-N3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. Суспензию из 11,4 г безводного хлорида церия (III) в 120 мл тетрагидрофурана перемешивают в течение 2 ч при комнатной температуре в атмосфере азота, затем при 0 С по каплям смешивают с 17,5 мл 3-молярного эфирного раствора метилмагнийбромида, перемешивают в течение 30 мин, добавляют раствор из 3,5 г 11-фтор-3-гидрокси-17-метил-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен 17-она в 24 мл тетрагидрофурана и продолжают перемешивание еще в течение 30 мин. Затем добавляют насыщенный раствор хлорида аммония, разбавляют уксусным эфиром, промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 2,2 г 11-фтор-17-метил-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентансульфонил)пропиламино]пентилэстра-1,3,5(10)-триен-3,17 диола в виде кристаллов с температурой плавления 82,5 С. Пример 39. 11-Фтор-7-5-[N-метил-N-2(4,4,5,5,5-пентафторпентансульфонил)этиламино]пентилэстра-1,3,5(10)-триен-3,17-диол. а) 7-(5-Бромпентил)-11-фторэстр-4-ен 3,17-дион. Раствор из 33 г 11-фтор-7-(5 гидроксипентил)эстр-4-ен-3,17-диона в 330 мл дихлорметана смешивают при -5 С с 28,9 г трифенилфосфина и 36,7 г тетрабромметана и перемешивают в течение 0,5 ч. Затем добавляют дихлорметан и промывают водой, насыщенным раствором гидрокарбоната натрия и раствором поваренной соли. Органическую фазу сушат над сульфатом натрия и концентрируют под вакуумом. Затем сырой продукт хроматографируют на силикагеле градиентом гексан-уксусный эфир. Таким путем получают 28,5 г 7-(5 53 бромпентил)-11-фторэстр-4-ен-3,17-диона с температурой плавления 75-76 С. б) 7-(5-бромпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-он. К 27,8 г 7-(5-бромпентил)-11-фторэстр 4-ен-3,17-диона в 190 мл ацетонитрила при 80 С добавляют 17,0 г бромида меди (II). По истечении 8 ч реакционную смесь сливают при перемешивании в воду, трижды экстрагируют уксусным эфиром, дважды промывают хлоридом аммония, гидрокарбонатом натрия и поваренной солью, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 20,4 г 7-(5-бромпентил)-11-фтор-3 гидроксиэстра-1,3,5(10)-триен-17-она в виде бесцветных кристаллов с температурой плавления 178 С. в) 7-(5-Бромпентил)-11-фторэстра-1,3,5(10)-триен-3,17-диол. Раствор из 16,2 г 7-(5-бромпентил)-11 фтор-3-гидроксиэстра-1,3,5 (10)-триен-17-она в 162 мл тетрагидрофурана, а также 90 мл этанола и 36 мл воды порциями смешивают при 0 С с 4,7 г борогидрида натрия и перемешивают в течение 2 ч при 0 С. Затем сливают на воду,четырежды экстрагируют уксусным эфиром,промывают водой и раствором поваренной соли,сушат над сульфатом натрия и концентрируют под вакуумом. Таким путем получают 17,1 г сырого продукта. После хроматографии на силикагеле гексаном/уксусным эфиром получают 15,6 г чистого 7-(5-бромпентил)-11-фторэстра-1,3,5(10)-триен-3,17-диола. г) 11-Фтор-7-[5-(метиламино)пентил] эстра-1,3,5(10)-триен-3,17-диол. Раствор из 2 г 7-(5-бромпентил)-11 фторэстра-1,3,5(10)-триен-3,17-диола в 20 мл диметилформамида перемешивают с 8 мл 40%ного водного раствора метиламина в течение 3,5 ч при 80 С. Затем сливают на воду, трижды экстрагируют уксусным эфиром, промывают водой и раствором поваренной соли, сушат над сульфатом натрия и концентрируют под вакуумом. Таким путем получают 1,77 г 11-фтор-7-[5(метиламино)пентил]эстра-1,3,5(10)-триен-3,17-диола. д) 11-фтор-7-5-[N-метил-N-2-(4,4,5,5,5 пентафторпентансульфонил)этиламино]пентил эстра-1,3,5(10)-триен-3,17-диол. Раствор из 440 мг 11-фтор-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-3,17-диола в 15 мл метанола перемешивают с 500 мг 4,4,5,5,5-пентафторпентилвинилсульфона в течение 1 ч при 90 С. Затем сливают на воду,трижды экстрагируют уксусным эфиром, промывают водой и раствором поваренной соли,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/метанолом. В результате получают 488 мг 11-фтор-7-5-[N-метил-N-2(4,4,5,5,5 пентафторпентансульфонил)этиламино] пентилэстра-1,3,5(10)-триен-3,17-диола в виде кристаллов с температурой плавления 74-76 С. Промежуточный продукт 12 л) после удаления защитной группы обладает сильным антиэстрогенным действием. Пример 40. 11-Фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)-пропиламино] пентил-3-гидроксиэстра-1,3,5(10)-триен-17-он. Раствор из 1,6 г 11-фтор-7-5-[N-метилN-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-(тетрагидропиран-2-илокси)эстра 1,3,5(10)-триен-17-она в 20 мл метанола и 2 мл воды перемешивают с 1,0 г щавелевой кислоты. По истечении 3 ч реакционную смесь сливают в ледяную воду. Далее экстрагируют метиленхлоридом, промывают насыщенным раствором хлорида натрия, сушат и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид-метанол получают 1,1 г 11-фтор-7-5-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]пентил-3-гидроксиэстра-1,3,5(10)триен-17-она; []D22 = +69 (с = 0,5% в хлороформе). Пример 41. 11-Фтор-7-6-[N-метил-N-3(4,4,5,5,5-пентафторпентилтио)-пропиламино] гексилэстра-1,3,5(10)-триен-3,17-диол. а) 7-(6-Хлоргексил)-11-фторэстр-4-ен 3,17-дион. К суспензии из 6,8 г магниевой стружки в 100 мл ТГФ в атмосфере азота добавляют сначала 30 мл раствора из 41 мл 1-бром-6 хлоргексана в 270 мл ТГФ. После начала реакции остальное количество раствора добавляют по каплям таким образом, чтобы внутренняя температура не превышала 35 С. Во вторую колбу к суспензии из 26,4 г иодида меди (I) в 120 мл ТГФ при 0 С добавляют 48,1 г бромида лития и при этом внутренняя температура повышается до 40 С. Затем без охлаждения добавляют 46,4 мл 1,3-диметил-3,4,5,6-тетрагидро(1 Н)-пиримидин-2-она и перемешивают в течение 30 мин при 40 С. Таким путем получают прозрачный раствор, который по каплям добавляют к охлажденному до -40 С раствору Гриньяра. Далее перемешивают в течение 30 мин при-30 С и при -50 С смешивают по каплям с раствором из 23,5 г 11-фторэстра-4,6-диен-3,17 диона в 230 мл ТГФ, 24,6 мл 1,3-диметил 3,4,5,6-тетрагидро-(1 Н)-пиримидин-2-она и 55 мл триметилхлорсилана таким образом, чтобы внутренняя температура не превышала -40 С. В течение 1 ч перемешивают на холоду, затем по каплям добавляют 32 мл ледяной уксусной кислоты, охлаждающую баню удаляют и продолжают перемешивание в течение 1 ч при комнатной температуре. Для дальнейшей переработки реакционную смесь сливают на 1,5 л воды, раз 55 бавляют таким же количеством уксусного эфира, осадок отделяют с помощью броунмиллерита, промывают уксусным эфиром, водную фазу трижды экстрагируют уксусным эфиром, промывают раствором гидрокарбоната натрия и раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 25,2 г 7-(6-хлоргексил)-11-фторэстр-4 ен-3,17-диона. б) 7-(6-Хлоргексил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-он. К 25,2 г 7-(6-хлоргексил)-11-фторэстр 4-ен-3,17-диона в 175 мл безводного ацетонитрила при 80 С добавляют 28,1 г бромида меди(II) и 5,4 г бромида лития в 105 мл безводного ацетонитрила. По истечении 15 мин реакционную смесь охлаждают до 0 С и по каплям добавляют 250 мл насыщенного раствора гидрокарбоната натрия. Затем этот раствор сливают при перемешивании в 1 л воды, 2 н. соляной кислотой устанавливают на рН 6, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 5,7 г 7-(6-хлоргексил)-11-фтор-3-гидроксиэстра 1,3,5(10)-триен-17-она в виде пенистого вещества. в) 11-Фтор-3-гидрокси-7-(6-иодгексил) эстра-1,3,5(10)-триен-17-он. 2,7 г 7-(6-хлоргексил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 40 мл этилметилкетона, смешивают с 3,0 г иодида натрия и в течение ночи перемешивают при температуре ванны 90 С. Для последующей переработки реакционную смесь охлаждают до комнатной температуры, сливают при перемешивании в воду, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 3,4 г 11-фтор-3-гидрокси-7-(6-иодгексил) эстра-1,3,5(10)-триен-17-она в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. г) 11-Фтор-3-гидрокси-7-6-[N-метил-N3-(4,4,5,5,5-пентафторпентилтио)пропиламино] гексилэстра-1,3,5(10)-триен-17-он. 2,5 г 11-фтор-3-гидрокси-7-(6-иодгексил)эстра-1,3,5(10)-триен-17-она в 20 мл безводного ДМФ перемешивают при температуре ванны 100 С с 2,0 г метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]амина. По истечении 2 ч реакционную смесь сливают в полунасыщенный раствор гидрокарбоната натрия, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. Остаток хроматографируют на силикагеле градиен 001577 56 том метиленхлорид-метанол. Таким путем получают 3,15 г 11-фтор-3-гидрокси-7-6-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]гексилэстра-1,3,5(10)-триен-17 она в виде пенистого вещества. д) 11-Фтор-7-6-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)-пропиламино]гексил] эстра-1,3,5(10)-триен-3,17-диол. 250 мг 11-фтор-3-гидрокси-7-6-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]гексилэстра-1,3,5(10)-триен-17-она растворяют в 4,5 мл метанола и при 0 С смешивают порциями с 60 мг борогидрида натрия. После перемешивания в течение 3 ч при комнатной температуре растворитель удаляют под вакуумом, остаток смешивают с насыщенным раствором поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии на силикагеле градиентом метиленхлорид-метанол получают 165 мг 11-фтор 7-6-[N-метил-N-3-(4,4,5,5,5-пентафторпентилтио)пропиламино]гексилэстра-1,3,5(10)-триен 3,17-диола в виде пенистого вещества; []D =+37 (с = 1,01 в хлороформе). Пример 42. 11-Фтор-7-6-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфинил)пропиламино]гексилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-6-[N-метилN-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]гексилэстра-1,3,5(10)-триен-17-он. 500 мг 11-Фтор-3-гидрокси-7-6-[Nметил-N-3-(4,4,5,5,5-пентафторпентилтио) пропиламино]гексилэстра-1,3,5(10)-триен-17-она растворяют в 17 мл метанола и 3,3 мл воды, затем смешивают с 262 мг периодата натрия и перемешивают в течение 2 ч при комнатной температуре. Для последующей переработки реакционную смесь смешивают с полунасыщенным раствором поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. Остаток очищают на силикагеле градиентом метиленхлорид-метанол и выделяют 149 мг 11-фтор-3-гидрокси-7-6-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфинил)пропиламино]гексилэстра-1,3,5(10)-триен-17-она в виде пенистого вещества; []D = +45 (с = 1,015 в хлороформе). б) 11-Фтор-7-6-[N-метил-N-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино] гексилэстра-1,3,5(10)-триен-3,17-диол. 149 мг 11 р-фтор-3-гидрокси-7 сс-[6-[Мметил-М-3-(4,4,5,5,5-пентафторпентансульфинил)пропиламино]гексилэстра-1,3,5(10)-триен 17-она растворяют в 3 мл метанола и порциями смешивают с 35 мг борогидрида натрия. После перемешивания в течение 30 мин при комнатной температуре растворитель удаляют под вакуумом, остаток смешивают с водой, трижды 57 экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной тонкослойной хроматографии с использованием в качестве элюента метиленхлорид/метанол в соотношении 9:1 получают 109 мг 11-фтор-7-6-[N-метил-N-3(4,4,5,5,5-пентафторпентансульфинил)пропиламино]гексилэстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества; []D = +24 (с = 0,51 в хлороформе). Пример 43. 11-Фтор-7-(5-N-3-(фуран 2-илметилтио)пропил]-N-метиламинопентил) эстра-1,3,5(10)-триен-3,17-диол. а) 7-(5-Хлорпентил)-11-фторэстр-4-ен 3,17-дион. К суспензии из 7,2 г магниевой стружки в 100 мл ТГФ в атмосфере азота добавляют сначала 20% раствора из 39 мл 1-бром-5 хлорпентана в 300 мл ТГФ. После начала реакции, которую можно инициировать добавлением иода и дибромметана, остальное количество раствора добавляют по каплям таким образом,чтобы внутренняя температура не превышала 35 С. Во второй колбе к суспензии из 28,1 г иодида меди (I) в 130 мл ТГФ при 0 С добавляют 51,2 г бромида лития и при этом внутренняя температура повышается до 40 С. Затем без охлаждения добавляют 49,4 мл 1,3-диметил 3,4,5,6-тетрагидро-(1 Н)-пиримидин-2-она и перемешивают в течение 15 мин при 40 С. В результате получают прозрачный раствор, который по каплям добавляют к охлажденному до 50 С раствору Гриньяра. Затем перемешивают в течение 15 мин при -30 С и при -70 С по каплям смешивают с раствором из 25 г 11-фторэстра 4,6-диен-3,17-диона в 260 мл ТГФ, 26 мл 1,3 диметил-3,4,5,6-тетрагидро-(1 Н)-пиримидин-2 она и 59 мл триметилхлорсилана таким образом,чтобы внутренняя температура не превышала 65 С. Далее перемешивают в течение 30 мин на холоду, после чего добавляют по каплям 34,7 мл ледяной уксусной кислоты, охлаждающую баню удаляют и продолжают перемешивание еще в течение 1 часа при комнатной температуре. Для последующей переработки реакционную смесь сливают на 1,5 л воды, разбавляют таким же количеством уксусного эфира, осадок отделяют с помощью броунмиллерита, промывают уксусным эфиром, водную фазу трижды экстрагируют уксусным эфиром, промывают раствором гидрокарбоната натрия и раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 22,1 г 7-(5 хлорпентил)-11-фторэстр-4-ен-3,17-диона. б) 7-(5-Хлорпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-он. К 22,1 г 7-(5-хлорпентил)-11-фторэстр 4-ен-3,17-диона в 160 мл безводного ацетонитрила добавляют при 80 С 25,4 г бромида меди(II) и 4,9 г бромида лития в 95 мл безводного ацетонитрила. По истечении 20 мин реакционную смесь охлаждают до 0 С и добавляют по каплям 200 мл насыщенного раствора гидрокарбоната натрия. Затем раствор сливают при перемешивании в 750 мл воды, 2 н. соляной кислотой устанавливают на рН 6, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом гексан-уксусный эфир получают 14,7 г 7-(5-хлорпентил)-11-фтор-3-гидроксиэстра 1,3,5(10)-триен-17-она. в) 11-Фтор-3-гидрокси-7-(5-иодпентил) эстра-1,3,5(10)-триен-17-он. 5,0 г 7-(5-хлорпентил)-11-фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она растворяют в 80 мл этилметилкетона, смешивают с 5,7 г иодида натрия и перемешивают в течение ночи при температуре ванны 90 С. Для последующей переработки реакционную смесь охлаждают до комнатной температуры, сливают при перемешивании в воду, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 6,8 г 11-фтор-3-гидрокси-7-(5-иодпентил) эстра-1,3,5(10)-триен-17-она в виде сырого продукта, который без дальнейшей очистки используют на последующей стадии. г) 11-Фтор-3-гидрокси-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-17-он. В раствор из 6,8 г 11-фтор-3-гидрокси 7-(5-иодпентил)эстра-1,3,5(10)-триен-17-она в 35 мл безводного тетрагидрофурана при -78 С вводят 5,1 г метиламина и перемешивают в течение ночи при комнатной температуре в реакторе, работающем под давлением. После открытия реактора при -20 С смеси дают нагреться до комнатной температуры с целью обеспечить испарение избыточного метиламина. Затем реакционный раствор сливают в насыщенный раствор гидрокарбоната натрия, трижды экстрагируют уксусным эфиром, сушат над сульфатом магния и концентрируют под вакуумом. Таким путем получают 6,7 г 11-фтор-3-гидрокси-7[5-(метиламино)пентил]эстра-1,3,5(10)-триен 17-она в виде сырого продукта. д) 11-Фтор-7-(5-[N-3-(фуран-2-илметилтио)пропил]-N-метиламинопентил)-3-гидроксиэстра-1,3,5(10)-триен-17-он. 526 мг 11-фтор-3-гидрокси-7-[5(метиламино)пентил]эстра-1,3,5(10)-триен-17 она и 95 мг 2-(3-хлорпропилтиометил)фурана растворяют в 5 мл этилметилкетона, смешивают со 112 мг иодида натрия и 104 мг карбоната калия и перемешивают в течение 3 ч при температуре ванны 90 С. Для дальнейшей переработки реакционную смесь сливают в полунасыщенный раствор гидрокарбоната натрия, трижды экстра 59 гируют метиленхлоридом, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид-метанол получают 229 г 11-фтор-7-(5-[N-3-(фуран-2-илметилтио)пропил]-N-метиламинопентил)-3-гидроксиэстра-1,3,5(10)-триен-17-она в виде пенистого вещества. е) 11-Фтор-7-(5-[N-3-(фуран-2-илметилтио)пропил]-N-метиламинопентил)эстра 1,3,5(10)-триен-3,17-диол. 217 мг 11-фтор-7-(5-[N-3-(фуран-2 илметилтио)пропил]-N-метиламинопентил)-Згидроксиэстра-1,3,5(10)-триен-17-она растворяют в 6 мл метанола и порциями смешивают с 44 мг борогидрида натрия. После перемешивания в течение 2 ч при комнатной температуре растворитель удаляют под вакуумом, остаток смешивают с раствором поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной хроматографии на колонке градиентом метиленхлорид-метанол получают 146 мг 11-фтор-7-(5-[N-3-(фуран-2 илметилтио)пропил]-N-метиламинопентил)эстра-1,3,5(10)-триен-3,17-диола в виде пенистого вещества. Пример 44. 11-Фтор-7-(5-N-метил-[N3-(тиофен-2-илметилтио)пропил]аминопентил) эстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-(5-N-метил[N-3-(тиофен-2-илметилтио)пропил]амино пентил)эстра-1,3,5(10)-триен-17-он. 526 мг 11-фтор-3-гидрокси-7-[5-(метиламино)пентил]эстра-1,3,5(10)-триен-17-она и 103 мг 2-(3-хлорпропилтиометил)тиофена растворяют в 5 мл этилметилкетона, смешивают со 112 мг иодида натрия и 104 мг карбоната калия и перемешивают в течение 4,5 ч при температуре ванны 90 С. Для последующей переработки реакционную смесь сливают в полунасыщенный раствор гидрокарбоната натрия, трижды экстрагируют метиленхлоридом, промывают раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После хроматографии сырого продукта на силикагеле градиентом метиленхлорид-метанол получают 191 мг 11-фтор-3-гидрокси-7-(5-N-метил-[N3-(тиофен-2-илметилтио)пропил]аминопентил)эстра-1,3,5(10)-триен-17-она в виде пенистого вещества. б) 11-Фтор-7-(5-N-метил-[N-3-(тиофен 2-илметилтио)пропил]аминопентил)эстра-1,3,5(10)-триен-3,17-диол. 185 мг 11-фтор-3-гидрокси-7-(5-Nметил-[N-3-(тиофен-2-илметилтио)пропил] аминопентил)эстра-1,3,5(10)-триен-17-она растворяют в 5 мл метанола и порциями смешивают с 28 мг борогидрида натрия. После перемешивания в течение 45 мин при комнатной тем 001577 60 пературе большую часть растворителя удаляют под вакуумом, остаток сливают в раствор поваренной соли, трижды экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной хроматографии на колонке градиентом метиленхлорид-метанол получают 93 мг 11-фтор 7-(5-N-метил-[N-3-(тиофен-2-илметилтио) пропил]амино]пентил)эстра-1,3,5(10)-триен 3,17-диола в виде пенистого вещества. Пример 45. 11-Фтор-7-5-[(2S)-2-(4 трифторметилфенилтиометил)пирролидин-1 ил]пентилэстра-1,3,5(10)-триен-3,17-диол. а) 11-Фтор-3-гидрокси-7-5-[(2S)-2-(4 трифторметилфенилтиометил)пирролидин-1 ил]пентилэстра-1,3,5(10)-триен-17-он. Раствор из 0,5 г 7-(5-хлорпентил)-11 фтор-3-гидроксиэстра-1,3,5(10)-триен-17-она в 4 мл диметилформамида перемешивают с 0,55 г(2S)-2-(4-трифторметилфенилтиометил)пирролидина и 0,32 г иодида лития в течение 2 ч при температуре ванны 100 С. Затем сливают на раствор гидрокарбоната натрия, трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/ ацетоном. В результате получают 0,45 г 11-фтор 3-гидрокси-7-5-[(2S)-2-(4-трифторметилфенилтиометил)пирролидин-1-ил]пентилэстра 1,3,5(10)-триен-17-она; []D22 = +32,7 (с = 0,51% в хлороформе). б) 11-Фтор-7-5-[(2S)-2-(4-трифторметилфенилтиометил)пирролидин-1-ил]пентил эстра-1,3,5(10)-триен-3,17-диол. Раствор из 0,43 г 11-фтор-3-гидрокси-75-[(2S)-2-(4-трифторметилфенилтиометил) пирролидин-1-ил]пентилэстра-1,3,5(10)-триен 17-она в 4 мл тетрагидрофурана, 2,3 мл этанола и 1 мл воды смешивают порциями при 0 С со 111 мг борогидрида натрия и перемешивают в течение 2 ч. Затем сливают на ледяную воду,трижды экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле дихлорметаном/ацетоном. Таким путем получают 0,32 г 11-фтор-7-5-[(2S)-2-(4-трифторметилфенилтиометил)пирролидин-1-ил]пентилэстра 1,3,5(10)-триен-3,17-диола; []D22 = +16,2 (с = 0,51% в метаноле). Пример 46. 11-Фтор-17-метил-7-[5[(2S)-2-(4,4,5,5,5-пентафторпентансульфинилметил)пирролидин-1-ил]пентилэстра-1,3,5(10)триен-3,17-диол. Раствор из 0,2 г 11-фтор-17-метил-75-[(2S)-2-(4,4,5,5,5-пентафторпентилтиометил) пирролидин-1-ил]пентилэстра-1,3,5(10)-триен 3,17-диола в 5,8 мл метанола и 2,9 мл воды перемешивают с 82 мг периодата натрия в тече
МПК / Метки
МПК: A61P 35/00, A61K 31/567, C07J 53/00
Метки: лекарственных, изготовления, 7альфа-(кси-аминоалкил)эстратриены, получения, средств, 7альфа-(кси-аминоалкил, содержащие, фармацевтические, препараты, способ, эти, эстратриены, применение
Код ссылки
<a href="https://eas.patents.su/30-1577-7alfa-ksi-aminoalkilestratrieny-sposob-ih-polucheniya-farmacevticheskie-preparaty-soderzhashhie-eti-7alfa-ksi-aminoalkil-estratrieny-i-ih-primenenie-dlya-izgotovleniya-lekarstvenny.html" rel="bookmark" title="База патентов Евразийского Союза">7альфа-(кси-аминоалкил)эстратриены, способ их получения, фармацевтические препараты, содержащие эти 7альфа-(кси-аминоалкил) эстратриены, и их применение для изготовления лекарственных средств</a>
Предыдущий патент: Подложка для создания трехмерных изображений
Следующий патент: Водная силиконовая дисперсия.
Случайный патент: Ингибиторы тирозинкиназы брутона












