Бензоциклогептены, содержащие их фармацевтические препараты и их применение для получения лекарственных средств
Номер патента: 4182
Опубликовано: 26.02.2004
Авторы: Нишино Юкишиге, Кнауте Рудольф, Парчик Карстен, Хегеле-Хартунг Криста, Кролл Йорг, Лихтнер Роземари, Фритцемаер Карл-Генрих, Кюнцер Германн, Больманн Рольф, Лессль Моника, Шнайдер Мартин
Формула / Реферат
1. Бензоциклогептены общей формулы I
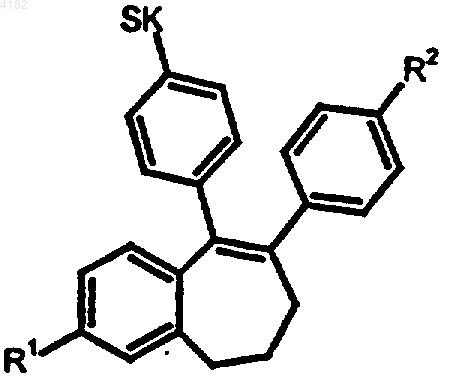
в которой R1 и R2 представляют собой независимо друг от друга атом водорода, гидроксильную группу, необязательно замещенную C1-C10алкоксигруппу, необязательно замещенную C1-C10алканоилоксигруппу или необязательно замещенную C7-C15ароилоксигруппу, а SK представляет собой боковую цепь -A-B-Z,
где A обозначает прямую связь или атом кислорода,
B обозначает неразветвленную либо разветвленную, необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10,
Z обозначает группу -D-SOx-E-G, аминогруппу -NR7R8 или заместитель G,
где D обозначает прямую связь или группу -NR3(R4-), R3 обозначает неразветвленную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10, а R4 обозначает неразветвленную либо разветвленную необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10, при этом атом азота может быть также встроен в 4-7-членную циклическую систему,
x обозначает 0, 1 или 2,
E обозначает неразветвленную либо разветвленную необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10,
G обозначает частично либо полностью фторированную, неразветвленную либо разветвленную алкильную группу с числом атомов углерода до 5, необязательно замещенный арильный или гетероарильный остаток, карбамоильный остаток -C(O)-NR5R6, где R5 и R6 имеют значения, идентичные R7 и R8, или обозначает атом галогена либо атом водорода,
R7 и R8 обозначают независимо друг от друга атом водорода, неразветвленный либо разветвленный, необязательно частично фторированный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14, который может быть разорван одним-тремя гетероатомами -O- и -S- и группировками -NR9-, где R9 представляет собой атом водорода или C1-C3алкильный остаток, необязательно одно- либо двузамещенный арильный или гетероарильный остаток, обозначает далее необязательно одно- либо двузамещенный C3-C10циклоалкильный остаток, необязательно одно- либо двузамещенный C4-C15циклоалкильный остаток, необязательно одно- либо двузамещенный C7-C20аралкильный остаток, необязательно одно- либо двузамещенный гетероарил-C1-C8алкильный остаток или необязательно замещенный аминоалкильный остаток, бифениленовый остаток или остаток формулы -C(O)R10, где R10 может иметь значения, идентичные вышеуказанным для R7, соответственно для R8, или
R7 и R8 образуют с атомом азота, с которым они связаны, насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи, который необязательно содержит один или два других гетероатома, выбранных из группы, включающей азот, кислород и серу, и который необязательно замещен,
при этом, если в боковой цепи -A-B-Z A обозначает атом кислорода, a Z обозначает G, то G не может быть атомом водорода или атомом галогена, или если A обозначает атом кислорода, а Z обозначает аминогруппу -NR7R8, в которой R7 и R8 каждый представляет собой метильную группу или вместе с атомом азота образуют пирролидиновое кольцо, то B содержит по меньшей мере 3 атома углерода, и за исключением соединения общей формулы I, в которой R1 и R2 идентичны и обозначают водород, SK обозначает боковую цепь -A-B-Z, где A представляет собой O, B представляет собой -(OH2)2-, а Z представляет собой N(C2H5)2.
2. Соединения общей формулы I по п.1, в которой R1 и/или R2 обозначают атом водорода.
3. Соединения общей формулы I по п.1, в которой A обозначает атом кислорода.
4. Соединения общей формулы I по п.1, в которой B обозначает неразветвленную алкениленовую цепь с 1-6 атомами углерода.
5. Соединения общей формулы I по п.1, в которой боковая цепь SK выбрана из группы, включающей
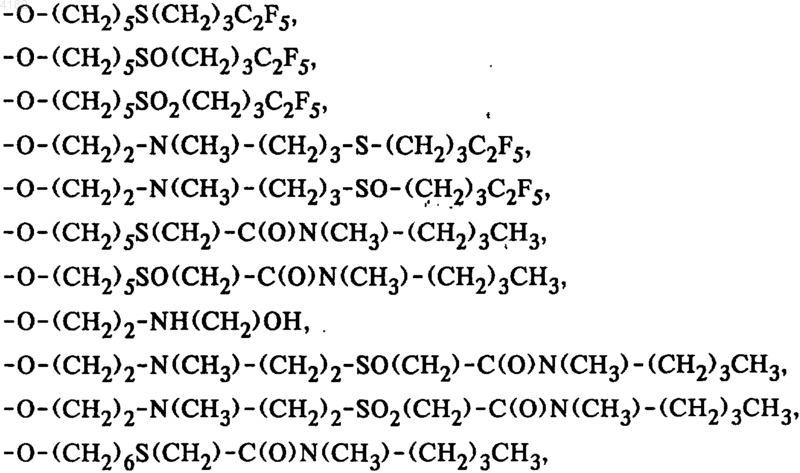
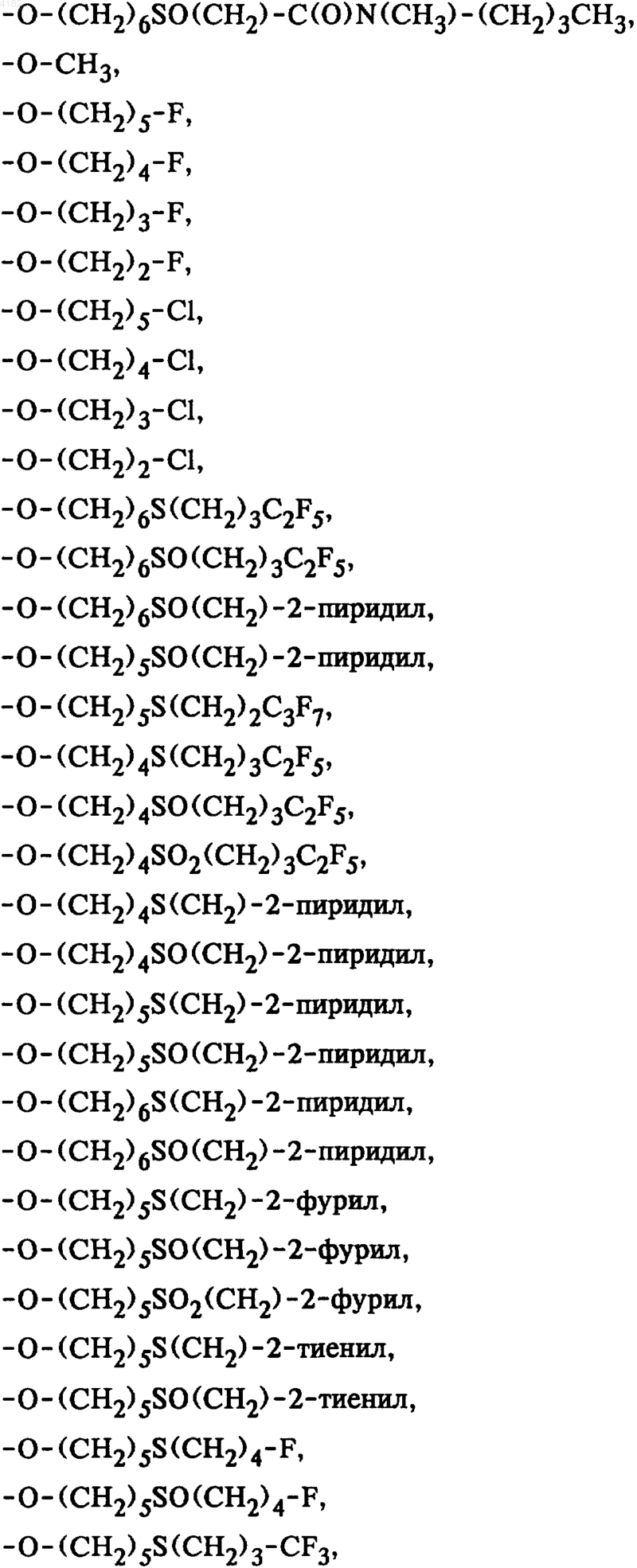
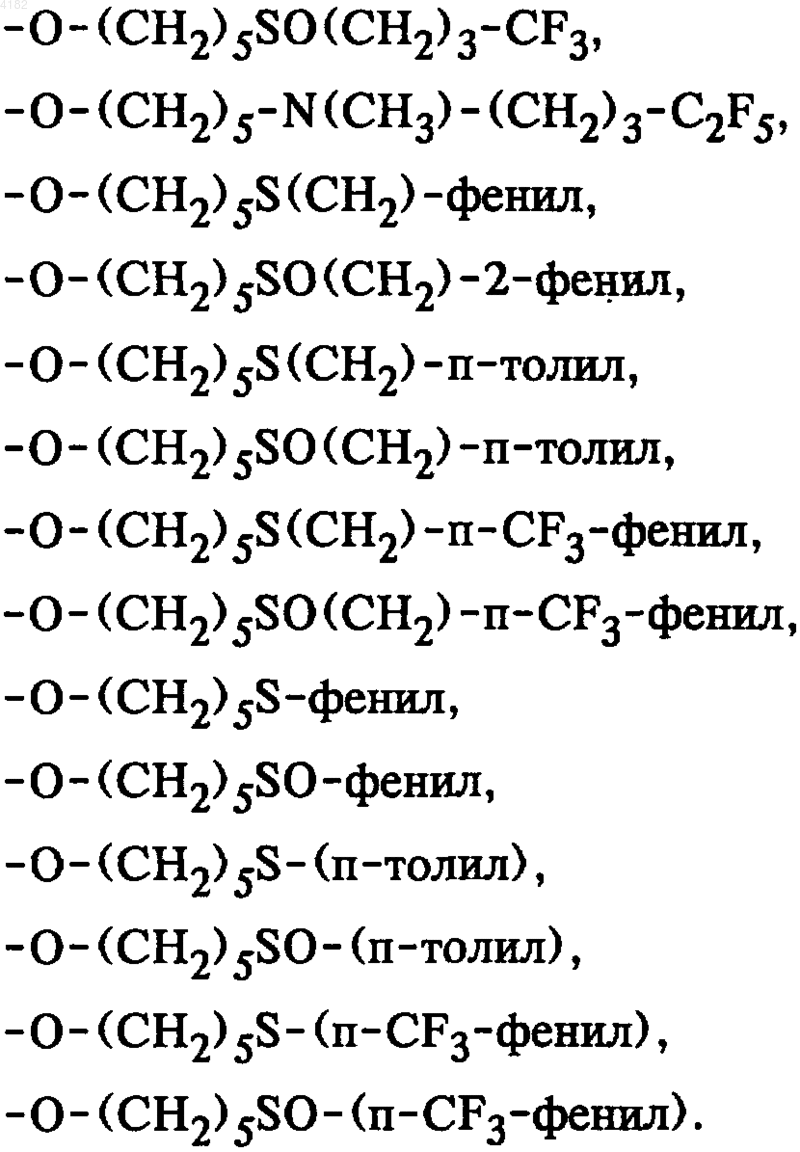
6. Соединения общей формулы I по п.1, в которой боковая цепь SK выбрана из группы, включающей
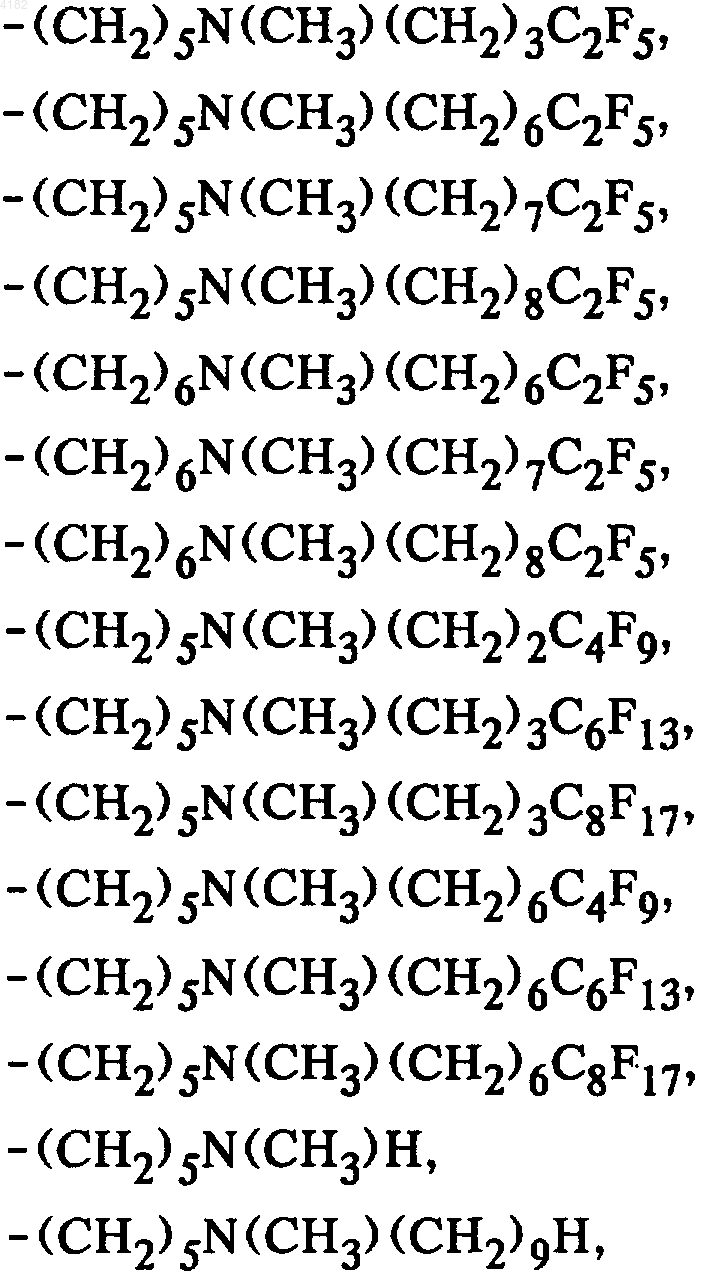
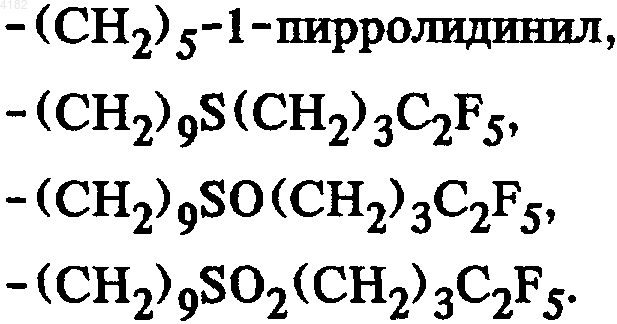
7. Соединения общей формулы I по п.1, в которой боковая цепь SK представлена общей субформулой
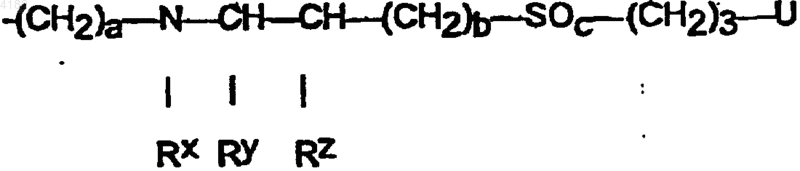
в которой a обозначает 4, 5 или 6,
b обозначает 0, 1 или 2,
c обозначает 0, 1 или 2,
RX обозначает атом водорода или C1-C5алкильную группу,
RY и RZ каждый обозначает атом водорода, или
RX и RY обозначают вместе алкиленовую группу -(CH2)d-, где d обозначает 2, 3, 4 или 5, и
RZ обозначает атом водорода, или
RX и RZ обозначают вместе алкиленовую группу -(CH2)e-, гдe e обозначает 2, 3 или 4, и
RY обозначает атом водорода и
U представляет собой незамещенный либо от одно- до пятикратно фторированный этильный остаток, или концевой заместитель -(CH2)3-U в боковой цепи заменен на необязательно замещенный арильный либо гетероарильный остаток, непосредственно связанный через моно-, ди- или триметиленовую группу с атомом серы.
8. Соединения общей формулы I по п.7, в которой SK представляет собой боковую цепь -(CH2)5N(CH3)(CH2)3S(CH2)3C2F5.
9. Соединения общей формулы I по п.7, в которой SK представляет собой боковую цепь (CH2)5N(RX)(CHRY)CH2S(CH2)3C2F5, где RX и RY вместе обозначают -(CH2)3-.
10. Соединения общей формулы I из группы, включающей
(4,4,5,5,5-пентафторпентил)-{5-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентил]сульфид;
(4,4,5,5,5-пентафторпентил)-{5-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентил}сульфоксид;
метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]-{2-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]этил}амин;
метил-[3-(4,4,5,5,5-пентафторпентилсульфинил)пропил]-{2-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]этил}амин;
S-{5-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентил}тиоацетат;
N-бутил-N-метил-2-{5-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентилтио}ацетамид;
N-бутил-N-метил-2-{5-[4-(6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентансульфинил}ацетамид;
5-{4-[5-(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4,4,5,5,5-пентафторпентансульфинил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-[4-(2-{метил-[3-(4,4,5,5,5-пентафторпентансульфинил)пропил]амино}этокси)фенил]-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-[4-(2-{метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]амино}этокси)фенил]-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
N-бутил-N-метил-2-{5-[4-(2-гидрокси-6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентилтио}ацетамид;
5-{4-[5-(4,4,5,5,5-пентафторпентансульфонил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
N-бутил-N-метил-2-{5-[4-(2-гидрокси-6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]пентансульфинил}ацетамид;
N-бутил-2-[2-({2-[4-(2-гидрокси-6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]этил}метиламино)этансульфинил]-N-метилацетамид;
N-бутил-2-[2-({2-[4-(2-гидрокси-6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]этил}метиламино)этансульфонил]-N-метилацетамид;
6-(4-гидроксифенил)-5-{4-[5-(4,4,5,5,5-пентафторпентансульфонил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
N-бутил-2-{6-[4-(2-гидрокси-6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]гексансульфинил}-N-метилацетамид;
N-бутил-2-{6-[4-(2-гидрокси-6-фенил-8,9-дигидро-7H-бензоциклогептен-5-ил)фенокси]гексилтио}-N-метилацетамид;
6-(4-гидроксифенил)-5-{4-[5-(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-(4-гидроксифенил)-5-{4-[5-(4,4,5,5,5-пентафторпентансульфинил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[4-(4,4,5,5,5-пентафторпентилтио)бутилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[4-(пиридин-2-илметилтио)бутилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(пиридин-2-илметилтио)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[6-(пиридин-2-илметилтио)гексилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[4-(4,4,5,5,5-пентафторпентансульфинил)бутилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[4-(пиридин-2-илметансульфинил)бутилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[6-(4,4,5,5,5-пентафторпентилтио)гексилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[6-(4,4,5,5,5-пентафторпентансульфинил)гексилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[6-(пиридин-2-илметансульфинил)гексилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(пиридин-2-илметансульфинил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол:
5-{4-[5-(фуран-2-илметилтио)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(тиен-2-илметилтио)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(фуран-2-илметансульфинил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(фуран-2-илметансульфонил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(тиен-2-илметансульфонил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(тиен-2-илметансульфинил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(3,3,4,4,5,5,5-гептафторпентилтио)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[2-(2-гидроксиэтиламино)этокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-фторбутилтио)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-фторбутансульфинил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4,4,4-трифторбутилтио)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4,4,4-трифторбутансульфинил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-(4-{5-[метил-(4,4,5,5,5-пентафторпентил)амино]пентилокси}фенил)-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-[4-(5-бензилтиопентилокси)фенил]-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-[4-(5-бензилсульфинилпентилокси)фенил]-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-метилбензилтио)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-метилбензилсульфинил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4-трифторметилбензилтио)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4-трифторметилбензилсульфинил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-[4-(5-фенилтиопентилокси)фенил]-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-[4-(5-фенилсульфинилпентилокси)фенил]-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-[4-(5-фенилсульфонилпентилокси)фенил]-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-трет-бутилфенилтио)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-трет-бутилфенилсульфинил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
5-{4-[5-(4-трет-бутилфенилсульфонил)пентилокси]фенил}-6-фенил-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4-трифторметилфенилтио)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4-трифторметилфенилсульфинил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол;
6-фенил-5-{4-[5-(4-трифторметилфенилсульфонил)пентилокси]фенил}-8,9-дигидро-7H-бензоциклогептен-2-ол.
11. Лекарственные средства, содержащие в своем составе по крайней мере одно соединение общей формулы I по п.1 и фармацевтически приемлемый носитель.
12. Применение соединений общей формулы I по п.1 для получения соответствующих лекарственных средств.
Текст
1 Настоящее изобретение относится к бензоциклогептенам общей формулы I в которой R1 и R2 представляют собой независимо друг от друга атом водорода, гидроксильную группу, необязательно замещенную C1 С 10 алкоксигруппу, необязательно замещеннуюC1-С 10 алканоилоксигруппу или необязательно замещенную C7-С 15 ароилоксигруппу, аSK представляет собой боковую цепь -AB-Z,где А обозначает прямую связь или атом кислорода,В обозначает неразветвленную либо разветвленную, необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10,Z обозначает группу -D-SOx-E-G, аминогруппу -NR7R8 или заместитель G,где D обозначает прямую связь или группу-NR3(R4-), где R3 обозначает неразветвленную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10, а R4 обозначает неразветвленную либо разветвленную, необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10, при этом атом азота может быть также встроен в 4-7-членную циклическую систему,х обозначает 0, 1 или 2,Е обозначает неразветвленную либо разветвленную, необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10,G обозначает частично либо полностью фторированную, неразветвленную либо разветвленную алкильную группу с числом атомов углерода до 5, необязательно замещенный арильный или гетероарильный остаток, карбамоильный остаток -C(O)-NR5R6, где R5 и R6 имеют значения, идентичные R7 и R8, или обозначает атом галогена либо атом водорода,R7 и R8 обозначают независимо друг от друга атом водорода, неразветвленный либо разветвленный, необязательно частично фторированный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14, который может быть разорван одним-тремя гетероатомами -O- и -S- и группировками -NR9-,где R9 представляет собой атом водорода илиC1-С 3 алкильный остаток, обозначает далее необязательно одно- либо двузамещенный арильный или гетероарильный остаток, необязательно одно- либо двузамещенный С 3-С 10 циклоалкильный остаток, необязательно одно- либо 2 двузамещенный С 4-С 15 циклоалкильный остаток,необязательно одно- либо двузамещенный C7 С 20 аралкильный остаток, необязательно однолибо двузамещенный гетероарил-C1-С 8 алкильный остаток или необязательно замещенный аминоалкильный остаток, бифениленовый остаток или остаток формулы -C(О)R10, где R10 может иметь значения, идентичные вышеуказанным для R7, соответственно для R8, илиR7 и R8 образуют с атомом азота, с которым они связаны, насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи,который необязательно содержит один или два других гетероатома, выбранных из группы,включающей азот, кислород и серу, и который необязательно замещен,при этом, если в боковой цепи -A-B-Z А обозначает атом кислорода, a Z обозначает G, тоG не может быть атомом водорода или атомом галогена, или если А обозначает атом кислорода, а Z обозначает аминогруппу -NR7R8, в которой R7 и R8 каждый представляет собой метильную группу или вместе с атомом азота образуют пирролидиновое кольцо, то В содержит по меньшей мере 3 атома углерода. В качестве C1-С 10 алкоксигруппы R1, соответственно R2 может рассматриваться, например,метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, трет-бутокси-, пентокси-,изопентокси-, неопентокси-, гептилокси-, гексилокси- или децилоксигруппа. Содержащиеся в R1 и R2 общей формулы I алканоильные группы должны в каждом случае содержать от 1 до 20 атомов углерода, при этом предпочтительными являются формильная, ацетильная, пропионильная и изопропионильная группы. Ароильные остатки R1, соответственно R2 представляют собой прежде всего бензоаты, а также бензоаты, замещенные в фенильном остатке; однако, таковыми могут быть и другие дериватизированные из поясняемых ниже более подробно арильных остатков ароильные и гетероароильные остатки. В качестве В, в первую очередь, может рассматриваться неразветвленная алкиленовая группа с числом атомов углерода от 1 до 6. В качестве алкильных групп R3, R7 и R8 следует рассматривать неразветвленные или разветвленные алкильные группы с числом атомов углерода до 10, например такие, как метил,этил, пропил, изопропил, бутил, изобутил, третбутил, пентил, изопентил, неопентил, гептил,гексил и децил. Они могут иметь до 3 ненасыщенных (двойных и/или тройных) связей. Алкильные группы R3, R7 и R8 могут быть частично либо полностью фторированы или замещены. В качестве частично либо полностью фторированной, неразветвленной либо разветвленной С 1-С 10 алкильной группы можно назвать,например такие, как трифторметильная, пента 3 фторэтильная, 2,2,2-трифторэтильная, 4,4,4-трифторбутильная, 3,3,4,4,4-пентафторбутильная,4,4,5,5,5-пентафторпентильная или нонафторбутильная группы. Они также могут иметь до 3 ненасыщенных (двойных и/или тройных) связей. Алкильный остаток, являющийся одним из значений R9, представляет собой метильный,этильный, пропильный или изопропильный остаток; предпочтителен из них метильный остаток. В качестве арильного остатка R7, соответственно R8 и G и арильного остатка в составе арилалкильного остатка R7, соответственно R8 могут быть представлены следующие, необязательно одно- либо многозамещенные остатки: моноциклический карбоциклический остаток, например фенильный остаток; моноциклический гетероциклический остаток, например тиенильный, фурильный, пирролильный, имидазолильный, пиразолильный,пиридильный, пиразинильный, пиримидинильный, пиридазинильный, тиазолильный, оксазолильный, фуразанильный, пирролинильный,имидазолинильный, пиразолинильный, тиазолинильный, триазолильный, тетразолильный остатки, а именно, все возможные изомеры по отношению к положению гетероатомов, а также по отношению к месту соединения с атомом серы в боковой цепи; конденсированный карбоциклический остаток, например нафтильный или фенантренильный остатки; конденсированный остаток, который состоит из карбоциклических и гетероциклических остатков, например таких, как бензофуранильная, бензотиенильная, бензимидазолильная,бензотиазолильная,нафто[2,3-b]тиенильная,тиантренильная, изобензофуранильная, хроменильная, ксантенильная, феноксатиинильная,индолизинильная, изоиндолильная, 3 Н-индолильная, индолильная, индазолильная, пиринильная, хинолизинильная, изохинолильная,хинолильная, фталазинильная, нафтиридинильная, хиноксалинильная, хинозалинильная, циннолинильная, птеридинильная, карбазолильная,-карболинильная, акридинильная, феназинильная, фенотиазинильная, феноксазинильная, индолинильная, изоиндолинильная, имидазопиридильная, имидазопиримидинильная или конденсированная полигетероциклическая система,например фурo[2,3-b]пиррол или тиено[2,3-b] фуран. В качестве заместителей у остатков В, G,R3, R4, R5, R6, R7, R8 и R10, а также R3 вместе с R4 могут рассматриваться нижеследующие заместители, при этом остатки могут быть однократно или многократно, идентично либо различно,замещены этими заместителями: атомы галогенов: фтор, хлор, бром, иод; амино-, моно(С 1-С 8 алкил)- или ди(С 1 С 8 алкил)аминогруппы; при этом обе алкильные 4 группы являются идентичными или различными, прежде всего метиламино- либо этиламино-,диметиламино-, диэтиламино- либо метилэтиламиногруппы; ди(аралкил)аминогруппы, при этом обе аралкильные группы являются идентичными или различными; гидроксильные группы; свободные, этерифицированные или представленные в виде соли карбоксильные группы: этерифицированные карбоксикарбонильной группой, например метоксикарбонил либо этоксикарбонил; в виде соли, например в виде соли натрия или калия; алкильные группы с числом атомов углерода от 1 до 8, например такие, как метильная, этильная, н- либо изопропильная, н-,изо-либо трет-бутильная группы, необязательно замещенные одним или несколькими атомами галогена, например фтором, в частности трифторметильная или пентафторэтильная группа; оксо-, азидо-, циано-, нитро- или формильные группы; ацильные группы, такие как ацетил, пропионил, бутирил и бензоил; ацилоксигруппы, такие как ацетокси, остатки формулы -О-СО-(СН 2)n-СООН, где n=1-5; С 1-С 4 алкоксигруппы, например такие, как метокси-, этокси-, пропокси-, изопропокси-,бутоксигруппы; алкилтиогруппы, например метилтио-,этилтио-, пропилтио-, изопропилтио-, бутилтиогруппы, все необязательно фторированные; карбамоильные группы; алкенильные группы, например винил и пропенил; алкинильные группы, например этинил и пропинил; С 6-С 12 арильные группы, такие как фенил,фурил, тиенил, которые также могут быть одно-,дву- или тризамещенными. В качестве циклоалкильной группы для заместителей R7 и R8 могут рассматриваться замещенные и незамещенные остатки с числом атомов углерода от 3 до 10; прежде всего следует назвать циклопропильную и циклопентильную группу, а в качестве алкилциклоалкильной группы - метилциклопропильную и метилциклопентильную группу. С 7-С 20 аралкильные остатки в R7 и R8 могут содержать в кольце до 14 атомов углерода,предпочтительно 6-10, а в алкильной цепи - от 1 до 8, предпочтительно от 1 до 4 атомов углерода. Гетероарил-С 1-С 8 алкильный остаток в R7 и 8R в качестве гетероарильного фрагмента имеет один из вышеназванных гетероарильных остатков; в алкильной цепи содержится 1-8, предпочтительно 1-4 атома углерода. В качестве аралкильных остатков могут рассматриваться, например, бензил, фенилэтил,нафтилметил, нафтилэтил, а в качестве гетероарилалкильного остатка - фурилметил, тиенилэтил и пиридилпропил. Кольца могут быть одно- или многозамещенными. Если R7 и R8 вместе с атомом азота, с которым они связаны, образуют насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи, который необязательно содержит один или два других гетероатома, выбранных из группы, включающей азот, кислород и серу, то этот гетероцикл представляет собой пирролидиновое, пиперидиновое, морфолиновое или пиперазиновое кольцо. В качестве заместителей для арильного,гетероарильного, аралкильного и гетероарилалкильного остатка можно назвать прежде всего трифторметильную, пентафторэтильную, трифторметилтио-, метокси-, этокси-, нитро-, циано-,галогено- (фтор, хлор, бром, иод), гидрокси-,амино-, моно(С 1-С 8 алкил-) или ди(С 1-С 8 алкил)аминогруппу, причем обе алкильные группы являются идентичными либо различными,ди(аралкил)аминогруппы, причем обе аралкильные группы являются идентичными либо различными, или 1-метоксиацетиламиногруппу. Атом серы в боковой цепи может быть представлен в виде простого серного мостика(сульфид), в виде сульфона или сульфоксида. Свободные гидроксильные группы в соединениях общей формулы I могут быть функционально дериватизированы, например, путем этерификации с образованием простого или сложного эфира, предпочтительными, однако,являются свободные гидроксильные группы. В качестве эфирных и ацильных остатков(защитные группы) могут рассматриваться известные специалистам в данной области техники остатки, например такие, как метоксиметильный, метоксиэтильный, этоксиэтильный,тетрагидропиранильный, тетрагидрофуранильный, триметилсилильный, триэтилсилильный,трет-бутилдиметилсилильный, трет-бутилдифенилсилильный, трибензилсилильный, триизопропилсилильный, метильный, трет-бутильный,бензильный, пара-нитробензильный, пара-метоксибензильный, формальный, ацетильный,пропионильный, изопропионильный, бутирильный, пивалильный и бензоильный остатки. Соответствующий обзор представлен, например, уSynthesis", изд-во John Wiley and Sons. В качестве специфических боковых цепей,в которых А обозначает атом кислорода, следует назвать следующие: В качестве боковых цепей, где А представляет собой прямую связь, могут рассматриваться, например, следующие (DE 19806357.1): Далее рассматриваются боковые цепи общей субформулы в которой а обозначает 4, 5 или 6,b обозначает 0, 1 или 2,с обозначает 0, 1 или 2,R5 обозначает атом водорода или С 1 С 5 алкильную группу,R6 и R7 каждый обозначает атом водорода илиR5 и R6 обозначают вместе алкиленовую группу -(СН 2)d-, где d равно 2, 3, 4 или 5, аR7 обозначает атом водорода илиR5 и R7 обозначают вместе алкиленовую группу -(СН 2)e-, где е равно 2, 3 или 4, аR6 обозначает атом водорода иU представляет собой незамещенный либо от одно- до пятикратно фторированный этильный остаток, или концевой заместитель -(СН 2)3U в боковой цепи заменен на необязательно замещенный арильный либо гетероарильный остаток, связанный непосредственно или через моно-, ди- или триметиленовую группу с атомом серы,и из указанных прежде всего боковые цепи(CHR6)CH2S(CH2)3C2F5, где R5 и R6 вместе обозначают -(СН 2)3-. Согласно настоящему изобретению предпочтительными соединениями являются следующие: 10 6-фенил-5-4-[5-(4,4,4-трифторбутансульфинил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол; 5-(4-5-[метил-(4,4,5,5,5-пентафторпентил) амино]пентилоксифенил)-6-фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол; 5-[4-(5-бензилтиопентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 5-[4-(5-бензилсульфинилпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 5-4-[5-(4-метилбензилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 5-4-[5-(4-метилбензилсульфинил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилбензилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилбензилсульфинил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол; 6-фенил-5-[4-(5-фенилтиопентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-[4-(5-фенилсульфинилпентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2 ол; 6-фенил-5-[4-(5-фенилсульфонилпентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2 ол; 5-4-[5-(4-трет-бутилфенилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 5-4-[5-(4-трет-бутилфенилсульфинил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 5-4-[5-(4-трет-бутилфенилсульфонил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилфенилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилфенилсульфинил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилфенилсульфонил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. Настоящее изобретение относится, помимо этих соединений общей формулы I, при условии, что в боковой цепи SK содержится атом азота, также к их физиологически приемлемым кислотно-аддитивным солям с органическими и неорганическими кислотами, к фармацевтическим препаратам, содержащим эти соединения общей формулы I, включая кислотноаддитивные соли, а также к их применению для получения соответствующих лекарственных средств. Для получения кислотно-аддитивных солей пригодными являются неорганические и 11 органические кислоты, известные специалистам в данной области техники и применяемые для образования физиологически приемлемых солей. В качестве кислотно-аддитивных солей можно назвать прежде всего гидрохлориды,гидробромиды, ацетаты, цитраты, оксалаты,тартраты и метансульфонаты. Соединения общей формулы I представляют собой соединения с сильным антиэстрогенным действием. Соединения согласно изобретению являются селективными эстрогенами, действие которых проявляется избирательно по отношению к тканям. Прежде всего это эстрогенное действие проявляется по отношению к костной ткани,тогда как по отношению к матке и печени оно не проявляется вовсе или проявляется лишь в незначительной степени. Соединения по изобретению могут обладать также антиэстрогенной эффективностью,что может быть подтверждено, например, тестом на исследование воздействия, препятствующего росту матки, или на моделях опухоли. Соединения, обладающие подобным механизмом действия, в последнее время получили название селективных модуляторов рецепторов эстрогенов (СМРЭ) (см. Structure-Activity Relationships of Selective Estrogen Receptor Modulators: Modifications to the 2-ArylbenzothiopheneChem., 40, стр. 146-167, 1997). Наиболее известным типичным представителем соединений этого класса является ралоксифен, который на сегодняшний день разрешен к применению в качестве медикамента для предупреждения и лечения остеопороза в период постменопаузы. Соединения с антиэстрогенными свойствами, т.е. вещества, которые подавляют действие эстрогенов, уже описаны в целом ряде публикаций. К таким соединениям относятся соединения как со стероидным, так и с нестероидным скелетом. Впервые представленный в BE 37389 тамоксифен, (Z)-2-[4-(1,2-дифенил-1-бутенил)фенокси]-N,N-диметилэтиламин, уже давно применяется в качестве антиэстрогена при лечении рака груди. Ралоксифен, 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидинэтокси)бензоил]бензо[b] тиофен, и его гидрохлорид, могут применяться для лечения и профилактики остеопороза (ЕР 0584952 В 1). Представленное в ЕР 0138504 В 1 стероидное производное 7-[9-(4,4,5,5,5-пентафторпентилсульфинил)-н-нонил]эстра-1,3,5(10)-триен 3,17-диол (ЕР 0138504, стр. 58, предпоследнее соединение) проходит в настоящее время клинические испытания при лечении опухолей, за 004182 12 висящих от гормональной регуляции (рак груди). Фармацевтические составы, которые содержат ингибиторы половых стероидов, обладающие стероидным скелетом, который имеет 7-боковую цепь при одновременном присутствии по крайней мере одного из других заместителей в положении 14, 15 или 16, являются объектом изобретения ЕР А 0376576. Изобретение согласно этой заявке относится также к нестероидным антиэстрогенным соединениям, в частности к соединению ЕМ 800. Первоначально это соединение было описано как чистый антиэстроген; затем, однако, было установлено, что это соединение обладает также заметным частичным эстрогенным действием. К представленным в WO 96/21656 агонистам и антагонистам эстрогенов относятся среди прочих производные бензоциклопентана, бензоциклогексана и бензоциклогептана, которые в ароматическом фрагменте несут гидроксильную группу, у 5-го углеродного атома азотное ароматическое соединение или фенильный остаток в положении 4 с боковой цепью и у 6-го атома углерода, в частности, фенильный остаток, необязательно имеющий боковую цепь. О соединениях с одной ненасыщенной связью в сконденсированном структурном фрагменте в этой публикации ничего не говорится. Фактически описаны в принципе только производные бензоциклогексана. Данные касательно некоторых соединений с бензоциклогептеновым скелетом можно найти в различных публикациях (см. Mol. Pharmacol. 39, стр. 421-428, 1991; J. Med. Chem., 29, стр. 2053-2059, 1986; J. Med. Chem., 31, стр. 13161326, 1988). Эти соединения имеют в положении 4 фенильного остатка, связанного с 5-м атомом углерода, метокси-, 2-(диметиламино) этокси- или 2-(1-пирролидинил)этоксигруппу. Информация о том, являются ли эти соединения селективными эстрогенами, отсутствует. Фармакологические исследования соединений по изобретению Воздействие соединений согласно изобретению на матку исследовали на росте матки (эстрогенное действие) и подавлении роста матки(антиэстрогенное действие), обе серии исследований проводились на молодых крысах. Эстрогенное/антиэстрогенное действие in vivo Исследование роста матки у молодых крыс(n=5 особей в каждой группе) У молодых животных, которым вводили обладающую эстрогенным действием субстанцию, наблюдается зависящее от эстрогенной эффективности последней увеличение веса как матки, так и влагалища. Кроме того, при эстрогенном воздействии в матке происходит пролиферация и увеличение высоты люминального эпителия. Незрелым интактным крысам (вес тела 40-50 г) в течение трех дней (д 1-д 3) подкожно вводят тестируемую субстанцию. На 4 13 ый день (д 4) животных умерщвляют с помощью СО 2. Затем извлекают и взвешивают матки. Для проведения гистологического анализа фрагмент матки, предпочтительно рог матки, помещают в формальдегид и заливают парафином. Стимулирование увеличения веса органа (в пересчете на мг/100 г веса тела), а также высота эпителия указаны в процентном выражении в сравнении с действием контрольного соединения 17 эстрадиола (дозировка Э 2 0,3 мкг/животное). Соединения по изобретению не оказывают стимулирующего воздействия на матку или оказывают его лишь в незначительной степени. Тест на подавление роста матки у молодых крыс(n=5 особей в каждой группе) Для подтверждения непосредственного действия субстанций, обладающих антиэстрогенными свойствами, в качестве тестовой модели может быть использована матка молодых крыс с эстрогенным замещением. Показателем эстрогенной эффективности является индуцированный эстрадиолом рост матки у молодых крыс, который подавляется в результате одновременного введения субстанции, обладающей антиэстрогенным действием. Тестируемые субстанции вводят животным подкожно последовательно в течение 3 дней (д 1-д 3) в сочетании с 17-эстрадиолом, применяющимся по методу заместительной терапии, в дозировке 0,3 мкг/животное/сутки. В качестве положительного контроля служит только 17-эстрадиол, а в качестве отрицательного контроля - группа, обработанная инертным носителем. На 4-ый день(д 4) животных умерщвляют, матки и влагалища извлекают и взвешивают. Вес органов пересчитывают в мг/100 г веса тела, а затем рассчитывают среднее значение и стандартное отклонение для каждой дозировки. Подавление роста матки, соответственно влагалища, обусловленного действием 17-эстрадиoла, выражают в %. Соединения согласно изобретению преимущественно проявляют ярко выраженный эффект подавления роста матки, вызванного действием 17-эстрадиола. Таким образом, предлагаемые в изобретении соединения по своему действию по отношению к матке заметно превосходят, как очевидно, соединения из уровня техники, которые не оказывают никакого эстрогенного влияния на этот орган или оказывают его лишь в незначительной степени. Исследование костной ткани Метод Трехмесячных самок крыс подвергают овариэктомии и непосредственно после операции в течение 28 дней 1 раз в день вводят им тестируемое соединение. Введение проводят подкожно с использованием смеси арахисовое масло/этанол. В день после последнего введения животных умерщвляют и извлекают большебедерные кости и матки. Матки взвешивают, за 004182 14 крепляют и соответствующим образом обрабатывают для проведения гистологических исследований. Плотность препарированных большеберцовых костей определяют ex vivo методом количественной компьютерной томографии. Измерения осуществляют на расстоянии 4-6 мм от суставной головки проксимальной большеберцовой кости. В результате овариэктомии плотность трабекулярной кости в измеренной области уменьшается с приблизительно 400 мг Са 2+/см 3 до приблизительно 300 мг Са 2+/см 3. Благодаря применению соответствующего соединения общей формулы I согласно настоящему изобретению (дозировка составляет 0,1-100 мкг/животное/день) удается предотвратить, соответственно ингибировать снижение плотности кости. Все исследования костной плотности проводили на большеберцовых костях. Касательно защитного действия, которое соединения по изобретению оказывают на костную ткань, следует отметить, что по этому показателю они как минимум сопоставимы с соединениями из уровня техники при одновременном снижении и даже отсутствии трофического воздействия на эстрогены матки. Таким образом, благодаря своему селективному действию по отношению к костной ткани и с учетом сниженного воздействия на матку соединения по изобретению диссоциированы в большей степени по сравнению с соединениями из уровня техники. Изобретение относится также к фармацевтическим препаратам, которые содержат по крайней мере одно соединение общей формулыI (или их физиологически приемлемые кислотно-аддитивные соли с органическими и неорганическими кислотами) и к применению этих соединений для получения соответствующих лекарственных средств, прежде всего при нижеследующих показаниях. Соединения могут применяться как орально, так и парентерально и показаны для следующих случаев: для ослабления симптомов андропаузы и менопаузы, т.е. для гормонозаместительной терапии (ГЗТ) пациентов мужского и женского пола, а именно, как для предупреждения, так и для лечения; для лечения недугов,связанных с дисменореей; для лечения дисфункциональных маточных кровотечений; для лечения угрей; для предупреждения и лечения сердечно-сосудистых заболеваний; для лечения гиперхолестеринемии и гиперлипидемии; для предупреждения и лечения атеросклероза; для подавления профилерации артериальных гладкомышечных клеток; для лечения синдрома удушья у новорожденных; для лечения первичного повышенного легочного кровяного давления; для предупреждения и лечения остеопорозаovariectomized rats; J. Clin. Invest. 93, стр. 63-69,1994); для предупреждения потери костной ткани у женщин в период постменопаузы, у женщин, у которых удалена матка, или у женщин,прошедших курс лечения агонистами или антагонистами LHRH; для подавления созревания спермы; для лечения ревматоидного артрита; для предупреждения болезни Альцгеймера; для лечения эндометриоза; для лечения миом; для лечения миом и эндрометриоза в сочетании сLHRH-аналогами; для лечения опухолей, связанных с состоянием гормональной системы,например рака молочной железы; для лечения заболеваний предстательной железы. Кроме того, благодаря их фармакологическим свойствам соединения согласно изобретению пригодны для контрацепции как для мужчин, так и для женщин. Предлагаемые соединения могут применяться также в сочетании с природным витамином D3 или с аналогами кальцитриола для образования новой костной ткани или в качестве дополнительной терапии при лечении, обусловливающем утраты костной массы (например,при терапии с использованием глюкокортикоидов и химиотерапии). И, наконец, соединения общей формулы I могут применяться в сочетании с антагонистами рецепторов прогестерона или в сочетании с чистыми эстрогенами, а именно, прежде всего в гормонозаместительной терапии, а также при лечении гинекологических нарушений и для контроля женского бесплодия. Терапевтический продукт, содержащий эстроген и чистый антиэстроген для одновременного, последовательного либо раздельного применения и предназначенный для селективной эстрогенотерапии в период предменопаузы или постменопуазы, уже описан в ЕР-А 0346014. Назначаемое количество соединения общей формулы I варьируется в широких пределах и может соответствовать любому эффективному количеству. В зависимости от показания к применению и метода введения суточная дозировка назначаемого соединения может составлять 0,01-10 мг/кг веса тела, предпочтительно 0,1-5 мг/кг веса тела. Для человека это соответствует суточной дозе от 0,8 до 800 мг, предпочтительно от 8 до 400 мг. Одна унифицированная доза содержит согласно изобретению от 0,4 до 400 мг одного или нескольких соединений общей формулы I. Соединения согласно изобретению и их кислотно-аддитивные соли пригодны для получения фармацевтических композиций и составов. Фармацевтические композиции, соответственно лекарственные средства, содержат в качестве активного вещества одно или несколько соединений по изобретению либо их кислотно 004182 16 аддитивные соли, необязательно в смеси с другими фармакологически, соответственно фармацевтически эффективными веществами. Лекарственные средства изготавливают по обычной технологии, при этом могут использоваться известные и обычные, применяемые в фармацевтике вспомогательные вещества, а также другие обычные носители и разбавители. К носителям и вспомогательным веществам такого рода относятся среди прочих такие,которые в нижеприведенной литературе рекомендуются в качестве вспомогательных средств для использования в фармацее, в косметике и родственных им областях: Ullmans Encyclopaedie der technischen Chemie, том 4 (1953), стр. 139; Journal of Pharmaceutical Sciences, том 52fuer Pharmazie, Kosmetik und angrenzende Gebiete, Cantor KG, Aulendorf in Wuerttemberg 1971. Соединения могут назначаться для орального или парентерального, например внутриперитонеального, внутримышечного, подкожного или чрескожного применения. Соединения могут быть также имплантированы в ткань. Для орального приема применяются капсулы, пилюли, таблетки, драже и т.д. Унифицированные дозы могут содержать помимо активного вещества фармацевтически приемлемый носитель, как, например, крахмал, сахар, сорбит, желатин, замасливатель, кремниевая кислота, тальк и т.д. При парентеральном введении активные вещества могут быть растворены или суспендированы в физиологически приемлемом разбавителе. В качестве разбавителя во многих случаях используют масла с или без добавки вещества,способствующего растворению, ПАВ, суспендирующего средства или эмульгатора. Примерами используемых масел являются оливковое масло, арахисовое масло, хлопковое масло, соевое масло, касторовое масло и кунжутное масло. Соединения могут применяться в виде инъекций продленного действия или имплантата, которые могут быть приготовлены таким образом, чтобы обеспечить замедленное высвобождение активного вещества. В качестве инертных материалов имплантаты могут содержать, например, биологически разлагаемые полимеры или синтетические силиконы, как, например, силоксановый каучук. При чрескожном введении активные вещества можно, кроме того, заделывать, например,в пластырь. Для изготовления содержащих активные соединения общей формулы I внутривагинальных (например, влагалищных колец) или внутриматочных систем (например, маточных колец,спиралей, ВМС, Mirena), предназначенных для 17 местного применения, пригодными являются различные полимеры, такие, например, как кремнийорганические полимеры, этиленвинилацетат, полиэтилен или полипропилен. Для повышения биосовместимости активного вещества соединения можно получать также в виде клатратов циклодекстрина. Для этих целей соединения подвергают взаимодействию с -, - или циклодекстрином или его производными(РСТ/ЕР 95/02656). Согласно изобретению соединения общей формулы I можно также инкапсулировать с использованием липосом. Соединения общей формулы I согласно изобретению могут быть получены, как это описано в примерах. Аналогичным образом при использовании реагентов, являющихся гомологами реагентов, описанных в примерах, могут быть получены все соединения общей формулы I. Этерификацию свободных гидроксильных групп с образованием простых и/или сложных эфиров осуществляют по обычным методам,известным специалистам в данной области техники. Те соединения общей формулы I, в которых А обозначает прямую связь, могут быть получены аналогично способам, описанным в заявках WO 98/07740 и DE 19806357.1. Для введения боковой цепи SK сначала 4 гидроксигруппу фенильного остатка в положении 5 исходного продукта переводят в трифторметилсульфонилоксигруппу, а затем в присутствии палладиевого катализатора осуществляют алкилирование фенильного остатка с целью введения функционализованного в концевом положении остатка В (J. Org. Chem., 58; 8; стр. 2201-2208, 1993; Tetrahedron Letters 28; 21; стр. 2387-2388, 1987). Последующую переработку для построения полной боковой цепи SK проводят аналогично тому, как это описано в заявках WO 98/07740 или DE 19806357.1. Примеры Пример 1. (4,4,5,5,5-Пентафторпентил)-5[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен 5-ил)фенокси]пентилсульфид. а) 9-[4-(5-Хлорпентилокси)фенил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептен. Суспензию из 3,0 г 4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенола [RaymondStoessel, J. Med. Chem. (29) 10, 1986, стр. 20532059] в 51 мл ацетонитрила перемешивают с 1,68 г карбоната калия и 1,49 мл 1-бром-5 хлорпентана в течение 9 ч при 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате получают 3,52 г 9-[4-(5 хлорпентилокси)фенил]-8-фенил-6,7-дигидро 004182 18 5 Н-бензоциклогептена в виде кристаллов с температурой плавления 118-120 С. б) 9-[4-(5-Иодпентилокси)фенил]-8-фенил 6,7-дигидро-5 Н-бензоциклогептен. Раствор из 3,32 г 9-[4-(5-хлорпентилокси) фенил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептена в 120 мл этилметилкетона перемешивают с 4,5 г иодида натрия в течение 9,5 ч при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 4,02 г 9-[4-(5-иодпентилокси)фенил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептена в виде кристаллов с температурой плавления 104-106 С. в) (4,4,5,5,5-Пентафторпентил)-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилсульфид. Раствор из 2,35 г 4,4,5,5,5-пентафторпентилтиоацетата в 12 мл метанола перемешивают с 1,88 мл 30%-ного раствора метилата натрия в метаноле при комнатной температуре в течение 0,5 ч. Этот раствор добавляют по каплям к суспензии из 4,0 г 9-[4-(5-иодпентилокси)фенил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептена в 44 мл метанола и 44 мл диэтилового эфира и в течение 6 ч перемешивают при комнатной температуре. Затем метанол концентрируют под вакуумом, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. В результате получают 4,5 г (4,4,5,5,5-пентафторпентил)-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилсульфида в виде кристаллов с температурой плавления 8485 С. Пример 2. (4,4,5,5,5-Пентафторпентил)-5[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен 5-ил)фенокси]пентилсульфоксид. Раствор из 4,4 г (4,4,5,5,5-пентафторпентил)-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилсульфида в 130 мл метанола смешивают с 7,1 мл воды и 1,86 г периодата натрия при комнатной температуре и перемешивают в течение 24 ч. Затем сушат под вакуумом досуха, растворяют в смеси дихлорметан/вода, промывают водой, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси дихлорметан/ацетон. В результате,получают 3,6 г (4,4,5,5,5-пентафторпентил)-5[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен 5-ил)фенокси]пентилсульфоксида в виде бесцветных кристаллов с температурой плавления 114-116 С. Пример 3. Метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]-2-[4-(6-фенил-8,9-дигидро 7 Н-бензоциклогептен-5-ил)фенокси]этиламин. а) 9-[4-(2-Xлорэтокси)фенил]-8-фенил-6,7 дигидро-5 Н-бензоциклогептен.Stoessel, J. Med. Chem. (29) 10, 1986, стр. 20532059] в 51 мл ацетонитрила в течение 28 ч перемешивают с 1,68 г карбоната калия и 0,95 мл 1-бром-2-хлорэтана при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют водой, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 2,93 г 9-[4-(2-хлорэтокси)фенил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептена в виде кристаллов с температурой плавления 171-172 С. б) 9-[4-(2-Иодэтокси)фенил]-8-фенил-6,7 дигидро-5 Н-бензоциклогептен. Раствор из 2,73 г 9-[4-(2-хлорэтокси)фенил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептена в 110 мл этилметилкетона перемешивают с 4,11 г иодида натрия в течение 28 ч при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате,получают 2,60 г 9-[4-(2-иодэтокси)фенил]-8 фенил-6,7-дигидро-5 Н-бензоциклогептена в виде кристаллов с температурой плавления 154156 С. в) Метил-2-[4-(6-фенил-8,9-дигидро-7 Нбензоциклогептен-5-ил)фенокси]этиламин. Раствор из 2,2 г 9-[4-(2-иодэтокси)фенил]8-фенил-6,7-дигидро-5 Н-бензоциклогептена в 55 мл диметилформамида и 1,1 мл триэтиламина перемешивают с 4,4 мл 40%-ного водного раствора метиламина в течение 1 ч при температуре бани 80 С. Затем сливают на насыщенный раствор поваренной соли, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 0,9 г метил-2-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этиламина в виде кристаллов с температурой плавления 165167 С. г) Метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]-2-[4-(6-фенил-8,9-дигидро-7 Нбензоциклогептен-5-ил)фенокси]этиламин. К раствору из 0,9 г метил-2-[4-(6-фенил 8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этиламина и 0,4 г карбоната калия в 14 мл диметилформамида примешивают по каплям раствор из 1,0 г 1-иод-3-(4,4,5,5,5-пентафторпентилтио)пропана в 2 мл диметилформамида и перемешивают в течение 2 ч при температуре бани 80 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до 20 нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом. В результате, получают 570 мг метил-[3-(4,4,5,5,5 пентафторпентилтио)пропил]-2-[4-(6-фенил 8,9-дигидро-7 Н-бензоциклогептен-5 ил)фенокси]этиламина в виде масла. Пример 4. Метил-[3-(4,4,5,5,5-пентафторпентилсульфинил)пропил]-2-[4-(6-фенил-8,9 дигидро-7 Н-бензоциклогептен-5-ил)фенокси] этиламин. Аналогично примеру 2 окисляют 0,55 г метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]2-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этиламина и получают 334 мг метил-[3-(4,4,5,5,5-пентафторпентилсульфинил)пропил]-2-[4-(6-фенил-8,9-дигидро-7 Нбензоциклогептен-5-ил)фенокси]этиламина в виде кристаллов с температурой плавления 7477 С. Пример 5. S-5-[4-(6-фенил-8,9-дигидро 7 Н-бензоциклогептен-5-ил)фенокси]пентил тиоацетат. Раствор из 8,0 г 9-[4-(5-иодпентилокси)фе-нил]-8-фенил-6,7-дигидро-5 Н-бензоциклогептена в 170 мл ацетона перемешивают с 5,36 г тиоацетата калия в течение 2,5 ч при комнатной температуре. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате получают 6,5 г S-5-[4-(6-фенил-8,9-дигидро-7 Нбензоциклогептен-5-ил)фенокси]пентилтиоацетата в виде кристаллов с температурой плавления 118-120 С. Пример 6. N-бутил-N-метил-2-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтиоацетамид. Раствор из 1 г S-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентил тиоацетата в 15 мл метанола и 10 мл тетрагидрофурана перемешивают с 0,42 мл 30%-ного раствора метилата натрия в метаноле в течение 0,5 ч при комнатной температуре и после добавления 0,5 мл 2-бром-N-бутил-N-метилацетамида перемешивают еще в течение 1 ч. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 593 г N-бутил-Nметил-2-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтио]ацетамида в виде масла. Пример 7. N-бутил-N-метил-2-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентасульфинилацетамид. Аналогично примеру 2 окисляют 0,4 г Nбутил-N-метил-2-5-[4-(6-фенил-8,9-дигидро 7 Н-бензоциклогептен-5-ил)фенокси]пентилтио 21 ацетамида и получают 301 мг N-бутил-N-метил 2-5-[4-(6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентасульфинилацетамида в виде кристаллов с температурой плавления 120-121 С. Пример 8. 5-4-[5-(4,4,5,5,5-Пентафторпентилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 2-Бензилокси-5-(4-метоксифенил)-6,7,8,9-тетрагидробензоциклогептен-5-ол. Суспензию из 14,57 г магниевой стружки в 150 мл диэтилового эфира добавляют по каплям к раствору из 88 мл 4-броманизола в 100 мл диэтилового эфира таким образом, чтобы реакционная смесь циркулировала без подвода тепла извне. После добавления суспензии раствор охлаждают до комнатной температуры и медленно добавляют раствор из 35,2 г 2-бензилокси 6,7,8,9-тетрагидробензоциклогептен-5-она [Lal В. и др., J. Med. Chem. (15) 1972, стр. 23-27] в 150 мл диэтилового эфира и перемешивают в течение последующих 4,5 ч при комнатной температуре. После этого охлаждают до 0 С и добавляют насыщенный раствор хлорида аммония. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия,концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате получают 37 г 2-бензилокси-5-(4-метоксифенил)-6,7,8,9 тетрагидробензоциклогептен-5-ола в виде кристаллов с температурой плавления 112-114 С. б) 2-Бензилокси-5-(4-метоксифенил)-8,9 дигидро-7 Н-бензоциклогептен. Суспензию из 35,8 г 2-бензилокси-5-(4 метоксифенил)-6,7,8,9-тетрагидробензоциклогептен-5-ола в 1 л метанола перемешивают с 32 мл концентрированной соляной кислоты в течение 3 ч при комнатной температуре. Затем нейтрализуют раствором гидрокарбоната натрия,концентрируют под вакуумом до объема 300 мл,сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия и концентрируют под вакуумом. В результате, получают 34 г 2 бензилокси-5-(4-метоксифенил)-8,9-дигидро 7 Н-бензоциклогептена в виде кристаллов с температурой плавления 76-78 С. в) 2-Бензилокси-6-бром-5-(4-метоксифенил)-8,9-дигидро-7 Н-бензоциклогептен. Раствор из 34 г 2-бензилокси-5-(4-метоксифенил)-8,9-дигидро-7 Н-бензоциклогептена в 310 мл дихлорметана смешивают порциями при 0 С с 29 г гидробромидпербромида пиридиния в течение 1 ч и перемешивают в течение 0,5 ч при температуре 0 С. Затем к этой смеси при 0 С добавляют 200 мл водного раствора гидросульфита натрия, сливают на воду, 2 раза экстрагируют дихлорметаном, промывают гидрокарбонатом натрия и раствором поваренной соли,сушат над сульфатом натрия, концентрируют 22 под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 35 г 2-бензилокси-6-бром-5-(4-метокси-фенил)-8,9-дигидро-7 Н-бензоциклогептена в виде кристаллов с температурой плавления 141-143 С. г) 2-Бензилокси-5-(4-метоксифенил)-6-фенил-8,9-дигидро-7 Н-бензоциклогептен. Суспензию из 22,32 г хлорида цинка в 60 мл тетрагидрофурана в течение 3 мин при комнатной температуре смешивают с 91,2 мл 1,8 М раствора фениллития и в течение 0,5 ч перемешивают при температуре бани 90 С. Этот раствор добавляют к раствору из 3,16 г тетракистрифенилфосфинпалладия (0) и 24 г 2-бензилокси-6-бром-5-(4-метоксифенил)-8,9-дигидро 7 Н-бензоциклогептена в 144 мл тетрагидрофурана и перемешивают в течение последующих 3 ч при температуре бани 90 С. Затем сливают на 170 мл 1 М раствора соляной кислоты, 3 раза экстрагируют уксусным эфиром, сушат над сульфатом натрия, концентрируют под вакуумом и разделяют путем перемешивания с диэтиловым эфиром. В результате, получают 22,53 г 2-бензилокси-5-(4 метоксифенил)-6-фенил-8,9-ди-гидро-7 Нбензоциклогептена в виде кристаллов с температурой плавления 163-164 С. д) 5-(4-Метоксифенил)-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 21,16 г 2-бензилокси-5-(4 метоксифенил)-6-фенил-8,9-дигидро-7 Н-бензоциклогептена в 900 мл дихлорметана перемешивают с 19 мл N,N-диметиланилина в течение 5 мин при 0 С, порциями смешивают с 26,1 г хлорида алюминия и в течение последующих 3 ч перемешивают при 0 С. Затем смешивают с 1 М соляной кислотой, сливают на воду, 3 раза экстрагируют дихлорметаном, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и разделяют путем перемешивания со смесью гексан/диэтиловый эфир. В результате, получают 17,4 г 5-(4-метоксифенил)-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 232-233 С. е) 2-[5-(4-Метоксифенил)-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокси]тетрагидропиран. Суспензию из 15,8 г 5-(4-метоксифенил)-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 150 мл толуола перемешивают с 15 мл дигидропирана и 60 мг моногидрата паратолуолсульфокислоты в течение 18 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают гидрокарбонатом натрия и раствором поваренной соли, сушат над сульфатом натрия и концентрируют под вакуумом. В результате, получают 19,7 г 2-[5-(4 метоксифенил)-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокси]тетрагидропирана в виде кристаллов с температурой плавления 131133 С. 23 ж) 4-[6-Фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил] фенол. Раствор из 19,7 г 2-[5-(4-метоксифенил)-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2 илокси]тетрагидропирана в 500 мл диметилформамида перемешивают с 9,73 г метилтиолата натрия в течение 6,5 ч при температуре бани 140 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 17,2 г 4-[6-фенил-2-(тетрагидропиран-2 илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]фенола в виде кристаллов с температурой плавления 183-185 С. з) 2-5-[4-(5-Хлорпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокси тетрагидропиран. Раствор из 6,02 г 4-[6-фенил-2(тетрагидропиран-2-илокси)-8,9-дигидро-7 Нбензоциклогептен-5-ил]фенола в 77 мл ацетонитрила перемешивают с 2,55 г карбоната калия и 2,27 мл 1-бром-5-хлорпентана в течение 9 ч при 90 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 6,9 г 2-5-[4-(5-хлорпентилокси)фенил]6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2 илокситетрагидропирана в виде кристаллов с температурой плавления 99-101 С. и) 5-[4-(5-Хлорпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 6,7 г 2-5-[4-(5-хлорпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокси)тетрагидропирана в 130 мл метанола и 13 мл воды перемешивают с 5,7 г щавелевой кислоты в течение 1 ч при температуре бани 100 С. Затем концентрируют под вакуумом до объема 50 мл, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом досуха и перекристаллизовывают из уксусного эфира. В результате, получают 5,48 г 5-[4-(5 хлорпентилокси)фенил]-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 200-202 С. к) 5-[4-(5-Иодпентилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 5,28 г 5-[4-(5-хлорпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 185 мл этилметилкетона перемешивают с 6,9 г иодида натрия в течение 24 ч при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, 004182 24 сушат над сульфатом натрия, концентрируют под вакуумом и кристаллизуют из смеси ацетон/гексан. В результате, получают 5,86 г 5-[4(5-иодпентилокси)фенил]-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 192-193 С. л) 5-4-[5-(4,4,5,5,5-Пентафторпентилтио) пентилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. Раствор из 1,7 г 4,4,5,5,5-пентафторпентилтиоацетата в 9 мл метанола перемешивают с 1,36 мл 30%-ного раствора метилата натрия в метаноле при комнатной температуре в течение 0,5 ч. Этот раствор по каплям добавляют к суспензии из 3 г 5-[4-(5-иодпентилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 35 мл метанола и 35 мл диэтилового эфира и перемешивают в течение 4 ч при комнатной температуре. Затем концентрируют под вакуумом, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия и концентрируют под вакуумом досуха. В результате,получают 3,38 г 5-4-[5-(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 167-168 С. Пример 9. 5-4-[5-(4,4,5,5,5-Пентафторпентансульфинил)пентилокси]фенил-6-фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол. Аналогично примеру 2 окисляют 2,38 г 54-[5-(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола и получают 2,2 г 5-4-[5-(4,4,5,5,5 пентафторпентансульфинил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 138-140 С. Пример 10. 5-[4-(2-Метил-[3-(4,4,5,5,5-пентафторпентансульфинил)пропил]аминоэтокси) фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Аналогично примеру 2 окисляют 0,8 г 5-[4(2-метил-[3-(4,4,5,5,5-пентафторпентитио)пропил]аминоэтокси)фенил]-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ола и получают 405 мг 5-[4-(2-метил-[3-(4,4,5,5,5-пентафторпентансульфинил)пропил]аминоэтокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 6365 С. Пример 11. 5-[4-(2-Метил-[3-(4,4,5,5,5 пентафторпентилтио)пропил]аминоэтокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 2-5-[4-(2-хлорэтилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропиран. Раствор из 6,0 г 4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]фенола в 77 мл ацетонитрила перемешивают с 2,55 г карбоната калия и 7,0 мл 1 25 бром-2-хлорэтана в течение 48 ч при 90 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 6,7 г 2-5-[4-(2-хлорэтилокси)фенил]-6-фенил-8,9 дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в виде кристаллов с температурой плавления 153-155 С. б) 5-[4-(2-Xлорэтилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 6,6 г 2-5-[4-(2-хлорэтилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 130 мл метанола и 13 мл воды перемешивают с 5,7 г щавелевой кислоты в течение 1 ч при температуре бани 100 С. Затем концентрируют под вакуумом до объема 50 мл, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом досуха и перекристаллизовывают из уксусного эфира. В результате, получают 5,0 г 5-[4-(2 хлорэтилокси)фенил]-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола в виде кристаллов с температурой плавления 238-240 С. в) 5-[4-(2-Иодэтилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 5,0 г 5-[4-(2-хлорэтилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 190 мл этилметилкетона перемешивают с 7,24 г иодида натрия в течение 28 ч при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и кристаллизуют из смеси ацетон/гексан. В результате, получают 5,9 г 5-[4-(2-иодэтилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 229-231 С. г) 5-4-[2-(Метиламино)этокси]фенил-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 4,5 г 5-[4-(2-иодэтилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 100 мл 2-метоксиэтанола перемешивают с 7,2 мл 40%-ного водного раствора метиламина в течение 2 ч при температуре бани 100 С. Затем сливают на насыщенный раствор поваренной соли, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия, концентрируют под вакуумом и разделяют путем перемешивания с уксусным эфиром. В результате, получают 2,7 г 5-4-[2-(метиламино)этокси]фенил-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 184-187 С. 26 д) 5-[4-(2-Метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]аминоэтокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. К раствору из 1,7 г 5-4-[2-(метиламино)этокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 34 мл 2-метоксиэтанола примешивают по каплям 3,4 мл 1-иод-3-(4,4,5,5,5-пентафторпентилтио)пропана и перемешивают в течение 1 ч при температуре бани 140 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и кристаллизуют из смеси ацетон/гексан. В результате,получают 1,1 г 5-[4-(2-метил-[3-(4,4,5,5,5-пентафторпентилтио)пропил]аминоэтокси)фенил]6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2 ола в виде кристаллов с температурой плавления 40-42 С. Пример 12. N-бутил-N-метил-2-5-[4-(2 гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтиоацетамид. а) 2-5-[4-(5-Иодпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропиран. Раствор из 1,25 г 2-5-[4-(5-хлорпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 40 мл этилметилкетона перемешивают с 1,38 г иодида натрия в течение 9 ч при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 0,7 г 2-5-[4-(5-иодпентилокси)фенил]6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2 илокситетрагидропирана в виде кристаллов с температурой плавления 109-111 С. б) S-5-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил) фенокси]пентилтиоацетат. Раствор из 0,7 г 2-5-[4-(5-иодпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 15 мл ацетона перемешивают с 392 мг тиоацетата калия в течение 2 ч при комнатной температуре. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 550 мг S-5-[4-(6-фенил-2-тетрагидропиранилокси 8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтиоацетата в виде кристаллов с температурой плавления 84-86 С. в) N-бутил-N-метил-2-5-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтиоацетамид. 27 Раствор из 0,5 г S-5-[4-(6-фенил-2 тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтиоацетата в 8 мл метанола и 5 мл тетрагидрофурана перемешивают с 0,2 мл 30%-ного раствора метилата натрия в метаноле в течение 0,5 ч при комнатной температуре и после добавления 0,25 мл 2 бром-N-бутил-N-метилацетамида продолжают перемешивание еще в течение 1 ч. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате получают 450 мг N-бутил-Nметил-2-5-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил) фенокси]пентилтиоацетамида в виде масла. г) N-бутил-N-метил-2-5-[4-(2-гидрокси-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил) фенокси]пентилтиоацетамид. Раствор из 400 г N-бутил-N-метил-2-5-[4(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентилтиоацетамида в 11 мл метанола и 1,1 мл воды перемешивают с 0,4 г щавелевой кислоты в течение 1 ч при температуре бани 100 С. Затем сливают на воду и 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом досуха и перекристаллизовывают из пентана. В результате, получают 360 мг N-бутил-N-метил-2-5-[4-(2-гидрокси-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-5 ил)фенокси]пентилтиоацетамида в виде кристаллов с температурой плавления 112-114 С. Пример 13. 5-4-[5-(4,4,5,5,5-Пентафторпентансульфонил)пентилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 2-5-[4-(5-(4,4,5,5,5-Пентафторпентансульфонил)пентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропиран. Суспензию из 0,5 г 4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]фенола (пример 8 ж) в 7 мл тетрагидрофурана перемешивают с 212,5 мг карбоната калия и 620 мг 1-иод-5-(4,4,5,5,5 пентафторпентансульфонил)пентана в течение 11 ч при температуре бани 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси гексан/уксусный эфир. В результате, получают 770 мг 2-5-[4-(5(4,4,5,5,5-пентафторпентансульфонил)пентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в виде кристаллов с температурой плавления 107110 С. 28 б) 5-4-[5-(4,4,5,5,5-Пентафторпентансульфонил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 0,7 г 2-5-[4-(5-(4,4,5,5,5-пентафторпентансульфонил)пентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 16 мл метанола и 1,6 мл воды перемешивают с 0,7 г щавелевой кислоты в течение 1 ч при температуре бани 100 С. Затем концентрируют под вакуумом до объема 50 мл, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, концентрируют под вакуумом досуха и перекристаллизовывают из уксусного эфира. В результате, получают 0,46 г 5-4-[5-(4,4,5,5,5 пентафторпентансульфонил)пентилокси]фенил 6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 176178 С. Пример 14. N-бутил-N-метил-2-5-[4-(2-гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен 5-ил)фенокси]пентансульфинилацетамид. Аналогично примеру 2 окисляют 210 мг Nбутил-N-метил-2-5-[4-(2-гидрокси-6-фенил-8,9 дигидро-7 Н-бензоциклогептен-5-ил)фенокси] пентилтиоацетамида (пример 12) и, в результате, получают 132 мг N-бутил-N-метил-2-5-[4(2-гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]пентансульфинилацетамида в виде кристаллов с температурой плавления 87-89 С. Пример 15. N-бутил-2-[2-(2-[4-(2-гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен 5-ил)фенокси]этилметиламино)этансульфинил]-N-метилацетамид. а) 2-5-[4-(2-Иодэтилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-илокси тетрагидропиран. Аналогично примеру 11 в иодируют раствор из 1,7 г 2-5-[4-(2-хлорэтилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана (пример 11 а) и получают 2 г 2-5-[4-(2-иодэтилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-илокси тетрагидропирана в виде кристаллов с температурой плавления 165-166 С. б) 2-5-4-[2-(метиламино)этокси]фенил 6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2 илокситетрагидропиран. Раствор из 2 г 2-5-[4-(2-иодэтилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 45 мл 2 метоксиэтанола перемешивают с 3,2 мл 40%ного водного раствора метиламина в течение 2 ч при температуре бани 100 С. Затем сливают на насыщенный раствор гидрокарбоната натрия, 3 раза экстрагируют уксусным эфиром, сушат над сульфатом натрия и концентрируют под вакуумом. В результате, получают 1,65 г 2-54-[2-(метиламино)этокси]фенил-6-фенил-8,9 29 дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в виде кристаллов с температурой плавления 133-137 С. в)N-бутил-2-[2-(2-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этилметиламино)этансульфинил]-N-метилацетамид. Раствор из 825 мг 2-5-4-[2-(метиламино)этокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 20 мл 2-метоксиэтанола перемешивают с 583 мг Nбутил-2-иодэтансульфинил-N-метилацетамида в течение 3,5 ч при температуре бани 120 С. Затем сливают на раствор поваренной соли, трижды экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси дихлорметан/метанол. В результате,получают 0,72 г N-бутил-2-[2-(2-[4-(6-фенил-2 тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этилметиламино) этансульфинил]-N-метилацетамида в виде пенистого вещества. г)N-бутил-2-иодэтансульфонил-N-метилацетамида в течение 3,5 ч при температуре бани 120 С. Затем сливают на раствор поваренной соли, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют на силикагеле с использованием смеси дихлорметан/метанол. В результате,получают 324 мг N-бутил-2-[2-(2-[4-(6-фенил 2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси] этилметиламино) этансульфонил]-N-метилацетамида в виде пенистого вещества. 30 б) N-бутил-2-[2-(2-[4-(2-гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этилметиламино)этансульфонил]-N-метилацетамид. Аналогично примеру 11 б из 300 мг N-бутил-2-[2-(2-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил) фенoкcи]этилмeтилaминo)этaнcyльфонил]-Nмeтилaцeтaмидa получают 231 мг N-бутил-2-[2(2-[4-(2-гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]этилметиламино)этансульфонил]-N-метилацетамида в виде кристаллов с температурой плавления 5760 С. Пример 17. 6-(4-Гидроксифенил-5-4-[5-(4,4,5,5,5-пентафторпентансульфонил)пентилокси] фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 2-Бензилокси-6-(4-трет-бутилдиметилсилилоксифенил)-5-(4-метоксифенил)-8,9-дигидро-7 Н-бензоциклогептен. Раствор из 10 г 2-бензилокси-6-бром-5-(4 метоксифенил)-8,9-дигидро-7 Н-бензоциклогептена (пример 8 в) в 114 мл толуола и 57 мл этанола перемешивают с 5,81 г [4-(трет-бутилдиметилсилилокси)фенил]борной кислоты, 23 мл 2 М водного раствора карбоната натрия и 246 мг тетракистрифенилфосфинпалладия (0) в течение 1 ч при температуре бани +90 С. Затем разбавляют уксусным эфиром, 2 раза промывают водой и раствором поваренной соли, сушат над сульфатом натрия и концентрируют под вакуумом. В результате, получают 13 г 2-бензилокси 6-(4-трет-бутилдиметилсилилоксифенил)-5-(4 метоксифенил)-8,9-дигидро-7 Н-бензоциклогептена. б) 4-[2-Бензилокси-5-(4-метоксифенил)-8,9 дигидро-7 Н-бензоциклогептен-6-ил]фенол. Суспензию из 13 г 2-бензилокси-6-(4-третбутилдиметилсилилоксифенил)-5-(4-метоксифенил)-8,9-дигидро-7 Н-бензоциклогептена в 235 мл метанола перемешивают с 7,25 мл концентрированной соляной кислоты в течение 7,5 ч при температуре бани 50 С. Затем нейтрализуют гидрокарбонатом натрия, концентрируют под вакуумом, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают раствором поваренной соли, сушат над сульфатом натрия, концентрируют под вакуумом и перекристаллизовывают из метанола. В результате, получают 10,3 г 4-[2-бензилокси-5-(4-метоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-6-ил] фенола в виде кристаллов с температурой плавления 173-175 С. в) 5-(4-Метоксифенил)-6-(4-гидроксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 10,3 г 4-[2-бензилокси-5-(4-метоксифенил)-8,9-дигидро-7 Н-бензоциклогептен 6-ил]фенола в 350 мл дихлорметана перемешивают сначала при 0 С с 8,76 мл N,Nдиметиланилина в течение 5 мин, а затем с 12,2 г хлорида алюминия в течение 4,5 ч при 0 С. После этого при 0 С смешивают с 2 М соляной 31 кислотой, сливают на воду, 3 раза экстрагируют дихлорметаном, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и разделяют путем перемешивания с диэтиловым эфиром и небольшим количеством дихлорметана. В результате, получают 7,8 г 5-(4-метоксифенил)-6-(4 гидроксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 250-252 С. г) 2-[5-(4-Метоксифенил)-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокси]тетрагидропиран. Раствор из 7,8 г 5-(4-метоксифенил)-6-(4 гидроксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 80 мл толуола и 40 мл тетрагидрофурана перемешивают с 17,4 мл дигидропирана и 71,4 мг паратолуолсульфокислоты в течение 20 ч при комнатной температуре. Затем разбавляют уксусным эфиром, промывают гидрокарбонатом натрия и раствором поваренной соли,сушат над сульфатом натрия, концентрируют под вакуумом и разделяют путем перемешивания с диэтиловым эфиром и небольшим количеством уксусного эфира. В результате, получают 8,1 г 2-[5-(4-метоксифенил)-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокси]тетрагидропирана в виде кристаллов с температурой плавления 160-161 С. д) 4-[2-Тетрагидропиранилокси-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]фенол. Раствор из 8,0 г 2-[5-(4-метоксифенил)-6(4-тетрагидропиранилоксифенил)-8,9-дигидро 7 Н-бензоциклогептен-2-илокси]тетрагидропирана в 160 мл диметилформамида перемешивают с 3,2 г метантиолата натрия в течение 7 ч при 140 С. Затем сливают на воду, трижды экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют подвакуумом и разделяют путем перемешивания с диэтиловым эфиром. В результате, получают 7,4 г 4-[2-тетрагидропиранилокси-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-5-ил] фенола в виде кристаллов с температурой плавления 182-183 С. е) 2-5-[4-(5-(4,4,5,5,5-Пентафторпентансульфонил)пентилокси)фенил]-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропиран. Суспензию из 1 г 4-[2-тетрагидропиранилокси-6-(4-тетрагидропиранилоксифенил)8,9-дигидро-7 Н-бензоциклогептен-5-ил]фенола в 14 мл ацетонитрила рециркулируют с 342 мг карбоната калия и 1 г 1-иод-5-(4,4,5,5,5-пентафторпентансульфонил)пентана в течение 21 ч при температуре бани 100 С. Затем концентрируют под вакуумом, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и пере 004182 32 кристаллизовывают из диэтилового эфира. В результате, получают 1,6 г 2-5-[4-(5-(4,4,5,5,5 пентафторпентансульфонил)пентилокси)фенил]6-(4-тетрагидропиранилоксифенил)-8,9-дигидро 7 Н-бензоциклогептен-2-илокситетрагидропирана в виде кристаллов с температурой плавления 108110 С. ж) 6-(4-Гидроксифенил)-5-4-[5-(4,4,5,5,5 пентафторпентансульфонил)пентилокси]фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. Суспензию из 1,5 г 2-5-[4-(5-(4,4,5,5,5 пентафторпентансульфонил)пентилокси)фенил]6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в 34 мл метанола и 3,4 мл воды перемешивают с 1,5 г щавелевой кислоты в течение 1 ч при 100 С. Затем сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и хроматографируют с использованием смеси гексан/диэтиловый эфир. В результате, получают 924 мг 6-(4-гидроксифенил)-5-4-[5-(4,4,5,5,5 пентафторпентансульфонил)пентилокси]фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 168170 С. Пример 18. N-бутил-2-6-[4-(2-гидрокси-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил) фенокси]гексансульфинил-N-метилацетамид. Аналогично примеру 2 окисляют 0,4 г Nбутил-2-6-[4-(2-гидрокси-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-5-ил)фенокси]гексилтиоN-метилацетамида (пример 19) и получают 394 мг 33 тетрагидропирана в виде кристаллов с температурой плавления 108-110 С. в) S-6-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил) фенокси]гексил]тиоацетат. Аналогично примеру 12 б 1 г 2-5-[4-(6 иодгексилокси)фенил]-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-илокситетрагидропирана тиоацетилируют 549 мг тиоацетата калия и получают 916 мг S-6-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]гексилтиоацетата в виде кристаллов с температурой плавления 98-100 С. г)N-бутил-N-метил-2-6-[4-(6-фенил-2 тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]гексилтиоацетамид. Аналогично примеру 12 в 0,8 г S-6-[4-(6 фенил-2-тетрагидропиранилокси-8,9-дигидро 7 Н-бензоциклогептен-5-ил)фенокси]гексилтиоацетата подвергают взаимодействию с 0,31 г 2 бром-N-бутил-N-метилацетамида с получением в результате 632 мг N-бутил-N-метил-2-6-[4-(6 фенил-2-тетрагидропиранилокси-8,9-дигидро 7 Н-бензоциклогептен-5-ил)фенокси]гексилтио ацетамида. д) N-бутил-2-6-[4-(2-гидрокси-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]гексилтио-N-метилацетамид. Аналогично примеру 12 г из 0,6 г N-бутилN-метил-2-6-[4-(6-фенил-2-тетрагидропиранилокси-8,9-дигидро-7 Н-бензоциклогептен-5 ил)фенокси]гексилтиоацетамида и 0,6 г щавелевой кислоты получают 520 мг N-бутил-2-6[4-(2-гидрокси-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-5-ил)фенокси]гексилтио-N-метилацетамида в виде кристаллов с температурой плавления 103-105 С. Пример 20. 6-(4-Гидроксифенил)-5-4-[5(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 2-5-[4-(5-Xлорпентилокси)фенил]-6-(4 тетрагидропиранилоксифенил)-8,9-дигидро-7 Нбензоциклогептен-2-илокситетрагидропиран. Аналогично примеру 8 з 2 г 4-[2-тетрагидропиранилокси-6-(4-тетрагдропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-ил] фенола (пример 17 д) алкилируют 0,61 мл 1 бром-5-хлорпентана и получают 2,4 г 2-5-[4-(5 хлорпентилокси)фенил]-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана в виде кристаллов с температурой плавления 110-112 С. б) 2-5-[4-(5-Иодпентилокси)фенил]-6-(4 тетрагидропиранилоксифенил)-8,9-дигидро-7 Нбензоциклогептен-2-илокситетрагидропиран. Аналогично примеру 12 а 2,3 г 2-5-[4-(5 хлорпентилокси)фенил]-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана замещают 2,13 г иодида натрия и получают 2,6 г 2-5-[4-(5-иодпентилокси)фенил]-6-(4-тетрагидропиранилок 004182 34 сифенил)-8,9-дигидро-7 Н-бензоциклогептен-2 илокситетрагидропирана. в) 6-(4-Гидроксифенил)-5-[4-(5-иодпентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен 2-ол. Аналогично примеру 12 г из 2,6 г 2-5-[4(5-иодпентилокси)фенил]-6-(4-тетрагидропиранилоксифенил)-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана и 2,6 г щавелевой кислоты получают 2,0 г 6-(4-гидроксифенил)-5-[4-(5-иодпентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 202-204 С. г) 6-(4-Гидроксифенил)-5-4-[5-(4,4,5,5,5 пентафторпентилтио)пентилокси]фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол. Аналогично примеру 8 л 1,9 г 6-(4-гидроксифенил)-5-[4-(5-иодпентилокси)фенил]-8,9 дигидро-7 Н-бензоциклогептен-2-ола подвергают взаимодействию с 1,7 г 4,4,5,5,5-пентафторпентилтиоацетата. В результате, получают 1,4 г 6-(4-гидроксифенил)-5-4-[5-(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 157-158 С. Пример 21. 6-(4-Гидроксифенил)-5-4-[5(4,4,5,5,5-пентафторпентансульфинил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2 ол. Аналогично примеру 2 окисляют 1,3 г 6-(4 гидроксифенил)-5-4-[5-(4,4,5,5,5-пентафторпентилтио)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола и получают 2,2 г 6-(4 гидроксифенил)-5-4-[5-(4,4,5,5,5-пентафторпентансульфинил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 165-168 С. Пример 22. 5-4-[4-(4,4,5,5,5-пентафторпентилтио)бутилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 2-5-[4-(4-хлорбутилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропиран. 4,8 г 4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил] фенола (пример 8 ж) предварительно помещают в 50 мл ацетонитрила, при комнатной температуре примешивают 2,04 г карбоната калия и 1,61 мл 1-бром-4-хлорбутана, после чего перемешивают в течение 8 ч при 90 С. Вследствие неполного превращения добавляют еще 20% от первоначального количества карбоната калия и 1 бром-4-хлорбутана и нагревают в течение последующих 6 ч при 90 С. Для дальнейшей переработки смесь концентрируют под вакуумом,смешивают с водой, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. Остаток очищают на силикагеле, используя смесь гексан/уксусный эфир. В результате, получают 5,18 г 2-5-[4-(4-хлорбутилокси)фенил]-6-фенил-8,9 35 дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана. б) 5-[4-(4-Xлорбутилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. 5,15 г 2-5-[4-(4-хлорбутилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана суспендируют в 100 мл метанола и 10 мл воды, смешивают с 4,47 г щавелевой кислоты и перемешивают в течение 75 мин при 100 С. Затем растворитель отгоняют под вакуумом наполовину, смесь сливают в воду, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. После препаративной колоночной хроматографии на силикагеле, используя смесь гексан/уксусный эфир, получают 5,01 г 5-[4-(4-хлорбутилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола. в) 5-[4-(4-Иодбутилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. 2,0 г 5-[4-(4-хлорбутилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола предварительно помещают в 72 мл этилметилкетона, смешивают с 2,70 г иодида натрия и нагревают в течение 12 ч при 100 С с обратным холодильником. Охлажденную реакционную смесь концентрируют под вакуумом, смешивают с водой, 3 раза экстрагируют уксусным эфиром. Затем органическую фазу промывают раствором тиосульфата натрия и насыщенным раствором хлорида натрия. После сушки над сульфатом магния и концентрирования под вакуумом получают 2,14 г 5-[4-(4-иодбутилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола, который без дальнейшей очистки используют на следующей стадии. г) 5-4-[4-(4,4,5,5,5-Пентафторпентилтио) бутилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 1,22 г 4,4,5,5,5-пентафторпентилтиоацетата в 6 мл метанола перемешивают с 0,98 мл 30%-ного раствора метилата натрия в метаноле при комнатной температуре в течение 0,5 ч. Этот раствор по каплям добавляют к суспензии из 2,1 г 5-[4-(4-иодбутилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 25 мл метанола и 25 мл диэтилового эфира и перемешивают в течение 4 ч при комнатной температуре. Затем реакционную смесь концентрируют под вакуумом, сливают на воду, 3 раза концентрируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После разделения путем колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 1,84 г 5-4-[4(4,4,5,5,5-пентафторпентилтио)бутилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 167 С. 36 Пример 23. 6-Фенил-5-4-[4-(пиридин-2 илметилтио)бутилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. 12,3 г 10%-ного раствора 2-меркаптометилпиридина в этаноле по каплям смешивают с 1,67 мл 30%-ного раствора метилата натрия в метаноле при комнатной температуре и затем перемешивают еще в течение 15 мин. Далее раствор по каплям добавляют к суспензии из 1,70 г 5-[4-(4-иодбутилокси)фенил]-6-фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ола(пример 22 в) в 16 мл метанола и нагревают в течение 2 ч при температуре бани 80 С с обратным холодильником. Из охлажденной реакционной смеси удаляют растворитель, к остатку примешивают полунасыщенный раствор хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия,сушат над сульфатом магния и концентрируют под вакуумом. После очистки путем колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 1,37 г 6-фенил-5-4-[4-(пиридин-2-илметилтио) бутилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 155 С. Пример 24. 6-Фенил-5-4-[5-(пиридин-2 илметилтио)пентилокси]фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. 21,4 г 10%-ного раствора 2-меркаптометилпиридина в этаноле по каплям смешивают с 2,91 мл 30%-ного раствора метилата натрия в метаноле при комнатной температуре и после этого перемешивают в течение 15 мин. Затем раствор по каплям добавляют к суспензии из 2,52 г 5-[4-(5-хлорпентилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 8 и) и 1,03 г иодида натрия в 29 мл метанола и кипятят с обратным холодильником в течение 2 ч при температуре бани 80 С. Для последующей переработки реакционную смесь охлаждают до комнатой температуры и под вакуумом удаляют растворитель. К остатку добавляют полунасыщенный раствор хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия,сушат над сульфатом магния и концентрируют под вакуумом. После перекристаллизации из уксусного эфира получают 2,15 г 6-фенил-5-4[5-(пиридин-2-илметилтио)пентилокси]фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 159 С. Пример 25. 6-Фенил-5-4-[6-(пиридин-2 илметилтио)гексилокси]фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. 16,8 г 10%-ного раствора 2-меркаптометилпиридина в этаноле по каплям смешивают при комнатной температуре с 2,30 мл 30%-ного раствора метилата натрия в метаноле, после чего перемешивают в течение 15 мин. Затем раствор по каплям добавляют к суспензии из 2,05 г 5-[4-(6-хлоргексилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 28 а) 37 и 812 мг иодида натрия в 22 мл метанола и кипятят в течение 2 ч при температуре бани 80 С с обратным холодильником. Для последующей переработки реакционную смесь охлаждают до комнатной температуры и под вакуумом удаляют растворитель. К остатку добавляют полунасыщенный раствор хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором поваренной соли, сушат над сульфатом магния и концентрируют под вакуумом. После перекристаллизации из уксусного эфира получают 1,63 г 6-фенил-5-4-[6-(пиридин-2-илметилтио)гексилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 127 С. Пример 26. 5-4-[4-(4,4,5,5,5-Пентафторпентансульфинил)бутилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,41 г 5-4-[4-(4,4,5,5,5-пентафторпентилтио)бутилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола (пример 22 г) суспендируют в 40 мл метанола и 2,32 мл воды, смешивают с 550 мг периодата натрия и перемешивают в течение 12 ч при комнатной температуре. Затем отгоняют метанол под вакуумом, остаток сливают в воду, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. После растирания сырого продукта с гексаном получают 1,39 г 5-4-[4-(4,4,5,5,5-пентафторпентансульфинил) бутилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 155 С. Пример 27. 6-Фенил-5-4-[4-(пиридин-2 илметансульфинил)бутилокси]фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол. 990 мг 6-фенил-5-4-[4-(пиридин-2-илметилтио)бутилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола (пример 23) суспендируют в 3,2 мл метанола и 1,85 мл воды, смешивают с 440 мг периодата натрия и в течение ночи перемешивают при комнатной температуре. На следующий день смесь нагревают в течение 75 мин до 50 С. Затем для последующей переработки удаляют под вакуумом растворитель, к остатку добавляют воду, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. После очистки сырого продукта на силикагеле с использованием смеси метиленхлорид/метанол получают 612 мг 6-фенил-5-4-[4-(пиридин-2 илметансульфинил)бутилокси]фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 162 С. Пример 28. 5-4-[6-(4,4,5,5,5-Пентафторпентилтио)гексилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) 5-[4-(6-Xлоргексилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 38 5,42 г 2-5-[4-(6-хлоргексилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана (пример 19 а) растворяют в 100 мл тетрагидрофурана и 10 мл воды,примешивают 4,64 г щавелевой кислоты и в течение 75 мин перемешивают при температуре бани 100 С. После этого реакционную смесь охлаждают до комнатной температуры и растворитель отгоняют под вакуумом. К остатку добавляют воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния,сушат над сульфатом магния и сгущают под вакуумом. После разделения посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 4,17 г 5-[4-(6-хлоргексилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 193 С. б) 5-[4-(6-Иодгексилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. 2,05 г 5-[4-(6-хлоргексилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола предварительно помещают в 70 мл этилметилкетона, затем примешивают 2,60 г иодида натрия и перемешивают в течение 12 ч при температуре бани 100 С. Охлажденную реакционную смесь концентрируют под вакуумом, добавляют воду и 3 раза экстрагируют уксусным эфиром. После этого органическую фазу промывают раствором тиосульфата натрия и насыщенным раствором хлорида натрия. После сушки над сульфатом магния и концентрирования под вакуумом получают 2,50 г 5-[4-(6-иодгексилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола, который без дальнейшей очистки используют на следующей стадии. в) 5-4-[6-(4,4,5,5,5-Пентафторпентилтио) гексилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. Раствор из 1,37 г 4,4,5,5,5-пентафторпентилтиоацетата в 6 мл метанола перемешивают с 1,1 мл 30%-ного раствора метилата натрия в метаноле в течение 0,5 ч при комнатной температуре. Этот раствор по каплям добавляют к суспензии из 2,48 г 5-[4-(6-иодгексилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в 25 мл метанола и 25 мл диэтилового эфира и перемешивают в течение 4 ч при комнатной температуре. Затем смесь концентрируют под вакуумом, сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После перекристаллизации сырого продукта из гексана и диэтилового эфира получают 2,44 г 5-4-[6(4,4,5,5,5-пентафторпентилтио)гексилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 166 С. Пример 29. 5-4-[6-(4,4,5,5,5-Пентафторпентансульфинил)гексилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. 39 2,1 г 5-4-[6-(4,4,5,5,5-пентафторпентилтио)гексилокси]фенил-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ола (пример 28 в) предварительно помещают в 56 мл метанола и 3,3 мл воды, затем добавляют 782 мг периодата натрия и перемешивают в течение 12 ч при комнатной температуре. После этого под вакуумом отгоняют метанол, остаток сливают на воду, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. В результате, получают 2,13 г 5-4[6-(4,4,5,5,5-пентафторпентансульфинил)гексилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 121 С. Пример 30. 6-Фенил-5-4-[6-(пиридин-2 илметансульфинил)гексилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,30 г 6-фенил-5-4-[6-(пиридин-2-илметилтио)гексилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 25) предварительно помещают в 40 мл метанола и 2,3 мл воды,затем примешивают 550 мг периодата натрия и в течение ночи перемешивают при комнатной температуре. На следующий день в течение 6 ч нагревают до 40 С и повторно перемешивают в течение ночи при комнатной температуре. После этого под вакуумом отгоняют метанол, к остатку добавляют воду, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. После разделения посредством колоночной хроматографии на силикагеле с использованием смеси метиленхлорид/метанол получают 464 мг 6-фенил-5-4-[6-(пиридин-2-илметансульфинил) гексилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 80 С. Пример 31. 6-Фенил-5-4-[5-(пиридин-2 илметансульфинил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,86 г 6-фенил-5-4-[5-(пиридин-2-илмeтилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 24) предварительно помещают в 58 мл метанола и 3,4 мл воды,затем примешивают 805 мг периодата натрия,перемешивают в течение ночи при комнатной температуре, а на следующий день в течение 6 ч при 40 С. После этого под вакуумом отгоняют метанол, к остатку добавляют воду, трижды экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. В результате получают 2,97 г сырого продукта, который очищают посредством колоночной хроматографии на силикагеле с использованием смеси метиленхлорид/метанол. После перекристаллизации из метиленхлорида и простого эфира получают 635 мг 6-фенил-5-4-[5(пиридин-2-илметансульфинил)пентилокси]фе 004182 40 нил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 176 С. Пример 32. 5-4-[5-(Фуран-2-илметилтио) пентилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. 0,6 мл фурфурилмеркаптана в 2 мл метанола по каплям смешивают при комнатной температуре с 1,1 мл 30%-ного раствора метилата натрия в метаноле и перемешивают в течение 15 мин. Затем этот раствор по каплям добавляют к суспензии из 1,08 г 5-[4-(5-иодпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 8) и нагревают в 10 мл метанола в течение 2 ч до температуры бани 80 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, смешивают с полунасыщенным раствором хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. После перекристаллизации из гексана получают 920 мг 5-4-[5-(фуран-2-илметилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 171 С. Пример 33. 6-Фенил-5-4-[5-(тиен-2-илметилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 0,24 мл 2-тиенилметилмеркаптана растворяют в 1 мл метанола и по каплям смешивают с 0,5 мл 30%-ного раствора метилата натрия в метаноле при комнатной температуре. Далее перемешивают еще в течение 15 мин, а затем этот раствор добавляют к суспензии из 524 мг 5[4-(5-иодпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 8 к) в 5 мл метанола и в течение 2 ч нагревают до температуры бани 80 С. Охлажденную до комнатной температуры реакционную смесь сливают в полунасыщенный раствор хлорида натрия, 3 раза экстрагируют уксусным эфиром, сушат над сульфатом магния и концентрируют под вакуумом. После перекристаллизации из гексана получают 451 мг 6-фенил-5-4-[5-(тиен-2-илметилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 178 С. Примеры 34 и 35. 5-4-[5-(Фуран-2-илметансульфинил)пентилокси]фенил-6-фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол и 5-4-[5(фуран-2-илметансульфонил)пентилокси]фенил 6-фенил-8,9-дигидро-7 Н-бензоциклогеп-тен-2 ол. 510 мг 5-4-[5-(фуран-2-илметилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 32) растворяют в 16 мл метанола и 0,95 мл воды, смешивают с 225 мг периодата натрия и в течение ночи перемешивают при комнатной температуре. На следующий день добавляют еще 55 мг периодата натрия и перемешивают в течение 1 ч при 50 С. 41 Затем охлажденную реакционную смесь сливают в полунасыщенный раствор хлорида натрия,3 раза экстрагируют уксусным эфиром, промывают насыщенным раствором хлорида натрия,сушат над сульфатом натрия и концентрируют под вакуумом. После очистки путем, колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 498 мг 5-4-[5-(фуран-2-илметансульфинил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 168 С и 16 мг 5-4-[5-(фуран-2-илметансульфонил) пентилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола с температурой плавления 186 С. Примеры 36 и 37. 6-Фенил-5-4-[5-(тиен-2 илметансульфонил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол и 6-фенил-54-[5-(тиен-2-илметансульфинил)пентилокси] фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 386 мг 6-фенил-5-4-[5-(тиен-2-илметилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 33) подвергают реакции аналогично примерам 34/35. После хроматографической очистки на силикагеле с использованием смеси гексан/уксусный эфир получают 28 мг 6-фенил-5-4-[5-(тиен-2-илметансульфонил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 212 С и 312 мг 6-фенил-5-4-[5(тиен-2-илметансульфинил)пентилокси]фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 174-177 С. Пример 38. 5-4-[5-(3,3,4,4,5,5,5-Гептафторпентилтио)пентилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) (3,3,4,4,5,5,5-Гептафторпентил)-(5-4-[6 фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептeн-5-ил]феноксипентил) сульфид. 404 мг S-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)тиоацетата (пример 12 б) в 1 мл метанола по каплям смешивают при комнатной температуре с 0,14 мл 30%-ного раствора метилата натрия в метаноле. Затем перемешивают еще в течение 30 мин при комнатной температуре, после чего по каплям добавляют раствор из 187 мг гептафтор-5-иодпентана в 4 мл метанола. После перемешивания в течение 90 мин при комнатной температуре смесь сливают в полунасыщенный раствор хлорида натрия, 3 раза экстрагируют уксусным эфиром,сушат над сульфатом магния и концентрируют под вакуумом. После очистки остатка посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 120 мг (3,3,4,4,5,5,5-гептафторпентил)-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфида. 42 б) 5-4-[5-(3,3,4,4,5,5,5-Гептафторпентилтио)пентилокси]фенил-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. 110 мг (3,3,4,4,5,5,5-гептафторпентил)-(54-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9 дигидро-7 Н-бензоциклогептен-5-ил]фенокси пентил)сульфида растворяют в 2,5 мл метанола и 0,25 мл воды, смешивают со 100 мг щавелевой кислоты и перемешивают в течение 2 ч при 50 С. Затем охлажденную реакционную смесь смешивают с приблизительно 5 мл воды и перемешивают в течение 30 мин. Выпавший осадок отфильтровывают с помощью вакуумфильтра, тщательно промывают и сушат под вакуумом. В результате, получают 86 мг 5-4[5-(3,3,4,4,5,5,5-гептафторпентилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 156 С. Пример 39. 5-4-[2-(1-гидроксиэтиламино)этокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. Раствор из 1 г 5-[4-(2-иодэтилокси)фенил]6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2 ола (пример 11 в) в 10 мл метанола в течение 0,5 ч при температуре бани 160 С рециркулируют с 1,24 мл 2-аминэтанола. Затем сливают на раствор гидрокарбоната натрия, 3 раза экстрагируют смесью уксусный эфир/метанол (в соотношении 4:1), промывают до нейтрального состояния, сушат над сульфатом натрия, концентрируют под вакуумом и перекристаллизовывают из смеси уксусный эфир/метанол. В результате, получают 621 мг 5-4-[2-(1-гидроксиэтиламино)этокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола в виде кристаллов с температурой плавления 176-178 С. Исходный материал 1-Иод-3-(4,4,5,5,5-пентафторпентилтио)пропан, 1-иод-5-(4,4,5,5,5-пентафторпентансульфинил)пентан, 1-иод-5-(4,4,5,5,5-пентафторпентансульфонил)пентан, N-бутил-2-иодэтансульфинил-N-метилацетамид. Пример 40. 5-4-[5-(4-Фторбутилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) (4-Фторбутил)-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфид. 500 мг S-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)тиоацетата (пример 12 б) растворяют в 5 мл тетрагидрофурана и 7,4 мл метанола и при комнатной температуре по каплям смешивают с 0,2 мл 30%-ного раствора метилата натрия в метаноле. После этого перемешивают еще в течение 30 мин при комнатной температуре, а затем при той же температуре по каплям добавляют 0,15 мл 1-бром-4 фторбутана. Через 90 мин реакционную смесь смешивают с полунасыщенным раствором хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, 43 сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 344 мг (4-фторбутил)-(5-4-[6-фенил-2(тетрагидропиран-2-илокси)-8,9-дигидро-7 Нбензоциклогептен-5-ил]феноксипентил)сульфида в виде пенистого вещества. б) 5-4-[5-(4-Фторбутилтио)пентилокси] фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 336 мг (4-фторбутил)-(5-4-[6-фенил-2(тетрагидропиран-2-илокси)-8,9-дигидро-7 Нбензоциклогептен-5-ил]феноксипентил)сульфида растворяют в 9 мл метанола, 10 мл тетрагидрофурана и 0,92 мл воды, смешивают с 368 мг щавелевой кислоты и перемешивают при 50 С. Через 2 ч добавляют еще 184 мг щавелевой кислоты. Через 24 ч реакционную смесь охлаждают до комнатной температуры, смешивают с 25 мл воды и перемешивают в течение 30 мин. Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. В результате,получают 275 мг 5-4-[5-(4-фторбутилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 163 С. Пример 41. 5-4-[5-(4-Фторбутансульфинил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 181 мг 5-4-[5-(4-фторбутилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 40 б) растворяют в 6 мл метанола и 0,5 мл воды, смешивают с 81 мг периодата натрия и перемешивают в течение 2 ч при 50 С. Для дальнейшей переработки реакционную смесь смешивают с разбавленным раствором хлорида натрия, 3 раза экстрагируют метиленхлоридом, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Остаток отделяют путем перемешивания с 10 мл простого эфира, твердое вещество отфильтровывают с помощью вакуум-фильтра и сушат. В результате, получают 173 мг 5-4-[5(4-фторбутансульфинил)пентилокси]фенил-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 233 С. Пример 42. 6-Фенил-5-4-[5-(4,4,4-трифторбутилтио)пентилокси]фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. а) 5-4-[6-Фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил] феноксипентил-(4,4,4-трифторбутил)сульфид. 500 мг S-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)тиоацетата (пример 12 б) растворяют в 5 мл тетрагидрофурана и 7,4 мл метанола и при комнатной температуре по каплям смешивают с 0,2 мл 30%-ного раствора метилата натрия в метаноле. После этого перемешивают еще в течение 30 мин при комнатной температуре и затем при той же температуре 44 добавляют 325 мг 4,4,4-трифтор-1-иодбутана. Через 90 мин реакционную смесь смешивают с полунасыщенным раствором хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 314 мг 5-4-[6 фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил(4,4,4-трифторбутил)сульфида в виде пенистого вещества. б) 6-Фенил-5-4-[5-(4,4,4-трифторбутилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 310 мг 5-4-[6-фенил-2-(тетрагидропиран 2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил-(4,4,4-трифторбутил)сульфида растворяют в 8 мл метанола, 7 мл тетрагидрофурана и 0,8 мл воды, смешивают с 319 мг щавелевой кислоты и перемешивают в течение 3 ч при 50 С. После этого реакционную смесь охлаждают до комнатной температуры, смешивают с 25 мл воды и перемешивают в течение 30 мин. Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. В результате, получают 243 мг 6-фенил-5-4-[5-(4,4,4-трифторбутилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 168 С. Пример 43. 6-Фенил-5-4-[5-(4,4,4-трифторбутансульфинил)пентилокси]фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол. 109 мг 6-фенил-5-4-[5-(4,4,4-трифторбутилтио)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола растворяют при 0 С в 4 мл тетрагидрофурана, смешивают с 44 мг мхлорпербензойной кислоты и перемешивают при 0 С. Через 15 мин повторно добавляют 15 мг м-хлорпербензойной кислоты и перемешивают в течение следующих 15 мин при той же температуре 0 С. Для дальнейшей переработки реакционную смесь сливают в 10%-ный раствор тиосульфата натрия, 3 раза экстрагируют метиленхлоридом, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси метиленхлорид/метанол получают 82 мг 6-фенил-5-4-[5-(4,4,4-трифторбутансульфинил) пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 145 С. Пример 44. 5-4-[5-Метил-(4,4,5,5,5-пентафторпентил)амино]пентилоксифенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) Метил-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)амин. 45 914 мг 2-5-[4-(5-иодпентилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана (пример 12 а) растворяют в 5 мл тетрагидрофурана в автоклаве и при 15 С конденсируют в нем приблизительно 800 г метиламина. После этого закрытый автоклав оставляют на ночь при комнатной температуре. Для дальнейшей переработки реакционный сосуд охлаждают до -15 С, избыток метиламина испаряют при комнатной температуре в токе азота, затем смесь сливают в разбавленный раствор хлорида натрия, 3 раза экстрагируют метиленхлоридом, сушат над сульфатом магния и концентрируют под вакуумом. В результате,получают 809 мг метил-(5-4-[6-фенил-2(тетрагидропиран-2-илокси)-8,9-дигидро-7 Нбензоциклогептен-5-ил]феноксипентил)амина в виде сырого продукта, который без дальнейшей очистки используют на следующей стадии. б) Метил-(4,4,5,5,5-пентафторпентил)-(54-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9 дигидро-7 Н-бензоциклогептен-5-ил]фенокси пентил)амин. 809 мг метил-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)амина растворяют в 15 мл N-метилпирролидона, порциями смешивают в общей сложности с 698 мг 4,4,5,5,5-пентафторпентилтозилатом и перемешивают в течение 3 ч при 80 С. После охлаждения смеси до комнатной температуры реакционную смесь сливают в разбавленный раствор хлорида натрия, 3 раза экстрагируют диэтиловым эфиром, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси метиленхлорид/метанол получают 1,8 г метил-(4,4,5,5,5 пентафторпентил)-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)амина, содержащего еще примеси N-метилпирролидона. в) 5-4-[5-[Метил-(4,4,5,5,5-пентафторпентил)амино]пентилоксифенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,8 г метил-(4,4,5,5,5-пентафторпентил)-(54-[6 фенил-2-(тетрагидропиран-2-илокси)-8,9 дигидро-7 Н-бензоциклогептен-5-ил]фенокси пентил)амина, содержащего еще примеси N-метилпирролидона, растворяют в 25 мл метанола и 2,5 мл воды, смешивают с 1,85 г щавелевой кислоты и перемешивают в течение 90 мин при 50 С. После этого реакционную смесь охлаждают и сливают в разбавленный раствор гидрокарбоната натрия, 3 раза экстрагируют диэтиловым эфиром, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Остаток хроматографируют на силикагеле с использованием смеси метиленхлорид/метанол. В результате, получают 214 мг 54-[5-[метил-(4,4,5,5,5-пентафторпентил)амино] 46 пентилоксифенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола. Получение исходного материала 4,4,5,5,5-Пентафторпентилтозилат. 6,4 г п-толуолсульфонилхлорида предварительно помещают в 10 мл пиридина, по каплям смешивают с 5,44 г 4,4,5,5,5-пентафторпентан-1-ола при 0 С, после чего в течение 2 ч перемешивают при комнатной температуре. Для дальнейшей переработки смесь вводят в ледяную 2 н. соляную кислоту, три раза экстрагируют диэтиловым эфиром, промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 8,7 г 4,4,5,5,5-пентафторпентилтозилата в виде прозрачной жидкости. Пример 45. 5-[4-(5-Бензилтиопентилокси) фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) Бензил-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфид. 1,5 г S-(5-4-[6-фенил-2-(тетрагидропиран 2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)тиоацетата (пример 12 б) растворяют в 10 мл тетрагидрофурана и 22 мл метанола и при комнатной температуре по каплям смешивают с 0,6 мл 30%-ного раствора метилата натрия в метаноле. Затем перемешивают еще в течение 30 мин при комнатной температуре, после чего при той же температуре по каплям добавляют 0,5 мл бензилбромида. Через 2 ч реакционную смесь смешивают с разбавленным раствором хлорида магния, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 1,12 г бензил-(54-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9 дигидро-7 Н-бензоциклогептен-5-ил]фенокси пентил)сульфида в виде пенистого вещества. б) 5-[4-[5-Бензилтиопентилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,12 г бензил-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфида растворяют в 27 мл метанола, 3 мл тетрагидрофурана и 2,7 мл воды, смешивают с 1,16 г щавелевой кислоты и перемешивают в течение 3 ч при 0 С. После этого реакционную смесь охлаждают до комнатной температуры, смешивают с 5 мл воды и перемешивают в течение 5 мин. Выпавший осадок отфильтровывают с помощью вакуумфильтра и сушат. В результате, получают 855 мг 5-[4-(5-бензилтиопентилокси)фенил]-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 178-186 С. 47 Пример 46. 5-[4-(5-Бензилсульфинилпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 555 мг 5-[4-(5-бензилтиопентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 45) растворяют в 17 мл метанола, 15 мл уксусного эфира и 1 мл воды, смешивают с 241 мг периодата натрия и перемешивают сначала при комнатной температуре, а затем в течение 3 ч при 50 С. Для дальнейшей переработки реакционную смесь смешивают с разбавленным раствором хлорида натрия, 3 раза экстрагируют метиленхлоридом, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 469 мг 5-[4-(5-бензилсульфинилпентилокси)фенил]-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 196 С. Пример 47. 5-4-[5-(4-метилбензилтио) пентилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. а) (4-Метилбензил)-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфид. 1,5 г S-(5-4-[6-фенил-2-(тетрагидропиран 2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)тиоацетата (пример 12 б) растворяют в 5 мл тетрагидрофурана и 20 мл метанола и при комнатной температуре по каплям смешивают с 0,6 мл 30%-ного раствора метилата натрия в метаноле. После этого перемешивают еще в течение 30 мин при комнатной температуре, а затем при той же температуре по каплям добавляют раствор из 757 мг 4 метилбензилбромида в 5 мл тетрагидрофурана. Через 2 ч реакционную смесь смешивают с разбавленным раствором хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 1,24 г (4-метилбензил)-(5-4-[6-фенил-2-(тетрагидропиран-2 илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)сульфида в виде пенистого вещества. б) 5-4-[5-(4-Метилбензилтио)пентилокси] фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 250 мг (4-метилбензил)-(5-4-[6-фенил-2(тетрагидропиран-2-илокси)-8,9-дигидро-7 Нбензоциклогептен-5-ил]феноксипентил)сульфида растворяют в 6 мл метанола, 1 мл тетрагидрофурана и 0,6 мл воды, смешивают с 258 мг щавелевой кислоты и перемешивают в течение 3 ч при 50 С. Затем реакционную смесь охлаждают до комнатной температуры, смешивают с 5 мл воды и перемешивают в течение 5 мин. 48 Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. В результате, получают 196 мг 5-4-[5-(4-метилбензилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 165169 С. Пример 48. 5-4-[5-(4-Метилбензилсульфинил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 600 мг 5-4-[5-(4-метилбензилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 47 б) растворяют в 18 мл метанола, 15 мл уксусного эфира и 1 мл воды, смешивают с 252 мг периодата натрия и перемешивают сначала при комнатной температуре, а затем в течение 3 ч при 50 С. Для дальнейшей переработки реакционную смесь смешивают с разбавленным раствором хлорида натрия, 3 раза экстрагируют метиленхлоридом,промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 248 мг 5-4-[5-(4-метилбензилсульфинил)пентилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола. Пример 49. 6-Фенил-5-4-[5-(4-трифторметилбензилтио)пентилокси]фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. а) (5-4-[6-Фенил-2-(тетрагидропиран-2 илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)-(4-рифторметилбензил) сульфид. 1,5 г S-(5-4-[6-фенил-2-(тетрагидропиран 2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)тиоацетата (пример 12 б) растворяют в 10 мл тетрагидрофурана и 20 мл метанола и при комнатной температуре по каплям смешивают с 0,6 мл 30%-ного раствора метилата натрия в метаноле. После этого перемешивают еще в течение 30 мин при комнатной температуре, а затем при той же температуре по каплям добавляют 977 мг 4-(трифторметил)бензилбромида в 5 мл тетрагидрофурана. Через 2 ч реакционную смесь смешивают с разбавленным раствором хлорида натрия, 3 раза экстрагируют уксусным эфиром, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 1,15 г (5-4-[6 фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)(4-трифторметилбензил)сульфида в виде пенистого вещества. б) 6-Фенил-5-4-[5-(4-трифторметилбензилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,14 г (5-4-[6-фенил-2-(тетрагидропиран 2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 49 ил]феноксипентил)-(4-трифторметилбензил) сульфида растворяют в 27 мл метанола, 3 мл тетрагидрофурана и 2,7 мл воды, смешивают с 1,16 г щавелевой кислоты и перемешивают в течение 3 ч при 50 С. Затем реакционную смесь охлаждают до комнатной температуры, смешивают с 5 мл воды и перемешивают в течение 5 мин. Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. В результате,получают 933 мг 6-фенил-5-4-[5-(4-трифторметилбензилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 147 С. Пример 50. 6-Фенил-5-4-[5-(4-трифторметилбензилсульфинил)пентилокси]фенил-8,9 дигидро-7 Н-бензоциклогептен-2-ол. 600 мг 6-фенил-5-4-[5-(4-трифторметилбензилтио)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола (пример 49 б) растворяют в 16 мл метанола, 15 мл уксусного эфира и 1 мл воды, смешивают с 230 мг периодата натрия и перемешивают сначала при комнатной температуре, а затем в течение 3 ч при 50 С. Для дальнейшей переработки реакционную смесь смешивают с разбавленным раствором хлорида натрия, 3 раза экстрагируют метиленхлоридом, промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 494 мг 6 фенил-5-4-[5-(4-трифторметилбензилсульфинил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола. Пример 51. 6-Фенил-5-[4-(5-фенилтиопентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ол. а) Фенил-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфид. 1,0 г 2-5-[4-(5-иодпентилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана (пример 12 а) растворяют в 5 мл тетрагидрофурана и при комнатной температуре смешивают с 0,34 мл 30%-ного водного раствора гидроксида калия и 0,17 мл тиофенола. Затем перемешивают в течение 4 ч при 90 С. Для дальнейшей переработки смеси дают охладиться до комнатной температуры,разбавляют диэтиловым эфиром, 3 раза промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 816 мг фенил-(5-4-[6-фенил-2(тетрагидропиран-2-илокси)-8,9-дигидро-7 Нбензоциклогептен-5-ил]феноксипентил)сульфида в виде пенистого вещества. б) 6-Фенил-5-[4-(5-фенилтиопентилокси) фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 50 816 мг фенил-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфида растворяют в 20 мл метанола, 5 мл тетрагидрофурана и 2 мл воды, смешивают с 890 мг щавелевой кислоты и перемешивают в течение 90 мин при 50 С. После этого реакционную смесь охлаждают до комнатной температуры, смешивают с 25 мл воды и перемешивают в течение 30 мин. Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. В результате, получают 670 мг 6-фенил-5-[4-(5-фенилтиопентилокси) фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 192 С. Примеры 52 и 53. 6-Фенил-5-[4-(5-фенилсульфинилпентилокси)фенил]-8,9-дигидро-7 Нбензоциклогептен-2-ол и 6-фенил-5-[4-(5-фенилсульфонилпентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен 2-ол. 109 мг 6-фенил-5-[4-(5-фенилтиопентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ола (пример 51 б) предварительно помещают при 0 С в 8 мл метиленхлорида и смешивают с 57 мг м-хлорпербензойной кислоты. В течение 1,5 ч перемешивают на холоду и завершают реакцию за счет добавления раствора тиосульфата натрия. Затем смесь смешивают с насыщенным раствором гидрокарбоната натрия, 3 раза экстрагируют метиленхлоридом, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют досуха под вакуумом. После проведения препаративной тонкослойной хроматографии с использованием смеси гексан/уксусный эфир получают 22 мг 6 фенил-5-[4-(5-фенилсульфонилпентилокси)фенил]-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 162 С и 75 мл 6-фенил 5-[4-(5-фенилсульфинилпентилокси)фенил]-8,9 дигидро-7 Н-бензоциклогептен-2-ола. Пример 54. 5-4-[5-(4-трет-Бутилфенилтио)пентилокси]фенил-6-фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. а) (4-трет-Бутилфенил)-(5-4-[6-фенил-2(тетрагидропиран-2-илокси-8,9-дигидро-7 Нбензоциклогептен-5-ил]феноксипентил)сульфид. 1,5 г 2-5-[4-(5-иодпентилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-илокситетрагидропирана (пример 12 а) растворяют в 7,5 мл тетрагидрофурана и смешивают при комнатной температуре с 0,51 мл 30%-ного водного раствора гидроксида калия и 409 мг 4-третбутилтиофенола. После этого перемешивают в течение 1 ч при 90 С. Для дальнейшей переработки реакционной смеси дают остыть до комнатной температуры, разбавляют диэтиловым эфиром, два раза промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/диэтиловый эфир получают 1,35 г(4-трет-бутилфенил)-(5-4-[6-фенил-2-(тетрагидропиран-2-илокси-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)сульфида в виде пенистого вещества. б) 5-4-[5-(4-трет-Бутилфенилтио)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,34 г (4-трет-бутилфенил)-(5-4-[6-фенил 2-(тетрагидропиран-2-илокси-8,9-дигидро-7 Нбензоциклогептен-5-ил]фенокси]пентил)сульфида растворяют в 30 мл метанола, 3 мл тетрагидрофурана и 3 мл воды, смешивают с 1,33 г щавелевой кислоты и перемешивают в течение 5 ч при 50 С. После этого реакционную смесь охлаждают до комнатной температуры, смешивают с 10 мл воды и перемешивают в течение 15 мин. Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. После проведения препаративной колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 946 мг 5-4-[5-(4 трет-бутилфенилтио)пентилокси]фенил-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 139 С. Примеры 55 и 56. 5-4-[5-(4-трет-Бутилфенилсульфинил)пентилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ол и 5-4-[5-(4-трет-бутилфенилсульфонил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 450 мг 5-4-[5-(4-трет-бутилфенилтио) пентилокси]фенил-6-фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола (пример 54 б) предварительно помещают при 0 С в 30 мл метиленхлорида и смешивают с 206 мг м-хлорпербензойной кислоты. После перемешивания в течение 1 ч на холоду смесь смешивают с насыщенным раствором гидрокарбоната натрия, 3 раза экстрагируют метиленхлоридом, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют под вакуумом. После проведения препаративной колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 32 мг 5-4-[5(4-трет-бутилфенилсульфонил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола и 412 мг 5-4-[5-(4-трет-бутилфенилсульфинил)пентилокси]фенил-6-фенил 8,9-дигидро-7 Н-бензоциклогептен-2-ола. Пример 57. 6-Фенил-5-4-[5-(4-трифторметилфенилтио)пентилокси]фенил-8,9-дигидро 7 Н-бензоциклогептен-2-ол. а) (5-4-[6-Фенил-2-(тетрагидропиран-2 илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)-(4-трифторметилфенил) сульфид. 1,5 г 2-5-[4-(5-иодпентилокси)фенил]-6 фенил-8,9-дигидро-7 Н-бензоциклогептен-2 илокситетрагидропирана (пример 12 а) растворяют в 7,5 мл тетрагидрофурана и при комнатной температуре смешивают с 0,51 мл 30%-ного водного раствора гидроксида калия и 438 мг 4 004182(трифторметил)тиофенола. Затем перемешивают в течение 1 ч при 90 С. Для дальнейшей переработки реакционную смесь охлаждают до комнатной температуры, разбавляют диэтиловым эфиром, 2 раза промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. После очистки посредством колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 1,28 г (5-4-[6-фенил-2-(тетрагидропиран-2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5-ил]феноксипентил)-(4-трифторметилфе-нил)сульфида. б) 6-Фенил-5-4-[5-(4-трифторметилфенилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 1,28 г (5-4-[6-фенил-2-(тетрагидропиран 2-илокси)-8,9-дигидро-7 Н-бензоциклогептен-5 ил]феноксипентил)-(4-трифторметилфенил) сульфида растворяют в 29 мл метанола, 3 мл тетрагидрофурана и 3 мл воды, смешивают с 1,25 г щавелевой кислоты и перемешивают в течение 5 ч при 50 С. Затем реакционную смесь охлаждают до комнатной температуры, смешивают с 10 мл воды и перемешивают в течение 15 мин. Выпавший осадок отфильтровывают с помощью вакуум-фильтра и сушат. После перекристаллизации из уксусного эфира получают 890 мг 6-фенил-5-4-[5-(4-трифторметилфенилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 189 С. Примеры 58 и 59. 6-Фенил-5-4-[5-(4-трифторметилфенилсульфинил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол и 6-фенил-5-4-[5-(4-трифторметилфенилсульфонил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол. 425 мг 6-фенил-5-4-[5-(4-трифторметилфенилтио)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ола (пример 57 б) предварительно помещают при 0 С в 28 мл метиленхлорида и смешивают со 190 мг м-хлорпербензойной кислоты. После перемешивания в течение 1 ч на холоду к смеси примешивают насыщенный раствор гидрокарбоната натрия, 3 раза экстрагируют метиленхлоридом, промывают до нейтрального состояния, сушат над сульфатом магния и концентрируют досуха под вакуумом. После проведения препаративной колоночной хроматографии на силикагеле с использованием смеси гексан/уксусный эфир получают 71 мг 6-фенил-5-4-[5-(4-трифторметилфенилсульфонил)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ола с температурой плавления 187 С и 325 мг 6-фенил-5-4-[5(4-трифторметилфенилсульфинил)пентилокси] фенил-8,9-дигидро-7 Н-бензоциклогептен-2 ола. 53 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Бензоциклогептены общей формулы I в которой R1 и R2 представляют собой независимо друг от друга атом водорода, гидроксильную группу, необязательно замещенную С 1 С 10 алкоксигруппу, необязательно замещенную С 1-С 10 алканоилоксигруппу или необязательно замещенную С 7-С 15 ароилоксигруппу, а SK представляет собой боковую цепь -A-B-Z,где А обозначает прямую связь или атом кислорода,В обозначает неразветвленную либо разветвленную, необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10,Z обозначает группу -D-SOx-E-G, аминогруппу -NR7R8 или заместитель G,где D обозначает прямую связь или группу-NR3(R4-), R3 обозначает неразветвленную либо разветвленную алкильную, алкенильную или алкинильную группу с числом атомов углерода до 10, а R4 обозначает неразветвленную либо разветвленную необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10, при этом атом азота может быть также встроен в 47-членную циклическую систему,х обозначает 0, 1 или 2,Е обозначает неразветвленную либо разветвленную необязательно замещенную алкиленовую, алкениленовую или алкиниленовую группу с числом атомов углерода до 10,G обозначает частично либо полностью фторированную, неразветвленную либо разветвленную алкильную группу с числом атомов углерода до 5, необязательно замещенный арильный или гетероарильный остаток, карбамоильный остаток C(O)-NR5R6, где R5 и R6 имеют значения, идентичные R7 и R8, или обозначает атом галогена либо атом водорода,R7 и R8 обозначают независимо друг от друга атом водорода, неразветвленный либо разветвленный, необязательно частично фторированный алкильный, алкенильный или алкинильный остаток с числом атомов углерода до 14, который может быть разорван одним-тремя гетероатомами -О- и -S- и группировками -NR9-,где R9 представляет собой атом водорода или С 1-С 3 алкильный остаток, необязательно однолибо двузамещенный арильный или гетероарильный остаток, обозначает далее необязательно одно- либо двузамещенный С 3-С 10 циклоалкильный остаток, необязательно одно- либо двузамещенный С 4-С 15 циклоалкильный остаток,необязательно одно- либо двузамещенный С 7 С 20 аралкильный остаток, необязательно одно 004182 54 либо двузамещенный гетероарил-С 1-С 8aлкильный остаток или необязательно замещенный аминоалкильный остаток, бифениленовый остаток или остаток формулы -C(О)R10, где R10 может иметь значения, идентичные вышеуказанным для R7, соответственно для R8, илиR7 и R8 образуют с атомом азота, с которым они связаны, насыщенный либо ненасыщенный гетероцикл с 5 или 6 звеньями цепи,который необязательно содержит один или два других гетероатома, выбранных из группы,включающей азот, кислород и серу, и который необязательно замещен,при этом, если в боковой цепи -A-B-Z А обозначает атом кислорода, a Z обозначает G, тоG не может быть атомом водорода или атомом галогена, или если А обозначает атом кислорода, а Z обозначает аминогруппу -NR7R8, в которой R7 и R8 каждый представляет собой метильную группу или вместе с атомом азота образуют пирролидиновое кольцо, то В содержит по меньшей мере 3 атома углерода, и за исключением соединения общей формулы I, в которойR1 и R2 идентичны и обозначают водород, SK обозначает боковую цепь -A-B-Z, где А представляет собой О, В представляет собой -(ОН 2)2-,а Z представляет собой N(C2H5)2. 2. Соединения общей формулы I по п.1, в которой R1 и/или R2 обозначают атом водорода. 3. Соединения общей формулы I по п.1, в которой А обозначает атом кислорода. 4. Соединения общей формулы I по п.1, в которой В обозначает неразветвленную алкениленовую цепь с 1-6 атомами углерода. 5. Соединения общей формулы I по п.1, в которой боковая цепь SK выбрана из группы,включающей 7. Соединения общей формулы I по п.1, в которой боковая цепь SK представлена общей субформулой 6. Соединения общей формулы I по п.1, в которой боковая цепь SK выбрана из группы,включающей в которой а обозначает 4, 5 или 6,b обозначает 0, 1 или 2,с обозначает 0, 1 или 2,RX обозначает атом водорода или С 1 С 5 алкильную группу,RY и RZ каждый обозначает атом водорода,илиRX и RY обозначают вместе алкиленовую группу -(СН 2)d-, где d обозначает 2, 3, 4 или 5, иRX и RZ обозначают вместе алкиленовую группу -(СН 2)е-, гдe e обозначает 2, 3 или 4, иRY обозначает атом водорода иU представляет собой незамещенный либо от одно- до пятикратно фторированный этильный остаток, или концевой заместитель -(СН 2)3-U в боковой цепи заменен на необязательно замещенный арильный либо гетероарильный остаток, непосредственно связанный через моно-,ди- или триметиленовую группу с атомом серы. 8. Соединения общей формулы I по п.7, в которой SK представляет собой боковую цепь (СН 2)5N(СH3)(СН 2)3S(СН 2)3 С 2F5. 9. Соединения общей формулы I по п.7, в которой SK представляет собой боковую цепь(CH2)5N(RX)(CHRY)CH2S(CH2)3C2F5, где RX и RY вместе обозначают -(СН 2)3-. 10. Соединения общей формулы I из группы, включающей 60 5-4-[5-(4-трет-бутилфенилсульфонил)пентилокси]фенил-6-фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилфенилтио)пентилокси]фенил-8,9-дигидро-7 Н-бензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилфенилсульфинил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол; 6-фенил-5-4-[5-(4-трифторметилфенилсульфонил)пентилокси]фенил-8,9-дигидро-7 Нбензоциклогептен-2-ол. 11. Лекарственные средства, содержащие в своем составе по крайней мере одно соединение общей формулы I по п.1 и фармацевтически приемлемый носитель. 12. Применение соединений общей формулы I по п.1 для получения соответствующих лекарственных средств.
МПК / Метки
МПК: C07C 317/18, A61K 31/10, C07D 213/32
Метки: средств, препараты, получения, применение, фармацевтические, содержащие, бензоциклогептены, лекарственных
Код ссылки
<a href="https://eas.patents.su/30-4182-benzociklogepteny-soderzhashhie-ih-farmacevticheskie-preparaty-i-ih-primenenie-dlya-polucheniya-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Бензоциклогептены, содержащие их фармацевтические препараты и их применение для получения лекарственных средств</a>
Предыдущий патент: Способ получения фосфонометилглицина
Следующий патент: Способ закупоривания емкости и затвор для этого
Случайный патент: Абсолютное количественное определение нуклеиновых кислот от-пцр












