Арильные агонисты рецептора gpr120 и их применение
Номер патента: 22417
Опубликовано: 30.12.2015
Авторы: Новак Аарон, Фам Фуонгли, Чэнь Синь, Ма Цзинюань, Чжао Цзучунь, Чой Юнь-Цзюн, Ши Дун Фан, Раббат Кристофер Дж., Нашашиби Имад, Сун Цзяньгао
Формула / Реферат
1. Соединение формулы (А)
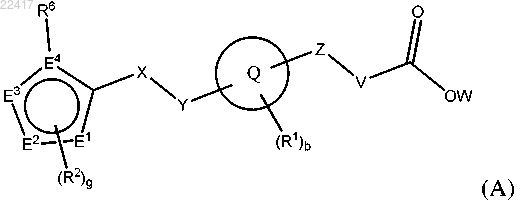 или фармацевтически приемлемая соль указанного соединения, где
или фармацевтически приемлемая соль указанного соединения, где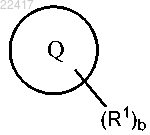 выбран из группы, состоящей из
выбран из группы, состоящей из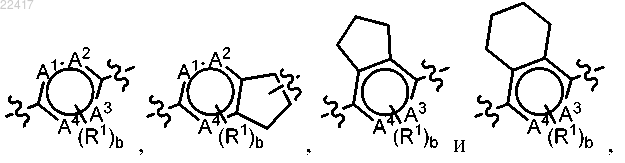
где А1, А2, А3 и А4 независимо выбраны из группы, состоящей из С, СН и N, при условии, что только 0, 1 или 2 из А1, А2, А3 и А4 представляют собой N;
два из Е1, Е2 и Е3 независимо представляют собой С, СН или N, а один из Е1, Е2 и Е3 выбран из группы, состоящей из С, СН, N и S;
Е4 выбран из группы, состоящей из С и N;
X выбран из группы, состоящей из -СН2-и -С(О)СН2-;
Y выбран из группы, состоящей из -СН2-, -NH- и -О-;
Z выбран из группы, состоящей из -(CR4R5)n-, -S- и -С(О)-;
V выбран из группы, состоящей из связи, -(CR4R5)n-, -CR4=CR5- и -O-CR4R5-;
W выбран из группы, состоящей из Н и C1-6алкила;
каждый R1 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, C3-7циклоалкила, C2-6алкенила, C2-6алкинила, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -NRaC(O)Rb, -SRa, -S(O)Ra и-S(O)2Ra;
каждый R2 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, C3-7циклоалкила, C2-6алкенила, C2-6алкинила, C6-14арилокси, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb,-NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;
каждый из Ra и Rb независимо выбран из группы, состоящей из Н, C1-6алкила, C3-7циклоалкила, C2-6алкенила и C2-6алкинила;
каждый R4 независимо выбран из группы, состоящей из Н, галогена, C1-6алкила, C1-6алкокси;
каждый R5 независимо выбран из группы, состоящей из Н, галогена, C1-6алкила и C1-6алкокси;
R6 выбран из группы, состоящей из C6-14арила, пиридила, фуранила, тиенила, тиазолила, изотиазолила, тетразолила, триазолила, имидазолила, изоксазолила, пирролила, пиразолила, пиридазинила или пиримидинила, причем указанный C6-14арил, пиридил, фуранил, тиенил, тиазолил, изотиазолил, тетразолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиридазинил или пиримидинил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, С3-7циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;
R4 и R5 необязательно объединены в цикл с образованием C3-7насыщенного кольца или спиро C3-7циклоалкильной группы;
индекс b равен 0, 1, 2, 3 или 4;
индекс g равен 0, 1 или 2; и
индекс n независимо равен 1 или 2;
при условии, что указанное соединение не представляет собой этиловый эфир (+/-)3-{4-[2-(2,6-дихлорфенил)-4-изопропил-2Н-пиразол-3-илметокси]-2-метилфенил}масляной кислоты.
2. Соединение по п.1, отличающееся тем, что X представляет собой -СН2-; Y представляет собой -О-; Z представляет собой -(CR4R5)n и V представляет собой связь.
3. Соединение по п.1 формулы (В)

или фармацевтически приемлемая соль указанного соединения, где
кольцо, содержащее J1, J2, J3, J4 и J5, представляет собой фенил, пиридил или пиримидинил;
каждый R3 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, С3-7циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;
индекс с равен 0, 1, 2 или 3; и
Е1, Е2, Е3, Е4, R1, R2, Z, V, Ra, Rb, индекс b и индекс g являются такими, как определено ранее в п.1.
4. Соединение формулы (С)
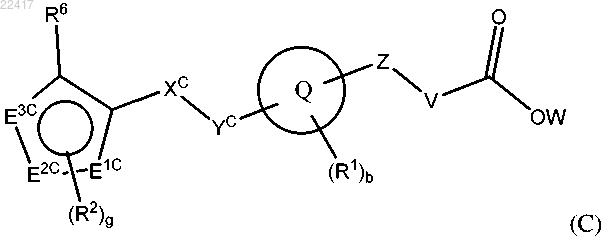 или фармацевтически приемлемая соль указанного соединения, где
или фармацевтически приемлемая соль указанного соединения, где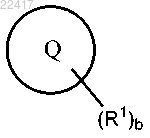 выбран из группы, состоящей из
выбран из группы, состоящей из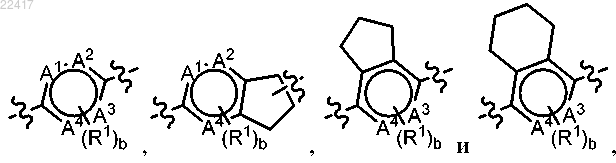
где А1, А2, А3 и А4 независимо выбраны из группы, состоящей из С, СН и N, при условии, что только 0, 1 или 2 из А1, А2, А3 и А4 представляют собой N;
два из E1C, E2C и E3C независимо представляют собой С, СН или N, и один из E1C, E2C и E3C выбран из группы, состоящей из С, СН, N и О;
XC выбран из группы, состоящей из -СН2- и -С(О)СН2-;
YC выбран из группы, состоящей из -СН2- и -О-;
Z выбран из группы, состоящей из -(CR4R5)n-, -S- и -С(О)-;
V выбран из группы, состоящей из связи, -(CR4R5)n-, -CR4=CR5- и -O-CR4R5-;
W выбран из группы, состоящей из Н и C1-6алкила;
каждый R1 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, C3-7циклоалкила, C2-6алкенила, C2-6алкинила, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -NRaC(O)Rb, -SRa, -S(O)Ra и-S(O)2Ra;
каждый R2 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, C3-7циклоалкила, C2-6алкенила, C2-6алкинила, C6-14арилокси, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb,-NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;
каждый из Ra и Rb независимо выбран из группы, состоящей из Н, C1-6алкила, C3-7циклоалкила, C2-6алкенила и C2-6алкинила;
каждый R4 независимо выбран из группы, состоящей из Н, галогена, C1-6алкила, C1-6алкокси;
каждый R5 независимо выбран из группы, состоящей из Н, галогена, C1-6алкила и C1-6алкокси;
R6 выбран из группы, состоящей из C6-14арила, пиридила, фуранила, тиенила, тиазолила, изотиазолила, тетразолила, триазолила, имидазолила, изоксазолила, пирролила, пиразолила, пиридазинила или пиримидинила, причем указанный C6-14арил, пиридил, фуранил, тиенил, тиазолил, изотиазолил, тетразолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиридазинил или пиримидинил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, С3-7циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;
R4 и R5 необязательно объединены в цикл с образованием C3-7насыщенного кольца или спиро C3-7циклоалкильной группы;
индекс b равен 0, 1, 2, 3 или 4;
индекс g равен 0, 1 или 2 и
индекс n независимо равен 1 или 2;
при условии, что указанное соединение не выбрано из метилового эфира 3-(4-((3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовой кислоты, 3-(4-((3-(2-хлор-6-метилфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовой кислоты, 3-(4-((3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовой кислоты, этилового эфира 3-(4-((4-(3-хлорфенил)-2-(трифторметил)фуран-3-ил)метокси)-2-метилфенил)пропионовой кислоты, 3-(3-фтор-5-метил-4-((3-метил-5-фенилизоксазол-4-ил)метокси)фенил)пропионовой кислоты и этилового эфира (+/-)3-{4-[2-(2,6-дихлорфенил)-4-изопропил-2Н-пиразол-3-илметокси]-2-метилфенил}масляной кислоты.
5. Соединение по п.4, отличающееся тем, что XC представляет собой -СН2-; YC представляет собой -О-; Z представляет собой -(CR4R5)n и V представляет собой связь.
6. Соединение по п.2 или 5, отличающееся тем, что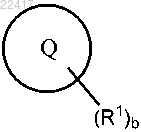 выбран из группы, состоящей из
выбран из группы, состоящей из
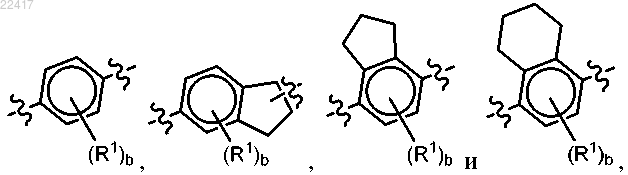
где R1 и индекс b являются такими, как определено ранее в п.1 или 4.
7. Соединение по п.4 формулы (D)
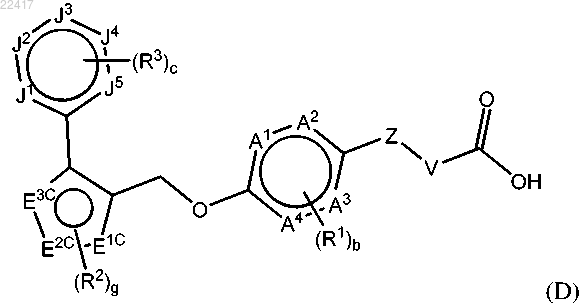
или фармацевтически приемлемая соль указанного соединения, где
А1, А2, А3 и А4 независимо выбраны из группы, состоящей из С, СН и N, при условии, что только 0, 1 или 2 из А1, А2, А3 и А4 представляют собой N;
кольцо, содержащее J1, J2, J3, J4 и J5, представляет собой фенил, пиридил или пиримидинил;
каждый R3 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, C3-7циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb, -NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;
индекс с равен 0, 1, 2 или 3; и
E1C, E2C, E3C, R1, R2, Z, V, Ra, Rb, индекс b и индекс g являются такими, как определено в п.4.
8. Соединение по любому из пп.1, 4 или 7, отличающееся тем, что Z и V, взятые вместе, выбраны из группы, состоящей из
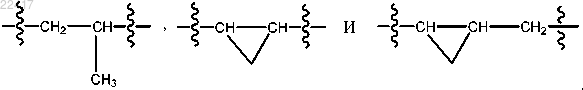
9. Соединение по п.8, отличающееся тем, что когда указанное соединение представляет собой соединение формулы (В), Е1 и Е2 оба представляют собой С или СН, а Е3 и Е4 оба представляют собой N; когда указанное соединение представляет собой соединение формулы (D), Е1С представляет собой С и один из E2C и E3C представляет собой N, а другой из E2C и E3C представляет собой О или N.
10. Соединение по п.9, отличающееся тем, что А1, А2, А3 и А4 все представляют собой С или СН, и J1, J2, J3, J4 и J5 все представляют собой С или СН.
11. Соединение по п.10, отличающееся тем, что индекс g равен 0 или 1; индекс с равен 0 или 1; а индекс b равен 0, 1 или 2.
12. Соединение по п.11, отличающееся тем, что R1 представляет собой галоген, C1-3алкил или CF3; g равен 0 или g равен 1 и R2 представляет собой СН3; a R3 представляет собой C1-4алкил или галоген.
13. Соединение формулы (XIII) или (XIV)
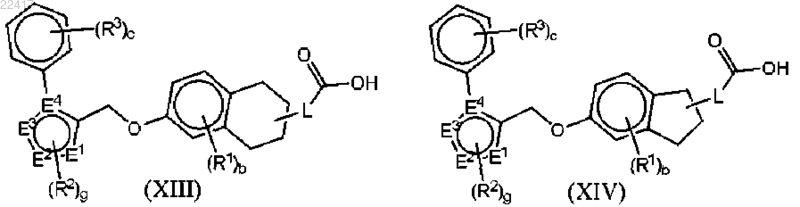
или фармацевтически приемлемая соль указанного соединения, где
Е1, Е2 и Е3 независимо выбраны из группы, состоящей из С, СН, N, О и S; при условии, что когда один из Е1, Е2 или Е3 представляет собой О или S, остальные из Е1, Е2 или Е3 независимо представляют собой С, СН или N;
Е4 представляет собой С или N;
L представляет собой -(CR4R5)n-;
индекс с равен 0, 1 или 2;
индекс b равен 0, 1, 2 или 3;
индекс g равен 0, 1, 2 или 3;
индекс n равен 0, 1, 2, 3 или 4;
каждый R1 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила и -ORa;
каждый R2 независимо выбран из группы, состоящей из галогена, C1-6алкила и галогенС1-6алкила;
каждый R3 независимо выбран из группы, состоящей из галогена, C1-6алкила, галогенС1-6алкила, C3-7циклоалкила, циано, -ORa и -C(O)NRaRb;
каждый R4 независимо выбран из группы, состоящей из Н и C1-6алкила;
каждый R5 независимо выбран из группы, состоящей из Н и C1-6алкила и
каждый из Ra и Rb независимо выбран из группы, состоящей из Н и C1-6алкила.
14. Соединение по п.13, отличающееся тем, что Е1 и Е2 представляют собой С или СН.
15. Соединение по п.13, отличающееся тем, что Е3 и Е4 представляют собой N.
16. Соединение по п.13, отличающееся тем, что L представляет собой -(CR4R5)2-.
17. Соединение по п.13, отличающееся тем, что L представляет собой -(CR4R5)2-, R1 представляет собой галоген, R2 представляет собой C1-6алкил, a R3 представляет собой галоген, C1-6алкил или галогенС1-6алкил.
18. Соединение по любому из пп.1, 4 или 13, выбранное из
3-(3,5-дифтор-4-((3-изопропил-1-фенил-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (55);
этилового эфира 3-(3,5-дифтор-4-((4-фенил-1,2,3-тиадиазол-5-ил)метокси)фенил)пропионовой кислоты (57);
3-(3,5-дифтор-4-((1-фенил-1H-имидазол-5-ил)метокси)фенил)пропионовой кислоты (59);
2-(2-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)циклопропил)уксусной кислоты (62);
3-(3,5-дифтор-4-((1-фенил-1H-1,2,3-триазол-5-ил)метокси)фенил)пропионовой кислоты (65);
2-(2-(3,5-дифтор-4-((5-метил-3-фенилизоксазол-4-ил)метокси)фенил)циклопропил)уксусной кислоты (67);
3-(3,5-дифтор-4-((5-фенилоксазол-4-ил)метокси)фенил)пропионовой кислоты (71);
3-(3,5-дифтор-4-((5-метил-2-фенилфуран-3-ил)метокси)фенил)пропионовой кислоты (73);
3-(3,5-дифтор-4-((1-метил-5-фенил-1H-пиразол-4-ил)метокси)фенил)пропионовой кислоты (74);
3-(3,5-дифтор-4-((5-метил-3-фенилизоксазол-4-ил)метокси)фенил)пропионовой кислоты (75);
3-(3,5-дифтор-4-((3-метил-5-фенилизоксазол-4-ил)метокси)фенил)пропионовой кислоты (76);
2-(3,5-дифтор-4-((5-метил-3-фенилизоксазол-4-ил)метокси)фенил)циклопропанкарбоновой кислоты (77);
2-(3,5-дифтор-4-((3-(4-фторфенил)-5-метилизоксазол-4-ил)метокси)фенил)циклопропанкарбоновой кислоты (78);
3-(3,5-дифтор-4-((3-(4-фторфенил)-5-метилизоксазол-4-ил)метокси)фенил)пропионовой кислоты (79);
3-(4-((3',5-диметил-3,5'-биизоксазол-4'-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (80);
3-(4-((3-(1H-пиррол-1-ил)тиофен-2-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (81);
3-(3,5-дифтор-4-((3-(4-метоксифенил)-5-метилизоксазол-4-ил)метокси)фенил)пропионовой кислоты (82);
3-(4-((3-(2,6-дихлорфенил)-5-метилизоксазол-4-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (83);
3-(4-((3-(4-хлорфенил)-5-метилизоксазол-4-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (85);
3-(3,5-дифтор-4-(2-(5-метил-3-фенилизоксазол-4-ил)-2-оксоэтокси)фенил)пропионовой кислоты (87);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)бутановой кислоты (88);
3-(3,5-дифтор-4-((5-фенилтиазол-4-ил)метокси)фенил)пропионовой кислоты (89);
2-(4-((4-фенил-1,2,3-тиадиазол-5-ил)метокси)фенилтио)уксусной кислоты (90);
3-(3,5-дифтор-4-((2-метил-4-фенилтиазол-5-ил)метокси)фенил)пропионовой кислоты (91);
3-(3,5-дифтор-4-((4-(4-фторфенил)-1,2,3-тиадиазол-5-ил)метокси)фенил)пропионовой кислоты (92);
3-(4-((4-(3-хлорфенил)-1,2,3-тиадиазол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (93);
2-(3,5-дифтор-4-((2-метил-4-фенилтиазол-5-ил)метокси)фенил)циклопропанкарбоновой кислоты (94);
2-(3,5-дифтор-4-((5-метил-3-фенилизоксазол-4-ил)метокси)бензилокси)уксусной кислоты (95);
2-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторбензилокси)уксусной кислоты (96);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (97);
3-(3,5-дифтор-4-((5-метил-3-фенилизоксазол-4-ил)метокси)фенил)-2-метилпропионовой кислоты (98);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2,2-диметилпропионовой кислоты (99);
2-(6-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-1,2,3,4-тетрагидронафталин-2-ил)уксусной кислоты (100);
2-(6-((5-метил-3-фенилизоксазол-4-ил)метокси)-1,2,3,4-тетрагидронафталин-2-ил)уксусной кислоты (101);
3-(3,5-дифтор-4-((2-метил-4-фенилтиазол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (103);
(R)-3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (104);
(S)-3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (105);
4-(4-((3-метил-1-фенил-1H-пиразол-5-ил)метокси)фенил)бутановой кислоты (106);
3-(3,5-дифтор-4-((3-метил-1-фенил-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (107);
3-(3,5-дифтор-4-((1-(4-фторфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (108);
3-(3,5-дифтор-4-((1-фенил-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (109);
3-(3,5-дифтор-4-((1-(4-метоксифенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (110);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (111);
3-(3,5-дифтор-4-((1-(4-фторфенил)-4-метил-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (112);
3-(4-((4-(4-хлорфенил)-1,2,3-тиадиазол-5-ил)метокси)-3,5-дифторфенил)-2,2-дифторпропионовой кислоты (113);
3-(4-((1-(3,4-дифторфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (114);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-фторпропионовой кислоты (115);
2-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторбензил)циклопропанкарбоновой кислоты (116);
3-(4-((1-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (117);
3-(4-((1-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2,2-дифторпропионовой кислоты (118);
2-(5-((5-метил-3-фенилизоксазол-4-ил)метокси)-2,3-дигидро-1H-инден-1-ил)уксусной кислоты (119);
2-(5-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-дигидро-1H-инден-1-ил)уксусной кислоты (120);
2-(5-((5-метил-3-фенилизоксазол-4-ил)метокси)-2,3-дигидро-1H-инден-1-ил)пропионовой кислоты (121);
2-(5-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-дигидро-1H-инден-1-ил)пропионовой кислоты (122);
3-(4-((4-(4-хлорфенил)-1,2,3-тиадиазол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (123);
2-(3,5-дифтор-4-((4-фенил-1,2,3-тиадиазол-5-ил)метокси)фенил)циклопропанкарбоновой кислоты (124);
2-(3,5-дифтор-4-((3-метил-1-фенил-1H-пиразол-5-ил)метокси)фенил)циклопропанкарбоновой кислоты (125);
3-(3,5-дифтор-4-((1-фенил-3-(трифторметил)-1H-пиразол-5-ил)метокси)фенил)пропионовой кислоты (126);
4-(4-((4-(4-хлорфенил)-1,2,3-тиадиазол-5-ил)метокси)фенил)-4-оксобутановой кислоты (128);
(E)-4-(4-((4-(4-хлорфенил)-1,2,3-тиадиазол-5-ил)метокси)фенил)-3-метилбут-2-еновой кислоты (130);
(E)-5-(4-((4-(4-хлорфенил)-1,2,3-тиадиазол-5-ил)метокси)фенил)-3-метилпент-2-еновой кислоты (131);
5-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-3-метилпентановой кислоты (132);
4-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-3-метилбутановой кислоты (133);
3-(4-((4-(3,4-дифторфенил)-1,2,3-тиадиазол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (134);
3-(4-((1-(3,4-дихлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)пропионовой кислоты (135);
3-(3,5-дифтор-4-((1-(4-изопропилфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (137);
3-(3,5-дифтор-4-((3-метил-1-(4-(трифторметил)фенил)-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (138);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-(трифторметил)фенил)-2-метилпропионовой кислоты (139);
3-(4-((1-(4-карбамоилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (140);
3-(4-((1-(4-цианофенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (141);
3-(4-((1-(2,3-дигидро-1H-инден-5-ил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (142);
3-(4-((1-(4-бутилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (143);
3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (144);
3-(3,5-дифтор-4-((3-метил-1-паратолил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (145);
3-(3,5-дифтор-4-((1-(3-изопропилфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (146);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (147);
3-(4-((1-(3,4-диметилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (148);
3-(4-((1-(3-хлор-4-метилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (149);
3-(4-((1-(3-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (150);
3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-фторфенил)-2-метилпропионовой кислоты (151);
3-(3,5-дифтор-4-((1-фенил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (152);
3-(4-((1-(3,5-диметилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (153);
3-(4-((1-(4-хлорфенил)-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (154);
3-(4-((1-(4-хлор-3-метилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (155);
3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-метилфенил)-2-метилпропионовой кислоты (156);
3-(4-((1-(4-этилфенил)-3-(трифторметил)-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (157);
3-(4-((1-(4-бромфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (158);
(R)-3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (159);
(S)-3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (160);
3-(4-((1-(4-этилфенил)-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (161);
3-(4-((1-(4-хлорфенил)-3-этил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (162);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-этоксипропионовой кислоты (163);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2-метоксифенил)-2-метилпропионовой кислоты (164);
3-(4-((1-(4-циклогексилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (165);
3-(3,5-дифтор-4-((3-метил-1-(4-пропилфенил)-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (166);
2-(5-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-6-фтор-2,3-дигидро-1H-инден-1-ил)уксусной кислоты (167);
2-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)циклопент-1-енкарбоновой кислоты (168);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-фторфенил)-2-метилпропионовой кислоты (169);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-метилфенил)-2-метилпропионовой кислоты (170);
3-(4-((1-(5-хлорпиримидин-2-ил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (171);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)бензилиден)циклобутанкарбоновой кислоты (172);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-метоксифенил)-2-метилпропионовой кислоты (173);
3-(3,5-дихлор-4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (174);
3-(3,5-дифтор-4-((5-метил-2-фенилфуран-3-ил)метокси)фенил)-2-метилпропионовой кислоты (177);
3-(4-((1-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (178);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2-этилфенил)пропионовой кислоты (179);
2-(5-((1-(4-хлорфенил)-3-(трифторметил)-1H-пиразол-5-ил)метокси)-2,3-дигидро-1H-инден-1-ил)уксусной кислоты (180);
2-(5-((1-(2,3-дигидро-1H-инден-5-ил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-дигидро-1H-инден-1-ил)уксусной кислоты (181);
2-(5-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-дигидро-1H-инден-1-ил)уксусной кислоты (182);
3-(3,5-дифтор-4-((3-метил-1-фенил-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (183);
2-(6-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-1,2,3,4-тетрагидронафталин-1-ил)уксусной кислоты (184);
3-(3,5-дифтор-4-((3-метил-1-(пиридин-2-ил)-1H-пиразол-5-ил)метокси)фенил)-2-метилпропионовой кислоты (185);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-3-метилбутановой кислоты (186);
3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-3-метилбутановой кислоты (187);
4-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)бутановой кислоты (188);
4-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)бутановой кислоты (189);
4-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)бутановой кислоты (190);
4-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-3,5-дифторфенил)бутановой кислоты (191);
4-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-2-метилбутановой кислоты (192);
4-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)фенил)-2-метилбутановой кислоты (193);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-метоксифенил)пропионовой кислоты (194);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-3-фтор-2-метилфенил)пропионовой кислоты (195);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2-этил-3-фторфенил)пропионовой кислоты (196);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-диметилфенил)пропионовой кислоты (197);
3-(4-((1-(4-хлорфенил)-1H-пиразол-5-ил)метокси)-3-фтор-2-метилфенил)пропионовой кислоты (198);
3-(4-((1-(4-хлорфенил)-1H-пиразол-5-ил)метокси)-2,3-диметилфенил)пропионовой кислоты (199);
3-(4-((3-(4-хлорфенил)-5-метилизоксазол-4-ил)метокси)-2,3-диметилфенил)пропионовой кислоты (200);
3-(4-((1-(4-этилфенил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-диметилфенил)пропионовой кислоты (201);
3-(4-((1-(4-этилфенил)-1H-пиразол-5-ил)метокси)-2,3-диметилфенил)пропионовой кислоты (202);
3-(4-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-5,6,7,8-тетрагидронафталин-1-ил)пропионовой кислоты (203) и
3-(7-((1-(4-хлорфенил)-3-метил-1H-пиразол-5-ил)метокси)-2,3-дигидро-1H-инден-4-ил)пропионовой кислоты (207);
или фармацевтически приемлемая соль указанного соединения.
19. Фармацевтическая композиция, содержащая соединение по любому из пп.1-18 и фармацевтически приемлемый носитель.
20. Применение соединения по любому из пп.1-18 для получения лекарственного средства для модулирования активности GPR120 в клетке.
21. Применение по п.20, отличающееся тем, что указанное лекарственное средство предназначено для лечения диабета типа II у млекопитающего.
22. Применение по п.20, отличающееся тем, что указанное лекарственное средство предназначено для лечения диабета типа I у млекопитающего.
23. Применение по п.20, отличающееся тем, что указанное лекарственное средство предназначено для лечения метаболического синдрома у млекопитающего.
24. Применение по п.20, отличающееся тем, что указанное лекарственное средство предназначено для снижения уровня глюкозы в крови у млекопитающего.
25. Применение по п.20, отличающееся тем, что указанное лекарственное средство предназначено для стимулирования выработки инсулина у млекопитающего.
26. Применение по любому из пп.21-25, отличающееся тем, что указанное млекопитающее представляет собой человека.
27. Применение соединения по любому из пп.1-18 для лечения одного или более заболеваний, выбранных из диабета типа I, диабета типа II, метаболического синдрома, стимулирования выработки инсулина и/или снижения уровня глюкозы в крови.
Текст
АРИЛЬНЫЕ АГОНИСТЫ РЕЦЕПТОРА GPR120 И ИХ ПРИМЕНЕНИЕ Предложены арильные агонисты GPR120 общей формулы Указанные соединения подходят для лечения метаболических заболеваний, включая диабет типа II и заболевания, связанные с недостаточным гликемическим контролем. Сахарный диабет можно разделить на два клинических синдрома - сахарный диабет типа I и типа II. Диабет типа I, или инсулинозависимый сахарный диабет, представляет собой хроническое аутоиммунное заболевание, характеризующееся массовой гибелью бета-клеток островков Лангерганса поджелудочной железы (здесь и далее называемых "клетками островков поджелудочной железы" или "островковыми клетками"), вырабатывающих инсулин. По мере того, как указанные клетки постепенно разрушаются,количество секретируемого инсулина снижается, приводя в конечном итоге к гипергликемии (ненормально высокому уровню глюкозы в крови), когда секретируемое количество падает ниже уровня, необходимого для поддержания эугликемии (нормального уровня глюкозы в крови). Хотя точный пусковой механизм указанного иммунного ответа неизвестен, у пациентов, страдающих диабетом типа I, наблюдаются высокие уровни антител к бета-клеткам поджелудочной железы (здесь и далее "бета-клетки"). Однако не у всех пациентов с высокими уровнями указанных антител развивается диабет типа I. Диабет типа II, или инсулинонезависимый сахарный диабет, развивается, когда нарушен нормальный ответ на инсулин у клеток мышц, жировой ткани и печени. Указанный нарушенный ответ (называемый инсулинорезистентностью) может быть обусловлен уменьшенным числом рецепторов инсулина на указанных клетках, или дисфункцией путей передачи сигнала в указанных клетках, или обеими этими причинами. Вначале бета-клетки компенсируют указанную инсулинорезистентность увеличением выделения инсулина. Со временем указанные клетки оказываются не в состоянии вырабатывать достаточно инсулина для поддержания нормальных уровней глюкозы, что указывает на развитие диабета типа II(Kahn SE, Am J Med (2000) 108 Suppl 6a, 2S-8S). Гипергликемия натощак, характерная для диабета типаII, наблюдается как следствие совокупности поражений, вызываемых инсулинорезистентностью и дисфункцией бета-клеток. Указанное нарушение бета-клеток включает два компонента: первый компонент,повышение базального высвобождения инсулина (наблюдается в присутствии низких, не стимулирующих концентраций глюкозы), наблюдается на ранних стадиях предиабетического ожирения и инсулинорезистентности, а также при диабете типа II. Вторым компонентом является неспособность увеличения высвобождения инсулина свыше уже повышенного базального высвобождения в ответ на гипергликемическое воздействие. Описанное поражение отсутствует на стадии предиабета и возникает, указывая на переход от нормогликемических инсулинорезистентных состояний к явному диабету. В настоящее время не существует способов излечения диабета. Традиционные способы лечения диабета очень ограничены и направлены на попытку контролировать уровни глюкозы в крови с целью минимизации или отсрочки осложнений. Современные способы лечения нацелены или на инсулинорезистентность (метформин, тиазолидиндионы ("ТЗД", или на высвобождение инсулина из бета-клеток (сульфонилмочевины, эксенатид). Сульфонилмочевины и другие соединения, действующие благодаря деполяризации бета-клеток,имеют в качестве побочного эффекта гипогликемию, поскольку они вызывают секрецию инсулина независимо от уровней глюкозы в кровотоке. Одно из одобренных лекарственных средств, Баета (эксенатид),стимулирует секрецию инсулина только в присутствии высокой концентрации глюкозы, но оно недоступно для перорального применения и должно вводиться при помощи инъекций. Янувия (ситаглиптин) представляет собой другое недавно одобренное лекарственное средство, повышающее уровни в крови гормонов инкретина, которые могут увеличивать секрецию инсулина, уменьшать секрецию глюкагона и обладают другими, менее хорошо описанными действиями. Однако Янувия и другие ингибиторы дипептидилпептидаз IV могут также влиять на уровни других гормонов и пептидов в тканях, и долговременные последствия указанного более широкого действия до сих пор не полностью изучены. Существует неудовлетворенная потребность в лекарственных средствах для перорального применения, стимулирующих секрецию инсулина глюкозозависимым образом. Прогрессирующая инсулинорезистентность и гибель секретирующих инсулин бета-клеток поджелудочной железы являются основными характеристиками диабета типа II. В норме отклонение чувствительности к инсулину мышц и жировой ткани компенсируется увеличением секреции инсулина бетаклетками. Однако утрата функции бета-клеток и их массовая гибель приводят к инсулиновой недостаточности и диабету (Kahn B.B., Cell 92:593-596, 1998; Cavaghan M.K., et al., J. Clin Invest 106:329-333,2000; Saltiel A.R., Cell 104:517-529, 2001; Prentki M. and Nolan C.J., J. Clin Invest 116:1802-1812 (2006); иKahn S.E., J. Clin Endicrinol Metab 86:4047-4058, 2001). Гипергликемия дополнительно ускоряет ослабление функции бета-клеток (UKPDS Group, JAMA 281:2005-2012, 1999; Levy J., et al., Diabetes Med 15:290296, 1998; and Zhou Y.P., et al., J. Biol Chem 278:51316-23, 2003). Некоторые гены, аллельная вариация в которых связана с повышенным риском развития диабета типа II, экспрессированы селективно в бетаклетках (Bell GI and Polonsky KS, Nature 414:788-791 (2001); Saxena R., et al., Science (2007) Apr 26; иValgerdur Steinthorsdottir, et al., Nature Genetics (2007) Apr 26). Секреция инсулина бета-клетками островков поджелудочной железы обусловлена повышенными уровнями глюкозы в крови. Глюкоза поступает в бета-клетки в первую очередь при помощи селективного переносчика GLUT2 бета-клеток и печени (Thorens В, Mol Membr Biol 2001 Oct-Dec;18(4):265-73). Оказавшись в клетке, глюкоза подвергается фосфорилированию под действием глюкокиназы, которая представляет собой основной чувствительный к глюкозе элемент в бета-клетке, поскольку она катализирует необратимую лимитирующую стадию метаболизма глюкозы (Matschinsky FM, Curr Diab Rep 2005Jun;5(3): 171-6). Скорость выработки глюкозо-6-фосфата под действием глюкокиназы зависит от концен-1 022417 трации глюкозы вокруг бета-клетки, и поэтому указанный фермент обеспечивает прямую зависимость между уровнем глюкозы в крови и общей скоростью окисления глюкозы в клетке. Мутации, затрагивающие глюкокиназу, приводят к отклонениям в глюкозозависимой секреции инсулина у человека, что является дополнительным подтверждением того, что указанный представитель семейства гексокиназ играет ключевую роль в ответе островков на глюкозу (Gloyn A.L., et al., J. Biol Chem 2005 Apr 8;280 (14): 14105-13, Epub 2005 Jan 25). Низкомолекулярные активаторы глюкокиназы усиливают секрецию инсулина и могут обеспечивать путь терапевтического применения роли указанного фермента (Guertin K.R.and Grimsby J., Curr Med Chem 2006;13(15):1839-43; и Matschinsky F.M., et al., Diabetes 2006 Jan;55(l):l-12) при диабете. Метаболизм глюкозы за счет гликолиза и митохондриального окислительного фосфорилирования в конечном итоге приводит к выработке АТФ, при этом количество АТФ, продуцируемое бетаклетками, напрямую связано с концентрацией глюкозы, воздействующей на бета-клетки. Глюкозозависимая секреция инсулина бета-клетками зависит от множества нейротрансмиттеров и переносимых с кровью гормонов, а также местных, внутриостровковых факторов. Активация ЦНС вагусной иннервации островков может приводить к высвобождению малых молекул, таких как ацетилхолин, и пептидов, таких как вазоактивный интестинальный полипептид (ВИП), гастрин-высвобождающий пептид (ГВП) и пептид, активирующий аденилатциклазу гипофиза (РАСАР). Активация фосфолипазы С ацетилхолином посредством Gq-сопряженного мускаринового рецептора GPCR М 3 приводит к высвобождению Са 2+ из внутриклеточного пула (Gilon P. and Henquin J.C., Endocr Rev 2001 Oct; 22(5): 565604). Холинергические агонисты также приводят к деполяризации тонкой Na+-зависимой плазматической мембраны, которая может протекать наряду с инициированной глюкозой деполяризацией с усилением высвобождения инсулина (Gilon P. and Henquin J.C., Endocr Rev 2001 Oct; 22(5): 565-604). Каждый из ВИП и РАСАР связывается с частично повторяющимся набором G-сопряженных GPCR (PAC1,VIPR1 и VIPR2) на бета-клетках, что приводит к стимуляции аденилатциклазы и увеличению уровня внутриклеточной цАМФ (Filipsson K, et al., Diabetes 2001 Sep;50(9): 1959-69; Yamada H, et al., Regul Pept 2004 Dec 15;123(l-3):147-53; и Qader SS, et al., Am J Physiol Endocrinol Metab 2007 May;292(5):E1447-55). Инкретиновые гормоны, такие как глюкагоноподобный пептид (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ТИП, также известный как гастроингибиторный полипептид), также связываются со специфическими Gs-сопряженными рецепторами GPCR на поверхности островковых клеток, включая бета-клетки, и повышают количество внутриклеточной цАМФ (Drucker DJ, J Clin Invest 2007 Jan; 117(l):24-32). Хотя рецепторы указанных гормонов присутствуют в других клетках и тканях, общее суммарное действие указанных пептидов, по-видимому, благоприятно для контроля метаболизма глюкозы в организме (Hansotia T, et al., J Clin Invest 2007 Jan;117(l):143-52, Epub 2006 Dec 21). ГИП и ГПП-1 вырабатываются и секретируются K-и L-клетками кишечника, соответственно, при этом указанные пептидные гормоны высвобождаются в ответ на приемы пищи как благодаря непосредственному действию питательных веществ в просвете кишки, так и путем нервной стимуляции, возникающей в результате проглатывания пищи. ГИП и ГПП-1 имеют короткие периоды полужизни в кровотоке у человека благодаря действию протеазы дипептидилпептидазы IV (ДПП-IV), при этом ингибиторы указанной протеазы могут понижать уровень глюкозы в крови благодаря их способности повышать уровни активных форм инкретиновых пептидов. Понижение уровня глюкозы, которое может быть получено при помощи ингибиторов ДПП-IV, однако, несколько ограничено, поскольку указанные лекарственные средства зависят от эндогенного высвобождения инкретиновых гормонов. Пептиды (например, эксенатид (Баета и пептидные конъюгаты, которые связываются с рецепторами ГИП и ГПП-1, но устойчивы к расщеплению сывороточной протеазой, также могут существенно понижать глюкозу в крови (Gonzalez С, et al., Expert OpinInvestig Drugs 2006 Aug;15(8):887-95), но указанные миметики инкретина необходимо вводить при помощи инъекций, и они склонны вызывать высокий процент случаев тошноты и поэтому не являются идеальными вариантами лечения для массового применения у людей, страдающих диабетом типа II. Клиническая успешность ингибиторов ДПП-IV и миметиков инкретина, хотя и далекая от идеала, указывает на потенциальную применимость соединений, увеличивающих активность инкретина в крови. Некоторые исследования показали, что чувствительность бета-клеток к ГИП уменьшается при диабете типаII (Nauck M.A., et al., J. Clin Invest 91:301-307 (1993); и Elahi D., et al., Regul Pept 51:63-74 (1994. Восстановление указанной чувствительности (Meneilly G.S., et al., Diabetes Care 1993 Jan; 16(1): 110-4) может быть перспективным путем улучшения функции бета-клеток in vivo. Поскольку повышенная активность инкретина оказывает положительный эффект на глюкозозависимую секрецию инсулина и, возможно, другие механизмы, приводящие к понижению глюкозы в крови,также представляет интерес изучение терапевтических подходов к увеличению высвобождения инкретина из кишечных клеток K и L. По-видимому, секреция ГПП-1 при диабете типа II ослаблена (Vilsboll T,et al., Diabetes 50:609-613), поэтому усиление высвобождения инкретина может облегчать указанный компонент нарушения метаболизма. Питательные вещества, такие как глюкоза и жир, в просвете кишечника вызывают секрецию инкретина при взаимодействии с апикальными рецепторами (Vilsboll T, et al.,Diabetes 50:609-613). Высвобождение ГПП-1 и ГИП также может быть результатом нервной стимуляции; ацетилхолин и ГВП могут усиливать высвобождение инкретина, предположительно аналогично дейст-2 022417 вию указанных нейротрансмиттеров на бета-клетки в отношении секреции инсулина (Brubaker P, Ann NY Acad Sci 2006 Jul; 1070:10-26; и Reimann F, et al., Diabetes 2006 Dec; 55(Suppl 2):S78-S85). Соматостатин, лептин и свободные жирные кислоты также, по-видимому, модулируют секрецию инкретина(Brubaker P, Ann N Y Acad Sci 2006 Jul; 1070:10-26; и Reimann F, et al., Diabetes 2006 Dec;55(Suppl 2):S78S85). Однако до настоящего времени не найден способ селективного воздействия на указанные пути,способствующего секреции инкретина с достижением терапевтической пользы. Существует потребность в лекарственных средствах для перорального введения, стимулирующих секрецию инкретина при лечении диабета. Инкретины также могут увеличивать скорость пролиферации бета-клеток и уменьшать скорость апоптоза бета-клеток в моделях на животных (Farilla L, et al., Endocrinology 2002 Nov;143(ll):4397-408) и островках человека in vitro (Farilla L, et al., Endocrinology 2003 Dec; 144(12):5149-58). Итогом указанных изменений является увеличение числа бета-клеток и массы островков, которое должно предусматривать повышенную секреторную способность инсулина, что является другой задачей противодиабетической терапии. Также было показано, что ГПП-1 защищает островки от разрушительного действия таких агентов, как стрептозотоцин, путем блокирования апоптоза (Li Y., et al., J Biol Chem 2003 Jan 3;278 (1):471-8). Циклин D1, ключевой регулятор протекания клеточного цикла, повышающе регулируется ГПП-1, при этом другие агенты, увеличивающие активность цАМФ и ПКА, также оказывают аналогичное действиеMar;188(3):623-33). Увеличенная транскрипция гена циклина Dl наблюдается в ответ на фосфорилирование ПКА транскрипционных факторов CREB (цАМФ-зависимый элемент связывания) (Hussain MA, etal., Mol Cell Biol 2006 Oct;26(20):7747-59). Существует потребность в лекарственных средствах для перорального введения, увеличивающих число бета-клеток и массу островков при лечении диабета. Рецепторы, сопряженные с G-белком (GPCR), представляют собой рецепторы на поверхности клетки, которые играют важную физиологическую роль в виде трансдукции и амплификации внеклеточных сигналов, таких как гормоны, факторы роста, нейротрансмиттеры и физиологически активные вещества.GPCR связаны с изменениями внутриклеточной концентрации Са 2+, а также с увеличением внутриклеточной концентрации инозитол-1,4,5-трифосфата (ИФЗ). Указанные вторичные мессенджеры служат для фокусировки событий передачи сигнала и стимуляции других путей. Следовательно, GPCR представляют собой терапевтически важный класс мишеней в фармацевтической промышленности.GPR120 представляет собой GPCR для ненасыщенных длинноцепочечных свободных жирных кислот (СЖК) и широко экспрессирован в легких, кишечнике, адипоцитах и вкусовых клетках, а также в энтероэндокринных линиях клеток, таких как STC-1 и GLUTag (Hirasawa et al., Nature Medicine 2005 Jan; 11: 90-94; и Iakoubov et al., Endocrinology 2007 Mar; 148(3): 1089-1098; и Katsuma et al., J. Biol. Chem. 2005 May; 280:19507-19515; Matsumura et al., Biomed. Res. 2007 Feb; 28(1) 49-55). Стимуляция GPR120 под действием СЖК увеличивает высвобождение Са 2+ из внутриклеточного пула, указывая на то, чтоGPR120 представляет собой Gq-сопряженный рецептор. GPR120 опосредует действие ненасыщенных длинноцепочечных свободных жирных кислот на стимуляцию секреции ГГГП-1 и холецистокинина(ХЦК), повышает уровень инсулина в плазме, активацию каскада регулируемой внеклеточными сигналами киназы (ERK), пролиферацию -клеток поджелудочной железы, ингибирование индуцированного сывороточной недостаточностью апоптоза и адипогенеза (Katsuma et al., J. Biol. Chem. 2005 May; 280:19507-19515; и Rayasam et al., Expert Opin. Ther. Targets 2007 May; 11(5): 661-671; и Tanaka et al.,Naunyn Schmiedeberg Arch Pharmacol 2008 Jun; 377(4-6):515-22; и Gotoh et al., Biochem. Biophys. Res.Commun. 2007 Mar; 354(2): 591-597). Было показано, что свободные жирные кислоты являются лигандами недавно идентифицированных "сиротских" GPCR (Rayasam et al., Expert Opin Ther Targets 2007 May; 11(5): 661-671). GPR120 имеет общую с другими рецепторами жирных кислот лигандоспецифичность, и существует потребность разработки низкомолекулярных агентов, представляющих собой специфические модуляторы функции GPR120. В частности, GPR120 представляет собой перспективную мишень для лечения диабета, ожирения и метаболического синдрома с учетом значительной роли ГПП-1 и ХЦК в секреции инсулина, опорожнении желудка и контроле пищевого аппетита. Краткое описание изобретения Предложены новые соединения-агонисты рецептора GPR120, синтезированные родственные промежуточные соединения и композиции. Новые соединения-агонисты рецептора GPR120 подходят для лечения диабета и других родственных заболеваний, включая метаболический синдром, дислипидемию,инсулинорезистентность и осложнения при диабете. Указанные агонисты включают соединения формулы (A)-(D) и (XIII) и (XIV) и фармацевтически приемлемые соли указанных соединений. Также предложено применение одного или более указанных соединений, как подробнее описано ниже, для получения лекарственного средства для лечения таких заболеваний, как диабет типа II и других заболеваний и состояний. Кроме того, указанные соединения можно применять для стимуляции выработки инсулина и стимуляции секреции инсулина у млекопитающего, в частности у человека. Кроме того, соединения согласно настоящему описанию подходят для снижения глюкозы в крови при введении млекопитающему. Подробное описание изобретения В настоящем описании использованы общепринятые сокращения, если не определено иное: АсОН: уксусная кислота; n-BuLi: н-бутиллитий; Cs2CO3: карбонат цезия; CH2Cl2 или ДХМ: дихлорметан;SOCl2: тионилхлорид; ТГФ: тетрагидрофуран; ТСХ: тонкослойная хроматография; мкл: микролитр. Если не указано иное, следующие термины, используемые в описании и формуле изобретения,имеют значения, приведенные ниже."Алкил" относится к одновалентным насыщенным алифатическим углеводородным группам, содержащим от 1 до 10 атомов углерода, и в некоторых из вариантов реализации от 1 до 6 атомов углерода."Cu-v алкил" относится к алкильным группам, содержащим от u до v атомов углерода. Указанный термин включает, например, линейные и разветвленные углеводородные группы, такие как метил (СН 3-), этил"Алкенил" относится к линейной или разветвленной углеводородной группе, содержащей от 2 до 10 атомов углерода, и в некоторых из вариантов реализации от 2 до 6 атомов углерода или от 2 до 4 атомов углерода, и содержащей по меньшей мере один центр винильной ненасыщенности (С=С). "Cu-v алкенил" относится к алкенильной группе, содержащей от u до v атомов углерода, и включает, например,этенил, пропенил, 1,3-бутадиенил и тому подобное."Алкинил" относится к линейному одновалентному углеводородному радикалу или к разветвленному одновалентному углеводородному радикалу, содержащему по меньшей мере одну тройную связь. Термин "алкинил" также включает углеводородные группы, содержащие одну тройную связь и одну двойную связь. "Cu-v алкинил" относится к алкинильной группе, содержащей от u до v атомов углерода и включает этинил, пропинил и тому подобное."Арил" относится к ароматической группе, содержащей от 6 до 14 атомов углерода и не содержащей гетероатомов в кольце, и состоящей из одного кольца (например, фенил) или из множества конденсированных (слитых) колец (например, нафтил или антрил). В системах из множества колец, включая конденсированные, мостиковые и спирокольцевые системы, содержащие ароматические и неароматические кольца и не содержащие гетероатомов в кольцах, термин "арил" или "Ar" применяют, если точкой присоединения является ароматический атом углерода (например, 5,6,7,8-тетрагидронафталин-2-ил представляет собой арильную группу, если точкой ее присоединения является положение 2 ароматического фенильного кольца). "Замещенный арил" относится к арильным группам, содержащим от 1 до 8, и в некоторых из вариантов реализации от 1 до 5, от 1 до 3 или от 1 до 2 заместителей, выбранных из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, алкокси, замещенного алкокси, ацила, ациламино, ацилокси, амино, замещенного амино, аминокарбонила, аминотиокарбонила, аминокарбониламино, аминотиокарбониламино, аминокарбонилокси,аминосульфонила, аминосульфонилокси, аминосульфониламино, амидино, арила, замещенного арила,арилокси, замещенного арилокси, арилтио, замещенного арилтио, азидо, карбоксила, сложноэфирного карбоксила, (сложноэфирный карбоксил)амина, (сложноэфирный карбоксил)окси, циано, циклоалкила,замещенного циклоалкила, циклоалкилокси, замещенного циклоалкилокси, циклоалкилтио, замещенного циклоалкилтио, гуанидино, замещенного гуанидино, галогена, гидрокси, гидроксиамина, алкоксиамина,гидразино, замещенного гидразино, гетероарила, замещенного гетероарила, гетероарилокси, замещенного гетероарилокси, гетероарилтио, замещенного гетероарилтио, гетероциклила, замещенного гетероциклила, гетероциклилокси, замещенного гетероциклилокси, гетероциклилтио, замещенного гетероциклилтио, нитро, SO3H, замещенного сульфонила, сульфонилокси, тиоацила, тиоцианата, тиола, алкилтио и замещенного алкилтио, причем указанные заместители такие, как определено в настоящем описании."Циклоалкил" относится к насыщенной или частично ненасыщенной циклической группе, состоящей из 3-14 атомов углерода и не содержащей гетероатомов в кольце, и состоящей из одного кольца или из множества колец, включая конденсированные, мостиковые и спиро кольцевые системы. В системах из множества колец, содержащих ароматические и неароматические кольца и не содержащих гетероатомов в кольцах, термин "циклоалкил" применяют, если точкой присоединения является неароматический атом углерода (например, 5,6,7,8-тетрагидронафталин-5-ил). Термин "циклоалкил" включает циклоалкенильные группы. Примеры циклоалкильных групп включают, например, адамантил, циклопропил, циклобутил, циклопентил, циклооктил и циклогексил. "Cu-v циклоалкил" относится к циклоалкильной группе,содержащей от u до v атомов углерода в кольцах. "Cu-v циклоалкенил" относится к циклоалкенильной группе, содержащей от u до v атомов углерода в кольцах."Галоалкил" относится к замещению алкильных групп 1-5 или в некоторых из вариантов реализации 1-3 галогеновыми группами, например, -CH2Cl, -CH2F, -CH2Br, -CFClBr, -CH2CH2Cl, -CH2CH2F, -CF3,-CH2CF3, -CH2CCl3 и тому подобное, и дополнительно включает такие алкильные группы, как перфторалкильные группы, в которых все атомы водорода заменены на атомы фтора."Гетероарил" относится к ароматической группе, содержащей от 1 до 14 атомов углерода и от 1 до 6 гетероатомов, выбранных из группы, состоящей из кислорода, азота и серы, и содержащей 5-18-членное кольцо или систему колец, состоящую из одного кольца (например, имидазолил) или из множества колец(например, бензимидазол-2-ил и бензимидазол-6-ил). В системах из множества колец, включая конденсированные, мостиковые и спирокольцевые системы, содержащие ароматические и неароматические кольца, термин "гетероарил" применяют, если в кольце содержится по меньшей мере один гетероатом, и точкой присоединения является атом в ароматическом кольце (например, 1,2,3,4-тетрагидрохинолин-6 ил и 5,6,7,8-тетрагидрохинолин-3-ил). В одном из вариантов реализации, атомы азота и/или серы в кольце гетероарильной группы, возможно, окислены, с образованием фрагментов N-оксида (NO), сульфинила или сульфонила. Конкретнее, термин гетероарил включает, без ограничения, пиридил, фуранил,тиенил, тиазолил, изотиазолил, тетразолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил,пиридазинил, пиримидинил, бензофуранил, тетрагидробензофуранил, изобензофуранил, бензотиазолил,бензоизотиазолил, бензотриазолил, индолил, изоиндолил, бензоксазолил, хинолил, тетрагидрохинолил,изохинолил, хиназолинонил, бензимидазолил, бензизоксазолил или бензотиенил. "Замещенный гетероарил" относится к гетероарильным группам, несущим от 1 до 8 или в некоторых из вариантов реализации от 1 до 5, или от 1 до 3, или от 1 до 2 заместителей, выбранных из группы, состоящей из заместителей,определенных для замещенного арила. Примеры гетероциклических и гетероарильных групп включают, без ограничения, азетидин, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, дигидроиндол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтилпиридин, хиноксалин, хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, фенантролин, изотиазол, феназин, изоксазол, феноксазин, фенотиазин, имидазолидин, имидазолин, пиперидин, пиперазин, индолин,фталимид, 1,2,3,4-тетрагидроизохинолин, 4,5,6,7-тетрагидробензо[b]тиофен, тиазол, тиазолидин, тиофен,бензо[b]тиофен, морфолинил, тиоморфолинил (также называемый тиаморфолинил), 1,1-диоксотиоморфолинил, пиперидинил, пирролидин и тетрагидрофуранил."Оксид" относится к продуктам окисления одного или более гетероатомов. Примеры включают N-оксиды, сульфоксиды и сульфоны."Спироциклоалкил" относится к 3-10-членному циклическому заместителю, образованному путем замены двух атомов водорода при общем атоме углерода на алкиленовую группу, содержащую от 2 до 9 атомов углерода, как показано в приведенной в качестве примера следующей структуре, где метиленовая группа, показанная ниже, присоединенная по связям, помеченным волнистыми линиями, несет в качестве заместителя спироциклоалкильную группу:"Соединение" и "соединения" в настоящем описании относятся к соединению, включенному в общие формулы согласно настоящему описанию, любым частным вариантам указанных общих формул и любым формам соединений, определенных указанными общими формулами и частными вариантами общих формул, таким как фармацевтически приемлемые соли. Если не указано иное, указанный термин также включает рацематы, стереоизомеры и таутомеры соединения или соединений."Стереоизомер" или "стереоизомеры" относится к соединениям, различающимся хиральностью одного или более стереоцентров. Стереоизомеры включают энантиомеры и диастереомеры. Соединения согласно настоящему изобретению могут существовать в форме стереоизомеров, если они обладают одним или несколькими асимметрическими центрами или двойной связью с асимметрическим замещением,и, следовательно, могут быть получены в виде индивидуальных стереоизомеров или смесей. Если не указано иное, настоящее описание предназначено включать как индивидуальные стереоизомеры, так и смеси. Способы определения стереохимии и разделения стереоизомеров хорошо известны в данной области техники (см. обсуждение в Главе 4 Advanced Organic Chemistry, 4th ed., J. March, John Wiley and Sons,New York, 1992)."Таутомер" относится к переходящим одна в другую формам соединения, отличающимся расположением протона, таким как кетоенольные или иминенаминовые таутомеры, или таутомерные формы гетероарильных групп, содержащих атом в кольце, связанный одновременно с кольцевым фрагментом"Пролекарство" относится к любому производному соединения согласно вариантам реализации,способному непосредственно или опосредованно обеспечивать получение соединения согласно вариантам реализации или активного метаболита или остатка указанного соединения при введении пациенту. Пролекарства соединения согласно настоящему изобретению получают путем модификации функциональных групп, присутствующих в соединении, таким образом, что модификации могут быть отщепленыin vivo с высвобождением исходного соединения или активного метаболита. Например, пролекарства включают соединения, в которых гидроксильная, аминная или сульфгидрильная группы соединения связана с любой группой, способной к отщеплению in vivo с образованием свободной гидроксильной, аминной или сульфгидрильной группы, соответственно. Особенно предпочтительными производными или пролекарствами являются те, которые увеличивают биодоступность соединений согласно вариантам реализации при введении указанных соединений пациенту (например,обеспечивая более легкое всасывание в кровь перорально введенного соединения) или улучшают доставку исходного соединения в биологическое пространство (например, головной мозг или лимфатическую систему) по сравнению с исходными соединениями. Пролекарства включают сложноэфирные, амидные и карбаматные (например, N, N-диметиламинокарбонил) формы гидроксильных функциональных групп соединений согласно настоящему изобретению. Примеры сложноэфирных пролекарств включают производные формиата, ацетата, пропионата, бутирата, акрилата и этилсукцината. Общий обзор пролекарств представлен в Т. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S. Symposium Series, и в Edward В. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, каждый из которых включен в настоящее описание посредством ссылки."Фармацевтически приемлемая соль" относится к фармацевтически приемлемой соли, полученной с использованием разнообразных органических и неорганических противоионов, хорошо известных в данной области техники и включающих только в качестве примера натрий, калий, кальций, магний, аммоний и тетраалкиламмоний. Если молекула содержит основную функциональную группу, она может образовывать соли присоединения органических кислот или неорганических кислот, таких как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2 этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4 хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, щавелевая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, метансульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен 1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутамовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота, и тому подобное. Соли также могут быть образованы, когда кислотный протон, присутствующий в исходном соединении,или замещается на ион металла, например, ион щелочного металла, ион щелочно-земельного металла или ион алюминия; или координируется с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, триметиламин, N-метилглюкамин и тому подобное. Фармацевтически приемлемые соли подходят для введения пациенту и обладают желательными фармакологическими свойствами. Подходящие соли дополнительно включают соли, описанные в P. Heinrich Stahl, Camille G. Wermuth (Eds.),Handbook of Pharmaceutical Salts Properties, Selection, and Use; 2002. Если не указано иное, номенклатура заместителей, не четко оговоренных в настоящем описании,получена путем наименования концевой части функциональной группы с последующими соседними функциональными группами по направлению к точке присоединения. Например, заместитель "арилалки-6 022417 локсикарбонил" относится к группе (арил)-(алкил)-О-С(О)-. Следует учитывать, что для всех определенных выше замещенных групп в настоящем описании не должны входить полимеры, полученные путем определения заместителей, содержащих в свою очередь дополнительные заместители (например, замещенный арил, содержащий в качестве заместителя замещенную арильную группу, которая в свою очередь содержит в качестве заместителя замещенную арильную группу, которая дополнительно содержит в качестве заместителя замещенную арильную группу, и т.д.). В указанных случаях максимальное число таких замещений равно трем. Например, серия замещений замещенных арильных групп с двумя другими замещенными арильными группами ограничена группой -замещенный арил-(замещенный арил)-замещенный арил. Аналогично следует учитывать, что приведенные выше опрелделения не должны включать недопустимые схемы замещения (например, метил, содержащий в качестве заместителей 5 фторидных групп,или гетероарильные группы, содержащие два соседних атома кислорода в кольце). Указанные недопустимые схемы замещения хорошо известны опытному специалисту. Термины "возможный" или "возможно" в настоящем описании означают, что описанное вслед за ними явление или обстоятельство может наблюдаться, но не обязательно должно, и что описание включает случаи, когда указанное являение или обстоятельство наблюдается, и случаи, когда указанное явление или обстоятельство не наблюдается. Например, "гетероциклическая группа, возможно, моно- или дизамещенная алкильной группой" означает, что алкил может, но не обязательно должен присутствовать, и что описание включает случаи, когда гетероциклическая группа является моно- или дизамещенной алкильной группой, и случаи, когда гетероциклическая группа не является замещенной алкильной группой. В свою очередь, в композициях согласно настоящему изобретению термин "фармацевтически приемлемый носитель или наполнитель" обозначает носитель или наполнитель, подходящий для приготовления фармацевтической композиции, в общем случае, безопасной и обладающей приемлемой токсичностью. Подходящие носители или наполнители включают как приемлемые для ветеринарного применения, так и приемлемые для фармацевтического применения людьми. "Фармацевтически приемлемый носитель или наполнитель" в настоящем описании и формуле изобретения включает как один, так и более одного из указанных носителей или наполнителей. При указании на способы согласно настоящему изобретению следующие термины применяют в указанных значениях. Термины "лечить" или "лечение" заболевания включают:(1) предотвращение или уменьшение риска развития заболевания, т.е. такое воздействие, при котором у млекопитающего, которое может быть подвержено или предрасположено к заболеванию, но пока не испытывает или не проявляет симптомов заболевания, не развиваются симптомы заболевания,(2) ингибирование заболевания, т.е. остановка или уменьшение развития заболевания или клинических симптомов заболевания, и(3) облегчение заболевания, т.е. такое воздействие, при котором наблюдается обратное развитие заболевания или клинических симптомов заболевания. Предпочтительным вариантом реализации настоящего изобретения является лечение заболевания,заключающееся в облегчении заболевания. Термин "терапевтически эффективное количество" обозначает такое количество рассматриваемого соединения, которое вызовет биологическую или медицинскую реакцию ткани, системы, животного или человека, которой добивается исследователь, ветеринар, лечащий врач или другой клинический специалист. "Терапевтически эффективное количество" включает такое количество соединения, которое, при введении млекопитающему для лечения заболевания, достаточно для осуществления указанного лечения заболевания. "Терапевтически эффективное количество" может быть разным в зависимости от соединения, заболевания и тяжести заболевания, и возраста, массы, и т.д., млекопитающего, лечение которого проводят. Термин "млекопитающее" включает, без ограничения, людей, домашних животных (например, собак или кошек), сельскохозяйственных животных (коров, лошадей или свиней) и лабораторных животных (мышей, крыс, хомячков, морских свинок, свиней, кроликов, собак или обезьян). Термин "инсулинорезистентность" можно в общем случае определить как нарушение метаболизма глюкозы. Более конкретно, инсулинорезистентность можно определить как ослабленную способность инсулина оказывать свое биологическое действие в широком диапазоне концентраций, что приводит к меньшему биологическому эффекту, чем ожидалось (см., например, Reaven GM, J. BasicClin. Phys.Pharm. (1998) 9:387-406 и Flie J, Ann. Rev. Med. (1983) 34:145-60). Лица с инсулинорезистенотностью обладают ослабленной способностью соответствующим образом метаболизировать глюкозу и слабо реагируют, если вообще реагируют, на терапию инсулином. Проявления инсулинорезистентности включают недостаточную активацию инсулином усвоения глюкозы, окисления и запасания в мышцах, и неадекватное подавление инсулином липолиза жировой ткани и прогизводства и секреции глюкозы в печени. Инсулинорезистентность может вызывать или вносить вклад в поликистозный синдром яичников, нарушенную толерантность к глюкозе, гестационный диабет, метаболический синдром, гипертонию, ожирение, атеросклероз и множество других нарушений. Наконец, состояние инсулинорезистентных индиви-7 022417 дуумов может прогрессировать, пока не достигнет состояния диабета. Термин "сахарный диабет" или "диабет" обозначает заболевание или состояние, в общем случае,характеризующееся нарушениями метаболизма при выработке и утилизации глюкозы, которые могут привести к невозможности поддержания соотвествующих уровней глюкозы в крови в организме. Результатом указанных нарушений является повышенный уровень сахара в крови, называемый "гипергликемией". Двумя основными формами диабета являются диабет типа I и диабет типа II. Как описано выше,диабет типа I, в общем случае, является результатом абсолютной недостаточности инсулина, гормона,регулирующего утилизацию глюкозы. Диабет Типа II часто наблюдается на фоне нормальных или даже повышенных уровней инсулина, и может являться результатом неспособности тканей соответствующим образом реагировать на инсулин. Большинство пациентов, страдающих диабетом типа II, являются инсулинорезистентными и имеют относительную недостаточность инсулина, при которой секреция инсулина не может компенсировать резистентность периферических тканей в ответ на инсулин. Кроме того, многие пациенты с диабетом типа II страдают ожирением. Другие типы нарушений гомеостаза глюкозы включают нарушенную толерантность к глюкозе, которая является метаболической стадией, переходной между нормальным гомеостазом глюкозы и диабетом, и гестационный сахарный диабет, представляющий собой нарушенную толерантность к глюкозе во время беременности у женщин, в истории болезни которых ранее не отмечено диабета типа I или типа II. Термин "метаболический синдром" относится к группе метаболических аномалий, включающих абдоминальное ожирение, инсулинорезистентность, нарушенную толерантность к глюкозе, диабет, гипертонию и дислипидемию. Известно, что указанные аномалии связаны с повышенным риском сосудистых осложнений. Термин "абдоминальное ожирение" определяется предельной точкой окружности талии 102 см у мужчин и 80 см у женщин, как рекомендовано в третьем докладе национальной образовательной программой по холестерину, посвященной определению, оценке и лечению высокого уровня холестерина в крови у взрослых (NCEP/ATP Panel III). Руководство по диагностике диабета типа II, нарушенной толерантности к глюкозе и гестационного диабета было представлено Американской диабетической ассоциацией (см., например, The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus, DiabetesCare, (1999) Vol. 2 (Suppl 1):S5-19). Термин "стимулятор секреции" обозначает вещество или соединение, стимулирующее секрецию. Например, стимулятор секреции инсулина представляет собой вещество или соединение, стимулирующее секрецию инсулина. Термин "симптом" диабета включает, без ограничения, полиурию, полидипсию и полифагию, в настоящем описании применяемые в их обычном значении. Например, "полиурия" обозначает выделение большого объема мочи в течение определенного периода; "полидипсия" обозначает хроническую избыточную жажду; и "полифагия" обозначает избыточный прием пищи. Другие симптомы диабета включают, например, повышенную восприимчивость к некоторым инфекциям (особенно к грибковым и стафиллококковым инфекциям), тошноту и кетоацидоз (усиленное выделение в кровь кетоновых тел). Термин "осложнение" диабета включает, без ограничения, микрососудистые осложнения и макрососудистые осложнения. Микрососудистые осложнения представляют собой осложнения, в общем случае, вызванные повреждением мелких кровеносных сосудов. Указанные осложнения включают, например, ретинопатию (нарушение или потерю зрения, вызванные повреждением кровеносных сосудов глаз); нейропатию (повреждение нервов и проблемы с ногами, вызванные повреждением кровеносных сосудов в нервной системе); и нефропатию (заболевание почек, вызванное повреждением кровеносных сосудов почек). Макрососудистые осложнения представляют собой осложнения, в общем случае, вызванные повреждением крупных кровеносных сосудов. Указанные осложнения включают, например, сердечнососудистое заболевание и заболевание периферических сосудов. Сердечно-сосудистое заболевание относится к заболеваниям кровеносных сосудов сердца. См., например, Kaplan RM, et al., "Cardiovascular diseases" в Health and Human Behavior, pp. 206-242 (McGraw-Hill, New York 1993). Сердечно-сосудистое заболевание, в общем случае, имеет одну из более форм, включая, например, гипертонию (также извстную как повышенное кровяное давление), коронарное заболевание сердца, инсульт и ревматическое заболевание сердца. Заболевание периферических сосудов относится к заболеваниям любых кровеносных сосудов за пределами сердца. Часто это сужение кровеносных сосудов, снабжающих кровью мышцы рук и ног. Термин "атеросклероз" включает сосудистые заболевания и состояния, которые может распознать и понять врач, практикующий в соответствующих областях медицины. Атеросклеротическое сердечнососудистое заболевание, коронарное заболевание сердца (также известное как заболевание коронарных артерий или ишемическая болезнь сердца), заболевание сосудов головного мозга и заболевание периферических сосудов представляют собой клинические проявления атеросклероза, и следовательно, включены в термины "атеросклероз" и "атеросклеротическое заболевание". Термин "антигиперлипидемический" относится к понижению избыточных концентраций липидов в крови до желаемых уровней. Термин "модулировать" или "модулирование" относится к лечению, предотвращению, подавлению,усилению или индуцированию функции или состояния. Например, соединения могут модулировать диабет типа II путем повышения инсулина у человека, таким образом, подавляя гипергликемию. Соединения также могут модулировать GPR120, действуя как агонисты GPR120. Термин "триглицерид(ы)" (ТГ) в настоящем описании включает свое обычное применение. ТГ состоят из трех молекул жирных кислот, образующих сложный эфмир с молекулой глицерина. ТГ служат для хранения жирных кислот, которые используются мышечными клетками для производства энергии или поступают в жировую ткань и хранятся в ней. Поскольку холестерин и ТГ нерастворимы в воде, они должны быть заключены в специальные молекулярные комплексы, известные как "липопротеины", для транспортировки в плазму. Липопротеины могут накапливаться в плазме по причине их перепроизводства и/или недостаточной утилизации. Существует по меньшей мере пять отдельных липопротеинов, отличающихся по размеру, составу, плотности и функции. В клетках тонкого кишечника поступающие с пищей липиды помещаются в большие липопротеиновые комплексы, называемые "хиломикронами", которые содержат большое количество ТГ и малое количество холестерина. В печени ТГ и сложные эфиры холестерина упаковываются и высвобождаются в плазму в виде богатого ТГ липопротеина, называемого липопротеин очень низкой плотности("ЛПОНП"), основной функцией которого является эндогенный транспорт ТГ, образованных в печени или высвобожденных из жировой ткани. Под действием ферментов ЛПОНП может быть либо восстановлен и усвоен печенью, либо трансформирован в липопротеин промежуточной плотности ("ЛИНИ"). ЛИНИ, в свою очередь, либо усваивается печенью, либо далее изменяется, образуя липопротеин низкой плотности ("ЛНП"). ЛНП либо усваивается и разрушается печенью, либо всасывается непеченочными тканями. Липопротеин высокой плотности ("ЛВП") помогает удалять холестерин из периферических тканей в процессе, называемом обратным транспортом холестерина. Термин "дислипидемия" относится к аномальным уровням липопротеинов в плазме крови, включая как пониженные, так и повышенные уровни липопротеинов (например, повышенные уровни ЛНП и/или ЛПОНП, и пониженные уровни ЛВП). Термин "гиперлипидемия" включает, без ограничения, следующее.(1) Семейную гиперхиломикронемию, редкое генетическое нарушение, которое вызывает недостаточность фермента ЛП-липазы, который разрушает молекулы жира. Недостаточность ЛП-липазы можт вызывать накопление больших количеств жира или липопротеинов в крови.(2) Семейную гиперхолестеринемию, относительно обычное генетическое нарушение, вызываемое первоначальным дефектом, является ряд мутаций в гене-репортере ЛНП, что приводит к неверному функционированию рецепторов ЛНП и/или к отсутствию рецепторов ЛНП. Это приводит к неэффективному очищению ЛНП рецепторами ЛНП, что приводит к повышенным уровням ЛНП и общего холестерина в плазме.(3) Семейную комбинированную гиперлипидемию, также известную как гиперлипидемия смешанного типа, представляющую собой наследственное заболевание, при котором у пациентов и пораженных заболеванием родственников первой степени могут в различное время проявляться высокий холестерин и высокие триглицериды. Уровни холестерина ЛВП часто умеренно снижены.(4) Семейную недостаточность аполипопротеина В-100, представляющую собой относительно частую доминантную аутосомную генетическую аномалию. Указанный дефект вызван мутацией одного нуклеотида, что приводит к замещению глутамина на аргинин, что может вызвать понижение сродства частиц ЛНП к рецептору ЛНП. Следовательно, это может вызвать высокие уровни в плазме ЛНП и общего холестерина.(5) Семейную дисбеталипопротеинемию, также известную как гиперлипопротеинемия типа III,представляющую собой редкое наследственное заболевание, приводящее к умеренному или тяжелому повышению уровней ТГ и холестерина в сыворотке, с аномальной функцией аполипопротеина Е. Уровни ЛВП обычно нормальные.(6) Семейной гипертриглицеридемией, представляющей собой распространенное наследственное нарушение, при котором повышена концентрация ЛПОНП в плазме. Это может вызывать от слабого до умеренного повышения уровней ТГ (но обычно не уровня холестерина) и часто может ассоциироваться с низким уровнем ЛВП в плазме. Факторы риска гиперлипидемии включают, без ограничения, следующие: (1) факторы риска, связанные с заболеваниями, такими как диабет типа I, диабет типа II, синдром Кушинга, гипотиреоидизм и некоторые типы почечной недостаточности, в анамнезе; (2) факторы риска, связанные с лекарственными средствами, включающими противозачаточные таблетки; гормоны, такие как эстроген и кортикостероиды; некоторые диуретики; и различные Р-блокаторы; (3) факторы риска, связанные с питанием, включающие поступление жира с пищей более 40% от общей калорийности рациона; поступление насыщенного жира с пищей более 10% от общей калорийности рациона; поступление холестерина более 300 мг в день; привычное и чрезмерное употребление алкоголя и ожирение. Термины "страдающий ожирением" и "ожирение" относятся, согласно Всемирной Организации Здравоохранения, к индексу массы тела ("ИМТ") выше 27,8 кг/м для мужчин и 27,3 кг/м для женщин(ИМТ равен масса (кг)/рост (м 2. Ожирение связано с множеством медицинских состояний, включая диабет и гиперлипидемию. Ожирение также известно как фактор риска для развития диабета типа II (см.,например, Barrett-Conner E, Epidemol. Rev. (1989) 11:172-181; и Knowler, et al., Am. J. Clin. Nutr. (1991) 53:1543-1551). Термин "поджелудочная железа" относится к железе в пищеварительной и эндокринной системе позвоночных, включая млекопитающих. Поджелудочная железа секретирует как пищеварительные ферменты, так и гормоны, такие как инсулин, ГПП-1 и ГИП, а также другие гормоны. Термин "островок" или "островок Лангерганса" относится к эндокринным клеткам поджелудочной железы, сгруппированным в островки и секретирующим инсулин и другие гормоны. Термин "бета-клетки" относится к клеткам, обнаруженным в островке Лангерганса, которые секретируют инсулин, амилин и другие гормоны. Термин "эндокринная клетка" относится к клеткам, секретирующим гормоны в кровоток. Эндокринные клетки обнаружены в различных железах и системах органов организма, включая поджелудочную железу, кишечник и другие органы. Термин "L-клетка" относится к эндокринным клеткам кишечника, выделяющим ГПП-1. Термин "K-клетка" относится к эндокринным клеткам кишечника, выделяющим ГИП. Термин "инкретин" относится к группе гормонов, увеличивающих секрецию инсулина в ответ на прием пищи. Инкретины включают ГПП-1 и ГИП. Термин "инсулин" относится к полипептидному гормону, регулирующему метаболизм глюкозы. Инсулин связывается с рецепторами инсулина на чувствительных к инсулину клетках и опосредует усвоение глюкозы. Инсулин применяют для лечения диабета типа I и можно применять для лечения диабета типа II. Термин "ГПП-1" или "глюкагоноподобный пептид" представляет собой пептидный гормон, в основном, продуцируемый L-клетками. ГПП-1 увеличивает секрецию инсулина, уменьшает секрецию глюкагона, увеличивает массу бета-клеток и экспрессию гена инсулина, ингибирует секрецию кислоты в желудке и опорожнение желудка, и уменьшает прием пищи благодаря усилению насыщения. Термин "ГИП" или "гастроингибиторный пептид" или "глюкозозависимый инсулинотропный полипептид" относится к пептидному гормону, в основном, продуцируемому K-клетками. ГИП стимулирует секрецию инсулина. ГИП также оказывает значительное действие на метаболизм липидов. Термин "цАМФ" или "циклический АМФ" или "циклический аденозинмонофосфат" относится к внутриклеточной сигнальной молекуле, участвующей во многих биологических процессах, включая метаболизм глюкозы и липидов. Термин "агонист" относится к соединению, связывающемуся с рецептором и запускающему ответ в клетке. Агонист имитирует эффект эндогенного лиганда, например гормона, и производит физиологический ответ, аналогичный ответу, производимому эндогенным лигандом. Термин "частичный агонист" относится к соединению, связывающемуся с рецептором и запускающему ответ в клетке. Частичный агносит производит только частичный физиологический ответ эндогенного лиганда. Соответственно, в одном из вариантов реализации настоящего изобретения предложено соединение формулы (А) или фармацевтически приемлемая соль указанного соединения, где щей из из выбран из группы, состоя где А 1, А 2, А 3 и А 4 независимо выбраны из группы, состоящей из С и N, при условии, что только 0,1 или 2 из А 1, А 2, А 3 и А 4 представляют собой N; два из Е 1, Е 2 и Е 3 независимо представляют собой С или N, и один из Е 1, Е 2 и Е 3 выбран из группы,состоящей из С, N и S; Е 4 выбран из группы, состоящей из С и N;R1 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, C3-7 циклоалкила, C1-6 алкенила, C1-6 алкинила, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -NRaC(O)Rb, -SRa, -S(O)Ra иR2 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, C3-7 циклоалкила, C2-6 алкенила, C2-6 алкинила, C6-14 арилокси, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb,-NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra; каждый из Ra и Rb независимо выбран из группы, состоящей из Н, C1-6 алкила, C3-7 циклоалкила, C2-6 алкенила и C2-6 алкинила;R4 независимо выбран из группы, состоящей из Н, галогена, C1-6 алкила, C1-6 алкокси;R5 независимо выбран из группы, состоящей из Н, галогена, C1-6 алкила и C1-6 алкокси;R6 выбран из группы, состоящей из трет-бутила, C6-14 арила, пиридила, фуранила, тиенила, тиазолила, изотиазолила, тетразолила, триазолила, имидазолила, изоксазолила, пирролила, пиразолила, пиридазинила или пиримидинила, причем указанный C6-14 арил, пиридил, фуранил, тиенил, тиазолил, изотиазолил, тетразолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиридазинил или пиримидинил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, С 3-7 циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa,-C(O)NRaRb, -NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra;R4 и R5 необязательно объединены в цикл с образованием C3-7 насыщенного кольца или спиро C3-7 циклоалкильной группы; индекс b равен 0, 1, 2, 3 или 4; индекс g равен 0, 1 или 2; и индекс n независимо равен 1, 2 или 3,при условии, что указанное соединение не представляет собой метиловый эфир 3-(4-3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовой кислоты, 3-(4-3-(2-хлор-6-метилфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовую кислоту, 3-(4-3-(2,6-дихлорфенил)-5 изопропилизоксазол-4-ил)метокси)фенил)пропионовую кислоту, этиловый эфир 3-(4-4-(3-хлорфенил)2-(трифторметил)фуран-3-ил)метокси)-2-метилфенил)пропионовой кислоты и 3-(3-фтор-5-метил-4-3 метил-5-фенилизоксазол-4-ил)метокси)фенил)пропионовую кислоту. В некоторых из аспектов, X представляет собой -СН 2-; Y представляет собой -О-; где А 1, А 2, А 3 и А 4 независимо выбраны из группы, состоящей из С и N, при условии, что только 0,1 или 2 из А 1, А 2, А 3 и А 4 представляют собой N, a R1 и индекс b такие, как определено ранее. В одном из вариантов реализации предложено соединение формулы (В) или фармацевтически приемлемая соль указанного соединения, где А 1, А 2, А 3 и А 4 независимо выбраны из группы, состоящей из С и N, при условии, что только 0, 1 или 2 из А 1, А 2, А 3 и А 4 представляют собой N; кольцо, содержащее J1, J2, J3, J4 и J5, представляет собой фенил, пиридил или пиримидинил; каждый R3 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, C3-7 циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb,-NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra; индекс с равен 0, 1, 2 или 3; и Е 1, Е 2, Е 3, Е 4, R1, R2, Z, V, Ra, Rb, индекс b и индекс g такие, как определено ранее. В некоторых из аспектов Z и V, взятые вместе, выбраны из группы, состоящей из В некоторых из аспектов Е 1 и Е 2 оба представляют собой С, а Е 3 и Е 4 оба представляют собой N. В некоторых из указанных аспектов А 1, А 2, А 3 и А 4 все представляют собой С. В других аспектах J1, J2, J3,J4 и J5 все представляют собой С. В других аспектах индекс g равен 0 или 1; индекс с равен 0 или 1; а индекс b равен 0, 1 или 2. В других аспектах, R1 представляет собой галоген, C1-3 алкил или CF3; g равен 0,- 11022417 или g равен 1, и R2 представляет собой СН 3; a R3 представляет собой C1-4 алкил или галоген. В одном из вариантов реализации предложено соединение формулы (С) или фармацевтически приемлемая соль указанного соединения, где щей из выбран из группы, состоя где А 1, А 2, А 3 и А 4 независимо выбраны из группы, состоящей из С и N, при условии, что только 0,1 или 2 из А 1, А 2, А 3 и А 4 представляют собой N; два из E1C, E2C и E3C независимо представляют собой С или N, и один из E1C, E2C и E3C выбран из группы, состоящей из С, N и О;R1 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, C3-7 циклоалкила, C2-6 алкенила, C2-6 алкинила, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -NRaC(O)Rb, -SRa, -S(O)Ra иR2 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, C3-7 циклоалкила, C2-6 алкенила, C2-6 алкинила, C6-14 арилокси, CN, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb,-NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra; каждый из Ra и Rb независимо выбран из группы, состоящей из Н, C1-6 алкила, C3-7 циклоалкила, C2-6 алкенила и C2-6 алкинила;R4 независимо выбран из группы, состоящей из Н, галогена, C1-6 алкила, C1-6 алкокси;R5 независимо выбран из группы, состоящей из Н, галогена, C1-6 алкила и C1-6 алкокси;R4 и R5 необязательно объединены в цикл с образованием C3-7 насыщенного кольца или спиро C3-7 циклоалкильной группы;R6 выбран из группы, состоящей из трет-бутила, C6-14 арила, пиридила, фуранила, тиенила, тиазолила, изотиазолила, тетразолила, триазолила, имидазолила, изоксазолила, пирролила, пиразолила, пиридазинила или пиримидинила, причем указанный C6-14 арил, пиридил, фуранил, тиенил, тиазолил, изотиазолил, тетразолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиридазинил или пиримидинил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, С 3-7 циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa,-C(O)NRaRb, -NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra; индекс b равен 0, 1, 2, 3 или 4; индекс g равен 0, 1 или 2; и индекс n независимо равен 1 или 2; при условии, что указанное соединеие не представляет собой метиловый эфир 3-(4-3-(2,6 дихлорфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовой кислоты, 3-(4-3-(2-хлор-6-метилфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовую кислоту, 3-(4-3-(2,6-дихлорфенил)-5-изопропилизоксазол-4-ил)метокси)фенил)пропионовую кислоту, этиловый эфир 3-(4-4-(3-хлорфенил)-2-(трифторметил)фуран-3-ил)метокси)-2-метилфенил)пропионовой кислоты и 3-(3-фтор-5-метил 4-3-метил-5-фенилизоксазол-4-ил)метокси)фенил)пропионовую кислоту. В некоторых из аспектов, X представляет собой -СН 2-; Y представляет собой -О-; Z представляет собой -(CR4R5)n; a V представляет собой связь. В некоторых из указанных аспектов, Q выбран из группы,состоящей из где А 1, А 2, А 3 и А 4 представляют собой С, a R1 и индекс b такие, как определено ранее. В одном из вариантов реализации предложено соединение формулы (D) или фармацевтически приемлемая соль указанного соединения, где А 1, А 2, А 3 и А 4 независимо выбраны из группы, состоящей из С и N, при условии, что только 0, 1 или 2 из А 1, А 2, А 3 и А 4 представляют собой N; кольцо, содержащее J1, J2, J3, J4 и J5, представляет собой фенил, пиридил или пиримидинил; каждый R3 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, С 3-7 циклоалкила, циано, -ORa, -NRaRb, -C(O)Ra, -C(O)ORa, -C(O)NRaRb,-NRaC(O)Rb, -SRa, -S(O)Ra и -S(O)2Ra; индекс с равен 0, 1, 2 или 3; и В некоторых из аспектов E1C представляет собой С, и один из E2C и E3C представляет собой N, а другой из E2C и E3C представляет собой О или N. В некоторых из аспектов, А 1, А 2, А 3 и А 4 все представляют собой С. В других аспектах, J1, J2, J3, J4 и 5J все представляют собой С. В некоторых из аспектов индекс g равен 0 или 1; индекс с равен 0 или 1, а индексb равен 0, 1 или 2. В некоторых из аспектов R1 представляет собой галоген, C1-3 алкил или CF3; g равен 0, или g равен 1,2 и R представляет собой СН 3; a R4 представляет собой C1-4 алкил или галоген. В одном из вариантов реализации предложено соединение формулы (XIII) или (XIV) или фармацевтически приемлемая соль указанного соединения, где Е 1, Е 2 и Е 3 независимо выбраны из группы, состоящей из С, N, О и S; при условии, что когда один 1 из Е , Е 2 или Е 3 представляет собой О или S, остальные из Е 1, Е 2 или Е 3 независимо представляют собой С или N; Е 4 представляет собой С или N;R1 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила и -ORa;R2 независимо выбран из группы, состоящей из галогена, C1-6 алкила и галогенС 1-6 алкила;R3 независимо выбран из группы, состоящей из галогена, C1-6 алкила, галогенС 1-6 алкила, С 3-7 циклоалкила, CN, -ORa и -C(O)NRaRb;R4 независимо выбран из группы, состоящей из Н и C1-6 алкила;R5 независимо выбран из группы, состоящей из Н и C1-6 алкила; и каждый из Ra и Rb независимо выбран из группы, состоящей из Н и C1-6 алкила. В некоторых из аспектов Е 1 и Е 2 представляют собой С. В других аспектах Е 3 и Е 4 представляют собой N. В аспектах настоящего изобретения предложены соединения формул (A)-(D) и (XIII)-(XIV) и фармацевтически приемлемые соли указанных соединений, обладающие следующими особенностями, в сочетании с любыми описанными выше вариантами реализации и особенностями. В некоторых из аспектов L представляет собой -(CR4R5)2-. В некоторых из аспектов L представляет собой -(CR4R5)2- и R3 представляет собой галоген, C1-6 алкил или галогенС 1-6 алкил. В некоторых других аспектах R2 представляет собой C1-6 алкил. В некоторых других аспектах R1 представляет собой галоген. В некоторых из аспектов L представляет собой -(CR4R5)2-, R1 представляет собой галоген, R2 представляет собой C1-6 алкил, и R3 представляет собой галоген или галогенС 1-10 алкил. В некоторых из аспектов R6 выбран из группы, состоящей из трет-бутила. В одном из вариантов реализации предложены сложноэфирные пролекарства соединений формулы (A)-(D) и (XIII)-(XIV). В некоторых из вариантов реализации сложноэфирные пролекарства представляют собой соединения, в ко- 13022417 торых группа карбоновой кислоты превращена в сложный эфир, так что W в формулах представляет собой алкил. Получение соединений согласно настоящему изобретению Соединения согласно настоящему изобретению можно получить при помощи ряда различных путей, хорошо знакомых опытному специалисту в области органического химического синтеза. Схема синтеза соединений в настоящем изобретении не ограничена способами, приведенными в настоящем описании или предложенными в примерах. Отдельные соединения могут потребовать изменения условий с целью введения различных функциональных групп и могут потребовать соответствующего применения защитных групп. Очистку при необходимости можно выполнять на колонке с силикагелем, элюируемой подходящей системой органических растворителей. Также можно применять обращенно-фазовую ВЭЖХ или перекристаллизацию. Композиции и способы применения В одном из вариантов реализации клетка, экспрессирующая GPR120, представляет собой клетку поджелудочной железы, островковую клетку или бета-клетку, эндокринную клетку кишечника, L-клетку или K-клетку. В другом аспекте настоящего изобретения предложено применение заявленного соединения для стимулирования выработки инсулина у млекопитающего, в частности у человека. В ответ на введение соединения субъекту бета-клетки производят инсулин. В биологическом примере 3 представлен подробный способ, при помощи которого опытный специалист может измерить секрецию инсулина у лабораторных животных в ответ на введение соединения согласно настоящему изобретению. В ответ на введение соединения субъекту, бета-клетки секретируют инсулин в кровоток. После введения субъекту соединения, бета-клетки секретируют инсулин в кровоток глюкозозависимым образом. В биологическом примере 4 предложены способы, демонстрирующие действие соединений согласно настоящему изобретению в отношении снижения концентрации глюкозы в крови. В другом варианте реализации настоящего изобретения предложено применение заявленного соединения для снижения уровня глюкозы в крови у млекопитающего, в частности у человека. В ответ на введение соединения субъекту, уровни глюкозы в крови снижаются. Уровни глюкозы в крови легко можно измерить при помощи многочисленных коммерчески доступных устройств контроля уровня глюкозы, которые измеряют уровень глюкозы в крови, в образцах крови или мочи. Уровень глюкозы в крови также можно измерить при помощи коммерчески доступных глюкометров, для которых не требуется образцов крови или мочи. В биологических примерах 3 и 4 предложены способы согласно которым можно измерить улучшения диабетических показателей, включая мониторинг уровня глюкозы в крови. В ответ на введение заявленного соединения субъекту эндокринные клетки кишечника вырабатывают глюкагоноподобный пептид 1 и глюкозозависимый инсулинотропный пептид. В биологическом примере 5 подробно представлены способы, при помощи которых опытный специалист может измерить выработку инкретина у лабораторных животных в ответ на введение соединения согласно настоящему изобретению. Терапия Соединения согласно настоящему изобретению предложено в некоторых случаях применять в комбинации с другими терапевтическими агентами для получения желаемого действия. Выбор дополнительных агентов будет в большой степени зависеть от выбранной целевой терапии (см., например, Turner(eds.), Diabetes Reviews (1997) Vol. 5 No. 4). В ряде исследований изучали преимущества комбинированной терапии перорально вводимыми агентами (см., например, Mahler R., J. Clin. Endocrinol. Metab. (1999) 84:1165-71; United Kingdom Prospective Diabetes Study Group: UKPDS 28, Diabetes Care (1998) 21:87-92;Louis, MO 1997); Chiasson J., et al., Ann. Intern. Med. (1994) 121:928-935; Coniff R, et al., Clin. Ther. (1997) 19:16-26; Coniff R., et al., Am. J. Med. (1995) 98:443-451; and Iwamoto Y, et al., Diabet. Med. (1996) 13:365370; Kwiterovich P., Am. J. Cardiol (1998) 82(12A) 3U-17U). Указанные исследования показали, что модулирование диабета можно дополнительно улучшить при помощи введения в терапевтическую схему второго агента. Соединения формулы (A)-(D) и (XIII)-(XIV), применяемые в способах согласно настоящему изобретению, можно включить во множество различных составов и лекарственных средств для терапевтического ведения. Более конкретно, соединения формулы (A)-(D) и (XIII)-(XIV) можно включить в рецептуру фармацевтических композиций, комбинируя с соответствующими фармацевтически приемлемыми носителями или разбавителями, и можно включить в рецептуру препаратов в твердой,полутвердой, жидкой или газообразной формах, таких как таблетки, капсулы, пилюли, порошки,гранулы, драже, гели, суспензии, мази, растворы, суппозитории, препараты для инъекций, препараты для ингаляций и аэрозоли. Таким образом, введение соединений можно осуществить различными путями,включая пероральное, буккальное, ректальное, парентеральное, внутрибрюшинное, внутрикожное,трансдермальное и/или интратрахеальное введение. Более того, соединение можно вводить местно, а не системно, в виде депо или состава с замедленным высвобождением. Кроме того, соединения можно вводить в липосоме. Соединения формулы (A)-(D) и (XIII)-(XIV) можно изготовить в виде составов с обычными наполнителями, разбавителями или носителями и спрессовать в таблетки, или изготовить в виде составов эликсиров или растворов для обычного перорального введения, или вводить внутривенным или внутримышечным путями. Соединения можно вводить трансдермально и можно изготовить в виде составов дозированных форм с замедленным высвобождением, и тому подобное. Соединения формулы (A)-(D) и(XIII)-(XIV) можно вводить отдельно, в комбинации друг с другом или можно применять их в комбинации с другими известными соединениями. Подходящие составы для применения в настоящем изобретении можно найти в Remington's Pharmaceutical Sciences (Mack Publishing Company (1985) Philadelphia, PA, 17th ed.), включенном в настоящую заявку посредством ссылки. Кроме того, для краткого обзора способов доставки лекарственных средств,см. Langer, Science (1990) 249:1527-1533, включенный в настоящую заявку посредством ссылки. Фармацевтические композиции согласно настоящему описанию можно производить способом, известным специалистам в данной области техники, т.е. посредством обычных процессов смешивания, растворения,гранулирования, дражирования, отмучивания, эмульгирования, капсулирования, улавливания или лиофилизации. Следующие способы и наполнители приведены только в качестве примера, но никоим образом не ограничивают изобретение. Для инъекции соединение формулы (A)-(D) и (I)-(XIV) можно включить в состав лекарственного препарата путем растворения, суспендирования или эмульгирования указанных соединений в водном или неводном растворителе, таком как растительное или другое подобное масло, глицериды синтетических алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоля; и при желании с обычными добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгирующие агенты, стабилизаторы и консерванты. Предпочтительно соединения согласно настоящему изобретению можно включить в состав водных растворов,предпочтительно в физиологически совместимых буферных растворах, таких как раствор Хэнка, раствор Рингера или физиологический солевой буферный раствор. Для чресслизистого введения в составе применяют усилители проницаемости, подходящие для барьера, которые необходимо преодолеть. Указанные усилители проницаемости хорошо известны в данной области техники. Для перорального введения соединения формулы (A)-(D) и (XIII)-(XIV) легко можно включить в состав, комбинируя с хорошо известными в данной области техники фармацевтически приемлемыми носителями. Указанные носители обеспечивают возможность включения соединений в состав таблеток,пилюль, драже, капсул, эмульсий, липофильных и гидрофильных суспензий, жидкостей, гелей, сиропов,кашиц, суспензий, и тому подобное, для приема внутрь пациентом, подлежащим лечению. Фармацевтические препараты для перорального применения можно получить путем смешивания соединений с твердым наполнителем, возможно, дражируя полученную смесь и перерабатывая смесь в гранулы, после добавления подходящих вспомогательных веществ, при желании, для получения сердцевин таблеток или драже. Подходящие наполнители представляют собой, в частности, наполнители, такие как сахара,включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие, например, как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовую камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрия карбоксиметилцеллюлозу и/или поливинилпирролидон. При желании можно добавить дезинтегрирующие агенты, такие как сшитый поливинилпирролидон, агар, или альгиновую кислоту или соли альгиновой кислоты, такие как альгинат натрия. Сердцевины драже снабжают подходящими покрытиями. Для указанных целей можно применять концентрированные растворы сахара, которые могут возможно содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. В покрытия драже или таблеток можно добавить красители или пигменты для идентификации или для обозначения различных комбинаций доз активного соединения. Фармацевтические препараты, подходящие для перорального применения, включают плотно закрывающиеся капсулы, изготовленные из желатина, а также мягкие запечатанные капсулы, изготовленные из желатина с пластификатором, таким как глицерин или сорбит. Плотно закрывающиеся капсулы могут содержать активные ингредиенты, смешанные с наполнителем, таким как лактоза, связующими веществами, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, можно добавить стабилизаторы. Все составы для перорального введения должны быть в дозировках, подходящих для такого введения. Для трансбуккального введения композиции могут иметь форму таблеток или леденцов, изготовленных обычным образом. Для введения посредством ингаляции соединения для применения согласно настоящему изобретению обычно вводят в форме аэрозольного спрея, подаваемого из упаковки под давлением или небулайзера, с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана,дихлортетрафторэтана, диоксида углерода или другого подходящего газа, или из порошкового ингалятора без пропеллента. В случае аэрозоля под давлением дозировочную единицу можно определять, преду- 15022417 сматривая клапан для доставки отмеренного количества. Можно изготовить составы для капсул и картриджей, например, из желатина, для применения в ингаляторе или инсуффляторе, содержащие порошкообразную смесь соединения и подходящей порошкообразной основы, такой как лактоза или крахмал. Соединения можно изготовить в виде составов для парентерального введения путем инъекции, например, путем болюсной инъекции или длительной инфузии. Составы для инъекций могут находиться в виде дозированных лекарственных форм, например, в ампулах или в мультидозовых контейнерах, в которые добавлен консервант. Составы могут иметь форму суспензий, растворов или эмульсий в масляных или водных средах и могут содержать такие вспомогательные агенты, как суспендирующие, стабилизирующие и/или диспергирующие агенты. Фармацевтические составы для парентерального введения включают водные растворы активных соединений в водорастворимой форме. Кроме того, суспензии активных соединений можно приготовить в виде подходящих масляных суспензий для инъекций. Подходящие липофильные растворители или среды, включающие жирные масла, такие как кунжутное масло, или сложные эфиры синтетических жирных кислот, такие как этиолоеат или тригилцериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, увеличивающие вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Возможно, суспензия может также содержать подходящие стабилизаторы или агенты, увеличивающие растворимость соединений, обеспечивая возможность приготовления сильно концентрированных растворов. Как вариант, активный ингредиент может быть в форме порошка для восстановления при помощи подходящего носителя, например, стерильной апирогенной воды, перед применением. Соединения также можно изготовить в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащих обычные основы для суппозиториев, такие как масло какао, углеводородные воски, полиэтиленгликоли или другие глицериды, все из которых плавятся при температуре тела, но затвердевают при комнатной температуре. Кроме описанных ранее составов, соединения можно также изготовить в форме депопрепарата. Такие составы длительного действия можно вводить при помощи имплантации (например, подкожно или внутримышечно) или при помощи внутримышечной инъекции. Так, например, соединения можно включить в состав с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами, или в виде труднорастворимых производных,например труднорастворимой соли. Как вариант, можно применять другие системы доставки гидрофобных фармацевтических соединений. Липосомы и эмульсии являются хорошо известными примерами сред или носителей для доставки гидрофобных лекарственных средств. В настоящем предпочтительном варианте применяют длительно циркулирующие, т.е. стелс-липосомы. Указанные липосомы в целом описаны Woodle, et al., патент США 5,013,556. Соединения согласно настоящему изобретению также можно вводить средствами и/или приспособлениями для контролируемого высвобождения, такими, как описанные в патентах США 3845770; 3916899; 3536809; 3598123; и 4008719. Также можно применять некоторые органические растворители, такие как диметилсульфоксид ("ДМСО"), хотя обычно они имеют повышенную токсичность. Кроме того, соединения можно вводить при помощи системы с замедленным высвобождением, такой как полупроницаемые основы из твердых гидрофобных полимеров, содержащие терапевтический агент. Различные типы материалов с замедленным высвобождением были признаны и хорошо известны опытному специалисту в данной области техники. Медленным высвобождением могут в зависимости от их химической природы высвобождаться соединения на протяжении от нескольких часов до свыше 100 дней. Фармацевтические композиции также могут содержать подходящие твердые или гелеобразные носители или наполнители. Примеры таких носителей или наполнителей включают, без ограничения, карбонат кальция, фосфат кальция, различные сахара, крахмалы, производные целлюлозы, желатин и полимеры,такие как полиэтиленгликоли. Фармацевтические композиции, подходящие для применения в настоящем изобретении, включают композиции, содержащие активные ингредиенты в терапевтически эффективном количестве. Количество вводимой композиции, конечно, будет зависеть от субъекта, лечение которого проводят, массы субъекта, тяжести болезни, способа введения и мнения терапевта, назначающего лечение. Определение эффективного количества вполне доступно опытному специалисту в данной области техники, особенно учитывая представленное в настоящей заявке подробное описание. Для любого соединения, применяемого в настоящем изобретении терапевтически эффективную дозу можно первоначально оценить в тестах на культурах клеток, моделях на животных или при микродозировании людям. Кроме того, токсичность и терапевтическую эффективность соединений согласно настоящему описанию можно определить при помощи стандартных фармацевтических методик на культурах клеток или на лабораторных животных, например, путем определения LD50, (доза, смертельная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Дозовое соотношение между терапевтическим и токсическим эффектом представляет собой терапевтический индекс и может быть выражено как отношение LD50 к ED50. предпочтительны соединения, обладающие высокими терапевтическими индексами. Данные, полученные из указанных исследований на культурах клеток и лабораторных живот- 16022417 ных, можно применять для составления диапазона дозировок, нетоксичных при применении на людях. Дозировка указанных соединений предпочтительно находится в таком диапазоне, чтобы концентрации в кровотоке включали ED50 при малой токсичности или отсутствии токсичности. Дозировки можно варьировать в указанном диапазоне в зависимости от применяемой дозированной формы и пути введения. Точный состав, путь введения и дозировку может выбрать отдельный терапевт, учитывая состояние пациента (см., например, Fingl, et al., 1975 In: The Pharmacological Basis of Therapeutics, Ch. 1). Количество соединения формулы (XIII)-(XIV), которое можно комбинировать с материаломносителем для получения одной дозированной формы, может варьировать в зависимости от заболевания,которое лечат, вида млекопитающего и конкретного пути введения. Однако в качестве общего руководства, подходящие разовые дозы соединений согласно настоящему изобретению могут, например, предпочтительно содержать от 0,1 мг примерно до 1000 мг активного соединения. Предпочтительная разовая доза составляет от 1 мг примерно до 500 мг. Более предпочтительная разовая доза составляет от 1 мг примерно до 300 мг. Еще более предпочтительная разовая доза составляет от 1 мг примерно до 100 мг. Указанную разовую дозу можно вводить несколько раз в день, например, 2, 3, 4, 5 или 6 раз в день, но предпочтительно 1 или 2 раза в день, так чтобы суммарная доза для взрослого массой 70 кг находилась в диапазоне от 0,001 до примерно 15 мг на кг массы тела субъекта на введение. Предпочтительная дозировка составляет от 0,01 до примерно 1,5 мг на кг массы тела субъекта на введение, и указанную терапию можно проводить в течение ряда недель, месяцев, и в некоторых случаях лет. Однако следует понимать, что конкретный уровень дозировки для любого конкретного пациента будет зависеть от ряда факторов, включая активность конкретного применяемого соединения; возраст, массу тела, общее состояние здоровья, пол и питание индивидуума, лечение которого проводят; время и путь введения; скорость выведения; другие лекарственные средства, вводимые ранее; и тяжесть конкретного заболевания, подвергающегося лечению, как хорошо понятно специалисту в указанной области. Обычная дозировка может представлять собой таблетку от 1 мг до примерно 100 мг или от 1 мг до примерно 300 мг, принимаемую один раз в день или несколько раз в день, или капсулу или таблетку с замедленным высвобождением,принимаемую один раз в день и содержащую пропорционально более высокое содержание активного ингредиента. Эффект замедленного высвобождения можно получить при помощи материалов капсулы, которые растворяются при различных рН, при помощи капсул, медленно высвобождающих свое содержимое благодаря осмотическому давлению или при помощи любых других известных способов контролируемого высвобождения. Может быть необходимо применять дозировки, выходящие за рамки указанного диапазона в неострых случаях, которые будут очевидны опытному специалисту в данной области техники. Далее, необходимо отметить, что клиницист или лечащий терапевт будет знать, когда и как начинать,прерывать, регулировать или прекращать терапию с учетом индивидуальной реакции пациента. Что касается композиций, способов и наборов, предложенных выше, опытный специалист в данной области техники поймет, что предпочтительными соединениями для применения в каждом из них являются соединения, отмеченные выше как предпочтительные. Еще более предпочтительными соединениями для композиций, способов и наборов являются соединения, предложенные в неограничительных примерах ниже. Химические примеры Общие методы. Все операции, в которых задействованы чувствительные к влаге и/или кислороду материалы, проводили в атмосфере сухого азота в предварительно просушенной лабораторной посуде. Если не указано иное, материалы получены из коммерчески доступных источников и применялись без дополнительной очистки. Флэш-хроматографию проводили на Isco Combiflash Companion с использованием силикагелевых картриджей RediSep Rf производства Teledyne Isco. Тонкослойную хроматографию проводили с использованием пластин с покрытием, поставляемых Е. Merck (силикагель 60 PF254, 0,25 мм), пятна визуализировали длинноволновым ультрафиолетовым светом с последующим окрашиванием подходящим реагентом. Спектры ядерного магнитного резонанса ("ЯМР") записывали на резонансном спектрометре Varian Inova-400. Химические сдвиги 1 Н ЯМР приведены в миллионных доляхвниз по полю от тетраметилсилана ("ТМС") и использованием сигнала ТМС или остаточного сигнала растворителя (CHCl3 =7,24, ДМСО =2,50) в качестве внутреннего стандарта. Информация 1 Н ЯМР представлена в следующем формате: мультиплетность (с, синглет; д, дублет; т, триплет; кв, квартет; м, мультиплет), константа(ы) расщепления (J) в герцах, число протонов. Префикс "каж" применяют в тех случаях,когда истинная мультиплетность сигнала не разрешена, а "уш" указывает на то, что рассматриваемый сигнал уширенный. Названия соединений даны при помощи ChemBioDraw Ultra Version 11.0. Анализ ЖХ-МС проводили при помощи спектрометра РЕ SCIEX API 2000 с колонкой PhenomenexLuna 5 микрон C18. Препаративную ВЭЖХ проводили на приборе Gilson HPLC 215 liquid handler с колонкой Phenomenex (Gemini 10 , C18, 110A) и детектором UV/VIS 156. Если получение исходных материалов отдельно не описано, указанные соединения известны или могут быть получены аналогично способам, известным в данной области техники или описанным в примерах. Опытный специалист в данной области техники поймет, что описанные в настоящей заявке методики синтеза являются только типичными примерами способов получения соединений согласно настоящему изобретению и аналогично можно применять другие хорошо известные способы. Далее настоящее изобретение иллюстрировано, но не ограничено, следующими примерами, которые иллюстрируют получение соединений согласно настоящему изобретению. Получение промежуточных соединений Промежуточное соединение 1. (3-Метил-1-фенил-1H-пиразол-5-ил)метанол (2) Стадия А. К раствору этилового эфира 4-метил-3-оксопентановой кислоты (2,5 г, 13,4 ммоль) в этаноле (20 мл) добавляли фенилгидразин и уксусную кислоту (0,5 мл). Полученный раствор перемешивали в течение 24 ч и концентрировали в вакууме. Полученный остаток содержал два региоизомера, из которых целевой изомер был менее полярным. Полученную смесь очищали при помощи хроматографии (020% EtOAc в гексане), получая сложный эфир (1) в виде желтого масла. Стадия В. Сложный эфир (1) (0,95 г, 3,68 ммоль) растворяли в безводном ТГФ (4 мл) и охлаждали до 0 С в атмосфере азота. Добавляли алюмогидрид лития в ТГФ (1,0 М, 4,05 мл, 4,05 ммоль) в течение 10 мин. По окончании добавления раствор оставляли нагреваться до комнатной температуры и перемешивали еще в течение часа. Охлаждали раствор до 0 С и останавливали реакцию добавлением этилацетата(5 мл) с последующим добавлением насыщенного водного раствора сульфата натрия (5 мл). Полученную смесь разбавляли этилацетатом и фильтровали через слой целита. Объединенные фильтраты высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали при помощи хроматографии на силикагеле (0-100% EtOAc в гексане), получая целевой спирт (2) в виде желтого масла. Промежуточное соединение 2. 5-(Бромметил)-4-фенил-1,2,3-гиадиазол (5) Стадия А. К раствору пропиофенона (2,5 г, 18,6 ммоль) в этаноле (35 мл) добавляли 4 метилбензолсульфоногидразид (3,53 г, 20,5 ммоль) с последующим добавлением уксусной кислоты (0,35 мл). Полученный раствор кипятили с обратным холодильником в течение 1 ч и охлаждали до комнатной температуры. Растворитель удаляли в вакууме и ополаскивали полученный остаток метанолом. При помощи фильтрования выделяли твердый целевой продукт (E)-4-метил-N'-(1-фенилпропиледен)бензолсульфоногидразид (3). Стадия В. Гидразон (3) (3,0 г, 9,9 ммоль) растворяли в тионилхлориде (10 мл) и перемешивали при КТ в течение 1 ч. Полученный раствор медленно выливали в водный раствор гидроксида натрия (1,0 N,50 мл). Полученный раствор экстрагировали ДХМ, высушивали органический слой над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи хроматографии на силикагеле (0 -30% EtOAc в гексане), получая 5-метил-4-фенил-1,2,3-тиадиазол (4) в виде желтого масла. Стадия С. К раствору тиадиазола (4) (1,6 г, 9,08 ммоль) в тетрахлорметане (40 мл) добавляли Nбромсукцинимид (3,23 г, 18,2 ммоль) и бензоилпероксид (0,314 г, 0,91 ммоль). Полученный раствор кипятили с обратным холодильником в течение 24 ч. Затем указанный раствор охлаждали до комнатной температуры и удаляли тетрахлорметан в вакууме. Полученный остаток растворяли в этилацетате и промывали водой. Отделяли органический слой, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток подвергали хроматографии на силикагеле (0-30% EtOAc в гексане), выделяя 5-(бромметил)-4-фенил-1,2,3-тиадиазол (5). Промежуточное соединение 3. (1-Фенил-1H-имидазол-5-ил)метанол (8) Стадия А. К раствору анилина (2,3 мл, 25 ммоль) в метаноле (50 мл) добавляли этилглиоксалат. Полученный раствор кипятили с обратным холодильником в течение 3,5 ч, охлаждали до комнатной температуры, и затем удаляли растворитель в вакууме. Полученное масло (6) применяли на следующей стадии без дополнительной очистки. Стадия В. К раствору этилового эфира 2-метокси-2-(фениламино)уксусной кислоты (6) (3,13 г, 15 ммоль) в этаноле (30 мл) добавляли 1-(изоцианатометилсульфонил)-4-метилбензол (4,4 г, 22,5 ммоль) и карбонат калия (4,14 г, 30 ммоль). Полученную суспензию нагревали при 65 С в течение 4 ч. После охлаждения до комнатной температуры полученную смесь выливали в воду и экстрагировали этилацетатом. Отделяли органический слой, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи препаративной ВЭЖХ, получая этиловый эфир 1 фенил-1H-имидазол-5-карбоновой кислоты (7). Стадия С. Сложный эфир (7) (0,80 г, 3,70 ммоль) растворяли в безводном ТГФ (4 мл) и охлаждали до 0 С в атмосфере азота. Добавляли алюмогидрид лития в ТГФ (1,0 М 3,7 мл, 3,7 ммоль) в течение 10 мин. По окончании добавления оставляли полученный раствор нагреться до комнатной температуры и перемешивали еще в течение шестидесяти минут. Охлаждали раствор до 0 С и останавливали реакцию добавлением этилацетата (5 мл) с последующим добавлением насыщенного водного раствора сульфата натрия (5 мл). Полученную смесь разбавляли этилацетатом и фильтровали через слой целита. Объединенные фильтраты высушивали над сульфатом натрия и концентрировали в вакууме. Полученное масло очищали при помощи хроматографии на силикагеле (0-100% EtOAc в гексане), получая целевой спирт Стадия А. К раствору этилового эфира 3-метилпиразол-5-карбоновой кислоты (5,04 г, 0,032 моль) в ацетоне (20 мл) добавляли K2CO3 (18,14 г), с последующим добавлением 1-йод-2-метилпропана (22,21 г). Полученную смесь кипятили с обратным холодильником при 70 С в течение ночи. Полученную смесь фильтровали через целит, и концентрировали полученный фильтрат в вакууме. Полученный остаток содержал два региоизомера, из которых целевой изомер был менее полярным. В результате очистки полученного продукта при помощи флэш-хроматографии на силикагеле (0-30% EtOAc в гексане), получали 2,14 г этилового эфира 1-изобутил-3-метил-1H-пиразол-5-карбоновой кислоты (9) в виде бесцветной жидкости. 1 Н ЯМР (400 Гц, CDCl3) : 6,61 (с, 1H), 4,38-4,24 (м, 4 Н), 2,27 (с, 3H), 2,24-2,13 (м, 1H), 1,36 (т,J=7,1 Гц, 3H), 0,88 (д, J=6,7 Гц, 6 Н). Стадия В. К раствору этилового эфира 1-изобутил-3-метил-1H-пиразол-5-карбоновой кислоты (9)(1,99 г, 9,46 ммоль) в ТГФ (10 мл) при 0 С добавляли раствор алюмогидрида лития в ТГФ (1 М, 15 мл, 15 ммоль). После перемешивания при комнатной температуре в течение ночи добавляли 10 мл EtOAc и перемешивали полученную смесь еще в течение 10 мин. Добавляли воду (15 мл), перемешивали полученную смесь еще в течение 10 мин, фильтровали через целит и ополаскивали EtOAc. Фильтрат распределяли между EtOAc и H2O/раствор соли, промывали Н 2 О/раствором соли, высушивали над Na2SO4 и концентрировали в вакууме, получая 1,73 г целевого спирта (10) в виде бесцветной жидкости. Полученный продукт был достаточно чистым для применения непосредственно на следующей стадии бромирования. 1 Н ЯМР (400 МГц, CDCl3) : 5,97 (с, 1 Н), 4,62 (д, J=5,8 Гц, 2 Н), 3,87 (д, J=7,5 Гц, 2 Н), 2,35-2,25 (м, 1H),2,25 (с, 3H), 0,90 (д, J=6,7 Гц, 6 Н). Стадия С. К раствору неочищенного этил-(1-изобутил-3-метил-1H-пиразол-5-ил)метанола (10) (1,72 г) и PPh3 (2,99 г) в дихлорметане (10 мл) при 0 С добавляли CBr4 (3,76 г). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь концентрировали в вакууме. В результате очистки полученного продукта при помощи флэш-хроматографии на силикагеле (0-40% EtOAc в гексане),получали 1,614 г (бромметил)-1-изобутил-3-метил-1H-пиразола (11) в виде бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3) : 6,05 (с, 1H), 4,43 (с, 2 Н), 3,85 (д, J=7,5 Гц, 2 Н), 2,38-2,24 (м, 1H), 2,23 (с, 3H),0,94 (д, J=6,7 Гц, 6 Н). Промежуточное соединение 5. Этиловый эфир 2-(2-(3,5-дифтор-4-гидроксифенил)циклопропил)уксусной кислоты (20) Стадия А. В трубку высокого давления объемом 350 мл помещали 4-бром-2,6-дифторфенол (23,82 г, 0,11 моль), триэтиламин (55 мл, 0,39 моль), этилацетат (34,27 г, 0,34 моль), ДМФА (50 мл), ацетат палладия (II) (1,29 г, 5,75 ммоль) и три-орто-толилфосфин (2,34 г, 7,6 ммоль) в атмосфере N2. полученную смесь запаивали в стеклянную трубку и перемешивали при 110 С в течение ночи (21 ч). Реакционную смесь охлаждали до комнатной температуры и добавляли EtOAc (150 мл). Полученную смесь перемешивали в течение 30 мин, фильтровали через целит и ополаскивали EtOAc (100 мл 3). Фильтрат подкисляли 2N HCl до рН 2. Органический слой отделяли, а водный слой экстрагировали EtOAc (50 мл 2). Органические слои объединяли и промывали водой (100 мл 2), раствором соли (100 мл) и высушивали надNa2SO4. После фильтрования добавляли гептан (200 мл) и концентрировали полученный раствор в вакууме. Полученный осадок отфильтровывали, промывали гептаном (50 мл 2) и высушивали, получая целевой продукт (12) (17,09 г) в виде светло-желтого твердого вещества. Фильтрат концентрировали,получая дополнительное количество целевого продукта (4,29 г) в виде бледно-желтого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3) : 7,50 (д, J= 15,9 Гц, 1H), 7,09 (д, J= 8,3 Гц, 2 Н), 6,29 (д, J= 15,9 Гц, 1H),5,54 (уш, 1H), 4,26 (кв, J= 7,1 Гц, 2 Н), 1,33 (т, J= 7,1 Гц, 3H). Стадия В. К смеси N-метил-N'-нитро-N-нитрозогуанидина (TCI-America по каталогуМ 0527, 10 г в расчете на сухую массу, 0,068 моль) в эфире (150 мл) при 0 С добавляли к холодному раствору KOH(12,60 г) в воде (21 мл). После перемешивания в течение 2 мин порцию желтого эфирного раствора полученного диазометана добавляли к раствору этилового эфира 3-(3,5-дифтор-4-гидроксифенил)акриловой кислоты (12) (2,28 г, 0,010 моль) в эфире (100 мл) при 0 С. Добавляли часть ацетата палладия (II) (0,372 г, 1,66 ммоль) с последующим добавлением дополнительной порции раствора диазометана. Описанный процесс продолжали до добавления всего раствора диазометана и ацетата палладия (II). Полученную темную смесь перемешивали при 0-5 С в течение 4 ч и добавляли уксусную кислоту (6 капель) для нейтрализации любого избыточного реагента. После удаления растворителя очищали полученный остаток хроматографией на силикагеле (0-30% EtOAc в гексане), получая 2,04 г целевого продукта в виде белого твердого вещества (13). 1H ЯМР (400 МГц, CDCl3) : 6,67 (д, J= 8,4 Гц, 2 Н), 5,05 (уш, 1H), 4,20 (кв, J= 7,1 Гц, 2 Н), 2,45-2,40 (м, 1H), 1,87-1,74 (м, 1H), 1,39-1,14 (м, 5 Н). Стадия С. К смеси этилового эфира 2-(3,5-дифтор-4-гидроксифенил)циклопропанкарбоновой кислоты (13) (2,04 г, 8,4 ммоль) и K2CO3 (1,69 г, 12,2 ммоль) в ДМФА (15 мл) добавляли бензилбромид(1,88 г, 11 ммоль). Полученную смесь перемешивали при KT в течение ночи и распределяли между этилацетатом и водой. Органический экстракт промывали водой и раствором соли, высушивали над сульфатом натрия и концентрировали в вакууме. В результате очистки полученного продукта при помощи флэш-хроматографии на силикагеле (0-20% EtOAc в гексане), получали 2,76 г целевого продукта (14) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3) : 7,50-7,43 (м, 2 Н), 7,38-7,32 (м, 3H), 6,62 (д,J=9,0 Гц, 2 Н), 5,12 (с, 2 Н), 4,19-4,11 (м, 2 Н), 2,43-2,38 (м, 1H), 1,89-1,76 (м, 1H), 1,65-1,58 (м, 1H), 1,291,15 (м, 4 Н). Стадия D. К раствору этилового эфира 2-(4-(бензилокси)-3,5-дифторфенил)циклопропанкарбоновой кислоты (14) (2,74 г, 8,24 ммоль) в ТГФ (10 мл) при 0 С добавляли раствор LiAlH4 (1N в эфире, 12,5 мл). После перемешивания при КТ в течение 2 ч добавляли 8 мл EtOAc и перемешивали полученный раствор в течение 10 мин. Добавляли воду (10 мл), перемешивали полученную смесь еще в течение 10 мин,фильтровали через целит и ополаскивали EtOAc. Фильтрат распределяли между EtOAc и H2O/раствором соли, промывали H2O/раствором соли, высушивали над Na2SO4 и концентрировали в вакууме, получая 2,25 г целевого продукта (15) в виде бесцветной жидкости. Полученный продукт был достаточно чистым для непосредственного применения в последующем окислении по Сверну. 1 Н ЯМР (400 МГц, CDCl3) : 7,49-7,39 (м, 2 Н), 7,39-7,33 (м, 3H), 6,59 (д, J= 9,2 Гц, 2 Н), 5,10 (с, 2 Н), 3,68-3,51 (м, 2 Н), 1,81-1,68 (м, 1H),1,47-1,20 (м, 1H), 1,02-0,83 (м, 2 Н).(15 мл) при -78 С, затем добавляли раствор (2-(4-(бензилокси)-3,5-дифторфенил)циклопропил)метанола(15) (2,25 г, 7,75 ммоль) в CH2Cl2 (5 мл) с последующим добавлением Et3N (5,6 мл). В результате очистки полученного продукта при помощи флэш-хроматографии на силикагеле (0-30%), получали 2,07 г целевого продукта (16) в виде бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3) : 9,37 (с, 1H), 7,47-7,41 (м, 2 Н),7,40-7,29 (м, 3H), 6,65 (д, J= 7,1 Гц, 2 Н), 5,13 (с, 2 Н), 2,59-2,45 (м, 1H), 2,19-2,10 (м, 1H), 1,78-1,65 (м, 1H),1,51-1,36 (м, 1H). Стадии F, G и Н: указанные реакции проводили в соответствии с протоколом, описанным в патенте США (US 2004/0092538, стр. 40-41). Стадия I. К раствору этилового эфира 2-(2-(4-(бензилокси)-3,5-дифторфенил)циклопропил)уксусной кислоты (19) (0,782 г, 2,25 ммоль) в EtOAc/EtOH (5 мл/10 мл) добавляли 159 мг 10% Pd/C и перемешивали полученную смесь при пропускании H2 в течение ночи. После фильтрования через целит и промывания EtOH фильтрат концентрировали в вакууме, получая 0,508 г целевого продукта (20) в виде бледно-желтой жидкости. Продукт был достаточно истым для применения непосредственно в последующих реакциях. 1H ЯМР (400 МГц, CDCl3) : 6,67 (д, J= 8,4 Гц, 2 Н), 4,96 (уш, 1 Н), 4,23-4,05 (м, 2 Н),2,50-2,26 (м, 2 Н), 1,70-1,66 (м, 1H), 1,33-1,19 (м, 4 Н), 0,97-0,79 (м, 2 Н). Промежуточное соединение 6. (4-Изопропокси-2-метилтиазол-5-ил)метанол (23)(2,23 г, 29,7 ммоль). После кипячения с обратным холодильником в течение 4 ч полученный раствор охлаждали и удаляли растворитель в вакууме. Полученный остаток растворяли в этилацетате, промывали водой, насыщенным раствором бикарбоната натрия и раствором соли. Органический слой отделяли, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученное твердое вещество (21) промывали холодным эфиром и выделяли путем фильтрования. Стадия В. К раствору (21) и 2-йодпропана в ДМФА (2 мл) добавляли гидрид натрия (60%, 0,026 г,0,646 ммоль). Полученную смесь нагревали при 50 С в течение 18 ч. После охлаждения добавляли воду(2 мл) и разбавляли полученный раствор этилацетатом (5 мл). Отделяли органический слой и концентрировали в вакууме. Полученный остаток очищали при помощи флэш-хроматографии на силикагеле (050% EtOAc в гексане), получая целевой продукт (22). Стадия С. Сложный эфир (22) (0,310 г, 1,35 ммоль) растворяли в безводном ТГФ (4 мл) и охлаждали до 0 С в атмосфере азота. Добавляли алюмогидрид лития в ТГФ (1,0 М, 1,6 мл, 1,6 ммоль) в течение 10 мин. По окончании добавления оставляли полученный раствор нагреться до комнатной температуры и перемешивали еще в течение 60 мин. Охлаждали раствор до 0 С и останавливали реакцию добавлением этилацетата (5 мл) с последующим добавлением насыщенного водного раствора сульфата натрия (5 мл). Полученную смесь разбавляли этилацетатом и фильтровали через слой целита. Объединенные фильтраты высушивали над сульфатом натрия и концентрировали в вакууме. Полученный остаток очищали при помощи хроматографии на силикагеле (0-100% EtOAc в гексане), получая целевой спирт (23). Промежуточное соединение 7. Метиловый эфир 2-(6-гидрокси-1,2,3,4-тетрагидронафталин-2 ил)уксусной кислоты (26) Стадия А. К смеси бензола (5 мл) и гидрида натрия (680 мг, 17,01 ммоль, 60% в минеральном масле) при 0 С медленно добавляли триэтилфосфоноацетат (1,82 мл, 9,08 ммоль) и перемешивали реакционную смесь в течение 30 мин. Добавляли 6-метокси-3,4-дигидронафталин-2(1H)-он (1 г, 5,67 ммоль) в бензоле (1 мл) и перемешивали при комнатной температуре в течение ночи. Выливали реакционную смесь в воду (20 мл), экстрагировали этилацетатом, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэшхроматографии на силикагеле с гексаном и EtOAc, получая (Е)-этиловый эфир 2-(6-метокси-3,4 дигидронафталин-2(1 Н)-илиден)уксусной кислоты (24). Стадия В. К раствору (Е)-этилового эфира 2-(6-метокси-3,4-дигидронафталин-2(1H)-илиден)уксусной кислоты (24) (810 мг, 3,29 ммоль) в этаноле (20 мл) добавляли Pd/C (81 мг, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая этиловый эфир 2-(6-метокси-1,2,3,4 тетрагидронафталин-2-ил)уксусной кислоты (25). Стадия С. К раствору этилового эфира 2-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)уксусной кислоты (25) (766 мг, 3,09 ммоль) в (31 мл) дихлорметане при 0 С добавляли трибромид бора (2,92 мл, 30,9 ммоль) и перемешивали в течение 3 ч. Реакцию останавливали очень медленным добавлением метанола,выливали в насыщенный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая метиловый эфир 2-(6-гидрокси-1,2,3,4-тетрагидронафталин-2-ил)уксусной кислоты (26). Промежуточное соединение 8. Этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)-2-метилпропионовой кислоты (30) Стадия А. Раствор 2,6-дифторфенола (25 г, 192 ммоль), гексаметилентетрамина (26 г, 192 ммоль) и трифторуксусной кислоты (190 ммоль) кипятили с обратным холодильником в течение ночи. Реакционную смесь охлаждали, разбавляли водой (200 мл) и экстрагировали дихлорметаном (3100 мл). Органический слой промывали 10% водным раствором карбоната калия (2100 мл). Водный слой подкисляли концентрированной соляной кислотой и экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 3,5-дифтор-4-гидроксибензальдегид в виде белого твердого вещества (27). После того, как целевой продукт начинал выпадать в осадок из исходного водного слоя, его экстрагировали дихлорметаном. Указанный слой фильтровали,получая продукт в виде длинных белых кристаллов. Стадия В. К смеси 3,5-дифтор-4-гидроксибензальдегида (27) (8,26 г, 52,2 ммоль) и карбоната калия(14,4 г, 104,4 ммоль) в диметилформамиде (100 мл) добавляли бензилхлорид (7,2 мл, 62,7 ммоль)и перемешивали в течение ночи при 50 С. Реакционную смесь разбавляли водой и экстрагировали этилацетатом (375 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая 4-(бензилокси)-3,5-дифторбензальдегид (28). Стадия С. Раствор 4-(бензилокси)-3,5-дифторбензальдегида (28) (1,32 г, 5,34 ммоль) и (1-этоксикарбонилэтилиден)трифенилфосфорана (2,32 г, 6,41 ммоль) в тетрагидрофуране (53 мл) кипятили с обратным холодильником в течение 2 ч. Реакционную смесь концентрировали в вакууме и очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая (E)-этиловый эфир 3-(4-(бензилокси)-3,5-дифторфенил)-2-метилакриловой кислоты (29). Стадия D. К раствору (E)-этилового эфира 3-(4-(бензилокси)-3,5-дифторфенил)-2-метилакриловой кислоты (29) (1,4 г, 4,21 ммоль) в этаноле (25 мл) добавляли Pd/C (140 мг, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая этиловый эфир 3-(3,5-дифтор-4 гидроксифенил)-2-метилпропионовой кислоты (30). Промежуточное соединение 9. Этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)-2,2-диметилпропионовой кислоты (34) Стадия А. К смеси 3,5-дифтор-4-гидроксибензальдегида (2,55 г, 16,3 ммоль), и карбоната калия (4,5 г, 32,3 ммоль) в диметилформамиде (30 мл) добавляли метилйодид (1,2 мл, 19,4 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой и экстрагировали этилацетатом (375 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентри- 22022417 ровали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая 3,5-дифтор-4-метоксибензальдегид (31). Стадия В. Диизопропиламид лития (5 мл, 10,1 ммоль, 2 М тетрагидрофуран/ гептан /этилбензол) добавляли к раствору этилизобутирата (1,36 мл, 10,1 ммоль) в тетрагидрофуране (4 мл) при -78 С и перемешивали в течение 2 ч. Добавляли 3,5-дифтор-4-метоксибензальдегид (31) (754 мг, 4,38 ммоль) и оставляли реакционную смесь нагреться до комнатной температуры в течение ночи. Заливали реакционную смесь водой и экстрагировали этилацетатом (310 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 3-(3,5-дифтор-4 метоксифенил)-3-гидрокси-2,2-диметилпропионовой кислоты (32). Стадия С. К раствору этилового эфира 3-(3,5-дифтор-4-метоксифенил)-3-гидрокси-2,2-диметилпропионовой кислоты (32) (200 мг, 0,69 ммоль), триэтилсилана (62 мкл, 0,76 ммоль) и дихлорметана (2 мл) при 0 С добавляли комплекс трифторида бора и диэтилового эфира (95 мкл, 0,76 ммоль) и перемешивали в течение 2 ч при комнатной температуре. По данным ТСХ все еще присутствовал исходный материал, поэтому добавляли еще 0,5 мл триэтилсилана и 0,5 мл комплекса трифторида бора и диэтилового эфира и перемешивали при комнатной температуре в течение ночи. Реакцию останавливали насыщенным раствором бикарбоната натрия и экстрагировали этилацетатом (310 мл), органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 3-(3,5-дифтор-4-метоксифенил)-2,2-диметилпропионовой кислоты (33). Стадия D. К раствору этилового эфира 3-(3,5-дифтор-4-метоксифенил)-2,2-диметилпропионовой кислоты (33) (155,7 мг, 0,57 ммоль) в дихлорметане (6 мл) при 0 С добавляли трибромид бора (0,54 мл,5,71 ммоль) и перемешивали в течение 3 ч. Реакцию останавливали очень медленным добавлением этанола, выливали в насыщенный раствор бикарбоната натрия и экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)-2,2-диметилпропионовой кислоты (34). Промежуточное соединение 10. Этиловый эфир 2-(3,5-дифтор-4-гидроксибензилокси)уксусной кислоты (37) Стадия А. К раствору 4-(бензилокси)-3,5-дифторбензальдегида (1 г, 4,03 ммоль) в тетрагидрофуране:метаноле (2:1) (22 мл) добавляли борогидрид натрия (304 мг, 8,1 ммоль) и перемешивали в течение 2 ч. Заливали реакционную смесь водой и экстрагировали этилацетатом (325 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая (4-(бензилокси)3,5-дифторфенил)метанол (35). Стадия В. К раствору (4-(бензилокси)-3,5-дифторфенил)метанола (35) (890 мг, 3,56 ммоль) в тетрагидрофуране (35 мл) добавляли гидрид натрия (156 мг, 3,91 ммоль, 60% в минеральном масле) и перемешивали при комнатной температуре в течение 30 мин. Добавляли этиловый эфир бромуксусной кислоты (0,44 мл, 3,91 ммоль) и перемешивали реакционную смесь в течение ночи. Заливали реакционную смесь водой и экстрагировали этилацетатом (350 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 2-(4-(бензилокси)3,5-дифторбензилокси)уксусной кислоты (36). Стадия С. К раствору этилового эфира 2-(4-(бензилокси)-3,5-дифторбензилокси)уксусной кислоты(36) (363 мг, 1,08 ммоль) в этаноле (25 мл) добавляли Pd/C (36 мг, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая этиловый эфир 2-(3,5-дифтор-4-гидрокибензилокси) уксусной кислоты (37). Промежуточное соединение 11. (R)-4-бензил-3-S)-3-(3,5-дифтор-4-гидроксифенил)-2-метилпропаноил)оксазолидин-2-он (40) и (R)-4-бензил-3-R)-3-(3,5-дифтор-4-гидроксифенил)-2-метилпропаноил) оксазолидин-2-он (41) Стадия А. К смеси этилового эфира 3-(3,5-дифтор-4-гидроксифенил)-2-метилпропионовой кислоты(0,53 мл, 4,57 ммоль) и перемешивали в течение ночи при 50 С. Разбавляли реакционную смесь водой и экстрагировали этилацетатом (325 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэшхроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 3-(4-(бензилокси)-3,5 дифторфенил)-2-метилпропионовой кислоты (38). Стадия В. К смеси этилового эфира 3-(4-(бензилокси)-3,5-дифторфенил)-2-метилпропионовой кислоты (38) (1,09 г, 3,26 ммоль) в тетрагидрофуране (10 мл), воде (10 мл) и метаноле (20 мл) добавляли гидроксид лития (547 мг, 13,04 ммоль) и перемешивали в течение ночи при 80 С. Реакционную смесь концентрировали, подкисляли 1N соляной кислотой и экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая 3-(4(бензилокси)-3,5-дифторфенил)-2-метилпропионовую кислоту (39). Стадия С. К раствору 3-(4-(бензилокси)-3,5-дифторфенил)-2-метилпропионоой кислоты (0,99 г, 3,23 ммоль) в тетрагидрофуране (2,5 мл) при 0 С добавляли триэтиламин (0,50 мл, 3,57 ммоль) и пивалоилхлорид (0,44 мл, 3,57 ммоль) и перемешивали реакционную смесь в течение 30 мин. В отдельном сосуде растворяли (R)-4-бензилоксазолидин-2-он (0,48 г, 2,69 ммоль) в тетрагидрофуране (4 мл) и охлаждали до-78 С. Добавляли nBuLi (1,77 мл, 2,69 ммоль, 1,52 М в гексане) и перемешивали реакционную смесь в течение 30 мин. Раствор 3-(4-(бензилокси)-3,5-дифторфенил)-2-метилпропионовой кислоты добавляли к раствору (R)-4-бензилоксазолидин-2-она и перемешивали при -78 С в течение 3 ч и при комнатной температуре в течение 30 мин. Заливали реакционную смесь насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэшхроматографии на силикагеле с гексаном и EtOAc, получая два диастереомера R)-4-бензил-3-R)-3(3,5-дифтор-4-гидроксифенил)-2-метилпропаноил)оксазолидин-2-он и Стадия А. К раствору 4-меркаптофенола (49,7 мг, 0,39 ммоль) в тетрагидрофуране (2 мл) добавляли карбонат цезия (128 мг, 0,39 ммоль) и этиловый эфир бромуксусной кислоты (44 мкл, 0,39 ммоль) и перемешивали реакционную смесь при 50 С в течение ночи. Заливали реакционную смесь водой и экстрагировали этилацетатом (310 мл). Органический слой высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэшхроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 2-(4-гидроксифенилтио)уксусной кислоты (42). Промежуточное соединение 13. (5-Фенилтиазол-4-ил)метанол (44) Стадия А. К суспензии цианида натрия (0,32 г, 6,5 ммоль) в этаноле (65 мл) добавляли раствор Оэтилового эфира тиобензойной кислоты (8,3 г, 49,9 ммоль) и этилового эфира изоцианоуксусной кислоты(6,03 мл, 54,9 ммоль) в этаноле (30 мл). Реакционную смесь нагревали при 50 С в течение ночи и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 5-фенилтиазол-4-карбоновой кислоты (43). Стадия В. К раствору этилового эфира 5-фенилтиазол-4-карбоновой кислоты (43) (1 г, 4,28 ммоль) в тетрагидрофуране (43 мл) при 0 С добавляли алюмогидрид лития (4,3 мл, 4,28 ммоль, 1M в тетрагидро- 24022417 фуране) и оставляли реакционную смесь нагреться до комнатной температуры в течение ночи. Заливали реакционную смесь водой, фильтровали через целит и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэш-хроматографии на силикагеле с гексаном и EtOAc, получая (5 фенилтиазол-4-ил)метанол (44). Промежуточное соединение 14. Этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)-2,2-дифторпропионовой кислоты (46) Стадия А. Гидрид натрия (0,3 г, 7,5 ммоль) добавляли к смеси 4-(бензилокси)-3,5-дифторбензальдегида (1,2 г, 5 ммоль) и триэтил 2-фтор-2-фосфоноацетата (1,2 г, 6 ммоль) в безводном ТГФ (10 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 2 ч и заливали H2O. Полученный продукт экстрагировали этилацетатом. Органическую фазу промывали H2O, раствором соли, высушивали над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали при помощи флэш-хроматографии на силикагеле, получая желтое масло (47) (1 г). Стадия В. Соединение (47) растворяли в этилацетате (20 мл), добавляли к полученному раствору 100 мг 10% Pd/C и перемешивали полученную смесь, пропуская H2 из баллона в течение 24 ч. После фильтрования через целит и промывания этилацетатом фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи флэш-хроматографии на силикагеле, получая твердое вещество (48) (0,6 г). 1H ЯМР (400 МГц, CDCl3) : 6,81 (д, J= 8,4 Гц, 2 Н), 5,2 (уш, 1H), 5,05 (ддд, J= 52, 7,4 Гц, 1H), 4,24 (кв, J= 7,2 Гц, 2 Н), 3,2-3 (м, 2 Н), 1,28 (д, J= 7,2 Гц, 2 Н). Промежуточное соединение 16. Этиловый эфир 2-(3,5-дифтор-4-гидроксибензил)цилопропанкарбоновой кислоты (52) Стадия А. Раствор бис(триметилсилил)амида лития (30 мл, 30 ммоль) добавляли к смеси метокси метилтрифенилфосфонийхлорида (10,3 г, 30 ммоль) в безводном ТГФ (25 л) при 0 С в атмосфере азота. Через 15 мин добавляли к смеси при 0 С 4-(бензилокси)-3,5-дифторбензальдегид (5 г, 20 ммоль) в ТГФ(25 мл). Реакционную смесь перемешивали в течение 2 ч и заливали H2O. Полученный продукт экстрагировали этилацетатом. Органическую фазу промывали H2O, раствором соли, высушивали над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали при помощи флэшхроматографии на силикагеле, получая желтое масло (5 г). Выделенное масло растворяли в ТГФ (100 мл) и 2N растворе HCl (50 мл). Полученный раствор перемешивали при 70 С в течение 5 ч. Выпаривали ТГФ и разбавляли полученный остаток H2O и этилацетатом. Органическую фазу промывали H2O, раствором соли, высушивали над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали при помощи флэш-хроматографии на силикагеле, получая желтое масло (49) (3,3 г). Стадия В. Гидрид натрия (0,24 г, 6 ммоль) добавляли к смеси 2-(4-(бензилокси)-3,5-дифторфенил) ацетальдегида (49) (1,3 г, 5 ммоль) и триэтил фосфоноацетата (1,3 г, 6 ммоль) в безводном ТГФ (20 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 5 ч и заливали H2O. Полученный продукт экстрагировали этилацетатом. Органическую фазу промывали H2O, раствором соли, высушивали над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали при помощи флэш-хроматографии на силикагеле, получая желтое масло (50) (1,1 г). Стадия С. К смеси Nметил-N'-нитро-N-нитрозогуанидина (10 г в расчете на сухую массу, 0,068 моль) в эфире (150 мл) при 0 С добавляли по каплям холодный раствор KOH (12,60 г) в воде (21 мл). После перемешивания в течение 2 минут желтый эфирный раствор полученного диазометана из верхнего слоя добавляли к раствору(E)-этилового эфира 4-(4-(бензилокси)-3,5-дифторфенил)бут-2-еновой кислоты (50) (1,1 г, 3,3 моль) в эфире (50 мл) при 0 С попеременно с ацетатом палладия (II) (0,4 г, 1,78 ммоль). Полученную темную смесь перемешивали при 0-5 С в течение 4 ч. После удаления растворителя полученный остаток очищали при помощи флэш-хроматографии на силикагеле, получая целевой продукт (51) (1 г) в виде желтого масла. Стадия D. Сложный эфир (51) растворяли в этилацетате (20 мл), добавляли к полученному раствору 100 мг 10% Pd/C и перемешивали полученную смесь, пропуская H2 из баллона, в течение ночи. После фильтрования через целит и промывания этилацетатом фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи флэш-хроматографии на силикагеле, получая желтое масло (52) (0,7 г). 1H ЯМР (400 МГц, CDCl3) : 6,67 (д, J= 8,4 Гц, 2 Н), 4,96 (уш, 1H), 4,23-4,05 (м, 2 Н),2,50-2,26 (м, 2 Н), 1,70-1,66 (м, 1H), 1,33-1,19 (м, 4 Н), 0,97-0,79 (м, 2 Н). Промежуточное соединение 17. Этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)пропионовой кислоты (53) Стадия А. В стеклянный сосуд, подходящий для работы под давлением, помещали 4-бром-2,6 дифторфенол (23,82 г, 0,11 моль), триэтиламин (55 мл, 0,39 моль), этилакрилат (34,27 г, 0,34 моль),ДМФА (50 мл), ацетат палладия (II) (1,29 г, 5,75 ммоль) с последующим добавлением три-ортотолилфосфина (2,34 г, 7,6 ммоль) в атмосфере N2. Полученную смесь запаивали в стеклянном сосуде и перемешивали при 110 С в течение ночи (21 ч), охлаждали до комнатной температуры, добавляли EtOAc(150 мл) и перемешивали в течение 30 мин, фильтровали через целит и ополаскивали EtOAc (100 мл 3). Фильтрат подкисляли 2N HCl до рН 2. Отделяли органический слой и экстрагировали водный слойEtOAc (50 мл 2). Органические слои объединяли, промывали водой (100 мл 2), раствором соли (100 мл) и высушивали над Na2SO4. После фильтрования добавляли гептан (200 мл) и концентрировали полученный раствор в вакууме. Полученный садок отфильтровывали, промывали гептаном (50 мл 2) и высушивали, получая целевой продукт (17,09 г) в виде светло-желтого твердого вещества. Фильтрат концентрировали, получая дополнительное количество целевого продукта (12) (4,29 г) в виде бледножелтого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3) : 7,50 (д, J= 15,9 Гц, 1H), 7,09 (д, J=8,3 Гц, 2 Н),6,29 (д, J=15,9 Гц, 1H), 5,54 (уш, 1H), 4,26 (кв, J=7,1 Гц, 2 Н), 1,33 (т, J= 7,1 Гц, 3H). Стадия В. К раствору (E)-этилового эфира 3-(3,5-дифтор-4-гидроксифенил)акриловой кислоты (12)(0,751 г, 3,29 ммоль) в этаноле (20 мл) добавляли Pd/C (81 мг, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)пропионовой кислоты (53). Промежуточное соединение 18. (1-(4-Хлорфенил)-1H-пиразол-5-ил)метанол (251) Стадия А. Этилпируват (1,91 мл, 17,2 ммоль) и N,N-диметилформамида диметилацеталь (2,29 мл,17,2 ммоль) помещали в сцинтилляционный сосуд и перемешивали в течение ночи при комнатной температуре. Полученный темный красно-коричневый раствор добавляли к раствору 4-хлорфенилгидразина гидрохлорида (3,08 г, 17,2 ммоль) в этаноле (50 мл) и нагревали при 85 С в течение 3 ч. Концентрировали реакционную смесь в вакууме. Полученный остаток очищали при помощи колоночной флэшхроматографии на силикагеле с гексаном и EtOAc, получая этиловый эфир 1-(4-хлорфенил)-1H-пиразол 5-карбоновой кислоты (250). Стадия В. Сложный эфир (250) (0,600 г, 2,40 ммоль) растворяли в безводном ТГФ (24 мл) и охлаждали до 0 С в атмосфере азота. Добавляли алюмогидрид лития в ТГФ (1,0 М, 2,9 мл, 2,9 ммоль) в течение 10 мин. По окончании добавления оставляли полученный раствор нагреться до комнатной температуры и перемешивали еще в течение 60 мин. Полученный раствор охлаждали до 0 С и останавливали реакцию добавлением этилацетата (5 мл) с последующим добавление насыщенного водного раствора сульфата натрия (5 мл). Полученную смесь разбавляли этилацетатом и фильтровали через слой целита. Объеди- 26022417 ненные фильтраты высушивали над сульфатом натрия и концентрировали в вакууме. Полученное масло очищали при помощи хроматографии на силикагеле (0-100% EtOAc в гексане), получая целевой спирт Стадия А. К раствору этилового эфира 2-хлор-2-этоксиуксусной кислоты (10 г, 60 ммоль) в хлороформе (30 мл) добавляли трифенилфосфин (15,7 г, 60 ммоль) и перемешивали в течение ночи при комнатной температуре. Удали растворитель в вакууме и добавляли диэтиловый эфир. Вновь удаляли растворитель и высушивали в вакууме, получая хлорид (1,2-диэтокси-2-оксоэтил)трифенилфосфония (21 г,выход 82%) (252) в виде пенистого твердого вещества. Стадия В. К раствору хлорида (1,2-диэтокси-2-оксоэтил)трифенилфосфония (252) (1,61 г, 3,76 ммоль) в ТГФ (56 мл) добавляли DBU (0,67 мл, 4,51 ммоль) и перемешивали реакционную смесь в течение 10 мин при комнатной температуре. Добавляли 4-(бензилокси)-3,5-дифторбензальдегид (1,40 г, 5,64 ммоль) за один прием и перемешивали реакционную смесь при комнатной температуре в течение 18 ч. Удаляли растворитель в вакууме, добавляли диэтиловый эфир и отфильтровывали твердое вещество. Фильтрат концентрировали в вакууме и полученный маслянистый остаток очищали при помощи хроматографии на силикагеле (0-30% EtOAc в гексане), получая (Z)-этиловый эфир 3-(4-(бензилокси)-3,5 дифторфенил)-2-этоксиакриловой кислоты (253). Стадия С. К раствору (Z)-этилового эфира 3-(4-(бензилокси)-3,5-дифторфенил)-2-этоксиакриловой кислоты (253) (1,3 г, 3,59 ммоль) в этаноле (25 мл) добавляли Pd/C (140 мг, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Перемешивали реакционную смесь в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая этиловый эфир 3-(3,5-дифтор-4-гидроксифенил)-2-этоксипропионовой кислоты (0,81 г) (254). Промежуточное соединение 20. Этиловый эфир 2-(6-фтор-5-гидрокси-2,3-дигидро-1H-инден-1-ил) уксусной кислоты (260) Стадия А. К раствору малоновой кислоты (21,5 г, 207 ммоль) в пиридине (50 мл) добавляли 4-фтор 3-метоксибензальдегид (16 г, 104 ммоль) и пиперидин (1,5 мл). Реакционную смесь кипятили с обратным холодильником в течение 13 ч. Добавляли воду (25 мл) с последующим добавлением концентрированнойHCl (40 мл). Выпавший в осадок продукт (255) собирали путем фильтрования и промывали водой. Стадия В. К раствору (255) (25 г, 127 ммоль) в этаноле (40 мл) добавляли Pd/C (2 г, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Реакционную смесь перемешивали в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая соединение (256). Стадия С. В микроволновую пробирку объемом 20 мл помещали соединение (256) (2,00 г, 10,1 ммоль) и метансульфоновую кислоту (15 мл). Трубку запаивали и нагревали при 90 С в течение 10 мин. Полученный раствор выливали в ледяную баню, нейтрализовывали до рН 7 водным раствором NaOH. Полученный осадок выделяли путем фильтрования и промывали водой, получая соединение (257). Стадия D. К раствору кетона (257) (3,56 г, 19,8 ммоль) в толуоле/ТГФ (50:1, 40 мл) добавляли пыль Полученную суспензию нагревали при 90 С в течение 30 мин. После охлаждения до комнатной температуры добавляли этиловый эфир бромуксусной кислоты (3,4 мл, 31,6 ммоль). Полученную суспензию нагревали при 100 С в течение 4 ч. После охлаждения до комнатной температуры добавляли водный раствор HCl (50 мл, 2N) и экстрагировали полученный раствор этилацетатом (250 мл). Органические экстракты объединяли, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи хроматографии на силикагеле (0-50% EtOAc в гексане), получая целевой сложный эфир (258) в виде смеси изомеров. Стадия Е. К раствору (258) (0,79 г, 3,2 ммоль) в этаноле (10 мл) добавляли Pd/C (0,08 г, 10% типа Дегусса). Подключали газообразный водород из баллона и трижды вакуумировали и вновь наполняли водородом реакционный сосуд. Перемешивали реакционную смесь в течение ночи при комнатной температуре, фильтровали через слой целита и концентрировали в вакууме, получая соединение (259). Стадия F. К раствору сложного эфира (259) (1,06 г, 4,2 ммоль) в дихлорметане (40 мл) при 0 С добавляли трибромид бора (3,96 мл, 41,9 ммоль). Полученный раствор перемешивали в течение 2 ч и заливали этанолом (5 мл), с последующим добавлением насыщенного раствора бикарбоната натрия (5 мл),отделяли органический слой, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая целевой продукт (260). Промежуточное соединение 21. Метиловый эфир 2-(3,5-дифтор-4-гидроксифенил)циклопент-1 енкарбоновой кислоты (261) Стадия А. В стеклянный сосуд, подходящий для работы под давлением, объемом 350 мл помещали 4-бром-2,6-дифторфенол (5,0 г, 0,024 моль), триэтиламин (100 мл), метиловый эфир 1-циклопентен-1 карбоновой кислоты (4,5 г, 1,5 экв.), ацетат палладия (II) (0,27 г, 0,05 экв.), с последующим добавлением три-орто-толилфосфина (0,73 г, 0,1 экв.) в атмосфере N2. Полученную смесь запаивали в стеклянной трубке и перемешивали при 100 С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, добавляли EtOAc (150 мл) и перемешивали в течение 30 мин, фильтровали через целит и ополаскивали EtOAc (100 мл 3). Фильтрат подкисляли 2N HCl до рН 2. Отделяли органический слой, и экстрагировали водный слой EtOAc (50 мл 2). Объединяли органические слои, промывали водой (100 мл 2), раствором соли (100 мл) и высушивали над Na2SO4. Фильтрат концентрировали в вакууме и очищали полученное масло при помощи хроматографии на силикагеле, получая целевой продукт (261) (5,43 г,выход 89%) в виде светло-желтого влажного твердого вещества. Промежуточное соединение 22. Бензиловый эфир 3-(4-гидроксибензилиден)циклобутанкарбоновой кислоты (262) Стадия А. В стеклянный сосуд, подходящий для работы под давлением, объемом 100 мл помещали 4-бромфенол (1,0 г, 0,0057 моль), триэтиламин (30 мл), бензиловый эфир 3-метиленциклобутанкарбоновой кислоты (1,5 г, 1,3 экв.), ацетат палладия (II) (0,064 г, 0,05 экв.), с последующим добавлением три-орто-толилфосфина (0,175 г, 0,1 экв.) в атмосфере N2. Полученную смесь запаивали в стеклянной трубке и перемешивали при 100 С в течение ночи. Охлаждали реакционную смесь до комнатной температуры и добавляли EtOAc (100 мл), перемешивали в течение 30 мин, фильтровали через целит и ополаскивали EtOAc (50 мл 3). Фильтрат подкисляли 2N HCl до рН 2. Отделяли органический слой, и экстрагировали водный слой EtOAc (50 мл 2). Объединяли органические слои, промывали водой (100 мл 2), раствором соли (100 мл) и высушивали над Na2SO4. Фильтрат концентрировали в вакууме и очищали полученное масло при помощи хроматографии на силикагеле, получая целевой продукт (262) (5,43 г,выход 58%). Промежуточное соединение 23. Этиловый эфир 3-(2-этил-4-гидроксифенил)-2-метилпропионовой кислоты (265) Стадия А. К раствору 3-этилфенола (6,11 г, 50 ммоль) в CH2Cl2 добавляли TiCl4 в CH2Cl2 (100 мл,100 ммоль) при 0 С с последующим добавлением дихлор(метокси) метана (7,4 мл, 80 ммоль). Реакционную смесь перемешивали при 0 С в течение 1 ч. Полученную смесь выливали в ледяную воду и экстрагировали этилацетатом (325 мл). Органические слои высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Полученный остаток очищали при помощи колоночной флэшхроматографии на силикагеле с гексаном и EtOAc, получая 2-этил-4-гидроксибензальдегид (263). 1 Н ЯМР (400 МГц, CDCl3)10,07 (с, 1H), 7,76 (д, J=8,3 Гц, 1H), 6,82 (д, J=8,4 Гц, 1H), 6,77 (с, 1H), 3,02 (кв,J=7 Гц, 2 Н), 1,25 (т, J =7 Гц, 3H). Стадия В. Соединение (264) получали способом, аналогичным способу, описанному для синтеза соединения 29. Стадия С. Соединение (265) получали способом, аналогичным способу, описанному для синтеза соединения 30. Промежуточное соединение 24. Этиловый эфир 2-(6-гидрокси-1,2,3,4-тетрагидронафталин-1 ил)уксусной кислоты (268) Стадия А. К раствору 6-метокси-3,4-дигидронафталин-1(2 Н)-она (5,0 ммоль, 0,881 г) в ТГФ (25,0 мл) добавляли NaH (12,5 ммоль, 0,50 г), а затем этиловый эфир 2-(диэтиоксифосфорил)уксусной кислоты(12,5 ммоль, 2,5 мл) в атмосфере азота при комнатной температуре. Реакционную смесь нагревали до 60 С в течение 4 ч. Реакционную смесь охлаждали и заливали водой, экстрагировали EtOAc. Органические слои промывали водой, раствором соли и высушивали над Na2SO4. Удалял и растворитель при пониженном давлении и подвергали полученный остаток хроматографии (силикагель, 30% EtOAc в гексане), получая соединение (266) (0,792 г, 64,3%). ЖХ-МС ИЭР m/z; найдено 247,0 [М+Н]+. Стадия В. Смесь соединения (266) (0,792 г, 3,22 ммоль) в EtOH (50,0 мл) восстанавливали Pd/C(0,100 г) в атмосфере водорода при комнатной температуре в течение 12 ч, получая соединение (267)(0,709 г, 88,8%). 1 Н ЯМР (400 МГц, CDCl3)7,08 (д, J=8,5 Гц, 1H), 6,70 (дд, J=8,5, 2,7 Гц, 1H), 6,61 (д,J=2,5 Гц, 1H), 4,17 (кв, J=7,1 Гц, 2 Н), 3,77 (с, 3H), 3,38-3,22 (м, 1H), 2,82-2,60 (м, 3H), 2,57-2,41 (м, 1H),1,96-1,62 (м, 4 Н), 1,27 (т, J= 7,1 Гц, 3H). Стадия С. К смеси соединения (267) (0,709 г, 2,85 ммоль) в ДХМ (30,0 мл) при 0 С в атмосфере азота медленно добавляли трибромид бора (0,809 мл, 8,56 ммоль). Реакционную смесь перемешивали при 0 С в течение 2 ч, затем медленно заливали EtOH при 0 С. Заливали реакционную смесь NaHCO3, экстрагировали ДХМ. Органический слой промывали раствором соли и высушивали над Na2SO4. Удаляли растворитель в вакууме, получая соединение (268) (0,600 г, 89,9%). ЖХ-МС ИЭР m/z, найдено: 235,3
МПК / Метки
МПК: C07D 261/08, C07D 285/06, C07D 409/04, C07D 333/16, C07D 231/12, C07D 249/06, A61K 31/41, C07D 307/42, C07D 277/24, C07D 263/32, A61P 3/10, C07D 233/64
Метки: gpr120, арильные, агонисты, рецептора, применение
Код ссылки
<a href="https://eas.patents.su/30-22417-arilnye-agonisty-receptora-gpr120-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Арильные агонисты рецептора gpr120 и их применение</a>
Предыдущий патент: Комплексный сплав для микролегирования и раскисления стали
Следующий патент: Способы лечения заболеваний глаз
Случайный патент: Способ приготовления пищевого продукта












