Пиразиновые производные в качестве enac блокаторов
Номер патента: 21755
Опубликовано: 31.08.2015
Авторы: Хаушэм Кэтрин, Бхалай Гурдип, Эдвардс Ли, Смит Никола, Хант Питер
Формула / Реферат
1. Соединение формулы Ia
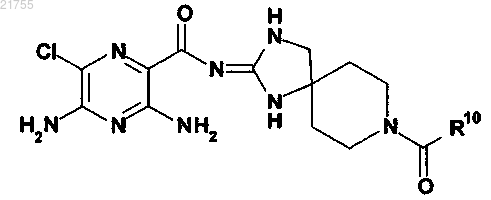
или его фармацевтически приемлемая соль, где
R10 представлен формулой 2
-(C0-С3-алкилен)-В-Х-(CR11aR12a)m-(CR11bR12b)n-(CR11cR12c)p-C(O)OR13,
алкиленовые группы необязательно замещены одной или более Z группами;
В представляет собой фенил, необязательно замещенный галогеном;
X выбран из -(SO2)NR15-, -NR15C(O)NR17- и О;
каждый R11a, R11b, R11c, R12a, R12b и R12c независимо выбран из Н и C1-C6-алкила; или
R11a и R12a вместе с атомом углерода, с которым они соединены, образуют 3-8-членную циклоалкильную группу; или
R11b и R12b вместе с атомом углерода, с которым они соединены, образуют 3-8-членную циклоалкильную группу; или
R11c и R12c вместе с атомом углерода, с которым они соединены, образуют 3-8-членную циклоалкильную группу;
R13 выбран из (C1-C3-алкил)-С(O)NR22R23 и (C1-C3-алкил)-С(О)OR23;
каждый R15 и R17 независимо выбран из Н и C1-C6-алкила;
R22 выбран из Н и C1-C3-алкила;
R23 выбран из Н; C1-C8-алкила; С3-С8-циклоалкила; C1-C4-алкокси-С1-С4-алкила; (С0-С4-алкил)C6-C15-арила, необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; (C0-C4-алкил)-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, оксо, C1-C6-алкила и C(O)C1-C6-алкила; (С0-С4-алкил)-O-C6-C15-арила, необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; и (С0-С4-алкил)-О-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, C1-C6-алкила и С(О)C1-C6-алкила; где алкильные группы необязательно замещены одним или более атомами галогена, гидроксил-C1-C4-алкокси, C(O)NH2, C(O)NHC1-C6-алкилом или C(O)N(C1-C6-алкил)2; или
R22 и R23 вместе с азотом, с которым они соединены, образуют 5-7-членную гетероциклоалкильную группу, причем гетероциклоалкильная группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклоалкильная группа необязательно замещена одной или более Z группами;
Z независимо выбран из -ОН, С6-С15-арила, -О-С6-С15-арила, С7-С14-аралкила, -O-C7-C14-аралкила, C1-C6-алкила, C1-C6-алкокси, -NR19(SO2)R21, -(SO2)NR19R21, -(SO2)R20, -NR19C(O)R20, -С(О)NR19R20,
-NR19C(O)NR20R18, -NR19C(O)OR20, -NR19R21, -C(O)OR19, -C(O)R19, SR19, -OR19, оксо, CN, NO2 и галогена, где каждая из алкильных, алкокси, аралкильных и арильных групп необязательно замещена одним или более заместителями, выбранными из ОН, галогена, C1-C4-галогеналкила и C1-C4-алкокси;
каждый R18, R20 независимо выбран из Н и C1-C6-алкила;
каждый R19, R21 независимо выбран из Н; C1-C8-алкила; С3-С8-циклоалкила; C1-C4-алкокси-C1-C4-алкила; (С0-С4-алкил) C6-C15-арила, необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; (С0-С4-алкил)-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, оксо, C1-C6-алкила и -C(O)C1-С6-алкила; -(С0-С4-алкил)-О-С6-С15-арила, необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; и (С0-С4-алкил)-О-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, C1-C6-алкила и -C(O)C1-C6-алкила; где алкильные группы необязательно замещены одним или более атомами галогена, гидроксилом, C1-C4-алкокси, -C(O)NH2, -С(O)NHC1-C6-алкилом или -C(O)N(C1-C6-алкил)2; или
R19 и R20 вместе с атомом азота, с которым они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одним или более заместителями, выбранными из ОН; галогена; С6-C15-арила; 5-10-членной гетероциклической группы, содержащей один или более гетероатомов, выбранных из N, О и S; -S(O)2-С6-С15-арила; -S(O)2-C1-C6-алкила; C1-C6-алкила, необязательно замещенного одним или более атомами галогена; C1-C6-алкокси, необязательно замещенного одной или более ОН-группами или C1-C4-алкокси; и C(O)OC1-C6-алкила, где арильные и гетероциклические замещающие группы сами необязательно замещены C1-C6-алкилом, C1-C6-галогеналкилом или C1-C6-алкокси; или
R19 и R21 вместе с атомом азота, с которым они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одним или более заместителями, выбранными из ОН; галогена; С6-С15-арила, 5-10-членной гетероциклической группы, содержащей один или более гетероатомов, выбранных из N, О и S; -S(O)2-С6-С15-арила; -S(O)2-C1-C6-алкила; C1-C6-алкила, необязательно замещенного одним или более атомами галогена; C1-C6-алкокси, необязательно замещенного одной или более ОН-группами или C1-C4-алкокси; и -С(О)ОС1-С6-алкила, где арильные и гетероциклические замещающие группы сами необязательно замещены C1-C6-алкилом, C1-C6-галогеналкилом или C1-C6-алкокси; или
R18 и R20 вместе с атомом азота, с которым они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одним или более заместителями, выбранными из ОН; галогена; C6-C15-арила; 5-10-членной гетероциклической группы, содержащей один или более гетероатомов, выбранных из N, О и S; -S(O)2-C6-C15-арила; -S(O)2-C1-C6-алкила,- C1-C6-алкила, необязательно замещенного одним или более атомами галогена; C1-C6-алкокси, необязательно замещенного одной или более ОН-группами или C1-C4-алкокси; и -C(O)OC1-C6-алкила, где арильные и гетероциклические замещающие группы сами необязательно замещены C1-C6-алкилом, C1-C6-галогеналкилом или C1-C6-алкокси; или
R22 и R23 вместе с атомом(ами), с которым(и) они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одной или более Z группами;
m равно 0, 1, 2 или 3;
n равно 0, 1, 2 или 3;
р равно 0, 1, 2 или 3;
где по меньшей мере один из m, n или р не равен 0.
2. Соединение по п.1, выбранное из
дипропилкарбамоилметилового эфира 3-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил}бензолсульфониламино)пропионовой кислоты;
[(2-гидроксиэтил)метилкарбамоил]метилового эфира [4-(3-{2-[(Z)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
циклогексилоксикарбонилметилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
циклогексилоксикарбонилметилового эфира 3-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил}бензолсульфониламино)пропионовой кислоты;
диметилкарбамоилметилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
дипропилкарбамоилметилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
трет-бутоксикарбонилметилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
бензилоксикарбонилметилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
диэтилкарбамоилметилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
2-оксо-2-пиперидин-1-илэтилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
дипропилкарбамоилметилового эфира [2-хлор-4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
2-оксо-2-(2-трифторметилпирролидин-1-ил)этилового эфира 3-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил}бензолсульфониламино)пропионовой кислоты;
2-(2-оксопиперидин-1-ил)этилового эфира [2-хлор-4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
2-морфолин-4-ил-2-оксоэтилового эфира [4-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил}-3-оксопропил)фенокси]уксусной кислоты;
дипропилкарбамоилметилового эфира 1-[(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил}бензолсульфониламино)метил]циклобутанкарбоновой кислоты;
дипропилкарбамоилметилового эфира 3-[3-(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил}фенил)уреидо]пропионовой кислоты и
2-оксо-2-(2-трифторметилпирролидин-1-ил)этилового эфира 1-[(3-{2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил}бензолсульфониламино)метил]циклобутанкарбоновой кислоты;
или их фармацевтически приемлемой соли или сольвата.
3. Соединение по п.1, имеющее структуру
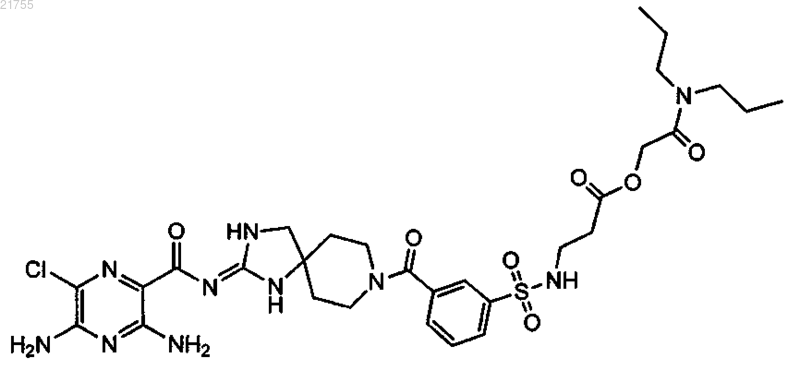
или его фармацевтически приемлемая соль.
4. Соединение по п.3, представляющее собой сукцинатную соль.
5. Соединение по п.1, имеющее структуру
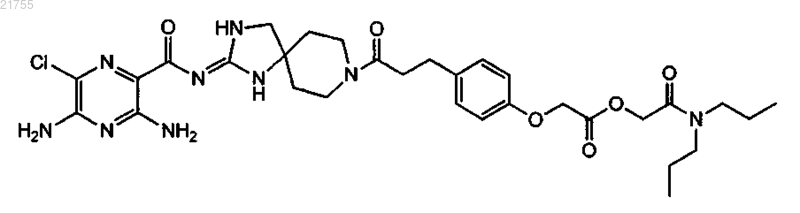
или его фармацевтически приемлемая соль.
6. Соединение по п.1, имеющее структуру
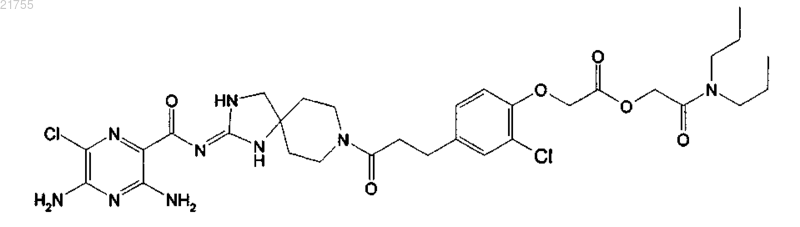
или его фармацевтически приемлемая соль.
7. Соединение по п.1, имеющее структуру
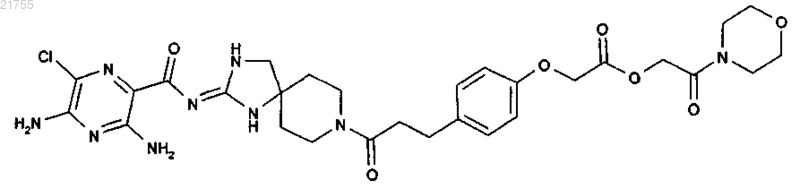
или его фармацевтически приемлемая соль.
8. Соединение по п.1, имеющее структуру
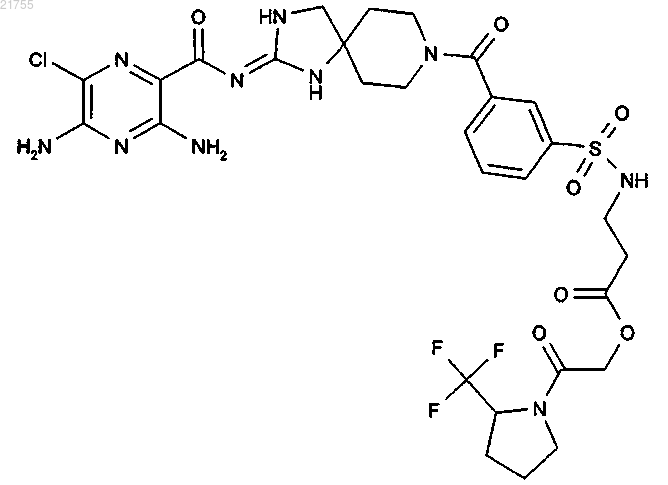
или его фармацевтически приемлемая соль.
9. Фармацевтическая композиция, обладающая активностью блокатора эпителиальных натриевых каналов, содержащая соединение по любому из пп.1-8 и одно или более фармацевтически приемлемых вспомогательных веществ, разбавителей и/или носителей.
10. Применение соединения по любому из пп.1-8 в качестве фармацевтического препарата.
11. Применение соединения по любому из пп.1-8 для лечения или предупреждения заболевания или состояния, чувствительного к блокаде эпителиальных натриевых каналов.
12. Применение соединения по любому из пп.1-8 для получения лекарственного средства для предупреждения или лечения заболевания или состояния, чувствительного к блокаде эпителиальных натриевых каналов.
13. Способ предупреждения или лечения заболевания или состояния, чувствительного к блокаде эпителиальных натриевых каналов, включающий введение эффективного количества соединения по любому из пп.1-8 нуждающемуся в данном лечении пациенту.
Текст
Соединения формулы (I) и их фармацевтически приемлемые соли и сольваты, где R1, R2, R3,R4, R5, R6, R7, R8, R9 и R10 имеют значения, как указано в описании, являются пригодными для лечения заболеваний, опосредованных блокадой эпителиальных натриевых каналов. Также описывают фармацевтические композиции, содержащие соединения, и способы получения данных соединений. Настоящее изобретение относится к органическим соединениям и их применению в качестве лекарственных препаратов, в частности, для лечения воспалительных, обструктивных или аллергических заболеваний и состояний, особенно воспалительного или обструктивного заболевания дыхательных путей,или гидратации слизистой. В одном аспекте настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли или сольвату, гдеR1 представляет собой Н, галоген, C1-C8-алкильную, C1-C8-галогеналкильную, C1-С 8-галогеналкокси, С 3-С 15-карбоциклическую группу, нитро, циано, С 6-С 15-членную ароматическую карбоциклическую группу или C1-C8-алкил, замещенный С 6-С 15-членной ароматической карбоциклической группой; каждый R2, R3, R4 и R5 независимо выбран из Н и C1-C6-алкила; каждый R6, R7, R8 и R9 независимо выбран из Н; SO2R16; арила, необязательно замещенного одной или более Z группами; С 3-С 10-карбоциклической группы, необязательно замещенной одной или более Z группами; C3-C14-гетероциклической группы, необязательно замещенной одной или более Z группами;C1-C8-алкила, необязательно замещенного арильной группой, которая необязательно замещена одной или более Z группами, С 3-С 10-карбоциклической группы, необязательно замещенной одной или более Z группами, или С 3-С 14-гетероциклической группы, необязательно замещенной одной или более Z группами;-(С 0-С 3-алкилен)-В-Х-(CR11aR12a)m-(CR11bR12b)n-(CR11cR12c)p-C(O)OR13,где алкиленовые группы необязательно замещены одной или более Z группами; В представляет собой арил, необязательно замещенный одной или более Z группами;-NR C(O)O-, -NR15-, С(O)O, OC(O), C(O), O и S; каждый R11a, R11b, R11c, R12a, R12b и R12c независимо выбраны из H и C1-C6-алкила; илиR13 выбран из (C1-C3-алкил)-С(О)NR22R23; (C1-C3-алкил)-С(О)OR23 и (C1-С 3-алкил)-NR23C(O)R22; каждый R15 и R17 независимо выбран из Н и C1-C6-алкила;R16 выбран из C1-C8-алкила, арила и 3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S;Z независимо выбран из -ОН, арила, -O-арила, C7-C14-аралкила, -О-С 7-С 14-аралкила, C1-C6-алкила,C1-C6-алкокси, NR19(SO2)R21, -(SO2)NR19R21, -(SO2)R20, -NR19C(O)R20, -С(O)NR19R20, -NR19C(O)NR20R18,-NR19C(O)OR20, -NR19R21, C(O)OR19, -C(O)R19, SR19, -OR19, оксо, CN, NO2 и галогена, где каждая из алкильных, алкокси, аралкильных и арильных групп необязательно замещена одним или более заместителями, выбранными из ОН, галогена, С 1-С 4-галогеналкила и С 1-С 4-алкокси; каждый R18, R20 и R22 независимо выбран из Н и C1-C6-алкила; каждый R19, R21 и R23 независимо выбран из Н; C1-C8-алкила; С 3-С 8-циклоалкила; C1-C4-алкокси-С 1 С 4-алкила; (С 0-С 4-алкил)арила, необязательно замещенного одной или более группами, выбранными изC1-C6-алкила, C1-C6-алкокси и галогена; (С 0-С 4-алкил)-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, оксо, C1-C6-алкила и -С(О)C1-C6 алкила; -(С 0-С 4-алкил)-О-арила, необязательно замещенного одной или более группами, выбранными изC1-C6-алкила, C1-C6-алкокси и галогена; и (С 0-С 4-алкил)-О-3-14-членной гетероциклической группы,причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, C1-C6-алкила и -C(O)C1C6-алкила; где алкильные группы необязательно замещены одним или более атомами галогена, гидроксилом, С 1-С 4-алкокси, -C(O)NH2, -C(O)NHC1-C6-алкилом или -C(O)N(C1-C6-алкил)2; или скую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов,выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одним или более заместителями, выбранными из ОН; галогена; арила; 5-10-членной гетероциклической группы, содержащей один или более гетероатомов, выбранных из N, О и S; -S(О)2-арила; -S(O)2-C1-C6-алкила; C1-C6 алкила, необязательно замещенного одним или более атомами галогена; C1-C6-алкокси, необязательно замещенного одной или более ОН-группами или С 1-С 4-алкокси; и C(O)OC1-C6-алкила, где арильные и гетероциклические замещающие группы сами необязательно замещены C1-C6-алкилом, C1-C6 галогеналкилом или C1-C6-алкокси; илиR19 и R21 вместе с атомом азота, с которым они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов,выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одним или более заместителями, выбранными из ОН; галогена; арила; 5-10-членной гетероциклической группы, содержащей один или более гетероатомов, выбранных из N, О и S; -S(О)2-арила; -S(O)2-C1-C6-алкила; C1-C6 алкила, необязательно замещенного одним или более атомами галогена; C1-C6-алкокси, необязательно замещенного одной или более ОН-группами или C1-C4-алкокси; и -C(O)OC1-C6-алкила, где арильные и гетероциклические замещающие группы сами необязательно замещены C1-C6-алкилом, C1-C6 галогеналкилом или C1-C6-алкокси; илиR18 и R20 вместе с атомом азота, с которым они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов,выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одним или более заместителями, выбранными из ОН; галогена; арила; 5-10-членной гетероциклической группы, содержащей один или более гетероатомов, выбранных из N, О и S; -S(О)2-арила; -S(O)2-C1-C6-алкила; C1-C6 алкила, необязательно замещенного одним или более атомами галогена; C1-C6-алкокси, необязательно замещенного одной или более ОН-группами или C1-C4-алкокси; и -C(O)OC1-C6-алкила, где арильные и гетероциклические замещающие группы сами необязательно замещены C1-C6-алкилом, C1-C6 галогеналкилом или C1-C6-алкокси; илиR22 и R23 вместе с атомом(ами), с которым(и) они соединены, образуют 5-10-членную гетероциклическую группу, причем гетероциклическая группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклическая группа необязательно замещена одной или болееn равно 0, 1, 2 или 3; р равно 0, 1, 2 или 3; где по меньшей мере один из m, n или р не равен 0. В другом варианте осуществления настоящего изобретения, как определено выше, R1 представляет собой галоген. В следующем варианте осуществления R1 представляет собой хлор. В другом варианте осуществления настоящего изобретения, как определено выше, R2, R3, R4 и R5 представляют собой Н. В другом варианте осуществления настоящего изобретения, как определено выше, R6, R7, R8 и R9 представляют собой Н. В другом варианте осуществления настоящего изобретения, как определено выше, R10 представляет собой -В-Х-(CR11aR12a)-(CR11bR12b)-C(O)OR13. В следующем варианте осуществления R10 представляет собой -В-(SO2)NR15-(CR11aR12a)-(CR11bR12b)С(О)OR13. В еще альтернативном следующем варианте осуществления R10 представляет собой -B15NR C(О)NR17-(CR11aR12a)-(CR11bR12b)-С(О)OR13. В альтернативном варианте осуществления настоящего изобретения, как определено выше, R10 представляет собой (С 2-алкилен)-В-Х-(CR11aR12a)-С(О)OR13, где алкиленовые группы необязательно замещены одной или более Z группами. В следующем варианте осуществления алкиленовые группы являются незамещенными. В еще следующем варианте осуществления X представляет собой О. В еще следующем варианте осуществления R10 представляет собой -(СН 2)2-В-О-(CR11aR12a)C(O)OR13. В другом варианте осуществления настоящего изобретения, как определено выше, В представляет собой фенил, необязательно замещенный одной или более Z группами. В следующем варианте осуществления В представляет собой фенил, необязательно замещенный галогеном; в еще следующем варианте осуществления галоген представляет собой хлор. В другом варианте осуществления настоящего изобретения, как определено выше, X выбран из-(SO2)NR15-, -NR15C(О)NR17- и О. В другом варианте осуществления настоящего изобретения, как определено выше, R15 и R17 представляют собой Н. В другом варианте осуществления настоящего изобретения, как определено выше, каждый R11a,11bR , R11c, R12a, R12b и R12c независимо выбран из Н и C1-С 3-алкила; илиR11c и R12c вместе с атомом углерода, с которым они соединены, образуют 3-, 4- или 5-членную циклоалкильную группу. В другом варианте осуществления настоящего изобретения, как определено выше, m равно 0 или 1. В другом варианте осуществления настоящего изобретения, как определено выше, n равно 0 или 1. В другом варианте осуществления настоящего изобретения, как определено выше, р равно 0 или 1. В другом варианте осуществления настоящего изобретения, как определено выше, сумма m, n и р равна 0, 1, 2 или 3; в следующем варианте осуществления сумма равна 1, 2 или 3; в еще следующем варианте осуществления сумма равна 1 или 2. В другом варианте осуществления настоящего изобретения, как определено выше, где X выбран из-(SO2)NR15- и -NR15C(O)NR17-, сумма m, n и р равна 2. В другом варианте осуществления настоящего изобретения, как определено выше, где X представляет собой О, сумма m, n и р равна 1. В другом варианте осуществления настоящего изобретения, как определено выше, R13 выбран из(C1-алкил)-С(О)NR22R23; (C1-алкил)-С(О)OR23 и (С 2-алкил)-NR23C(О)R22. В следующем варианте осуществления настоящего изобретения, как определено выше, R13 выбран из (C1-алкил)-С(О)NR22R23 и (C1-алкил)-С(О)OR23. В еще следующем варианте осуществления настоящего изобретения, как определено выше, R13 представляет собой (C1- алкил)-С(О)NR22R23. В другом варианте осуществления настоящего изобретения, как определено выше, R22 выбран из Н и C1-C3-алкила;R23 выбран из Н; C1-C8-алкила; С 3-С 8-циклоалкила; C1-C4-алкокси-С 1-С 4-алкила; (С 0-С 4-алкил)арила,необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; (С 0-С 4-алкил)-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, оксо, C1-C6-алкила и C(O)C1-C8-алкила; (С 0-С 4-алкил)-О-арила,необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; и (С 0-С 4-алкил)-О-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, C1-C6-алкила и C(O)C1-C6-алкила; где алкильные группы необязательно замещены одним или более атомами галогена, гидроксила, С 1-С 4-алкокси, С(О)NH2,C(O)NHC1-C6-алкила или C(O)N(C1-C6-алкил)2; илиR22 и R23 вместе с атомом(ами), с которым(и) они соединены, образуют 5-7-членную гетероциклоалкильную группу, причем гетероциклоалкильная группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклоалкильная группа необязательно замещена одной или более Z группами. В другом варианте осуществления настоящего изобретения, как определено выше, где R13 представляет собой (C1-С 3-алкил)-NR23C(O)R22, R22 и R23 вместе с атомами, с которыми они соединены, образуют оксо, замещенную 5-7-членной гетероциклоалкильной группой, причем гетероциклоалкильная группа содержит один или более дополнительных гетероатомов, выбранных из N, О и S, причем гетероциклоалкильная группа необязательно дополнительно замещена одной или более Z группами. В следующем варианте осуществления R13 представляет собой (C1-С 3-алкил)-NR23C(О)R22, где -NR23C(O)R22 представлен формулой 3 где q равно 0, 1 или 2 и звездочка показывает место присоединения к (C1-С 3-алкильной) группе. В другом варианте осуществления настоящего изобретения, как определено выше, где R13 выбран из (C1-C3-алкил)-С(О)NR22R23 и (C1-С 3-алкил)-С(О)OR23;R23 выбран из Н; C1-C8-алкила; C3-C8-циклоалкила; С 1-С 4-алкокси-C1-C4-алкила; (С 0-С 4-алкил)арила,необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; (С 0-С 4-алкил)-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, оксо, C1-C6-алкила и C(O)C1-C6-алкила; (С 0-С 4-алкил)-О-арила,необязательно замещенного одной или более группами, выбранными из C1-C6-алкила, C1-C6-алкокси и галогена; и (С 0-С 4-алкил)-О-3-14-членной гетероциклической группы, причем гетероциклическая группа содержит один или более гетероатомов, выбранных из N, О и S, необязательно замещенной одной или более группами, выбранными из галогена, C1-C6-алкила и C(O)C1-C6-алкила; где алкильные группы необязательно замещены одним или более атомами галогена, гидроксил C1-C4-алкокси, C(O)NH2,C(O)NHC1-C6-алкилом или C(O)N(C1-C6-алкил)2; илиR22 и R23 вместе с азотом, с которым они соединены, образуют 5-7-членную гетероциклоалкильную группу, причем гетероциклоалкильная группа содержит один или более дополнительных гетероатомов,выбранных из N, О и S, причем гетероциклоалкильная группа необязательно замещена одной или болееZ группами. В другом варианте осуществления настоящего изобретения, как определено выше, Z представляет собой гидроксил, циано, нитро, C1-C4-алкил, C1-C4-алкокси, галоген, C1-C4-алкилкарбонил, карбокси, C1C4-алкоксикарбонил, амино, C1-C4-алкиламино, ди-C1-С 4-алкиламино, C1-C4-алкиламинокарбонил, ди-C1C4-алкиламинокарбонил, С 1-С 4-алкилкарбониламино, C1-C4-алкилкарбонил(C1-C4-алкил)амино, где каждая из алкильных и алкоксигрупп независимо замещена одним или более заместителями, выбранными из гидроксила, галогена, C1-C4-галогеналкильных и C1-C4-алкоксигрупп. В еще следующем варианте осуществления настоящее изобретение относится к соединению формулы Ia или его фармацевтически приемлемой соли или сольвату, где R10 представляет собой, как определено выше относительно соединения формулы I. В еще следующем варианте осуществления настоящее изобретение относится к соединению формулы Ib или его фармацевтически приемлемой соли или сольвату, где В, R11a, R12a, R11b, R12b и R13 представляют собой такие, как определено выше относительно соединения формулы I. В еще следующем варианте осуществления настоящее изобретение относится к соединению формулы Ic или его фармацевтически приемлемой соли или сольвату, где В, R11a, R12a, R11b, R12b, R13 и R15 и R17 представляют собой такие, как определено выше относительно соединения формулы I. В еще следующем варианте осуществления настоящее изобретение относится к соединению формулы Id или его фармацевтически приемлемой соли или сольвату, где В, R11a, R12a и R13 представляют собой такие, как определено выше относительно соединения формулы I. В другом варианте осуществления отдельные соединения согласно настоящему изобретению являются соединениями, перечисленными в разделе примеров ниже. В другом варианте осуществления настоящего изобретения обеспечивают соединение формулы I,которое выбрано из дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты;[2-хлор-4-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2 карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил-3-оксопропил)фенокси]уксусной кислоты; 2-морфолин-4-ил-2-оксоэтилового эфира [4-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил-3-оксопропил)фенокси]уксусной кислоты; дипропилкарбамоилметилового эфира 1-[(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)метил]циклобутанкарбоновой кислоты; дипропилкарбамоилметилового эфира 3-[3-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилфенил)уреидо]пропионовой кислоты и 2-оксо-2-(2-трифторметилпирролидин-1-ил)этилового эфира 1-[(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)метил]циклобутанкарбоновой кислоты; или их фармацевтически приемлемой соли или сольвата. В вариантах осуществления, приведенных в настоящем изобретении, когда определяют только определенные переменные, предполагается, что оставшиеся переменные представляют собой такие, как определено в любом варианте осуществления в настоящем изобретении. Таким образом, настоящее изобретение относится к комбинации ограниченных или необязательных значений переменных. Предполагается, что следующие термины, как применяют в настоящем изобретении, имеют следующие значения."Необязательно замещенный", как применяют в настоящем изобретении, обозначает, что группа, на которую ссылаются, может быть незамещенной или замещенной в одном, или двух, или трех положениях любым одним или любой комбинацией радикалов, приведенных в настоящем изобретении ниже."C1-C3-алкил", "C1-C6-алкил", "C1-C8-алкил" и подобные, как применяют в настоящем изобретении,обозначают алкильную группу с нормальной или разветвленной цепью, которая содержит один-три,шесть или восемь (или соответствующее количество) атомов углерода и которая может быть замещенной, как определено."Арил", как применяют в настоящем изобретении, представляет собой ароматическую карбоциклическую кольцевую систему, содержащую 6-15 атомов углерода. Она может быть моноциклической, бициклической или трициклической и может быть необязательно замещенной, как определено. Примеры С 6-C15-арильных групп включают, но без ограничения, фенил, фенилен, бензолтриил, инданил, нафтил,нафтилен, нафталинтриил и антраценил."Гетероциклил" или "гетероциклический" относится к 4-14-членной гетероциклической кольцевой системе, содержащей по меньшей мере один кольцевой гетероатом, выбранный из группы, состоящей из азота, кислорода и серы, которая может быть насыщенной, частично насыщенной или ароматической(т.е. гетероарилом). Примеры 4-14-членных гетероциклических групп включают, но без ограничения,фуран, азетидин, пиррол, пирролидин, пиразол, имидазол, триазол, изотриазол, тетразол, тиадиазол, изотиазол, оксадиазол, пиридин, пиперидин, пиразин, оксазол, изоксазол, пиразин, пиридазин, пиримидин,пиперазин, пирролидин, пирролидинон, пиридинон, морфолин, триазин, оксазин, тетрагидрофуран, тетрагидротиофен, тетрагидротиопиран, тетрагидропиран, 1,4-диоксан, 1,4-оксатиан, индазол, хинолин, хиназолин, хиноксалин, индол, индолин, тиазол, тиофен, изохинолин, изоиндол, изоиндолин, бензотиофен,бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензофуран, дигидробензофуран, дигидроизобензофуран, бензодиоксол, бензимидазол, бензотриазол, пиразолопиридин, пиразолопиримидин, имидазопиридин, пурин, нафтиридин или тетрагидронафтиридин. "Гетероциклил" или "гетероциклический" также включает мостиковые гетероциклические группы, такие как 3-гидрокси-8-азабицикло[3,2,1]окт-8 ил и конденсированные кольцевые системы, такие как пиридопиримидин. 4-14-Членная гетероциклическая группа может быть незамещенной или замещенной."Гетероарил" представляет собой ароматическую кольцевую систему, содержащую от 5 до 15 кольцевых атомов, один или более из которых представляют собой гетероатом, выбранный из О, N или S. Предпочтительно присутствуют один или два гетероатома. Гетероарил (гетероциклический арил) представляет собой, например, пиридил, индолил, изоиндолил, индазолил, хиноксалинил, хиназолинил, хинолинил, изохинолинил, нафтиридинил, пиридопиримидинил, бензотиенил, бензофуранил, бензопиранил, бензотиопиранил, бензотриазолил, пиразолопиридинил, фуранил, пирролил, тиазолил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, имидазолил, тиенил. Гетероарильная группа может быть замещенной или незамещенной."С 3-С 10-циклоалкил" обозначает полностью насыщенное карбоциклическое кольцо, содержащее 310 кольцевых атома углерода, например моноциклическую группу, такую как циклопропил, циклобутил,циклопентил или циклогексил, циклогептил, циклооктил, циклононил или циклодецил, или бициклическую группу, такую как бициклогептил или бициклооктил. Могут быть указаны различные количества атомов углерода с внесением соответствующего изменения для значения. Циклоалкильная группа может быть замещенной или незамещенной."С 5-С 10-циклоалкенил" обозначает частично насыщенное карбоциклическое кольцо, содержащее 510 кольцевых атомов углерода, например моноциклическую группу, такую как циклопентенил или циклогексенил, циклогептенил, циклооктенил или циклононенил, или бициклическую группу, такую как бициклогептенил или бициклооктенил. Кольцо или кольцевая система может содержать более одной углерод-углерод двойной связи. Могут быть указаны различные количества атомов углерода с внесением соответствующего изменения для значения. Циклоалкенильная группа может быть замещенной или незамещенной."С 1-С 8-галогеналкил", как применяют в настоящем изобретении, обозначает C1-C8-алкил, как определено в настоящем изобретении выше, замещенный одним или более атомами галогена, предпочтительно одним, двумя или тремя атомами галогена. Могут быть указаны различные количества атомов углерода с внесением соответствующего изменения для значения."C1-С 8-алкиламино", как применяют в настоящем изобретении, обозначает амино, замещенный одной или двумя C1-C8-алкильными группами, как определено в настоящем изобретении выше, которые могут быть одинаковыми или различными. Могут быть указаны различные количества атомов углерода с внесением соответствующего изменения для значения."С 1-С 8-алкокси", как применяют в настоящем изобретении, обозначает алкокси с нормальной или разветвленной цепью, который содержит 1-8 атомов углерода. Могут быть указаны различные количества атомов углерода с внесением соответствующего изменения для значения. Во всем описании и в формуле изобретения, которая следует за ним, если контекст не требует другого, должно быть ясно, что слово "включает" или варианты, такие как "включая", обозначает включение указанного целого или стадии или группы целых или стадий, но не исключение любого другого целого или стадии или группы целых или стадий. Как применяют в настоящем изобретении, термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую активность и свойства соединений настоящего изобретения и которые не являются биологически или иначе нежелательными. Во многих случаях соединения настоящего изобретения могут образовывать соли с кислотой и/или основанием за счет присутствия амино и/или карбоксильных групп или аналогичных им групп. Фармацевтически приемлемые соли присоединения кислоты можно получить с неорганическими кислотами и органическими кислотами, например ацетатную, аспартатную, бензоатную, безилатную,бромидную/гидробромидную, бикарбонатную/карбонатную, бисульфатную/сульфатную, камфорсульфонатную, хлоридную/гидрохлоридную, хлортеофиллонатную, цитратную, этандисульфонатную, фумаратную, глуцептатную, глюконатную, глюкуронатную, гиппуратную, гидройодидную/йодидную, изетионатную, лактатную, лактобионатную, лаурилсульфатную, малатную, малеатную, малонатную, манделатную, мезилатную, метилсульфатную, нафтоатную, напсилатную, никотинатную, нитратную, октадеканоатную, олеатную, оксалатную, пальмитатную, памоатную, фосфатную/гидрофосфатную/дигидрофосфатную, полигалактуронатную, пропионатную, стеаратную, сукцинатную, сульфосалицилатную, тартратную, тозилатную и трифторацетатную соли. Неорганические кислоты, из которых получают соли, включают, например, хлористо-водорную кислоту, бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и подобные. Органические кислоты, из которых получают соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту,янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, миндальную кислоту, метансульфокислоту, этансульфокислоту, толуолсульфокислоту, сульфосалициловую кислоту и подобные. Фармацевтически приемлемые соли присоединения основания можно получить с неорганическими и органическими основаниями. Неорганические основания, из которых можно получить соли, включают, например, аммониевые соли и соли металлов из колонок I-XII Периодической таблицы. В определенных вариантах осуществления соли получают из натрия, калия, аммония, кальция, магния, железа, серебра, цинка и меди; особенно пригодные соли включают соли аммония, калия, натрия, кальция и магния. Органические основания, из которых получают соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая встречающиеся в природе замещенные амины, циклические амины, ионообменные смолы и подобные. Определенные органические амины включают изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин, лизин, меглумин, пиперазин и трометамин. Фармацевтически приемлемые соли настоящего изобретения можно получить из исходной молекулы основной или кислой группы общепринятыми химическими способами. Обычно данные соли можно получить реакцией свободной кислотной формы данных соединений со стехиометрическим количеством подходящего основания (такого как гидроксид, карбонат, бикарбонат Na, Ca, Mg, K или подобного) или реакцией свободной основной формы данных соединений со стехиометрическим количеством подходящей кислоты. Данные реакции обычно осуществляют в воде, или в органическом растворителе, или в смеси двух. Обычно применение неводной среды, подобной эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу, является желательным, при наличии возможности. Списки дополнительных подходящих солей можно найти, например, в "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishingand Wermuth (Wiley-VCH, Weinheim, Germany, 2011). Кроме того, соединения настоящего изобретения, включая их соли, можно также получить в виде их гидратов, или они содержат другие растворители, применяемые для их кристаллизации. Соединения настоящего изобретения, т.е. соединения формулы (I), которые содержат группы, которые способны действовать как доноры и/или акцепторы водородных связей, могут быть способны образовывать сокристаллы с подходящими агентами, образующими сокристаллы. Данные сокристаллы можно получить из соединений формулы (I) известными способами получения сокристаллов. Данные способы включают измельчение, нагревание, совместную возгонку, совместное плавление или контакт в растворе соединений формулы (I) с агентом, образующим сокристаллы, в условиях кристаллизации и выделение таким образом полученных сокристаллов. Подходящие агенты, образующие сокристаллы, включают агенты, описанные в WO 2004/078163. Следовательно, настоящее изобретение также относится к сокристаллам, содержащим соединение формулы (I). Как применяют в настоящем изобретении, термин "оптический изомер" или "стереоизомер" относится к любой из различных стереоизомерных конфигураций, которые могут существовать для указанного соединения настоящего изобретения, и включает геометрические изомеры. Ясно, что заместитель может быть присоединен при хиральном центре атома углерода. Следовательно, настоящее изобретение включает энантиомеры, диастереомеры или рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые являются неналагающимися зеркальными изображениями друг друга. 1:1 смесь пары энантиомеров представляет собой "рацемическую" смесь. Термин применяют для обозначе-7 021755 ния рацемической смеси при необходимости."Диастереоизомеры" представляют собой стереоизомеры, которые содержат по меньшей мере два асимметрических атома, но которые не являются зеркальными изображениями друг друга. Абсолютную стереохимию указывают согласно R-S системе Кана-Ингольда-Прелога. Когда соединение представляет собой чистый энантиомер, стереохимию при каждом хиральном углероде можно указать или R, или S. Разделенные соединения, чья абсолютная конфигурация является неизвестной, можно обозначить (+) или (-) в зависимости от направления (правовращающий или левовращающий), в котором они вращают плоскополяризованный свет при длине волны D линии натрия. Определенные из соединений, описанных в настоящем изобретении, содержат один или более асимметрических центров или осей, и могут, таким образом, давать энантиомеры, диастереомеры и другие стереоизомерные формы, которые можно определить, в терминах абсолютной стереохимии, как (R)- или (S)-. Подразумевается, что настоящее изобретение включает все данные возможные изомеры, включая рацемические смеси, оптически активные формы и промежуточные смеси. Необязательно активные (R)- и (S)-изомеры можно получить, применяя хиральные синтоны или хиральные реагенты, или разделять, применяя общепринятые способы. Если соединение содержит двойную связь, заместитель может иметь Е- или Z-конфигурацию. Если соединение содержит дизамещенный циклоалкил, циклоалкильный заместитель может иметь цис- или трансконфигурацию. Все таутомерные формы также предполагаются включенными. Таутомеры представляют собой один из двух или более структурных изомеров, которые существуют в равновесии и легко превращаются из одной изомерной формы в другую. Более конкретно, например, соединения формулы Ia могут существовать в одной или обеих из следующих таутомерных форм: Примеры таутомеров включают, но без ограничения, соединения, определенные в формуле изобретения. Любой асимметрический атом (например, углерод или подобные) соединения(соединений) настоящего изобретения могут присутствовать в рацемической или энантиомерно обогащенной, например (R)-,(S)- или (R,S)-конфигурации. В определенных вариантах осуществления каждый асимметрический атом имеет по меньшей мере 50% энантиомерный избыток, по меньшей мере 60% энантиомерный избыток, по меньшей мере 70% энантиомерный избыток, по меньшей мере 80% энантиомерный избыток, по меньшей мере 90% энантиомерный избыток, по меньшей мере 95% энантиомерный избыток или по меньшей мере 99% энантиомерный избыток (R)- или (S)-конфигурации. Заместители при атомах с ненасыщенными связями могут, если это возможно, присутствовать в виде цис- (Z)- или транс- (Е)-формы. Соответственно, как применяют в настоящем изобретении, соединения настоящего изобретения могут быть в виде одного из возможных изомеров, ротамеров, атропизомеров, таутомеров или их смесей,например в виде, по существу, чистых геометрических (цис или транс) изомеров, диастереомеров, оптических изомеров (антиподов), рацематов или их смесей. Любые полученные в результате смеси изомеры можно разделить на основе физико-химических различий компонентов на чистые или, по существу, чистые геометрические или оптические изомеры,диастереомеры, рацематы, например, хроматографией и/или фракционированной кристаллизацией. Любые полученные в результате рацематы конечных продуктов или промежуточных соединений можно разделить на оптические антиподы известными способами, например разделением их диастереомерных солей, полученных с оптически активной кислотой или основанием, и высвобождением оптически активного кислого или основного соединения. В частности, основную группу можно, таким образом,применять для разделения соединений настоящего изобретения на их оптические антиподы, например,фракционированной кристаллизацией соли, образованной оптически активной кислотой, например винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, ди-О,О'-п-толуоилвинной кислотой, миндальной кислотой, оксиянтарной кислотой или камфор-10-сульфокислотой. Рацемические продукты можно также разделить хиральной хроматографией, например высокоэффективной жидкостной хроматографией (ВЭЖХ), применяя хиральный адсорбент. Поскольку соединения настоящего изобретения предназначены для применения в фармацевтических композициях, ясно, что каждую из них предпочтительно обеспечивать, по существу, в чистой форме, например по меньшей мере 60% чистоты, предпочтительно по меньшей мере 75% чистоты и предпочтительно по меньшей мере 85% чистоты, особенно по меньшей мере 98% чистоты (%даны по весу). Составы с примесями соединений можно применять для получения более чистых форм, применяемых в фармацевтических композициях; данные менее чистые составы соединений должны содержать по меньшей мере 1%, предпочтительно по меньшей мере 5% и предпочтительно от 10 до 59% соединения настоящего изобретения. Соединения настоящего изобретения можно получить или в свободной форме, в виде его соли, или в виде его пролекарства. Когда и основная группа и кислотная группа присутствуют в одной молекуле, соединения настоящего изобретения могут также образовывать внутреннюю соль, например цвиттерионные молекулы. Настоящее изобретение также относится к пролекарствам соединений настоящего изобретения, которые превращаются in vivo в соединения настоящего изобретения. Пролекарство представляет собой активное или неактивное соединение, которое химически модифицируется при in vivo физиологическом действии, таком как гидролиз, метаболизм и подобные, до соединения настоящего изобретения после введения пролекарства субъекту. Пригодность и способы, применяемые для получения и применения пролекарств, являются хорошо известными специалисту в данной области техники. Пролекарства можно концептуально разделить на две неисключительные категории: пролекарства, являющиеся биопредшественниками, и пролекарства, являющиеся носителями. См. The Practice of Medicinal Chemistry, Ch. 31-32(Ed. Wermuth, Academic Press, San Diego, Calif., 2001). В общем, пролекарства, являющиеся биопредшественниками, представляют собой соединения, которые являются неактивными или обладают низкой активностью по сравнению с соответствующим активным лекарственным соединением, которые содержат одну или более защитных групп и превращаются в активную форму метаболизмом или сольволизом. И активная лекарственная форма, и любые высвободившиеся метаболические продукты должны иметь приемлемо низкую токсичность. Пролекарства, являющиеся носителями, представляют собой лекарственные соединения, которые содержат транспортную группу, например, которые увеличивают поглощение и/или локализованную доставку в место(места) действия. Желательно для данного пролекарства, являющегося носителем, чтобы связь между лекарственным фрагментом и транспортной группой представляла собой ковалентную связь, пролекарство было неактивным или менее активным, чем лекарственное соединение, и любая высвободившаяся транспортная группа была приемлемо нетоксичной. Что касается пролекарств, когда предполагается, что транспортная группа будет усиливать поглощение, обычно высвобождение транспортной группы должно быть быстрым. В других случаях желательно применять группу, которая обеспечивает медленное высвобождение, например, определенные полимеры или другие молекулы, такие как циклодекстрины. Пролекарства, являющиеся носителями, можно, например, применять для улучшения одного или более из следующих свойств: повышенная липофильность, увеличенная продолжительность фармакологических эффектов, повышенная сайт-специфичность, пониженные токсичность и побочные реакции, и/или улучшение характеристик лекарственного состава (например, стабильности, растворимости в воде, подавление нежелательных органолептических или физико-химических свойств). Например,липофильность можно повысить этерификацией (а) гидроксильных групп с липофильными карбоновыми кислотами (например, карбоновой кислотой, содержащей по меньшей мере одну липофильную группу),или (b) карбоксигрупп с липофильными спиртами (например, спиртом, содержащим по меньшей мере одну липофильную группу, например алифатическими спиртами). Примерами пролекарств являются, например, эфиры свободных карбоновых кислот и S-ацильные производные тиолов и О-ацильные производные спиртов или фенолов, где ацил имеет значение, как определено в настоящем изобретении. Подходящие пролекарства часто представляют собой фармацевтически приемлемые эфирные производные, превращаемые сольволизом в физиологических условиях в исходную карбоновую кислоту, например, низшие алкиловые эфиры, циклоалкиловые эфиры, низшие алкениловые эфиры, бензиловые эфиры, моно- или дизамещенные низшие алкиловые эфиры, такие как (амино, моно- или динизшие алкиламино, карбокси, низшие алкоксикарбонил)низшие алкиловые эфиры,-(низшие алканоилокси, низшие алкоксикарбонил или динизшие алкиламинокарбонил)низшие алкиловые эфиры, такие как пивалоилоксиметиловый эфир и подобные, обычно применяемые в данной области техники. Кроме того, амины маскируют в виде замещенных арилкарбонилоксиметилом производных,которые расщепляются эстеразами in vivo, высвобождая свободное лекарственное соединение и формальдегид (Bundgaard, J. Med. Chem. 2503 (1989. Более того, лекарственные соединения, содержащие кислую NH группу, такую как имидазол, имид, индол и подобные, маскируют N-ацилоксиметильными группами (Bundgaard, Design of Prodrugs, Elsevier (1985. Гидроксигруппы маскируют в виде простых или сложных эфиров. ЕР 039051 (Sloan и Little) описывает пролекарства, являющиеся гидроксамовыми кислотами, полученными реакцией Манниха, их получение и применение. Также предполагается, что любая формула, приведенная в настоящем изобретении, представляет немеченые формы, а также изотопномеченные формы соединений. Изотопномеченные соединения имеют структуру, изображенную формулами, приведенными в настоящем изобретении, за исключением того, что один или более атомов замещены атомом, имеющим выбранную атомную массу или массовое число. Примеры изотопов, которые можно вводить в соединения настоящего изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N,18F, 31P, 32P, 35S, 36Cl, 125I соответственно. Настоящее изобретение включает различные изотопномеченные соединения, как определено в настоящем изобретении, например соединения, в которых присутствуют радиоактивные изотопы, такие как 3 Н, 13 С и 14 С. Данные изотопномеченные соединения являются пригодными в метаболических исследованиях (с 14 С), исследованиях кинетики реакции (например, с 2 Н или 3 Н), способах обнаружения и проявления, таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография (SPECT), включая анализ на распределение лекарственного средства или субстрата в тканях, или в радиоактивном лечении пациентов. В частности, 18F меченное соединение может быть особенно предпочтительно для PET или SPECT исследований. Изотопномеченные соединения настоящего изобретения и их пролекарства можно обычно получить осуществлением способов, показанных на схемах или в примерах и примерах получения, описанных ниже, замещением немеченного изотопом реагента легко доступным изотопномеченным реагентом. Далее замещение более тяжелыми изотопами, в частности дейтерием (т.е. 2 Н или D), может давать определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например повышенный in vivo период полурасщепления или сниженные требуемые дозы или увеличение терапевтического индекса. Ясно, что дейтерий в данном контексте рассматривают как заместитель соединения формулы (I). Концентрацию данного более тяжелого изотопа, в частности дейтерия,можно определить фактором изотопного обогащения. Термин "фактор изотопного обогащения", как применяют в настоящем изобретении, обозначает отношение между содержанием изотопа и распространенностью в природе указанного изотопа. Если заместитель в соединении настоящего изобретения обозначен как дейтерий, данное соединение имеет фактор изотопного обогащения для каждого обозначенного атома дейтерия по меньшей мере 3500 (52,5% введение дейтерия для каждого обозначенного атома дейтерия), по меньшей мере 4000 (60% введение дейтерия), по меньшей мере 4500 (67,5% введение дейтерия), по меньшей мере 5000 (75% введение дейтерия), по меньшей мере 5500 (82,5% введение дейтерия), по меньшей мере 6000 (90% введение дейтерия), по меньшей мере 6333,3 (95% введение дейтерия),по меньшей мере 6466,7 (97% введение дейтерия), по меньшей мере 6600 (99% введение дейтерия) или по меньшей мере 6633,3 (99,5% введение дейтерия). Изотопномеченные соединения формулы (I) можно обычно получить общепринятыми способами,известными специалисту в данной области техники, или способами, аналогичными способам, описанным в сопроводительных примерах и примерах получения, применяя подходящие изотопномеченные реагенты вместо изотопнонемеченного реагента, применяемого ранее. Фармацевтически приемлемые сольваты согласно настоящему изобретению включают сольваты,где растворитель кристаллизации может быть изотопнозамещенным, например D2O, d6-ацетон, d6-DMSO. Получение. Соединения настоящего изобретения можно получить общими путями получения ниже, конкретные примеры которых описаны более подробно в примерах. Соединения формулы I можно получить согласно схеме 1. Альтернативно, соединения формулы I можно получить согласно схеме 2. Схема 2 где R10a представляет собой -(С 0-С 3-алкилен) -В-Х-(CR11aR12a)m-(CR11bR12b)n-(CR11cR12c)p-C(O)OH и L представляет собой подходящую уходящую группу. Приведенные выше общие схемы можно применять для получения соединений формулы I. Требуемые конкретные соединения можно получить выбором подходящих исходных веществ, реагентов и условий реакций. Все исходные вещества и реагенты в приведенной выше схеме являются или имеющимися в продаже, или их можно получить, следуя литературным способам. В частности, соединения формулы II и соединения формулы IV можно получить, как описано в международной патентной заявке, опубликованной как WO 2009074575, которая включена в настоящее изобретение с помощью ссылки. В пределах объема данного текста только легкоудаляемую группу, которая не является составляющей частью конкретного требуемого конечного продукта соединений настоящего изобретения, обозначают "защитной группой", если контекст не указывает иначе. Защита функциональных групп данными защитными группами, сами защитные группы и реакции их отщепления описывают, например, в стан- 11021755Jeschkeit, "Aminosauren, Peptide, Proteine" (Amino acids, Peptides, Proteins), Verlag Chemie, Weinheim,Deerfield Beach, and Basel 1982, и в Jochen Lehmann, "Chemie der Kohlenhydrate: Monosaccharide und Derivate" (Chemistry of Carbohydrates: Monosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart 1974. Характерной особенностью защитных групп является то, что их можно легко удалять (т.е. без протекания нежелательных побочных реакций), например, сольволизом, восстановлением, фотолизом или альтернативно в физиологических условиях (например, ферментативным расщеплением). Соли соединений настоящего изобретения, содержащие по меньшей мере одну образующую соль группу, можно получить способом, известным специалисту в данной области техники. Например, соли соединений настоящего изобретения, содержащие кислую группу, можно получить, например, реакцией соединений с металлическими соединениями, такими как соли щелочных металлов подходящих органических карбоновых кислот, например натриевая соль 2-этилгексановой кислоты, с органическими соединениями щелочных и щелочно-земельных металлов, такими как соответствующие гидроксиды, карбонаты или гидрокарбонаты, такие как гидроксид, карбонат или гидрокарбонат натрия или калия, с соответствующими кальциевыми соединениями или с аммиаком или подходящим органическим амином, стехиометрическими количествами или только небольшим избытком предпочтительно применяемого образующего соль агента. Соли присоединения кислоты соединений настоящего изобретения получают стандартным способом,например обработкой соединений кислым или подходящим анионообменным реагентом. Внутренние соли соединений настоящего изобретения, содержащие кислые и основные группы, образующие соль,например свободную карбоксильную группу и свободную аминогруппу, можно получить, например,нейтрализацией солей, таких как соли присоединения кислоты, до изоэлектрической точки, например,слабыми основаниями или обработкой ионообменными реагентами. Соли можно преобразовать в свободные соединения согласно способам, известным специалисту в данной области техники. Соли металла и аммония можно преобразовать, например, обработкой подходящими кислотами, и соли присоединения кислоты, например, обработкой подходящим основным агентом. Смеси изомеров, получаемые согласно настоящему изобретению, можно разделить способом, известным специалисту в данной области техники на отдельные изомеры; диастереоизомеры можно разделить, например, распределением между полифазными смесями растворителей, перекристаллизацией и/или хроматографическим разделением, например, на силикагеле или, например, жидкостной хроматографией среднего давления на обращенно-фазной колонке, и рацематы можно разделить, например, образованием солей с оптически активными образующими соль агентами и разделением смеси таким образом полученных диастереоизомеров, например посредством фракционной кристаллизации или хроматографией на оптически активном веществе для колонки. Промежуточные соединения и конечные продукты можно обрабатывать и/или очищать согласно стандартным способам, например, применяя хроматографические способы, способы распределения, (пере)кристаллизацией и подобными. Следующее является применимым, в общем, ко всем способам, приведенным в настоящем изобретении выше или ниже. Все приведенные выше стадии способа можно осуществлять в условиях реакции, которые являются известными специалисту в данной области техники, включая стадии, приведенные конкретно, в отсутствие или, обычно, в присутствии растворителей или разбавителей, включая, например, растворители или разбавители, которые являются инертными для применяемых реагентов и растворяют их, в отсутствие или в присутствии катализаторов, агентов для конденсации или нейтрализации, например, ионообменных агентов, таких как катионнообменные агенты, например, в Н+ форме, в зависимости от природы реакции и/или реагентов, при пониженной, нормальной или повышенной температуре, например в диапазоне температур от приблизительно -100 до приблизительно 190 С, включая, например, от приблизительно -80 до приблизительно 150 С, например при от -80 до -60 С, при комнатной температуре, при от-20 до 40 С или при температуре кипения с обратным холодильником, при атмосферном давлении или в закрытом сосуде, при необходимости под давлением, и/или в инертной атмосфере, например в атмосфере аргона или азота. На всех стадиях реакций смеси изомеров, которые образуются, можно разделить на отдельные изомеры, например диастереоизомеры или энантиомеры, или на требуемые смеси изомеров, например рацематы, или смеси диастереоизомеров, например аналогично способам, описанным в "Дополнительные стадии способов". Растворители, из которых можно выбрать растворители, которые являются подходящими для любой конкретной реакции, включают растворители, приведенные конкретно или, например, воду, эфиры,такие как низшие алкил-низшие алканоаты, например этилацетат, эфиры, такие как алифатические эфиры, например диэтиловый эфир, или циклические эфиры, например тетрагидрофуран или диоксан, жид- 12021755 кие ароматические углеводороды, такие как бензол или толуол, спирты, такие как метанол, этанол или 1 или 2-пропанол, нитрилы, такие как ацетонитрил, галогенированные углеводороды, такие как хлористый метилен или хлороформ, амиды кислот, такие как диметилформамид или диметилацетамид, основания,такие как гетероциклические содержащие азот основания, например пиридин или N-метилпирролидин-2 он, ангидриды карбоновых кислот, такие как ангидриды низших алкановых кислот, например уксусный ангидрид, циклические, линейные или разветвленные углеводороды, такие как циклогексан, гексан или изопентан, метилциклогексан, или смеси данных растворителей, например водные растворы, если не указано иначе в описании способов. Данные смеси растворителей можно также применять при обработке, например, хроматографией или распределением. Соединения, включая их соли, можно также получить в виде гидратов, или их кристаллы могут, например, содержать растворитель, применяемый для кристаллизации. Могут присутствовать различные кристаллические формы. Настоящее изобретение также относится к тем видам способа, в которых соединение, получаемое в качестве промежуточного соединения на любой стадии способа, применяют в качестве исходного вещества и проводят оставшиеся стадии способа или в которых исходное вещество образуется в условиях реакции или применяют в виде производного, например, в защищенной форме или в виде соли, или соединение, получаемое способом согласно настоящему изобретению, получают в условиях способа и обрабатывают далее in situ. Все исходные вещества, составляющие элементы, реагенты, кислоты, основания, обезвоживающие агенты, растворители и катализаторы, применяемые для получения соединений настоящего изобретения, являются или имеющимися в продаже, или их можно получить органическими способами получения, известными специалисту в данной области техники (Houben-Weyl 4th Ed. 1952,Methods of Organic Synthesis, Thieme, Volume 21). В качестве следующего аспекта настоящего изобретения обеспечивают способ получения соединений формулы I или их фармацевтически приемлемой соли или сольвата. Согласно следующему аспекту настоящего изобретения обеспечивают способ получения соединения формулы I или его фармацевтически приемлемой соли или сольвата, включающий стадии:(а) реакции соединения формулы II где R10 представляют собой такие, как определено выше,в общепринятых условиях реакции для конденсации кислоты и амина; или(b) реакции соединения формулы IVX, R , R11b, R11c, R12a, R12b, R12c, m, n и р представляют собой такие, как определено выше; и L представляет собой уходящую группу. Настоящее изобретение также включает любые варианты настоящих способов, в которых промежуточный продукт, получаемый на любой их стадии, применяют в качестве исходного вещества, и осуществляют оставшиеся стадии, или в которых исходные вещества образуются in situ в условиях реакции,или в которых компоненты реакции применяют в виде их солей или оптически чистых антиподов. 1 Соединения настоящего изобретения и промежуточные соединения можно также превратить друг в друга согласно способам, в общем известным специалисту в данной области техники. Средства настоящего изобретения действуют, блокируя эпителиальные натриевые каналы (ENaC). Принимая во внимание их блокировку эпителиальных натриевых каналов (ENaC), соединения формулы(I), в свободной или в виде фармацевтически приемлемой соли в настоящем изобретении далее будут называть "средства настоящего изобретения", являются пригодными для лечения заболеваний, которые являются чувствительными к блокаде эпителиальных натриевых каналов, в частности заболеваний, для которых полезна гидратация слизистой. Заболевания, опосредованные блокадой эпителиальных натриевых каналов, включают заболевания,связанные с регуляцией объемов жидкости по обе стороны от эпителиальных мембран. Например, объем поверхностной жидкости дыхательных путей является ключевым регулятором мукоцилиарного клиренса и поддержания здоровья легких. Блокада эпителиальных натриевых каналов будет способствовать накоплению жидкости на слизистой стороне эпителия дыхательных путей, посредством этого способствуя клиренсу слизистой и предотвращая накопление слизистой и мокроты в легочных тканях (включая дыхательные пути легких). Данные заболевания включают респираторные заболевания, такие как кистозный фиброз, первичная цилиарная дискинезия, хронический бронхит, хроническая обструктивная болезнь легких (ХОБЛ), астма, инфекции дыхательных путей (острые и хронические; вирусные и бактериальные) и карцинома легких. Заболевания, опосредованные блокадой эпителиальных натриевых каналов, также включают заболевания, отличные от респираторных заболеваний, которые связаны с нарушенной регуляцией жидкости через эпителий, возможно включающей нарушенную физиологию защитных поверхностных жидкостей на его поверхности, например ксеростомию (сухость во рту) или кератоконъюнктивит (сухость глаз). Кроме того, блокаду эпителиальных натриевых каналов в почке можно применять для того, чтобы способствовать диурезу и посредством этого вызывать гипотензивный эффект. Лечение согласно настоящему изобретению может быть при клинических проявлениях или профилактическим, в частности при клинических проявлениях. Таким образом, в следующем аспекте настоящее изобретение включает средство настоящего изобретения для применения в качестве фармацевтического препарата. Следовательно, согласно следующему аспекту настоящее изобретение относится к средству настоящего изобретения для лечения или предупреждения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов. Следовательно, согласно следующему аспекту настоящее изобретение относится к применению средства настоящего изобретения в получении лекарственного препарата для лечения или предупреждение заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов. Следовательно, согласно следующему аспекту настоящее изобретение относится к способу предупреждения или лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, при котором вводят эффективное количество средства настоящего изобретения нуждающемуся в данном лечении пациенту. Астма включает и наследственную (неаллергическую) бронхиальную астму и приобретенную (аллергическую) бронхиальную астму, легкую бронхиальную астму, умеренную бронхиальную астму, тяжелую бронхиальную астму, бронхитичную астму, бронхиальную астму физического усилия, профессиональную бронхиальную астму и бронхиальную астму, вызванную бактериальной инфекцией. Лечение астмы также следует понимать как включающее лечение субъектов, например, младше 4 или 5 лет с симптомами астмы и которым поставлен диагноз или можно поставить диагноз "дети с астмой", установленной категории пациентов основного медицинского наблюдения и в настоящее время часто определяемой как астматики на ранней стадии. (Для удобства данное конкретное астматическое заболевание называют "детский астматический синдром"). Профилактическая интенсивность лечения астмы будет подтверждаться пониженной частотой или тяжестью симптоматического обострения, например острого астматического или бронхоконстрикторного обострения, улучшением функционирования легких или улучшением гиперреактивности дыхательных путей. Она будет дополнительно подтверждаться пониженным требованием в другой, симптоматической терапии, т.е. терапии для или предназначенной для сдерживания или купирования симптоматического обострения, когда оно возникает, например противовоспалительной (например, кортикостероид) или бронхорасширяющей. Профилактическая польза при астме может, в частности, быть очевидна для субъектов, склонных к "значительному снижению максимального объема выдоха утром". "Значительное снижение максимального объема выдоха утром" представляет собой общепризнанный астматический синдром, общий для существенного процента астматиков и характеризуемый приступом астмы, например, между 4 и 6 ч утра, т.е. в момент времени, обычно, по существу, отдаленный от ранее проведенной терапии симптоматической астмы. Хроническое обструктивное заболевание легких включает хронический бронхит и связанную с ним отдышку, эмфизему, а также усиление гиперреактивности дыхательных путей вследствие терапии другими лекарственными средствами, в частности, другой ингаляционной лекарственной терапии. Настоя- 14021755 щее изобретение также является применимым для лечения бронхита любого типа или происхождения,включая, например, острый, арахидиновый, катаральный, крупозный, хронический или гнойный туберкулезный бронхит. Средства настоящего изобретения могут также быть пригодны в качестве блокаторов активируемых протонами ионных каналов (ASIC). Таким образом, они являются пригодными для лечения заболеваний,которые являются чувствительными к блокаде активируемых протонами ионных каналов. Пригодность блокатора эпителиальных натриевых каналов для лечения заболевания, для которого полезна гидратация слизистой, можно исследовать определением ингибирующего эффекта блокаторов каналов на ENaC в подходящем анализе на основе клеток. Например, изолированные клетки или конфлюентный эпителий, эндогенно экспрессирующий или сконструированный так, чтобы он сверхэкспрессировал ENaC, можно применять для оценки функционирования каналов, применяя электрофизиологические способы или исследования потока ионов. См. способы, описанные в Hirsh et al., J. Pharm. Exp.Ther. (2004); Moody et al., Am. J. Physiol. Cell Physiol. (2005). Согласно вышеизложенному настоящее изобретение также относится в следующем аспекте к способу предупреждения или лечения заболевания, чувствительного к блокаде эпителиальных натриевых каналов, например заболеваний, связанных с регуляцией объемов жидкости по обе стороны от эпителиальных мембран, в частности обструктивного заболевания дыхательных путей, который включает введение субъекту, в частности субъекту, являющемуся человеком, нуждающемуся в этом, соединения формулы (I) или его фармацевтически приемлемой соли или сольвата. В другом аспекте настоящее изобретение относится к соединению формулы (I) в свободной форме или его фармацевтически приемлемой соли или сольвату для предупреждения или лечения заболевания,чувствительного к блокаде эпителиальных натриевых каналов, в частности обструктивного заболевания дыхательных путей, например кистозного фиброза и ХОБЛ. В другом аспекте настоящее изобретение относится к применению соединения формулы (I) в свободной форме или его фармацевтически приемлемой соли или сольвата для получения лекарственного средства для предупреждения или лечения заболевания, чувствительного к блокаде эпителиальных натриевых каналов, в частности обструктивного заболевания дыхательных путей, например кистозного фиброза и ХОБЛ. Соединения настоящего изобретения обладают хорошей ENaC блокирующей активностью, и их можно испытывать в следующих анализах. Культура клеток. Бронхиальные эпителиальные клетки человека (НВЕС) (Cambrex) выращивали в условиях границы раздела водной и воздушной сред, получая хорошо дифференцированный мукоцилиарный фенотип. НВЕС выращивали, применяя модификацию способа, описанного Gray и коллегами (Gray et al.,1996). Клетки высевали в пластиковые Т-162 колбы и выращивали в среде для выращивания бронхиальных эпителиальных клеток (BEGM; Cambrex), снабженной экстрактом гипофиза быка (52 мкг/мл), гидрокортизоном (0,5 мкг/мл), человеческим рекомбинантным эпидермальным фактором роста (0,5 нг/мл),эпинефрином (0,5 мкг/мл), трансферрином (10 мкг/мл), инсулином (5 мкг/мл), ретиноевой кислотой (0,1 мкг/мл), трийодтиронином (6,5 мкг/мл), гентамицином (50 мкг/мл) и амфотерецином В (50 нг/мл). Среду заменяли каждые 48 ч до 90% конфлюентности клеток. Затем клетки пересевали и засевали (8,25105 клетки/вставка) на поликарбонатные Snapwell вставки (Costar) в среде для дифференциации, содержащей 50% DMEM в BEGM с такими же добавками, как выше, но без трийодтиронина и при конечной концентрации ретиноевой кислоты 50 нМ (полностью транс-ретиноевая кислота). Клетки выдерживали погруженными в течение первых 7 дней в культуре, после чего их подвергали апикальному воздушному сопряжению в течение оставшегося периода культивирования. На данный момент среду заменяли наDMEM:F12 среду, содержащую 2% об./об. Ultroser G, для остальной части культуры. Амфотерецин В удаляли из всех 3 фуражей среды перед применением в камере Уссинга. Клетки применяли между 7 и 21 днями после создания апикального воздушного сопряжения. На всех стадиях культивирования клетки выдерживали при 37 С в 5% СО 2 в воздушном инкубаторе. Измерения тока короткого замыкания (ISC).Snapwell вставки устанавливали в камеры для вертикальной диффузии (Costar) и непрерывно заливали насыщенным газом раствором Рингера (5% СО 2 в О 2; рН 7,4), поддерживаемым при 37 С, содержащем (в мМ): 120 NaCl, 25 NaHCO3, 3,3 KH2PO4, 0,8 K2HPO4, 1,2 CaCl2, 1/2 MgCl2 и 10 глюкозы. Осмолярность раствора была между 280 и 300 мОсмоль/кг Н 2 О для всех применяемых физиологических растворов соли. Клетки подвергали фиксации напряжения 0 мВ (model EVC4000; WPI). RT измеряли применением 1- или 2-мВ импульса с 30-секундными интервалами и рассчитывали RT по закону Ома. Данные регистрировали, применяя PowerLab рабочую станцию (ADInstruments). Испытуемые соединения получали в виде 10 мМ исходного раствора в DMSO (95%). Серийные 3 кратно разбавленные растворы получали свежими в подходящей среде (дистиллированная Н 2 О или раствор Рингера). Первоначальную концентрацию добавляли к апикальной камере в виде 1000 концентрата в 5 мкл, получая в результате конечную 1 концентрацию 5 мл объема камеры Уссига. Последующие добавления соединения осуществляли в 3,3 мкл объеме 1000 последовательно разбавленного исходного раствора. При завершении эксперимента "концентрация-отклик" добавляли в апикальную камеру амилорид (10 мкм), обеспечивая измерение чувствительного к амилориду тока. Амилоридный контроль IC50 устанавливали в начале каждого эксперимента. Результаты выражены в виде среднего % ингибирования чувствительного к амилориду ISC. Строили кривые концентрация-отклик, и IC50 величины получали, применяя GraphPad Prism 3.02 или Graphpad Prism 4. Клеточные вставки обычно анализировали дважды и IC50 рассчитывали на основе данных о среднем % ингибирования. Соединения примеров в настоящем изобретении ниже обычно имеют IC50 величины ниже 10 мкМ,обычно ниже 1 мкМ. Например, следующие примеры имеют указанные IC50 величины. Средства настоящего изобретения можно вводить любым подходящим путем, например перорально, например, в виде таблетки или капсулы; парентерально, например внутривенно; местно на кожу; интраназально, например для лечения аллергического ринита; или предпочтительно ингаляцией, в частности, для лечения обструктивного или воспалительного заболевания дыхательных путей. В частности,средства настоящего изобретения можно доставлять в виде ингалируемого состава для лечения ХОБЛ,кистозного фиброза или бронхиальной астмы. В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение настоящего изобретения и фармацевтически приемлемый носитель. Фармацевтическую композицию можно формулировать для конкретных путей введения, таких как пероральное введение, парентеральное введение и ректальное введение и т.д. Кроме того, фармацевтическую композицию настоящего изобретения можно получить в твердой форме (включая, без ограничения,капсулы, таблетки, пилюли, гранулы, порошки или суппозитории) или в жидкой форме (включая, без ограничения, растворы, суспензии или эмульсии). Фармацевтические композиции можно подвергать общепринятым фармацевтическим операциям, таким как стерилизация, и/или они смогут содержать общепринятые инертные разбавители, смазывающие агенты или буферы, а также адъюванты, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, буферы и т.д. Обычно фармацевтические композиции представляют собой таблетки или желатиновые капсулы,содержащие активный ингредиент вместе сb) смазывающими агентами, например диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; для таблеток такжеc) связующими, например силикатом магния алюминия, крахмальным клейстером, желатином, трагакантом, метилцеллюлозой, натрийкарбоксиметилцеллюлозой и/или поливинилпирролидоном; при желанииd) разрыхлителями, например крахмалом, агаром, альгиновой кислотой или ее натриевой солью,или шипучими смесями, и/илиe) абсорбентами, красителями, ароматизаторами и подсластителями. Таблетки можно покрывать или пленкой или энтеросолюбильной оболочкой согласно способам, известным в данной области техники. Подходящие композиции для перорального введения содержат эффективное количество соединения настоящего изобретения в виде таблеток, пастилок, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсии, твердых или мягких капсул, или сиропов, или эликсиров. Композиции, предназначенные для перорального применения, получают согласно любому способу, известному в области получения фармацевтических композиций, и данные композиции могут содержать один или более агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей и консервантов для того, чтобы обеспечить фармацевтически первоклассные и приятные на вид препараты. Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, которые являются подходящими для получения таблеток. Данные вспомогательные вещества представляют собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие агенты и разрыхлители, например кукурузный крахмал или альгиновую кислоту; связующие, например крахмал, желатин или аравийскую камедь; и смазывающие агенты, например стеарат магния, стеариновую кислоту или тальк. На таблетки не наносят покрытия или наносят покрытие известными способами для замедления распада и поглощения в желудочно-кишечном тракте и посредством этого обеспечивают пролонгированное действие в течение более длительного периода времени. Например, можно применять замедляющие материалы, такие как глицерилмоностеарат или глицерилдистеарат. Составы для перорального применения могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешивают с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешивают с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Определенные инъецируемые композиции представляют собой водные изотонические растворы или суспензии, и суппозитории предпочтительно получать из жирных эмульсий или суспензий. Указанные композиции можно стерилизовать и/или они могут содержать адъюванты, такие как консерванты,стабилизаторы, смачивающие агенты или эмульгаторы, агенты, способствующие растворению, соли для регуляции осмотического давления и/или буферы. Кроме того, они могут также содержать другие терапевтически ценные вещества. Указанные композиции получают согласно общепринятым способам смешивания, гранулирования или нанесения покрытия, соответственно, и они содержат приблизительно 0,175% или содержат приблизительно 1-50% активного ингредиента. Подходящие композиции для трансдермального применения содержат эффективное количество соединения настоящего изобретения с подходящим носителем. Носители, подходящие для трансдермальной доставки, включают абсорбируемые фармакологически приемлемые растворители, способствующие прохождению через кожу хозяина. Например, трансдермальные устройства имеют вид повязки, содержащей каркасный элемент, емкость, содержащую соединение необязательно с носителями, необязательно контролирующий скорость барьер для доставки соединения на кожу хозяина при контролируемой и заранее определенной скорости в течение продолжительного периода времени, и средства для крепления устройства к коже. Подходящие композиции для местного применения, например, на кожу и глаза включают водные растворы, суспензии, мази, кремы, гели или спреи, например, для доставки аэрозолем или подобные. Данные системы для местной доставки будут, в частности, подходить для кожного применения, например для лечения рака кожи, например для профилактического применения в кремах от солнца, лосьонах,спреях и подобных. Таким образом, они являются особенно пригодными для применения в местных,включая косметические, составах, хорошо известных в данной области техники. Они могут содержать агенты, способствующие растворению, стабилизаторы, агенты, регулирующие тоничность, буферы и консерванты. Как применяют в настоящем изобретении, местное применение может также относиться к ингаляции или интраназальному применению. Составы можно удобно доставлять в виде сухого порошка (или отдельно, в виде смеси, например сухой смеси с лактозой, или смешанных частиц компонентов, например, с фосфолипидами) из порошкового ингалятора или в виде спрей-аэрозоля из контейнера под давлением, пульверизатора, аэрозольного ингалятора или распылителя, с или без применения подходящего пропеллента. Когда ингалируемой формой активного ингредиента является аэрозольная композиция, устройство для ингаляции может представлять собой аэрозольный флакон, снабженный клапаном, приспособленным для доставки отмеренной дозы, такой как 10-100 мкл, например 25-50 мкл, композиции, т.е. устройство, известное как дозирующий ингалятор. Подходящие данные аэрозольные флаконы и способы наполнения в них аэрозольных композиций под давлением являются хорошо известными специалисту в области ингаляционной терапии. Например, аэрозольную композицию можно вводить из металлического баллона с покрытием, например, как описано в ЕР-А-0642992. Когда ингалируемая форма активного ингредиента представляет собой распыляемую водную, органическую или водную/органическую дисперсию, устройство для ингаляции может представлять собой известный распылитель, например общепринятый пневматический распылитель, такой как распылитель с воздушной форсункой или ультразвуковой распылитель, который может содержать, например, от 1 до 50 мл, обычно 1-10 мл дисперсии; или карманный распылитель, иногда называемый ингалятор типа "мягкий аэрозоль" или "мягкий спрей", например электронно-контролируемое устройство, такое как AERx (Aradigm, US) или Aerodose (Aerogen), или механическое устройство, такое как RESPIMAT (Boehringer Ingelheim) распылитель, который обеспечивает гораздо меньшими распыляемыми объемами, например 10-100 мкл, чем общепринятые распылители. Когда ингалируемой формой активного ингредиента является форма мелкодисперсных частиц, устройство для ингаляции может представлять собой, например, порошковый ингалятор, приспособленный для доставки сухого порошка из капсулы или блистера, содержащих сухой порошок, содержащий единицу дозирования (А) и/или (В), или многодозовый порошковый ингалятор (MDPI), приспособленный для доставки, например, 3-25 мг сухого порошка, содержащего единицу дозирования (А) и/или (В) при одном включении. Композиция в виде сухого порошка предпочтительно содержит разбавитель или носитель, такой как лактоза, и соединение, которое способствует защите против ухудшения качества продукта в результате воздействия влаги, например стеарат магния. Подходящие данные порошковые ингаляторы включают устройства, описанные в US 3991761 (включающий AEROLIZER устройство), WO 05/113042 (включающий BREEZHALER устройство), WO 97/20589 (включающий CERTIHALER устройство), WO 97/30743 (включающий TWISTHALER устройство), WO 05/37353 (включающий(включающий PROHALER устройство) и также устройства, описанные в WO 08/51621, WO 09/117112 и US 2005/0183724. Настоящее изобретение также включает (А) средство настоящего изобретения в свободной форме или его фармацевтически приемлемую соль или сольват в ингалируемой форме; (В) ингалируемое лекарственное средство, содержащее данное соединение в ингалируемой форме вместе с фармацевтически приемлемым носителем в ингалируемой форме; (С) фармацевтический продукт, содержащий данное соединение в ингалируемой форме в сочетании с устройством для ингаляции; и (D) устройство для ингаляции, содержащее данное соединение в ингалируемой форме. Дозы средств настоящего изобретения, применяемые при реализации на практике настоящего изобретения, будут, конечно, изменяться в зависимости, например, от конкретного заболевания, которое подвергают лечению, требуемого эффекта и способа введения. В общем, подходящие дневные дозы для введения ингаляцией будут порядка 0,0001-30 мг/кг, обычно 0,01-10 мг для пациента, тогда как подходящие дневные дозы для перорального введения будут порядка 0,01-100 мг/кг. Настоящее изобретение дополнительно относится к безводным фармацевтическим композициям и лекарственным формам, содержащим соединения настоящего изобретения в качестве активных ингредиентов, поскольку вода может способствовать разрушению определенных соединений. Безводные фармацевтические композиции и лекарственные формы настоящего изобретения можно получить, применяя безводные или содержащие мало влаги ингредиенты и условия с низким содержанием влаги или с низкой влажностью. Безводные фармацевтические композиции можно получить и хранить так, чтобы они сохранялись безводными. Соответственно, безводные композиции можно упаковывать, применяя вещества, о которых известно, что они препятствуют воздействию воды так, чтобы они могли содержаться в подходящих формулярных наборах. Примеры подходящих упаковок включают, но без ограничения, герметичные упаковки из фольги, пластиковые упаковки, контейнеры с единицами дозирования (например, ампулы), блистерные упаковки и контурные упаковки. Настоящее изобретение дополнительно относится к фармацевтическим композициям и лекарственным формам, которые содержат одно или более средств, которые снижают скорость, с которой соединение настоящего изобретения в качестве активного ингредиента будет разлагаться. Данные средства, которые называют в настоящем изобретении "стабилизаторами", включают, но без ограничения, антиоксиданты, такие как аскорбиновая кислота, рН буферы или солевые буферы и т.д. Соединение настоящего изобретения можно вводить или одновременно с, или перед, или после одного или более других терапевтических агентов. Соединение настоящего изобретения можно вводить отдельно, одинаковыми или различными путями введения или вместе в одной фармацевтической композиции, как другие агенты. В одном варианте осуществления настоящее изобретение относится к продукту, содержащему соединение формулы (I) и по меньшей мере один другой терапевтический агент в виде смешанного состава для одновременного, раздельного или последовательного применения в терапии. В одном варианте осуществления терапия представляет собой лечение заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов. Продукты, предоставленные в виде комбинированного состава,включают композицию, содержащую соединение формулы (I) и другой терапевтический агент(агенты) вместе в одной фармацевтической композиции, или соединение формулы (I) и другой терапевтический агент(агенты) в раздельных формах, например в виде набора. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) и другой терапевтический агент(агенты). Необязательно, фармацевтическая композиция может содержать фармацевтически приемлемое вспомогательное вещество,как описано выше. В одном варианте осуществления настоящее изобретение относится к набору, содержащему две или более отдельных фармацевтических композиции, по меньшей мере одна из которых содержит соединение формулы (I). В одном варианте осуществления набор содержит средства для раздельного хранения указанных композиций, такие как контейнер, разделенный флакон или разделенная упаковка из фольги. Примером данного набора является блистерная упаковка, как обычно применяют для упаковки таблеток,капсул и подобных. Набор настоящего изобретения можно применять для введения различных лекарственных форм,например пероральных и парентеральных, для введения отдельных композиций через различные интервалы дозирования или для титрования отдельных композиций относительно друг друга. Для облегчения соблюдения режима дозирования набор настоящего изобретения обычно содержит руководство по введению. Соединения формулы (I) и их фармацевтически приемлемые соли и сольваты имеют преимущество,заключающееся в том, что они являются более селективными, имеют более быстрое начало действия,являются более эффективными, лучше поглощаются, являются более стабильными, являются более устойчивыми к метаболизму, имеют пониженный "пищевой эффект", имеют улучшенный профиль безопасности или обладают другими более желательными свойствами (например, относительно растворимости или гигроскопичности), чем соединения предшествующего уровня техники. В частности, соединения настоящего изобретения обладают улучшенным профилем стабильности в плазме человека. Обеспечивая соединения, которые обладают улучшенным профилем стабильности в плазме человека, настоящее изобретение относится к соединениям, которые эффективно блокируют эпителиальные натриевые каналы (ENaC) с улучшенными фармакокинетическими свойствами. Стабильность соединений настоящего изобретения в плазме человека измеряли следующим образом. Стабильность в плазме человека. Кровь отбирали у здоровых добровольцев в литий-гепариновые пробирки и плазму получали разделением с помощью центрифугирования кровяных клеток при 1500g. Плазму по меньшей мере 3 индивидов смешивали и применяли для определения стабильности соединений. Соединения получали в 100% DMSO при концентрации 10 мМ и последовательно разбавляли до концентрации 100 мкМ. Инкубирование проводили при конечной концентрации 1 мкМ и инициировали добавлением 3 мкл 100 мкМ исходного раствора соединения в 297 мкл плазмы, предварительно нагретой в водяной бане при 37 С, с последующим непродолжительным смешиванием встряхиванием. 50 мкл аликвоты плазмы отбирали в 4 момента времени в течение 1-часового периода инкубирования и реакции немедленно прекращали осаждением белков, достигаемым добавлением аликвоты плазмы к заранее приготовленному 96-луночному планшету, содержащему 150 мкл ацетонитрила, содержащего подходящий внутренний стандарт. Образцы, обработанные ацетонитрилом, перемешивали встряхиванием с последующим центрифугированием в течение 20 мин при 1500g для удаления осажденных белков. Первоначальные концентрации соединения (в момент времени = 0 мин) определяли добавлением соединения к предварительно деактивированной плазме при той же концентрации, как применяемая в инкубировании. Затем надосадочную жидкость удаляли, разбавляли 1:1 водой и анализировали на остаток соединения жидкостной хроматографией-тандемной масс-спектрометрией (Waters Acquity UPLC, Applied BiosystemsAPI4000). Константу скорости разложения в плазме соединений рассчитывали аппроксимацией отношения площадей пиков соединения: внутренний стандарт к функции распада по экспоненте и время полуразложения рассчитывали делением натурального логарифма 2 на константу скорости разложения (Microsoft Excel). Следующие примеры имеют указанные величины времени полуразложения в плазме человека. В комбинационных терапиях настоящего изобретения соединение настоящего изобретения и другой терапевтический агент могут быть получены и/или сформулированы одним и тем же или различными производителями. Более того, соединение настоящего изобретения и другой терапевтический агент можно объединять в комбинационной терапии: (i) перед открытием комбинационного продукта терапевтом (например, в случае набора, содержащего соединение настоящего изобретения и другой терапевтический агент); (ii) самим терапевтом (или под руководством терапевта) незадолго до введения; (iii) самим пациентом, например, в процессе последовательного введения соединения настоящего изобретения и другого терапевтического агента. Соответственно, настоящее изобретение относится к применению соединения формулы (I) для лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где лекарственное средство получают для введения с другим терапевтическим агентом. Настоящее изобретение также относится к применению другого терапевтического агента для лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где лекарственное средство вводят с соединением формулы (I). Настоящее изобретение также относится к соединению формулы (I) для применения в способе лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где соединение формулы (I) получают для введения с другим терапевтическим агентом. Настоящее изобретение также относится к другому терапевтическому агенту для применения в способе лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где другой терапевтический агент получают для введения с соединением формулы (I). Настоящее изобретение также относится к соединению формулы (I) для применения в способе лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где соединение формулы (I) вводят с другим терапевтическим агентом. Настоящее изобретение также относится к другому терапевтическому агенту для применения в способе лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где другой терапевтический агент вводят с соединением формулы (I). Настоящее изобретение также относится к применению соединения формулы (I) для лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где пациент ранее(например, в пределах 24 ч) подвергался лечению другим терапевтическим агентом. Настоящее изобретение также относится к применению другого терапевтического агента для лечения заболевания или состояния, опосредованного блокадой эпителиальных натриевых каналов, где пациент ранее (например, в пределах 24 ч) подвергался лечению соединением формулы (I). В одном варианте осуществления другой терапевтический агент выбран из противовоспалительного, бронхорасширяющего, антигистаминового, противозастойного и противокашлевого лекарственного вещества, в частности для лечения кистозного фиброза или обструктивных или воспалительных заболеваний дыхательных путей, таких как заболевания, приведенные выше в настоящем изобретении, например, в качестве агентов, потенциирующих терапевтическую активность данных лекарственных средств или в качестве средств для снижения требуемой дозы или потенциальных побочных эффектов данных лекарственных средств. Соответственно, настоящее изобретение включает в качестве дополнительного аспекта комбинацию блокатора эпителиальных натриевых каналов настоящего изобретения с осмотическими агентами рующими CFTR функцию агентами дикого типа и мутантными (корректирующими и потенциирующими агентами), например, агентами, описанными в WO 2007/021982, WO 2006/099256, WO 2006/127588, WO 2004/080972, WO 2005/026137, WO 2005/035514, WO 2005/075435, WO 2004/111014, WO 2006/101740,WO 2004/110352, WO 2005/120497 и US 2005/0176761, противовоспалительным, бронхорасширяющим,антигистаминовым, противокашлевым, антибиотиком или DNase лекарственным веществом, причем указанный блокатор эпителиальных натриевых каналов и указанное лекарственное вещество могут быть в одной или разных фармацевтических композициях. Подходящие модифицирующие CFTR функцию агенты включают CFTR потенциирующие агенты,в частности соединение VX-770 формулы Подходящие антибиотики включают макролидные антибиотики, например тобрамицин (TOBI). Подходящие DNase лекарственные вещества включают дорназу альфа (Pulmozyme), хорошо очищенный раствор рекомбинантной человеческой дезоксирибонуклеазы I (rhDNase), которая селективно расщепляет ДНК. Дорназу альфа применяют для лечения кистозного фиброза. Другие подходящие комбинации блокаторов эпителиальных натриевых каналов с противовоспалительными агентами представляют собой комбинации с антагонистами хемокиновых рецепторов, например, CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 и CCR10, CXCR1, CXCR2,CXCR3, CXCR4, CXCR5, в частности CCR-5 антагонистами, такими как антагонисты Шеринга-Плау SC351125, SCH-55700 и SCH-D; антагонисты Такеда, такие как хлорид N-4-6,7-дигидро-2-(4 метилфенил)-5 Н-бензоциклогептен-8-ил]карбонил]амино]фенил]метил]тетрагидро-N,N-диметил-2 Нпиран-4-аминия (TAK-770) ; и CCR-5 антагонисты, описанные в USP 6166037 (особенно пп.18 и 19), WO 00/66558 (особенно п.8), WO 00/66559 (особенно п.9), WO 04/018425 и WO 04/026873. Подходящие противовоспалительные лекарственные средства включают стероиды, в частности глюкокортикостероиды, такие как будесонид, дипропионат бекламетазона, пропионат флутиказона, циклезонид или фуроат мометазона, или стероиды, описанные в WO 02/88167, WO 02/12266, WO 02/100879,WO 02/00679 (особенно стероиды примеров 3, 11, 14, 17, 19, 26, 34, 37, 39, 51, 60, 67, 72, 73, 90, 99 и 101),WO 03/35668, WO 03/48181, WO 03/62259, WO 03/64445, WO 03/72592, WO 04/39827 и WO 04/66920; нестероидные агонисты глюкокортикоидных рецепторов, такие как агонисты, описанные в DE 10261874,WO 00/00531, WO 02/10143, WO 03/82280, WO 03/82787, WO 03/86294, WO 03/104195, WO 03/101932,WO 04/05229, WO 04/18429, WO 04/19935 и WO 04/26248; LTD4 антагонисты, такие как монтелукаст и зафирлукаст; PDE4 ингибиторы, такие как циломиласт (Ariflo GlaxoSmithKline), рофлумиласт (BykProdesfarma), PD189659/PD168787 (Parke-Davis), AWD-12-281 (Asta Medica), CDC-801 (Celgene), SelCID(TM) CC-10004 (Celgene), VM554/UM565 (Vernalis), T-440 (Tanabe), KW-4490 (Kyowa Hakko Kogyo),и ингибиторы, описанные в WO 92/19594, WO 93/19749, WO 93/19750, WO 93/19751, WO 98/18796, WO 99/16766, WO 01/13953, WO 03/104204, WO 03/104205, WO 03/39544, WO 04/000814, WO 04/000839, WO 04/005258, WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/018431, WO 04/018449,WO 04/018450, WO 04/018451, WO 04/018457, WO 04/018465, WO 04/019944, WO 04/019945, WO 04/045607 и WO 04/037805; аденозиновые А 2 В рецепторные антагонисты, такие как антагонисты, описанные в WO 02/42298; и бета-2 адренорецепторные агонисты, такие как альбутерол (салбутамол), метапротеренол, тербуталин, салметерол, фенотерол, прокатерол и особенно формотерол, кармотерол и их фармацевтически приемлемые соли, и соединения (в свободной, или солевой, или сольватной форме) формулы (I) WO 0075114, который включен в настоящее изобретение с помощью ссылки, предпочтительно соединения его примеров, особенно соединение формулы сответствующее индакатеролу, и его фармацевтически приемлемые соли, а также соединения (в свободной, или солевой, или сольватной форме) формулы (I) WO 04/16601 и также соединения ЕР 1440966, JP 05025045, WO 93/18007, WO 99/64035, USP 2002/0055651, WO 01/42193, WO 01/83462, WO 02/66422,WO 02/70490, WO 02/76933, WO 03/24439, WO 03/42160, WO 03/42164, WO 03/72539, WO 03/91204, WO 03/99764, WO 04/16578, WO 04/22547, WO 04/32921, WO 04/33412, WO 04/37768, WO 04/37773, WO 04/37807, WO 04/39762, WO 04/39766, WO 04/45618, WO 04/46083, WO 04/80964, WO 04/108765 и WO 04/108676. Подходящие бронхорасширяющие лекарственные средства включают антихолинергические или антимускариновые агенты, в частности бромид ипратропия, бромид окситропия, тиотропиевые соли и CHF 4226 (Chiesi) и гликопирролат, но также соединения, описанные в ЕР 424021, USP 3714357, USP 5171744,WO 01/04118, WO 02/00652, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/33495, WO 03/53966, WO 03/87094, WO 04/018422 и WO 04/05285. Подходящие двойные противовоспалительные и бронхорасширяющие лекарственные средства включают двойные бета-2 адренорецепторный агонист/мускариновые антагонисты, такие как те, что описаны в USP 2004/0167167, WO 04/74246 и WO 04/74812. Подходящие антигистаминовые лекарственные вещества включают гидрохлорид цетиризина, ацетаминофен, фумарат клемастина, прометазин, лоратидин, деслоратидин, дифенгидрамин и гидрохлорид фексофенадина, активастин, астемизол, азеластин, эбастин, эпинастин, мизоластин и тефенадин, а также вещества, описанные в JP 2004107299, WO 03/099807 и WO 04/026841. Как применяют в настоящем изобретении, термин "фармацевтически приемлемый носитель" включает любой и все растворители, среды для диспергирования, покрывающие агенты, поверхностноактивные вещества, антиоксиданты, консерванты (например, противомикробные агенты, противогрибковые агенты), изотонические агенты, агенты, замедляющие поглощение, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие, вспомогательные вещества, разрыхлители, смазывающие агенты, подсластители, ароматизаторы, красители и подобные, и их комбинации, как известно специалисту в данной области техники (см., например, Remington's Pharmaceutical Sciences, 18thEd. Mack Printing Company, 1990, pp.1289-1329). За исключением случаев, когда любой общепринятый носитель является несовместимым с активным ингредиентом, предполагается его применение в терапевтических или фармацевтических композициях. Термин "терапевтически эффективное количество" соединения настоящего изобретения относится к количеству соединения настоящего изобретения, которое вызывает биологический или медицинский ответ у субъекта, например снижение или ингибирование активности фермента или белка, или облегчение симптомов, облегчение заболеваний, замедление или смягчение развития заболевания, или предупреждение заболевания и т.д. В одном неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения настоящего изобретения, которое при введении субъекту является эффективным для (1), по меньшей мере, частичного облегчения, ингибирования, предупреждения и/или амелиорации состояния или расстройства или заболевания (i), опосредованного эпителиальными натриевыми каналами, или (ii) связанного с активностью эпителиальных натриевых каналов, или (iii) характеризующегося активностью (нормальной или нарушенной) эпителиальных натриевых каналов; или (2) снижения или ингибирования активности эпителиальных натриевых каналов. В другом неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения настоящего изобретения, которое при введении в клетку,или ткань, или неклеточный биологический материал, или среду является эффективным для, по меньшей мере, частичного снижения или ингибирования активности эпителиальных натриевых каналов. Как применяют в настоящем изобретении, термин "субъект" относится к животному. Обычно животное представляет собой млекопитающее. Субъект также относится, например, к приматам (например,людям), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и т.п. В определенных вариантах осуществления субъект представляет собой примата. В еще другом варианте осуществления субъект представляет собой человека. Как применяют в настоящем изобретении, термины "ингибитор", "ингибировать" или "ингибирование" относятся к облегчению или подавлению указанного состояния, симптома или расстройства или заболевания, или значительному снижению исходной активности биологической активности или процесса. Как применяют в настоящем изобретении, термин "лечить" или "лечение" любого заболевания или расстройства относится в одном варианте осуществления к облегчению заболевания или расстройства(т.е. замедлению, или остановке, или снижению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечить" или "лечение" относится к облегчению или амелиорации по меньшей мере одного физического параметра, включая параметры, которые могут быть незаметны для пациента. В еще другом варианте осуществления "лечить" или "лечение" относится к модулированию заболевания или расстройства, или физически (например, стабилизация воспринимаемого симптома), физиологически (например, стабилизация физического параметра) или обоими. В еще другом варианте осуществления "лечить" или "лечение" относится к предупреждению или замедлению возникновения, или развития, или прогрессирования заболевания или расстройства. Как применяют в настоящем изобретении, субъект является "нуждающимся в" лечении, если данный субъект будет получать пользу биологически, медицински или у него будет улучшаться качество жизни при данном лечении. Как применяют в настоящем изобретении, любые термины, используемые в контексте настоящего изобретения (особенно в контексте формулы изобретения), следует понимать как включающие и единичные и множественные формы, если не указано иначе в настоящем изобретении или явно не противоречит контексту. Все способы, описанные в настоящем изобретении, можно осуществлять в любом подходящем порядке, если не указано иначе в настоящем изобретении или явно не противоречит контексту. Применение любого и всех примеров или выражения для приведения примеров (например, "такой как"), имеющихся в настоящем изобретении, предполагаются только для лучшего освещения настоящего изобретения и не являются ограничивающими объем настоящего изобретения, указанного в формуле изобретения. Настоящее изобретение проиллюстрировано следующими примерами. Примеры Ссылаясь на примеры, которые следуют далее, соединения предпочтительных вариантов осуществления получают, применяя способы, описанные в настоящем изобретении, или другие способы, которые являются известными в данной области техники. Должно быть ясно, что органические соединения согласно предпочтительным вариантам осуществления могут обладать свойством таутомерии. Поскольку химические структуры в описании могут представлять только одну из возможных таутомерных форм, должно быть ясно, что предпочтительные варианты осуществления включают любую таутомерную форму изображенной структуры. Ясно, что настоящее изобретение не ограничивается вариантами осуществления, приведенными в настоящем изобретении для иллюстрации, но включает все их формы, которые попадают в объем приведенного выше описания. Общие условия. Масс-спектры получали в LCMS системах, применяя электроспрей-ионизацию. Они представляли собой или комбинации Agilent 1100 ВЭЖХ/Micromass Platform масс-спектрометр или комбинации Agilent 1200 HPLC/Agilent 6130 квадрупольный масс-спектрометр, или Waters Acquity UPLC с SQD массспектрометр. [М+Н]+ относится к моноизотопным молекулярным весам. ЯМР-спектры получали на имеющемся в открытом доступе Bruker AVANCE 400 NMR спектрометре, применяя ICON-NMR. Спектры регистрировали при 298 К и относили к стандарту, применяя пик растворителя. Некоторые протоны не наблюдали из-за очень широкой природы их обменных резонансов. Следующие примеры предполагаются для иллюстрации настоящего изобретения, и не следует расценивать их как ограничивающие его. Температуры приведены в градусах Цельсия. Если не указано иначе, все упаривания проводят при пониженном давлении. Структуры конечных продуктов, промежуточных соединений и исходных веществ подтверждают стандартными аналитическими способами, например микроанализом, и спектроскопическими характеристиками, например MS, ИК, ЯМР. Применяемые сокращения являются сокращениями, общепринятыми в данной области техники. Если не определено,термины имеют их общепринятые значения. Сокращения. ушир - уширенный,д - дуплет,DCM - дихлорметан,DSC - дифференциальная сканирующая калориметрия,DMF - N,N-диметилформамид,DMI - 1,3-диметил-2-имидазолидинон,DMSO - диметилсульфоксид,EDCI - N-(3-диметиламинопропил)-N'-этилкарбодиимид,EtOAc - этилацетат,h - час(часы),HOBt - 1-гидроксибензотриазол,ВЭЖХ - высокоэффективная жидкостная хроматография,ЖХ-МС - жидкостная хроматография-масс-спектрометрия,МеОН - метанол,MS - масс-спектрометрия,м - мультиплет,2-meTHF - 2-метилтетрагидрофуран,min - мин,ml - миллилитр(миллилитры),m/z - отношение массы к заряду,ЯМР - ядерный магнитный резонанс,iPrOH - изопропанол,- 23021755ppm - частей на миллион,PS - полимерная подложка,PEAX РЕ-анионообменник (например, Isolute PE-AX колонки фирмы Biotage),Rt - время удерживания,с - синглет,SCX-2 сильный катионообменник (например, Isolute SCX-2 колонки фирмы Biotage),т - триплет,TEA - триэтиламин,TFA - трифторуксусная кислота,THF - тетрагидрофуран. Ссылаясь на примеры, которые следуют далее, соединения предпочтительных вариантов осуществления получают, применяя способы, описанные в настоящем изобретении, или другие способы, которые являются известными в данной области техники. Различные исходные вещества, промежуточные соединения и соединения предпочтительных вариантов осуществления можно выделить и очистить, при необходимости, применяя общепринятые способы, такие как осаждение, фильтрование, кристаллизация, упаривание, перегонка и хроматография. Если не указано иначе, все исходные вещества получают из коммерческих источников и применяют без дополнительной очистки. Соли можно получить из соединений известными способами образования солей. Должно быть ясно, что органические соединения согласно предпочтительным вариантам осуществления могут обладать свойством таутомерии. Поскольку химические структуры в описании могут представлять только одну из возможных таутомерных форм, должно быть ясно, что предпочтительные варианты осуществления включают любую таутомерную форму нарисованной структуры. Если не указано иначе, аналитические ВЭЖХ условия были следующими: Способ 2minLCv002 колонка Waters ВЕН С 18 502,1 мм, 1,7 мкм Температура колонки 50 С Элюенты А: Н 2 О, В: метанол, оба содержат 0,1% TFA Скорость потока 0,8 мл/мин Градиент 0,20 мин 5% В; 5% - 95% В в течение 1,30 мин, 0,25 мин 95% В Способ 2minLCv003 колонка Waters ВЕН С 18 502,1 мм, 1,7 мкм Температура колонки 50 С Элюенты А: H2O, В: ацетонитрил, оба содержат 0,1% TFA Скорость потока 0,8 мл/мин Градиент 0,20 мин 5% В; 5% - 95% В в течение 1,30 мин, 0,25 мин 95% В Способ 10minLCv002 колонка Waters ВЕН С 18 502,1 мм, 1,7 мкм Температура колонки 50 С Элюенты А: H2O, В: метанол, оба содержат 0,1% TFA Скорость потока 0,8 мл/мин Градиент 0,20 мин 5% В; 5% - 95% В в течение 7,80 мин, 1,00 мин 95% В Способ 10minLCv003 колонка Waters ВЕН С 18 502,1 мм, 1,7 мкм Температура колонки 50 С Элюенты А: H2O, В: ацетонитрил, оба содержат 0,1% TFA Скорость потока 0,8 мл/мин Градиент 0,20 мин 5% В; 5% - 95% В в течение 7,80 мин, 1,00 мин 95% В Способ (i) колонка Agilent Zorbax SB-C18 (Rapid resolution) 302,1 мм, 3,5 мкм Температура колонки 30 С Элюенты В: H2O, С: ацетонитрил, оба содержат 0,1% муравьиную кислоту Скорость потока 0,8 мл/мин Градиент 1 мин 5% С; 5% - 95% С в течение 5 мин, 3,00 мин 95% С Способ (ii) Колонка SB-C18 504,6 мм, 1,8 мкм Температура колонки 30 С Элюенты А: H2O, В: ацетонитрил, оба содержат 0,1% муравьиную кислоту Скорость потока 1 мл/мин Градиент 1 мин 2% В; 2% - 70% В в течение 4 мин, 70% - 90% В в течение 0,1 мин, 4,9 мин 95% В. Получение целевых соединений Пример 1.0. Сукцинатная соль дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5-диамино-6 хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты Стадия 1: дипропилкарбамоилметиловый эфир 3-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2 карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты. Указанное в заголовке соединение можно получить способом А или В. Способ А. К перемешиваемому раствору 3-(2-дипропилкарбамоилметоксикарбонилэтилсульфамоил)бензойной кислоты (промежуточное соединение АА) (7,0 г, 16,89 ммоль) в DMF при комнатной температуре добавляли гидрохлорид [1,3,8-триазаспиро[4,5]дек-(2 Е)-илиден]амид 3,5-диамино-6-хлорпиразин-2 карбоновой кислоты (WO 09074575, пример 38, стр. 123) (8,20 г, 16,89 ммоль) с последующим добавлением N-метилморфолина (7,43 мл, 67,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин и обрабатывали HATU (6,42 г, 16,89 ммоль) одной порцией. Смесь перемешивали при комнатной температуре в течение дополнительных 10 мин и затем реакцию прекращали добавлением ледяной воды (500 мл). Полученный в результате твердый остаток собирали фильтрацией и растворяли в DCM. Раствор промывали водой (1500 мл), сушили (MgSO4) и концентрировали в вакууме,получая неочищенное оранжевое масло. Очистка хроматографией на диоксиде кремния, элюируяH ЯМР (400 МГц, ДМСО-d6)8,52 (1 Н, ушир.с), 8,35 (1 Н, ушир.с), 7,88 (2 Н, дт), 7,77 (1 Н, с), 7,727,65 (2 Н, м), 6,72 (2 Н, ушир.с), 4,73 (2H, с), 3,80 (1H, ушир.с), 3,61 (1H, ушир.с), 3,43 (3 Н, ушир.с), 3,173,09 (4 Н, м), 3,04 (2 Н, т), 2,53 (2 Н, под ДМСО), 1,78 (2 Н, ушир.с), 1,69 (2 Н, ушир.с), 1,56-1,38 (4 Н, м),0,84 (3 Н, т), 0,78 (3 Н, т). Способ В. К перемешиваемому раствору 3-(2-дипропилкарбамоилметоксикарбонилэтилсульфамоил)бензойной кислоты (промежуточное соединение АА) (6,1 г, 12,60 ммоль) в THF (50 мл) добавляли последовательно воду (25 мл), N-метилморфолин (7 мл, 63 ммоль) и HOBt гидрат (2,9 г, 18,9 ммоль). Температуру внутри колбы поддерживали 20 С. Добавляли гидрохлорид [1,3,8-триазаспиро[4,5]дек-(2 Е)илиден]амида 3,5-диамино-6-хлорпиразин-2-карбоновой кислоты (WO 09074575, пример 38, стр. 123)(65% чистота, 6,3 г, 12,6 ммоль) и перемешивали до образования прозрачного раствора. ДобавлялиEDCIHCl (3,6 г, 18,9 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Добавляли к реакционной смеси 2-MeTHF (200 мл) и 2% водный Na2CO3 (150 мл). Слои разделяли и водную фазу промывали дополнительным 2-MeTHF (100 мл). Объединенные органические фазы промывали 2% водным Na2CO3 (200 мл) и водой (2200 мл). Добавляли ацетонитрил (100 мл) и раствор концентрировали при 30 С до объема 70 мл. Добавляли ацетонитрил (300 мл), и раствор снова концентрировали при 30 С до объема 150 мл. Раствор нагревали до 50 С и добавляли к полученному в результате раствору малеиновую кислоту (1,62 г). Немедленно образовывался не совсем белый осадок, температуру понижали до комнатной в течение 1 ч. Твердый остаток собирали фильтрацией, получая дипропилкарбамоилметиловый эфир 3-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5] декан-8-карбонилбензолсульфониламино)пропионовой кислоты в виде малеатной соли; добавлялиDCM (200 мл) и 2% водный Na2CO3 (200 мл) и перемешивали до полного растворения твердого остатка. Органический слой отделяли, промывали водой (2100 мл) и концентрировали в вакууме, получая указанное в заголовке соединение. ЖХ-МС 722,1 [М+Н]+, способ (i); 1(1 Н, м), 7,05-6,50 (2 Н, ушир.с), 6,95-6,20 (1 Н, ушир.с), 4,73 (2 Н, с), 3,81-3,39 (2 Н, м), 3,61-3,31 (2 Н, м),3,43 (2 Н, ушир.с), 3,15-3,11 (4 Н, м), 3,04 (2 Н, т), 2,51 (2 Н, т), 1,79-1,69 (м, 4 Н), 1,51-1,43 (4 Н, м), 0,84 (3 Н,т), 0,78 (3 Н, т). Стадия 2: сукцинатная соль дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5-диамино-6 хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты. Указанное в заголовке соединение можно получить способом С или D. Способ C. Янтарную кислоту (409 мг, 3,47 ммоль) добавляли к раствору дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонил бензолсульфониламино)пропионовой кислоты (стадия 1, способ В) (2,50 г, 3,47 ммоль) в ацетонитриле(25 мл) и воде (1,5 мл) при 50 С. Полученный в результате прозрачный раствор охлаждали до комнатной температуры в течение 30 мин. Кристаллизация начиналась при температуре внутри колбы 30 С. Полученную в результате суспензию перемешивали при комнатной температуре в течение 16 ч. Кристаллы собирали фильтрацией и остаток на фильтре промывали смесью ацетонитрил/вода (95:5) и сушили при 50 С в вакууме, получая указанное в заголовке соединение. Способ D. Смесь, содержащую янтарную кислоту (0,50 г, 4,23 ммоль) и ацетон (20 г), нагревали до 45 С до получения прозрачного раствора и затем фильтровали (0,2 мкм PTFE фильтр). Во второй реакционной колбе дипропилкарбамоилметиловый эфир 3-(3-2-[(Е)-3,5-диамино-6 хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты (стадия 1, способ В) (3,00 г, 4,16 ммоль) и ацетон (30 г) нагревали до 45 С до получения прозрачного раствора и затем фильтровали (0,2 мкм PTFE фильтр). Раствор янтарной кислоты (0,50 г, 4,23 ммоль) в ацетоне (20 мл) грели при 45 С в течение 1 ч и обрабатывали частью раствора дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5-диамино-6 хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты в ацетоне (1,62 г раствора) в течение 10 мин. Полученную в результате смесь обрабатывали суспензией затравки кристаллов дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5-диамино 6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты (как получено, применяя способ С, 20 мг) в ацетоне (300 мг) и перемешивали при 45 С в течение 30 мин. Оставшийся раствор дипропилкарбамоилметилового эфира 3-(3-2-[(Е)-3,5 диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]декан-8-карбонилбензолсульфониламино)пропионовой кислоты в ацетоне (31,38 г) добавляли к смеси в течение 5 ч и нагревание продолжали при 45 С в течение 1 ч. Суспензию охлаждали до 25 С в течение 1 ч и перемешивали в течение дополнительного 1 ч. Суспензию фильтровали через стеклоприпой и остаток на фильтре промывали ацетоном (25 г). Остаток на фильтре сушили при 50 С, получая указанное в заголовке соединение; HPLC Rt 4,02 мин, способ ii; 1H ЯМР (400 МГц, ДМСО-d6)7,87 (1 Н, м), 7,78 (1 Н, м), 7,69 (1 Н, м), 7,68 (1 Н, м), 6,85 (2 Н,ушир.с), 4,73 (2 Н, с), 3,84-3,20 (6 Н и вода, ушир. максимум), 3,17-3,09 (4 Н, м), 3,04 (2 Н, т), 2,53 (2 Н, под ДМСО), 2,39 (4 Н, с), 1,80 (2 Н, ушир.с), 1,70 (2 Н, ушир.с), 1,55-1,37 (4 Н, м), 0,85 (3 Н, т), 0,78 (3 Н, т) (пожалуйста, обратите внимание: два обменных сукцинатных протона и 3-4 кислых NH резонанса не наблюдались непосредственно из-за очень широкой природы некоторых из обменных резонансов; температура плавления Tm (DSC)=149C). Соединения следующих сведенных в таблицу примеров (табл. 1) получали способом, аналогичным примеру 1.0, заменяя 3-(2-дипропилкарбамоилметоксикарбонилэтилсульфамоил)бензойную кислоту(промежуточное соединение АА) на подходящее промежуточное соединение (получение которого описано в настоящем изобретении ранее, или оно коммерчески доступно). Таблица 1 Указанное в заголовке соединение можно получить способом А или В. Способ А. К суспензии трет-бутилового эфира [4-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]1,3,8-триазаспиро[4,5]дек-8-ил-3-оксопропил)фенокси]уксусной кислоты (WO 09074575, пример 71,стр. 134) (6,0 г, 8,2 ммоль) в 2-MeTHF/вода (60 мл/10 мл) добавляли порциями NaOH (1,0 г, 25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Органический слой отделяли и промывали водой (310 мл). Добавляли воду (60 мл) и 2-MeTHF удаляли в вакууме. ДобавлялиTHF (30 мл), затем NaOH (0,68 г, 17 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Органический растворитель удаляли в вакууме и оставшуюся водную фазу промывали МТВЕ (230 мл). Добавляли DMF (30 мл), и рН доводили до 7 4 н. HCl (4,25 мл) при комнатной температуре. PhMe азеотропную отгонку проводили три раза.(2,2 г, 12,4 ммоль) и полученную в результате реакционную смесь грели при 60 С в течение ночи. Смесь распределяли между DCM (60 мл) и водой (30 мл). Органическую фазу промывали водой/насыщенным водным NaHCO3 (10:1,530 мл), водой (30 мл) и концентрировали в вакууме до объема 20 мл. 5 млDCM раствора добавляли к изопропилацетату (20 мл) при перемешивании при комнатной температуре.DCM удаляли в вакууме. Данную процедуру повторяли до те пор, пока не прибавили весь DCM раствор. Полученную в результате суспензию фильтровали, получая неочищенный дипропилкарбамоилметиловый эфир [4-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил-3 оксопропил)фенокси]уксусной кислоты в виде не совсем белого твердого остатка. Твердый остаток суспендировали в iPrOH (50 мл) и грели при 60 С в течение 3 ч. Образовывалась белая суспензия, которую охлаждали до комнатной температуры, и твердый остаток собирали фильтрацией и сушили в вакууме,получая указанное в заголовке соединение; 1 Н ЯМР (400 МГц, ДМСО-d6)8,42 (1, с), 8,36 (1 Н, с), 7,15 (2 Н, д), 6,86 (2 Н, д), 6,72 (2 Н, ушир.с),4,88 (2 Н, с), 4,81 (2 Н, с), 3,62, 3,40 (2H, м), 3,56, 3,37 (2H, м), 3,38 (2 Н, с), 3,18-3,12 (4 Н, м), 2,74 (2 Н, т),2,59 (2 Н, т), 1,67-1,54 (4 Н, м), 1,54, 1,45 (4 Н, АВ), 0,85 (3 Н, т), 0,80 (3 Н, т). ЖХ-МС Rt 5,08 мин; 672,3(121 мл, 484 ммоль) добавляли по каплям в течение 15 мин и реакционную смесь перемешивали в течение ночи. Полученный в результате желтый твердый остаток фильтровали и промывали диэтиловым эфиром. Твердый остаток суспендировали в свежем диэтиловом эфире (500 мл) и обрабатывали ультразвуком в течение 30 мин. Полученный в результате твердый остаток собирали фильтрацией и сушили в вакууме, получая указанный в заголовке продукт в виде моногидрохлорида, дидиоксанового сольвата; ЖХ-МС Rt 0,79 мин; 531,3 и 533,3 [М+Н]+, способ 2minLCv003. Стадия 2: дипропилкарбамоилметиловый эфир [4-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2 карбонилимино]-1,3,8-триазаспиро[4,5]дек-8-ил-3-оксопропил)фенокси]уксусной кислоты[4-(3-2-[(Е)-3,5-диамино-6-хлорпиразин-2-карбонилимино]-1,3,8-триазаспиро[4,5]дек-8 ил-3-оксопропил)фенокси]уксусной кислоты (стадия 1) (811 мг, 1,53 ммоль) в DMF (30 мл) обрабатывали 2-хлор-N,N-дипропилацетамидом (813 мг, 4,59 ммоль) и гидрокарбонатом натрия (808 мг, 8,92 ммоль). Реакционную смесь грели при 70 С в течение 7 дней. Реакционную смесь охлаждали до комнатной температуры и разбавляли водой (100 мл). Образовывался белый осадок, который экстрагировалиEtOAc (275 мл) и DCM (275 мл). Органические экстракты объединяли, сушили над MgSO4 и концентрировали в вакууме, получая коричневое масло. Очистка хроматографией на диоксиде кремния, элюируя градиентом 0-20% EtOH/DCM, давала желтый маслянистый остаток, который растворяли в DCM (5 мл) и фильтровали через 2 мкм шприцевой фильтр. Раствор концентрировали в вакууме до 1 мл и добавляли диэтиловый эфир (10 мл). Полученный в результате белый осадок собирали фильтрацией и сушили в вакууме при 50 С в течение ночи, получая указанное в заголовке соединение; 1 Н ЯМР (400 МГц, ДМСО-d6)9,10-7,94 (1 Н, ушир.), 8,43 (1 Н ушир.с), 8,36 (1 Н, ушир.с), 7,15 (2 Н,д), 6,96-6,45 (1 Н, ушир.с), 6,86 (2 Н, д), 6,72 (2 Н, ушир.с), 4,88 (2 Н, с), 4,81 (2 Н, с), 3,62-3,37 (4 Н, м), 3,38 Указанное в заголовке соединение получали аналогично дипропилкарбамоилметиловому эфиру [4- 29
МПК / Метки
МПК: A61K 31/497, A61P 11/00, C07D 241/26, C07D 487/10, C07D 403/12
Метки: производные, пиразиновые, качестве, блокаторов
Код ссылки
<a href="https://eas.patents.su/30-21755-pirazinovye-proizvodnye-v-kachestve-enac-blokatorov.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразиновые производные в качестве enac блокаторов</a>
Предыдущий патент: Теплоизолированная гибкая многослойная полимерная труба и трубопровод
Следующий патент: Способ транспортирования, передачи и выгрузки порошкового химического состава
Случайный патент: Выпускная труба












