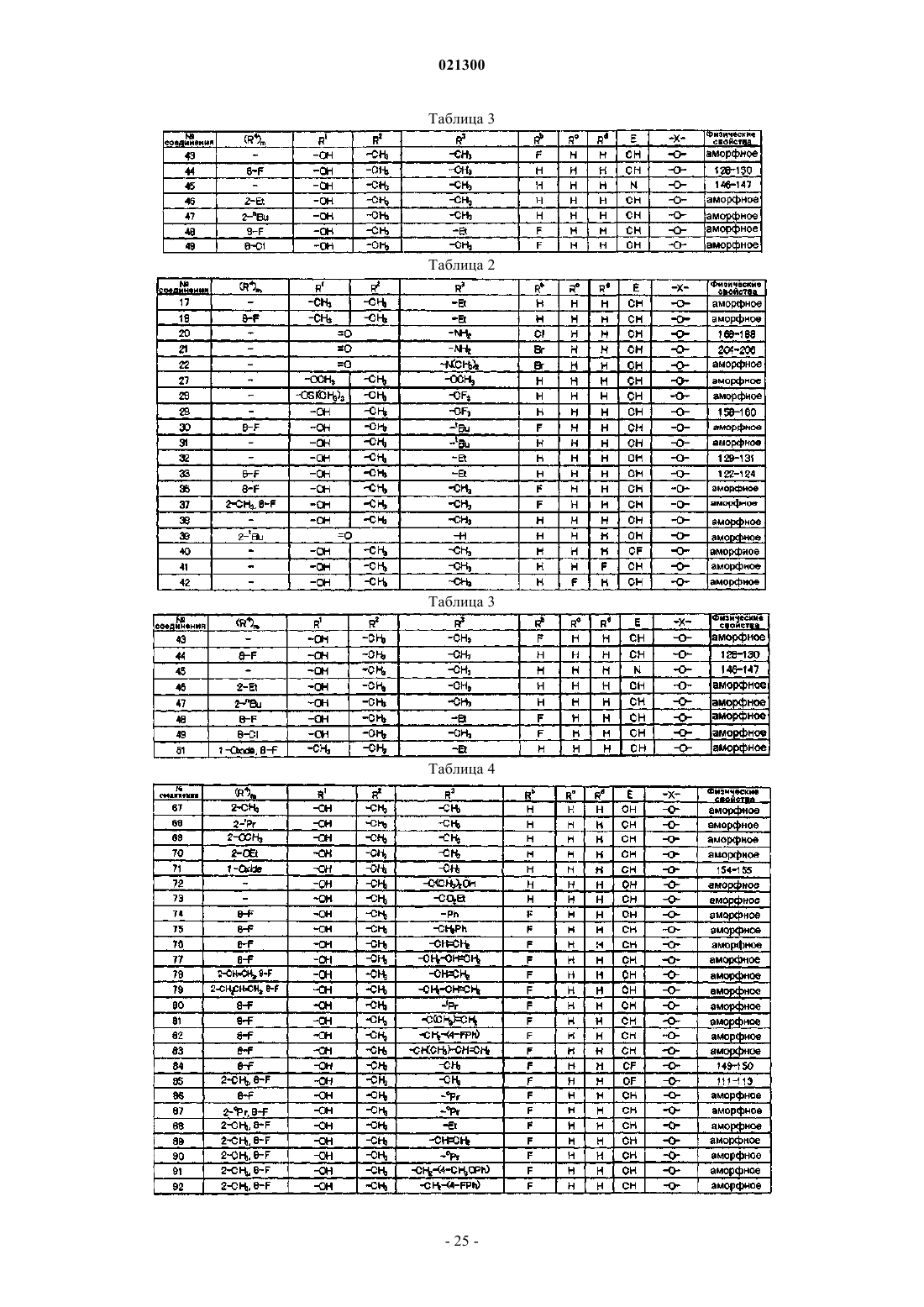
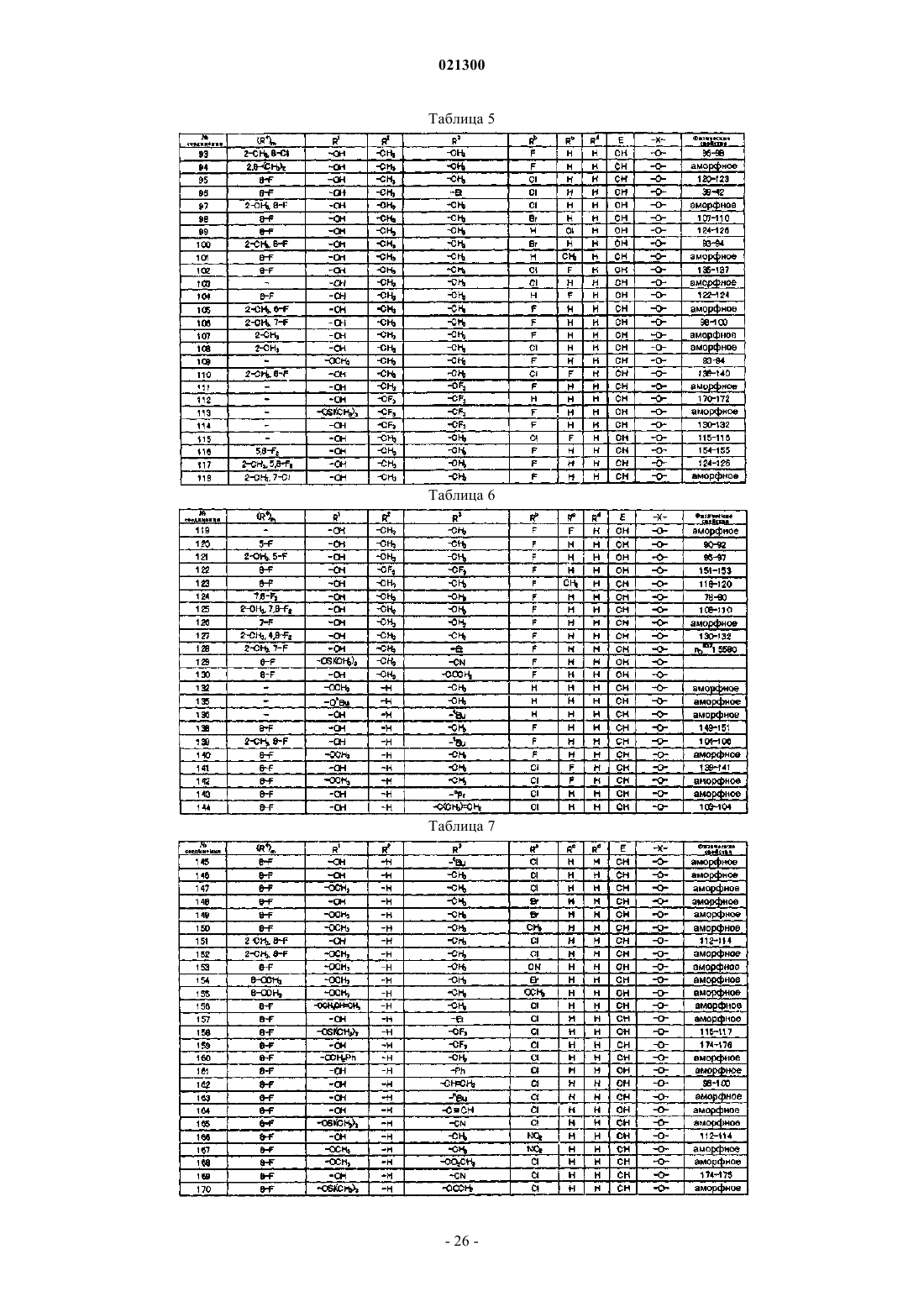
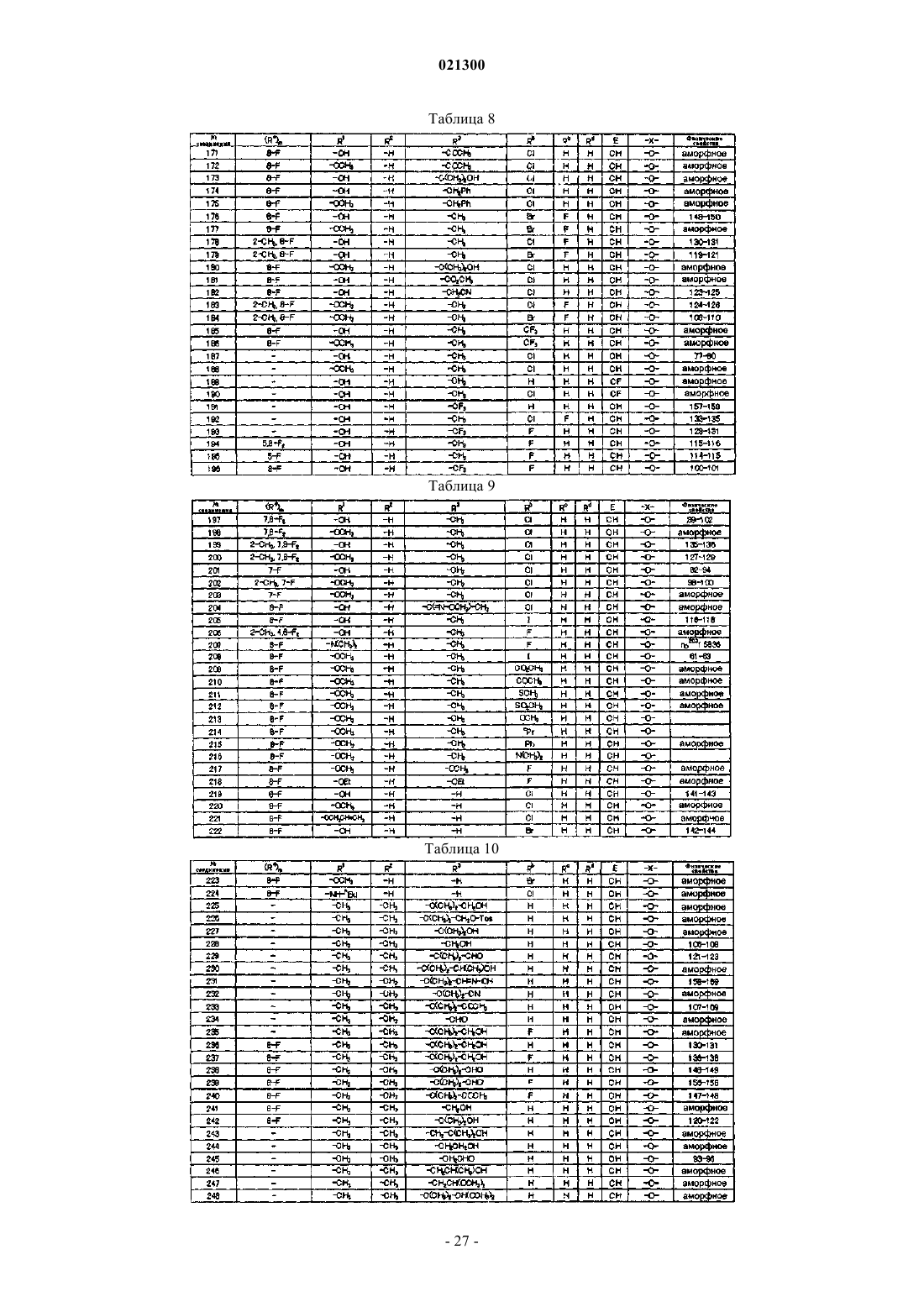
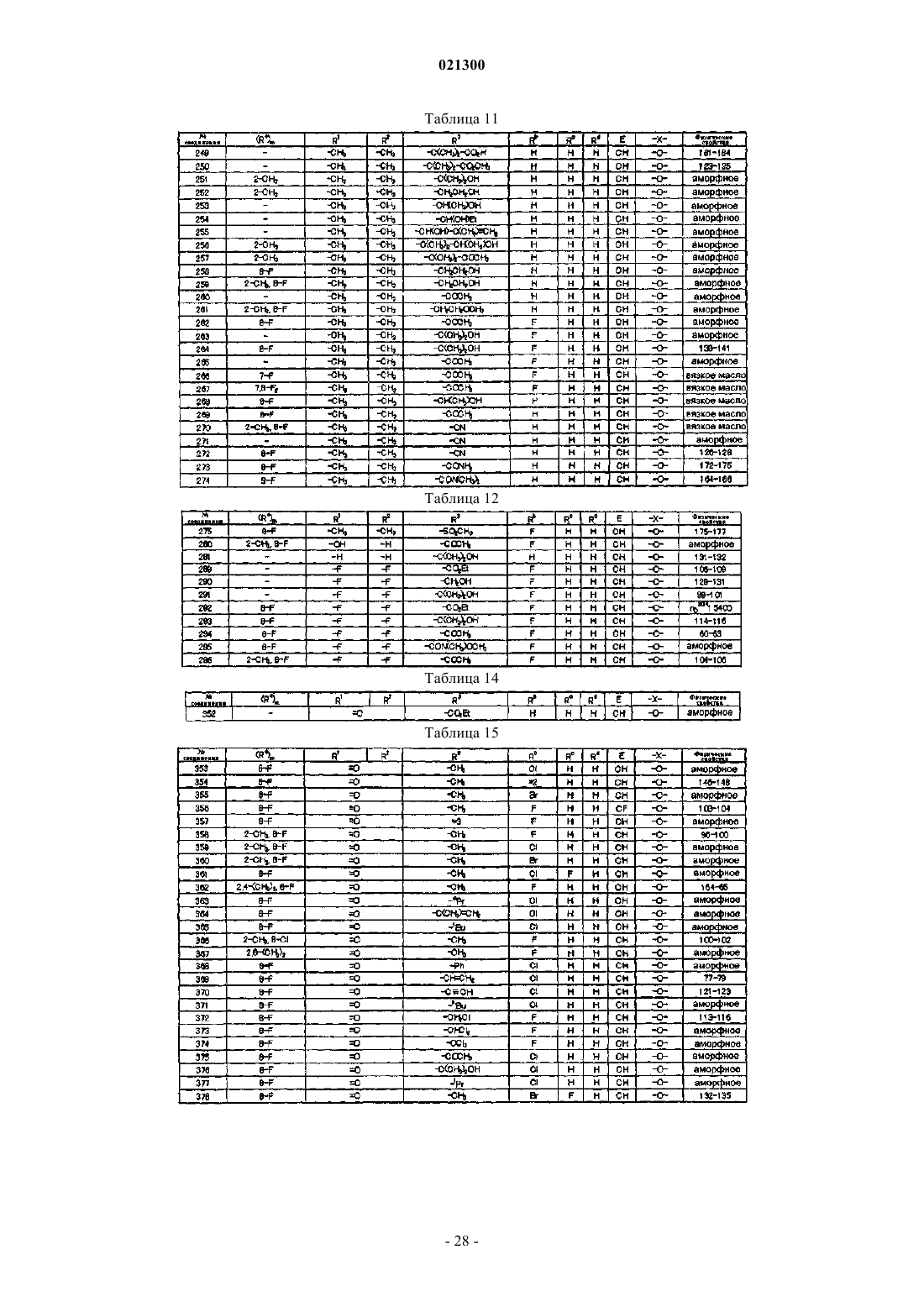
Азотсодержащее гетероциклическое соединение и сельскохозяйственный фунгицид
Номер патента: 21300
Опубликовано: 29.05.2015
Авторы: Сибаяма Котаро, Инагаки Дзун, Митани Акира, Сато Мотоаки, Нисимура Сатоси, Саики Юто, Кубоки Мами, Кувахара Раито
Формула / Реферат
1. Азотсодержащее гетероциклическое соединение, представленное формулой (II)
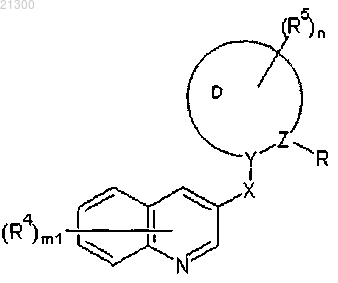
где R представляет собой группу, представленную CR1R2R3;
каждый из R1, R2 и R3 независимо представляет собой атом водорода, незамещенную или замещенную C1-8алкильную группу, незамещенную C2-8алкенильную группу, незамещенную C2-8алкинильную группу, незамещенную С3-8циклоалкильную группу, незамещенную С4-8циклоалкенильную группу, незамещенную C6-10арильную группу, незамещенную гетероциклическую группу, незамещенную C1-8ацильную группу, незамещенную (1-имино)C1-8алкильную группу, незамещенную или замещенную карбоксильную группу, незамещенную или замещенную карбамоильную группу, незамещенную или замещенную гидроксильную группу, незамещенную или замещенную аминогруппу, галогеногруппу, цианогруппу или нитрогруппу;
за исключением случая, в котором все из R1, R2 и R3 представляют собой атомы водорода; все из R1, R2 и R3 представляют собой незамещенные C1-8алкильные группы, любой из R1, R2 и R3 представляет собой атом водорода, и остальные два из них представляют собой незамещенные C1-8алкильные группы, и любой из R1, R2 и R3 представляет собой незамещенную C1-8алкильную группу, и остальные два из них представляют собой атомы водорода;
R1 и R2 могут быть соединены с образованием O=;
каждый из R4 независимо представляет собой незамещенную или замещенную C1-8алкильную группу, незамещенную C2-8алкенильную группу, незамещенную C2-8алкинильную группу, незамещенную С3-8циклоалкильную группу, незамещенную или замещенную гидроксильную группу, галогеногруппу, цианогруппу или нитрогруппу;
m1 представляет собой число радикалов R4 и равно целому числу 0-6;
каждый из R5 независимо представляет собой незамещенную или замещенную C1-8алкильную группу, незамещенную C2-8алкенильную группу, незамещенную C2-8алкинильную группу, незамещенную С3-8циклоалкильную группу, незамещенную или замещенную гидроксильную группу, галогеногруппу, цианогруппу или нитрогруппу;
n представляет собой число радикалов R5 и равно целому числу 0-5;
D представляет собой 5-7-членное углеводородное кольцо или 5-7-членное гетероциклическое кольцо;
X представляет собой атом кислорода;
Y представляет собой атом углерода;
Z представляет собой атом углерода,
замещенная C1-8алкильная группа представляет собой C3-6циклоалкил C1-6алкильную группу, C4-6циклоалкенил C1-6алкильную группу, C1-6галогеналкильную группу, C6-10арил C1-6алкильную группу, 5-6-членный гетероарил C1-6алкильную группу, гидрокси C1-6алкильную группу, C1-6алкокси C1-6алкильную группу, C1-7ацилокси C1-6алкильную группу, три C1-6алкилсилокси C1-6алкильную группу, C1-6алкилзамещенную C6-10арилсульфонилокси C1-6алкильную группу, циано C1-6алкильную группу, C1-6ацил C1-6алкильную группу, 2-гидроксиимино C2-6алкильную группу, формил C1-6алкильную группу, карбокси C1-6алкильную группу, C1-6алкоксикарбонил C1-6алкильную группу или азидо C1-6алкильную группу,
замещенная карбоксильная группа представляет собой C1-6алкоксикарбонильную группу, С2-6алкенилоксикарбонильную группу, C2-6алкинилоксикарбонильную группу, C6-10арилоксикарбонильную группу или C6-10арил C1-6алкоксикарбонильную группу,
замещенная карбамоильная группа представляет собой моно C1-6алкилкарбамоильную группу, ди C1-6алкилкарбамоильную группу или моно C6-10арилкарбамоильную группу,
замещенная гидроксльная группа представляет собой C1-6алкоксильную группу, C3-8циклоалкил C1-6алкоксильную группу, С6-10арил C1-6алкоксильную группу, C1-6галогеналкоксильную группу, C2-6алкенилоксильную группу, C2-6алкинилоксильную группу, C3-6циклоалкилоксильную группу, C6-10арилоксильную группу, С6-10арил C1-6алкилоксильную группу, С1-7ацилоксильную группу, C1-6алкоксикарбонил C1-6алкоксильную группу или три C1-6алкилсилоксильную группу,
замещенная аминогруппа представляет собой моно C1-6алкиламиногруппу, ди C1-6алкиламиногруппу, моно C1-6алкилиденаминогруппу, моно C6-10ариламиногруппу, ди C6-10ариламиногруппу, C6-10арил C1-6алкиламиногруппу, C1-6ациламиногруппу или C1-6алкоксикарбониламиногруппу,
гетероциклическая группа включает 1-4 гетероатома, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы в качестве составляющих атомов кольца,
или его соль или его N-оксидное производное.
2. Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное по п.1, где R1 представляет собой незамещенную или замещенную гидроксильную группу, R2 представляет собой атом водорода, незамещенную или замещенную C1-8алкильную группу, и R3 представляет собой атом водорода, незамещенную или замещенную C1-8алкильную группу, незамещенную C2-8алкенильную группу, незамещенную C2-8алкинильную группу, незамещенную С3-8циклоалкильную группу, незамещенную C6-10арильную группу, незамещенную гетероциклическую группу, незамещенную C1-8ацильную группу, незамещенную (1-имино) C1-8алкильную группу, C1-6алкоксикарбонильную группу, незамещенную или замещенную гидроксильную группу или цианогруппу.
3. Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное по п.1 или 2, где R4 представляет собой C1-6алкильную группу, C1-6галогеналкильную группу, C2-6алкенильную группу, C3-8циклоалкильную группу, гидроксильную группу, C1-6алкоксильную группу или галогеногруппу.
4. Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное по любому из пп.1-3, где R5 представляет собой C1-6алкильную группу, C1-6галогеналкильную группу, C6-10арил C1-6алкильную группу, С3-8циклоалкильную группу, C1-6алкоксигруппу, галогеногруппу, цианогруппу или нитрогруппу.
5. Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное по любому из пп.1-4, где азотсодержащее гетероциклическое соединение представлено формулой (III)

где каждый из R, R4, R5, m1 и X имеют такие же значения, как значения в формуле (II); и
n1 представляет собой число радикалов R5 и равно целому числу 0-4.
6. Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное по п.5, где азотсодержащее гетероциклическое соединение представляет собой 2-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-3,3-диметилбутан-2-ол, 2-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]пропан-2-ол, 2-[2-фтор-6-(8-фтор-2-метилхинолин-3-илокси)фенил]пропан-2-ол и 2-[2-фтор-6-(7,8-дифтор-2-метилхинолин-3-илокси)фенил]пропан-2-ол.
7. Сельскохозяйственный фунгицид, содержащий в качестве активного ингредиента по меньшей мере одно соединение, выбранное из группы, состоящей из азотсодержащего гетероциклического соединения, его соли и его N-оксидного производного по любому из пп.1-6.
8. Сельскохозяйственный фунгицид для обработки семян, содержащий в качестве активного ингредиента по меньшей мере одно соединение, выбранное из группы, состоящей из азотсодержащего гетероциклического соединения, его соли и его N-оксидного производного по п.1.
Текст
АЗОТСОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И СЕЛЬСКОХОЗЯЙСТВЕННЫЙ ФУНГИЦИД Предложен сельскохозяйственный фунгицид, который содержит по меньшей мере одно соединение,выбранное из группы, состоящей из нового азотсодержащего гетероциклического соединения,представленного формулой (II), его соли или его N-оксидного производного. В формуле (II) R представляет собой группу, представленную CR1R2R3, или цианогруппу. Каждый из R1-R3 независимо представляет собой атом водорода, незамещенную или замещенную C1-8 алкильную группу, незамещенную или замещенную гидроксильную группу или тому подобное. R4 или R5 представляет собой атом галогена или тому подобное.Y или Z представляет собой атом углерода или тому подобное, и D представляет собой кольцо бензола или тому подобное. X представляет собой атом кислорода. Область техники, к которой относится изобретение Настоящее изобретение относится к новым азотсодержащим гетероциклическим соединениям и сельскохозяйственному фунгициду, который содержит по меньшей мере одно соединение, выбранное из группы, состоящей из азотсодержащих гетероциклических соединений, в качестве активного ингредиента. Заявляется приоритет заявки на патент Японии 2010-000194, зарегистрированной 4 января 2010,содержание которой включается в контекст в качестве ссылки. Уровень техники При культивировании сельскохозяйственной культуры для борьбы с болезнями сельскохозяйственных культур применяют различные агенты. Однако имеется очень мало агентов, которые полностью удовлетворяют требованиям для применения в качестве агента для подавления болезни, вследствие таких аргументов, как недостаточное подавляющее болезнь действие, ограниченное применение из-за появления устойчивых к агентам патогенов, фитотоксичных или загрязняющих действий на растения или токсичности для людей, домашних животных и рыб и вредных действий на окружающую среду. Поэтому существует потребность в агентах, обладающих меньшими недостатками такого типа и которые являются безопасными для применения. В следующем патентном документе 1 или 2, близком настоящему изобретению, описаны производные хинолина, имеющие химические структуры, аналогичные соединениям согласно настоящему изобретению, и сельскохозяйственные фунгициды, содержащие производные хинолина в качестве активных ингредиентов. Документы предшествующего уровня техники Патентные документы[Патентный документ 2] проспект WO 2007/011022 Сущность изобретения Проблемы, которые разрешаются изобретением. Задачей настоящего изобретения является предоставление нового азотсодержащего гетероциклического соединения и его соли или его N-оксидного производного и сельскохозяйственного фунгицида,который обладает надежными действиями, является безопасным для применения и содержит по меньшей мере одно соединение, выбранное из группы, состоящей из азотсодержащего гетероциклического соединения, его соли и N-оксидного производного, в качестве активного ингредиента. Средства для разрешения проблем. Авторы изобретения провели интенсивные исследования для разрешения указанных выше проблем. В результате этого было получено азотсодержащее гетероциклическое соединение, его соль или его Nоксидное производное. Было также обнаружено, что азотсодержащее гетероциклическое соединение, его соль или его N-оксидное производное является приемлемым в качестве активного ингредиента сельскохозяйственного фунгицида, который обладает надежными действиями и является безопасным для применения. Настоящее изобретение было завершено дополнительными исследованиями, основанными на этих полученных данных. То есть настоящее изобретение включает в себя следующие аспекты. 1 Азотсодержащее гетероциклическое соединение, представленное формулой (II), его соль или его N-оксидное производное. В формуле (II) R представляет собой группу, представленную CR1R2R3; каждый из R1, R2 и R3 независимо представляет собой атом водорода, незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную C3-8 циклоалкильную группу, незамещенную C4-8 циклоалкенильную группу, незамещенную C6-10 арильную группу, незамещенную гетероциклическую группу, незамещенную C1-8 ацильную группу, незамещенную (1-имино)C1-8 алкильную группу, незамещенную или замещенную карбоксильную группу, незамещенную или замещенную карбамоильную группу, незамещенную или замещенную гидроксильную группу, незамещенную или замещенную аминогруппу, галогеногруппу, цианогруппу или нитрогруппу; за исключением случая, в котором все из R1, R2 и R3 представляют собой атомы водорода; все из R1,2R и R3 представляют собой незамещенные C1-8 алкильные группы; любой из R1, R2 и R3 представляет собой атом водорода, и остальные два из них представляют собой незамещенные C1-8 алкильные группы, и-1 021300 любой из R1, R2 и R3 представляет собой незамещенную C1-8 алкильную группу, и остальные два из них представляют собой атомы водорода;R1 и R2 могут быть соединены с образованием O=; каждый из R4 независимо представляет собой незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную C3-8 циклоалкильную группу, незамещенную или замещенную гидроксильную группу, галогеногруппу, цианогруппу или нитрогруппу;m1 представляет собой число радикалов R4 и равно целому числу 0-6; каждый из R5 независимо представляет собой незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 38 циклоалкильную группу, незамещенную или замещенную гидроксильную группу, галогеногруппу, цианогруппу или нитрогруппу;n представляет собой число радикалов R5 и равно целому числу 0-5;D представляет собой 5-7-членное углеводородное кольцо или 5-7-членное гетероциклическое кольцо;X представляет собой атом кислорода;Y представляет собой атом углерода; иZ представляет собой атом углерода, и замещенная C1-8 алкильная группа представляет собой C3-6 циклоалкил C1-6 алкильную группу, C4-6 циклоалкенил C1-6 алкильную группу, C1-6 галогеналкильную группу, C6-10 арил C1-6 алкильную группу, 5-6-членный гетероарил C1-6 алкильную группу, гидрокси C1-6 алкильную группу, C1-6 алкокси C1-6 алкильную группу, C1-7 ацилокси C1-6 алкильную группу, три C1-6 алкилсилокси C1-6 алкильную группу, C1-6 алкилзамещенную C6-10 арилсульфонилокси C1-6 алкильную группу,циано C1-6 алкильную группу, C1-6 ацил C1-6 алкильную группу, 2-гидроксиимино C2-6 алкильную группу,формил C1-6 алкильную группу, карбокси C1-6 алкильную группу, C1-6 алкоксикарбонил C1-6 алкильную группу или азидо C1-6 алкильную группу, замещенная карбоксильная группа представляет собой C1-6 алкоксикарбонильную группу, C2-6 алкенилоксикарбонильную группу, C2-6 алкинилоксикарбонильную группу, C6-10 арилоксикарбонильную группу или C6-10 арил C1-6 алкоксикарбонильную группу, замещенная карбамоильная группа представляет собой моно C1-6 алкилкарбамоильную группу, ди C1-6 алкилкарбамоильную группу или моно С 6-10 арилкарбамоильную группу, замещенная гидроксльная группа представляет собой C1-6 алкоксильную группу, С 3-8 циклоалкил C1-6 алкоксильную группу, С 6-10 арил C1-6 алкоксильную группу, C1-6 галогеналкоксильную группу, C2-6 алкенилоксильную группу, C2-6 алкинилоксильную группу,С 3-6 циклоалкилоксильную группу, C6-10 арилоксильную группу, C6-10 арил C1-6 алкилоксильную группу, C1-7 ацилоксильную группу, C1-6 алкоксикарбонил C1-6 алкоксильную группу или три C1-6 алкилсилоксильную группу, замещенная аминогруппа представляет собой моно C1-6 алкиламиногруппу, ди C1-6 алкиламиногруппу, моно C1-6 алкилиденаминогруппу, моно C6-10 ариламиногруппу, ди C6-10 ариламиногруппу, C6-10 арил C1-6 алкиламиногруппу, C1-6 ациламиногруппу или C1-6 алкоксикарбониламиногруппу, и гетероциклическая группа включает 1-4 гетероатома, выбранных из группы, состоящей из атома азота, атома кислорода и атома серы в качестве составляющих атомов кольца. 2 Азотсодержащее гетероциклическое соединение, представленное формулой (II), где R1 представляет собой незамещенную или замещенную гидроксильную группу, R2 представляет собой атом водорода, и R3 представляет собой атом водорода, незамещенную или замещенную C1-8 алкильную группу,незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 3-8 циклоалкильную группу, незамещенную C6-10 арильную группу, незамещенную гетероциклическую группу, незамещенную C1-8 ацильную группу, незамещенную (1-имино)C1-8 алкильную группу, C1-6 алкоксикарбонильную группу, незамещенную или замещенную гидроксильную группу или цианогруппу. 3 Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное как описано выше в 1 или 2, где R4 представляет собой C1-6 алкильную группу, C1-6 галогеналкильную группу, C2-6 алкенильную группу, C3-8 циклоалкильную группу, гидроксильную группу, C1-6 алкоксильную группу или галогеногруппу. 4 Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное описано выше в 1-3, где R5 представляет собой C1-6 алкильную группу, C1-6 галогеналкильную группу, C6-10 арил C1-6 алкильную группу, С 3-8 циклоалкильную группу, C1-6 алкокси группу, галогеногруппу, цианогруппу или нитрогруппу. 5 Азотсодержащее гетероциклическое соединение, представленное формулой (III), его соль или его N-оксидное производное. В формуле (III) каждый из R, R4, R5, m1 и X имеет такие же значения, как значения в формуле (II),-2 021300n1 представляет собой число радикалов R5 и равно целому числу 0-4. 6 Азотсодержащее гетероциклическое соединение, его соль или N-оксидное производное по п.5,где азотсодержащее гетероциклическое соединение представляет собой 2-[2-фтор-6-(8-фторхинолин-3 илокси)фенил]-3,3-диметилбутан-2-ол, 2-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]пропан-2-ол, 2-[2 фтор-6-(8-фтор-2-метилхинолин-3-илокси)фенил]пропан-2-ол и 2-[2-фтор-6-(7,8-дифтор-2 метилхинолин-3-илокси)фенил]пропан-2-ол. 7 Сельскохозяйственный фунгицид, содержащий в качестве активного ингредиента по меньшей мере одно соединение, выбранное из группы, состоящей из азотсодержащего гетероциклического соединения, его соли и его N-оксидного производного по любому из пп.1-6. Действие изобретения. Азотсодержащее гетероциклическое соединение, его соль и его N-оксидное производное согласно настоящему изобретению являются новыми соединениями, применимыми в качестве активного ингредиента сельскохозяйственного фунгицида, который обладает надежными действиями и является безопасным для применения. Сельскохозяйственный фунгицид согласно настоящему изобретению является агентом, который обладает превосходными подавляющими действиями, не вызывает фитотоксичность в растениях и обладает слабой токсичностью для людей, домашних животных и рыб или для окружающей среды. Способы осуществления изобретения В дальнейшем настоящее изобретение будет классифицировано на 1) азотсодержащее гетероциклическое соединение, представленное формулой (II), и его соль или его N-оксидное производное и 2) сельскохозяйственный фунгицид и будет описано подробно. 1) Азотсодержащее гетероциклическое соединение, представленное формулой (II), и его соль или его N-оксидное производное. Азотсодержащее гетероциклическое соединение согласно настоящему изобретению представлено формулой (II) (далее иногда называемое "соединением (II)"), предпочтительно представлено формулой(III) (далее иногда называемое "соединением (III)"). Азотсодержащим гетероциклическим соединением, его солью или его N-оксидным производным согласно настоящему изобретению может быть его гидрат, сольват, кристаллический полиморф или тому подобное. Кроме того, в азотсодержащем гетероциклическом соединении, его соли или его N-оксидном производном согласно настоящему изобретению может присутствовать асимметричный атом углерода,стереоизомеры на основе двойной связи или тому подобное или их смеси. Первым из всех будет объясняться значение "незамещенный" и "замещенный" в формулах (II) и(III). Термин "незамещенный" в настоящем описании означает, что конкретная группа образована только из группы, служащей в качестве основного центра. Когда указывается только название группы, служащей в качестве основного центра, без указания "замещенный", это означает, что группа является "незамещенной", если не указано иначе. С другой стороны, термин "замещенный" означает, что атом водорода группы, служащей в качестве основного центра, заменен заместителем, имеющим такую же структуру, как основной центр, или другую структуру. "Заместителем" является другая группа, которая связана с группой, служащей в качестве основного центра. Может быть один или несколько "заместителей". По меньшей мере два заместителя могут быть одинаковыми или разными. Такие термины, как "C1-6" или тому подобные, указывают, что число атомов углерода в группе,служащей в качестве основного центра, составляет 1-6 или тому подобное. Число атомов углерода не включает в себя атомы углерода в заместителе. Например, бутильная группа, имеющая эпоксигруппу в качестве заместителя, рассматривается как С 2 алкокси-С 4 алкильная группа."Заместитель", конкретно, но ограничивают при условии, что он является химически приемлемым и обладает действиями настоящего изобретения. Примеры "заместителя" включают в себя атом галогена, такой как атом фтора, атом хлора, атом брома или атом иода; C1-6 алкильную группу, такую как метильная группа, этильная группа, нпропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа или н-гексильная группа; C3-6 циклоалкильную группу, такую как циклопропильная группа, циклобутильная группа, циклопентильная группа или циклогексильная группа; C2-6 алкенильную группу, такую как винильная группа, 1-пропенильная группа, 2 пропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-метил-2 пропенильная группа, 2-метил-2-пропенильная группа, 1-пентенильная группа, 2-пентенильная группа,3-пентенильная группа, 4-пентенильная группа, 1-метил-2-бутенильная группа, 2-метил-2-бутенильная группа, 1-гексенильная группа, 2-гексенильная группа, 3-гексенильная группа, 4-гексенильная группа и 5-гексенильная группа; C3-6 циклоалкильную группу, такую как 2-циклопропенильная группа, 2 циклопентенильная группа или 3-циклогексенильная группа; C2-6 алкинильную группу, такую как этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-метил-2-пропинильная группа, 2-метил-3-бутинильная группа, 1-3 021300C1-6 алкоксигруппу, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа,н-бутоксигруппа, втор-бутоксигруппа, изобутоксигруппа или трет-бутоксигруппа; C2-6 алкенилоксигруппу, такую как винилоксигруппа, аллилоксигруппа, пропенилоксигруппа или бутенилоксигруппа, С 2-6 алкинилоксигруппу, такую как этинилоксигруппа или пропаргилоксигруппа; C6-10 арильную группу, такую как фенильная группа или нафтильная группа; C6-10 арилоксигруппу, такую как феноксигруппа или 1 нафтоксигруппа; C7-11 аралкильную группу, такую как бензильная группа или фенетильная группа; C7-11 аралкилоксигруппу, такую как бензилоксигруппа или фенетилоксигруппа; C1-7 ацильную группу, такую как формильная группа, ацетильная группа, пропионильная группа, бензоильная группа или циклогексилкарбонильная группа; C1-7 ацилоксигруппу, такую как формилоксигруппа, ацетилоксигруппа, пропионилоксигруппа, бензоилоксигруппа или циклогексилкарбонилоксигруппа; C1-6 алкоксикарбонильную группу, такую как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутоксикарбонильная группа и трет-бутоксикарбонильная группа; карбоксильную группу; гидроксильную группу; оксогруппу; C1-6 галогеналкильную группу, такую как хлорметильная группа, хлорэтильная группа, трифторметильная группа, 1,2-дихлор-н-пропильная группа, 1-фтор-нбутильная группа или перфтор-н-пентильная группа; C2-6 галогеналкенильную группу, такую как 2-хлор 1-пропенильная группа или 2-фтор-1-бутенильная группа; C2-6 галогеналкинильную группу, такую как 4,4-дихлор-1-бутинильная группа, 4-фтор-1-пентинильная группа или 5-бром-2-пентинильная группа;C1-6 галогеналкоксигруппу, такую как 2-хлор-н-пропоксигруппа или 2,3-дихлорбутоксигруппа; C2-6 галогеналкенилоксигруппу, такую как 2-хлорпропенилоксигруппа или 3-бромбутенилоксигруппа; C6-10 галогенарильную группу, такую как 4-хлорфенильная группа, 4-фторфенильная группа или 2,4-дихлорфенильная группа; C6-10 галогенарилоксигруппу, такую как 4-фторфенилоксигруппа или 4-хлор-1 нафтоксигруппа; C1-7 галогенацильную группу, такую как хлорацетильная группа, трифторацетильная группа, трихлорацетильная группа или 4-хлорбензоильная группа; цианогруппу; изоцианогруппу; нитрогруппу; изоцианатную группу; цианатную группу; азидогруппу, аминогруппу; C1-6 алкиламиногруппу, такую как метиламиногруппа, диметиламиногруппа или диэтиламиногруппа; C6-10 ариламиногруппу, такую как анилиногруппа или нафтиламиногруппа; C7-11 аралкиламиногруппу, такую как бензиламиногруппа или фенилэтиламиногруппа; C1-7 ациламиногруппу, такую как формиламиногруппа, ацетиламиногруппа, пропаноиламиногруппа, бутириламиногруппа, изопропилкарбониламиногруппа или бензоиламиногруппа; C1-6 алкоксикарбониламиногруппу, такую как метоксикарбониламиногруппа, этоксикарбониламиногруппа, н-пропоксикарбониламиногруппа или изопропоксикарбониламиногруппа; карбамоильную группу; замещенную карбамоильную группу, такую как диметилкарбамоильная группа, фенилкарбамоильная группа или N-фенил-N-метилкарбамоильная группа; иминоС 1-6 алкильную группу, такую как иминометильная группа, (1-имино)этильная группа или (1 имино)-н-пропильная группа; гидроксииминоС 1-6 алкильную группу, такую как гидроксииминометильная группа, (1-гидроксиимино)этильная группа или (1-гидроксиимино)пропильная группа; C1-6 алкоксииминоС 1-6 алкильную группу, такую как метоксииминометильная группа или (1-метоксиимино)этильная группа; 5-членную гетероарильную группу, такую как пирролильная группа, фурильная группа, тиенильная группа, имидазолильная группа, пиразолильная группа, оксазолильная группа, изоксазолильная группа,тиазолильная группа, изотиазолильная группа, триазолильная группа, оксадиазолильная группа, тиадиазолильная группа или тетразолильная группа; 6-членную гетероарильную группу, такую как пиридильная группа, пиразинильная группа, пиримидинильная группа, пиридазинильная группа или триазинильная группа; насыщенную гетероциклическую группу, такую как азиридинильная группа, эпоксигруппа,пирролидинильная группа, тетрагидрофуранильная группа, пиперидильная группа, пиперазинильная группа или морфолинильная группа; триС 1-6 алкилсилильную группу, такую как триметилсилильная группа, триэтилсилильная группа или трет-бутилдиметилсилильная группа; трифенилсилильную группу и тому подобное."Заместитель" может иметь другой "заместитель".[R] R представляет собой группу, представленную CR1R2R3, каждый из R1, R2 и R3 независимо представляет собой атом водорода, незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 3-8 циклоалкильную группу, незамещенную С 4-8 циклоалкенильную группу, незамещенную C6-10 арильную группу, незамещенную гетероциклическую группу, незамещенную C1-8 ацильную группу, незамещенную или замещенную (1-имино)C1-8 алкильную группу, незамещенную или замещенную карбоксильную группу, незамещенную или замещенную карбамоильную группу, незамещенную или замещенную гидроксильную группу, незамещенную или замещенную аминогруппу, галогеногруппу, цианогруппу или нитрогруппу. Однако не имеется случаев, в которых все из R1, R2 и R3 представляют собой атомы водорода. Кроме того, не имеется случаев, в которых все из R1, R2 и R3 представляют собой незамещенные C1-8 алкиль-4 021300 ные группы. К тому же, когда любой из R1, R2 и R3 представляет собой атом водорода, не имеется случаев, в которых остальные два представляют собой незамещенные C1-8 алкильные группы. Кроме того, когда любой из R1-R3 представляет собой C1-8 алкильную группу, не имеется случаев, в которых остальные два представляют собой атомы водорода."C1-8 Алкильная группа" представляет собой насыщенный углеводород, имеющий 1-8 атомов углерода. C1-8 Алкильная группа может иметь неразветвленную цепь или разветвленную цепь. Примеры C1-8 алкильной группы включают в себя метильную группу, этильную группу, н-пропильную группу, нбутильную группу, н-пентильную группу, н-гексильную группу, н-гептильную группу, н-октильную группу, изопропильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу,изопентильную группу, неопентильную группу, 2-метилбутильную группу, 2,2-диметилпропильную группу, изогексильную группу и тому подобное. Среди них предпочтительной является C1-6 алкильная группа. Примеры "замещенной C1-8 алкильной группы" включают в себя циклоалкильную группу, такую как циклопропилметильная группа, 2-циклопропилэтильная группа,циклопентилметильная группа или 2-циклогексилэтильная группа, предпочтительно C3-6 циклоалкилС 1-6 алкильная группа; циклоалкенилалкильную группу, такую как циклопентенилметильная группа, 3-циклопентенилметильная группа, 3-циклогексенилметильная группа или 2-(3-циклогексенил)этильная группа, предпочтительно C4-6 циклоалкенилС 1-6 алкильная группа; галогеналкильную группу, такую как фторметильная группа, хлорметильная группа, бромметильная группа, дифторметильная группа, дихлорметильная группа, дибромметильная группа, трифторметильная группа, трихлорметильная группа, трибромметильная группа, 2,2,2-трифторэтильная группа,2,2,2-трихлорэтильная группа, пентафторэтильная группа, 4-фторбутильная группа, 4-хлорбутильная группа, 3,3,3-трифторпропильная группа, 2,2,2-трифтор-1-трифторметилэтильная группа, перфторгексильная группа, перхлоргексильная группа, перфтороктильная группа, перхлороктильная группа, 2,4,6 трихлоргексильная группа, перфтордецильная группа или 2,2,4,4,6,6-гексахлороктильная группа, предпочтительно C1-6 галогеналкильная группа; арилалкильную группу (аралкильную группу), такую как бензильная группа, фенетильная группа,3-фенилпропильная группа, 1-нафтилметильная группа или 2-нафтилметильная группа, предпочтительноC6-10 арилС 1-6 алкильная группа; гетероарилалкильную группу, такую как 2-пиридилметильная группа, 3-пиридилметильная группа,4-пиридилметильная группа, 2-(2-пиридил)этильная группа, 2-(3-пиридил)этильная группа, 2-(4-пиридил)этильная группа, 3-(2-пиридил)пропильная группа, 3-(3-пиридил)пропильная группа, 3-(4-пиридил)пропиьная группа, 2-пиразинилметильная группа, 3-пиразинилметильная группа, 2-(2-пиразинил)этильная группа, 2-(3-пиразинил)этильная группа, 3-(2-пиразинил)пропильная группа, 3-(3-пиразинил)пропильная группа, 2-пиримидилметильная группа, 4-пиримидилметильная группа, 2-(2-пиримидил)этильная группа, 2-(4-пиримидил)этильная группа, 3-(2-пиримидил)пропильная группа, 3-(4 пиримидил)пропильная группа, 2-фурилметильная группа, 3-фурилметильная группа, 2-(2 фурил)этильная группа, 2-(3-фурил)этильная группа, 3-(2-фурил)пропильная группа или 3-(3 фурил)пропильная группа, предпочтительно 5- или 6-членный гетероарилС 1-6 алкильная группа; гидроксиалкильную группу, такую как гидроксиметильная группа, 1-гидроксиэтильная группа, 2 гидроксиэтильная группа, 1-гидроксипропильная группа, 3-гидроксипропильная группа, 1-гидрокси-1 метилэтильная группа, 2-гидрокси-1,1-диметилэтильная группа, 2-гидрокси-1,1-диметилпропильная группа или 2-гидрокси-2-метилпропильная группа, предпочтительно гидроксилС 1-8 алкильная группа; алкоксиалкильную группу, такую как метоксиметильная группа, этоксиметильная группа, 2 метоксиэтильная группа, 2-этоксиэтильная группа, метокси-н-пропильная группа, н-пропоксиметильная группа, изопропоксиэтильная группа, втор-бутоксиметильная группа, трет-бутоксиэтильная группа, 2,2 диметоксиэтильная группа или 2,2-диметокси-1,1-диметилэтильная группа, предпочтительно C1-6 алкоксиC1-6 алкильная группа; ацилоксиалкильную группу, такую как формилоксиметильная группа, ацетоксиметильная группа,2-ацетоксиэтильная группа, пропионилоксиметильная группа или пропионилоксиэтильная группа, предпочтительно C1-7 ацилоксиС 1-6 алкильная группа; триалкилсилилоксиалкильную группу, такую как триметилсилилоксиметильная группа или третбутилдиметилсилилоксиметильная группа, предпочтительно триС 1-6 алкилсилилоксиС 1-6 алкильная группа; арилсульфонилоксиалкильную группу, такую как тозилоксиметильная группа или 2-тозилокси-1,1 диметилэтильная группа, предпочтительно C1-6 алкилзамещенная C6-10 арилсульфонилоксиС 1-6 алкильная группа; цианоалкильную группу, такую как цианометильная группа, 2-цианоэтильная группа или 1-циано 1-метилэтильная группа, предпочтительно цианоС 1-6 алкильная группа; ацилалкильную группу, такую как формилметильная группа, 2-формилэтильная группа, 3 формилпропильная группа, 1-формил-1-метилэтильная группа, 2-формил-1,1-диметилэтильная группа,-5 021300 ацетилметильная группа, 2-ацетилэтильная группа, 3-ацетилпропильная группа, 1-ацетил-1 метилэтильная группа или 2-ацетил-1,1-диметилэтильная группа, предпочтительно С 1-6 ацилС 1-8 алкилС 1-6 алкильная группа; 2-гидроксииминоалкильную группу, такую как 2-гидроксииминоэтильная группа, 2-гидроксиимино-1-метилэтильная группа, 2-гидрокси-1,1-диметилэтильная группа или 2-гидроксииминопропильная группа, предпочтительно 2-гидроксииминоС 2-6 алкильная группа; ацилалкильную группу, такую как ацетилметильная группа, 2-ацетилэтильная группа, 3-ацетилпропильная группа, 1-ацетил-1-метилэтильная группа или 2-ацетил-1,1-диметилэтильная группа, предпочтительно формилС 1-6 алкильная группа; карбоксиалкильную группу, такую как карбоксиметильная группа, 2-карбоксиэтильная группа, 3 карбоксипропильная группа, 1-карбокси-1-метилэтильная группа или 1-карбокси-1,1-диметилэтильная группа, предпочтительно карбоксиС 1-6 алкильная группа; алкоксикарбонилалкильную группу, такую как метоксикарбонилметильная группа, 2-метоксикарбонилэтильная группа, 3-метоксикарбонилпропильная группа, 1-метоксикарбонил-1-метилэтильная группа или 2-метоксикарбонил-1,1-диметилэтильная группа, предпочтительно C1-6 алкоксикарбонилС 1-6 алильная группа; азидоалкильную группу, такую как азидометильная группа, 2-азидоэтильная группа или 1-азидо-1 метилэтильная группа, предпочтительно азидоС 1-6 алкильная группа, и тому подобное."C2-8 Алкенильная группа" представляет собой ненасыщенную углеводородную группу, включающую в себя 2-8 атомов углерода и содержащую по меньшей мере одну углерод-углеродную двойную связь. C2-6 Алкенильная группа может иметь неразветвленную цепь или разветвленную цепь. Примеры C28 алкенильной группы включают в себя винильную группу, 1-пропенильную группу, изопропенильную группу, аллильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, 1 пентенильную группу, 2-пентенильную группу, 3-пентенильную группу, 4-пентенильную группу, 1 гексенильную группу, 2-гексенильную группу, 3-гексенильную группу, 4-гексенильную группу, 5 гексенильную группу, 1-гептенильную группу, 6-гептенильную группу, 1-октенильную группу, 7 октенильную группу, 1-метилаллильную группу, 2-метилаллильную группу, 1-метил-2-бутенильную группу, 2-метил-2-бутенильную группу и тому подобное. Среди них предпочтительной является С 2-6 алкенильная группа."C2-8 Алкинильная группа" представляет собой ненасыщенную углеводородную группу, включающую в себя 2-8 атомов углерода и содержащую по меньшей мере одну углерод-углеродную тройную связь. C2-6 Алкинильная группа может иметь неразветвленную цепь или разветвленную цепь. ПримерыC2-8 алкинильной группы включают в себя этинильную группу, 1-пропинильную группу, пропаргильную группу, 1-бутинильную группу, 2-бутинильную группу, 3-бутинильную группу, 1-пентинильную группу,2-пентинильную группу, 3-пентинильную группу, 4-пентинильную группу, 1-гексинильную группу, 1 метил-2-пропинильнуюую группу, 2-метил-3-бутинильную группу, 1-метил-2-бутинильную группу, 2 метил-3-пентинильную группу, 1,1-диметил-2-бутинильную группу и тому подобное. Среди них предпочтительной является C2-6 алкинильная группа."С 3-8 Циклоалкильная группа" представляет собой алкильную группу, включающую в себя 3-8 атомов углерода и содержащей циклическую часть. Примеры С 3-8 циклоалкильной группы включают в себя циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу,циклогептильную группу, циклооктильную группу и тому подобное. Среди них предпочтительной является C3-6 циклоалкильная группа."С 4-8 Циклоалкенильная группа" является алкенильной группой, включающей в себя 4-8 атомов углерода и содержащей циклическую часть. Примеры С 4-8 циклоалкенильной группы включают в себя 1 циклобутенильную группу, 1-циклопентенильную группу, 3-циклопентенильную группу, 1 циклогексенильную группу, 3-циклогексенильную группу, 3-циклогептенильную группу, 4 циклооктенильную группу и тому подобное."C6-10 Арильная группа" является моноциклической или полициклической арильной группой, имеющей 6-10 атомов углерода. В полициклической арильной группе, если по меньшей мере одно кольцо является ароматическим кольцом, другим кольцом(ами) может быть любое из насыщенного алициклического кольца, ненасыщенного алициклического кольца и ароматического кольца. Примеры C6-10 арильной группы включают в себя фенильную группу, нафтильную группу, азуленильную группу, инденильную группу, инданильную группу, тетралинильную группу и тому подобное. Среди них предпочтительной является фенильная группа."Гетероциклическая группа" включает в себя 1-4 гетероатома(ов), выбранные из группы, состоящей из атома азота, атома кислорода и атома серы в качестве составляющих кольцо атома(ов). Гетероциклическая группа может быть моноциклической или полициклической. Примеры гетероциклической группы включают в себя 5-членную гетероарильную группу, 6 членную гетероарильную группу, конденсированную гетероарильную группу, насыщенную гетероциклическую группу, частично ненасыщенную гетероциклическую группу и тому подобное. Примеры 5-членной гетероарильной группы включают в себя пирролильную группу, такую как пиррол-1-ильная группа, пиррол-2-ильная группа или пиррол-3-ильная группа; фурильную группу, такую как фуран-2-ильная группа или фуран-3-ильная группа; тиенильную группу, такую как тиофен-2 ильная группа или тиофен-3-ильная группа; имидазолильную группу, такую как имидазол-1-ильная группа, имидазол-2-ильная группа, имидазол-4-ильная группа или имидазол-5-ильная группа; пиразолильную группу, такую как пиразол-1-ильная группа, пиразол-3-ильная группа, пиразол-4-ильная группа или пиразол-5-ильная группа; оксазолильную группу, такую как оксазол-2-ильная группа, оксазол-4 ильная группа или оксазол-5-ильная группа; изоксазолильную группу, такую как изоксазол-3-ильная группа, изоксазол-4-ильная группа или изоксазол-5-ильная группа; тиазолильную группу, такую как тиазол-2-ильная группа, тиазол-4-ильная группа или тиазол-5 ильная группа; изотиазолильную группу, такую как изотиазол-3-ильная группа, изотиазол-4-ильная группа или изотиазол-5-ильная группа; триазолильную группу, такую как 1,2,3-триазол-1-ильная группа,1,2,3-триазол-4-ильная группа, 1,2,3-триазол-5-ильная группа, 1,2,4-триазол-1-ильная группа, 1,2,4 триазол-3-ильная группа или 1,2,4-триазол-5-ильная группа; оксадиазолильную группу, такую как 1,2,4 оксадиазол-3-ильная группа, 1,2,4-оксадиазол-5-ильная группа или 1,3,4-оксадиазол-2-ильная группа; тиадиазолильную группу, такую как 1,2,4-тиадиазолил-3-ильная группа, 1,2,4-тиадиазолил-5-ильная группа или 1,3,4-тиадиазолил-2-ильная группа; тетразолильную группу, такую как тетразол-1-ильную группу или тетразол-2-ильную группу, и тому подобное. Примеры 6-членной гетероарильной группы включают в себя пиридильную группу, такую как пиридин-2-ильная группа, пиридин-3-ильная группа или пиридин-4-ильная группа; пиразинильную группу,такую как пиразин-2-ильная группа или пиразин-3-ильная группа; пиримидинильную группу, такую как пиримидин-2-ильная группа, пиримидин-4-ильная группа или пиримидин-5-ильная группа; пиридазинильную группу, такую как пиридазин-3-ильная группа или пиридазин-4-ильная группа; триазинильную группу и тому подобное. Примеры конденсированной гетероарильной группы включают в себя индол-1-ильную группу, индол-2-ильную группу, индол-3-ильную группу, индол-4-ильную группу, индол-5-ильную группу, индол 6-ильную группу, индол-7-ильную группу; бензофуран-2-ильную группу, бензофуран-3-ильную группу,бензофуран-4-ильную группу, бензофуран-5-ильную группу, бензофуран-6-ильную группу, бензофуран 7-ильную группу; бензотиофен-2-ильную группу, бензотиофен-3-ильную группу, бензотиофен-4-ильную группу, бензотиофен-5-ильную группу, бензотиофен-6-ильную группу, бензотиофен-7-ильную группу; бензоимидазол-1-ильную группу, бензоимидазол-2-ильную группу, бензоимидазол-4-ильную группу,бензоимидазол-5-ильную группу; бензоксазол-2-ильную группу, бензоксазол-4-ильную группу, бензоксазол-5-ильную группу, бензотиазол-2-ильную группу, бензотиазол-4-ильную группу, бензотиазол-5 ильную группу, хинолин-2-ильную группу, хинолин-3-ильную группу, хинолин-4-ильную группу, хинолин-5-ильную группу, хинолин-6-ильную группу, хинолин-7-ильную группу, хинолин-8-ильную группу и тому подобное. Примеры другой гетероциклической группы включают в себя 3-членное насыщенное гетероциклическое кольцо, такое как азиридин-1-ильная группа, азиридин-2-ильная группа или оксиранильная группа; 5-членное насыщенное гетероциклическое кольцо, такое как пирролидин-1-ильная группа, пирролидин-2-ильная группа, пирролидин-3-ильная группа, тетрагидрофуран-2-ильная группа, тетрагидрофуран 3-ильная группа или [1,3]диоксиран-2-ильная группа; 6-членное насыщенное гетероциклическое кольцо,такое как пиперидин-1-ильная группа, пиперидин-2-ильная группа, пиперидин-3-ильная группа, пиперидин-4-ильная группа, пиперазин-1-ильная группа, пиперазин-2-ильная группа, морфолин-2-ильная группа, морфолин-3-ильная группа или морфолин-4-ильная группа; 1,3-бензодиоксол-4-ильную группу, 1,3 бензодиоксол-5-ильную группа, 1,4-бензодиоксан-5-ильную группу, 1,4-бензодиоксан-6-ильную группу,3,4-дигидро-2 Н-1,5-бензодиоксепин-6-ильную группу, 3,4-дигидро-2 Н-1,5-бензодиоксепин-7-ильную группу, 2,3-дигидробензофуран-4-ильную группу, 2,3-дигидробензофуран-5-ильную группу, 2,3 дигидробензофуран-6-ильную группу или 2,3-дигидробензофуран-7-ильную группу и тому подобное."C1-8 Ацильная группа" представляет собой группу, у которой атом водорода, C1-7 алкильная группа,С 2-7 алкенильная группа, С 2-7 алкинильная группа, С 6-7 арильная группа или 5-7-членная гетероциклическая группу связана с карбонильной группой. Примеры C1-8 ацильной группы включают в себя формильную группу; алкилкарбонильную группу,такую как ацетильная группа, пропионильная группа, н-пропилкарбонильная группа, н-бутилкарбонильная группа, пентаноильная группа, валерильная группа, октаноильная группа, изопропилкарбонильная группа, изобутилкарбонильная группа, пивалоильная группа или изовалерильная группа, предпочтительно C1-6 алкилкарбонильная группа; алкенилкарбонильную группу, такую как акрилоильная группа или метакрилоильная группа, предпочтительно С 2-6 алкенилкарбонильная группа; алкинилкарбонильную группу, такую как пропиолоильную группу, предпочтительно C2-6 алкинилкарбонильная группа; арилкарбонильную группу, такую как бензоильная группа; гетероциклическую карбонильную группу, такую как 2-пиридилкарбонильная группа или тиенилкарбонильная группа, и тому подобное."(1-Имино)C1-8 алкильная группа" представляет собой иминометильную группу или группу, в которой C1-7 алкильная группа связана с иминометильной группой. Примеры (1-имино)C1-8 алкильной группы включают в себя иминометильную группу, (1-имино)этильную группу, (1-имино)пропильную группу, (1-7 021300 имино)бутильную группу, (1-имино)пентильную группу, (1-имино)гексильную группу, (1 имино)гептильную группу и тому подобное. Среди них предпочтительной является (1-имино)C1-6 алкильная группа."Замещенная карбоксильная группа" представляет собой группу, в которой C1-6 алкильная группа,C2-6 алкенильная группа, C2-6 алкинильная группа, C6-10 арильная группа, C6-10 арилС 1-6 алкильная группа или 5-6-членная гетероциклическая группа связана с карбонильной группой. Примеры "замещенной карбоксильной группы" включают в себя алкоксикарбонильную группу, такую как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа,изопропоксикарбонильная группа, н-бутоксикарбонильная группа, изобутоксикарбонильная группа,трет-бутоксикарбонильная группа, н-пентилоксикарбонильная группа или н-гексилоксикарбонильная группа, предпочтительно C1-6 алкоксикарбонильная группа; алкенилоксикарбонильную группу, такую как винилоксикарбонильная группа или аллилоксикарбонильная группа, предпочтительно C2-6 алкенилоксикарбонильная группа; алкинилоксикарбонильную группу, такую как этинилоксикарбонильная группа или пропаргилоксикарбонильная группа, предпочтительно C2-6 алкинилоксикарбонильная группа; арилоксикарбонильную группу, такую как феноксикарбонильная группа или нафтоксикарбонильная группа, предпочтительно C6-10 арилоксикарбонильная группа; аралкилоксикарбонильную группу, такую как бензилоксикарбонильная группа, предпочтительно"Замещенная карбамоильная группа" представляет собой группу, в которой C1-6 алкильная группа,C2-6 алкенильная группа, C2-6 алкинильная группа, С 6-10 арильная группа, C6-10 арилС 1-6 алкильная группа или 5-6-членная гетероциклическая группа связана с карбамоильной группой. Примеры "замещенной карбамоильной группы" включают в себя моноалкилкарбамоильную группу или диалкилкарбамоильную группу, такую как метилкарбамоильная группа, этилкарбамоильная группа,диметилкарбамоильная группа или диэтилкарбамоильная группа, предпочтительно моноС 1-6 алкилкарбамоильная группа или диС 1-6 алкилкарбамоильная группа; моноарилкарбамоильную группу, такую как фенилкарбамоильная группа или 4-метилфенилкарбамоильная группа, предпочтительно моноС 6-10 арилкарбамоильная группа, и тому подобное. Примеры "замещенной гидроксильной группы" включают в себя алкоксигруппу, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, н-бутоксигруппа, н-пентилоксигруппа, н-гексилоксигруппа,децилоксигруппа, додецилоксигруппа, лаурилоксигруппа, изопропоксигруппа, изобутоксигруппа, вторбутоксигруппа, трет-бутоксигруппа, 1-этилпропоксигруппа, изогексилоксигруппа, 4-метилпентоксигруппа, 3-метилпентоксигруппа, 2-метилпентоксигруппа, 1-метилпентоксигруппа, 3,3-диметилбутоксигруппа, 2,2-диметилбутоксигруппа, 1,1-диметилбутоксигруппа, 1,2-диметилбутоксигруппа, 1,3-диметилбутоксигруппа, 2,3-диметилбутоксигруппа, 1-этилбутоксигруппа или 2-этилбутоксигруппа, предпочтительно C1-6 алкоксигруппа; циклоалкилалкоксигруппу, такую как циклопропилметилоксигруппа или 2-циклопентилэтилоксигруппа, предпочтительно С 3-8 циклоалкилС 1-6 алкоксигруппа; аралкилоксигруппу, такую как бензилоксигруппа, предпочтительно C6-10 арилС 1-6 алкоксигруппа; галогеналкоксигруппу, такую как хлорметоксигруппа, дихлорметоксигруппа, трихлорметоксигруппа, трифторметоксигруппа, 1-фторэтоксигруппа, 1,1-дифторэтоксигруппа, 2,2,2-трифторэтоксигруппа или пентафторэтоксигруппа, предпочтительно C1-6 галогеналкоксигруппа; аленилоксигруппу, такую как винилоксигруппа, 1-пропенилоксигруппа, аллилоксигруппа, 1-бутенилоксигруппа, 2-бутенилоксигруппа, 3 бутенилоксигруппа, 1-пентенилоксигруппа, 2-пентенилоксигруппа, 3-пентенилоксигруппа, 4-пентенилоксигруппа, 1-гексенилоксигруппа, 2-гексенилоксигруппа, 3-гексенилоксигруппа, 4-гексенилоксигруппа, 5-гексенилоксигруппа, 1-метил-2-пропенилоксигруппа, 2-метил-2-пропенилоксигруппа, 1 метил-2-бутенилоксигруппа или 2-метил-2-бутенилоксигруппа, предпочтительно C2-6 алкенилоксигруппа; алкинилоксигруппу, такую как этинилоксигруппа, пропинилоксигруппа, пропаргилоксигруппа, 1 бутинилоксигруппа, 2-бутинилоксигруппа, 3-бутинилоксигруппа, 1-пентинилоксигруппа, 2-пентинилоксигруппа, 3-пентинилоксигруппа, 4-пентинилоксигруппа, 1-гексинилоксигруппа, 1-метил-2-пропинилоксигруппа, 2-метил-3-бутинилоксигруппа, 1-метил-2-бутинилоксигруппа, 2-метил-3-пентинилоксигруппа или 1,1-диметил-2-бутинилоксигруппа, предпочтительно С 2-6 алкинилоксигруппа; циклоалкилоксигруппу, такую как циклопропилоксигруппа, циклобутилоксигруппу, циклопентилоксигруппа, циклогексилоксигруппа, циклогептилоксигруппа, циклооктилоксигруппа, 2-метилциклопропилоксигруппа,2-этилциклопропилоксигруппа, 2,3,3-триметилциклобутилоксигруппа, 2-метилциклопентилоксигруппа,2-этилциклогексилоксигруппа, 2-этилциклооктилоксигруппа, 4,4,6,6-тетраметилциклогексилоксигруппа или 1,3-дибутилциклогексилоксигруппа, предпочтительно C3-6 циклоалкилоксигруппа; арилоксигруппу, такую как фенилоксигруппа, нафтилоксигруппа, азуленилоксигруппа, инденилоксигруппа, инданилоксигруппа или тетралинилоксигруппа, предпочтительно C6-10 арилоксигруппа; арилалкилоксигруппу (аралкилоксигруппу), такую как бензилоксигруппа, фенетилоксигруппа или 2-нафтилметоксигруппа, предпочтительно C6-10 арилС 1-6 алкилоксигруппа; ацилоксигрупу, такую как ацетилоксигруппа, пропионилоксигруппа, н-пропилкарбонилоксигруппа,-8 021300 изопропилкарбонилоксигруппа, н-бутилкарбонилоксигруппа, изобутилкарбонилоксигруппа, пентаноилоксигруппа или пивалоилоксигруппа, предпочтительно C1-7 ацилоксигруппа; алкоксикарбонилалкилоксигруппу, такую как метоксикарбонилметилоксигруппа или 1-метоксикарбонил-1-метилэтилоксигруппа, предпочтительно C1-6 алкоксикарбонилС 1-6 алкоксигруппа; триалкилсилилоксигруппу, такую как триметилсилилоксигруппа или трет-бутилдиметилсилилоксигруппа, предпочтительно три-С 1-6 алкилсилилоксигруппа; и тому подобное. Примеры "замещенной аминогруппы" включают в себя алкиламиногруппу, такую как метиламиногруппа, этиламиногруппа, н-пропиламиногруппа, н-бутиламиногруппа, диметиламиногруппа или диэтиламиногруппа, предпочтительно моноС 1-6 алкиламиногруппа или диС 1-6 алкиламиногруппа; моноС 1-6 алкилиденаминогруппу, такую как метилиденаминогруппа или этилиденаминогруппа; моноариламиногруппу, такую как фениламиногруппа или 4-метилфениламиногруппа, предпочтительно моноС 6-10 ариламиногруппа; диариламиногруппу, такую как ди-1-нафтиламиногруппа, предпочтительно диС 6-10 ариламиногруппа; аралкиламиногруппу, такую как бензиламиногруппа, предпочтительноC6-10 арилС 1-6 алкиламиногруппа; ациламиногруппу, такую как ацетиламиногруппа, трифторацетиламиногруппа или бензоиламиногруппа, предпочтительно C1-6 ациламиногруппа; алкоксикарбониламиногруппу,такую как метоксикарбониламиногруппа или третбутоксикарбониламиногруппа, предпочтительно C1-6 алкоксикарбониламиногруппа; и тому подобное. Примеры " галогеногруппы" включают в себя атом фтора, атом хлора, атом брома, атом иода и тому подобное. В качестве предпочтительной комбинации групп, представленной CR1R2R3, может быть включена следующая комбинация.R1 представляет собой незамещенную или замещенную гидроксильную группу;R2 представляет собой атом водорода или незамещенную или замещенную C1-8 алкильную группу; иR3 представляет собой атом водорода, незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 3-8 циклоалкильную группу, незамещенную C6-10 арильную группу, незамещенную гетероциклическую группу,незамещенную C1-8 ацильную группу, незамещенную (1-имино)C1-8 алкильную группу, незамещенную или замещенную C1-8 алкоксикарбонильную группу, незамещенную или замещенную гидроксильную группу или цианогруппу. В качестве предпочтительного примера можно включить также следующую комбинацию.R1 представляет собой незамещенную или замещенную C1-8 алкильную группу;R2 представляет собой незамещенную или замещенную C1-8 алкильную группу; иR3 представляет собой замещенную C1-8 алкильную группу, незамещенную С 2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 3-8 циклоалкильную группу, незамещеннуюC6-10 арильную группу, незамещенную гетероциклическую группу, незамещенную C1-8 ацильную группу,незамещенную (1-имино)C1-8 алкильную группу, незамещенную или замещенную C1-8 алкоксикарбонильную группу, незамещенную или замещенную карбамоильную группу или цианогруппу.R1 и R2 могут быть соединены с образованием O=.[R4] Каждый R4 независимо представляет собой незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 3-8 циклоалкильную группу, незамещенную или замещенную гидроксильную группу, галогеногруппу,цианогруппу или нитрогруппу. Группы, представленные R4, могут быть такими же, как примеры, указанные в группах, представленных R1-R3. В формулах (II) и (III) m1 представляет собой число радикалов R4 и равно целому числу 0-6.R4 предпочтительно представляет собой C1-6 алкильную группу, C1-6 галогеналкильную группу, C2-6 алкенильную группу, С 3-8 циклоалкильную группу, гидроксильную группу, C1-8 алкоксигруппу или галогеногруппу.[R5] Каждый R5 независимо представляет собой незамещенную или замещенную C1-8 алкильную группу, незамещенную C2-8 алкенильную группу, незамещенную C2-8 алкинильную группу, незамещенную С 3-8 циклоалкильную группу, незамещенную или замещенную гидроксильную группу, галогеногруппу,цианогруппу или нитрогруппу. Группы, представленные R5, могут быть такими же, как примеры, указанные в группах, представленных R1-R3. В формуле (II) n представляет собой число радикалов R5 и равно целому числу 0-5. В формуле (III) n1 представляет собой число радикалов R5 и равно числу 0-4.R5 предпочтительно представляет собой C1-6 алкильную группу, C1-6 галогеналкильную группу, C6-10 арилС 1-6 алкильную группу, С 3-8 циклоалкильную группу, C1-6 алкоксигруппу, галогеноргуппу, цианогруппу или нитрогруппу.[D] D представляет собой 5-7-членное углеводородное кольцо или 5-7-членное гетероциклическое кольцо. Примеры 5-7-членного углеводородного кольца и 5-7-членного гетероциклического кольца включают в себя ароматическое углеводородное кольцо, такое как кольцо бензола; кольцо С 5-7 циклоалкена, такое как кольцо циклопентена, кольцо циклогексена, кольцо циклогептена; ароматическое 5-7 членное гетероциклическое кольцо, такое как кольцо фурана, кольцо тиофена, кольцо пиррола, кольцо имидазола, кольцо пиразола, кольцо тиазола, кольцо оксазола, кольцо изоксазола, кольцо пиридина,кольцо пиразина, кольцо пиримидина, кольцо пиридазина, кольцо азепина или кольцо диазепина; ненасыщенное 5-7-членное гетероциклическое кольцо, такое как кольцо дигидро-2 Н-пирана, кольцо дигидро 2 Н-тиопирана или кольцо тетрагидропиридина, и тому подобное. Среди них предпочтительным является ароматическое углеводородное кольцо и более предпочтительным является кольцо бензола, и среди них предпочтительным является ароматическое углеводородное кольцо и более предпочтительным является кольцо бензола. То есть более предпочтительно, чтобы соединением согласно настоящему изобретению было соединение (III).[X, Y, Z] X представляет собой атом кислорода. Y представляет собой атом углерода. Z представляет собой атом углерода. Предпочтительно, чтобы оба из Y и Z были атомами углерода и D был ароматическим кольцом, которое включает в себя как Y, так и Z. Соль или N-оксидное соединение согласно настоящему изобретению конкретно не ограничивают,при условии, что такое соединение является сельскохозяйственно приемлемой солью или N-оксидным соединением. Примеры соли включают в себя соль неорганической кислоты, такой как хлористоводородная кислота или серная кислота; соль органической кислоты, такой как уксусная кислота или молочная кислота; соль щелочного металла, такого как литий, натрий или калий; соль щелочно-земельного металла, такого как кальций или магний; соль переходного металла, такого как железо или медь; соль органического основания, такого как аммиак, триэтиламин, трибутиламин, пиридин или гидразин, и тому подобное.(Получение соединения согласно настоящему изобретению.) Соединение согласно настоящему изобретению можно получить согласно следующим способам синтеза.(В формулах R, R4, R5, D, X, Y, Z, m1 и n имеют такие же значения, как значения, описанные выше.Q представляет собой атом галогена). Соединение, представленное формулой (II), можно получить реакцией соединения, представленного формулой (1), и соединения, представленного формулой (2), общепринятыми способами. Согласно настоящему изобретению, 7,8-дифтор-3-иодхинолин является применимым промежуточным продуктом.(В формулах R, R4, R5, D, X, Y, Z, m1 и n имеют такие же значения, как значения, описанные выше.) Соединение, представленное формулой (II), можно получить реакцией соединения, представленного формулой (3), и соединения, представленного формулой (4), общепринятыми способами. Согласно настоящему изобретению, 8-фтор-3-гидроксихинолин, 7,8-дифтор-3-гидроксихинолин, 8 фтор-3-гидрокси-2-метилхинолин или 7,8-дифтор-3-гидрокси-2-метилхинлин является применимым промежуточным продуктом.(В формулах R, R4, R5, D, X, Y, Z, m1 и n имеют такие же значения, как значения, описанные выше. М представляет собой литий или магний.) Соединение, представленное формулой (5), получают литиированием или образованием комплекса с магнием с применением алкиллитиевого реагента или реактива Гриньяра или синтезированного комплекса, полученного из алкиллитиевого реагента или реактива Гриньяра, и затем к продукту добавляют соединение, представленное формулой (6), получая при этом соединение, представленное формулой (7). Примеры алкиллитиевого реагента, применяемого при литиировании, включают в себя метиллитий,н-бутиллитий, втор-бутиллитий, трет-бутиллитий и тому подобное. Примеры реактива Гриньяра, применяемого при получении комплекса магния, включают в себя метилмагнийхлорид, этилмагнийхлорид, н-бутилмагнийхлорид, изопропилмагнийхлорид и тому подобное. Кроме того, можно применять синтезированный комплекс, полученный из н-бутилмагнийхлорида и нбутиллития. Растворитель, применяемый при литиировании или образовании комплекса магния, конкретно не ограничивают, при условии, что он образует безводную реакционную систему без растворения соединения, которое реагирует с соединением лития или магния или проявляет любое конкретное взаимодействие с ними. Подходящие примеры его включают в себя растворитель на основе алкана, такой как пентан,гексан, гептан, изопар (зарегистрированный товарный знак) Е или изопар (зарегистрированный товарный знак) G; растворитель на основе ароматического углеводорода, такой как бензол, толуол или ортоксилол; растворитель на основе простого эфира, такой как диэтиловый простой эфир или тетрагидрофуран; и их смесь. Среди них предпочтительным является растворитель на основе простого эфира, такой как диэтиловый простой эфир или тетрагидрофуран. Реакцию можно проводить в атмосфере азота и в безводной системе и при температуре от -10 до -78C.(В формулах R4, R5, D, X, Y, Z, m1 и n имеют такие же значения, как значения, описанные выше. R1' и R из числа указанных выше R1, R2 и R3 представляют собой незамещенную или замещенную алкильную группу, незамещенную алкенильную группу, незамещенную алкинильную группу, незамещенную арильную группу или незамещенное гетероциклическое кольцо. Hal представляет собой галогеногруппу.). Соединение, представленное формулой (10), можно получить реакцией эквивалента реактива Гриньяра с соединением, представленным формулой (9). Кроме того, соединение, представленное формулой(11), можно получить реакцией по меньшей мере двух эквивалентов реактива Гриньяра с соединением,представленным формулой (9).(В формулах R4, R5, R2', D, X, Y, Z, m1, n и Hal имеют такие же значения, как значения, описанные выше. G представляет собой уходящую группу, такую как алкоксигруппа или атом галогена). Соединение, представленное формулой (13), можно получить реакцией одного эквивалента реактива Гриньяра с соединением, представленным формулой (12). Кроме того, соединение, представленное формулой (14), можно получить реакцией по меньшей мере двух эквивалентов реактива Гриньяра с соединением, представленным формулой (12).(В формулах R4, R5, D, X, Y, Z, m1 и n имеют такие же значения, как значения, описанные выше. J представляет собой алкоксикарбонильную группу или цианогруппу. K1 и K2 представляют собой алкильную группу). Соединение, представленное формулой (16), можно получить гидролизом с применением общепринятых способов. Кроме того, соединение, представленное формулой (17), можно получить реакцией с(В формулах R, R4, R5, D, X, Y, Z, m1, n и Hal имеют такие же значения, как значения, описанные выше. R4' представляет собой незамещенную или замещенную алкоксигруппу, незамещенную или замещенную алкильную группу, незамещенную или замещенную алкенильную группу, незамещенную или замещенную алкинильную группу, незамещенную или замещенную арильную группу или незамещенное или замещенное гетероциклическое кольцо, незамещенную или замещенную аминогруппу или незамещенную или замещенную тиоалкильную группу).N-Оксидное соединение, представленное формулой (19), можно получить окислением соединения,представленного формулой (18), с применением обычных способов, таких как способы с применением окисляющего агента. Соединение, представленное формулой (20), можно получить реакцией обычного галогенирующего агента, такого как оксихлорид фосфора, с соединением, представленным формулой(19). И затем соединение, представленное формулой (20), подвергают реакции нуклеофильного замещения или реакции сочетания с применением металлорганического катализатора для синтеза соединения,представленного формулой (21).(В формулах R, R4, R5, D, X, Y, Z, m1 и n имеют такие же значения, как значения, описанные выше.R' представляет собой C1-8 алкильную группу. М представляет собой щелочной металл, такой как литий,натрий или калий. L представляет собой атом галогена). Соединение, представленное формулой (II), можно получить реакцией сочетания Сузуки производного бороновой кислоты, представленной формулой (22) или формулой (23), с галогенидным производным, представленным формулой (24).N-Оксидное соединение можно получить общепринятой реакцией окисления. Например, в растворителях или в отсутствие растворителей его можно получить контактированием соединения, представленного формулой (II), и пероксида, такого как пероксид водорода. В любой реакции после того, как реакция завершена, образовавшийся продукт подвергают обычной послереакционной операции в органической синтетической химии с последующим, если необходимо,общепринятым разделением и очисткой для эффективного выделения желаемого продукта. Структуру желаемого продукта можно идентифицировать и подтвердить с применением измерений 1 Н ЯМР-спектра, ИК-спектра или масс-спектра или элементным анализом или тому подобного. 2) Сельскохозяйственный фунгицид. Сельскохозяйственный фунгицид согласно настоящему изобретению содержит в качестве его активного ингредиента по меньшей мере одно соединение, выбранное из группы, состоящей из азотсодержащего гетероциклического соединения, его соли и его N-оксидного соединения. Фунгицид согласно настоящему изобретению обладает превосходной фунгицидной способностью в пределах большого диапазона филаментозных грибов, таких как бактерии, который относятся к Oomycetes, Ascomycetes, Deuteromycetes или Basidomycetes. Фунгицид согласно настоящему изобретению можно применять для предотвращения различных болезней, которые имеют место при культивировании сельскохозяйственных культур, включающих в себя цветы, газоны и злаки посредством обработки семян, опрыскивания листьев, внесения в почву или применения погружением. Например, его можно применяют для предотвращения появления у сахарной свеклы: пятнистости листьев (Cercospora beticola), черной гнили корней (Aphanomycescochlloides), корневой гнили (Thanatephorus cucumeris), гнили листьев (Thanatephorus cucumeris); арахиса: бурой пятнистости листьев (Mycosphaerella arachidis), черной ржавчины (Mycosphaerellaberkeleyi); огурцов: настоящей мучнистой росы (Sphaerotheca fuliginea), ложной мучнистой росы (Pseudoperonospora cubensis), черной микосфереллезной гнили (Mycospherella melonis), увядания (Fusarium oxysporum), склеротиниозной гнили (Sclerotinia sclerotiorum), серой гнили (Botrytis cinerea), антракноза(Colletotrichum orbiculare), парши (Cladosporium cucumerinum), "мишеневой" пятнистости листьев (Corynespora cassicola), черной ножки (Pythium debaryanam, Rhizoctonia solani Kuhn), бактериальной пятнистости (Pseudomonas syringae pv. Lecrymans); томатов: серой гнили (Botrytis cinerea), плесени листвы (Cladosporium fulvum), фитофторозной гнили корней (Phytophthora infestans); баклажанов: серой гнили (Botrytis cinerea), черной гнили (Corynespora melongenae), настоящей мучнистой росы (Erysiphe cichoracearum), чернящей плесени (Mycovellosiella nattrassii), земляники (клубники): серой гнили (Botrytis cinerea), настоящей мучнистой росы (Sohaerotheca Humuli), антракнозы (Colletotrichum acutatum, Colletotrichum fragariae), фитофторозной корневой гнили (Phytophthora cactorum); лука: серой шейковой плесневой гнили (Botrytis allii), серой гнили (Botrytis cinerea), повреждения листьев (Botrytis squamosa), ложной мучнистой росы (Peronospora destructor); капусты: килы (Plasmodiophora brassicae), мокрой гнили (Erwinia carotovora), ложной мучнистой росы (Peronospora parasitica); фасоли обыкновенной: склеротиниозной гнили (Sclerotinia sclerotiorum), серой гнили (Botrytis cinerea); яблок: настоящей мучнистой росы (Podosphaera leucotricha), парши (Venturia inaequalis), монилиозной болезни (Monilinia mali), пятнистости плодов фруктов Brooks (Mycosphaerella pomi), коричневого рака плодовых деревьев (Valsa mali), пятнистости Alternaria (Alternaria mali), решетчатой ржавчины яблок (Gymnosporangium), белой гнили (Botryosphaeria berengeriana), антракронзома (Glomerella cingulata,Collectotrichum acutatum), марсонинозной пятнистости (Diplocarpon mali), "мукоседа" яблок (Zygophialajamaicensis), сажистой пятнистости (Gloeodes pomigena); хурмы: настоящей мучностой росы (Phyllactinia kakicola), антракноза (Gloeosporium kaki), угловатой пятнистости листьев (Cercospora kaki); персика обыкновенного: бурой гнили (Monilinia fructicola), парши (Cladosporium carpophilum), фомозной бактериальной гнили (Phomopsis sp.); вишни: бурой гнили (Monilinia fructicola); винограда: серой гнили (Botrytis cinerea), настоящей мучностой росы (Unicinula necator), гломереллезной гнили ягод винограда (Glomerella cingulata, Colletorichum acutatum), ложной мучнистой росы(Plasmopara viticola), гнили первоцвета мучнистого (Elsinoe ampelina), пятнистости листьев (Pseudocercospora vitus), черной гнили (Guignardia bidwellii); груши: парши (Venturia nashicola), решетчатой ржавчины яблонь (Gymnosporangium asiaticum), пятнистости листьев (Alternaria kikuchiana), черной гнили (Botryosphaeria berenengeriana), настоящей мучнистой росы (Phyllactinia mali); чайного куста: гниения шейки куста (Pestalotia theae), антракноза (Colletotrichum theae-sinensis); цитрусов: парши (Elsinoe fawcetti), голубой гнили (Penicillium italicum), зеленой гнили (Penicilliumcampestris pv. Citri); пшеницы: настоящей мучнистой росы (Erysiphe graminis f.sp.tritici), Petch (Gibberella zeae), ржавчины листьев (Puccinia recondita), коричневого туфулеза злаковых трав (Pythium iwayamai), красного туфулеза злаковых трав (Monographella nivalis), черной пятнистости (pseudocercosporella herpotrichoides), повреждения листьев (Septoria tritici), септориоза колосковой чешуи пшеницы (Leptosphaeria nodorum), туфулеза (Typhula incarnata), склеротиниоза (Myriosclerotinia borealis), офиоболеза (Gaeumanomyces graminis); ячменя: полосатой пятнистости (Pyrenophora grarainea), ринхоспориозной пятнистости листьевgraminicolum), бактериоза (Xanthoraonas oryzae), бактериальной черной ножки (Burkholderia plantarii),желто-бурой пятнистости листьев злаковых трав (Acidovorax avenae), бактериальной гнили зерна(Burkholderia glumae); табака: склеротиниозной гнили (Sclerotinia sclerotiorum), настоящей мучнистой росы (Erysipheasphanidermatum); ежи сборной: настоящей мучнистой росы (Erysiphe graminis); сои культурной: альтернариоза (Cercospora kikuchii), ложной мучнистой росы (Peronospora Manshurica), стеблевой гнили (Phytophthora sojae); картофеля и томатов: фитофториозной гнили корней (phytophthora infestans); или тому подобное. Кроме того, фунгицид согласно настоящему изобретению проявляет также превосходное фунгицидное действие на резистентные бактерии. Примеры резистентных бактерий включают в себя бактерии серой гнили (Botrytis cinerea), бактерии бурой пятнистости сахарной свеклы (Cercospora beticola), бактерии парши яблок (Venturia inaequalis), бактерии парши груши (Venturia nashicola), резистентные к фунгициду на основе бензимидазола, такому как тиофанатметил, беномил или карбендазим, бактерии серой гнили (Botrytis cinerea), резистентные к фунгициду на основе дикарбоксимида (такого как винклозолин,процимидон или ипродион) и тому подобное. Примеры болезней, при которых применение фунгицида согласно настоящему изобретению является более предпочтительным, включают в себя паршу яблок, серую гниль огурцов, настоящую мучнистую росу пшеницы, фитофтороз томатов, листовую ржавчину пшеницы, шейковую гниль риса, вертициллезную болезнь огурцов и тому подобное. Кроме того, фунгицид согласно настоящему изобретению является агентом с низкой фитотоксичностью, низкой токсичность для рыб или теплокровных животных и высокой безопасностью. Фунгицид согласно настоящему изобретению можно применять в сельскохозяйственно приемлемой форме, то есть в форме агрохимического препарата, такого как диспергируемый в воде порошок, гранулы, порошок, эмульсия, водорастворимый порошок, суспензия или диспергируемые в воде гранулы. Примеры добавки и носителя, применяемых в твердом препарате, включают в себя растительный порошок, такой как соевая мука или пшеничная мука; минеральный тонкоизмельченный порошок, такой как диатомит, апатит, гипс, тальк, бентонит, пирофилит или глина; органическое или неорганическое соединение, такое как бензоат натрия, мочевина или сульфат натрия, и тому подобное. Примеры растворителя, применяемого в жидком препарате, включают в себя ароматический углеводород, такой как керосин, ксилол или ароматический углеводород на нефтяной основе; циклогексан,циклогексанон, диметилформамид, диметилсульфоксид, спирт, ацетон, трихлорэтилен, метилизобутилкетон, минеральное масло, растительное масло, воду и тому подобное. Кроме того, если необходимо, в препараты для достижения их однородной и стабильной формы можно добавить поверхностно-активное вещество. Поверхностно-активное вещество, которое можно добавить, конкретно не ограничивают. Примеры поверхностно-активного вещества включают в себя неионогенное поверхностно-активное вещество, такое как алкилфениловый эфир полиоксиэтилена, алкиловый эфир полиоксиэтилена, эфир, образованный полиоксиэтиленом и высшей жирной кислотой, эфир, образованный полиоксиэтиленсорбитаном и высшей жирной кислотой, тристирилфениловый эфир полиоксиэтилена; соль эфира, образованного серной кислотой и алкилфениловым простым эфиром полиоксиэтилена, соль эфира серной кислоты и высшего спирта, алкилнафталинсульфонат, поликарбоксилат, лигнинсульфонат, продукт конденсации формальдегида с алкилнафталинсульфонатом, сополимер изобутилена и безводной малеиновой кислотой и тому подобное. Таким образом полученный диспергируемый в воде порошок, эмульсия, сыпучий агент, водорастворимый порошок или диспергируемые в воде гранулы разбавляют водой до заданной концентрации и применяют в виде раствора, суспензии или эмульсии для разбрызгивания на растения. Кроме того, порошок и гранулы применяют непосредственно распылением на растения в их исходной форме. Количество фунгицида согласно настоящему изобретению обычно составляет относительно общего количества препарата предпочтительно 0,01-90 мас.% и более предпочтительно 0,05-85 мас.%. Норма внесения фунгицида согласно изобретению, хотя и различается в зависимости от погодных условий, формы препарата, времени внесения, способа внесения, площади внесения, целевой подавляемой болезни или возделываемой сельскохозяйственной культуры, она обычно составляет в виде количества активного ингредиента на гектар 1-1000 г, предпочтительно 10-100 г. Когда диспергируемый в воде порошок, эмульсию, суспензию, водорастворимый порошок или диспергируемые в воде гранулы разбавляют водой, применяемая концентрация составляет 1-1000 м.д.,предпочтительно 10-250 м.д. Фунгицид согласно настоящему изобретению можно смешивать с другими фунгицидами или смесью инсектициды/акарициды или синергистами. Репрезентативные примеры других фунгицидов, инсектицидов, акарицидов и регуляторов роста растений, которые можно смешивать и применять с фунгицидом согласно настоящему изобретению,указаны ниже. Фунгицид: ряда бензоимидазола, такой как беномил, карбендазим, фуберидазол, тиабендазол или тиофанат-метил;QiI-фунгицид (Qi-ингибитор), такой как циазофамид; бензамид, такой как зоксамид; энопиранурон, такой как бластицидин, милдиомицин; гексопиранозил, такой как казугамицин; глюкопираноцил, такой как стрептомицин, валидамицин; цианоацетамид, такой как цимоксанил; карбамат, такой как пропамокарб, протиокарб или поликарбамат; несочетающий агент, такой как бинапакрил, динокап, феримзон или флуазинам; оловоорганическое соединение, такое как ацетат трифенилолова, хлорид трифенилолова или гидроксид трифенилолова; органофосфат, такой как фосфорная кислота, толклофос-метил или фосетил; фталамовая кислота, такая как техлофталам; бензотриазин, такой как триазоксид; бензолсульфонамид, такой как флусульфамид; пиридазинон, такой как дикломезин; САА-фунгицид (амид карбоновой кислоты), такой как диметоморф, флуморф, бентиаваликарб, ипроваликарб или мандипропамид; тетрациклин, такой как окситетрациклин; тиокарбамат, такой как метасульфокарб, или другие соединения, такие как этридиазол, полиоксин,оксолиновая кислота, гидроксиизоксазол, октинолин, силтиофам, дифлуметорим, ацибензолар-S-метил,пробеназол, тиадинил, этабоксам, цифлуфенамид, прохиназид, метрафенон, флуопиколид, гидроксид меди(II), медьорганическое соединение, сера, фербам, манзеб, манеб, метирам, пропинеб, тиурам, зинеб,зирам, каптан, каптафол, фолпет, хлороталонил, дихлофлуанид, толилфлуанид, додин, гуазатин, иминоктадин, анилазин, дитианон, хлорпикрин, дизомет, метам-натрий, хинометионат, ципрофурам, силтиофам,арго-бактериум или фторимид. Инсектициды и акарициды. Инсектициды ряда фосфорорганических соединений и ряда карбаматов: фентион, фенитротион, диазинон, хлорпирифос, ESP, вамидотион, фентоат, диметоат, формотион, малатон, трихлорхон, тиометон,фосмет, дихлорвос, ацефат, ЕРВР, метилпаратион, оксидеметон-метил, этион, салитион, цианофос, изоксатион, пиридафентион, фосалон, метидатион, сульпрофос, хлорфенвинфос, тетрахлорвинфос, диметилвинфос, пропафос, изофенфос, этилтиометон, профенофос, пираклофос, монокротофос, азинфосметил, альдикарб, метомил, тиодикарб, карбофуран, карбосульфан, бенфуракарб, фуратиокарб, пропоксур, ВРМС, МТМС, MIPC, карбарил, пиримикарб, этиофенкарб, феноксикарб, EDDP или тому подобное. Инсектициды ряда пиретроидов: перметрин, циперметрин, делтаметрин, фенвалерат,- 15021300 фенпропатрин, пиретрин, аллетрин, тетраметрин, резметрин, диметрин, пропатрин, фенотрин, протрин,флувалинат, цифлутрин, цигалотрин, флуцитринат, этофенпрокс, цикропротрин, тралометрин, силафлуофен, брофенпрокс, акринатрин или тому подобное. Другие инсектициды ряда бензоилмочевины: микробные агрохимикаты, такие как дифлубензурон,хлорфлуазурон, гексафлумурон, трифлумурон, тетрабензурон, флуфеноксурон, флуциклоксурон, бупрофезин, пирипроксифен, метопрен, бензоепин, диафентиурон, ацетамиприд, имидаклоприд, нитенпирам,фипронил, картап, тиоциклам, бенсултап, никотинсульфат, ротенон, метальдегид, машинное масло, ВТ,патогенные для несекомых вирусы или тому подобное. Нематоциды: фенамифос, фостиазат или тому подобное. Акарициды: хлорбензилат, фенисобромолат, дикофол, амитраз, BPPS, бензомат, гекситиазокс, фенбутатина оксид, полинактины, хинометионат, CPCBS, тетрадифон, авермектин, милбемектин, клофентезин, цигексатин, пиридабен, фенпироксимат, тебуфенпирад, пиримидифен, фенотиокарб, диенохлор или тому подобное. Регулятор роста растений: абсцизовая кислота, индолмасляная кислота, униконазол, этилхлозат,этефон, клоксифонак, хлормекват, экстракт хлореллы, кальция пероксид, цианамид, дихлорпроп, гиббереллин, даминозид, дециловый спирт, тринексапак-этил, мепиквата хлорид, паклобутразол, парафин,воск, пиперонилбутоксид, пирафлуфен-этил, флурпримидол, прогидрожасмон, прогексадион-кальций,бензиламинопурин, пендиметалин, форхлорфенурон, калиевая соль гидразида малеиновой кислоты, 1 нафтилацетамид, 4-СРА, МСРВ, коррин, оксихинолина сульфат, этихлозат, бутралин, 1 метилциклопропен, авиглицина гидрохлорид. Примеры Далее настоящее изобретение описано более подробно обращением к примерам, однако, настоящее изобретение ни в малейшей степени не ограничивается следующими примерами. Пример 1. Синтез 1-[2-(хинолин-3-илокси)фенил]этанона 0,73 г 3-хинолинола, 1,8 г карбоната цезия, 0,18 г дипивалоилметана, 2,0 г 2-бромацетофенона и 0,50 г хлорида меди(I) растворяли в 10 мл N-метилпирролидона и смесь перемешивали в течение 3 ч при 130C. Образовавшийся продукт очищали колоночной хроматографией на силикагеле и получали 0,82 г 1-[2-(хинолин-3-илокси)фенил]этанона (соединение номер 1). Соединения, представленные соединениями номеров 2-13, синтезировали таким же способом, как способ примера 1. Ссылочный пример 2. Синтез 2-(2-трет-бутилфенокси)хинолина 0,60 г 2-трет-бутилфенола, 1,3 г карбоната цезия, 0,07 г дипивалоилметана, 0,42 г 3-бромхинолина и 0,20 г хлорида меди(I) растворяли в 4 мл N-метилпирролидона и смесь перемешивали в течение одного дня при 130C. Образовавшийся продукт очищали колоночной хроматографией на силикагеле и получали 0,04 г 3-(2-трет-бутилфенокси)хинолина (соединение номер 14). Соединения, представленные соединениями номеров 15-19, синтезировали таким же способом, как способ примера 2. Пример 3. Синтез 2-хлор-6-(хинолин-3-илокси)бензамида 1,18 г 2-хлор-6-(хинолин-3-илокси)бензонитрила растворяли в 5 мл 80% серной кислоты и смесь перемешивали в течение 3 ч при 100C. После нейтрализации водным раствором гидроксида натрия жидкость разделяли этилацетатом, органический слой концентрировали и получали 1,03 г 2-хлор-6(хинолин-3-илокси)бензамида (соединение номер 20). Соединение, представленное соединением номер 21, синтезировали таким же способом, как способ примера 3. Пример 4. Синтез 2-бром-N,N-диметил-6-(хинолин-3-илокси)бензамида раствору при комнатной температуре добавляли 47 г гидрида натрия. После добавления к реакционному раствору 0,21 г метилиодида смесь нагревали при 100C и перемешивали в течение 4 ч. После разделения жидкости этилацетатом растворитель выпаривали и образовавшийся продукт очищали колоночной хроматографией на силикагеле, получая при этом 0,11 г 2-бром-N,N-диметил-6-(хинолин-3-илокси)бензамида (соединения номер 22). Ссылочный пример 5. Синтез оксима 1-[2-(хинолин-3-илокси)фенил]этанона 0,46 г 1-[2-(хинолин-3-илокси)фенил]этанона и 0,15 г гидрохлорида гидроксиламина растворяли в 3 мл пиридина и затем смесь перемешивали в течение 24 ч при комнатной температуре. После обработки реакционной смеси разбавленной хлористоводородной кислотой и разделения этилацетатом органический слой концентрировали, получая при этом 0,54 г оксима 1-[2-(хинолин-3-илокси)фенил]этанона (соединение номер 23). Соединения, представленные соединениями номеров 24-26, синтезировали таким же способом, как способ примера 5. Пример 6. Синтез 3-[2-(1,1-диметоксиэтил)фенокси)хинолина После растворения 0,13 г 1-[2-(хинолин-3-илокси)фенил]этанона и 0,06 г триметилортоформиата в 1,5 мл метанола добавляли 0,02 г трибромида тетрабутиламмония и смесь перемешивали в течение 4 дней при комнатной температуре. Реакционную смесь концентрировали и затем очищали колоночной хроматографией на силикагеле, получая при этом 0,08 г 3-[2-(1,1-диметоксиэтил)фенокси)хинолина (соединение номер 27). Пример 7. Синтез 3-[2-(2,2,2-трифтор-1-метил-1-триметилсиланилоксиэтил)фенокси]хинолина После растворения 0,26 г 1-[2-хинолин-3-илокси)фенил]этанона и 0,16 г (трифторметил)триметилсилана в 3 мл тетрагидрофурана при охлаждении льдом добавляли 2 капли фторида тетрабутиламмония(1,0 М раствор в тетрагидрофуране) и смеси затем перемешивали в течение 4 ч. После концентрирования реакционной смеси и очистки колоночной хроматографией на силикагеле получали 0,34 г 3-[2-(2,2,2 трифтор-1-метил-1-триметилсиланилоксиэтил)фенокси]хинолина (соединение номер 28). Пример 8. Синтез 1,1,1-трифтор-2-[2-(хинолин-3-илокси)фенил]пропан-2-ола После растворения 0,17 г 3-[2-(2,2,2-трифтор-1-метил-1-триметилсиланилоксиэтил)фенокси]хинолина в 1,5 мл тетрагидрофурана добавляли 1 мл фторида тетрабутиламмония (1,0 М раствор в тетрагидрофуране) и смесь перемешивали в течение 16 ч. Реакционную смесь концентрировали и затем очищали колоночной хроматографией на силикагеле, получая при этом 0,11 г 1,1,1-трифтор-2-[2-(хинолин-3 илокси)фенил]пропан-2-ола (соединение номера 29). Пример 9. Синтез 2-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-3,3-димеилбутан-2-ола После того как 0,15 г 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]этанон растворяли в 1,5 мл тетрагидрофурана и затем раствор охлаждали до -78C, по каплям добавляли 0,3 мл хлорида третбутилмагния (2,0 М раствор в диэтиловом простом эфире). После повышения температуры реакционного раствора до комнатной температуры реакционный раствор обрабатывали разбавленной хлористоводородной кислотой и затем жидкость разделяли этилацетатом. Органический слой концентрировали и затем очищали колоночной хроматографией на силикагеле, получая при этом 0,04 г 2-[2-фтор-6-(8 фторхинолин-3-илокси)фенил]-3,3-димеилбутан-2-ола (соединение номер 30). Соединения, представленные соединениями номеров 31-35, синтезировали таким же способом, как После растворения 0,3 г этилового эфира 2-фтор-6-(8-фторхинолин-3-илокси)бензойной кислоты в 4,5 мл тетрагидрофурана раствор охлаждали до -78C и по каплям добавляли 0,77 мл метилмагнийхлорида (3,0 М раствор в диэтиловом простом эфире). После того как температура реакционной смеси повышалась до комнатной температуры, реакционный раствор обрабатывали разбавленной хлористоводородная кислотой и жидкость разделяли этилацетатом. Органический слой концентрировали и затем очищали колоночной хроматографией на силикагеле, получая при этом 0,12 г 2-[2-фтор-6-(8-фторхинолин-3 илокси)фенил]пропан-2-ола (соединение номер 36) и 0,05 г 2-[2-фтор-6-(8-фтор-2-метилхинолин-3 илокси)фенил]пропан-2-ола (соединение номер 37). Соединения, представленные соединениями номеров 38-49, синтезировали таким же способом, как способ примера 10. Пример 11. Синтез 7-(хинолин-3-иламино)индан-1-она 0,4 3 г 3-бромхинолина, 0,29 г 7-аминоиндан-1-она, 0,08 г иодида меди(I), 0,41 г карбоната калия и 4 мл N-метилпирролидона смешивали и затем смесь перемешивали в течение 2 ч при 200C. Образовавшуюся смесь очищали колоночной хроматографией на силикагеле, получая при этом 0,15 г 7-(хинолин 3-иламино)индан-1-она (соединение номер 50). Соединение, представленное соединением номер 51, синтезировали таким же способом, как способ примера 11. Ссылочный пример 12. Синтез 3-(трет-бутилбензил)-8-фторхинолина После растворения 0,69 г соли триола, полученной из 8-фторхинолин-3-борной кислоты и 1,1,1 трис(гидроксиметил)этана способом, описанным в литературе (Angew. Chem. Int. Ed., 2008, 47, 928-931),и 0,45 г 1-бромметил-2-трет-бутилбензола в 10 мл толуола добавляли 0,46 г тетракистрифенилфосфинпалладия и смесь перемешивали в течение 3 ч. После выпаривания растворителя реакционной смеси образовавшийся продукт очищали колоночной хроматографией на силикагеле, получая при этом 0,14 г 3(трет-бутилбензил)-8-фторхинолина (соединение номер 52). Соединение, представленное соединением номер 53, синтезировали таким же способом, как способ примера 12. Ссылочный пример 13. Синтез (2-трет-бутилфенил)-(8-фторхинолин-3-ил)метанола После того как 3 мл тетрагидрофурана охладили до -10C, добавляли 0,91 мл н-бутиллития (2,6 М раствор в гексане) и 1,35 мл хлорида н-бутилмагния (0,91 М раствор в тетрагидрофуране). После 30 мин перемешивания добавляли 0,98 г 8-фтор-3-иодхинолина и смесь перемешивали в течение 15 мин. К реакционному раствору добавляли 0,49 г 2-трет-бутилбензальдегида и смесь перемешивали в течение 3 ч. После добавления к реакционной смеси разбавленной хлористоводородной кислоты жидкость разделяют этилацетатом. После концентрирования органического слоя и очистки колоночной хроматографией на силикагеле получали 0,55 г (2-трет-бутилфенил)-(8-фторхинолин-3-ил)метанола (соединение номер 54). Соединения, представленные соединениями номеров 55-56, синтезировали таким же способом, как способ примера 13. Ссылочный пример 14. Синтез (2-трет-бутилфенил)-(8-фторхинолин-3-ил)метанона После того как 0,32 г (2-трет-бутилфенил)-(8-фторхинолин-3-ил) метанола растворили в 3 мл дихлорметана, добавляли 0,51 г реагента Десс-Мартина и смесь перемешивали в течение 1 ч при комнатной температуре. После того как добавляли воду и затем жидкость разделяли этилацетатом, органический слой концентрировали и очищали колоночной хроматографией, получая при этом 0,21 г (2-третбутилфенил)-(8-фторхинолин-3-ил)метанона (соединение номер 57). Соединения, представленные соединениями номеров 58-59, синтезировали таким же способом, как способ примера 14. Ссылочный пример 15. Синтез 2-хлор-3-(1,1-диметилиндан-7-илокси)хинолина. 0,2 г 3-(1,1-диметилиндан-7-илокси)хинолона растворяли в 5 мл хлороформа и к раствору добавляли 0,2 г m-СРВА (70%) и смесь перемешивали на протяжении ночи при комнатной температуре. После разбавления реакционной смеси хлороформом и промывания насыщенным водным раствором бикарбоната натрия добавляли сульфат магния для сушки образовавшегося продукта. Растворитель выпаривали при пониженном давлении, получая при этом 0,2 г N-оксида 3-(1,1-диметилиндан-7-илокси)хинолина. Образовавшийся продукт растворяли в оксихлориде фосфора и раствор нагревали при кипячении с обратным холодильником в течение 4 ч. Оксихлорид фосфора выпаривали при пониженном давлении и остаток растворяли в этилацетате и раствор промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили сульфатом магния и упаривали при пониженном давлении. Полученный сырой продукт очищали колоночной хроматографией на силикагеле и получали 0,13 г 2-хлор-3-(1,1 диметилиндан-7-илокси)хинолина (соединение номер 60). Соединение, представленное соединением номер 61, синтезировали таким же способом, как способ примера 15. Пример 16. Синтез 3-(2-цианофенокси)хинолина. После растворения 0,27 г 3-гидроксихинолина в N-метил-2-пирролидоне к раствору при охлаждении льдом добавляли 0,087 г гидрида натрия (60% дисперсия в масле) и смесь перемешивали в течение 30 мин. При такой же температуре добавляли 0,27 г 2-фторбензонитрила и затем смесь перемешивали в течение 6 ч при комнатной температуре. После выливания реакционной смеси в ледяную воду, экстрагирования ее этилацетатом и промывания насыщенным раствором соли образовавшийся продукт сушили сульфатом магния. После выпаривания растворителя при пониженном давлении сырой продукт очищали колоночной хроматографией на силикагеле, получая при этом 0,37 г 3-(2-цианофенокси)хинолина (соединение номер 62). Соединения, представленные соединениями номеров 63-66, синтезировали таким же способом, как способ примера 16. Пример 17. Синтез дифтор-[2-фтор-6-(8-фторхинолин-3-илокси)этилацетата]. Стадия 1) Синтез 8-фтор-3-(3-фтор-2-иодфенокси)хинолина 16 мл N-метилпирролидона добавляли к 1,06 г 8-фтор-3-гидроксихинолина, 1,94 г 2,6 дифториодбензола и 1,7 г карбоната калия и смесь перемешивали в течение 24 ч при 130C. Реакционный раствор очищали колоночной хроматографией на силикагеле и получали 0,55 г 8-фтор-3-(3-фтор-2 иодфенокси)хинолина. Стадия 2) Синтез дифтор-[2-фтор-6-(8-фторхинолин-3-илокси)этилацетата] После растворения 0,4 г 8-фтор-3-(3-фтор-2-иодфенокси)хинолина в 4 мл диметилсульфоксида к раствору добавляли 0,25 г меди (порошка) и 0,41 г бромдифторэтилацетата и затем смесь перемешивали в течение 24 ч при 40C. Реакционный раствор очищали колоночной хроматографией на силикагеле и получали 0,27 г дифтор-[2-фтор-6-(8-фторхинолин-3-илокси)этилацетата] (соединение номер 292). Пример 18. Синтез 1,1-дифтор-1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-2-метилпропан-2-ола 0,18 г дифтор-[2-фтор-6-(8-фторхинолин-3-илокси)этилацетата] растворяли в 3 мл тетрагидрофурана и по каплям при 0C добавляли 0,4 мл метилмагнийхлорида (3,0 М раствор в тетрагидрофуране). После перемешивания смеси в течение 2 ч при 0C добавляли разбавленную хлористоводородную кислоту и жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,10 г 1,1-дифтор-1-[2-фтор-6-(8-фторхинолин-3 илокси)фенил]-2-метилпропан-2-ола (соединение номер 293). Пример 19. Синтез 1-[2-(7,8-дифторхинолин-3-илокси)-6-фторфенил]этанона После того как 0,91 г 7,8-дифтор-3-гидроксихинолина и 0,94 г 2, 6-дифторацетофенона растворили в 10 мл диметилформамида, добавляли 0,9 г карбоната калия. Реакционный раствор нагревали до 100C и смесь перемешивали в течение 4,5 ч. К реакционному раствору добавляли разбавленную хлористоводородную кислоту и раствор разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,64 г 1-[2-(7,8-дифторхинолин-3-илокси)-6 фторфенил]этанона (соединение номер 391). Пример 20. Синтез 2-[2-(7,8-дифторхинолин-3-илокси)-6-фторфенил]пропан-2-ола После того как 0,64 г 1-[2-(7,8-дифторхинолин-3-илокси)- 6-фторфенил]этанон растворили в 10 мл тетрагидрофурана, образовавшийся раствор охлаждали до 0C и по каплям добавляли 1,5 мл хлорида метилмагния (3,0 М раствор Е тетрагидрофуране). К реакционному раствору добавляли по каплям разбавленную хлористо-водородную кислоту и жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,49 г 2-[2-(7,8 дифторхинолин-3-илокси)-6-фторфенил]пропан-2-ола (соединение номер 124). Пример 21. Синтез 3-[2-(7,8-дифторхинолин-3-илокси)-6-фторфенил]-3-метилбутан-2-она 3 мл N-метилпирролидона добавляли к 0,78 г 7,8-дифтор-3-иодхинолина, 0,26 г 3-(2-фтор-6 гидроксифенил)-3-метилбутан-2-она, 1,05 г карбоната цезия, 53 мг дипивалоилметана и 0,27 г хлорида меди(I). После 48 ч перемешивания при 130C реакционный раствор фильтровали через целит и жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией, получая при этом 0,05 г 3-[2-(7,8-дифторхинолин-3-илокси)-6-фторфенил]-3-метилбутан-2-она (соединение номер 267). Пример 22. Синтез 2-фтор-6-(8-фторхинолин-3-илокси)бензальдегида После добавления 30 мл ацетонитрила к 3,0 г 8-фтор-3-гидроксихинолина добавляли 3,1 г карбоната калия и 3,5 г 2,6-дифторацетофенона. После того как реакционный раствор нагревали при кипячении с обратным холодильником в течение 3 ч реакционный раствор фильтровали через целит. После экстракции фильтрата этилацетатом органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 3,0 г 2-фтор-6-(8-фторхинолин-3-илокси) бензальдегида (соединение номер 341). Пример 23. Синтез 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]пропан-1,2-диона. Стадия 1) Синтез [2-фтор-6-(8-фторхинолин-3-илокси)фенил]триметилсилилоксиацетонитрила После растворения 3,2 г 2-фтор-6-(8-фторхинолин-3-илокси) бензальдегида в 70 мл дихлорметана и охлаждения образовавшегося раствора до 0C добавляли 1,3 г тетраизопропоксида титана. После нагревания реакционного раствора до комнатной температуры к нему добавляли 4,5 г триметилсилилцианида и смесь перемешивали в течение 2 ч. К реакционному раствору добавляли разбавленную хлористоводородную кислоту и раствор экстрагировали дихлорметаном. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 3,1 г [2-фтор-6-(8-фторхинолин-3 илокси)фенил]триметилсилилоксиацетонитрила (чистота приблизительно 90%). Стадия 2) Синтез 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-1-гидроксипропан-2-она 3,3 г [2-фтор-6-(8-фторхинолин-3-илокси)фенил]триметилсилилоксиацетонитрила (чистота приблизительно 90%) растворяли в 50 мл дизтилового простого эфира и по каплям при комнатной температуре добавляли 5,7 мл бромида метилмагния (3,0 М раствор в диэтиловом эфире). После перемешивания смеси в течение 1 ч при комнатной температуре образовавшуюся смесь нагревали при кипячении с обратным холодильником в течение 3 ч и затем обрабатывали разбавленной хлористоводородной кислотой. Образовавшуюся смесь подвергали экстракции этилацетатом и затем органический слой концентрировали, получая при этом 3,9 г сырого продукта. К 1,9 г сырого продукта добавляли 20 мл 2 н. хлористоводородной кислоты и 10 мл тетрагидрофурана и смесь перемешивали в течение 4 ч при комнатной температуре. Реакционный раствор экстрагировали этилацетатом и затем очищали колоночной хроматографией на силикагеле, получая при этом 0,4 г 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-1 гидроксипропан-2-она. Стадия 3) Синтез 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]пропан-1,2-диона После растворения 0,14 г 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-1-гидроксипропан-2-она в 10 мл дихлорметана к раствору при 0C добавляли 0,91 г реагента Десс-Мартина. После 3 ч перемешивания реакционный раствор концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,08 г 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]пропан-1,2-диона (соединение номер 396). Пример 24. Синтез 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-2-гидрокси-2-метилпропан-1-она Стадия 1) Синтез 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-2-гидрокси-2-метилпропан-1,2 диола 3,3 г [2-фтор-6-(8-фторхинолин-3-илокси)фенил]триметилсилилоксиацетонитрила растворяли в 50 мл диэтилового простого эфира и при комнатной температуре по каплям добавляли 5,7 мл бромида метилмагния (3,0 М раствор в диэтиловом простом эфире). После перемешивания смеси в течение 1 ч при комнатной температуре образовавшуюся смесь нагревали при кипячении с обратным холодильником в течение 3 ч и затем обрабатывали разбавленной хлористоводородной кислотой. Образовавшуюся смесь подвергали экстракции этилацетатом и затем органический слой концентрировали, получая при этом 3,9 г сырого продукта. 1,9 г сырого продукта растворяли в 20 мл тетрагидрофурана и при 0C по каплям добавляли 3,2 мл бромида метилмагния (3,0 М раствор в диэтиловом простом эфире). После 3 ч перемешивания при 0C добавляли 20 мл 2 н. хлористо-водородной кислоты и смесь перемешивали в течение одного дня при комнатной температуре. Реакционный раствор экстрагировали этилацетатом и очищали колоночной хроматографией на силикагеле, получая при этом 0,25 г 1-[2-фтор-6-(8-фторхинолин-3 илокси)фенил]-2-метилпропан-1,2-диола в виде сырого продукта. Стадия 2) Синтез 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-2-гидрокси-2-метилпропан-1-она 0,15 г 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-2-метилпропан-1,2-диола растворяли в 10 мл дихлорметана и к раствору при 0C добавляли 0,20 г реагента Десс-Мартина. После 2 ч перемешивания реакционный раствор концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,03 г 1-[2-фтор-6-(8-фторхинолин-3-илокси)фенил]-2-гидрокси-2-метилпропан-1-она (соединение номер 398). Пример 25. Синтез 2-[2-фтор-6-(7,8-дифтор-2-метилхинолин-3-илокси)фенил]пропан-2-ола 26,3 г 7,8-дифтор-3-гидрокси-2-метилхинолина растворяли в 200 мл диметилформамида. К раствору добавляли 27,2 г 2,6-дифторацетофенона и 24,0 г карбоната калия и смесь перемешивали в течение 4 ч при 100C. После этого таким образом полученный реакционный раствор выливали в ледяную воду и нейтрализовали разбавленной хлористоводородной кислотой, жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 17,0 г 1-[2-фтор-6-(7,8-дифтор-2-метилхинолин-3-илокси)фенил]этанона. После растворения полученного 11,0 г 1-[2-фтор-6-(7,8-дифтор-2-метилхинолин-3-илокси)фенил] этанона в 80 мл тетрагидрофурана и охлаждения до 0C по каплям добавляли 16,6 мл хлорида метилмагния (3,0 М раствор в тетрагидрофуране). После нагревания образовавшейся смеси до комнатной температуры ее перемешивания в течение 2 ч реакционный раствор обрабатывали разбавленной хлористоводородной кислотой и жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 10,0 г 2-[2-фтор-6-(7,8-дифтор-2 метилхинолин-3-илокси)фенил]пропанол-2-ола. (Было получено соединение номер 125). Пример 26. Синтез 2-[2-фтор-6-(7,8-дифторхинолин-3-илокси)фенил]пропан-2-ола 0,5 г 7,8-дифтор-3-гидроксихинолина растворяли в 10 мл диметилформамида. К раствору добавляли 0,52 г 2,6-дифторацетофенона и 0,46 г карбоната калия и смесь перемешивали в течение 2,5 ч при 100C. Полученный таким образом реакционный раствор выливали в ледяную воду и затем нейтрализовали разбавленной хлористо-водородной кислотой, жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,38 г 1-[2-фтор 6-(7,8-дифторхинолин-3-илокси)фенил]этанона (соединение номер 391). После растворения 0,38 г полученного 1-[2-фтор-6-(7,8-дифторхинолин-3-илокси)фенил]этанона в 5 мл тетрагидрофурана и охлаждения до 0C по каплям добавляли 1,4 мл бромида метилмагния (3,0 М раствор в диэтиловом простом эфире). После нагревания образовавшейся смеси до комнатной температуры и перемешивания в течение 2 ч реакционный раствор обрабатывали разбавленной хлористоводородной кислотой и жидкость разделяли этилацетатом. Органический слой концентрировали и очищали колоночной хроматографией на силикагеле, получая при этом 0,33 г 2-[2-фтор-6-(7,8-дифторхинолин-3 илокси)фенил]пропан-2-ола (соединение номер 124). В дальнейшем промежуточный продукт согласно настоящему изобретению описывается более подробно обращением к примерам, однако, промежуточный продукт согласно настоящему изобретению ни в малейшей степени не ограничивается нижеследующими примерами. Пример 27. Синтез 7,8-дифтор-3-гидрокси-2-метилхинолина. Стадия 1) Синтез 6,7-дифторизатина После того как 15,7 г 2,3-дифторанилина добавляли к 825 мл воды и затем к раствору добавляли 24,2 г моногидрата трихлорацетальдегида, 30,8 г гидрохлорида гидроксиламина, 138,6 г безводного сульфата натрия, смесь перемешивали в течение 10 ч при 50C. После того как образовавшуюся смесь охлаждали до комнатной температуры, добавляли 44 мл 2 н. хлористо-водородной кислоты и затем смесь перемешивали в течение 30 мин с последующим сбором кристаллов фильтрованием. После того как по- 22021300 лученные таким образом кристаллы сушили, их затем добавляли в концентрированную серную кислоту,нагретую до 70C, и смесь перемешивали в течение 1 ч при 80-90C. Реакционный раствор выливали в лед с последующей экстракцией этилацетатом и затем промыванием насыщенным раствором соли. После сушки органического слоя сульфатом магния растворитель выпаривали при пониженном давлении,получая при этом 26 г сырого продукта 6,7-дифторизатина. Стадия 2) Синтез 7,8-дифтор-3-гидрокси-2-метилхинолина. После добавления 41 г сырого продукта 6,7-дифоризатина к 200 мл воды к раствору при охлаждении льдом добавляли 75,3 г гидроксида калия (6 эквивалентов) и смесь перемешивали в течение 30 мин. К суспензии при поддержании внутренней температуры реакционного раствора 20-25C по каплям добавляли 42 г бромацетофенона (1,4 эквивалента) и смесь дополнительно перемешивали на протяжении ночи при комнатной температуре. После нейтрализации образовавшейся смеси концентрированной хлористоводородной кислотой осажденные кристаллы собирали фильтрованием и промывали небольшим количеством воды. Полученные таким образом кристаллы сушили до достаточной степени и затем постепенно добавляли к 100 мл нитробензола, нагретого до 130-140C, и смесь дополнительно перемешивали в течение 1 ч при 150C. После охлаждения реакционного раствора до комнатной температуры осажденные кристаллы промывали хлороформом, получая при этом 26,3 г 7,8-дифтср-3-гидрокси-2 метилхинолина. 1H ЯМР (300 МГц, ДМСО-d6)2,57 (с, 3H), 7,4-7,7 (м, 3H), 10,60 (ушир., 1 Н). Следующее соединение получали с применением такого же способа. 8-Фтор-3-гидрокси-2-метилхинолин. 1 В 3 л колбу с формой баклажана, содержащую перемешивающий брусок, вводили 80% серную кислоту (607,7 г, 49,57 моль) и охлаждали до 0C и затем медленно добавляли 2,3-дифторанилин (160,0 г,1,24 моль). После добавления смесь перемешивали в течение 1 ч при комнатной температуре, к смеси далее добавляли иодид натрия (1,85 г, 12,3 ммоль) и затем смесь нагревали на масляной бане до тех пор,пока температура не достигала 150C (температура бани). При достижении такой температуры по каплям добавляли глицерин (125,5 г, 1,36 моль) на протяжении периода одного часа и смесь перемешивали в течение 1 ч при 150C. Температуру бани дополнительно повышали до 180C и воду выпаривали на протяжении периода 2 ч с применением аппарата для дистилляции. После подтверждения того, что исходное вещество исчезло, смесь нейтрализовали с применением 10 н. водного раствора гидроксида натрия при охлаждении баней со смесью вода-лед (внутренняя температура 69-70C). После нейтрализации, перед тем, как внутренняя температура возвращалась к комнатной температуре, образовавшуюся смесь подвергали экстракции этилацетатом и экстракт сушили сульфатом магния, фильтровали и концентрировали. Полученный таким образом сырой продукт очищали колоночной хроматографией на силикагеле (применяли обычную смесь гексан:этилацетат), получая при этом 185,5 г 7,8-дифторхинолина (91%) в виде светло-коричневого твердого вещества. Стадия 2) Синтез 7,8-дифтор-3-иодхинолина. В 3 г колбу с формой баклажана, содержащую перемешивающий брусок, вводили 7,8 дифторхинолин (185,5 г, 1,12 моль), N-иодсукцинимид (505,4 г, 2,25 моль) и уксусную кислоту (927 мл) и смесь перемешивали в течение 30 ч при 90C. После охлаждения осажденные кристаллы отделяли фильтрованием и сушили. С другой стороны, фильтрат концентрировали при пониженном давлении,остаточную уксусную кислоту нейтрализовали гидрокарбонатом натрия и образовавшуюся смесь подвергали экстракции этилацетатом. Кроме того, после сушки фильтрата сульфатом магния, фильтрования и концентрирования полученный сырой продукт очищали колоночной хроматографией на силикагеле(применяли обычно смесь гексан:этилацетат), получая при этом 227,2 г (70%) 7,8-дифтор-3-иодхинолина в виде светло-коричневого твердого вещества, смешанного с ранее полученными кристаллами. В 3 л колбу в форме баклажана, содержащую перемешивающий брусок, вводили 7,8-дифтор-3 иодхинолин (227,2 г, 0,78 моль), диметилсульфоксид (600 мл) и воду (600 мл) и добавляли гидроксид натрия (131,5 г, 2,34 моль), CuI (14,8 г, 0,078 моль) и 1,10-фенантролин (28,1 г, 0,156 моль). Смесь дополнительно нагревали до 100C на масляной бане и перемешивали в течение 24 ч. После охлаждения органический слой удаляли добавлением этилацетата и воды. Полученный таким образом водный слой нейтрализовали концентрированной хлористо-водородной кислотой и затем осажденные кристаллы отделяли фильтрованием и сушили. С другой стороны, после экстракции фильтрата этилацетатом, сушки фильтрата сульфатом магния, фильтрования и концентрирования полученный сырой продукт очищали колоночной хроматографией на силикагеле (обычно применяли гексан:этилацетат), получая при этом 133,7 г (95%) 7,8-дифтор-3-гидроксихинолин в виде светло-коричневого твердого вещества, смешанного с ранее полученными кристаллами. 1H ЯМР (300 МГц, CD3OD)7,39-7,60 (м, 3H), 8,59 (д, 1 Н, J=2,4 Гц). С применением такого же способа получали следующее соединение: 8-фтор-3-гидроксихинолин. 1H ЯМР (300 МГц, CDCl3)7,16 (м, 1 Н),7,34-7,49 (м, 3H), 8,71 (д, 1 Н, J=2,7 Гц), 9,90 (ушир. 1 Н). Азотсодержащие гетероциклические соединения, полученные в указанных выше примерах, показаны в табл. 1-12, 14-19. Кроме того, соединения, синтезированные таким же способом, как способ любого из указанных выше примеров, дополнительно показаны в таблицах от 20, 25-28. Кроме того, Et представляет собой этильную группу, nPr представляет собой н-пропильную группу, iPr представляет собой изопропильную группу, cPr представляет собой циклопропильную группу, nBu представляет собой нбутильную группу, tBu представляет собой трет-бутильную группу, Ph представляет собой фенильную группу, Вn представляет собой бензильную группу и Tos представляет собой толуолсульфонильную группу. 1 Н ЯМР соединений в каждой таблице также показаны в таблицах от 29 до 40. Таблица 1
МПК / Метки
МПК: C07D 401/12, C07D 215/38, C07D 215/14, A01P 3/00, A01N 55/00, C07D 215/20, C07D 221/04, C07D 491/048, C07D 471/04, C07D 495/04, A01N 43/42, C07D 215/18
Метки: сельскохозяйственный, азотсодержащее, гетероциклическое, фунгицид, соединение
Код ссылки
<a href="https://eas.patents.su/30-21300-azotsoderzhashhee-geterociklicheskoe-soedinenie-i-selskohozyajjstvennyjj-fungicid.html" rel="bookmark" title="База патентов Евразийского Союза">Азотсодержащее гетероциклическое соединение и сельскохозяйственный фунгицид</a>