Новые формы полициклического соединения
Номер патента: 20756
Опубликовано: 30.01.2015
Авторы: Кресс Майкл, Маккин Роберт Э., Филд Р.Скотт, Язданиан Мехран, Курвуазье Лоран, Хи Линли, Маури Дейл Р., Холтиванджер Р.Кертис, Кристи Майкл, Петрейтис Джозеф, Бирлмэйер Стефен, Джейкобс Мартин Дж.
Формула / Реферат
1. Кристаллическая форма соединения I, имеющего формулу
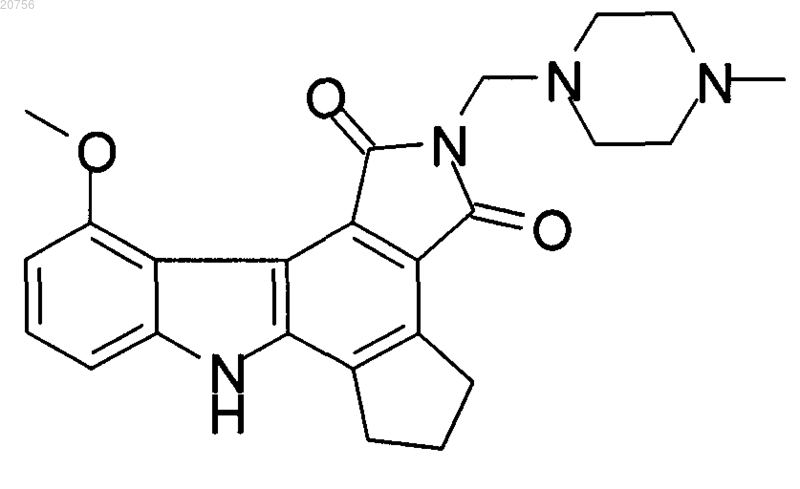
где кристаллическая форма представляет собой
(А)
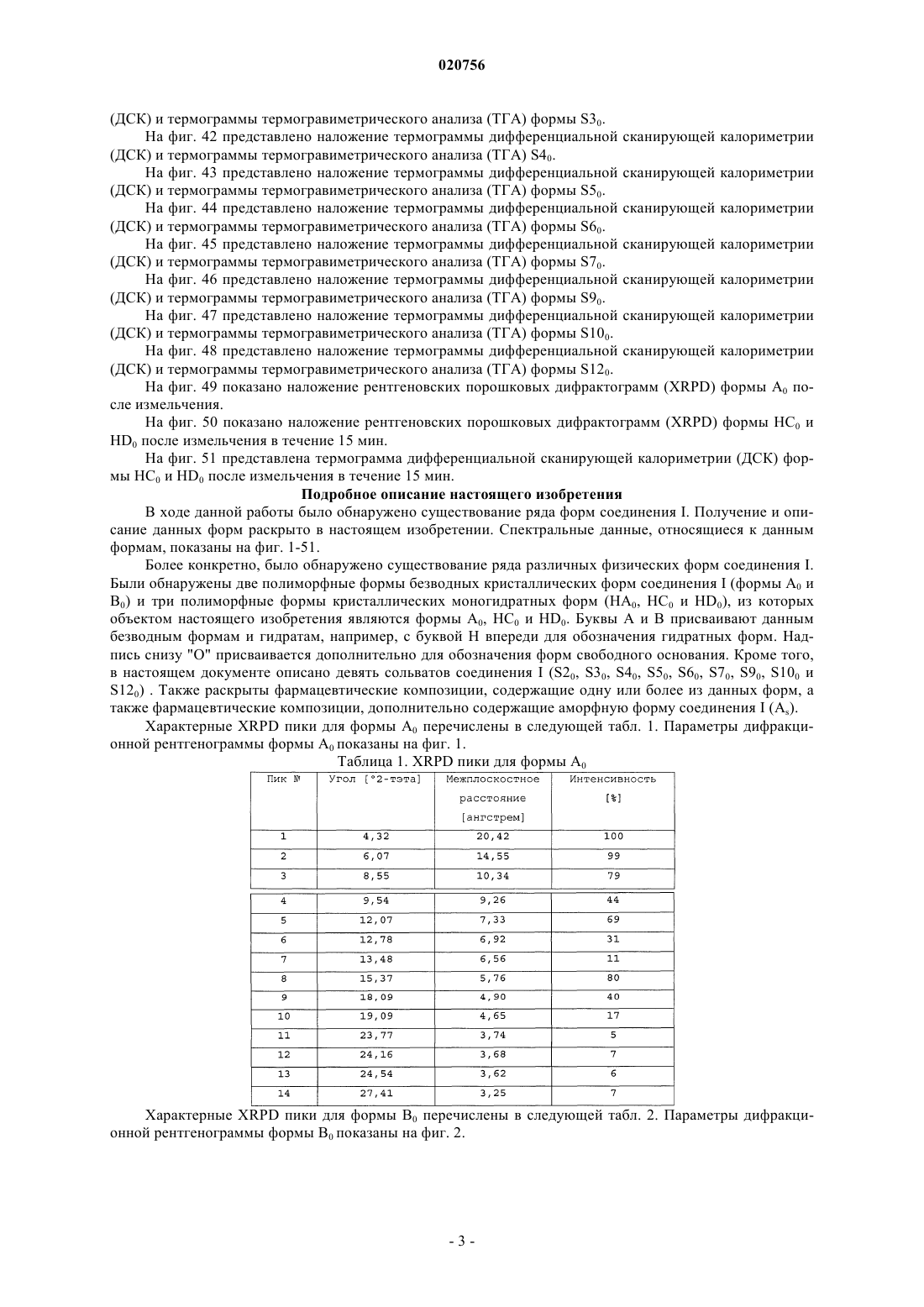
а) форму А0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 4,32, 6,07, 8,55, 12,07 и 15,37 ±0,2° 2-тэта; или
(В)
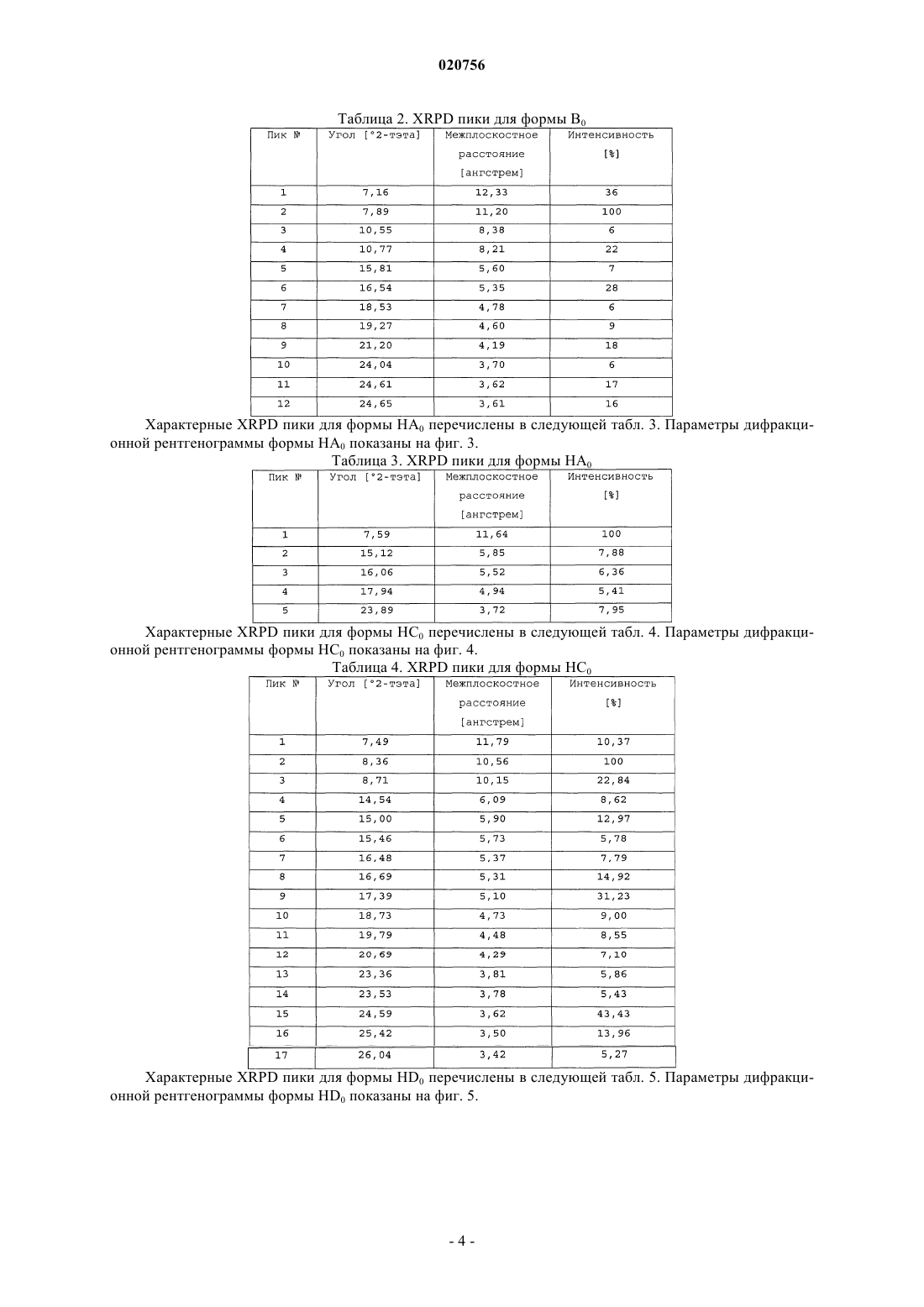
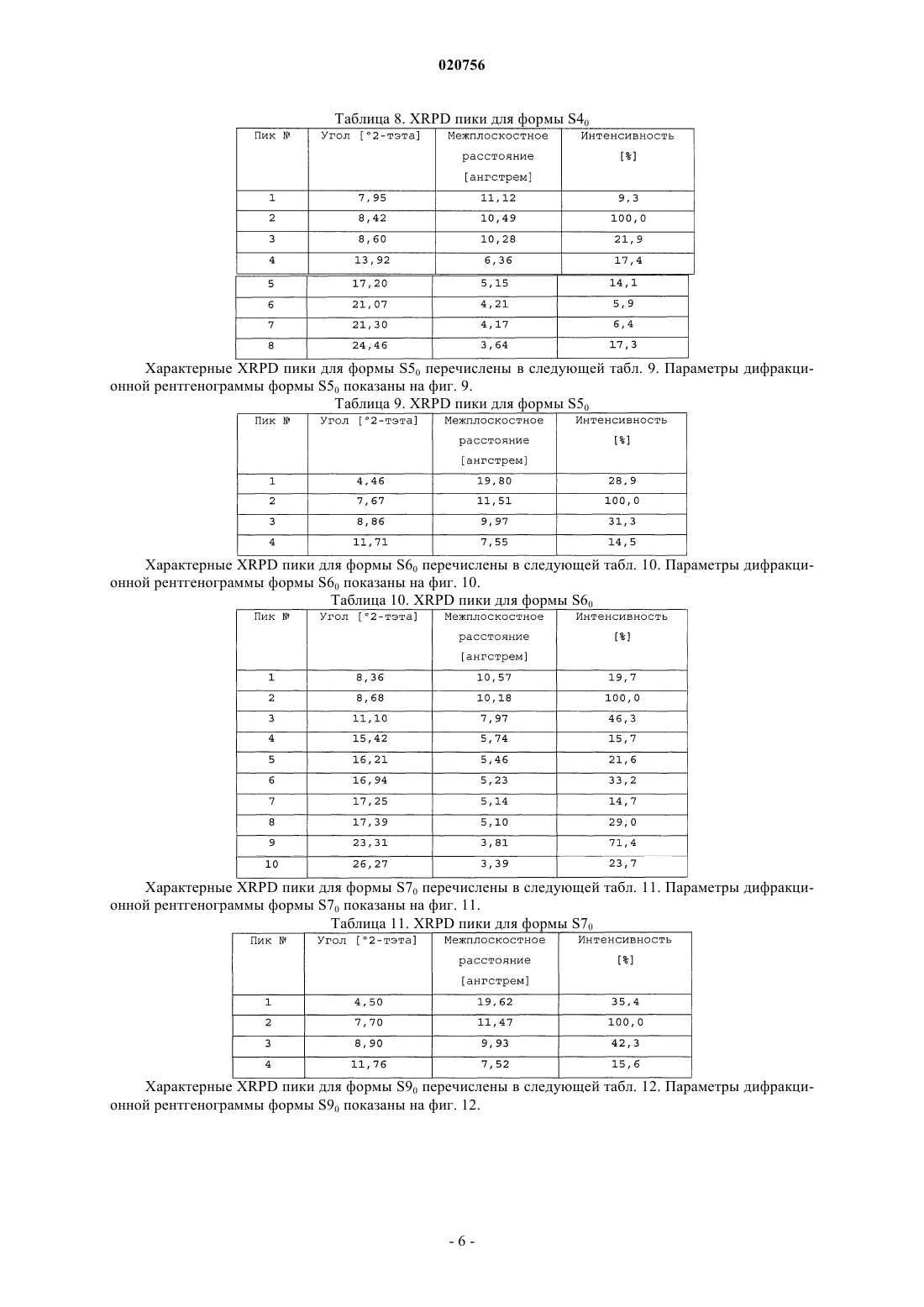
a) форму НС0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 8,36, 8,71, 16,69, 17,39 и 24,59 ± 0,2° 2-тэта; или
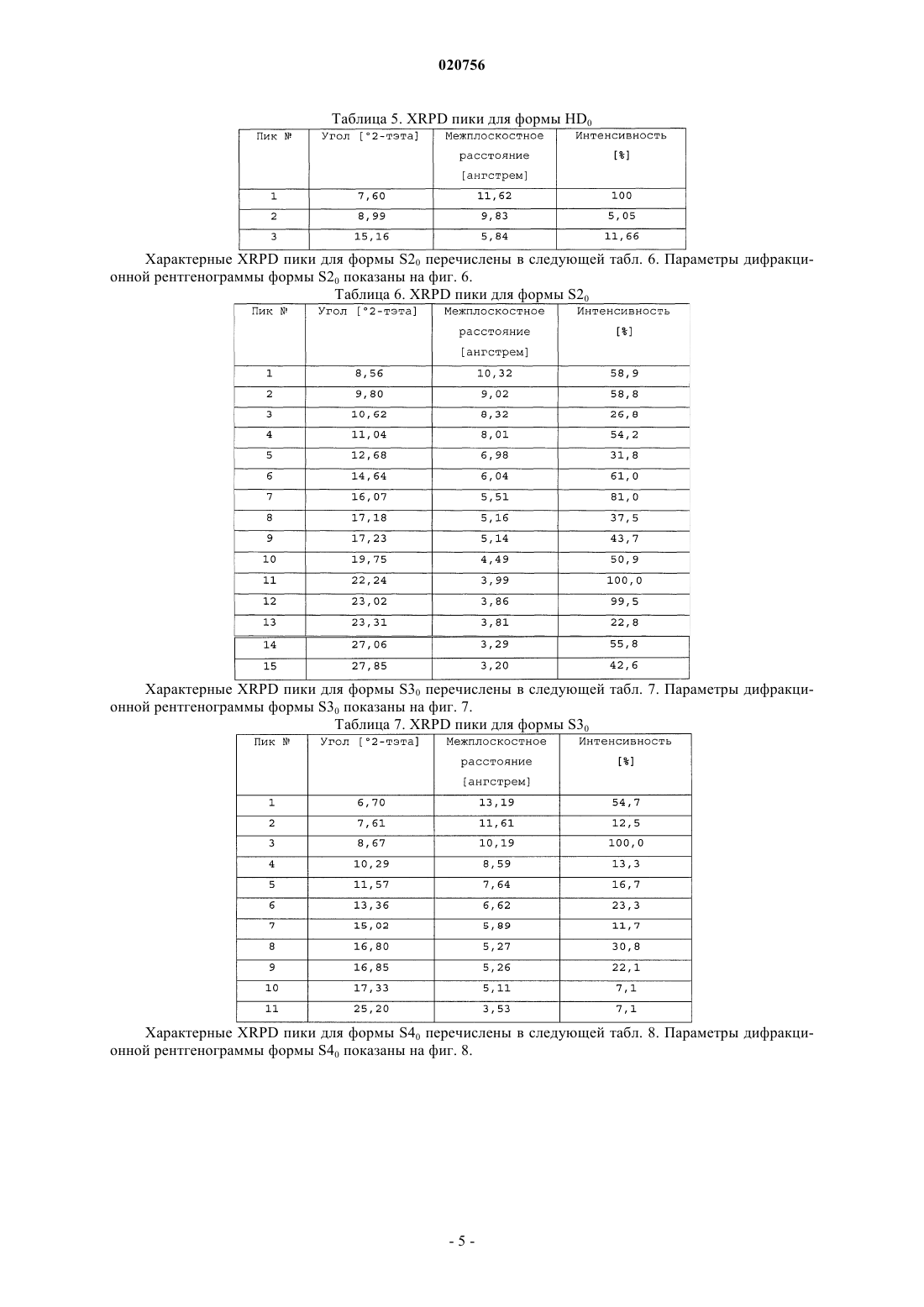
b) форму HD0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 7,60, 8,99 и 15,16 ± 0,2°2-тэта;
или их смесь.
2. Кристаллическая форма соединения I по п.1, которая представляет собой форму А0.
3. Кристаллическая форма соединения I по п.1, которая представляет собой форму НС0.
4. Кристаллическая форма соединения I по п.1, которая представляет собой форму HD0.
5. Фармацевтическая композиция для лечения рака, содержащая кристаллическую форму соединения I по любому из пп.2-4 или их смесь.
6. Фармацевтическая композиция по п.5, содержащая смесь указанных форм.
7. Фармацевтическая композиция по п.5 или 6, дополнительно содержащая аморфную форму соединения I.
Текст
НОВЫЕ ФОРМЫ ПОЛИЦИКЛИЧЕСКОГО СОЕДИНЕНИЯ Изобретение относится к кристаллической форме соединения I, где кристаллическая форма представляет собой: (А) а) форму А 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 4,32, 6,07, 8,55, 12,07 и 15,370,2 градуса 2-тэта; или (В) a) форму НС 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 8,36, 8,71, 16,69, 17,39 и 24,590,2 градуса 2-тэта; или b) форму HD0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 7,60, 8,99 и 15,160,2 градуса 2-тэта; или их смесь. Изобретение также относится к фармацевтической композиции для лечения рака, содержащей кристаллическую форму соединения I. Область техники, к которой относится настоящее изобретение Настоящее изобретение относится к композициям, которые содержат новые формы полициклического соединения (называемого в настоящем изобретении соединением I), и фармацевтическим композициям, содержащим соединение I. Уровень техники настоящего изобретения Активные фармацевтические ингредиенты (API) можно получить в виде ряда различных форм, например в виде химических производных, сольватов, гидратов, сокристаллов или солей. API могут также быть аморфными, могут иметь различные кристаллические полиморфные формы или могут существовать в различных сольватированных или гидратированных состояниях. Изменяя форму API, можно изменять его физические свойства. Например, кристаллические полиморфные формы обычно обладают различной растворимостью, так что более термодинамически стабильная полиморфная форма является менее растворимой, чем менее термодинамически стабильная полиморфная форма. Полиморфные формы могут также отличаться по свойствам, таким как стабильность, биодоступность, структура, давление паров, плотность, цвет и коэффициент сжатия. Соответственно, изменение кристаллического состоянияAPI представляет собой один из многих путей для изменения его физических и фармакологических свойств. Поли(АДФ-рибозная) полимераза (PARP, также называемая поли(АДФ-рибозная) синтетаза, илиPARS) представляет собой ядерный фермент, который катализирует синтез поли(АДФ-рибозных) цепей из NAD+ в ответ на разрывы одноцепочечной ДНК как часть процесса репарирования ДНК (de Murcia,G.; de Murcia, J.M. Poly(ADP-ribose) polymerase: a molecular nick-sensor. Trends Biochem. Sci. 1994, 19,172-176; Alvarez-Gonzalez, R.; Pacheco-Rodriguez, G.; Mendoza-Alvarez, H. Enzymology of ADP-ribose polymer synthesis. Mol. Cell. Biochem. 1994, 138, 33). Была выдвинута гипотеза, что низкомолекулярные ингибиторы PARP могут играть потенциальную роль в терапевтическом лечении нейродегенеративных заболеваний, рака и других связанных с PARP и киназой заболеваний. Специфическое ингибирующее PARP соединение, имеющее химическое обозначение 4,5,6,7-тетрагидро-11-метокси-2-[(4-метил-1-пиперазинил)метил]-1 Н-циклопента[а]пирроло[3,4-с]карбазол-1,3(2 Н)дион, может быть пригодно для лечения опухолей груди и яичника и в сочетании с химиотерапией или радиотерапией для лечения других устойчивых к лекарственным средствам видов рака. Данное соединение представлено следующей формулой (I): и называется в настоящем изобретении "соединением I". Патент США 7122679 и 2006/0276497 описывает соединение I и его применение. Различные формы соединения I имеют различные температуры плавления, растворимость или скорость растворения; данные физические свойства, или отдельно, или в комбинации, могут влиять, например, на биодоступность. В свете потенциальных преимуществ альтернативных форм API существует необходимость в обнаружении и получении альтернативных форм соединения I. Сущность настоящего изобретения Настоящее изобретение относится к новой кристаллической форме соединения I, имеющего формулу где кристаллическая форма представляет собой(А) а) форму А 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 4,32, 6,07, 8,55, 12,07 и 15,37 0,2 2-тэта; илиa) форму НС 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 8,36, 8,71, 16,69, 17,39 и 24,590,2 2-тэта; илиb) форму HD0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 7,60, 8,99 и 15,160,2 2-тэта; или их смесь. Кроме того, настоящее изобретение относится к фармацевтической композиции для лечения рака,содержащей кристаллическую форму соединения I, представляющую собой форму А 0, форму НС 0, фор-1 020756 му HD0 или их смесь. В предпочтительном варианте фармацевтическая композиция содержит смесь указанных форм. В другом предпочтительном варианте фармацевтическая композиция дополнительно включает аморфную форму соединения I. Краткое описание чертежей На фиг. 1 представлена рентгеновская порошковая дифрактограмма (XRPD) формы А 0. На фиг. 2 представлена рентгеновская порошковая дифрактограмма (XRPD) формы В 0. На фиг. 3 представлена рентгеновская порошковая дифрактограмма (XRPD) формы НА 0. На фиг. 4 представлена рентгеновская порошковая дифрактограмма (XRPD) формы НС 0. На фиг. 5 представлена рентгеновская порошковая дифрактограмма (XRPD) формы HD0. На фиг. 6 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S20. На фиг. 7 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S30. На фиг. 8 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S40. На фиг. 9 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S50. На фиг. 10 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S60. На фиг. 11 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S70. На фиг. 12 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S90. На фиг. 13 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S100. На фиг. 14 представлена рентгеновская порошковая дифрактограмма (XRPD) формы S120. На фиг. 15 представлена рентгеновская порошковая дифрактограмма с переменной температурой(VT-XRPD) формы А 0. На фиг. 16 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА, TGA) формы А 0. На фиг. 17 представлен регулярный график изотермы при динамической сорбции паров (ДСП,DVS) формы А 0. На фиг. 18 показаны рентгеновские порошковые дифрактограммы (XRPD) формы А 0 перед и после анализа с помощью динамической сорбции паров (ДСП). На фиг. 19 представлен нерегулярный график изотермы при динамической сорбции паров (ДСП) формы А 0. На фиг. 20 представлен инфракрасный спектр с Фурье-преобразованием (FTIR) формы А 0. На фиг. 21 представлен рамановский спектр формы А 0. На фиг. 22 представлена рентгеновская порошковая дифрактограмма с переменной температурой(VT-XRPD) формы В 0. На фиг. 23 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК, DSC) и термограммы термогравиметрического анализа (ТГА) формы В 0. На фиг. 24 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы НА 0. На фиг. 25 представлен график изотермы при динамической сорбции паров (ДСП) формы НА 0. На фиг. 26 представлен инфракрасный спектр с Фурье-преобразованием (FTIR) формы НА 0. На фиг. 27 представлен рамановский спектр формы НА 0. На фиг. 28 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы НС 0. На фиг. 29 представлен регулярный график изотермы при динамической сорбции паров (ДСП) НС 0. На фиг. 30 показаны рентгеновские порошковые дифрактограммы (XRPD) формы НС 0 перед и после анализа с помощью динамической сорбции паров (ДСП). На фиг. 31 представлен нерегулярный график изотермы при динамической сорбции паров (ДСП) формы НС 0. На фиг. 32 представлен инфракрасный спектр с Фурье-преобразованием (FTIR) формы НС 0. На фиг. 33 представлен рамановский спектр НС 0. На фиг. 34 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы HD0. На фиг. 35 представлен регулярный график изотермы при динамической сорбции паров (ДСП) формы HD0. На фиг. 36 показаны рентгеновские порошковые дифрактограммы (XRPD) формы HD0 перед и после анализа с помощью динамической сорбции паров (ДСП). На фиг. 37 представлен нерегулярный график изотермы при динамической сорбции паров (ДСП) формы HD0. На фиг. 38 представлен инфракрасный спектр с Фурье-преобразованием (FTIR) формы HD0. На фиг. 39 представлен рамановский спектр HD0. На фиг. 40 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S20. На фиг. 41 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S30. На фиг. 42 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) S40. На фиг. 43 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S50. На фиг. 44 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S60. На фиг. 45 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S70. На фиг. 46 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S90. На фиг. 47 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S100. На фиг. 48 представлено наложение термограммы дифференциальной сканирующей калориметрии(ДСК) и термограммы термогравиметрического анализа (ТГА) формы S120. На фиг. 49 показано наложение рентгеновских порошковых дифрактограмм (XRPD) формы А 0 после измельчения. На фиг. 50 показано наложение рентгеновских порошковых дифрактограмм (XRPD) формы НС 0 иHD0 после измельчения в течение 15 мин. На фиг. 51 представлена термограмма дифференциальной сканирующей калориметрии (ДСК) формы НС 0 и HD0 после измельчения в течение 15 мин. Подробное описание настоящего изобретения В ходе данной работы было обнаружено существование ряда форм соединения I. Получение и описание данных форм раскрыто в настоящем изобретении. Спектральные данные, относящиеся к данным формам, показаны на фиг. 1-51. Более конкретно, было обнаружено существование ряда различных физических форм соединения I. Были обнаружены две полиморфные формы безводных кристаллических форм соединения I (формы А 0 и В 0) и три полиморфные формы кристаллических моногидратных форм (НА 0, НС 0 и HD0), из которых объектом настоящего изобретения являются формы А 0, НС 0 и HD0. Буквы А и В присваивают данным безводным формам и гидратам, например, с буквой Н впереди для обозначения гидратных форм. Надпись снизу "О" присваивается дополнительно для обозначения форм свободного основания. Кроме того,в настоящем документе описано девять сольватов соединения I (S20, S30, S40, S50, S60, S70, S90, S100 иS120) . Также раскрыты фармацевтические композиции, содержащие одну или более из данных форм, а также фармацевтические композиции, дополнительно содержащие аморфную форму соединения I (As). Характерные XRPD пики для формы А 0 перечислены в следующей табл. 1. Параметры дифракционной рентгенограммы формы А 0 показаны на фиг. 1. Таблица 1. XRPD пики для формы А 0 Характерные XRPD пики для формы В 0 перечислены в следующей табл. 2. Параметры дифракционной рентгенограммы формы В 0 показаны на фиг. 2. Таблица 2. XRPD пики для формы В 0 Характерные XRPD пики для формы НА 0 перечислены в следующей табл. 3. Параметры дифракционной рентгенограммы формы НА 0 показаны на фиг. 3. Таблица 3. XRPD пики для формы НА 0 Характерные XRPD пики для формы НС 0 перечислены в следующей табл. 4. Параметры дифракционной рентгенограммы формы НС 0 показаны на фиг. 4. Таблица 4. XRPD пики для формы НС 0 Характерные XRPD пики для формы HD0 перечислены в следующей табл. 5. Параметры дифракционной рентгенограммы формы HD0 показаны на фиг. 5. Таблица 5. XRPD пики для формы HD0 Характерные XRPD пики для формы S20 перечислены в следующей табл. 6. Параметры дифракционной рентгенограммы формы S20 показаны на фиг. 6. Таблица 6. XRPD пики для формы S20 Характерные XRPD пики для формы S30 перечислены в следующей табл. 7. Параметры дифракционной рентгенограммы формы S30 показаны на фиг. 7. Таблица 7. XRPD пики для формы S30 Характерные XRPD пики для формы S40 перечислены в следующей табл. 8. Параметры дифракционной рентгенограммы формы S40 показаны на фиг. 8. Таблица 8. XRPD пики для формы S40 Характерные XRPD пики для формы S50 перечислены в следующей табл. 9. Параметры дифракционной рентгенограммы формы S50 показаны на фиг. 9. Таблица 9. XRPD пики для формы S50 Характерные XRPD пики для формы S60 перечислены в следующей табл. 10. Параметры дифракционной рентгенограммы формы S60 показаны на фиг. 10. Таблица 10. XRPD пики для формы S60 Характерные XRPD пики для формы S70 перечислены в следующей табл. 11. Параметры дифракционной рентгенограммы формы S70 показаны на фиг. 11. Таблица 11. XRPD пики для формы S70 Характерные XRPD пики для формы S90 перечислены в следующей табл. 12. Параметры дифракционной рентгенограммы формы S90 показаны на фиг. 12. Таблица 12. XRPD пики для формы S90 Характерные XRPD пики для формы S100 перечислены в следующей табл. 13. Параметры дифракционной рентгенограммы формы S100 показаны на фиг. 13. Таблица 13. XRPD пики для формы S100 Характерные XRPD пики для формы S120 перечислены в следующей табл. 14. Параметры дифракционной рентгенограммы формы S120 показаны на фиг. 14. Таблица 14. XRPD пики для формы S120 Соответственно, в одном аспекте настоящее изобретение относится к новой кристаллической форме соединения I, имеющего формулу где кристаллическая форма представляет собой(А) а) форму А 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 4,32, 6,07, 8,55, 12,07 и 15,370,2 2-тэта; илиa) форму НС 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 8,36, 8,71, 16,69, 17,39 и 24,590,2 2-тэта; илиb) форму HD0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 7,60, 8,99 и 15,160,2 2-тэта; или их смесь. Другим аспектом настоящего изобретения является фармацевтическая композиция для лечения рака, содержащая одну из указанных выше кристаллических форм соединения I или их смесь. В предпочтительном варианте фармацевтическая композиция содержащит смесь указанных форм. В другом предпочтительном варианте фармацевтическая композиция дополнительно содержит аморфную форму соединения I. Терминология Термин "аморфный", как применяют в настоящем изобретении, относится к отсутствию характерной формы кристалла или кристаллической структуры. Термин "антирастворитель", как применяют в настоящем изобретении, относится к растворителю, в котором соединение является в основном нерастворимым. Термин "кристаллический", как применяют в настоящем изобретении, относится к имеющему регулярно повторяющуюся структуру молекул или плоскостей наружных поверхностей. Термин "кристаллическая форма", как применяют в настоящем изобретении, относится к твердому химическому соединению или смеси соединений, которая обеспечивает характеристичной диаграммой пиков при анализе порошковой рентгеновской дифракцией; она включает, но не ограничивается этим,полиморфные формы, сольваты, гидраты, сокристаллы и десольватированные сольваты. Термин "полиморфный" или "полиморфизм" определяют как возможность по меньшей мере двух кристаллических структур для одной и той же химической молекулы. Термин "растворенное вещество", как применяют в настоящем изобретении, относится к веществу,растворенному в другом веществе, обычно компоненту раствора, присутствующему в небольшом количестве. Термин "раствор", как применяют в настоящем изобретении, относится к смеси, содержащей по меньшей мере один растворитель и по меньшей мере одно соединение, по меньшей мере, частично растворенное в растворителе. Термин "сольват", как применяют в настоящем изобретении, относится к кристаллическому веществу, которое содержит в кристаллической структуре молекулы растворителя. Термин "растворитель", как применяют в настоящем изобретении, относится к веществу, обычно жидкости, которая способна полностью или частично растворять другое вещество, обычно твердое вещество. Растворители для осуществления на практике настоящего изобретения включают, но не ограничиваются, воду,уксусную кислоту, ацетон, ацетонитрил (ACN), бензиловый спирт, 1-бутанол, 2-бутанол, 2-бутанон, бутиронитрил, трет-бутанол, N-бутилацетат, хлорбензол, хлороформ, циклогексан, 1,2-дихлорэтан (DCE), дихлорметан (DCM), дибутиловый эфир диэтиленгликоля (DGDE), диизопропиламин (DIPA), диизопропиловый эфир(NMP):вода; 2-пентанон, 3-пентанон, 1-пентанол, 1,2-пропандиол, 2-пропанол (IPA), 1-пропанол, пропанонитрил, пропиленкарбонат, 1,2-пропиленгликоль (PG), пиридин, тетрагидрофуран (THF), тетрагидропиран (ТНР),толуол, триэтиламин, ксилол, их смеси и подобные. Данные растворители разделяют на пять классов в соответствии с их функциональной группой: класс 1: "протонные" или подающие водородную связь растворители(кислоты Льюиса), включая бензиловый спирт, этанол, IPA, метанол и воду; класс 2: акцептирующие водородную связь растворители (основания Льюиса), включая ацетон, 1,4-диоксан, DMF, этилацетат, MEK,МТВЕ, THF и воду; класс 3: полярные апротонные растворители, которые имеет более подходящий термин"негидроксильные растворители", включая ацетонитрил, DMA, DMF и DMSO; класс 4: хлороуглеводородные растворители, которые включают хлороформ; Класс 5: углеводородные растворители, и насыщенные, и ненасыщенные, включая н-гептан, толуол, п-ксилол и ксилол. Термин "терапевтически эффективное количество", как применяют в настоящем изобретении, относится к количеству, требующемуся, как определено, для оказания предполагаемого физиологического эффекта, связанного с указанным лекарственным средством, как измерено согласно традиционным фармакокинетическим способам и методикам, для указанного пути введения. Подходящие и конкретные терапевтически эффективные количества может легко определить лечащий специалист, устанавливающий диагноз как специалист в данной области техники применением общепринятых способов. Эффективная доза будет изменяться в зависимости от ряда факторов, включая тип и стадию заболевания или расстройства, общее состояние здоровья конкретного пациента, относительную биологическую эффективность выбранного соединения, состав активного агента с подходящими вспомогательными веществами и путь введения. Обычно кристаллические формы будут вводить при более низких дозах с постепенным увеличением до достижения требуемого эффекта. Если не установлено иначе, проценты, указанные в настоящем описании, представляют собой проценты мас./мас. (w/w). Термин "фармацевтически приемлемые вспомогательные вещества", как применяют в настоящем изобретении, включает любой и все растворители, диспергаторы, покрытия, антибактериальные и противогрибковые агенты, агенты, придающие изотоничность, и агенты, задерживающие всасывание, и подобные. Применение данных сред и агентов для фармацевтически активных веществ является хорошо известным в данной области техники (например, описывается в Remington: The Science and Practice ofPharmacy, 20th ed.; Gennaro, A. R., Ed.; Lippincott WilliamsWilkins: Philadelphia, PA, 2000). За исключением случаев, когда любая общепринятая среда или агент является несовместимым с активным ингредиентом, предполагается его применение в терапевтических композициях. Дополнительные активные ингредиенты можно также вводить в композиции. Для терапевтических целей кристаллические формы настоящего изобретения можно вводить любым способом, который приводит в результате к контакту активного лекарственного вещества с местом его действия в организме субъекта. Кристаллические формы можно вводить любым общепринятым способом, пригодным для применения в сочетании с фармацевтическими средствами, или в виде отдельных терапевтических средств, или в комбинации с другими терапевтическими средствами, такими как, например, анальгетики. Кристаллические формы настоящего изобретения предпочтительно вводить в терапевтически эффективных количествах для лечения заболевании и расстройств, описанных в настоящем изобретении, у нуждающегося в лечении субъекта. При терапевтическом или профилактическом применении кристаллические формы настоящего изобретения можно вводить любым путем, которым обычно вводят лекарственные средства. Данные пути введения включают внутрибрюшинный, внутривенный, внутримышечный, подкожный, интратекальный,интратрахеальный, интравентрикулярный, пероральный, буккальный, ректальный, парентеральный, интраназальный, трансдермальный или внутрикожный. Введение может быть системным или локализованным. Кристаллические формы, описанные в настоящем изобретении, можно вводить в чистой форме,смешанной с другими активными ингредиентами или смешанной с фармацевтически приемлемыми нетоксичными вспомогательными веществами или носителями. Оральные композиции будут обычно содержать инертный носитель, являющийся разбавителем, или носитель, пригодный для употребления в пищу. Фармацевтически совместимые связующие агенты и/или вспомогательные вещества можно включать как часть композиции. Таблетки, пилюли, капсулы, пастилки и подобные могут содержать любой из следующих ингредиентов или соединений аналогичной природы: связующий агент, такой как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательное вещество, такое как крахмал или лактоза, диспергатор, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающий агент, такой как стеарат магния; регулятор сыпучести, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор. Когда стандартной лекарственной формой является капсула, она может содержать в добавление к веществам вышеуказанного типа жидкий носитель, такой как жирное масло. Кроме того, стандартные лекарственные формы могут содержать различные другие вещества,которые изменяют физическую форму лекарственной формы, например, покрытие из сахара, шеллак или кишечнорастворимые агенты. Кроме того, сироп может содержать в добавление к активным соединениям сахарозу в качестве подсластителя и определенные консерванты, красители, красящие вещества и ароматизаторы. Альтернативные препараты для введения включают стерильные водные или неводные растворы,суспензии и эмульсии. Примерами неводных растворителей являются диметилсульфоксид, спирты, пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и сложные инъецируемые органические эфиры, такие как этилолеат. Водные носители включают смеси спиртов и воды,буферные среды и соляной раствор. Внутривенные среды включают подкрепители среды и питательных веществ, электролитные подкрепители, такие как подкрепители на основе раствора Рингера с декстрозой,и подобные. Могут также присутствовать консерванты и другие добавки, такие как, например, противомикробные вещества, антиоксиданты, хелатообразующие вещества, инертные газы и подобные. Предпочтительные способы введения кристаллических форм млекопитающим включают внутрибрюшинную инъекцию, внутримышечную инъекцию и внутривенное вливание. Различные жидкие составы являются возможными для данных способов доставки, включая соляной раствор, спирт, DMSO и растворы на основе воды. Концентрация может изменяться в зависимости от дозы и объема, которые нужно доставить, и может находиться в диапазоне от приблизительно 1 до приблизительно 1000 мг/мл. Другие составляющие жидких составов могут включать консерванты, неорганические соли, кислоты,основания, буферы, питательные вещества, витамины или другие фармацевтические агенты, такие как анальгетики или дополнительные ингибиторы PARP и киназ. Измерительное оборудование Порошковая рентгеновская дифракция (XRPD)XRPD рентгенограммы регистрировали на PANalytical X' Pert Pro дифрактометре, применяя Cu K излучение при 40 кВ и 40 мА. Кремниевый стандарт применяли для проверки настройки рентгеновской трубки. Образец прижимали к кварцевой пластине на нулевом уровне в алюминиевом фиксаторе. Стандартные снимки порошковой рентгенограммы получают от приблизительно 2 до 40 2 с 0,0080 размером шага и 96,06-секундным временем счета, что приводило в результате к скорости развертки 0,5/мин. Для данных монокристаллических исследований отобранные кристаллы покрывают паратоновым маслом и быстро замораживают на Oxford diffraction CCD дифрактометре (Xcalibur S, с Sapphire детекто-9 020756 ром). Данные собирают с помощью способов с детектором со стандартной зоной. Структуры разрешают и уточняют с помощью SHELXTL пакета программ. Программное уточнение методом Ритвельда параметров монокристалла на основании полученной XRPD рентгенограммы хорошо согласуется с не необъяснимыми пиками. Порошковая рентгеновская дифракция с переменной температурой (VT-XRPD) Исследования с переменной температурой проводили в атмосфере азота с Anton Paar TTK450 камерой для температурных испытаний с компьютерным контролем с помощью Anton Paar TCU100 устройства для контроля температуры. Применяли две схемы измерения, ограниченную и непрерывную. В ограниченном режиме измерения осуществляли только тогда, когда TK450 камера достигала требуемой температуры. В непрерывном режиме образец нагревали при скорости 10 С/мин и получали быстрые сканы при изменении температуры. После достижения требуемой температуры образец охлаждали при скорости 30 или 35 С/мин и получали более медленные сканы при 25 С. Температуры выбирали на основе ДСК результатов. Дифференциальная сканирующая калориметрия (ДСК) Кривые нагрева получали, применяя Perkin-Elmer Sapphire ДСК устройство, снабженное автоматическим пробоотборником, управляемое Pyris программным обеспечением версии 6.0, калиброванное индием перед анализом. Твердые образцы 1-11 мг взвешивали в 20 мкл открытых алюминиевых кюветах для образцов. Затем ДСК кювету продували азотом и температуру повышали от 0 до 275 С при скорости 10 С/мин. Термогравиметрический анализ (ТГА) Кривые нагрева получали, применяя Perkin-Elmer Pyris 1 TGA устройство, управляемое Pyris программным обеспечением версии 6.0, калиброванное моногидратом оксалата кальция. ТГА образцы между 1-15 мг проверяли на процентную потерю веса при нагревании от 25 до 400 С со скоростью 10 С/мин в печи, продуваемой гелием при приблизительно 50 мл/мин. Динамическая сорбция паров (ДСП) Эксперименты с гравиметрической сорбцией паров осуществляли, применяя DVS-HT устройство(Surface Measurement Systems, London, UK). Данное устройство измеряет поглощение и потерю паров гравиметрически, применяя регистрирующие вес ультрамикровесы с весовым разрешением 0,1 мкг. Парциальное давление паров (1,0%) вокруг образца контролируют смешением насыщенного и сухого потоков газа-носителя, применяя электронные регуляторы массового расхода. Требуемую температуру поддерживают в диапазоне 0,1 С. Образцы (10-25 мг) помещают в DVS-HT устройство при требуемой температуре. Проводят два типа экспериментов с динамической сорбцией паров 1. Образец первоначально сушат в потоке сухого воздуха (0,1% относительная влажность (RH в течение 20 ч для получения сухой массы и подвергают двум 0-90% RH циклам (с 10% RH приращением). 2. Образец подвергают 90% RH в течение 20 ч и подвергают двум 90-0% RH циклам (с 10% RH приращением). Инфракрасная спектрометрия (FTIR) Спектры получали, применяя Thermo Electron-Nicolet Avatar 370 DTGS прибор с Smart Orbit ATR приставкой, содержащей алмазное окно. Thermo Electron Omnic программное обеспечение (версия 3.1) применяли для расчета спектра от 4000 до 400 см-1 от первоначальной интерферограммы. Получали скан фона перед получением спектра для каждого образца. Для каждого образца получали 32 скана при 4 см-1 спектральном разрешении и усредняли. Рамановская спектроскопия Рамановские спектры образца регистрировали с помощью FT-Raman модуля на vertex 70 FTIR спектрометре (Bruker RAM II, Bruker optics, Germany). Германиевый фотодиод применяли для регистрации FT-Raman спектра, возбужденный лазером на иттрий-алюминиевом гранате с неодимом (подавление флуоресценции). Полистирольный стандарт применяли перед анализом образцов. Время исследования для каждого образца составляло 1 мин с разрешением 4 см-1, и мощность 1064 нм лазера для образца составляла 50 мВт. Индивидуальность, анализ и чистота Обычно 10 мкл аликвоты растворов образцов разбавляли до 1 мл ацетонитрилом и концентрации для анализа определяли из среднего для дублирующих инъекций, применяя следующий ВЭЖХ способ. Анализ чистоты и примесей осуществляли, применяя общепринятую ВЭЖХ. Примеры Способ получения соединения I Соединение I можно получить согласно схеме I. схема I В схеме I синтез начинают с 4-метоксииндола, имеющегося в продаже исходного соединения. После защиты атома азота индола ди-трет-бутилдикарбонатом Вос)2O) индольное производное активируют литийдиизопропиламидом (LDA) для получения карбаниона в 2-положении индола, который реагирует in-situ с триизопропилборатом. Кислая обработка гидролизует боронатный эфир, являющийся промежуточным соединением, до соответствующей индолбороновой кислоты А. Затем соединение А конденсируют с 1-циклопентенилтрифторметансульфонатом (также называемым енолтрифлатом в настоящем изобретении) в присутствии каталитических количеств ацетата палладия и трифенилфосфина в условиях реакции Судзуки для получения ключевого диенового промежуточного соединения В. После удаления Boc защитной группы метоксидом натрия диеновое соединение С конденсируют с малеимидом по реакции Дильса-Альдера в уксусной кислоте для получения пентациклического промежуточного соединения D. Ароматизация с помощью окисления хлоранилом превращает соединение D в соединение Е,которое конденсируют с 1-метилпиперазином в условиях реакции Манниха для получения целевого соединения I. Подробные особенности получения приводятся ниже. Получение N-Boc-4-метоксииндола В 100-галлоновый стеклоэмалированный реактор загружали 4-метоксииндол (20,0 кг, 136 моль,Yixing Zhongyu Medicine Technology Co., Ltd.) с последующим добавлением DMAP (0,50 кг, 4,1 моль,Aldrich) и толуола (92 кг, Corco reagent grade). Полученную в результате смесь перемешивали и нагревали до приблизительно 40 С. Тем временем во втором реакторе получали раствор ди-третбутилдикарбоната (31,8 кг, 146 моль, Lacamas Laboratories, Inc.) в толуоле (60 кг, Corco reagent grade).- 11020756 Данный раствор добавляли к индольному раствору в течение приблизительно 13/4 ч. Слегка экзотермическая реакция (максимальная температура приблизительно 41 С) сопровождалась выделением газа. После перемешивания в течение дополнительного часа при 40 С реакционный раствор охлаждали до 203 С. Испытание в ходе процесса показало, что 4-метоксииндол был израсходован полностью. Деионизированную воду (15 галлонов) добавляли для разложения избытка (Вос)2O (осторожно: выделение газа). Полученную в результате смесь энергично перемешивали в течение 1/2 ч, затем выдерживали в течение ночи. После удаления нижнего водного слоя органический слой частично концентрировали при пониженном давлении для удаления приблизительно 145 л отгона (60 С рубашка, вплоть до 60 мм Hg). На данном этапе дополнительное количество толуола (30 кг, Corco reagent grade) загружали и продолжали отгонку до суммарного количества отгона 200 л. Затем остаток охлаждали до комнатной температуры и сбрасывали в пластиковую бочку, что давало в результате 62,3 кг темно-желтого раствора, содержащего 33,6 кг N-Boc-4-метоксииндола (принимаемый теоретический выход). Его применяли в следующей стадии без дополнительной очистки. Получение соединения А 1-(1,1-Диметилэтиловый) эфир 2-бороно-4-метокси-1 Н-индол-1-кабоновая кислота Приблизительно половину полученного выше раствора помещали в 100-галлоновый стеклоэмалированный реактор с последующим добавлением толуола (3,0 кг для разбавления загружаемого вещества до 50 мас.%), триизопропилбората (19,9 кг, 105,9 моль, Anderson Development Со.) и THF (91 кг, Corcoreagent grade). Полученный в результате раствор перемешивали и охлаждали до -2 С. На данном этапе литийдиизопропиламид (37,3 кг, 91,8 моль, 27% раствор в этилбензол/тетрагидрофуран/гептан, FMCLithium) добавляли в течение 1 ч, сохраняя температуру смеси ниже 3 С (-10 С рубашка). Полученную в результате реакционную смесь перемешивали при 0+3 С после добавления LDA до обнаружения завершения реакции ВЭЖХ (0,6 А% N-Boc-4-метоксииндола, оставшегося через 30 мин после добавленияLDA). Тем временем, раствор 3 N HCl получали и охлаждали до 5 С во втором реакторе разбавлением 27 кг концентрированной хлористо-водородной кислоты в 16,3 галлонах деионизированной воды. Данную разбавленную HCl добавляли к смеси в течение 1 ч, поддерживая температуру смеси 15 С (температура смеси достигала 8 С в конце добавления). Затем температуру рубашки устанавливали равной 20 С. Реактор и линии для добавления промывали деионизированной водой (6 галлонов) и промывочные растворы объединяли со смесью. За этим следовало добавление МТВЕ (27 кг, Pride). Полученную в результате смесь перемешивали в течение 1/2 ч, затем перемешивание останавливали для разделения фаз. Водный слой отделяли и экстрагировали МТВЕ (14 кг, Pride) во втором реакторе. Объединенные органические слои промывали последовательно 5% NaCl (34 л), 5% NaHCO3 (34 л) и 10% NaCl (19 л). После переноса в бочку и взвешивания (172,2 кг) органическую фазу возвращали в реактор и концентрировали при пониженном давлении (температура рубашки реактора установлена на 30 С), удаляя 116 кг отгона в течение трехчасового периода. Полученную в результате суспензию разбавляли н-гептаном (75 кг, Corcoreagent grade) и дополнительно упаривали для удаления дополнительных 75 л отгона. После перемешивания при комнатной температуре в течение ночи суспензию охлаждали до 5 С в течение 1 ч. Продукт собирали на Aurora фильтре и промывали 33 кг н-гептана. Остаток на фильтре сушили в лотках при комнатном давлении в течение ночи с продувкой азотом, но не нагреванием. Это давало в результате 17,8 кгLCAP, 95,8 LCWP. Получение 1-циклопентен-1-илового эфира 1,1,1-трифторметансульфоновой кислоты В 100-галлоновый стеклоэмалированный реактор при комнатной температуре загружали циклопентанон (8,95 кг, 106,5 моль) с последующим добавлением толуола (116,40 кг, Corco reagent grade) и этилдиизопропиламина (16,6 кг, 128,7 моль). Полученный в результате раствор перемешивали и нагревали до 455 С. На данном этапе трифторметансульфангидрид (36,2 кг, 128,4 моль) добавляли в течение приблизительно 1 ч из 30-литровой капельной воронки. Добавление трифторметансульфоангидрида было очень экзотермичным. Охлаждение с помощью рубашки (установлена на 10 С) применяли для поддержания температуры смеси 455 С. Температура смеси падала ниже 40 С в течение 7 мин в процессе 44 минутного добавления. Перемешивание продолжали при 39-45 С в течение 20 мин после добавления трифторметансульфоангидрида. Испытание в ходе процесса после данных 20 мин показало полное потребление циклопентанона. После охлаждения до 19,6 С смесь фильтровали через слой целита (18,0 кг) на фильтре. Фильтрат собирали в чистую стальную бочку с полимерным покрытием. Слой целита промывали толуолом (37,0 кг, Corco reagent grade). Промывочный раствор смешивали со смесью в той же самой стальной бочке с полимерным покрытием. Фильтрат (159,85 кг) анализировали с образцом для сравнения для того, чтобы показать, что он содержит 19,50 кг (83,3% выход) енолтрифлата. Данный раствор енолтрифлата в толуоле хранили в холодной комнате в течение ночи и применяли в последующей реакции конденсации Сузуки без дополнительной очистки. Получение соединения В 1,1-Диметилэтиловый эфир 2-(1-циклопентен-1-ил)-4-метокси-1 Н-индол-1-карбоновой кислоты В 100-галлоновый стеклоэмалированный реактор при комнатной температуре загружали соединение А (18,00 кг, 61,8 моль), трифенилфосфин (648,8 г, 2,47 моль) и ацетат палладия (277,0 г, 1,23 моль). Затем реактор разрежали и заполняли три раза азотом. Толуол (78,3 кг, Corco reagent grade) вводили в реактор с помощью струйного насоса с последующим добавлением дициклогексиламина (44,5 кг, 245,4 моль). Это добавление отнимало 4 мин. Полученную в результате суспензию энергично перемешивали(125 об/мин) при комнатной температуре в течение 21 мин с последующим медленным добавлением енолтрифлата в толуоле (131,7 кг, содержащие 16,07 кг енолтрифлата, 74,3 моль) в течение 43 мин. Добавление енолтрифлата было экзотермическим. Охлаждение с помощью рубашки применяли для поддержания температуры смеси равной 18,8-27,5 С. Полученную в результате гетерогенную смесь перемешивали при 18,4-22,3 С до обнаружения завершения реакции ВЭЖХ (обратите внимание: хотя реакция завершилась за менее чем 1 ч, перемешивание все еще продолжали при комнатной температуре в течение ночи перед продолжением обработки. Это было сделано ради удобства. Смесь можно выдерживать при комнатной температуре в течение вплоть до 100 ч с отсутствием побочных эффектов на продукт). Добавляли к смеси целит (9,00 кг). Смесь перемешивали при комнатной температуре в течение 10 мин и затем фильтровали через слой целлита (2,70 кг) на фильтре. Фильтрат собирали в две чистые стальные бочки с полимерным покрытием. Остаток на фильтре промывали толуолом (47,8 кг, Corco reagent grade). Промывочный раствор объединяли со смесью в тех же самых стальных бочках с полимерным покрытием. Фильтрат (260,45 кг) анализировали с образцом для сравнения для того, чтобы показать,что он содержит 20,59 кг (106,4% выход) соединения В. Было сделано предположение на основе анализа,что данная реакция прошла со 100% выходом, и загрузки в следующую стадию осуществляли, как если бы реакция прошла на 100%. Раствор соединения В в толуоле хранили в опытной установке при комнатной температуре и применяли в следующей стадии деблокирования без дополнительной очистки. Получение соединения С 2-(Циклопентен-1-ил)-4-метокси-1 Н-индол В 100-галлоновый стеклоэмалированный реактор при комнатной температуре загружали соединение В в потоке толуола (12,82 кг соединения В, 40,96 моль) с последующим добавлением метоксида натрия (44,0 кг, 25-30 мас.% раствор в МеОН, 203,7 моль). Полученный в результате раствор перемешивали и нагревали до 455 С. Перемешивание продолжали при 455 С до обнаружения завершения реакции ВЭЖХ (реакция завершалась в течение 4 ч, ВЭЖХ данные получены через 8 ч). Затем смесь охлаждали до 23,5 С в течение 26 мин. Смесь перемешивали в течение ночи при 222 С. Через 17 ч при 22 С приблизительно 1/2 смеси (111,15 кг) переносили во второй реактор и обрабатывали отдельно. В первый реактор загружали DI воду (21 галлон). Полученную в результате смесь перемешивали в течение 16 мин,затем перемешивание останавливали. После разделения слоев при комнатной температуре в течение 46 мин нижний водный слой удаляли. За этим следовала небольшая порция смешанного слоя, который сбрасывали в чистый баллон. Оставшийся органический слой фильтровали через слой целлита (3,84 кг) на фильтре. Фильтрат собирали в чистую стальную бочку с полимерным покрытием. Затем смешанный слой фильтровали через тот же слой целита и фильтрат собирали в новый баллон. Слой целита промывали толуолом (6,20 кг, Corco reagent grade) и данный промывочный раствор смешивали с отфильтрованным смешанным слоем. Затем отфильтрованный смешанный слой переносили в стеклянную делительную воронку, в которой нижний водный слой удаляли, и органический слой из смеси смешивали с первоначальным органическим слоем. Данный способ обработки повторяли со второй половиной смеси,получая второй толуольный раствор соединения С. Максимальное возможное количество второго раствора помещали в стальную бочку с полимерным покрытием, содержащую первый органический слой(164,70 кг, содержащие 8,14 кг соединения С). Оставшийся второй органический слой содержали в небольшой полимерной бочке (19,05 кг, содержащий 0,49 кг соединения С). Данные два раствора хранили в опытной установке для дальнейшей обработки в следующей стадии без дополнительной очистки. Был получен суммарный вес 8,63 кг (99,2% выход) соединения С. Получение соединения D 3 а,3b,4,5,6,6 а,7,11 с-Октагидро-11-метокси-1 Н-циклопента[а]пирроло[3,4-с]карбазол-1,3(2 Н)-дион В 100-галлоновый стеклоэмалированный реактор при комнатной температуре загружали соединение С в потоке толуола (12,58 кг соединения С, 59,1 моль). Данный раствор концентрировали при максимальном вакууме и при внутренней температуре 40 С до того, как остаток весил приблизительно в шесть раз больше соединения С (требуемый объем 75,5 л), в течение приблизительно 7 ч. Данный остаток выливали в чистую полиэтиленовую бочку и применяли в следующей реакции Дильса-Альдера без дополнительной очистки. Во второй 100-галлоновый стеклоэмалированный реактор загружали малеимид(7,45 кг, 76,8 моль, Carbosynth Limited) с последующим добавлением ледяной уксусной кислоты (145,70 кг). Полученную в результате смесь перемешивали для получения раствора. На данном этапе концентрированный раствор соединения С, полученный ранее (84,95 кг), загружали в течение приблизительно 20 мин, контролируя температуру смеси равной 2010 С (температуру рубашки устанавливали равной 15 С). Полученную в результате смесь перемешивали при 303 С до обнаружения завершения реакции ВЭЖХ (реакция завершалась через 15,5 ч, ВЭЖХ данные получали через 17,5 ч). Затем смесь охлаждали до 23,2 С в течение приблизительно 20 мин. После анализа маточника на массу на основе ВЭЖХ анализа и подтверждения, что он содержит менее чем 10% соединения D (найдено 5,88%), смесь фильтровали через Aurora фильтр (2,5 ч после достижения 23,2 С для времени фильтрования). Остаток на фильтре промывали ледяной уксусной кислотой (39,65 кг) и продували для сушки на фильтре в вакууме потоком азота до достижения чистоты соединения D, удовлетворяющей требованиям спецификации (90 мас.%) ВЭЖХ анализом на основе веса (сушку осуществляли в течение 3 ночей, чистота равнялась 99,5 мас.%, после 3 ночей). Затем продукт выгружали в две картонные бочки с полиэтиленовыми мешками для получения 13,43 кг (73,3% выход) требуемого соединения D в виде коричневого твердого остатка. Данное соединение применяли в следующей стадии окисления хлоранилом без очистки. Получение соединения Е 4,5,6,7-Тетрагидро-11-метокси-1 Н-циклопента[а]пирроло[3,4-с]карбазол-1,3(2 Н)дион В 100-галлоновый стеклоэмалированный реактор при комнатной температуре загружали соединение D (28,66 кг, 92,45 моль) с последующим добавлением тетрахлор-п-бензохинона (45,50 кг, 185,0 моль,99%, ACROS) и THF (253,1 кг, CORCO reagent grade). Полученную в результате гетерогенную смесь нагревали до 655 С и перемешивали при данной температуре до обнаружения завершения реакции ВЭЖХ(реакция протекала в течение 22 ч, ВЭЖХ данные получали через 23 ч). Затем смесь охлаждали до 225 С в течение 35 мин, анализировали на расход соединения Е в растворе (10% требования; найдено 1,9%) и фильтровали через фильтр. Реактор, линии и остаток на фильтре промывали смесью THF-EtOHH2O (полученной во втором реакторе смешением 62,0 кг THF с 41,25 кг EtOH и 4,64 галлонами деионизированной воды). Влажный остаток на фильтре сушили на фильтре в вакууме в потоке азота, до того как продукт стал удовлетворять требованиям спецификации (80 мас.% соединения Е; найдено 80,8 мас.% через 5 дней). Затем продукт выгружали в две пластиковые бочки с полиэтиленовыми мешками, получая 23,84 кг (86,7% выход) соединения Е темного зелено-желтого твердого остатка. Данное вещество применяли непосредственно в следующей реакции Манниха без дополнительной очистки. Получение соединения I В 100-галлоновый стеклоэмалированный реактор загружали соединение Е (15,20 кг, 40,1 моль) с последующим добавлением параформальдегида (2,51 кг, 80,9 моль, 97%, ACROS) и денатурированного этанола (223,45 кг, reagent grade). Полученную в результате смесь перемешивали (121 об/мин), в то время как 1-метилпиперазин (6,65 кг, 65,77 моль, ACROS, 99%) добавляли в течение приблизительно 10 мин из капельной воронки. Полученную в результате реакционную смесь нагревали и перемешивали при 70 С. Протекание реакции контролировали ВЭЖХ (1,35% соединения Е оставалось через 5 ч). После перемешивания при 70 С в течение в сумме 9 ч смесь охлаждали до 203 С и перемешивали при данной температуре в течение ночи. Продукт фильтровали через фильтр. Остаток на фильтре промывали этанолом(43,9 кг, reagent grade) и сушили на фильтре продувкой азотом до того, как остаточный этанол составлял менее чем 12 мас.% с помощью 1 Н ЯМР (8,4 мас.% относительно соединения I). Затем продукт выгружали в картонную бочку с полиэтиленовым пакетом для получения 18,05 кг (95,8% выход) неочищенного соединения I в виде желтого твердого остатка: 98,6 LCAP, 89,2 LCWP. Данное вещество применяли непосредственно в следующем по потоку процессе без дополнительной очистки. Скрининг полиморфизма Исследования по кристаллизации осуществляли для изучения полиморфизма в 48 различных растворителях. Растворители выбирали на основе соответствия требованиям (ICH класс 3 и 2) и для того,чтобы получить диапазон диэлектрических постоянных, дипольных моментов и функциональных групп. Выбирали два исходных вещества: форму А 0 и лот 7 (смесь формы А 0, формы НС 0 и формы HD0). При наличии возможности получали все характеристики для новых форм, которые были получены в процессе скрининга полиморфизма соединения I. Данные характеристики включали XRPD, термический анализ,ДСП, хранение при 40 С/75% RH и чистоту. Четыре методики для кристаллизации, включая охлаждение, упаривание и добавление антирастворителя, применяли для получения различных полиморфных форм соединения I. Подробности каждого способа кристаллизации даны ниже. Твердые формы, полученные из каждого растворителя из данных методик, приведены в табл. 15. Способ кристаллизации 1. Скрининг с быстрой кристаллизацией Применяли две мелкомасштабные методики скрининга.A. Приблизительно 1 мг соединения I взвешивали в 0,5-мл полипропиленовой пробирке для центрифуги и 0,5 мл растворителя. Пробирку для центрифуги оставляли в течение 18 ч нетронутой при комнатной температуре и наблюдали изменения. Затем пробирку встряхивали в течение 2,5 ч при 52,5 С и наблюдали изменения в каждой пробирке. Затем нагретую пробирку для центрифуги встряхивали в течение 20 ч при 2-8 С и осуществляли наблюдения за изменением кристаллического состояния (если оно вообще было) по сравнению с первоначальными условиями с комнатной температурой.B. Пластинки, содержащие 10 объемов соединения I (40 мг лота 7 в 400 мкл), нагревали от 20 С до первоначальной температуры 80 С при скорости нагревания 4,8 С/мин и через 30 мин охлаждали при низкой (0,28 С/мин) или высокой (10 С/мин) скорости охлаждения до конечной температуры 5 С и выдерживали при данной температуре в течение 18 ч. Эксперименты по кристаллизации осуществляли в планшетах с лунками для стеклянных пробирок (4 мл) и твердые вещества выделяли фильтрацией. Твердое вещество сушили при 57 С в течение 10 ч. 2. Кристаллизация с быстрым охлаждением Образцы получали добавлением 40 мг (2) твердого соединения I к объему растворителя, обеспечивая условием насыщения при температуре кипения. Смесь охлаждали и фильтровали через 0,2-мкм найлоновый мембранный фильтр в нагретую стеклянную пробирку или коническую колбу Эрленмейера. Раствор охлаждали до комнатной температуры и помещали в холодильник (приблизительно 4 С) до того,как, по-видимому, образование кристаллов завершалось, как определено визуальным обследованием. Каждый образец из холодильника декантировали, и кристаллы переносили на бумагу для взвешивания и сушили до постоянного веса в естественных лабораторных условиях. Образцы, которые было сложно декантировать, центрифугировали при 12000 об/мин в течение 4 мин. Если способ с быстрым охлаждением не давал в результате твердые вещества, данные образцы концентрировали упариванием приблизительно до половины объема растворителя. Растворы снова помещали в холодильник, и твердое вещество выделяли декантированием или центрифугированием. 3. Кристаллизация при выдерживании лота 7 и формы А 0 Осуществляли два типа исследований с выдерживанием.A. Образцы получали добавлением приблизительно 10 мг или лота 7 или формы А 0 к 1,0 мл каждого растворителя в пробирках с завинчивающейся пробкой (объем приблизительно 4,0 мл). Затем их нагревали до 64 С при встряхивании. После выдерживания при 64 С в течение 40 мин образцы охлаждали до 5 С (при скорости охлаждения -0,25 С/мин). Образцы выдерживали при 5 С в течение суммарного времени 18 ч и переносили пипеткой в 1,5-мл полипропиленовые пробирки для центрифуги и центрифугировали при 12000 об/мин в течение 1 мин. Надосадочную жидкость декантировали. Затем остатки в пробирках для центрифуги или стеклянных пробирках сушили в вакуумной печи при 110 С в течение 18 ч и анализировали XRPD.(0,5 С/мин) и 5 С (-0,5 С/мин). Затем твердое вещество выделяли фильтрацией и анализировали XRPD и термическим анализом. 4. Кристаллизация с применением суспензии формы А 0 Суспензии (20 мг формы А 0 в 500 мкл каждого растворителя) встряхивали при 25 С в течение различного времени. Твердое вещество выделяли фильтрацией и сушили при 57 С в течение 2 ч и анализировали XRPD.XRPD результаты для выделенных твердых форм для четырех способов кристаллизации показаны в табл. 15 ниже. Таблица 15. Итоговая таблица для форм соединения I, полученная на основании XRPD результатов для 48 различных растворителей и различных способов кристаллизации Скрининг полиморфизма соединения I дал четырнадцать форм и новую форму (форма В 0), полученную только при нагревании гидратов выше 120 С. Результаты выделенных форм показаны в табл. 16 ниже. Таблица 16. Характеристики выделенных форм соединения I Описание стабильных твердых форм Получение безводной формы А 0 Приблизительно 200 мг соединения I суспендировали в 45 объемах гептана при 85 С в течение 45 ч,охлаждали до 65 С и сушили на фильтре при высоком вакууме при комнатной температуре в течение 3 ч. Количество выделенной формы А 0 составляло 97%. В альтернативном способе превращение соединения I в форму А 0 осуществляли согласно следующему способу: 1) соединение I растворяли в 30 объемах THF (ТГФ). На данном этапе раствор при желании можно обрабатывать секвестрантом металлов или углем. 2) Полученный в результате раствор фильтровали для удаления секвестранта металлов или угля с последующей полировочной фильтрацией через 1-микронный встроенный картриджный фильтр для удаления внешних частиц. 3) Растворитель (THF) частично отгоняли до приблизительно 60% первоначального объема в вакууме при температуре окружающей среды с последующим медленным добавлением эквивалентного количества антирастворителя (гептана) для осаждения соединения I. 4) Вакуумную отгонку и добавление дополнительного количества гептана продолжали до того, как содержание растворителя составляло менее чем 5% THF по объему. 5) Полученную в результате суспензию нагревали до 90-96 С и перемешивали при данной температуре в течение 3-5 ч для достижения полного превращения в форму А 0. 6) Суспензию охлаждали до температуры окружающей среды (255 С). 7) Продукт/соединение I собирали с помощью фильтрации в атмосфере сухого инертного газа для того, чтобы избежать поглощения продуктом влаги. 8) Влажный остаток на фильтре сушили при вплоть до 80 С до того, как остаточное количество растворителей удовлетворяло бы спецификации. Сушку можно осуществлять при атмосферном давлении или в вакууме. Определение характеристик формы А 0 с применением порошковой рентгеновской дифракции с переменной температурой (VT-XRPD) Полиморфного превращения не происходило в диапазоне температур 20-250 С для формы А 0. После воздействия условий окружающей среды не было заметных изменений в XRPD дифрактограмме образца, полученного нагреванием до 220 С (см. фиг. 15). Определение характеристик формы А 0 термическим гравиметрическим анализом (ТГА) Форма А 0 имеет единственный пик при приблизительно 239 С с энтальпией плавления (HFus) 84,4 Дж/г. Потерю массы не наблюдали с помощью ТГА. Протекание процесса десольватации отбрасывали,потому что с помощью ТГА не была обнаружена потеря массы (см. фиг. 16). Определение характеристик формы А 0 поглощением воды (ДСП) Регулярная ДСП (0-90% RH) Количество влаги, поглощенное при 75% RH, было меньшим чем 0,08% и приблизительно 0,1% при 90% RH. Кривые адсорбции и десорбции перекрывались, предполагая, что форма А 0 не является гигроскопичной (см. фиг. 17 и табл. 25). Заметные изменения не наблюдали XRPD повторным анализом после ДСП (фиг. 18). Таблица 17. ДСП данные для формы А 0 (регулярная) Нерегулярная ДСП (90-0% RH) Масса образца увеличивалась только на 0,5% при 90%RH. Зона неоднозначности предполагает,что протекает только поверхностное поглощение воды. Изотерма является обратимой с суммарным увеличением массы 0,6% (фиг. 19 и табл. 26). Заметные изменения не наблюдали XRPD повторным анализом после ДСП (фиг. 18). Таблица 18. ДСП данные для формы А 0 (нерегулярная) Определение характеристик формы А 0 инфракрасной спектроскопией с Фурье-преобразованиемFTIR и рамановский спектр кристаллической формы А 0 показаны на фиг. 20 и 21, соответственно. Получение безводной формы В 0 Форму В 0 получали нагреванием 20 мг соединения I до 125 С в потоке азота. Определение характеристик формы В 0 порошковой рентгеновской дифракцией с переменной температурой (VT-XRPD) После дегидратации полиморфное превращение не протекало в диапазоне 150-200 С для формы В 0(см. фиг. 22). Определение характеристик формы В 0 термическим анализом Диаграмма дифференциальной сканирующей калориметрии (ДСК) формы В 0 имела температуру плавления, приблизительно равную 197 С, с энтальпией плавления (Hfus) 68,2 Дж/г (фиг. 23). Протекало полиморфное превращение до температуры плавления формы В 0 соединения I. Форму В 0 получали только десольватацией. Относительная термодинамическая стабильность форм отражена в ДСК данных, показанных между 120 и 199 С. Получение гидратной формы НА 0 Кристаллизация из смеси THF/гептан Форму НА 0 получали в виде 200 мг соединения I, осажденного из 70 объемов THF с 143 объемами гептана при комнатной температуре. Продукт выделяли фильтрацией. Вещество сушили при 57 С в течение 18 ч. Получение твердофазным переходом Форму НА 0 получали в виде 20 мг соединения I нагреванием до 125 С и охлаждением до комнатной температуры без потока азота. Определение характеристик формы НА 0 термическим анализом ДСК термограммы формы НА 0 показали наличие двух различных эндотермических пиков (фиг. 24 и табл. 27). В открытой кювете гидраты обладали широким эндотермическим пиком между приблизительно 60 и 120 С, соответствующим суммарному количеству воды, покидающему кристалл. Эндотермический процесс соответствует процессу дегидратации, включающему выделение воды из кристаллической решетки. Десольватация происходит в твердом состоянии с эндотермическим пиком. Положение и энергия данного эндотермического пика зависят от диаграммы фазового равновесия двух компонентов,лекарственного средства и растворителя, и стабильности образующегося компонента. ДСК термограммы сольватов содержат широкие эндотермические пики при температурах вблизи температуры кипения соответствующих им растворителей, которые можно приписать процессам десольватации, что подтверждается ТГА. Моногидратная форма НА 0 при исследовании ТГА демонстрирует среднюю потерю массы 4,0% между 50 и 120 С. Это согласуется с теоретической величиной для объединения одного моля воды с одним молем соединения I, равной 4,1%. Таблица 19. ДСК температуры начала и максимальная температура десольватации для формы НА 0 Определение характеристик формы НА 0 сорбцией воды Фиг. 25 показывает данные по динамической сорбции паров, полученные для формы НА 0. После сушки протекает немедленное поглощение при воздействии влаги. Изотерма формы НА 0 показывает 1,25% снижение веса между 20-30% RH. Начиная с 30-90% RH, поглощение начинает достигать равновесия. В течение первой фазы десорбции присутствует небольшой гистерезис, предполагающий только поверхностное поглощение. Десорбция практически отсутствует в течение второй фазы десорбции, но образец подвергается второму изменению 0,4%. Сорбция доказывает, что данная форма представляет собой канальный гидрат. Нестехиометрическая гидратация является результатом неполной гидратации каналов кристаллической решетки. Значительные изменения не наблюдали при XRPD повторном анализе после ДСП. Определение характеристик FTIR и рамановской спектроскопиейFTIR и рамановские спектры кристаллической формы НА 0 показаны на фиг. 26 и 27, соответственно. Получение гидратной формы НС 0 Перекристаллизация из смеси этанол/вода Форму НС 0 получали по мере того, как 40 мг лота 7 добавляли в 400 мкл этанола и 100 мкл воды. Образец нагревали до первоначальной температуры 80 С при скорости нагревания 4,8 С/мин и через 30 мин охлаждали при 0,28 С/мин до конечной температуры 5 С и выдерживали при данной температуре в течение 18 ч. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Хранение при 40 С/75% RH в виде сольвата с этанолом Форму НС 0, полученную в виде 20 мг сольвата с этанолом соединения I, хранили при 40 С/75% RH в течение 9 дней. Получение кристаллической структуры Монокристаллы получали добавлением 200 мг твердого вещества лота 7 к тетрагидрофурану для обеспечения насыщенных условий при температуре кипения для моногидрата НС 0. Смесь охлаждали и фильтровали через 0,22-мкм найлоновый мембранный фильтр в нагретую стеклянную пробирку. Раствор охлаждали до 20 С 0,2 С для того, чтобы увеличить величину перенасыщения, и гомогенный раствор оставляли на несколько дней. Определение кристаллической структуры дифракцией рентгеновских лучей на монокристаллах Данные дифракции рентгеновских лучей на монокристаллах получали для НС 0. Параметры ячейки,полученные из этих данных, представлены в табл. 28. Данные получали при температуре 103 К, применяя -2 способ сканирования. Бесцветную пластинку C24H28N4O4, имеющую приблизительные размеры 0,300,160,11 мм, устанавливали на стекловолокно с произвольной ориентацией. Параметры триклинной элементарной ячейки (Р-1, Z=2) и рассчитанные объемы были следующими: Таблица 20. Данные рентгеновского анализа кристаллов и параметры уточнения для формы НС 0 Определение характеристик формы НС 0 термическим анализом ДСК термограмма формы НС 0 показывает наличие двух различных эндотермических пиков (фиг. 28 и табл. 29). Моногидратная НС 0 при анализе ТГА показала среднюю потерю массы 3,9% между 50 и 120 С. Это соответствует теоретической величине для объединения одного моля воды с одним молем соединения I 4,1%. Таблица 21. ДСК начальная и максимальная температуры десольватации для формы НС 0 Определение характеристик формы НС 0 сорбцией воды Регулярная ДСП (0-90% RH) Зона неоднозначности предполагает, что протекает только поверхностное поглощение воды с суммарным поглощением 0,4% (фиг. 29 и табл. 30). Значительные изменения не наблюдали XRPD повторным анализом после ДСП (фиг. 30). Таблица 22. ДСП данные для формы НС 0 (регулярная) Нерегулярная ДСП (90-0% RH) Зона неоднозначности предполагает, что протекает только поверхностное поглощение воды от 040% RH. Начиная с 40-90% RH, по-видимому, протекает объемное поглощение (фиг. 31 и табл. 31). Значительные изменения не наблюдали XRPD повторным анализом после ДСП (фиг. 30). Таблица 23. ДСП данные для формы НС 0 (нерегулярная)FTIR и рамановские спектры кристаллической формы НС 0 показаны на фиг. 32 и 33, соответственно. Получение гидратной формы HD0 Перекристаллизация из смеси ацетон/вода Форму HD0 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл ацетона и 100 мкл воды. Образец нагревали до первоначальной температуры 80 С при скорости нагревания 4,8 С/мин и через 30 мин охлаждали при скорости охлаждения 0,28 С/мин до конечной температуры 5 С и выдерживали при данной температуре в течение 18 ч. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из 2-метил-2-пропанола Форму HD0 получали по мере того, как 0,54 г соединения I в 55 мл 2-метил-2-пропанола практически полностью растворяли нагреванием до температуры кипения. Мутный раствор фильтровали через шприц, применяя 5-мкм найлоновый мембранный шприцевой фильтр, для получения прозрачного раствора (приблизительно 15% пролили и потеряли). Раствор концентрировали до 25-30 мл и охлаждали в течение 4,5-5 ч при 2-8 С для получения твердого вещества. Твердое вещество плавили в печи при 50 С и нерастворимое вещество отделяли фильтрацией с отсасыванием на теплой установке для предотвращения замерзания трет-бутилового спирта. Полученное в результате твердое вещество сушили в 50 С печи в течение 2 ч для получения 0,42 г (75% извлечение). Перекристаллизация из изопропилацетата Форму HD0 получали по мере того, как 0,45 г соединения I в 7,5 мл изопропилацетата перемешивали в течение 20 ч при комнатной температуре с магнитной мешалкой в стеклянном 20-мл сцинтилляционном флаконе со слегка закрепленной крышкой. Суспензию фильтровали с отсасыванием, и твердое вещество сушили в течение 110 ч на воздухе, в вытяжном шкафу. Высушенное вещество весило 380 мг(84% извлечение). Получение кристаллической структуры Монокристаллы получали добавлением 200 мг твердого вещества лота 7 к тетрагидрофурану для обеспечения насыщенными условиями моногидратной НС 0 при температуре кипения. Смесь охлаждали и фильтровали через 0,22-мкм найлоновый мембранный фильтр в нагретую стеклянную пробирку. Раствор охлаждали до 20 С 0,2 С для того, чтобы увеличить величину пересыщения, и гомогенный раствор оставляли в течение нескольких дней. Определение кристаллической структуры дифракцией рентгеновских лучей на монокристаллах Данные дифракции рентгеновских лучей на монокристаллах получали для HD0. Параметры ячейки,полученные из этих данных, представлены в табл. 32 ниже. Данные получали при температуре 103 К,применяя -2 способ сканирования. Бесцветную пластинку C24H28N4O4, имеющую приблизительные размеры 0,400,250,08 мм, устанавливали на стекловолокно с произвольной ориентацией. Параметры триклинной элементарной ячейки (Р-1, Z=2) и рассчитанные объемы были следующими: Таблица 24. Данные рентгеновского анализа кристаллов и параметры уточнения для формы HD0 Определение характеристик формы HD0 термическим анализом ДСК термограмма формы HD0 показывает наличие двух различных эндотермических пиков (фиг. 34 и табл. 33). Моногидратная HD0 при анализе ТГА показала среднюю потерю веса 4,0% между 50 и 120 С. Это соответствует теоретической величине для объединения одного моля воды с одним молем соединения I 4,1%. Таблица 25. ДСП начальный и максимальная температуры десольватации для формы HD0 Определение характеристик формы HD0 сорбцией воды Регулярная ДСП (0-90% RH) Масса образца увеличивалась только на 0,6% при 90% RH. Зона неоднозначности предполагает, что протекает поверхностная адсорбция воды и объемная абсорбция (фиг. 35 и табл. 34). Значительные изменения не наблюдали XRPD повторным анализом после ДСП (фиг. 36). Таблица 26. ДСП данные для формы HD0 (регулярная) Нерегулярная ДСП (90-0% RH) Масса образца увеличивалась только на 0,8% при 90% RH. Зона неоднозначности предполагает, что протекает поверхностная адсорбция воды и ограниченная объемная абсорбция (фиг. 37 и табл. 26). Значительные изменения не наблюдали XRPD повторным анализом после ДСП (фиг. 27). Таблица 27. ДСП данные для формы HD0 (нерегулярная) Определение характеристик формы HD0 FTIR и рамановской спектроскопиейFTIR и рамановские спектры кристаллической формы HD0 показаны на фиг. 38 и 39, соответственно. Сольватные формы соединения I Перекристаллизация из метанола Форму S20 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл метанола. Образец суспендировали при 20 С 0,2 в течение 3 дней. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из 2-пропанола Форму S30 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл 2-пропанола. Образец суспендировали при 20 С 0,2 в течение 3 дней. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из этанола Форму S40 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл этанола. Образец суспендировали при 20 С 0,2 в течение 3 дней. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Получение кристаллической структуры Монокристаллы получали добавлением 200 мг твердого вещества лота 7 к этанолу для обеспечения насыщенных условий при температуре кипения для сольвата с этанолом. Смесь охлаждали и фильтровали через 0,22-мкм найлоновый мембранный фильтр в нагретую стеклянную пробирку. Раствор охлаждали до 20 оС 0,2 С для того, чтобы увеличить величину пересыщения, и гомогенный раствор оставляли на несколько дней. Перекристаллизация из N,N-диметилформамида Форму S50 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл N,N-диметилформамида(DMF). Образец суспендировали при 20 С 0,2 в течение 3 дней. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из этиленгликоля Форму S60 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл этиленгликоля. Образец нагревали до первоначальной температуры 80 С при скорости нагревания 4,8 С/мин и через 30 мин охлаждали при скорости 0,28 С/мин до конечной температуры 5 С и выдерживали при данной температуре в течение 18 ч. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из пиридина Форму S70 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл пиридина. Образец нагревали до первоначальной температуры 80 С при скорости нагревания 4,8 С/мин и через 30 мин охлаждали при скорости 0,28 С/мин до конечной температуры 5 С и выдерживали при данной температуре в течение 18 ч. Твердое вещество выделяли фильтрацией. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из 1-пропанола Форму S90 получали в виде 40 мг соединения I в 1-пропаноле, обеспечивая насыщенными условиями при температуре кипения. Смесь охлаждали и фильтровали через 5-мкм найлоновый мембранный фильтр в нагретую стеклянную пробирку. Раствор охлаждали до комнатной температуры и помещали в холодильник (приблизительно 4 С) до того, как образование кристаллов, по-видимому, достигало завершения, как определено визуальным осмотром. Образцы, которые было трудно декантировать, центрифугировали при 12000 об/мин в течение 4 мин. Перекристаллизация из N,N-диметилацетамида Форму S100 получали по мере того, как 40 мг лота 7 добавляли к 400 мкл N,N-диметилацетамида(DMA). Образец суспендировали при 20 С 0,2 в течение 3 дней. Твердое вещество выделяли фильтраци- 23020756 ей. Вещество сушили при 57 С в течение 10 ч. Перекристаллизация из изобутанола Форму S120 получали в виде 40 мг соединения I в изобутаноле, обеспечивая насыщенными условиями при температуре кипения. Смесь охлаждали и фильтровали через 5-мкм найлоновый мембранный фильтр в нагретую стеклянную пробирку. Раствор охлаждали до комнатной температуры и помещали в холодильник (приблизительно 4 С) до того, как образование кристаллов, по-видимому, достигало завершения, как определено визуальным осмотром. Образцы, которые было трудно декантировать, центрифугировали при 12000 об/мин в течение 4 мин. Определение кристаллической структуры дифракцией рентгеновских лучей на монокристаллах Данные дифракции рентгеновских лучей на монокристаллах получали для формы S40. Параметры ячейки, полученные из этих данных, представлены в табл. 28. Таблица 28. Данные рентгеновского анализа кристаллов и параметры уточнения для сольвата с этанолом S40 Термический анализ сольватированных форм соединения I ДСК кривые нагрева показывают наличие большой и широкой эндотермы перед температурой плавления соединения I для всех сольватов. ТГА исследования показали, что данные эндотермы можно объяснить процессом десольватации для форм S20 (фиг. 40), S30 (фиг. 41), S40 (фиг. 42), S50 (фиг. 43), S60(фиг. 44), S70 (фиг. 45), S90 (фиг. 46), S100 (фиг. 47) и S120 (фиг. 48). Расчеты потери веса растворителя,приведенные для данных растворителей, представлены в табл. 29. Таблица 29. ДСК начальная и максимальная температуры десольватации для сольватных форм Определение кристаллической структуры моногидратов соединения I Гидратные формы НС 0 и HD0 являются изоструктурными, что значит то, что отдельные "изоморфные сольваты" кристаллизуются в одной группе симметрии только с небольшими искажениями постоянных решетки и с таким же типом молекулярной сетки основных молекул (Reutzel-Edens S. М., Newman ACo. KGaA ISBN: 9783527311460). Форма НС 0 и форма HD0 отличаются конформацией тетрагидропиразинового кольца. Порошковую рентгеновскую дифрактограмму двух гидратных форм можно результативно уточнить, применяя способ Ритвельда (Rietveld H. M. "A profile refinement method for nuclear andmagnetic structures", Journal of Applied Crystallography 2: 65-71 (1969 с параметрами монокристаллов в качестве исходных данных. Подробные данные о постоянных решетки, накопленные данные и данные по уточнению резюмированы в табл. 28 и 32.FTIR и FT-рамановский способ для идентификации Сравнение FTIR и рамановских спектров на фиг. 20 и 21 для формы А 0 и для гидратов (фиг. 26, 32,38) и (фиг. 27, 33, 39) показывает небольшое различие, за исключением области колебаний карбонильной группы для FTIR. В А 0 пик средней интенсивности возникает при 1765 см-1 для FTIR и 1770 см-1 для рамановской- 24020756 спектроскопии. В гидратных формах пик средней интенсивности появлялся в области 1742 см-1 для FTIR и 1754-1695 см-1 для рамановской спектроскопии. Данный пик поглощения приписывают карбонильной группе имида, содержащейся в пятичленном кольце структуры соединения I. Данное различие является достаточно большим и может применяться для идентификации практически чистых твердых форм. Икспектры гидратных форм и А 0 обладают некоторыми различиями, но наиболее значительно затрагивают широкую полосу (3800-2800), присутствующую у гидратных форм в результате колебаний -ОН связи в гидроксильной группе. Таблица 30. Частоты (см-1) и отнесение собственных колебаний для соединения I для FTIR Таблица 31. Частоты (см-1) и отнесение собственных колебаний для соединения I для рамановской спектроскопии Переходы между твердыми состояниями Относительная стабильность суспензий соединения I в воде Когда гидрат НА 0 и А 0 кристаллизуют из водной среды, получают смесь форм HC0+HD0 (табл. 32). Таблица 32. Кристаллические формы, полученные в планшете с лунками, соединения I Два мл воды добавляли к нескольким миллиграммам форм соединения I. Образцы суспендировали в течение ночи. Небольшой образец твердого вещества отбирали и анализировали XRPD. После суспендирования было обнаружено, что формы НА 0 и А 0 превратились в гидратные формы (смесь форм НС 0 иHD0) при всех исследуемых условиях (табл. 33-37). По-видимому, гидратная форма является более термодинамически стабильной, чем форма А 0 между 5 и 45 С. Таблица 33. XRPD анализ оставшегося твердого вещества после экспериментов на термодинамическую стабильность формы А 0 в воде при 5 С Таблица 34. XRPD анализ оставшегося твердого вещества после экспериментов на термодинамическую стабильность формы НА 0 и формы НВ 0 (смесь НС 0 и HD0) в воде при комнатной температуре Таблица 35. XRPD анализ оставшегося твердого вещества после экспериментов на термодинамическую стабильность формы НА 0 и формы НС 0 в воде при комнатной температуре Таблица 36. XRPD анализ оставшегося твердого вещества после экспериментов на термодинамическую стабильность формы НА 0 и формы HD0 в воде при комнатной температуре Таблица 37. XRPD анализ оставшегося твердого вещества после экспериментов на термодинамическую стабильность формы А 0 при 45 С в воде Относительная стабильность моногидратов Измеряя термодинамическую стабильность двух полиморфных форм (форма НС 0 и форма HD0) при используемом на практике диапазоне температур, можно определить, какая из форм является более стабильной и является ли переход между ними монотропным или энантиотропным. Эксперименты ставили так, чтобы измерить термодинамическую стабильность данных моногидратных форм при комнатной температуре и 55 С в этилацетате, МТВЕ и 1-пентаноле. Данные растворители выбирали, поскольку соединение I не образует сольватов в данных растворителях в процессе скрининга полиморфизма. Таблица 38. XRPD анализ оставшегося твердого вещества после экспериментов на термодинамическую стабильность моногидратных форм Результаты, приведенные в табл. 38, показывают, что для применяемых растворителей и диапазонов температур величины растворимости двух гидратированных полиморфных форм являются очень близкими, но всегда больше для формы HD0. Это действительно показывает, что между комнатной температурой и 55 С в растворе форма HD0 является более термодинамически стабильной, чем форма НС 0 и форма НА 0. Стабильность твердых форм при внешнем воздействии Исследования стабильности при внешнем воздействии осуществляли для получения заблаговременного представления о влиянии температуры и влажности на стабильность форм. Был разработан ВЭЖХ анализ, определяющий стабильность, для количественного определения количеств соединения I и его основного продукта разложения, 7-метокси-1,2,3,11-тетрагидро-5,11-диаза-бензо[а]тринден-4,6 диона, ранее называемого "соединением Е". Разработанный способ является специфичным, достоверным, точным и надежным. Способ позволяет точно и количественно определять соединение I и соединение Е. Все продукты разложения, образовавшиеся в процессе исследований по принудительному разложению, хорошо отделяются от основных пиков, демонстрируя то, что разработанный способ является специфичным и позволяющим определять стабильность. Форма А 0 В твердом состоянии безводная форма А 0 имеет склонность поглощать воду из окружающей среды и давать при стандартных ICH стрессовых условиях, 40 С и 75% RH, гидратные формы НС 0 и HD0 через 3 месяца. Химическое разложение не наблюдается в образцах соединения I при данных стрессовых условиях. Химическое разложение наблюдается только тогда, когда на соединение I воздействуют температурой 110 С (табл. 39, 40 и 41). Таблица 39. Стабильность формы А 0 при 40 С/75% RH Моногидратные формы Табл. 42, 43 и 44 показывают, что в твердом состоянии все кристаллические моногидраты были стабильны в течение 28 дней при хранении при 40 С и 75% относительной влажности. Таблица 42. Стабильность формы НА 0 при 40 С/75% RH Таблица 43. Данные о стабильности формы НС 0 при 40 С/75% RH Форма S40 Форма S40, сольват с этанолом, превращается в моногидратную форму НС 0 через 9 дней при 40 С/75% RH и остается в данном состоянии в течение 62 дней (табл. 45). Таблица 45. Данные о стабильности S40 при 40 С/75% RH Превращение форм при механическом воздействии Измельчение в ступке с пестиком Приблизительно 100 мг соединения I измельчали в течение различных периодов времени в диапазоне от 5 до 27 мин в агатовой ступке. Образцы отбирали для XRPD и термического анализа. Процесс измельчения прекращали каждые 5 мин для соскабливания и повторного смешения порошка с изгибающегося конца ступок для обеспечения гомогенного измельчения. Размол Wig-L-BugWig-1-Bug (Piketech, USA) применяли для измельчения формы А 0, НА 0 и НВ 0 (смесь форм НС 0 иHD0) соединения I. Каждый образец (50 мг) измельчали в течение периодов 5 и 10 мин или до того момента, когда не наблюдали изменений. Каждый размол осуществляли в 2,82 см 3 емкости, применяя 0,9 г шарик из нержавеющей стали (0,6 мм в диаметре). Емкость вращали по 6,5 дуге при 3200 об/мин, вызывая тем самым удар шариком по днищу емкости при частоте выше 100 Гц. Стабильность формы А 0 После 20 мин (ступка с пестиком) и 5 мин (Wig-1-Bug) XRPD рентгенограммы показали, что степень кристалличности заметно снизилась. Поскольку оставшиеся пики были в том же положении как для исходного вещества, образцы не стали полностью аморфными (фиг. 49). Стабильность форм НА 0, НС 0 и HD0 После трех пятиминутных интервалов измельчения XRPD рентгенограмма для измельченной формы НВ 0 (смесь форм НС 0 и HD0) (фиг. 50) была аналогичной рентгенограмме для измельченной НА 0.XRPD пик при 7,6(2) уменьшался по интенсивности приблизительно в 30 раз. ДСК кривые имеют широкую эндотерму в диапазоне от 50 до 100 С, которую можно приписать выделению воды. Термограмма показывают первый фазовый переход второго порядка Tg, расположенный приблизительно при 113 С (фиг. 51). ДСК показывает, что одна наблюдаемая экзотерма соответствует одностадийной перекристаллизации при 136 С в метастабильную форму В 0. Широкий эндотермический процесс соответствует плавлению формы В 0 и завершается при 231 С (форма А 0). Объяснение данных процессов можно получить, если рассматривать данные формы А 0 и В 0 как монотропные, когда форма А 0 является более стабильной формой. Подразумевается, что должно быть ясно, что высоты пиков, полученных как результат XRPD, VTXRPD экспериментов и дифрактограмм монокристаллов, могут изменяться и будут зависеть от переменных, таких как температура, размер кристалла или структуры, способа получения образца или высоты образца в анализируемой лунке PANalytical X Pert Pro дифрактометра или Oxford diffraction CCD дифрактометра. Кроме того, подразумевается, что должно быть ясно, что положения пиков могут меняться при измерении различными источниками излучения. Например, Cu-K1, Mo-K, Co-K и Fe-K излучение,имеющие длины волн 1,54060, 0,7107 , 1,7902 и 1,9373, соответственно, могут давать положения пиков, которые отличаются от измеренных с помощью Cu-K излучения. Кроме того, подразумевается, что должно быть ясно, что термин "0,2 2-тэта" после ряда положений пиков относится к тому, что все пики группы, за которыми этот термин следует, приводятся в единицах угловых координат с дисперсией 0,2 2-тэта. Например, "6,81, 8,52, 9,73, 12,04 и/или 13,250,2 2 тэта" относится к "6,810,2 2-тэта, 8,520,2 2-тэта, 9,730,2 2-тэта, 12,040,2 2-тэта и/или 13,250,2 2-тэта". Специалистам в данной области техники ясно, что многочисленные модификации и варианты настоящего изобретения являются возможными в свете вышеуказанных идей. Следовательно, должно быть ясно, что в пределах объема прилагаемой формулы изобретения настоящее изобретение можно осуществлять на практике, например, отличным от описанного в настоящем изобретении способа, и предполагается, что объем настоящего изобретения включает все данные варианты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма соединения I, имеющего формулу где кристаллическая форма представляет собой(А) а) форму А 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 4,32, 6,07, 8,55, 12,07 и 15,37 0,2 2-тэта; илиa) форму НС 0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 8,36, 8,71, 16,69, 17,39 и 24,590,2 2-тэта; илиb) форму HD0, которая характеризуется порошковой рентгеновской дифрактограммой, содержащей один или более из следующих пиков: 7,60, 8,99 и 15,160,2 2-тэта; или их смесь. 2. Кристаллическая форма соединения I по п.1, которая представляет собой форму А 0. 3. Кристаллическая форма соединения I по п.1, которая представляет собой форму НС 0. 4. Кристаллическая форма соединения I по п.1, которая представляет собой форму HD0. 5. Фармацевтическая композиция для лечения рака, содержащая кристаллическую форму соединения I по любому из пп.2-4 или их смесь. 6. Фармацевтическая композиция по п.5, содержащая смесь указанных форм. 7. Фармацевтическая композиция по п.5 или 6, дополнительно содержащая аморфную форму соединения I.
МПК / Метки
МПК: C07D 487/04, A61P 25/28, A61K 31/407
Метки: соединения, формы, полициклического, новые
Код ссылки
<a href="https://eas.patents.su/30-20756-novye-formy-policiklicheskogo-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые формы полициклического соединения</a>
Предыдущий патент: Инсектицидные соединения
Следующий патент: Способ увеличения длительности цикла работы пастеризатора
Случайный патент: Армирующее устройство для фильеры, производящей волокна, в частности, элементарные стеклянные волокна