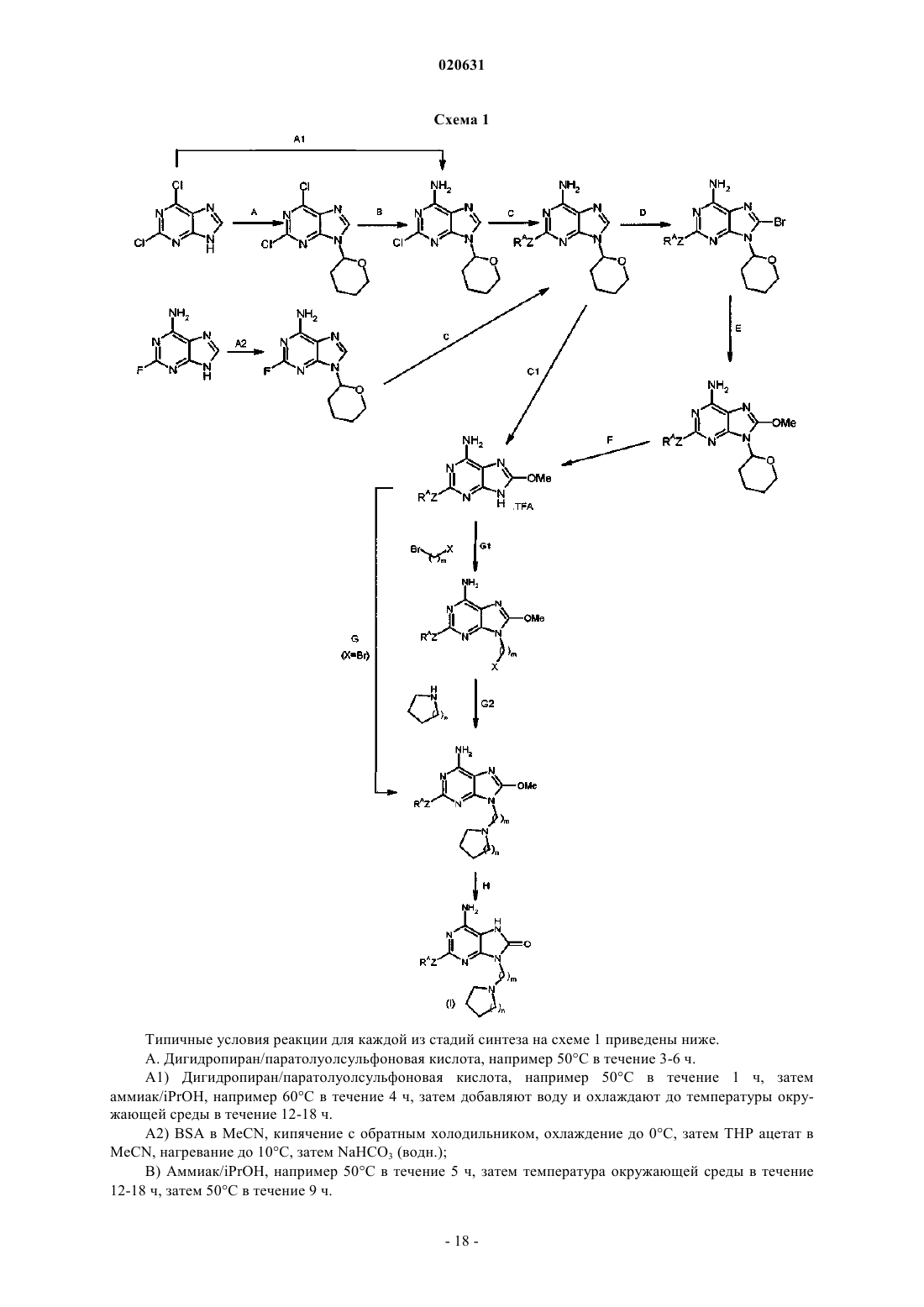
Производные пурина для применения в лечении аллергических, воспалительных и инфекционных заболеваний
Номер патента: 20631
Опубликовано: 30.12.2014
Авторы: Смит Стефан Аллан, Биггадайк Кейт, Льюэлл Сяо Цин, Митчелл Шарлотт Джейн, Триведи Наимиша, Коэ Дайан Мэри
Формула / Реферат
1. Соединение формулы (I)

где R1 представляет собой С1-6алкиламино, С1-6алкокси;
m равен целому числу, имеющему значение от 3 до 6;
n равен целому числу, имеющему значение от 0 до 4,
или его соль.
2. Соединение по п.1 или его соль, где R1 представляет собой н-бутилокси.
3. Соединение по п.1 или его соль, где R1 представляет собой (1S)-1-метилбутилокси.
4. Соединение или его соль, выбранные из перечня, состоящего из
6-амино-2-(бутилокси)-9-[6-(1-пирролидинил)гексил]-7,9-дигидро-8H-пурин-8-она;
6-амино-2-(бутилокси)-9-[6-(гексагидро-1Н-азепин-1-ил)гексил]-7,9-дигидро-8Н-пурин-8-она;
6-амино-2-{[(1S)-1-метилбутил]окси}-9-[4-(1-пиперидинил)бутил]-7,9-дигидро-8Н-пурин-8-она;
6-амино-9-[4-(гексагидро-1H-азепин-1-ил)бутил]-2-{[(1S)-1-метилбутил]окси}-7,9-дигидро-8H-пурин-8-она;
6-амино-2-{[(1S)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Н-пурин-8-она и
6-амино-9-[5-(гексагидро-1Н-азепин-1-ил)пентил]-2-{[(1S)-1-метилбутил]окси}-7,9-дигидро-8Н-пурин-8-она
и их солей.
5. Соединение по любому из пп.1-4, которое находится в форме фармацевтически приемлемой соли.
6. Соединение, представляющее собой 6-амино-2-{[(1S)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Н-пурин-8-он или его соль.
7. Соединение, представляющее собой 6-амино-2-{[(1S)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Н-пурин-8-он или его фармацевтически приемлемую соль.
8. Соединение по любому из пп.1-4, которое находится в форме свободного основания.
9. Соединение, представляющее собой 6-амино-2-{[(1S)-1-метилбутил]окси}-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8Н-пурин-8-он в виде свободного основания.
10. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли в терапии.
11. Применение соединения по любому из пп.8, 9 в терапии.
12. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли в лечении аллергических заболеваний и других воспалительных состояний, инфекционных заболеваний и рака.
13. Применение соединения по любому из пп.8, 9 в лечении аллергических заболеваний и других воспалительных состояний, инфекционных заболеваний и рака.
14. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли в лечении аллергического ринита.
15. Применение соединения по любому из пп.8, 9 или его фармацевтически приемлемой соли в лечении аллергического ринита.
16. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли в лечении астмы.
17. Применение соединения по любому из пп.8, 9 в лечении астмы.
18. Способ лечения аллергических заболеваний и других воспалительных состояний, включающий введение субъекту - человеку, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-7 или его фармацевтически приемлемой соли или соединения по любому из пп.8 или 9.
19. Способ лечения аллергического ринита, включающий введение субъекту - человеку, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-7 или его фармацевтически приемлемой соли или соединения по любому из пп.8 или 9.
20. Фармацевтическая композиция, содержащая соединение по любому из пп.1-7 или его фармацевтически приемлемую соль и один или более фармацевтически приемлемый разбавитель или носитель.
21. Фармацевтическая композиция, содержащая соединение по любому из пп.8, 9 и один или более фармацевтически приемлемый разбавитель или носитель.
22. Применение соединения по любому из пп.1-9 или его фармацевтически приемлемой соли в качестве вакцинного адъюванта.
23. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли или соединения по любому из пп.8, 9 для изготовления лекарственного средства для лечения аллергических заболеваний и других воспалительных состояний.
24. Применение по п.23 для лечения аллергического ринита.
Текст
ПРОИЗВОДНЫЕ ПУРИНА ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ АЛЛЕРГИЧЕСКИХ,ВОСПАЛИТЕЛЬНЫХ И ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ Предложены соединения формулы (I) где R1 представляет собой C1-6 алкиламино, C1-6 алкокси; m равен целому числу, имеющему значение от 3 до 6; n равен целому числу, имеющему значение от 0 до 4, и их соли, которые являются индукторами человеческого интерферона, а также содержащая их фармацевтическая композиция. Предложено также применение заявленных соединений в терапии, в частности в лечении аллергических заболеваний и других воспалительных состояний, например аллергического ринита и астмы, в лечении инфекционных заболеваний и рака, а также в качестве вакцинных адъювантов. Предшествующий уровень техники Настоящее изобретение относится к соединениям, способам их получения, содержащим их композициям, к их применению в лечении различных расстройств, в частности аллергических заболеваний и других воспалительных состояний, например аллергического ринита и астмы, инфекционных заболеваний, рака, а также в качестве вакцинных адъювантов. Позвоночным животным постоянно угрожает инвазия микроорганизмов, и у них развились механизмы иммунной защиты для устранения инфекционных патогенов. У млекопитающих эта иммунная система включает две ветви: врожденный иммунитет и приобретенный иммунитет. Первая линия защиты хозяина представляет собой систему врожденного иммунитета, которая опосредована макрофагами и дендритными клетками. Приобретенный иммунитет включает устранение патогенов на более поздних стадиях инфекции и также обеспечивает формирование иммунологической памяти. Приобретенный иммунитет является высокоспецифическим вследствие широкого репертуара лимфоцитов с антигенспецифическими репертуарами, которые претерпевают генетическую перегруппировку. Ответ в системе врожденного иммунитета, как изначально считалось, является неспецифическим,но в настоящее время известно, что она способна отличать свое от разнообразия патогенов. Система врожденного иммунитета распознает микробы путем ограниченного количества генетически кодируемых "образ-распознающих рецепторов" (Pattern-Recognition Receptors, PRR), которые обладают множеством важных характеристик.Toll-подобные рецепторы (TLR) представляют собой семейство из 10 образ-распознающих рецепторов, описанных у людей. TLR экспрессируются преимущественно клетками системы врожденного иммунитета, где их роль заключается в контроле окружающей среды в отношении показателей инфицирования и после активации в мобилизации механизмов защиты, цель которых заключается в устранении проникших патогенов. Ранние ответы врожденного иммунитета, запускаемые TLR, ограничивают распространение инфекции, тогда как провоспалительные цитокины и хемокины, которые они могут индуцировать, приводят к рекрутингу и активации антигенпрезентирующих клеток, В- и Т-клеток. TLR могут модулировать природу адаптивных иммунных ответов с обеспечением соответствующей защиты путем активации дендритных клеток и высвобождения цитокина (Akira S. et al., Nat. Immunol., 2001, 2, 675680). Профиль ответа, обнаруживаемого для различных агонистов TLR, зависит от типа активируемых клеток.TLR7 представляет собой член подгруппы TLR (TLR 3, 7, 8 и 9), локализованный в эндосомальном компартменте клеток, которые специализированы для обнаружения нуклеиновых кислот, отличающихся от нуклеиновых кислот хозяина. TLR7 играет ключевую роль в антивирусной защите путем распознавания ssRNA (одноцепочечной РНК) (Diebold S.S. et al., Science, 2004, 303, 1529-1531 и Lund J.M. et al.,PNAS, 2004, 101, 5598-5603). TLR7 обладает ограниченным профилем экспрессии у людей и экспрессируется преимущественно В-клетками и плазмацитоидными дендритными клетками (pDC) и в меньшей степени моноцитами. Плазмоцитоидные DC представляют собой уникальную популяцию лимфоидных дендритных клеток (0,2-0,8% мононуклеарных клеток периферической крови (РВМС, которые представляют собой главные интерферон-продуцирующие клетки I типа, секретирующие высокие уровни интерферона альфа (IFN) и интерферона бета (IFN) в ответ на вирусные инфекции (Liu Y.-J., Annu.Rev. Immunol., 2005, 23, 275-306). Аллергические заболевания ассоциированы со смещенным в сторону Th2 иммунным ответом на аллергены. Th2-ответы ассоциированы с повышенными уровнями IgE, который благодаря своим действиям в отношении тучных клеток способствует гиперчувствительности в отношении аллергенов, приводя в результате к симптомам, наблюдаемым, например, при аллергическом рините. У здоровых индивидов иммунный ответ на аллергены в большей степени сбалансирован со смешанным Th2/Th1 и регуляторным Т-клеточным ответом. Показано, что лиганды TLR7 уменьшают высвобождение Th2-цитокина и усиливают высвобождение Th1-цитокина in vitro и уменьшают интенсивность воспалительных ответовTh2-типа в аллергических легочных моделях in vivo (Fili L. et al., J. All. Clin. Immunol., 2006, 118, 511517; Moisan J. et al., Am. J. Physiol. Lung Cell Mol. Physiol., 2006, 290, L987-995; Tao et al., Chin. Med. J.,2006, 119, 640-648). Таким образом, лиганды TLR7 обладают потенциалом возвращать равновесие иммунного ответа, обнаруживаемого у индивидов, страдающих аллергией, и приводят к модификации заболевания. В центре образования эффективного ответа врожденного иммунитета у млекопитающих находятся механизмы, которые приводят к индукции интерферонов и других цитокинов, которые действуют в отношении клеток, вызывая множество эффектов. Эти эффекты могут включать активацию экспрессии противоинфекционных генов, активацию презентации антигена в клетках для запуска сильного антигенспецифического иммунитета и стимуляцию фагоцитоза в фагоцитирующих клетках. Интерферон изначально описывали как вещество, которое может защищать клетки от вирусной инфекции (IsaacsLindemann, J. Virus Interference. Proc. R. Soc. Lon. Ser. B. Biol. Sci. 1957, 147, 258-267). У людей интерфероны I типа представляют собой семейство родственных белков, кодируемых генами на хромосоме 9, которые кодируют по меньшей мере 13 изоформ интерферона альфа (IFN) и одну изо-1 020631 форму интерферона бета (IFN). Рекомбинантный IFN представлял собой первый одобренный биологический терапевтический агент и стал важным терапевтическим средством при вирусных инфекциях и при раке. Известно, что помимо непосредственного антивирусного действия на клетки интерфероны являются сильными модуляторами иммунного ответа, действуя на клетки иммунной системы. В качестве первой линии терапии заболевания, вызванного вирусом гепатита C (HCV), комбинации интерферона могут быть высокоэффективны для снижения вирусной нагрузки и у некоторых субъектов для устранения репликации вируса. Тем не менее, для множества пациентов не удалось продемонстрировать устойчивый противовирусный ответ, и у этих пациентов вирусная нагрузка не контролируется. Дополнительно, терапия путем инъекции интерферона может быть ассоциирована со множеством нежелательных неблагоприятных действий, которые, как показано, влияют на соблюдение пациентом схемы лечения (Dudley T, et al., Gut., 2006, 55(9), 1362-3). Введение небольшой молекулы соединения, которое может стимулировать ответ системы врожденного иммунитета, включающий активацию интерферонов I типа и других цитокинов, может представлять собой важную стратегию для лечения или предупреждения заболеваний людей, включая вирусные инфекции. Этот тип иммуномодулирующей стратегии дает возможность идентифицировать соединения,которые могут быть полезны не только при инфекционных заболеваниях, но также при раке (Krieg. Curr.Physiol., 2006, 290, L987-995), других воспалительных состояниях, таких как синдром раздраженного кишечника (Rakoff-Nahoum S., Cell., 2004, 23, 118(2):229-41), и в качестве вакцинных адъювантов (Persing et al. Trends Microbiol. 2002:10(10 Suppl), S32-7). В моделях на животных имиквимод продемонстрировал адъювантные активности местно (Adams S.et al., Infect. Immun., 2007, 75:5939-46). Также продемонстрировано, что резиквимод и другие родственные агонисты TLR7/8 демонстрируют адъювантную активность (Ma R. et al., Biochem. Biophys. Res.Commun., 2007, 361:537-42; Wille-Reece U. et al., Proc. Natl. Acad. Sci. USA, 2005, 102:15190-4; WilleReece U. et al., US2006045885 A1). Механизмы, которые ведут к индукции интерферонов I типа, только частично поняты. Один из механизмов, которые могут вести к индукции интерферона во множестве клеточных типов, заключаются в распознавании двухцепочечной вирусной РНК РНК-хеликазами RIG-I и MDA5. Полагают, что этот механизм представляет собой первичный механизм, при помощи которого интерфероны индуцируются инфицированием клеток вирусом Сендай. Дополнительные механизмы индукции интерферонов опосредованы TLR-зависимыми сигнальными событиями. У людей плазмацитоидные дендритные клетки (pDC), представляющие собой профессиональные интерферон-продуцирующие клетки, способны продуцировать значительные количества интерферонов в ответ на вирусную инфекцию, например. Продемонстрировано, что pDC преимущественно экспрессируют TLR7 и TLR9, и стимуляция этих рецепторов вирусной РНК или ДНК соответственно может индуцировать экспрессию интерферона альфа. Описаны олигонуклеотидные агонисты TLR7 и TLR9 и низкомолекулярные агонисты TLR7 на основе пурина, которые могут индуцировать высвобождение интерферона альфа этими типами клеток у животных и у людей (Takeda K. et al., Annu. Rev. Immunol., 2003, 21, 335-76). Агонисты TLR7 включают имидазохинолиновые соединения, такие как имиквимод и резиквимод, оксоадениновые аналоги и также нуклеозидные аналоги, такие как локсорибин и 7-тиа-8-оксогуанозин, который, как давно известно, индуцирует высвобождение интерферона альфа. В публикации международной заявки WO 2008/114008(AstraZeneca AB/Dainippon Sumitomo Pharma Co. Ltd.) раскрыты 9-замещенные-8-оксоадениновые соединения в качестве модуляторов TLR7. Остается не ясным то, каким образом низкомолекулярные соединения типа пуринов могут индуцировать интерфероны I типа и другие цитокины, поскольку молекулярные мишени этих известных индукторов не идентифицированы. Тем не менее, разработана стратегия анализа для характеристики низкомолекулярных индукторов человеческого интерферона IFN (независимо от механизма), которая основана на стимуляции первичных человеческих донорных клеток соединениями и раскрыта здесь. Краткое описание изобретения Показано, что определенные соединения по изобретению представляют собой индукторы человеческого интерферона и могут демонстрировать улучшенный профиль в отношении известных индукторов человеческого интерферона, например улучшенную эффективность, и могут демонстрировать улучшенную селективность в отношении IFN по сравнению с TNF. Например, некоторые соединения по изобретению указывают на более чем 1000-кратную селективность в отношении индукции IFN по сравнению с индукцией TNF. Соединения, которые индуцируют человеческий интерферон, могут быть полезны в лечении различных расстройств, например в лечении аллергических заболеваний и других воспалительных состояний, например аллергического ринита и астмы, в лечении инфекционных заболеваний и рака, и также могут быть полезны в качестве вакцинных адъювантов.-2 020631 Некоторые соединения по изобретению представляют собой сильные иммуномодуляторы, и, соответственно, следует соблюдать осторожность при их использовании. Краткое изложение сущности изобретения Согласно настоящему изобретению предложено соединение формулы (I)m равен целому числу, имеющему значение от 3 до 6;n равен целому числу, имеющему значение от 0 до 4,или его соль. Предпочтительным является соединение, как оно определено выше, или его соль, где R1 представляет собой н-бутилокси или (1S)-1-метилбутилокси. Особенно предпочтительными являются соединения по изобретению или их соли, выбранные из перечня, состоящего из 6-амино-2-(бутилокси)-9-[6-(1-пирролидинил)гексил]-7,9-дигидро-8H-пурин-8-она; 6-амино-2-(бутилокси)-9-[6-(гексагидро-1 Н-азепин-1-ил)гексил]-7,9-дигидро-8H-пурин-8-она; 6-амино-2-[(1S)-1-метилбутил]окси-9-[4-(1-пиперидинил)бутил]-7,9-дигидро-8 Н-пурин-8-она; 6-амино-9-[4-(гексагидро-1 Н-азепин-1-ил)бутил]-2-[(1S)-1-метилбутил]окси-7,9-дигидро-8Hпурин-8-она; 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-она и 6-амино-9-[5-(гексагидро-1 Н-азепин-1-ил)пентил]-2-[(1S)-1-метилбутил]окси-7,9-дигидро-8 Нпурин-8-она,и их солей. Особенно предпочтительным является соединение по изобретению, представляющее собой 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-он или его соль. В еще одном аспекте изобретения предложено соединение формулы (I), как оно определено выше,которое находится в форме фармацевтически приемлемой соли. Предпочтительным является соединение по изобретению, представляющее собой 6-амино-2-[(1S)1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он или его фармацевтически приемлемую соль. В еще одном аспекте изобретения предложено соединение формулы (I), как оно определено выше,которое находится в форме свободного основания. Предпочтительным является соединение,представляющее собой 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-он в виде свободного основания. В еще одном аспекте изобретения предложено применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она или его фармацевтически приемлемой соли, в терапии. Также предложено применение соединения формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-она в виде свободного основания, в терапии. В еще одном аспекте изобретения предложено применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-она или его фармацевтически приемлемой соли, в лечении аллергических заболеваний и других воспалительных состояний, инфекционных заболеваний и рака. Также предложено применение соединения формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в виде свободного основания, в лечении аллергических заболеваний и других воспалительных состояний, инфекционных заболеваний и рака. В еще одном аспекте изобретения предложено применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она или его фармацевтически-3 020631 приемлемой соли, в лечении аллергического ринита. Также предложено применение соединения формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в виде свободного основания, в лечении аллергического ринита. В еще одном аспекте изобретения предложено применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она или его фармацевтически приемлемой соли, в лечении астмы. Также предложено применение соединения формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-она в виде свободного основания, в лечении астмы. Согласно настоящему изобретению также предложен способ лечения аллергических заболеваний и других воспалительных состояний, включающий введение субъекту - человеку, нуждающемуся в этом,терапевтически эффективного количества соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1 пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-она или его фармацевтически приемлемой соли, либо соединения формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8 она в виде свободного основания. Согласно настоящему изобретению также предложен способ лечения аллергического ринита, включающий введение субъекту - человеку, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она или его фармацевтически приемлемой соли, либо соединения формулы (I), как оно определено выше,которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-она в виде свободного основания. В еще одном аспекте изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I), как оно определено выше, или его фармацевтически приемлемую соль, в частности 6 амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он или его фармацевтически приемлемую соль, и один или более чем один фармацевтически приемлемый разбавитель или носитель. В еще одном аспекте изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8H-пурин-8-он в виде свободного основания, и один или более чем один фармацевтически приемлемый разбавитель или носитель. В еще одном аспекте изобретения предложено применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли в качестве вакцинного адъюванта. В еще одном аспекте изобретения предложено применение соединения формулы (I), как оно определено выше, или его фармацевтически приемлемой соли, в частности 6-амино-2-[(1S)-1 метилбутил]окси-9-[5-(1-пиперидинил)пентил]-7,9-дигидро-8 Н-пурин-8-она или его фармацевтически приемлемой соли, либо соединения формулы (I), как оно определено выше, которое находится в форме свободного основания, в частности 6-амино-2-[(1S)-1-метилбутил]окси-9-[5-(1-пиперидинил)пентил]7,9-дигидро-8H-пурин-8-она в виде свободного основания, для изготовления лекарственного средства для лечения аллергических заболеваний и других воспалительных состояний, в частности для лечения аллергического ринита. Подробное описание изобретения Настоящее изобретение описано в терминах, известных и понятных специалистам в данной области техники. Для облегчения ссылок здесь определены некоторые термины. Однако тот факт, что определены некоторые термины, не следует рассматривать как показатель того, что определенные термины используются таким образом, что не согласуются с обычным значением или, альтернативно, что какойлибо термин, который не определен, является не идентифицированным или не используется в обычном и приемлемом смысле. Скорее полагают, что все использованные здесь термины описывают изобретение таким образом, что специалист в данной области техники может понять объем настоящего изобретения. Следующие определения предназначены для разъяснения, а не ограничения определенных терминов. Ссылки на "алкил" включают ссылки на алифатические изомеры с прямой и разветвленной цепью соответствующего алкила, содержащего вплоть до шести атомов углерода, например вплоть до четырех атомов углерода или вплоть до двух атомов углерода. Такие ссылки на "алкил" также применимы тогда,когда алкильная группа представляет собой часть другой группы, например алкиламино или алкоксигруппы. Примеры таких алкильных групп и групп, содержащих алкильные группы, представляют собой C1-6 алкил, С 1-6 алкиламино и C1-6 алкокси.-4 020631 Ссылки на "циклоалкил" относятся к моноциклическим алкильным группам, содержащим от трех до семи атомов углерода, например четыре атома углерода, или пять атомов углерода, или шесть атомов углерода. Такие ссылки на "циклоалкил" также применимы тогда, когда циклоалкильная группа представляет собой часть другой группы, например циклоалкоксигруппы. Примеры таких циклоалкильных групп представляют собой циклобутил, циклопентил и циклогексил. Ссылки на "гетероцикл" или "гетероциклил" относятся к моноциклическому насыщенному гетероциклическому алифатическому кольцу, содержащему 3-7 атомов углерода и один гетероатом, который представляет собой азот. Такое гетероциклическое кольцо представляет собой азетидин или азетидинил,пирролидин или пирролидинил, пиперидин или пиперидинил, гексагидроазепин или гексагидроазепинил и октагидроазоцин или гексагидро-(2 Н)-азоцинил. Ссылки на "галоген" относятся к йоду, брому, хлору или фтору, типично брому, хлору или фтору. Ссылки на "галогено" относятся к йодо, бромо, хлоро или фторо, типично бромо, хлоро или фторо. Следует понимать, что приведенные здесь ссылки на соединения по изобретению означают соединение формулы (I) в виде свободного основания или в виде соли, например фармацевтически приемлемой соли. Соли соединений формулы (I) включают фармацевтически приемлемые соли и соли, которые могут не быть фармацевтически приемлемыми, но могут быть полезны при получении соединений формулы и их фармацевтически приемлемых солей. Соли могут быть получены из некоторых неорганических или органических кислот или некоторых неорганических или органических оснований. Изобретение включает в своем объеме все возможные стехиометрические и нестехиометрические формы солей соединений формулы (I). Примеры солей представляют собой фармацевтически приемлемые соли. Фармацевтически приемлемые соли включают соли присоединения кислот и соли присоединения оснований. Обзор подходящих солей см. в Berge et al., J. Pharm. Sci., 66:1-19 (1977). Примеры фармацевтически приемлемых солей присоединения кислот соединений формулы (I) включают соли гидробромид, гидрохлорид, сульфат, паратолуолсульфонат, метансульфонат, нафталинсульфонат и фенилсульфонат. Соли могут быть получены с использованием способов, хорошо известных в данной области техники, например осаждением из раствора с последующим фильтрованием или выпариванием растворителя. Типично, фармацевтически приемлемая соль присоединения кислоты может быть получена путем взаимодействия соединения формулы (I) с подходящей сильной кислотой (такой как бромистоводородная, соляная, серная, паратолуолсульфоновая, метансульфоновая или нафталинсульфоновая кислоты), возможно в подходящем растворителе, таком как органический растворитель, с получением соли, которую обычно выделяют, например, путем кристаллизации и фильтрования. Следует понимать, что многие органические соединения могут образовывать комплексы с растворителями, в которых они вступают во взаимодействие или из которых они осаждаются или кристаллизуются. Эти комплексы известны как "сольваты". Например, комплекс с водой известен как "гидрат". Растворители, обладающие высокой температурой кипения, и/или растворители, обладающие высокой тенденцией образовывать водородные связи, такие как вода, этанол, изопропиловый спирт иN-метилпирролидинон, могут быть использованы для образования сольватов. Способы идентификации сольватов включают ЯМР (ядерный магнитный резонанс) и микроанализ, но не ограничиваются ими. Сольваты соединений формулы (I) находятся в объеме изобретения. Использованный здесь термин"сольват" охватывает сольваты свободного основания соединения, а также любой его соли. Некоторые из соединений по изобретению могут содержать хиральные атомы и/или множественные связи и, следовательно, могут существовать в одной или более чем одной стереоизомерной форме. Настоящее изобретение охватывает все из стереоизомеров соединений по изобретению, включая оптические изомеры, в виде индивидуальных стереоизомеров или в виде их смесей, включая рацемические модификации. Любой стереоизомер может содержать менее 10 мас.%, например менее 5 мас.% или менее 0,5 мас.% любого другого стереоизомера. Например, любой оптический изомер может содержать менее 10 мас.%, например менее 5 мас.% или менее 0,5 мас.% своего антипода. Некоторые из соединений по изобретению могут существовать в таутомерных формах. Понятно,что настоящее изобретение охватывает все из таутомеров соединений по изобретению в виде индивидуальных таутомеров или в виде их смесей. Соединения по изобретению могут находиться в кристаллической или аморфной форме. Кроме того, некоторые из кристаллических форм соединений по изобретению могут существовать в виде полиморфов, все из которых включены в объем настоящего изобретения. Наиболее термодинамически стабильная полиморфная форма или формы соединений по изобретению представляют особенный интерес. Полиморфные формы соединений по изобретению могут быть охарактеризованы и дифференцированы с использованием множества обычных аналитических способов, включающих дифракцию рентгеновских лучей на порошке (XRPD), инфракрасную спектроскопию (IR), рамановскую спектроскопию,дифференциальную сканирующую калориметрию (DSC), термогравиметрический анализ (TGA) и ядерный магнитный резонанс твердого состояния (ssNMR), но не ограничивающихся ими.-5 020631 Из предшествующего описания понятно, что в объем изобретения включены сольваты, гидраты,изомеры и полиморфные формы соединений формулы (I) и их соли и сольваты. Примеры болезненных состояний, при которых соединения формулы (I) и их фармацевтически приемлемые соли обладают потенциально благоприятными эффектами, включают аллергические заболевания и другие воспалительные состояния, например аллергический ринит и астма, инфекционные заболевания и рак. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть использованы в качестве вакцинных адъювантов. В качестве модуляторов иммунного ответа соединения формулы (I) и их фармацевтически приемлемые соли также могут быть полезны, взятые отдельно или в комбинации, в качестве адъюванта в лечении и/или предупреждении опосредованных иммунной системой расстройств, включающих воспалительные или аллергические заболевания, такие как астма, аллергический ринит и риноконъюнктивит,пищевая аллергия, гиперчувствительность легкого, эозинофильная пневмония, расстройства гиперчувствительности замедленного типа, атеросклероз, панкреатит, гастрит, колит, остеоартрит, псориаз, саркоидоз, легочный фиброз, респираторный дистресс-синдром, бронхиолит, хроническое обструктивное заболевание легкого, синусит, муковисцидоз, актинический кератоз, кожная дисплазия, хроническая крапивница, экзема и все типы дерматита, но не ограничивающихся ими. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть полезны в лечении и/или предупреждении реакций против респираторных инфекций, включающих обострения вирусных заболеваний дыхательных путей и тонзиллит, но не ограничивающихся ими. Соединения также могут быть полезны в лечении и/или предупреждении аутоиммунных заболеваний, включающих ревматоидный артрит, псориатический артрит, системную красную волчанку, синдром Шегрена, анкилозирующий спондилоартрит, склеродермию, дерматомиозит, сахарный диабет, отторжение трансплантата,включая заболевание "трансплантат против хозяина", воспалительные заболевания кишечника, включающие без ограничения болезнь Крона и неспецифический язвенный колит, но не ограничивающихся ими. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть полезны в лечении инфекционных заболеваний, включающих заболевания, вызванные вирусами гепатита (например,вирусом гепатита В, вирусом гепатита С), вирусом иммунодефицита человека, папилломавирусами, вирусами герпеса, респираторными вирусами (например, вирусами гриппа, респираторно-синцитиальным вирусом, риновирусом, метапневмовирусом, вирусом парагриппа, SARS) и вирусом Западного Нила, но не ограничивающихся ими. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть полезны в лечении микробных инфекций, вызванных, например, бактериями, грибами или простейшими. Они включают туберкулез, бактериальную пневмонию, аспергиллез, гистоплазмоз, кандидоз,пневмоцитоз, лепру, хламидиоз, криптококковое заболевание, криптоспоридиоз, токсоплазмоз, лейшманию, малярию и трипаносомоз, но не ограничиваются ими. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть полезны в лечении различных форм рака, в частности лечении форм рака, которые, как известно, чувствительны к иммунотерапии и включают почечно-клеточный рак, рак легкого, рак молочной железы, колоректальный рак, рак мочевого пузыря, меланому, лейкоз, лимфомы и рак яичника, но не ограничиваются ими. Специалисту в данной области техники понятно, что приведенные здесь ссылки на лечение или терапию в зависимости от состояния могут распространяться на профилактику, а также лечение установленных состояний. В соответствии с упомянутым здесь соединения формулы (I) и их фармацевтически приемлемые соли могут быть полезны в качестве терапевтических агентов. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть изготовлены в виде препаратов для введения любым удобным путем. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть изготовлены, например, для перорального, местного, ингаляционного, интраназального, трансбуккального, парентерального(например, внутривенного, подкожного, внутрикожного или внутримышечного) или ректального введения. В одном из аспектов соединения формулы (I) и их фармацевтически приемлемые соли готовят для перорального введения. В еще одном аспекте соединения формулы (I) и их фармацевтически приемлемые соли готовят для местного введения, например интраназального или ингаляционного введения. Таблетки и капсулы для перорального введения могут содержать обычные эксципиенты, такие как связывающие агенты, например жидкую смолу, аравийскую камедь, желатин, сорбит, трагакантовую камедь, клейкое вещество крахмала, целлюлозу или поливинилпирролидон; наполнители, например лактозу, микрокристаллическую целлюлозу, сахар, кукурузный крахмал, ортофосфат кальция или сорбит; смазывающие вещества, например стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например картофельный крахмал, натрий-кроскармеллозу или натрийкрахмалгликолят; или увлажнители, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии со способами, известными в данной области техники. Жидкие препараты для перорального введения могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде-6 020631 безводного продукта для разведения перед использованием водой или другим подходящим разбавителем. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты,например сироп сорбита, метилцеллюлозу, глюкозный/сахарный сироп, желатин, гидроксиметилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия или гидрогенированные пищевые жиры; эмульгаторы, например лецитин, сорбитанмоноолеат или аравийскую камедь; неводные разбавители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло,масляные сложные эфиры, пропиленгликоль или этиловый спирт; или консерванты, например метилили пропил-пара-гидроксибензоаты или сорбиновую кислоту. Препараты также могут содержать при необходимости буферные соли, корригенты, красители и/или подсластители (например, маннит). Композиции для интраназального введения включают водные композиции, вводимые в нос при помощи капель или при помощи нагнетаемой помпы. Подходящие композиции для этой цели содержат воду в качестве разбавителя или носителя. Композиции для введения в легкое или нос могут содержать один или более чем один эксципиент, например один или более чем один суспендирующий агент, один или более чем один консервант, одно или более чем одно поверхностно-активное вещество, один или более чем один агент, регулирующий тоничность, один или более чем один сорастворитель, и могут включать компоненты для контроля pH композиции, например буферную систему. Кроме того, композиции может содержать другие эксципиенты, такие как антиоксиданты, например метабисульфит натрия, и агенты, маскирующие вкус. Композиции также могут быть введены в носовую полость или другие части дыхательных путей посредством распыления. Композиции для интраназального введения могут обеспечить доставку соединения(й) формулы (I) или его (их) фармацевтически приемлемой(ых) соли(ей) во все области носовых полостей (тканьмишень) и, кроме того, могут обеспечить контакт соединения(й) формулы (I) или его(их) фармацевтически приемлемой(ых) соли(ей) с тканью-мишенью в течение более длительных периодов времени. Подходящая схема введения дозы для композиций для интраназального введения является такой, когда пациент медленно ингалирует через нос после очистки носовой полости. Во время ингаляции композиция может быть введена в одну ноздрю, тогда как другая зажимается вручную. Эта процедура затем может быть повторена для другой ноздри. Типично, один или два спрея на ноздрю могут быть введены при помощи вышеприведенной процедуры один, два или три раза в сутки, идеально один раз в сутки. Особенный интерес представляют композиции для интраназального введения, подходящие для введения один раз в сутки. Если суспендирующий(ие) агент(ы) включен(ы), то он(и) типично представлен(ы) в количестве от 0,1 до 5% (мас./мас.), таком как от 1,5 до 2,4% (мас./мас.), в расчете на общую массу композиции. Примеры фармацевтически приемлемых суспендирующих агентов включают Avicel (микрокристаллическая целлюлоза и натриевая карбоксиметилцеллюлоза), натриевую карбоксиметилцеллюлозу, вигум, трагакантовую камедь, бентонит, метилцеллюлозу, ксантановую смолу, карбопол и полиэтиленгликоли, но не ограничиваются ими. Композиции для введения в легкое или нос могут содержать один или более чем один эксципиент,могут быть защищены от микробной или грибковой контаминации и роста путем включения одного или более чем одного консерванта. Примеры фармацевтически приемлемых противомикробных агентов или консервантов включают четвертичные аммониевые соединения (например, бензалконий хлорид, бензэтоний хлорид, цетримид, цетилпиридиний хлорид, лаурилалконий хлорид и миристилпиколиний хлорид), ртутные агенты (например, нитрат фенилртути, ацетат фенилртути и тимеросал), спиртовые агенты(например, хлорбутанол, фенилэтиловый спирт и бензиловый спирт), антибактериальные сложные эфиры (например, сложные эфиры парагидроксибензойной кислоты), хелатообразующие агенты, такие как динатрия эдетат (EDTA), и другие антимикробные агенты, такие как хлоргексидин, хлоркрезол, сорбиновая кислота и ее соли (такие как сорбат калия) и полимиксин, но не ограничиваются ими. Примеры фармацевтически приемлемых противогрибковых агентов или консервантов включают бензоат натрия,сорбиновую кислоту, пропионат натрия, метилпарабен, этилпарабен, пропилпарабен и бутилпарабен, но не ограничиваются ими. Если включен консервант(ы), то он может быть представлен в количестве от 0,001 до 1% (мас./мас.), таком как от 0,015 до 0,5% (мас./мас.), в расчете на общую массу композиции. Композиции (например, где по меньшей мере одно соединение находится в суспензии) могут включать одно или более чем одно поверхностно-активное вещество, которое действует для облегчения растворения частиц лекарственного средства в водной фазе композиции. Например, количество используемого поверхностно-активного вещества представляет собой количество, которое не вызывает вспенивания во время смешивания. Примеры фармацевтически приемлемых поверхностно-активных веществ включают спирты жирных кислот, сложные и простые эфиры, такие как полиоксиэтилен (20) сорбитанмоноолеат (Polysorbate 80), простые эфиры макрогола и полоксамеры. Поверхностно-активное вещество может быть представлено в количестве, составляющем от приблизительно 0,01 до 10% (мас./мас.), таком как от 0,01 до 0,75% (мас./мас.), например приблизительно 0,5% (мас./мас.), в расчете на общую массу композиции.-7 020631 Один или более чем один агент, регулирующий тоничность, может быть включен для достижения тоничности с жидкостями организма, например жидкостями в носовой полости, приводя в результате к уменьшенным уровням раздражения. Примеры фармацевтически приемлемых агентов, регулирующих тоничность, включают хлорид натрия, декстрозу, ксилит, хлорид кальция, глюкозу, глицерин и сорбит,но не ограничиваются ими. Если присутствует агент, регулирующий тоничность, то он может быть включен в количестве от 0,1 до 10% (мас./мас.), таком как от 4,5 до 5,5% (мас./мас.), например приблизительно 5,0% (мас./мас.), в расчете на общую массу композиции. Композиции по изобретению могут быть забуферены путем добавления подходящих забуферивающих агентов, таких как цитрат натрия, лимонная кислота, трометамол, фосфаты, такие как двузамещенный фосфат натрия (например, додекагидрат, гептагидрат, дигидрат и безводные формы), или ортофосфат натрия и их смеси. Если присутствует забуферивающий агент, то он может быть включен в количестве от 0,1 до 5%(мас./мас.), например от 1 до 3% (мас./мас.), в расчете на общую массу композиции. Примеры агентов, маскирующих вкус, включают сукралозу, сахарозу, сахарин или его соль, фруктозу, декстрозу, глицерин, кукурузный сироп, аспартам, ацесульфам-K, ксилит, сорбит, эритрит, глицирризинат аммония, тауматин, неотам, маннит, ментол, эвкалиптовое масло, камфору, природный корригент, искусственный корригент и их комбинации. Один или более чем один сорастворитель может быть включен для того, чтобы способствовать растворимости лекарственного(ых) соединения(й) и/или других эксципиентов. Примеры фармацевтически приемлемых сорастворителей включают пропиленгликоль, дипропиленгликоль, этиленгликоль, глицерин, этанол, полиэтиленгликоли (например, PEG300 или PEG400) и метанол, но не ограничиваются ими. В одном из воплощений сорастворитель представляет собой пропиленгликоль. Если присутствует сорастворитель(и), то он может быть включен в количестве от 0,05 до 30%(мас./мас.), таком как от 1 до 25% (мас./мас.), например от 1 до 10% (мас./мас.), в расчете на общую массу композиции. Композиции для ингаляционного введения включают водные, органические или водные/органические смеси, сухие порошковые или кристаллические композиции, вводимые в дыхательные пути при помощи сжимаемого насоса или ингалятора, например сухих порошковых ингаляторов с резервуаром, сухих порошковых ингаляторов, содержащих разовую дозу, сухих порошковых ингаляторов с предварительно отмеренными дробными дозами, назальных ингаляторов или аэрозольных ингаляторов под давлением, распылителей или инсуффляторов. Подходящие композиции содержат воду в качестве разбавителя или носителя для этой цели и могут быть предложены с обычными эксципиентами, такими как буферные агенты, агенты, модифицирующие тоничность, и т.п. Водные композиции также могут быть введены в нос и другие части дыхательных путей посредством распыления. Такие композиции могут представлять собой водные растворы или суспензии либо аэрозоли, доставляемые из упаковок под давлением, таких как дозирующий ингалятор, с использованием подходящего сжиженного пропеллента. Композиции для местного введения в нос (например, для лечения ринита) или в легкое включают аэрозольные композиции под давлением и водные композиции, доставляемые в носовые полости при помощи сжимаемого насоса. Особенный интерес представляют композиции, которые не находятся под давлением и подходят для местного введения в носовую полость. Подходящие композиции содержат воду в качестве разбавителя или носителя для этой цели. Водные композиции для введения в легкое или нос могут быть предложены с обычными эксципиентами, такими как буферные агенты, агенты, модифицирующие тоничность, и т.п. Водные композиции также могут быть введены в нос посредством распыления. Жидкостный диспенсер может типично быть использован для доставки жидкой композиции в носовые полости. Жидкая композиция может быть водной или неводной, но обычно водной. Такой жидкостный диспенсер может иметь раздаточную форсунку или раздаточное отверстие, через которое выдается отмеренная доза жидкой композиции при приложении пользователем силы к нагнетающему механизму жидкостного диспенсера. Такие жидкостные диспенсеры, как правило, оборудованы резервуаром с большим количеством отмеренных доз жидкой композиции, причем дозы выдаются при последовательных приведениях в действие насоса. Раздаточные форсунка или отверстие могут быть выполнены с возможностью вставления в ноздри пользователя для выдачи жидкой композиции в виде спрея в носовую полость. Жидкостный диспенсер вышеупомянутого типа описан и проиллюстрирован в публикации международной заявки WO 2005/044354 (Glaxo Group Limited). Диспенсер имеет кожух, который вмещает нагнетающее жидкость устройство, имеющее нагнетающий насос, установленный на контейнере, содержащем жидкую композицию. Кожух имеет по меньшей мере один приводимый в действие пальцем боковой рычаг, который выполнен с возможностью перемещения внутрь относительно кожуха для перемещения контейнера вверх в кожухе при помощи эксцентрика, приводя к тому, что насос сжимается и выталкивает отмеренную дозу композиции из стержня насоса через назальную форсунку кожуха. В одном из вариантов выполнения жидкостный диспенсер представляет собой диспенсер общего типа, проиллюстрированный на фиг. 30-40 в WO 2005/044354.-8 020631 Водные композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль, также могут быть доставлены при помощи насоса, как раскрыто в публикации международной заявки WO2007/138084 (Glaxo Group Limited), например, как раскрыто со ссылкой на фиг. 22-46 в ней, или как раскрыто в заявке на патент ВеликобританииGB0723418.0 (Glaxo Group Limited), например, как раскрыто со ссылкой на фиг. 7-32 в ней. Насос может быть приведен в действие при помощи привода,как раскрыто на фиг. 1-6 BGB0723418.0. Сухие порошкообразные композиции для местной доставки в легкое путем ингаляции могут быть представлены, например, в капсулах и картриджах, например из желатина, или блистерах, например из ламинированной алюминиевой фольги, для применения в ингаляторе или инсуффляторе. Порошковые композиции, как правило,. содержат порошкообразную смесь для ингаляции соединения формулы (I) или его фармацевтически приемлемой соли и подходящего порошкообразного основания (вещество носитель/разбавитель/эксципиент), такого как моно-, ди- или полисахариды (например, лактоза или крахмал). Сухие порошкообразные композиции также могут включать, в дополнение к лекарственному средству и носителю, дополнительный эксципиент (например, третичный агент, такой как эфир сахара, например целлобиозы октаацетат, стеарат кальция или стеарат магния). В одном из воплощений композиция, подходящая для ингаляционного введения, может быть включена во множество контейнеров с заключенной дозой, устроенных на медицинскую упаковку(и), закрепляемую(ые) внутри подходящего ингалирующего устройства. Контейнеры могут быть протыкаемыми,вскрываемыми или иным образом раскрываемыми поочередно, и дозы сухой порошкообразной композиции введены путем ингаляции через мундштук ингалирующего устройства, как известно в данной области техники. Упаковка лекарственного средства может принимать множество различных форм, например форму диска или удлиненной полоски. Типичные ингалирующие устройства представляют собой устройства DISKHALER и DISKUS, поставляемые на рынок GlaxoSmithKline. Сухая порошкообразная ингалируемая композиция также может быть доставлена при помощи объемного резервуара в ингалирующем устройстве, где устройство тогда может быть оснащено дозирующим механизмом, отмеривающим дозу композиции из резервуара в ингалирующий канал, где эта отмеренная доза готова для ингалирования пациентом через мундштук данного устройства. Примеры представленных на рынке устройств этого типа представляют собой TURBUHALER (AstraZeneca),TWISTHALER (Schering) и CLICKHALER (Innovata.) Еще один способ доставки сухой порошкообразной ингалируемой композиции заключается в том,чтобы отмеренные дозы композиции были представлены в капсулах (одна доза на капсулу), которые затем загружаются в ингаляционное устройство, как правило, при потребности пациента. Устройство имеет средства для прокалывания, прорыва или открывания иным образом капсулы, таким образом, чтобы доза могла проникнуть в легкое пациента при ее ингаляции через мундштук устройства. В качестве представленных на рынке примеров таких устройств можно упомянуть ROTAHALER(GlaxoSmithKline) и HANDIHALER (Boehringer Ingelheim.) Аэрозольные композиции под давлением, подходящие для ингаляции, могут представлять собой суспензии или раствор и могут содержать соединение формулы (I) или его фармацевтически приемлемую соль и подходящий пропеллент, такой как фторуглерод или содержащий водород хлорфторуглерод или их смеси, в частности гидрофторалканы, в частности 1,1,1,2-тетрафторэтан, 1,1,1,2,3,3,3-гептафторн-пропан или их смесь. Аэрозольная композиция может содержать дополнительные эксципиенты композиции, хорошо известные в данной области техники, такие как поверхностно-активные вещества, например олеиновую кислоту, лецитин или олигомолочную кислоту или ее производное, например, как описано в WO 94/21229 и WO 98/34596 (Minnesota Mining and Manufacturing Company), и сорастворители, например этанол. Композиции под давлением, как правило, содержатся в контейнере (например, алюминиевом контейнере), закрытом клапаном (например, отмеривающим клапаном), и заполняются в активатор, оборудованный мундштуком. Мази, кремы и гели, например, могут быть приготовлены с водной или масляной основой при добавлении подходящего загустителя и/или гелеобразующего агента и/или растворителей. Таким образом,такие основы могут, например, включать воду и/или масло, такое как жидкий парафин или растительное масло, такое как арахисовое масло или касторовое масло, или растворитель, такой как полиэтиленгликоль. Загустители и гелеобразующие агенты, которые могут быть использованы в соответствии с природой основы, включают мягкий парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли,ланолин, пчелиный воск, карбоксиполиметилен и производные целлюлозы, и/или глицерилмоностеарат,и/или неионные эмульгаторы. Лосьоны могут быть приготовлены с водной или масляной основой и, как правило, также содержат один или более чем один эмульгатор, стабилизатор, диспергирующий агент, суспендирующий агент или загуститель. Порошки для наружного применения могут быть приготовлены с помощью любой подходящей порошковой основы, например талька, лактозы или крахмала. Капли могут быть приготовлены с водным или неводным основанием, также содержащим один или более чем один диспергирующий агент, солю-9 020631 билизирующий агент, суспендирующий агент или консервант. Соединения формулы (I) и их фармацевтически приемлемые соли могут, например, быть приготовлены для трансдермальной доставки путем помещения композиции в пластыри или другие устройства(например, устройства со сжатым газом), которые доставляют активный компонент в кожу. Для трансбуккального введения композиции могут принимать форму таблеток или лепешек, приготовленных традиционным образом. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть приготовлены в виде суппозиториев, например, содержащих обычные основы суппозиториев, такие как масло какао или другие глицериды. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть приготовлены для парентерального введения путем болюсной инъекции или непрерывной инфузии и могут быть представлены в стандартной лекарственной форме, например в виде ампул, флаконов, инфузий небольшого объема или предварительно заполненных шприцев, или в многодозовых контейнерах с добавленным консервантом. Композиции могут принимать такие формы, как растворы, суспензии или эмульсии в водных или неводных разбавителях, и могут содержать агенты, используемые при приготовлении, такие как антиоксиданты, буферы, антимикробные агенты и/или агенты, регулирующие тоничность. Альтернативно, активный ингредиент может находиться в порошкообразной форме для разведения перед использованием подходящим разбавителем, например стерильной апирогенной водой. Сухая твердая композиция может быть приготовлена путем асептического заполнения стерильного порошка в индивидуальные стерильные контейнеры или путем асептического заполнения стерильного раствора в каждый контейнер и лиофилизации. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть приготовлены с вакцинами в качестве адъювантов для модуляции их активности. Такие композиции могут содержать антитело(а) или фрагмент(ы) антитела или антигенный компонент, включающий белок, ДНК, живые или мертвые бактерии и/или вирусы, или вирусоподобные частицы вместе с одним или более чем одним компонентом, обладающим адъювантной активностью, включая соли алюминия, масляные и водные эмульсии, но не ограничиваясь ими, белки теплового шока, препараты и производные липида A, гликолипиды, другие агонисты TLR, такие как CpG ДНК или подобные агенты, цитокины, такие как GM-CSF(колониестимулирующий гранулоцитарно-макрофагеальный фактор) или IL-12 или подобные агенты, но не ограничиваясь ими. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы отдельно или в комбинации с другими терапевтическими агентами. Соединения формулы (I) и их фармацевтически приемлемые соли и другой фармацевтически активный агент(ы) могут быть введены вместе или раздельно, и при раздельном введении последнее может быть осуществлено одновременно или последовательно в любом порядке. Количества соединения(й) формулы (I) или их фармацевтически приемлемых солей и другого фармацевтически активного агента(ов) и относительные времена введения выбирают таким образом, чтобы достичь желаемого объединенного терапевтического эффекта. Введение комбинации соединения формулы (I) или его фармацевтически приемлемой соли с другими агентами для лечения может быть осуществлено путем одновременного введения в одной фармацевтической композиции, включающей оба соединения, или в отдельных фармацевтических композициях, каждая из которых включает одно из соединений. Альтернативно, комбинация может быть введена по отдельности последовательным образом, когда один агент для введения вводят первым, а другой вторым, или наоборот. Такое последовательное введение может быть близким по времени или удаленным по времени. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в комбинации с одним или более чем одним агентом, полезным в предупреждении или лечении вирусных инфекций. Примеры таких агентов включают, без ограничения, ингибиторы полимеразы, такие как раскрытые в WO 2004/037818-А 1, а также раскрытые в WO 2004/037818 и WO 2006/045613; JTK-003, JTK-019,NM-283, HCV-796, R-803, R1728, R1626, а также раскрытые в WO 2006/018725, WO 2004/074270,WO 2003/095441, US2005/0176701, WO 2006/020082, WO 2005/080388, WO 2004/064925,WO 2004/065367, WO 2003/007945, WO 02/04425, WO 2005/014543, WO 2003/000254, ЕР 1065213,WO 01/47883, WO 2002/057287, WO 2002/057245, и подобные агенты; ингибиторы репликации, такие как ацикловир, фамцикловир, ганцикловир, цидофовир, ламивудин и подобные агенты; ингибиторы протеазы, такие как ингибиторы протеазы HIV (вируса иммунодефицита человека), саквинавир, ритонавир, индинавир, нелфинавир, ампренавир, фосампренавир, бреканавир, атазанавир, типранавир, палинавир, ласинавир, и ингибиторы протеазы HCV (вируса гепатита С) BILN2061, VX-950, SCH503034; и подобные агенты; нуклеозидные и нуклеотидные ингибиторы обратной транскриптазы, такие как зидовудин, диданозин, ламивудин, залцитабин, абакавир, ставидин, адефовир, адефовир дипивоксил, фозивудин, тодоксил, эмтрицитабин, аловудин, амдоксовир, элвуцитабин и подобные агенты; ненуклеозидные ингибиторы обратной транскриптазы (включающие агент, обладающий антиоксидантной активностью, такой как иммунокал, олтипраз и т.д.), такие как невирапин, делавирдин, эфавиренз, ловирид, иммунокал, олтипраз, каправирин, ТМС-278, ТМС-125, этравирин и подобные агенты; ингибиторы проникновения, такие как энфувиртид (Т-20), Т-1249, PRO-542, PRO-140, TNX-355, BMS-806, 5-Helix и подобные агенты; ин- 10020631 гибиторы интегразы, такие как L-870180 и подобные агенты; ингибиторы активной репликации вируса после проникновения в клетку, такие как РА-344 и РА-457 и подобные агенты; ингибиторы хемокинового рецептора, такие как викривирок (Sch-C), Sch-D, TAK779, маравирок (UK-427,857), TAK449, а также раскрытые в WO 02/74769, WO 2004/054974, WO 2004/055012, WO 2004/055010, WO 2004/055016,WO 2004/055011 и WO 2004/054581, и подобные агенты; ингибиторы нейраминидазы, такие как CS-8958,занамивир, оселтамивир, перамивир и подобные агенты; блокаторы ионных каналов, такие как амантадин или римантадин, и подобные агенты; и интерферирующая РНК и антисмысловые олигонуклеотиды,такие как ISIS-14803 и подобные агенты; антивирусные агенты неустановленного механизма действия,например, раскрытые в WO 2005/105761, WO 2003/085375, WO 2006/122011, рибавирин и подобные агенты. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть использованы в комбинации с одним или более чем одним другим агентом, который может быть полезен в профилактике или лечении вирусных инфекций, например, иммунотерапевтическим средством (например, интерфероном или другими цитокинами/хемокинами, модуляторами цитокинового/хемокинового рецептора, цитокиновыми агонистами или антагонистами и подобными агентами); и терапевтическими вакцинами, противофиброзными агентами, противовоспалительными агентами, такими как кортикостероиды илиNSAID (нестероидные противовоспалительные агенты) и подобными агентами. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в комбинации с одним или более чем одним другим агентом, который может быть полезен в предупреждении или лечении аллергического заболевания, воспалительного заболевания, аутоиммунного заболевания,например антигенным иммунотерапевтическим средством, антигистаминами, стероидами, NSAID, бронходилататорами (например, бета-2 агонистами, адренергическими агонистами, антихолинергическими агентами, теофиллином), метотрексатом, лейкотриеновыми модуляторами и подобными агентами; терапией моноклональными антителами, такими как антитела против IgE, антитела против TNF (фактор некроза опухоли), антитела против IL-5, антитела против IL-6, антитела против IL-12, антитела против IL-1 и подобные агенты; рецепторной терапией, например энтанерцепт и подобные агенты; антигеннеспецифическими иммунотерапевтическими средствами (например, интерферон или другие цитокины/хемокины, модуляторы цитокинового/хемокинового рецептора, цитокиновые агонисты или антагонисты, агонисты TLR и подобные агенты). Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в комбинации с одним или более чем одним другим агентом, который может быть полезен в предупреждении или лечении рака, например химиотерапевтическими агентами, такими как алкилирующие агенты, ингибиторы топоизомеразы, антиметаболиты, антимитотические агенты, ингибиторы киназы и подобные агенты; агентами для терапии моноклональными антителами, такими как трастузумаб, гемтузумаб и другие подобные агенты; и агентами для гормональной терапии, такими как тамоксифен, гозерелин и подобные агенты. Фармацевтические композиции по изобретению также могут быть использованы отдельно или в комбинации по меньшей мере с одним другим терапевтическим агентом в других терапевтических областях, например при желудочно-кишечном заболевании. Композиции по изобретению также могут быть использованы в комбинации с гензаместительной терапией. Изобретение раскрывает комбинацию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль вместе по меньшей мере с одним другим терапевтически активным агентом. Вышеупомянутые комбинации для удобства могут быть представлены для применения в форме фармацевтической композиции, и, таким образом, фармацевтические композиции, содержащие комбинацию, определенную выше, вместе по меньшей мере с одним ее фармацевтически приемлемым разбавителем или носителем, также раскрыты в изобретении. Терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли зависит от множества факторов. Например, вид, возраст и масса тела реципиента, точное состояние, которое требует лечения, и его тяжесть, природа композиции и путь введения представляют собой факторы, которые следует рассматривать. Терапевтически эффективное количество в конечном итоге должно находиться на усмотрении лечащего врача. Вне зависимости, эффективное количество соединения по настоящему изобретению для лечения людей, страдающих болезнью, как правило, должно находиться в диапазоне от 0,0001 до 100 мг/кг массы тела реципиента в сутки. Обычно эффективное количество должно находиться в диапазоне от 0,001 до 10 мг/кг массы тела в сутки. Таким образом, для взрослого человека массой 70 кг один пример действительного количества в сутки обычно может составлять от 7 до 700 мг. Для интраназального и ингаляционного путей введения типичные дозы для взрослого человека массой 70 кг должны находиться в диапазоне от 1 мкг до 1 мг в сутки. Это количество может быть введено в разовой дозе в сутки или во множестве (таких как две, три, четыре, пять или более) субдоз в сутки, так что общая суточная доза является той же самой. Эффективное количество фармацевтически приемлемой соли соединения формулы (I) может быть определено как доля эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли как таковая. Подобные дозы должны подходить для лечения других упомянутых здесь состояний.- 11020631 Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть введены с любой подходящей частотой, например 1-7 раз в неделю. Точная схема введения доз, безусловно, зависит от факторов, таких как терапевтическое показание, возраст и состояние пациента и конкретный выбранный путь введения. Фармацевтические композиции могут быть представлены в стандартных лекарственных формах,содержащих предопределенное количество активного ингредиента на стандартную дозу. Такая доза может содержать в качестве не ограничивающего примера от 0,5 мг до 1 г соединения формулы (I) или его фармацевтически приемлемой соли в зависимости от состояния, которое лечат, пути введения и возраста,массы тела и состояния пациента. Предпочтительные композиции стандартной дозы представляют собой композиции, содержащие суточную дозу или субдозу, как изложено выше, или ее подходящую фракцию активного ингредиента. Такие фармацевтические композиции могут быть изготовлены любым из способов, хорошо известных в области фармации. Таким образом, дополнительно предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и один или более чем один фармацевтически приемлемый разбавитель или носитель. Также раскрыт способ изготовления такой фармацевтической композиции, включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли с одним или более чем одним фармацевтически приемлемым разбавителем или носителем. В описании и следующей формуле изобретения, если иное не требуется по контексту, следует понимать, что слово "содержать" и варианты, такие как "содержит" и "содержащий", подразумевают включение указанного целого числа, или стадии, или группы целых чисел, но не исключение какого-либо другого целого числа, или стадии, или группы целых чисел или стадий. Соединения формулы (I) и его соли могут быть получены описанными ниже способами, составляющими дополнительные аспекты данного изобретения. Соответственно, раскрыт способ получения соединения формулы (I), включающий удаление защиты с соединения формулы (II) где R1, m и n являются такими, как определено выше для соединения формулы (I);R2 представляет собой C1-6 алкил и затем при необходимости одну или более чем одну из следующих возможных стадий:(1) удаление любой необходимой защитной группы;(2) получение соли образованного таким образом соединения. Например, соединение формулы (II) растворяют в подходящем растворителе в присутствии раствора подходящей кислоты, например раствора хлороводорода в 1,4-диоксане, и перемешивают при подходящей температуре, например температуре окружающей среды, в течение подходящего периода времени, например 12-24 ч. Растворитель удаляют при пониженном давлении и остаток растворяют в подходящем растворителе, например метаноле, и наносят на ионообменный картридж, например аминопропиловый SPE-картридж. Картридж элюируют подходящим растворителем, например метанолом, и растворитель удаляют с получением соединения формулы (I). Соединение формулы (II) может быть получено путем взаимодействия соединения формулы (III) где R1 и m являются такими, как определено выше для соединения формулы (I);R2 является таким, как определено выше для соединения формулы (II);X представляет собой уходящую группу, например группу галогено, такую как бромо или хлоро,с соединением формулы (IV) где n является таким, как определено для соединения формулы (I).N,N-диизопропилэтиламин, растворяют в подходящем растворителе, например DMF (диметилформамид), и нагревают при подходящей температуре, например 50-60C, в течение подходящего периода времени, например 46-50 ч. При необходимости добавляют дополнительное количество соединения формулы (IV) и основание и эту реакционную смесь нагревают при подходящей температуре, например 50-60C, в течение подходящего периода времени, например 46-50 ч. Продукт затем экстрагируют из реакционной смеси с использованием обычных способов, например путем распределения между подходящим органическим растворителем и водой, а затем отделения органической фазы и удаления растворителя и при необходимости очистки. Соединение формулы (III) может быть получено путем взаимодействия соединения формулы (V),например соли соединения формулы (V), такой как соль трифторацетат: где R1 является таким, как определено выше для соединения формулы (I);R2 является таким, как определено выше для соединения формулы (II),с соединением формулы (VI) где m является таким, как определено выше для соединения формулы (I);X является таким, как определено выше для соединения формулы (III). Например, соль трифторацетат соединения формулы (V) и подходящее основание, например карбонат калия, суспендируют в подходящем растворителе, например DMF, и нагревают до подходящей температуры, например 50-60C, в подходящей атмосфере, например атмосфере азота, в течение подходящего периода времени, например 20-120 мин. Эту смесь охлаждают до подходящей температуры, например температуры окружающей среды, и добавляют соединение формулы (VI) и перемешивание продолжают при температуре окружающей среды в течение подходящего периода времени, например 18-24 ч. Растворитель выпаривают при пониженном давлении и остаток распределяют между подходящим растворителем, например DCM, и водой. Неочищенный продукт затем выделяют из органической фазы и очищают обычными способами, такими как колоночная хроматография. Альтернативно, соединение формулы (II) может быть получено путем взаимодействия соединения формулы (V), например соли соединения формулы (V), такой как соль трифторацетат, с соединением формулы (VI), где X представляет собой бромо, с соединением формулы (IV) в виде "однореакторного" способа. Например, соль трифторацетат соединения формулы (V) растворяют в подходящем растворителе,например DMF, и добавляют подходящее основание, например карбонат калия. Реакционную смесь перемешивают при подходящей температуре, например 45-60C, в подходящей атмосфере, например атмосфере азота, в течение подходящего периода времени, например 1-2 ч, и затем охлаждают до подходящей температуры, например температуры окружающей среды. Затем добавляют соединение формулы (VI),где X представляет собой бромо, и после перемешивания в течение подходящего периода времени, например 40-60 мин, добавляют соединение формулы (IV) и подходящее основание, например триэтиламин, в подходящем растворителе, например DMF. Реакционную смесь затем перемешивают в течение подходящего периода времени, например 12-24 ч. Растворитель удаляют и остаток распределяют между подходящим органическим растворителем, например дихлорметаном, и водой. Неочищенный продукт формулы (II) выделяют обычными способами и очищают, например, хроматографией. Соль соединения формулы (V) может быть получена путем удаления защиты с соединения формулы (VII) где R1 является таким, как определено выше для соединения формулы (I);R2 является таким, как определено выше для соединения формулы (II); Р представляет собой защитную группу, например группу тетрагидро-2 Н-пиран-2-ил,в присутствии подходящей кислоты, например трифторуксусной кислоты. Например, подходящую кислоту, например трифторуксусную кислоту, добавляют к раствору соединения формулы (VII) в подходящем растворителе, например метаноле. Смесь перемешивают при подходящей температуре, например температуре окружающей среды, в течение подходящего периода- 13020631 времени, например 48-72 ч. Реакционную смесь затем концентрируют при пониженном давлении, а затем разбавляют подходящим растворителем, например этилацетатом. Получающуюся в результате смесь фильтруют и промывают небольшим объемом подходящего растворителя, например этилацетата, до обесцвечивания фильтрата. Остаток сушат на воздухе и затем при пониженном давлении с получением соли соединения формулы (V). Фильтрат можно сконцентрировать и концентрат разбавить небольшим объемом подходящего растворителя, например этилацетата, и затем отфильтровать и высушить с получением второго выхода соли соединения формулы (V). Соль соединения формулы (V), например соль трифторацетат, также может быть получена путем взаимодействия соединения формулы (IX) где R1 является таким, как определено выше для соединения формулы (I); Р является таким, как определено выше для соединения формулы (VII),с подходящим галогенирующим агентом, например N-бромсукцинимидом, а затем взаимодействия с алкоксид-анионом, например метоксид-анионом, и затем выделена в присутствии подходящей кислоты,например трифторуксусной кислоты. Например, к раствору неочищенного соединения формулы (IX) в подходящем безводном растворителе, например безводном хлороформе, при подходящей температуре, например температуре окружающей среды, порциями добавляют подходящий галогенирующий агент, например N-бромсукцинимид, в течение подходящего периода времени, например 5 мин. Раствор перемешивают при подходящей температуре, например температуре окружающей среды, в течение подходящего периода времени, например 25-35 мин. Реакционную смесь затем промывают водой и органическую фазу сушат путем, например,пропускания через гидрофобную фритту и концентрируют при пониженном давлении. Полученное в результате твердое вещество растворяют в подходящем безводном растворителе, например безводном метаноле, и добавляют подходящий алкоксид, например раствор метоксида натрия в метаноле, при подходящей температуре, например температуре окружающей среды, в инертной атмосфере, например атмосфере азота. Реакционную смесь нагревают при подходящей температуре, например 60-70C, с присоединенным конденсатором, в течение подходящего периода времени, например 12-18 ч. Реакционную смесь затем охлаждают и концентрируют при пониженном давлении. Остаток затем суспендируют в подходящем растворителе, например этилацетате, и вливают в подходящую водную среду, например насыщенный водный раствор хлорида аммония. Органический слой отделяют и дополнительно промывают водой, сушат, например, над сульфатом магния, фильтруют и концентрируют при пониженном давлении. К раствору этого вещества в подходящем безводном растворителе, таком как безводный метанол,при подходящей температуре, например температуре окружающей среды, добавляют подходящую кислоту, например трифторуксусную кислоту. Реакционную смесь перемешивают в течение подходящего периода времени, например 25-35 ч, и концентрируют при пониженном давлении с получением соединения формулы (V). Соединение формулы (VII) может быть получено путем взаимодействия соединения формулы где R1 является таким, как определено выше для соединения формулы (I);P является таким, как определено выше для соединения формулы (VII);Q представляет собой атом галогена, например атом брома, с алкоксид-анионом, например метоксид-анионом. Например, раствор соединения формулы (VIII) в подходящем растворителе, например метаноле, нагревают до температуры дефлегмации с раствором подходящего алкоксида, например метоксида натрия,в подходящем растворителе, например метаноле, в течение подходящего периода времени, например 4-5 ч. Реакционную смесь концентрируют при пониженном давлении и распределяют между подходящим органическим растворителем, например этилацетатом, и подходящей водной средой, например насыщенным водным раствором хлорида аммония. Органическую фазу отделяют, промывают, например, рассолом, и сушат путем, например, пропускания через гидрофобную фритту. Растворитель затем удаляют при пониженном давлении с получением соединения формулы (VII). Соединение формулы (VIII) может быть получено путем взаимодействия соединения формулы (IX) с подходящим галогенирующим агентом, таким как N-бромсукцинимид.- 14020631 Например, соединение формулы (IX) растворяют в подходящем растворителе, например хлороформе, и охлаждают до подходящей температуры, например 0-0,5C. К этому раствору добавляют подходящий галогенирующий агент, такой как N-бромсукцинимид, поддерживая температуру ниже приблизительно 3C. Раствор перемешивают при подходящей температуре, например 2-3C, в течение подходящего периода времени, например 30-45 мин, затем оставляют нагреваться до подходящей температуры, например температуры окружающей среды, и перемешивают в течение подходящего периода времени, например 5-7 ч. Реакционную смесь затем промывают водой и органическую фазу сушат и отделяют от водной фазы с использованием, например, гидрофобной фритты. Органический растворитель затем удаляют и неочищенный продукт очищают, например, хроматографией с получением соединения формулы(VIII). Соединение формулы (IX), где R1 представляет собой C1-6 алкокси, может быть получено путем взаимодействия соединения формулы (X) где Р является таким, как определено выше для соединения формулы (VII); Т представляет собой подходящую уходящую группу, например атом галогена, например атом хлора или атом фтора,с раствором соединения формулы (XIII) где R1 представляет собой С 1-6 алкокси; М представляет собой подходящий лиганд щелочного металла, такого как натрий, приготовленным в растворителе формулы (IIIS) где группа R1 в соединении формулы (XIII) является такой же, как группа R1 в растворителе формулы (XIIIS). Например, соединение формулы (XIII), такое как трет-бутоксид натрия, добавляют к растворителю формулы (XIIIS). Смесь перемешивают до гомогенного состояния, затем добавляют соединение формулы (VII). Реакционную смесь нагревают до подходящей температуры, например 100C, в течение подходящего периода времени, например 12-18 ч. Растворитель в значительной степени удаляют при пониженном давлении и смесь распределяют между подходящим растворителем, например диэтиловым эфиром, и водой. Органическую фазу отделяют и водную фазу повторно экстрагируют дополнительным количеством растворителя. Органические слои затем отделяют, объединяют, сушат с использованием подходящего осушителя, например безводного сульфата магния. Осушитель удаляют путем фильтрования и растворитель удаляют из продукта при пониженном давлении с получением соединения формулы (IX),где R1 представляет собой C1-6 алкокси. Соединение формулы (IX), где R1 представляет собой C1-6 алкиламино, может быть получено путем взаимодействия соединения формулы (X) с соединением формулы (XIV) где R1 представляет собой C1-6 алкиламино. Например, соединение формулы (XIV) добавляют к раствору соединения формулы (X) в подходящем безводном растворителе, например безводном этиленгликоле, при подходящей температуре, например температуре окружающей среды, в подходящей инертной атмосфере, например атмосфере азота. Реакционную смесь нагревают при подходящей температуре, например 110-130C, в течение подходящего периода времени, например 12-18 ч. Реакционную смесь затем охлаждают до подходящей температуры, например температуры окружающей среды, разбавляют подходящим растворителем, например этилацетатом, и промывают водой. Органический слой сушат подходящим осушителем, например безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением соединения формулы (IX), где R1 представляет собой C1-6 алкиламино. Соединение формулы (X) может быть получено путем взаимодействия соединения формулы (XI) где Р является таким, как определено выше для соединения формулы (VII); Т является таким, как определено выше для соединения формулы (X);V представляет собой подходящую уходящую группу, например атом галогена, например атом хло- 15020631 ра,со спиртовым раствором аммиака, например раствором аммиака в изопропиловом спирте. Например, соединение формулы (XI) нагревают со спиртовым раствором аммиака, например 2 М раствором аммиака в изопропиловом спирте, при подходящей температуре, например 50-60C, в течение подходящего периода времени, например 5-6 ч. Реакционную смесь затем оставляют при подходящей температуре, например температуре окружающей среды, в течение подходящего периода времени, например 12-18 ч. Дополнительное количество спиртового раствора аммиака, например 2 М раствора аммиака в изопропиловом спирте, добавляют для разрушения образующегося в результате осадка и реакционную смесь нагревают в течение дополнительного периода времени, например 8-10 ч, до полного завершения реакции. Воду добавляют к этой реакционной смеси и твердое вещество удаляют путем фильтрования, промывают подходящей промывочной средой, например смесью изопропилового спирта и воды, и затем сушат, например путем сушки на воздухе при аспирации с получением первого выхода соединения формулы (X). Фильтрат оставляют на дополнительный период времени, например 12-18 ч, и образующийся в результате второй выход соединения формулы (X) выделяют путем фильтрования и сушат. Соединение формулы (X) также может быть получено путем взаимодействия соединения формулы где Т является таким, как определено выше для соединения формулы (X);V является таким, как определено выше для соединения формулы (XI),с соединением формулы (XV) где PU представляет собой подходящий предшественник для защитной группы P, например 3,4-дигидро-2H-пиранильную группу, с последующим взаимодействием со спиртовым раствором аммиака, например раствором аммиака в изопропиловом спирте. Например, моногидрат паратолуолсульфоновой кислоты добавляют к раствору соединения формулы (XII) в подходящем безводном растворителе, например безводном этилацетате. Реакционную смесь нагревают до подходящей температуры, например 50-60C, и добавляют соединение формулы (XV). Реакционную смесь перемешивают при подходящей температуре, например 50-60C, в течение подходящего периода времени, например 1-2 ч, и растворитель удаляют при пониженном давлении. Суспензию образующегося в результате твердого вещества в спиртовом растворе аммиака, например 2 М растворе аммиака в изопропиловом спирте, нагревают в подходящей инертной атмосфере, например атмосфере азота, при подходящей температуре, например 60-70C, в течение подходящего периода времени, например 4-5 ч, с присоединенным конденсатором. Реакционную смесь вливают в воду и оставляют охлаждаться в течение подходящего периода времени, например 12-18 ч. Образующийся в результате осадок выделяют путем фильтрования и сушат с получением соединения формулы (X). Соединение формулы (X) также может быть получено путем взаимодействия соединения формулы где Т представляет собой атом фтора,с подходящим защитным агентом,например силилирующим агентом,таким какN,О-бис-(триметилсилил)ацетамид, с последующим взаимодействием защищенного соединения формулы (XIA) с соединением формулы (XVE) где PU представляет собой подходящий предшественник защитной группы P, например 3,4-дигидро-2 Н-пиранильную группу; Е представляет собой ацилоксигруппу, например ацетатную группу. Например, подходящий защитный агент, например N,O-бис-(триметилсилил)ацетамид, добавляют к перемешиваемой суспензии соединения формулы (XIA), например 2-фтор-1 Н-пурин-6-амина, в подходящем безводном растворителе, например безводном ацетонитриле, и получающуюся в результате смесь нагревают до температуры дефлегмации в течение подходящего периода времени, например 2-3 ч. Реакционную смесь затем охлаждают до подходящей температуры, например 0-5C. Затем медленно добавляют раствор соединения формулы (XVE), например тетрагидропиранилацетата, в подходящем безвод- 16020631 ном растворителе, например безводном ацетонитриле, а затем по каплям добавляют кислоту Льюиса,например триметилсилил-трифторметансульфонат. Температуру реакционной смеси доводят до подходящей температуры, например 8-15C, и перемешивание поддерживают в течение дополнительного периода времени, например 1-2 ч. Смесь затем гасят путем добавления 1 М карбоната натрия. Органический слой охлаждают до 0C при перемешивании. Осажденное твердое вещество затем собирают путем,например, фильтрования и сушат. Соединение формулы (XI) может быть получено путем взаимодействия соединения формулы (XII) с соединением формулы (XV). Например, к соединению формулы (XII) добавляют подходящий органический растворитель, например этилацетат, а затем паратолуолсульфоновую кислоту. Смесь нагревают до подходящей температуры, например 50-60C, и затем добавляют 3,4-дигидро-2H-пиран. Реакционную смесь затем нагревают при подходящей температуре, например 50-60C, в течение подходящего периода времени, например 4-5 ч. Растворитель затем удаляют из реакционной смеси при пониженном давлении с получением соединения формулы (XI). Сокращения. В следующем перечне приведены определения некоторых используемых здесь сокращений. Понятно, что перечень не является избыточным, но значения тех сокращений, которые не определены ниже,легко понятны специалисту в данной области техники.ISCO Companion - автоматическое оборудование для флэш-хроматографии с анализом фракций по УФ (ультрафиолетовому) поглощению, поставляемое Presearch Limited, Basingstoke, Hants, RG24 8PZ,UK;MDAP HPLC - обращенно-фазовая HPLC на колонке C18 с использованием градиента двух растворителей и анализа фракций с использованием масс-спектрометрии с распылением электронов;Ph - фенил; к.т. - комнатная температура. Описанные выше способы синтеза обобщены на схеме 1. Типичные условия реакции для каждой из стадий синтеза на схеме 1 приведены ниже. А. Дигидропиран/паратолуолсульфоновая кислота, например 50C в течение 3-6 ч. А 1) Дигидропиран/паратолуолсульфоновая кислота, например 50C в течение 1 ч, затем аммиак/iPrOH, например 60C в течение 4 ч, затем добавляют воду и охлаждают до температуры окружающей среды в течение 12-18 ч. А 2) BSA в MeCN, кипячение с обратным холодильником, охлаждение до 0C, затем ТНР ацетат вB) Аммиак/iPrOH, например 50C в течение 5 ч, затем температура окружающей среды в течение 12-18 ч, затем 50C в течение 9 ч.C1) NBS (N-бромсукцинимид) в CHCl3, например 0-5C в течение 30 мин, затем температура окружающей среды в течение 0,5-1 ч, затем, например, NaOMe/метанол при N2/60-70C/12-18 ч, затемTFA/MeOH, например при температуре окружающей среды в течение 18-65 ч.D) NBS в CHCl3, например 0-5C в течение 30 мин, затем температура окружающей среды в течение 36-48 ч.F) TFA/MeOH, например температура окружающей среды в течение 18-65 ч.G) K2CO3/DMF, затем 50C в течение 1-1,5 ч, затем добавляют (VI), перемешивают в течение 40 мин, затем добавляют (IV)/Et3N, затем температура окружающей среды в течение 18 ч.G1) K2CO3/DMF, затем 50C в атмосфере N2 в течение 30 мин, затем температура окружающей среды, добавляют (VI), перемешивают в течение 20 ч.G2) Раствор в DMF с N,N-диизопропилэтиламином, затем 50C в течение 48 ч, затем добавляют дополнительное количество (IV), затем еще 50C в течение 48 ч. Н) HCl/метанол, затем температура окружающей среды в течение 18 ч. Соединения формул (IV), (VI), (XIA), (XII), (XIII), (XIV) и (XV) известны из литературы или имеются в продаже, например от Sigma-Aldrich, UK, или могут быть получены аналогично известным способам, например способам, раскрытым в стандартных изданиях по методологии синтеза, таких как J.March, Advanced Organic Chemistry, 6th Edition (2007), WileyBlackwell, или Comprehensive Organic Synthesis (Trost B.M. and Fleming I., (Eds.), Pergamon Press, 1991), каждое из которых включено здесь путем ссылки как относящееся к таким способам. Примеры других защитных групп, которые могут быть использованы в описанных здесь путях синтеза, и способы их удаления можно найти в Т.W. Greene "Protective Groups in Organic Synthesis", 4thEdition, J. WileySons, 2006, включенном в данное описание путем ссылки как относящийся к таким способам. Для любой из описанных ранее реакций или способов могут быть использованы обычные способы нагревания и охлаждения, например масляные бани с регулировкой температуры или термоблоки с регулировкой температуры, и бани лед/соль или бани лед/ацетон соответственно. Могут быть использованы обычные способы выделения, например экстракция из водного или неводного растворителя или в водный или неводный растворитель. Могут быть использованы обычные способы сушки органических растворителей, растворов или экстрактов, такие как встряхивание с безводным сульфатом магния или безводным сульфатом натрия или пропускание через гидрофобную фритту. При необходимости могут быть использованы обычные способы очистки, например кристаллизация и хроматография, например хроматография на диоксиде кремния или обращенно-фазовая хроматография. Кристаллизация может быть осуществлена с использованием обычных растворителей, таких как этилацетат, метанол, этанол или бутанол или их водные смеси. Понятно, что температуры в конкретные моменты времени типично могут быть определены способами контроля взаимодействия, например тонкослойной хроматографии и LC-MS(жидкостная хроматография/масс-спектрометрия). Когда подходит, индивидуальные изомерные формы соединений по изобретению могут быть получены в виде индивидуальных изомеров с использованием обычных способов, таких как фракционная кристаллизация диастереоизомерных производных или хиральная высокоэффективная жидкостная хроматография (хиральная HPLC). Абсолютная стереохимия соединений может быть определена с использованием обычных способов,таких как рентгеновская кристаллография. Аспекты изобретения проиллюстрированы путем ссылки на следующие примеры, но никаким образом не ограничиваются ими. Общее подробное описание экспериментов. Соединения названы с использованием программного обеспечения для присваивания химических названий ACD/Name PRO 6.02 от Advanced Chemistry Developments Inc., Toronto, Ontario, M5H2L3, Canada. Подробности экспериментов для приведенных здесь систем A-D LCMS являются следующими. Система А. Колонка: 502,1 мм ID (внутренний диаметр), 1,7 м Acquity UPLC ВЕН C18. Скорость потока: 1 мл/мин. Температура: 40C. Диапазон УФ-детекции: 210-350 нм. Масс-спектр: Регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительных и отрицательных ионов с распылением электронов путем ионизации. Растворители: А: 0,1% об./об. муравьиная кислота в воде; Система В. Колонка: 304,6 мм ID, 3,5 мкм Sunfire C18. Скорость потока: 3 мл/мин. Температура: 30C. Диапазон УФ-детекции: 210-350 нм. Масс-спектр: Регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительных и отрицательных ионов с распылением электронов путем ионизации. Растворители: А: 0,1% об./об. раствор муравьиной кислоты в воде; В: 0,1% об./об. раствор муравьиной кислоты в ацетонитриле. Система С. Колонка: 502,1 мм ID, 1,7 мкм Acquity UPLC ВЕН C18. Скорость потока: 1 мл/мин. Температура: 40C. Диапазон УФ-детекции: 210-350 нм. Масс-спектр: Регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительных и отрицательных ионов с распылением электронов путем ионизации. Растворители: А: 10 мМ бикарбонат аммония в воде, доведенный до pH 10 раствором аммиака; В: ацетонитрил. Система D. Колонка: 504,6 мм ID, 3,5 мкм XBridge С 18. Скорость потока: 3 мл/мин. Температура: 30C. Диапазон УФ-детекции: 210-350 нм. Масс-спектр: Регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительных и отрицательных ионов с распылением электронов путем ионизации. Растворители: А: 10 мМ бикарбонат аммония в воде, доведенной до pH10 раствором аммиака. В: ацетонитрил. Хроматографическую очистку, как правило, осуществляли с использованием предварительно упакованных картриджей силикагеля. FlashMaster II представляет собой автоматическую многопользовательскую систему флэш-хроматографии, доступную от Argonaut Technologies Ltd, в которой используются одноразовые картриджи для твердофазной экстракции (SPE) с нормальной фазой (от 2 до 100 г). Она обеспечивает смешивание четырех растворителей в потоке для обеспечения реализации градиентных способов. Образцы поочередно обрабатывают с использованием многофункционального программного обеспечения с открытым доступом, которое управляет растворителями, скоростями потока, профилем градиента и условиями сбора. Система оборудована УФ-детектором с изменяемой длиной волны Knauer и двумя коллекторами фракций Gilson FC204, обеспечивающими автоматический выход пиков, сбор и отслеживание пиков. Удаление растворителей с использованием потока азота осуществляли при 30-40C в системеBruker Avance DRX, или Varian Unity 400, все из которых функционируют при 400 МГц. Внутренний использованный стандарт представлял собой тетраметилсилан или остаточный протонированный растворитель при 7,25 млн-1 для CDCl3 или 2,50 млн-1 для DMSO-d6. Автопрепаративную HPLC с управлением по массе осуществляли в приведенных ниже условиях. УФ-детекция представляла собой усредненный сигнал в диапазоне длин волн от 210 до 350 нм, и массспектры регистрировали на масс-спектрометре с использованием альтернативного режима сканирования положительных и отрицательных ионов с распылением электронов путем ионизации. Способ А. Способ А осуществляли на колонке XBridge C18 (типично 15019 мм в.д., диаметр упакованных частиц 5 мкм) при температуре окружающей среды. Используемые растворители представляли собой: А: 10 мМ водный бикарбонат аммония, доведенный до pH 10 раствором аммиака; В: ацетонитрил. Способ В. Способ В осуществляли на колонке Sunfire C18 (типично 15030 мм в.д., диаметр упакованных частиц 5 мкм) при температуре окружающей среды. Используемые растворители представляли собой: А: 0,1% об./об. раствор муравьиной кислоты в воде; В: 0,1% об./об. раствор муравьиной кислоты в ацетонитриле. Способ С. Способ С осуществляли на колонке Sunfire C18 (типично 15030 мм в.д., диаметр упакованных частиц 5 мкм) при температуре окружающей среды. Используемые растворители представляли собой: А: 0,1% об./об. раствор трифторуксусной кислоты в воде; В: 0,1% об./об. раствор трифторуксусной кислоты в ацетонитриле. Способ D. Способ D осуществляли на колонке Atlantis C18 (типично 10030 мм в.д., диаметр упакованных частиц 5 мкм) при температуре окружающей среды. Используемые растворители представляли собой: А: 0,1% об./об. раствор муравьиной кислоты в воде; В: 0,1% об./об. раствор муравьиной кислоты в ацетонитриле. Способ Е. Способ Е осуществляли на колонке Supelcosil ABZ+Plus (типично 10021,2 мм в.д., диаметр упакованных частиц 5 мкм) при температуре окружающей среды. Используемые растворители представляли собой: А: 0,1% об./об. раствор муравьиной кислоты в воде; В: ацетонитрил:вода 95:5 + 0,05% муравьиная кислота. Примеры Промежуточное соединение 1. 2,6-Дихлор-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин К 2,6-дихлорпурину (25,0 г) (например, доступному от Aldrich, UK) добавляли этилацетат (260 мл),а затем паратолуолсульфоновую кислоту (0,253 г). Смесь нагревали до 50C и затем добавляли 3,4-дигидро-2H-пиран (16,8 г). Реакционную смесь затем нагревали при 50C в течение 4 ч. Реакционную смесь упаривали в вакууме с получением указанного в заголовке соединения в виде желтого твердого вещества (36,9 г). 1 Н ЯМР (CDCl3): 8.35 (1 Н, s), 5.77 (1 Н, dd), 4.20 (1 Н, m), 3.79 (1 Н, m), 2.20-1.65 (6 Н, m). Промежуточное соединение 2. 2-Хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-амин 2,6-Дихлор-9-(тетрагидро-2 Н-пиран-2-ил)-9H-пурин (36,9 г) нагревали с 2 М аммиаком в изопропаноле (250 мл) при 50C в течение 5 ч. После выстаивания при температуре окружающей среды в течение ночи добавляли дополнительное количество 2 М аммиака в изопропаноле (100 мл) для разрушения возникающего в результате осадка и реакционную смесь нагревали в течение еще 9 ч до завершения реакции. К реакционной смеси добавляли воду (70 мл) и желтое твердое вещество отфильтровывали. Это твердое вещество промывали смесью изопропиловый спирт:вода (5:1 (об./об.), 60 мл) и затем сушили на воздухе при аспирации с получением первого выхода. Фильтрат повторно фильтровали после выстаивания в течение ночи с выделением осадка и оба твердых вещества сушили в вакууме. Первый выход был чистым, тогда как второй выход вещества продемонстрировал очень малое количество примесей (выделенный широкий сигнал при 3,5 млн-1, не обнаруживаемый в первом выходе), но в иных отношениях был идентичным. Первый выход твердого вещества (28,4 г), второй выход твердого вещества (3,42 г). 1 Н ЯМР (CDCl3): 8.01 (1 Н, s), 5.98 (2 Н, шир. s), 5.70 (1 Н, dd), 4.16 (1 Н, m), 3.78 (1 Н, m), 2.15-1.60 К раствору 2,6-дихлорпурина (25 г) (например, доступному от Aldrich, UK) в безводном этилацетате (200 мл) добавляли моногидрат паратолуолсульфоновой кислоты (235 мг). Реакционную смесь нагревали до 50C и добавляли однократно 3,4-дигидро-2 Н-пиран (18,1 мл). Реакционную смесь оставляли перемешиваться при 50C в течение 1 ч и растворитель удаляли при сниженном давлении. Это дало желтое твердое вещество. Суспензию этого твердого вещества (приблизительно 36 г) в 2 М аммиаке в изопропаноле (460 мл) нагревали в атмосфере азота при 60C в течение 4 ч с присоединенным конденсатором. Реакционную смесь вливали в воду (50 мл) и оставляли охлаждаться в течение ночи. Осадок отфильтровывали и сушили в роторном испарителе (60C) в течение 30 мин с получением указанного в заголовке соединения в виде беловатого твердого вещества, 31 г (93%, 2 стадии).- 22020631 К бутан-1-олу (76 мл) порциями добавляли трет-бутоксид натрия (15,2 г) (указание: реакционная смесь нагревается). Вышеприведенную смесь перемешивали до гомогенного состояния (приблизительно 15 мин), а затем к полученному в результате бледно-желтому раствору добавляли 2-хлор-9-(тетрагидро 2 Н-пиран-2-ил)-9H-пурин-6-амин (10,0 г). Реакционную смесь затем нагревали до 100C в течение ночи. Реакционную смесь упаривали для удаления максимально возможного количества бутан-1-ола, а затем распределяли между диэтиловым эфиром и водой. Фазу диэтилового эфира отделяли и водную фазу снова экстрагировали дополнительным количеством диэтилового эфира. Объединенные органические слои сушили над сульфатом магния (безводным). Сульфат магния отфильтровывали и фильтрат упаривали с получением коричневого вязкого масла, которое подвергали азеотропной перегонке с толуолом (3 раза) и помещали в высокий вакуум в течение ночи, переносили в новую колбу с дихлорметаном и упаривали,помещали в высокий вакуум с получением указанного в заголовке соединения в виде коричневого стекловидного вещества (9,45 г). 1 Н ЯМР (CDCl3): 7.85 (1 Н, s), 5.92 (2 Н, broad s), 5.64 (1 Н, d), 4.32 (2 Н, t), 4.14 (1 Н, m), 3.75 (1 Н, m),2.10-1.95 (3 Н, перекрывающиеся m), 1.81-1.58 (5 Н, перекрывающиеся m), 1.50 (2 Н, m), 0.97 (3 Н, t). Промежуточное соединение 4. 8-Бром-2-(бутилокси)-9-(тетрагидро-2H-пиран-2-ил)-9 Н-пурин-6 амин(50 мл) и охлаждали до 0C (ледяная баня). К этому раствору порциями добавляли N-бромсукцинимид(6,07 г), поддерживая температуру ниже 3C. Полученный таким образом темно-зеленый раствор перемешивали при 2,5C в течение 30 мин, а затем оставляли нагреваться до комнатной температуры и затем перемешивали в течение 6 ч. Реакционную смесь затем промывали водой (100 мл, дважды). Органическую фазу сушили/отделяли с использованием гидрофобной фритты и упаривали с получением темнокоричневой смолы, которую очищали путем хроматографии на силикагеле (120 г) (ISCO) с использованием градиентной элюции 0-50% этилацетат:циклогексан с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (8,37 г). 1 Н ЯМР (CDCl3): 5.61 (1 Н, dd), 5.49 (2 Н, шир. s), 4.32 (2 Н, m), 4.17 (1 Н, m), 3.71 (1 Н, m), 3.04 (1 Н,m), 2.11 (1 Н, шир. d), 1.89-1.45 (6 Н, перекрывающиеся m), 1.50 (2 Н, m), 0.97 (3H, t). Промежуточное соединение 5. 2-(Бутилокси)-8-(метилокси)-9-(тетрагидро-2H-пиран-2-ил)-9 Нпурин-6-амин 8-Бром-2-(бутилокси)-9-(тетрагидро-2H-пиран-2-ил)-9 Н-пурин-6-амин (8,37 г) нагревали до температуры дефлегмации с 25% метоксидом натрия в метаноле (14,4 мл) и метаноле (65 мл) в течение 4,5 ч. Реакционную смесь концентрировали при пониженном давлении и распределяли между этилацетатом и насыщенным раствором хлорида аммония. Органическую фазу отделяли и проводили повторную экстракцию в этилацетат. Объединенные органические фазы промывали рассолом (дважды). Органическую фазу пропускали через гидрофобную фритту после отделения водной фазы и упаривали с получением светло-коричневой смолы, которую помещали в высокий вакуум с получением пены (7,52 г), которая сжималась до смолы (7,34 г) при давлении окружающей среды и затвердевала в течение ночи с получением указанного в заголовке соединения в виде желтого аморфного твердого вещества. К раствору 2-(бутилокси)-8-(метилокси)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-амина (7,34 г) в метаноле (100 мл) добавляли трифторуксусную кислоту (10 мл). Смесь перемешивали при температуре окружающей среды в течение выходных дней с получением суспензии. Реакционную смесь концентрировали до небольшого объема (густая суспензия), а затем разбавляли этилацетатом (50 мл). Полученную в результате суспензию отфильтровывали и промывали небольшим объемом этилацетата до обесцвечивания фильтрата. Оставшееся твердое вещество сушили на воздухе и затем в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (6,20 г). Полученный ранее фильтрат концентрировали с получением суспензии, которую разбавляли небольшим объемом этилацетата (10 мл) и затем фильтровали и сушили, как указано выше. Этот второй выход выделяли в виде белого твердого вещества (0,276 г). Оба выхода были идентичны по ЯМР. К раствору 2-хлор-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-амина (10 г) в безводном этиленгликоле (50 мл) при комнатной температуре и в атмосфере азота однократно добавляли н-бутиламин(16 мл). Реакционную смесь нагревали при 120C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом (150 мл) и промывали водой (250 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Это дало указанное в заголовке соединение в виде вязкого зеленого масла (10,2 г), которое использовали на следующей стадии без дополнительной очистки.MS найдено (распыление электронов): (М+Н)+ = 291. 1 Н ЯМР CD3)2SO):7.8 (1 Н, s), 6.6 (2 Н, s), 6.2 (1 Н, t), 5.4 (1 Н, dd), 4.0 (1 Н, m), 3.6 (1 Н, m), 3.2 (2 Н,m), 2.2 (1 Н, m), 1.9 (1 Н, m), 1.8 (1 Н, m), 1.7 (1 Н, m), 1.5 (2 Н, m), 1.4 (2 Н, m), 1.3 (2 Н, m), 0.9 (3 Н, t). Промежуточное соединение 8. Соль трифторуксусной кислоты N2-бутил-8-(метилокси)-9 Н-пурин 2,6-диамина К раствору неочищенного N2-бутил-9-(тетрагидро-2 Н-пиран-2-ил)-9 Н-пурин-2,6-диамина (приблизительно 10,2 г) в безводном хлороформе (100 мл) при комнатной температуре порциями добавлялиN-бромсукцинимид (6,3 г) в течение 5 мин. Темный раствор оставляли перемешиваться при комнатной температуре в течение 30 мин. Реакционную смесь промывали водой (20 мл). Органическую фазу пропускали через гидрофобную фритту и концентрировали в вакууме. Это дало бежевое твердое вещество,которое растворяли в безводном метаноле (100 мл), и при комнатной температуре в атмосфере азота однократно добавляли раствор метоксида натрия (25 мас.% в метаноле, 24 мл). Реакционную смесь нагревали при 65C с присоединенным конденсатором в течение ночи. Эту реакционную смесь охлаждали и концентрировали в вакууме. Полученный в результате оранжевый остаток помещали в этилацетат(150 мл) и эту смесь вливали в насыщенный водный хлорид аммония (50 мл). Органический слой отделяли и промывали дополнительным количеством воды (50 мл). Органический слой сушили над MgSO4,фильтровали и концентрировали в вакууме. К этому веществу в безводном метаноле (70 мл) при комнатной температуре однократно добавляли трифторуксусную кислоту (7 мл). Реакционную смесь перемешивали в течение 30 ч и концентрировали в вакууме с получением темно-коричневого твердого вещест- 24020631 ва. Его суспендировали в диэтиловом эфире (20 мл) и растирали. Твердое вещество отфильтровывали с получением указанного в заголовке соединения в виде бежевого твердого вещества (3,3 г, 35%, 4 стадии).MS найдено (распыление электронов): (М+Н)+ = 237. 1 Н ЯМР CD3)2SO):13.3-12.3 (1 Н, br.m), 8.6-7.3 (2 Н, m), 4.05 (3 Н, s), 3.28 (2 Н, m), 1.52 (2 Н, m),1.33 (2 Н, m), 0,89 (3 Н, t) (оставшиеся взаимозаменяемые протоны не ясны). Промежуточное соединение 9. 2-[(1S)-1-Метилбутил]окси-9-(тетрагидро-2 Н-пиран-2-ил)-9Hпурин-6-амин Способ А. трет-Бутоксид натрия (48,5 г, 505 ммоль) порциями при комнатной температуре добавляли к(S)-2-пентанолу (185 мл) (например, доступному от Julich Chiral Solutions, Germany), перемешивали до гомогенного состояния (указание: реакция является экзотермической). Добавляли 2-хлор-9-(тетрагидро 2 Н-пиран-2-ил)-9 Н-пурин-6-амин (32 г, 126 ммоль) и эту реакционную смесь нагревали при 70C в течение 72 ч. Реакционную смесь охлаждали до комнатной температуры и распределяли между этилацетатом(500 мл) и водой (500 мл). Органическую фазу промывали насыщенным раствором хлорида натрия(100 мл), сушили (MgSO4), фильтровали и упаривали. Остаток растирали с простым эфиром и твердое вещество отфильтровывали. Осадок повторно промывали простым эфиром и фильтраты объединяли и упаривали. Неочищенное вещество (приблизительно 30 г) растворяли в смеси DMSO:метанол (1:1) и очищали путем хроматографии на колонке с обращенной фазой (C18) (330 г) с использованием градиента 25-65% ацетонитрил (+0,1%TFA)-вода(+0,1%TFA) в 8 объемах колонки, фракции немедленно нейтрализовали насыщенным водным раствором карбоната натрия. Соответствующие фракции объединяли и распределяли между дихлорметаном и насыщенным водным гидрокарбонатом натрия. Органическую фазу сушили путем пропускания через гидрофобную фритту, фильтровали и упаривали с получением указанного в заголовке соединения в виде бледно-кремовой пены (14,97 г).LCMS (система В): tRET (время удерживания) = 2,21 мин. МН+ = 306. Способ В. трет-Бутоксид натрия (206 г, 2,144 моль) добавляли к (S)-2-пентанолу (720 мл, 6,58 моль) (например, доступному от Julich Chiral Solutions, Germany) в круглодонной колбе объемом 2 л. Смесь перемешивали при 50C до растворения всего трет-бутоксида натрия. Затем добавляли 2-фтор-9-(тетрагидро 2H-пиран-2-ил)-9H-пурин-6-амин (130 г, 548 ммоль) порциями в течение 5 мин. Через 3 ч LCMS-анализ показал полное потребление исходного вещества, смесь вливали в лед/воду (3 л) и затем экстрагировали метил-трет-бутиловым эфиром. Это привело в результате к образованию эмульсии, смесь фильтровывали через целит и органическую фазу отделяли. Водный слой затем обрабатывали твердым NaCl и затем повторно экстрагировали метил-трет-бутиловым эфиром. Органические экстракты объединяли и промывали рассолом, сушили над сульфатом магния, фильтровали и затем упаривали с получением указанного в заголовке соединения в виде бледно-коричневой смолы (158,59 г).(14,9 г,48,8 ммоль) в хлороформе (80 мл) при 5C в атмосфере азота. Эту реакционную смесь перемешивали при 5C в течение 5 ч, затем промывали насыщенным раствором гидрокарбоната натрия (80 мл), затем водой (80 мл). Пену растворяли в DCM (50 мл) и промывали водой (50 мл), затем рассолом (50 мл). Объединенные водные фазы промывали DCM (50 мл). Объединенные органические слои сушили через гидрофобную фритту и растворитель удаляли в вакууме с получением указанного в заголовке соединения в виде оранжевой пены (18,5 г).(7,1 г,18,48 ммоль) растворяли в безводном метаноле (70 мл) и по каплям добавляли раствор метоксида натрия(25%) в метаноле (8 мл) в атмосфере азота. Раствор нагревали до температуры дефлегмации при 90C в течение 4 ч в атмосфере азота. Добавляли дополнительное количество метоксида натрия в метаноле (25% раствор, 3 мл) и эту реакционную смесь перемешивали при 60C в течение еще 16 ч. Добавляли дополнительную порцию метоксида натрия в метаноле (25% раствор, 5 мл) и реакционную смесь перемешивали при 90C в течение еще 7 ч. Растворитель удаляли в роторном испарителе и неочищенный продукт распределяли между EtOAc (75 мл) и насыщенным раствором хлорида аммония (75 мл). Органический слой промывали рассолом (75 мл). Растворитель удаляли в роторном испарителе с получением указанного в заголовке соединения в виде бледно-оранжевой пены (6 г). 2-[(1S)-1-Метилбутил]окси-8-(метилокси)-9-(тетрагидро-2H-пиран-2-ил)-9H-пурин-6-амин (6 г,17,89 ммоль) растворяли в метаноле (50 мл). По каплям добавляли трифторуксусную кислоту (20,67 мл,268 ммоль) и эту смесь перемешивали при 20C в течение 72 ч в атмосфере азота. Растворитель удаляли в вакууме и полученное в результате твердое вещество промывали этилацетатом и фильтровали. Фильтрат упаривали и остаток промывали этилацетатом. Объединенные твердые остатки сушили в вакуумсушильном шкафу в течение 2 ч с получением указанного в заголовке соединения в виде беловатого твердого вещества (5,3 г). Трифторацетат 2-(бутилокси)-8-(метилокси)-9H-пурин-6-амина (4,7 г, 13,38 ммоль) и карбонат калия (4,62 г, 33,4 ммоль) в безводном DMF (50 мл) перемешивали и нагревали при 50C в атмосфере азота в течение 75 мин. Смесь оставляли охлаждаться до комнатной температуры и затем охлаждали до 0C и добавляли 1-бром-3-хлорпропан (2,106 г, 13,38 ммоль). Эту смесь перемешивали при 0-10C в течение приблизительно 5 ч, затем оставляли нагреваться до комнатной температуры и перемешивали в течение приблизительно еще 40 ч, когда LCMS указала приблизительно на 70% желаемого продукта. Смесь оставляли осаждаться и супернатант отбирали путем пипетирования, а растворитель выпаривали в роторном испарителе с использованием высоковакуумного насоса приблизительно при 23C. Хлороформ и воду добавляли к объединенным остаткам, которые перемешивали, и фазы разделяли с использованием гидрофобной фритты. Водный слой повторно экстрагировали дополнительными порциями хлороформа и объединенные экстракты в хлороформе упаривали в высоком вакууме при 23C с получением желтого твердого вещества (2,798 г). Это неочищенное вещество объединяли с аналогичным веществом, полученным в результате двух аналогичных получений (0,56 г и 0,995 г), и объединяли путем колоночной флэш-хроматографии на диоксиде кремния с использованием смеси этилацетат/хлороформ 2:1 в качестве элюента с получением указанного в заголовке соединения в виде беловатого твердого вещества (3,011 г).(1,967 г, 14,23 ммоль) суспендировали в DMF (20 мл) и нагревали до 50C в атмосфере азота в течение 30 мин. Смесь охлаждали до комнатной температуры, добавляли 1-бром-4-хлорбутан (0,656 мл,5,69 ммоль) и перемешивание продолжали при комнатной температуре в течение 20 ч. Растворитель выпаривали при пониженном давлении и остаток распределяли между DCM (40 мл) и водой (40 мл). Слои разделяли с использованием гидрофобной фритты и водный слой промывали DCM (10 мл). Объединенные органические экстракты концентрировали в вакууме с получением неочищенного вещества, которое очищали путем хроматографии на силикагеле с использованием FlashMaster (картридж 70 г), элюируя градиентом циклогексан:этилацетат 0-100% в течение 30 мин. Фракции, содержащие продукт, объединяли и упаривали с получением указанного в заголовке соединения в виде белого твердого вещества (1,4 г).(1,967 г, 14,23 ммоль) суспендировали в DMF (20 мл) и нагревали до 50C в атмосфере азота в течение 1 ч. Смесь охлаждали до комнатной температуры, добавляли 1-бром-5-хлорпентан (0,75 мл, 5,69 ммоль) и перемешивание продолжали при комнатной температуре в течение 18 ч. Реакционную смесь распределяли между DCM (40 мл) и водой (40 мл) и слои разделяли с использованием гидрофобной фритты. Водный слой снова экстрагировали DCM (10 мл) и объединенные органические слои промывали насыщенным раствором хлорида лития, отделяли (гидрофобная фритта) и концентрировали в вакууме с получением указанного в заголовке соединения в виде желтого масла (1,946 г). К раствору соли трифторацетата 2-(бутилокси)-8-(метилокси)-9H-пурин-6-амина (3 г, 8,54 ммоль) вDMF (30 мл) добавляли карбонат калия (2,95 г, 21,35 ммоль) и смесь перемешивали при 60C в течение 1 ч в атмосфере азота. Смесь затем охлаждали до комнатной температуры и добавляли 1-бром-6-хлоргексан (1,27 мл, 8,54 ммоль) и эту реакционную смесь нагревали до 50C и перемешивали в течение ночи в атмосфере азота. Реакционную смесь разбавляли водой (приблизительно 50 мл) и экстрагировали этилацетатом (270 мл). Объединенные органические экстракты сушили (MgSO4), фильтро- 27020631 вали и фильтрат концентрировали с получением оранжевого масла (приблизительно 3,5 г). Это вещество растворяли в дихлорметане и очищали на FlashMaster II (аминопропиловый картридж 70 г) с использованием градиента 0-100% этилацетат в циклогексане в течение 60 мин. Соответствующие фракции объединяли и упаривали в вакууме с получением указанного в заголовке соединения в виде желтого масла, которое затвердевало до бледно-желтого твердого вещества (1,2 г). Трифторацетат N2-бутил-8-(метилокси)-9 Н-пурин-2,6-диамина (701 мг, 2,001 ммоль) и карбонат калия (690 мг, 4,99 ммоль) суспендировали в DMF (10 мл) и смесь нагревали при 50C в атмосфере азота в течение 2 ч. Смесь оставляли охлаждаться и затем добавляли 1-бром-3-хлорпропан (198 мкл,2,002 ммоль) и эту реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Через 16 ч реакционную смесь распределяли между водой и DCM (25 мл каждого). Водную фазу экстрагировали дополнительным количеством DCM (220 мл). Объединенные экстракты DCM сушили над сульфатом магния и концентрировали в вакууме с получением указанного в заголовке соединения с примесями в виде бледно-желтого масла с некоторым количеством твердого вещества (0,76 г), которое использовали без дополнительной очистки.(4,93 г, 35,7 ммоль) суспендировали в DMF (40 мл) и нагревали до 50C в атмосфере азота в течение 30 мин. Смесь охлаждали до комнатной температуры, добавляли 1-бром-4-хлорбутан (1,645 мл,14,27 ммоль) и перемешивание продолжали при комнатной температуре в течение 20 ч. Растворитель концентрировали в вакууме и остаток распределяли между DCM (100 мл) и водой (100 мл). Слои разделяли с использованием гидрофобной фритты и водную фазу повторно экстрагировали DCM (100 мл). Объединенные органические экстракты концентрировали в вакууме и остаток очищали путем хроматографии с использованием аппарата FlashMaster (100 г картридж диоксида кремния) и с использованием градиента DCM:метанол 0-25% в течение 40 мин. Желаемые фракции объединяли и концентрировали в вакууме с получением указанного в заголовке соединения с примесями в виде желтого масла (5,1 г).- 28020631 в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, когда добавляли 1-бром-5-хлорпентан (0,216 мл, 1,642 ммоль) и триэтиламин (0,343 мл, 2,464 ммоль), и эту смесь перемешивали при 20C в атмосфере азота в течение 16 ч. Смесь затем разбавляли водой (10 мл) и рассолом(10 мл) и экстрагировали DCM (210 мл). Объединенные органические экстракты упаривали и остаток растворяли в DCM и очищали путем колоночной хроматографии с использованием FlashMaster II (70 г аминопропиловый картридж) с градиентом 0-100% этилацетата в циклогексане в течение 40 мин. Соответствующие фракции объединяли и упаривали в вакууме с получением указанного в заголовке соединения в виде желтой смолы (430 мг).DMF (1 мл) и добавляли карбонат калия (98 мг, 0,712 ммоль). Реакционную смесь перемешивали при 50C в атмосфере азота в течение 1 ч и затем охлаждали до комнатной температуры. Добавляли 1,3-дибромпропан (0,029 мл, 0,285 ммоль) и после перемешивания в течение еще 40 мин добавляли азетидин (0,038 мл, 0,569 ммоль) и триэтиламин (0,079 мл, 0,569 ммоль) в DMF (1 мл). Реакционную смесь затем перемешивали в течение еще 18 ч. Растворитель удаляли и остаток распределяли между дихлорметаном (2 мл) и водой (2 мл). Слои разделяли с использованием гидрофобной фритты и водную фазу повторно экстрагировали DCM (2 мл). Объединенные органические экстракты концентрировали и остаток растворяли в смеси MeOH:DMSO 1:1 (1 мл) и очищали посредством MDAP (способ А). Продукт, содержащий фракции, упаривали в потоке азота с получением указанного в заголовке соединения в виде белого твердого вещества (13 мг). Получали аналогично промежуточному соединению 20 из трифторацетата 2-(бутилокси)-8(метилокси)-1H-пурин-6-амина, 1,3-дибромпропана и пирролидина. Получали аналогично промежуточному соединению 20 из трифторацетата 2-(бутилокси)-8(метилокси)-1 Н-пурин-6-амина, 1,3-дибромпропана и гексагидро-1H-азепина.
МПК / Метки
МПК: C07D 473/16, A61K 31/522, C07D 473/18, A61P 35/00, A61P 37/00
Метки: применения, заболеваний, инфекционных, лечении, пурина, аллергических, воспалительных, производные
Код ссылки
<a href="https://eas.patents.su/30-20631-proizvodnye-purina-dlya-primeneniya-v-lechenii-allergicheskih-vospalitelnyh-i-infekcionnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пурина для применения в лечении аллергических, воспалительных и инфекционных заболеваний</a>
Предыдущий патент: Корпус насоса
Следующий патент: Эластичный штифт для блокирующего остеосинтеза перелома длинной трубчатой кости
Случайный патент: Фланцевые окклюзионные устройства и способы