Ингибиторы киназы pim и способы их применения
Номер патента: 19951
Опубликовано: 30.07.2014
Авторы: Антониос-Маккри Уилльям Джр., Бёргер Маттью, Линдвалл Мика, Гарсиа Пабло, Аталлах Гордана, Шафер Синтия, Хан Вусок, Макбрайд Кристофер, Лань Цзян, Заворотинская Татьяна, Вальтер Аннетте, Белламасина Корнелия, Нишигучи Джизель, Ху Кей
Формула / Реферат
1. Соединение формулы (I) или его стереоизомер либо фармацевтически приемлемая соль
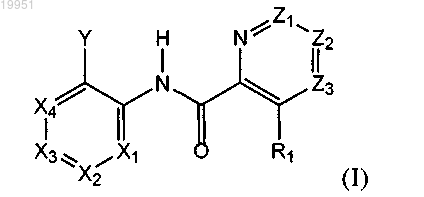
в которой X1, X2, Х3 и Х4 независимо выбраны из CR2 и N; при условии, что по меньшей мере один и не более двух из Х1, Х2, Х3 и Х4 обозначают N;
Y обозначает замещенную аминогруппу или замещенный или незамещенный C3-C8-циклоалкил, гетероциклоалкил или гетероарил;
Z1, Z2 и Z3 независимо выбраны из CR2 и N; при условии, что не более чем один из Z1, Z2 и Z3 может обозначать N;
R1 выбран из группы, включающей водород, галоген и -NH2;
каждый R2 независимо выбран из группы, включающей водород, галоген, гидроксигруппу, цианогруппу и замещенный или незамещенный C1-C12-алкил, C1-C12-алкоксигруппу, аминогруппу, аминокарбонил, C6-C10-арил, гетероарил, C3-C8-циклоалкил, гетероциклоалкил, частично насыщенный C3-C8-циклоалкил и C3-C8-циклоалкилоксигруппу;
термин "замещенный" относится к группе, в которой атом водорода замещен одним или более одновалентным или двухвалентными радикалами, где эти радикалы выбраны из гидроксигруппы, галогена, аминогруппы, цианогруппы, оксогруппы, карбоксигруппы, С1-С6-алкила, который является незамещенным или замещенным галогеном, гидроксигруппой, аминогруппой, нитрогруппой и/или цианогруппой; С1-С12-алкилкарбонила и аминокарбонила;
термин "гетероциклоалкил" относится к циклической группе, содержащей 3-8 атомов, из которых 1-4 в кольце являются гетероатомами, выбранными из N, О и S;
термин "гетероарил" относится к 5-10-членной ароматической группе, содержащей в качестве кольцевых атомов 1-4 гетероатома, выбранных из N, О и S;
термин "замещенный аминокарбонил" относится к группе -C(=O)-NRR', где R обозначает С1-С6-алкил и R' обозначает Н или С1-С6-алкил.
2. Соединение по п.1, в котором X1 обозначает N и Х2, Х3 и Х4 обозначают CR2.
3. Соединение по п.1, в котором X2 обозначает N и X1, X3 и Х4 обозначают CR2.
4. Соединение по п.1, в котором X3 обозначает N и Х1 Х2 и Х4 обозначают CR2.
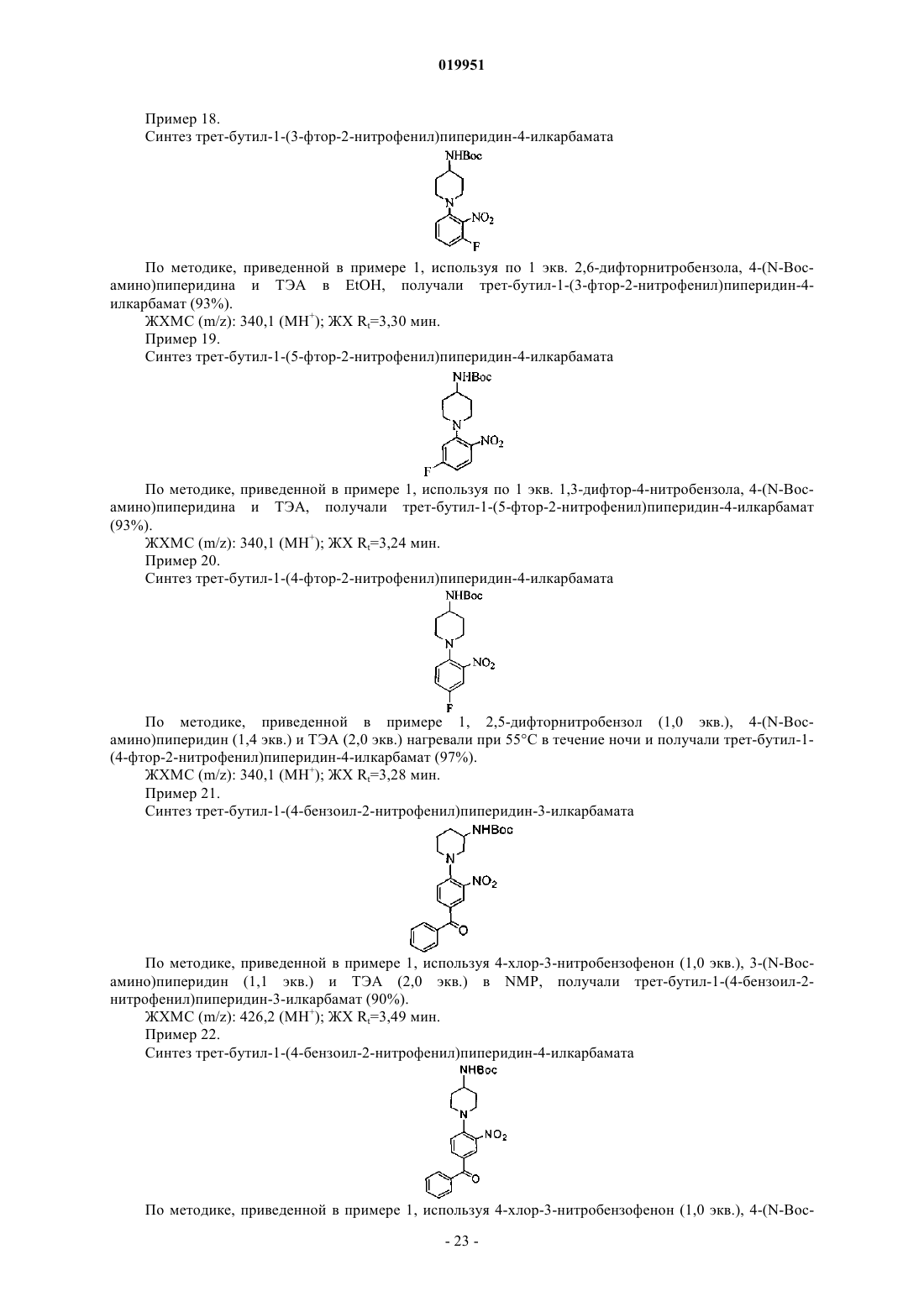
5. Соединение по п.1, в котором Х4 обозначает N и Х1, X2 и Х3 обозначают CR2.
6. Соединение по п.1, в котором Y обозначает замещенный или незамещенный пиперидинил или пиперазинил.
7. Соединение по п.1, в котором Z1, Z2 и Z3 обозначают CR2.
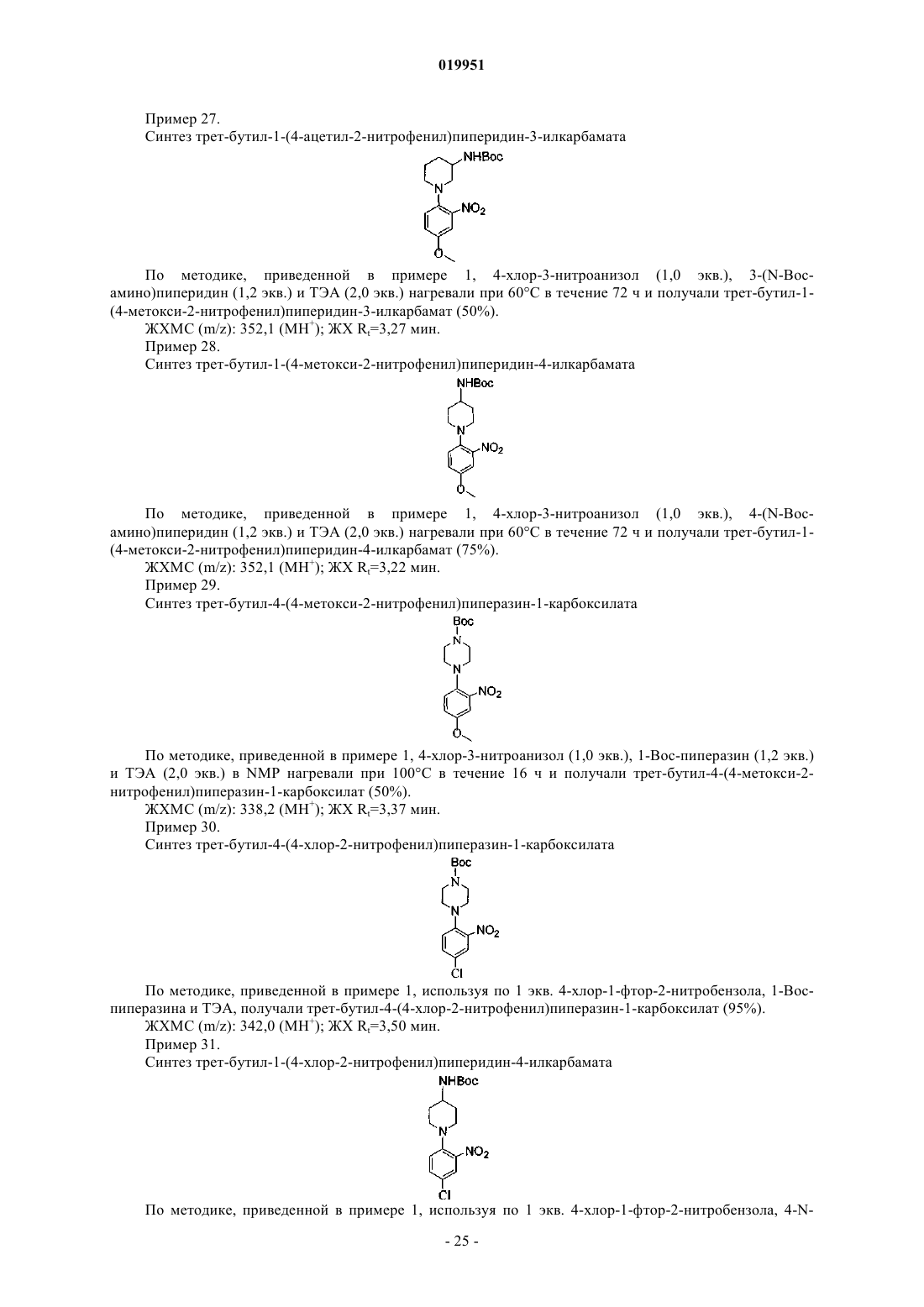
8. Соединение по п.1, в котором Z1 обозначает N и Z2 и Z3 обозначают CR2.
9. Соединение по п.1, в котором Z2 обозначает N и Z1 и Z3 обозначают CR2.
10. Соединение по п.1, в котором Z3 обозначает N и Z1 и Z2 обозначают CR2.
11. Соединение по п.1, в котором R1 обозначает водород.
12. Соединение по п.1, в котором каждый R2 независимо выбран из группы, включающей водород, галоген, гидроксигруппу, аминогруппу, цианогруппу, замещенный или незамещенный C1-C12-алкил и фенил.
13. Соединение по п.1 формулы (II) или его стереоизомер либо фармацевтически приемлемая соль
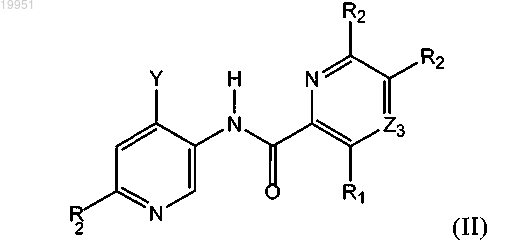
в которой Y обозначает замещенную аминогруппу или замещенный или незамещенный C3-C8-циклоалкил, гетероциклоалкил или гетероарил;
значения Z3, R1 и R2 определены в п.1.
14. Фармацевтическая композиция, предназначенная для лечения рака, включающая соединение по п.1 или его стереоизомер либо фармацевтически приемлемую соль в терапевтически эффективном количестве в комбинации с фармацевтически приемлемым носителем.
15. Композиция по п.14, которая дополнительно включает по меньшей мере одно дополнительное средство для лечения рака.
16. Способ ингибирования активности провирусной интеграции киназы Мэлони (киназа PIM) в клетке, включающий взаимодействие клетки с соединением по п.1 в эффективном количестве.
17. Способ лечения патологического состояния путем модуляции активности киназы PIM, включающий введение пациенту, нуждающемуся в таком лечении, соединения по п.1 в эффективном количестве.
18. Способ ингибирования активности киназы PIM у пациента, включающий введение пациенту композиции по п.14.
19. Способ лечения рака у пациента, включающий введение пациенту композиции по п.14.
20. Применение соединения по любому из пп.1-13 в качестве терапевтического средства, предназначенного для лечения рака.
21. Применение соединения по любому из пп.1-13 для приготовления лекарственного средства, предназначенного для лечения рака.
22. Соединение, выбранное из группы, включающей

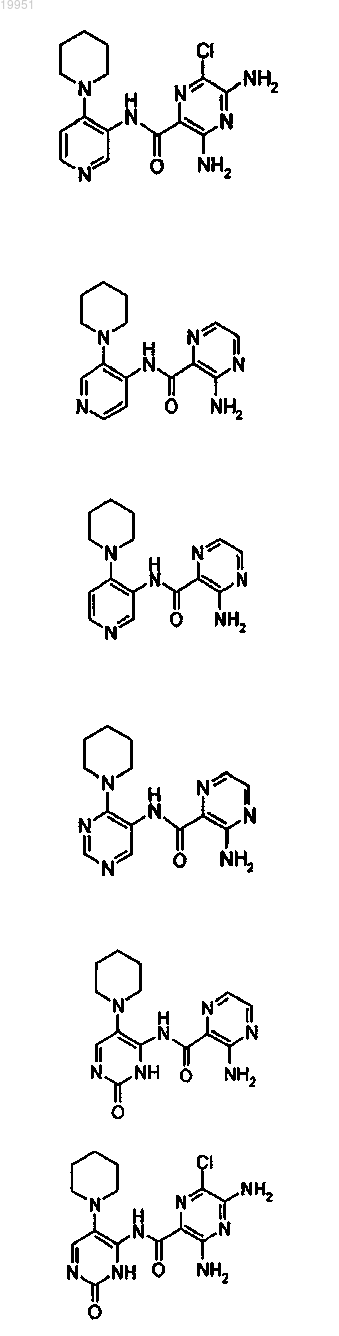
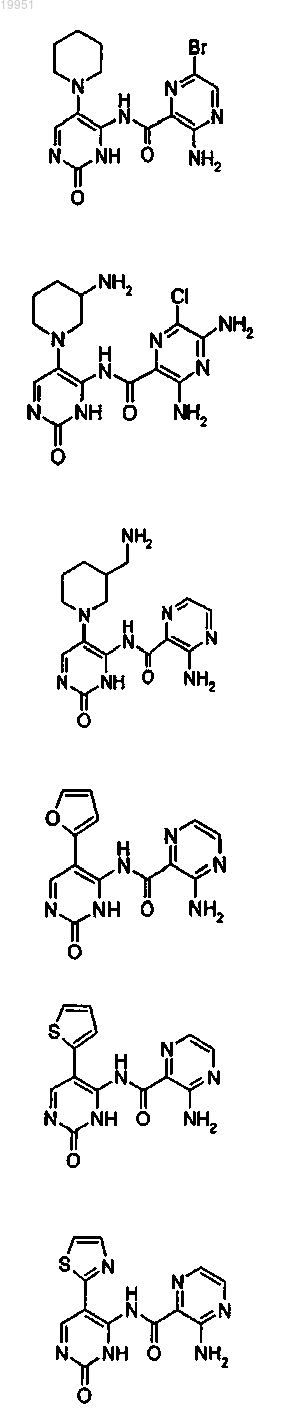
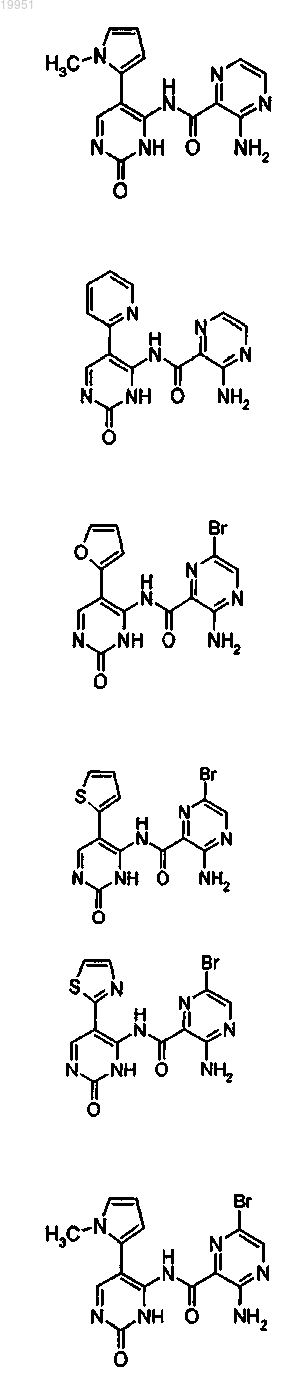

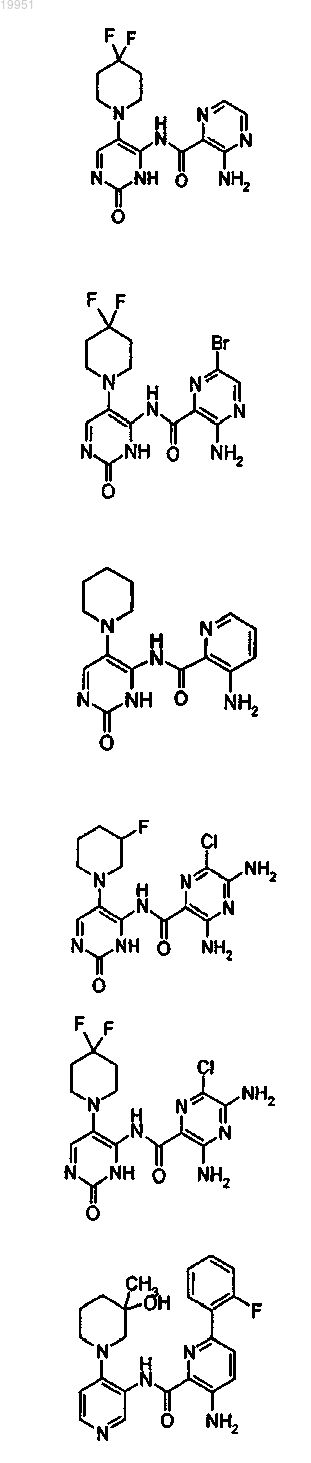

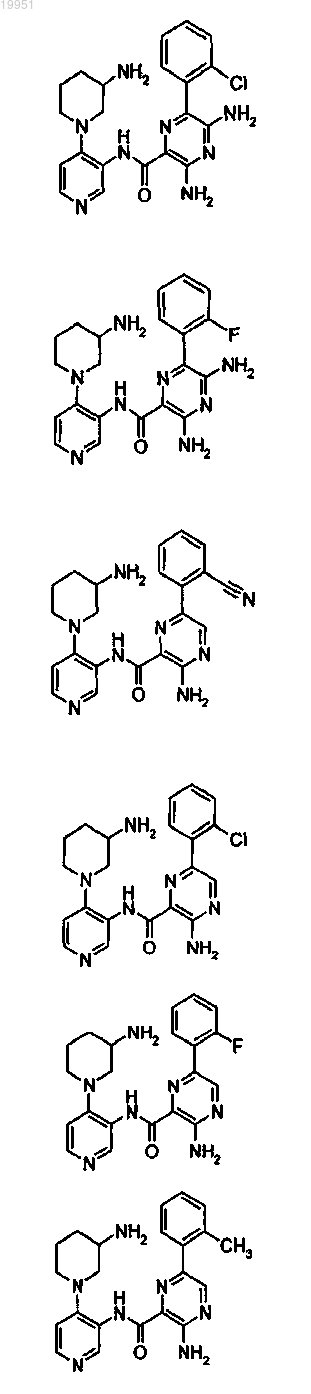
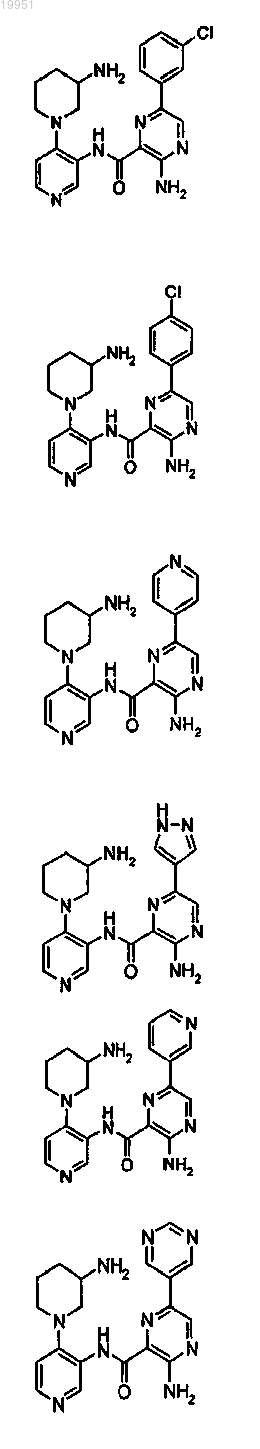
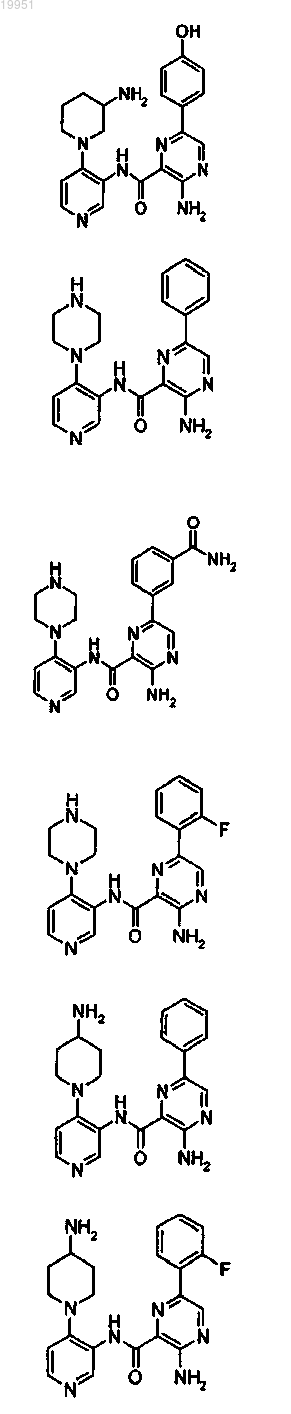
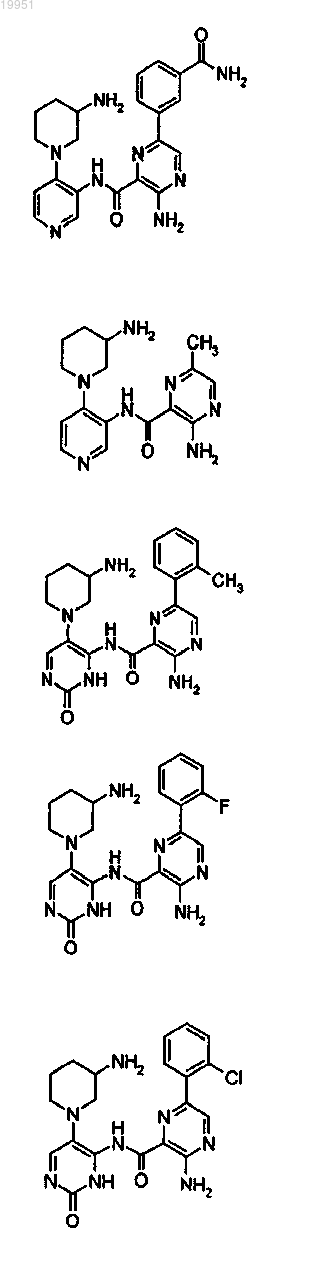
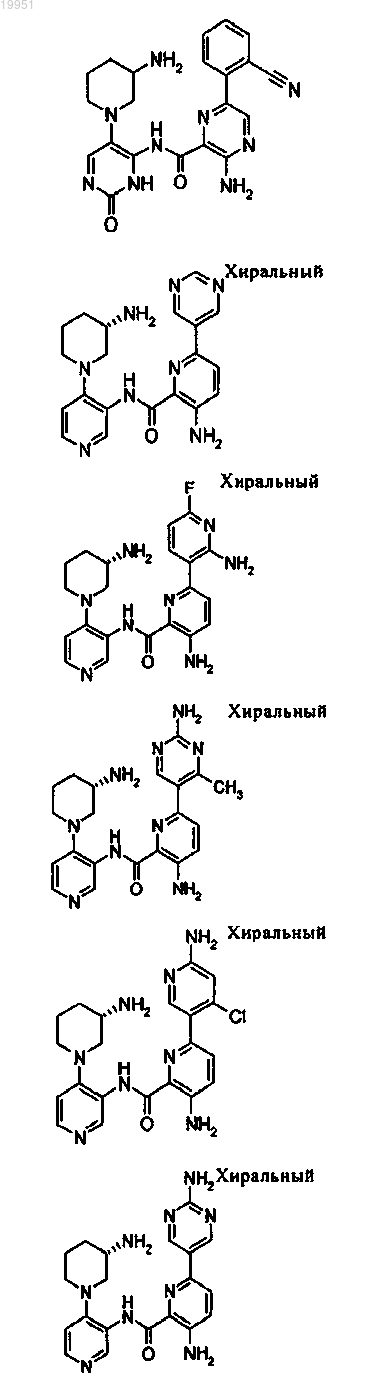
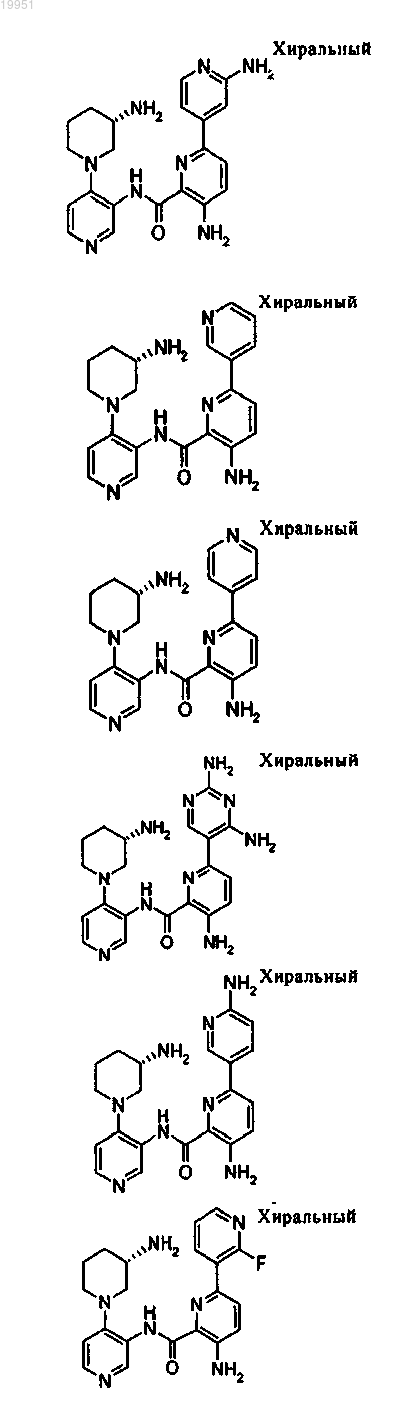
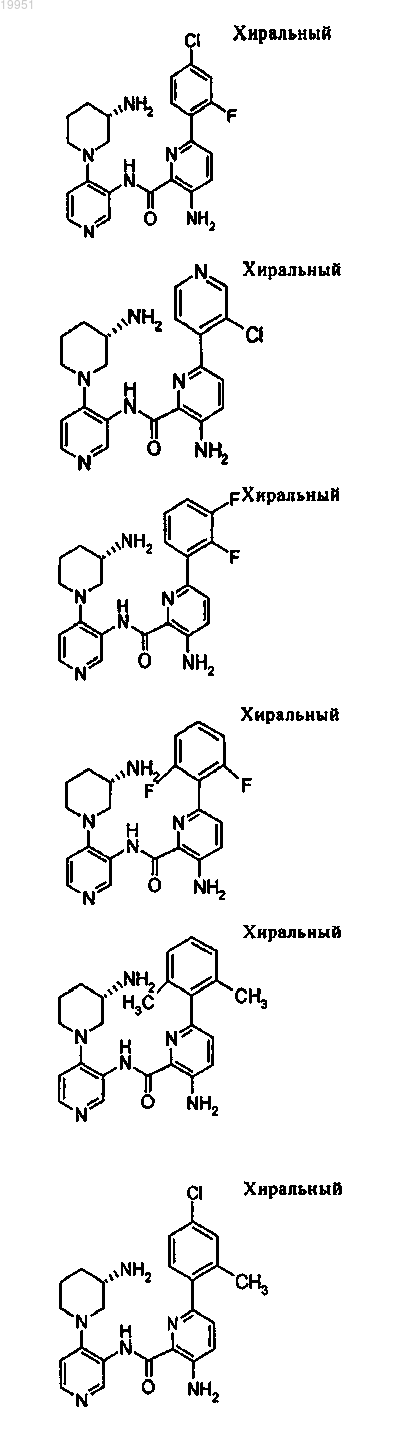
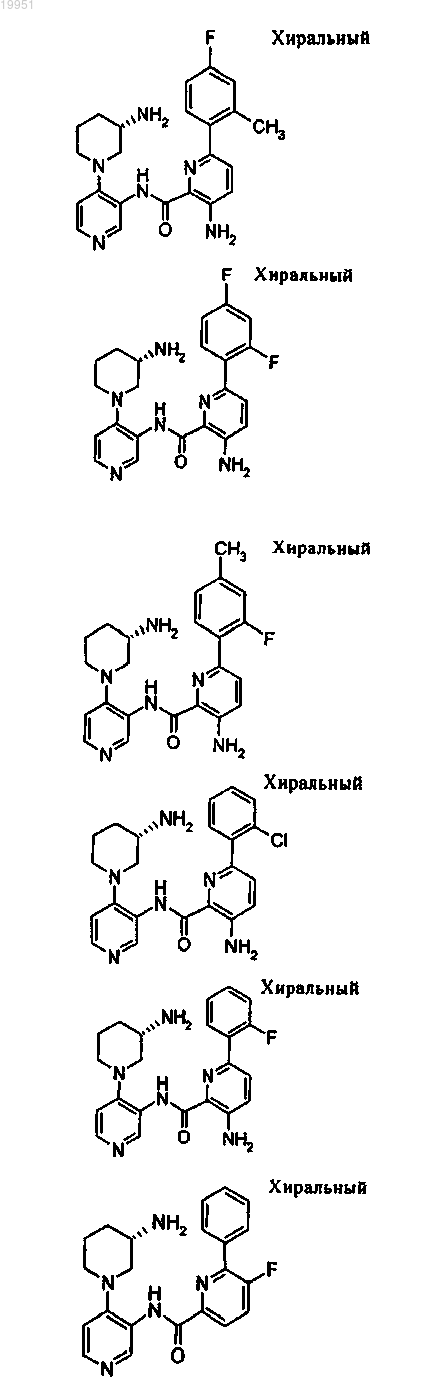

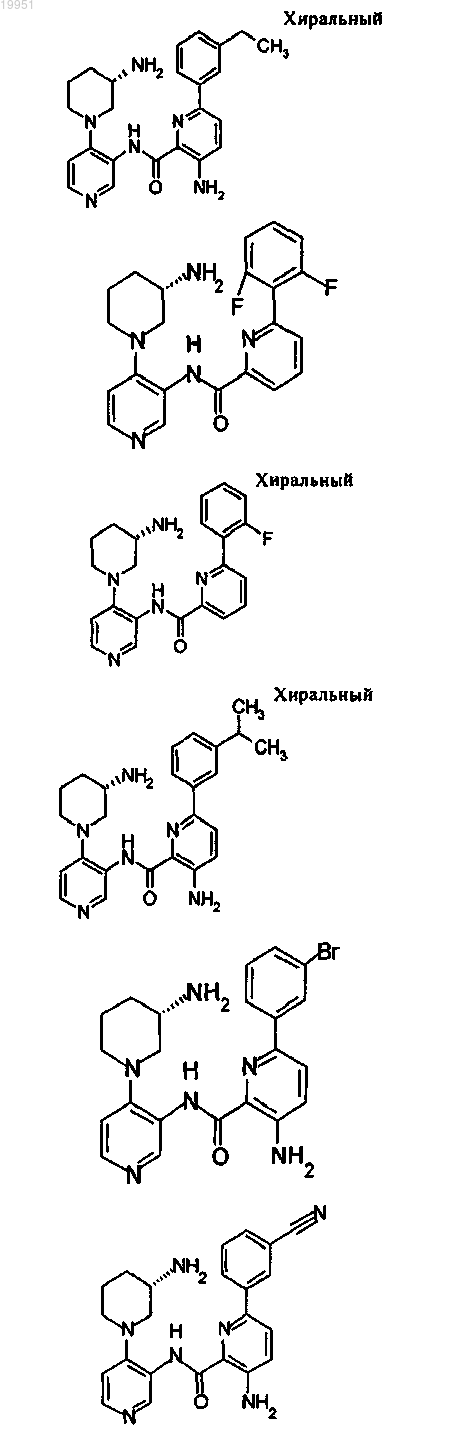
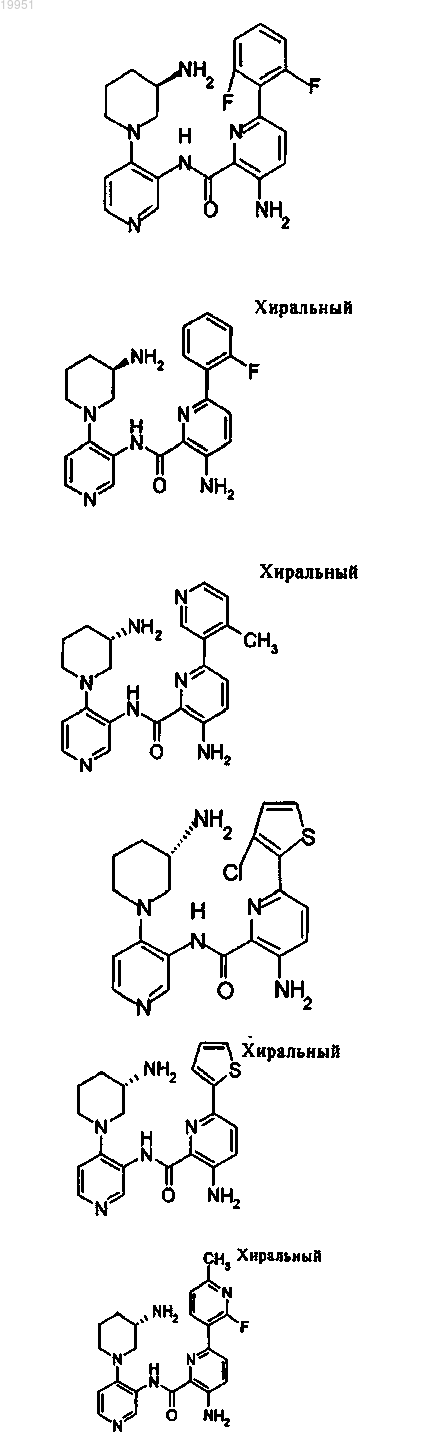
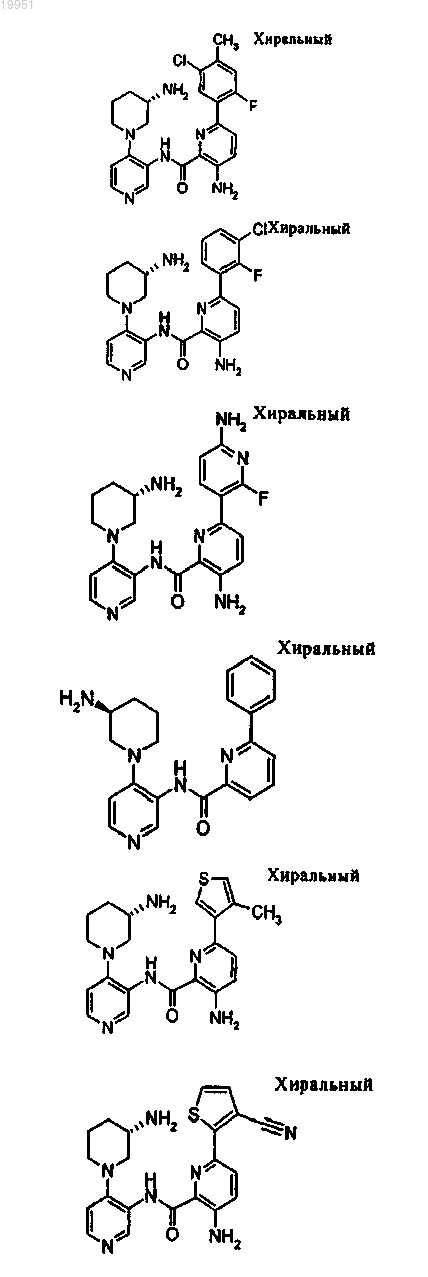
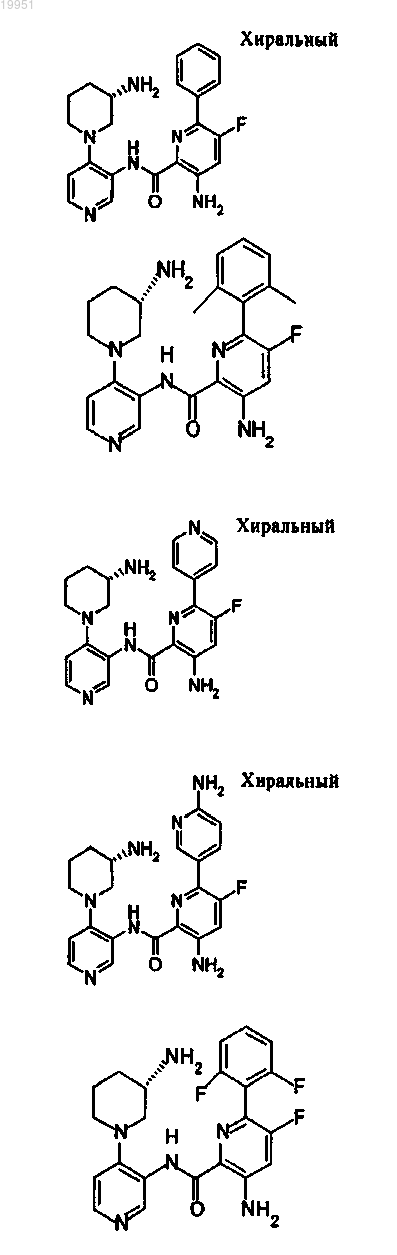

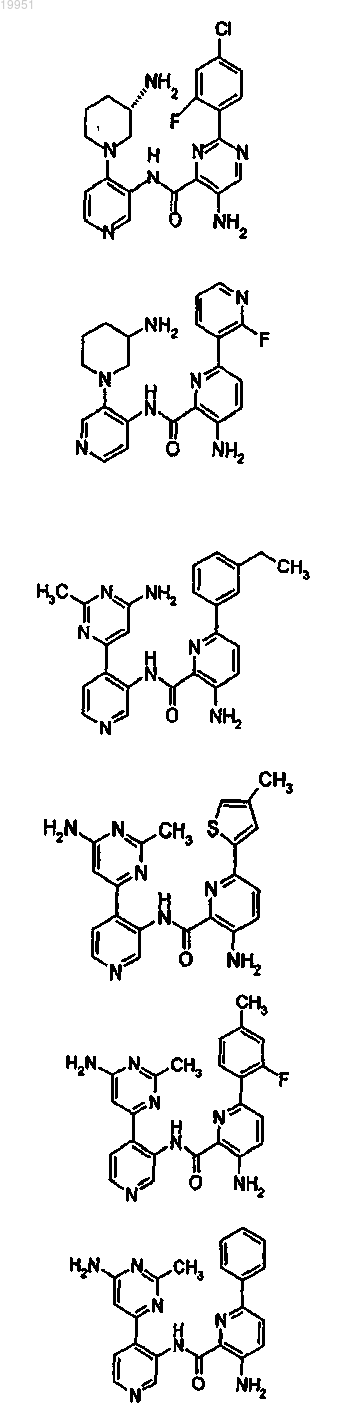
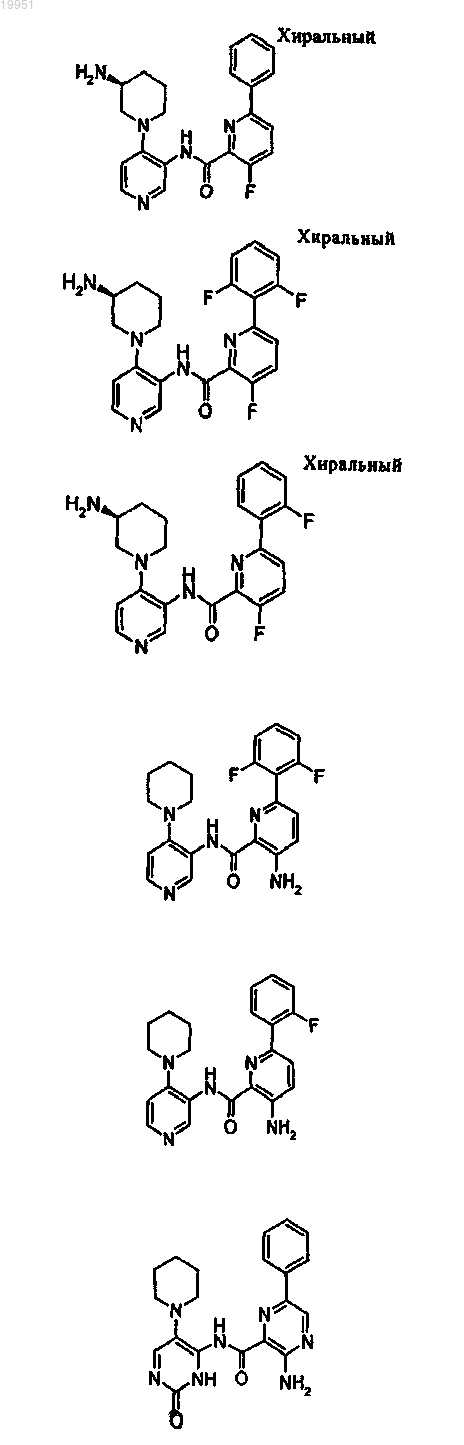
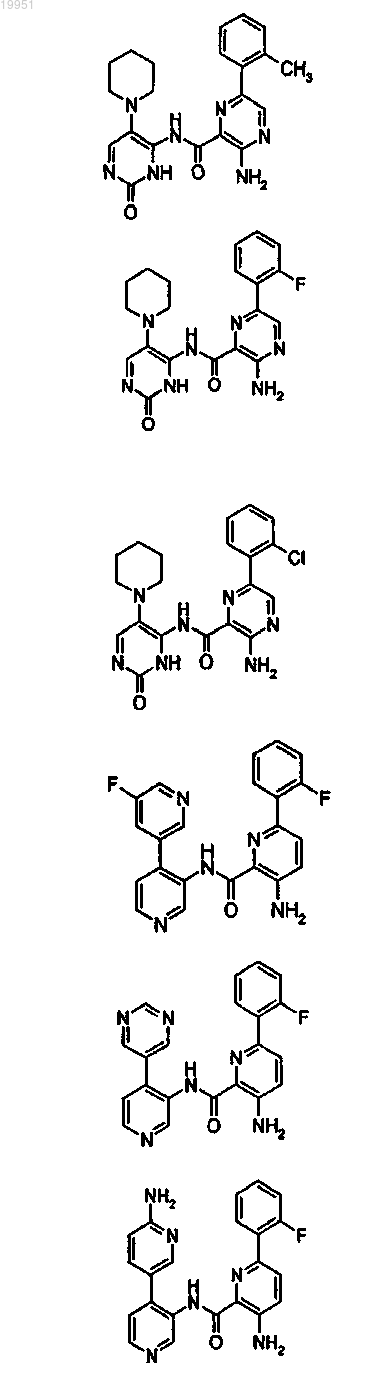
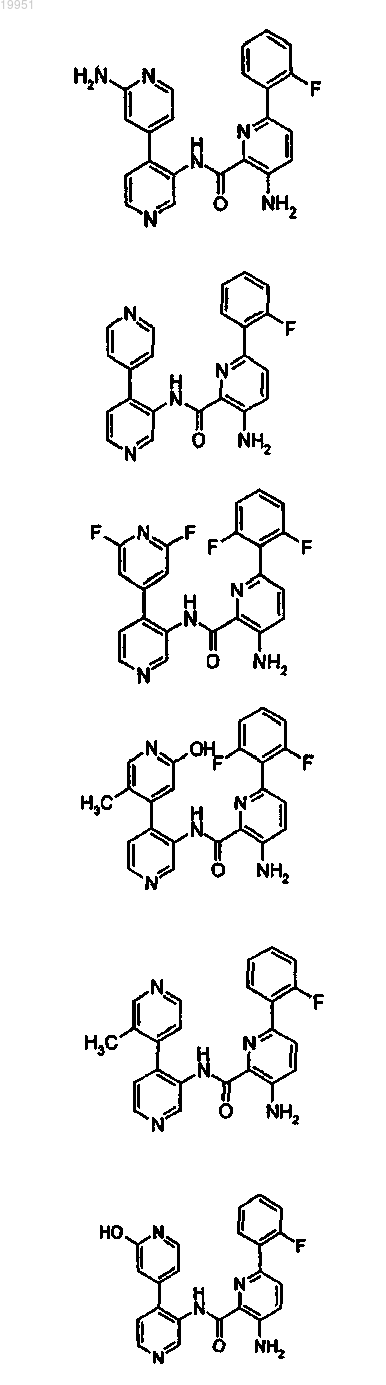
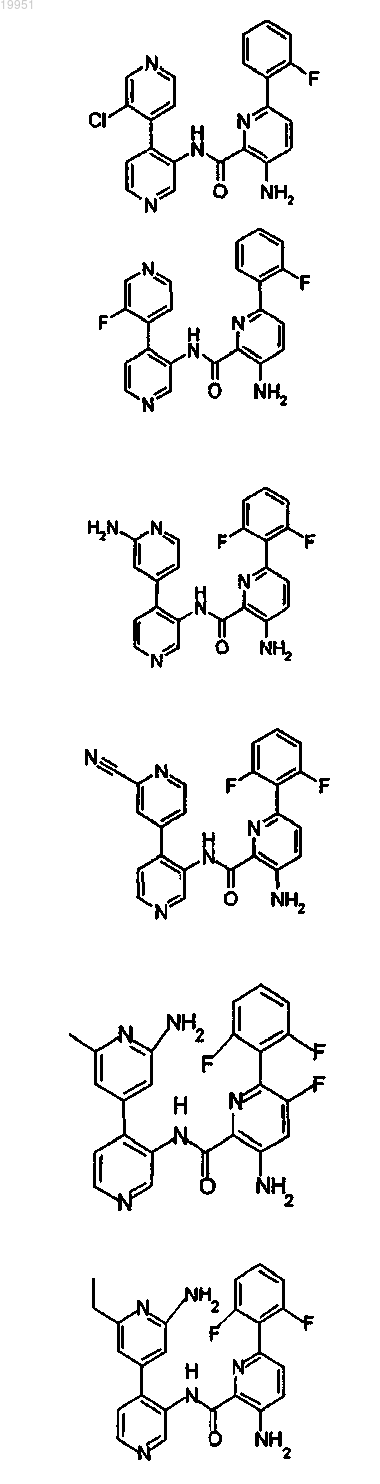
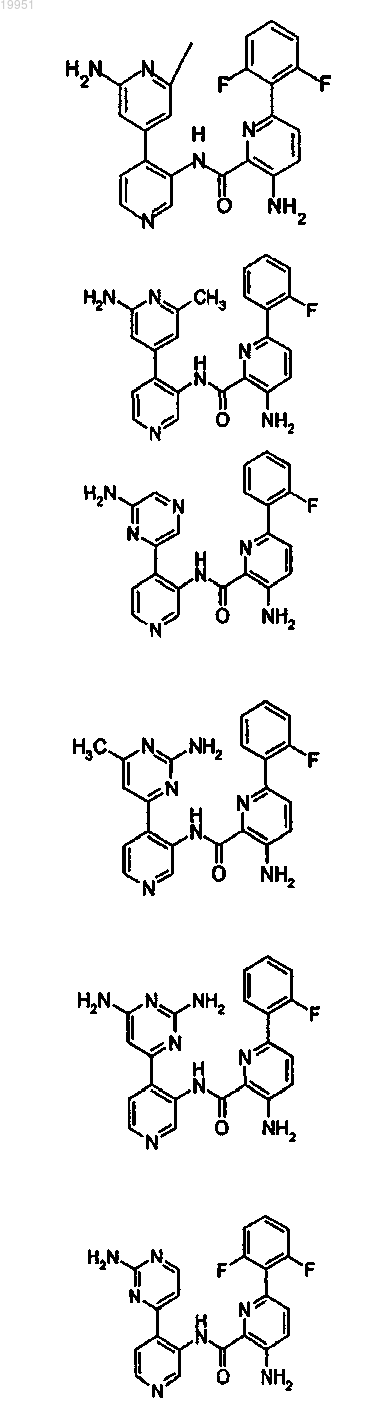
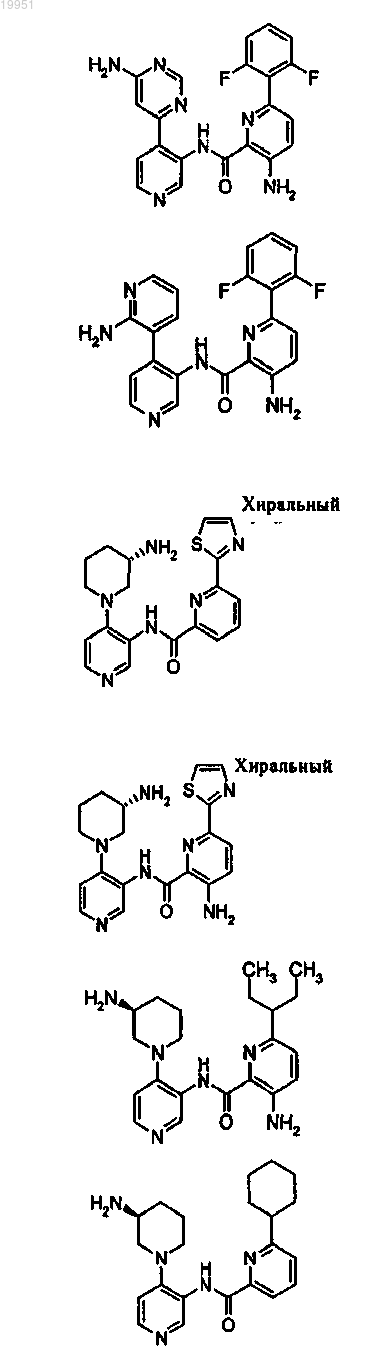
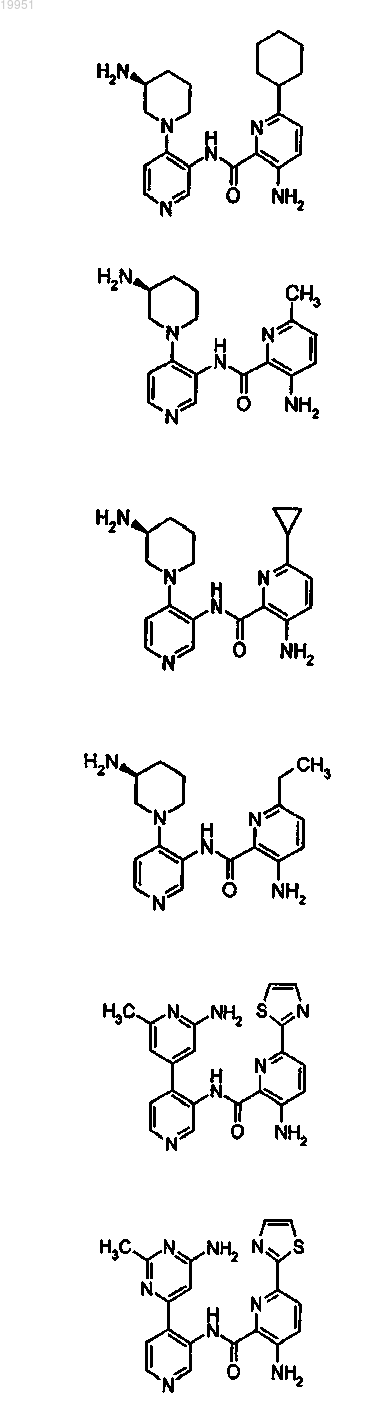
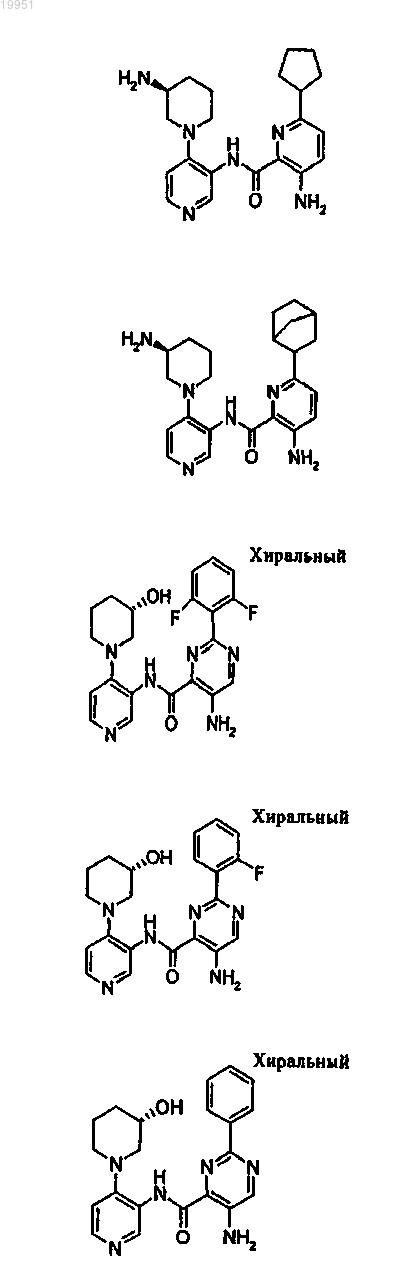

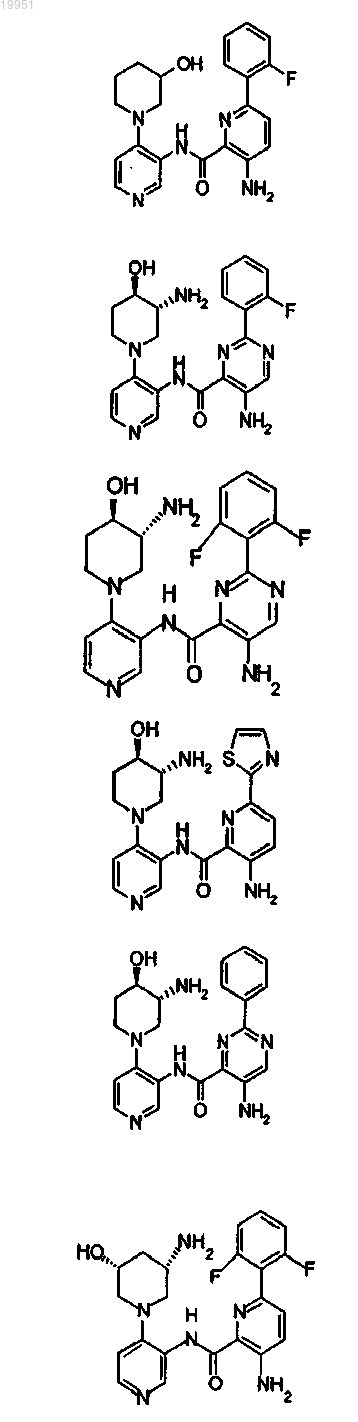
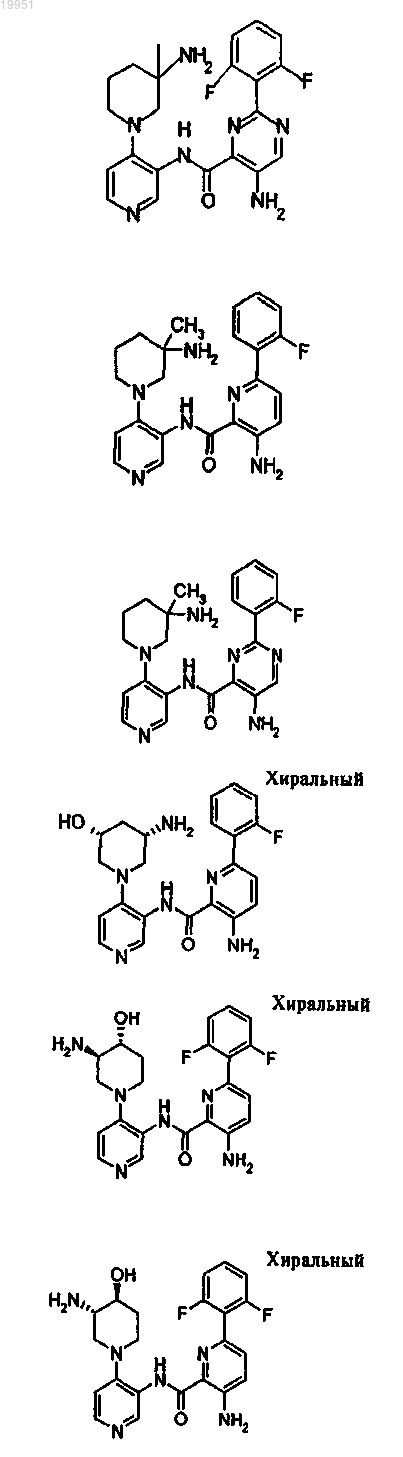
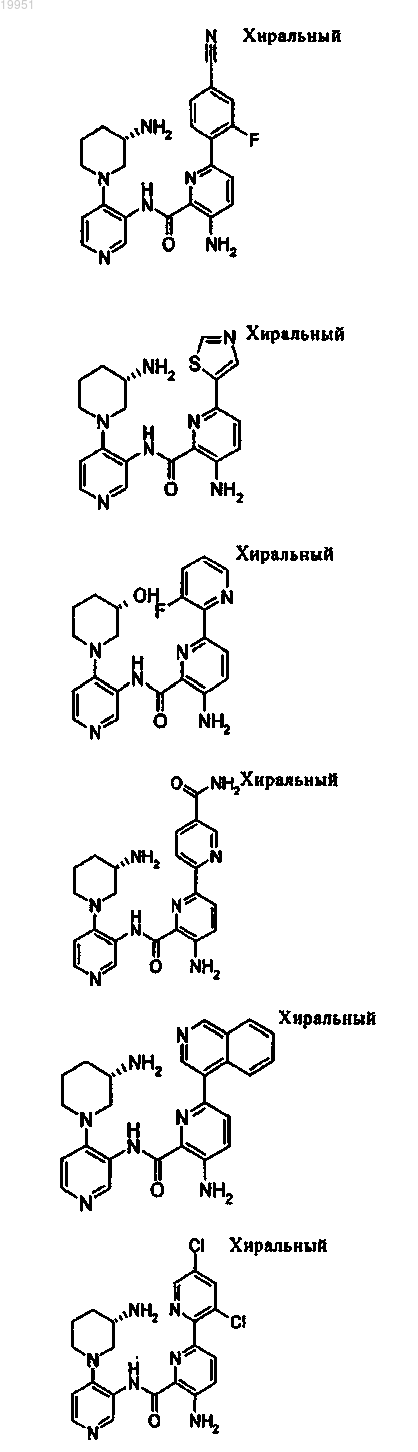
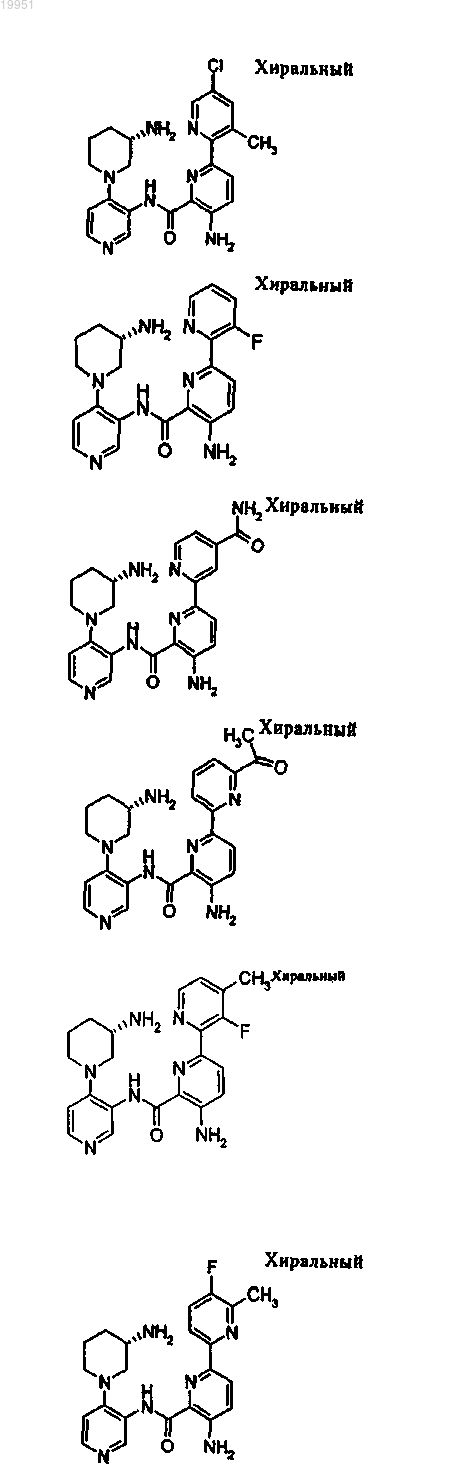
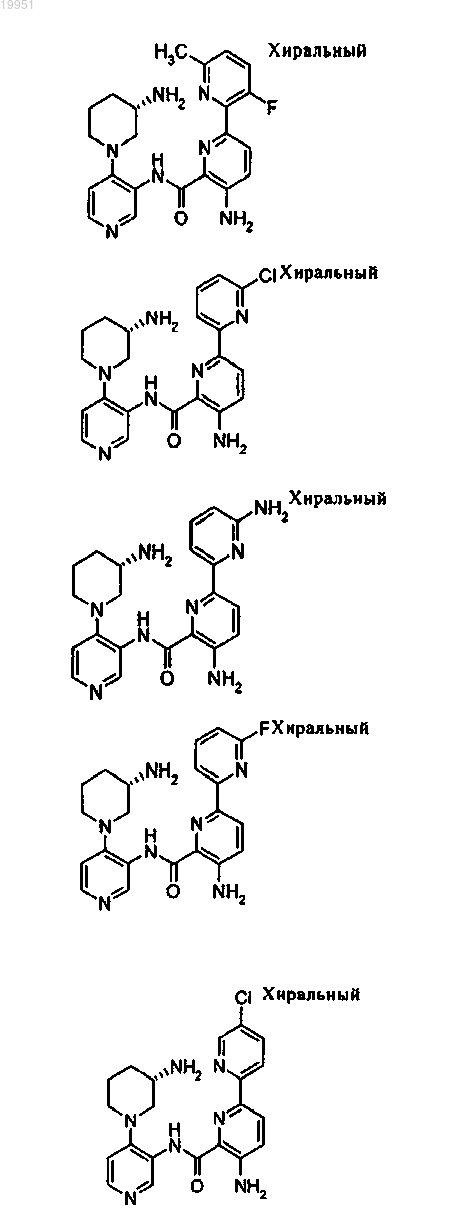
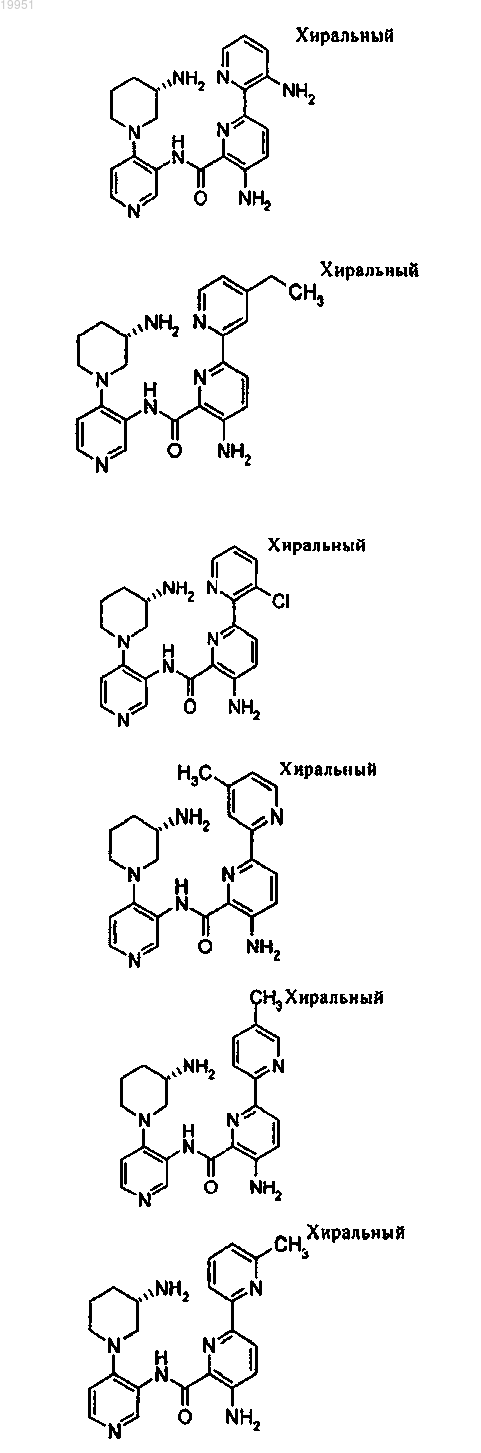
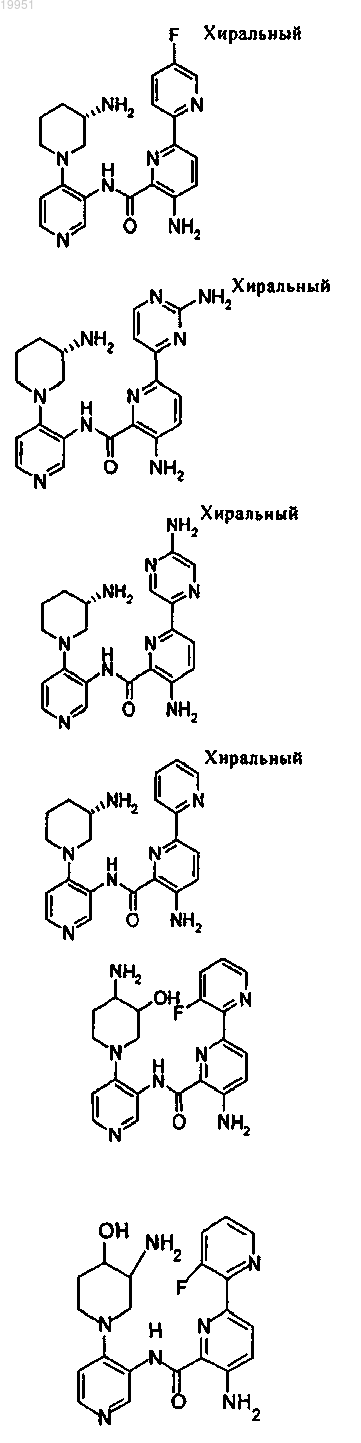
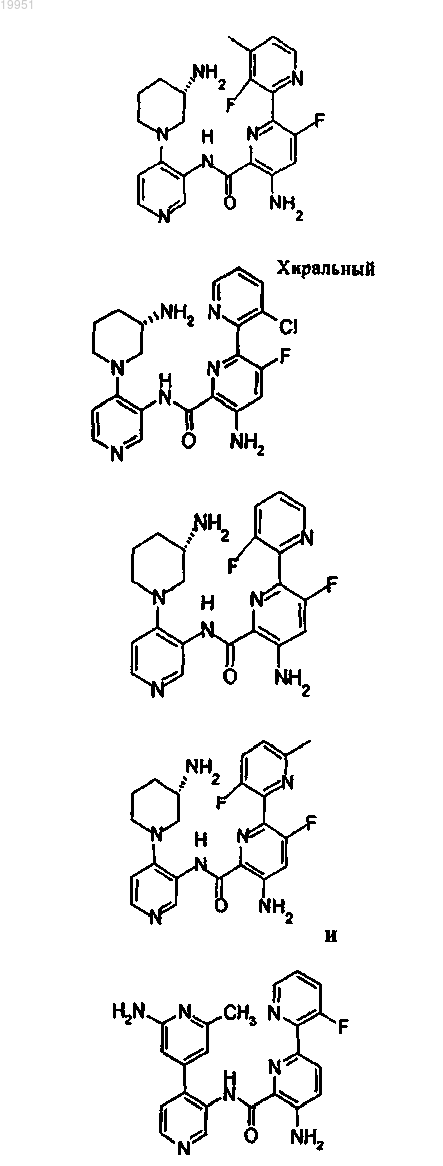
или его фармацевтически приемлемая соль.
Текст
Изобретение относится к новым соединениям формулы (I), их стереоизомерам или их фармацевтически приемлемым солям где Х 1, Х 2, Х 3 и Х 4 независимо выбраны из CR2 и N; при условии, что по меньшей мере один и не более двух из Х 1, Х 2, Х 3 и Х 4 обозначают N; Y обозначает замещенную аминогруппу или замещенный или незамещенный C3-C8-циклоалкил, гетероциклоалкил или гетероарил; Z1, Z2 и Z3 независимо выбраны из CR2 и N; при условии, что не более чем один из Z1, Z2 и Z3 может обозначатьN; R1 и R2 имеют значения, указанные в описании; фармацевтическим композициям для лечения рака, содержащим указанные соединения, способу ингибирования активности киназы, связанной с онкогенезом у человека или животного, и к применению новых соединений по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством для профилактики или лечения рака. Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, их стереоизомерам и их фармацевтически приемлемым солям, фармацевтическим композициям, содержащим новые соединения в комбинации с фармацевтически приемлемыми носителями, и к применению новых соединений по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством для профилактики или лечения рака. Уровень техники Инфицирование ретровирусом Мэлони и интеграция генома в геном клетки-хозяина приводит к развитию лимфом у мышей. Провирусная интеграция киназы Мэлони (киназа PIM) идентифицирована как один из частых протоонкогенов, способный транскрипционно активироваться этим явлением ретровирусной интеграции (Cuypers H.T. et al., "Murine leukemia virus-induced T-cell lymphomagenesis: integration of proviruses in distinct chromosomal region", Cell 37(1):141-50 (1984); Selten G. et al., "Proviral activation of the putative oncogene PIM-1 in MuLV induced T-cell lymphomas", EMBO J. 4(7):1793-8 (1985, и тем самым установлена корреляция между сверхэкспрессированием этой киназы и ее онкогенным потенциалом. Анализ гомологии последовательностей показал, что существуют 3 сильно гомологичные киназыPIM (PIM1, 2 и 3), PIM1 является протоонкогеном, впервые идентифицированным с помощью ретровирусной интеграции. Кроме того, у трансгенных мышей, сверхэкспрессирующих PIM1 или PIM2, обнаруживается повышенная частота Т-клеточных лимфом (Breuer M. et al., "Very high frequency of lymphomainduction by chemical carcinogen in pim-1 transgenic mice", Nature 340(6228):61-3 (1989, а сверхэкспрессирование в сочетании с c-myc связывают с частотой В-клеточных лимфом (Verbeek S. et al., "Mice bearing the E mu-myc и Е mu-pim-1 transgenes develop pre-B-cell leukemia prenatally", Mol Cell Biol, 11(2):11769 (1991. Таким образом, эти модели на животных приводят к сильной корреляции между сверхэкспрессированием PIM и онкогенезом при гематопоэтических злокачественных новообразованиях. В дополнение к данным для этих моделей на животных сверхэкспрессирование PIM обнаружено для многих других новообразований человека. Сверхэкспрессирование PIM1, 2 и 3 часто наблюдается для многих гематопоэтических злокачественных новообразований (Amson R. et al., "The human protooncogene productB-cell chronic lymphocytic leukaemia prognostic subgroups defined by ZAP-70 и CD38 expression status",Leukemia 20:1774-1782 (2006 и при раке предстательной железы (Dhanasekaran SM, et al., "Delineation ofPIM-1 during progression of prostatic adenocarcinoma", J. Clin Pathol 59(3):285-8 (2006, а сверхэкспрессирование PIM3 часто наблюдается при гепатоцеллюлярной карциноме (Fujii С, et al., "Aberrant expressionof serine/threonine kinase PIM-3 in hepatocellular carcinoma development и its role in the proliferation of human hepatoma cell lines", Int J. Cancer 114:209-218 (2005 и раке поджелудочной железы (Li Y.Y. et al.,"PIM-3, proto-oncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer и phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancer cell lines", Cancer Res 66(13):6741-7 (2006.PIM1, 2 и 3 являются серин/треонинкиназами, нормально функционирующими при жизнедеятельности и пролиферации гематопоэтических клеток в ответ на факторы роста и цитокины. Сигналы цитокинов по пути Jak/Stat приводят к активации транскрипции генов PIM и синтезу белков. Для обеспечения активности киназы PIM не требуются дополнительные посттрансляционные модификации. Таким образом, передача сигналов в прямом направлении в первую очередь контролируется на уровне транскрипции/трансляции и метаболизма белков. Субстраты киназ PIM включают регуляторы апоптоза, такие какnecessary for mitosis", Chromosoma 111(2):80-95 (2002 и регулятор синтеза белка 4 ЕВР 1 (HammermanP.S. et al., "PIM and Akt oncogenes are independent regulators of hematopoietic cell growth and survival",Blood 105(11):4477-83 (2005. Влияние киназ PIM на эти регуляторы согласуется с ролью в защите от апоптоза и стимулировании пролиферации и роста клеток. Поэтому предполагается, что сверхэкспрессирование киназ PIM при раке играет роль при стимулировании выживаемости и пролиферации раковых клеток и поэтому их ингибирование должно представлять собой эффективный путь лечения раковых заболеваний, при которых они сверхэкспрессируются. В действительности, в нескольких публикациях отмечают, что нарушение экспрессирования киназ PIM с помощью siPHK приводит к ингибированию пролиферации и гибели клеток (Dai J.M. et al., "Antisense oligodeoxynucleotides targeting the serine/threonine kinase PIM-2 inhibited proliferation of DU-145 cells", Acta Pharmacol Sin 26(3):364-8 (2005);Fujii et al. 2005; Li et al. 2006). Кроме того, полагают, что мутационная активация некоторых хорошо известных онкогенов при гематопоэтических злокачественных новообразованиях, по меньшей мере, частично оказывает свои воздействия посредством киназ PIM. Например, направленная понижающая регуляция экспрессирования PIM нарушает жизнедеятельность гематопоэтических клеток, трансформированных с помощью Flt3 и BCR/ABL (Adam et al. 2006). Таким образом, ингибиторы PIM1, 2 и 3 должны быть применимы для лечения этих злокачественных новообразований. В дополнение к потенциальной применимости для лечения рака и миелопролиферативных заболеваний, такой ингибитор должен быть полезен для регулирования распространения иммунных клеток при других патологических состояниях,таких как аутоиммунные заболевания, аллергические реакции и синдромы при отторжении трансплантатов органов. В пользу такого заключения свидетельствуют данные о том, что дифференциация Th1 хелперных Т-клеток с помощью IL-12 и IFN- приводит к индукции экспрессирования обеих PIM1 и 2 (Ahotype 1, but not T helper type 2, cell differentiation", Immunology 116:82-88 (2005. Кроме того, экспрессирование киназ PIM подавляется в обоих типах клеток иммуносупрессорными TGF-P (Aho et al. 2005). Эти результаты показывают, что киназы PIM участвуют в раннем процессе дифференциации хелперных Тклеток, что координирует иммунные ответы при аутоиммунных заболеваниях, аллергических реакциях и отторжении трансплантатов органов. Показано, что в дополнение к киназе PIM непосредственно участвуют в раке и некоторые другие киназы, такие как Flt3, KDR и PKC. Например, несколько типов активирующих мутаций в Flt3 обнаружены у 20-30% пациентов, страдающих острым миелолейкозом (ОМЛ). Предполагается, что эти активирующие мутации представляют собой наиболее характерные явления для этих пациентов и в настоящее время разные ингибиторы Flt3 испытывают для лечения этих пациентов в клинических исследованияхleukaemia", Expert Opin Emerg Drugs 11:153-165 (2006. KDR является одним из рецепторов VEGF, который играет критически важную роль при ангиогенезе опухолей и является мишенью для клинически проверенного лекарственного средства бевацизумаб (последний обзор см. в публикации Ranieri G. et al.,"Vascular endothelial growth factor (VEGF) as target of bevacizumab in cancer: from the biology to the clinic",Curr Med Chem 13:1845-1857 (2006. Кроме того, показано, что сверхэкспрессирование PKC в клеткахNIH3T3 приводит к трансформации клетки in vitro и стимулирует образование опухоли in vivo (Perletti etal. Oncogene 12:847 (1996); Mischak et al., J. Biol Chem 268:6090 (1993. Кроме того, у голых мышей сверхэкспрессирование PKC в линии клеток LNCaP приводит к их трансформации в адроген-зависимые растущие опухоли (Wu et al., Cancer Research 62:2423 (2002. Кроме того, сверхэкспрессированиеPKC в эпителии трансгенных мышей ускоряет развитие высокозлокачественной и быстро метастазирующей плоскоклеточной карциномы (Jansen et al., Cancer Research 61:808 (2001. Кроме того, в клинических условиях установлено, что сильное экспрессирование PKC в опухолях человека связано с низкой выживаемостью в период ремиссии и низкой общей выживаемостью (Pan et al., Cancer Research 65:8366(2005. Таким образом, описанные соединения должны быть применимы для лечения рака путем ингибирования этих надежно установленных мишеней противораковых лекарственных средств. Сохраняется необходимость в соединения, которые подавляют пролиферацию капилляров, подавляют рост опухолей, лечат рак, модулируют остановку клеточного цикла и/или ингибируют такие молекулы, как PIM1, PIM2, PIM3, Flt3, KDR и PKC, и фармацевтические препараты и лекарственные средства, которые содержат такие соединения. Также необходимы способы введения таких соединений, фармацевтических препаратов и лекарственных средств нуждающимся в них пациентам или субъектам. Краткое изложение сущности изобретения Это краткое изложение предназначено для вводного описания понятий в упрощенной форме, которые будут описаны ниже в подробном описании. Это краткое изложение не предназначено для описания главных особенностей заявленного объекта изобретения и не предназначено для использования в качестве средства оценки объема заявленного объекта изобретения. Настоящее изобретение относится к новым соединениям формулы (I), их стереоизомерам и их фармацевтически приемлемым солям, содержащим улучшающие растворимость фрагменты: в которой Х 1, Х 2, Х 3 и Х 4 независимо выбраны из CR2 и N; при условии, что по меньшей мере один и не более двух из Х 1, Х 2, Х 3 и Х 4 обозначают N;Y обозначает замещенную аминогруппу или замещенный или незамещенный C3-C8-циклоалкил, гетероциклоалкил или гетероарил;Z1, Z2 и Z3 независимо выбраны из CR2 и N; при условии, что не более чем один из Z1, Z2 и Z3 можетR1 выбран из группы, включающей водород, галоген и -NH2; каждый R2 независимо выбран из группы, включающей водород, галоген, гидроксигруппу, цианогруппу и замещенный или незамещенный C1-C12-алкил, C1-C12-алкоксигруппу, аминогруппу, аминокарбонил, C6-C10-арил, гетероарил, C3-C8-циклоалкил, гетероциклоалкил, частично насыщенный C3-C8 циклоалкил и C3-C8-циклоалкилоксигруппу; термин "замещенный" относится к группе, в которой атом водорода замещен одним или более одновалентным или двухвалентными радикалами, где эти радикалы выбраны из гидроксигруппы, галогена,аминогруппы, цианогруппы, оксогруппы, карбоксигруппы, C1-C6-алкила, который является незамещенным или замещенным галогеном, гидроксигруппой, аминогруппой, нитрогруппой и/или цианогруппой;C1-C12-алкилкарбонила и аминокарбонила; термин "гетероциклоалкил" относится к циклической группе, содержащей 3-8 атомов, из которых 14 в кольце являются гетероатомами, выбранными из N, О и S; термин "гетероарил" относится к 5-10-членной ароматической группе, содержащей в качестве кольцевых атомов 1-4 гетероатома, выбранных из N, О и S; термин "замещенный аминокарбонил" относится к группе -C(=O)-NRR', где R обозначает C1-C6 алкил и R' обозначает Н или C1-C6-алкил. Другие варианты осуществления относятся к новым соединениям формулы (II) в которой Y обозначает замещенную аминогруппу или замещенный или незамещенный C3-C8 циклоалкил, гетероциклоалкил или гетероарил; значения Z3, R1 и R2 указаны выше. Другой вариант осуществления настоящего изобретения относится к новым соединениям формулы(I), где X1 обозначает N и Х 2, Х 3 и Х 4 обозначают CR2. Еще один вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где Х 2 обозначает N и X1, X3 и Х 4 обозначают CR2. Следующий предпочтительный вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где Х 3 обозначает N и X1, X2 и Х 4 обозначают CR2. Еще один вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где Х 4 обозначает N и Х 1, Х 2 и Х 3 обозначают CR2. Другой вариант осуществления настоящего изобретения относится к новым соединениям формулы(I), где Y обозначает замещенный или незамещенный пиперидинил или пиперазинил. Следующий вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где Z1, Z2 и Z3 обозначают CR2. Еще один вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где Z1 обозначает N и Z2 и Z3 обозначают CR2. Следующий вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где Z2 обозначает N и Z1 и Z3 обозначают CR2. Кроме того, одним из вариантов осуществления настоящего изобретения являются новые соединения формулы (I), где Z3 обозначает N и Z1 и Z2 обозначают CR2. Предпочтительно в соединениях формулы (I) R1 обозначает водород. Еще один вариант осуществления настоящего изобретения относится к новым соединениям формулы (I), где каждый R2 независимо выбран из группы, включающей водород, галоген, гидроксигруппу,аминогруппу, цианогруппу, замещенный или незамещенный C1-C12-алкил и фенил. Другим объектом настоящего изобретения является фармацевтическая композиция, включающая соединение формулы (I) или его стереоизомер или фармацевтически приемлемую соль в терапевтически эффективном количестве в комбинации с фармацевтически приемлемым носителем, предназначенная для лечения рака. Другим вариантом осуществления настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы (I) или его стереоизомер или фармацевтически приемлемую соль и фармацевтически приемлемый носитель, дополнительно включающая по меньшей мере одно дополнительное средство для лечения рака. Другим объектом настоящего изобретения является способ ингибирования активности провирусной интеграции киназы Мэлони (киназа PIM) в клетке, включающий взаимодействие клетки с соединением формулы (I) в эффективном количестве. Следующим объектом настоящего изобретения является способ лечения патологического состояния путем модуляции активности киназы PIM, включающий введение пациенту, нуждающемуся в таком лечении, соединения формулы (I) в эффективном количестве. Еще одним объектом является способ ингибирования активности провирусной интеграции киназы Мэлони (киназа PIM) у пациента, включающий введение пациенту фармацевтической композиции, содержащей соединение формулы (I). Следующим объектом настоящего изобретения является способ лечения рака у пациента, включающий введение пациенту фармацевтической композиции, содержащей соединение формулы (I). Настоящее изобретение относится также к применению соединения формулы (I) в качестве терапевтического средства, предназначенного для лечения рака. Кроме того, настоящее изобретение относится к применению соединения формулы (I) для приготовления лекарственного средства, предназначенного для лечения рака. Настоящее изобретение также относится к соединению, выбранному из группы, включающей соединение примеров 119-123, 128, 130-132, 134-139, 143-145, 149-151, 154-158, 160-162, 331-333, 338-340,342, 343, 345, 345, 350-359, 361, 363, 364, 368, 369, 371, 400-403, 407-412, 414, 415, 417-420, 422, 424, 425,426, 429-434, 442, 444, 445, 448-452, 454-456, 459, 461-463, 472, 474-476, 478, 479, 484, 487, 489, 490, 499,509, 513, 514, 516-518, 522, 524, 543, 546, 547, 552, 555, 556, 558, 559, 568, 570, 571, 583, 588-592, 595,601, 602, 604-607, 612-620, 623-632, 634-639, 641, 643, 644, 646, 648-650, 653-655, 658-663, 669, 670, 672674, 676, 678-680, 686, 688, 690-692, 700-702, 704, 706-713, 716, 717, 719, 724-730, 734, 735, 737, 743, 744,745 и 746, представленных далее в описании. Соединения, предлагаемые в настоящем изобретении, применимы для лечения раковых заболеваний, включая гематопоэтические злокачественные новообразования, карциномы (например, легких, печени, поджелудочной железы, яичников, щитовидной железы, мочевого пузыря или ободочной кишки),меланому, миелоидные нарушения (например, миелолейкоз, множественную миелому и эритролейкоз),аденомы (например, ворсинчатую аденому ободочной кишки), саркомы (например, остеосаркому), аутоиммунные заболевания, аллергические реакции и синдромы при отторжении трансплантатов органов. Подробное описание изобретения Как указано выше, одним из вариантов осуществления настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы (I) и по меньшей мере одно дополнительное средство для лечения рака. Целый ряд подходящих противораковых средств, применяющихся в виде комбинации с терапевтическими средствами, применим для использования в композициях, предлагаемых в настоящем изобретении, такими как средства, которые индуцируют апоптоз; полинуклеотиды (например, рибозимы); полипептиды (например, ферменты); лекарственные средства; биологические миметики; алкалоиды; алкилирующие средства; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные антитела, конъюгированные с противораковыми лекарственными средствами, токсинами и/или радионуклидами; модификаторы биологического ответа (например, интерфероны [например,IFN- и т.п.], интерлейкины [например, IL-2, и т.п.] и т.п.); адаптивные иммунотерапевтические средства; гематопоэтические факторы роста; средства, которые индуцируют дифференциацию опухолевых клеток (например, полностью-транс-ретиноевая кислота и т.п.); реагенты генной терапии; реагенты антисмысловой терапии и нуклеотиды; противоопухолевые вакцины; ингибиторы ангиогенеза и т.п. Многочисленные другие примеры химиотерапевтических соединений и противораковых средств, пригодных для комбинации с раскрытыми соединениями формулы (I) или (II), известны специалистам в данной области техники. В предпочтительных вариантах осуществления противораковые средства для применения в комбинации с соединениями, предлагаемыми в настоящем изобретении, включают средства, которые индуцируют или стимулируют апоптоз. Средства, которые индуцируют апоптоз, включают, но не ограничиваются только ими, лучевую терапию (например, W); ингибиторы киназы (например, ингибитор киназы рецептора эпидермального фактора роста [EGFR], ингибитор киназы рецептора сосудистого эндотелиального фактора роста [VEGFR], ингибитор киназы рецептора фибробластного фактора роста [FGFR],ингибитор киназы рецептора тромбоцитарного фактора роста [PDGFR] I и ингибиторы киназы Bcr-Ab1,такие как STI-571, глеевек и гливек]); антисмысловые молекулы; антитела [например, герцептин и ритуксан]; антиэстрогены [например, ралоксифен и тамоксифен]; антиадрогены [например, флутамид, бикалутамид, финастерид, аминоглютетамид, кетоконазол и кортикостероиды]; ингибиторы циклооксигеназы 2 (СОХ-2) [например, целекоксиб, мелоксикам, NS-398 и нестероидные противовоспалительные лекарственные средства (NSAIDs)]; лекарственные средства для химиотерапии рака [например, иринотекан (камптосар), СРТ-11, флударабин (флудара), дакарбазин (DTIC), дексаметазон, митоксантрон, милотарг, VP-16, цисплатин, 5-фторурацил, доксрубицин, таксотер или таксол]; клеточные сигнальные молекулы; керамиды и цитиокины; и стауроспорин и т.п. Соединения, предлагаемые в настоящем изобретении, применимы для лечения раковых заболеваний, включая гематопоэтические злокачественные новообразования, карциномы (например, легких, печени, поджелудочной железы, яичников, щитовидной железы, мочевого пузыря или ободочной кишки),-4 019951 меланому, миелоидные нарушения (например, миелолейкоз, множественную миелому и эритролейкоз),аденомы (например, ворсинчатую аденому ободочной кишки), саркомы (например, остеосаркому), аутоиммунные заболевания, аллергические реакции и синдромы при отторжении трансплантатов органов."Ингибитор PIM" используется в настоящем изобретении для обозначения соединения, которое обладает значением IC50 для активности киназы PIM, равным не более примерно 100 мкМ, и чаще - не более примерно 50 мкМ, полученным при исследованиях расходования при воздействии PIM, описанных ниже в настоящем изобретении. Термин "алкил" означает алкильные группы, которые не содержат гетероатомы. Этот термин включает алкильные группы с линейной цепью, такие как метил, этил, пропил, бутил, пентил, гексил, гептил,октил, нонил, децил, ундецил, додецил и т.п. Термин также включает обладающие разветвленной цепью изомеры линейных алкильных групп, включая, но не ограничиваясь только ими, следующие, приведенные в качестве примеров: -CH(CH3)2, -СН(CH3)(СН 2 СН 3), -CH(СН 2 СН 3)2, -С(СН 3)3, -С(СН 2 СН 3)3,-СН 2 СН(СН 3)2,-СН 2 СН(CH3)(СН 2 СН 3),-СН 2 СН(СН 2 СН 3)2,-СН 2 С(СН 3)3,-СН 2 С(СН 2 СН 3)3,-СН(CH3)СН(СН 3)(СН 2 СН 3), -СН 2 СН 2 СН(СН 3)2, -СН 2 СН 2 СН(CH3)(СН 2 СН 3), -СН 2 СН 2 СН(СН 2 СН 3)2,-СН 2 СН 2 С(СН 3)3,-СН 2 СН 2 С(СН 2 СН 3)3,-СН(СН 3)СН 2 СН(СН 3)2,-CH(CH3)СН(СН 3)СН(СН 3)2,-СН(CH2CH3)СН(CH3)СН(CH3)(CH2CH3) и др. Термин также включает циклические алкильные группы,такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, и такие кольца, замещенные обладающими линейной и разветвленной цепью алкильными группами, определенными выше. Таким образом, выражение "алкильные группы" включает первичные алкильные группы,вторичные алкильные группы и третичные алкильные группы. Предпочтительные алкильные группы включают обладающие линейной и разветвленной цепью алкильные группы, содержащие от 1 до 12 атомов углерода. При использовании в настоящем изобретении "низший алкил" включает замещенные или незамещенные обладающие линейной или разветвленной цепью алкильные группы, содержащие от 1 до 6 атомов углерода. Типичные низшие алкильные группы включают, например, метил, этил, пропил, изопропил, н-бутил, трет-бутил, неопентил, трифторметил, пентафторэтил и т.п. Низшие алкильные группы могут содержать заместители, такие как галоген, гидроксигруппу, аминогруппу, нитро- и/или цианогруппы и т.п. Типичные галогензамещенные и гидроксизамещенные низшие алкилы включают хлорметил, трихлорметил, хлорэтил, гидроксиэтил и т.п. Другие подходящие замещенные низшие алкильные фрагменты включают, например, арилалкил, аминоалкил, аминоарилалкил, карбониламиноалкил, алкилкарбониламиноалкил, арилкарбониламиноалкил, арилалкилкарбониламиноалкил, аминоалкоксиалкил и ариламиноалкил."Низшая алкоксигруппа" при использовании в настоящем изобретении означает RO-, в которой R обозначает низший алкил. Типичные примеры низших алкоксигрупп включают метоксигруппу, этоксигруппу, трет-бутоксигруппу, трифторметоксигруппу и т.п. При использовании в настоящем изобретении термин "галоген" означает хлоридную, бромидную,фторидную и йодидную группы. "Галогеналкил" означает алкильный радикал, замещенный одним или большим количеством атомов галогенов. Термин "галоген низший алкил" означает низший алкильный радикал, замещенный одним или большим количеством атомов галогенов. Термин "галогеналкоксигруппа" означает алкоксильный радикал, замещенный одним или большим количеством атомов галогенов. Термин "галоген низшая алкоксигруппа" означает низший алкоксильный радикал, замещенный одним или большим количеством атомов галогенов."Аминогруппа" в настоящем изобретении означает группу -NH2. Термин "алкиламиногруппа" в настоящем изобретении означает группу -NRR', в которой R и R' все независимо выбраны из группы,включающей водород и низший алкил. Термин "ариламиногруппа" в настоящем изобретении означает группу -NRR', в которой R обозначает арил и R' обозначает водород, низший алкил или арил. Термин"арилалкиламиногруппа" в настоящем изобретении означает группу -NRR', в которой R обозначает арилнизший алкил и R' обозначает водород, низший алкил, арил или арил-низший алкил. Термин "алкоксиалкил" означает группу -alk1-O-alk2, в которой alk1 означает алкил или алкенил иalk2 означает алкил или алкенил. Термин "низший алкоксиалкил" означает алкоксиалкил, в котором alk1 означает низший алкил или низший алкенил, и alk2 означает низший алкил или низший алкенил. Термин-алкиленил-О-арилалкил, в которой арилалкил означает арил-низший алкил. Термин "аминокарбонил" в настоящем изобретении означает группу -С(О)-NH2. "Замещенный аминокарбонил" в настоящем изобретении означает группу -C(O)-NRR', когда R обозначает низший алкил иR' обозначает водород или низший алкил. В некоторых вариантах осуществления R и R1 вместе с присоединенным к ним атомом N могут вместе образовать "гетероциклоалкилкарбонильную" группу. Термин "ариламинокарбонил" в настоящем изобретении означает группу -C(O)-NRR', где R обозначает арил и R1 обозначает водород, низший алкил или арил; "арилалкиламинокарбонил" в настоящем изобретении означает группу -C(O)-NRR', где R обозначает арил-низший алкил и R1 обозначает водород, низший алкил, арил или арил-низший алкил."Карбонил" означает двухвалентную группу -С(О)-. "Карбоксигруппа" означает -С(=О)-ОН. "Ал-5 019951 коксикарбонил" означает сложный эфир -C(=O)-OR, в котором R обозначает алкил. "Низший алкоксикарбонил" означает сложный эфир -C(=O)-OR, в котором R обозначает низший алкил. "Циклоалкилоксикарбонил" означает -C(=O)-OR, в котором R обозначает циклоалкил. "Арилоксикарбонил" означает C(=O)-OR, в котором R обозначает арил. "Гетероциклилоксикарбонил" означает -C(=O)-OR, в котором R обозначает гетероциклил. Термин "арилалкоксикарбонил" в настоящем изобретении означает группу -С(О)-О-арилалкил, в которой арилалкил представляет собой арил-низший алкил."Циклоалкил" означает моно- или полициклический, гетероциклический или карбоциклический алкильный заместитель. Типичные циклоалкильные заместители содержат от 3 до 8 входящих в главную цепь (т.е. в кольцо) атомов, в которых каждый атом главной цепи является атомом углерода или гетероатомом. Термин "гетероциклоалкил" в настоящем изобретении означает циклоалкильные заместители,которые содержат в кольцевой структуре от 1 до 5 и чаще от 1 до 4 гетероатомов. Подходящими гетероатомами, использующимися в соединениях, предлагаемых в настоящем изобретении, являются азот, кислород и сера. Типичные гетероциклоалкильные фрагменты включают, например, морфолиновую группу, пиперазинил, пиперидинил и т.п. Карбоциклоалкильные группы представляют собой циклоалкильные группы, в которых все кольцевые атомы являются атомами углерода. При использовании в связи с циклоалкильными заместителями термин "полициклический" в настоящем изобретении означает конденсированные и неконденсированные циклоалкильные структуры. Термин "замещенный гетероцикл", или "гетероциклическая группа", или "гетероцикл" при использовании в настоящем изобретении означает любое 3- или 4-членное кольцо, содержащее гетероатом, выбранный из группы, включающей азот, кислород и серу, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу; где 5-членное кольцо содержит 0-2 двойных связей и 6-членное кольцо содержит 0-3 двойных связей; где атомы азота и серы необязательно могут быть окислены; где атомы азота и серы необязательно могут кватернизованы; и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим 5- или 6-членным гетероциклическим кольцом, независимо определенным выше. Таким образом, термин "гетероцикл" включает кольца, в которых азот является гетероатомом, а также частично и полностью насыщенные кольца. Предпочтительные гетероциклы включают, например, диазепинил, пиррил, пирролинил, пирролидинил, пиразолил, пиразолинил,пиразолидинил, имидазолил, имидазолинил, имидазолидинил, пиридил, пиперидинил, пиразинил, пиперазинил, N-метилпиперазинил, азетидинил, N-метилазетидинил, пиримидинил, пиридазинил, оксазолил,оксазолидинил, изоксазолил, изоазолидинил, морфолинил, тиазолил, тиазолидинил, изотиазолил, изотиазолидинил, индолил, хинолинил, изохинолинил, бензимидазолил, бензотиазолил, бензоксазолил, фурил,тиенил, триазолил и бензотиенил. Гетероциклические фрагменты могут быть незамещенными или монозамещенными или дизамещенными различными заместителями, независимо выбранными из группы, включающей гидроксигруппу, галоген, оксогруппу (С=О), алкилиминогруппу (RN=, в которой R обозначает низший алкил или низшую алкоксигруппу), аминогруппу, алкиламиногруппу, диалкиламиногруппу, ациламиноалкил, алкоксигруппу, тиоалкоксигруппу, полиалкоксигруппу, низший алкил, циклоалкил или галогеналкил. Гетероциклические группы могут быть присоединены в разных положениях, как это должно быть очевидно специалистам в области органической и медицинской химии в связи с раскрытием в настоящем изобретении."Арил" означает необязательно замещенные моноциклические и полициклические ароматические группы, содержащие в главной цепи от 3 до 14 атомов углерода и гетероатомов и включают карбоциклические арильные группы и гетероциклические арильные группы. Карбоциклические арильные группы представляют собой арильные группы, в которых все кольцевые атомы ароматического кольца являются атомами углерода. Термин "гетероарил" в настоящем изобретении означает арильные группы, содержащие от 1 до 4 гетероатомов в качестве кольцевых атомов ароматического кольца, а остальные кольцевые атомы являются атомами углерода. При использовании в связи с арильными заместителями термин "полициклический арил" в настоящем изобретении означает конденсированные и неконденсированные циклические структуры, в которых по меньшей мере одна циклическая структура является ароматической,такой как, например, бензодиоксозоловая группа, которая содержит гетероциклическую структуру,сконденсированную с фенильной группой, т.е."Арилалкил" означает алкильную группу, замещенную арильной группой. Обычно арилалкильные группы, использующиеся в соединениях, предлагаемых в настоящем изобретении, содержат от 1 до 6 атомов углерода, включенных в алкильный фрагмент арилалкильной группы. Подходящие арилалкильные группы, использующиеся в соединениях, предлагаемых в настоящем изобретении, включают, например, бензил, пиколил и т.п. Типичные гетероарильные группы включают, например, приведенные ниже. Эти гетероарильные группы могут быть дополнительно замещены и могут быть присоединены в разных положениях, как это должно быть очевидно специалистам в области органической и медицинской химии в связи с раскрытием в настоящем изобретении."Необязательно замещенный" или "замещенный" означает замещение водорода одним или большим количеством одновалентных или двухвалентных радикалов. Подходящие замещающие группы включают, например, гидроксигруппу, нитрогруппу, аминогруппу, иминогруппу, цианогруппу, галоген, тиогруппу, сульфонил, тиоамидную группу, амидиновую группу, имидиновую группу, оксогруппу, оксамидиновую группу, метоксамидиновую группу, имидиновую группу, гуанидиновую группу, сульфонамидную группу, карбоксигруппу, формил, низший алкил, галоген-низший алкил, низшую алкиламиногруппу, галоген-низшую алкиламиногруппу, низшую алкоксигруппу, галоген-низшую алкоксигруппу, низший алкоксиалкил, алкилкарбонил, аминокарбонил, арилкарбонил, арилалкилкарбонил, гетероарилкарбонил, гетероарилалкилкарбонил, алкилтиогруппу, аминоалкил, цианоалкил, арил и т.п. Замещающая группа сама может быть замещенной. Заместителем замещающей группы может быть карбоксигруппа, галоген, нитрогруппа, аминогруппа, цианогруппа, гидроксигруппа, низший алкил, низшая алкоксигруппа, аминокарбонил, -SR, тиоамидная группа, -SO3H, -SO2R или циклоалкил, в которых R обычно обозначает водород, гидроксигруппу или низший алкил. Если замещенный заместитель включает группу, обладающую линейной цепью, то замещение может происходить внутри цепи (например, 2-гидроксипропил, 2-аминобутил и т.п.) или в конце цепи (например, 2-гидроксиэтил, 3-цианопропил и т.п.). Замещенные заместители могут представлять собой обладающую линейной цепью, разветвленную или циклическую группировку ковалентно связанных атомов углерода или гетероатомов. Следует понимать, что приведенные выше определения не включают недопустимые схемы замещения (например, метил, замещенный 5 фторидными группами). Такие недопустимые схемы замещения хорошо известны специалисту в данной области техники. Специалистам в данной области техники должно быть понятно, что соединения, предлагаемые в настоящем изобретении, включая соединения формул (I) и (II) или их стереоизомеры, а также фармацевтически приемлемые соли любого из них могут испытывать таутомерные превращения и поэтому могут существовать в разных таутомерных формах, в которых протон одного атома молекулы перемещается к другому атому и химические связи между атомами молекулы соответствующим образом перестраиваются. См., например, March, Advanced Organic Chemistry: Reactions, Mechanisms and Structures, Fourth Edition, John WileySons, p. 69-74 (1992). При использовании в настоящем изобретении термин "таутомер" означает соединения, образованные путем перемещения протона, и следует понимать, что все таутомерные формы, если они могут существовать, входят в объем настоящего изобретения. Соединения, предлагаемые в настоящем изобретении, включая соединения формул (I) и (II) или их таутомеры, а также фармацевтически приемлемые соли, могут содержать асимметрично замещенные атомы углерода. Такие асимметрично замещенные атомы углерода могут привести к соединениям, предлагаемым в настоящем изобретении, существующим в энантиомерных, диастереоизомерных и других стереоизомерных формах, которые с помощью обозначений абсолютных стереохимических конфигураций можно обозначить как (R)- или (S)-формы. Поэтому все такие возможные изомеры, отдельные стереоизомеры в их оптически чистых формах, их смеси, рацемические смеси (или "рацематы"), смеси диастереоизомеров, а также отдельные диастереоизомеры соединений, предлагаемых в настоящем изобретении, входят в объем настоящего изобретения. Термины "S" и "R" конфигурация при использовании в настоящем изобретении обладают значениями, определенными в публикации IUPAC 1974RECOMMENDATIONS FOR SECTION E, FUNDAMENTAL STEREOCHEMISTRY, Pure Appl. Chem. 45:13-30 (1976). Обозначенияииспользуются для определения положений циклов в циклических соединениях. -Положение в рассматриваемой плоскости является положением, в котором предпочтительный заместитель расположен в положении с меньшим номером. Заместители, расположенные с противоположной стороны рассматриваемой плоскости, отмечают символом . Следует отметить, что эти обозначения отличаются от обозначений циклических стереоизомеров, для которых означает "ниже плоскости " и обозначает абсолютную конфигурацию. Термины - и -конфигурация при использовании в настоящем изобретении обладают значениями, определенными в публикации Chemical Abstracts IndexGuide-Appendix IV (1987), paragraph 203. При использовании в настоящем изобретении термин "фармацевтически приемлемые соли" означает соли нетоксичной кислоты или соли нетоксичного щелочно-земельного металла соединений формул(I) или (II). Эти соли можно получить in situ при окончательном выделении и очистке соединений формул (I) или (II) или путем раздельных реакций основных или кислотных групп с подходящей органической или неорганической кислотой или основанием соответственно. Типичные соли включают, но не ограничиваются только ими, следующие: ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат,никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат,пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы можно кватернизировать такими реагентами, как низш. алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, галогениды с длинными цепями, такие как децил-,лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, арилалкилгалогениды, такие как бензил- и фенетилбромиды и др. Таким образом получают растворимые или диспергирующиеся в воде или масле продукты. Примеры кислот, которые можно использовать для получения фармацевтически приемлемых солей присоединения с кислотами, включают такие неорганические кислоты, как хлористо-водородная кислота, азотная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, метансульфоновая кислота, янтарная кислота и лимонная кислота. Соли присоединения с основаниями можно получить in situ при окончательном выделении и очистке соедине-8 019951 ний формулы (I) или путем раздельных реакций кислотных групп карбоновых кислот с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком или с первичным, вторичным или третичным органическим амином. Фармацевтически приемлемые соли включают, но не ограничиваются только ими, соли, содержащие катионы щелочных и щелочно-земельных металлов, такие как соли натрия, лития, калия, кальция, магния, алюминия и т.п., а также нетоксичные соли аммония, четвертичного аммония и аминов, включая, но не ограничиваясь только ими, соли аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, этиламина и т.п. Другие типичные органические амины, применяющиеся для получения солей присоединения с основаниями, включают диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и т.п. Термин "фармацевтически приемлемые пролекарства" при использовании в настоящем изобретении означает такие пролекарства соединений, предлагаемых в настоящем изобретении, которые с медицинской точки зрения применимы для взаимодействия с тканями человека и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции и т.п., характеризуются разумным соотношением польза/риск и эффективные для применения по назначению, а также, когда это возможно, цвиттерионные формы соединений, предлагаемых в настоящем изобретении. Термин "пролекарство" означает соединения, которые быстро подвергаются превращению in vivo и образуют исходные соединения указанной выше формулы, например, путем гидролиза в крови. Подробное обсуждение приведено в публикациях Т. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems, Vol. 14 of the A.C.S.Association and Pergamon Press, 1987, которые включены в настоящее изобретение в качестве ссылки. Специалистам в данной области техники должно быть очевидно, что соединения, предлагаемые в настоящем изобретении, включая соединения формул (I) или (II) или их таутомеры и стереоизомеры, а также фармацевтически приемлемые соли могут подвергнуться преобразованиям in vivo путем метаболизма в организме человека или животного или в клетке с образованием метаболитов. Термин "метаболит" при использовании в настоящем изобретении означает любое производное, образовавшееся в субъекте после введения исходного соединения. Производные могут образоваться из исходного соединения посредством различных биохимических превращений, происходящих в субъекте, таких как, например,окисление, восстановление, гидролиз или конъюгация, и включают, например, оксиды и деметилированные производные. Метаболиты соединения, соответствующего вариантам осуществления, можно идентифицировать по стандартным методикам, известным в данной области техники. См., например, Bertolini, G. et al., J. Med. Chem. 40:2011-2016 (1997); Shan, D. et al., J. Pharm. Sci. 86(7):765-767; Bagshawe K.,Drug Dev. Res. 54:220-230 (1995); Bodor, N., Advances in Drug Res. 75:224-331 (1984); Bundgaard, H., Design of Prodrugs (Elsevier Press 1985); и Larsen, I.K., Design and Application of Prodrugs, Drug Design andDevelopment (Krogsgaard-Larsen et al., eds., Harwood Academic Publishers, 1991). Термин "рак" означает раковые заболевания, которые можно эффективно лечить путем ингибирования киназы PIM, включая,например, солидные раковые заболевания, такие как карциномы (например, легких, поджелудочной железы, щитовидной железы, яичников, мочевого пузыря, молочной железы, предстательной железы или ободочной кишки), меланому, миелоидные нарушения (например, миелолейкоз, множественную миелому и эритролейкоз), аденомы (например, ворсинчатую аденому ободочной кишки) и саркомы (например,остеосаркому). Способы получения соединений формул (I), (II) и синтетических промежуточных продуктов, использующихся в таких способах, подробно описанные ниже. Методики синтеза. Соединения, предлагаемые в настоящем изобретении, можно получить по методикам, известным специалистам в данной области техники. Например, как показано на схеме 1, 4-хлор-3-нитропиридин можно ввести в реакцию с нуклеофильным реагентом и после восстановления нитрогруппы получить 4 замещенный 3-аминопиридин I. Альтернативно, 3-бром-4-нитропиридин-N-оксид можно ввести в реакцию с нуклеофильным реагентом и после восстановления нитрогруппы и N-оксида получить 3 замещенный 4-аминопиридин II. Аминозамещенные пиридины I и II можно ацилировать карбоновыми кислотами с использованием реагентов сочетания или галогенангидридами кислот и получить 3,4 дизамещенные пиридины III и IV. Соединения, предлагаемые в настоящем изобретении, содержащие 3,4 дизамещенные фенилы, можно получить по реакциям, аналогичным приведенным на схеме 1, с использованием 3-галоген-4-нитробензолов в качестве исходных веществ. Альтернативно, 3,4-дизамещенные пиридины, как показано на схеме 2, можно получить по реакции галогеннитронитропиридинов с бороновыми кислотами по реакции Судзуки с последующим восстановлением нитрогруппы и N-оксида получить аминозамещенные пиридины V и VII. Последующее ацилирование амина дает 3,4-дизамещенные пиридины VI и VIII. Соединения, предлагаемые в настоящем изобретении, содержащие 3,4-дизамещенные фенилы, можно получить по реакциям, аналогичным приведенным на схеме 2, с использованием 3-галоген-4-нитробензолов в качестве исходных веществ. Схема 2 Альтернативным образом, 3,4-дизамещенные пиридины можно получить, как показано на схеме 3. Образование бисаниона N-Boc-3-аминопиридина или N-пивалоил-3-аминопиридина и реакция с электрофильным реагентом дает 4-замещенный, защищенный по атому 3-N аминопиридин IX. Проводимое кислотой удаление защитной группы Boc или Piv и последующее ацилирование дают 3,4-дизамещенный пиридин X. Соединения, предлагаемые в настоящем изобретении, содержащие 3,4-дизамещенные фенилы, можно получить по реакциям, аналогичным приведенным на схеме 3, с использованием соответствующим образом защищенных анилинов в качестве исходных веществ. Схема 3 Соединения, предлагаемые в настоящем изобретении, содержащие 5-замещенные 4 аминоацилпиримидоны, такие как XII и XIII, можно получить, как показано на схеме 4. Нуклеофильное замещение или сочетание типа Судзуки с 5-бромцитозином с последующим N-ацилированием дает 5 замещенные 4-аминоацилпиримидоны. Если амидный фрагмент замещенных пиридинов, бензолов или пиримидонов содержит галогенгетероарильную группу, то замещенные пиридины, бензолы или пиримидоны можно модифицировать, как показано на схеме 5. Связанные непосредственно с атомами углерода группы (R1) можно присоединить к гетероарильной группе по реакциям Судзуки, Негиши, Гриньяра или другим методикам, в которых используются металлоорганические соединения. Альтернативно, содержащие азот, кислород, серу и углерод нуклеофилы можно присоединить к гетероарильной группе по стандартным методикам с использованием реакций SnAr или Бухвальда/Гартвига. Схема 5 Соединения, предлагаемые в настоящем изобретении, применимы in vitro или in vivo для подавления роста раковых клеток. Соединения можно применять по отдельности или в композициях вместе с фармацевтически приемлемым носителем или инертным наполнителем. Подходящие фармацевтически приемлемые носители или инертные наполнители включают, например, технологические добавки и вещества, модифицирующие и улучшающие доставку лекарственного средства, такие как, например, фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, декстроза, гидроксипропилциклодекстрин, поливинилпирролидинон, низкоплавкие воска, ионообменные смолы и т.п., а также комбинации любых двух или большего количества из них. Другие подходящие фармацевтически приемлемые инертные наполнители описаны в публикации "Remington's Pharmaceutical Sciences", Mack Pub. Co., New Jersey(1991), которая включена в настоящее изобретение в качестве ссылки. Эффективные количества соединений, предлагаемых в настоящем изобретении, обычно представляют собой любые количества, достаточные для регистрируемого ингибирования активности PIM, обнаруживаемого с помощью любой из методик исследования, описанных в настоящем изобретении, с по- 11019951 мощью других методик исследования активности киназы PIM, известных специалистам с общей подготовкой в данной области техники, или обнаруживаемого по подавлению или ослаблению симптомов рака. Количество активного ингредиента, которое можно объединить с носителями с получением разовой дозированной формы, будет меняться в зависимости от подвергающегося лечению реципиента и конкретного пути введения. Однако следует понимать, что точная доза для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного использующегося соединения,возраст, массу тела, общее состояния здоровья, пол, диету, время введения, путь введения, скорость выведения, комбинацию лекарственных средств и тяжесть конкретного заболевания, подвергающегося лечению. В каждом случае терапевтически эффективное количество можно легко определить с помощью стандартных исследований и на основании своей профессиональной подготовки решение принимает лечащий врач. Для задач настоящего изобретения терапевтически эффективная доза обычно представляет собой полную суточную дозу, вводимую реципиенту в виде одной или разделенных доз в количествах, которые могут составлять, например, от 0,001 до 1000 мг/(кг массы тела) в сутки и более предпочтительно от 1,0 до 30 мг/(кг массы тела) в сутки. Разовая доза композиции может составлять доли таких количеств, так чтобы в сумме они образовывали суточную дозу. Соединения, предлагаемые в настоящем изобретении, можно вводить перорально, парентерально,сублингвально, с помощью аэрозоля или ингаляции спрея, ректально или местно в виде разовых доз композиций, при необходимости содержащих обычные нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и растворители. Местное введение также может включать применение средств чрескожного введения, таких как чрескожные пластыри или устройства для ионофореза. Термин "парентерально" при использовании в настоящем изобретении включает подкожные инъекции,внутривенные, внутримышечные, надчревные инъекции и вливание. Препараты для инъекции, например стерильные водные или масляные суспензии для инъекции,можно приготовить с использованием известных в данной области техники подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекции также может представлять собой стерильный раствор, суспензию или эмульсию для инъекции в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-пропандиоле. В число приемлемых носителей и разбавителей, которые можно использовать, входят вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое жидкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для приготовления средств для инъекции используют жирные кислоты, такие как олеиновую кислоту. Суппозитории для ректального введения лекарственного средства можно приготовить путем смешивания лекарственного средства с подходящим не оказывающим раздражающее воздействие инертным наполнителем, таким как масло какао или полиэтиленгликоли, которые являются твердыми при температуре окружающей среды, но жидкими при температуре прямой кишки и поэтому плавятся в прямой кишке и высвобождают лекарственное средство. Твердые дозированные формы для перорального введения могут включать капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых дозированных формах активное соединение можно смешать по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие твердые дозированные формы могут включать, что является обычной практикой, дополнительные вещества,не являющиеся инертными разбавителями, например, смазывающие вещества, такие как стеарат магния. В случае капсул, таблеток и пилюль дозированные формы также могут включать буферные агенты. Таблетки и пилюли также можно изготовить с энтеросолюбильными покрытиями. Жидкие дозированные формы для перорального введения могут включать фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры, которые могут содержать инертные разбавители, обычно использующиеся в данной области техники, такие как воду. Такие композиции также могут содержать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, циклодекстрины и подсластители, вкусовые добавки и отдушки. Соединения, предлагаемые в настоящем изобретении, также можно вводить в виде липосом. Как известно в данной области техники, липосомы обычно получают из фосфолипидов или других липидов. Липосомы формируются моно- или многослойными гидратированными жидкими кристаллами, которые диспергированы в водной среде. Можно использовать любой нетоксичный физиологически приемлемый и подвергающийся метаболизму липид, способный образовывать липосомы. Композиции, предлагаемые в настоящем изобретении, в липосомной форме в дополнение к соединению, предлагаемому в настоящем изобретении, могут содержать стабилизаторы, консерванты, инертные наполнители и т.п. Предпочтительными липидами являются фосфолипиды и фосфатидилхолины (лецитины), натуральные и синтетические. Методики приготовления липосом известны в данной области техники. См., например, публикацию Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.W., p. 33 et seq. Хотя соединения предпочтительных вариантов осуществления можно вводить в качестве единственного лекарственного средства, их также можно применять в комбинации с одним или большим количеством других средств, применяющихся для лечения рака. Соединения, предлагаемые в настоящем изобретении, также применимы в комбинации с известными лекарственными средствами и противораковыми средствами и комбинации соединений, предлагаемых в настоящем изобретении, с другими противораковыми средствами или химиотерапевтическими средствами входят в объем настоящего изобретения. Примеры таких средств приведены в публикации Cancer Principles and Practice of Oncology, V.T. Devitaand S. Hellman (editors), 6tn edition (Feb. 15, 2001), Lippincott WilliamsWilkins Publishers. Специалист с общей подготовкой в данной области техники должен быть способен определить, какие комбинации средств будут применимы в соответствии с характеристиками конкретных лекарственных средств и подвергающимся лечению раком. Такие противораковые средства включают, но не ограничиваются только ими, следующие: модуляторы эстрогенного рецептора, модуляторы андрогенного рецептора, модуляторы ретиноидного рецептора, цитотоксические/цитостатические средства, антипролиферативные средства, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-CoA редуктазы и другие ингибиторы ангиогенеза, ингибиторы пролиферации клеток и передачи сигналов жизнеспособности, средства, индуцирующие апоптоз, и средства, которые оказывают мешающее воздействие на ключевых стадиях клеточного цикла. Соединения, предлагаемые в настоящем изобретении, также применимы совместно с лучевой терапией. Поэтому в одном варианте осуществления соединения также применяются в комбинации с известными противораковыми средствами, включая, например, модуляторы эстрогенного рецептора, модуляторы андрогенного рецептора, модуляторы ретиноидного рецептора, цитотоксические средства, антипролиферативные средства, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-CoA редуктазы,ингибиторы протеазы ВИЧ (вирус иммунодефицита человека), ингибиторы обратной транскриптазы и другие ингибиторы ангиогенеза. Модуляторы эстрогенного рецептора представляют собой соединения, которые, независимо от механизма, могут препятствовать связыванию эстрогена с рецептором или ингибировать это связывание. Примеры модуляторов эстрогенного рецептора включают, но не ограничиваются только ими, тамоксифен, ралоксифен, идоксифен, LY353381, LY117081, торемифен, фулвестрант, 4-[7-(2,2-диметил-1 оксопропокси-4-метил-2-[4-[2-(1-пиперидинил)этокси]фенил]-2 Н-1-бензопиран-3-ил]фенил-2,2 диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646. Модуляторы андрогенного рецептора представляют собой соединения, которые могут препятствовать связыванию андрогенов с андрогенным рецептором или ингибировать это связывание. Типичные примеры модуляторов андрогенного рецептора включают финастерид и другие ингибиторы 5 редуктазы, нилутамид, флутамид, бикалутамид, лиарозол и абиратеронацетат. Модуляторы ретиноидного рецептора представляют собой соединения, которые препятствуют связыванию ретиноидов с ретиноидным рецептором или ингибируют это связывание. Примеры модуляторов ретиноидного рецептора включают бексаротен, третиноин, 13-цис-ретиноевую кислоту, 9-цис-ретиноевую кислоту, дифторметилорнитин,LX23-7553,транс-N-(4'-гидроксифенил)ретинамид иN4 карбоксифенилретинамид. Цитотоксические и/или цитостатические средства представляют собой соединения, которые могут вызывать гибель клеток или ингибировать пролиферацию клеток преимущественно путем непосредственного препятствования функционированию клеток или ингибирования митоза клеток или препятствования митозу, включая алкилирующие средства, факторы некроза опухолей, интеркаляторы, соединения,вызывающие гипоксию, ингибиторы микротрубочек/средства, стабилизирующие микротрубочки, ингибиторы митотических кинезинов, ингибиторы киназ, участвующих в прогрессировании митоза, антиметаболиты; модификаторы биологического ответа; гормональные/антигормональные лекарственные средства, факторы гематопоэтического роста, лекарственные средства, воздействующие на моноклональные антитела, ингибиторы топоизомеразы, ингибиторы протеосомы и ингибиторы убиквитинлигазы. Примеры цитотоксических средств включают, но не ограничиваются только ими, сертенеф, кахектин, ифосфамид, тасонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдульцитол, рамимустин,фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин, импросульфантозилат,трофосфамид, нимустин, диброспидийхлорид, пумитепу, лобаплатин, сатраплатин, профиромицин, цисплатин, ирофульвен, дексифосфамид, цис-аминдихлор(2-метилпиридин)платину, бензилгуанин, глюфосфамид,GPX100,(транс,транс,транс)-бис-мю-(гексан-1,6-диамин)-мю-[диамин-платина(II)]-бис[диамин(хлор)платина(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино 10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-дезамино-3'-морфолино-13 дезоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид, MEN10755 и 4-деметокси-3 дезамино-3-азиридинил-4-метилсульфонилдаунорубицин (см. WO 00/50032). Типичным примером соединений, вызывающих гипоксию, является тирапазамин. Ингибиторы протеосомы включают, но не ограничиваются только ими, лактацистин и бортезомиб. Примеры ингибиторов микротрубочек/средств,- 13019951 стабилизирующих микротрубочки, включают паклитаксел, виндезинсульфат, 3',4'-дидегидро-4'-дезокси 8'-норвинкалейкобластин, доцетаксол, ризоксин, доластатин, мивобулинизетиноат, ауристатин, цематодин,RPR109881,BMS184476,винфлунин,криптофицин,2,3,4,5,6-пентафтор-N-(3-фтор-4 метоксифенил)бензолсульфонамид,ангидровинбластин,N,N-диметил-L-валил-L-валил-N-метил-Lвалил-L-пролил-L-пролин-трет-бутиламид, TDX258, эпотилоны (см., например, патенты US6284781 и 6288237) и BMS188797. Типичные примеры ингибиторов топоизомеразы включают топотекан, гикаптамин, иринотекан, рубитекан, 6-этоксипропионил-3',4'-О-экзо-бензилиденшартрезин, 9-метокси-N,Nдиметил-5-нитропиразоло[3,4,5-kl]акридин-2-(6 Н)пропанамин,1-амино-9-этил-5-фтор-2,3-дигидро-9 гидрокси-4-метил-1H,12 Н-бензо[de]пирано[3',4':b,7]индолизино[1,2b]хинолин-10,13(9 Н,15 Н)дион, лутротекан, 7-[2-(N-изопропиламино)этил]-(20S)камптотецин, BNP1350, BNPI1100, BN80915, BN80942,этопозидфосфат, тенипозид, собузоксан, 2'-диметиламино-2'-дезоксиэтопозид, GL331, N-[2(диметиламино)этил]-9-гидрокси-5,6-диметил-6 Н-пиридо[4,3-b]карбазол-1-карбоксамид,азулакрин,(5 а,5 аВ,8 аа,9b)-9-[2-[N-[2-(диметиламино)этил]-N-метиламино]этил]-5-[4-гидрокси-3,5 диметоксифенил]-5,5 а,6,8,8 а,9-гексагидрофуро(3',4':6,7)нафто(2,3-d)-1,3-диоксол-6-он,2,3(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо[с]-фенантридиний,6,9-бис-[(2 аминоэтил)амино]бензо[g]изохинолин-5,10-дион,5-(3-аминопропиламино)-7,10-дигидрокси-2-(2 гидроксиэтиламинометил)-6 Н-пиразоло[4,5,1'-de]акридин-6-он,N-[1-[2(диэтиламино)этиламино]-7 метокси-9-оксо-9 Н-тиоксантен-4-илметил]формамид, N-(2-(диметиламино)этил)акридин-4-карбоксамид,6-2-(диметиламино)этил]амино]-3-гидрокси-7 Н-индено[2,1-с]хинолин-7-он и димесна. Примеры ингибиторов митотических кинезинов, таких как митотический кинезин KSP человека, описаны в публикациях РСТ WO 01/30768 и WO 01/98278, WO 03/050064 (19 июня 2003 г.), WO 03/050122 (19 июня 2003 г.),WO 03/049527 (19 июня 2003 г.), WO 03/049,679 (19 июня 2003 г.), WO 03/049678 (19 июня 2003 г.) и WO 03/39460 (15 мая 2003 г.) и находящихся на рассмотрении заявках РСТUS03/06403 (подана 4 марта 2003 г.), US03/15861 (подана 19 мая 2003 г.), US03/15810 (подана 19 мая 2003), US03/18482 (подана 12 июня 2003 г.) и US03/18694 (подана 12 июня 2003 г.). В вариантах осуществления ингибиторы митотических кинезинов включают, но не ограничиваются только ими, ингибиторы KSP, ингибиторы MKLP1,ингибиторы CENP-E, ингибиторы MCAK, ингибиторы Kif14, ингибиторы Mphosph1 и ингибиторы Rab6KIFL. Ингибиторы киназ, участвующих в прогрессировании митоза, включают, но не ограничиваются только ими, ингибиторы киназы aurora, ингибиторы Polo-подобных киназ (PLK) (например, ингибиторыPLK-1), ингибиторы bub-1 и ингибиторы bub-1R. Антипролиферативные средства включают антисмысловые олигонуклеотиды РНК и ДНК, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001, и антиметаболиты, такие как эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат,флударабин, капецитабин, галоцитабин, цитарабин окфосфат, гидрат фостеабина натрия, ралтитрексед,палтитрексед, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-дезокси-2'метилиденцитидин, 2'-фторметилен-2'-дезоксицитидин, N-[5-(2,3-дигидробензофурил)сульфонил]-N'(3,4-дихлорфенил)мочевина, N6-[4-дезокси-4-[N2-[2(Е),4(Е)-тетрадекадиеноил]глициламино]-L-глицероВ-L-манногептопиранозил]аденин, аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8 тетрагидро-3 Н-пиримидино[5,4-b][1,4]тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовая кислота, аминоптерин, 5-фторурацил, аланозин, эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14 окса-1,1-диазатетрацикло(7.4.1.0.0)-тетрадека-2,4,6-триен-9-илуксусной кислоты, свайнсонин, лометрексол, дексразоксан, метиониназа, 2'-циано-2'-дезокси-N4-пальмитоил-1-В-D-арабинофуранозилцитозин и 3-аминопиридин-2-карбоксальдегидтиосемикарбазон. Примеры лекарственных средств, воздействующих на моноклональные антитела, включают такие лекарственные средства, которые содержат цитотоксические средства или радиоизотопы, присоединенные к моноклональным антителам, специфическим по отношению к раковым клеткам или клеткам-мишеням. Примеры включают, например, бекксар. Ингибиторы HMG-CoA редуктазы представляют собой ингибиторы 3-гидрокси-3-метилглутарилCoA редуктазы. Соединения, которые обладают ингибирующей активностью по отношению к HMG-CoA редуктазе, можно легко идентифицировать с помощью анализов, хорошо известных в данной области техники, таких как описанные или цитированные в патенте US4231938 и WO 84/02131. Примеры ингибиторов HMG-CoA редуктазы, которые можно использовать, включают, но не ограничиваются только ими, ловастатин (мевакор; см. патенты US4231938, 4294926 и 4319039), симвастатин (зокор; см. патенты US4444784, 4820850 и 4916239), правастатин (правахол; см. патенты US4346227,4537859, 4410629, 5030447 и 5180589), флувастатин (лескол; см. патенты US5354772, 4911165,4929437, 5189164, 5118853, 5290946 и 5356896) и аторвастатин (липитор; см. патенты US5273995,4681893, 5489691 и 5342952). Структурные формулы этих и других ингибиторов HMG-CoA редуктазы,которые можно использовать в способах, предлагаемых в настоящем изобретении, описаны на с. 87 публикации М. Yalpani, "Cholesterol Lowering Drugs", ChemistryIndustry, p. 85-89 (5 Feb. 1996) и в патентах US4782084 и 4885314. В одном варианте осуществления ингибитор HMG-CoA редуктазы выбран из группы, включающей ловастатин или симвастатин. Ингибиторы пренилпротеинтрансферазы представляют собой соединения, которые ингибируют любой фермент или любую комбинацию ферментов пренилпротеинтрансфераз, включая фарнезилпротеинтрансферазу (FPTase), геранилгеранилпротеинтрансферазу типа I (GGPTase-I), геранилгеранилпротеинтрансферазу типа II (GGPTase-II, также называемую Rab GGPTase). Примеры соединений, ингибирующих пренилпротеинтрансферазу, включают-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил 2(1 Н)хинолинон,(-)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)хинолинон,(+)-6-[амино(4-хлорфенил)(1-метил-1 Н-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)хинолинон,5(S)-n-бутил-1-(2,3-диметилфенил)-4-[1-(4-цианобензил)-5-имидазолилметил-2-пиперазинон,(S)-1-(3-хлорфенил)-4-[1-(4-цианобензил)-5-имидазолилметил]-5-[2-(этансульфонил)метил]-2 пиперазинон,5(S)-n-бутил-1-(2-метилфенил)-4-[1-(4-цианобензил)-5-имидазолилметил]-2-пиперазинон,1-(3-хлорфенил)-4-[1-(4-цианобензил)-2-метил-5-имидазолилметил]-2-пиперазинон,1-(2,2-дифенилэтил)-3-[N-(1-(4-цианобензил)-1H-имидазол-5-илэтил)карбамоил]пиперидин,4[4-гидроксиметил-4-(4-хлорпиридин-2-илметил)пиперидин-1-илметил]-2-метилимидазол-1 илметилбензонитрил,45-[4-гидроксиметил-4-(3-хлорбензил)пиперидин-1-илметил]-2-метилимидазол-1 илметилбензонитрил,4-3-[4-(2-оксо-2 Н-пиридин-1-ил)бензил]-3H-имидазол-4-илметилбензонитрил,4-3-[4-(5-хлор-2-оксо-2 Н-[1,2']бипиридин-5'-илметил)]-3H-имидазол-4-илметилбензонитрил,4-3-[4-(2-оксо-2 Н-[1,2']бипиридин-5'-илметил)]-3H-имидазол-4-илметилбензонитрил,4-[3-(2-оксо-1-фенил-1,2-дигидропиридин-4-илметил)-3 Н-имидазол-4-илметил]бензонитрил,18,19-дигидро-19-оксо-5 Н,17 Н-6,10:12,16-диметено-1 Н-имидазо[4,3 с][1,11,4]диоксаазациклононадецин-9-карбонитрил,-19,20-дигидро-19-оксо-5 Н-18,21-этано-12,14-этено-6,10-метено-22 Н-бензо[d]имидазо[4,3k][1,6,9,12]оксатриазациклооктадецин-9-карбонитрил,19,20-дигидро-19-оксо-5 Н,17 Н-18,21-этано-6,10:12,16-диметено-22 Н-имидазо[3,4h][1,8,11,14]оксатриазациклоэйкозин-9-карбонитрил,-19,20-дигидро-3-метил-19-оксо-5 Н-18,21-этано-12,14-этено-6,10-метено-22 Нбензо[d]имидазо[4,3-k][1,6,9,12]оксатриазациклооктадецин-9-карбонитрил. Другие примеры ингибиторов пренилпротеинтрансферазы приведены в следующих публикациях и патентах: WO 96/30343, WO 97/18813, WO 97/21701, WO 97/23478, WO 97/38665, WO 98/28980,WO 98/29119, WO 95/32987, патент US5420245, патент US5523430, патент US5532359, патентUS5510510, патент US5589485, патент US5602098, публикация Европейского патента 0618221,публикация Европейского патента 0675112, публикация Европейского патента 0604181, публикация Европейского патента 0696593, WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572,WO 95/10514, патент US5661152, WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535,WO 95/25086, WO 96/05529, WO 96/06138, WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456,WO 96/22278, WO 96/24611, WO 96/24612, WO 96/05168, WO 96/05169, WO 96/00736, патент US5571792, WO 96/17861, WO 96/33159, WO 96/34850, WO 96/34851, WO 96/30017, WO 96/30018,WO 96/30362, WO 96/30363, WO 96/31111, WO 96/31477, WO 96/31478, WO 96/31501, WO 97/00252,WO 97/03047, WO 97/03050, WO 97/04785, WO 97/02920, WO 97/17070, WO 97/23478, WO 97/26246,WO 97/30053, WO 97/44350, WO 98/02436 и патент US5532359. Пример влияния ингибитора пренилпротеинтрансферазы на ангиогенез см. в публикации European J. of Cancer 35(9):1394-1401 (1999). Ингибиторы ангиогенеза представляют собой соединения, которые, независимо от механизма, могут ингибировать образование новых кровеносных сосудов. Примеры ингибиторов ангиогенеза включают, но не ограничиваются только ими, ингибиторы тирозинкиназы, такие как ингибиторы рецепторов тирозинкиназы Flt-1 (VEGFR1) и Flk-1/KDR (VEGFR2), ингибиторы эпидермального, фибробластного или тромбоцитарного факторов роста, ингибиторы ММР (матричной металлопротеазы), блокаторы интегрина, ингибиторы интерферона-альфа, интерлейкина-12, пентозанполисульфата, циклооксигеназы,включая нестероидные противовоспалительные средства (NSAID), такие как аспирин и ибупрофен, а также селективные ингибиторы циклооксигеназы-2, такие как целекоксиб и рофекоксиб (PNAS 89:7384(1997); Cancer Res. 57:1625 (1997); Cell 93:705 (1998); Intl. J. Mol. Med. 2:715 (1998); J. Biol. Chem. 274:9116 (1999, стероидные противовоспалительные средства (такие как кортикостероиды, минералокортикоиды, дексаметазон, преднизон, преднизолон, метилпред, бетаметазон), карбкосиамидотриазол,комбретастатин А 4, скваламин, 6-О-хлорацетилкарбонил-фумагиллол, талидомид, ангиостатин, тропонин-1, антагонисты ангиотензина II (см. Fernandez et al., J. Lab. Clin. Med. 105:141-145 (1985, и антитела к VEGF (см. Nature Biotechnology, 17:963-968 (October 1999); Kim et al., Nature, 362:841-844 (1993); WO 00/44777 и WO 00/61186). Другие лекарственные средства, которые модулируют или ингибируют ангиогенез и также могут применяться в комбинации с соединениями предпочтительных вариантов осуществления, включают средства, которые модулируют или ингибируют системы коагуляции и фибринолизиса(см. обзор в публикации Clin. Chem. La. Med. 38:619-692 (2000. Примеры таких средств, которые модулируют или ингибируют пути коагуляции и фибринолизиса, включают, но не ограничиваются только ими, гепарин (см. Thromb. Haemost. 50:10-23 (1998, обладающие низкой молекулярной массой гепарины и ингибиторы карбоксипептидазы U (также известные как ингибиторы активного тромбина, активирумые ингибитором фибринолизиса [TAFIa]) (см. Thrombosis Res. 101:329-354 (2001. Ингибиторы TAFIa описаны в публикации РСТ WO 03/013526 и US Ser. No. 60/349925 (поданной 18 января 2002 г.). Предпочтительные варианты осуществления также включают комбинации соединений предпочтительных вариантов осуществления с NSAID, которые являются селективными ингибиторами СОХ-2 (обычно определяющиеся как такие, для которых специфичность ингибирования СОХ-2 превышает специфичность ингибирования СОХ-1 не менее чем примерно в 100 раз по данным определения по отношению значений IC50 для СОХ-2 и СОХ-1, определенных путем исследований клеток или микросом). Такие соединения включают, но не ограничиваются только ими, раскрытые в патенте US5474995, выданном 12 декабря 1995 г., патенте US5861419, выданном 19 января 1999 г., патенте US6001843, выданном 14 декабря 1999 г., патенте US6020343, выданном 1 февраля 2000 г., патенте US5409944, выданном 25 апреля 1995 г., патенте US5436265, выданном 25 июля 1995 г., патенте US5536752, выданном 16 июля 1996 г., патенте US5550142, выданном 27 августа 1996 г., патенте US5604260,выданном 18 февраля 1997 г., патенте US5698584, выданном 16 декабря 1997 г., патенте US5710140, выданном 20 января 1998 г., WO 94/15932, опубликованной 21 июля 1994 г., патенте US5344991, выданном 6 июня 1994 г., патенте US5134142, выданном 28 июля 1992 г., патенте US5380738, выданном 10 января 1995 г., патенте US5393790, выданном 20 февраля 1995 г., патентеUS5932598, выданном 3 августа 1999 г., которые включены в настоящее изобретение в качестве ссылки. Типичные ингибиторы СОХ-2, которые применимы в способах предпочтительных вариантов осуществления, включают 3-фенил-4-(4-(метилсульфонил)фенил)-2-(5 Н)-фуранон и 5-хлор-3-(4 метилсульфонил)фенил-2-(2-метил-5-пиридинил)пиридин. Соединения, которые описаны как специфические ингибиторы СОХ-2 и поэтому применимы в предпочтительных вариантах осуществления, и методики их синтеза приведены в следующих патентах, находящихся на рассмотрении заявках и публикациях, которые включены в настоящее изобретение в качестве ссылки: WO 94/15932, опубликованной 21 июля 1994 г., патенте US5344991, выданном 6 июня 1994 г., патенте US5134142, выданном 28 июля 1992 г., патенте US5380738, выданном 10 января 1995 г., патенте US5393790, выданном 20 февраля 1995 г., патенте US5466823, выданном 14 ноября 1995 г., патенте US5633272, выданном 27 мая 1997 г., патенте US5932598, выданном 3 августа 1999 г., патенте US5474995, выданном 12 декабря 1995 г., патенте US5861419, выданном 19 января 1999 г., патенте US6001843, выданном 14 декабря 1999 г., патенте US6020343, выданном 1 февраля 2000 г., патенте US5409944, выданном 25 апреля 1995 г., патенте US5436265, выданном 25 июля 1995 г., патенте US5536752, выданном 16 июля 1996 г., патенте US5550142, выданном 27 августа 1996 г., патенте US5604260, выданном 18 февраля 1997 г., патенте US5698584, выданном 16 декабря 1997 г., и патенте US5710140, выданном 20 января 1998 г. Другие примеры ингибиторов ангиогенеза включают, но не ограничиваются только ими, эндостатин, украин, ранпирназ, IM862, 5-метокси-4-[2-метил-3-(3-метил-2 бутенил)оксиранил]-1-оксаспиро[2,5]окт-6-ил(хлорацетил)карбамат, ацетилидинаналин, 5-амино-1-3,5 дихлор-4-(4-хлорбензоил)фенил]метил]-1 Н-1,2,3-триазол-4-карбоксамид, СМ 101, скваламин, комбретастатин, RPI4610, NX31838, сульфированный фосфат маннопентаозы, 7,7-(карбонил-бис-[имино-N-метил 4,2-пирролокарбонилимино-[N-метил-4,2-пиррол]карбонилимино]-бис-(1,3-нафталиндисульфонат) и 3[(2,4-диметилпиррол-5-ил)метилен]-2-индолинон (SU5416). Средства, которые оказывают мешающее воздействие на ключевых стадиях клеточного цикла,представляют собой соединения, которые могут ингибировать протеинкиназы, которые передают сигналы на ключевых стадиях клеточного цикла, тем самым сенсибилизируя раковые клетки по отношению к средствам, повреждающим ДНК. Такие средства включают ингибиторы ATR, ATM, киназ Chk1 и Chk2 и ингибиторы киназы cdk и cdc и их предпочтительными примерами являются 7-гидроксистауроспорин,флавопиридол, CYC202 (циклацел) и BMS-387032. Ингибиторы пролиферации клеток и передачи сигналов жизнеспособности могут представлять собой фармацевтические средства, которые могут ингибировать рецепторы поверхностей клеток и передачу каскадов сигналов в прямом направлении от этих рецепторов поверхностей клеток. Такие средства включают ингибиторы ингибиторов EGFR (например, гефитиниб и эрлотиниб), ингибиторы ERB-2 (например, трастузумаб), ингибиторы IGFR, ингибиторы цитокиновых рецепторов, ингибиторы МЕТ, ингибиторы PI3K (например, LY294002), серин/треонинкиназ (включая, но не ограничиваясь только ими, ингибиторы Akt, такие как описанные в WO 02/083064, WO 02/083139, WO 02/083140 и WO 02/083138),ингибиторы киназы Raf (например, BAY-43-9006), ингибиторы MEK (например, CI-1040 и PD-098059) и ингибиторы mTOR (например, Wyeth CCI-779). Такие средства включают небольшие молекулыингибиторы и антагонисты антител. Средства, индуцирующие апоптоз, включают активаторы рецепторов группы TNF (включая рецепторы TRAIL). В некоторых особенно предпочтительных вариантах осуществления настоящего изобретения типичные средства, применимые в комбинации с соединениями, предлагаемыми в настоящем изобретении,для лечения рака, включают, например, иринотекан, топотекан, гемцитабин, 5-фторурацил, лейковорин,карбоплатин, цисплатин, таксаны, тезацитабин, циклофосфамид, алкалоиды барвинка, иматиниб (глеевек), антрациклины, ритуксимаб, трастузумаб, а также другие противораковые химиотерапевтические средства. Указанные выше соединения, применяющиеся в комбинации с соединениями, предлагаемыми в настоящем изобретении, можно использовать в терапевтических количествах, как это указано в публикации Physicians' Desk Reference (PDR) 47th Edition (1993), которая включена в настоящее изобретение в качестве ссылки, или в таких терапевтически применимых количествах, которые должны быть известны специалисту с общей подготовкой в данной области техники. Соединения, предлагаемые в настоящем изобретении, и другие противораковые средства можно вводить в рекомендованной максимальной клинической дозировке или в меньших дозах. Величины доз активных соединений в композициях предпочтительных вариантов осуществления могут меняться так,чтобы обеспечить необходимое терапевтическое воздействие в соответствии с путем введения, тяжестью заболевания и реакцией пациента. Комбинацию можно вводить в виде отдельных композиций или в виде разовой дозированной формы, содержащей оба средства. При введении в виде комбинации лекарственные средства можно приготовить в виде отдельных композиций, которые вводят одновременно или в разные моменты времени, или лекарственные средства можно вводить в виде одной композиции. Антиэстрогены, такие как тамоксифен, подавляют рост рака молочной железы, вызывая остановку клеточного цикла, для которой необходимо воздействие ингибитора p27Kip клеточного цикла. Недавно показано, что активация пути киназы Ras-Raf-MAP меняет состояние фосфорилирования p27Kip, так что ослабляется его ингибирующее воздействие при остановке клеточного цикла, что способствует резистентности к антиэстрогенам (Donovan et al., J. Biol. Chem. 276:40888, 2001). Как показано в публикацииDonovan et al., ингибирование сигнального пути MAPK путем лечения ингибитором MEK меняет состояние фосфорилирования р 27 в случае стойких к гормону линий клеток рака молочной железы и тем самым восстанавливает чувствительность к гормону. В соответствии с этим в одном варианте осуществления соединения формул (I) и (II) можно использовать для лечения зависящих от гормонов типов рака,таких как рак молочной и предстательной железы, путем устранения стойкости к гормонам, обычно наблюдающейся для этих типов рака при использовании обычных противораковых средств. При раковых заболеваниях крови, таких как хронический миелолейкоз (ХМЛ), транслокация хромосом ответственна за конститутивно активированную BCR-Ab1 тирозинкиназу. Страдающие этими заболеваниями пациенты реагируют на глеевек, небольшую молекулу - ингибитор тирозинкиназы,вследствие ингибирования активности киназы Ab1. Однако на прогрессирующей стадии заболевания многие пациенты сначала реагируют на глеевек, но затем происходит рецидив вследствие приводящих к резистентности мутаций в домене киназы Ab1. Исследования in vitro показали, что для оказания воздействия BCR-Ab1 использует пути киназы Ras-Raf. Кроме того, ингибирование на том же пути более одной киназы приводит к дополнительной защите от мутаций, приводящих к резистентности. В соответствии с этим в другом варианте осуществления настоящего изобретения соединения формул (I) и (II) применяют в комбинации по меньшей мере с одним дополнительным средством, таким как глеевек, для лечения раковых заболеваний крови, таких как хронический миелолейкоз (ХМЛ), с целью обращения или предупреждения резистентности по меньшей мере к одному дополнительному средству. Настоящее изобретение будет легче понять с использованием приведенных ниже примеров, которые представлены только для иллюстрации и не предназначены для ограничения настоящего изобретения. Типичные боковые цепи для использования в соединениях в последующих примерах обычно можно получить по следующим методикам. Примеры В приведенных ниже примерах соединения, соответствующие предпочтительным вариантам осуществления, синтезировали по методикам, описанным в настоящем изобретении, или по другим методикам, которые известны в данной области техники. Соединения и/или промежуточные продукты характеризовали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографической системы Waters Millenium с модулем разделения 2695 (Milford, MA). Использовали аналитические колонки с обращенной фазой Phenomenex Luna C18 -5 мкм, 4,650 мм, выпускающиеся фирмой Alltech (Deerfield, IL). Использовали элюирование в градиентном режиме (скорость потока 2,5 мл/мин), обычно начиная от смеси 5% ацетонитрил/95% вода и заканчивая 100% ацетонитрилом, в течение 10 мин. Все растворители содержали 0,1% трифторуксусной кислоты (ТФК). Соединения детектировали по поглощению в ультрафиолетовой (УФ) области спектра при длине волны 220 или 254 нм. Использовали растворители для ВЭЖХ, выпускающиеся фирмами Burdick and Jackson (Muskegan, MI) или Fisher Scientific (Pittsburgh, PA). В некоторых случаях чистоту определяли с помощью тонкослойной хроматографии (ТСХ) с использованием стеклянных или пластмассовых пластин, покрытых силикагелем, таких как, например,гибкие пластины Baker-Flex Silica Gel 1B2-F. Данные ТСХ легко получали путем визуального детектирования при ультрафиолетовом освещении или путем использования хорошо известной методики окрашивания парами йода или различных других методик окрашивания. Масс-спектрометрические исследования проводили на одном из трех приборов для ЖХМС (жидкостная хроматография-масс-спектроскопия): Waters System (Alliance HT ВЭЖХ и Micromass ZQ массспектрометр; колонка: Eclipse XDB-C18, 2,150 мм; градиентный режим: 5-95% (или 35-95%, или 6595% или 95-95%) ацетонитрил в воде с добавлением 0,05% ТФК в течение 4 мин; скорость потока 0,8 мл/мин; диапазон молекулярных масс 200-1500; разность потенциалов на конусе 20 В; температура колонки 40C), или Waters System (ACQUITY UPLC system и ZQ 2000 system; колонка: ACQUITY UPLCHSS-C18, 1,8 мкм, 2,150 мм; градиентный режим: 5-95% (или 35-95%, или 65-95% или 95-95%) ацетонитрил в воде с добавлением 0,05% ТФК в течение 1,3 мин; скорость потока 1,2 мл/мин; диапазон молекулярных масс 150-850; потенциалов на конусе 20 В; температура колонки 50C) или Hewlett PackardSystem (Series 1100 ВЭЖХ; колонка: Eclipse XDB-C18, 2,150 мм; градиентный режим: 5-95% ацетонитрил в воде с прибавлением 0,05% ТФК в течение 4 мин; скорость потока 0,8 мл/мин; диапазон молекулярных масс 150-850; разность потенциалов на конусе 50 В; температура колонки 30C). Все приведенные массы относятся к протонированным исходным ионам. Исследования с помощью ГХ (газовая хроматография)/МС (масс-спектрометрия) проводили на приборе Hewlett Packard (HP6890 Series газовый хроматограф с селективным по массе детектором 5973; инжектируемый объем: 1 мкл; начальная температура колонки: 50C; конечная температура колонки: 250C; время линейного повышения: 20 мин; скорость потока газа: 1 мл/мин; колонка: 5% фенилметилсилоксан, Model No. HP 190915-443, размеры: 30,0250,25 м). Исследования с помощью ядерного магнитного резонанса (ЯМР) проводили для некоторых соединений на приборе Variant 300 МГц ЯМР (Palo Alto, CA). В качестве стандарта использовали триметилсилан или известный химический сдвиг растворителя. Некоторые образцы соединений исследовали при повышенных температурах (например, 75C), чтобы повысить растворимость образца. Чистоту некоторых соединений исследовали с помощью элементного анализа (Desert Analytics,Tucson, AZ). Температуры плавления определяли на приборе Laboratory Devices Mel-Temp (Holliston, MA). Препаративные разделения проводили с помощью хроматографической системы Flash 40 и KP-Sil,60A (Biotage, Charlottesville, VA) или с помощью колоночной флэш-хроматографии с использованием силикагеля (230-400 меш) в качестве насадки, или с помощью ВЭЖХ с использованием Waters 2767Sample Manager, С-18 колонки с обращенной фазой, 3050 мм, скорость потока 75 мл/мин. Типичными растворителями, использованными для системы Flash 40 Biotage и флэш-хроматографии, являлись дихлорметан, метанол, этилацетат, гексан, ацетон, водный раствор аммиака (или гидроксид аммония) и триэтиламин. Типичными растворителями, использованными для ВЭЖХ с обращенной фазой, являлись ацетонитрил в разных концентрациях и вода с добавлением 0,1% трифторуксусной кислоты. Следует понимать, что органические соединения, соответствующие предпочтительным вариантам осуществления, могут обладать таутомерией. Поскольку химические структуры в настоящем изобретении могут представлять только одну из возможных таутомерных форм, следует понимать, что предпочтительные варианты осуществления включают любую таутомерную форму изображенной структуры. Следует понимать, что настоящее изобретение не ограничивается вариантами осуществления, представленными в настоящем изобретении для иллюстрации, а включает все его формы, соответствующие объему приведенного выше описания. В примерах, приведенных ниже, а также во всем настоящем изобретении представленные ниже аббревиатуры обладают указанными значениями. Термины, для которых не приведены определения, обладают общепринятыми значениями. Раствор 4-хлор-3-нитропиридина (1,0 экв.) и пиперидина (2,0 экв.) в этаноле при концентрации 0,5 М перемешивали при КТ в течение 48 ч, затем этанол удаляли в вакууме. Остаток подвергали распределению между EtOAc (300 мл) и Na2CO3(нас.) (75 мл), затем промывали с помощью H2O (50 мл) и NaCl(нас.)(50 мл), сушили над MgSO4, фильтровали и летучие компоненты удаляли в вакууме и получали 3-нитро 4-(пиперидин-1-ил)пиридин (95%). ЖХМС (m/z): 207,7 (МН+); ЖХ Rt=1,60 мин. 1 Н ЯМР (CDCl3):8,80 (s, 1H), 8,31 (d, J=5,7, 1H), 6,84 (d, J=6,3, 1H), 3,18-3,21 (m, 4H), 1,64-1,78 (m,6H). Пример 2. Синтез трет-бутил-1-(3-нитропиридин-4-ил)пиперидин-3-илкарбамата По методике, приведенной в примере 1, 2,4-дихлор-5-нитропиримидин (1,0 экв.) и пиперидин (2,0 экв.) в EtOH выдерживали при температуре от 0C до КТ и после промывания 1 М раствором лимонной кислоты и 1 М раствором HCl (для удаления примеси бис-продукта) получали 2-хлор-5-нитро-4(пиперидин-1-ил)пиримидин (67%). ЖХМС (m/z): 242,9 (МН+); ЖХ Rt=4,09 мин.NaH (1,3 экв.), перемешивали в течение 1 ч и затем добавляли 4-хлор-3-нитропиридин (1,0 экв.). Реакционную смесь перемешивали при КТ в течение ночи, выливали в холодную воду и экстрагировали с помощью EtOAc. Органический слой сушили над Na2CO3, фильтровали, концентрировали и получали третбутил-2-(3-нитропиридин-4-илокси)этилкарбамат. ЖХМС (m/z): 284,1 (МН+); ЖХ Rt=2,09 мин.
МПК / Метки
МПК: C07D 401/12, C07D 213/78
Метки: киназы, способы, ингибиторы, применения
Код ссылки
<a href="https://eas.patents.su/30-19951-ingibitory-kinazy-pim-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы киназы pim и способы их применения</a>
Предыдущий патент: Оконечная часть для банки и банка с такой оконечной частью
Следующий патент: Устойчивые к гербицидам, ингибирующим ahas, растения подсолнечника с двумя различными аллелями ahasl1 и способы их применения
Случайный патент: 4-(гетероциклил)алкил-n-(арилсульфонил)индолсоединения и их применение в качестве 5-нт6 лигандов