4-(гетероциклил)алкил-n-(арилсульфонил)индолсоединения и их применение в качестве 5-нт6 лигандов
Номер патента: 16015
Опубликовано: 30.01.2012
Авторы: Рамакришна Нироджи Венката Сатья, Камбхампати Рама Састри, Джасти Венкатесварлу, Дешпанде Амол Динкар
Формула / Реферат
1. Соединение формулы (I)

где Ar представляет собой фенил, который может быть замещен одним или несколькими независимыми заместителями, выбранными из R1;
R1 представляет собой один или несколько независимых заместителей, выбранных из водорода, гидрокси, галогена, (C1-C3)алкила, галоген(C1-C3)алкила, (C1-C3)алкокси, галоген(C1-C3)алкокси, цикло(С3-C6)алкила или цикло(С3-С6)алкокси;
R2 представляет собой водород, галоген, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси;
R3 представляет собой водород, галоген, (C1-C3)алкил или галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси;
R представляет собой атом галогена, (C1-C3)алкильную или галоген(C1-C3)алкильную группу;
R4 и R5 представляют собой водород, галоген, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси.
2. Соединение по п.1, где Ar представляет собой фенил.
3. Соединение по п.1, где R1 представляет собой водород, галоген, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси, галоген(C1-C3)алкокси, цикло(С3-С6)алкил или цикло(С3-C6)алкокси.
4. Соединение по любому из предшествующих пунктов, где R2 представляет собой водород, галоген, (C1-C3)алкил, галоген(C1-С3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси.
5. Соединение по любому из предшествующих пунктов, где R3 представляет собой водород, галоген, (C1-C3)алкил или галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси.
6. Соединение по любому из предшествующих пунктов, где как R4, так и R5 представляют собой водород.
7. Соединение по п.1, выбираемое из группы, включающей
1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(4-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(2-бром-4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(2-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(3-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(2,4-дифторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-(2,5-дихлор-3-тиофенсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(5-бром-2-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(2-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(2,6-дифторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(2,6-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(3-хлор-2-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(2-хлор-4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-бензолсульфонил-3-бром-4-(4-метилпиперазин-1-илметил)-1H-индол;
3-бром-1-(2-бром-4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-бром-1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-бром-1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-бром-1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
3-бром-1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
3-бром-1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
3-бром-1-(1-нафтилсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
3-бром-1-(5-хлор-2-метокси-4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-(2-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
3-хлор-1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-(1-нафтилсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
3-хлор-1-(5-хлор-2-метокси-4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(2-бромбензолсульфонил)-4-(пиперазин-1-илметил)-1Н-индол дигидрохлорид;
1-бензолсульфонил-4-(пиперазин-1-илметил)-1Н-индол дигидрохлорид;
1-(4-метилбензолсульфонил-4-(пиперазин-1-илметил)-1Н-индол дигидрохлорид;
1-нафтилсульфонил-4-(4-метилпиперазин-1-илметил)-1Н-индол;
1-(2,4-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол;
1-бензолсульфонил-5-гидрокси-3-метил-4-(4-метилпиперазин-1-илметил)-1H-индол;
его стереоизомер и соль.
8. Способ получения соединения формулы (I) по п.1, включающий контактирование соединения формулы (а)
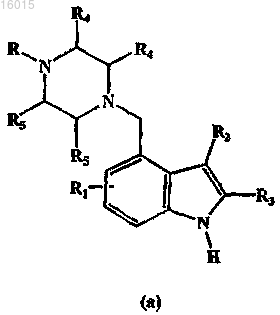
с арилсульфонилсоединением формулы ArSO2Cl с использованием подходящего инертного растворителя, выбранного из группы, включающей ДМСО, ДМФА, ацетонитрил, ТГФ, простой диэтиловый эфир и/или простой дифениловый эфир, и основания при температуре от 0 до 25°С, с получением соединения формулы (I), где все заместители такие, как определено в п.1.
9. Способ по п.8, где указанные основания выбирают из гидридов щелочных металлов и гидридов щелочно-земельных металлов.
10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель, разбавитель, реципиент или сольват вместе с терапевтически эффективным количеством соединения по п.1, его стереоизомеров, фармацевтически приемлемых солей и любой подходящей комбинацией указанных выше соединений.
11. Фармацевтическая композиция по п.10, которая находится в форме таблетки, капсулы, порошка, пастилок, суппозиториев, сиропа, раствора, суспензии или инъецируемой форме, где упомянутую форму вводят в одной дозе или в многократных унифицированных дозах.
12. Применение соединения по любому из пп.1-7 для получения лекарственного средства для лечения и предупреждения заболеваний, связанных с 5-НТ6 рецептором.
Текст
Настоящее изобретение относится к новым 4-(гетероциклил)алкил-N-(арилсульфонил) индолсоединениям формулы (I), их производным, стереоизомерам, фармацевтически приемлемым солям и содержащим их фармацевтически приемлемым композициям. Настоящее изобретение также относится к способу получения упомянутых выше новых соединений, их производных, стереоизомеров, фармацевтически приемлемых солей и к содержащим их фармацевтически приемлемым композициям. Такие соединения применимы при лечении различных расстройств,которые связаны с 5-НТ 6 рецепторными функциями. Конкретно, соединения данного изобретения также применимы при лечении различных расстройств CNS, гематологических расстройств,расстройств пищевого поведения, заболеваний, связанных с болью, респираторных заболеваний,урогенитальных расстройств, сердечно-сосудистых заболеваний и рака. Рамакришна Нироджи Венката Сатья,Камбхампати Рама Састри, Дешпанде Амол Динкар, Джасти Венкатесварлу (IN)(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД 016015 Область изобретения Настоящее изобретение относится к новым 4-(гетероциклил)алкил-N-(арилсульфонил)индолсоединениям формулы (I), их производным, стереоизомерам, фармацевтически приемлемым солям и содержащим их фармацевтически приемлемым композициям. Данное изобретение также относится к способу получения вышеуказанных новых соединений, их производных, стереоизомеров, фармацевтически приемлемых солей и содержащих их фармацевтически приемлемых композиций. Такие соединения применимы при лечении различных расстройств, которые связаны с 5-НТ 6 рецепторными функциями. Конкретно, соединения данного изобретения также применимы при лечении различных расстройств CNS, гематологических расстройств, расстройств пищевого поведения, заболеваний,связанных с болью, респираторных заболеваний, урогенитальных расстройств, сердечно-сосудистых заболеваний и рака. Уровень техники и предшествующий уровень техники изобретения Полагают, что различные расстройства центральной нервной системы, такие как тревога, депрессия, двигательные расстройства и т.д., связаны с нарушением нейротрансмиттера 5-гидрокситриптамина(5-НТ) или серотонина. Серотонин локализован в центральной и периферической нервных системах и,как известно, воздействует на многие типы заболеваний, включающих, среди других, психические расстройства, двигательную активность, расстройство пищевого поведения, половую активность и нейроэндокринное регулирование. 5-НТ рецепторные подтипы регулируют различные действия серотонина. Известное 5-НТ рецепторное семейство включает подтипы семейства 5-HT1 (например, 5-НТ 1 А), семейства 5-НТ 2 (например, 5-HT2A), 5-НТ 3, 5-НТ 4, 5-НТ 5, 5-НТ 6 и 5-НТ 7. Подтип рецептора 5-НТ 6 был впервые клонирован из ткани крысы в 1993 (Monsma, F.J.; Shen, Y.;Ward, R.P.; Hamblin, H.M., Molecular Pharmacology, 1993, 43, 320-327) и затем из ткани человека (Kohen,R.; Metcalf, M.A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D.R., Journal of Neurochemistry, 1996, 66, 47-56). Рецептор представляет собой рецептор, сопряженный с G-белком (GPCR), положительно связанный с аденилатциклазой (Ruat, М.; Traiffort, Е.; Arrang, J-M.; Tardivel-Lacombe, L.; Diaz, L.; Leurs, R.; Schwartz,J-K.; Biochemicsl Biophysical Research Communications, 1993, 193, 268-276). Рецептор обнаруживается почти исключительно в участках центральной нервной системы (CNS) как у крыс, так и у людей.In situ исследования гибридизации 5-НТ 6 рецептора в головном мозге крысы с использованием мРНК показывают главную локализацию в участках 5-НТ проекции, включающих полосатое тело, nucleus accumbens, обонятельный туберкул и структуру гиппокампа (Ward, R.P.; Hamblin, M.W.; Lachowicz,J.E.; Hoffman, B.J.; Sibley, D.R.; Dorsa, D.M., Neuroscience, 1995, 64, 1105-1111). Самые высокие уровни 5 НТ 6 рецепторных мРНК наблюдали в обонятельном туберкуле, полосатом теле, nucleus accumbens, зубчатых извилинах, а также и в участках CA1, СА 2 и СА 3 гиппокампа. Более низкие уровни 5-НТ 6 рецепторной мРНК наблюдали в гранулярном слое мозжечка, некоторых диэнцефалических ядрах, миндалевидном теле и в коре головного мозга. Методом назерн-блоттинга обнаружено, что 5-НТ 6 рецепторная мРНК, по-видимому, исключительно присутствует в головном мозге с небольшим признаком присутствия в периферических тканях. Высокое сродство ряда антипсихотических агентов к 5-НТ 6 рецептору, локализация его мРНК в полосатом теле, обонятельном туберкуле и nucleus accumbens позволяют предпологать, что некоторые из клинических действий таких соединений могут быть опосредованы через названный рецептор. Его способность связываться с широким рядом терапевтических соединений, применяемых в психиатрии, связанная с вызывающим интерес распределением в головном мозге, стимулирует значительный интерес к новым соединениям, которые способны взаимодействовать с указанным рецептором (ссылка: Sleight,A.J. et al. (1997) 5-НТ 6 and 5-HT7 receptors: molecular biology, functional correlates and possible therapeuticindications, Drag News Perspect. 10, 214-224). Прилагаются значительные усилия для понимания возможной роли 5-НТ 6 рецепторов в психиатрии, нарушении познавательной функции, двигательной функции и контроля, памяти, настроения и тому подобное. Соединения, которые демонстрируют связывающее сродство к 5-НТ 6 рецептору, настоятельно ищут как помощь в изучении 5-НТ 6 рецептора, так и как возможные терапевтические агенты для лечения расстройств центральной нервной системы, например,смотри Reavill С. and Rogers D.С., Current Opinion in Investigational Drugs, 2001, 2(1): 104-109, PharmaMonsma F.J. et al. (1003) and Kohen R. et al. (2001) показали, что некоторые трициклические антиде-1 016015 прессантные соединения, такие как амитриптилин, и нетипичные антидепрессантные соединения, такие как миансерин, обладают высоким сродством к 5-НТ 6 рецептору. Такие полученные данные привели к гипотезе, что 5-НТ 6 рецептор вовлекается в патогенез и/или лечение аффективных расстройств. Поведение модели грызуна, связанное с тревогой, дает в результате противоречивые результаты относительно роли 5-НТ 6 рецептора при тревоге. Обработка 5-НТ 6 рецепторными антагонистами увеличивает порог пароксизма у крысы в максимальном электрошоковом тесте [Stean, Т. et al. (1999) Anticonvulsant properties of the selective 5-HT6 receptor antagonist SB-271046 in the rat maximal electroshock seizure threshold test,Br. J. Pharmacol. 27, 131P; Ruotledge, С. et al. (2000) Characterization SB-271046: a potent, selective andorally active 5-HT6) receptor antagonist, Br. J. Pharmacol. 130, 1606-1612]. Даже если показано, что 5-НТ 6 рецепторы могут регулировать порог пароксизма, действие не является как явно выраженным, так и действием известных противосудорожных лекарственных средств. Понимание авторами роли 5-НТ 6 рецепторных лигандов наиболее продвинуто в двух терапевтических показаниях, в которых этот рецептор, вероятно, играет главную роль: расстройства функции обучаемости и памяти и аномальное пищевое поведение. Точная роль 5-НТ 6 рецептора еще устанавливается в других CNS показаниях, таких как тревога; хотя недавно один 5-НТ 6 агонист достиг фазы I клинических испытаний, точная роль рецептора все еще устанавливается и находится в центре значительного исследования. Имеется много потенциальных терапевтических применений для 5-НТ 6 рецепторных лигандов на людях, основанных на непосредственных действиях и на свидетельствах из доступных научных исследований. Такие исследования включают локализацию рацептора, сродство лигандов с известной активностью in vivo и различные исследования на животных, проводимые до сих пор. Предпочтительно проводят поиск антагонистических соединений 5-НТ 6 рецепторов как терапевтических агентов. Одно потенциальное терапевтическое применение модуляторов 5-НТ 6 рецепторных функций состоит в усилении познавательной способности и памяти при таких заболеваниях человека, как болезнь Альцгеймера. Высокие уровни рецептора, обнаруженные в таких структурах, как передний мозг, включая caudata/putamen (хвостатое тело/скорлупа чечевидного ядра), гиппокамп, nucleus accumbens и кору головного мозга, позволяют предположить роль рецептора в функции памяти и познавательной способности, поскольку известно, что данные участки играют жизненную роль в функции памяти (Gerard, С.;Martres, M.P.; Lefevre, K.; Miquel, М.С.; Verge, D.; Lanfumey, R.; Doucet, E.; Hamon, M.; Mestikawy E.I., S.,Brain Research, 1997, 746, 207-219). Способность известных 5-НТ 6 рецепторных лигандов усиливать холинергическую трансмиссию также позволяет предполагать потенциальное применение в отношении познавательной способности (Bentey, J.C.; Boursson, A.; Boess, F.G.; Kone, F.C.; Marsden, C.A.; Petit, N.;Sleight, A.J., British Journal of Pharmacology, 1999, 126 (7), 1537-1542). Исследования обнаружили, что известный 5-НТ 6 селективный антагонист значительно повышает уровни глутамата и аспартата во фронтальном участке коры головного мозга без повышения уровней норадреналина, допамина или 5-НТ. Такое селективное увеличение некоторых нейрохимических средств, отмеченное во время функции памяти и познавательной способности, убедительно позволяет предполагать роль 5-НТ 6 лигандов в познавательной функции (Dawson, L.A.; Nguyen, H.Q.; Li, P. BritishJournal of Pharmacology, 2000, 130 (1), 23-26). Исследования на животных функции памяти и обучаемости с известным селективным 5-НТ 6 антагонистом имеют некоторые положительные действия (Rogers, D.C.;Hatcher, P.D.; Hagan, J.J. Society of Neuroscience, Abstracts, 2000, 26, 680). Близкое потенциальное терапевтическое применение 5-HT6 лигандов представляет собой лечение расстройств с дефицитом внимания (ADD, также известных как расстройство с гиперактивностью и дефицитом внимания или ADHD) у детей, а также и взрослых. Так как 5-НТ 6 антагонисты, по-видимому,увеличивают активность допаминового пути, имеющего отношение к эфферентной связи черного вещества с полосатым телом, и ADHD связано с аномалиями в хвостатом ядре (Ernst, М.; Zametkin, A.J.; Matochik, J.H.; Jons, P.A.; Cohen, R.M., Journal of Neuroscience, 1998, 18(15), 5901-5907), 5-HT6 антагонисты могут ослаблять симптомы расстройств с дефицитом внимания. В настоящее время доступно немного полностью селективных агонистов. Агонист Wyeth WAY181187 в настоящее время находится в фазе I испытаний для нацеливания на тревогу [Cole, D.C. et al.Meet. (Aug 28-Sept 1, Washington DC), Abstract MEDI 17]. В международной патентной публикации WO 03/066056 A1 описано, что антагонизм 5-НТ 6 рецептора может промотировать нейрональный рост внутри центральной нервной системы млекопитающего. В другой патентной публикации WO 03/065046 А 2 описан новый вариант человеческого 5-НТ 6 рецептора и сделано предположение, что 5-НТ 6 рецептор связан с многочисленными другими расстройствами. В ранних исследованиях, изучавших сродство различных CNS лигандов с известным терапевтическим применением или сильным структурным сходством с известными лекарственными средствами,сделано предположение о роли 5-НТ 6 лигандов в лечении шизофрении и депрессии. Например, клозапин(эффективное клиническое антипсихотическое средство) обладает высоким сродством к 5-НТ 6 рецепторному подтипу. Кроме того, некоторые клинические антидепрессанты обладают высоким сродством к рецепторам, а также и действием как антагонисты такого сайта (Branchek, T.A.; Blackburn, T.P., Annual-2 016015 Далее, недавние исследования in vivo на крысах показали, что 5-НТ 6 модуляторы можно применять при лечении двигательных расстройств, включающих эпилепсию (Stean, Т.; Routledge, С.; Upton, N., British Journal of Pharmacology, 1999, 127 Proc. Supplement-131P; and Routlege, C.; Bromidge, S.M.; Moss, S.F.;Price, G.W.; Hirst, W.; Newman, H.; Riley, G.; Gager, Т.; Stean, Т.; Upton, N.; Clarke, S.E.; Brown, A.M., British Journal of Pharmacology, 2000, 30(7), 1606-1612). Взятые вместе вышеупомянутые исследования убедительно позволяют предположить, что названные соединения, которые представляют собой 5-НТ 6 рецепторные модуляторы, т.е. лиганды, можно применять для терапевтических показаний, включающих лечение заболеваний, связанных с недостаточностью памяти, познавательной способности и обучаемости, таких как болезнь Альцгеймера и расстройства с недостатком внимания; лечение таких расстройств личности, как шизофрения; лечение расстройства поведения, например тревоги, депрессии и обсессивно-компульсивных расстройств; лечение таких расстройств движения или моторной функции, как болезнь Паркинсона и эпилепсия; лечение заболеваний, связанных с нейродегенерацией, таких как инсульт или травма головы; или абстиненция в результате лекарственной аддикции, включающей аддикцию к никотину, алкоголю и злоупотребление другими веществами. Полагают также, что такие соединения применимы при лечении некоторых желудочно-кишечных(GI) расстройств, таких как функциональное кишечное расстройство, смотри, например, Roth, B.L.; et al.,Journal of Pharmacology and Experimental Therapeutics, 1994, 268, pages 1403-1412; Sibley, D.R.; et al., Molecular Pharmacology, 1993, 43, 320-327, Sleight, A.J.; et al., Neurotransmission, 1995, 11, 1-5 и Sleight, A.J.;et al., Serotonin ID Research Alert, 1997, 2(3), 115-118. Кроме того, описано действие 5-НТ 6 антагониста и 5-HT6 антисмысловых олигонуклеотидов для уменьшения потребления пищи у крыс, таким образом, возможно, для лечения ожирения, смотри, например, Bentey, J.C.; Boursson, A.; Boess, F.G.; Kone, F.C.; Marsden, С.A.; Petit, N.; Sleight, A.J., Britishstrategies to 5-HT6 receptor ligands as potential cognitive enhancers and antiobesity agents демонстрирует сложную дискуссию об эволюции 5-НТ 6 лигандов. Суммированы фармакологические инструментальные средства и предклинические кандидаты, применяемые при оценке 5-НТ 6 рецептора при таких заболеваниях, как шизофрения, других связанных с допамином расстройств и депрессии, и для профиля нейрохимических средств и электрофизиологических действий либо блокирования, либо активации 5-НТ 6 рецепторов. Кроме того, их применяют для характеристики 5-НТ 6 рецептора и для исследования его распределения. Известные до сих пор клинические кандидаты образуют части структур типа индола и являются полностью структурно аналогичными эндогенному лиганду 5-НТ, например соединения, описанныеMattsson, C. et al., 2-Alkyl-3-(1,2,3,6-tetrahygropyridin-4-yl)-1H-indoles as novel 5-НТ 6 receptor agonists, Bioorg. Med. Chem. Lett. 15, 4230-4234, 2005. Структурные функциональные зависимости описаны в разделе об индолоподобных структурах (и на стадии рецепторного моделирования, в которой Pullagurla et al. утверждают о различных связывающих сайтах для агонистов и антагонистов [Pullagurla, M.R. et al. (2004) Possible differences in modes ofagonist and antagonist binding at human 5-HT6 receptors. Bioorg. Med. Chem. Lett. 14, 4569-4573]. Большинство антагонистов, которые описаны, являются частью классов моноциклических, бициклических и трициклических арилпиперазинов [Bromidge, S.M. et al. (1999) 5-Chloro-N-(4-methoxy-3-piperazin-1ylphenyl)-3-methyl-2-benzothiophensulfonamide (SB-271046): A potent, selective and orally bioavailable 5HT6 receptor antagonist. J. Med. Chem. 42, 202-205; Bromidge, S.M. et al. (2001) Phenyl benzenesulfonamidesRo 63-0563: Potent and selective antagonists at human and rat 5-HT6 receptors. Br. J. Pharmacol. 124,(556-562). Кандидат антагониста фазы II от GlaxoSmithKline, SB-742457 для терапевтического показанияWO patent 2003080580], и соединение Lilly LY-483518 [Filla, S.A. et al. (2002) Preparation of benzenesulfonic acid indol-5-yl esters as antagonists of the 5-HT6 receptor. WO 20020608710]. Для SB-271046 прервано проведение клинической разработки фазы I первого 5-НТ 6 рецепторного антагониста (вероятно из-за низкой пенетрации через гематоэнцефалический барьер). Помимо этого, селективный 5-НТ 6 рецепторный антагонист SB-271046 является неактивным в тестах на животных, касающихся либо положительных, либо отрицательных симптомов шизофрении [Pouzet, В. et al. (2002) Effects of 5-HT6 receptor antagonist, SP-271046, in animal models for schisophrenia. Pharmacol. Biochem. Behav. 71, 635-643]. Международные патентные публикации WO 2004/055026 A1, WO 2004/048331 A1, WO 2004/048330A1 и WO 2004/048328 A2 (все относятся к Suven Life Sciences Limited) описывают аналогичный предшествующий уровень техники. Далее WO 98/27081, WO 99/02502, WO 99/37623, WO 99/42465 и WO 01/32646 (все относятся к Glaxo SmithKline Beecham PLC) описывают ряды арилсульфонамидных и сульфоксидных соединений в качестве 5-НТ 6 рецепторных антагонистов и утверждают применимость при лечении различных CNS расстройств. Несмотря на то что обнаружено несколько 5-НТ 6 модуляторов,сохраняется необходимость соединений, которые применимы для модулирования 5-НТ 6. Неожиданно обнаружено, что 4-(гетероциклил)алкил-N1-(арилсульфонил)индолсоединения формулы (I) демонстрируют очень высокое 5-НТ 6 рецепторное сродство. Таким образом, задача данного изобретения - получение соединений, которые применимы в качестве терапевтических агентов при лечении ряда расстройств центральной нервной системы или расстройств, подвергающихся влиянию 5-НТ 6 рецептора. Описание изобретения Настоящее изобретение относится к новым 4-(гетероциклил)алкил-N-(арилсульфонил)индолсоединениям общей формулы (I), их производным, стереоизомерам, фармацевтически приемлемым солям и содержащим их фармацевтически приемлемым композициям где Ar представляет собой фенил, нафтил, моноциклические или бициклические кольца, которые могут быть замещены одним или несколькими независимыми заместителями, выбранными из R1;R1 представляет собой один или несколько заместителей, выбранных из водорода, гидрокси, галогена, (C1-C3)алкила, галоген (C1-C3)алкила, (C1-C3)алкокси, галоген(C1-C3)алкокси, цикло(C3-C6)алкила или цикло(C3-C6)алкокси;R представляет собой атом водорода, (C1-C3)алкильную или галоген(C1-C3)алкильную группу;R4 и R5 представляют собой водород, галоген, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси. Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства для лечения или предупреждения расстройства, включающего селективное сродство в отношении 5-НТ 6 рецептора. Конкретно, соединения данного изобретения также применимы при лечении различных расстройств CNS, гематологических расстройств, расстройств пищевого поведения, заболеваний, связанных с болью, респираторных заболеваний, урогенитальных расстройств, сердечно-сосудистых заболеваний и рака. В другом аспекте изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) или его индивидуальных стереоизомеров, рацемической или нерацемической смеси стереоизомеров или фармацевтически приемлемых солей или сольватов в смеси по меньшей мере с одним подходящим носителем. В другом аспекте изобретение относится к композициям, включающим и способы применения соединений формулы (I). Еще в одном аспекте изобретение относится к применению терапевтически эффективного количества соединения формулы (I), к получению лекарственного средства для лечения или предупреждения расстройства, включающего эффективное сродство в отношении 5-НТ 6 рецептора. В одном аспекте изобретение дополнительно относится к способу получения соединений формулы-4 016015 Нижеследующее представляет собой отдельный список соединений, относящихся к общей формуле(I): 1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1(4-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2-бром-4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(3-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2,4-дифторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2,5-дихлор-3-тиофенсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(5-бром-2-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2,6-дифторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2,6-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(3-хлор-2-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2-хлор-4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-бензолсульфонил-3-бром-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(2-бром-4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-бром-1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(1-нафтилсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(5-хлор-2-метокси-4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(2-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(1-нафтилсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(5-хлор-2-метокси-4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2-бромбензолсульфонил)-4-(пиперазин-1-илметил)-1 Н-индол дигидрохлорид; 1-бензолсульфонил-4-(пиперазин-1-илметил)-1 Н-индол дигидрохлорид; 1-(4-метилбензолсульфонил)-4-(пиперазин-1-илметил)-1 Н-индол дигидрохлорид; 1-нафтилсульфонил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2,4-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-бензолсульфонил-5-гидрокси-3-метил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(4-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-6-гидрокси-1 Н-индол; 1-(4-гидроксибензолсульфонил)-5-метил-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(4-хлорбензолсульфонил)-6-метокси-4-(4-метилпиперазин-1-илметил)-1H-индол; 6-хлор-1-(4-хлорбензолсульфонил)-4-(3,4-диметилпиперазин-1-илметил)-3-метил-1 Н-индол; 6-хлор-1-(4-гидроксибензолсульфонил)-3-метил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 4-(3,4-диметилпиперазин-1-илметил)-1-(4-метоксибензолсульфонил)-1 Н-индол; 1-(4-фторбензолсульфонил)-4-(3-метокси-4-метилпиперазин-1-илметил)-1H-индол; 4-(3-хлор-4-метилпиперазин-1-илметил)-1-(4-метилбензолсульфонил)-1 Н-индол; 4-(4-метил-3-трифторметилпиперазин-1-илметил)-1-(4-метилбензолсульфонил)-1 Н-индол; 1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-2-трифторметил-1 Н-индол; его стереоизомер и соль. Подробное описание изобретения Если не упомянуто иначе, следующие термины, применяемые в описании и формуле изобретения,имеют значения, приведенные ниже по тексту."(C1-C3)алкил" означает имеющие нормальную или разветвленную цепь алкильные радикалы, содержащие от 1 до 3 углеродных атомов, и включает метил, этил, н-пропил и изопропил."(C1-C3)алкокси" означает имеющие нормальную или разветвленную цепь алкильные радикалы, со-5 016015 держащие от 1 до 3 углеродных атомов, и включает метокси, этокси, пропилокси и изопропилокси."Галоген(C1-C3)алкил" означает имеющие нормальную или разветвленную цепь алкильные радикалы, содержащие от 1 до 3 углеродных атомов, и включает фторметил, дифторметил, трифторметил,трифторэтил, фторэтил, дифторэтил и тому подобное."Галоген (C1-C3)алкокси" означает имеющие нормальную или разветвленную цепь алкильные радикалы, содержащие от 1 до 3 углеродных атомов, и включает фторметокси, дифторметокси, трифторметокси, трифторэтокси, фторэтокси, дифторэтокси и тому подобное."Цикло(C3-C6)алкокси" означает циклические или циклоалкильные радикалы с алкилом разветвленного строения, содержащие от 3 до 6 углеродных атомов, и включает циклопропилокси, циклобутилокси, циклопентилокси или циклогексилокси. Подразумевают, что "моноциклическая или бициклическая кольцевая система" означает как гетероарильные, так и гетероциклические кольца."Гетероарил" означает 5-6-членное моноциклическое ароматическое кольцо или конденсированные 8-10-членные бициклические ароматические кольца, содержащие 1-3 гетероатома, выбранные из кислорода, азота и серы. Подходящие примеры моноциклических ароматических колец включают тиенил, фурил, пирролил, триазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил,тиадиазолил, пиразолил, пиримидинил, пиридазинил, пиразинил и пиридил. Подходящие примеры конденсированных ароматических колец включают бензоконденсированные ароматические кольца, такие как хинолинил, изохинолинил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил, индолил, изоиндолил, индазолил, пирролопиридинил, бензофуранил, изобензофуранил, бензотиенил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил и тому подобное. Гетероарильные группы, как описано выше, могут быть связаны с остальной частью молекулы через углеродный атом или, когда присутствует, через подходящий атом азота, исключая те случаи, когда выше упомянуто иное."Гетероциклическое кольцо" означает 5-7-членное неароматическое кольцо, содержащее 1-3 гетероатома, выбранные из кислорода, азота и серы. Такие кольца могут быть частично ненасыщенными. Подходящие примеры гетероциклических колец включают пиперидинил, тетрагидропиридинил, пирролидинил, морфолинил, азепанил, диазепанил и пиперазинил. 5-7-членное гетероциклическое кольцо, как описано выше по тексту, может быть связано с остальной частью молекулы через углеродный атом или подходящий атом азота. Термин "шизофрения" означает шизофрению, форму шизофрении, расстройство, шизоаффективное расстройство и психотическое расстройство, где термин "психотическое" относится к бреду, заметным галлюцинациям, бессвязной речи или дезорганизованному или кататоническому поведению. Смотри Diagnostic and Statistical Manual of Mental Disorder, forth edition, American Psychiatric Association, Washington, D.C. Фраза "фармацевтически приемлемый" обозначает, что вещество или композиция должна быть совместима химически и/или токсикологически с другими ингредиентами, включающими препарат, и/или с млекопитающим, подвергаемым лечению таким средством."Терапевтически эффективное количество" означает количество соединения настоящего изобретения, которое: (i) лечит или предупреждает конкретное заболевание, патологическое состояние или расстройство, (ii) уменьшает, ослабляет или устраняет один или несколько симптомов конкретного заболевания, патологического состояния или расстройства, (iii) предупреждает или замедляет наступление одного или нескольких симптомов описанного здесь конкретного заболевания, патологического состояния или расстройства. Термины "обработка", "лечить" или "лечение" заключают в себе все значения, такие как предупреждающее, профилактическое и паллиативное. Термин "стереоизомеры" представляет собой общий термин для всех изомеров индивидуальных молекул, которые отличаются только с ориентацией их атомов в пространстве. Термин включает изомеры зеркального отображения (энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений более чем с одним хиральным центром, которые не являются зеркальными отображениями один другого(диастереомеры). Некоторые соединения формулы (I) способны существовать в стереоизомерных формах (т.е. диастереомеры и энантиомеры), и изобретение распространяется на каждую из этих стереоизомерных форм и на их смеси, включающие рацематы. Различные стереоизомерные формы можно отделять одну от другой обычными способами или любой взятый изомер можно получить стереоспецифическим или асимметрическим синтезом. Изобретение также распространяется на любые таутомерные формы и их смеси. Стереоизомеры, как правило, обычно получают в виде рацематов, которые можно разделить на оптически активные изомеры, по существу, известным способом. В случае соединений общей формулы (I),имеющих асимметрический атом углерода, настоящее изобретение относится к D-форме, L-форме и D,-6 016015L-смесям и в случае ряда асимметрических атомов углерода - к диастереомерным формам, и изобретение распространяется на каждую из этих стереоизомерных форм и на их смеси, включающие рацематы. Названные соединения общей формулы (I), которые имеют асимметрический атом углерода и, как правило,получаемые в виде рацематов можно отделить одно от другого обычными методами, или любой данный изомер можно получать стереоспецифическим или асимметрическим синтезом. Однако возможно также использование оптически активного соединения вначале, причем соответственно оптически активное или диастереомерное соединение затем получали в качестве конечного соединения. Стереоизомеры соединений общей формулы (I) можно получать одним или несколькими путями,представленными ниже по тексту.i. Можно применять один или несколько реагентов в оптически активной форме.ii. В способе восстановления можно использовать оптически чистый катализатор или хиральные лиганды вместе с металлическим катализатором. В способе восстановления можно использовать металлические катализаторы. Металлическим катализатором может быть родий, рутений, индий и тому подобное. Хиральными лигандами предпочтительно могут быть хиральные фосфины (Principles of Asymmetric synthesis, J. E.Baldwin Ed., Tetrahedron series, 14, 311-316).iii. Смеси стереоизомеров можно разделить такими общепринятыми способами, как образование диастереомерных солей с хиральными кислотами или хиральными аминами, или с хиральными аминоспиртами, хиральными аминокислотами. Полученную в результате смесь диастереомеров затем можно разделить такими способами, как фракционная кристаллизация, хроматография и тому подобное, которые следуют за дополнительной стадией выделения оптически активного продукта гидролизом производного (Jacqueve et al., "Enantiomers, Racemates and Resolution", Wiley Interscience, 1981).iv. Смеси стереоизомеров можно разделить такими общепринятыми способами, как микробное разделение, разделение диастереомерных солей, образованных с хиральными кислотами или хиральными основаниями. Хиральными кислотами, которые можно использовать, могут быть винная кислота, миндальная кислота, молочная кислота, камфорсульфоновая кислота, аминокислоты и тому подобное. Хиральными основаниями, которые можно использовать, могут быть хинные алкалоиды, бруцин или такая аминокислота основного характера, как лизин, аргинин и тому подобное. В случае соединений общей формулы (I),включающих геометрические изомеры, настоящее изобретение относится ко всем таким геометрическим изомерам. Подходящие фармацевтически приемлемые соли будут очевидны для специалиста в области техники и включают те, которые описаны в J. Pharm. Sci., 1977, 66, 1-19, такие как аддитивные соли с кислотой, образованные с неорганическими кислотами, например хлористо-водородной, бромистоводородной, серной, азотной или фосфорной кислотой; и органическими кислотами, например янтарной,малеиновой, уксусной, фумаровой, лимонной, винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотами. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, представляющие собой часть данного изобретения, можно получать обработкой соединения формулы (I) 1-6 экв. такого основания, как гидрид натрия, метоксид натрия, этоксид натрия, гидроксид натрия, трет-бутоксид калия, гидроксид кальция, ацетат кальция, хлорид кальция, гидроксид магния, хлорид магния и тому подобное. Можно применять такие растворители, как вода, ацетон, простой эфир, ТГФ, метанол, этанол, трет-бутанол, диоксан, изопропанол, простой изопропиловый эфир или их смеси. Помимо фармацевтически приемлемых солей в изобретение включены другие соли. Соли могут служить в качестве промежуточных продуктов при очистке соединений, при получении других солей или для идентификации и характеристики соединений или промежуточных продуктов. Соединения формулы (I) можно получать в кристаллической или некристаллической форме, если в кристаллической, то соли могут быть необязательно сольватированными, например в виде гидрата. Данное изобретение включает в свой объем стехиометрические сольваты (например, гидраты), а также соединения, содержащие переменные количества растворителя (например, воды). Настоящее изобретение также предлагает способ получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает следующий путь, где ключевой промежуточный продукт синтезировали различными способами, известными в литературе. Промежуточный продукт дополнительно обрабатывали следующим образом: Способ данного изобретения включает контактирование соединения следующей формулы (а): где все заместители представляют собой такие, как описано ранее, с арилсульфонилсоединением формулы ArSO2Cl, где Ar представляет собой как определено для соединений формулы (I), в присутствии инертного растворителя и соответствующего основания при подходящей температуре, с получением соединения формулы (I), которое, если требуется, можно затем функционализировать. В предыдущей патентной заявке авторов WO 2004/048330 А 1 представлено больше подробностей о реакционных условиях и реагентах, применяемых в вышеупомянутых взаимных превращениях соединений формулы (I). Взаимодействие производного индола с арилсульфонилхлоридами (ArSO2Cl) может происходить в присутствии инертного органического растворителя, который включает ароматические углеводороды,такие как толуол, о-, м-, п-ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол; простые эфиры, такие как простой диэтиловый эфир, простой дифениловый эфир,простой диизопропиловый эфир, простой трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран; нитрилы, такие как ацетонитрил и пропионитрил; спирты, такие как метанол, этанол, н-пропанол, нбутанол, трет-бутанол, и также ДМФА (N,N-диметилформамид), ДМСО (N,N-диметилсульфоксид), и воду. Перечень предпочтительных растворителей включает ДМСО, ДМФА, ацетонитрил и ТГФ. Можно применять их смеси в различных отношениях. Подходящие основания представляют собой обычно такие неорганические соединения, как гидроксиды щелочных металлов и гидроксиды щелочно-земельных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид кальция; оксиды щелочных металлов и оксиды щелочно-земельных металлов, такие как оксид лития, оксид натрия, оксид магния и оксид кальция; гидриды щелочных металлов и гидриды щелочно-земельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; амиды щелочных металлов и амиды щелочно-земельных металлов, такие как амид лития, амид натрия, амид калия и амид кальция; карбонаты щелочных металлов и карбонаты щелочно-земельных металлов, такие как карбонат лития и карбонат кальция; а также гидрокарбонаты щелочных металлов и гидрокарбонаты щелочно-земельных металлов,такие как гидрокарбонат натрия; органометаллические соединения, в особенности алкилсоединения щелочных металлов, такие как метиллитий, бутиллитий, фениллитий; алкилмагнийгалогениды, такие как метилмагнийхлорид, алкоксиды щелочных металлов и алкоксиды щелочно-земельных металлов, такие как метоксид натрия, этоксид натрия, этоксид калия, трет-бутоксид калия и диметоксимагний, сверх того, органические основания, например триэтиламин, триизопропиламин и N-метилпиперидин, пиридин. Особенно предпочтительны гидроксид натрия, метоксид натрия, этоксид натрия, гидроксид калия, карбонат калия и триэтиламин. Соответственно реакцию можно осуществлять в присутствии межфазного-8 016015 катализатора, такого как тетра-н-бутиламмонийгидросульфат и тому подобное. Инертную атмосферу можно поддерживать с применением инертных газов, таких как N2, Ar или He, длительность реакции можно поддерживать в интервале от 1 до 24 ч, предпочтительно от 2 до 6 ч. Если требуется, полученное в результате соединение сохраняют в виде его соли. Соединения, полученные вышеназванным способом получения настоящего изобретения, можно превратить в другое соединение данного изобретения дополнительными химическими модификациями хорошо известной реакции, такой как окисление, восстановление, защита, удаление защиты, реакция перегруппировки, галогенирование, гидроксилирование, алкилирование, алкилтиолирование, деметилирование, О-алкилирование, O-ацилирование, N-алкилирование, N-алкенилирование, N-ацилирование, Nцианирование, N-сульфонилирование, реакция сочетания с применением переходных металлов и тому подобное. Если необходимо, можно проводить любую одну или более чем одну из следующих стадий:i) превращение соединения формулы (I) в другое соединение формулы (I);ii) удаление любых защитных групп илиiii) образование его фармацевтически приемлемой соли, сольвата или пролекарства. Способ (i) можно осуществлять с применением общепринятых методов взаимного превращения,таких как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное ароматическое замещение, и гидролиз сложного эфира или образование амидной связи. В способе (ii) примеры защитных групп и средства для их удаления можно найти в публикацииT.W. Greene "Protective Groups in Organic Synthesis" (J. Wiley and Sons, 1991). Подходящие аминные защитные группы включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые можно удалять гидролизом (например, с применением такой кислоты, как хлористоводородная или трифторуксусная кислота) или путем восстановления (например, гидрогенолизом бензильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы с применением цинка в уксусной кислоте) как целесообразно. Другие подходящие аминные защитные группы включают трифторацетил, который можно удалять катализированным основанием гидролизом, или связанную смолой в твердую фазу бензильную группу, такую как связанную смолой Меррифилд 2,6 диметоксибензильную группу, (линкер Эллмана), которую можно удалять гидролизом, катализированным кислотой, например трифторуксусной кислотой. В способе (iii) можно осуществлять галогенирование, гидроксилирование, алкилирование и/или фармацевтически приемлемые соли можно получать как общепринято реакцией взаимодействия с подходящей кислотой или кислотным производным, как подробно описано ранее. Для того чтобы применять соединения формулы (I) в терапии, их обычно должны приготавливать в фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Фармацевтические композиции настоящего изобретения можно приготавливать общепринятым способом с применением одного или нескольких фармацевтически приемлемых носителей. Таким образом, активные соединения изобретения можно приготавливать для перорального, трансбуккального, интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или для ректального введения или формировать подходящим образом для введения путем ингаляции или инсуффляции. Для перорального введения фармацевтические композиции могут находиться в форме, например,таблеток или капсул, приготовленных общепринятыми средствами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, преджелатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза,микрокристаллическая целлюлоза или фосфат кальция); смазывающие агенты (например, стеарат магния, тальк или оксид кремния); дезинтегрирующие агенты (например, картофельный крахмал или гликолят натрийкрахмала); или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами, хорошо известными в области техники. Жидкие препараты для перорального введения могут находиться в форме, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для получения состава с водой или другим подходящим растворителем перед применением. Такие жидкие препараты можно получать общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные растворители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил или пропил-п-гидроксибензоаты либо сорбиновая кислота). Для трансбуккального введения композицию можно получать в форме таблеток или пастилок, приготовленных общепринятым способом. Активные соединения изобретения можно приготавливать для парентерального введения путем инъекции, включающим применение общепринятых методов катетеризации или инфузии. Препараты для инъекции могут быть представлены в унифицированной лекарственной форме, например в ампулах или-9 016015 в контейнерах с множеством доз, с добавленным консервантом. Композиции можно получать в таких формах, как суспензии, растворы или эмульсии в масляных или водных растворителях и могут содержать такие агенты для приготовления, как суспендирующие, стабилизирующие и/или диспергирующие агенты. В альтернативном случае активный ингредиент может быть в форме порошка для реконструирования перед применением с подходящим растворителем, например стерильной апирогенной водой. Активные соединения изобретения можно также приготавливать в ректальных композициях, таких как суппозитории или удерживаемые клизмы, например, содержащие общепринятые для суппозитория основы, такие как масло какао или другие глицериды. Для интраназального введения или введения путем ингаляции активные соединения изобретения удобно доставлять в форме аэрозольного спрея из контейнера под давлением или распылителя, или из капсулы с применением ингалятора или инсуффлятора. В случае аэрозоля под давлением подходящий пропеллент, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и единицу дозирования можно установить применением клапана для доставки отмеряемого количества. Лекарственное средство для контейнера под давлением или распылителя может содержать раствор или суспензию активного соединения, в то время как для капсулы он предпочтительно должен быть в форме порошка. Капсулы или картриджи (сделанные, например, из желатина) для применения в ингаляторе или инсуффляторе можно приготавливать с содержанием порошковой смеси соединения изобретения и подходящей порошковой основы, такой как лактоза или крахмал. Аэрозольные препараты для лечения патологических состояний, упомянутых выше по тексту (например, мигрени) у среднего взрослого человека предпочтительно приспособлены так, что каждая отмеряемая доза или "пуфф" аэрозоля содержит от 20 до 1000 мкг соединения изобретения. Суммарная суточная доза с аэрозолем будет находиться в интервале от 100 мкг до 10 мг. Вводить можно несколько раз в день, например 2, 3, 4 или 8 раз, подавая, например, 1, 2 или 3 дозы каждый раз. Для получения лекарственного средства можно применять эффективное количество соединения общей формулы (I) или его производных, как определено выше по тексту, вместе с общепринятыми фармацевтическими вспомогательными агентами, носителями и добавками. Такая терапия включает множество вариантов: например, введение двух совместимых соединений одновременно в одной форме дозы или введение каждого соединения индивидуально в отдельной дозе; или, если требуется, с одинаковыми временными интервалами или раздельно для того, чтобы максимизировать полезное действие или минимизировать возможные побочные действия лекарственных средств,согласно известным принципам фармакологии. Доза активных соединений может различаться в зависимости от таких факторов, как путь введения,возраст и масса пациента, природа и тяжесть заболевания, подвергаемого лечению, и подобных факторов. Поэтому любая ссылка здесь на фармакологически эффективное количество соединений общей формулы (I) относится к вышеупомянутым факторам. Предполагаемая доза активных соединений данного изобретения либо для перорального, парентерального, назального, либо трансбуккального введения среднему взрослому человеку для лечения патологических состояний, названных выше по тексту, составляет от 0,1 до 200 мг активного ингредиента на единицу дозы, которую можно вводить, например, от 1 до 4 раз в день. Для иллюстративных целей представленная здесь схема реакции предусматривает возможные пути синтеза соединений настоящего изобретения, а также и ключевые промежуточные продукты. Более подробное описание отдельных стадий реакции смотри в разделе "Примеры". Специалисту в области техники будет очевидно, что для синтеза соединений изобретения можно применять другие пути синтеза. Хотя специфические исходные вещества и реагенты изображены на схемах и обсуждаются ниже по тексту,другие исходные вещества и реагенты можно легко заменить для обеспечения ряда производных и/или реакционных условий. Помимо этого, многие из соединений, полученных способами, описанными ниже по тексту, можно дополнительно модифицировать в аспекте данного описания с применением общепринятой химии, хорошо известной специалисту в области техники. Имеющиеся в коммерции реагенты применяли без дополнительной очистки. Комнатная температура относится к 25-30 С. ИК-спектры получали с применением KBr и в твердом состоянии. Если не указано иное, все масс-спектры выполняли с применением условий ESI. 1 Н ЯМР спектры регистрировали при 400 МГц на приборе Bruker. В качестве растворителя применяли дейтерированный хлороформ (99,8% D). В качестве внутреннего ссылочного стандарта применяли ТМС. Величины химических сдвигов выражали в величинах частей на миллион . Применяли следующие аббревиатуры для многообразия сигналов ЯМР: с означает синглет, ушир. с означает уширенный синглет, д означает дублет, т означает триплет, кв означает квартет, кви означает квинтет, г означает гептет, дд означает двойной дуплет, дт означает двойной триплет, тт означает триплет триплетов, м означает мультиплет. Термин хроматография относится к колоночной хроматографии, выполняемой с применением силикагеля 60-120 меш и осуществляемой в условиях под давлением азота (флэш-хроматография). Новые соединения настоящего изобретения получали способами согласно следующих схем и примеров с применением подходящих веществ и дополнительно проиллюстрировали следующими конкретными примерами. Наиболее предпочтительные соединения изобретения представляют собой любое или- 10016015 все соединения, конкретно предложенные в этих примерах. Однако названные соединения не должны быть истолкованы как образующие единственный тип, который рассматривается как изобретение, и любая комбинация соединений или их частей сама может образовывать тип соединений. Следующие примеры дополнительно иллюстрируют подробности получения соединений настоящего изобретения. Специалисты в области техники будут легко понимать, что известные варианты условий и способ следующих препаративных методов можно применить для получения таких соединений. Пример 1. Получение (4-метилпиперазин-1-илметил)-1 Н-индола. Стадия (i). Получение (2-метил-3-нитрофенил)-(4-метилпиперазин-1-ил)метанона. 2-Метил-3-нитробензойную кислоту (5,525 ммоль, 1,0 г) помещали в 25-мл двухгорлую круглодонную колбу, соединенную с холодильником, снабженным защитной трубкой. К этому добавляли тионилхлорид (6,07 ммоль, 0,735 г) и 1,2-дихлорэтан (5 мл) и раствор кипятили с обратным холодильником в течение периода 3 ч. Данную реакционную смесь добавляли в другую 100-мл колбу, содержащую раствор N-метилпиперазина (16,57 ммоль, 1,66 г) в 10 мл 1,2-дихлорэтана, поддерживая температуру ниже 5 С. Затем реакционную смесь перемешивали в течение 0,5 ч при 25 С. После завершения реакции реакционную смесь выливали в 50 мл воды. Собирали слой 1,2-дихлорэтана, промывали водой (210 мл),насыщенным раствором соли (10 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Полученную густую сиропообразную массу соединения применяли на следующей стадии реакции без очистки. Стадия(5,7033 ммоль) и пирролидин (5,7033 ммоль) и кипятили с обратным холодильником в течение перода 6 ч. После завершения реакции реакционную смесь выливали на 20 г ледяной воды, подщелачивали 20% раствором NaOH (до рН 10) и смесь экстрагировали этилацетатом (230 мл). Объединенные этилацетатные экстракты затем промывали водой (230 мл), насыщенным раствором соли 30 мл и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Такую густую сиропообразную массу соединения применяли на следующей стадии реакции без очистки. Стадия (iii). Получение (1 Н-индол-4-ил)-(4-метилпиперазин-1-ил)метанона.(полученный на стадии (ii помещали в 25-мл двухгорлую круглодонную колбу, соединенную с холодильником, в атмосфере азота. К этому добавляли ТГФ (7 мл), с последующим никелем Ренея (Ra-Ni)(0,1 г, 10% мас./мас.). К вышеупомянутой реакционной смеси добавляли гидразингидрат (14,54 ммоль,0,73 г) таким образом, чтобы начиналось кипячение реакционной смеси с обратным холодильником. Затем реакционную смесь кипятили с обратным холодильником в течение 3 ч. После завершения реакцииRa-Ni удаляли фильтрованием, ТГФ и метанол отгоняли и концентрат разбавляли водой (20 мл), подщелачивали 20% раствором гидроксида натрия до рН 10 и смесь экстрагировали этилацетатом (230 мл). Затем объединенные этилацетатные экстракты промывали водой (230 мл), насыщенным раствором соли 30 мл и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Такую густую сиропообразную массу соединения очищали на колонке с силикагелем этилацетатом и триэтиламином (от 0,2 до 1,0%) в качестве элюентов. Стадия (iv). Получение (4-метилпиперазин-1-илметил)-1 Н-индола. Литийалюминийгидрид (LAH) (2,4 691 ммоль, 0,0938 г) помещали в 25-мл двухгорлую круглодонную колбу, соединенную с холодильником, в атмосфере азота. К этому добавляли (1 Н-индол-4-ил)-(4 метилпиперазин-1-ил)метанон (2,0576 ммоль, 0,5 г) (полученный на стадии (iii, растворенный в 5 мл ТГФ, и кипятили массу с обратным холодильником в течение периода 2 ч. После завершения реакции реакционную смесь охлаждали до 25 С и гасили медленным добавлением охлажденной на льду воды для разложения избытка LAH. Полученный в результате осадок гидроксида алюминия удаляли фильтрованием над hy-flow. От этой эмульсии отгоняли ТГФ и концентрат разбавляли водой (20 мл), подщелачивали 20% раствором гидроксида натрия до рН 10 и смесь экстрагировали этилацетатом (220 мл). Затем объединенные этилацетатные экстракты промывали водой (220 мл), насыщенным раствором соли, 20 мл, и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Неочищенное соединение очищали на силикагелевой колонке этилацетатом и триэтиламином (от 0,2 до 1,0%) в качестве элюентов. Пример 2. Получение 1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1 Н-индола.(4-Метилпиперазин-1-илметил)-1H-индол (0,8733 ммоль, 0,2 г) [полученный по примеру 1] растворяли в 2 мл N,N-диметилформамида. Затем вышеупомянутый раствор медленно добавляли в 25-мл колбу, содержащую суспензию гидрида натрия (1,31 ммоль, 31,4 мг) в 1 мл ДМФА, в атмосфере азота, в тоже время поддерживая температуру ниже 10 С. Затем реакционную смесь перемешивали в течение 1 ч- 11016015 при 25 С. К такому хорошо перемешиваемому раствору медленно добавляли бензолсульфонилхлорид(1,31 ммоль, 0,2312 г), в то же время поддерживая температуру ниже 10 С. Затем реакционную смесь перемешивали в течение периода 2 ч. После завершения реакции реакционную смесь при перемешивании выливали на 20 г смесь льда с водой и полученную в результате смесь экстрагировали этилацетатом(220 мл). Объединенные этилацетатные экстракты затем промывали водой (20 мл), насыщенным раствором соли (20 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Соединение очищали на силикагелевой колонке этилацетатом и триэтиламином (от 0,2 до 1,0%) в качестве элюентов. ИК спектры (см-1): 1676, 1447, 1292, 1164, 1371. Масса (m/z): 370 (М+Н)+. 1 Н-ЯМР (ч./млн): 2,26 (3 Н, с), 2,42 (8 Н, ушир. с), 3,68 (2 Н, с), 6,90-6,91 (1 Н, д), 7,16-7,18 (1 Н, д),7,22-7,26 (1 Н, м), 7,42-7,46 (2 Н, м), 7,51-7,53 (1 Н, м), 7,55-7,56 (1 Н, д), 7,88-7,90 (3 Н, м). Пример 3. Следующие соединения изобретения (2-42) получали следующим способом, как описано в примере 2, с некоторыми некритическими изменениями Пример 4. Следующие соединения изобретения (43-52) могут быть получены специалистом в области техники следующим способом, описанным в примере 2. Пример 5. Измерение потребления пищи (поведенческая модель). Использовали самцов крыс Wistar (120-140 г), полученных из N.I.N. (National Institute of Nutrition,Hyderabad, India). Затем хроническое действие соединений общей формулы (I) на потребление пищи у хорошо откормленных крыс определяли следующим способом. Крыс помещали в клетки с отдельными помещениями на 28 дней. Во время этого периода крысам вводили дозу либо перорально, либо интраперитонеально, с композицией, включающей соединение формулы (I), либо с соответствующей композицией (растворителя) без упомянутого соединения (контрольная группа), один раз в день. Крыс обеспечивали кормом и водой ad libitum. На 0, 1, 7, 14, 21 и 28 день крыс оставляли с предварительно взвешенным количеством корма. Потребление пищи и прирост массы измеряли на общепринятом основании. Способ (измерения) потребления корма описан в литературе (Kask et al., European Journal of Pharmacology, 414, 2001, 215-224 и Turnball et al., Diabetes, vol. 51, August, 2002, и некоторые внутренние модификации). Соответствующие части описаний включены здесь в качестве ссылки, и они образуют часть описания изобретения. Некоторые репрезентативные соединения продемонстрировали статистически значимое уменьшение потребления пищи при введении вышеупомянутым способом в дозе либо 10, либо 30 мг/кг, либо в обеих дозах. Пример 6. Таблетка, включающая соединение формулы Ингредиенты объединяли и гранулировали с применением такого растворителя, как метанол. Затем состав сушили и изготавливали в виде таблеток (содержащих приблизительно 20 мг активного соединения) с помощью соответствующего устройства для изготовления таблеток. Пример 7. Композиция для перорального введения Ингредиенты смешивали и распределяли в капсулы, содержащие приблизительно 100 мг каждая; одна капсула будет приблизительно равна суммарной суточной дозе. Ингредиенты смешивали с образованием суспензии для перорального введения. Пример 9. Парентеральный препарат Активный ингредиент растворяли в части воды для инъекции. Затем добавляли при перемешивании достаточное количество хлористого натрия для получения изотонического раствора. Раствор дополняли до массы оставшейся частью воды для инъекции, фильтровали через мембранный фильтр 0,2 мкм и упаковывали в стерильных условиях. Пример 10. Препарат суппозитория Ингредиенты сплавляли вместе и перемешивали на паровой бане и выливали в формы, содержащие 2,5 г суммарной массы. Пример 11. Местнодействующий препарат Все ингредиенты, кроме воды, объединяли и нагревали приблизительно до 60 С при перемешивании. Затем добавляли достаточное количество воды приблизительно при 60 С при энергичном перемешивании для эмульгирования ингредиентов и затем добавляли воду, сколько требуется, приблизительно 100 г. Пример 12. Модель задачи распознавания объекта. Свойства усиления познавательной способности соединений данного изобретения оценивали с применением модели познавательной способности животного: модель задачи распознавания объекта. В качестве экспериментальных животных использовали самцов крыс Wistar (230-280 г), полученных от N.I.N. (National Institute of Nutrition, Hyderabad, India). В каждую клетку помещали четырех животных. Животных держали на 20% пищевой депривации за один день до тестирования, давали воду adlibitum на протяжении эксперимента и содержали при 12-часовом цикле свет/темнота. Крыс также поселяли в индивидуальные места на 1 ч в отсутствие каких-либо объектов. Одна группа из 12 крыс получала растворитель (1 мл/кг) перорально и другой набор животных по- 19016015 лучал соединение формулы (I) либо перорально, либо интраперитонеально за 1 ч до ознакомления (Т 1) и выбора испытания (Т 2). Эксперимент выполняли в камере "открытое поле" 505050 см, изготовленной из акрила. В фазе ознакомления (Т 1) крыс помещали отдельно в открытое поле на 3 мин, в котором находились в двух смежных углах, 10 см от стенок, два идентичных объекта (пластиковые бутылки, высота 12,5 смдиаметр 5,5 см), покрытых только желтой маскирующей лентой (a1 и а 2). Через 24 ч испытание (Т 1) на долговременный тест памяти нескольких крыс помещали в туже самую арену, в какую их помещали в испытании Т 1. Фаза выбора (Т 2) предоставляла возможность крысам обследовать открытое поле в течение 3 мин в присутствии одного знакомого объекта (а 3) и одного нового объекта (b) (стеклянная бутылка янтарного цвета, высотой 12 см и диаметром 5 см). Знакомые объекты представлены похожими текстурами, цветом и размерами. Во время испытания Т 1 и Т 2 исследование каждого объекта (обозначенного как обнюхивание, облизывание, жевание или движение вибриссами, в то же время наведение носа к объекту на расстояние менее чем 1 см) записывали раздельно секундомером с остановкой. Сидение на объекте не принимали во внимание как испытательную активность, однако это наблюдали редко. Т 1 представляет собой суммарное время, затраченное на исследование знакомых объектов (a1+a2),Т 2 представляет собой суммарное время, затраченное на исследование знакомого объекта и нового объекта (а 3+b). Тест распознавания объекта проводили, как описано Ennaceur, A., Delacour, J., 1988, A new one-trialtest for neurobiological studies of memory in rats - Behavioral data, Behav. Brain Res., 31, 47-59. Некоторые репрезентативные соединения демонстрировали положительные действия, указывающие на увеличение распознавания нового объекта viz; увеличенное время исследования в отношении нового объекта и более высокий индекс различения. Пример 13. Индукция жевания/зевоты/потягивания R антагонистами 5-НТ 6. Использовали самцов крыс Wistar массой 200-250 г. Крысам вводили инъекции растворителя и помещали в отдельные прозрачные камеры на 1 ч каждый день в течение 2 дней перед днем тестирования для привыкания их к камерам наблюдения и процедуре тестирования. В день тестирования крыс помещали в камеры наблюдения немедленно после введения лекарственного средства и непрерывно наблюдали за поведением, зевотой, потягиванием и жеванием, от 60 до 90 мин после инъекций лекарственного средства или растворителя. За 60 мин до введения лекарственного средства всем животным вводили интраперитонеально фитостигмин, 0,1 мг/кг. Среднее число зеваний, потягиваний и праздных жевательных движений регистрировали в течение 30-минутного периода наблюдения. Ссылки: (A) King M.V., Sleight A.J., Woolley M.L., and et al., Neuropharmacology, 2004, 47, 195-204.Pharmacology, 1999, 126 (7), 1537-1542). Пример 14. Испытание - водный лабиринт. Устройство водного лабиринта состоит из круглого бассейна (диаметром 1,8 м, высотой 0,6 м),сконструированного в черном Perspex (системы TSE, Германия), наполненного водой (242 С), и расположенной внизу широкоугольной видеокамеры для прослеживания животного. 10-см 2 платформу perspex, лежащую на 1 см ниже поверхности воды, помещали в центре одного из четырех квадрантов отображения, который оставался постоянным для всех крыс. Черный Perspex, применяемый в конструкции бассейна и платформы, не предоставлял ориентиры внутри бассейна для управления поведением бегства. В противоположность этому комната выработки навыков предоставляла несколько значительных визуальных ориентиров вне бассейна, чтобы помочь формированию пространственной карты, необходимой для обучаемости избеганию. Применяли автоматизированную систему слежения, [Videomot 2 (5.51), системы TSE, Германия]. Эта программа анализирует видиоизображения, получаемые через цифровую камеру и пульт обнаружения изображения, которые определяли длину пути, скорость плавания и некоторое количество вхождений и продолжительность времени, затраченного на плавание в каждом квадранте водного бассейна. Ссылка: (A)Yamada N., Hattoria A., Hayashi Т., Nishikawa Т., Fukuda H., et al., Pharmacology, Biochem. And Behaviour, 2004, 78, 787-791, (B) Linder M.D., Hodges D.B., Hogan J.B., Corsa J.A., et al., TheJournal of Pharmacology and Experimental Therapeutics, 2003, 307 (2), 682-691. Пример 15. Устройство пассивного избегания. У животных вырабатывали навык в однократном испытании, скачкообразно, парадигма пассивного уклонения свет-темнота. Устройство для выработки навыка состоит из камеры длиной 300 мм, шириной 260 мм и высотой 270 мм, сконструированной по общепринятым чертежам. Передняя сторона и верх были прозрачными, обеспечивающими возможность экспериментатору наблюдать поведение животного внутри устройства. Камера разделена на два отделения, разделенных центральной задвижкой, которая снабжена отверстием 50 мм ширины и 75 мм высоты, установленным близко к передней стороне камеры. Меньшее из отделений имело размер 9 мм в ширину, и содержало источник освещения низкой мощности(6 Вт). Большее отделение имело размер 210 мм в ширину и было неосвещенным. Пол такого темного отделения состоял из решетки из 16 горизонтальных неокрашенных стальных прутьев, которые были- 20016015 диаметром 5 мм и с зазором на расстоянии 12,5 мм. Генератор тока, подававший 0,75 мА на решетку пола, который скремблировали (пропускали) один раз каждые 0,5 с через 16 полосок. Вычисляли интервал сопротивления 40-60 мкОм для контрольной группы крыс и соответственно калибровали устройство. Электронная схема, детектирующая сопротивляемость животного, обеспечивала точность доставки тока автоматическим изменением напряжения с изменением сопротивляемости. Экспериментальная методика. Эксперимент выполняли, как описано ранее (Fox et al., 1995). Использовали взрослых самцов крысWistar. Животных приносили в лабораторию за 1 ч до эксперимента. На день выработки навыков животных помещали мордой к задней стороне освещенного отделения устройства. Таймер включали, как только животное полностью поворачивалось мордой к передней стенке камеры. Время ожидания для вхождения в темную камеру регистрировали (обычно 20 с) и после завершения вхождения в темное отделение к животному неизбежно применяли шок на лапы 0,75 мА в течение 3 с. Затем возвращали в клетки их местопребывания. Между каждыми сеансами выработки навыков у животных оба отделения камеры очищали для удаления любых путающих обоняние сигналов. Повтор такого ингибирующего стимула вычисляли через 24, 72 ч и на 7 день после выработки навыка возвращением животного в освещенную камеру и регистрированием их времени ожидания для вхождения в темную камеру, применяли критерий времени 300 с. Ссылки: (A) Callahan P.M., Ilch СР., Rowe N.B., Tehim A., Abst. 776.19.2004, Society for neuroscience,2004, (B) Fox G.B., Connell A.W.U., Murphy K.J., Regan С.М., Journal of Neurochemistry, 1995, 65, 6, 27962799. Пример 16. Анализ на связывание в отношении 5-НТ 6 рецептора человека. Материалы и способы. Источник рецептора: человеческий рекомбинант, экспрессированный в клетки HEK293. Радиолиганд: [3H]LSD (60-80 кюри/ммоль). Конечная концентрация лиганда - [1,5 нМ]. Неспецифический детерминант: метиотепинмезилат - [0,1 мкМ]. Ссылочное соединение: метиотепинмезилат. Положительный контроль: метиотепинмезилат. Условия инкубирования. Реакции осуществляли в 50 мкМ TRIS-HCl (рН 7,4), содержащем 10 мкМ MgCl2, 0,5 мМ ЭДТА в течение 60 мин при 37 С. Реакцию завершали быстрой вакуумной фильтрацией на стекловолокнистых фильтрах. Определяли радиоактивность, улавливаемую на фильтрах, и сравнивали с контрольными значениями для того, чтобы установить какие-либо взаимодействия тестируемых соединений с клонированным серотонин 5-HT6 связывающим сайтом. Литературная ссылка: Monsma F.J.Jr., et al., Molecular Cloning and Expression of Novel Serotonin Receptor with High Affinity for Tricyclic Psychotropic, Drugs. Mol. Pharmacol. (43): 320-327 (1993). Пример 17. 5-HT6 функциональный анализ циклического AMP. Антагонистическое свойство соединений у человеческих 5-HT6 рецепторов определяли тестированием их действия на аккумуляцию сАМР в стабильно трансфектированных клетках HEK293. Связывание агониста с человеческим 5-НТ 6 рецептором будет приводить к увеличению активности аденилциклазы. Соединение, которое является агонистом, будет демонстрировать увеличение продуцирования сАМР и соединение, которое является антагонистом, будет блокировать агонистическое действие. Человеческие 5-НТ 6 рецепторы клонировали и стабильно экспрессировали в клетки HEK293. Такие клетки культивировали в 6 луночных планшетах в среде DMEM/F12 с 10% фетальной коровьей сывороткой (FCS) и 500 мкг/мл G418 и инкубировали при 37 С в инкубаторе с CO2. Клеткам предоставляли возможность роста приблизительно до 70% конфлюентности перед началом эксперимента. На день эксперимента культуральные среды удаляли и клетки промывали однократно средой без сыворотки (SFM). Добавляли 2 мл сред SFM+IBMX и инкубировали при 37 С в течение 10 мин. Среды удаляли и к соответствующим лункам добавляли свежие среды SFM+IBMX, содержащие различные соединения и 1 мкМ серотонина (в качестве антагониста), и инкубировали в течение 30 мин. После инкубирования среды удаляли и клетки промывали однократно 1 мл PBS (буферированного фосфатом физиологического раствора соли). Каждую лунку обрабатывали 1 мл холодного 95% этанола и 5 мкМ ЭДТА (2:1) при 4 С в течение 1 ч. Затем клетки соскабливали и переносили в пробирки Эппендорфа. Пробирки центрифугировали в течение 5 мин при 4 С и супернатанты сохраняли при 4 С до проведения анализа. Содержание сАМР определяли EIA (ферментативным иммуноанализом) с применением набораAmersham Biotrak сАМР EIA (Amersham RPN 225). Применяли метод такой, как описан для набора. Вкратце, сАМР определяли путем конкуренции между немеченого сАМР и фиксируемым количеством меченного пероксидазой сАМР за связывающие сайты на антителе против сАМР. Антитело иммобилизовали на полистирольных микротитрационных лунках, предварительно покрытых вторым антителом. Реакцию начинали добавлением 50 мкл меченного пероксидазой сАМР к образцу (100 мкл), предварительно инкубированному с антисывороткой (100 мл), в течение 2 ч при 4 С. После 1 ч инкубирования при 4 С несвязанный лиганд отделяли методом простого промывания. Затем добавляли ферментный субстрат, триметилбензидин (1), и инкубировали при комнатной температуре в течение 60 мин. Реакцию останавливали добавлением 100 мл 1,0 М серной кислоты и полученную в результате окраску считывали спектрофотометром на микротитрационном планшете при 450 нм в пределах 30 мин. В функциональном аденилилциклазном анализе обнаружено, что некоторое количество соединения данного изобретения представляет собой конкурирующий антагонист с хорошей селективностью по сравнению с рядом других рецепторов, включающих другие серотониновые рецепторы, такие как 5-HT1A и 5-НТ 7. Пример 18. Фармакокинетическое исследование на грызунах. В качестве экспериментального животного применяли самцов крыс Wistar (230-280 г), полученных от N.I.N (National Institute of Nutrition, Hyderabad, India).- 22016015 От трех до пяти животных помещали в каждую клетку. Животных содержали на 20% пищевой депривации за 1 день до эксперимента, давали воду ad libitum на всем протяжении эксперимента и содержали при 12-часовом цикле свет/темнота. Одна группа крыс получала соединение NCE (3-30 мг/кг) перорально, а другая группа животных получала такое же соединение внутривенно. В каждой временной точке кровь собирали через яремную вену. Плазму сохраняли замороженной при -20 С до анализа. Концентрации соединения NCE в плазме определяли с применением метода ЖХМС/МС. Схема временных точек: перед дозированием 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 ч после дозирования (n=3). В плазме количественно определяли соединения NCE сертифицированным методом ЖХМС/МС с применением методики экстракции в твердой фазе. Соединения NCE определяли количественно в калибровочном интервале 2-2000 нг/мл в плазме и гомогенизате головного мозга. Исследуемые образцы анализировали с применением в серии калибровочных образцов и удовлетворяющие требованиям контрольные образцы распределяли по всей серии. Фармакокинетические параметры Смаке, Тмакс, AUCt (площадь под частью кривой "концентрациявремя" от нуля до времени t), AUCinf, период полувыведения, объем распределения, клиренс, среднее время удерживания и тем самым пероральную биопригодность вычисляли посредством неделимой на части модели с применением программы WinNonlin версия 4.1. Пример 19. Исследование пенетрации в головной мозг на грызунах. В качестве экспериментального животного применяли самцов крыс Wistar (230-280 г), полученных от N.I.N (National Institute of Nutrition, Hyderabad, India). От трех до пяти животных помещали в каждую клетку. Животных содержали на 20% пищевой депривации за 1 день до эксперимента, давали воду ad libitum на всем протяжении эксперимента и содержали при 12-часовом цикле свет/темнота. Каждая группа животных получала соединение NCE (3-30 мг/кг) перорально или интраперитонеально. В каждой временной точке кровь собирали через яремную вену. Животных приносили в жертву,чтобы собрать ткань головного мозга и гомогенизировать. Плазму и головной мозг сохраняли замороженным при -20 С до анализа. Концентрации соединения NCE в плазме и головном мозге определяли с применением метода ЖХ-МС/МС. Схема временных точек: перед дозированием 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 ч после дозирования (n=3). Соединения NCE определяли количественно в плазме и гомогенизате головного мозга сертифицированным методом ЖХ-МС/МС с применением методики экстракции твердой фазы. Соединения NCE определяли количественно в калиброванном интервале 2-2000 нг/мл в плазме и гомогенизате головного мозга. Исследуемые образцы анализировали с применением в серии калибровочных образцов и удовлетворяющие требованиям образцы распределяли по всей серии. Фармакокинетические параметры Смаке, Тмакс, AUCt, AUCinf, период полувыведения, объем распределения, клиренс, среднее время удерживания и тем самым Cb/Ср, отношение NCE в головном мозге,в зависимости от плазмы, вычисляли посредством неделимой на части модели с применением компьютерной программы WinNonlin, версия 4.1. Пример 20. Микродиализное исследование головного мозга для возможного модулирования нейротрансмиттеров на грызунах. В качестве экспериментальных животных применяли самцов крыс Wistar (230-280 г), полученных от N.I.N (National Institute of Nutrition, Hyderabad, India). Групповое распределение. Группа 1: растворитель (вода; 5 мл/кг; через рот), группа 2: NCE (3 мг/кг; через рот), группа 3: NCE (10 мг/кг; через рот). Хирургическая процедура: крыс анестезировали хлоралгидратом и помещали в стереотаксическую рамку. Управляемую канюлю (СМА/12) помещали у АР: -5,2 мм, ML: +5,0 мм относительно от брегмы иDV: -3,8 мм от поверхности головного мозга согласно атласа Paxinos и Watson (1986). Пока животное еще было анестезировано, вставляли зонд микродиализа (СМА/12, 4 мм, PC) с помощью управляемой канюли и закрепляли в участке. После хирургического вмешательства поддерживали период восстановления 48-72 ч перед тем, как животное подвергали исследованию. За день до исследования животных переносили в домашние клетки для акклиматизации и имплантируемый зонд в течение ночи подвергали перфузии с модифицированным раствором Рингера, включающим 1,3 мкМ CaCl2 (Sigma), 1,0 мкМ MgCl2 (Sigma), 3,0 мкМ KCl (Sigma), 147,0 мкМ NaCl (Sigma),1,0 мкМ Na2HPO47H2O и 0,2 мкМ NaH2PO42H2O и 0,3 мкМ неостигминбромида (Sigma) (pH до 7,2), со скоростью 0,2 мкл/мин, устанавливаемой микроинфузионным насосом (PicoPlus, Harvard). На день эксперимента скорость перфузии изменяли до 1,2 мкл/мин и предоставляли возможность стабилизации в течение 3 ч. После периода стабилизации перед дозированием собирали четыре основы с интервалами 20 мин. Образцы диализата собирали в стеклянные пробирки с использованием охлаждаемого коллектора фракций СМА/170. Растворитель или NCE (3 или 10 мг/кг) вводили путем зондового питания после того, как собирали четыре фракции. Перфузат собирали вплоть до 6 ч после введения. Концентрации ацетилхолина в образцах диализата измеряли методом ЖХ-МС/МС (API 4000, MDSSCIEX). Ацетилхолин в диализатах количественно определяли в калибровочном интервале от 0,250 до 8,004 нг/мг. В завершение экспериментов микродиализа животных приносили в жертву, их головной мозг удаляли и сохраняли в 10% растворе формалина. Каждый головной мозг подвергали сплайсингу, 50 мк, на криостате (Leica), окрашивали и исследовали микроскопически для подтверждения местоположения зонда. Данные из животных с неправильным местоположением зонда отбрасывали. Данные микродиализа выражали как изменения в процентах (среднееS.E.M. (среднее квадратичное отклонение базовой линии, определяемые как среднее абсолютное значение (в fM/10 мкл) четырех образцов перед введением лекарственного средства. Действия обработок NCE (3 или 10 мг/кг) и растворителем статистически оценивали однократным путем ANOVA вслед за множественными сравнительными тестами Dunnett. Во всех статистических измерениях величину р 0,05 полагали как значимую. Данные статистически оценивали с помощью программы Graph Pad Prism. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где Ar представляет собой фенил, который может быть замещен одним или несколькими независимыми заместителями, выбранными из R1;R1 представляет собой один или несколько независимых заместителей, выбранных из водорода,гидрокси, галогена, (C1-C3)алкила, галоген(C1-C3)алкила, (C1-C3)алкокси, галоген(C1-C3)алкокси, циклоR представляет собой атом галогена, (C1-C3)алкильную или галоген(C1-C3)алкильную группу;R4 и R5 представляют собой водород, галоген, (C1-C3)алкил, галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси. 2. Соединение по п.1, где Ar представляет собой фенил. 3. Соединение по п.1, где R1 представляет собой водород, галоген, (C1-C3)алкил, галоген(C1C3)алкил, (C1-C3)алкокси, галоген(C1-C3)алкокси, цикло(С 3-С 6)алкил или цикло(С 3-C6)алкокси. 4. Соединение по любому из предшествующих пунктов, где R2 представляет собой водород, галоген, (C1-C3)алкил, галоген(C1-С 3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси. 5. Соединение по любому из предшествующих пунктов, где R3 представляет собой водород, галоген, (C1-C3)алкил или галоген(C1-C3)алкил, (C1-C3)алкокси или галоген(C1-C3)алкокси. 6. Соединение по любому из предшествующих пунктов, где как R4, так и R5 представляют собой водород. 7. Соединение по п.1, выбираемое из группы, включающей 1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(4-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2-бром-4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(3-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2,4-дифторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2,5-дихлор-3-тиофенсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(5-бром-2-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2,6-дифторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол;- 24016015 1-(2,6-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(3-хлор-2-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2-хлор-4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-бензолсульфонил-3-бром-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-бром-1-(2-бром-4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-бром-1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-бром-1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-бром-1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-бром-1-(1-нафтилсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-бром-1-(5-хлор-2-метокси-4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-бензолсульфонил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-[4-(1-метилэтил)бензолсульфонил]-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(2-бромбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(4-фторбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(4-метоксибензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 3-хлор-1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(1-нафтилсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 3-хлор-1-(5-хлор-2-метокси-4-метилбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2-бромбензолсульфонил)-4-(пиперазин-1-илметил)-1 Н-индол дигидрохлорид; 1-бензолсульфонил-4-(пиперазин-1-илметил)-1 Н-индол дигидрохлорид; 1-(4-метилбензолсульфонил-4-(пиперазин-1-илметил)-1 Н-индол дигидрохлорид; 1-нафтилсульфонил-4-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2,4-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(3-хлорбензолсульфонил)-4-(4-метилпиперазин-1-илметил)-1H-индол; 1-бензолсульфонил-5-гидрокси-3-метил-4-(4-метилпиперазин-1-илметил)-1H-индол; его стереоизомер и соль. 8. Способ получения соединения формулы (I) по п.1, включающий контактирование соединения формулы (а) с арилсульфонилсоединением формулы ArSO2Cl с использованием подходящего инертного растворителя, выбранного из группы, включающей ДМСО, ДМФА, ацетонитрил, ТГФ, простой диэтиловый эфир и/или простой дифениловый эфир, и основания при температуре от 0 до 25 С, с получением соединения формулы (I), где все заместители такие, как определено в п.1. 9. Способ по п.8, где указанные основания выбирают из гидридов щелочных металлов и гидридов щелочно-земельных металлов. 10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель, разбавитель, реципиент или сольват вместе с терапевтически эффективным количеством соединения по п.1, его стереоизомеров, фармацевтически приемлемых солей и любой подходящей комбинацией указанных выше соединений. 11. Фармацевтическая композиция по п.10, которая находится в форме таблетки, капсулы, порошка,пастилок, суппозиториев, сиропа, раствора, суспензии или инъецируемой форме, где упомянутую форму вводят в одной дозе или в многократных унифицированных дозах. 12. Применение соединения по любому из пп.1-7 для получения лекарственного средства для лечения и предупреждения заболеваний, связанных с 5-НТ 6 рецептором.
МПК / Метки
МПК: C07D 209/30, A61K 31/404, A61P 25/00
Метки: 4-(гетероциклил)алкил-n-(арилсульфонил)индолсоединения, применение, качестве, 5-нт6, лигандов
Код ссылки
<a href="https://eas.patents.su/26-16015-4-geterociklilalkil-n-arilsulfonilindolsoedineniya-i-ih-primenenie-v-kachestve-5-nt6-ligandov.html" rel="bookmark" title="База патентов Евразийского Союза">4-(гетероциклил)алкил-n-(арилсульфонил)индолсоединения и их применение в качестве 5-нт6 лигандов</a>
Предыдущий патент: Устройство и способ укладывания контейнеров сжимаемого типа в распределительный узел
Следующий патент: Способ и установка для термической обработки мелкозернистых твердых частиц
Случайный патент: Способ расснаряжения путём разрезания струёй жидкого аммиака с использованием сольватированных электронов












