Производные иминопиридина и их применение
Формула / Реферат
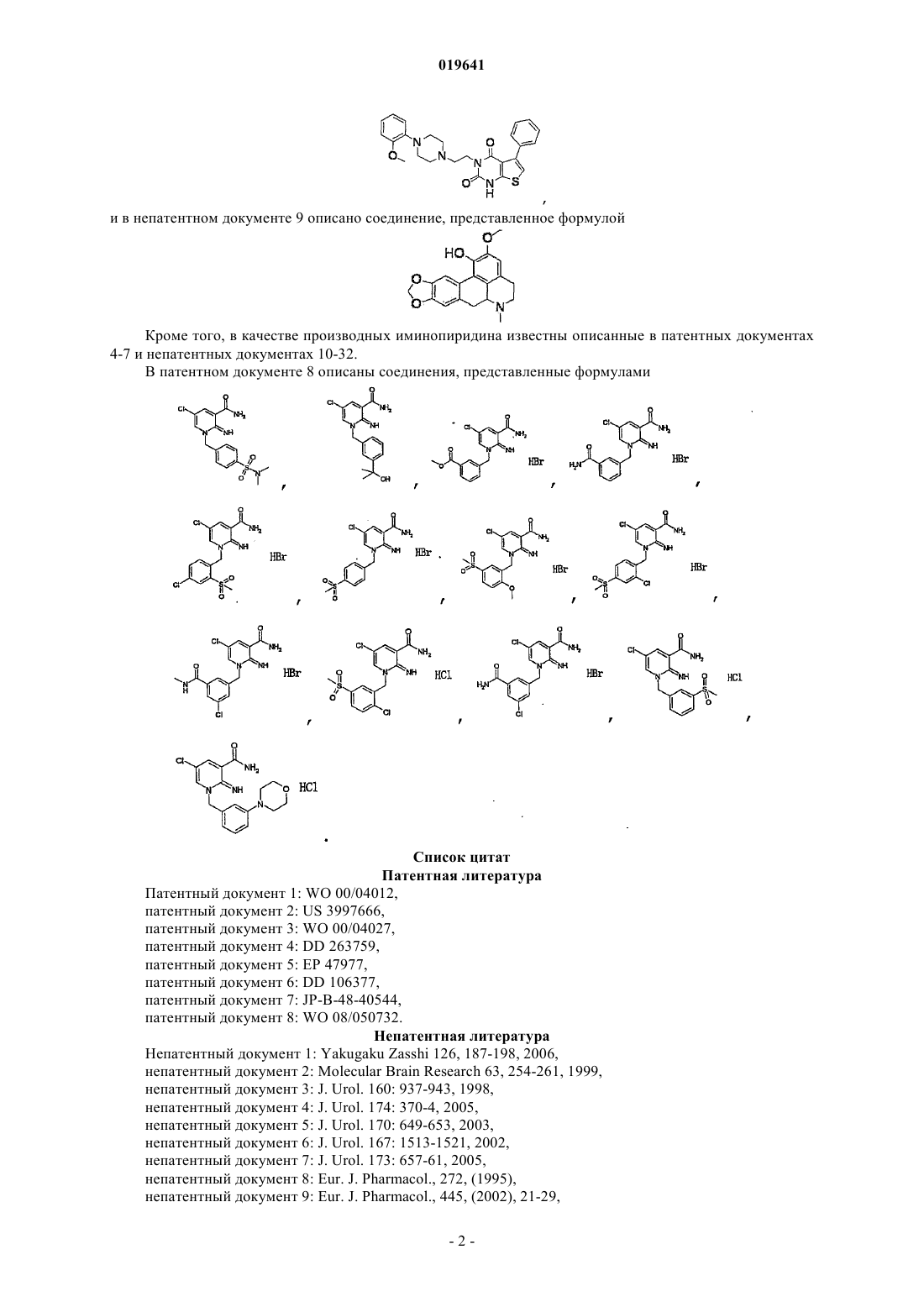
1. Соединение, представленное формулой
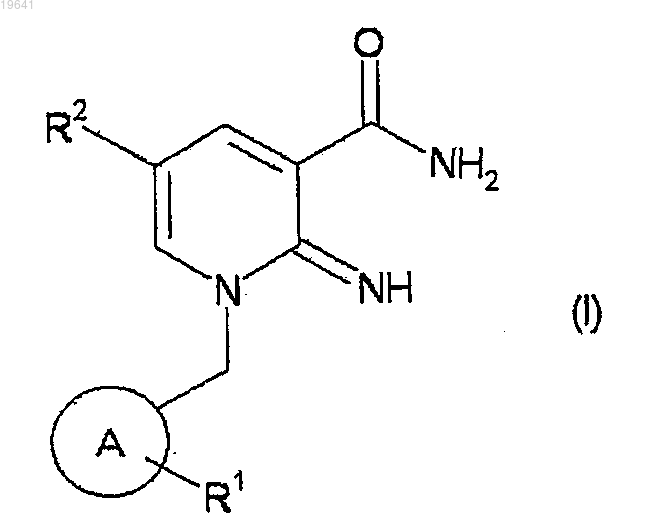
в которой
кольцо А- является C6-14 арильной группой, имеющей по меньшей мере один заместитель R1 и, необязательно, дополнительно имеющей заместитель,
R1 обозначает группу, выбранную из
(1) группы, представленной формулой -S(O)nR3, в которой R3 обозначает
1) C1-6 алкильную группу, необязательно замещенную от 1 до 3 C1-6 алкокси,
2) С3-7 циклоалкильную группу,
3) С6-14 арильную группу или
4) аминогруппу, необязательно замещенную 1 или 2 заместителями, выбранными из
(a) C1-6 алкила, необязательно замещенного от 1 до 3 C1-6 алкокси;
(b) С3-7 циклоалкила и
(c) С6-14 арила и
n равно целому числу 1 или 2,
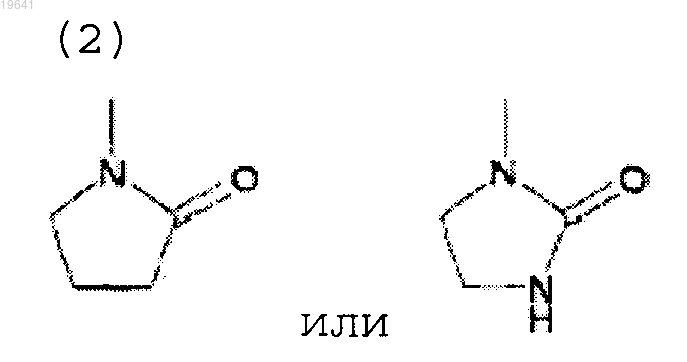
(3) карбамоильной группы, необязательно замещенной 1 или 2 C1-6 алкилом;
(4) карбамоильной группы или моно- или ди-С1-6 алкилкарбамоиламиногруппы,
(5) C1-6 алкоксикарбонильной группы и
(6) C1-6 алкильной группы, замещенной гидрокси;
R2 представляет собой атом галогена или C1-6 алкильную группу; и
кольцо А-, необязательно, дополнительно имеет, кроме R1, заместитель, выбранный из
1) атома галогена,
2) C1-6 алкокси, необязательно, имеющего от 1 до 3 атомов галогена, и
3) C1-6 алкила, необязательно, имеющего от 1 до 3 заместителей, выбранных из атома галогена и гидроксила, при условии, что исключены
5-хлор-1-{4-[(диметиламино)сульфонил]бензил}-2-имино-1,2-дигидропиридин-3-карбоксамид,
5-хлор-1-[3-(1-гидрокси-1-метилэтил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,
3-{[3-(аминокарбонил)-5-хлор-2-иминопиридин-1(2Н)-ил]метил}метилбензоат,
1-[3-(аминокарбонил)бензил]-5-хлор-2-имино-1,2-дигидропиридин-3-карбоксамид,
5-хлор-1-[4-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,
5-хлор-2-имино-1-[4-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,
5-хлор-2-имино-1-[2-метокси-5-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,
5-хлор-1-[2-хлор-4-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,
5-хлор-1-{3-хлор-5-[(метиламино)карбонил]бензил}-2-имино-1,2-дигидропиридин-3-карбоксамид,
5-хлор-1-[2-хлор-5-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,
1-[3-(аминокарбонил)-5-хлорбензил]-5-хлор-2-имино-1,2-дигидропиридин-3-карбоксамид и
5-хлор-2-имино-1-[3-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,
или его фармацевтически приемлемая соль.
2. Соединение или фармацевтически приемлемая соль по п.1, в котором кольцо А- является группой, представленной

в которой
R1 имеет значения, определенные в п.1, и
R4 обозначает атом галогена или C1-6 алкильную группу, необязательно, имеющую от 1 до 3 заместителей, выбранных из атома галогена и гидроксила.
3. Соединение или фармацевтически приемлемая соль по п.1, в котором кольцо А- является группой, представленной

в котором
R15 обозначает
(1) атом галогена,
(2) C1-6 алкоксигруппу, необязательно, имеющую от 1 до 3 атомов галогена, или
(3) С1-6 алкильную группу, необязательно, имеющую от 1 до 3 заместителей, выбранных из атома галогена и гидроксила,
m означает целое число от 0 до 2 и
другие символы имеют значения, определенные в п.1.
4. Соединение или фармацевтически приемлемая соль по п.3, в котором кольцо А- является группой, представленной
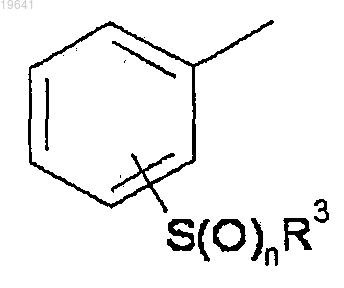
в котором каждый символ имеет значения, определенные в п.1.
5. 5-Хлор-1-[5-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль.
6. 5-Хлор-1-[5-хлор-2-(метилсульфинил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль.
7. 5-Хлор-1-[5-фтор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль.
8. 5-Хлор-1-[2-(этилсульфонил)-5-фторбензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль.
9. 5-Хлор-1-(5-хлор-2-сульфамоилбензил)-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль.
10. 5-Хлор-1-[5-хлор-2-(2-оксопирролидин-1-ил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль.
11. Антагонист адренорецептора α1D, содержащий соединение или фармацевтически приемлемую соль по п.1.
12. Средство для профилактики или лечения заболеваний нижних мочевыводящих путей, которое содержит соединение или фармацевтически приемлемую соль по п.1.
13. Способ профилактики или лечения заболеваний нижних мочевыводящих путей у млекопитающего, который включает введение млекопитающему эффективного количества соединения или фармацевтически приемлемой соли по п.1.
14. Применение соединения или фармацевтически приемлемой соли по п.1 для получения средства для профилактики или лечения заболеваний нижних мочевыводящих путей.
Текст
Настоящее изобретение относится к соединению - производному иминопиридина, имеющему антагонистическую активность в отношении адренергического рецептора 1D, которое может быть использовано в качестве средства для профилактики или лечения заболевания нижних мочевыводящих путей и т.п. Настоящее изобретение относится к соединению, представленному формулой в которой каждый символ имеет значения, определенные в описании, или к его соли.(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Область техники Настоящее изобретение относится к производным иминопиридина, имеющим превосходную селективную антагонистическую активность в отношении адренергического рецептора 1D (в дальнейшем для простоты изложения также называемого рецептором 1D) и пригодным для использования в качестве средства для профилактики или лечения заболевания нижних мочевыводящих путей и т.п., и к способу скрининга соединения, имеющего антагонистическую активность в отношении адренергического рецептора 1D. Уровень техники 1 адренергические рецепторы широко распространены в сердечно-сосудистой системе, нижних мочевыводящих путях и т.п. и участвуют в активности ответов симпатических нервов. Поскольку имеются предположения о наличии связи с такими патологиями, как артериальная гипертензия, кардиальная гипертрофия и дизурия, рецепторы 1 с некоторых пор привлекают внимание, и было сделано множество попыток разработать терапевтические препараты. В последние годы выяснилось, что блокаторы 1 являются эффективными для лечения дизурии, связанной с доброкачественной гипертрофией предстательной железы (ВРН). Вместе с перспективами на рынке это создало повышенный интерес (непатентный документ 1). Ген рецептора 1 был клонирован с конца 1980-х к началу 1990-х, и было выявлено наличие трех подтипов 1A, 1B и 1D. Было подтверждено, что среди них 1D экспрессируется во множестве тканей,таких как кровеносные сосуды, головной мозг, спинной мозг, желудочно-кишечный тракт, мочевой пузырь, почка и т.п. Несмотря на то что физиологическая функция рецептора 1D не была объяснена, антагонисты рецептора 1D могут представлять собой терапевтические средства для лечения различных заболеваний, так как они широко локализованы. Было подтверждено более широкое распространение рецепторов 1D в мочевом пузыре, ядрах парасимпатических нервов крестцового отдела спинного мозга и т.п. по сравнению с другими подтипами(непатентные документы 2, 3), что, таким образом, позволяет предположить выраженное участие в накоплении мочи. Фактически, имеется отчет относительно значительного увеличения емкости мочевого пузыря и разового объема опорожнения у мышей с нокаутом по 1D (непатентный документ 4). В недавних отчетах было задокументировано, что количественно экспрессия мРНК рецептора 1D увеличивается в мочевом пузыре пациентов с ВРН и в животной модели ВРН (непатентные документы 5 и 6), мышца мочевого пузыря, изолированная от пациентов ВРН, может показывать промотированную контрактильную функцию через рецептор 1D (непатентный документ 7) и т.п., что, таким образом, позволяет предположить возможное участие рецептора 1D, экспрессируемого в мочевом пузыре, в патологии ВРН. Исходя из вышесказанного, антагонист рецептора 1D является многообещающим как средство для профилактики или лечения заболеваний нижних мочевыводящих путей и т.п. Как примеры соединения, показывающего антагонистическую активность в отношении рецептора 1D, в непатентном документе 8 описано соединение, представленное формулой Кроме того, в качестве производных иминопиридина известны описанные в патентных документах 4-7 и непатентных документах 10-32. В патентном документе 8 описаны соединения, представленные формулами Список цитат Патентная литература Патентный документ 1: WO 00/04012,патентный документ 2: US 3997666,патентный документ 3: WO 00/04027,патентный документ 4: DD 263759,патентный документ 5: ЕР 47977,патентный документ 6: DD 106377,патентный документ 7: JP-B-48-40544,патентный документ 8: WO 08/050732. Непатентная литература Непатентный документ 1: Yakugaku Zasshi 126, 187-198, 2006,непатентный документ 2: Molecular Brain Research 63, 254-261, 1999,непатентный документ 3: J. Urol. 160: 937-943, 1998,непатентный документ 4: J. Urol. 174: 370-4, 2005,непатентный документ 5: J. Urol. 170: 649-653, 2003,непатентный документ 6: J. Urol. 167: 1513-1521, 2002,непатентный документ 7: J. Urol. 173: 657-61, 2005,непатентный документ 8: Eur. J. Pharmacol., 272, (1995),непатентный документ 9: Eur. J. Pharmacol., 445, (2002), 21-29,-2 019641Chemie (1980), 35B (4), 490-3,непатентный документ 20: Tetrahedron (1979), 35(21), 2591-3,непатентный документ 21: Fette, Seifen, Anstrichmittel (1980), 82(2), 82-6,непатентный документ 22: Tetrahedron (1979), 35(6), 809-12,непатентный документ 23: Journal of Chemical Society of Japan (1978), (5), 730-6,непатентный документ 24: Tetrahedron Letters (1977), (15), 1333-6,непатентный документ 25: Journal fuer Praktische Chemie (Leipzir) (1976), 318(5), 705-30,непатентный документ 26: Zeitschrift fuer Chemie (1973), 13(9), 342-3,непатентный документ 27: Journal of Chemical Society [Section] C: Organic (1971), (10), 1892-5,непатентный документ 28: Angewandte Chemie, International Edition in English (1971), 10(1), 68-70,непатентный документ 29: ChemicalPharmaceutical Bulletin (1969), 17(11), 2209-16,непатентный документ 30: ChemicalPharmaceutical Bulletin (1966), 14(8), 861-6,непатентный документ 31: Doklady Akademii Nauk SSSR (1949), 66, 647-50,непатентный документ 32: Ann. (1925), 443, 272-309. Сущность изобретения Целью настоящего изобретения является получение соединения, пригодного для использования в качестве средства для профилактики или лечения заболевания нижних мочевыводящих путей и т.п. Авторы настоящего изобретения провели интенсивные исследования ввиду вышеописанной ситуации и обнаружили, что соединение, представленное формулой в которой кольцо А- является C6-14 арильной группой, имеющей по меньшей мере один заместитель R1 и, необязательно, дополнительно имеющей заместитель,R1 обозначает группу, выбранную из(1) группы, представленной формулой -S(O)nR3, в которой R3 обозначает 1) C1-6 алкильную группу, необязательно замещенную от 1 до 3 C1-6 алкокси,2) С 3-7 циклоалкильную группу,3) С 6-14 арильную группу или 4) аминогруппу, необязательно замещенную 1 или 2 заместителями, выбранными из(a) С 1-6 алкила, необязательно замещенного от 1 до 3 С 1-6 алкокси;n равно целому числу 1 или 2,(4) карбамоильной группы или моно- или ди-С 1-6 алкилкарбамоиламиногруппы,(5) C1-6 алкоксикарбонильной группы иR2 представляет собой атом галогена или C1-6 алкильную группу;-3 019641 кольцо А-, необязательно, дополнительно имеет кроме R1 заместитель, выбранный из(3) C1-6 алкила, необязательно, имеющего от 1 до 3 заместителей, выбранных из атома галогена и гидроксила (в дальнейшем для простоты называемое соединением (I,или его соль имеет антагонистическую активность в отношении адренергического рецептора 1D,основанную на его особой химической структуре. На основании этого открытия они осуществили настоящее изобретение. Соответственно, настоящее изобретение относится к следующему: в которой кольцо А- является C6-14 арильной группой, имеющей по меньшей мере один заместитель R1 и, необязательно, дополнительно имеющей заместитель,R1 обозначает группу, выбранную из(1) группы, представленной формулой -S(O)nR3, в которой R3 обозначает 5) C1-6 алкильную группу, необязательно, замещенную от 1 до 3 C1-6 алкокси,6) С 3-7 циклоалкильную группу,7) С 6-14 арильную группу или 8) аминогруппу, необязательно, замещенную 1 или 2 заместителями, выбранными изn равно целому числу 1 или 2,(4) карбамоильной группы или моно- или ди-C1-6 алкилкарбамоиламиногруппы,(5) C1-6 алкоксикарбонильной группы иR2 представляет собой атом галогена или C1-6 алкильную группу; кольцо А-, необязательно, дополнительно имеет кроме R1 заместитель, выбранный из(3) C1-6 алкила, необязательно, имеющего от 1 до 3 заместителей, выбранных из атома галогена и гидроксила, при условии, что исключены 5-хлор-1-4-[(диметиламино)сульфонил]бензил-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[3-(1-гидрокси-1-метилэтил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,3-[3-(аминокарбонил)-5-хлор-2-иминопиридин-1(2 Н)-ил]метилметилбензоат,1-[3-(аминокарбонил)бензил]-5-хлор-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[4-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-2-имино-1-[4-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,5-хлор-2-имино-1-[2-метокси-5-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[2-хлор-4-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-3-хлор-5-[(метиламино)карбонил]бензил-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[2-хлор-5-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,1-[3-(аминокарбонил)-5-хлорбензил]-5-хлор-2-имино-1,2-дигидропиридин-3-карбоксамид и 5-хлор-2-имино-1-[3-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,или его фармацевтически приемлемая соль;[2] соединение согласно вышеуказанному [1], в которомR4 обозначает атом галогена или C1-6 алкильную группу, необязательно, имеющую от 1 до 3 заместителей, выбранных из атома галогена и гидроксила;[3] соединение согласно вышеуказанному [1], в котором кольцо А- является группой, представленнойR15 обозначает (1) атом галогена, (2) C1-6 алкоксигруппу, необязательно, имеющую от 1 до 3 атомов галогена, или (3) C1-6 алкильную группу, необязательно, имеющую от 1 до 3 заместителей, выбранных из атома галогена и гидроксила,m означает целое число от 0 до 2, и другие символы имеют значения, определенные в вышеуказанном [1];[4] соединение согласно вышеуказанному [1], в котором кольцо А- является группой, представленной в котором каждый символ имеет значения, определенные в вышеуказанном [1];[5] 5-хлор-1-[5-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль;[6] 5-хлор-1-[5-хлор-2-(метилсульфинил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль;[7] 5-хлор-1-[5-фтор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль;[8] 5-хлор-1-[2-(этилсульфонил)-5-фторбензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль;[9] 5-хлор-1-(5-хлор-2-сульфамоилбензил)-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль;[10] 5-хлор-1-[5-хлор-2-(2-оксопирролидин-1-ил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид или его фармацевтически приемлемая соль;[11] антагонист адренорецептора 1D, содержащий соединение или фармацевтически приемлемую соль согласно вышеуказанному [1];[12] средство для профилактики или лечения заболеваний нижних мочевыводящих путей, которое содержит соединение или фармацевтически приемлемую соль согласно вышеуказанному [1];[13] способ профилактики или лечения заболеваний нижних мочевыводящих путей у млекопитающего, который включает введение млекопитающему эффективного количества соединения или фармацевтически приемлемой соли согласно вышеуказанному [1];[14] применение соединения или фармацевтически приемлемой соли согласно вышеуказанному [1] для получения средства для профилактики или лечения заболеваний нижних мочевыводящих путей; и т.п. Выгодный эффект изобретения Соединение (I) согласно настоящему изобретению имеет превосходную селективную антагонистическую активность в отношении рецептора адреналина 1D и может быть использовано в качестве средства для профилактики или лечения заболевания нижних мочевыводящих путей и т.п. Подробное описание изобретения Настоящее изобретение объясняется подробно в следующей части описания. В формуле (I) примеры арильной группы включают C6-14 арильную группу, такую как фенил, 1- или 2-нафтил, 1- или 2-антрил и т.п.(1) группы, представленной формулой -S(O)nR3, в которой R3 обозначает 9) C1-6 алкильную группу, необязательно, замещенную от 1 до 3 C1-6 алкокси,10) С 3-7 циклоалкильную группу,11) С 6-14 арильную группу или 12) аминогруппу, необязательно, замещенную 1 или 2 заместителями, выбранными изn равно целому числу 1 или 2,(4) карбамоильной группы или моно- или ди-С 1-6 алкилкарбамоиламиногруппы,(5) C1-6 алкоксикарбонильной группы и(6) C1-6 алкильной группы, замещенной гидрокси. Примеры алкила включают C1-6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил,втор-бутил, трет-бутил, пентил, гексил и т.д.) и т.п. Примеры циклоалкила включают С 3-7 циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д.) и т.п. Примеры арила включают C6-14 арил (например, фенил, 1-нафтил, 2-нафтил, 2-бифенилил, 3 бифенилил, 4-бифенилил, 2-антрил и т.д.) и т.п. Примеры "аминогруппы, в случае необходимости имеющей заместитель(заместители)" для R3 включают группу, представленную -NR5R6, где R5 и R6 являются одинаковыми или разными, и каждый обозначает атом водорода, углеводородную группу, в случае необходимости имеющую заместитель(заместители), гетероциклическую группу, в случае необходимости имеющая заместитель(заместители), или ацильную группу. Примеры "гетероциклической группы" в "гетероциклической группе, в случае необходимости имеющей заместитель(заместители)" для R5 или R6 включают 3-8-членную гетероциклическую группу(предпочтительно 5- или 6-членную гетероциклическую группу), содержащую от 1 до 4 гетероатомов,выбранных из атома азота (в случае необходимости окисленного), атома кислорода, атом серы (в случае необходимости моно- или диокисленного) и т.п.; и группу, полученную из конденсированного кольца,образованного 3-8-членным гетероциклом (предпочтительно 5- или 6-членным гетероциклом), содержащим от 1 до 4 гетероатомов, выбранных из атома азота (в случае необходимости окисленного), атома кислорода, атома серы (в случае необходимости моно- или диокисленного) и т.п., и бензольным кольцом или 3-8-членным гетероциклом (предпочтительно 5- или 6-членным гетероциклом), содержащим от 1 до 4 гетероатомов, выбранных из атома азота (в случае необходимости окисленного), атома кислорода, атома серы (в случае необходимости моно- или диокисленного) и т.п., предпочтительно группу, полученную из конденсированного кольца, образованного 3-8-членным гетероциклом (предпочтительно 5- или 6 членным гетероциклом), содержащим от 1 до 4 гетероатомов, выбранных из атома азота (в случае необходимости окисленного), атома кислорода, атома серы (в случае необходимости моно- или диокисленного) и т.п., и бензольным кольцом. Частные примеры такой группы включают азиридинил (например, 1- или 2-азиридинил), азиринил(например, 1,2,3-триазол-1-, 4- или 5-ил, 1,2,4-триазол-1-, 3-, 4- или 5-ил), тетразолил (например, тетразол-1-, 2- или 5-ил), фурил (например, 2- или 3-фурил), тиенил (например, 2- или 3-тиенил), тиенил, в котором атом серы является окисленным (например, 2- или 3-тиенил-1,1-диоксид), оксазолил (например,2-, 4- или 5-оксазолил), изоксазолил (например, 3-, 4- или 5-изоксазолил), оксадиазолил (например, 1,2,3 оксадиазол-4- или 5-ил, 1,2,4-оксадиазол-3- или 5-ил, 1,2,5-оксадиазол-3-ил, 1,3,4-оксадиазол-2-ил), тиазолил (например, 2-, 4- или 5-тиазолил), изотиазолил (например, 3-, 4- или 5-изотиазолил), тиадиазолил(например, 1,2,3-тиадиазол-4- или 5-ил, 1,2,4-тиадиазол-3- или 5-ил, 1,2,5-тиадиазол-3-ил, 1,3,4 тиадиазол-2-ил), пирролидинил (например, 1-, 2- или 3-пирролидинил), пиридил (например, 2-, 3- или 4 пиридил), пиридил, в котором атом азота является окисленным (например, 2-, 3- или 4-пиридил-Nоксид), пиридазинил (например, 3- или 4-пиридазинил), пиридазинил, в котором один или оба атома азота являются окисленными (например, 3-, 4-, 5- или 6-пиридазинил-N-оксид), пиримидинил (например, 2-,4- или 5-пиримидинил), пиримидинил, в котором один или оба атома азота являются окисленными (например, 2-, 4-, 5- или 6-пиримидинил-N-оксид), пиразинил, пиперидил (например, 1-, 2-, 3- или 4 пиперидил), пиперазинил (например, 1- или 2-пиперазинил), индолил (например, 3 Н-индол-2-, 3-, 4-, 5-,6- или 7-ил), пиранил (например, 2-, 3- или 4-пиранил), тиопиранил (например, 2-, 3- или 4-тиопиранил),тиопиранил, в котором атом серы является окисленным (например, 2-, 3- или 4-тиопиранил-1,1-диоксид),морфолинил (например, 2-, 3- или 4-морфолинил), тиоморфолинил, хинолил (например, 2-, 3-, 4-, 5-, 6-,7- или 8-хинолил), изохинолил, пиридо[2,3-d]пиримидинил (например, пиридо[2,3-d]пиримидин-2-ил),нафтиридинил, такой как 1,5-, 1,6-, 1,7-, 1,8-, 2,6- или 2,7-нафтиридинил и т.п. (например, 1,5 нафтиридин-2- или 3-ил), тиено[2,3-d]пиридил (например, тиено[2,3-d]пиридин-3-ил), пиразинохинолил(например, пиразино[2,3-d]хинолин-2-ил), хроменил (например, 2 Н-хромен-2- или 3-ил), 2 бензо[b]тиенил, 3-бензо[b]тиенил, 2-бензо[b]фуранил, 3-бензо[b]фуранил и т.п. Примеры "заместителя", который "гетероциклическая группа" может иметь, включают заместители,подобные заместителям, которые может иметь "углеводородная группа" в вышеуказанной "в случае необходимости замещенной углеводородной группе" для R3, когда углеводородная группа представляет собой циклоалкил, арил или аралкил. Число заместителей составляет от 1 до 5, предпочтительно от 1 до 3. Примеры "ацильной группы" для R5 или R6 включают ацильную группу, полученную в случае необходимости из замещенной карбоновой кислоты, в случае необходимости замещенной оксикарбоновой кислоты, в случае необходимости замещенной сульфоновой кислоты, в случае необходимости замещенной сульфиновой кислоты и т.д., например группу, представленную формулой -S(O)p-R7, в которой р=1 или 2 и R7 обозначает гидроксильную группу, углеводородную группу, в случае необходимости имеющую заместитель (заместители), или гетероциклическую группу, в случае необходимости имеющую заместитель (заместители); группу, представленную формулой -COOR8, в которой R8 обозначает атом водорода, углеводородную группу, в случае необходимости имеющую заместитель (заместители), или гетероциклическую группу, в случае необходимости имеющую заместитель (заместители); группу, представленную формулой -CONR9R10, в которой R9 и R10 являются одинаковыми или разными, и каждый обозначает атом водорода, углеводородную группу, в случае необходимости имеющую заместитель (заместители), или гетероциклическую группу, в случае необходимости имеющую заместитель (заместители); группу, представленную формулой -SO2NH-R11, в которой R11 обозначает атом водорода, углеводородную группу, в случае необходимости имеющую заместитель (заместители), или гетероциклическую группу, в случае необходимости имеющую заместитель (заместители); или группу, представленную формулой -CO-R12, в которой R12 обозначает атом водорода, углеводородную группу, в случае необходимости имеющую заместитель (заместители), или гетероциклическую группу, в случае необходимости имеющую заместитель (заместители); и т.п. Примеры "углеводородной группы, в случае необходимости имеющей заместитель (заместители)",для R7, R8, R9, R10, R11 или R12 включают подобные вышеуказанной "углеводородной группе, в случае необходимости имеющей заместитель (заместители)" для R3. Примеры "гетероциклической группы, в случае необходимости имеющей заместитель (заместители)", для R7, R8, R9, R10, R11 или R12 включают подобные вышеуказанной "гетероциклической группе, в случае необходимости имеющей заместитель (заместители)" для R5 или R6."Карбамоильная группа, в случае необходимости имеющая заместитель (заместители)", является предпочтительно карбамоильной группой, в случае необходимости замещенной 1 или 2 C1-6 алкилами(например, метилом, этилом и т.д.). Примеры "карбамоила, в случае необходимости имеющего заместитель (заместители)", который"аминогруппа" в "аминогруппе, замещенной карбамоилом, в случае необходимости имеющим заместитель (заместители)", для R1 включают заместители, подобные вышеуказанной "карбамоильной группе, в случае необходимости имеющей заместитель (заместители)", для R1. Число заместителей на аминогруппе составляет 1 или 2."Аминогруппа, замещенная карбамоилом, в случае необходимости имеющим заместитель (заместители)", является предпочтительно карбамоиламиногруппой, моно- или ди-C1-6 алкил (например, метил,этил и т.д.)-карбамоиламиногруппой и т.п. Примеры "алкоксикарбонильной группы" для R1 включают C1-6 алкоксикарбонильную группу, такую как метоксикарбонил, этоксикарбонил, пропоксикарбонил, трет-бутоксикарбонил и т.п. Примеры "алкильной группы, замещенной гидроксигруппой", для R1 включают C1-6 алкильную группу (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.д.), замещенную 1-3 гидроксигруппами. Из соединений (I) 5-хлор-1-[5-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 1),-7 019641 5-хлор-2-имино-1-[5-метил-2-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид (пример 8),5-хлор-1-[3-хлор-5-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 12),5-хлор-1-[5-хлор-2-(метилсульфинил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 14),5-хлор-1-[4-хлор-3-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 15),5-хлор-1-[5-хлор-2-(этилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 17),5-хлор-1-[5-фтор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 18) и их соли и т.п. являются предпочтительными. В другом варианте осуществления 5-хлор-1-[5-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 1),5-хлор-2-имино-1-[5-метил-2-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид (пример 8),5-хлор-1-[3-хлор-5-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 12),5-хлор-1-[5-хлор-2-(метилсульфинил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 14),5-хлор-1-[4-хлор-3-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 15),5-хлор-1-[5-хлор-2-(этилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 17),5-хлор-1-[5-фтор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 18),5-хлор-1-[2-(этилсульфонил)-5-фторбензил]-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 24),5-хлор-1-(5-хлор-2-сульфамоилбензил)-2-имино-1,2-дигидропиридин-3-карбоксамид (пример 28),5-хлор-1-[5-хлор-2-(2-оксопирролидин-1-ил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид(пример 35) и их соли и т.п. являются особенно предпочтительными. Соединение (I) не охватывает 5-хлор-1-4-[(диметиламино)сульфонил]бензил-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[3-(1-гидрокси-1-метилэтил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,3-[3-(аминокарбонил)-5-хлор-2-иминопиридин-1(2 Н)-ил]метилметилбензоат,1-[3-(аминокарбонил)бензил]-5-хлор-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[4-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-2-имино-1-[4-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,5-хлор-2-имино-1-[2-метокси-5-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[2-хлор-4-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-3-хлор-5-[(метиламино)карбонил]бензил-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-1-[2-хлор-5-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбоксамид,1-[3-(аминокарбонил)-5-хлорбензил]-5-хлор-2-имино-1,2-дигидропиридин-3-карбоксамид,5-хлор-2-имино-1-[3-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид и 5-хлор-2-имино-1-(3-морфолин-4-илбензил)-1,2-дигидропиридин-3-карбоксамид. Когда соединение (I) или (I') находится в форме соли, примеры такой соли включают соли с неорганическими основаниями, солями аммония, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами, соли с основными или кислыми аминокислотами и т.п. Предпочтительные примеры соли с неорганическим основанием включают соль натрия, соль калия и подобные соли щелочного металла; соль кальция, соль магния, соль бария и подобные соли щелочноземельного металла; соль алюминия и т.п. Предпочтительные примеры соли с органическим основанием включают соль с триметиламином,триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином, N,N'-дибензилэтилендиамином и т.п. Предпочтительные примеры соли с неорганической кислотой включают соль с соляной кислотой,бромисто-водородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой и т.п. Предпочтительные примеры соли с органической кислотой включают соль с муравьиной кислотой,уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и т.п. Предпочтительные примеры соли с основной аминокислотой включают соль с аргинином, лизином,орнитином и т.п. Предпочтительные примеры соли с кислой аминокислотой включают соль с аспарагиновой кислотой, глутаминовой кислотой и т.п. Из них предпочтительна фармацевтически приемлемая соль. Соединение (I) или (I') может представлять собой гидрат, и гидрат, негидрат, сольват и несольват входят в рамки настоящего изобретения. Соединение (I) или (I') может быть мечено изотопом (например, 3 Н, 14 С, 35S, 125I и т.п.). Соединение (I) или (I') может также иметь форму преобразования дейтерия, в которой 1H был превращен в 2H(D). Когда соединение (I) или (I') имеет центр асимметрии, могут присутствовать изомеры, такие как энантиомер, диастереомер и т.п. Такие изомеры и их смесь входят в рамки настоящего изобретения. Когда присутствует конформационный изомер, такой изомер и его смесь также входят в понятие соединения (I) согласно настоящему изобретению. Способы получения соединения (I) или его соли согласно настоящему изобретению объясняются в следующем разделе. Соединение (I) может быть получено согласно следующему способу А или аналогичному ему способу. Исходные соединения на каждой стадии следующих способов получения могут использоваться в форме соли, и примеры такой соли включают подобные солям соединения (I). Способ А. Соединение, представленное формулой (II), используемое как исходный материал в этом способе,может быть получено согласно способу, известному per se, или способу, аналогичному ему, например способом, описанным в J. Org. Chem., (1954), 19, 1633, Tetrahedron. Lett., (1994), 35(32), 5775, или подобным. Соединение, представленное формулой (III), в которой L обозначает уходящую группу и кольцо Аи R1 имеют значения, определенные выше, которое используется как исходный материал в этом способе,может быть коммерчески доступным продуктом, который может использоваться непосредственно или после выделения и очистки, или может быть получено согласно способу, известному per se, или способу,аналогичному ему. Стадия 1. Соединение (I) может быть получено, например, реакцией соединения (II) с соединением (III). Примеры "уходящей группы" для L включают атом галогена (например, атом хлора, атом брома,атом йода и т.п.), замещенную сульфонилоксигруппу (например, C1-6 алкилсульфонилоксигруппу, такую как метансульфонилокси, этансульфонилокси и т.п.; C6-14 арилсульфонилоксигруппу, такую как бензолсульфонилокси, п-толуолсульфонилокси и т.п.; C7-16 аралкилсульфонилоксигруппу, такую как бензилсульфонилоксигруппа и т.д.), и т.п., и атом галогена является особенно предпочтительным. Эту реакцию обычно осуществляют в растворителе, инертном к реакции. Растворитель для этой реакции особо не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), диметилацетамид (DMA) и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; кетоны, такие как ацетон и т.п.; нитрилы,-9 019641 такие как ацетонитрил и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; и смеси этих растворителей. Количество используемого соединения (III) обычно составляет от приблизительно 1 до приблизительно 5 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения(II). Эту реакцию обычно осуществляют при температуре от приблизительно 0 до приблизительно 200 С, предпочтительно от приблизительно 20 до приблизительно 150 С. Время этой реакции обычно составляет от приблизительно 0,5 до приблизительно 60 ч. Полученное таким образом соединение (I) может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Из соединений (I) соединение, представленное формулой в которой X обозначает атом галогена, и другие символы имеют значения, определенные выше (в дальнейшем для упрощения называемое соединением (I-A, может быть получено согласно следующему способу В или аналогичному способу. Исходные соединения на каждой стадии следующих способов получения могут использоваться в форме соли, и примеры такой соли включают подобные солям соединения (I). Способ В. Соединение, представленное формулой (IV), и соединение, представленное формулой (VIII), каждое из которых используется как исходный материал в этом способе, может быть коммерчески доступным продуктом, который может использоваться непосредственно или после выделения и очистки, или может быть получено согласно способу, известному per se, или способу, аналогичному ему. Соединение, представленное формулой (VII), используемое как исходный материал в этом способе,может быть получено согласно способу, известному per se, или способу, аналогичному ему, например способом, описанным в J. Chem. Soc., 1953, 75, 1909, или подобным. Стадия 1. Эта стадия представляет собой стадию введения соединения (IV) в реакцию с альдегидом (VII), в котором X обозначает атом галогена, в присутствии основания с получением соединения (V). Примеры "атома галогена" для X включают атом хлора, атом брома, атом йода и т.п. Эту реакцию обычно осуществляют в растворителе, инертном к реакции. Примеры основания, используемого для этой реакции, включают соли щелочного металла, такие как гидроксид калия, гидроксид натрия, карбонат натрия, карбонат калия и т.п.; амины, такие как пиридин, триметиламин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п.; алкоголяты металла, такие как метилат натрия, этилат натрия, трет-бутилат калия и т.п.; гидриды металла, такие как гидрид натрия, гидрид калия и т.п. Количество используемого основания обычно составляет от приблизительно 1 до приблизительно 20 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (IV). Количество используемого альдегида (VII) обычно составляет от приблизительно 1 до приблизительно 5 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения(IV). Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такой как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), 1-метил-2 пирролидон и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; воду и смеси этих растворителей. Эту реакцию обычно осуществляют при температуре от приблизительно -50 до приблизительно 200 С, предпочтительно от приблизительно -10 до приблизительно 100 С. Время этой реакции обычно составляет от приблизительно 0,5 до приблизительно 60 ч. Полученное таким образом соединение (V) может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Стадия 2. Эта стадия представляет собой стадию циклизации соединения (V) с амином (VIII) в инертном растворителе в присутствии основания с получением соединения (VI). Количество используемого амина (VIII) обычно составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (V). Примеры основания, используемого для этой реакции, включают соли щелочного металла, такие как гидроксид калия, гидроксид натрия, карбонат натрия, карбонат калия и т.п.; амины, такие как пиридин, триметиламин, триэтиламин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п.; алкоголяты металла, такие как метилат натрия, этилат натрия, трет-бутилат калия и т.п.; органические металлы, такие как н-бутиллитий, литийдиизопропиламид (LDA) и т.п.; гидриды металла, такие как гидрид натрия, гидрид калия и т.п. Количество используемого основания обычно составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (V). Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), 1-метил-2 пирролидон и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; кетоны, такие как ацетон и т.п.; нитрилы, такие как ацетонитрил и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; вода и смеси этих растворителей. Эту реакцию обычно осуществляют при температуре от приблизительно -50 до приблизительно 200 С, предпочтительно от приблизительно -10 до приблизительно 100 С. Время этой реакции обычно составляет от приблизительно 0,1 до приблизительно 60 ч. Полученное таким образом соединение (VI) может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Кроме того, соединение (VI) может использоваться в форме реакционной смеси на следующей стадии (стадия 3) без выделения и очистки. Стадия 3. Эта стадия представляет собой стадию введения соединения, представленного формулой (VI), в реакцию декарбоксилирования с получением соединения (I-A). В этой реакции декарбоксилирования может использоваться известная реакция декарбоксилирования. Например, могут использоваться такие способы, как нагревание, использование кислоты или основания с нагреванием в случае необходимости и т.п. Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), 1-метил-2 пирролидон и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; нитрилы, такие как ацетонитрил и т.п.; органические кислоты, такие как уксусная кислота, трифторуксусная кислота и т.п.; вода и смеси этих растворителей. Примеры основания, которое используется для этой реакции, включают соли щелочного металла,такие как гидроксид калия, гидроксид натрия, карбонат натрия, карбонат калия и т.п.; амины, такие как пиридин, триметиламин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п.; алкоголяты металла, такие как метилат натрия, этилат натрия, трет-бутилат калия и т.п.; гидриды металла, такие как гидрид натрия, гидрид калия и т.п. Примеры кислоты включают неорганические кислоты, такие как соляная кислота, серная кислота, бромисто-водородная кислота и т.п.; органические кислоты, такие как уксусная кислота, трифторуксусная кислота и т.п. Количество используемого основания или кислоты обычно составляет от приблизительно 1 до приблизительно 100 моль, предпочтительно от приблизительно 1 до приблизительно 10 моль на 1 моль соединения (VI). Эту реакцию обычно осуществляют при температуре от приблизительно -50 до приблизительно 200 С, предпочтительно от приблизительно -10 до приблизительно 100 С. Время этой реакции обычно составляет от приблизительно 0,1 до приблизительно 60 ч. Полученное таким образом соединение (I-A) может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Способы получения соединения (I') или его соли согласно настоящему изобретению объясняются в следующем разделе. Соединение (I') может быть получено согласно следующему способу А' или способу, аналогичному ему. Исходные соединения на каждой стадии следующих способов получения могут использоваться в форме соли, и примеры такой соли включают подобные солям соединения (I'). Способ А'. Соединение, представленное формулой (II'), используемое как исходный материал в этом способе,может быть получено согласно способу, известному per se, или способу, аналогичному ему, например способом, описанным в J. Org. Chem., (1954), 19, 1633, Tetrahedron. Lett., (1994), 35(32), 5775, или подобным. Соединение, представленное формулой (III'), в которой L обозначает уходящую группу и кольцо А 0 10 и R имеют значения, определенные выше, которое используется как исходный материал в этом способе, может быть коммерчески доступным продуктом, который может использоваться непосредственно или после выделения и очистки, или может быть получено согласно способу, известному per se, или способу, аналогичному ему. Стадия 1. Соединение (I') может быть получено, например, реакцией соединения (II') с соединением (III'). Примеры "уходящей группы" для L включают атом галогена (например, атом хлора, атом брома,атом йода и т.п.), замещенную сульфонилоксигруппу (например, C1-6 алкилсульфонилоксигруппу, такую как метансульфонилокси, этансульфонилокси и т.п.; С 6-14 арилсульфонилоксигруппу, такую как бензолсульфонилокси, п-толуолсульфонилокси и т.п.; С 7-16 аралкилсульфонилоксигруппу, такую как бензилсульфонилоксигруппа и т.д.) и т.п., и атом галогена является особенно предпочтительным. Эту реакцию обычно осуществляют в растворителе, инертном к реакции. Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), диметилацетамид (DMA) и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; кетоны, такие как ацетон и т.п.; нитрилы,такие как ацетонитрил и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; и смеси этих растворителей. Количество используемого соединения (III') обычно составляет от приблизительно 1 до приблизительно 5 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения(II'). Эту реакцию обычно осуществляют при температуре от приблизительно 0 до приблизительно 200 С, предпочтительно от приблизительно 20 до приблизительно 150 С. Время этой реакции обычно составляет от приблизительно 0,5 до приблизительно 60 ч. Полученное таким образом соединение (I') может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Из соединений (I') соединение, представленное формулой в которой X обозначает атом галогена, и другие символы имеют значения, определенные выше (в дальнейшем для упрощения называемое соединением (I'-А, может быть получено согласно следующему способу В' или способу, аналогичному ему. Исходные соединения на каждой стадии следующих спо- 12019641 собов получения могут использоваться в форме соли, и примеры такой соли включают подобные солям соединения (I'). Способ В'. Соединение, представленное формулой (IV), и соединение, представленное формулой (VIII'), каждое из которых используется как исходный материал в этом способе, может быть коммерчески доступным продуктом, который может использоваться непосредственно или после выделения и очистки, или может быть получено согласно способу, известному per se, или способу, аналогичному ему. Соединение, представленное формулой (VII'), используемое как исходный материал в этом способе,может быть получено согласно способу, известному per se, или способу, аналогичному ему, например способом, описанным в J. Chem. Soc., 1953, 75, 1909, или подобным. Стадия 1. Эта стадия представляет собой стадию введения соединения (IV) в реакцию с альдегидом (VII), в котором X обозначает атом галогена, в присутствии основания с получением соединения (V'). Примеры "атома галогена" для X включают атом хлора, атом брома, атом йода и т.п. Эту реакцию обычно осуществляют в растворителе, инертном к реакции. Примеры основания, используемого для этой реакции, включают соли щелочного металла, такие как гидроксид калия, гидроксид натрия, карбонат натрия, карбонат калия и т.п.; амины, такие как пиридин, триметиламин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п.; алкоголяты металла, такие как метилат натрия, этилат натрия, трет-бутилат калия и т.п.; гидриды металла, такие как гидрид натрия, гидрид калия и т.п. Количество используемого основания обычно составляет от приблизительно 1 до приблизительно 20 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (IV'). Количество используемого альдегида (VII') обычно составляет от приблизительно 1 до приблизительно 5 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения(IV'). Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), 1-метил-2 пирролидон и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; воду и смеси этих растворителей. Эту реакцию обычно осуществляют при температуре от приблизительно -50 до приблизительно 200 С, предпочтительно от приблизительно -10 до приблизительно 100 С. Время этой реакции обычно составляет от приблизительно 0,5 до приблизительно 60 ч. Полученное таким образом соединение (V') может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Стадия 2. Эта стадия представляет собой стадию циклизации соединения (V') с амином (VIII') в инертном растворителе в присутствии основания с получением соединения (VI'). Количество используемого амина (VIII') обычно составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (V'). Примеры основания, используемого для этой реакции, включают соли щелочного металла, такие как гидроксид калия, гидроксид натрия, карбонат натрия, карбонат калия и т.п.; амины, такие как пиридин, триметиламин, триэтиламин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п.; алкоголяты металла, такие как метилат натрия, этилат натрия, трет-бутилат калия и т.п.; органические металлы, такие как н-бутиллитий, литийдиизопропиламид (LDA) и т.п.; гидриды металла, такие как гидрид натрия, гидрид калия и т.п. Количество используемого основания обычно составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (V'). Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), 1-метил-2 пирролидон и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; кетоны, такие как ацетон и т.п.; нитрилы, такие как ацетонитрил и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; воду и смеси этих растворителей. Эту реакцию обычно осуществляют при температуре от приблизительно -50 до приблизительно 200 С, предпочтительно от приблизительно -10 до приблизительно 100 С. Время этой реакции обычно составляет от приблизительно 0,1 до приблизительно 60 ч. Полученное таким образом соединение (VI') может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. Кроме того, соединение (VI') может использоваться в форме реакционной смеси на следующей стадии (стадия 3) без выделения и очистки. Стадия 3. Эта стадия представляет собой стадию введения соединения, представленного формулой (VI'), в реакцию декарбоксилирования с получением соединения (I'-А). В этой реакции декарбоксилирования может использоваться известная реакция декарбоксилирования. Например, могут использоваться такие способы, как нагревание, использование кислоты или основания с нагреванием в случае необходимости и т.п. Растворитель для этой реакции особенно не ограничен при условии, что реакция может протекать. Примеры этого растворителя включают ароматические углеводороды, такие как бензол, толуол, ксилол и т.п.; простые эфиры, такие как тетрагидрофуран, диметоксиэтан, диоксан, простой диэтиловый эфир и т.п.; амиды, такие как N,N-диметилформамид (DMF), N,N-диметилацетамид (DMA), 1-метил-2 пирролидон и т.п.; спирты, такие как метанол, этанол, пропанол, трет-бутанол, метоксиэтанол и т.п.; сульфоксиды, такие как диметилсульфоксид (ДМСО) и т.п.; нитрилы, такие как ацетонитрил и т.п.; органические кислоты, такие как уксусная кислота, трифторуксусная кислота и т.п.; воду и смеси этих растворителей. Примеры основания, которое используется для этой реакции, включают соли щелочного металла,такие как гидроксид калия, гидроксид натрия, карбонат натрия, карбонат калия и т.п.; амины, такие как пиридин, триметиламин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) и т.п.; алкоголяты металла, такие как метилат натрия, этилат натрия, трет-бутилат калия и т.п.; гидриды металла, такие как гидрид натрия, гидрид калия и т.п. Примеры кислоты включают неорганические кислоты, такие как соляная кислота, серная кислота, бромисто-водородная кислота и т.п.; органические кислоты, такие как уксусная кислота, трифторуксусная кислота и т.п. Количество используемого основания или кислоты обычно составляет от приблизительно 1 до приблизительно 100 моль, предпочтительно от приблизительно 1 до приблизительно 10 моль на 1 моль соединения (VI'). Эту реакцию обычно осуществляют при температуре от приблизительно -50 до приблизительно 200 С, предпочтительно от приблизительно -10 до приблизительно 100 С. Время этой реакции обычно составляет от приблизительно 0,1 до приблизительно 60 ч. Полученное таким образом соединение (I'-А) может быть выделено и очищено известными средствами отделения и очистки, например концентрацией, концентрацией при пониженном давлении, экстракцией растворителем, кристаллизацией, перекристаллизацией, фазовым переносом, хроматографией и т.п. В каждой из реакций синтеза целевых соединений и исходных материалов, когда исходные соединения имеют аминогруппу, карбоксильную группу или гидроксильную группу в качестве заместителя,такие группы могут быть защищены защитными группами, которые обычно используются в химии пептидов и т.д. В таком случае, в случае необходимости, такие защитные группы могут быть удалены с получением после реакций целевых соединений. Такая защитная группа включает, например, защитные группы, описанные в "Protective Groups inOrganic Synthesis, 3rd Ed. (1999)", изд. Theodara W. Greene, Peter G.M. Wuts, опубликовано WileyInterscience. Примеры защитной группы для аминогруппы включают формильную группу, C1-6 алкилкарбонильную группу (например, ацетильную группу, пропионильную группу и т.д.), фенилкарбонильную группу, C1-6 алкилоксикарбонильную группу (например, метоксикарбонильную группу, этоксикарбонильную группу и т.д.), арилоксикарбонильную группу (например, фенилоксикарбонильную группу и т.д.), С 7-10 аралкилкарбонильную группу (например, бензилоксикарбонильную группу и т.д.), бензильную группу, бензгидрильную группу, тритильную группу, фталоил и т.д., каждая из которых может иметь заместитель (заместители). Примеры такого заместителя включают атом галогена (например, атом фтора,атом хлора, атом брома, атом йода и т.д.), C1-6 алкилкарбонильную группу (например, ацетильную группу, пропионильную группу, бутилкарбонильную группу и т.д.), нитрогруппу и т.п. Число заместителя Примеры защитной группы для карбоксильной группы включают C1-6 алкильную группу (например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу и т.д.), фенильную группу, тритильную группу, силильную группу и т.п.,каждая из которых может иметь заместитель (заместители). Примеры этих заместителей включают атом галогена (атом фтора, атом хлора, атом брома, атом йода), формильную группу, C1-6 алкилкарбонильную группу (например, ацетильную группу, пропионильную группу, бутилкарбонильную группу и т.д.), нитрогруппу и т.п. Число заместителя (заместителей) составляет от 1 до 3. Примеры защитной группы для гидроксила включают C1-6 алкильную группу (например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, третбутильную группу и т.д.), фенильную группу, С 7-10 аралкильную группу (например, бензильную группу и т.д.), формильную группу, C1-6 алкилкарбонильную группу (например, ацетильную группу, пропионильную группу и т.д.), арилоксикарбонильную группу (например, фенилоксикарбонильную группу и т.д.),С 7-10 аралкилкарбонильную группу (например, бензилоксикарбонильную группу и т.д.), пиранильную группу, фуранильную группу, силильную группу и т.п., каждый из которых может иметь заместитель(заместители). Примеры этих заместителей включают атом галогена (атом фтора, атом хлора, атом брома, атом йода), C1-6 алкильную группу, фенильную группу, С 7-10 аралкильную группу, нитрогруппу и т.п. Число заместителя (заместителей) составляет от 1 до 4. Такие защитные группы могут быть удалены известным способом или способом, описанным в "Protective Groups in Organic Synthesis, 3rd Ed. (1999)", изд. Theodora W. Greene, Peter G.M. Wuts, опубликовано Wiley-Interscience, или подобным, или аналогичным способом. Например, может использоваться обработка кислотой, основанием, восстановление, ультрафиолетовое облучение, обработка гидразином,фенилгидразином, N-метилдитиокарбаматом натрия, тетрабутиламмоний фторидом, ацетатом палладия и т.п. В вышеописанных способах, когда соединение (I) или соединение (I') получено как свободное соединение, оно может образовывать соль, например, с неорганической кислотой (например, соляной кислотой, серной кислотой, бромисто-водородной кислотой и т.п.), органической кислотой (например, метансульфоновой кислотой, бензолсульфоновой кислотой, толуолсульфоновой кислотой, щавелевой кислотой, фумаровой кислотой, малеиновой кислотой, винной кислотой и т.п.), неорганическим основанием (например, щелочными металлами, такими как натрий, калий и т.п., щелочно-земельными металлами,такими как кальций, магний и т.п., алюминий, аммоний и т.п.) или органическим основанием (например,триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином, N,N'-дибензилэтилендиамином и т.п.) и т.п. согласно обычному способу. Когда соединение (I) (или соединение (I' получено в форме соли, оно может также быть превращено в свободное соединение или другую соль согласно обычному способу. Кроме того, когда исходное соединение образует соль в каждой из вышеописанных реакций, соединение может использоваться в форме соли. Такая соль включает, например, проиллюстрированные как соль соединения (I) (или соединения (I'. Соединение (I) (или соединение (I', полученное такими способами, может быть выделено и очищено такими обычными средствами разделения, как перекристаллизация, перегонка, хроматография и т.п. Когда соединение (I) (или соединение (I' включает оптический изомер, стереоизомер, региоизомер и ротамер, они также включены в понятие соединения (I) (или соединения (I' и могут быть получены как единственные продукты согласно методам синтеза и разделения, известным per se (например, концентрацией, экстракцией растворителем, хроматографией на колонках, перекристаллизацией и т.д.). Например, когда соединение (I) (или соединение (I' имеет оптический изомер, этот оптический изомер,отделенный от этого соединения, также входит в понятие в соединения (I) (или соединения (I'. Оптический изомер может быть получен способом, известным per se. В частности, используется оптически активное синтетическое промежуточное соединение или конечный рацемический продукт подвергают оптическому разделению согласно обычному способу с получением оптического изомера. Способ оптического разделения может быть способом, известным per se, таким как способ фракционной перекристаллизации, способ хиральной колонки, диастереомерный способ и т.д. 1) Способ фракционной перекристаллизации. Способ, в котором получают соль рацемата с оптически активным соединением (например, (+)миндальной кислотой, (-)-миндальной кислотой, (+)-винной кислотой, (-)-винной кислотой, (+)-1 фенетиламином, (-)-1-фенетиламином, цинхонином, (-)-цинхонидином, бруцином и т.д.), который разделяют способом фракционной перекристаллизации, и, если желательно, осуществляют стадию нейтрализации с получением свободного оптического изомера. 2) Способ хиральной колонки. Способ, в котором рацемат или его соль наносят на колонку для разделения оптического изомера(хиральная колонка), чтобы осуществить разделение. В случае жидкостной хроматографии, например,смесь оптических изомеров наносят на хиральную колонку, такую как ENANTIO-OVM (Tosoh Corporation), серия CHIRAL (Daicel Chemical Industries, Ltd.) и т.п., и проявляют водой, различными буферами(например, фосфатным буфером и т.д.) и органическими растворителями (например, этанолом, метанолом, изопропанолом, ацетонитрилом, трифторуксусной кислотой, диэтиламином и т.д.), индивидуально или в смеси, чтобы отделить оптический изомер. В случае газовой хроматографии, например, используют такую хиральную колонку, как CP-Chirasil-DeX CB (GL Sciences Inc.) и т.п., чтобы осуществить разделение. 3) Диастереомерный способ. Способ, в котором рацемическую смесь получают в диастереомерной смеси химической реакцией с оптически активным реагентом, которую превращают в единственное вещество обычными средствами разделения (например, способом фракционной перекристаллизации, способом хроматографии и т.д.) и подвергают химической обработке, такой как гидролиз и т.п., чтобы отделить оптически активную группу реагента, в результате чего получают оптический изомер. Например, когда соединение (I) (или соединение (I' содержит в составе молекулы гидроксигруппу или группу первичного или вторичного амина,соединение и оптически активную органическую кислоту (например, МТРА [-метокси(трифторметил)фенилуксусную кислоту], (-)-метоксиуксусную кислоту и т.д.) подвергают реакции конденсации с получением диастереомеров сложноэфирного соединения или амидного соединения соответственно. Когда соединение (I) (или соединение (I' имеет карбоксильную группу, это соединение и оптически активный амин или оптически активный спирт подвергают реакции конденсации с получением диастереомеров амидного соединения или сложноэфирного соединения соответственно. Отделенный диастереомер превращают в оптический изомер первоначального соединения кислотным гидролизом или основным гидролизом. Соединение (I) (или соединение (I' может быть в форме кристаллов. Кристалл соединения (I) (или соединения (I' может быть получен кристаллизацией соединения (I)(или соединения (I' способом кристаллизации, известным per se. Примеры способа кристаллизации включают способ кристаллизации из раствора, способ кристаллизации из пара, способ кристаллизации из расплавов и т.п."Кристаллизация из раствора" является обычно способом перевода из ненасыщенного состояния в перенасыщенное состояние путем изменения факторов, участвующих в растворимости соединений (композиция растворителя, температура, ионная сила, состояние окислительно-восстановительного потенциала и т.д.), или количества растворителя. Конкретнее, например, способ концентрации, способ холодного удаления, способ реакции (метод диффузии, метод электролиза), способ гидротермального роста,способ потока и т.п. Примеры растворителя, который используется, включают ароматические углеводороды (например, бензол, толуол, ксилол и т.д.), галогензамещенные углеводороды (например, дихлорметан, хлороформ и т.д.), насыщенные углеводороды (например, гексан, гептан, циклогексан и т.д.), простые эфиры (например, простой диэтиловый эфир, простой диизопропиловый эфир, тетрагидрофуран,диоксан и т.д.), нитрилы (например, ацетонитрил и т.д.), кетоны (например, ацетон и т.д.), сульфоксиды(например, диметилсульфоксид и т.д.), амиды кислоты (например, N,N-диметилформамид и т.д.), сложные эфиры (например, этилацетат и т.д.), спирты (например, метанол, этанол, изопропиловый спирт и т.д.), воду и т.п. Эти растворители используются индивидуально или в комбинации двух или более в подходящем соотношении (например, от 1:1 до 1:100 (об. дол При необходимости может также использоваться затравка кристаллизации."Кристаллизация из пара" представляет собой, например, способ упаривания (способ закрытой пробирки, способ газового потока), способ реакции газовой фазы, способ химический транспортировки и т.п.(способ Czochralski, способ температурного градиента и способ Бриджмена), способ зонального плавления (способ выравнивания зоны и способ плавающей зоны), способ специального роста (способ VLS и способ эпитаксии жидкой фазы) и т.п. Предпочтительные примеры способа кристаллизации включают способ растворения соединения (I)(или соединения (I' в подходящем растворителе (например, спиртах, таких как метанол, этанол и т.д.) при температуре от 20 до 120 С и охлаждения полученного раствора до температуры не выше, чем температура растворения (например, от 0 до 50 С, предпочтительно от 0 до 20 С). Таким образом полученные кристаллы соединения (I) (или соединения (I' могут быть выделены,например, фильтрацией и т.п. Как способ анализа полученного кристалла обычно используется кристаллический анализ порошковой дифракцией рентгеновских лучей. Кроме того, как способ для определения ориентации кристаллов, механический способ и т.п. может также быть упомянут оптический способ. Кристаллы соединения (I) (или соединения (I', полученные в вышеописанном способе получения(в дальнейшем для упрощения называемые как "кристалл согласно настоящему изобретению"), имеют высокую чистоту, высокое качество и низкую гигроскопичность, не содержат денатуратов даже после долговременного хранения в нормальных условиях и имеют чрезвычайно высокую стабильность. Кристалл также имеет высокие биологические свойства (например, кинетические свойства in vivo (абсорбционная способность, распределение, метаболизм, экскреция), экспрессию эффективности и т.д.), и чрезвычайно полезны в качестве фармацевтического средства. В настоящем описании температура плавления означает температуру плавления, измеренную с использованием, например, прибора для измерения точки микроплавления (Yanako, MP-500D) или устройства DSC (дифференциальная сканирующая калориметрия) (SEIKO, EXSTAR 6000) и т.п. Пролекарство соединения (I) (или соединения (I' означает соединение, которое превращается в соединение (I) (или соединение (I' вследствие реакции с ферментом, кислотой желудка и т.д. в физиологических условиях в живом организме, то есть соединение, которое превращается в соединение (I) (или соединение (I' ферментативным окислением, восстановлением, гидролизом, и т.д.; соединение, которое превращается в соединение (I) (или соединение (I' гидролизом и т.д. вследствие действия кислоты желудка и т.п. Пролекарство соединения (I) (или соединения (I' может быть соединением, полученным ацилированием, алкилированием или фосфорилированием аминогруппы в соединении (I) (или соединении (I' (например, соединение, полученное эйкозаноилированием, аланилированием, пентиламинокарбонилированием, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилированием, тетрагидрофуранилированием, пирролидилметилированием, пивалоилоксиметилированием и трет-бутилированием аминогруппы в соединении (I) (или соединении (I' и т.д.); соединение, полученное ацилированием, алкилированием, фосфорилированием или борированием гидроксильной группы в соединении (I) (или соединении (I' (например, соединение, полученное ацетилированием, пальмитоилированием, пропаноилированием, пивалоилированием, сукцинилированием, фумарилированием, аланилированием, диметиламинометилкарбонилированием и т.д. гидроксильной группы в соединении (I) (или соединении (I'; соединение, полученное этерификацией или амидированием карбоксильной группы в соединении (I) (или соединении (I' (например, соединение, полученное этилэстерификацией, фенилэстерификацией, карбоксиметилэстерификацией, диметиламинометилэтерификацией, пивалоилоксиметилэтерификацией, этоксикарбонилоксиэтилэтерификацией, фталидилэтерификацией, (5-метил-2-оксо-1,3-диоксолен-4-ил)метилэтерификацией, циклогексилоксикарбонилэтилэтерификацией и метиламидированием и т.д. карбоксильной группы в соединении (I) (или соединении (I' и т.п. Любое из этих соединений может быть получено из соединения (I) (или соединения (I' способом, известным per se. Пролекарство соединения (I) (или соединения (I' может также быть пролекарством, которое превращается в соединение (I) (или соединение (I' в физиологических условиях, таких как описанные вIYAKUHIN no KAIHATSU (Development of Pharmaceuticals), Vol. 7, Design of Molecules, p. 163-198, 1990,опубликовано HIROKAWA SHOTEN. Соединение (I), его соль и его пролекарство, а также соединение (I'), его соль и его пролекарство в дальнейшем упрощенно вместе называют "соединение согласно настоящему изобретению". Соединение согласно настоящему изобретению имеет превосходную антагонистическую активность в отношении 1D адренергического рецептора. В частности, соединение согласно настоящему изобретению представляет собой соединение, имеющее селективную антагонистическую активность в отношении 1D адренергического рецептора. Селективная антагонистическая активность в отношении 1D адренергического рецептора в рамках изобретения означает наличие антагонистической активности, по меньшей мере в 10 раз или более высокой, чем в отношении 1D адренергического рецептора, и по меньшей мере в 10 раз или более высокой, чем в отношении 1B адренергического рецептора. Так как соединение согласно настоящему изобретению имеет селективную антагонистическую активность в отношении 1D адренергического рецептора, оно понижает кровяное давление и т.п., и этот эффект, как считается, основан на антагонистическом действии на рецептор 1A или рецептор 1B. Поэтому считается, что соединение согласно настоящему изобретению представляет собой фармацевтическое средство, обладающее небольшим числом побочных эффектов. Кроме того, поскольку соединение согласно настоящему изобретению демонстрирует низкую токсичность (например, кардиотоксичность (например, ингибирующую активность в отношении человеческого гена специфических калиевых каналов сердца), фосфолипидоз (PLsis), острую токсичность, хроническую токсичность, генотоксичность, токсичность в отношении репродуктивной сферы), межлекарственное взаимодействие, карциногенность, фототоксичность и т.д.), оно является безопасным для введения млекопитающему (например, мыши, крысе, хомяку, кролику, кошке, собаке, крупному рогатому скоту, овце, обезьяне, человеку и т.д.). Кроме того, соединение согласно настоящему изобретению обладает улучшенными фармакокинетическими свойствами (например, абсорбционной способностью, клиренсом и т.д.). На основании антагонистической активности в отношении 1D адренергического рецептора, соединение согласно настоящему изобретению может быть использовано в качестве лекарственного средства для профилактики или лечения любого связанного с 1D адренергическим рецептором заболевания у млекопитающих (например, мыши, крысы, хомяка, кролика, кошки, собаки, крупного рогатого скота,овцы, обезьяны, человека и т.д.), например,(1) заболеваний нижних мочевыводящих путей (включая все заболевания, имеющие симптом нижних мочевыводящих путей, как описано далее, например гиперактивность мочевого пузыря, доброкачественную гиперплазию предстательной железы, промежуточный цистит, хронический простатит и т.д.),симптома накопления (повышенная частота дневного мочеиспускания, ноктурия, императивные позывы к мочеиспусканию, недержание мочи, недержание мочи при стрессе, императивное недержание мочи,смешанное недержание мочи, энурез, ночной энурез, постоянное недержание мочи, другое недержание мочи, ощущение увеличенного, уменьшенного или отсутствующего мочевого пузыря и т.д.), симптома опорожнения (слабый поток (или медленный поток) мочи, разделенный поток (или расщепленный поток) мочи, распыленный поток, неустойчивый поток мочи (или неустойчивый поток), отсрочка (или неуверенность) опорожнения, напряжение при мочеиспускании (или напряжение), терминальное подкапывание (или терминальный дриблинг) и т.д.), симптом постмочеиспускания (чувство остаточной мочи, подкапывание при постмочеиспускании и т.д.), симптома, являющегося следствием полового акта (коитальная боль, сухость влагалища, недержание мочи и т.д.), симптома, являющегося следствием пролапса тазового органа (ощущение инородного тела, прострел и т.д.), боли в половых органах или боли в нижних мочевыводящих путях (цисталгия, уретральная боль, пудендалгия, вагинодиния, скротальная боль, перинеальная боль, тазовая боль и т.д.), болевого синдрома, связанного с половыми органами или мочевыводящими путями (синдром цисталгии, синдром уретральной боли, синдром пудендалгии, влагалищный синдром, синдром скротальной боли, синдром перинеальной боли, синдром тазовой боли и т.д.), синдрома симптома, предполагающего дисфункцию нижних мочевыводящих путей (синдром гиперактивного мочевого пузыря, симптом нижних мочевыводящих путей, предполагающий обструкцию выпускного отверстия мочевого пузыря и т.д.), полиурии, мочекаменной болезни (мочевой проток, уретра) и т.п.,(2) метаболических нарушений [например, диабета (инсулинзависимый диабет, диабетические осложнения, диабетическая ретинопатия, диабетическая микроангиопатия, диабетическая невропатия и т.д.), ослабленной переносимости глюкозы, ожирения, доброкачественной гиперплазии предстательной железы, половой дисфункции и т.п.],(3) заболеваний центральной нервной системы [например, нейродегенеративных заболеваний (например, болезни Альцгеймера, болезни Дауна, болезни Паркинсона, болезни Крейфельда-Якоба, бокового амиотрофического склероза (ALS), хореи Гентингтона, диабетической невропатии, рассеянного склероза и т.д.), психических заболеваний (например, шизофрении, депрессии, мании, тревожного невроза,невроза навязчивых состояний, панического нарушения, эпилепсии, алкоголизма, наркотической зависимости, тревоги, тревожного ментального статуса, эмоционального расстройства, циклотимии, нервного эретизма, аутизма, обморока, зависимости, низкого либидо и т.д.), таких расстройств, как расстройства центральной нервной системы и периферического нерва (например, травмы головы, травмы спинного мозга, отека мозга, нарушений сенсорной функции, патологий сенсорной функции, нарушения функции автономной нервной системы, патологий функции автономной нервной системы, хлыстовой травмы и т.д.), нарушений памяти (например, сенильной деменции, амнезии, цереброваскулярной деменции и т.д.),цереброваскулярного нарушения (например, мозгового кровотечения, инфаркта мозга и т.п. и его последствий или осложнений, бессимптомного цереброваскулярного нарушения, транзиторной церебральной ишемической атаки, гипертензивной энцефалопатии, нарушения гематоэнцефалического барьера и т.д.), рецидива и осложнения цереброваскулярных нарушений (например, невральных симптомов, ментальных симптомов, субъективных симптомов, нарушений повседневных активностей и т.д.), гипофункции центральной нервной системы после окклюзии кровеносного сосуда мозга, нарушений или патологий способности к саморегуляции мозгового кровообращения или почечного кровообращения и т.д.],расстройств сна,(4) заболеваний, связанных с половой недостаточностью [например, мужская эректильная дисфункция, дисспермия, женская половая недостаточность и т.д.],(5) желудочно-кишечных заболеваний [например, синдром раздраженного кишечника, воспалительное заболевание кишечника, неспецифический язвенный колит, болезнь Крона, патологии (например, гастрит, желудочная язва и т.д.), вызванные уреазоположительными грамотрицательными хеликобактериями (например, Helicobacter pylori и т.д.), рака желудка, постгастростомического нарушения,диспепсии, язвы желудка, панкреатита, полипа толстого кишечника, холелитиаза, геморроя, язвенной болезни, ситуативного илеита, обжорства, запора, диареи, урчания в животе и т.д.],(6) воспалительных или аллергических заболеваний [например, аллергического ринита, конъюнктивита, желудочно-кишечной аллергии, поллиноза, анафилаксии, дерматита, герпеса, псориаза, бронхита,выделения мокроты, ретинопатии, послеоперационного и посттравматического воспаления, регрессии отечности, фарингита, цистита, менингита, воспалительных заболеваний глаз и т.д.],(7) остеоартропатических заболеваний [например, ревматоидный артрит (хронический ревматоидный артрит), деформирующий артрит, ревматоидный миелит, остеопороз, аномальный рост клеток, перелом кости, повторный перелом кости, остеомаляция, остеопения, болезнь Бехчета, ригидный миелит,деструкция суставной ткани вседствие деформирующего гонартроза и подобные заболевания и т.д.],(8) респираторных заболеваний [например, простуда, пневмония, астма, легочная артериальная гипертензия, легочные тромбы/легочная облитерация, саркоидоз легких, туберкулез легких, промежуточная пневмония, силикоз, респираторный дистресс-синдром взрослых, хронические облитерирующие заболевания легких, кашель и т.д.],(9) инфекционных заболеваний [заболевания, вызванные инфекцией ВИЧ, инфекционные заболевания, вызванные цитомегаловирусом, вирусом гриппа, вирусом герпеса и т.п., инфекционные заболева- 18019641 ния, вызванные риккетсиями, бактериальные инфекционные заболевания, заболевания, передающиеся половым путем, carinii pneumonia, заболевания, вызванные инфекцией Helicobacter pylori, системные грибковые инфекционные заболевания, туберкулез, инвазивные стафилококковые инфекционные заболевания, острый вирусный энцефалит, острый бактериальный менингит, энцефалит при СПИДе, септицемия, сепсис, sepsis gravis, синдромы септического шока, эндотоксинового шока, токсического шока и т.д.],(10) рака [например, первичный, метастатический или рекуррентный рак молочной железы, рак предстательной железы, рак поджелудочной железы, рак желудка, рак легкого, колоректальный рак (рак толстой кишечника, ректальный рак, анальный рак), рак пищевода, рак двенадцатиперстной кишки, рак головы и шеи (рак языка, рак глотки, рак гортани), опухоль головного мозга, шваннома, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак печени, рак почки, рак желчных путей, рак матки (рак эндометрия, рак шейки матки), рак яичника, рак мочевого пузыря, рак кожи, гемангиома, злокачественная лимфома, злокачественная меланома, рак щитовидной железы, опухоль кости, сосудистая фиброма,ретиносаркома, рак полового члена, солидный рак в детстве, саркома Капоши, саркома Капоши, вызванная СПИДом, опухоль верхней челюсти, волокнистая гитиоцитома, лейомиосаркома, рабдомиосаркома,липосаркома, фиброзные опухоли матки, остеобластома, остеосаркома, хондросаркома, злокачественная мезотелиома, опухоли, такие как лейкоз, болезнь Ходжкина и т.д.],(11) болезней органов кровообращения [например, острые синдромы коронарных артерий (например, острый инфаркт миокарда, нестабильная стенокардия и т.д.), периферическая артериальная обструкция, болезнь Рейно; болезнь Бюргера; рестеноз после вмешательства на коронарной артерии (чрескожная транслюминальная пластическая операция на коронарных сосудах (РТСА), направленная коронарная атерэктомия (DCA), стентирование и т.д.), рестеноз после шунтирования коронарной артерии,рестеноз после вмешательства (пластическая операция на сосудах, атерэктомия, стентирование и т.д.) или шунтирование другой периферической артерии, ишемические заболевания сердца (например, инфаркт миокарда, стенокардия и т.д.), миокардит, перемежающаяся хромота, лакунарный инфаркт, артериосклероз (например, атеросклероз и т.д.), порок сердца (острый порок сердца, хронический порок сердца, сопровождаемый воспалением), аритмия, прогресс атеросклеротической бляшки, тромбоз, артериальная гипертензия, гипертензивный шум в ушах; гипотензия и т.д.],(12) боли [например, головная боль, мигрень, невралгия и тазовая висцеральная боль, включая цисталгию и т.д.],(13) аутоиммунных заболеваний [например, коллагеновое заболевание, системная красная волчанка, склеродермия, полиартериит, миастения гравис, рассеянный склероз, синдром Съегрена, болезнь Бехчета и т.д.],(14) заболеваний печени [например, гепатит (включая хронический гепатит), цирроз, промежуточные заболевания печени и т.д.],(15) заболеваний поджелудочной железы [например, панкреатит (включая хронический панкреатит) и т.д.],(16) заболеваний почек [например, нефрит, гломерулонефрит, гломерулосклероз, отказ почек,тромбическая микроангиопатия, осложнения диализа, нарушения органа, включая нефропатию, вызванную радиацией, диабетическую нефропатию и т.д.],(17) эндокринных заболеваний [например, Аддисонова болезнь, синдром Кушинга, меланома, первичный альдостеронизм и т.д.],(18) других заболеваний, таких как(a) отторжение трансплантата [например, посттрансплантационное отторжение, посттрансплантационная полицитемия, артериальная гипертензия, нарушение органа и/или сосудистая гипертрофия, реакция "трансплантант против хозяина" и т.д.],(b) патологии в характеристиках крови и/или компонентов крови [например, повышенная агрегация тромбоцитов, патологии деформируемости эритроцитов, повышение в способности к склеиванию лейкоцитов, увеличение вязкости крови, полицитемия, пелиоз сосудов, аутоиммунная гемолитическая анемия,синдром диссеминированного внутрисосудистого свертывания (ДВС), множественная миелопатия и т.д.],(c) гинекологические заболевания [например, нарушение климактерического периода, гестоз, эндометриоз, миома матки, заболевание яичника, заболевание молочной железы, предменструальный синдром, пролапс тазового органа (например, пролапс передней стенки влагалища, пролапс апекса влагалища, пролапс задней стенки влагалища, пролапс матки и т.д.), другие заболевания, где орган пролабируется от нормального положения вследствие ослабления мышц тазового дна (например, ректальный пролапс и т.д.) и т.п.],(d) кожные заболевания [например, келоидный рубец, гемангиома, псориаз, зуд и т.д.],(e) глазные заболевания [например, глаукома, заболевание, вызванное артериальной гипертензией глаза и т.д.],(f) отоларингологические заболевания [например, синдром Menuel, шум в ушах, нарушение вкуса,головокружение, неустойчивость, дисфагия и т.д.],- 19019641(g) заболевания, являющиеся следствием экологических и/или профессиональных факторов (например, расстройство, вызванное облучением, расстройство, вызванное ультрафиолетовыми/инфракрасными/лазерными лучами, высотная болезнь и т.д.),(h) атаксия, ригидность, тремор, нарушение движений, акинез,(i) синдром хронической усталости,(j) внезапная смерть ребенка грудного возраста во время сна,(k) икота,(1) заболевания, вызывающие сердцебиение, головокружение, изжогу и т.п. Среди этих заболеваний соединение согласно настоящему изобретению особенно полезно в качестве средства для облегчения заболеваний нижних мочевыводящих путей, таких как гиперактивность мочевого пузыря, недержание мочи при стрессе, гипертрофия предстательной железы и т.п., а также в качестве лекарственного средства для профилактики или лечения этих заболеваний нижних мочевыводящих путей. Препарат, включающий соединение согласно настоящему изобретению, может быть любым из твердых препаратов, таких как порошок, гранула, таблетка, капсула, разлагаемые во рту пленки и т.п., и жидкостей, таких как сироп, эмульсия, инъекция и т.п. Средство для профилактики или лечения согласно настоящему изобретению может быть получено любым обычным способом, например смешиванием, перемешиванием, грануляцией, таблетированием,нанесением покрытия, стерилизацией, эмульгированием и т.д., в соответствии с получаемой формой препарата. Для получения таких фармацевтических препаратов, например, можно обратиться к каждому из разделов в общих принципах для фармацевтических препаратов в Фармакопее Японии. Кроме того,препарат согласно настоящему изобретению может быть составлен в форме препарата замедленного высвобождения, содержащего активный ингредиент и биоразлагаемое полимерное соединение. Препарат замедленного высвобождения может быть получен согласно способу, описанному в JP-A-9-263545. В препаратах согласно настоящему изобретению содержание соединения согласно настоящему изобретению варьирует в зависимости от формы препарата, но обычно составляет от 0,01 до 100 вес.%,предпочтительно от 0,1 до 50 вес.%, более предпочтительно от 0,5 до 20 вес.%, относительно массы целого препарата. Когда соединение согласно настоящему изобретению используется в вышеуказанном фармацевтическом продукте, оно может использоваться индивидуально или в смеси с подходящим, фармацевтически приемлемым носителем, например эксципиентами (например, крахмал, лактоза, сахароза, карбонат кальция, фосфат кальция и т.д.), связующими (например, крахмал, гуммиарабик, карбоксилметилцеллюлоза, гидроксипропилцеллюлоза, кристаллическая целлюлоза, альгиновая кислота, желатин, поливинилпирролидон и т.д.), лубрикантами (например, стеариновая кислота, стеарат магния, стеарат кальция,тальк и т.д.), дезинтеграторами (например, кальций карбоксиметилцеллюлоза, тальк и т.д.), разбавителями (например, вода для инъекций, физиологический солевой раствор и т.д.) и, если желательно, с добавками (например, стабилизатором, консервантом, красителем, ароматизатором, солюбилизатором, эмульгатором, буфером, изотоническим агентом и т.д.) и т.п., обычными способами. Оно может быть составлено в твердые препараты, такие как порошки, тонкие гранулы, гранулы, таблетки, капсулы и т.д., или в жидкие препараты, такие как инъекции и т.д., и может вводиться перорально или парентерально. В этом случае предпочтительно получают препарат для инъекций. Оно может также вводиться как парентеральное средство для топического введения (например, внутримышечной, подкожной, органной или суставной инъекции и т.д., твердый препарат, такой как имплантируемый агент, гранулы, порошок и т.п., жидкость, такая как суспензия и т.п., мазь и т.д.). Например, для получения препарата для инъекции соединение согласно настоящему изобретению получают в водной суспензии вместе с диспергирующим агентом (например, поверхностно-активным веществом, таким как Tween 80, НСО-60 и т.п., полисахаридами, такими как карбоксиметилцеллюлоза,альгинат натрия, гиалуроновая кислота и т.п., полисорбат и т.д.), консервантом (например, метилпарабеном, пропилпарабеном и т.д.), изотонизирующим агентом (например, хлоридом натрия, маннитом, сорбитом, глюкозой и т.д.), буферным средством (например, карбонатом кальция и т.д.), регулятором рН(например, фосфатом натрия, фосфатом калия и т.д.) и т.п., в результате чего получают практичный препарат для инъекций. Кроме того, соединение (I) диспергируют вместе с растительным маслом, таким как кунжутное масло, кукурузное масло и т.п., или его смесью с фосфолипидом, таким как лецитин и т.п.,или триглицеридом жирной кислоты со средней длиной цепи (например, miglyol 812 и т.д.) с получением масляной суспензии для практической инъекции. Профилактическое или терапевтическое средство согласно настоящему изобретению может также использоваться вместе с другими фармацевтическими средствами. Лекарственное средство, которое смешано или скомбинировано с соединением согласно настоящему изобретению (в дальнейшем кратко называемое комбинированным лекарственным средством) включает следующее.(1) Средство для профилактики или лечения других заболеваний нижних мочевыводящих путей(включая любое заболевание, включающее симптом, представленный симптомами со стороны нижних мочевыводящих путей), блокатор рецептора адреналина 1 (например, тамсулозин, урапидил, нафтодипил, силодозин, доксазозин, альфузозин и т.д.), антихолиновое лекарственное средство (например, оксибутинин, пропиверин, дарифенацин, толтеродин, солифенацин, темиверин, троспиум хлорид и его соли и т.д.), антагонист рецептора NK-1 (например, апрепитант, казопитант, LY686017 и т.д.), агонист рецептора адреналина 3 (например, солабегрон, YM-178, KRP-204, KUC-7483, MN-246, CL-316243 и т.д.), агонист рецептора TRPV1 (например, резинифератоксин, препарат капсаицина и т.д.), антагонист рецептораTRPV1 (например, SB-705498, NGD-8243 и т.д.), препарат токсина Botulinus (например, ВТХ-А и т.д.),агонист рецептора адреналина 1 (например, эфедрин гидрохлорид, мидодрин гидрохлорид и т.д.), агонист рецептора адреналина 2 (например, кленбутерол и т.д.), вещество-ингибитор захвата норадреналина вещество-ингибитор захвата норадреналина и серотонина (например, дулоксетин и т.д.), трициклический антидепрессант (например, имипрамин гидрохлорид и т.д.), стимулятор гладкомышечных клеток(например, целимеверин гидрохлорид и т.д.), лекарственный препарат женских половых гормонов (например, эстрогена связанного типа (премарин), эстриола и т.д.) и т.п.(2) Средство для лечения диабета. Препараты инсулина (например, препараты инсулина животных, экстрагируемые из поджелудочной железы крупного рогатого скота или свиней; препараты человеческого инсулина, синтезируемые методом генной инженерии с использованием Escherichia coli или дрожжей; инсулин цинка; инсулин протамина цинка; фрагмент или производное инсулина (например, INS-1 и т.д.), и т.п.), средства для потенцирования чувствительности к инсулину (например, пиоглитазон гидрохлорид, троглитазон, розиглитазон или его малеат, JTT-501, МСС-555, YM-440, GI-262570, KRP-297, FK-614, CS-011 и т.д.), ингибиторы -глюкозидазы (например, воглибоз, акарбоз, миглитол, эмиглитат и т.д.), бигуаниды (например,фенетилбигуанид, метформин, буформин и т.д.), сульфонилмочевины (например, толбутамид, глибенкламид, гликлазид, хлорпропамид, толазамид, ацетогексамид, гликлопирамид, глимепирид и т.д.) и другие средства, усиливающие секрецию инсулина (например, репаглинид, сенаглинид, митиглинид или его гидрат соли кальция, GLP-1, натеглинид и т.д.), ингибитор дипептидил пептидазы IV (например, NVPDPP-278, РТ-100, Р 32/98 и т.д.), 3 агонисты (например, CL-316243, SR-58611-A, UL-TG-307, AJ-9677,AZ40140 и т.д.), агонисты амилина (например, прамлинтид и т.д.), ингибиторы фосфотирозинфосфатазы(3) Средство для лечения диабетических осложнений. Ингибиторы альдозоредуктазы (например, толрестат, эпалрестат, зенарестат, зополрестат, фидарестат (SNK-860), миналрестат (ARI-509), СТ-112 и т.д.), нейротрофические факторы (например, NGF, NT3 и т.д.), ингибиторы AGE (например, ALT-945, пимагедин, пиратоксатин, N-фенацилтиазолий бромид(ALT-766), ЕХО-226 и т.д.), активные акцепторы кислорода (например, липоевая кислота и т.д.), мозговые сосудорасширяющие средства (например, тиапурид и т.д.) и т.п.(4) Антигиперлипидимическое средство. Соединения статина, ингибирующие синтез холестерина (например, правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, церивастатин или их соль (например, натриевая соль и т.д., ингибиторы скваленсинтазы или фибратные соединения, имеющие триглицеридпонижающее действие (например, безафибрат, клофибрат, симфибрат, клинофибрат и т.д.).(5) Гипотензивное средство. Ингибиторы ангиотензинпревращающего фермента (например, каптоприл, эналаприл, делаприл и т.д.), антагонисты ангиотензина (например, лосартан, кандесартан цилексетил и т.д.), антагонисты кальция (например, манидипин, нифедипин, амлодипин, эфонидипин, никардипин и т.д.), клонидин, и т.п.(6) Средство против ожирения. Лекарственные средства против ожирения, действующие на центральную нервную систему (например, дексфенфлурамин, фенфлурамин, фентермин, сибутрамин, анфепрамон, дексамфетамин, мазиндол,фенилпропаноламин, клобензорекс и т.д.), ингибиторы стипсина (например, орлистат и т.д.), 3 агонисты(например, CL-316243, SR-58611-A, UL-TG-307, AJ-9677, AZ40140 и т.д.), анорексические пептиды (например, лептин, CNTF (реснитчатый нейротрофический фактор) и т.д.), агонисты холецистокинина (например, линтитрипт, FPL-15849 и т.д.), агонисты рецептора серотонина 2 С (например, APD-356, SCA136, ATHX-105, WAY-163909, YM-348) и т.п.(7) Диуретическое средство. Производные ксантина (например, теобромин натрий салицилат, теобромин кальций салицилат и т.д.), препараты тиазида (например, этиазид, циклопентиазид, трихлорметиазид, гидрохлоротиазид, гидрофлуметиазид, бензилгидрохлортиазид, пенфлутизид, политиазид, метиклотиазид и т.д.), антиальдостероновые препараты (например, спиронолактон, триамтерен и т.д.), ингибиторы карбоангидразы (например, ацетазоламид и т.д.), препараты хлорбензолсульфонамида (например, хлорталидон, мефрусид, индапамид и т.д.), азосемид, изосорбид, этакриновая кислота, пиретанид, буметанид, фуросемид и т.д. Алкилирующие агенты (например, циклофосфамид, ифосфамид и т.д.), метаболические антагонисты (например, метотрексат, 5-фтороурацил и т.д.), противоопухолевые антибиотики (например, митомицин, адриамицин и т.д.), противоопухолевые средства растительного происхождения (например, винкристин, виндезин, таксол и т.д.), цисплатин, карбоплатин, этопозид и т.д. Из них предпочтительными являются производные 5-фтороурацила, такие как фуртулон и нео-фуртулон.(9) Иммунотерапевтическое средство. Компоненты, происходящие из микроорганизмов или бактерией (например, производные мурамилдипептида, пицибанил и т.д.), иммуностимулирующие полисахариды (например, лентинан, шизофиллан,крестин и т.д.), цитокины, полученные генной инженерией (например, интерфероны, интерлейкины (IL) и т.д.), колониестимулирующие факторы (например, колониестимулирующий фактор гранулоцитов, эритропоэтин и т.д.) и т.п. Из них предпочтительными являются IL-1, IL-2, IL-12 и т.д.(10) Терапевтическое средство, известное как облегчающее кахексию на моделях животных или в клинической практике. Производные прогестерона (например, мегестрол ацетат) [Journal of Clinical Oncology, vol. 12, pp. 213225, 1994], фармацевтические препараты метоклопрамида, фармацевтические препараты тетрагидроканнабинола (вышеуказанная ссылка относится и к тем, и к другим), средства, улучшающие жировой обмен (например, эйкозапентановая кислота) [British Journal of Cancer, vol. 68, pp. 314-318, 1993], гормоны роста,IGF-1 и антитела к вызывающим кахексию факторам, таким как TNF-, LIF, IL-6 и онкостатин М.(12) Разное. Ингибиторы гликозилирования (например, ALT-711 и т.д.), лекарственные средства, промотирующие регенерацию нерва (например, Y-128, VX853, просаптид и т.д.), лекарственные средства, действующие на центральную нервную систему (например, антидепрессанты, такие как десипрамин, амитриптилин, имипрамин, флуоксетин, пароксетин, доксепин и т.д.), противосудорожные средства (например,ламотригин, карбамазепин), антиаритмические препараты (например, мексилетин), лиганды рецептора ацетилхолина (например, АВТ-594), антагонисты рецептора эндотелина (например, АВТ-627), ингибиторы захвата моноамина (например, трамадол), ингибиторы захвата индолеамина (например, флуоксетин,пароксетин), наркотические аналгезирующие средства (например, морфин), агонисты рецептора ГАМК(например, габапентин), ингибиторы захвата ГАМК (например, тиагабин), агонисты рецептора 2 (например, клонидин), местные аналгезирующие средства (например, капсаицин), ингибиторы протеинкиназы С (например, LY-333531), анксиолитические лекарственные средства (например, бензодиазепины),ингибиторы фосфодиэстеразы (например, силденафил), агонисты рецептора допамина (например, апоморфин), антагонисты рецептора допамина (например, галоперидол), агонисты рецептора серотонина(например, тандоспирон цитрат, суматриптан), антагонисты рецептора серотонина (например, ципргептадин гидрохлорид, ондасетрон), ингибиторы захвата серотонина (например, флувоксамин малеат, флуоксетин, пароксетин), снотворные препараты (например, триазолам, золпидем), антихолинергические средства, блокаторы рецептора 1 (например, тамсулозин), миорелаксанты (например, баклофен и т.д.),активаторы калиевых каналов (например, никорандил), блокаторы кальциевых каналов (например, нифедипин), средства для профилактики или лечения болезни Альцгеймера (например, донепезил, ривастигмин, галантамин), средства для лечения болезни Паркинсона (например, L-допа), средства для профилактики или лечения рассеянного склероза (например, интерферон -1 а), ингибиторы рецептора гистаминH1 (например, прометазин гидрохлорид), ингибиторы протонной помпы (например, лансопразол, омепразол), антитромбические средства (например, аспирин, цилостазол), антагонисты рецептора NK-2, средства лечения инфекции ВИЧ (саквинавир, зидовудин, ламивудин, невирапин), средства для лечения хронических обструктивных заболеваний легких (сальметерол, тиотропий бромид, циломистат) и т.п. Антихолинергические средства включают, например, атропин, скополамин, гоматропин, тропикамид, циклопентолат, бутилскополамин бромид, пропантелин бромид, метилбенактизий бромид, мепензолат бромид, флавоксат, пирензепин, ипратропий бромид, тригексифенидил, оксибутинин, пропиверин,дарифенацин, толтеродин, темиверин, троспий хлорид или его соль (например, атропин сульфат, скополамин гидробромид, гоматропин гидробромид, циклопентолат гидрохлорид, флавоксат гидрохлорид,пирензепин гидрохлорид, тригексифенидил гидрохлорид, оксибутинин гидрохлорид, толтеродин тартрат и т.д.) и т.п., предпочтительно оксибутинин, пропиверин, дарифенацин, толтеродин, темиверин, троспий хлорид или его соль (например, оксибутинин гидрохлорид, толтеродин тартрат и т.д.). Кроме того, могут использоваться ингибиторы ацетилхолин эстеразы (например, дистигмин и т.д. Антагонисты рецептора NK-2 включают, например, производное пиперидина, такое как GR159897,GR149861, SR48968 (саредутант), SR144190, YM35375, YM38336, ZD7944, L-743986, MDL105212A,ZD6021, MDL105172A, SCH205528, SCH62373, R-113281 и т.д., производное пергидроизоиндола, такое как RPR-106145, производное хинолина, такое как SB-414240, производное пирролопиримидина, такое как ZM-253270, производное псевдопептида, такое как MEN11420 (непадутант), SCH217048, L-659877,PD-147714 (САМ-2291), MEN10376, S16474 и т.д., и другие, такие как GR100679, DNK333, GR94800,UK-224671, MEN10376, MEN10627, или их соли и т.п. Для комбинированного использования время введения соединения согласно настоящему изобретению и сопутствующего лекарственного средства не ограничено, и соединение согласно настоящему изобретению или его фармацевтическая композиция и сопутствующее лекарственное средство или его фармацевтическая композиция могут вводиться пациенту одновременно или могут вводиться в разное время. Дозировка сопутствующего лекарственного средства может быть определена согласно клинически используемой дозе и может быть соответственно выбрана в зависимости от пациента, пути введения,заболевания, комбинации и т.п. Способ введения сопутствующего лекарственного средства особенно не ограничен, и соединение согласно настоящему изобретению и сопутствующее лекарственное средство требуют только комбинирования при введении. Примеры такого способа введения включают следующее:(1) введение единственного препарата, полученного путем одновременного процессинга соединения согласно настоящему изобретению или его фармацевтической композиции и сопутствующего лекарственного средства, (2) одновременное введение двух видов препаратов соединения согласно настоящему изобретению или его фармацевтической композиции и сопутствующего лекарственного средства или его фармацевтической композиции, которые получали отдельно, тем же самым путем введения, (3) введение двух видов препаратов соединения согласно настоящему изобретению или его фармацевтической композиции и сопутствующего лекарственного средства или его фармацевтической композиции, которые получали отдельно, тем же самым путем введения ступенчатым образом, (4) одновременное введение двух видов препаратов соединения согласно настоящему изобретению или его фармацевтической композиции и сопутствующего лекарственного средства или его фармацевтической композиции, которые получали отдельно, различными путями введения, (5) введение двух видов препаратов соединения согласно настоящему изобретению или его фармацевтической композиции и сопутствующего лекарственного средства или его фармацевтической композиции, которые получали отдельно, различными путями введения ступенчатым образом (например, введение в указанном порядке соединения согласно настоящему изобретению или его фармацевтической композиции и сопутствующего лекарственного средства или его фармацевтической композиции, или в обратном порядке) и т.п. Отношение соединения согласно настоящему изобретению к сопутствующему лекарственному средству в комбинированном средстве согласно настоящему изобретению может быть соответственно выбрано в зависимости от пациента, пути введения, заболеваний и т.п. Например, содержание соединения согласно настоящему изобретению в комбинированном средстве согласно настоящему изобретению варьирует в зависимости от формы препарата и обычно составляет от приблизительно 0,01 до 100 вес.%, предпочтительно от приблизительно 0,1 до 50 вес.%, более предпочтительно от приблизительно 0,5 до 20 вес.% в расчете на общую массу препарата. Хотя содержание сопутствующего лекарственного средства в комбинированном средстве согласно настоящему изобретению варьирует в зависимости от формы препарата, оно обычно составляет от приблизительно 0,01 до 100 вес.%, предпочтительно от приблизительно 0,1 до 50 вес.%, более предпочтительно от приблизительно 0,5 до 20 вес.% в расчете на общую массу препарата. Хотя содержание добавок, таких как носитель и т.п., в комбинированном средстве согласно настоящему изобретению варьирует в зависимости от формы препарата, оно обычно составляет приблизительно от 1 до 99,99 вес.%, предпочтительно приблизительно от 10 до 90 вес.% в расчете на общую массу препарата. Подобное содержание может использоваться для индивидуальных препаратов соединения согласно настоящему изобретению и сопутствующего лекарственного средства. Хотя доза варьирует в зависимости от вида соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, пути введения, симптома, возраста пациента и т.п., она состаляет,например, приблизительно от 0,005 до 50 мг/кг массы тела/сутки, предпочтительно приблизительно от 0,05 до 10 мг/кг массы тела/сутки, более предпочтительно приблизительно от 0,2 до 4 мг/кг массы тела/сутки, как соединение согласно настоящему изобретению для перорального введения взрослому пациенту с недержанием мочи при стрессе, и эта доза может вводиться приблизительно в 1-3 частях. Когда фармацевтическая композиция согласно настоящему изобретению представляет собой препарат замедленного высвобождения, доза варьирует в зависимости от вида и содержания соединения согласно настоящему изобретению, лекарственной формы, продолжительности высвобождения лекарственного средства, животного-пациента (например, млекопитающего, такого как человек, крыса, мышь,кошка, собака, кролик, корова, свинья и т.п.) и цели введения. Для парентерального введения, например,от приблизительно 0,1 до приблизительно 100 мг соединения согласно настоящему изобретению высвобождаются из введенного препарата за одну неделю. Доза комбинированного лекарственного средства может быть установлена такой, чтобы она не вызывала никаких побочных эффектов. Суточная доза комбинированного лекарственного средства варьирует в зависимости от серьезности симптомов, возраста, пола, массы тела и чувствительности пациента,- 23019641 времени и интервала введения, свойства, состава ивидов фармацевтического препарата, видов активных ингредиентов и т.д. и особенно не ограничена. В случае перорального введения суточная доза в расчете на сопутствующее лекарственное средство составляет величину порядка приблизительно от 0,001 до 2000 мг, предпочтительно приблизительно от 0,01 до 500 мг и более предпочтительно приблизительно от 0,1 до 100 мг на 1 кг массы тела млекопитающих, причем эта доза может вводиться один раз в сутки или в виде от двух до четырех разделенных частей в сутки. При введении комбинированного лекарственного средства согласно настоящему изобретению оно может вводиться в одно и то же время, или используемые в комбинации лекарственные средства могут вводиться перед введением соединения согласно настоящему изобретению, и наоборот. В случае ступенчатого введения временной интервал варьирует в зависимости от вводимых активных ингредиентов, состава и пути введения. Например, если используемые в комбинации лекарственные средства вводят сначала, соединение согласно настоящему изобретению может вводиться через интервал времени от 1 мин до 3 дней, предпочтительно от 10 мин до 1 дня, более предпочтительно от 15 мин до 1 ч после введения используемых в комбинации лекарственных средств. Если соединение согласно настоящему изобретению вводят сначала, используемые в комбинации лекарственные средства могут вводиться через интервал времени от 1 мин до 1 дня, предпочтительно от 10 мин до 6 ч, более предпочтительно от 15 мин до 1 ч после введения соединения согласно настоящему изобретению. Фармацевтическая композиция согласно настоящему изобретению имеет низкую токсичность и может использоваться безопасно. В частности, поскольку соединения, проиллюстрированные в примерах, приведенных ниже, имеют высокую абсорбционную способность при пероральном введении, они могут использоваться для пероральных препаратов. Примеры Настоящее изобретение объясняется подробно в следующем разделе с помощью справочных примеров, примеров, примеров-составов и экспериментальных примеров. Однако настоящее изобретение не ограничено примерами и может быть модифицировано без выхода за рамки изобретения. Спектр 1 Н-ЯМР измеряли, используя AV-400M (400 МГц), AVANCE 300 (300 МГц) и AVANCE II 300 (300 МГц) производства Bruker и используя тетраметилсилан как внутренний стандарт, все значенияпоказаны в м.д. Если не указано иное, числовые обозначения, показанные для смешанных растворителей, представляют собой объемные отношения в смеси соответствующих растворителей. Если не указано иное, % означает вес.%. Комнатная температура (температура окружающей среды) в настоящем описании представляет собой температуру от приблизительно 10 до приблизительно 35 С. Если не указано иное, элюирование хроматографией на колонках в справочных примерах и примерах осуществляли при наблюдении методом TLC (тонкослойной хроматографии). Для наблюдения TLC в качестве планшета TLC использовали 60F254 производства Merck или TLC (NH) производства FUJI SILYSIA, и растворитель, используемый в качестве элюента для хроматографии на колонках, использовался в качестве элюента. Для детекции использовался УФ-детектор. Силикагель 60 (70-230 меш) производства Merck использовался как силикагель для хроматографии на колонках, и силикагель (CHROMATOREX NH) производства FUJI SILYSIA использовался как основной силикагель. Другие аббревиатуры, используемые в описании, означают следующее:s - синглет,d - дублет,t - триплет,q - квартет,dd - двойной дублет,ушир. - уширенный,J - константа взаимодействия,Гц - Герц,CDCl3 - дейтеризованный хлороформ,1 Н ЯМР - протонный ядерный магнитный резонанс. Справочный пример 1. 2-Циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамид. Мукохлористую кислоту (15,1 г) и 2-цианоацетамид (7,53 г) растворяли в метаноле (53,6 мл) и 2,5 н. водный раствор гидроксида натрия (53,6 мл) добавляли по каплям с перемешиванием при охлаждении льдом. Смеси давали нагреться до комнатной температуры и далее перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь вливали в 1 н. соляную кислоту, содержащую воду со льдом,метанол выпаривали при пониженном давлении и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток кристаллизовали из смеси этанол-простой диизопропиловый эфир с получением указанного в заголовке соединения (3,74 г) в форме светло-коричневых кристаллов. 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 4,84 (1 Н, д, J=3,2 Гц), 5,91 (1 Н, д, J=4,0 Гц), 7,85 (1 Н, ушир.с),8,03 (1 Н, ушир.с). Пример 1. 5-Хлор-1-[5-хлор-2-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3 карбоксамид гидрохлорид. Стадия 1. К раствору 5-хлор-2-(метилсульфанил)метилбензоата (3,0 г) в этилацетате (200 мл) при 0 С добавляли м-хлорпербензойную кислоту (8,53 г, содержащую воду: Wako Pure Chemical Industries, Ltd.). Смесь перемешивали при комнатной температуре в течение 5 ч и обрабатывали водным раствором бикарбоната натрия. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=1:3) с получением 5-хлор-2-(метилсульфонил)метилбензоата (2,67 г). 1 Н ЯМР (300 МГц, CDCl3)м.д. 3,35 (3 Н, с), 3,99 (3 Н, с), 7,55-7,77 (2 Н, м), 8,07 (1 Н, д, J=8,48 Гц). Стадия 2. К раствору 5-хлор-2-(метилсульфонил)метилбензоата, полученного на стадии 1 (2,65 г), в смеси тетрагидрофуран-этанол (50 мл+5 мл) при 0 С добавляли боргидрид лития (348 мг). Смесь перемешивали при 60 С в течение 2 ч, обрабатывали льдом и экстрагировали этилацетатом. Экстракт промывали последовательно 1 н. соляной кислотой и насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали хроматографией на колонках с силикагелем (этилацетат:гексан=2:1) с получением [5-хлор-2-(метилсульфонил)фенил]метанола(1 Н, дд, J=8,38, 2.17 Гц), 7,61 (1 Н, д, J=1,88 Гц), 7,98 (1 Н, д, J=8,29 Гц). Стадия 3. Трифенилфосфин (1,19 г) суспендировали в ацетонитриле (50 мл), добавляли бром (0,24 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси добавляли раствор[5-хлор-2-(метилсульфонил)фенил]метанола, полученного на стадии 2 (1 г), в ацетонитриле (10 мл). Смесь перемешивали при 70 С в течение 3 ч, обрабатывали водой и экстрагировали этилацетатом. Экстракт промывали последовательно водным раствором бикарбоната натрия и насыщенным солевым раствором и высушивали над безводным сульфатом магния. Растворитель выпаривали при пониженном давлении. Полученный остаток очищали основной хроматографией на силикагеле (этилацетат:гексан=1:3) с получением 2-(бромметил)-4-хлор-1-(метилсульфонил)бензола (0,46 г). 1 Н ЯМР (300 МГц, CDCl3)м.д. 3,25 (3 Н, с), 5,02 (2 Н, с), 7,49 (1 Н, дд, J=8,52, 2,08 Гц), 7,58 (1 Н, д,J=2,27 Гц), 8,01 (1 Н, д, J=8,33 Гц). Стадия 4. Раствор 2-амино-5-хлорникотинамида (210 мг) и 2-(бромметил)-4-хлор-1-(метилсульфонил)бензола,полученного на стадии 3 (450 мг), в DMF (5 мл) перемешивали при 100 С в течение 3 ч. Смеси давали охладиться до комнатной температуры, добавляли этилацетат и осажденные кристаллы собирали фильтрацией. Полученные кристаллы растворяли в водном растворе бикарбоната натрия и раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=1:13:1). Полученное твердое вещество желтого цвета растворяли в метаноле и добавляли раствор 2 н. соляная кислота-этилацетат. Растворитель выпаривали при пониженном давлении и остаток кристаллизовали из смеси метанол-этилацетат с получением указанного в заголовке соединения (30 мг). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 3,42 (3 Н, с), 5,84 (2 Н, с), 7,15 (1 Н, д, J=1,88 Гц), 7,78 (1 Н, дд,J=8,48, 1,88 Гц), 8,07 (1 Н, д, J=8,48 Гц), 8,24 (1 Н, с), 8,63-8,75 (3 Н, м), 9,67 (2 Н, с). Пример 2. 5-Хлор-2-имино-1-[3-(метилсульфинил)бензил]-1,2-дигидропиридин-3-карбоксамид гидрохлорид. К суспензии 2-циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамида (1,0 г) в метаноле (10 мл) при комнатной температуре добавляли раствор 1-[3-(метилсульфинил)фенил]метанамин гидрохлорида (1,8 г) и триэтиламина (2,4 мл) в метаноле (5 мл) и смесь перемешивали в течение ночи при 50 С. Растворитель реакции выпаривали при пониженном давлении, добавляли уксусную кислоту (5 мл) и смесь перемешивали при 50 С в течение 2 ч. Растворитель выпаривали при пониженном давлении, остаток разделяли этилацетатом, 1 н. водным раствором гидроксида натрия и водным раствором бикарбоната натрия и органический слой высушивали над сульфатом натрия. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=7:31:0). К полученному желтому маслу добавляли раствор 4 н. гидрохлорид-этилацетат (1 мл) и осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (270 мг). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,76 (3 Н, с), 5,66 (2 Н, с), 7,40 (1 Н, д, J=7,7 Гц), 7,52-7,79 (3 Н, м),8,21 (1 Н, ушир.с), 8,68 (2 Н, ушир.с), 8,84 (1 Н, ушир.с), 9,52 (2 Н, ушир.с). Пример 3. 5-Хлор-1-[3-хлор-4-(метилсульфонил)бензил]-2-имино-1,2-дигидропиридин-3-карбокс- 25019641(430 мг) в DMF (3 мл) перемешивали при 100 С в течение 4 ч. Смеси давали охладиться до комнатной температуры, добавляли этилацетат и осажденные кристаллы собирали фильтрацией. Полученные кристаллы растворяли в 1 н. растворе гидроксида натрия и раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=9:11:0). Полученное твердое вещество желтого цвета растворяли в метаноле, добавляли раствор 4 н. соляная кислота-этилацетат и осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (65 мг). 1(0,88 г) и смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель выпаривали при пониженном давлении, добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали при пониженном давлении. К раствору (10 мл) остатка в этаноле добавляли 10%-ный порошок палладия на угле (0,46 г) и смесь перемешивали в течение ночи в атмосфере водорода(1 атм). Раствор фильтровали через целит. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат) с получением 3(аминометил)-N-метилбензолсульфонамида (0,38 г) в форме бесцветного масла. 1 Н ЯМР (300 МГц, CDCl3)м.д. 1,70 (2 Н, ушир.с), 2,68 (3 Н, д, J=4,9 Гц), 3,86 (2 Н, с), 4,88 (1 Н,ушир.с), 7,39-7,62 (2 Н, м), 7,76 (1 Н, дт, J=7,5, 1,6 Гц), 7,89 (1 Н, с). Стадия 2. К суспензии 2-циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамида (0,28 г) и 3(аминометил)-N-метилбензолсульфонамида, полученного на стадии 1 (0,36 г), в этаноле (10 мл) при комнатной температуре добавляли карбонат калия (0,25 г) и смесь перемешивали в течение ночи при 70 С. Реакционный раствор фильтровали через целит. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=7:31:0). К полученному желтому маслу добавляли раствор 4 н. гидрохлорид-этилацетат (1 мл) и осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (76 мг). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,42 (3 Н, д, J=5,3 Гц), 5,68 (2 Н, ушир.с), 7,50 (1 Н, д, J=7,2 Гц),7,54-7,71 (2 Н, м), 7,71-7,85 (2 Н, м), 8,21 (1 Н, ушир.с), 8,70 (2 Н, ушир.с), 8,86 (1 Н, ушир.с), 9,53 (2 Н,ушир.с). Пример 5. 5-Хлор-2-имино-1-[3-(диметилсульфамоил)бензил]-1,2-дигидропиридин-3-карбоксамид гидрохлорид. Стадия 1. К 2 М раствору диметиламина в метаноле (3,7 мл) при 0 С добавляли 3-цианобензолсульфонил хлорид (1,5 г) и смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель выпаривали при пониженном давлении, добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали при пониженном давлении. К раствору (10 мл) остатка в этаноле добавляли 10%-ный порошок палладия на угле (0,79 г) и смесь перемешивали в течение ночи в атмосфере водорода (1 атм). Раствор фильтровали через целит. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат) с получением 3(аминометил)-N,N-диметилбензолсульфонамида (1,0 г) в форме бесцветного масла. 1(2 Н, дд, J=9,1, 7,8 Гц), 7,79 (1 Н, ушир.с). Стадия 2. К суспензии 2-циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамида (0,73 г) и 3(аминометил)-N,N-диметилбензолсульфонамида, полученного на стадии 1 (1,0 г), в этаноле (10 мл) при комнатной температуре добавляли карбонат калия (0,65 г) и смесь перемешивали в течение ночи при 70 С. Реакционный раствор фильтровали через целит. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=7: 31:0). К полученному желтому маслу добавляли раствор 4 н. гидрохлорид-этилацетат (1 мл) и осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (306 мг). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,61 (6 Н, с), 5,70 (2 Н, с), 7,56 (1 Н, д, J=7,7 Гц), 7,63-7,78 (2 Н, м),7,83 (1 Н, ушир.с), 8,21 (1 Н, ушир.с), 8,67 (2 Н, д, J=2,1 Гц), 8,89 (1 Н, д, J=2,3 Гц), 9,55 (2 Н, ушир.с).(860 мг) в DMF (5 мл) перемешивали при 100 С в течение 6 ч. Смеси давали охладиться до комнатной температуры, добавляли этилацетат и осажденные кристаллы собирали фильтрацией. Полученные кристаллы растворяли в 1 н. растворе гидроксида натрия и раствор экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=9:1 этилацетат:метанол=1:0). Полученное твердое вещество желтого цвета растворяли в метаноле, добавляли раствор 4 н. соляная кислота-этилацетат и осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения(195 мг). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 3,38 (3 Н, с), 5,66 (2 Н, с), 7,47 (1 Н, д, J=8,33 Гц), 7,95 (1 Н, с),8,06 (1 Н, д, J=8,33 Гц), 8,22 (1 Н, с), 8,67 (2 Н, с), 8,82 (1 Н, с), 9,53 (2 Н, с). Пример 7. 1-[5-Хлор-2-(метилсульфонил)бензил]-2-имино-5-метил-1,2-дигидропиридин-3 карбоксамид гидрохлорид. К раствору (3 мл) 2-амино-5-метилникотинамида (100 мг) в N,N-диметилформамиде добавляли 2(бромметил)-4-хлор-1-(метилсульфонил)бензол (220 мг) и смесь перемешивали при 100 С в течение 4 ч. Смеси давали охладиться до комнатной температуры, добавляли этилацетат и осажденные кристаллы собирали фильтрацией. Полученные кристаллы растворяли в 1 н. растворе гидроксида натрия и раствор экстрагировали зтилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем(этилацетат:гексан= 5:1 этилацетат:метанол=10:1). Полученное твердое вещество желтого цвета растворяли в метаноле,добавляли раствор 4 н. соляная кислота-этилацетат (1 мл) и остаток кристаллизовали из смеси метанолэтилацетат с получением указанного в заголовке соединения (45 мг). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,21 (3 Н, с), 3,42 (3 Н, с), 5,81 (2 Н, с), 6,98 (1 Н, д, J=1,88 Гц),7,80 (1 Н, дд, J=8,48, 2,07 Гц), 8,05-8,6 (3 Н, м) , 8,51 (1 Н, д, J=1,70 Гц), 8,60 (1 Н, с), 9,32 (2 Н, с). Пример 8. 5-Хлор-2-имино-1-[5-метил-2-(метилсульфонил)бензил]-1,2-дигидропиридин-3-карбоксамид гидрохлорид. Стадия 1. К раствору 1-[5-метил-2-(метилсульфанил)фенил]метанамин гидрохлорида (8,0 г) и триэтиламина(7,95 г) в тетрагидрофуране (200 мл) при комнатной температуре добавляли ди-трет-бутилбикарбонат(12,85 г). Смесь перемешивали при той же самой температуре в течение 6 ч, обрабатывали 1 н. соляной кислотой и экстрагировали зтилацетатом. Экстракт промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Полученный остаток растворяли в этилацетате (300 мл), и м-хлорпербензойную кислоту (24,2 г, содержащую воду:Wako Pure Chemical Industries, Ltd.) добавляли при комнатной температуре. Смесь перемешивали при той же самой температуре в течение 14 ч и обрабатывали водным раствором бикарбоната натрия. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=1:1). Полученный остаток растворяли в метаноле (50 мл), добавляли раствор 4 н. соляная кислота-этилацетат (20 мл) и смесь перемешивали при 60 С в течение 1 ч и концентрировали при пониженном давлении с получением кристаллов. Полученные кристаллы промывали простым диэтиловым эфиром с получением 1-[5-метил-2-(метилсульфонил)фенил]метанамин гидрохлорида(6,50 г) в форме твердого вещества. 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,42 (3 Н, с), 3,30 (3 Н, с), 4,38 (2 Н, с), 7,49 (1 Н, дд, J=8,10, 0,94 Гц), 7,64 (1 Н, с), 7,88 (1 Н, д, J=8,10 Гц), 8,52 (3 Н, с). Стадия 2. 2-Циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамид (2,49 г), 1-[5-метил-2-(метилсульфонил)фенил]метанамин гидрохлорид, полученный на стадии 1 (3,0 г), и карбонат калия (4,4 г) перемешивали в этаноле (30 мл) при 80 С в течение 24 ч. Реакционную смесь обрабатывали 1 н. раствором гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=4:1). Полученный остаток растворяли в метаноле, добавляли раствор 4 н. соляная кислота-этилацетат (5 мл) и смесь кристаллизовали из смеси метанол-этилацетат. Осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (1,26 г). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,35 (3 Н, с), 3,37 (3 Н, с), 5,83 (2 Н, с), 6,80 (1 Н, с), 7,49 (1 Н, д,J=8,10 Гц), 7,95 (1 Н, д, J=8,10 Гц), 8,24 (1 Н, с), 8,63 (1 Н, д, J=1,51 Гц), 8,67-8,79 (2 Н, м), 9,63 (2 Н, с). Пример 9 5-Хлор-2-имино-1-[2-(метилсульфонил)-5-(трифторметил)бензил]-1,2-дигидропиридин-3- 27019641N,N-диметилформамиде (30 мл) при 80 С в течение 14 ч. Реакционный раствор обрабатывали 1 н. соляной кислотой и экстрагировали этилацетатом. Экстракт промывали последовательно водным раствором бикарбоната натрия и насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении с получением 2-(метилсульфанил)-5-(трифторметил)бензонитрила (7,71 г) в форме твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)м.д. 2,61 (3 Н, с), 7,37 (1 Н, д, J=8,48 Гц), 7,74 (1 Н, дд, J=8,8, 1,51 Гц),7,82 (1 Н, с). Стадия 2. К суспензии литий-алюминийгидрида (1,61 г) в тетрагидрофуране (250 мл) при 0 С добавляли 2(метилсульфанил)-5-(трифторметил)бензонитрил, полученный на стадии 1 (7,7 г). Смесь перемешивали при комнатной температуре в течение 2 ч и обрабатывали 10 гидратом сульфата натрия и неорганическое вещество фильтровали через целит. Фильтрат концентрировали при пониженном давлении. Остаток растворяли в метаноле, добавляли раствор 4 н. соляная кислота-этилацетат (15 мл) и смесь кристаллизовали из смеси метанол-этилацетат с получением 1-[2-(метилсульфанил)-5-(трифторметил)фенил]метанамин гидрохлорид (4,28 г). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,61 (3 Н, с), 4,11 (2 Н, д, J=4,54 Гц), 7,56 (1 Н, д, J=8,33 Гц), 7,74(1 Н, д, J=8,33 Гц), 7,81 (1 Н, с), 8,48 (3 Н, с). Стадия 3. К раствору 1-[2-(метилсульфанил)-5-(трифторметил)фенил]метанамин гидрохлорида, полученного на стадии 2 (4,27 г), и триэтиламина (3,35 г) в тетрагидрофуране (150 мл) при комнатной температуре добавляли ди-трет-бутилбикарбонат (5,42 г). Смесь перемешивали при той же самой температуре в течение 12 ч, обрабатывали 1 н. соляной кислотой и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Полученный остаток растворяли в этилацетате (200 мл) и м-хлорпербензойную кислоту (10,2 г, содержащую воду: Wako Pure Chemical Industries, Ltd.) добавляли при комнатной температуре. Смесь перемешивали при той же самой температуре в течение 3 ч и обрабатывали водным раствором бикарбоната натрия. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=1:1). Полученный остаток растворяли в метаноле (100 мл), добавляли раствор 4 н. соляная кислота-этилацетат (10 мл) и смесь перемешивали при 60 С в течение 30 мин и концентрировали при пониженном давлении с получением кристаллов. Полученные кристаллы промывали этилацетатом с получением 1-[2-(метилсульфонил)-5(трифторметил)фенил]метанамин гидрохлорида (2,96 г) в форме твердого вещества. 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 3,42 (3 Н, с), 4,53 (2 Н, с), 8,04-8,15 (1 Н, м), 8,22 (2 Н, д, J=9,09 Гц), 8,58 (3 Н, с). Стадия 4. 2-Циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамид (1,69 г), 1-[2-(метилсульфонил)-5(трифторметил)фенил]метанамин гидрохлорид, полученный на стадии 3 (2,5 г), и карбонат калия (2,98 г) перемешивали в этаноле (30 мл) при 80 С в течение 16 ч. Реакционную смесь обрабатывали 1 н. раствором гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=4:1). Полученный остаток растворяли в метаноле, добавляли раствор 4 н. соляная кислотаэтилацетат (5 мл) и смесь кристаллизовали из смеси метанол-этилацетат. Осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (1,0 г). 1H ЯМР (300 МГц, ДМСО-d6)м.д. 3,48 (3 Н, с), 5,92 (2 Н, с), 7,37 (1 Н, с), 8,12 (1 Н, дд, J=8,19, 1,04 Гц), 8,25 (1 Н, с), 8,31 (1 Н, д, J=8,10 Гц), 8,63 (1 Н, д, J=2,26 Гц), 8,72 (2 Н, д, J=2,26 Гц), 9,69 (2 Н, с). Пример 10. 1-[5-Бром-2-(метилсульфонил)бензил]-5-хлор-2-имино-1,2-дигидропиридин-3 карбоксамид гидрохлорид. Стадия 1. 5-Бром-2-фторбензальдегид (15,4 г) и метантиолат натрия (5,85 г) перемешивали в N,Nдиметилформамиде (30 мл) при 60 С в течение 30 мин. Реакционный раствор обрабатывали 1 н. соляной кислотой и экстрагировали этилацетатом. Экстракт промывали последовательно водным раствором бикарбоната натрия и насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток кристаллизовали из смеси этилацетат-гексан с получением 5-бром-2-(метилсульфанил)бензальдегида (11,1 г). 1 Н ЯМР (300 МГц, CDCl3)м.д. 2,50 (3 Н, с), 7,22 (1 Н, д, J=8,67 Гц), 7,63 (1 Н, дд, J=8,48, 2,26 Гц),7,92 (1 Н, д, J=2,26 Гц), 10,22 (1 Н, с). Стадия 2. 5-Бром-2-(метилсульфанил)бензальдегид, полученный на стадии 1 (11,0 г), и О-метилгидроксиламин гидрохлорид (4,37 г) перемешивали в пиридине (30 мл) при комнатной температуре в течение 14 ч. Реакционный раствор обрабатывали водой и экстрагировали этилацетатом. Экстракт промывали последовательно 1 н. соляной кислотой (дважды) и насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении с получением 5-бром 2-(метилсульфанил)бензальдегид О-метилоксима (11,9 г). 1 Н ЯМР (300 МГц, CDCl3)м.д. 2,43 (3 Н, с), 4,00 (3 Н, с), 7,18 (1 Н, д, J=8,71 Гц), 7,43 (1 Н, дд,J=8,52, 2,46 Гц), 7,90 (1 Н, д, J=2,27 Гц), 8,46 (1 Н, с). Стадия 3. К раствору 5-бром-2-(метилсульфанил)бензальдегид О-метилоксима, полученного на стадии 2 (11,8 г), в тетрагидрофуране (200 мл) при 0 С добавляли смесь тетрагидрофуран-боран (113,4 мл, 1 М раствор в тетрагидрофуране). Смесь перемешивали при 80 С в течение 3 ч, обрабатывали льдом и добавляли 1 н. соляную кислоту (200 мл). Смесь перемешивали при 90 С в течение 1 ч и к смеси добавляли этилацетат. Отделенный водный слой подщелачивали 8 н. раствором гидроксида натрия и экстрагировали этилацетатом. Экстракт промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Полученный остаток растворяли в метаноле, добавляли раствор 4 н. соляная кислота-этилацетат (15 мл) и полученный осадок собирали фильтрацией и промывали этилацетатом с получением 1-[5-бром-2-(метилсульфанил)фенил]метанамин гидрохлорида (7,25 г). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 2,52 (3 Н, с), 4,05 (2 Н, с), 7,35 (1 Н, д, J=8,48 Гц), 7,59 (1 Н, дд,J=8,48, 2,26 Гц), 7,66-7,76 (1 Н, м), 8,47 (3 Н, с). Стадия 4. К раствору 1-[5-бром-2-(метилсульфанил)фенил]метанамин гидрохлорида, полученного на стадии 3(6,25 г), и триэтиламина (4,72 г) в тетрагидрофуране (150 мл) при комнатной температуре добавляли дитрет-бутилбикарбонат (7,62 г). Смесь перемешивали при той же самой температуре в течение 14 ч, обрабатывали водой и экстрагировали этилацетатом. Экстракт промывали последовательно 1 н. соляной кислотой и насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Полученный остаток растворяли в этилацетате (200 мл) и мхлорпербензойную кислоту (14,4 г, содержащую воду: Wako Pure Chemical Industries, Ltd.) добавляли при комнатной температуре. Смесь перемешивали при той же самой температуре в течение 4 ч и обрабатывали водным раствором бикарбоната натрия. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=2:1). Полученный остаток растворяли в метаноле (100 мл), добавляли раствор 4 н. соляная кислота-этилацетат (15 мл) и смесь перемешивали при 60 С в течение 1 ч и концентрировали при пониженном давлении с получением кристаллов. Полученные кристаллы промывали этилацетатом с получением 1-[5-бром-2(метилсульфонил)фенил]метанамин гидрохлорида (5,85 г) в форме твердого вещества. 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 3,35 (3 Н, с), 4,43 (2 Н, с), 7,91 (2 Н, с), 8,09 (1 Н, с), 8,60 (3 Н, с). Стадия 5. 2-Циано-2-(3,4-дихлор-5-оксо-2,5-дигидрофуран-2-ил)ацетамид (1,95 г), 1-[5-бром-2-(метилсульфонил)фенил]метанамин гидрохлорид, полученный на стадии 4 (3,0 г), и карбонат калия (3,45 г) перемешивали в этаноле (30 мл) при 80 С в течение 16 ч. Реакционную смесь обрабатывали 1 н. раствором гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Остаток очищали основной хроматографией на колонках с силикагелем (этилацетат:гексан=4:1). Полученный остаток растворяли в метаноле, добавляли раствор 4 н. соляная кислота-этилацетат (3 мл) и смесь кристаллизовали из смеси метанол-этилацетат. Осажденные кристаллы собирали фильтрацией и перекристаллизовывали с получением указанного в заголовке соединения (0,9 г). 1 Н ЯМР (300 МГц, ДМСО-d6)м.д. 3,41 (3 Н, с), 5,84 (2 Н, с), 7,26 (1 Н, д, J=1,51 Гц), 7,86-8,04 (2 Н,м), 8,24 (1 Н, с), 8,56-8,76 (3 Н, м), 9,65 (2 Н, с). Пример 11. 5-Хлор-2-имино-1-[5-метокси-2-(метилсульфонил)бензил]-1,2-дигидропиридин-3 карбоксамид гидрохлорид. Стадия 1. Смесь 2-фтор-5-метоксибензонитрил (10 г) и метантиолат натрия (5,1 г) перемешивали в N,Nдиметилформамиде (20 мл) при 60 С в течение 3 ч. Реакционный раствор обрабатывали водой и экстрагировали этилацетатом. Экстракт промывали последовательно 1 н. соляной кислотой, водным раствором бикарбоната натрия и насыщенным солевым раствором и высушивали над сульфатом магния. Растворитель выпаривали при пониженном давлении. Полученный остаток кристаллизовали из смеси этилацетатгексан с получением 5-метокси-2-(метилсульфанил)бензонитрила (8,3 г). 1 Н ЯМР (300 МГц, CDCl3)м.д. 2,52 (3 Н, с), 3,82 (3 Н, с), 7,02-7,11 (1 Н, м), 7,13 (1 Н, д, J=3,03 Гц),7,37 (1 Н, д, J=8,71 Гц).
МПК / Метки
МПК: C07D 213/82, A61P 13/02, A61K 31/44
Метки: иминопиридина, применение, производные
Код ссылки
<a href="https://eas.patents.su/30-19641-proizvodnye-iminopiridina-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные иминопиридина и их применение</a>
Предыдущий патент: Производные индола и их применение в качестве активаторов глюкокиназы
Следующий патент: Способ получения гидрохлорида лерканидипина (v форма)
Случайный патент: Способ получения производного тетразола