Производные пиперазинона и их применение
Номер патента: 3511
Опубликовано: 26.06.2003
Авторы: Жибуло Тьерри, Анри Маргерит, Йю Кристоф, Лезюр Брижитт
Формула / Реферат
1. Соединение общей формулы I
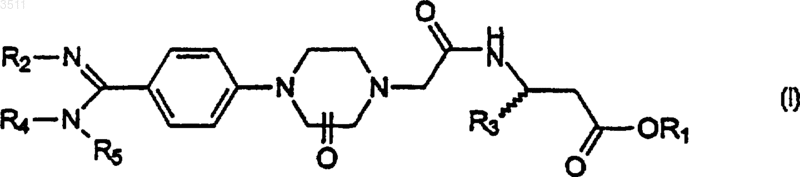
где R1 означает водород, C1-C4алкил или фенил(C1-C4)алкил;
R2 означает водород, гидроксил или защитную группу для амидиногруппы;
R3 означает водород либо C1-C5алкил, C3-C12моно- или бициклический циклоалкил, C2-C4алкенил или C2-C4алкинил, причем эти группы необязательно могут быть замещены либо галогенами, либо гидроксильной группой, моно-, би- или трициклическую C6-C14арильную группу, гетероарильную группу, выбранную из пиридила, тиенила, фурила, хинолила, бензодиоксанила, бензодиоксолила, бензотиенила, бензофурила и пиразинила, фенил-(C1-C4)алкил или нафтил-(C1-C4)алкил, или пиперонил;
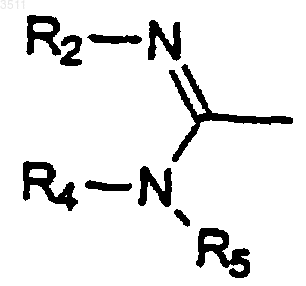
R4 и R5 означают, независимо друг от друга, водород или C1-C5алкил, либо же они вместе с атомом азота образуют пиперидил или морфолинил;
причем арил и гетероарил необязательно могут быть замещены одной или несколькими группами, выбранными независимо из галогенов, C1-C4алкила, трифторометила, C1-C4алкилтио, C1-C4алкилсульфонила, C1-C4алкилокси, нитрогруппы и групп -COOR, -CH2COOR и -O-CH2-COOH, где R означает C1-C4алкил,
и оксогруппа находится в положении 2 или 3 пиперазина;
или их соли фармацевтически приемлемых кислот.
2. Соединение по п.1, выбранное из
этил-3-{[2-(4-{4-[амино(гидроксиимино)метил]фенил}-2-оксопиперазино)ацетил]амино}-3-(1,3-бензодиоксол-5-ил)пропаноата,
этил-3-{[2-(4-{4-[амино(гидроксиимино)метил]фенил}-2-оксопиперазино)ацетил]амино}-5-фенилпентаноата,
3-{[2-(4-{4-[амино(имино)метил]фенил}-2-оксопиперазино)ацетил]амино}-3-(1,3-бензодиоксол-5-ил)пропановой кислоты
или их солей фармацевтически приемлемых кислот.
3. Способ получения соединений формулы I по п.1 с помощью
a) реакции между кислотой формулы II
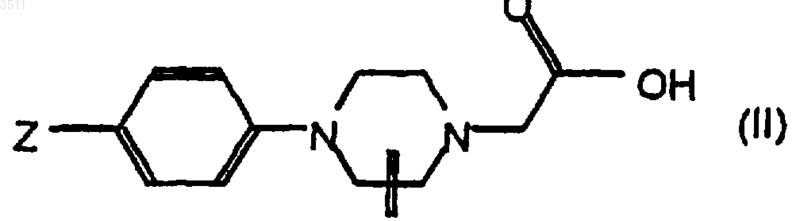
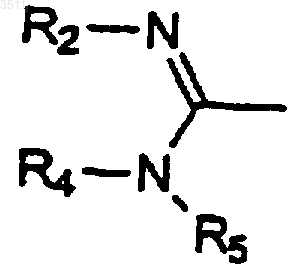
где Z означает предшественник группы
и амином формулы III
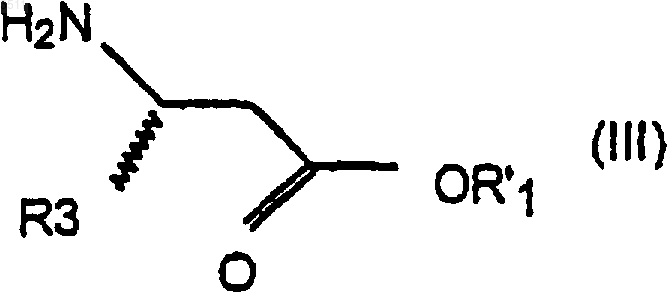
где R'1 означает C1-C4алкил или фенил-(C1-C4)алкил,
с получением соединения формулы IV
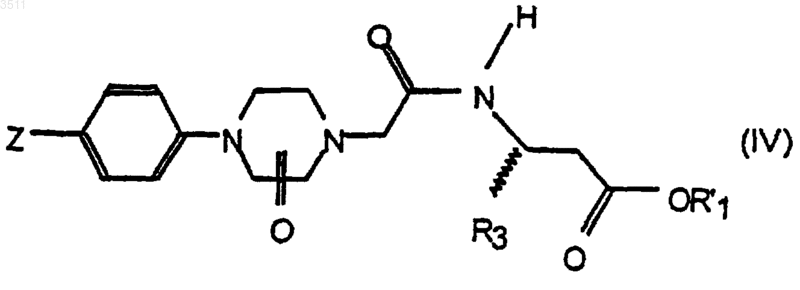
b) превращения группы Z в группу
c) при необходимости, превращения группы R'1 в атом водорода.
4. Терапевтическая композиция, включающая в качестве активного начала соединение, определенное в п.1 или 2.
5. Применение соединения по п.1 или 2 для приготовления антитромботического средства.
6. Способ ингибирования связывания фибриногена с тромбоцитами крови у млекопитающих, включающий введение млекопитающему эффективного количества соединения по п.1 или 2.
7. Способ ингибирования аггрегации тромбоцитов крови у пациентов, включающий введение пациенту эффективного количества соединения по п.1 или 2.
8. Способ лечения тромбоза у пациентов, включающий введение пациенту эффективного количества соединения по п.1 или 2.
9. Способ профилактики тромбоза у пациентов, включающий введение пациенту эффективного количества соединения по п.1 или 2.
Текст
1 Настоящее изобретение относится к новым соединениям, которые являются ингибиторами связывания фибриногена с рецепторами Gp(сгустка крови), аггрегация тромбоцитов представляет собой ключевую стадию, поскольку от нее зависит степень тяжести этого явления. В частности, с самого начала образования тромба,особенно в артериальном кровотоке, в результате нескольких взаимозависимых биохимических реакций происходит аггрегация все возрастающего числа тромбоцитов путем превращения растворимого фибриногена в нерастворимые фибриновые нити (филаменты), отчего увеличивается размер массы тромбоцитов, сначала в самом месте повреждения артериального сосуда, а затем по возрастающей и в просвете сосуда. В этом механизме аггрегация тромбоцитов еще больше усиливается вследствие активации рецепторов Gp IIb/IIIа. Фибриноген связывается с этими рецепторами через свои два димера и усиливает сцепление между тромбоцитами, что ведет к образованию массы тромбоцитов, образующей тромб на месте разрыва атеросклеротической бляшки. Этот механизм аггрегации тромбоцитов особенно активен при всех артериальных тромбозах, независимо от того, появляются ли они при проведении кардиологических процедур(транслюминальная перкутанная (подкожная) ангиопластия, вставка растяжек), сердечной хирургии (аортокоронарное шунтирование, операции на клапанах), при острых сердечных заболеваниях (инфаркт миокарда, стенокардия,острые коронарные синдромы и т.п.) или при некоторых типах ишемии мозга, или же при ишемии миокарда, что может вызвать осложнения при проведении антитромботического лечения. Поэтому снижение или предупреждение активации тромбоцитов, контактирующих с разрушенной атеросклеротической бляшкой,представляет собой новый и эффективный терапевтический подход к лечению тромбозов, особенно артериальных тромбозов, а тем самым и действенное средство профилактики острых коронарных синдромов, включая стенокардию и инфаркт миокарда. Настоящее изобретение направлено на получение новых конкурентных ингибиторов связывания фибриногена с рецепторами Gp IIb/IIIа,которые можно применять в качестве антитромботических лекарств. Настоящее изобретение также направлено на получение соединений, которые можно вводить перорально, что дает возможность про 003511 2 длить продолжительность действия и избежать риска кровотечения. Одним из объектов настоящего изобретения являются соединения общей формулы (I)R2 означает водород, гидроксил или защитную группу для амидиногруппы;R3 означает водород,C1-C5 алкил, С 3-С 12-моно- или бициклический циклоалкил, С 2-С 4 алкенил или С 2-С 4 алкинил, причем эти группы необязательно могут быть замещены либо галогенами, либо гидроксильной группой,моно-, би- или трициклическую С 6-С 14 арильную группу,гетероарильную группу, выбранную из пиридила, тиенила, фурила, хинолила, бензодиоксанила, бензодиоксолила, бензотиенила, бензофурила и пиразинила; фенил-(С 1-С 4)алкил или нафтил(С 1-С 4)алкил, или пиперонил;R4 и R5 означают, независимо друг от друга, водород или C1-C5 алкил, либо вместе с атомом азота они образуют пиперидил или морфолинил; причем арил и гетероарил необязательно могут быть замещены одной или несколькими группами,выбранными независимо из галогенов, С 1-С 4 алкила,трифторометила, C1-С 4 алкилтио, С 1-С 4 алкилсульфонила, С 1-С 4-алкилокси, нитрогруппы и групп-COOR, -CH2COOR и -О-СН 2-СООН, где R означает С 1-С 4 алкил,и оксогруппа находится в положении 2 или 3 пиперазина; а также их соли, образованные фармацевтически приемлемыми кислотами. В качестве примера арильных групп можно назвать фенил, -нафтил, -нафтил и флуоренил. С 1-С 5 алкильные группы могут быть линейными или разветвленными. В качестве примера можно назвать метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и пентил. В качестве примера алкинильных групп можно привести этинил, пропаргил и бутинил. В качестве примера алкенильных групп можно привести винил и аллил. С 1-С 4 алкоксигруппы также могут быть линейными или разветвленными. В качестве примера можно назвать метокси, этокси, пропокси,изопропокси, бутокси и изобутокси группы. Галогены могут быть выбраны из фтора,хлора, брома и иода. В качестве примера защитных групп для амидиногруппы можно назвать этоксикарбонил, бензилоксикарбонил, паранитробензилоксикарбонил и t-бутоксикарбонил."Соли фармацевтически приемлемых кислот" означают соли, обладающие биологическими свойствами свободных оснований и не оказывающие нежелательных эффектов. Эти соли могут быть образованы, в частности, минеральными кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота или фосфорная кислота; кислыми солями металлов, такими как двунатриевый ортофосфат или однозамещенный сульфат калия; а также органическими кислотами. Соединения формулы I можно получить путем: а) реакции между кислотой формулы II Когда Z представляет собой группу NC-,е также можно превратить в имидат путем присоединения этанола в присутствии HCl в этилацетате. Полученный имидат затем превращается в соединения формулы I, в которых R2 означает водород, a -NR4R5 является либо пиперидилом, либо морфолинилом, путем реакции с соответствующим амином в среде, содержащей этанол/этилацетат. Соединения формулы II, содержащие 2 пиперазинон, когда Z является нитрильной группой, можно получить по схеме 1. Схема 1 где R'1 означает С 1-С 4 алкил или фенил-(С 1 С 4)алкил,с получением соединения формулы IV с) при необходимости, превращения группы R'1 в атом водорода. Кислоты формулы II могут реагировать с аминами формулы III в полярном растворителе,таком как DMF, THF или этилацетат, в присутствии конденсирующего агента (DCC/HOBT,ВОР, изобутилхлороформиат) при температуре от 15 до 50 С. Когда Z представляет собой группу NC-,е можно превратить в амидоксим путем присоединения гидроксиламина к нитрильной группе в присутствии подходящего основания(К 2 СО 3, Et3N, NаОС 2 Н 5) в спиртовом растворителе. При гидрогенолизе полученных соединений в присутствии палладия на угле в смеси уксусного ангидрида и уксусной кислоты образуются соединения формулы I, в которых R2 означает водород (непосредствено образуются соединения, в которых R1 = Н, когда R'1 является бензильной группой). При реакции 4-фторобензонитрила с избытком этилендиамина в апротонном растворителе образуется 4-(2-аминоэтил)бензонитрил,который затем подвергается моноалкилированию этилбромоацетатом в полярном растворителе, таком как этанол или ацетонитрил и в присутствии неорганического основания или третичного амина. Ацилирование с помощью хлороацетилхлорида с последующей циклизацией и гидролизом дает кислоту 1. Соединения формулы II, содержащие 3 пиперазинон, когда Z является нитрильной группой, можно получить по схеме 2. 4-(2-Аминоэтил)бензонитрил подвергается диалкилированию этилбромоацетатом; циклизация проводится в присутствии третичного амина, неорганического основания или их смеси; и после гидролиза получается кислота 2. Схема 2 Соли обычно получают путем реакции соединения формулы I с фармацевтически приемлемой кислотой в подходящем растворителе. И наоборот, из этих солей можно получить основания при обработке сильным основанием. Следующие примеры иллюстрируют получение соединений формулы I. 5 А. Получение соединений формулы II 1. Синтез 2-[4-(4-цианофенил)-2-оксопиперазино]уксусной кислоты (1) а) 4-(2-Аминоэтиламино)бензонитрил Суспензию 4-фторобензонитрила (167 г,1,38 моль), этилендиамина (330 г, 5,5 моль) и карбоната калия (300 г, 2,17 моль) в 2 л толуола кипятили с дефлегматором в течение 6 ч. После охлаждения до комнатной температуры смесь фильтровали и промывали толуолом, фильтрат упаривали до состояния желтого масла, которое перекристаллизовывали из толуола. Продукт отфильтровывали, промывали толуолом и высушивали под вакуумом при 50 С, получая 200 г желтоватого вещества. Выход = 90%. Температура плавления = 85 С. 1b) Этил-2-2-(хлороацетил)-2-(4-цианоанилино)этиламиноацетат Этилбромоацетат (84 г, 0,5 моль) добавляли к суспензии 4-(2-аминоэтиламино)бензонитрила (80,5 г, 0,5 моль) и диизопропилэтиламина (65 г, 0,5 моль) в 800 мл ацетонитрила. Продолжали перемешивать в течение 18 ч при комнатной температуре. Большая часть ацетонитрила испарялась, а остаток растворяли в дихлорометане. Эту смесь промывали водой и высушивали над сульфатом натрия; неочищенный продукт пропускали через короткую колонку с диоксидом кремния (элюировали дихлорометаном, а затем смесью дихлорометана с метанолом 20:1), получая масло. Полученный продукт растворяли в 1 л тетрагидрофурана и добавляли диизопропилэтиламин (51 г, 0,4 моль), после чего медленно при -5 С добавляли хлороацетилхлорид(45 г, 0,4 моль). После перемешивания в течение 18 ч при комнатной температуре добавляли 1 л этилацетата и смесь 3 раза промывали водой,высушивали над сульфатом натрия и упаривали,получая твердое вещество, которое перемешивали со смесью дихлорометана с эфиром (1:3). Суспензию фильтровали, промывали смесью дихлорометана с эфиром (1:3) и высушивали под вакуумом, получая 100 г кристаллического вещества бежевого цвета. Выход = 62%. 1 6 в течение 2 ч. Растворитель упаривали, а остаток растворяли в дихлорометане, промывали водой, высушивали над сульфатом натрия и упаривали до состояния коричневого масла,которое перекристаллизовывали из смеси циклогексана с этилацетатом, получая 125 г коричневатого кристаллического вещества. Выход = 93%. Температура плавления = 108 С. 1d) 2-[4-(4-Цианофенил)-2-оксопиперазино] уксусная кислота Этил-2-[4-(4-цианофенил)-2-оксопиперазино]ацетат (20,7 г, 72 ммоль) растворяли в 80 мл метанола, 80 мл тетрагидрофурана и 100 мл воды, а затем добавляли гидроокись лития в виде моногидрата (4 г, 98 ммоль). Перемешивание продолжали 20 мин, после чего удаляли органический растворитель под вакуумом. К полученной суспензии прибавляли около 100 мл воды и подкисляли эту смесь. Продукт отфильтровывали, промывали водой и высушивали под вакуумом при 50 С, получая 18,5 г порошка бежевого цвета. Выход = 100%. Температура плавления = 215 С. 1H-NMR (200 MHz, DMSO-d6):3,5 (t, 2 Н),3,65 (t, 2 Н), 4,0 (s, 2 Н), 4,1 (s, 2H), 7,0 (d, 2H),7,6(d, 2H). 2. Синтез 2-[4-(4-цианофенил)-3-оксопиперазино]уксусной кислоты (2) а) Этил-2-[2-(4-цианоанилино)этил(2-этокси-2-оксоэтил)амино]ацетат Суспензию 4-(2-аминоэтиламино)бензонитрила (1 а) (32 г, 0,2 моль), карбоната калия (55 г, 0,4 моль) и этилбромоацетата (67 г, 0,4 моль) в 400 мл ацетонитрила кипятили с обратным холодильником в течение 18 ч. Неочищенный продукт отфильтровывали и пропускали через короткую колонку с диоксидом кремния (элюировали дихлорометаном), получая 58 г коричневого масла. Выход = 87%. 1b) 2-[4-(4-цианофенил)-3-оксопиперазино]уксусная кислота Суспензию этил-2-[2-(4-цианоанилино) этил(2-этокси-2-оксоэтил)амино]ацетата (58 г,0,174 моль), диизопропилэтиламина (4 г, 0,03 моль) и карбоната калия (24 г, 0,174 моль) в 400 мл ацетонитрила кипятили с дефлегматором в течение 2 дней. Смесь фильтровали и промывали дихлорометаном. Фильтрат упаривали, получая коричневое вещество, которое растворяли в 150 мл метанола и 50 мл воды, а затем добавляли гидроокись лития моногидрат (8,4 г, 0,2 7 моль). После перемешивания 30 мин при комнатной температуре половину метанола удаляли под вакуумом, получая суспензию. Добавляли примерно 100 мл воды и эту смесь подкисляли при 5 С. Продукт отфильтровывали, промывали водой и высушивали под вакуумом при 50 С,получая 27,2 г порошка бежевого цвета. Выход = 55%. Температура плавления = 120 С. 1(d,2H). В. Получение промежуточных продуктов формулы IV 1. Синтез этил-3-[2-(4-(4-цианофенил)-2 оксопиперазино)ацетил]амино-пропаноата(промежуточный продукт В 1) Изобутилхлороформиат (1,39 г, 10 ммоль) добавляли к суспензии 2-[4-(4-цианофенил)-3 оксопиперазино]уксусной кислоты (2,59 г, 10 ммоль) и N-метилморфолина (2,1 г, 20,8 ммоль) в 30 мл тетрагидрофурана при 5-10 С, после чего смесь перемешивали 10 мин при комнатной температуре, а затем добавляли этил-3 аминопропаноат гидрохлорид (1,55 г, 10 ммоль). Продолжали перемешивать в течение 1 ч; растворитель упаривали и остаток очищали методом тонкослойной хроматографии (дихлорометан : метанол =15:1), получая 2 г белого твердого вещества. Выход = 56%. 1H-NMR (200 MHz, CDCl3):1,25 (t, 3H),2,5 (t, 2H), 3,5 (dd, 2H), 3,65 (m, 4H), 4,05 (s, 2H),4,08 (s, 2H), 4,1 (q, 2H), 6,75 (bs, 1H), 6,8 (d, 2H),7,55 (d, 2H). Описанный в п.1 метод применяли для получения следующих промежуточных продуктов. 2. Бензил-3-[2-(4-(4-цианофенил)-2-оксопиперазино)ацетил]аминопропаноат (промежуточный продукт В 2) Исходный материал - бензил-3-аминопропаноат тозилат. Выход = 71%. 1(промежуточный продукт В 9) Исходный материал - этил-3-амино-5 метилгексаноат гидрохлорид. Неочищенный препарат непосредственно использовали для примера 9. 10. Этил-3-[2-(4-(4-цианофенил)-2-оксопиперазино)ацетил]амино-4,4-диметилпентаноат (промежуточный продукт В 10) Исходный материал - этил-3-амино-4,4 диметилпентаноат гидрохлорид. Этот препарат непосредственно использовали для примера 10.(промежуточный продукт В 11) Исходный материал - этил-3-амино-4 метилпентаноат гидрохлорид. Этот препарат непосредственно использовали для примера 11. 12. Этил-3-[2-(4-(4-цианофенил)-3-оксопиперазино)ацетил]аминопропаноат (промежуточный продукт В 12) Изобутилхлороформиат (1,39 г, 10 ммоль) добавляли к суспензии 2-[4-(4-цианофенил)-3 оксопиперазино]уксусной кислоты (пример 2b)(2,59 г, 10 ммоль) и N-метилморфолина (2,1 г,20 ммоль) в 30 мл тетрагидрофурана, после чего смесь нагревали в течение 5 мин в бане при 40 С; затем добавляли этил-3-аминопропаноат гидрохлорид (1,55 г, 10 ммоль). Продолжали перемешивать при комнатной температуре в течение 18 ч; растворитель упаривали, а остаток очищали методом тонкослойной хроматографииH-NMR (200 MHz, CDCl3):1,25 (t, 3H),2,6 (t, 2H), 2,95 (t, 2H), 3,15 (s, 1H), 3,4 (s, 2H),3,55 (dd, 2H), 3,8 (dd, 2H), 4,1 (q, 2H), 7,45 (bs,1H), 7,5 (d, 2H), 7,7 (d, 2H). Описанный в пункте 12 метод применяли для получения следующих промежуточных продуктов. 13. Бензил-3-[2-(4-(4-цианофенил)-3 оксопиперазино)ацетил]аминопропаноат (промежуточный продукт В 13) Исходный материал - бензил-3-аминопропаноат тозилат. Выход = 69%. 1H-NMR (200 MHz, CDCl3):2,6 (t, 2H),2,8 (t, 2H), 3,1 (s, 2H), 3,4 (s, 2H), 3,55 (q, 2H),3,65 (dd, 2H), 5,1 (s, 2H), 7,3 (s, 5H), 7,4 (bs, 1H),7,45 (d, 2H) 7,6 (d, 2H). 14. Этил-3-[2-(4-(4-цианофенил)-3-оксопиперазино)ацетил]амино-3-(1,3-6 ензодиоксол-5-ил)пропаноат (промежуточный продукт В 14) Исходный материал - этил-3-амино-3-(1,3 бензодиоксол-5-ил)пропаноат гидрохлорид. Выход = 48%. 15. Бензил-3-[2-(4-(4-цианофенил)-3-оксопиперазино)ацетил]амино-3-(1,3-бензодиоксол-5-ил)пропаноат (промежуточный продукт В 15) Исходный материал - бензил-3-амино-3(1,3-бензодиоксол-5-ил)пропаноат тозилат. Выход = 48%. Пример 1. Этил-3-[2-(4-4-[амино(гидроксиимино) метил]фенил-2-оксопиперазино)-ацетил]аминопропаноат (CRL 42656) Смесь из промежуточного продукта В 1 - этил 3-[2-(4-(4-цианофенил)-2-оксопиперазино)ацетил]аминопропаноата (6,2 г, 17,3 ммоль), 003511 10 триэтиламина (3,8 г, 37,6 ммоль) и гидроксиламина гидрохлорида (2,5 г, 6 ммоль) в 150 мл этанола кипятили с обратным холодильником в течение 3 ч. После охлаждения смесь фильтровали, промывали этанолом и высушивали под вакуумом, получая 5,2 г белых кристаллов. Выход = 77%. 1MS-Cl m/z: 392 (M+H)+. Описанный в примере 1 метод применяли для получения следующих продуктов. Пример 2. Бензил-3-[2-(4-4-[амино(гидроксиимино)метил]фенил-2-оксопиперазино)ацетил]аминопропаноат Исходный материал - промежуточный продукт В 2. Выход = 71%. 1MS-ES m/z: 456 (M+Na)+. Пример 12. Этил-3-[2-(4-4-[амино(гидроксиимино) метил]фенил-3-оксопиперазино)ацетил]-аминопропаноат (CRL 42655) Раствор промежуточного продукта В 12 этил-3-2-[4-(4-цианофенил)-3-оксопиперазиноацетил]аминопропаноата (4,96 г, 13,9 ммоль), триэтиламина (2,9 г, 28,7 ммоль) и гидроксиламина гидрохлорида (2 г, 28,8 ммоль) в 200 мл этанола кипятили с обратным холодильником в течение 4 ч, а затем удаляли растворитель под вакуумом. Добавляли около 30 мл воды и раствор насыщали хлористым натрием. После этого смесь фильтровали, промывали холодной водой и высушивали под вакуумом,получая 3 г вещества бежевого цвета. Выход = 55%. 1MS-ES m/z: 392 (M+H)+. Описанный в примере 12 метод применяли для получения следующих продуктов. Пример 13. Бензил-3-[2-(4-4-[амино(гидроксиимино)метил]фенил-3-оксопиперазино)ацетил]аминопропаноат Исходный материал - промежуточный продукт В 13. Выход = 86%. Пример 14. Этил-3-[2-(4-4-[амино(гидроксиимино)метил]фенил-3-оксопиперазино)ацетил]амино-3-(1,3-бензодиоксол-5-ил)пропаноатMS-ES m/z: 534 (M+Na)+. Пример 15. Бензил-3-[2-(4-4-амино(гидроксиимино) фенил-3-оксопиперазино)ацетил]-амино-3(1,3-бензодиоксол-5-ил)пропаноат Исходный материал - промежуточный продукт В 15. Выход = 92%. Пример 16. Этил-3-[2-(4-4-[амино(имино)метил]фенил-2-оксопиперазино)ацетил]амино-пропаноатацетат (CRL 42673) Этил-3-[2-(4-4-[амино(гидроксиимино)метил]фенил-2-оксопиперазино)-ацетил] аминопропаноат (пример 1) (2,88 г, 7,36 ммоль) растворяли в 100 мл уксусной кислоты и затем добавляли уксусный ангидрид (1,5 г, 14,7 ммоль) и 0,5 г 10% палладия на угле. Эту смесь гидрогенизировали при комнатной температуре при 50 фунт-дюйм 2 (psi) в течение 3 ч. После этого смесь фильтровали и упаривали досуха под вакуумом, получая порошок. После добавления эфира образовалась суспензия, которую фильтровали, получая 2,8 г розоватого порошка. Его растворяли в 100 мл воды, обрабатывали углем и фильтровали, а фильтрат сублимировали, получая 2,5 г вещества бежевого цвета. Выход = 78%. 1MS-ES m/z: 376 (M+H)+. Описанный в примере 16 метод применяли для получения следующих продуктов (с превращением ацетата в гидрохлорид для соединений в примерах 17, 19, 28 и 30). Пример 17. Гидрохлорид 3-[2-(4-4-[амино(имино) метил]фенил-2-оксопиперазино)ацетил]аминопропановой кислоты (CRL 42674) Исходный материал - пример 2. Выход = 88%. 1(CRL 42960) Препарат из примера 18 превращали в гидрохлорид добавлением 2N раствора соляной кислоты HCl с последующим фильтрованием. К раствору полученного таким образом гидрохлорида (2,2 г, 4,1 ммоль) в 50 мл DMF при 5 С последовательно добавляли триэтиламин (1,1 г, 11 ммоль) и этилхлороформиат (0,54 г, 5 ммоль). Перемешивание продолжали при комнатной температуре в течение 18 ч. Добавляли воду и этилацетат, органическую фазу промывали водой и высушивали над сульфатом натрия. После хроматографии на диоксиде кремния (этилацетат : метанол = 10:1) получали 1,3 г желтоватого твердого вещества. Выход = 55%. 1MS-ES m/z: 590 (M+Na)+. Пример 32. Этил-3-[2-(4-4-[имино(пиперидино)метил]фенил-2-оксопиперазино)ацетил]амино-5 фенилпентаноат (CRL 43101) В смесь этил-3-[2-(4-(4-цианофенил)-2 оксопиперазино)ацетил]амино-5-фенилпентаноата (промежуточного продукта В 7) (3,3 г, 7,1 ммоль) с 5 мл этанола при 5 С добавляли 60 мл 4N раствора соляной кислоты в этилацетате. Перемешивание продолжали при комнатной температуре в течение 40 ч. Смесь упаривали досуха, получая желтоватое вещество. Полученный таким образом имидат (2,1 г,3,8 ммоль) суспендировали в 10 мл этанола и 50 мл этилацетата и туда добавляли пиперидин (2,6 г, 30,6 ммоль). После перемешивания при комнатной температуре в течение 24 ч смесь фильтровали. Неочищенный продукт перекристаллизовывали из смеси этилацетата и этанола, получая 0,7 г вещества бежевого цвета. Выход = 65%.MS-ES m/z: 548 (M+H)+. Описанный в примере 32 метод применяли для получения следующих продуктов. Пример 33. Этил-3-[2-(4-4-[имино(морфолино)меил]фенил-2-оксопиперазино)ацетил]амино-5 фенилпентаноат (CRL 43102) Исходный материал - промежуточный продукт В 7 и морфолин. Выход = 56%. 1MS-ES m/z: 566 (M+H)+. Исследование ингибиторной активности соединений формулы I на аггрегацию тромбоцитов проводили in vitro, то есть при прямом контакте растворов этих соединений в различных концентрациях с тромбоцитами, выделенными из образцов цельной крови, взятых при стандартных условиях у лабораторных животных (морских свинок) и у здоровых людей, не принимавших никаких веществ или медикаментов, которые могли бы повлиять на свертывае 003511 18 мость крови. Подавление аггрегации тромбоцитов также изучали ех vivo/vitro, то есть после введения заявленных соединений морским свинкам, чтобы измерить интенсивность и продолжительность подавления аггрегации под влиянием той доли испытуемого препарата, что поглощена организмом и циркулирует в крови. 1. Фармакологические исследования in vitro 1.1 Исследования на тромбоцитах морских свинок Кровь отбирали путем внутрисердечной пункции у самцов морских свинок линии(концентрация водного раствора = 1,55%), чтобы полностью предупредить свертывание. Обогащенную тромбоцитами плазму (PRP) получали центрифугированием пробирок с цельной кровью 15 мин при 150xg. Использовали "объединенные" образцы плазмы. Содержание тромбоцитов в таких "объединенных" образцах подсчитывали с помощью автоматического счетчика клеток для гематологии Coulter ZM: при необходимости делали разведения так, чтобы концентрация тромбоцитов в плазме находилась между 200 000 и 400 000 тромбоцитов/мм 3. Одновременно другие порции этих "объединенных" образцов использовали для получения обедненной тромбоцитами плазмы (РРР) путем центрифугирования 15 мин при 1500xg. Кинетические исследования аггрегации тромбоцитов проводили при добавлении в PRP раствора коллагена (1 мкг/мл) с помощью аггрегометра фирмы Chronolog Corporation (490-D1 или 560 VS), в котором применяется оптическая детекция появления тромба. Определение концентрации 50%-го ингибирования (IC50) проводили, добавляя фиксированный объем растворителя (контроль) или соединений при возрастающих концентрациях: 1,5x10-8 М, 7 х 10-8 М, 1,5 х 10-7 М, 3x10-7 M, 7x10-7 М, l,5x10-6 M и 7x10-5 М в образцы "объединенной" PRP. Ингибирование аггрегации измеряли через 3 мин после добавления при 37 С с перемешиванием. 1.2 Исследование на тромбоцитах человека Отбирали венозную кровь в группе из 10 здоровых лиц одинакового возраста путем прокола вены в локтевом сгибе и собирали в стеклянные пробирки, содержащие 0,129 М раствор цитрата натрия в воде (1 объем цитрата на 9 объемов крови). Каждую пробирку затем центрифугировали, первый раз 15 мин при 100xg и 20 С, получая обогащенную тромбоцитами плазму (PRP); после удаления PRP пробирку еще раз центрифугировали 15 мин при 2000xg и при этом получали обедненную тромбоцитами плазму (РРР). В каждом из образцов PRP подсчитывали тромбоциты с помощью счетчика клеток CoulterZM. Затем в них изучали степень ингибирования аггрегации тромбоцитов, вызванной добавлением раствора коллагена в глюкозе Chromopar Reagent фирмы Coultronics (при концентрации 5 мкг/мл), в зависимости от возрастающих концентраций каждого соединения в пределах от 10-8 до 10-5 М (примеры концентраций: 10-8 М, 5 х 10-7 М, 3 х 10-7 М, 10-7 М, 8x10-6 М, 4x10-6 М, 2x10-6 М, 10-6 М, 5 х 10-5 М, 10-5 М). Все соединения заранее растворяли в воде при концентрации 10-3 М. Делали контрольную пробу для проверки возможного влияния растворителей (контрольное значение) на аггрегацию тромбоцитов в каждой серии измерений, которые проводились через 3 мин после добавления при 37 С с перемешиванием. По измерениям процента ингибирования аггрегации тромбоцитов при каждой концентрации рассчитывали концентрации 50%-го ингибирования (IC50) для каждого соединения. 2. Фармакологические исследования exvivo/vitro на морских свинках Оценка активности соединений против аггрегации тромбоцитов проводилась на тех же морских свинках, что были указаны выше (линии Dunkin-Hartley). Каждый препарат в дозах от 150 мг/кг до 10 мг/кг и каждый растворитель(5 мл/кг) вводили через желудок за 1,2,4,6,8 или 12 ч перед взятием крови у морских свинок, не получавших пищи накануне. Животных разбивали на соответствующие группы случайным образом. Брали образцы крови и обрабатывали в тех же условиях, что описаны выше для опытов invitro. Полученные результаты по ингибированию аггрегации тромбоцитов по каждой из исследованных концентраций дают возможность рассчитать концентрации IC50 для каждого препарата, а также кинетику эффекта ингибирования и продолжительность его действия. Результаты опытов по ингибированию вызванной коллагеном аггрегации тромбоцитов представлены в нижеследующей таблице. Пример Морские Человек свинки 1 16 17 27 28 5 19 3 21 18 20 30 22 Некоторые соединения проявляют ингибирование аггрегации тромбоцитов при весьма низких дозах. Таковы, к примеру, CRL 42789,CRL 42788 и CRL 42903, у которых подавление аггрегации ex vivo у морских свинок, получавших дозу в 10 мг/кг перорально (через желудок) за 1 и 2 ч до измерения аггрегации, составило 69 и 72% (CRL 42789), 57 и 24% (CRL 42788) или 72% (за 1 ч для CRL 42903), соответственно. Предметом настоящего изобретения поэтому также являются фармацевтические композиции, включающие эффективное количество соединения формулы I или его соли фармацевтически приемлемых кислот. Предметом изобретения, в частности, являются соединения, ингибирующие аггрегацию тромбоцитов крови и включающие эффективное количество одного из этих соединений. Предметом изобретения также являются:- способ ингибирования связывания фибриногена с тромбоцитами крови у млекопитающих, включающий введение млекопитающему эффективного количества одного из этих соединений,- способ ингибирования аггрегации тромбоцитов крови у пациентов, включающий введение эффективного количества одного из этих соединений пациенту,- способ лечения тромба у пациентов,включающий введение пациенту эффективного количества одного из этих соединений,- способ профилактики тромбоза у пациентов, включающий введение пациенту эффективного количества одного из этих соединений. Соединения формулы I могут применяться,в частности, в следующих областях: 1) Острая профилактика артериального тромбоза при проведении операций на сердце(подкожная) ангиопластия, эндартэктомия,вставка растяжек), при этом соединения применяются наряду с признанными средствами профилактики артериального тромбоза; пероральное введение ацетилсалициловой кислоты начинают до операции (150-500 мг/день перорально) и продолжают после нее; внутривенную инфузию нефракционированного гепарина начинают во время операции и продолжают еще 48-96 ч. Соединения формулы I можно вводить либо перорально (0,5-1,5 мг/кг) вместе с приемом аспирина, либо путем внутривенной инфузии(от 0,25 до 1 мг/кг/сутки) вместе с лекарством или без него. Через 48 ч, если соединение вводилось внутривенно, его заменяют на пероральное введение (от 0,25 до 10 мг/кг за два приема с промежутком в 12 ч), чтобы облегчить больничный уход и последующее амбулаторное лечение. 2) Вторичная профилактика артериального тромбоза у пациентов, подверженных приступам стенокардии или инфаркта миокарда; при этом высокая биодоступность заявленных соединений, то есть возможность быстрого достижения эффективных концентраций в крови,способных ингибировать связывание фибриногена с тромбоцитами, дает возможность перорального применения заявленных лекарств именно в тот период, когда пациенты подвергаются риску артериального тромбоза. В таких ситуациях эти соединения предпочтительно вводить перорально за 1-3 приема в день, причем вследствие их высокой биодоступности и продолжительности действия дозу выбирают в пределах от 0,5 до 10 мг/кг. В состав фармацевтических композиций,включающих одно из действующих начал, описанных в настоящей заявке на патент, активное вещество входит либо в виде основания, либо в виде фармацевтически приемлемой соли, или же в виде предшественника с одной или несколькими защитными группами, которые затем отщепляются in vivo после перорального приема. В состав этих фармацевтических композиций входят вспомогательные компоненты и растворители, известные специалистам в этой области. В их число входит целый ряд фармацевтических средств, признанных в фармакопее. В качестве примера для получения лекарственных форм, предназначенных для перорального введения, можно указать крахмал, стеарат магния,тальк, желатин, агар, пектин, лактозу, полиэтиленгликоли и т.п. Могут применяться следующие лекарственные формы: разрушаемые или неразрушаемые таблетки, гелевые капсулы, пастилки, гранулы, порошки. В зависимости от характеристики патологии и морфологии пациента ежедневная пероральная доза колеблется от 0,02 до 50 мг/кг/день, причем е разбивают на 1-3 приема с равномерными промежутками для того, чтобы поддерживать эффективный уровень занятости рецепторов Gp IIb/IIIa на тромбоцитах. Что касается внутривенного введения, то лекарственные формы, предназначенные для острой фазы лечения, выбирают таким образом,чтобы иметь возможность подбирать дозу индивидуально на основе максимального ингибирования аггрегации тромбоцитов в зависимости от ближайших последствий операции. В этом плане лиофилизаты и готовые к употреблению растворы для инфузии дают возможность выбирать дозировку индивидуально в пределах от 0,01 до 20 мг/кг/день. 22 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы IR2 означает водород, гидроксил или защитную группу для амидиногруппы;R3 означает водород либо C1-C5 алкил, С 3 С 12 моно- или бициклический циклоалкил, С 2 С 4 алкенил или С 2-С 4 алкинил, причем эти группы необязательно могут быть замещены либо галогенами, либо гидроксильной группой, моно-,би- или трициклическую С 6-С 14 арильную группу,гетероарильную группу, выбранную из пиридила,тиенила, фурила, хинолила, бензодиоксанила,бензодиоксолила, бензотиенила, бензофурила и пиразинила, фенил-(С 1-С 4)алкил или нафтил(С 1-С 4)алкил, или пиперонил;R4 и R5 означают, независимо друг от друга, водород или C1-C5 алкил, либо же они вместе с атомом азота образуют пиперидил или морфолинил; причем арил и гетероарил необязательно могут быть замещены одной или несколькими группами, выбранными независимо из галогенов, С 1-С 4 алкила, трифторометила, C1-С 4 алкилтио, С 1-С 4 алкилсульфонила, С 1-С 4 алкилокси,нитрогруппы и групп -COOR, -CH2COOR и -ОСН 2-СООН, где R означает С 1-С 4 алкил,и оксогруппа находится в положении 2 или 3 пиперазина; или их соли фармацевтически приемлемых кислот. 2. Соединение по п.1, выбранное из этил-3-[2-(4-4-[aминo(гидpoкcииминo) мeтил]фeнил-2-oкcoпипepaзинo)aцeтил]амино-3-(1,3-бензодиоксол-5-ил)пропаноата,этил-3-[2-(4-4-[амино(гидроксиимино) метил]фенил-2-оксопиперазино)ацетил]амино-5-фенилпентаноата,3-[2-(4-4-[амино(имино)метил]фенил-2 оксопиперазино)ацетил]амино-3-(1,3-бензодиоксол-5-ил)пропановой кислоты или их солей фармацевтически приемлемых кислот. 3. Способ получения соединений формулыI по п.1 с помощью а) реакции между кислотой формулы II где R'1 означает С 1-С 4 алкил или фенил-(С 1 С 4)алкил,с получением соединения формулы IV с) при необходимости, превращения группы R'1 в атом водорода. 4. Терапевтическая композиция, включающая в качестве активного начала соединение,определенное в п.1 или 2. 24 5. Применение соединения по п.1 или 2 для приготовления антитромботического средства. 6. Способ ингибирования связывания фибриногена с тромбоцитами крови у млекопитающих, включающий введение млекопитающему эффективного количества соединения по п.1 или 2. 7. Способ ингибирования аггрегации тромбоцитов крови у пациентов, включающий введение пациенту эффективного количества соединения по п.1 или 2. 8. Способ лечения тромбоза у пациентов,включающий введение пациенту эффективного количества соединения по п.1 или 2. 9. Способ профилактики тромбоза у пациентов, включающий введение пациенту эффективного количества соединения по п.1 или 2.
МПК / Метки
МПК: A61P 7/02, C07D 241/08, A61K 31/495
Метки: производные, применение, пиперазинона
Код ссылки
<a href="https://eas.patents.su/13-3511-proizvodnye-piperazinona-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперазинона и их применение</a>
Предыдущий патент: Ингибиторы фарнезилпротеинтрансферазы, применяемые для лечения артропатий
Следующий патент: Желудочная и/или дуоденальная клейкая лекарственная форма
Случайный патент: Всасывающее моющее устройство












